Diklofenak to jedna z najczęściej stosowanych substancji przeciwbólowych i przeciwzapalnych. Dostępny w wielu postaciach – od żeli i tabletek, przez czopki, aż po roztwory do wstrzykiwań i krople do oczu – sprawdza się zarówno w leczeniu bólu pourazowego, jak i przewlekłych chorób reumatycznych. Jego szerokie zastosowanie pozwala dobrać odpowiednią formę leczenia do indywidualnych potrzeb pacjenta.
Jak działa diklofenak?
Diklofenak należy do grupy niesteroidowych leków przeciwzapalnych (NLPZ). Jego główne działanie polega na łagodzeniu bólu, zmniejszaniu stanu zapalnego oraz obrzęków. Substancja ta hamuje produkcję prostaglandyn, czyli związków odpowiedzialnych za rozwój bólu i stanu zapalnego w organizmie123. Dzięki temu diklofenak jest skuteczny w leczeniu różnych dolegliwości bólowych, zarówno ostrych, jak i przewlekłych.
Dostępne postacie leku i dawki
- Tabletki powlekane: 25 mg, 50 mg (np. diklofenak potasowy, diklofenak sodowy)1
- Tabletki o zmodyfikowanym uwalnianiu: 75 mg2
- Czopki: 50 mg, 100 mg3
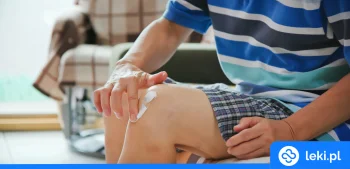
- Żel do stosowania miejscowego: 10 mg/g, 11,6 mg/g456
- Roztwór do wstrzykiwań (domięśniowo, podskórnie, dożylnie): 25 mg/ml, 50 mg/ml, 75 mg/ml78910
- Krople do oczu: 1 mg/ml11
- Roztwór do płukania jamy ustnej i gardła: 0,74 mg/ml12
- Połączenie z mizoprostolem w tabletkach: 50 mg diklofenaku + 0,2 mg mizoprostolu13
Diklofenak występuje także w połączeniach z innymi substancjami, np. z mizoprostolem, co pozwala na jednoczesną ochronę błony śluzowej żołądka podczas terapii przeciwzapalnej13.
Wskazania do stosowania
- Bóle pourazowe i pooperacyjne12
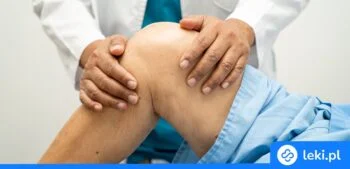
- Stany zapalne i bóle w chorobach reumatycznych, takich jak reumatoidalne zapalenie stawów, choroba zwyrodnieniowa stawów34
- Bóle kręgosłupa1
- Bóle i stany zapalne w ginekologii (np. bolesne miesiączkowanie)4
- Leczenie napadów migreny2
- Leczenie objawowe stanów zapalnych w jamie ustnej i gardle5
- Leczenie stanów zapalnych po operacjach okulistycznych (krople do oczu)6
Dawkowanie – podstawowe informacje
Najczęściej stosowane dawki diklofenaku zależą od postaci leku oraz wieku i stanu zdrowia pacjenta. Przykładowo, tabletki podaje się zwykle w dawce 75–150 mg na dobę w 2–3 dawkach podzielonych1. Żel nakłada się miejscowo na bolące miejsca 3–4 razy dziennie2. Roztwory do wstrzykiwań najczęściej stosuje się w dawce 75 mg na dobę, nie dłużej niż przez 2 dni3.
Przeciwwskazania
- Nadwrażliwość na diklofenak lub inne składniki preparatu1
- Czynna choroba wrzodowa żołądka lub dwunastnicy, krwawienie lub perforacja2
- Ostatni trymestr ciąży3
- Ciężka niewydolność wątroby, nerek lub serca4
- Stwierdzona zastoinowa niewydolność serca, choroba niedokrwienna serca, choroba naczyń obwodowych lub mózgowych2
- Reakcje alergiczne (astma, pokrzywka, nieżyt nosa) po zastosowaniu kwasu acetylosalicylowego lub innych NLPZ5
Profil bezpieczeństwa
Diklofenak nie powinien być stosowany w ostatnim trymestrze ciąży. W pierwszym i drugim trymestrze oraz podczas karmienia piersią decyzję o zastosowaniu podejmuje lekarz1. Lek może wpływać na zdolność prowadzenia pojazdów – szczególnie jeśli wystąpią zawroty głowy lub zaburzenia widzenia2. W przypadku osób starszych, z niewydolnością nerek lub wątroby, konieczna jest ostrożność i ścisła kontrola podczas stosowania3. Diklofenak nie powinien być łączony z alkoholem, ponieważ zwiększa to ryzyko uszkodzenia przewodu pokarmowego i wątroby4.
Przedawkowanie
Objawy przedawkowania diklofenaku mogą obejmować nudności, wymioty, biegunkę, krwawienia z przewodu pokarmowego, zawroty głowy czy drgawki1. W ciężkich przypadkach może dojść do uszkodzenia nerek lub wątroby2. W przypadku podejrzenia przedawkowania należy niezwłocznie zwrócić się o pomoc medyczną.
Najważniejsze interakcje
- Inne niesteroidowe leki przeciwzapalne (NLPZ) – zwiększone ryzyko działań niepożądanych1
- Leki przeciwzakrzepowe i przeciwpłytkowe – większe ryzyko krwawień1
- Leki moczopędne, inhibitory ACE – możliwe osłabienie działania tych leków i ryzyko zaburzeń nerek2
- Leki na cukrzycę – konieczność monitorowania poziomu cukru3
- Metotreksat, cyklosporyna, takrolimus – większe ryzyko działań niepożądanych4
Najczęstsze działania niepożądane
- Bóle głowy i zawroty głowy1
- Nudności, biegunka, ból brzucha1
- Wysypka, świąd, pokrzywka1
- Reakcje alergiczne, rzadziej obrzęk naczynioruchowy1
- Podrażnienia i reakcje w miejscu podania (żel, zastrzyki)2
- Wysokie dawki i długotrwałe stosowanie mogą zwiększać ryzyko powikłań sercowo-naczyniowych3
Mechanizm działania
Diklofenak hamuje enzymy cyklooksygenazy (COX-1 i COX-2), które biorą udział w wytwarzaniu prostaglandyn – substancji odpowiedzialnych za powstawanie bólu, gorączki i stanu zapalnego12. Dzięki temu zmniejsza objawy zapalenia i łagodzi ból.
Stosowanie w ciąży
Diklofenak jest przeciwwskazany w ostatnim trymestrze ciąży1. W pierwszym i drugim trymestrze stosowanie leku jest możliwe tylko wtedy, gdy lekarz uzna to za konieczne, w możliwie najniższej dawce i przez najkrótszy czas2.
Stosowanie u dzieci
Nie wszystkie postacie diklofenaku są przeznaczone dla dzieci. Większość preparatów jest zalecana dopiero od 14. roku życia1. Stosowanie u młodszych dzieci jest możliwe tylko w określonych przypadkach i pod ścisłym nadzorem lekarza.
Stosowanie u kierowców
Diklofenak może powodować zawroty głowy, senność lub zaburzenia widzenia. Jeśli takie objawy wystąpią, nie należy prowadzić pojazdów ani obsługiwać maszyn1.
Diklofenak – porównanie substancji czynnych
Diklofenak, aceklofenak i ketoprofen to leki przeciwzapalne stosowane głównie w leczeniu bólu i stanów zapalnych stawów. Różnią się wskazaniami, bezpieczeństwem i postaciami. Podobieństwa i różnice mi...
czytaj więcej ❯❯- CHPL leku Veral, Żel, 10 mg/g (1%)Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Veral, 10 mg/g (1%), żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 10 mg diklofenaku sodowego (Diclofenacum natricum). Substancja pomocnicza o znanym działaniu: etanol 15 g/100 g. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel. Jednorodny, bezbarwny, przejrzysty żel o charakterystycznym zapachu alkoholu.
- CHPL leku Veral, Żel, 10 mg/g (1%)Wskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy Veral jest wskazany do stosowania dorosłych i młodzieży w wieku powyżej 14 lat. Produkt działa przeciwbólowo, przeciwzapalnie i przeciwobrzękowo. Stosowany jest w miejscowym leczeniu: Dorośli i młodzież powyżej 14 lat: pourazowych stanów zapalnych ścięgien, więzadeł, mięśni i stawów (np. powstałych wskutek skręceń, nadwyrężeń lub stłuczeń) bólu pleców ograniczonych stanów zapalnych tkanek miękkich takich, jak: zapalenie ścięgien, łokieć tenisisty, zapalenie torebki stawowej, zapalenie okołostawowe. Dorośli (powyżej 18 lat) ograniczonych i łagodnych postaci choroby zwyrodnieniowej stawów.
- CHPL leku Veral, Żel, 10 mg/g (1%)Dawkowanie
4.2 Dawkowanie i sposób podawania Dorośli i młodzież powyżej 14 lat: Dawkowanie Veral należy stosować miejscowo na skórę trzy lub cztery razy na dobę, delikatnie wcierając. Ilość zużytego żelu należy dostosować do rozmiarów miejsca zmienionego chorobowo. Na przykład ilość 2 g do 4 g produktu Veral (ilość odpowiadająca wielkości owocu wiśni do rozmiarów orzecha włoskiego) jest wystarczająca do posmarowania powierzchni około 400 cm2 do 800 cm2. Po zastosowaniu produktu należy umyć ręce, chyba że to ręce są miejscem wymagającym leczenia. Należy unikać kontaktu żelu z błoną śluzową oczu i jamy ustnej. Czas trwania leczenia Czas leczenia zależy od wskazań do stosowania i reakcji pacjenta na leczenie. U osób dorosłych i młodzieży powyżej 14 lat w przypadku stosowania produktu bez konsultacji z lekarzem, nie należy go stosować dłużej niż przez 14 dni w przypadku nadwyrężeń i reumatyzmu tkanki miękkiej.
- CHPL leku Veral, Żel, 10 mg/g (1%)Dawkowanie
U osób dorosłych (powyżej 18 lat) w przypadku bólu związanego z chorobą zwyrodnieniową stawów bez konsultacji z lekarzem nie należy stosować produktu przez dłużej niż 21 dni. Zaleca się kontrolę lekarską po 7 dniach stosowania żelu w przypadku braku skuteczności leczenia lub z chwilą nasilenia się objawów chorobowych. Stosowanie u dzieci (poniżej 14 lat) Brak wystarczających danych dotyczących skuteczności i bezpieczeństwa stosowania produktu u dzieci i młodzieży poniżej 14 lat (patrz także punkt. 4.3 Przeciwwskazania) Stosowanie u dzieci i młodzieży (powyżej 14 lat) U młodzieży powyżej 14 lat, w razie konieczności stosowania produktu leczniczego dłużej niż 7 dni w leczeniu bólu lub w przypadku pogorszenia się objawów, pacjent powinien skontaktować się z lekarzem. Stosowanie u osób w podeszłym wieku W przypadku stosowania produktu Veral u osób w podeszłym wieku należy stosować dawkowanie jak u osób dorosłych.
- CHPL leku Veral, Żel, 10 mg/g (1%)Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Stwierdzona wcześniej alergia na kwas acetylosalicylowy lub inne niesteroidowe leki przeciwzapalne, objawiająca się napadem astmy, pokrzywką lub ostrym zapaleniem błony śluzowej nosa). Produktu nie wolno stosować w trzecim trymestrze ciąży. Nie stosować u dzieci i młodzieży w wieku poniżej 14 lat.
- CHPL leku Veral, Żel, 10 mg/g (1%)Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie można wykluczyć możliwości wystąpienia ogólnoustrojowych działań niepożądanych w przypadku stosowania produktu Veral na duże powierzchnie skóry lub podczas stosowania długotrwałego. Veral należy stosować tylko na nieuszkodzoną powierzchnię skóry. Należy unikać kontaktu żelu z oczami i błonami śluzowymi (np. jama ustna). Należy zaprzestać stosowania produktu, jeśli po jego nałożeniu pojawi się wysypka. Veral może być stosowany jednocześnie z nieokluzyjnymi bandażami, ale nie należy stosować go z nieprzepuszczającymi powietrza opatrunkami okluzyjnymi. Ten produkt leczniczy zawiera 600 mg alkoholu (etanolu) w każdej dawce 4 g żelu, co jest równoważne 15 g/ 100 g. Może powodować pieczenie uszkodzonej skóry.
- CHPL leku Veral, Żel, 10 mg/g (1%)Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Po zastosowaniu żelu na skórę, ilość diklofenaku, która ulega wchłonięciu do krążenia ogólnego jest niewielka, dlatego prawdopodobieństwo wystąpienia interakcji z innymi lekami jest niewielkie.
- CHPL leku Veral, Żel, 10 mg/g (1%)Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Stopień ekspozycji ogólnoustrojowej diklofenaku po zastosowaniu na skórę jest niższy w porównaniu z doustnymi formami. W oparciu o doświadczenia dotyczące stosowania NLPZ i ich działanie ogólnoustrojowe zaleca się uwzględnić poniższe informacje: Zahamowanie syntezy prostaglandyn może negatywnie wpływać na ciążę i (lub) rozwój zarodka lub płodu. Dane z badań epidemiologicznych sugerują zwiększone ryzyko poronienia, wad rozwojowych serca i wytrzewienia w przypadku stosowania inhibitorów syntezy prostaglandyn we wczesnej ciąży. Całkowite ryzyko wystąpienia wad rozwojowych serca zostaje zwiększone z 1% do 1,5%. Uważa się, że ryzyko to zwiększa się wraz ze zwiększeniem dawki i czasu trwania terapii. U zwierząt wykazano, że podawanie inhibitorów syntezy prostaglandyn skutkowało zwiększoną utratą płodów przed i po implantacji oraz śmiertelnością zarodków lub płodów.
- CHPL leku Veral, Żel, 10 mg/g (1%)Wpływ na płodność, ciążę i laktację
Dodatkowo zwiększenie ilości przypadków różnych wad wrodzonych, również układu sercowo-naczyniowego obserwowano u zwierząt, którym podawano inhibitory syntezy prostaglandyn podczas okresu organogenezy. Jeśli nie jest to wyraźnie konieczne, nie należy stosować diklofenaku podczas pierwszego i drugiego trymestru ciąży. W przypadku stosowania diklofenaku u kobiet planujących ciążę oraz w czasie pierwszego i drugiego trymestru ciąży, należy stosować dawkę możliwie najmniejszą, a czas trwania terapii najkrótszy. Podczas trzeciego trymestru ciąży stosowanie wszystkich inhibitorów syntezy prostaglandyn może powodować ekspozycję płodu na: d działanie toksyczne na układ krążenia i oddechowy (w tym przedwczesne zamknięcie przewodu tętniczego i nadciśnienie płucne) zaburzenia czynności nerek, które mogą postępować skutkując niewydolnością nerek z małowodziem.
- CHPL leku Veral, Żel, 10 mg/g (1%)Wpływ na płodność, ciążę i laktację
Narażenie matki i noworodka pod koniec ciąży na: możliwe wydłużenie czasu trwania krwawienia oraz działanie antyagregacyjne, które mogą wystąpić nawet podczas stosowania bardzo małych dawek zahamowanie skurczów macicy skutkujące opóźnionym lub przedłużonym porodem. Dlatego też stosowanie diklofenaku jest przeciwwskazane podczas trzeciego trymestru ciąży. Laktacja Podobnie jak inne NLPZ, diklofenak przenika do mleka kobiet karmiących piersią w niewielkich ilościach. Mimo to stosowanie produktu Veral w dawkach terapeutycznych nie wywiera wpływu na karmione dziecko. Ze względu na brak kontrolowanych badań dotyczących kobiet karmiących piersią, produkt należy stosować w czasie laktacji jedynie na zlecenie lekarza. W takich przypadkach produktu Veral nie należy stosować na okolice piersi kobiet karmiących piersią ani też na duże powierzchnie skóry lub długotrwale (patrz punkt 4.4).
- CHPL leku Veral, Żel, 10 mg/g (1%)Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Veral nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn, po zastosowaniu na skórę.
- CHPL leku Veral, Żel, 10 mg/g (1%)Działania niepożądane
4.8 Działania niepożądane Poniżej podano działania niepożądane zgodnie z klasyfikacją MedDRA, z następującymi wskaźnikami częstości występowania: bardzo często (≥1/10); często (1/100 do <1/10); niezbyt często (1/1000 do <1/100); rzadko (1/10 000 do <1/1000); bardzo rzadko (<1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia ogólne i stany w miejscu podania Rzadko: miejscowe zapalenie skóry z wysypką, świądem, zaczerwienieniem, obrzękiem, obecnością grudek, łuszczeniem się skóry lub uczuciem palenia skóry. Zakażenia i zarażenia pasożytnicze Bardzo rzadko: wysypka grudkowata. Zaburzenia układu immunologicznego Bardzo rzadko: nadwrażliwość (w tym pokrzywka), obrzęk naczynioruchowy. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Bardzo rzadko: astma. Zaburzenia skóry i tkanki podskórnej Często: wysypka, wyprysk, rumień, zapalenie skóry (w tym kontaktowe zapalenie skóry), świąd.
- CHPL leku Veral, Żel, 10 mg/g (1%)Działania niepożądane
Rzadko: pęcherzykowe zapalenie skóry. Bardzo rzadko: reakcje nadwrażliwości na światło. Wyjątkowo, podczas stosowania produktu na dużych powierzchniach skóry nie można wykluczyć wystąpienia działań niepożądanych dotyczących przewodu pokarmowego. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: 22 49-21-301, fax: 22 49-21-309, strona internetowa: https://smz.ezdrowie.gov.pl.
- CHPL leku Veral, Żel, 10 mg/g (1%)Działania niepożądane
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego w Polsce.
- CHPL leku Veral, Żel, 10 mg/g (1%)Przedawkowanie
4.9 Przedawkowanie Przedawkowanie produktu jest mało prawdopodobne ze względu na niewielkie wchłanianie diklofenaku stosowanego miejscowo. Po przypadkowym połknięciu produktu Veral mogą wystąpić działania niepożądane, podobne do obserwowanych po przedawkowaniu diklofenaku w postaci tabletek (100 g produktu zawiera 1000 mg soli sodowej diklofenaku). W razie przypadkowego połknięcia produktu, skutkującego działaniami niepożądanymi, należy zastosować leki i wdrożyć leczenie objawowe zwykle stosowane w przypadku leczenia zatruć niesteroidowymi lekami przeciwzapalnymi. Można wykonać płukanie żołądka lub podać węgiel aktywowany, zwłaszcza w początkowym okresie po spożyciu produktu.
- CHPL leku Veral, Żel, 10 mg/g (1%)Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne i przeciwreumatyczne do stosowania miejscowego, kod ATC: M 02 AA 15. Mechanizm działania Diklofenak jest niesteroidowym lekiem przeciwzapalnym (NLPZ) o silnym działaniu przeciwbólowym, przeciwzapalnym i przeciwgorączkowym. Podstawowy mechanizm działania diklofenaku polega na hamowaniu syntezy prostaglandyn. W zapaleniach pochodzenia urazowego lub reumatycznego diklofenak łagodzi ból, zmniejsza obrzęk i skraca czas powrotu do stanu normalnego funkcjonowania. Dane z badań klinicznych przeprowadzonych wśród pacjentów z ostrym bólem karku wykazały, że diklofenak redukuje ostry ból (p<0,0001 w porównaniu z placebo w postaci żelu) w ciągu godziny po zastosowaniu. Po dwóch dniach leczenia 94% pacjentów potwierdziło działanie diklofenaku w porównaniu z 8% pacjentów, którzy odczuli poprawę po zastosowaniu placebo w żelu (p<0.0001).
- CHPL leku Veral, Żel, 10 mg/g (1%)Właściwości farmakodynamiczne
Przywrócenie sprawności ruchowej oraz redukcja bólu nastąpiła po 4 dniach stosowania diklofenaku (p<0,0001 w porównaniu z placebo w postaci żelu). Ze względu na wodno-alkoholowe podłoże Veral wykazuje również działanie kojące i chłodzące.
- CHPL leku Veral, Żel, 10 mg/g (1%)Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Ilość wchłanianego przez skórę diklofenaku po zastosowaniu diklofenaku zależy od czasu kontaktu żelu ze skórą, od rozmiarów leczonego miejsca, jak również od całkowitej użytej miejscowo dawki oraz od stopnia nawilżenia skóry. Po zastosowaniu miejscowym 2,5g diklofenaku na powierzchnię 500 cm², ilość wchłoniętego diklofenaku odpowiada około 6% dawki podanej jako diklofenak tabletki. Określana jest ona w stosunku do ilości diklofenaku w ogólnej eliminacji nerkowej. Okluzja prowadzona przez 10 godzin prowadzi do trzykrotnego zwiększenia ilości wchłoniętego diklofenaku. Dystrybucja Po zastosowaniu miejscowym diklofenaku na stawy kolanowe i rąk można oznaczyć stężenie diklofenaku w osoczu krwi, w maziówce i w płynie maziówkowym. Jego maksymalne stężenie w osoczu krwi jest około 100 razy mniejsze niż stężenie osiągane po doustnym podaniu tabletek zawierających diklofenak.
- CHPL leku Veral, Żel, 10 mg/g (1%)Właściwości farmakokinetyczne
99,7% diklofenaku wiąże się z białkami osocza krwi, głównie z albuminami (99,4%). Diklofenak gromadzi się w skórze, która działa jak rezerwuar, z którego uwalniany jest on w sposób ciągły do głębiej znajdujących się tkanek. Diklofenak jest preferencyjnie dystrybuowany i pozostaje w głębi tkanek objętych stanem zapalnym, gdzie osiąga stężenie do 20 razy wyższe niż w osoczu krwi. Metabolizm Biotransformacja diklofenaku obejmuje częściowo glukuronidację nie zmienionej cząsteczki, jednak przede wszystkim ulega on pojedynczej lub wielokrotnej hydroksylacji, w wyniku czego powstają metabolity fenolowe, z których większość jest sprzęgana z glukuronidami. Dwa metabolity fenolowe są biologicznie czynne, wykazują jednak znacznie mniejszy stopień aktywności w porównaniu z diklofenakiem. Eliminacja Całkowity klirens nerkowy diklofenaku wynosi 263 ± 56 ml/min. Okres półtrwania w fazie eliminacji w osoczu wynosi 1 do 2 godzin.
- CHPL leku Veral, Żel, 10 mg/g (1%)Właściwości farmakokinetyczne
Cztery metabolity, włączając dwa metabolity biologicznie czynne, mają także krótki osoczowy okres półtrwania wynoszący 1 do 3 godzin. Piąty z metabolitów, 3`-hydroksy- 4`-metoksy-diklofenak, ma dłuższy okres półtrwania. Jest to jednak metabolit nieaktywny biologicznie. Diklofenak i jego metabolity ulegają wydalaniu głównie w moczu. Nie zaobserwowano występowania kumulacji diklofenaku i jego metabolitów u pacjentów z zaburzeniami czynności nerek. U pacjentów z przewlekłym zapaleniem wątroby lub wyrównaną marskością wątroby, kinetyka i metabolizm diklofenaku są takie same jak u pacjentów bez chorób wątroby.
- CHPL leku Veral, Żel, 10 mg/g (1%)Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane przedkliniczne z badań toksyczności ostrej i po podaniu dawki wielokrotnej, a także z badań genotoksyczności, potencjału mutagennego i rakotwórczego wykazały, że w zakresie dawek terapeutycznych diklofenak nie wykazuje specyficznego zagrożenia dla ludzi. Nie wykazano teratogennego działania diklofenaku u myszy, szczurów i królików. Diklofenak nie wpływa na płodność u szczurów. Rozwój przed-, około- i poporodowy potomstwa nie był zaburzony. W wielu badaniach diklofenak był dobrze tolerowany. Produkt nie wykazywał działania fotouczulającego, oraz nie powodował uczuleń skórnych.
- CHPL leku Veral, Żel, 10 mg/g (1%)Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Alkohol etylowy 96% Alkohol izopropylowy Trolamina Karbomer Woda oczyszczona 6.2 Niezgodności farmaceutyczne Brak. 6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem. 6.5 Rodzaj i zawartość opakowania Tuba Aluminium z membraną, zamknięta zakrętką z PE lub PP, w tekturowym pudełku. Tuba laminowana (PE/Aluminium/PE lub PE/EVOH/PE) z zakrętką z polipropylenu w tekturowym pudełku. Wielkość opakowania: 55 g żelu, 100 g żelu. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Podanie miejscowe na skórę. Zwykle 3 do 4 razy na dobę 2 g do 4 g żelu (ilość odpowiadająca wielkości czereśni lub orzecha włoskiego, wystarczająca do posmarowania powierzchni około 400 cm2 do 800 cm2). Nanieść na chore miejsce i rozetrzeć.
- CHPL leku Veral, Żel, 10 mg/g (1%)Dane farmaceutyczne
Po zastosowaniu produktu należy umyć ręce, chyba że to ręce są miejscem wymagającym leczenia. Należy unikać kontaktu żelu z błoną śluzową oczu i jamy ustnej.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ARTHROTEC, 50 mg + 0,2 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne: Każda tabletka składa się z rdzenia odpornego na działanie soku żołądkowego, zawierającego 50 mg diklofenaku sodowego, osłoniętego zewnętrzną otoczką zawierającą 0,2 mg mizoprostolu (w postaci zawiesiny Mizoprostol: Hypromeloza 1:100) (Diclofenacum natricum + Misoprostolum). Substancje pomocnicze o znanym działaniu: Każda tabletka zawiera 13 mg laktozy jednowodnej. Każda tabletka zawiera 1,3 mg oleju rycynowego uwodornionego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka. Białe, okrągłe, obustronnie wypukłe tabletki, oznaczone „A” na jednej stronie i „Searle 1411” na drugiej stronie.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt ARTHROTEC jest wskazany do stosowania u pacjentów wymagających jednoczesnego stosowania niesteroidowego leku przeciwzapalnego (diklofenak) z mizoprostolem. Diklofenak wchodzący w skład produktu ARTHROTEC jest wskazany w leczeniu objawowym choroby zwyrodnieniowej stawów oraz reumatoidalnego zapalenia stawów. Mizoprostol jest wskazany w leczeniu pacjentów, u których istnieje konieczność profilaktyki owrzodzenia żołądka i (lub) dwunastnicy wywołanego przez leki z grupy NLPZ.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgDawkowanie
4.2 Dawkowanie i sposób podawania Występowanie działań niepożądanych można ograniczyć stosując produkt w najmniejszej skutecznej dawce i nie dłużej niż to koniecznie do kontrolowania objawów (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Dawkowanie Dorośli: Jedna tabletka przyjmowana podczas posiłku, jeden do trzech razy na dobę. Tabletki należy połykać w całości, nie rozgryzać. Pacjenci w podeszłym wieku, pacjenci z zaburzeniami czynności nerek, wątroby, pacjenci z niewydolnością serca: Nie ma konieczności modyfikacji dawkowania produktu u pacjentów w podeszłym wieku, u pacjentów z zaburzeniami czynności wątroby oraz u pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności nerek, ponieważ nie stwierdzono znaczących klinicznie zmian właściwości farmakokinetycznych produktu w tych grupach pacjentów.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgDawkowanie
Jednak pacjenci w podeszłym wieku, pacjenci z zaburzeniami czynności nerek lub wątroby oraz pacjenci z niewydolnością serca, powinni być dokładnie monitorowani (patrz punkty 4.3, 4.4 i 4.8). Dzieci i młodzież: Bezpieczeństwo i skuteczność stosowania produktu ARTHROTEC u dzieci i młodzieży w wieku poniżej 18 lat nie zostały zbadane.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgPrzeciwwskazania
4.3 Przeciwwskazania Produkt ARTHROTEC jest przeciwwskazany w następujących przypadkach: nadwrażliwość na diklofenak, kwas acetylosalicylowy, leki z grupy NLPZ, mizoprostol, inne prostaglandyny lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; czynna choroba wrzodowa żołądka i (lub) dwunastnicy, perforacja lub krwawienie; inne czynne krwawienia, np. krwawienia o charakterze naczyniowo-mózgowym; u kobiet w czasie ciąży lub u kobiet planujących ciążę (patrz punkty 4.6 i 4.8); u kobiet w wieku rozrodczym, które nie stosują skutecznych metod antykoncepcji (patrz punkty 4.4, 4.6 i 4.8); u pacjentów, u których kwas acetylosalicylowy lub leki z grupy NLPZ wywołują napady astmy, pokrzywkę lub ostry nieżyt nosa; leczenie bólu okołooperacyjnego w przypadku zabiegu pomostowania tętnic wieńcowych; stwierdzona zastoinowa niewydolność serca (klasa II–IV wg NYHA), choroba niedokrwienna serca, choroba naczyń obwodowych i (lub) choroba naczyń mózgowych; ciężka niewydolność nerek lub wątroby.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ostrzeżenia Należy unikać jednoczesnego stosowania produktu ARTHROTEC i innych podawanych ogólnoustrojowo leków z grupy NLPZ innych niż kwas acetylosalicylowy, w tym inhibitorów COX-2. Jednoczesne stosowanie podawanego ogólnoustrojowo leku z grupy NLPZ i innego podawanego ogólnoustrojowo leku z grupy NLPZ może zwiększać częstość występowania owrzodzeń i krwawień z przewodu pokarmowego. Stosowanie u kobiet w wieku rozrodczym Nie stosować produktu ARTHROTEC u kobiet w wieku rozrodczym (patrz też punkt 4.3), chyba że stosują one skuteczne metody antykoncepcji i zostały poinformowane o zagrożeniach związanych z przyjmowaniem tego produktu w okresie ciąży (patrz punkt 4.6). Na opakowaniu znajduje się ostrzeżenie: „Nie stosować u kobiet w wieku rozrodczym, chyba że stosują one skuteczne metody antykoncepcji”.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
Środki ostrożności Działania niepożądane mogą być zmniejszone poprzez stosowanie najmniejszej skutecznej dawki przez możliwie najkrótszy okres konieczny do złagodzenia objawów (patrz punkt 4.2 oraz informacje poniżej). Zaburzenia czynności nerek lub wątroby, zaburzenia serca Zaleca się zachowanie ostrożności u pacjentów z zaburzeniami czynności nerek, wątroby lub z poważnymi zaburzeniami serca oraz u osób w podeszłym wieku, ponieważ stosowanie leków z grupy NLPZ może powodować zaburzenia czynności nerek. W przypadku poważnych zaburzeń serca, ciężkich zaburzeń czynności nerek, ciężkich zaburzeń czynności wątroby, znacznego odwodnienia produkt ARTHROTEC powinien być stosowany tylko w wyjątkowych sytuacjach i w warunkach ścisłego monitorowania stanu pacjenta. Metabolity diklofenaku są wydalane głównie przez nerki (patrz punkt 5.2). Nie określono stopnia, w jakim metabolity te mogą się kumulować u pacjentów z niewydolnością nerek.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
Podobnie jak w przypadku stosowania pozostałych leków z grupy NLPZ, których metabolity wydalane są przez nerki, podczas stosowania produktu ARTHROTEC należy dokładnie monitorować pacjentów z zaburzeniami czynności nerek. Rzadko, leki z grupy NLPZ, w tym produkt złożony zawierający diklofenak i mizoprostol, mogą powodować śródmiąższowe zapalenie nerek, zapalenie kłębuszków nerkowych, martwicę brodawek nerkowych oraz zespół nerczycowy. Leki z grupy NLPZ hamują syntezę prostaglandyny w nerkach, która wspomaga utrzymywanie perfuzji nerek u pacjentów z obniżonym przepływem krwi przez nerki oraz zmniejszoną objętością krwi krążącej. U tych pacjentów podawanie leków z grupy NLPZ może powodować klinicznie jawną dekompensację czynności nerek, która zazwyczaj ustępuje do stanu sprzed leczenia po odstawieniu leków z tej grupy.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
Do grupy najwyższego ryzyka w tym zakresie należą pacjenci z zastoinową niewydolnością serca, marskością wątroby, zespołem nerczycowym, klinicznie jawną chorobą nerek i pacjenci w podeszłym wieku. Pacjenci ci powinni być dokładnie monitorowani podczas podawania leków z grupy NLPZ. Wpływ na wątrobę W badaniach klinicznych trwających od 4 do 12 tygodni, zaobserwowano klinicznie znamienne (>3-krotnie powyżej górnej granicy normy) zwiększenie aktywności AlAT (SGPT) i (lub) AspAT (SGOT) u 1,6% lub u mniejszego odsetka pacjentów otrzymujących diklofenak+mizoprostol lub diklofenak+placebo. W dużym badaniu, w którym pacjenci otrzymywali diklofenak w okresie wynoszącym średnio 18 miesięcy, u 3,1% pacjentów zaobserwowano zwiększenie aktywności AlAT/AspAT. Występowało ono zazwyczaj w okresie od 1. do 6. miesiąca.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
W badaniach klinicznych u pacjentów przyjmujących diklofenak obserwowano przypadki zapalenia wątroby; po wprowadzeniu produktu do obrotu zgłaszano inne reakcje ze strony wątroby, w tym żółtaczkę i niewydolność wątroby. U pacjentów leczonych produktem ARTHROTEC należy okresowo kontrolować czynność wątroby. Podczas stosowania produktu ARTHROTEC należy dokładnie monitorować pacjentów z zaburzeniami czynności wątroby. Należy podjąć decyzję o zaprzestaniu stosowania produktu, jeśli badania wskazują na utrzymywanie się lub pogorszenie zaburzeń czynności wątroby, wystąpią objawy kliniczne wskazujące na chorobę wątroby, zmiany ogólnoustrojowe lub wystąpią inne objawy, takie jak eozynofilia czy wysypka (patrz punkt 4.3). Zapalenie wątroby może przebiegać bez poprzedzających objawów. Wpływ na układ krążenia i naczynia zaopatrujące mózg Ze względu na obserwowane przypadki zatrzymywania płynów i obrzęków związanych ze stosowaniem leków z grupy NLPZ, u pacjentów z nadciśnieniem tętniczym i (lub) łagodną zastoinową niewydolnością serca konieczne jest odpowiednie monitorowanie i zalecenia lekarskie.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
Diklofenak należy stosować bardzo ostrożnie u pacjentów z istotnymi czynnikami ryzyka zdarzeń dotyczących układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Produkt ten należy stosować możliwie najkrócej i w najmniejszej skutecznej dawce dobowej, ze względu na możliwość nasilenia ryzyka dotyczącego układu krążenia po zastosowaniu diklofenaku w dużych dawkach i długotrwale. Należy okresowo kontrolować konieczność kontynuacji leczenia objawowego i odpowiedź na leczenie. Badania kliniczne oraz dane epidemiologiczne wskazują, że stosowanie diklofenaku, szczególnie w dużych dawkach (150 mg na dobę) oraz w leczeniu długotrwałym, może być związane ze zwiększonym ryzykiem wystąpienia ciężkich zdarzeń sercowo-naczyniowych (np. zawału serca lub udaru), które mogą prowadzić do zgonu.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
Względny wzrost tego ryzyka wydaje się być podobny u pacjentów z rozpoznaną lub nierozpoznaną chorobą sercowo-naczyniową lub u pacjentów, u których występują czynniki ryzyka wystąpienia zdarzeń sercowo-naczyniowych. Jednak u pacjentów z rozpoznaną chorobą sercowo-naczyniową lub u pacjentów, u których występują czynniki ryzyka wystąpienia zdarzeń sercowo-naczyniowych, ryzyko to może być zwiększone, gdyż występuje ono już na początku obserwacji. Lekarze i pacjenci powinni być świadomi możliwości wystąpienia takich zdarzeń nawet wówczas, gdy wcześniej nie pojawiły się żadne objawy dotyczące układu sercowo-naczyniowego. Należy poinformować pacjentów o objawach przedmiotowych i podmiotowych ciężkiej toksyczności dotyczącej układu sercowo-naczyniowego oraz o działaniach, jakie należy podjąć w przypadku wystąpienia takich objawów (patrz punkt 4.3).
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
Zaburzenia układu pokarmowego Leki z grupy NLPZ, w tym produkt złożony zawierający diklofenak i mizoprostol, mogą powodować ciężkie działania niepożądane dotyczące przewodu pokarmowego, w tym stany zapalne, krwawienie, owrzodzenie oraz perforacje żołądka, jelita cienkiego i jelita grubego, mogące kończyć się zgonem. W przypadku wystąpienia krwawienia lub owrzodzeń w przewodzie pokarmowym należy przerwać podawanie produktu złożonego zawierającego diklofenak i mizoprostol. Powyższe zdarzenia mogą wystąpić w dowolnym momencie leczenia, z objawami zwiastującymi lub bez, lub u pacjentów z ciężkimi zdarzeniami niepożądanymi dotyczącymi przewodu pokarmowego w wywiadzie. Do grupy największego ryzyka występowania wymienionych powikłań dotyczących układu pokarmowego związanych ze stosowaniem leków z grupy NLPZ należą pacjenci otrzymujący duże dawki produktu leczniczego, pacjenci w podeszłym wieku, pacjenci z zaburzeniami sercowo-naczyniowymi, pacjenci przyjmujący jednocześnie kwas acetylosalicylowy, kortykosteroidy, selektywne inhibitory wychwytu zwrotnego serotoniny, pacjenci spożywający alkohol lub pacjenci z chorobami przewodu pokarmowego, czynnymi lub w wywiadzie, takimi jak owrzodzenie, krwawienie z przewodu pokarmowego lub stan zapalny błony śluzowej przewodu pokarmowego.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
Z tego względu produkt złożony zawierający diklofenak i mizoprostol należy stosować w tej grupie pacjentów ostrożnie, rozpoczynając leczenie od możliwie najmniejszej skutecznej dawki (patrz punkt 4.3). Pacjenci z objawami toksycznego wpływu na przewód pokarmowy w wywiadzie, w szczególności pacjenci w podeszłym wieku, powinni zgłaszać zwłaszcza w początkowej fazie leczenia, wszelkie nietypowe objawy brzuszne (szczególnie krwawienie z przewodu pokarmowego). Należy zachować ostrożność u pacjentów przyjmujących jednocześnie leki, które mogą zwiększać ryzyko owrzodzenia lub krwawienia, takie jak doustne kortykosteroidy, leki przeciwzakrzepowe, takie jak warfaryna, acenokumarol, selektywne inhibitory wychwytu zwrotnego serotoniny oraz leki hamujące agregację płytek, takie jak kwas acetylosalicylowy (patrz punkt 4.5). Stosowanie NLPZ, w tym diklofenaku, może wiązać się ze zwiększeniem ryzyka nieszczelności zespolenia żołądkowo-jelitowego.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
Zaleca się ścisły nadzór medyczny i zachowanie ostrożności podczas stosowania diklofenaku po operacjach przewodu pokarmowego. Produkt ARTHROTEC, podobnie jak inne leki z grupy NLPZ, może zmniejszać agregację płytek i wydłużać czas krwawienia. Szczególnie uważne monitorowanie pod tym kątem jest wskazane u pacjentów z zaburzeniami układu krwiotwórczego lub o zmniejszonej krzepliwości, oraz u pacjentów z krwawieniem naczyniowo-mózgowym w wywiadzie. Produkt może zaostrzać objawy choroby u pacjentów z wrzodziejącym zapaleniem jelita grubego lub chorobą Leśniowskiego-Crohna, dlatego konieczne jest zachowanie ostrożności podczas jego stosowania w tych grupach pacjentów (patrz punkt 4.8). Należy zachować ostrożność u pacjentów w podeszłym wieku oraz u pacjentów przyjmujących kortykosteroidy, inne leki z grupy NLPZ oraz leki przeciwzakrzepowe (patrz punkt 4.5).
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
Toczeń rumieniowaty układowy i choroby tkanki łącznej U pacjentów z toczniem rumieniowatym układowym i chorobami tkanki łącznej, produkt ARTHROTEC może zwiększać ryzyko wystąpienia jałowego zapalenia opon mózgowych. Wpływ na skórę, reakcje skórne Podczas stosowania leków z grupy NLPZ, w tym produktu złożonego zawierającego diklofenak i mizoprostol (patrz punkt 4.8), bardzo rzadko obserwowano ciężkie reakcje skórne, niektóre zakończone zgonem, w tym osutka polekowa z eozynofilią i objawami układowymi (DRESS, ang. drug reaction with eosinophilia and systemic symptoms), złuszczające zapalenie skóry, zespół Stevensa-Johnsona oraz zespół Lyella. Uważa się, że ryzyko wystąpienia powyższych zdarzeń jest największe na początku leczenia, zazwyczaj w pierwszym miesiącu leczenia. Należy przerwać leczenie produktem ARTHROTEC w przypadku pierwszego wystąpienia wysypki skórnej, zmian w obrębie błon śluzowych lub jakichkolwiek innych objawów nadwrażliwości.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
Reakcje nadwrażliwości, astma Leki z grupy NLPZ mogą powodować skurcz oskrzeli u pacjentów z astmą oskrzelową lub chorobą alergiczną - czynną lub w wywiadzie. Tak, jak w przypadku innych NLPZ, rzadko mogą również występować reakcje alergiczne, w tym reakcje anafilaktyczne (rzekomoanafilaktyczne), po podaniu diklofenaku u osób, które wcześniej nie przyjmowały tego leku. Reakcje nadwrażliwości mogą także rozwinąć się w zespół Kounisa, ciężką reakcję alergiczną, która może prowadzić do zawału mięśnia sercowego. Objawy takich reakcji mogą obejmować ból w klatce piersiowej występujący w związku z reakcją alergiczną na diklofenak. Leczenie długotrwałe Wszystkich pacjentów otrzymujących długotrwałe leczenie produktem ARTHROTEC należy monitorować (np. monitorowanie czynności nerek i wątroby, oraz morfologii krwi).
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
Podczas leczenia długotrwałego z zastosowaniem dużych dawek produktu ARTHROTEC może wystąpić ból głowy, którego nie wolno leczyć poprzez podawanie kolejnych dawek tego produktu ani innych leków z grupy NLPZ. Produkt ARTHROTEC może maskować gorączkę, a tym samym chorobę zasadniczą, będącą przyczyną gorączki. Produkt ARTHROTEC nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy. Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę. Pacjentów będących na diecie niskosodowej można poinformować, że ten produkt leczniczy jest zasadniczo „wolny od sodu”. Produkt leczniczy ARTHROTEC zawiera również olej rycynowy uwodorniony, który może powodować niestrawność i biegunkę. Stosowanie diklofenaku z mizoprostolem może niekorzystnie wpływać na płodność u kobiet i nie jest ono zalecane u kobiet, które planują ciążę.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
W przypadku kobiet, które mają trudności z zajściem w ciążę lub są poddawane badaniom diagnostycznym w związku z niepłodnością, należy rozważyć zakończenie stosowania diklofenaku z mizoprostolem. Tak jak inne NLPZ, ARTHROTEC może powodować zaburzenia widzenia. Należy poinformować pacjenta, że powinien skontaktować się z lekarzem okulistą w przypadku wystąpienia zaburzeń widzenia. Stosowanie z doustnymi lekami przeciwzakrzepowymi Jednoczesne stosowanie leków z grupy NLPZ, w tym diklofenaku/mizoprostolu oraz doustnych leków przeciwzakrzepowych zwiększa ryzyko wystąpienia krwawień z przewodu pokarmowego i innych krwawień. Należy zachować ostrożność podczas jednoczesnego stosowania tych leków. Do doustnych leków przeciwzakrzepowych należą warfaryna/pochodne kumaryny oraz nowe leki przeciwzakrzepowe (np. apiksaban, dabigatran, rywaroksaban).
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgSpecjalne środki ostrozności
U pacjentów przyjmujących warfarynę/leki przeciwzakrzepowe z grupy pochodnych kumaryny należy kontrolować efekt przeciwkrzepliwy i (lub) wartość współczynnika INR (patrz punkt 4.5).
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Leki z grupy NLPZ mogą zmniejszać skuteczność działania diuretyków, ze względu na hamowanie nerkowej syntezy prostaglandyn. Podczas jednoczesnego stosowania z lekami moczopędnymi oszczędzającymi potas może wystąpić zwiększenie stężenia potasu w osoczu. Dlatego w takich przypadkach należy monitorować stężenie potasu w surowicy. Ze względu na działanie na prostaglandyny nerkowe, leki z grupy NLPZ, takie jak diklofenak, mogą zwiększać działania nefrotoksyczne cyklosporyny. W przypadku jednoczesnego podawania leków z grupy NLPZ z takrolimusem może wystąpić zwiększone działanie nefrotoksyczne. Jednoczesne stosowanie z cyklosporyną prowadzi do dwukrotnego zwiększenia ogólnoustrojowej ekspozycji na diklofenak. W związku z tym, ważne jest aby podawanie diklofenaku/mizoprostolu rozpocząć od najmniejszej dawki i uważnie monitorować stan pacjenta pod kątem wystąpienia objawów działania toksycznego.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgInterakcje
Produkt ARTHROTEC może powodować zwiększenie stężenia litu i digoksyny w osoczu w stanie stacjonarnym oraz zmniejszać stężenie ketokonazolu. Pacjentów przyjmujących digoksynę jednocześnie z produktem ARTHROTEC należy obserwować w kierunku możliwego wystąpienia toksycznego działania digoksyny. Badania farmakodynamiczne nie wykazały, aby diklofenak nasilał działanie doustnych leków przeciwcukrzycowych oraz doustnych leków zmniejszających krzepliwość. Diklofenak nie zmienia metabolizmu glukozy u zdrowych osób, a oddziaływanie doustnych leków zmniejszających stężenie glukozy we krwi nie ulegało zmianie w wyniku jednoczesnego podawania diklofenaku. Jednak ze względu na doniesienia o takich interakcjach z innymi lekami z grupy NLPZ zaleca się zachowanie ostrożności i monitorowanie pacjentów przyjmujących insulinę lub doustne leki zmniejszające stężenie glukozy we krwi (patrz punkt 4.4).
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgInterakcje
Ze względu na zmniejszoną agregację płytek krwi, zaleca się zachowanie ostrożności podczas stosowania produktu ARTHROTEC jednocześnie z lekami przeciwzakrzepowymi. Leki z grupy NLPZ mogą nasilać działanie leków przeciwzakrzepowych, takich jak warfaryna, leków hamujących agregację płytek, takich jak kwas acetylosalicylowy oraz inhibitorów selektywnego wychwytu zwrotnego serotoniny (SSRI), tym samym zwiększając ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.4). Kwas acetylosalicylowy: Diklofenak zostaje wyparty ze swojego miejsca wiązania przez kwas acetylosalicylowy, co prowadzi do zmniejszenia stężenia w osoczu, mniejszego maksymalnego stężenia w osoczu oraz zmniejszenia wartości AUC. Nie zaleca się jednoczesnego stosowania produktu ARTHROTEC w skojarzeniu z kwasem acetylosalicylowym. Podczas jednoczesnego podawania z lekami przeciwcukrzycowymi obserwowano przypadki hipo- i hiperglikemii.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgInterakcje
Należy ostrożnie stosować leki z grupy NLPZ jednocześnie z metotreksatem ze względu na możliwość zwiększonego działania toksycznego metotreksatu, związanego z jego zwiększonym stężeniem w osoczu, szczególnie u pacjentów otrzymujących duże dawki metotreksatu. Jednoczesne stosowanie z innymi lekami z grupy NLPZ lub z kortykosteroidami może zwiększać częstość występowania owrzodzeń lub krwawień z przewodu pokarmowego i innych działań niepożądanych. Leki przeciwnadciśnieniowe, w tym leki moczopędne, inhibitory konwertazy angiotensyny (ACE), antagoniści receptora AT1 angiotensyny II (AIIA) i ß-adrenolityki: Leki z grupy NLPZ mogą zmniejszać skuteczność leków moczopędnych i innych leków przeciwnadciśnieniowych, w tym inhibitorów konwertazy angiotensyny (ACE), antagonistów receptora angiotensyny II (AIIA) i ß-adrenolityków. U pacjentów z zaburzoną czynnością nerek (np.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgInterakcje
pacjentów odwodnionych lub w podeszłym wieku z zaburzoną czynnością nerek), jednoczesne podawanie inhibitora ACE lub leków z grupy AIIA i (lub) leków moczopędnych z inhibitorem cyklooksygenazy może prowadzić do zaburzenia czynności nerek, w tym do powstania ostrej niewydolności nerek, która jest na ogół odwracalna. Należy uwzględnić możliwość wystąpienia powyższych interakcji u pacjentów stosujących produkt złożony, zawierający diklofenak i mizoprostol jednocześnie z inhibitorem ACE lub lekiem z grupy AIIA, i (lub) lekami moczopędnymi. Produkty neutralizujące kwas solny mogą opóźniać wchłanianie diklofenaku. Produkty neutralizujące kwas solny w soku żołądkowym zawierające magnez mogą nasilać biegunkę wywołaną przez mizoprostol. Dane z badań na zwierzętach wskazują, że leki z grupy NLPZ mogą zwiększać częstość drgawek związanych z podawaniem chinolonów. U pacjentów przyjmujących leki z grupy NLPZ i chinolony może występować zwiększone ryzyko drgawek.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgInterakcje
Leki z grupy NLPZ nie powinny być stosowane w ciągu 8 do 12 dni po podaniu mifeprystonu, ponieważ mogą zmniejszać jego działanie. Silne inhibitory CYP2C9: Zaleca się zachowanie ostrożności w przypadku przepisywania diklofenaku w skojarzeniu z silnymi inhibitorami CYP2C9 (takimi jak sulfinpirazon i worykonazol), ponieważ może to skutkować znaczącym zwiększeniem stężenia maksymalnego w osoczu oraz ekspozycji na diklofenak w wyniku zahamowania metabolizmu diklofenaku. Worykonazol: Worykonazol zwiększa Cmax oraz AUC diklofenaku (przy zastosowaniu pojedynczej dawki 50 mg) odpowiednio o 114% i 78%.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Stosowanie produktu ARTHROTEC jest przeciwwskazane u kobiet w ciąży oraz planujących zajście w ciążę. Mizoprostol Mizoprostol wywołuje skurcze macicy i może powodować przerwanie ciąży, przedwczesny poród, śmierć płodu lub wady rozwojowe płodu. U kobiet w ciąży narażonych na działanie mizoprostolu w pierwszym trymestrze ciąży notowano około 3-krotnie większe ryzyko wad rozwojowych niż w grupie kontrolnej, w której ryzyko to wynosiło 2%. Narażenie na mizoprostol w okresie prenatalnym wiązało się w szczególności z wystąpieniem: zespołu Möbiusa (wrodzone porażenie nerwu twarzowego, prowadzące do hipomimii, trudności ze ssaniem i połykaniem oraz ruchy gałek ocznych, z wadami kończyn lub bez), zespoły pasm owodniowych [między innymi brak lub deformacja kończyn, zwłaszcza stopa końsko-szpotawa, wrodzony brak jednej lub obu rąk (ang.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgWpływ na płodność, ciążę i laktację
acheiria), oligodaktylia, rozszczep podniebienia] i wad rozwojowych ośrodkowego układu nerwowego (wady rozwojowe mózgu i czaszki, bezmózgowie, wodogłowie, niedorozwój móżdżku, wady cewy nerwowej). Obserwowano również inne wady, w tym artrogrypozę. W związku z tym: pacjentkę należy poinformować o ryzyku działania teratogennego, jeśli po narażeniu na działanie mizoprostolu in utero, pacjentka chce kontynuować ciążę, konieczne jest uważne monitorowanie ciąży za pomocą USG, ze szczególnym uwzględnieniem oceny kończyn i głowy płodu. Diklofenak Hamowanie syntezy prostaglandyn może wpływać negatywnie na ciążę i (lub) rozwój zarodka lub płodu. Dane z badań epidemiologicznych wskazują na zwiększone ryzyko poronienia, wad wrodzonych serca i wytrzewienia po zastosowaniu inhibitorów syntezy prostaglandyn we wczesnym stadium ciąży. Całkowite ryzyko wad rozwojowych układu krążenia zwiększyło się z poniżej 1% do około 1,5%. Uważa się, że ryzyko to zwiększa się wraz z dawką i czasem leczenia.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgWpływ na płodność, ciążę i laktację
U zwierząt wykazano, że podawanie inhibitorów syntezy prostaglandyn prowadzi do zwiększenia przed- i poimplantacyjnej utraty zarodków oraz do obumierania zarodka lub płodu. U zwierząt otrzymujących inhibitor syntezy prostaglandyn w okresie organogenezy dodatkowo odnotowano zwiększoną częstość występowania różnych wad rozwojowych, w tym wad układu krążenia. W drugim lub trzecim trymestrze ciąży leki z grupy NLPZ mogą działać na płód w następujący sposób: zaburzenia czynności nerek, które mogą prowadzić do niewydolności nerek z małowodziem. Takie działania mogą pojawić się wkrótce po rozpoczęciu leczenia i zwykle są odwracalne po zaprzestaniu stosowania; ponadto zgłaszano przypadki zwężenia przewodu tętniczego w trakcie leczenia w drugim trymestrze ciąży, z których większość ustępowała po zaprzestaniu stosowania.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgWpływ na płodność, ciążę i laktację
W trzecim trymestrze ciąży wszystkie inhibitory syntezy prostaglandyn mogą działać na płód w następujący sposób: toksyczne działanie dotyczące płuc i serca (przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne); zaburzenia czynności nerek (patrz wyżej). U matki i noworodka, pod koniec ciąży mogą prowadzić do: wydłużenia czasu krwawienia w wyniku działania antyagregacyjnego, które może wystąpić nawet po zastosowaniu bardzo małych dawek; hamowania czynności skurczowej macicy powodującego opóźnienie lub przedłużanie się porodu. Karmienie piersi? W organizmie kobiety karmiącej mizoprostol ulega szybkiemu przekształceniu do kwasu mizoprostolowego - związku biologicznie czynnego, i przenika do mleka matki. Nie należy stosować produktu ARTHROTEC u kobiet karmiących piersią, ponieważ kwas mizoprostolowy może wywołać u niemowląt karmionych piersią działania niepożądane, takie jak biegunka.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgWpływ na płodność, ciążę i laktację
Płodność Mechanizm działania sugeruje, że stosowanie NLPZ, w tym diklofenaku z mizoprostolem, może opóźnić lub uniemożliwić pękanie pęcherzyków Graafa, co wiązano z odwracalną bezpłodnością u niektórych kobiet. U kobiet mających trudności z poczęciem lub przechodzących badanie przyczyn bezpłodności, należy rozważyć odstawienie NLPZ, w tym diklofenaku z mizoprostolem. Kobiety w wieku rozrodczym Przed rozpoczęciem stosowania diklofenaku z mizoprostolem kobietę w wieku rozrodczym należy koniecznie poinformować o ryzyku działania teratogennego. Nie rozpoczynać stosowania produktu, do czasu upewnienia się, że kobieta nie jest w ciąży i że została w pełni poinformowana o znaczeniu stosowania odpowiedniej antykoncepcji w okresie przyjmowania produktu. Jeśli podejrzewa się, że kobieta jest w ciąży, leczenie należy natychmiast przerwać (patrz punkty 4.3, 4.4 i 4.8).
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjenci, u których występują zawroty głowy lub inne zaburzenia dotyczące ośrodkowego układu nerwowego podczas stosowania leków z grupy NLPZ, nie powinni prowadzić pojazdów ani obsługiwać maszyn.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgDziałania niepożądane
4.8 Działania niepożądane W poniższej tabeli przedstawiamy działania niepożądane produktu ARTHROTEC zaobserwowane w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu: Klasyfikacja układów i narządów Bardzo często (≥1/10) Często (≥1/100 do <1/10) Niezbyt często (≥1/1 000 do <1/100) Rzadko (≥1/10 000 do <1/1 000) Bardzo rzadko (<1/10 000) Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) Zakażenia i zarażenia pasożytnicze zapalenie pochwy Zaburzenia krwi i układu chłonnego trombocytopenia* niedokrwistość hemolityczna*, agranulocytoza*, zahamowanie agregacji płytek krwi* Zaburzenia układu immunologicznego reakcja anafilaktyczna* Zaburzenia metabolizmu i odżywiania retencja płynów* Zaburzenia psychiczne bezsenność koszmary senne* zmiany nastroju* Zaburzenia układu nerwowego ból głowy, zawroty głowy udar* aseptyczne zapalenie opon mózgowych* Zaburzenia oka niewyraźne widzenie* Zaburzenia serca zawał serca*, niewydolność serca* zespół Kounisa Zaburzenia naczyniowe nadciśnienie tętnicze* zapalenie naczyń* Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia duszność* Zaburzenia żołądka i jelit ból brzucha, biegunka, nudności, niestrawność owrzodzenie przewodu pokarmowego*, zapalenie dwunastnicy, zapalenie żołądka, zapalenie przełyku, zapalenie przewodu pokarmowego*, wymioty, zaparcia, wzdęcia z oddawaniem gazów, odbijanie się ze zwracaniem treści żołądkowej krwotok z przewodu pokarmowego*, zapalenia błony śluzowej jamy ustnej* zapalenie trzustki* perforacje przewodu pokarmowego* Zaburzenia wątroby i dróg żółciowych zapalenie wątroby* niewydolność wątroby*, żółtaczka* Zaburzenia skóry i tkanki podskórnej wysypka*, świąd pokrzywka*, plamica pęcherzowe zapalenie skóry*, obrzęk naczynioruchowy* toksyczne martwicze oddzielanie się naskórka*, zespół Stevensa-Johnsona*, rumień wielopostaciowy*, złuszczające zapalenie skóry*, reakcje śluzówkowo-skórne*, zespół DRESS Zaburzenia nerek i dróg moczowych niewydolność nerek*, zaburzenia czynności nerek*, martwica brodawek nerkowych*, zespół nerczycowy,* śródmiąższowe zapalenie nerek*, zapalenie kłębuszków nerkowych błoniaste*, zapalenie kłębuszków nerkowych submikroskopowe*, zapalenie kłębuszków nerkowych* Ciąża, połóg i okres okołoporodowy obumarcie płodu*, zator płynem owodniowym*, poronienie niepełne*, poród przedwczesny*, nieprawidłowe skurcze macicy* Zaburzenia układu rozrodczego i piersi nieregularne lub śródcykliczne krwawienie menstruacyjne, nadmierne krwawienie miesięczne, krwotok z pochwy (w tym krwawienie pomenopauzalne)*, zaburzenia miesiączkowania ból piersi, bolesne miesiączkowanie krwotok z macicy*, skurcz macicy, niepłodność kobieca (obniżenie płodności u kobiet)* Wady wrodzone, choroby rodzinne i genetyczne wady rozwojowe płodu* Zaburzenia ogólne i stany w miejscu podania gorączka*, obrzęk*, dreszcze* Badania diagnostyczne zwiększenie aktywności aminotransferazy alaninowej, obniżenie wartości hematokrytu, zwiększenie aktywności fosfatazy alkalicznej we krwi zwiększenie aktywności aminotransferazy asparaginianowej Urazy, zatrucia i powikłania po zabiegach pęknięcie macicy*, perforacja macicy* Działania niepożądane zgłoszone po wprowadzeniu produktu leczniczego do obrotu.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgDziałania niepożądane
† Terminy te dotyczą działań niepożądanych, które nie są zgodne ze słownikiem MedDRA 17.1. Działania niepożądane z kontrolowanych badań klinicznych, trwających do 24 miesięcy, dotyczą głównie układu pokarmowego. Biegunka i ból brzucha mają zwykle łagodne lub umiarkowane nasilenie i są przemijające; objawy te występują na wczesnym etapie leczenia i mogą trwać przez kilka dni. Biegunka i ból brzucha ustępują spontanicznie w trakcie trwania terapii diklofenakiem+mizoprostolem. U pacjentów w wieku 65 lat i starszych profil działań niepożądanych diklofenaku+mizoprostolu był zbliżony do profilu u młodszych pacjentów. Jedyną kliniczną różnicą było to, że pacjenci w wieku 65 lat i starsi wykazywali mniejszą tolerancję w stosunku do działań niepożądanych dotyczących żołądka i jelit, związanych ze stosowaniem diklofenaku+mizoprostolu podawanego trzy razy na dobę. Podczas stosowania leków z grupy NLPZ, w bardzo rzadkich przypadkach obserwowano nasilenie stanu zapalnego związanego z infekcją.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgDziałania niepożądane
W odniesieniu do względnej częstości zgłaszania działań niepożądanych obserwowanych po wprowadzeniu produktu leczniczego do obrotu, najczęściej zgłaszano działania niepożądane dotyczące układu pokarmowego (około 45% wszystkich zgłoszonych przypadków w bazie danych podmiotu odpowiedzialnego dotyczącej bezpieczeństwa stosowania), drugie w kolejności częstości zgłaszania były reakcje skórne oraz nadwrażliwości, co jest zgodne z profilem działań niepożądanych leków z grupy NLPZ. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg/dobę) i w leczeniu długotrwałym zwiększa ryzyko zakrzepicy tętnic (np. zawał serca lub udar) (patrz punkty 4.3 Przeciwwskazania i 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania).
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgPrzedawkowanie
4.9 Przedawkowanie Nie ustalono dawki toksycznej produktu ARTHROTEC. Opisano jednak objawy przedawkowania składników produktu. Do przedmiotowych objawów klinicznych, mogących wskazywać na przedawkowanie mizoprostolu, należą: uspokojenie polekowe, drżenie, drgawki, duszność, ból brzucha, biegunka, gorączka, kołatanie serca, niedociśnienie tętnicze lub bradykardia. Po przedawkowaniu produktu leczniczego ARTHROTEC pacjenci powinni być leczeni objawowo i wspomagająco. Brak jest swoistych odtrutek. Podanie węgla aktywowanego, jako leczenie pierwszego rzutu, może pomóc w zmniejszeniu wchłaniania produktu leczniczego ARTHROTEC. W przypadku przedawkowania należy monitorować czynność nerek. Nie potwierdzono wpływu dializy na eliminację diklofenaku (99% w postaci związanej z białkami) i kwasu mizoprostolu (mniej niż 90% w postaci związanej z białkami).
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu octowego w połączeniu z innymi lekami, diklofenak w połączeniach. Kod ATC: M01AB55 Produkt ARTHROTEC jest niesteroidowym lekiem przeciwzapalnym, skutecznym w leczeniu objawów podmiotowych i przedmiotowych stanów zapalnych stawów. Powyższe działanie jest związane z obecnością diklofenaku, który ma właściwości przeciwzapalne i przeciwbólowe. Produkt ARTHROTEC zawiera również składnik działający ochronnie na błonę śluzową żołądka i dwunastnicy – mizoprostol, który jest syntetycznym analogiem prostaglandyny E1, wzmacniającym szereg czynników działających ochronnie na błonę śluzową żołądka i dwunastnicy.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Profil farmakokinetyczny diklofenaku i mizoprostolu wchodzących w skład produktu ARTHROTEC jest zbliżony do profilu oddzielnie podawanych tabletek zawierających diklofenak i mizoprostol. Nie zaobserwowano interakcji farmakokinetycznych pomiędzy substancjami czynnymi produktu. Wchłanianie Po podaniu doustnym na czczo diklofenak sodowy jest całkowicie wchłaniany z przewodu pokarmowego. Ze względu na metabolizm pierwszego przejścia 50% wchłoniętej dawki jest dostępne układowo. Maksymalne stężenie produktu w osoczu występuje w ciągu 2 godzin (zakres 1 do 4 godzin), zaś pole powierzchni pod krzywą stężenia w osoczu (AUC) jest proporcjonalne do dawki w zakresie od 25 mg do 150 mg. Pokarm nie wpływa w sposób istotny na stopień wchłaniania diklofenaku sodowego. Mizoprostol jest wchłaniany szybko i w dużym stopniu. Podlega szybkiemu metabolizmowi do czynnej postaci – kwasu mizoprostolu, którego półokres eliminacji t½ wynosi około 30 minut.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgWłaściwości farmakokinetyczne
W badaniach po podaniu wielokrotnym nie wykazano kumulacji kwasu mizoprostolu, zaś stan stacjonarny w osoczu osiągano w ciągu 2 dni. Stopień wiązania kwasu mizoprostolu z białkami osocza wynosi poniżej 90%. Około 73% podanej dawki jest wydalane z moczem, głównie w postaci biologicznie nieczynnych metabolitów (patrz punkty 4.2 i 4.3). U pacjentów z łagodnym lub umiarkowanym zaburzeniem czynności nerek, t½ (okres półtrwania w fazie eliminacji), Cmax oraz AUC były zwiększone w porównaniu do grupy kontrolnej, nie wykazano jednak wyraźnej korelacji pomiędzy stopniem zaburzenia czynności nerek a AUC. U czterech z sześciu pacjentów z całkowitą niewydolnością nerek wartość AUC była około dwukrotnie większa. Metabolizm Przeprowadzono badania po podaniu jednokrotnym i wielokrotnym porównujące właściwości farmakokinetyczne produktu ARTHROTEC i diklofenaku oraz mizoprostolu podawanych oddzielnie.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgWłaściwości farmakokinetyczne
Biorównoważność obu sposobów podawania diklofenaku wykazano dla AUC i szybkości wchłaniania (Cmax/AUC). W stanie stacjonarnym i na czczo wykazano biorównoważność pod względem AUC. Jedzenie zmniejszało szybkość i stopień wchłaniania diklofenaku podawanego zarówno w produkcie ARTHROTEC, jak i diklofenaku podawanego oddzielnie. Pomimo niemal identycznych wartości AUC u pacjentów po posiłku, w stanie stacjonarnym, nie ustalono statystycznej biorównoważności. Jest to jednak związane z szerokim zakresem współczynnika wariancji w tych badaniach, ze względu na dużą zmienność międzyosobniczą pod względem długości czasu wchłaniania oraz intensywny metabolizm pierwszego przejścia, który występuje w przypadku diklofenaku. W odniesieniu do podawania mizoprostolu wykazano biorównoważność po jednokrotnym podaniu produktu ARTHROTEC lub tylko mizoprostolu.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgWłaściwości farmakokinetyczne
Po osiągnięciu stanu stacjonarnego pokarm zmniejsza Cmax mizoprostolu po podaniu produktu ARTHROTEC oraz w niewielkim stopniu opóźnia wchłanianie, nie zmieniając jednak AUC. Eliminacja Okres półtrwania w fazie eliminacji wynosi około dwie godziny. Klirens oraz objętość dystrybucji wynoszą odpowiednio około 350 ml/min i 550 ml/kg mc. (masy ciała). Ponad 99% diklofenaku sodowego w sposób odwracalny wiąże się z albuminami w osoczu, niezależnie od wieku pacjenta. Diklofenak sodowy jest eliminowany w drodze metabolizmu, a następnie wydalany z moczem i kałem jako koniugaty metabolitów z kwasem glukuronowym i siarkowym. Około 65% dawki jest wydalane z moczem, zaś 35% z żółcią. Mniej niż 1% substancji macierzystej jest wydalane w postaci niezmienionej (patrz punkty 4.2 i 4.3).
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach, podczas jednoczesnego podawania diklofenaku i mizoprostolu, mizoprostol nie nasilał toksycznego działania diklofenaku. Wykazano, że jednoczesne podawanie obu leków nie jest teratogenne ani mutagenne. Substancje czynne produktu ARTHROTEC podawane oddzielnie nie wykazują żadnego potencjału działań karcynogennych. Mizoprostol w dawce wielokrotnie przekraczającej zalecaną dawkę terapeutyczną u zwierząt powodował przerost błony śluzowej żołądka. Powyższa charakterystyczna reakcja na prostaglandyny typu E, ustępuje po odstawieniu składnika produktu.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń: Laktoza jednowodna Celuloza mikrokrystaliczna Skrobia kukurydziana Powidon Magnezu stearynian Otoczka: Kwasu metakrylowego kopolimer (typ C) Sodu wodorotlenek (do ustalenia pH) Talk Trietylu cytrynian Otoczka zewnętrzna: Krospowidon Krzemionka koloidalna bezwodna Olej rycynowy uwodorniony Celuloza mikrokrystaliczna Talk 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w suchym miejscu w temperaturze poniżej 25C. 6.5 Rodzaj i zawartość opakowania Blistry Aluminium/ (OPA/Al/PVC) umieszczone w tekturowym pudełku. Opakowanie zawiera: 10 tabletek (1 blister), 20 tabletek (2 blistry po 10 tabletek), 30 tabletek (3 blistry po 10 tabletek) lub 60 tabletek (6 blistrów po 10 tabletek). Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
- CHPL leku Arthrotec, tabletki, 50 mg + 0,2 mgDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Cataflam 50, 50 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka produktu leczniczego Cataflam 50 zawiera 50 mg diklofenaku potasowego (Diclofenacum kalicum). Substancja pomocnicza: sacharoza. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana, do stosowania doustnego.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgWskazania do stosowania
4.1 Wskazania do stosowania Krótkotrwałe leczenie następujących stanów ostrych: Bólów pourazowych, stanów zapalnych i obrzęków, np. w wyniku skręcenia stawu. Bólów pooperacyjnych, stanów zapalnych i obrzęków, np. po zabiegach stomatologicznych i ortopedycznych. Stanu bólowego i (lub) zapalnego w ginekologii, np. pierwotnego bolesnego miesiączkowania lub zapalenia przydatków. Napadów migreny. Zespołów bólowych kręgosłupa. Reumatyzmu pozastawowego. Jako środek wspomagający w ciężkich bolesnych zakażeniach uszu, nosa lub gardła, np. zapalenie gardła i migdałków, zapalenie ucha. Zgodnie z ogólnymi zasadami terapeutycznymi, należy w pierwszej kolejności zastosować leczenie przyczynowe. Gorączka będąca jedynym objawem choroby nie jest wskazaniem do podania produktu leczniczego.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Ogólnie zaleca się indywidualne ustalanie dawkowania produktu leczniczego. Występowanie działań niepożądanych można ograniczyć stosując produkt w najmniejszej skutecznej dawce i nie dłużej niż to koniecznie do kontrolowania objawów (patrz punkt 4.4). Ogólna grupa docelowa: Zalecana, początkowa dawka dobowa wynosi od 100 mg do 150 mg. W łagodniejszych przypadkach zazwyczaj dawkę 75 mg do 100 mg na dobę uważa się za wystarczającą. Całkowita dobowa dawka powinna być podzielona i podawana w 2 lub 3 dawkach, jeśli dotyczy. W pierwotnym bolesnym miesiączkowaniu Dawkę dobową należy ustalać indywidualnie. Zwykle wynosi ona od 50 mg do 150 mg. Początkowo należy podawać 50 mg do 100 mg, a w razie potrzeby dawkowanie można zwiększyć w ciągu kilku cykli menstruacyjnych do maksymalnej dawki 200 mg na dobę.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgDawkowanie
Leczenie należy rozpocząć w momencie pojawienia się pierwszych objawów i w zależności od ich nasilenia, kontynuować terapię przez kilka dni. W leczeniu migreny Początkowa dawka produktu leczniczego wynosi 50 mg i należy ją przyjąć w chwili wystąpienia pierwszych objawów zwiastujących napad choroby. Jeśli w ciągu 2 godzin od podania pierwszej dawki złagodzenie bólu nie jest wystarczające, można podać kolejną dawkę w wysokości 50 mg. W razie konieczności, można przyjmować kolejne dawki po 50 mg w odstępach od 4 do 6 godzin. Nie należy przekraczać dawki 200 mg na dobę. Szczególne grupy pacjentów Dzieci i młodzież: Produkt leczniczy Cataflam 50 w postaci tabletek powlekanych, nie jest zalecany do stosowania u dzieci w wieku poniżej 14 lat. Dzieciom i młodzieży w wieku poniżej 14 lat zaleca się stosowanie diklofenaku w postaci czopków, w dawce 25 mg na dobę.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgDawkowanie
W przypadku młodzieży w wieku powyżej 14 lat zazwyczaj wystarcza podanie dawki 75 mg do 100 mg na dobę w 2 do 3 dawkach podzielonych. Nie należy przekraczać maksymalnej dobowej dawki 150 mg. Całkowita dobowa dawka powinna być podzielona i podawana w 2 do 3 dawkach, jeśli dotyczy. Działanie produktu leczniczego Cataflam 50 w leczeniu migreny u dzieci i młodzieży nie zostało zbadane. Osoby w podeszłym wieku (powyżej 65 lat): Nie jest wymagana zmiana dawkowania początkowego u osób w podeszłym wieku (patrz punkt 4.4). Rozpoznana choroba układu krążenia lub istotne sercowo-naczyniowe czynniki ryzyka: Leczenie produktem leczniczym Cataflam 50 nie jest na ogół zalecane u pacjentów z rozpoznaną chorobą układu krążenia lub niewyrównanym nadciśnieniem tętniczym. W razie potrzeby pacjenci z rozpoznaną chorobą układu sercowo-naczyniowego, niewyrównanym nadciśnieniem tętniczym lub istotnymi czynnikami ryzyka choroby sercowo-naczyniowej powinni być leczeni produktem leczniczym Cataflam 50 wyłącznie po dokonaniu wnikliwej oceny i tylko dawkami ≤100 mg na dobę, jeśli leczenie trwa dłużej niż 4 tygodnie (patrz punkt 4.4).
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgDawkowanie
Zaburzenie czynności nerek: Produkt leczniczy Cataflam 50 jest przeciwwskazany u pacjentów z niewydolnością nerek (patrz punkt 4.3). Nie przeprowadzono specjalnych badań u pacjentów z zaburzeniami czynności nerek, dlatego nie można sformułować odpowiednich zaleceń dotyczących dostosowania dawki. Zaleca się zachowanie ostrożności podczas podawania produktu leczniczego Cataflam 50 pacjentom z zaburzeniami czynności nerek w stopniu łagodnym do umiarkowanego (patrz punkt 4.4). Zaburzenie czynności wątroby: Produkt leczniczy Cataflam 50 jest przeciwwskazany u pacjentów z niewydolnością wątroby (patrz punkt 4.3). Nie przeprowadzono specjalnych badań u pacjentów z zaburzeniami czynności wątroby, dlatego nie można sformułować odpowiednich zaleceń dotyczących dostosowania dawki. Zaleca się zachowanie ostrożności podczas podawania produktu leczniczego Cataflam 50 pacjentom z zaburzeniami czynności wątroby w stopniu łagodnym do umiarkowanego (patrz punkt 4.4).
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgDawkowanie
Sposób podawania Tabletki należy połknąć w całości, popijając wodą, najlepiej przed posiłkiem. Nie należy dzielić ani żuć tabletki.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na diklofenak lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Czynna lub podawana w wywiadzie, choroba wrzodowa żołądka i (lub) dwunastnicy, krwawienie lub perforacja (patrz punkt 4.4). Podawane w wywiadzie krwawienie z przewodu pokarmowego lub perforacja, związane z wcześniejszym leczeniem niesteroidowymi lekami przeciwzapalnymi (NLPZ). Czynna lub podawana w wywiadzie nawracająca choroba wrzodowa i (lub) krwotok (wystąpienie dwóch lub więcej odrębnych przypadków potwierdzonego owrzodzenia lub krwawienia). Ostatni trymestr ciąży (patrz punkt 4.6). Niewydolność wątroby. Niewydolność nerek. Stwierdzona zastoinowa niewydolność serca (klasa II–IV wg NYHA), choroba niedokrwienna serca, choroba naczyń obwodowych i (lub) choroba naczyń mózgowych.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgPrzeciwwskazania
Podobnie jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), nie należy stosować produktu leczniczego Cataflam 50 u osób, u których podanie kwasu acetylosalicylowego lub innych NLPZ może być przyczyną wystąpienia astmy, obrzęku naczynioruchowego, pokrzywki lub ostrego nieżytu nosa (tj. nadwrażliwości krzyżowej na NLPZ) (patrz punkt 4.4 i 4.8).
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ogólne Przyjmowanie leku w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz wpływ na przewód pokarmowy i układ krążenia poniżej). Produkt leczniczy zawiera sacharozę jako substancję pomocniczą. Pacjenci z rzadkimi dziedzicznymi zaburzeniami związanymi z nietolerancją fruktozy, zespołem złego wchłaniania glukozy-galaktozy lub niedoborem sacharazy-izomaltazy, nie powinni przyjmować tego produktu leczniczego. Tak, jak w przypadku innych NLPZ, rzadko mogą również występować reakcje alergiczne, w tym reakcje anafilaktyczne (rzekomoanafilaktyczne), po podaniu diklofenaku u osób, które wcześniej nie przyjmowały tego leku. Reakcje nadwrażliwości mogą także rozwinąć się w zespół Kounisa, ciężką reakcję alergiczną, która może prowadzić do zawału mięśnia sercowego.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgSpecjalne środki ostrozności
Objawy takich reakcji mogą obejmować ból w klatce piersiowej występujący w związku z reakcją alergiczną na diklofenak. Wpływ na przewód pokarmowy Krwawienie, owrzodzenie lub perforacja przewodu pokarmowego, które mogą zakończyć się śmiercią, raportowane w przypadku wszystkich NLPZ, w tym diklofenaku, i mogą wystąpić w każdym okresie leczenia, z objawami poprzedzających lub bez, i niezależnie od ciężkich powikłań dotyczących przewodu pokarmowego w wywiadzie. Powikłania te są bardziej niebezpieczne u osób w podeszłym wieku. Należy przerwać stosowanie produktu leczniczego Cataflam 50 w przypadku, gdy u pacjenta pojawi się krwawienie lub owrzodzenie przewodu pokarmowego. Tak jak w przypadku innych NLPZ, w tym diklofenaku, u pacjentów z objawami wskazującymi na zaburzenia żołądka i jelit lub z wywiadem sugerującym chorobę wrzodową żołądka i (lub) dwunastnicy, krwawienia lub perforację, niezbędny jest ścisły nadzór lekarski.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgSpecjalne środki ostrozności
Produkt leczniczy Cataflam 50 należy szczególnie ostrożnie zalecać tym pacjentom (patrz punkt 4.8). Ryzyko krwawienia z przewodu pokarmowego jest większe w przypadku zwiększania dawek NLPZ i u pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie, szczególnie gdy przebiegała z krwotokami lub perforacją oraz u pacjentów w podeszłym wieku. U osób w podeszłym wieku, zwiększona jest częstość występowania działań niepożądanych związanych ze stosowaniem NLPZ, zwłaszcza krwawienia i perforacji, które mogą być śmiertelne. Aby zmniejszyć ryzyko toksycznego wpływu na układ pokarmowy u pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie, szczególnie gdy przebiegała z krwotokami lub perforacją, oraz u pacjentów w podeszłym wieku, należy rozpoczynać i kontynuować leczenie z zastosowaniem najmniejszych skutecznych dawek.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgSpecjalne środki ostrozności
U tych pacjentów, jak również u pacjentów, u których konieczne jest jednoczesne stosowanie leków zawierających małe dawki kwasu acetylosalicylowego (aspiryna) lub innych leków mogących zwiększyć ryzyko wystąpienia zaburzeń żołądkowo-jelitowych, należy rozważyć leczenie skojarzone z lekami osłonowymi (np. inhibitorami pompy protonowej lub mizoprostolem). Pacjenci ze stwierdzonymi zaburzeniami żołądka i jelit w wywiadzie, szczególnie pacjenci w podeszłym wieku, powinni informować lekarza o jakichkolwiek nietypowych objawach brzusznych (szczególnie o krwawieniach z przewodu pokarmowego). Należy zachować ostrożność u pacjentów otrzymujących jednocześnie leki, które mogą powodować zwiększenie ryzyka powstania choroby wrzodowej żołądka i (lub) dwunastnicy lub krwawienia, takie jak kortykosteroidy działające ogólnoustrojowo, leki przeciwzakrzepowe, leki przeciwpłytkowe, lub selektywne inhibitory wychwytu zwrotnego serotoniny (patrz punkt 4.5).
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgSpecjalne środki ostrozności
Pacjenci z wrzodziejącym zapaleniem okrężnicy lub z chorobą Crohna powinni być pod ścisłą kontrolą lekarską, ze względu na możliwość pogorszenia stanu ogólnego (patrz punkt 4.8). Stosowanie NLPZ, w tym diklofenaku, może wiązać się ze zwiększeniem ryzyka nieszczelności zespolenia żołądkowo-jelitowego. Zaleca się ścisły nadzór medyczny i zachowanie ostrożności podczas stosowania diklofenaku po operacjach przewodu pokarmowego. Wpływ na czynność wątroby Ścisły nadzór medyczny jest konieczny w przypadku zalecenia produktu leczniczego Cataflam 50 pacjentom z zaburzeniami czynności wątroby, ze względu na możliwość pogorszenia stanu ogólnego. Tak jak niesteroidowe leki przeciwzapalne (NLPZ), diklofenak może zwiększać aktywność jednego lub więcej enzymów wątrobowych. W trakcie długotrwałego leczenia produktem leczniczym Cataflam 50, jako środek ostrożności, należy regularne kontrolować czynności wątroby.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgSpecjalne środki ostrozności
Należy przerwać stosowanie produktu leczniczego Cataflam 50, jeśli utrzymują się nieprawidłowe wyniki badań czynnościowych wątroby lub ulegają pogorszeniu oraz gdy wystąpią kliniczne oznaki lub objawy wskazujące na zaburzenia czynności wątroby oraz inne objawy (np.: eozynofilia, wysypka itp.). Zapalenie wątroby, spowodowane stosowaniem diklofenaku, może wystąpić nie poprzedzone objawami prodromalnymi. Należy zachować ostrożność stosując Cataflam 50 u pacjentów z porfirią wątrobową, ponieważ może on wywołać atak choroby. Wpływ na czynność nerek W związku z leczeniem NLPZ, w tym diklofenakiem, odnotowano przypadki zatrzymywania płynów i powstawania obrzęków, dlatego szczególną ostrożność należy zachować w przypadku pacjentów z zaburzoną czynnością serca lub nerek, z nadciśnieniem tętniczym w wywiadzie, u osób w podeszłym wieku, u pacjentów jednocześnie otrzymujących leki moczopędne lub produkty lecznicze znacząco wpływające na czynność nerek oraz pacjentów z nadmierną utratą płynu pozakomórkowego o różnej etiologii, np.: w fazie około- lub pooperacyjnej po dużych zabiegach chirurgicznych (patrz punkt 4.3).
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgSpecjalne środki ostrozności
W takich przypadkach, podczas stosowania produktu leczniczego Cataflam 50 jako środek ostrożności, zaleca się monitorowanie czynności nerek. Przerwanie leczenia produktem leczniczym Cataflam 50 zwykle powoduje powrót do stanu poprzedzającego leczenie. Wpływ na skórę Ciężkie reakcje skórne, niektóre z nich ze skutkiem śmiertelnym, włączając złuszczające zapalenie skóry, zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka były bardzo rzadko raportowane w związku ze stosowaniem leków z grupy NLPZ (patrz punkt 4.8). Największe ryzyko wystąpienia tych ciężkich reakcji występuje na początku terapii, w większości przypadków w pierwszym miesiącu stosowania produktu. Stosowanie produktu leczniczego należy natychmiast przerwać po wystąpieniu pierwszych objawów takich jak wysypka skórna, uszkodzenie błony śluzowej lub innych objawów nadwrażliwości.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgSpecjalne środki ostrozności
Tak jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), także po podaniu diklofenaku, rzadko mogą wystąpić reakcje alergiczne, w tym reakcje anafilaktyczne i rzekomoanafilaktyczne, nawet wtedy, gdy ten produkt leczniczy nie był wcześniej stosowany. Wpływ na układ krążenia i naczynia zaopatrujące mózg Pacjentów z nadciśnieniem tętniczym w wywiadzie lub łagodną do umiarkowanej zastoinową niewydolnością serca, z zatrzymaniem płynów i z obrzękami, należy odpowiednio kontrolować i wydawać właściwe zalecenia. Zatrzymanie płynów i obrzęki były zgłaszane w związku z leczeniem NLPZ. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg na dobę) przez długi okres czasu może być związane z niewielkim zwiększeniem ryzyka zakrzepicy tętnic (np. zawał serca lub udar).
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgSpecjalne środki ostrozności
Leczenie produktem leczniczym Cataflam 50 nie jest na ogół zalecane u pacjentów z rozpoznaną chorobą układu krążenia lub niewyrównanym nadciśnieniem tętniczym. W razie potrzeby pacjenci z rozpoznaną chorobą układu sercowo-naczyniowego, niewyrównanym nadciśnieniem tętniczym lub istotnymi czynnikami ryzyka choroby sercowo-naczyniowej powinni być leczeni produktem leczniczym Cataflam 50 wyłącznie po dokonaniu wnikliwej oceny i tylko dawkami ≤100 mg na dobę, jeśli leczenie trwa dłużej niż 4 tygodnie (patrz punkt 4.4). Ryzyko dla układu sercowo-naczyniowego związane ze stosowaniem diklofenaku może wzrastać wraz ze zwiększaniem dawki i czasu trwania ekspozycji i dlatego należy stosować najmniejszą skuteczną dawkę leku przez możliwie najkrótszy czas. Należy okresowo oceniać zapotrzebowanie pacjenta na leczenie objawowe oraz jego odpowiedź na lek. Diklofenak należy stosować bardzo ostrożnie u pacjentów z istotnymi czynnikami ryzyka zdarzeń dotyczących układu krążenia (np.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgSpecjalne środki ostrozności
nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Produkt ten należy stosować możliwie jak najkrócej i w najmniejszej skutecznej dawce dobowej, ze względu na możliwość nasilenia ryzyka dotyczącego układu krążenia po zastosowaniu diklofenaku w dużych dawkach i długotrwale. Należy okresowo kontrolować konieczność kontynuacji leczenia objawowego i odpowiedź na leczenie. Pacjenci powinni być czujni wobec przedmiotowych i podmiotowych objawów ciężkich zdarzeń zakrzepowych w tętnicach (np. bólu w klatce piersiowej, duszności, osłabienia, niewyraźnej mowy), które mogą wystąpić nagle. Należy pouczyć pacjentów o konieczności natychmiastowego zgłoszenia się do lekarza w takim przypadku. Wpływ na wskaźniki hematologiczne Zaleca się stosowanie produktu leczniczego Cataflam 50 w terapii krótkoterminowej.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgSpecjalne środki ostrozności
W trakcie długotrwałego leczenia produktem leczniczym Cataflam 50, podobnie jak w przypadku stosowania innych niesteroidowych leków przeciwzapalnych (NLPZ), zaleca się kontrolowanie wskaźników hematologicznych. Tak jak inne niesteroidowe leki przeciwzapalne (NLPZ), Cataflam 50 może przemijająco hamować agregację płytek krwi. Należy dokładnie kontrolować pacjentów z zaburzeniami hemostazy. Astma w wywiadzie U pacjentów z astmą, sezonowym alergicznym nieżytem nosa, obrzękiem błony śluzowej nosa (np. polipy nosa), przewlekłą obturacyjną chorobą płuc lub przewlekłymi zakażeniami układu oddechowego (szczególnie gdy mają objawy podobne do objawów alergicznego nieżytu nosa), częściej niż u innych pacjentów występują zaostrzenia astmy w wyniku zastosowania NLPZ (nietolerancja leków przeciwbólowych), obrzęk Quinckego lub pokrzywka. W związku z tym u tych pacjentów zaleca się szczególną ostrożność (należy umożliwić szybki dostęp do pomocy lekarskiej).
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgSpecjalne środki ostrozności
Szczególne środki ostrożności należy zachować u pacjentów uczulonych na inne substancje, np. z odczynami skórnymi, świądem lub pokrzywką. Osoby w podeszłym wieku Produkt leczniczy należy stosować ostrożnie u osób w podeszłym wieku. W przypadku osób w podeszłym wieku i u osób z małą masą ciała zaleca się stosowanie najmniejszej skutecznej dawki. Interakcje z niesteroidowymi lekami przeciwzapalnymi (NLPZ) Należy unikać jednoczesnego stosowania produktu leczniczego Cataflam 50 z ogólnie działającymi NLPZ, w tym selektywnymi inhibitorami cyklooksygenazy-2, ze względu na potencjalne nasilenie działań niepożądanych (patrz punkt 4.5). Maskowanie objawów zakażenia Podobnie jak inne niesteroidowe leki przeciwzapalne (NLPZ), produkt leczniczy Cataflam 50 może maskować objawy przedmiotowe i podmiotowe zakażenia, co wynika z właściwości farmakodynamicznych produktu leczniczego.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Opisane interakcje uwzględniają także te zaobserwowane po zastosowaniu innych postaci farmaceutycznych zawierających diklofenak. Zaobserwowane interakcje Silne inhibitory CYP2C9: Należy zachować ostrożność podczas przepisywania diklofenaku wraz z silnymi inhibitorami CYP2C9 (takimi jak worykonazol), ponieważ w wyniku zahamowania metabolizmu diklofenaku, jego stężenie w osoczu oraz ekspozycja na lek może znacznie wzrosnąć. Lit: Cataflam 50 podawany jednocześnie z produktami leczniczymi zawierającymi lit może zwiększać jego stężenie w osoczu. Zaleca się monitorowanie stężenia litu w surowicy. Digoksyna: Cataflam 50 podawany jednocześnie z produktami leczniczymi zawierającymi digoksynę może zwiększać jej stężenie w osoczu. Zaleca się monitorowanie stężenia digoksyny w surowicy.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgInterakcje
Leki moczopędne i leki zmniejszające ciśnienie krwi: Podobnie jak w przypadku innych NLPZ, jednoczesne stosowanie diklofenaku z lekami moczopędnymi lub lekami zmniejszającymi ciśnienie tętnicze krwi (np. leki blokujące receptory beta-adrenergiczne, inhibitory ACE) może spowodować zmniejszenie ich działania przeciwnadciśnieniowego. Z tego względu należy ostrożnie stosować Cataflam 50 jednocześnie z lekami moczopędnymi lub zmniejszającymi ciśnienie tętnicze. Z powodu zwiększonego ryzyka nefrotoksyczności, pacjentów należy odpowiednio nawadniać i okresowo kontrolować czynność nerek, po rozpoczęciu leczenia oraz podczas leczenia skojarzonego, szczególnie po zastosowaniu leków moczopędnych i inhibitorów konwertazy angiotensyny. U pacjentów, szczególnie w podeszłym wieku, należy regularnie kontrolować ciśnienie tętnicze (patrz punkt 4.4).
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgInterakcje
Cyklosporyna: Diklofenak, jak i inne niesteroidowe leki przeciwzapalne, może zwiększyć nefrotoksyczność cyklosporyny ze względu na wpływ na prostaglandyny nerkowe. W związku z tym diklofenak powinien być podawany w dawkach mniejszych niż u pacjentów nieotrzymujących cyklosporyny. Leki określane jako wywołujące hiperkaliemię: Jednoczesne stosowanie leków oszczędzających potas, cyklosporyny, takrolimusu lub trimetoprimu może być związane ze zwiększeniem stężenia potasu w surowicy, w związku z tym należy regularnie kontrolować stężenie potasu w surowicy (patrz punkt 4.4). Chinolony przeciwbakteryjne: Odnotowano pojedyncze przypadki wystąpienia drgawek, które mogły być spowodowane jednoczesnym stosowaniem chinolonów i niesteroidowych leków przeciwzapalnych (NLPZ). Przewidywane interakcje, które należy uwzględnić Niesteroidowe leki przeciwzapalne (NLPZ) i kortykosteroidy: Jednoczesne podawanie diklofenaku i innych niesteroidowych leków przeciwzapalnych lub kortykosteroidów może zwiększać częstość występowania działań niepożądanych dotyczących przewodu pokarmowego (patrz punkt 4.4).
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgInterakcje
Leki przeciwzakrzepowe i antyagregacyjne: Należy zachować ostrożność, ponieważ jednoczesne stosowanie może zwiększyć ryzyko krwawień (patrz punkt 4.4). Chociaż badania kliniczne nie wskazują, aby diklofenak wpływał na działanie leków przeciwzakrzepowych, to istnieją doniesienia o zwiększonym ryzyku wystąpienia krwotoku w przypadku skojarzonego stosowania produktu leczniczego Cataflam 50 i leków przeciwzakrzepowych. Dlatego też, zaleca się w tym przypadku, dokładną kontrolę pacjentów. Selektywne inhibitory wychwytu zwrotnego serotoniny: Jednoczesne stosowanie NLPZ, w tym diklofenaku, i selektywnych inhibitorów wychwytu zwrotnego serotoniny może zwiększyć ryzyko krwawień z przewodu pokarmowego (patrz punkt 4.4). Leki przeciwcukrzycowe: Badania kliniczne wykazały, że diklofenak można podawać jednocześnie z doustnymi lekami przeciwcukrzycowymi bez wpływu na ich działanie kliniczne.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgInterakcje
Jednakże wystąpiły pojedyncze przypadki zarówno działania hipoglikemizującego jak i hiperglikemizującego, które spowodowały konieczność zmiany dawkowania leków przeciwcukrzycowych w trakcie leczenia diklofenakiem. Z tego powodu monitorowanie stężenia glukozy we krwi jest konieczne podczas jednoczesnej terapii. Fenytoina: Podczas stosowania fenytoiny razem z diklofenakiem, należy monitorować stężenie fenytoiny w osoczu, ze względu na spodziewany wzrost ekspozycji na fenytoinę. Metotreksat: Diklofenak może hamować klirens nerkowy metotreksatu, zwiększając przez to stężenie metotreksatu we krwi. Zaleca się ostrożność podczas stosowania niesteroidowych leków przeciwzapalnych, w tym diklofenaku, w czasie krótszym niż 24 godziny, przed lub po leczeniu metotreksatem, ponieważ może wystąpić zwiększenie stężenia metotreksatu we krwi i może wystąpić zwiększenie toksyczności działania tej substancji.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgInterakcje
Kolestypol i cholestyramina: Związki te mogą spowodować opóźnienie lub zmniejszenie wchłaniania diklofenaku. W związku z tym, zalecane jest stosowanie diklofenaku przynajmniej jedną godzinę przed lub od 4 do 6-ciu godzin po przyjęciu kolestypolu/cholestyraminy.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na przebieg ciąży i (lub) rozwój zarodka/płodu. Dane z badań epidemiologicznych wskazują zwiększone ryzyko wystąpienia poronienia, wad rozwojowych serca i wytrzewienia jelit po zastosowaniu inhibitora syntezy prostaglandyn we wczesnym okresie ciąży. Wartość bezwzględnego ryzyka wystąpienia wad rozwojowych układu sercowo-naczyniowego wzrosła z mniej niż 1% do ok. 1,5%. Wartość ta może wzrosnąć wraz ze zwiększeniem dawki i wydłużeniem okresu leczenia. W badaniach na zwierzętach wykazano, że podawanie inhibitora syntezy prostaglandyn zwiększyło liczbę strat po- i przedimplantacyjnych oraz śmiertelność zarodka i płodu. Dodatkowo, zaobserwowano zwiększenie częstości występowania różnych wad wrodzonych, w tym wad rozwojowych układu sercowo-naczyniowego u zwierząt, którym podawano inhibitor syntezy prostaglandyn w okresie organogenezy. Od 20.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgWpływ na płodność, ciążę i laktację
tygodnia ciąży stosowanie diklofenaku może powodować małowodzie wkutek zaburzeń czynności nerek płodu. Może ono wystąpić krótko po rozpoczęciu leczenia i jest zwykle odwracalne po jego przerwaniu. Dodatkowo, po leczeniu w drugim trymestrze zgłaszano przypadki zwężenia przewodu tętniczego, z których większość ustąpiła po jego zaprzestaniu. W związku z tym w pierwszym i drugim trymestrze ciąży nie należy podawać diklofenaku, chyba że jest to bezwzględnie konieczne. Jeśli diklofenak jest stosowany przez kobietę starającą się zajść w ciążę lub podczas pierwszego i drugiego trymestru ciąży, zastosowana dawka powinna być jak najmniejsza, a czas trwania leczenia jak najkrótszy. Należy rozważyć przedporodowe monitorowanie w kierunku małowodzia oraz zwężenia przewodu tętniczego po ekspozycji na diklofenak przez kilka dni od.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Cataflam 50 nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane zgłaszane w trakcie badań klinicznych czy w raportach spontanicznych lub danych z literatury wymieniono zgodnie z klasyfikacją układów i narządów MedDRA. Dla każdej z klasyfikacji układów i narządów, działania niepożądane przedstawiono według częstości ich występowania, począwszy od najczęściej występujących. W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Ponadto, odpowiednia kategoria częstotliwości dla każdego działania niepożądanego podana jest na podstawie następującego schematu: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do < 1/100); rzadko (≥1/10 000 do < 1/1 000); bardzo rzadko (<1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgDziałania niepożądane
Przedstawione poniżej działania niepożądane obejmują działania niepożądane odnotowane w przypadku produktu leczniczego Cataflam 50, jak również obserwowane podczas stosowania innych postaci diklofenaku potasowego i diklofenaku sodowego, stosowanych krótko- lub długotrwale. Zaburzenia krwi i układu chłonnego Bardzo rzadko: Trombocytopenia, leukopenia, anemia (w tym anemia hemolityczna i aplastyczna), agranulocytoza Zaburzenia układu immunologicznego Rzadko: Nadwrażliwość, reakcje anafilaktyczne i rzekomoanafilaktyczne (w tym hipotensja i szok) Bardzo rzadko: Obrzęk naczynioruchowy (w tym obrzęk twarzy) Zaburzenia psychiczne Bardzo rzadko: Dezorientacja, depresja, bezsenność, koszmary senne, drażliwość, zaburzenia psychotyczne Zaburzenia układu nerwowego Często: Ból głowy, zawroty głowy Rzadko: Senność Bardzo rzadko: Parestezje, zaburzenia pamięci, drgawki, lęk, drżenie, jałowe zapalenie opon mózgowych, zaburzenia smaku, udar naczyniowy mózgu Zaburzenia oka Bardzo rzadko: Zaburzenia widzenia, niewyraźne widzenie, podwójne widzenie Zaburzenia ucha i błędnika Często: Zawroty głowy Bardzo rzadko: Szumy uszne, zaburzenia słuchu Zaburzenia serca Niezbyt często: Zawał mięśnia sercowego, niewydolność serca, kołatanie serca, ból w klatce piersiowej Częstość nieznana: Zespół Kounisa Zaburzenia naczyniowe Bardzo rzadko: Nadciśnienie tętnicze, zapalenie naczyń Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Rzadko: Astma (w tym duszność) Bardzo rzadko: Zapalenie płuc Zaburzenia żołądka i jelit Często: Nudności, wymioty, biegunka, niestrawność, ból brzucha, wzdęcia, zmniejszony apetyt Rzadko: Zapalenie błony śluzowej żołądka, krwawienia z przewodu pokarmowego, krwawe wymioty, krwawe biegunki, smoliste stolce, choroba wrzodowa żołądka i (lub) dwunastnicy (z krwawieniem lub bez i perforacją) Bardzo rzadko: Zapalenie okrężnicy (także krwotoczne zapalenie okrężnicy oraz zaostrzenie wrzodziejącego zapalenia okrężnicy, choroba Crohna), zaparcia, zapalenie błony śluzowej jamy ustnej (w tym wrzodziejące zapalenie jamy ustnej), zapalenie języka, zaburzenia w obrębie przełyku, błoniaste zwężenie jelit, zapalenie trzustki Nieznana: Niedokrwienne zapalenie okrężnicy Zaburzenia wątroby i dróg żółciowych Często: Zwiększenie aktywności aminotransferaz Rzadko: Zapalenie wątroby, żółtaczka, zaburzenia czynności wątroby Bardzo rzadko: Piorunujące zapalenie wątroby, martwica wątroby, niewydolność wątroby Zaburzenia skóry i tkanki podskórnej Często: Wysypka Rzadko: Pokrzywka Bardzo rzadko: Wysypka pęcherzowa, wyprysk, rumień, rumień wielopostaciowy, zespół Stevensa-Johnsona, toksyczne martwicze oddzielanie się naskórka (zespół Lyella), złuszczające zapalenie skóry, łysienie, reakcje nadwrażliwości na światło, plamica, choroba Schönleina-Henocha, świąd Zaburzenia nerek i dróg moczowych Bardzo rzadko: Ostra niewydolność nerek, krwiomocz, białkomocz, zespół nerczycowy, śródmiąższowe zapalnie nerek, martwica brodawek nerkowych Zaburzenia ogólne i stany w miejscu podania Rzadko: Obrzęk W związku z leczeniem NLPZ zgłaszano występowanie obrzęków, nadciśnienia tętniczego i niewydolności serca.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgDziałania niepożądane
Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg/dobę) i w leczeniu długotrwałym zwiększa ryzyko zakrzepicy tętnic (np. zawał serca lub udar) (patrz punkty 4.3 i 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem: Departament Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgPrzedawkowanie
4.9 Przedawkowanie Objawy Nie ma specyficznych objawów klinicznych, wynikających z przedawkowania diklofenaku. Przedawkowanie może wywołać takie objawy jak wymioty, krwotok z przewodu pokarmowego, biegunkę, zawroty głowy, szumy uszne lub drgawki. W przypadku znacznego zatrucia może nastąpić ostra niewydolność nerek i uszkodzenie wątroby. Leczenie przedawkowania Leczenie ostrego zatrucia niesteroidowymi lekami przeciwzapalnymi (NLPZ), w tym diklofenakiem, zasadniczo obejmuje stosowanie środków podtrzymujących czynność ważnych dla życia narządów oraz leczenie objawowe. Leczenie podtrzymujące i objawowe należy zastosować w przypadku takich powikłań jak znaczne zmniejszenie ciśnienia tętniczego krwi, niewydolność nerek, drgawki, zaburzenia żołądka i jelit oraz zaburzenia oddychania. Wymuszona diureza, dializa lub przetaczanie krwi nie przyspieszają eliminowania niesteroidowych leków przeciwzapalnych (NLPZ), w tym diklofenaku, ze względu na dużą zdolność wiązania z białkami i wydłużony metabolizm.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgPrzedawkowanie
Po przyjęciu potencjalnie toksycznej dawki należy rozważyć podanie węgla aktywnego i opróżnienie żołądka (np. sprowokowanie wymiotów, płukanie żołądka).
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu octowego; kod ATC: M 01 AB 05 Mechanizm działania Cataflam 50 zawiera diklofenak potasowy, który jest związkiem niesteroidowym o działaniu przeciwreumatycznym, przeciwzapalnym, przeciwbólowym i przeciwgorączkowym. Wykazano doświadczalnie, że w mechanizmie działania produktu leczniczego Cataflam 50, istotne znaczenie ma hamowanie biosyntezy prostaglandyn. Prostaglandyny odgrywają zasadniczą rolę w patogenezie procesu zapalnego, bólu i gorączki. Produkt leczniczy Cataflam 50 ma szybki początek działania, co czyni go szczególnie przydatnym w leczeniu ostrych stanów bólowych i zapalnych. In vitro diklofenak potasowy nie hamuje biosyntezy proteoglikanów w chrząstce w zakresie stężeń odpowiadających wartościom osiąganym w organizmie ludzkim.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgWłaściwości farmakodynamiczne
Działanie farmakodynamiczne Cataflam 50 charakteryzuje się znacznym działaniem przeciwbólowym, łagodząc ból o nasileniu umiarkowanym i ciężkim. U pacjentów ze stanem zapalnym, wynikającym np. z urazu lub po zabiegach chirurgicznych Cataflam 50 szybko zmniejsza zarówno samoistny ból jak i ból podczas ruchu, a także zmniejsza obrzęk, powstały w wyniku stanu zapalnego i obrzęk powstały w wyniku zranienia. Ponadto, badania kliniczne wykazały, że substancja czynna produktu leczniczego Cataflam 50, podana pacjentkom z pierwotnym bolesnym miesiączkowaniem, zmniejsza dolegliwości bólowe i krwawienie. Wykazano, że w napadach migreny Cataflam 50 skutecznie zmniejsza ból głowy i inne objawy towarzyszące takie jak nudności i wymioty.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Diklofenak w postaci soli potasowej ulega szybkiemu i całkowitemu wchłonięciu. Absorpcja następuje natychmiast po przyjęciu produktu leczniczego, a wchłonięta ilość jest identyczna z ilością wchłoniętą po przyjęciu takiej samej dawki produktu leczniczego dojelitowego. Średnie maksymalne stężenia w osoczu, wynoszące 3,8 mikromol/l osiągane są po 20 do 60 minutach od przyjęcia jednej tabletki produktu leczniczego Cataflam 50 w dawce 50 mg. Przyjmowanie produktu leczniczego wraz z pokarmem nie powinno mieć wpływu na ilość wchłoniętego diklofenaku, może jednak nieznacznie opóźniać początek działania i prędkość absorpcji. Ponieważ około połowa podanej dawki diklofenaku jest metabolizowana podczas pierwszego przejścia przez wątrobę (efekt „pierwszego przejścia”), pole pod krzywą stężenia (AUC) po podaniu doustnym lub doodbytniczym jest w przybliżeniu połową wartości występującej po parenteralnym podaniu równoważnej dawki.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgWłaściwości farmakokinetyczne
Podczas ponownego podania produktu leczniczego farmakokinetyka pozostaje niezmieniona. Nie dochodzi do kumulacji produktu leczniczego w organizmie, jeśli zachowane zostaną zalecane przerwy w dawkowaniu. Dystrybucja Diklofenak łączy się z białkami osocza w 99,7%, głównie z albuminami (99,4%). Objętość dystrybucji ocenia się na 0,12 l/kg do 0,17 l/kg. Diklofenak przenika do płynu maziowego, gdzie maksymalne stężenie występuje po 2 do 4 godzinach od osiągnięcia maksymalnego stężenia w osoczu krwi. Okres półtrwania w fazie eliminacji z płynu maziowego wynosi 3 do 6 godzin. Po dwóch godzinach od osiągnięcia wartości maksymalnych w osoczu krwi, wartości stężenia substancji czynnej w płynie maziowym, są już większe niż w osoczu i pozostają większe aż przez 12 godzin. Diklofenak został wykryty w niewielkim stężeniu (100 ng/ml) w mleku matki u jednej matki karmiącej. Szacunkowa ilość spożyta przez niemowlę przyjmujące mleko matki jest równoważna 0,03 mg /kg/dawkę dobową.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgWłaściwości farmakokinetyczne
Metabolizm Biotransformacja diklofenaku obejmuje częściowo glukuronidację nie zmienionej cząsteczki, lecz diklofenak ulega przede wszystkim pojedynczej lub wielokrotnej hydroksylacji i metoksylacji, w wyniku czego powstaje kilka pochodnych fenolowych (3'-hydroksy-, 4'-hydroksy-, 5-hydroksy-, 4',5-dwuhydroksy- i 3'-hydroksy-4'-metoksy-diklofenak), z których większość ulega przekształceniu do glukuronidów. Dwie spośród pochodnych fenolowych wykazują aktywność biologiczną, chociaż w znacznie mniejszym zakresie niż diklofenak. Eliminacja Całkowity ogólnoustrojowy klirens osoczowy diklofenaku wynosi 263±56 ml/min. (średnia wartość ± SD). Okres półtrwania w fazie eliminacji w osoczu wynosi 1 do 2 godzin. Cztery metabolity, w tym dwa aktywne, mają również krótki okres półtrwania 1 do 3 godzin. Jeden metabolit, 3'-hydroksy-4'-metoksy-diklofenak, ma znacznie dłuższy okres półtrwania, ale jest on praktycznie nieaktywny.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgWłaściwości farmakokinetyczne
Około 60% podanej dawki ulega wydaleniu w moczu w postaci sprzężonych z glukuronidami niezmienionych cząsteczek i metabolitów, z których większość również ulega przekształceniu do połączeń glukuronidowych. Mniej niż 1% produktu leczniczego ulega wydaleniu w postaci niezmienionej. Pozostała część dawki ulega eliminacji w postaci metabolitów z żółcią w kale. Liniowość lub nieliniowość Ilość wchłoniętego produktu leczniczego jest liniowo zależna od wielkości dawki. Szczególne grupy pacjentów Nie zaobserwowano istotnych, zależnych od wieku różnic we wchłanianiu, metabolizmie, czy wydalaniu produktu leczniczego. U pacjentów z zaburzeniami czynności nerek, badania dotyczące kinetyki pojedynczej dawki, z zastosowaniem typowego schematu dawkowania, nie wskazują na występowanie kumulacji niezmienionej substancji czynnej.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgWłaściwości farmakokinetyczne
W przypadku klirensu kreatyniny mniejszego niż 10 ml/min, stężenia hydroksypochodnych diklofenaku w osoczu krwi obliczone w stanie równowagi dynamicznej, są około 4 razy większe niż u osób z prawidłową czynnością nerek. Metabolity są jednak ostatecznie wydalane z żółcią. U pacjentów z przewlekłym zapaleniem wątroby lub wyrównaną marskością wątroby, kinetyka i metabolizm diklofenaku są takie same jak u pacjentów bez chorób wątroby.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają żadnego szczególnego zagrożenia dla człowieka. Brak danych dotyczących wpływu diklofenaku na działanie teratogenne u myszy, szczurów lub królików, pochodzących ze standardowych badań przedklinicznych na zwierzętach. Diklofenak nie wpływa na rozród szczurów. Poza minimalnym wpływem na płód w dawce toksycznej dla matki, rozwój przed-, około- i poporodowy potomstwa nie został zaburzony. Podawanie niesteroidowych leków przeciwzapalnych (w tym diklofenaku) hamuje owulację u królików oraz implantację i tworzenie się łożyska u szczurów, oraz prowadzi do przedwczesnego zamknięcia przewodu tętniczego u szczurów w ciąży.
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgPrzedkliniczne dane o bezpieczeństwie
Podanie diklofenaku w dawce toksycznej dla matki wiązało się z dystocją, wydłużeniem ciąży, zmniejszoną przeżywalnością płodów i wewnątrzmacicznym zahamowaniem wzrostu u szczurów. Niewielki wpływ diklofenaku na parametry reprodukcji i porodu, jak również zwężenie przewodu tętniczego w macicy są farmakologicznymi konsekwencjami tej klasy inhibitorów syntezy prostaglandyn (patrz punkt 4.3 i 4.6).
- CHPL leku Cataflam 50, tabletki powlekane, 50 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki: krzemionka koloidalna, wapnia fosforan, magnezu stearynian, skrobia kukurydziana, powidon, karboksymetyloskrobia sodowa. Skład otoczki: celuloza mikrokrystaliczna, tytanu dwutlenek (E 171), żelaza tlenek czerwony (E 172), Makrogol 8000, powidon, sacharoza, talk. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C, chronić przed wilgocią. 6.5 Rodzaj i zawartość opakowania Jedno opakowanie produktu leczniczego Cataflam 50 zawiera 10 tabletek powlekanych. Blister Al/PVC/PE/PVCD w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO DICLOREUM 25 mg / ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ampułka (3 ml) zawiera 75 mg diklofenaku sodowego (Diclofenacum natricum). Substancje pomocnicze o znanym działaniu: 1 ampułka (3 ml) zawiera alkohol benzylowy 119 mg, glikol propylenowy 581 mg, pirosiarczyn sodu 9 mg. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Leczenie objawowe epizodów ostrego bólu w przebiegu chorób zapalnych układu mięśniowo-szkieletowego.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Występowanie działań niepożądanych można ograniczyć, stosując produkt w najmniejszej skutecznej dawce i nie dłużej niż to koniecznie do kontrolowania objawów (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Dorośli Zaleca się podawanie 1 ampułki zawierającej 75 mg diklofenaku sodowego na dobę, głęboko domięśniowo, w górny, zewnętrzny kwadrant pośladka (należy podawać naprzemiennie w oba pośladki). W ciężkich przypadkach można podać dwie ampułki na dobę i jak najszybciej rozpocząć podawanie tabletek lub czopków. Schemat dawkowania u osób w podeszłym wieku musi być ustalony przez lekarza, który powinien rozważyć zmniejszenie zalecanych dawek. Dzieci i młodzież Nie zaleca się stosowania produktu leczniczego Dicloreum roztwór do wstrzykiwań u dzieci i młodzieży ze względu na dawkę.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na diklofenak lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Czynna choroba wrzodowa żołądka i (lub) dwunastnicy, krwawienie lub perforacja. Krwawienie do przewodu pokarmowego lub perforacja w wywiadzie, związane z wcześniejszym leczeniem niesteroidowymi lekami przeciwzapalnymi (NLPZ) lub nawroty choroby wrzodowej żołądka/krwawień w wywiadzie (dwa lub więcej epizodów ze stwierdzonym owrzodzeniem lub krwawieniem). Ostatni trymestr ciąży (patrz punkt 4.6). Ciężka niewydolność wątroby, nerek i serca (patrz punkt 4.4). Podobnie jak inne niesteroidowe leki przeciwzapalne (NLPZ), nie należy stosować produktu leczniczego Dicloreum u osób, u których podanie kwasu acetylosalicylowego lub innych produktów leczniczych hamujących syntezę prostaglandyn może być przyczyną wystąpienia napadu astmy, pokrzywki lub ostrego nieżytu nosa.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlPrzeciwwskazania
Stwierdzona zastoinowa niewydolność serca (klasa II–IV wg NYHA), choroba niedokrwienna serca, choroba naczyń obwodowych i (lub) choroba naczyń mózgowych.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Przyjmowanie produktu leczniczego w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz wpływ na przewód pokarmowy i układ krążenia poniżej). Krwawienie, owrzodzenie lub perforacja przewodu pokarmowego, które mogą zakończyć się śmiercią, raportowane są w przypadku wszystkich NLPZ i mogą wystąpić w każdym okresie leczenia, z lub bez objawów poprzedzających i niezależnie od ciężkich powikłań dotyczących przewodu pokarmowego w wywiadzie. Powikłania te są bardziej niebezpieczne u osób w podeszłym wieku. W przypadkach, gdy u pacjentów otrzymujących produkt leczniczy Dicloreum pojawi się krwawienie lub owrzodzenie przewodu pokarmowego, produkt leczniczy należy odstawić.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlSpecjalne środki ostrozności
W związku z zastosowaniem NLPZ, w tym produktu leczniczego Dicloreum bardzo rzadko raportowano o ciężkich reakcjach skórnych, niektórych ze skutkiem śmiertelnym, w tym złuszczającym zapaleniu skóry, zespole Stevensa-Johnsona i toksycznego martwiczego oddzielania się naskórka (patrz punkt 4.8). U pacjentów będących w najwyższej grupie ryzyka wystąpienia tych reakcji w początkowym okresie leczenia, w większości przypadków, pojawiły się one w pierwszym miesiącu leczenia. Produkt leczniczy Dicloreum należy odstawić od razu po wystąpieniu wysypki skórnej, zmian na błonach śluzowych lub jakichkolwiek innych objawów nadwrażliwości. Tak jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), rzadko mogą wystąpić reakcje alergiczne, w tym reakcje anafilaktyczne i rzekomoanafilaktyczne, nawet wtedy, gdy produkt leczniczy nie był wcześniej stosowany.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlSpecjalne środki ostrozności
Reakcje nadwrażliwości mogą także rozwinąć się w zespół Kounisa, ciężką reakcję alergiczną, która może prowadzić do zawału mięśnia sercowego. Objawy takich reakcji mogą obejmować ból w klatce piersiowej występujący w związku z reakcją alergiczną na diklofenak. Podobnie jak inne niesteroidowe leki przeciwzapalne (NLPZ), Dicloreum może maskować objawy przedmiotowe i podmiotowe zakażenia, co wynika z właściwości farmakodynamicznych produktu leczniczego. Stosowanie diklofenaku może niekorzystnie wpływać na płodność i nie jest ono zalecane u kobiet, które planują ciążę. W przypadku kobiet, które mają trudności z zajściem w ciążę lub które są poddawane badaniom w związku z niepłodnością, należy rozważyć zakończenie stosowania diklofenaku (patrz punkt 4.6). Należy ściśle przestrzegać instrukcji wykonywania wstrzyknięcia domięśniowego w celu uniknięcia wystąpienia działań niepożądanych w miejscu wstrzyknięcia, które mogą powodować osłabienie mięśni, porażenie mięśni, niedoczulicę, embolia cutis medicamentosa (zespół Nicolaua) i martwicę w miejscu wstrzyknięcia.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlSpecjalne środki ostrozności
Reakcje w miejscu wstrzyknięcia Zgłaszano występowanie reakcji w miejscu wstrzyknięcia po podaniu domięśniowym diklofenaku, obejmującą martwicę w miejscu wstrzyknięcia oraz embolia cutis medicamentosa, znaną także jako zespół Nicolaua (zwłaszcza po nieumyślnym podaniu podskórnym). Podczas domięśniowego podawania diklofenaku należy stosować właściwy dobór igły i techniki wstrzykiwania (patrz punkt). 4.2 Środki ostrożności Ogólne Należy unikać jednoczesnego stosowania produktu leczniczego Dicloreum z działającymi ogólnoustrojowo NLPZ, w tym selektywnymi inhibitorami cyklooksygenazy-2, ze względu na brak dowodów dotyczących korzyści wynikających ze stosowania skojarzonego oraz potencjalnego zwiększenia działań niepożądanych. Produkt leczniczy Dicloreum należy stosować ostrożnie u osób w podeszłym wieku. W przypadku osób w podeszłym wieku i u osób z małą masą ciała zaleca się stosowanie najmniejszej skutecznej dawki.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlSpecjalne środki ostrozności
Astma w wywiadzie U pacjentów z astmą, sezonowym alergicznym nieżytem nosa, obrzękiem błony śluzowej nosa (np. polipy nosa), przewlekłą obturacyjną chorobą płuc lub przewlekłymi zakażeniami układu oddechowego (szczególnie, gdy mają objawy podobne do objawów alergicznego nieżytu nosa) częściej niż u innych pacjentów występują zaostrzenia astmy w wyniku zastosowania NLPZ (nietolerancja produktów leczniczych przeciwbólowych), obrzęk Quinckego lub pokrzywka. W związku z tym u tych pacjentów zaleca się szczególną ostrożność (należy umożliwić szybki dostęp do pomocy lekarskiej). Szczególne środki ostrożności należy zachować u pacjentów z alergią na inne substancje, np. pacjentów z odczynami skórnymi, świądem lub pokrzywką oraz u pacjentów z astmą oskrzelową, przyjmujących Dicloreum w postaci ampułek, ze względu na możliwość zaostrzenia się objawów choroby.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlSpecjalne środki ostrozności
Wpływ na przewód pokarmowy U pacjentów z objawami wskazującymi na zaburzenia żołądka i jelit lub z wywiadem sugerującym chorobę wrzodową żołądka i (lub) jelit, krwawienia lub perforację tak jak w przypadku innych NLPZ niezbędny jest ścisły nadzór lekarski i należy szczególnie ostrożnie zalecać produkt leczniczy Dicloreum tym pacjentom (patrz punkt 4.8). Ryzyko krwawienia z przewodu pokarmowego jest większe w przypadku zwiększania dawek NLPZ i u pacjentów z chorobą wrzodową w wywiadzie, szczególnie gdy przebiegała ona z krwotokami lub perforacją oraz u pacjentów w podeszłym wieku. Aby zmniejszyć ryzyko toksyczności na układ pokarmowy u pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie, szczególnie gdy przebiegała z krwotokami lub perforacją, oraz u pacjentów w podeszłym wieku należy rozpoczynać i kontynuować leczenie z zastosowaniem najmniejszych skutecznych dawek. U tych pacjentów należy rozważyć leczenie skojarzone produktami leczniczymi osłonowymi (np.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlSpecjalne środki ostrozności
inhibitorami pompy protonowej lub mizoprostolem) jak również u pacjentów, u których konieczne jest jednoczesne stosowanie produktów leczniczych zawierających małe dawki kwasu acetylosalicylowego (aspiryna) lub innych produktów leczniczych mogących zwiększyć ryzyko wystąpienia zaburzeń żołądka i jelit. Pacjenci ze stwierdzonymi zaburzeniami żołądka i jelit w wywiadzie, szczególnie pacjenci w podeszłym wieku, powinni informować lekarza o każdych nietypowych objawach brzusznych (szczególnie o krwawieniach z przewodu pokarmowego). Należy zachować ostrożność u pacjentów otrzymujących jednocześnie produkty lecznicze, które mogą powodować zwiększenie ryzyka powstania choroby wrzodowej żołądka i (lub) dwunastnicy lub krwawienia, takie jak kortykosteroidy działające ogólnoustrojowo, produkty lecznicze przeciwzakrzepowe, produkty lecznicze przeciwpłytkowe lub selektywne inhibitory wychwytu zwrotnego serotoniny (patrz punkt 4.5).
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlSpecjalne środki ostrozności
Pacjenci z wrzodziejącym zapaleniem okrężnicy lub z chorobą Leśniowskiego-Crohna powinni być pod ścisłą kontrolą lekarską, ze względu na możliwość zaostrzenia ogólnego stanu (patrz punkt 4.8). Stosowanie NLPZ, w tym diklofenaku, może wiązać się ze zwiększeniem ryzyka nieszczelności zespolenia żołądkowo-jelitowego. Zaleca się ścisły nadzór medyczny i zachowanie ostrożności podczas stosowania diklofenaku po operacjach przewodu pokarmowego. Wpływ na czynność wątroby Ścisły nadzór medyczny jest konieczny w przypadku zalecenia produktu leczniczego Dicloreum pacjentom z zaburzeniami czynności wątroby, ze względu na możliwość pogorszenia ogólnego stanu. Tak jak inne niesteroidowe leki przeciwzapalne (NLPZ), Dicloreum może zwiększać aktywność jednego lub więcej enzymów wątrobowych. W trakcie długotrwałego leczenia produktem leczniczym Dicloreum zaleca się, jako środek ostrożności, regularne kontrolowanie czynności wątroby.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlSpecjalne środki ostrozności
Należy przerwać stosowanie produktu leczniczego Dicloreum, jeśli utrzymują się nieprawidłowe wyniki badań czynnościowych wątroby lub ulegają pogorszeniu oraz gdy wystąpią kliniczne oznaki lub objawy wskazujące na zaburzenia czynności wątroby oraz inne objawy (np.: eozynofilia, wysypka itp.). Zapalenie wątroby może wystąpić nie poprzedzone objawami prodromalnymi. Należy zachować ostrożność stosując produkt leczniczy Dicloreum u pacjentów z porfirią wątrobową, ponieważ może on wywołać atak choroby. Wpływ na czynność nerek W związku z leczeniem NLPZ odnotowano przypadki zatrzymywania płynów i powstawania obrzęków, dlatego szczególną ostrożność należy zachować w przypadku pacjentów z zaburzoną czynnością serca lub nerek, z nadciśnieniem tętniczym w wywiadzie, u osób w podeszłym wieku, u pacjentów jednocześnie otrzymujących produkty lecznicze moczopędne lub produkty lecznicze znacząco wpływające na czynność nerek oraz u pacjentów z nadmierną utratą płynu pozakomórkowego o różnej etiologii np.: w fazie około- lub pooperacyjnej po dużych zabiegach chirurgicznych (patrz punkt 4.3).
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlSpecjalne środki ostrozności
W takich przypadkach, podczas stosowania produktu leczniczego Dicloreum jako środek ostrożności, zaleca się monitorowanie czynności nerek. Przerwanie leczenia produktem leczniczym Dicloreum zwykle powoduje powrót do stanu poprzedzającego leczenie. Wpływ na wskaźniki hematologiczne W trakcie długotrwałego leczenia produktem leczniczym Dicloreum, podobnie jak w przypadku stosowania innych niesteroidowych leków przeciwzapalnych (NLPZ), zaleca się kontrolowanie wskaźników hematologicznych. Tak jak inne niesteroidowe leki przeciwzapalne (NLPZ), produkt leczniczy Dicloreum, może przemijająco hamować agregację płytek krwi. Pacjenci z zaburzeniami hemostazy powinni być dokładnie kontrolowani.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Opisane interakcje uwzględniają także te zaobserwowane po zastosowaniu innych postaci farmaceutycznych zawierających diklofenak. Lit: Dicloreum podawany jednocześnie z produktami leczniczymi zawierającymi lit może zwiększać jego stężenie w osoczu. Zaleca się monitorowanie stężenia litu w surowicy. Digoksyna: Dicloreum podawany jednocześnie z produktami leczniczymi zawierającymi digoksynę może zwiększać jej stężenie w osoczu. Zaleca się monitorowanie stężenia digoksyny w surowicy. Antykoagulanty: niesteroidowe leki przeciwzapalne mogą zwiększać efekt działania produktów leczniczych przeciwzakrzepowych z grupy kumaryn takich jak warfaryna (patrz punkt 4.4). Produkty lecznicze moczopędne i produkty lecznicze zmniejszające ciśnienie krwi: Podobnie jak w przypadku innych NLPZ jednoczesne stosowanie diklofenaku z produktami leczniczymi moczopędnymi lub produktami leczniczymi zmniejszającymi ciśnienie krwi (np.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlInterakcje
produkty lecznicze blokujące receptor β-adrenergiczny, inhibitory ACE) może spowodować zmniejszenie ich działania przeciwnadciśnieniowego. Z tego względu należy ostrożnie stosować produkt leczniczy Dicloreum jednocześnie z produktem leczniczym moczopędnym lub zmniejszającym ciśnienie tętnicze. Z powodu zwiększonego ryzyka nefrotoksyczności, pacjentów należy odpowiednio nawadniać i okresowo kontrolować czynność nerek, po rozpoczęciu oraz podczas leczenia skojarzonego, szczególnie po zastosowaniu produktów leczniczych moczopędnych i inhibitorów konwertazy angiotensyny. U pacjentów, szczególnie w podeszłym wieku, należy regularnie kontrolować ciśnienie tętnicze. Podczas jednoczesnego stosowania produktów leczniczych oszczędzających potas należy regularnie kontrolować stężenie potasu w surowicy (patrz punkt 4.4).
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Niesteroidowe leki przeciwzapalne (NLPZ) i kortykosteroidy: Jednoczesne podawanie diklofenaku i innych niesteroidowych leków przeciwzapalnych lub kortykosteroidów może zwiększać częstość występowania działań niepożądanych dotyczących przewodu pokarmowego (patrz punkt 4.4). Produkty lecznicze przeciwzakrzepowe i produkty lecznicze przeciwpłytkowe: Należy zachować ostrożność ze względu na zwiększone ryzyko krwawienia. Wprawdzie badania kliniczne nie świadczą o tym, aby diklofenak wpływał na działanie produktów leczniczych przeciwzakrzepowych, jednak donoszono o zwiększonym ryzyku krwotoku u pacjentów przyjmujących jednocześnie diklofenak i produkty lecznicze przeciwzakrzepowe. Pacjentów takich należy uważnie kontrolować. Selektywne inhibitory wychwytu zwrotnego serotoniny: Jednoczesne stosowanie NLPZ i selektywnych inhibitorów wychwytu zwrotnego serotoniny może zwiększyć ryzyko krwawień z przewodu pokarmowego (patrz punkt 4.4).
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Produkty lecznicze przeciwcukrzycowe: Badania kliniczne wykazały, że diklofenak można podawać jednocześnie z doustnymi produktami leczniczymi przeciwcukrzycowymi bez wpływu na ich działanie kliniczne. Jednakże wystąpiły pojedyncze przypadki zarówno działania hipoglikemizującego jak i hiperglikemizującego, które spowodowały konieczność zmiany dawkowania produktów leczniczych przeciwcukrzycowych w trakcie leczenia diklofenakiem. Z tego powodu monitorowanie stężenia glukozy we krwi jest konieczne podczas jednoczesnego leczenia. Metotreksat: Zaleca się ostrożność podczas stosowania niesteroidowych leków przeciwzapalnych w czasie krótszym niż 24 godziny, przed lub po leczeniu metotreksatem, ponieważ może wystąpić zwiększenie stężenia metotreksatu we krwi i może wystąpić zwiększenie toksyczności działania tej substancji.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Cyklosporyna i takrolimus: Diklofenak jak i inne niesteroidowe leki przeciwzapalne może zwiększyć działanie nefrotoksyczne cyklosporyny i takrolimusa ze względu na wpływ na prostaglandyny nerkowe. W związku z tym diklofenak powinien być podawany w dawkach mniejszych niż u pacjentów nie otrzymujących cyklosporyny i takrolimusa. Działanie to może wynikać z nerkowego wpływu antyprostaglandynowego NLPZ i inhibitora kalcyneuryny. Chinolony przeciwbakteryjne: Odnotowano pojedyncze przypadki wystąpienia drgawek, które mogły być spowodowane jednoczesnym stosowaniem chinolonów i niesteroidowych leków przeciwzapalnych (NLPZ). Glikozydy nasercowe: Jednoczesne stosowanie glikozydów nasercowych i NLPZ może spowodować zaostrzenie choroby wieńcowej, zmniejszyć przepływ nerkowy i zwiększyć stężenie glikozydów we krwi. Mifepryston: Niesteroidowe leki przeciwzapalne nie powinny być stosowane przez 8 do 12 dni po podaniu mifeprystonu, ponieważ mogą zmniejszać jego skuteczność.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Fenytoina: Podczas jednoczesnego stosowania z diklofenakiem, zaleca się monitorowanie stężenia fenytoiny w osoczu, ze względu na możliwy wzrost ekspozycji na fenytoinę. Kolestypol i cholestramina: Te substancje mogą spowodować opóźnienie lub obniżenie absorpcji diklofenaku. Dlatego zaleca się podawanie diklofenaku co najmniej jedna godzinę przed lub 4 do 6 godzin po podaniu kolestypolu i (lub) cholestraminy. Silne inhibitory CYP2C9: Należy zachować ostrożność podczas przepisywania diklofenaku wraz z silnymi inhibitorami CYP2C9 (takimi jak sulfinpirazon i worykonazol), ponieważ w wyniku zahamowania metabolizmu diklofenaku, jego stężenie w osoczu oraz ekspozycja na produkt leczniczy może znacznie wzrosnąć.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na przebieg ciąży i (lub) rozwój zarodka lub płodu. Dane z badań epidemiologicznych sugerują, że wzrasta ryzyko poronienia oraz wad rozwojowych serca i wytrzewienia po zastosowaniu inhibitorów syntezy prostaglandyn we wczesnej ciąży. Ryzyko bezwzględne wystąpienia wad rozwojowych serca było podwyższone z mniej niż 1% do około 1,5%. Uważa się, że ryzyko wzrasta wraz ze zwiększaniem dawki oraz z czasem trwania leczenia. U zwierząt wykazano, że podawanie inhibitorów syntezy prostaglandyn powodowało wzrost poronień przed i po zagnieżdżeniu oraz wzrost śmiertelności zarodków i płodów. Ponadto wykazano, że podawanie inhibitorów syntezy prostaglandyn u zwierząt w okresie organogenezy powodowało wzrost liczby różnego rodzaju wad rozwojowych, włączając w to wady sercowo-naczyniowe. Od 20. tygodnia ciąży stosowanie diklofenaku może powodować małowodzie wskutek zaburzeń czynności nerek płodu.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlWpływ na płodność, ciążę i laktację
Może ono wystąpić krótko po rozpoczęciu leczenia i jest zwykle odwracalne po jego przerwaniu. Dodatkowo odnotowano przypadki zwężenia przewodu tętniczego w następstwie leczenia w drugim trymestrze ciąży, z których większość ustąpiła po zaprzestaniu leczenia. W pierwszym i drugim trymestrze ciąży nie należy podawać diklofenaku, chyba że jest to bezwzględnie konieczne. Jeśli diklofenak jest stosowany przez kobietę starającą się o ciążę lub podczas pierwszego i drugiego trymestru ciąży, zastosowana dawka powinna być jak najmniejsza, a czas trwania leczenia jak najkrótszy. Należy rozważyć przedporodowe monitorowanie w kierunku małowodzia oraz zwężenia przewodu tętniczego po ekspozycji na diklofenak przez kilka dni od 20. tygodnia ciąży. W przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego należy zaprzestać stosowania diklofenaku.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlWpływ na płodność, ciążę i laktację
W trzecim trymestrze ciąży wszystkie inhibitory syntezy prostaglandyn mogą działać na płód w następujący sposób: toksyczne działanie dotyczące płuc i serca (w tym przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne); zaburzenia czynności nerek (patrz powyżej); U matki i noworodka pod koniec ciąży może prowadzić do: wydłużenia czasu krwawienia w wyniku działania antyagregacyjnego, które może wystąpić się nawet po zastosowaniu bardzo małych dawek; hamowania czynności skurczowej macicy powodującego opóźnienie lub przedłużanie się porodu. W związku z tym diklofenak jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3). Karmienie piersi? Tak jak inne NLPZ diklofenak przenika do mleka kobiet karmiących piersią w niewielkich ilościach. Z tego względu Dicloreum nie powinien być podawany kobietom karmiącym piersią w celu uniknięcia wystąpienia działań niepożądanych u dziecka.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlWpływ na płodność, ciążę i laktację
Płodność Tak jak w przypadku innych NLPZ, stosowanie produktu leczniczego Dicloreum może wpływać na płodność i nie jest zalecane u kobiet planujących ciążę. U kobiet mających problemy z zajściem w ciążę lub które są w trakcie diagnozowania niepłodności, należy rozważyć odstawienie produktu leczniczego Dicloreum.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjenci przyjmujący Dicloreum, u których występują zaburzenia widzenia, senność, zawroty głowy lub inne zaburzenia dotyczące ośrodkowego układu nerwowego, powinni zaprzestać prowadzenia pojazdów lub obsługiwania maszyn.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlDziałania niepożądane
4.8 Działania niepożądane Częstość występowania działań niepożądanych szacowano następująco: często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do < 1/100); rzadko (≥1/10 000 do < 1/1 000); bardzo rzadko (<1/10 000), nieznana (częstość nie może być określona na podstawie dostępnych danych). Przedstawione poniżej działania niepożądane obejmują działania niepożądane odnotowane dla produktu leczniczego Dicloreum w postaci ampułek, jak również obserwowane podczas stosowania innych postaci diklofenaku, stosowanych krótko- lub długotrwale. Zakażenia i zakażenia pasożytnicze Bardzo rzadko: ropnie w miejscu podania Częstość nieznana: martwica w miejscu wstrzyknięcia Zaburzenia krwi i układu chłonnego Bardzo rzadko: trombocytopenia, leukopenia, anemia (w tym anemia hemolityczna i aplastyczna), agranulocytoza Zaburzenia układu immunologicznego Rzadko: nadwrażliwość, reakcje anafilaktyczne i rzekomoanafilaktyczne (w tym hipotensja i wstrząs) Bardzo rzadko: obrzęk naczynioruchowy (w tym obrzęk twarzy) Zaburzenia psychiczne Bardzo rzadko: dezorientacja, depresja, bezsenność, koszmary senne, drażliwość, zaburzenia psychotyczne Zaburzenia układu nerwowego Często: bóle głowy, zawroty głowy Rzadko: senność Bardzo rzadko: parestezje, zaburzenia pamięci, drgawki, lęk, drżenie, jałowe zapalenie opon mózgowych, zaburzenia smaku, udar naczyniowy mózgu Zaburzenia oka Bardzo rzadko: zaburzenia widzenia, niewyraźne widzenia, podwójne widzenie Zaburzenia ucha i błędnika Często: zawroty głowy Bardzo rzadko: szumy uszne, zaburzenia słuchu Zaburzenia serca Bardzo rzadko: kołatanie serca, ból w klatce piersiowej, niewydolność serca, zawał mięśnia sercowego Częstość nieznana: zespół Kounisa Zaburzenia naczyniowe Bardzo rzadko: nadciśnienie tętnicze, zapalenie naczyń Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Rzadko: astma (w tym duszność) Bardzo rzadko: zapalenie płuc Zaburzenia żołądka i jelit Często: nudności, wymioty, biegunka, niestrawność, ból brzucha, wzdęcia, anoreksja Rzadko: zapalenie błony śluzowej żołądka, krwawienia z przewodu pokarmowego, krwawe wymioty, krwawe biegunki, smoliste stolce, choroba wrzodowa żołądka i (lub) dwunastnicy (z krwawieniem lub bez i perforacją) Bardzo rzadko: zapalenie okrężnicy (także krwotoczne oraz zaostrzenie wrzodziejącego zapalenia okrężnicy lub choroba Crohna), zaparcia, zapalenie błony śluzowej jamy ustnej, zapalenie języka, zaburzenia w obrębie przełyku, błoniaste zwężenie jelit, zapalenie trzustki Częstość nieznana: niedokrwienne zapalenie okrężnicy Zaburzenia wątroby i dróg żółciowych Często: zwiększenie aktywności aminotransferaz Rzadko: zapalenie wątroby, żółtaczka, zaburzenia czynności wątroby Bardzo rzadko: piorunujące zapalenie wątroby Zaburzenia skóry i tkanki podskórnej Często: wysypka Rzadko: pokrzywka Bardzo rzadko: wysypka pęcherzowa, wyprysk, rumień, rumień wielopostaciowy, zespół Stevens-Johnsona, toksyczne martwicze oddzielanie się naskórka (zespół Lyella), złuszczające zapalenie skóry, łysienie, reakcje nadwrażliwości na światło, plamica, choroba Schönleina i Henocha, świąd Zaburzenia nerek i dróg moczowych Bardzo rzadko: ostra niewydolność nerek, krwiomocz, białkomocz, zespół nerczycowy, śródmiąższowe zapalenie nerek, martwica brodawek nerkowych Zaburzenia ogólne i stany w miejscu podania Często: podrażnienie, ból, stwardnienie w miejscu podania Rzadko: obrzęk, zanik tkanki w miejscu podania Częstość nieznana: embolia cutis medicamentosa (zespół Nicolaua) W związku z leczeniem NLPZ zgłaszano występowanie obrzęków, nadciśnienia tętniczego i niewydolności serca.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlDziałania niepożądane
Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg na dobę) i w leczeniu długotrwałym zwiększa ryzyko zakrzepicy tętnic (np. zawał serca lub udar). Patrz punkty 4.3 Przeciwwskazania i 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlDziałania niepożądane
Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy Brak charakterystycznego obrazu klinicznego wynikającego z przedawkowania diklofenaku. Przedawkowanie może wywołać takie objawy jak: wymioty, krwotok z przewodu pokarmowego, biegunkę, zawroty głowy, szumy uszne lub drgawki. W przypadku znacznego zatrucia może pojawić się ostra niewydolność nerek i uszkodzenie wątroby. Leczenie przedawkowania Leczenie ostrego zatrucia niesteroidowymi lekami przeciwzapalnymi (NLPZ) zasadniczo obejmuje stosowanie środków podtrzymujących czynność ważnych dla życia narządów oraz leczenie objawowe. Leczenie podtrzymujące i objawowe należy zastosować w przypadku takich powikłań jak znaczne zmniejszenie ciśnienia tętniczego krwi, niewydolność nerek, drgawki, zaburzenia żołądka i jelit oraz zaburzenia oddychania. Specjalne środki zaradcze takie jak wymuszona diureza, dializa lub przetaczanie krwi nie są pomocne w przyspieszeniu eliminowania niesteroidowych leków przeciwzapalnych (NLPZ), ze względu na ich dużą zdolność wiązania z białkami i rozległy metabolizm.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu octowego kod ATC: M 01 AB 05 Dicloreum zawiera diklofenak sodowy, która jest związkiem niesteroidowym o działaniu przeciwreumatycznym, przeciwzapalnym, przeciwbólowym i przeciwgorączkowym. Wykazano doświadczalnie, że w mechanizmie działania produktu leczniczego Dicloreum, istotne znaczenie ma hamowanie biosyntezy prostaglandyn. Prostaglandyny odgrywają zasadniczą rolę w patogenezie procesu zapalnego, bólu i gorączki. In vitro diklofenak sodowy nie hamuje biosyntezy proteoglikanów w chrząstce w zakresie stężeń odpowiadających wartościom osiąganym w organizmie ludzkim.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Po iniekcji domięśniowej 75 mg diklofenaku sodowego maksymalne stężenie diklofenaku w osoczu 2,5 μg/ml (8 μmol/l), obserwuje się po około 20 minutach od momentu podania. Stężenie w osoczu jest zależne od wielkości podawanej dawki. Dystrybucja Diklofenak łączy się z białkami osocza w 99,7%, głównie z albuminami (99,4%). Objętość dystrybucji ocenia się na 0,12 l/kg do 0,17 l/kg. Diklofenak przenika do płynu maziowego, gdzie maksymalne stężenie występuje po 2 do 4 godzin od osiągnięcia maksymalnego stężenia w osoczu krwi. Okres półtrwania w fazie eliminacji z płynu maziowego wynosi od 3 do 6 godzin. Po dwóch godzinach od osiągnięcia wartości maksymalnych w osoczu krwi, wartości stężenia substancji czynnej w płynie maziowym, są już większe niż w osoczu i pozostają większe aż przez 12 godzin.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlWłaściwości farmakokinetyczne
Metabolizm Metabolizm diklofenaku obejmuje częściowo glukuronizację niezmienionej cząsteczki, lecz diklofenak ulega przede wszystkim pojedynczej lub wielokrotnej hydroksylacji i metoksylacji, w wyniku czego powstaje kilka pochodnych fenolowych (3'-hydroksy-, 4'-hydroksy-, 5-hydroksy-, 4',5-dwuhydroksy- i 3' -hydroksy-4'-metoksy-diklofenak), z których większość ulega przekształceniu do połączeń glukuronidowych. Dwie spośród pochodnych fenolowych wykazują aktywność biologiczną, chociaż w znacznie mniejszym zakresie niż diklofenak. Eliminacja Całkowity, ogólnoustrojowy klirens osoczowy diklofenaku wynosi 263± 56 ml/minutę (średnia wartość ± SD). Okres półtrwania w fazie eliminacji w osoczu wynosi od 1 do 2 godzin. Cztery metabolity, w tym dwa aktywne, mają również krótki okres półtrwania od 1 do 3 godzin. Jeden metabolit, 3'-hydroksy-4'-metoksy- diklofenak, ma znacznie dłuższy okres półtrwania, ale jest on praktycznie nieaktywny.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlWłaściwości farmakokinetyczne
Około 60% podanej dawki ulega wydaleniu w mocz u w postaci sprzężonych z glukuronidami niezmienionych cząsteczek i metabolitów, z których większość również ulega przekształceniu do glukuronidów. Mniej niż 1% produktu leczniczego ulega wydaleniu w postaci niezmienionej. Pozostała część dawki ulega eliminacji w postaci metabolitów z żółcią w kale.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, pochodzące z badań toksyczności ostrej i po podaniu dawki wielokrotnej jak również badania genotoksyczności, mutagenności i rakotwórczości z zastosowaniem diklofenaku w dawkach terapeutycznych nie wykazały szczególnego zagrożenia dla człowieka. Nie stwierdzono działania teratogennego u zwierząt. W badaniach ostrej toksyczności u królików, nie stwierdzono zaburzeń hemodynamicznych u badanych zwierząt. LD50 u szczurów wynosi po podaniu domięśniowym > 225 mg /kg masy ciała, LD50 u myszy wynosi po podaniu domięśniowym > 250 mg /kg masy ciała. Badania przewlekłej toksyczności potwierdzają niską toksyczność diklofenaku.
- CHPL leku Dicloreum, roztwór do wstrzykiwań, 25 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Glikol propylenowy, alkohol benzylowy, sodu wodorotlenek, sodu pirosiarczyn, woda do wstrzykiwań. 6.2 Niezgodności farmaceutyczne Dicloreum w postaci roztworu do wstrzykiwań nie powinien być mieszany z innymi roztworami do wstrzykiwań. 6. SZCZEGÓŁOWE DANE KLINICZNE 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. 6.5 Rodzaj i zawartość opakowania 6 ampułek z oranżowego szkła zawierających po 3 ml roztworu umieszczonych w tekturowym pudełku. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Dicloreum w postaci roztworu należy podawać jako głęboką iniekcję w górny zewnętrzny kwadrant pośladka. Brak szczególnych wymagań. Nie stosować doustnie.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Naclof, 1 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu leczniczego Naclof zawiera 1 mg diklofenaku sodowego (Diclofenacum natricum). Substancja pomocnicza o znanym działaniu: benzalkoniowy chlorek (0,05 mg/ml). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krople do oczu, roztwór
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Pooperacyjne stany zapalne po operacji zaćmy i innych zabiegach chirurgicznych. Profilaktyka torbielowatego obrzęku plamki po operacji zaćmy z implantacją soczewki. Pourazowe stany zapalne w przypadku urazów bez perforacji gałki ocznej. Hamowanie zwężenia źrenicy w czasie operacji zaćmy. Przeciwdziałanie objawom bólu i światłowstrętowi.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli a) Chirurgia oka i jej powikłania: Przed zabiegiem chirurgicznym stosuje się 1 kroplę 5 razy w ciągu 3 godzin. Po zabiegu chirurgicznym – 1 kropla 3 razy w ciągu dnia po operacji, a w ciągu następnych dni 1 kropla 3 do 5 razy na dobę, tak długo, jak jest to konieczne. b) Postępowanie w przypadkach objawów bólu i światłowstrętu: 1 kropla co 4 do 6 godzin. Jeśli ból jest skutkiem zabiegu chirurgicznego, stosuje się 1 do 2 kropli w ciągu godziny poprzedzającej zabieg, 1 do 2 kropli w ciągu 15 minut po zabiegu i 1 kroplę co 4 do 6 godzin w ciągu 3 dni po zabiegu chirurgicznym. Pacjenci w podeszłym wieku: nie jest konieczna modyfikacja dawek. Dzieci i młodzież: produkt leczniczy Naclof nie jest zalecany do stosowania u dzieci. Dostępne są jedynie ograniczone dane z badań klinicznych operacji zeza u dzieci. Sposób podawania Zawartość opakowania jest jałowa, jeśli oryginalne zamknięcie jest nienaruszone.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlDawkowanie
Pacjenta należy poinformować, że dotknięcie końcówką zakraplacza do oka lub jego otoczenia może spowodować zanieczyszczenie zawartości pojemnika. W przypadku stosowania więcej niż jednego leku do oka pomiędzy kolejnymi zakropleniami należy zachować odstęp co najmniej 5 minut. Uciśnięcie kanalika nosowo-łzowego lub zamknięcie oczu po podaniu leku na 5 minut może zmniejszyć ogólną absorpcję. Dzięki temu zmniejsza się ryzyko wystąpienia ogólnoustrojowych działań niepożądanych i zwiększa działanie miejscowe.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Podobnie jak inne niesteroidowe leki przeciwzapalne, produkt leczniczy Naclof jest przeciwwskazany u pacjentów z astmą, pokrzywką lub zapaleniem błony śluzowej nosa po zastosowaniu kwasu acetylosalicylowego lub innych substancji hamujących syntezę prostaglandyn. U pacjentów z nadwrażliwością na kwas acetylosalicylowy możliwe jest występowanie nadwrażliwości na pochodne kwasu fenylooctowego i inne niesteroidowe leki przeciwzapalne (nadwrażliwość krzyżowa).
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Niesteroidowe leki przeciwzapalne poprzez swoje działanie mogą maskować ujawnienie się i (lub) rozwój zakażeń. W przypadku wystąpienia zakażenia lub ryzyka jego wystąpienia należy wprowadzić odpowiedni lek przeciwbakteryjny jednocześnie z produktem leczniczym Naclof. Mimo że do tej pory nie opisano takich przypadków, istnieje możliwość, że u pacjentów przyjmujących leki wydłużające czas krwawienia lub u pacjentów z zaburzeniami hemostazy w wywiadzie po zastosowaniu diklofenaku może wystąpić nasilenie zaburzeń krzepnięcia krwi. Należy zachować ostrożność w przypadku jednoczesnego stosowania niesteroidowych leków przeciwzapalnych, takich jak diklofenak, z miejscowo działającymi steroidami (patrz punkt 4.5). Produkt leczniczy Naclof jest lekiem wyłącznie do stosowania zewnętrznego, miejscowo do worka spojówkowego. Nie należy podawać go w postaci wstrzyknięć podspojówkowych lub bezpośrednio do komory przedniej oka.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlSpecjalne środki ostrozności
Produkt leczniczy zawiera chlorek benzalkoniowy jako środek konserwujący. Lek zawiera 0,0014 mg chlorku benzalkoniowego w każdej kropli. Należy unikać kontaktu leku z miękkimi soczewkami kontaktowymi. Chlorek benzalkoniowy może być adsorbowany przez miękkie soczewki kontaktowe i może zmieniać ich zabarwienie. Pacjentom należy zalecić zdjęcie soczewek kontaktowych przed zastosowaniem tego produktu leczniczego i odczekanie co najmniej 15 minut przed ich ponownym założeniem. Zgłaszano, że chlorek benzalkoniowy może powodować także podrażnienie oczu, objawy zespołu suchego oka lub może wpływać na film łzowy i powierzchnię rogówki. Chlorek benzalkoniowy należy stosować ostrożnie u pacjentów z zespołem suchego oka oraz u pacjentów z uszkodzeniami rogówki. Pacjentów leczonych długotrwale należy kontrolować.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Jednoczesne stosowanie niesteroidowych leków przeciwzapalnych o działaniu miejscowym, takich jak diklofenak, i steroidów o działaniu miejscowym u pacjentów ze znaczącym uprzednim zakażeniem rogówki może powodować zwiększenie ryzyka powikłań. Dlatego należy zachować ostrożność. Produkt leczniczy Naclof stosowano bezpiecznie w badaniach klinicznych w skojarzeniu z antybiotykami oraz lekami hamującymi receptory β-adrenergiczne podawanymi do oka.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie przeprowadzono badań nad toksycznym wpływem produktu leczniczego Naclof na reprodukcję. Wykazano, że diklofenak o działaniu ogólnoustrojowym przenika przez łożysko u myszy i szczurów, jednak nie ma wpływu na płodność samców i samic szczura. W rutynowych badaniach nad rozwojem zarodka i płodu myszy, szczurów i królików nie znaleziono dowodów potwierdzających teratogenne działanie diklofenaku. U szczurów dawki toksyczne dla matki wiązały się z występowaniem trudnych porodów, przedłużeniem ciąży, skróconym czasem życia płodu i wewnątrzmacicznymi opóźnieniami wzrostu. Farmakologicznym następstwem działania tej grupy inhibitorów syntezy prostaglandyn jest niewielki wpływ diklofenaku na płodność i przebieg porodu oraz zwężenie przewodu tętniczego in utero. Lek nie miał wpływu na przed-, około- i pourodzeniowy rozwój potomstwa.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlWpływ na płodność, ciążę i laktację
Dotychczasowe badania na zwierzętach nie wykazały ryzyka dla płodu w pierwszym i drugim trymestrze ciąży, brak jest jednak kontrolowanych badań z udziałem kobiet ciężarnych. Produktu leczniczego Naclof nie należy stosować w trzecim trymestrze ciąży, z uwagi na możliwe ryzyko przedwczesnego zamknięcia przewodu tętniczego i ewentualne zahamowanie skurczów. Karmienie piersi? Po doustnym podaniu tabletek powlekanych w dawce 50 mg (zawartość dziesięciu 5 mililitrowych butelek produktu leczniczego Naclof) w mleku kobiecym stwierdzano jedynie śladowe ilości substancji czynnej – tak nieznaczne, że nie należy spodziewać się, by powodowały one jakiekolwiek działania niepożądane u karmionego piersią dziecka. Nie zaleca się stosowania diklofenaku do oczu podczas karmienia piersią, chyba że przewidywane korzyści przewyższają możliwe ryzyko.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjenci, u których po podaniu kropli występuje niewyraźne widzenie, nie powinni prowadzić pojazdów ani obsługiwać urządzeń mechanicznych.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlDziałania niepożądane
4.8 Działania niepożądane Częstość występowania działań niepożądanych przedstawiono zgodnie z następującą konwencją: bardzo często (≥ 1/10), często (≥ 1/100 do < 1/10), niezbyt często (≥ 1/1 000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1 000), bardzo rzadko (< 1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia układu immunologicznego: Częstość nieznana: nadwrażliwość. Zaburzenia oka: Bardzo często: ból oka. Często: podrażnienie oczu. Niezbyt często: świąd oczu, przekrwienie oka, niewyraźne widzenie, punktowate zapalenie rogówki. Rzadko: zaburzenia rogówki, wrzodziejące zapalenia rogówki, przerost rogówki, scieńczenie rogówki, ubytki nabłonka rogówki, obrzęk rogówki, zaburzenia widzenia, przekrwienie spojówek, alergiczne zapalenie spojówek, podrażnienie powiek, alergia oka, obrzęk powiek. Częstość nieznana: świąd powiek.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlDziałania niepożądane
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Rzadko: zaostrzenie objawów astmy, duszność. Częstość nieznana: kaszel i nieżyt nosa. Zaburzenia skóry i tkanki podskórnej: Częstość nieznana: pokrzywka, wysypka, wyprysk, rumień, świąd. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych – Al.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlDziałania niepożądane
Jerozolimskie 181C, 02-222 Warszawa Tel.: +48 22 49 21 301 Faks: +48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlPrzedawkowanie
4.9 Przedawkowanie Do tej pory nie opisano przypadku przedawkowania diklofenaku po jego zastosowaniu w postaci kropli do oczu. Ryzyko przedawkowania leku, również w przypadku przypadkowego przyjęcia doustnego, praktycznie nie występuje, ponieważ całe opakowanie 5 ml zawiera 5 mg diklofenaku, co stanowi 3% zalecanej dawki dobowej tego leku u dorosłych w przypadku podawania doustnego.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa terapeutyczna: leki oftalmologiczne, środki przeciwzapalne, niesteroidowe, kod ATC: S01BC03 Produkt leczniczy Naclof zawiera diklofenak sodowy, niesteroidowy lek przeciwzapalny wykazujący również właściwości przeciwbólowe. Mechanizm działania diklofenaku polega na hamowaniu syntezy prostaglandyn (mediatorów stanu zapalnego). W trakcie badań klinicznych obserwowano wpływ diklofenaku na hamowanie zwężenia źrenic podczas zabiegów operacyjnych zaćmy i zmniejszenie stanu zapalnego oraz bólu towarzyszącego uszkodzeniu nabłonka rogówki po niektórych zabiegach chirurgicznych. Brak dowodów wskazujących na to, że diklofenak hamuje gojenie się ran. Produkt leczniczy Naclof zawiera hydroksypropylo-gamma-cyklodekstrynę (HPgamma-CD). Cyklodekstryny zwiększają rozpuszczalność wybranych lipofilnych leków nierozpuszczalnych w wodzie.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlWłaściwości farmakodynamiczne
Uważa się, że cyklodekstryny działają jako rzeczywiste nośniki, utrzymując w roztworze hydrofobowe cząsteczki leków i przenosząc je na powierzchnię błon biologicznych.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne U królików maksymalne stężenia diklofenaku znakowanego 14C wykrywano w rogówce i spojówce 30 minut po podaniu. Lek był szybko i niemal całkowicie wydalany po 6 godzinach. U królików po pojedynczym podaniu leku do oka lub podawaniu leku do oka cztery razy na dobę (q.i.d.) przez 28 dni stężenia HP-gamma-CD w osoczu i cieczy wodnistej były poniżej granicy oznaczalności (1 nmol/ml). Małe stężenia HP-gamma-CD wykryto w cieczy wodnistej u dwóch królików (u jednego po pojedynczym zakropleniu do oka, a u drugiego po zakraplaniu cztery razy na dobę przez 28 dni). U ludzi potwierdzono przenikanie diklofenaku do komory przedniej oka. Po zakropleniu do oczu produktu leczniczego o stężeniu 1 mg/ml stężenie diklofenaku w osoczu było zbyt małe, by można je było oznaczyć.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane przedkliniczne z badań nad toksycznością ostrą i toksycznością po podaniu wielokrotnych dawek diklofenaku w postaci ogólnoustrojowej, jak również z badań oceniających działanie genotoksyczne, mutagenne, teratogenne, rakotwórcze i wpływ na reprodukcję, nie wykazały szczególnego zagrożenia dla ludzi po zastosowaniu zalecanych dawek terapeutycznych. Wykazano, że diklofenak o działaniu ogólnoustrojowym przenika przez łożysko u myszy i szczurów, nie wpływa jednak na płodność samców i samic szczura. U szczurów dawki toksyczne dla matki wiązały się z występowaniem trudnych porodów, przedłużeniem ciąży, skróconym przeżyciem płodu i wewnątrzmacicznymi opóźnieniami wzrostu. Farmakologicznym następstwem działania tej grupy inhibitorów syntezy prostaglandyn jest niewielki wpływ diklofenaku na płodność i przebieg porodu oraz zwężenie przewodu tętniczego in utero.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlPrzedkliniczne dane o bezpieczeństwie
Badania tolerancji na lek po miejscowym podaniu do oka oraz toksyczności różnych postaci produktu leczniczego nie przyniosły dowodów na toksyczność leku i występowanie miejscowych działań niepożądanych. Ryzyko wystąpienia toksycznych działań miejscowych w oku oraz toksycznych działań układowych produktu leczniczego Naclof i hydroksypropylo-gamma-cyklodekstryny (HPgamma-CD) oceniano w serii badań nad tolerancją leku w gałce ocznej królików. W trakcie badań wkraplano 8-krotnie 25 mikrolitrów roztworu do worka spojówkowego prawego oka, codziennie przez maksymalnie 13 tygodni. Leku nie zakraplano do lewego oka, które traktowano jako kontrolę w ocenie miejscowego działania leku. Zwierzęta otrzymywały produkt leczniczy Naclof z zawartością chlorku benzalkoniowego lub bez, lub też postać leku zawierającą wszystkie substancje pomocnicze produktu leczniczego Naclof, a jako substancję czynną 0,1% soli potasowej diklofenaku (zamiast 0,1% soli sodowej diklofenaku) lub 2% roztwór HPgamma-CD w roztworze soli fizjologicznej.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlPrzedkliniczne dane o bezpieczeństwie
W żadnym z tych badań nie stwierdzono objawów miejscowych działań niepożądanych dających się wykryć badaniem okulistycznym. Nie obserwowano również działań układowych w zakresie hematologii, biochemii, w obrazie moczu oraz w histologicznym badaniu wątroby, płuc i nerek.
- CHPL leku Naclof, krople do oczu, roztwór, 1 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Disodu edetynian Hydroksypropylo-γ-cyklodekstryna Kwas solny 1 M Glikol propylenowy Trometamol Tyloksapol Woda do wstrzykiwań Benzalkoniowy chlorek 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata Po otwarciu opakowania: 1 miesiąc 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25C. 6.5 Rodzaj i zawartość opakowania Butelka LDPE z zakrętką z HDPE oraz kroplomierzem LDPE, w tekturowym pudełku. 1 butelka po 5 ml 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LE CZNICZEGO Naklofen, 25 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 25 mg diklofenaku sodowego (Diclofenacum natricum). 3 ml roztworu do wstrzykiwań (1 ampułka) zawiera 75 mg diklofenaku sodowego. Substancje pomocnicze o znanym działaniu: alkohol benzylowy: 120 mg/3 ml roztworu sodu pirosiarczyn: 3 mg/3 ml roztworu glikol propylenowy: 630 mg/3 ml roztworu Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań Roztwór do wstrzykiwań jest przeźroczysty, bezbarwny do lekko żółtego.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Leczenie zapalnych lub zwyrodnieniowych postaci choroby reumatycznej: reumatoidalne zapalenie stawów, zesztywniające zapalenie stawów kręgosłupa, choroba zwyrodnieniowa stawów, reumatyzm pozastawowy.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Produkt leczniczy Naklofen w postaci roztworu do wstrzykiwań stosowany jest w leczeniu stanów ostrych. Wstrzyknięcia powinny być jak najszybciej zastąpione przez lek podawany w innej postaci (tabletki dojelitowe, tabletki/kapsułki o przedłużonym uwalnianiu lub czopki). Produkt leczniczy nie powinien być podawany dłużej niż 2 dni. Produkt leczniczy stosuje się zazwyczaj w dawce 75 mg - jedna ampułka na dobę, w głębokim wstrzyknięciu w górny zewnętrzny kwadrant pośladka. Nie należy stosować większej dawki niż 150 mg na dobę. Wyjątkowo, w ciężkich przypadkach, dawka dobowa może zostać zwiększona do dwóch wstrzyknięć po 75 mg, w odstępie kilku godzin (po jednym wstrzyknięciu w każdy pośladek). Występowanie działań niepożądanych można ograniczyć, stosując produkt w najmniejszej skutecznej dawce i nie dłużej niż to konieczne do kontrolowania objawów (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania).
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlDawkowanie
Dzieci i młodzież Nie zaleca się stosowania produktu leczniczego Naklofen w postaci roztworu do wstrzykiwań u dzieci i młodzieży ze względu na dawkę. Sposób podawania Podanie domięśniowe. Nie zaleca się mieszania produktu leczniczego z innymi produktami leczniczymi w jednej strzykawce.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na diklofenak, pirosiarczyn sodu lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Czynna choroba wrzodowa żołądka i (lub) dwunastnicy, krwawienie lub perforacja. Podawane w wywiadzie krwawienie z przewodu pokarmowego lub perforacja, związane z wcześniejszym leczeniem niesteroidowymi lekami przeciwzapalnymi (NLPZ). Czynna lub podawana w wywiadzie nawracająca choroba wrzodowa i (lub) krwotok (wystąpienie dwóch lub więcej odrębnych przypadków potwierdzonego owrzodzenia lub krwawienia). Ostatni trymestr ciąży (patrz punkt 4.6). Ciężka niewydolność wątroby lub nerek (patrz punkt 4.4). Stwierdzona zastoinowa niewydolność serca (klasa II-IV wg NYHA), choroba niedokrwienna serca, choroba naczyń obwodowych i (lub) choroba naczyń mózgowych. Podobnie jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), nie należy stosować diklofenaku u osób, u których podanie kwasu acetylosalicylowego lub innych leków hamujących syntezę prostaglandyn może być przyczyną wystąpienia napadu astmy, pokrzywki lub ostrego nieżytu nosa (patrz punkt 4.4 i 4.8).
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ogólne Przyjmowanie produktu leczniczego w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz wpływ na przewód pokarmowy i układ krążenia poniżej). Należy unikać jednoczesnego stosowania diklofenaku z NLPZ o działaniu ogólnoustrojowym, w tym z selektywnymi inhibitorami cyklooksygenazy-2, ze względu na brak dowodów dotyczących korzyści wynikających ze stosowania skojarzonego oraz potencjalnego nasilenia działań niepożądanych. Wskazane jest zachowanie ostrożności u osób w podeszłym wieku. W przypadku pacjentów w podeszłym wieku oraz osób z małą masą ciała zaleca się stosowanie najmniejszej skutecznej dawki. Tak jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), także po podaniu diklofenaku, rzadko mogą wystąpić reakcje alergiczne, w tym reakcje anafilaktyczne i rzekomoanafilaktyczne, nawet wtedy, gdy ten produkt leczniczy nie był wcześniej stosowany.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlSpecjalne środki ostrozności
Reakcje nadwrażliwości mogą także rozwinąć się w zespół Kounisa, ciężką reakcję alergiczną, która może prowadzić do zawału mięśnia sercowego. Objawy takich reakcji mogą obejmować ból w klatce piersiowej występujący w związku z reakcją alergiczną na diklofenak. Podobnie jak inne NLPZ, diklofenak może maskować objawy przedmiotowe i podmiotowe zakażenia, co wynika z jego właściwości farmakodynamicznych. Stosowanie NLPZ, w tym diklofenaku, może wiązać się ze zwiększeniem ryzyka nieszczelności zespolenia żołądkowo-jelitowego. Zaleca się ścisły nadzór medyczny i zachowanie ostrożności podczas stosowania diklofenaku po operacjach przewodu pokarmowego. Należy ściśle przestrzegać zaleceń dotyczących wykonywania wstrzyknięć domięśniowych, aby uniknąć zdarzeń niepożądanych w miejscu wstrzyknięcia, mogących doprowadzić do osłabienia mięśni, porażenia mięśni, niedoczulicy, embolia cutis medicamentosa (zespół Nicolaua) i martwicy w miejscu wstrzyknięcia.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Opisane interakcje uwzględniają również te zaobserwowane po zastosowaniu diklofenaku w innych postaciach farmaceutycznych. Lit: diklofenak podawany jednocześnie z preparatami zawierającymi lit może zwiększać jego stężenie w osoczu. Zaleca się monitorowanie stężenia litu. Digoksyna: diklofenak podawany jednocześnie z preparatami zawierającymi digoksynę może zwiększać jej stężenie w osoczu. Zaleca się monitorowanie stężenia digoksyny. Leki moczopędne i leki zmniejszające ciśnienie krwi: Podobnie jak w przypadku innych NLPZ jednoczesne stosowanie diklofenaku z lekami moczopędnymi lub lekami zmniejszającymi ciśnienie tętnicze krwi (np. leki blokujące receptory β-adrenergiczne, inhibitory ACE) może spowodować zmniejszenie ich działania przeciwnadciśnieniowego.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Z tego względu należy ostrożnie stosować diklofenak jednocześnie z tymi lekami i okresowo kontrolować ciśnienie krwi, szczególnie u osób w podeszłym wieku. Z powodu zwiększonego ryzyka działania nefrotoksycznego, pacjentów należy odpowiednio nawadniać i okresowo kontrolować czynność nerek, po rozpoczęciu leczenia oraz podczas leczenia skojarzonego, szczególnie po zastosowaniu leków moczopędnych i inhibitorów konwertazy angiotensyny. Podczas jednoczesnego stosowania leków oszczędzających potas należy często kontrolować stężenie potasu w surowicy, ponieważ może dojść do jego wzrostu (patrz punkt 4.4). Leki o których wiadomo, że powodują hiperkaliemię: Jednoczesne stosowanie leków moczopędnych oszczędzających potas, cyklosporyny, takrolimusu lub trimetoprymu może być związane ze zwiększeniem stężeniem potasu w surowicy. Z tego powodu należy często kontrolować stężenie potasu we krwi.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Inne niesteroidowe leki przeciwzapalne (NLPZ) i kortykosteroidy: Jednoczesne podawanie diklofenaku i innych niesteroidowych leków przeciwzapalnych lub kortykosteroidów może zwiększać częstość występowania działań niepożądanych dotyczących przewodu pokarmowego (patrz punkt 4.4). Leki przeciwzakrzepowe i przeciwpłytkowe: Należy zachować ostrożność, ponieważ jednoczesne stosowanie może zwiększyć ryzyko krwawień (patrz punkt 4.4). Chociaż badania kliniczne nie wskazują, aby diklofenak wpływał na działanie leków przeciwzakrzepowych, to istnieją pojedyncze doniesienia o zwiększonym ryzyku wystąpienia krwotoku w przypadku skojarzonego stosowania diklofenaku i leków przeciwzakrzepowych. Dlatego też, zaleca się w tym przypadku, dokładną kontrolę pacjentów. Selektywne inhibitory wychwytu zwrotnego serotoniny (ang.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
SSRIs): Jednoczesne stosowanie NLPZ, w tym diklofenaku, i selektywnych inhibitorów wychwytu zwrotnego serotoniny może zwiększyć ryzyko krwawień z przewodu pokarmowego (patrz punkt 4.4). Leki przeciwcukrzycowe: Badania kliniczne wykazały, że diklofenak można podawać jednocześnie z doustnymi lekami przeciwcukrzycowymi bez wpływu na ich działanie kliniczne. Jednakże wystąpiły pojedyncze przypadki zarówno działania hipoglikemizującego jak i hiperglikemizującego, które spowodowały konieczność zmiany dawkowania leków przeciwcukrzycowych w trakcie leczenia diklofenakiem. Z tego powodu monitorowanie stężenia glukozy we krwi jest konieczne podczas jednoczesnego leczenia. Probenecyd: Leki zawierające probenecyd mogą opóźniać eliminację diklofenaku z organizmu. Metotreksat: Diklofenak może hamować klirens nerkowy metotreksatu, zwiększając przez to stężenie metotreksatu we krwi.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Zaleca się ostrożność podczas stosowania NLPZ, w tym diklofenaku, w czasie krótszym niż 24 godziny, przed lub po leczeniu metotreksatem, ponieważ może wystąpić zwiększenie stężenia metotreksatu we krwi i może wystąpić zwiększenie działania toksycznego tej substancji. Cyklosporyna i takrolimus: Diklofenak, jak i inne NLPZ, może zwiększyć nefrotoksyczność cyklosporyny ze względu na wpływ na prostaglandyny nerkowe. W związku z tym diklofenak powinien być podawany w dawkach mniejszych niż u pacjentów nie otrzymujących cyklosporyny i takrolimusa. Chinolony przeciwbakteryjne: Odnotowano pojedyncze przypadki wystąpienia drgawek, które mogły być spowodowane jednoczesnym stosowaniem chinolonów i NLPZ. Fenytoina: Podczas stosowania fenytoiny jednocześnie z diklofenakiem, należy monitorować stężenie fenytoiny w osoczu, ze względu na spodziewany wzrost ekspozycji na fenytoinę.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Kolestypol i cholestyramina: Substancje te mogą spowodować opóźnienie lub zmniejszenie wchłaniania diklofenaku. W związku z tym, zalecane jest stosowanie diklofenaku przynajmniej jedną godzinę przed lub od 4 do 6 godzin po przyjęciu kolestypolu/cholestyraminy. Silne inhibitory CYP2C9: Należy zachować ostrożność podczas przepisywania diklofenaku wraz z silnymi inhibitorami CYP2C9 (takimi jak worykonazol), ponieważ w wyniku zahamowania metabolizmu diklofenaku, jego stężenie w osoczu oraz ekspozycja na lek może znacznie wzrosnąć. 4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na przebieg ciąży i (lub) rozwój zarodka/płodu. Dane z badań epidemiologicznych wskazują zwiększone ryzyko wystąpienia poronienia, wad rozwojowych serca i wytrzewienia jelit po zastosowaniu inhibitora syntezy prostaglandyn we wczesnym okresie ciąży.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Wartość bezwzględnego ryzyka wad rozwojowych układu sercowo-naczyniowego wzrosła z mniej niż 1% do ok. 1,5%. Wartość ta może wzrosnąć wraz ze zwiększeniem dawki i wydłużeniem okresu leczenia. W badaniach na zwierzętach wykazano, że podawanie inhibitora syntezy prostaglandyn zwiększyło liczbę strat po- i przedimplantacyjnych oraz śmiertelność zarodka i płodu. Dodatkowo, zaobserwowano zwiększenie częstości występowania różnych wad wrodzonych, w tym wad rozwojowych układu sercowo-naczyniowego u zwierząt, którym podawano inhibitor syntezy prostaglandyn w okresie organogenezy. Od 20. tygodnia ciąży stosowanie diklofenaku może powodować małowodzie wskutek zaburzeń czynności nerek płodu. Może ono wystąpić krótko po rozpoczęciu leczenia i jest zwykle odwracalne po jego przerwaniu. Ponadto, odnotowano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze, z których większość ustąpiła po zaprzestaniu leczenia.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
W pierwszym i drugim trymestrze ciąży nie należy podawać diklofenaku, chyba że jest to bezwzględnie konieczne. Jeśli diklofenak jest stosowany przez kobietę starającą się o ciążę lub podczas pierwszego i drugiego trymestru ciąży, zastosowana dawka powinna być jak najmniejsza, a czas trwania leczenia jak najkrótszy. Należy rozważyć przedporodowe monitorowanie w kierunku małowodzia i zwężenia przewodu tętniczego po ekspozycji na diklofenak przez kilka dni od 20. tygodnia ciąży. W przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego należy zaprzestać stosowania diklofenaku. W trzecim trymestrze ciąży wszystkie inhibitory syntezy prostaglandyn mogą działać na płód w następujący sposób: toksyczne działanie dotyczące płuc i serca (w tym przedwczesne zwężenia/zamknięcie przewodu tętniczego i nadciśnienie płucne); zaburzenia czynności nerek, które może prowadzić do niewydolności nerek z małowodziem (patrz powyżej).
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
U matki i noworodka pod koniec ciąży może prowadzić do: wydłużenia czasu krwawienia w wyniku działania przeciwagregacyjnego, które może wystąpić nawet po zastosowaniu bardzo małych dawek; hamowania czynności skurczowej macicy, powodując opóźnienie lub przedłużanie się porodu. W związku z tym, diklofenak jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3; 5.3). Karmienie piersi? Tak jak inne NLPZ diklofenak przenika do mleka kobiet karmiących piersią w niewielkich ilościach. Z tego względu, diklofenaku nie należy podawać kobietom karmiącym piersią w celu uniknięcia wystąpienia działań niepożądanych u dziecka. Płodność Stosowanie diklofenaku może niekorzystnie wpływać na płodność u kobiet i nie jest ono zalecane u kobiet, które planują ciążę. W przypadku kobiet, które mają trudności z zajściem w ciążę lub które są poddawane badaniom w związku z niepłodnością, należy rozważyć zakończenie stosowania diklofenaku.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjenci przyjmujący diklofenak, u których występują zaburzenia widzenia, zawroty głowy, zaburzenia równowagi, senność lub inne zaburzenia ośrodkowego układu nerwowego nie powinni prowadzić pojazdów oraz obsługiwać maszyn. 4.8 Działania niepożądane Działania niepożądane mogące pojawić się podczas leczenia diklofenakiem zostały sklasyfikowane według częstości występowania: bardzo często (≥1/10) często (≥1/100 do <1/10) niezbyt często (≥1/1000 do <1/100) rzadko (≥1/10 000 do <1/1000) bardzo rzadko (<1/10 000) częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) Przedstawione poniżej działania niepożądane obejmują działania niepożądane zgłaszane podczas krótkotrwałego lub długotrwałego leczenia. Zaburzenia krwi i układu chłonnego Bardzo rzadko trombocytopenia, leukopenia, niedokrwistość (w tym niedokrwistość hemolityczna i aplastyczna), agranulocytoza.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Zaburzenia układu immunologicznego Rzadko nadwrażliwość, reakcje anafilaktyczne i rzekomoanafilaktyczne (w tym skurcz oskrzeli, obrzęk naczynioruchowy, niedociśnienie i wstrząs). Bardzo rzadko obrzęk naczynioruchowy (w tym obrzęk twarzy), świąd i pokrzywka. Zaburzenia psychiczne Bardzo rzadko dezorientacja, depresja, bezsenność, zmęczenie, koszmary senne, drażliwość, zaburzenia psychotyczne. Zaburzenia układu nerwowego Często bóle głowy, zawroty głowy. Rzadko senność, zmęczenie. Bardzo rzadko parestezja, zaburzenia pamięci, drgawki, niepokój, drżenie, aseptyczne zapalenie opon mózgowych, zaburzenia smaku, udar naczyniowy mózgu. Częstość nieznana splątanie, omamy, złe samopoczucie. Zaburzenia oka Bardzo rzadko zaburzenia widzenia, niewyraźne widzenie, podwójne widzenie. Zaburzenia ucha i błędnika Często zawroty głowy pochodzenia błędnikowego. Bardzo rzadko zaburzenia słuchu, szumy uszne. Zaburzenia serca Rzadko zatrzymanie płynów i obrzęk.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Bardzo rzadko kołatanie serca, ból w klatce piersiowej, niewydolność serca, zawał mięśnia sercowego, zespół Kounisa. Częstość nieznana: zatrzymanie płynów i obrzęk. Zaburzenia naczyniowe Bardzo rzadko nadciśnienie tętnicze, zapalenie naczyń. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Rzadko astma (w tym duszność). Bardzo rzadko zapalenie płuc. Zaburzenia żołądka i jelit Często nudności, wymioty, biegunka, niestrawność, bóle brzucha, wzdęcia z oddawaniem gazów, jadłowstręt. Rzadko zapalenie błony śluzowej żołądka, krwawienie z przewodu pokarmowego, krwawe wymioty, smoliste stolce, krwotoczna biegunka, choroba wrzodowa żołądka i (lub) dwunastnicy (z krwawieniem lub bez i perforacją). Bardzo rzadko zapalenie jelita grubego (w tym krwotoczne zapalenie okrężnicy i zaostrzenie wrzodziejącego zapalenia jelita grubego lub choroby Crohna), zaparcia, zapalenie błony śluzowej jamy ustnej (w tym wrzodziejące zapalenie błony śluzowej jamy ustnej), zapalenie języka, zaburzenia w obrębie przełyku, tworzenie się przeponopodobnych zwężeń w jelitach, zapalenie trzustki.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Zaburzenia wątroby i dróg żółciowych Często zwiększenie aktywności aminotransferaz. Rzadko żółtaczka, bezobjawowe zapalenie wątroby, ostre zapalenie wątroby, przewlekłe aktywne zapalenie wątroby, zastój żółci. Bardzo rzadko piorunujące zapalenie wątroby, martwica wątroby, niewydolność wątroby. Zaburzenia skóry i tkanki podskórnej Często wysypka. Rzadko pokrzywka. Bardzo rzadko wysypka pęcherzowa, wyprysk, rumień, rumień wielopostaciowy, zespół Stevensa-Johnsona, toksyczne martwicze oddzielanie się naskórka (zespół Lyella), złuszczające zapalenie skóry, wypadanie włosów, nadwrażliwość na światło, plamica, plamica alergiczna, świąd. Zaburzenia nerek i dróg moczowych Bardzo rzadko niewydolność nerek, ostra niewydolność nerek, krwiomocz, białkomocz, zespół nerczycowy, śródmiąższowe zapalenie nerek, martwica brodawek nerkowych. Zaburzenia ogólne i stany w miejscu podania Często podrażnienie, ból w miejscu podania, stwardnienie w miejscu podania.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Rzadko obrzęk, zanik tkanki w miejscu podania. Częstość nieznana Embolia cutis medicamentosa (zespół Nicolaua). Zakażenia i zarażenia pasożytnicze Bardzo rzadko ropień w miejscu wstrzyknięcia. Częstość nieznana martwica w miejscu wstrzyknięcia. W związku z leczeniem NLPZ zgłaszano występowanie obrzęków, nadciśnienia tętniczego i niewydolności serca. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg/dobę) i w leczeniu długotrwałym zwiększa ryzyko zakrzepicy tętnic (np. zawał serca lub udar) (patrz punkty 4.3 Przeciwwskazania i 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). W razie wystąpienia poważnych działań niepożądanych należy odstawić produkt leczniczy Naklofen. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: tel: + 48 22 49 21 301, fax: + 48 22 49 21 309, Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. 4.9 Przedawkowanie Objawy Nie ma specyficznych objawów klinicznych, wynikających z przedawkowania diklofenaku. Przedawkowanie może wywołać takie objawy jak wymioty, krwotok z przewodu pokarmowego, biegunkę, zawroty głowy, szumy uszne lub drgawki. W przypadku znacznego zatrucia może nastąpić ostra niewydolność nerek i uszkodzenie wątroby.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlInterakcje
Leczenie przedawkowania Leczenie ostrego zatrucia NLPZ, w tym diklofenakiem, zasadniczo obejmuje stosowanie leczenia podtrzymującego i objawowego. Leczenie podtrzymujące i objawowe należy zastosować w przypadku takich powikłań jak znaczne niedociśnienie, niewydolność nerek, drgawki, zaburzenia żołądka i jelit oraz zaburzenia oddychania. Wymuszona diureza, dializa lub przetaczanie krwi prawdopodobnie nie przyspieszają eliminowania NLPZ, w tym diklofenaku, ze względu na dużą zdolność wiązania z białkami i rozległy metabolizm.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na przewód pokarmowy Krwawienie, owrzodzenie lub perforacja przewodu pokarmowego, które mogą zakończyć się zgonem, zgłaszane w przypadku wszystkich NLPZ, w tym diklofenaku, mogą wystąpić w każdym okresie leczenia, z objawami poprzedzającymi lub bez, i niezależnie od ciężkich powikłań dotyczących przewodu pokarmowego w wywiadzie. Powikłania te są bardziej niebezpieczne u osób w podeszłym wieku. Należy przerwać stosowanie diklofenaku w przypadku, gdy u pacjenta pojawi się krwawienie lub owrzodzenie przewodu pokarmowego. Tak jak w przypadku innych NLPZ, w tym diklofenaku, u pacjentów z objawami wskazującymi na zaburzenia żołądka i jelit lub z wywiadem sugerującym chorobę wrzodową żołądka i (lub) dwunastnicy, krwawienia lub perforację, niezbędny jest ścisły nadzór lekarski. Produkt leczniczy Naklofen należy szczególnie ostrożnie zalecać tym pacjentom (patrz punkt 4.8).
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlWpływ na płodność, ciążę i laktację
Ryzyko krwawienia z przewodu pokarmowego jest większe w przypadku zwiększania dawek NLPZ i u pacjentów z chorobą wrzodową w wywiadzie, szczególnie gdy przebiegała z krwotokami lub perforacją. U osób w podeszłym wieku, zwiększona jest częstość występowania działań niepożądanych związanych ze stosowaniem NLPZ, zwłaszcza krwawienia i perforacji, które mogą być śmiertelne. Aby zmniejszyć ryzyko wystąpienia działania toksycznego na układ pokarmowy u pacjentów z chorobą wrzodową w wywiadzie, szczególnie gdy przebiegała z krwotokami lub perforacją, oraz u pacjentów w podeszłym wieku, należy rozpoczynać i kontynuować leczenie z zastosowaniem najmniejszych skutecznych dawek. U tych pacjentów, jak również u pacjentów, u których konieczne jest jednoczesne stosowanie leków zawierających małe dawki kwasu acetylosalicylowego (aspiryna) lub innych leków mogących zwiększyć ryzyko zaburzeń żołądkowo-jelitowych, należy rozważyć leczenie skojarzone z lekami osłonowymi (np.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlWpływ na płodność, ciążę i laktację
inhibitorami pompy protonowej lub mizoprostolem). Pacjenci ze stwierdzonymi zaburzeniami żołądka i jelit w wywiadzie, szczególnie pacjenci w podeszłym wieku, powinni informować lekarza o jakichkolwiek nietypowych objawach brzusznych (szczególnie o krwawieniach z przewodu pokarmowego). Należy zachować ostrożność u pacjentów otrzymujących jednocześnie leki, które mogą powodować zwiększenie ryzyka powstania owrzodzenia lub krwawienia, takie jak kortykosteroidy działające ogólnoustrojowo, leki przeciwzakrzepowe, leki przeciwpłytkowe, lub selektywne inhibitory wychwytu zwrotnego serotoniny (patrz punkt 4.5). Pacjenci z wrzodziejącym zapaleniem okrężnicy lub z chorobą Crohna powinni być pod ścisłą kontrolą lekarską, ze względu na możliwość pogorszenia stanu ogólnego (patrz punkt 4.8).
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na czynność wątroby Ścisły nadzór medyczny jest konieczny w przypadku stosowania diklofenaku u pacjentów z zaburzeniami czynności wątroby, ze względu na możliwość pogorszenia stanu ogólnego. Podobnie jak inne niesteroidowe leki przeciwzapalne (NLPZ), diklofenak może zwiększać aktywność jednego lub więcej enzymów wątrobowych. W trakcie długotrwałego leczenia diklofenakiem należy regularne kontrolować czynności wątroby. Należy przerwać stosowanie diklofenaku, jeśli utrzymują się nieprawidłowe wyniki badań czynnościowych wątroby lub ulegają pogorszeniu oraz gdy wystąpią kliniczne objawy przedmiotowe lub podmiotowe wskazujące na zaburzenia czynności wątroby oraz inne objawy (np.: eozynofilia, wysypka). Zapalenie wątroby, spowodowane stosowaniem diklofenaku, może nie być poprzedzone objawami prodromalnymi. Należy zachować ostrożność, stosując diklofenak u pacjentów z porfirią wątrobową, ponieważ może wywołać atak choroby.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane mogące pojawić się podczas leczenia diklofenakiem zostały sklasyfikowane według częstości występowania: bardzo często (≥1/10) często (≥1/100 do <1/10) niezbyt często (≥1/1000 do <1/100) rzadko (≥1/10 000 do <1/1000) bardzo rzadko (<1/10 000) częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) Przedstawione poniżej działania niepożądane obejmują działania niepożądane zgłaszane podczas krótkotrwałego lub długotrwałego leczenia. Zaburzenia krwi i układu chłonnego Bardzo rzadko trombocytopenia, leukopenia, niedokrwistość (w tym niedokrwistość hemolityczna i aplastyczna), agranulocytoza. Zaburzenia układu immunologicznego Rzadko nadwrażliwość, reakcje anafilaktyczne i rzekomoanafilaktyczne (w tym skurcz oskrzeli, obrzęk naczynioruchowy, niedociśnienie i wstrząs). Bardzo rzadko obrzęk naczynioruchowy (w tym obrzęk twarzy), świąd i pokrzywka.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlDziałania niepożądane
Zaburzenia psychiczne Bardzo rzadko dezorientacja, depresja, bezsenność, zmęczenie, koszmary senne, drażliwość, zaburzenia psychotyczne. Zaburzenia układu nerwowego Często bóle głowy, zawroty głowy. Rzadko senność, zmęczenie. Bardzo rzadko parestezja, zaburzenia pamięci, drgawki, niepokój, drżenie, aseptyczne zapalenie opon mózgowych, zaburzenia smaku, udar naczyniowy mózgu. Częstość nieznana splątanie, omamy, złe samopoczucie. Zaburzenia oka Bardzo rzadko zaburzenia widzenia, niewyraźne widzenie, podwójne widzenie. Zaburzenia ucha i błędnika Często zawroty głowy pochodzenia błędnikowego. Bardzo rzadko zaburzenia słuchu, szumy uszne. Zaburzenia serca Rzadko zatrzymanie płynów i obrzęk. Bardzo rzadko kołatanie serca, ból w klatce piersiowej, niewydolność serca, zawał mięśnia sercowego, zespół Kounisa. Częstość nieznana: zatrzymanie płynów i obrzęk. Zaburzenia naczyniowe Bardzo rzadko nadciśnienie tętnicze, zapalenie naczyń.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlDziałania niepożądane
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Rzadko astma (w tym duszność). Bardzo rzadko zapalenie płuc. Zaburzenia żołądka i jelit Często nudności, wymioty, biegunka, niestrawność, bóle brzucha, wzdęcia z oddawaniem gazów, jadłowstręt. Rzadko zapalenie błony śluzowej żołądka, krwawienie z przewodu pokarmowego, krwawe wymioty, smoliste stolce, krwotoczna biegunka, choroba wrzodowa żołądka i (lub) dwunastnicy (z krwawieniem lub bez i perforacją). Bardzo rzadko zapalenie jelita grubego (w tym krwotoczne zapalenie okrężnicy i zaostrzenie wrzodziejącego zapalenia jelita grubego lub choroby Crohna), zaparcia, zapalenie błony śluzowej jamy ustnej (w tym wrzodziejące zapalenie błony śluzowej jamy ustnej), zapalenie języka, zaburzenia w obrębie przełyku, tworzenie się przeponopodobnych zwężeń w jelitach, zapalenie trzustki. Zaburzenia wątroby i dróg żółciowych Często zwiększenie aktywności aminotransferaz.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlDziałania niepożądane
Rzadko żółtaczka, bezobjawowe zapalenie wątroby, ostre zapalenie wątroby, przewlekłe aktywne zapalenie wątroby, zastój żółci. Bardzo rzadko piorunujące zapalenie wątroby, martwica wątroby, niewydolność wątroby. Zaburzenia skóry i tkanki podskórnej Często wysypka. Rzadko pokrzywka. Bardzo rzadko wysypka pęcherzowa, wyprysk, rumień, rumień wielopostaciowy, zespół Stevensa-Johnsona, toksyczne martwicze oddzielanie się naskórka (zespół Lyella), złuszczające zapalenie skóry, wypadanie włosów, nadwrażliwość na światło, plamica, plamica alergiczna, świąd. Zaburzenia nerek i dróg moczowych Bardzo rzadko niewydolność nerek, ostra niewydolność nerek, krwiomocz, białkomocz, zespół nerczycowy, śródmiąższowe zapalenie nerek, martwica brodawek nerkowych. Zaburzenia ogólne i stany w miejscu podania Często podrażnienie, ból w miejscu podania, stwardnienie w miejscu podania. Rzadko obrzęk, zanik tkanki w miejscu podania. Częstość nieznana Embolia cutis medicamentosa (zespół Nicolaua).
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlDziałania niepożądane
Zakażenia i zarażenia pasożytnicze Bardzo rzadko ropień w miejscu wstrzyknięcia. Częstość nieznana martwica w miejscu wstrzyknięcia. W związku z leczeniem NLPZ zgłaszano występowanie obrzęków, nadciśnienia tętniczego i niewydolności serca. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg/dobę) i w leczeniu długotrwałym zwiększa ryzyko zakrzepicy tętnic (np. zawał serca lub udar) (patrz punkty 4.3 Przeciwwskazania i 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). W razie wystąpienia poważnych działań niepożądanych należy odstawić produkt leczniczy Naklofen. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: tel: + 48 22 49 21 301, fax: + 48 22 49 21 309, Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. 4.9 Przedawkowanie Objawy Nie ma specyficznych objawów klinicznych, wynikających z przedawkowania diklofenaku. Przedawkowanie może wywołać takie objawy jak wymioty, krwotok z przewodu pokarmowego, biegunkę, zawroty głowy, szumy uszne lub drgawki. W przypadku znacznego zatrucia może nastąpić ostra niewydolność nerek i uszkodzenie wątroby. Leczenie przedawkowania Leczenie ostrego zatrucia NLPZ, w tym diklofenakiem, zasadniczo obejmuje stosowanie leczenia podtrzymującego i objawowego.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlDziałania niepożądane
Leczenie podtrzymujące i objawowe należy zastosować w przypadku takich powikłań jak znaczne niedociśnienie, niewydolność nerek, drgawki, zaburzenia żołądka i jelit oraz zaburzenia oddychania. Wymuszona diureza, dializa lub przetaczanie krwi prawdopodobnie nie przyspieszają eliminowania NLPZ, w tym diklofenaku, ze względu na dużą zdolność wiązania z białkami i rozległy metabolizm.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy Nie ma specyficznych objawów klinicznych, wynikających z przedawkowania diklofenaku. Przedawkowanie może wywołać takie objawy jak wymioty, krwotok z przewodu pokarmowego, biegunkę, zawroty głowy, szumy uszne lub drgawki. W przypadku znacznego zatrucia może nastąpić ostra niewydolność nerek i uszkodzenie wątroby. Leczenie przedawkowania Leczenie ostrego zatrucia NLPZ, w tym diklofenakiem, zasadniczo obejmuje stosowanie leczenia podtrzymującego i objawowego. Leczenie podtrzymujące i objawowe należy zastosować w przypadku takich powikłań jak znaczne niedociśnienie, niewydolność nerek, drgawki, zaburzenia żołądka i jelit oraz zaburzenia oddychania. Wymuszona diureza, dializa lub przetaczanie krwi prawdopodobnie nie przyspieszają eliminowania NLPZ, w tym diklofenaku, ze względu na dużą zdolność wiązania z białkami i rozległy metabolizm.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu octowego; Kod ATC: M01AB05. Działanie farmakodynamiczne Diklofenak jest niesteroidowym lekiem przeciwzapalnym o właściwościach przeciwbólowych, przeciwzapalnych oraz przeciwgorączkowych. Diklofenak blokuje syntezę prostaglandyn poprzez hamowanie aktywności cyklooksygenazy. Podczas stosowania diklofenaku stwierdzono zmniejszone stężenie prostaglandyn w moczu, błonie śluzowej żołądka i płynie maziowym.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Dystrybucja Maksymalne stężenie leku w surowicy krwi występuje w ciągu pół godziny. Diklofenak wiąże się w 99% z białkami osocza, głównie z albuminami. Diklofenak przedostaje się łatwo do płynu maziowego, w którym osiąga 60 do 70% stężenia w surowicy krwi. Po upływie trzech do sześciu godzin od podania leku stężenie substancji czynnej oraz jej metabolitów w płynie maziowym osiąga wartości wyższe od tych w surowicy krwi. Diklofenak jest wydalany z płynu maziowego wolniej niż z surowicy krwi. Metabolizm Okres półtrwania diklofenaku wynosi od 1 do 2 godzin. U pacjentów z łagodnymi zaburzeniami czynności nerek lub wątroby pozostaje niezmieniony. Eliminacja Diklofenak jest niemal w całości metabolizowany w wątrobie, głównie na drodze hydroksylacji i metoksylacji. Około 70% diklofenaku wydalane jest z moczem w postaci farmakologicznie nieaktywnych metabolitów. Jedynie 1% leku ulega wydaleniu w formie niezmienionej.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlWłaściwości farmakokinetyczne
Pozostałe metabolity wydalane są z żółcią i kałem. Wchłanianie, dystrybucja, metabolizm i wydalanie leku nie różnią się znacząco u osób w podeszłym wieku.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Badania dotyczące ostrej toksyczności, prowadzone u różnych gatunków zwierząt, nie wykazały szczególnej wrażliwości. W zależności od sposobu podawania oraz płci zwierząt, stwierdzono następujące wartości LD50: od 116 do 470 mg diklofenaku/kg mc. u myszy, od 80 do 196 mg diklofenaku/kg mc. u szczurów, około 100 mg diklofenaku/kg mc. u królików oraz 50 mg diklofenaku/kg mc. u psów. Wartość LD50 u małp wynosiła 3200 mg diklofenaku/kg mc. Badania nad przewlekłą toksycznością przeprowadzano u szczurów i psów. Po zastosowaniu stężeń toksycznych, tj. dawek przekraczających 0,5 lub 2,0 mg/kg mc. (w zależności od gatunku zwierząt), obserwowano owrzodzenia przewodu pokarmowego oraz zmiany ilości erytrocytów i leukocytów. Długoterminowe badania dotyczące działania rakotwórczego u myszy i szczurów (do 2 mg diklofenaku/kg mc./dobę) nie wykazały znaczącego wzrostu częstości występowania nowotworów.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlPrzedkliniczne dane o bezpieczeństwie
Ponadto nie stwierdzono, aby produkt leczniczy posiadał właściwości mutagenne. Embriotoksyczność i teratogenność diklofenaku badano u szczurów, myszy i królików. Śmierć płodu i wolniejszy rozwój obserwowano jedynie w przypadku podawania matkom dawek toksycznych substancji czynnej. Nie stwierdzono zmian. Czas trwania ciąży i porodu uległ wydłużeniu.
- CHPL leku Naklofen, roztwór do wstrzykiwań, 25 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZ NE 6.1 Wykaz substancji pomocniczych Alkohol benzylowy Glikol propylenowy Sodu pirosiarczyn (E 223) Sodu wodorotlenek Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie zaleca się mieszania leku z innymi lekami w jednej strzykawce. 6.3 Okres ważności 5 lat 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem. 6.5 Rodzaj i zawartość opakowania Ampułka z bezbarwnego szkła z niebieskim pierścieniem. 5 ampułek zawierających 3 ml roztworu do wstrzykiwań, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowywania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Olfen hydrożel, 10mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera: 10 mg diklofenaku sodowego (Diclofenacum naricum) Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel Bezbarwny do jasnożółtego, przezroczysty żel o zapachu izopropanolu.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Olfen hydrożel jest wskazany do stosowania u osób dorosłych i młodzieży w wieku powyżej 14 lat. Produkt działa przeciwbólowo, przeciwzapalnie i przeciwobrzękowo. Stosowany jest w miejscowym leczeniu: Dorośli i młodzież w wieku powyżej 14 lat: pourazowych stanów zapalnych ścięgien, więzadeł, mięśni i stawów (np. powstałych wskutek skręceń, nadwyrężeń lub stłuczeń), bólu pleców, ograniczonych stanów zapalnych tkanek miękkich takich, jak: zapalenie ścięgien, łokieć tenisisty, zapalenie torebki stawowej, zapalenie okołostawowe. Dorośli (w wieku powyżej 18 lat) ograniczonych i łagodnych postaci choroby zwyrodnieniowej stawów.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Do stosowania na skórę. Jeśli po upływie 7 dni nie nastąpiła poprawa lub pacjent czuje się gorzej, należy skontaktować się z lekarzem. Dorośli i młodzież w wieku powyżej 14 lat: Dawkowanie Olfen hydrożel należy stosować miejscowo na skórę trzy lub cztery razy na dobę, delikatnie rozsmarowywać żel na skórze, nie wcierać. Ilość zużytego żelu należy dostosować do rozmiarów miejsca zmienionego chorobowo. Na przykład ilość od 2 g do 4 g produktu Olfen hydrożel (ilość odpowiadająca wielkości owocu wiśni do rozmiarów orzecha włoskiego) jest wystarczająca do posmarowania powierzchni około 400 cm2 do 800 cm2. Po zastosowaniu produktu należy: Wytrzeć dłonie w chusteczkę, a następnie umyć dłonie chyba, że to właśnie dłonie są miejscem leczonym. Zużytą chusteczkę należy wyrzucić do śmieci. Należy unikać kontaktu żelu z oczami i ustami.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gDawkowanie
Pacjent po zastosowaniu produktu Olfen hydrożel powinien poczekać do pełnego wyschnięcia produktu przed rozpoczęciem kąpieli. Czas trwania leczenia Okres leczenia zależy od wskazań i od reakcji na leczenie. U osób dorosłych i młodzieży w wieku powyżej 14 lat w przypadku stosowania produktu bez konsultacji z lekarzem, nie należy go stosować dłużej niż przez 14 dni w przypadku nadwyrężeń i reumatyzmu tkanki miękkiej. U osób dorosłych (w wieku powyżej 18 lat) w przypadku bólu związanego z chorobą zwyrodnieniową stawów bez konsultacji z lekarzem nie należy stosować produktu przez dłużej niż 21 dni. Zaleca się kontrolę lekarską po 7 dniach stosowania żelu w przypadku braku skuteczności leczenia lub z chwilą nasilenia się objawów chorobowych. Stosowanie u dzieci (w wieku poniżej 14 lat) Brak wystarczających danych dotyczących skuteczności i bezpieczeństwa stosowania produktu u dzieci i młodzieży w wieku poniżej 14 lat (patrz także punkt 4.3).
- CHPL leku Olfen hydrożel, Żel, 10 mg/gDawkowanie
Stosowanie u dzieci i młodzieży (w wieku powyżej 14 lat) U młodzieży w wieku powyżej 14 lat, w razie konieczności stosowania produktu leczniczego przez dłużej niż 7 dni w leczeniu bólu lub w przypadku pogorszenia się objawów, pacjent powinien skontaktować się z lekarzem. Stosowanie u osób w podeszłym wieku W przypadku stosowania produktu Olfen hydrożel u osób w podeszłym wieku należy stosować dawkowanie jak u osób dorosłych.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą produktu leczniczego wymienioną w punkcie 6.1. W ostatnim trymestrze ciąży (patrz punkt 4.6). Pacjenci, u których astma, obrzęk naczynioruchowy, pokrzywka lub ostre zapalenie błony śluzowej nosa są wywołane przez kwas acetylosalicylowy lub inne niesteroidowe leki przeciwzapalne. Dzieci i młodzieży w wieku poniżej 14 lat.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie można wykluczyć możliwości wystąpienia ogólnoustrojowych działań niepożądanych (tych związanych ze stosowaniem doustnych form diklofenaku) w przypadku stosowania produktu Olfen hydrożel w wyższej dawce i dłużej niż zalecany okres użytkowania (patrz punkt 4.2: ”Dawkowanie i sposób podawania”). Olfen hydrożel należy stosować tylko na nieuszkodzoną powierzchnię skóry. Należy unikać kontaktu żelu z oczami i błonami śluzowymi (np. jama ustna), nie należy go połykać. Należy zaprzestać stosowania produktu, jeśli po jego nałożeniu pojawi się wysypka. Olfen hydrożel może być stosowany jednocześnie z nieokluzyjnymi bandażami, ale nie należy stosować go z nieprzepuszczającymi powietrza opatrunkami okluzyjnymi.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Po zastosowaniu żelu na skórę, ilość diklofenaku, która ulega wchłonięciu do krążenia ogólnego jest niewielka, dlatego prawdopodobieństwo wystąpienia interakcji z innymi produktami leczniczymi jest niewielkie.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Stopień ekspozycji ogólnoustrojowej diklofenaku po zastosowaniu na skórę jest niższy w porównaniu z doustnymi formami. W oparciu o doświadczenia dotyczące stosowania NLPZ i ich działanie ogólnoustrojowe zaleca się uwzględnić poniższe informacje: Zahamowanie syntezy prostaglandyn może negatywnie wpływać na ciążę i (lub) rozwój zarodka lub płodu. Dane z badań epidemiologicznych sugerują zwiększone ryzyko poronienia, wad rozwojowych serca i wytrzewienia w przypadku stosowania inhibitorów syntezy prostaglandyn we wczesnej ciąży. Całkowite ryzyko wystąpienia wad rozwojowych serca zostaje zwiększone z 1% do 1,5%. Uważa się, że ryzyko to zwiększa się wraz ze zwiększeniem dawki i czasu trwania terapii. U zwierząt wykazano, że podawanie inhibitorów syntezy prostaglandyn skutkowało zwiększoną utratą płodów przed i po implantacji oraz śmiertelnością zarodków lub płodów.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gWpływ na płodność, ciążę i laktację
Dodatkowo zwiększenie ilości przypadków różnych wad wrodzonych, również układu sercowo-naczyniowego obserwowano u zwierząt, którym podawano inhibitory syntezy prostaglandyn podczas okresu organogenezy. Jeśli nie jest to wyraźnie konieczne, nie należy stosować diklofenaku podczas pierwszego i drugiego trymestru ciąży. W przypadku stosowania diklofenaku u kobiet planujących ciążę oraz w czasie pierwszego i drugiego trymestru ciąży, należy stosować dawkę możliwie najmniejszą, a czas trwania leczenia jak najkrótszy. Podczas trzeciego trymestru ciąży stosowanie wszystkich inhibitorów syntezy prostaglandyn może powodować ekspozycję płodu na: d działanie toksyczne na układ krążenia i oddechowy (w tym przedwczesne zamknięcie przewodu tętniczego i nadciśnienie płucne), zaburzenia czynności nerek, które mogą postępować, skutkując niewydolnością nerek z małowodziem.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gWpływ na płodność, ciążę i laktację
Narażenie matki i noworodka pod koniec ciąży na: możliwe wydłużenie czasu trwania krwawienia oraz działanie antyagregacyjne, które mogą wystąpić nawet podczas stosowania bardzo małych dawek, zahamowanie skurczów macicy skutkujące opóźnionym lub przedłużonym porodem. Dlatego też stosowanie diklofenaku jest przeciwwskazane podczas trzeciego trymestru ciąży. Karmienie piersi? Podobnie jak inne NLPZ, diklofenak przenika do mleka kobiet karmiących piersią w niewielkich ilościach. Mimo to stosowanie produktu Olfen hydrożel w dawkach terapeutycznych nie wywiera wpływu na karmione dziecko. Ze względu na brak kontrolowanych badań dotyczących kobiet karmiących piersią, produkt należy stosować w czasie karmienia piersią jedynie na zlecenie lekarza. W takich przypadkach produktu Olfen hydrożel nie należy stosować na okolice piersi kobiet karmiących piersią ani też na duże powierzchnie skóry lub długotrwale (patrz punkt 4.4).
- CHPL leku Olfen hydrożel, Żel, 10 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt Olfen hydrożel stosowany miejscowo nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane zostały zestawione w Tabeli 1 według klasyfikacji układów i narządów oraz częstotliwości. Następująca konwencja została wykorzystana do klasyfikacji działań niepożądanych: Często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do < 1/100); rzadko (≥1/10 000 do < 1/1 000); bardzo rzadko (<1/10 000); częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Działania niepożądane zebrane po wprowadzeniu produktu do obrotu zgłaszane są dobrowolnie i pochodzą z populacji o nieokreślonej wielkości. Nie zawsze jest możliwe oszacowanie ich częstości, najprawdopodobniej występują z częstotliwością: rzadko lub bardzo rzadko. W obrębie każdej grupy o określonej częstości występowania objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasilaniem.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gDziałania niepożądane
Tabelaryczne zestawienie działań niepożądanych Tabela 1: Klasyfikacja układów i narządów MedDRA Często (≥ 1/100, < 1/10) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (< 1/10 000) Częstość nieznana Zakażenia i zarażenia pasożytnicze Wysypka grudkowata Zaburzenia układu immunologicznego Nadwrażliwość (w tym pokrzywka) Obrzęk naczynioruchowy Zaburzenia oddechowe, klatki piersiowej i śródpiersia Astma Zaburzenia skóry i tkanki podskórnej Wysypka Pęcherzykowe zapalenie skóry Reakcje nadwrażliwości na światło Uczucie pieczenia w miejscu aplikacji Wyprysk Suchość skóry Rumień Zapalenie skóry (w tym kontaktowe zapalenie skóry) Świąd Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181 C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gPrzedawkowanie
4.9 Przedawkowanie Objawy Przedawkowanie produktu jest mało prawdopodobne ze względu na niewielkie wchłanianie diklofenaku stosowanego miejscowo. Po przypadkowym połknięciu diklofenaku w postaci żelu mogą wystąpić działania niepożądane, podobne do obserwowanych po przedawkowaniu diklofenaku w postaci tabletek (100 g produktu zawiera 1000 mg soli sodowej diklofenaku). W razie przypadkowego połknięcia produktu, skutkującego działaniami niepożądanymi, należy zastosować leki i wdrożyć leczenie objawowe zwykle stosowane w przypadku leczenia zatruć niesteroidowymi lekami przeciwzapalnymi. Dalsze leczenie powinno odbywać w warunkach szpitalnych lub zgodnie z zaleceniami krajowego ośrodka leczenia zatruć.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Niesteroidowe leki przeciwzapalne do stosowania miejscowego, ATC: M02AA15 Diklofenak jest niesteroidowym lekiem przeciwzapalnym (NLPZ) o silnym działaniu przeciwbólowym, przeciwzapalnym i przeciwgorączkowym. Diklofenak jest nieselektywnym inhibitorem izoenzymów COX-2 i COX-1, który wywiera efekt terapeutyczny poprzez inhibicje cyklooksygenazy 2 (COX-2), co hamuje syntezę prostaglandyn. W zapaleniach pochodzenia urazowego lub reumatycznego produkt Olfen hydrożel łagodzi ból, zmniejsza obrzęk i skraca czas powrotu do stanu normalnego funkcjonowania. Ze względu na wodno-alkoholowe podłoże Olfen hydrożel wykazuje również działanie kojące i chłodzące.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Ilość wchłanianego przez skórę diklofenaku po zastosowaniu produktu w postaci żelu zależy od czasu kontaktu ze skórą, od rozmiarów leczonego miejsca, jak również od całkowitej użytej miejscowo dawki oraz od stopnia nawilżenia skóry. Po zastosowaniu miejscowym 2,5 g produktu Olfen hydrożel z diklofenakiem na powierzchnię 500 cm², ilość wchłoniętej substancji odpowiada około 6 % dawki podanej w postaci tabletki. Określana jest ona w stosunku do ilości diklofenaku w ogólnej eliminacji nerkowej. Okluzja prowadzona przez 10 godzin prowadzi do trzykrotnego zwiększenia ilości wchłoniętego diklofenaku. Dystrybucja Po zastosowaniu miejscowym Olfen hydrożel na stawy kolanowe i rąk można oznaczyć stężenie diklofenaku w osoczu krwi, w maziówce i w płynie maziówkowym. Jego maksymalne stężenie w osoczu krwi jest około 100 razy mniejsze niż stężenie osiągane po doustnym podaniu tabletek z diklofenakiem.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gWłaściwości farmakokinetyczne
99,7% diklofenaku wiąże się z białkami osocza, między innymi z albuminami (99,4%). Diklofenak gromadzi się w skórze, która działa jako rezerwuar, z którego uwalniany jest on w sposób ciągły do głębiej znajdujących się tkanek. Diklofenak jest preferencyjnie dystrybuowany i pozostaje w głębi tkanek objętych stanem zapalnym, gdzie osiąga stężenie do 20 razy wyższe niż w osoczu krwi. Metabolizm Biotransformacja diklofenaku obejmuje pojedynczą lub wielokrotną hydroksylacje, a następnie glukuronidację i częściową glukuronidację niezmienionej cząsteczki. Eliminacja Całkowity klirens nerkowy diklofenaku wynosi 263 ± 56 ml/minutę. Okres półtrwania w fazie eliminacji w osoczu wynosi od 1 do 2 godzin. Cztery metabolity, włączając dwa metabolity biologicznie czynne, mają także krótki osoczowy okres półtrwania wynoszący od 1 do 3 godzin. Piąty z metabolitów, 3`- hydroksy- 4`-metoksy-diklofenak, ma dłuższy okres półtrwania. Jest to jednak metabolit nieaktywny biologicznie.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gWłaściwości farmakokinetyczne
Diklofenak i jego metabolity ulegają wydalaniu głównie z moczem. Nie zaobserwowano występowania kumulacji diklofenaku i jego metabolitów u pacjentów z zaburzeniami czynności nerek. U pacjentów z przewlekłym zapaleniem wątroby lub wyrównaną marskością wątroby, kinetyka i metabolizm diklofenaku są takie same jak u pacjentów bez chorób wątroby.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane przedkliniczne z badań toksyczności ostrej i po podaniu dawki wielokrotnej, a także z badań genotoksyczności i potencjału i rakotwórczego wykazały, że w zakresie dawek leczniczych diklofenak nie wykazuje specyficznego zagrożenia dla ludzi. Diklofenak w postaci żelu był dobrze tolerowany w różnych badaniach. Nie wykazywał działania fotouczulającego i nie powodował uczuleń skórnych. Diklofenak nie wykazał żadnych oznak upośledzenia płodności samców i samic szczura. Nie wykazano teratogennego działania diklofenaku u myszy, szczurów i królików. Rozwój przed-, około- i poporodowy potomstwa nie był zaburzony.
- CHPL leku Olfen hydrożel, Żel, 10 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Adypinian izopropylu Kwas mlekowy Alkohol izopropylowy Sodu pirosiarczyn Hydroksypropyloceluloza Hydroksyetyloceluloza Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania 50 g tuba 100 g tuba Tuba aluminiowa wewnątrz lakierowana z zakrętką z HDPE w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak szczególnych wymagań dotyczących usuwania.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Voltaren, 25 mg/ml, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna 3 ml ampułka produktu leczniczego Voltaren zawiera 75 mg diklofenaku sodowego (Diclofenacum natricum). Pełny wykaz substancze pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań lub do sporządzania roztworów do infuzji.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Podanie domięśniowe Leczenie: Zaostrzeń zapalnych lub zwyrodnieniowych postaci choroby reumatycznej: reumatoidalnego zapalenia stawów, zesztywniającego zapalenia stawów kręgosłupa, choroby zwyrodnieniowej stawów, zapalenia stawów kręgosłupa, zespołów bólowych związanych ze zmianami w kręgosłupie, reumatyzmu pozastawowego. Ostrych napadów dny. Kolki nerkowej i wątrobowej. Bólów spowodowanych pourazowymi i pooperacyjnymi stanami zapalnymi i obrzękami. Ciężkich napadów migreny. Podanie dożylne: W leczeniu lub profilaktyce bólów pooperacyjnych u pacjentów pozostających w leczeniu szpitalnym.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Ogólnie zaleca się indywidualne ustalanie dawkowania produktu leczniczego. Występowanie działań niepożądanych można ograniczyć, stosując produkt w najmniejszej skutecznej dawce i nie dłużej niż to koniecznie do kontrolowania objawów (patrz punkt 4.4). Ogólna grupa docelowa Produkt leczniczy Voltaren w ampułkach, nie powinien być podawany dłużej niż 2 dni. W razie potrzeby leczenie może być kontynuowane tabletkami lub czopkami. Szczególne grupy pacjentów Dzieci i młodzież: Nie zaleca się stosowania produktu leczniczego Voltaren ampułki u dzieci i młodzieży ze względu na dawkę. Osoby w podeszłym wieku (powyżej 65 lat): Nie jest wymagana zmiana dawkowania początkowego u osób w podeszłym wieku (patrz punkt 4.4). Rozpoznana choroba układu krążenia lub istotne sercowo-naczyniowe czynniki ryzyka: Leczenie produktem leczniczym Voltaren nie jest na ogół zalecane u pacjentów z rozpoznaną chorobą układu krążenia lub niewyrównanym nadciśnieniem tętniczym.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlDawkowanie
W razie potrzeby pacjenci z rozpoznaną chorobą układu sercowo-naczyniowego, niewyrównanym nadciśnieniem tętniczym lub istotnymi czynnikami ryzyka choroby sercowo-naczyniowej powinni być leczeni produktem leczniczym Voltaren wyłącznie po dokonaniu wnikliwej oceny i tylko dawkami ≤100 mg na dobę, jeśli leczenie trwa dłużej niż 4 tygodnie (patrz punkt 4.4). Zaburzenia czynności nerek: Produkt leczniczy Voltaren jest przeciwwskazany u pacjentów z niewydolnością nerek (patrz punkt 4.3). Nie przeprowadzono specjalnych badań u pacjentów z zaburzeniami czynności nerek, dlatego nie można sformułować odpowiednich zaleceń dotyczących dostosowania dawki. Zaleca się zachowanie ostrożności podczas podawania produktu leczniczego Voltaren pacjentom z zaburzeniami czynności nerek w stopniu łagodnym do umiarkowanego (patrz punkt 4.4). Zaburzenia czynności wątroby: Produkt leczniczy Voltaren jest przeciwwskazany u pacjentów z niewydolnością wątroby (patrz punkt 4.3).
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlDawkowanie
Nie przeprowadzono specjalnych badań u pacjentów z zaburzeniami czynności wątroby, dlatego nie można sformułować odpowiednich zaleceń dotyczących dostosowania dawki. Zaleca się zachowanie ostrożności podczas podawania produktu leczniczego Voltaren pacjentom z zaburzeniami czynności wątroby w stopniu łagodnym do umiarkowanego (patrz punkt 4.4). Sposób podawania Wstrzyknięcie domięśniowe W celu uniknięcia uszkodzenia nerwu lub innych tkanek w miejscu wstrzyknięcia, należy przestrzegać zaleceń dotyczących wstrzykiwania. Produkt leczniczy stosuje się zazwyczaj w dawce 75 mg - jedna ampułka na dobę, w głębokim wstrzyknięciu w górny zewnętrzny kwadrant pośladka. Wyjątkowo, w ciężkich przypadkach (np.: napad bólu kolkowego), dawka dobowa może zostać zwiększona do dwóch wstrzyknięć po 75 mg, w odstępie kilku godzin (po jednym wstrzyknięciu w każdy pośladek).
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlDawkowanie
Można również podać jedną ampułkę 75 mg w skojarzeniu z inną formą produktu leczniczego Voltaren (tabletki, czopki), nie stosując większej dawki niż 150 mg na dobę. Doświadczenie kliniczne dotyczące stosowania produktu leczniczego w napadach migreny ogranicza się do podawania 1 ampułki zawierającej 75 mg soli sodowej diklofenaku, najszybciej jak to możliwe, jako dawki wstępnej, a następnie jeżeli to konieczne, tego samego dnia, podawania czopków w dawce do 100 mg. Całkowita dawka podana pierwszego dnia nie powinna przekraczać 175 mg. Infuzja dożylna Produktu leczniczego Voltaren, nie wolno podawać w dożylnym jednokrotnym, krótkotrwałym wstrzyknięciu. Każda ampułka produktu leczniczego Voltaren przeznaczona jest do jednorazowego użytku. Bezpośrednio przed rozpoczęciem infuzji produkt leczniczy Voltaren, należy rozcieńczyć w 0,9% roztworze soli fizjologicznej lub 5% roztworze glukozy do infuzji, zbuforowanymi dwuwęglanem sodu (patrz punkt 6.6).
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlDawkowanie
Zaleca się dwa alternatywne sposoby podawania produktu leczniczego Voltaren w ampułkach: W leczeniu umiarkowanego do ciężkiego bólu pooperacyjnego podaje się 75 mg produktu leczniczego w infuzji ciągłej przez 30 minut do 2 godzin. W razie konieczności, podanie może być powtórzone po kilku godzinach, ale nie należy przekraczać dawki 150 mg w ciągu 24 godzin. W profilaktyce bólów pooperacyjnych, dawkę wstępną 25 mg do 50 mg należy podać po zakończeniu zabiegu chirurgicznego w infuzji przez 15 minut do 1 godziny, a następnie podawać w infuzji ciągłej około 5 mg na godzinę, do maksymalnej dawki dobowej 150 mg.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na diklofenak, pirosiarczyn sodu lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Czynna choroba wrzodowa żołądka i (lub) dwunastnicy, krwawienie lub perforacja (patrz punkt 4.4). Podawane w wywiadzie krwawienie z przewodu pokarmowego lub perforacja, związane z wcześniejszym leczeniem niesteroidowymi lekami przeciwzapalnymi (NLPZ). Czynna lub podawana w wywiadzie nawracająca choroba wrzodowa i (lub) krwotok (wystąpienie dwóch lub więcej odrębnych przypadków potwierdzonego owrzodzenia lub krwawienia). Ostatni trymestr ciąży (patrz punkt 4.6). Niewydolność wątroby. Niewydolność nerek. Stwierdzona zastoinowa niewydolność serca (klasa II–IV wg NYHA), choroba niedokrwienna serca, choroba naczyń obwodowych i (lub) choroba naczyń mózgowych.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlPrzeciwwskazania
Podobnie jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), nie należy stosować produktu leczniczego Voltaren u osób, u których podanie kwasu acetylosalicylowego lub innych NLPZ może być przyczyną wystąpienia astmy, obrzęku naczynioruchowego, pokrzywki lub ostrego nieżytu nosa (tj. nadwrażliwości krzyżowej na NLPZ) (patrz punkt 4.4 i 4.8).
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Informacje ogólne Przyjmowanie produktu leczniczego w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz wpływ na przewód pokarmowy i układ krążenia poniżej). Należy ściśle przestrzegać instrukcji wykonywania wstrzyknięcia domięśniowego w celu uniknięcia wystąpienia działań niepożądanych w miejscu wstrzyknięcia, które mogą powodować osłabienie mięśni, porażenie mięśni, niedoczulicę, embolia cutis medicamentosa (zespół Nicolaua) i martwicę w miejscu wstrzyknięcia. Nie wolno podawać roztworu do wstrzykiwań Voltaren wcześniakom ani noworodkom. Alkohol benzylowy może powodować wystąpienie reakcji toksycznych i reakcji rzekomoanafilaktycznych u niemowląt oraz u dzieci w wieku do 3 lat.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
Tak, jak w przypadku innych NLPZ, rzadko mogą również występować reakcje alergiczne, w tym reakcje anafilaktyczne (rzekomoanafilaktyczne), po podaniu diklofenaku u osób, które wcześniej nie przyjmowały tego produktu leczniczego. Reakcje nadwrażliwości mogą także rozwinąć się w zespół Kounisa, ciężką reakcję alergiczną, która może prowadzić do zawału mięśnia sercowego. Objawy takich reakcji mogą obejmować ból w klatce piersiowej występujący w związku z reakcją alergiczną na diklofenak. Wpływ na przewód pokarmowy Krwawienie, owrzodzenie lub perforacja przewodu pokarmowego, które mogą zakończyć się zgonem, raportowane w przypadku wszystkich NLPZ, w tym diklofenaku, mogą wystąpić w każdym okresie leczenia, z objawami poprzedzającymi lub bez, i niezależnie od ciężkich powikłań dotyczących przewodu pokarmowego w wywiadzie. Powikłania te są bardziej niebezpieczne u osób w podeszłym wieku.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
Należy przerwać stosowanie produktu leczniczego Voltaren w przypadku, gdy u pacjenta pojawi się krwawienie lub owrzodzenie przewodu pokarmowego. Tak jak w przypadku innych NLPZ, w tym diklofenaku, u pacjentów z objawami wskazującymi na zaburzenia żołądka i jelit lub z wywiadem sugerującym chorobę wrzodową żołądka i (lub) dwunastnicy, krwawienia lub perforację, niezbędny jest ścisły nadzór lekarski. Produkt leczniczy Voltaren należy szczególnie ostrożnie zalecać tym pacjentom (patrz punkt 4.8). Ryzyko krwawienia z przewodu pokarmowego jest większe w przypadku zwiększania dawek NLPZ i u pacjentów z chorobą wrzodową w wywiadzie, szczególnie gdy przebiegała z krwotokami lub perforacją oraz u pacjentów w podeszłym wieku. U osób w podeszłym wieku, zwiększona jest częstość występowania działań niepożądanych związanych ze stosowaniem NLPZ, zwłaszcza krwawienia i perforacji, które mogą być śmiertelne.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
Aby zmniejszyć ryzyko wystąpienia działania toksycznego na układ pokarmowy u pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie, szczególnie gdy przebiegała z krwotokami lub perforacją, oraz u pacjentów w podeszłym wieku należy rozpoczynać i kontynuować leczenie z zastosowaniem najmniejszych skutecznych dawek. U tych pacjentów, jak również u pacjentów, u których konieczne jest jednoczesne stosowanie produktów leczniczych zawierających małe dawki kwasu acetylosalicylowego (aspiryna) lub innych produktów leczniczych mogących zwiększyć ryzyko wystąpienia zaburzeń żołądkowo-jelitowych, należy rozważyć leczenie skojarzone z produktami leczniczymi osłonowymi (np. inhibitorami pompy protonowej lub mizoprostolem). Pacjenci ze stwierdzonymi zaburzeniami żołądka i jelit w wywiadzie, szczególnie pacjenci w podeszłym wieku, powinni informować lekarza o jakichkolwiek nietypowych objawach brzusznych (szczególnie o krwawieniach z przewodu pokarmowego).
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
Należy zachować ostrożność u pacjentów otrzymujących jednocześnie produkty lecznicze, które mogą powodować zwiększenie ryzyka powstania owrzodzenia lub krwawienia, takie jak kortykosteroidy działające ogólnoustrojowo, leki przeciwzakrzepowe, leki przeciwpłytkowe, lub selektywne inhibitory wychwytu zwrotnego serotoniny (patrz punkt 4.5). Pacjenci z wrzodziejącym zapaleniem okrężnicy lub z chorobą Crohna powinni być pod ścisłą kontrolą lekarską, ze względu na możliwość zaostrzenia ogólnego stanu (patrz punkt 4.8). Stosowanie NLPZ, w tym diklofenaku, może wiązać się ze zwiększeniem ryzyka nieszczelności zespolenia żołądkowo-jelitowego. Zaleca się ścisły nadzór medyczny i zachowanie ostrożności podczas stosowania diklofenaku po operacjach przewodu pokarmowego. Wpływ na czynność wątroby Ścisły nadzór medyczny jest konieczny w przypadku zalecenia produktu leczniczego Voltaren pacjentom z zaburzeniami czynności wątroby, ze względu na możliwość pogorszenia ogólnego stanu.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
Tak jak niesteroidowe leki przeciwzapalne (NLPZ), diklofenak może zwiększać aktywność jednego lub więcej enzymów wątrobowych. W trakcie długotrwałego leczenia produktem leczniczym Voltaren należy regularnie kontrolować czynności wątroby. Należy przerwać stosowanie produktu leczniczego Voltaren, jeśli utrzymują się nieprawidłowe wyniki badań czynnościowych wątroby lub ulegają pogorszeniu oraz gdy wystąpią kliniczne oznaki lub objawy wskazujące na zaburzenia czynności wątroby oraz inne objawy (np.: eozynofilia, wysypka itp.). Zapalenie wątroby, spowodowane stosowaniem diklofenaku, może wystąpić nie poprzedzone objawami prodromalnymi. Należy zachować ostrożność, stosując produkt leczniczy Voltaren u pacjentów z porfirią wątrobową, ponieważ może wywołać zaostrzenie choroby. Wpływ na czynność nerek W związku z leczeniem NLPZ, w tym diklofenakiem, odnotowano przypadki zatrzymywania płynów i powstawania obrzęków, dlatego szczególną ostrożność należy zachować w przypadku pacjentów z zaburzoną czynnością serca lub nerek, z nadciśnieniem tętniczym w wywiadzie, u osób w podeszłym wieku, u pacjentów jednocześnie otrzymujących leki moczopędne lub leki znacząco wpływające na czynność nerek oraz pacjentów z nadmierną utratą płynu pozakomórkowego o różnej etiologii, np.: w fazie około- lub pooperacyjnej po dużych zabiegach chirurgicznych (patrz punkt 4.3).
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
W takich przypadkach, podczas stosowania produktu leczniczego Voltaren, zaleca się monitorowanie czynności nerek. Przerwanie leczenia produktem leczniczym Voltaren zwykle powoduje powrót do stanu poprzedzającego leczenie. Wpływ na skórę Ciężkie reakcje skórne, niektóre z nich ze skutkiem śmiertelnym, włączając złuszczające zapalenie skóry, zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka były bardzo rzadko raportowane w związku ze stosowaniem leków z grupy NLPZ (patrz punkt 4.8). Największe ryzyko wystąpienia tych ciężkich reakcji występuje na początku terapii, w większości przypadków w pierwszym miesiącu stosowania produktu. Stosowanie produktu leczniczego należy natychmiast przerwać po wystąpieniu pierwszych objawów takich jak wysypka skórna, uszkodzenie błony śluzowej lub innych objawów nadwrażliwości.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
W miejscu podania domięśniowego mogą pojawić się odczyny miejscowe, w tym martwica w miejscu wstrzyknięcia i embolia cutis medicamentosa (zespół Nicolaua - szczególnie po niezamierzonym podaniu podskórnym). Tak jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), także po podaniu diklofenaku, rzadko mogą wystąpić reakcje alergiczne, w tym reakcje anafilaktyczne i rzekomoanafilaktyczne, nawet wtedy, gdy ten produkt leczniczy nie był wcześniej stosowany. Reakcje w miejscu wstrzyknięcia Zgłaszano występowanie reakcji w miejscu wstrzyknięcia po podaniu domięśniowym diklofenaku, obejmującej martwicę w miejscu wstrzyknięcia oraz embolia cutis medicamentosa, znaną także jako zespół Nicolaua (zwłaszcza po nieumyślnym podaniu podskórnym). Podczas domięśniowego podawania diklofenaku należy stosować właściwy dobór igły i techniki wstrzykiwania (patrz punkt).
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
4.2 i (lub) 6.6, w stosownych przypadkach) Wpływ na układ krążenia i naczynia zaopatrujące mózg Pacjentów z nadciśnieniem tętniczym w wywiadzie lub łagodną do umiarkowanej zastoinową niewydolnością serca, z zatrzymaniem płynów i z obrzękami należy odpowiednio kontrolować i wydawać właściwe zalecenia. Zatrzymanie płynów i obrzęki były zgłaszane w związku z leczeniem NLPZ. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg na dobę) przez długi okres czasu może być związane z niewielkim zwiększeniem ryzyka zakrzepicy tętnic (np. zawał serca lub udar). Leczenie produktem leczniczym Voltaren nie jest na ogół zalecane u pacjentów z rozpoznaną chorobą układu krążenia lub niewyrównanym nadciśnieniem tętniczym. W razie potrzeby pacjenci z rozpoznaną chorobą układu sercowo-naczyniowego, niewyrównanym nadciśnieniem lub istotnymi czynnikami ryzyka choroby sercowo-naczyniowej powinni być leczeni produktem leczniczym Voltaren wyłącznie po dokonaniu wnikliwej oceny i tylko dawkami ≤100 mg na dobę, jeśli leczenie trwa dłużej niż 4 tygodnie (patrz punkt 4.4).
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
Ryzyko dla układu sercowo-naczyniowego związane ze stosowaniem diklofenaku może wzrastać wraz ze zwiększaniem dawki i czasu trwania ekspozycji i dlatego należy stosować najmniejszą skuteczną dawkę produktu leczniczego przez możliwie najkrótszy czas. Należy okresowo oceniać zapotrzebowanie pacjenta na leczenie objawowe oraz jego odpowiedź na produkt leczniczy. Diklofenak należy stosować bardzo ostrożnie u pacjentów z istotnymi czynnikami ryzyka zdarzeń dotyczących układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Produkt ten należy stosować możliwie jak najkrócej i w najmniejszej skutecznej dawce dobowej, ze względu na możliwość nasilenia ryzyka dotyczącego układu krążenia po zastosowaniu diklofenaku w dużych dawkach i długotrwale. Należy okresowo kontrolować konieczność kontynuacji leczenia objawowego i odpowiedź na leczenie. Pacjenci powinni być czujni wobec przedmiotowych i podmiotowych objawów ciężkich zdarzeń zakrzepowych w tętnicach (np.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
bólu w klatce piersiowej, duszności, osłabienia, niewyraźnej mowy), które mogą wystąpić nagle. Należy pouczyć pacjentów o konieczności natychmiastowego zgłoszenia się do lekarza w takim przypadku. Wpływ na wskaźniki hematologiczne W trakcie długotrwałego leczenia produktem leczniczym Voltaren, podobnie jak w przypadku stosowania innych niesteroidowych leków przeciwzapalnych (NLPZ), zaleca się kontrolowanie wskaźników hematologicznych. Tak jak inne niesteroidowe leki przeciwzapalne (NLPZ), produkt leczniczy Voltaren może przemijająco hamować agregację płytek krwi. Należy dokładnie kontrolować pacjentów z zaburzeniami hemostazy. Astma w wywiadzie U pacjentów z astmą, sezonowym alergicznym nieżytem nosa, obrzękiem błony śluzowej nosa, (np. polipy nosa), przewlekłą obturacyjną chorobą płuc lub przewlekłymi zakażeniami układu oddechowego (szczególnie gdy mają objawy podobne do objawów alergicznego nieżytu nosa) częściej niż u innych pacjentów występują zaostrzenia astmy w wyniku zastosowania NLPZ (nietolerancja leków przeciwbólowych), obrzęk Quinckego lub pokrzywka.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
W związku z tym u tych pacjentów zaleca się szczególną ostrożność (należy umożliwić szybki dostęp do pomocy lekarskiej). Szczególne środki ostrożności należy zachować u pacjentów z alergią na inne substancje, np. z odczynami skórnymi, świądem lub pokrzywką oraz u pacjentów z astmą oskrzelową, przyjmujących Voltaren, w postaci roztworu do wstrzykiwań lub do sporządzania roztworu do infuzji, ze względu na możliwość zaostrzenia się objawów choroby. Osoby w podeszłym wieku Produkt leczniczy należy stosować ostrożnie u osób w podeszłym wieku. W przypadku osób w podeszłym wieku i u osób z małą masą ciała zaleca się stosowanie najmniejszej skutecznej dawki. Interakcje z niesteroidowymi lekami przeciwzapalnymi (NLPZ) Należy unikać jednoczesnego stosowania produktu leczniczego Voltaren z ogólnie działającymi NLPZ, w tym selektywnymi inhibitorami cyklooksygenazy-2, ze względu na potencjalne nasilenie działań niepożądanych (patrz punkt 4.5).
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
Maskowanie objawów zakażenia Podobnie jak inne niesteroidowe leki przeciwzapalne (NLPZ), produkt leczniczy Voltaren może maskować objawy przedmiotowe i podmiotowe zakażenia, co wynika z właściwości farmakodynamicznych produktu leczniczego. Specjalne ostrzeżenia dotyczące substancji pomocniczych Pirosiarczyn sodu, wchodzący w skład roztworu do wstrzykiwań, może spowodować wystąpienie ciężkich reakcji nadwrażliwości oraz skurczu oskrzeli. Duże objętości produktu leczniczego zawierającego alkohol benzylowy należy podawać z ostrożnością i tylko w razie konieczności, zwłaszcza u pacjentów z zaburzeniami czynności nerek lub wątroby z powodu ryzyka kumulacji toksyczności (kwasica metaboliczna). Chociaż nie wykazano toksycznego wpływu glikolu propylenowego na rozród i rozwój potomstwa, może on przenikać do płodu i do mleka matki. Dlatego też podanie glikolu propylenowego pacjentce w ciąży należy rozważyć w każdym przypadku indywidualnie.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlSpecjalne środki ostrozności
Pacjenci z zaburzeniami czynności nerek lub wątroby powinni pozostawać pod kontrolą lekarza z powodu różnych działań niepożądanych przypisywanych glikolowi propylenowemu, takich jak zaburzenia czynności nerek (ostra martwica kanalików nerkowych), ostra niewydolność nerek i zaburzenia czynności wątroby. Należy ściśle przestrzegać zaleceń dotyczących wykonywania wstrzyknięć domięśniowych, aby uniknąć zdarzeń niepożądanych w miejscu wstrzyknięcia, mogących doprowadzić do osłabienia mięśni, porażenia mięśni, niedoczulicy i martwicy w miejscu wstrzyknięcia. Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na 3 mililitry, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Opisane interakcje uwzględniają także te zaobserwowane po zastosowaniu innych postaci farmaceutycznych zawierających diklofenak. Zaobserwowane interakcje Silne inhibitory CYP2C9: Należy zachować ostrożność podczas przepisywania diklofenaku wraz z silnymi inhibitorami CYP2C9 (takimi jak worykonazol), ponieważ w wyniku zahamowania metabolizmu diklofenaku, jego stężenie w osoczu oraz ekspozycja na lek może znacznie wzrosnąć. Lit: Voltaren podawany jednocześnie z produktami leczniczymi zawierającymi lit może zwiększać jego stężenie w osoczu. Zaleca się monitorowanie stężenia litu. Digoksyna: Voltaren podawany jednocześnie z produktami leczniczymi zawierającymi digoksynę może zwiększać jej stężenie w osoczu. Zaleca się monitorowanie stężenia digoksyny.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlInterakcje
Leki moczopędne i leki zmniejszające ciśnienie krwi: Podobnie jak w przypadku innych NLPZ, jednoczesne stosowanie diklofenaku z lekami moczopędnymi lub lekami zmniejszającymi ciśnienie tętnicze krwi (np. leki blokujące receptory beta-adrenergiczne, inhibitory ACE) może spowodować zmniejszenie ich działania przeciwnadciśnieniowego. Z tego względu należy ostrożnie stosować produkt leczniczy Voltaren jednocześnie z lekami moczopędnymi lub zmniejszającymi ciśnienie tętnicze. Z powodu zwiększonego ryzyka wystąpienia działania nefrotoksycznego, pacjentów należy odpowiednio nawadniać i okresowo kontrolować czynność nerek, po rozpoczęciu oraz podczas leczenia skojarzonego, szczególnie po zastosowaniu leków moczopędnych i inhibitorów konwertazy angiotensyny. U pacjentów, szczególnie w podeszłym wieku, należy regularnie kontrolować ciśnienie tętnicze (patrz punkt 4.4).
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlInterakcje
Cyklosporyna: Diklofenak, jak i inne niesteroidowe leki przeciwzapalne, może zwiększyć nefrotoksyczność cyklosporyny ze względu na wpływ na prostaglandyny nerkowe. W związku z tym diklofenak powinien być podawany w dawkach mniejszych niż u pacjentów nieotrzymujących cyklosporyny. Leki określane jako wywołujące hiperkaliemię: Jednoczesne stosowanie leków oszczędzających potas, cyklosporyny, takrolimusu lub trimetoprimu może być związane ze zwiększeniem stężenia potasu w surowicy, w związku z tym należy regularnie kontrolować stężenie potasu w surowicy (patrz punkt 4.4). Chinolony przeciwbakteryjne: Odnotowano pojedyncze przypadki wystąpienia drgawek, które mogły być spowodowane jednoczesnym stosowaniem chinolonów i niesteroidowych leków przeciwzapalnych (NLPZ). Przewidywane interakcje, które należy uwzględnić Niesteroidowe leki przeciwzapalne (NLPZ) i kortykosteroidy: Jednoczesne podawanie diklofenaku i innych niesteroidowych leków przeciwzapalnych lub kortykosteroidów może zwiększać częstość występowania działań niepożądanych dotyczących przewodu pokarmowego (patrz punkt 4.4).
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlInterakcje
Leki przeciwzakrzepowe i leki antyagregacyjne: Należy zachować ostrożność, ponieważ jednoczesne stosowanie może zwiększyć ryzyko krwawienia (patrz punkt 4.4). Chociaż badania kliniczne nie wskazują, aby diklofenak wpływał na działanie leków przeciwzakrzepowych, to istnieją doniesienia o zwiększonym ryzyku wystąpienia krwotoku w przypadku skojarzonego stosowania produktu leczniczego Voltaren i leków przeciwzakrzepowych. Dlatego też, zaleca się w tym przypadku, ścisłą kontrolę pacjentów. Selektywne inhibitory wychwytu zwrotnego serotoniny: Jednoczesne stosowanie NLPZ, w tym diklofenaku, i selektywnych inhibitorów wychwytu zwrotnego serotoniny może zwiększyć ryzyko krwawień z przewodu pokarmowego (patrz punkt 4.4). Leki przeciwcukrzycowe: Badania kliniczne wykazały, że diklofenak można podawać jednocześnie z doustnymi lekami przeciwcukrzycowymi bez wpływu na ich działanie kliniczne.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlInterakcje
Jednakże wystąpiły pojedyncze przypadki zarówno działania hipoglikemizującego jak i hiperglikemizującego, które spowodowały konieczność zmiany dawkowania leków przeciwcukrzycowych w trakcie leczenia diklofenakiem. Z tego powodu monitorowanie stężenia glukozy we krwi jest konieczne podczas jednoczesnej terapii. Fenytoina: Podczas stosowania fenytoiny razem z diklofenakiem, należy monitorować stężenie fenytoiny w osoczu, ze względu na spodziewany wzrost ekspozycji na fenytoinę. Metotreksat: Diklofenak może hamować klirens nerkowy metotreksatu, zwiększając przez to stężenie metotreksatu we krwi. Zaleca się ostrożność podczas stosowania niesteroidowych leków przeciwzapalnych, w tym diklofenaku, w czasie krótszym niż 24 godziny, przed lub po leczeniu metotreksatem, ponieważ może wystąpić zwiększenie stężenia metotreksatu we krwi i może wystąpić zwiększenie działania toksycznego tej substancji.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlInterakcje
Kolestypol i cholestyramina: Związki te mogą spowodować opóźnienie lub zmniejszenie wchłaniania diklofenaku. W związku z tym, zalecane jest stosowanie diklofenaku przynajmniej jedną godzinę przed lub od 4 do 6-ciu godzin po przyjęciu kolestypolu/cholestyraminy.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na przebieg ciąży i (lub) rozwój zarodka/płodu. Dane z badań epidemiologicznych wskazują zwiększone ryzyko wystąpienia poronienia, wad rozwojowych serca i wytrzewienia jelit po zastosowaniu inhibitora syntezy prostaglandyn we wczesnym okresie ciąży. Wartość bezwzględnego ryzyka wystąpienia wad rozwojowych układu sercowo-naczyniowego wzrosła z mniej niż 1% do ok. 1,5%. Wartość ta może wzrosnąć wraz ze zwiększeniem dawki i wydłużeniem okresu leczenia. W badaniach na zwierzętach wykazano, że podawanie inhibitora syntezy prostaglandyn zwiększyło liczbę strat po- i przedimplantacyjnych oraz śmiertelność zarodka i płodu. Dodatkowo, zaobserwowano zwiększenie częstości występowania różnych wad wrodzonych, w tym wad rozwojowych układu sercowo-naczyniowego u zwierząt, którym podawano inhibitor syntezy prostaglandyn w okresie organogenezy. Od 20.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlWpływ na płodność, ciążę i laktację
tygodnia ciąży stosowanie diklofenaku może powodować małowodzie wskutek zaburzeń czynności nerek płodu. Może ono wystąpić krótko po rozpoczęciu leczenia i jest zwykle odwracalne po jego przerwaniu. Dodatkowo, po leczeniu w drugim trymestrze zgłaszano przypadki zwężenia przewodu tętniczego, z których większość ustąpiła po jego zaprzestaniu. W związku z tym w pierwszym i drugim trymestrze ciąży nie należy podawać diklofenaku, chyba że jest to bezwzględnie konieczne. Jeśli diklofenak jest stosowany przez kobietę starającą się o ciążę lub podczas pierwszego i drugiego trymestru ciąży, zastosowana dawka powinna być jak najmniejsza, a czas trwania leczenia jak najkrótszy. Należy rozważyć przedporodowe monitorowanie w kierunku małowodzia oraz zwężenia przewodu tętniczego po ekspozycji na diklofenak przez kilka dni od.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Voltaren nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane zgłaszane w trakcie badań klinicznych czy w raportach spontanicznych lub danych z literatury wymieniono zgodnie z klasyfikacją układów i narządów MedDRA. Dla każdej z klasyfikacji układów i narządów, działania niepożądane przedstawiono według częstości ich występowania, począwszy od najczęściej występujących. W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Ponadto, odpowiednia kategoria częstotliwości dla każdego działania niepożądanego podana jest na podstawie następującego schematu: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do < 1/100); rzadko (≥1/10 000 do < 1/1 000); bardzo rzadko (<1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlDziałania niepożądane
Przedstawione poniżej działania niepożądane obejmują działania niepożądane odnotowane w przypadku produktu leczniczego Voltaren w postaci ampułek, jak również obserwowane podczas stosowania innych postaci diklofenaku, stosowanych krótko- lub długotrwale. Zakażenia i zakażenia pasożytnicze: Bardzo rzadko: Ropnie w miejscu podania Nieznana: Martwica w miejscu wstrzyknięcia Zaburzenia krwi i układu chłonnego Bardzo rzadko: Trombocytopenia, leukopenia, anemia (w tym anemia hemolityczna i aplastyczna), agranulocytoza Zaburzenia układu immunologicznego Rzadko: Nadwrażliwość, reakcje anafilaktyczne i rzekomoanafilaktyczne (w tym hipotensja i wstrząs) Bardzo rzadko: Obrzęk naczynioruchowy (w tym obrzęk twarzy) Zaburzenia psychiczne Bardzo rzadko: Dezorientacja, depresja, bezsenność, koszmary senne, drażliwość, zaburzenia psychotyczne Zaburzenia układu nerwowego Często: Bóle głowy, zawroty głowy Rzadko: Senność Bardzo rzadko: Parestezje, zaburzenia pamięci, drgawki, lęk, drżenie, jałowe zapalenie opon mózgowych, zaburzenia smaku, udar naczyniowy mózgu Zaburzenia oka Bardzo rzadko: Zaburzenia widzenia, niewyraźne widzenie, podwójne widzenie Zaburzenia ucha i błędnika Często: Zawroty głowy Bardzo rzadko: Szumy uszne, zaburzenia słuchu Zaburzenia serca Niezbyt często: Zawał mięśnia sercowego, niewydolność serca, kołatanie serca, ból w klatce piersiowej Częstość nieznana: Zespół Kounisa Zaburzenia naczyniowe Bardzo rzadko: Nadciśnienie tętnicze, zapalenie naczyń Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Rzadko: Astma (w tym duszności) Bardzo rzadko: Zapalenie płuc Zaburzenia żołądka i jelit Często: Nudności, wymioty, biegunka, niestrawność, ból brzucha, wzdęcia, zmniejszony apetyt Rzadko: Zapalenie błony śluzowej żołądka, krwawienia z przewodu pokarmowego, krwawe wymioty, krwawe biegunki, smoliste stolce, choroba wrzodowa żołądka i (lub) dwunastnicy (z krwawieniem lub bez i perforacją) Bardzo rzadko: Zapalenie okrężnicy (także krwotoczne zapalenie okrężnicy oraz zaostrzenie wrzodziejącego zapalenia okrężnicy lub choroba Crohna), zaparcia, zapalenie błony śluzowej jamy ustnej (w tym wrzodziejące zapalenie jamy ustnej), zapalenie języka, zaburzenia w obrębie przełyku, błoniaste zwężenie jelit, zapalenie trzustki Częstość nieznana: Niedokrwienne zapalenie okrężnicy Zaburzenia wątroby i dróg żółciowych Często: Zwiększenie aktywności aminotransferaz Rzadko: Zapalenie wątroby, żółtaczka, zaburzenia czynności wątroby Bardzo rzadko: Piorunujące zapalenie wątroby, martwica wątroby, niewydolność wątroby Zaburzenia skóry i tkanki podskórnej Często: Wysypka Rzadko: Pokrzywka Bardzo rzadko: Wysypka pęcherzowa, wyprysk, rumień, rumień wielopostaciowy, zespół Stevensa-Johnsona, toksyczne martwicze oddzielanie się naskórka (zespół Lyella), złuszczające zapalenie skóry, łysienie, reakcje nadwrażliwości na światło, plamica, choroba Schönleina-Henocha, świąd Częstość nieznana: Embolia cutis medicamentosa (zespół Nicolaua) Zaburzenia nerek i dróg moczowych Bardzo rzadko: Ostra niewydolność nerek, krwiomocz, białkomocz, zespół nerczycowy, śródmiąższowe zapalnie nerek, martwica brodawek nerkowych Zaburzenia ogólne i stany w miejscu podania Często: Podrażnienie, ból, stwardnienie w miejscu podania Rzadko: Obrzęk, zanik tkanki w miejscu podania Częstość nieznana: Embolia cutis medicamentosa (zespół Nicolaua) W związku z leczeniem NLPZ zgłaszano występowanie obrzęków, nadciśnienia tętniczego i niewydolności serca.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlDziałania niepożądane
Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg/dobę) i w leczeniu długotrwałym zwiększa ryzyko zakrzepicy tętnic (np. zawał serca lub udar) (patrz punkty 4.3 i 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlDziałania niepożądane
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy Brak charakterystycznego obrazu klinicznego wynikającego z przedawkowania diklofenaku. Przedawkowanie może wywołać takie objawy jak wymioty, krwotok z przewodu pokarmowego, biegunkę, zawroty głowy, szumy uszne lub drgawki. W przypadku znacznego zatrucia może nastąpić ostra niewydolność nerek i uszkodzenie wątroby. Leczenie przedawkowania Leczenie ostrego zatrucia niesteroidowymi lekami przeciwzapalnymi (NLPZ), w tym diklofenakiem, zasadniczo obejmuje stosowanie środków podtrzymujących czynność ważnych dla życia narządów oraz leczenie objawowe. Leczenie podtrzymujące i objawowe należy zastosować w przypadku takich powikłań jak znaczne zmniejszenie ciśnienia tętniczego krwi, niewydolność nerek, drgawki, zaburzenia żołądka i jelit oraz zaburzenia oddychania.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlPrzedawkowanie
Wymuszona diureza, dializa lub przetaczanie krwi nie przyspieszają eliminowania niesteroidowych leków przeciwzapalnych (NLPZ), w tym diklofenaku, ze względu na dużą zdolność wiązania z białkami i rozległy metabolizm.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteriodowe leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu octowego; kod ATC: M 01 AB 05 Mechanizm działania Voltaren zawiera diklofenak sodowy, który jest związkiem niesteroidowym o działaniu przeciwreumatycznym, przeciwzapalnym, przeciwbólowym i przeciwgorączkowym. Wykazano doświadczalnie, że w mechanizmie działania produktu leczniczego Voltaren, istotne znaczenie ma hamowanie biosyntezy prostaglandyn. Prostaglandyny odgrywają zasadniczą rolę w patogenezie procesu zapalnego, bólu i gorączki. In vitro diklofenak sodowy nie hamuje biosyntezy proteoglikanów w chrząstce w zakresie stężeń odpowiadających wartościom osiąganym w organizmie ludzkim. Działanie farmakodynamiczne Działanie terapeutyczne produktu leczniczego Voltaren w chorobach reumatycznych wynika z jego właściwości przeciwzapalnych i przeciwbólowych, które warunkują wyraźne złagodzenie objawów klinicznych i subiektywnych, takich jak ból spoczynkowy, ból podczas ruchu, sztywność poranna i obrzęk stawów oraz poprawę ogólnej sprawności fizycznej.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlWłaściwości farmakodynamiczne
Dane z badań klinicznych wykazały również, że produkt leczniczy Voltaren wywiera wyraźne działanie przeciwbólowe w umiarkowanych i ciężkich stanach bólowych pochodzenia niereumatycznego. Działanie to pojawia się w przeciągu 15 do 30 minut. Produkt leczniczy Voltaren działa również skutecznie w napadach migreny. W pourazowych lub pooperacyjnych stanach zapalnych, Voltaren szybko łagodzi zarówno ból spoczynkowy jak i ból podczas ruchu oraz zmniejsza obrzęk powstały w wyniku stanu zapalnego i obrzęk powstały w wyniku zranienia. W celu zmniejszenia bólu pooperacyjnego, podany jednocześnie z opioidami pozwala znacząco zmniejszyć ich dawkę. Produkt leczniczy Voltaren w ampułkach, szczególnie stosowany w początkowym okresie leczenia stanów zapalnych i choroby zwyrodnieniowej stawów a także stanów bólowych, pochodzenia niereumatycznego.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Po podaniu 75 mg diklofenaku, we wstrzyknięciu domięśniowym, produkt leczniczy wchłania się natychmiast i po około 20 minutach zostaje osiągnięte średnie stężenie maksymalne około 2,5 mikrograma/ml (8 mikromola/l). Po podaniu 75 mg diklofenaku w infuzji dożylnej w ciągu około 2 godzin, średnie stężenie maksymalne wynosi ok. 1,9 mikrograma/ml (5,9 mikromola/l). Skrócenie okresu infuzji prowadzi do uzyskania większych, maksymalnych stężeń w osoczu. Natomiast podczas dłużej trwającej infuzji, po 3 do 4 godzinach, stężenie w osoczu osiąga plateau proporcjonalne do szybkości infuzji. Stężenie w osoczu ulega szybko zmniejszeniu po osiągnięciu stężenia maksymalnego, w przeciwieństwie do sytuacji, która ma miejsce w przypadku wstrzyknięcia domięśniowego, czy podania w postaci powlekanych tabletek dojelitowych lub czopków.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlWłaściwości farmakokinetyczne
Pole pod krzywą stężenia (AUC) po podaniu domięśniowym lub dożylnym jest około dwa razy większe niż po podaniu doustnym lub doodbytniczym identycznej dawki, ponieważ po podaniu doustnym lub doodbytniczym około połowa substancji czynnej jest szybko metabolizowana w wątrobie (efekt “pierwszego przejścia”). Podczas ponownego podania produktu leczniczego, jego farmakokinetyka pozostaje niezmieniona. Jeżeli zalecane przerwy w sposobie dawkowania są zachowane, nie dochodzi do kumulacji produktu leczniczego w organizmie. Dystrybucja Diklofenak łączy się z białkami osocza w 99,7%, głównie z albuminami (99,4%). Objętość dystrybucji ocenia się na 0,12 l/kg mc. do 0,17 l/kg mc. Diklofenak przenika do płynu maziowego, gdzie maksymalne stężenie występuje po 2 do 4 godzin od osiągnięcia maksymalnego stężenia w osoczu. Okres półtrwania w fazie eliminacji z płynu maziowego wynosi 3 do 6 godzin.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlWłaściwości farmakokinetyczne
Po dwóch godzinach od osiągnięcia wartości maksymalnych w osoczu, wartości stężenia substancji czynnej w płynie maziowym, są większe niż w osoczu i pozostają większe aż przez 12 godzin. Diklofenak został wykryty w niewielkim stężeniu (100 ng/ml) w mleku matki u jednej matki karmiącej. Szacunkowa ilość spożyta przez niemowlę przyjmujące mleko matki jest równoważna 0,03 mg/kg mc./dawkę dobową. Metabolizm Biotransformacja diklofenaku obejmuje częściowo glukuronizację niezmienionej cząsteczki, lecz diklofenak ulega przede wszystkim pojedynczej lub wielokrotnej hydroksylacji i metoksylacji, w wyniku czego powstaje kilka pochodnych fenolowych (3'-hydroksy-, 4'-hydroksy-, 5-hydroksy-, 4',5-dwuhydroksy- i 3'-hydroksy-4'-metoksy-diklofenak), z których większość ulega przekształceniu do połączeń glukuronidowych. Dwie spośród pochodnych fenolowych wykazują aktywność biologiczną, chociaż w znacznie mniejszym zakresie niż diklofenak.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlWłaściwości farmakokinetyczne
Eliminacja Całkowity, ogólnoustrojowy klirens osoczowy diklofenaku wynosi 263±56 ml/minutę (średnia wartość ± SD). Okres półtrwania w fazie eliminacji w osoczu wynosi 1 do 2 godzin. Cztery metabolity, w tym dwa aktywne, mają również krótki okres półtrwania 1 do 3 godzin. Jeden metabolit, 3'-hydroksy-4'-metoksy-diklofenak, ma znacznie dłuższy okres półtrwania, ale jest on praktycznie nieaktywny. Około 60% podanej dawki ulega wydaleniu w moczu w postaci sprzężonych z glukuronidami niezmienionych cząsteczek i metabolitów, z których większość również ulega przekształceniu do glukuronidów. Mniej niż 1% produktu leczniczego ulega wydaleniu w postaci niezmienionej. Pozostała część dawki ulega eliminacji w postaci metabolitów z żółcią z kałem. Liniowość lub nieliniowość Ilość wchłoniętego produktu leczniczego jest liniowo zależna od wielkości dawki.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlWłaściwości farmakokinetyczne
Szczególne grupy pacjentów Nie zaobserwowano istotnych, zależnych od wieku różnic we wchłanianiu, metabolizmie, czy wydalaniu produktu leczniczego. Jednakże u kilku pacjentów w podeszłym wieku 15 minutowa infuzja dożylna powodowała wyższe o 50% stężenie w osoczu krwi, niż należałoby tego oczekiwać na podstawie wyników uzyskanych u młodych, zdrowych osób. U pacjentów z zaburzeniami czynności nerek, badania dotyczące kinetyki pojedynczej dawki, z zastosowaniem typowego schematu dawkowania, nie wskazują na występowanie kumulacji niezmienionej substancji czynnej. W przypadku klirensu kreatyniny mniejszego niż 10 ml/min, stężenia hydroksypochodnych diklofenaku w osoczu krwi obliczone w stanie równowagi dynamicznej, są około 4 razy większe niż u osób z prawidłową czynnością nerek. Metabolity są jednak ostatecznie wydalane z żółcią.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlWłaściwości farmakokinetyczne
U pacjentów z przewlekłym zapaleniem wątroby lub wyrównaną marskością wątroby, kinetyka i metabolizm diklofenaku są takie same jak u pacjentów bez chorób wątroby.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają żadnego szczególnego zagrożenia dla człowieka. Brak danych dotyczących wpływu dikolfenaku na działanie teratogenne u myszy, szczurów, lub królików, pochodzących ze standardowych badań przedklinicznych na zwierzętach. Diklofenak nie wpływa na rozród szczurów. Poza minimalnym wpływem na płód w dawce toksycznej dla matki, rozwój przed-, około- i poporodowy potomstwa nie został zaburzony. Podawanie niesteroidowych leków przeciwzapalnych (w tym diklofenaku) hamuje owulację u królików oraz implantację i tworzenie się łożyska u szczurów, oraz prowadzi do przedwczesnego zamknięcia przewodu tętniczego u szczurów w ciąży.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlPrzedkliniczne dane o bezpieczeństwie
Podanie diklofenaku w dawce toksycznej dla matki wiązało się z dystocją, wydłużeniem ciąży, zmniejszoną przeżywalnością płodów i wewnątrzmacicznym zahamowaniem wzrostu u szczurów. Niewielki wpływ diklofenaku na parametry reprodukcji i porodu, jak również zwężenie przewodu tętniczego w macicy są farmakologicznymi konsekwencjami tej klasy inhibitorów syntezy prostaglandyn (patrz punkt 4.3 i 4.6).
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Mannitol sodu pirosiarczyn alkohol benzylowy glikol propylenowy (E 1520) sodu wodorotlenek woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C, chronić przed światłem. 6.5 Rodzaj i zawartość opakowania 5 ampułek po 3 ml. Ampułka za szkła bezbarwnego w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Voltaren w postaci roztworu można podawać zarówno jako głęboką iniekcję w górny zewnętrzny kwadrant pośladka, jak i w powolnej infuzji dożylnej po rozcieńczeniu produktu leczniczego zgodnie z następującymi wskazówkami.
- CHPL leku Voltaren, roztwór do wstrzykiwań lub do sporządzania roztworu do infuzji, 25 mg/mlDane farmaceutyczne
Należy zastosować odpowiednią technikę wstrzyknięcia i odpowiednią długość igły (biorąc pod uwagę grubość tłuszczu pośladkowego pacjenta), aby uniknąć nieumyślnego podskórnego wstrzyknięcia produktu leczniczego Voltaren. W zależności od wymaganego czasu trwania infuzji dożylnej (patrz punkt 4.2) należy zmieszać od 100 ml do 500 ml 0,9% izotonicznego roztworu chlorku sodu lub 5% roztworu glukozy. Obydwa roztwory należy zmieszać z roztworem dwuwęglanu sodu do iniekcji (0,5 ml roztworu 8,4% lub 1 ml roztworu 4,2% lub odpowiednią objętość roztworu o innym stężeniu) z opakowania otwartego bezpośrednio przed użyciem. Do uzyskanego roztworu należy dodać zawartość jednej ampułki produktu leczniczego Voltaren. Można stosować tylko roztwory przeźroczyste, wolne od nierozpuszczalnych zanieczyszczeń. Bez szczególnych wymagań. Nie stosować doustnie.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Voltaren SPORT, 11,6 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram produktu Voltaren SPORT zawiera 11,6 mg diklofenaku dietyloamoniowego (Diclofenacum diethylammonium), co odpowiada 10 mg diklofenaku sodowego. Substancje pomocnicze o znanym działaniu: 1 g żelu Voltaren SPORT zawiera 50 mg glikolu propylenowego. 1 g żelu Voltaren SPORT zawiera 1 mg substancji zapachowej (z benzoesanem benzylu, alkoholem benzylowym, cytralem, cytronellolem, kumaryną, d-limonenem, eugenolem, farnezolem, geraniolem, linalolem). Pełny wykaz substancji pomocniczych patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel Biały lub prawie biały, delikatny, jednorodny żel, o kremowej konsystencji.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Voltaren SPORT jest wskazany do stosowania u osób dorosłych i młodzieży w wieku powyżej 14 lat. Produkt działa przeciwbólowo, przeciwzapalnie i przeciwobrzękowo. Stosowany jest w miejscowym leczeniu: Dorośli i młodzież w wieku powyżej 14 lat: pourazowych stanów zapalnych ścięgien, więzadeł, mięśni i stawów (np. powstałych wskutek skręceń, nadwerężeń lub stłuczeń), bólu pleców, ograniczonych stanów zapalnych tkanek miękkich, takich jak: zapalenie ścięgien, łokieć tenisisty, zapalenie torebki stawowej, zapalenie okołostawowe. Dorośli (w wieku powyżej 18 lat): ograniczonych i łagodnych postaci choroby zwyrodnieniowej stawów.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Do stosowania na skórę. Jeśli po upływie 7 dni nie nastąpiła poprawa lub pacjent czuje się gorzej, należy skontaktować się z lekarzem. Dawkowanie Dorośli i młodzież w wieku powyżej 14 lat Voltaren SPORT należy stosować miejscowo na skórę trzy lub cztery razy na dobę, delikatnie wcierając. Ilość zużytego żelu należy dostosować do rozmiarów miejsca zmienionego chorobowo. Na przykład ilość 2 g do 4 g produktu Voltaren SPORT (ilość odpowiadająca wielkości owocu wiśni do rozmiarów orzecha włoskiego) jest wystarczająca do posmarowania powierzchni około 400 cm2 do 800 cm2. Po zastosowaniu produktu należy: Wytrzeć dłonie w chusteczkę, a następnie je umyć, chyba że to właśnie dłonie są miejscem leczonym. Zużytą chusteczkę należy wyrzucić do śmieci. Należy unikać kontaktu żelu z oczami i ustami. Pacjent po zastosowaniu produktu Voltaren SPORT powinien poczekać do pełnego wyschnięcia produktu przed rozpoczęciem kąpieli.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gDawkowanie
Czas trwania leczenia Okres leczenia zależy od wskazań i od reakcji na leczenie. W przypadku stosowania produktu bez konsultacji z lekarzem, nie należy go stosować dłużej niż przez 14 dni w przypadku nadwerężeń i reumatyzmu tkanki miękkiej. U osób dorosłych (w wieku powyżej 18 lat), w przypadku bólu związanego z chorobą zwyrodnieniową stawów, bez konsultacji z lekarzem nie należy stosować produktu przez dłużej niż 21 dni. Zaleca się kontrolę lekarską po 7 dniach stosowania żelu w przypadku braku skuteczności leczenia lub z chwilą nasilenia się objawów chorobowych. Stosowanie u dzieci (w wieku poniżej 14 lat) Brak wystarczających danych dotyczących skuteczności i bezpieczeństwa stosowania produktu u dzieci i młodzieży w wieku poniżej 14 lat (patrz także punkt 4.3 Przeciwwskazania). Stosowanie u dzieci i młodzieży (w wieku powyżej 14 lat) U młodzieży w wieku powyżej 14 lat, w razie konieczności stosowania produktu leczniczego przez dłużej niż 7 dni w leczeniu bólu lub w przypadku pogorszenia się objawów, pacjent powinien skontaktować się z lekarzem.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gDawkowanie
Stosowanie u osób w podeszłym wieku W przypadku stosowania produktu Voltaren SPORT u osób w podeszłym wieku, należy stosować dawkowanie jak u osób dorosłych.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na diklofenak lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Voltaren SPORT jest także przeciwwskazany u tych pacjentów, u których astma, obrzęk naczynioruchowy, pokrzywka, czy ostre zapalenie błony śluzowej nosa są wywoływane przez kwas acetylosalicylowy lub inne niesteroidowe leki przeciwzapalne. Ostatni trymestr ciąży. Dzieci i młodzież w wieku poniżej 14 lat.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie można wykluczyć możliwości wystąpienia ogólnoustrojowych działań niepożądanych (tych związanych ze stosowaniem doustnych form diklofenaku) w przypadku stosowania produktu Voltaren SPORT w wyższej dawce i dłużej niż zalecany okres użytkowania (patrz punkt 4.2:” Dawkowanie i sposób podawania”). Voltaren SPORT należy stosować tylko na nieuszkodzoną powierzchnię skóry. Należy unikać kontaktu żelu z oczami i błonami śluzowymi (np. jama ustna), nie należy go połykać. Należy zaprzestać stosowania produktu, jeśli po jego nałożeniu pojawi się wysypka. Voltaren SPORT może być stosowany jednocześnie z nieokluzyjnymi bandażami, ale nie należy stosować go z nieprzepuszczającymi powietrza opatrunkami okluzyjnymi. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Specjalne ostrzeżenia dotyczące substancji pomocniczych Glikol propylenowy Produkt leczniczy zawiera 50 mg glikolu propylenowego w każdym gramie.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gSpecjalne środki ostrozności
Glikol propylenowy może powodować podrażnienie skóry. Substancja zapachowa Produkt leczniczy zawiera substancję zapachową z benzoesanem benzylu, alkoholem benzylowym, cytralem, cytronellolem, kumaryną, d-limonenem, eugenolem, farnezolem, geraniolem, linalolem, które mogą powodować reakcje alergiczne.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Po zastosowaniu żelu na skórę, ilość diklofenaku, która ulega wchłonięciu do krążenia ogólnego jest niewielka, dlatego prawdopodobieństwo wystąpienia interakcji z innymi produktami leczniczymi jest niewielkie.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Stopień ekspozycji ogólnoustrojowej diklofenaku po zastosowaniu na skórę jest niższy w porównaniu z doustnymi postaciami. W oparciu o doświadczenia dotyczące stosowania NLPZ i ich działanie ogólnoustrojowe zaleca się uwzględnić poniższe informacje. Zahamowanie syntezy prostaglandyn może negatywnie wpływać na ciążę i (lub) rozwój zarodka lub płodu. Dane z badań epidemiologicznych sugerują zwiększone ryzyko poronienia, wad rozwojowych serca i wytrzewienia w przypadku stosowania inhibitorów syntezy prostaglandyn we wczesnej ciąży. Całkowite ryzyko wystąpienia wad rozwojowych serca zostaje zwiększone z 1% do 1,5%. Uważa się, że ryzyko to zwiększa się wraz ze zwiększeniem dawki i czasu trwania terapii. U zwierząt wykazano, że podawanie inhibitorów syntezy prostaglandyn skutkowało zwiększoną utratą płodów przed i po implantacji oraz śmiertelnością zarodków lub płodów.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gWpływ na płodność, ciążę i laktację
Dodatkowo zwiększenie ilości przypadków różnych wad wrodzonych, również układu sercowo-naczyniowego obserwowano u zwierząt, którym podawano inhibitory syntezy prostaglandyn podczas okresu organogenezy. Jeśli nie jest to wyraźnie konieczne, nie należy stosować diklofenaku podczas pierwszego i drugiego trymestru ciąży. W przypadku stosowania diklofenaku u kobiet planujących ciążę oraz w czasie pierwszego i drugiego trymestru ciąży, należy stosować dawkę możliwie najmniejszą, a czas trwania leczenia jak najkrótszy. Podczas trzeciego trymestru ciąży stosowanie wszystkich inhibitorów syntezy prostaglandyn może powodować ekspozycję płodu na: d działanie toksyczne na układ krążenia i oddechowy (w tym przedwczesne zamknięcie przewodu tętniczego i nadciśnienie płucne), zaburzenia czynności nerek, które mogą postępować skutkując niewydolnością nerek z małowodziem.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gWpływ na płodność, ciążę i laktację
Ekspozycja matki i noworodka pod koniec ciąży na: możliwe wydłużenie czasu trwania krwawienia oraz działanie antyagregacyjne, które mogą wystąpić nawet podczas stosowania bardzo małych dawek, zahamowanie skurczów macicy skutkujące opóźnionym lub przedłużonym porodem. Dlatego też stosowanie diklofenaku jest przeciwwskazane podczas trzeciego trymestru ciąży. Karmienie piersi? Podobnie jak inne NLPZ, diklofenak przenika do mleka kobiet karmiących piersią w niewielkich ilościach. Mimo to stosowanie produktu Voltaren SPORT w dawkach terapeutycznych nie wywiera wpływu na karmione dziecko. Ze względu na brak kontrolowanych badań dotyczących kobiet karmiących piersią, produkt należy stosować w czasie karmienia piersią jedynie na zalecenie lekarza. Tylko wtedy, kiedy korzyści wynikające ze stosowania produktu leczniczego przewyższają ryzyko dla nowo narodzonego dziecka.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gWpływ na płodność, ciążę i laktację
W takich przypadkach produktu Voltaren SPORT nie należy stosować na okolice piersi kobiet karmiących piersią ani też na duże powierzchnie skóry lub długotrwale (patrz punkt 4.4).
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Voltaren SPORT stosowany miejscowo, nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane zostały zestawione w Tabeli 1. według klasyfikacji układów i narządów oraz częstotliwości. Następująca konwencja została wykorzystana do klasyfikacji działań niepożądanych: często (≥ 1/100, < 1/10); niezbyt często (≥ 1/1000, < 1/100); rzadko (≥ 1/10 000, < 1/1000); bardzo rzadko (< 1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Działania niepożądane zebrane po wprowadzeniu produktu do obrotu zgłaszane są dobrowolnie i pochodzą z populacji o nieokreślonej wielkości. Nie zawsze jest możliwe oszacowanie ich częstości, najprawdopodobniej występują z częstotliwością: rzadko lub bardzo rzadko. W obrębie każdej grupy o określonej częstości występowania objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasilaniem. Tabela 1.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gDziałania niepożądane
Klasyfikacja układów i narządów MedDRA Często (≥ 1/100, < 1/10) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (< 1/10 000) Zakażenia i zarażenia pasożytnicze Wysypka grudkowata Zaburzenia układu immunologicznego Nadwrażliwość (w tym pokrzywka) Obrzęk naczynioruchowy Zaburzenia oddechowe, klatki piersiowej i śródpiersia Astma Zaburzenia skóry i tkanki podskórnej Wysypka Pęcherzykowe zapalenie skóry Reakcje nadwrażliwości na światło Wyprysk Rumień Zapalenie skóry (w tym kontaktowe zapalenie skóry) Świąd Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gPrzedawkowanie
4.9 Przedawkowanie Przedawkowanie produktu jest mało prawdopodobne ze względu na niewielkie wchłanianie diklofenaku stosowanego miejscowo. Po przypadkowym połknięciu produktu Voltaren SPORT mogą wystąpić działania niepożądane, podobne do obserwowanych po przedawkowaniu diklofenaku w postaci tabletek (100 g produktu zawiera ekwiwalent 1000 mg diklofenaku sodowego). W razie przypadkowego połknięcia produktu, skutkującego działaniami niepożądanymi, należy zastosować leki i wdrożyć leczenie objawowe zwykle stosowane w przypadku leczenia zatruć niesteroidowymi lekami przeciwzapalnymi. Dalsze leczenie powinno odbywać w warunkach szpitalnych lub zgodnie z zaleceniami krajowego ośrodka leczenia zatruć.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Niesteroidowe leki przeciwzapalne do stosowania miejscowego Kod ATC: M02AA15. Diklofenak jest niesteroidowym lekiem przeciwzapalnym (NLPZ) o silnym działaniu przeciwbólowym, przeciwzapalnym i przeciwgorączkowym. Diklofenak jest nieselektywnym inhibitorem izoenzymów COX-2 i COX-1, który wywiera efekt terapeutyczny poprzez inhibicje cyklooksygenazy 2 (COX-2), co hamuje syntezę prostaglandyn. W zapaleniach pochodzenia urazowego lub reumatycznego produkt Voltaren SPORT łagodzi ból, zmniejsza obrzęk i skraca czas powrotu do stanu normalnego funkcjonowania. Dane z badań klinicznych przeprowadzonych wśród pacjentów z ostrym bólem karku wykazały, że produkt Voltaren SPORT redukuje ostry ból (p<0,0001 w porównaniu z placebo w postaci żelu) w ciągu godziny po zastosowaniu.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gWłaściwości farmakodynamiczne
W ciągu dwóch dni po zastosowaniu produktu Voltaren SPORT ból odczuwany podczas ruchu zmniejszył się w stosunku do wartości początkowej o 58 mm w 100 mm wizualnej skali analogowej (zmniejszenie o 75%), podczas gdy po zastosowaniu placebo w żelu ból ten zmniejszył się o 17 mm w porównaniu do wartości początkowej (zmniejszenie o 23%) (p<0.0001). Po dwóch dniach leczenia 94% pacjentów potwierdziło działanie produktu Voltaren SPORT w porównaniu z 8% pacjentów, którzy odczuli poprawę po zastosowaniu placebo w żelu (p<0.0001). Konsekwentnie średni (mediana) czas odpowiedzi na leczenie wynosił 2 dni w przypadku grupy pacjentów stosujących Voltaren SPORT, natomiast 5 dni w grupie osób stosujących placebo (p<0,0001). Przywrócenie sprawności ruchowej oraz redukcja bólu nastąpiło po 4 dniach stosowania produktu Voltaren SPORT (p<0,0001 w porównaniu z placebo w postaci żelu). Ze względu na wodno-alkoholowe podłoże Voltaren SPORT wykazuje również działanie kojące i chłodzące.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Ilość wchłanianego przez skórę diklofenaku po zastosowaniu produktu Voltaren SPORT zależy od czasu kontaktu żelu ze skórą, od rozmiarów leczonego miejsca, jak również od całkowitej użytej miejscowo dawki oraz od stopnia nawilżenia skóry. Po zastosowaniu miejscowym 2,5 g produktu Voltaren SPORT na powierzchnię 500 cm², ilość wchłoniętego diklofenaku odpowiada około 6% dawki podanej jako Voltaren tabletki. Określana jest ona w stosunku do ilości diklofenaku w ogólnej eliminacji nerkowej. Okluzja prowadzona przez 10 godzin prowadzi do trzykrotnego zwiększenia ilości wchłoniętego diklofenaku. Dystrybucja Po zastosowaniu miejscowym produktu Voltaren SPORT na stawy kolanowe i rąk można oznaczyć stężenie diklofenaku w osoczu krwi, w maziówce i w płynie maziówkowym. Jego maksymalne stężenie w osoczu krwi jest około 100 razy mniejsze niż stężenie osiągane po doustnym podaniu tabletek Voltaren.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gWłaściwości farmakokinetyczne
99,7% diklofenaku wiąże się z białkami osocza krwi, głównie z albuminami (99,4%). Diklofenak gromadzi się w skórze, która działa jak rezerwuar, z którego uwalniany jest on w sposób ciągły do głębiej znajdujących się tkanek. Diklofenak jest preferencyjnie dystrybuowany i pozostaje w głębi tkanek objętych stanem zapalnym, gdzie osiąga stężenie do 20 razy wyższe niż w osoczu krwi. Metabolizm Biotransformacja diklofenaku obejmuje pojedynczą lub wielokrotną hydroksylację, a następnie glukuronidację i częściową glukuronidację niezmienionej cząsteczki. Eliminacja Całkowity klirens nerkowy diklofenaku wynosi 263 ± 56 ml/minutę. Okres półtrwania w fazie eliminacji w osoczu wynosi od 1 do 2 godzin. Cztery metabolity, włączając dwa metabolity biologicznie czynne, mają także krótki osoczowy okres półtrwania wynoszący od 1 do 3 godzin. Piąty z metabolitów, 3`-hydroksy- 4`-metoksy-diklofenak, ma dłuższy okres półtrwania. Jest to jednak metabolit nieaktywny biologicznie.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gWłaściwości farmakokinetyczne
Diklofenak i jego metabolity ulegają wydalaniu głównie z moczem. Nie zaobserwowano występowania kumulacji diklofenaku i jego metabolitów u pacjentów z zaburzeniami czynności nerek. U pacjentów z przewlekłym zapaleniem wątroby lub wyrównaną marskością wątroby, kinetyka i metabolizm diklofenaku są takie same jak u pacjentów bez chorób wątroby.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne z badań toksyczności ostrej i po podaniu dawki wielokrotnej, a także z badań genotoksyczności i potencjału rakotwórczego wykazały, że w zakresie dawek terapeutycznych diklofenak nie wykazuje specyficznego zagrożenia dla ludzi. Voltaren SPORT był dobrze tolerowany w różnych badaniach. Nie wykazywał działania fotouczulającego i nie powodował uczuleń skórnych. Diklofenak nie wykazał żadnych oznak upośledzenia płodności samców i samic szczura. Nie wykazano teratogennego działania diklofenaku u myszy, szczurów i królików. Rozwój przed-, około- i poporodowy potomstwa nie był zaburzony.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Carbopol 974P, cetomakrogol 1000, dietyloamina, alkohol izopropylowy, glikol propylenowy, ciekła parafina, substancja zapachowa (Perfume cream 45 – z benzoesanem benzylu, alkoholem benzylowym, cytralem, cytronellolem, kumaryną, d-limonenem, eugenolem, farnezolem, geraniolem, linalolem), cetiol LC, woda oczyszczona. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności Tuba zamknięta zakrętką (aplikatorem): 3 lata. Po pierwszym otwarciu: 1 rok Tuba i Pojemnik z aplikatorem: 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Tuba: Przechowywać w temperaturze poniżej 25°C. Pojemnik z aplikatorem: Przechowywać w temperaturze poniżej 25°C. Pojemnik ciśnieniowy, należy przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem. Nie przebijać i nie spalać nawet po zużyciu.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gDane farmaceutyczne
6.5 Rodzaj i zawartość opakowania Tuba: 20 g, 30 g, 40 g, 50 g, 75 g, 80 g (4 tuby po 20 g), 100 g, 120 g i 150 g. Tuba aluminiowa z membraną aluminiową, zamknięta zakrętką z polipropylenu, w tekturowym pudełku. Tuba aluminiowa laminowana (LDPE / Aluminium/ HDPE [warstwa wewnętrzna] z końcówką HDPE i z zabezpieczeniem, zamknięta zakrętką z polipropylenu umożliwiającą usunięcie zabezpieczenia z tuby, przed pierwszym użyciem, umieszczona w tekturowym pudełku. Tuba aluminiowa laminowana (LDPE / Aluminium/ HDPE [warstwa wewnętrzna] z końcówką HDPE i z zabezpieczeniem, zamknięta zakrętką (aplikatorem) z HDPE/PP umożliwiającą usunięcie zabezpieczenia z tuby, przed pierwszym użyciem, oraz nakładka z PP, umieszczona w tekturowym pudełku. Tuba aluminiowa laminowana (LDPE / Aluminium / mieszanina LDPE i HDPE [warstwa wewnętrzna] z końcówką HDPE i z zabezpieczeniem, zamknięta zakrętką z polipropylenu umożliwiającą usunięcie zabezpieczenia z tuby, przed pierwszym użyciem, umieszczona w tekturowym pudełku.
- CHPL leku Voltaren Sport, Żel, 11,6 mg/gDane farmaceutyczne
Tuba aluminiowa laminowana (LDPE / Aluminium / mieszanina LDPE i HDPE [warstwa wewnętrzna] z końcówką HDPE i z zabezpieczeniem, zamknięta zakrętką (aplikatorem) z HDPE/PP umożliwiającą usunięcie zabezpieczenia z tuby, przed pierwszym użyciem, oraz nakładka z PP, umieszczona w tekturowym pudełku. Pojemnik z aplikatorem: 50 ml i 75 ml. Pojemnik aluminiowy z wielowarstwową torebką wewnątrz, zaworem, urządzeniem uruchamiającym, pierścieniem ochronnym i nasadką w tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowywania produktu leczniczego do stosowania Brak specjalnych wymagań.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Diclac 50, 50 mg, czopki Diclac 100, 100 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Diclac 50 Jeden czopek zawiera 50 mg diklofenaku sodowego (Diclofenacum natricum). Diclac 100 Jeden czopek zawiera 100 mg diklofenaku sodowego (Diclofenacum natricum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Czopek
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWskazania do stosowania
4.1 Wskazania do stosowania Leczenie: zapalnych lub zwyrodnieniowych postaci choroby reumatycznej: reumatoidalnego zapalenia stawów, młodzieńczego reumatoidalnego zapalenia stawów (choroba Stilla), zesztywniającego zapalenia stawów kręgosłupa, choroby zwyrodnieniowej stawów, zapalenia stawów kręgosłupa, zespołów bólowych związanych ze zmianami w kręgosłupie, reumatyzmu pozastawowego; ostrych napadów dny; bólów spowodowanych pourazowymi i pooperacyjnymi stanami zapalnymi i obrzękami, np. po zabiegach stomatologicznych lub ortopedycznych; stanów bólowych i zapalnych w ginekologii, np. pierwotnego bolesnego miesiączkowania lub zapalenia przydatków; napadów migreny; wspomagające w ciężkich, bolesnych zakażeniach uszu, nosa lub gardła, np. zapalenie gardła i migdałków, zapalenie ucha). Zgodnie z ogólnymi zasadami terapeutycznymi, w przypadku wyżej wymienionych chorób w pierwszej kolejności należy zastosować leczenie przyczynowe.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWskazania do stosowania
Gorączka, jako jedyny objaw, nie jest wskazaniem do stosowania.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Ogólnie zaleca się indywidualne ustalanie dawkowania. Występowanie działań niepożądanych można ograniczyć, stosując produkt leczniczy w najmniejszej skutecznej dawce i nie dłużej niż to koniecznie do kontrolowania objawów (patrz punkt 4.4). Ogólna grupa docelowa Zalecana początkowa dawka dobowa wynosi od 100 mg do 150 mg. W łagodniejszych przypadkach oraz w długotrwałym stosowaniu dawka do 100 mg na dobę jest na ogół wystarczająca. Całkowitą dawkę dobową należy podawać w 2 lub 3 dawkach podzielonych. W celu zniesienia bólu nocnego i sztywności porannej leczenie tabletkami w ciągu dnia można uzupełnić podaniem czopka przed snem (nie przekraczając całkowitej maksymalnej dawki dobowej 150 mg). W pierwotnym bolesnym miesiączkowaniu dawkę dobową należy ustalać indywidualnie. Zwykle wynosi ona od 50 mg do 150 mg.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgDawkowanie
Początkowo należy podawać od 50 mg do 100 mg, a w razie potrzeby dawkę tę można zwiększyć w ciągu kilku cykli menstruacyjnych do dawki maksymalnej 200 mg na dobę. Leczenie należy rozpocząć w momencie pojawienia się pierwszych objawów i, w zależności od ich nasilenia, kontynuować leczenie przez kilka dni. Leczenie napadów migreny diklofenakiem w postaci czopków należy rozpocząć od dawki 100 mg podanej po wystąpieniu pierwszych objawów zwiastujących napad. W razie konieczności można tego samego dnia zastosować dodatkowo czopki, do 100 mg. Jeżeli pacjent wymaga dalszego leczenia w ciągu następnych dni, maksymalną dawkę dobową należy ograniczyć do 150 mg w dawkach podzielonych. 4.3 Szczególne grupy pacjentów Dzieci i młodzież Stosowanie produktu leczniczego Diclac w postaci czopków nie jest zalecane u dzieci i młodzieży. Osoby w podeszłym wieku (powyżej 65 lat) U osób w podeszłym wieku zmiana dawkowania początkowego nie jest konieczna (patrz punkt 4.4).
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgDawkowanie
Rozpoznana choroba układu krążenia lub istotne sercowo-naczyniowe czynniki ryzyka Leczenie diklofenakiem nie jest na ogół zalecane u pacjentów z rozpoznaną chorobą układu krążenia lub niewyrównanym nadciśnieniem tętniczym. W razie potrzeby pacjenci z rozpoznaną chorobą układu sercowo-naczyniowego, niewyrównanym nadciśnieniem tętniczym lub istotnymi czynnikami ryzyka choroby sercowo-naczyniowej powinni być leczeni diklofenakiem wyłącznie po dokonaniu wnikliwej oceny i tylko dawkami ≤100 mg na dobę, jeśli leczenie trwa dłużej niż 4 tygodnie (patrz punkt 4.4). Zaburzenia czynności nerek Stosowanie produktu leczniczego Diclac 50 i Diclac 100 u pacjentów z niewydolnością nerek jest przeciwwskazane (patrz punkt 4.3). Nie przeprowadzono specjalnych badań u pacjentów z zaburzeniami czynności nerek, dlatego nie można sformułować odpowiednich zaleceń dotyczących dostosowania dawki.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgDawkowanie
U pacjentów z lekkimi lub umiarkowanymi zaburzeniami czynności nerek zaleca się zachowanie ostrożności podczas podawania produktu leczniczego Diclac 50 i Diclac 100 (patrz punkt 4.4). Zaburzenia czynności wątroby Stosowanie produktu leczniczego Diclac 50 i Diclac 100 u pacjentów z niewydolnością wątroby jest przeciwwskazane (patrz punkt 4.3). Nie przeprowadzono specjalnych badań u pacjentów z zaburzeniami czynności wątroby, dlatego nie można sformułować odpowiednich zaleceń dotyczących dostosowania dawki. U pacjentów z lekkimi lub umiarkowanymi zaburzeniami czynności wątroby zaleca się zachowanie ostrożności podczas podawania produktu leczniczego Diclac 50 i Diclac 100 (patrz punkt 4.4). 4.4 Sposób podawania Podanie doodbytnicze. Czopek należy prawidłowo umieścić w odbytnicy. Zaleca się stosowanie czopków po wypróżnieniu. Nie wolno stosować doustnie.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na diklofenak lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Czynna lub podawana w wywiadzie choroba wrzodowa żołądka i (lub) dwunastnicy, krwawienie lub perforacja (patrz punkt 4.4). Podawane w wywiadzie krwawienie z przewodu pokarmowego lub perforacja, związane z wcześniejszym leczeniem niesteroidowymi lekami przeciwzapalnymi (NLPZ). Czynna lub podawana w wywiadzie nawracająca choroba wrzodowa i (lub) krwotok (co najmniej dwa odrębne przypadki potwierdzonego owrzodzenia lub krwawienia). Ostatni trymestr ciąży (patrz punkt 4.6). Niewydolność wątroby. Niewydolność nerek. Stwierdzona zastoinowa niewydolność serca (klasa II–IV wg NYHA), choroba niedokrwienna serca, choroba naczyń obwodowych i (lub) choroba naczyń mózgowych. Podobnie jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), nie należy stosować produktu leczniczego Diclac w postaci czopków u osób, u których podanie kwasu acetylosalicylowego lub innych NLPZ może być przyczyną wystąpienia astmy, obrzęku naczynioruchowego, pokrzywki lub ostrego nieżytu nosa (tj.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgPrzeciwwskazania
nadwrażliwość krzyżowa na NLZP), patrz punkty 4.4 i 4.8. Zapalenie odbytnicy lub odbytu.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ogólne Przyjmowanie produktu leczniczego w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz wpływ na przewód pokarmowy i układ krążenia poniżej). Wpływ na przewód pokarmowy Krwawienie, owrzodzenie lub perforacja przewodu pokarmowego, które mogą zakończyć się zgonem, raportowane w przypadku wszystkich NLPZ, w tym diklofenaku, mogą wystąpić w każdym okresie leczenia, z objawami poprzedzającymi lub bez, i niezależnie od ciężkich powikłań dotyczących przewodu pokarmowego w wywiadzie. Powikłania te są bardziej niebezpieczne u osób w podeszłym wieku. Jeśli u pacjenta wystąpi krwawienie lub owrzodzenie przewodu pokarmowego, stosowanie produktu leczniczego Diclac 50 i Diclac 100 należy przerwać.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgSpecjalne środki ostrozności
Tak jak w przypadku innych NLPZ, w tym diklofenaku, u pacjentów z objawami wskazującymi na zaburzenia żołądka i jelit lub z wywiadem sugerującym chorobę wrzodową żołądka i (lub) dwunastnicy, krwawienia lub perforację, niezbędny jest ścisły nadzór lekarski. Produkt leczniczy Diclac 50 i Diclac 100 należy zalecać tym pacjentom szczególnie ostrożnie (patrz punkt 4.8). Ryzyko krwawienia z przewodu pokarmowego jest większe w przypadku zwiększania dawek NLPZ i u pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie, szczególnie gdy przebiegała z krwotokami lub perforacją oraz u pacjentów w podeszłym wieku. U osób w podeszłym wieku, zwiększona jest częstość działań niepożądanych związanych ze stosowaniem NLPZ, zwłaszcza krwawienia i perforacji, które mogą być śmiertelne. W celu zmniejszenia ryzyka działania toksycznego na układ pokarmowy u pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie (zwłaszcza powikłaną krwotokami lub perforacją) oraz u pacjentów w podeszłym wieku należy rozpoczynać i kontynuować leczenie z zastosowaniem najmniejszych skutecznych dawek.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgSpecjalne środki ostrozności
U tych pacjentów, jak również u pacjentów, u których konieczne jest jednoczesne stosowanie produktów leczniczych zawierających małe dawki kwasu acetylosalicylowego lub innych produktów leczniczych mogących zwiększyć ryzyko powikłań żołądkowo-jelitowych, należy rozważyć leczenie skojarzone z lekami osłonowymi (np. inhibitorami pompy protonowej lub mizoprostolem). Pacjenci z zaburzeniami żołądka i jelit w wywiadzie, szczególnie pacjenci w podeszłym wieku, powinni informować lekarza o jakichkolwiek nietypowych objawach brzusznych (szczególnie o krwawieniach z przewodu pokarmowego). Należy zachować ostrożność u pacjentów otrzymujących jednocześnie leki, które mogą powodować zwiększenie ryzyka powstania owrzodzenia lub krwawienia, takie jak kortykosteroidy działające ogólnoustrojowo, leki przeciwzakrzepowe, leki przeciwpłytkowe, lub selektywne inhibitory wychwytu zwrotnego serotoniny (patrz punkt 4.5).
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgSpecjalne środki ostrozności
Pacjenci z wrzodziejącym zapaleniem okrężnicy lub z chorobą Leśniowskiego-Crohna powinni być pod ścisłą kontrolą lekarską, ze względu na możliwość zaostrzenia ogólnego stanu (patrz punkt 4.8). Wpływ na czynność wątroby Pacjenci z zaburzeniami czynności wątroby powinni przyjmować Diclac 50 i Diclac 100 pod ścisłym nadzorem lekarza ze względu na możliwość pogorszenia stanu ogólnego. Tak jak niesteroidowe leki przeciwzapalne (NLPZ), diklofenak może zwiększać aktywność jednego lub więcej enzymów wątrobowych. W trakcie długotrwałego leczenia diklofenakiem należy regularnie kontrolować czynności wątroby. Stosowanie diklofenaku należy przerwać, jeśli nieprawidłowe wyniki badań czynności wątroby utrzymują się lub pogarszają, a także gdy wystąpią kliniczne oznaki lub objawy wskazujące na zaburzenia czynności wątroby oraz inne objawy (np. eozynofilia, wysypka itp.). Zapalenie wątroby spowodowane stosowaniem diklofenaku może wystąpić niepoprzedzone objawami prodromalnymi.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgSpecjalne środki ostrozności
Należy zachować ostrożność, stosując Diclac 50 lub Diclac 100 u pacjentów z porfirią wątrobową, ponieważ może wywołać napad choroby. Wpływ na czynność nerek Podczas leczenia NLPZ, w tym diklofenakiem, odnotowano przypadki zatrzymywania płynów i powstawania obrzęków, dlatego szczególną ostrożność należy zachować u pacjentów z zaburzeniami czynności serca lub nerek, z nadciśnieniem tętniczym w wywiadzie, u osób w podeszłym wieku, u pacjentów jednocześnie otrzymujących leki moczopędne lub leki znacząco wpływające na czynność nerek oraz pacjentów z nadmierną utratą płynu pozakomórkowego o różnej etiologii, np. w fazie około- lub pooperacyjnej po dużych zabiegach chirurgicznych (patrz punkt 4.3). Podczas stosowania diklofenaku zaleca się u tych pacjentów kontrolowanie czynności nerek. Odstawienie produktu leczniczego powoduje zwykle powrót do stanu sprzed leczenia.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgSpecjalne środki ostrozności
Wpływ na skórę Bardzo rzadko po zastosowaniu NLPZ obserwowano ciężkie reakcje skórne (niektóre zakończone zgonem), w tym złuszczające zapalenie skóry, zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka (patrz punkt 4.8). Ryzyko wystąpienia tych ciężkich reakcji jest największe na początku leczenia, w większości przypadków w pierwszym miesiącu stosowania. Produkt leczniczy należy odstawić natychmiast po wystąpieniu pierwszych objawów takich jak wysypka skórna, uszkodzenie błony śluzowej lub inne objawy nadwrażliwości. Tak jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), po podaniu diklofenaku rzadko mogą wystąpić reakcje alergiczne, w tym reakcje anafilaktyczne i rzekomoanafilaktyczne, nawet wtedy, gdy ten produkt leczniczy nie był wcześniej stosowany.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgSpecjalne środki ostrozności
Wpływ na układ krążenia i naczynia zaopatrujące mózg Pacjentów z nadciśnieniem tętniczym w wywiadzie lub łagodną do umiarkowanej zastoinową niewydolnością serca, z zatrzymaniem płynów i z obrzękami należy odpowiednio kontrolować i wydawać właściwe zalecenia. Zatrzymanie płynów i obrzęki były zgłaszane w związku z leczeniem NLPZ. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg na dobę) przez długi czas może być związane z niewielkim zwiększeniem ryzyka zakrzepicy tętnic (np. zawał serca lub udar). Stosowanie diklofenaku nie jest na ogół zalecane u pacjentów z rozpoznaną chorobą układu krążenia lub niewyrównanym nadciśnieniem tętniczym. W razie potrzeby pacjentom z rozpoznaną chorobą układu sercowo-naczyniowego, niewyrównanym nadciśnieniem tętniczym lub istotnymi czynnikami ryzyka choroby sercowo-naczyniowej należy podawać diklofenak wyłącznie po dokonaniu wnikliwej oceny i tylko w dawce ≤100 mg na dobę, jeśli leczenie trwa dłużej niż 4 tygodnie (patrz punkt 4.4).
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgSpecjalne środki ostrozności
Ryzyko dla układu sercowo-naczyniowego związane ze stosowaniem diklofenaku może wzrastać wraz ze zwiększaniem dawki i czasu trwania ekspozycji, dlatego należy stosować najmniejszą skuteczną dawkę produktu leczniczego przez możliwie najkrótszy czas. Należy okresowo oceniać zapotrzebowanie pacjenta na leczenie objawowe oraz jego odpowiedź na produkt leczniczy. Diklofenak należy stosować bardzo ostrożnie u pacjentów z istotnymi czynnikami ryzyka zdarzeń dotyczących układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Produkt leczniczy należy stosować możliwie jak najkrócej i w najmniejszej skutecznej dawce dobowej ze względu na możliwość nasilenia ryzyka dotyczącego układu krążenia po zastosowaniu diklofenaku w dużych dawkach i długotrwale. Należy okresowo kontrolować konieczność kontynuacji leczenia objawowego i odpowiedź na leczenie. Pacjenci powinni być czujni wobec przedmiotowych i podmiotowych objawów ciężkich zdarzeń zakrzepowych w tętnicach (np.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgSpecjalne środki ostrozności
bólu w klatce piersiowej, duszności, osłabienia, niewyraźnej mowy), które mogą wystąpić nagle. Należy pouczyć pacjentów o konieczności natychmiastowego zgłoszenia się do lekarza w takim przypadku. Wpływ na wskaźniki hematologiczne Tak jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), podczas długotrwałego stosowania diklofenaku zaleca się kontrolowanie wskaźników hematologicznych. Tak jak inne niesteroidowe leki przeciwzapalne (NLPZ), diklofenak może przemijająco hamować agregację płytek krwi. Należy dokładnie kontrolować pacjentów z zaburzeniami hemostazy. Astma w wywiadzie U pacjentów z astmą, sezonowym alergicznym zapaleniem błony śluzowej nosa, obrzękiem błony śluzowej nosa, (np. polipy nosa), przewlekłą obturacyjną chorobą płuc lub przewlekłymi zakażeniami układu oddechowego (szczególnie z objawami podobnymi do objawów alergicznego nieżytu nosa) częściej niż u innych pacjentów występują zaostrzenia astmy w wyniku zastosowania NLPZ (nietolerancja leków przeciwbólowych), obrzęk Quinckego lub pokrzywka.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgSpecjalne środki ostrozności
Dlatego u tych pacjentów zaleca się szczególną ostrożność (należy umożliwić szybki dostęp do pomocy lekarskiej). Szczególne środki ostrożności należy zachować u pacjentów z alergią na inne substancje, np. z odczynami skórnymi, świądem lub pokrzywką. Osoby w podeszłym wieku Diklofenak należy stosować ostrożnie u osób w podeszłym wieku. U osób w podeszłym wieku i osób z małą masą ciała zaleca się stosowanie najmniejszej skutecznej dawki. Interakcje z niesteroidowymi lekami przeciwzapalnymi (NLPZ) Należy unikać jednoczesnego stosowania produktu leczniczego Diclac 50 i Diclac 100 z ogólnie działającymi NLPZ, w tym selektywnymi inhibitorami cyklooksygenazy-2, ze względu na potencjalne nasilenie działań niepożądanych (patrz punkt 4.5). Maskowanie objawów zakażenia Diklofenak, tak jak inne NLPZ, może maskować objawy zakażenia ze względu na swoje właściwości farmakodynamiczne.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgSpecjalne środki ostrozności
Produkt leczniczy Diclac 50 i Diclac 100 zawiera mniej niż 1 mmol (23 mg) sodu w czopku, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Opisane interakcje uwzględniają obserwacje dotyczące stosowania diklofenaku w czopkach i (lub) w innych postaciach farmaceutycznych. Silne inhibitory CYP2C9 Należy zachować ostrożność podczas przepisywania diklofenaku wraz z silnymi inhibitorami CYP2C9 (takimi jak worykonazol), gdyż w wyniku zahamowania metabolizmu diklofenaku jego stężenie w osoczu oraz ekspozycja na lek może znacznie wzrosnąć. Lit Diklofenak może zwiększać stężenie w osoczu jednocześnie podawanego litu. Zaleca się monitorowanie stężenia litu. Digoksyna Diklofenak podawany jednocześnie z lekami zawierającymi digoksynę może zwiększać jej stężenie w osoczu. Zaleca się monitorowanie stężenia digoksyny. Leki moczopędne i leki zmniejszające ciśnienie krwi Tak jak inne NLPZ, diklofenak może osłabiać działanie przeciwnadciśnieniowe jednocześnie stosowanych leków moczopędnych lub leków zmniejszających ciśnienie tętnicze krwi (tj.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgInterakcje
leki blokujące receptory beta-adrenergiczne, inhibitory ACE). Z powodu zwiększonego ryzyka działania nefrotoksycznego, pacjentów należy odpowiednio nawadniać i okresowo kontrolować czynność nerek po rozpoczęciu leczenia skojarzonego oraz w trakcie jego trwania, szczególnie po zastosowaniu leków moczopędnych i inhibitorów konwertazy angiotensyny. U pacjentów, zwłaszcza w podeszłym wieku, należy regularnie kontrolować ciśnienie tętnicze (patrz punkt 4.4). Cyklosporyna Diklofenak, tak jak inne NLPZ, może zwiększyć nefrotoksyczność cyklosporyny ze względu na wpływ na prostaglandyny nerkowe. Dlatego diklofenak należy podawać w dawkach mniejszych niż u pacjentów nieotrzymujących cyklosporyny. Leki, które mogą wywoływać hiperkaliemię Jednoczesne stosowanie leków oszczędzających potas, cyklosporyny, takrolimusu lub trimetoprimu może być związane ze zwiększeniem stężenia potasu w surowicy, w związku z czym należy regularnie kontrolować stężenie potasu w surowicy (patrz punkt 4.4).
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgInterakcje
Chinolony przeciwbakteryjne Odnotowano pojedyncze przypadki wystąpienia drgawek, które mogły być spowodowane jednoczesnym stosowaniem chinolonów i niesteroidowych leków przeciwzapalnych (NLPZ). Przewidywane interakcje, które należy uwzględnić Niesteroidowe leki przeciwzapalne (NLPZ) i kortykosteroidy Jednoczesne podawanie diklofenaku i innych NLPZ lub kortykosteroidów może zwiększać częstość działań niepożądanych dotyczących przewodu pokarmowego (patrz punkt 4.4). Leki przeciwzakrzepowe i przeciwpłytkowe Należy zachować ostrożność, ze względu na zwiększone ryzyko krwawienia (patrz punkt 4.4). Wprawdzie badania kliniczne nie wskazują, aby diklofenak wpływał na działanie leków przeciwzakrzepowych, jednak donoszono o zwiększonym ryzyku wystąpienia krwotoku u pacjentów przyjmujących jednocześnie diklofenak i leki przeciwzakrzepowe. Pacjentów takich należy uważnie kontrolować.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgInterakcje
Selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI) Jednoczesne stosowanie NLPZ (w tym diklofenaku) i selektywnych inhibitorów wychwytu zwrotnego serotoniny może zwiększyć ryzyko krwawień z przewodu pokarmowego.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na przebieg ciąży i (lub) rozwój zarodka/płodu. Dane z badań epidemiologicznych wskazują na zwiększone ryzyko poronienia, wad rozwojowych serca i wytrzewienia jelit po zastosowaniu inhibitora syntezy prostaglandyn (tj. NLPZ) we wczesnym okresie ciąży. Wartość bezwzględnego ryzyka wystąpienia wad rozwojowych układu sercowo-naczyniowego wzrosła z mniej niż 1% do ok. 1,5%. Wartość ta może wzrosnąć wraz ze zwiększeniem dawki i wydłużeniem okresu leczenia. W badaniach na zwierzętach wykazano, że podawanie inhibitora syntezy prostaglandyn zwiększyło liczbę strat po- i przedimplantacyjnych oraz śmiertelność zarodka i płodu. Dodatkowo, zaobserwowano zwiększenie częstości różnych wad wrodzonych, w tym wad rozwojowych układu sercowo-naczyniowego u zwierząt, którym podawano inhibitor syntezy prostaglandyn w okresie organogenezy. Od 20.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWpływ na płodność, ciążę i laktację
tygodnia ciąży stosowanie diklofenaku może powodować małowodzie wskutek zaburzeń czynności nerek płodu. Może ono wystąpić krótko po rozpoczęciu leczenia i jest zwykle odwracalne po jego przerwaniu. Ponadto, odnotowano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze, z których większość ustąpiła po zaprzestaniu leczenia. W pierwszym i drugim trymestrze ciąży nie należy podawać diklofenaku, chyba że jest to bezwzględnie konieczne. Jeśli diklofenak jest stosowany przez kobietę starającą się o ciążę lub podczas pierwszego i drugiego trymestru ciąży, zastosowana dawka powinna być jak najmniejsza, a czas trwania leczenia jak najkrótszy. Należy rozważyć przedporodowe monitorowanie w kierunku małowodzia i zwężenia przewodu tętniczego po ekspozycji na diklofenak przez kilka dni od 20. tygodnia ciąży. W przypadku stwierdzenia małowodzia lub zwężenia przewodu należy zaprzestać stosowania diklofenaku.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWpływ na płodność, ciążę i laktację
W trzecim trymestrze ciąży Wszystkie inhibitory syntezy prostaglandyn mogą działać na płód w następujący sposób: toksyczne działanie dotyczące płuc i serca (w tym przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne); zaburzenia czynności nerek, które mogą prowadzić do niewydolności nerek z małowodziem (patrz powyżej). U matki i noworodka Podawanie inhibitorów syntezy prostaglandyn pod koniec ciąży może prowadzić do: wydłużenia czasu krwawienia w wyniku działania antyagregacyjnego, które może wystąpić nawet po zastosowaniu bardzo małych dawek; hamowania czynności skurczowej macicy, powodującego opóźnienie lub przedłużanie się porodu. W związku z tym diklofenak jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3). Karmienie piersi? Tak jak inne NLPZ, diklofenak przenika w niewielkich ilościach do mleka kobiet karmiących piersią.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWpływ na płodność, ciążę i laktację
Z tego względu produktu leczniczego Diclac 50 i Diclac 100 nie należy podawać kobietom karmiącym piersią w celu uniknięcia wystąpienia działań niepożądanych u dziecka. Płodność Stosowanie diklofenaku może niekorzystnie wpływać na płodność u kobiet i nie jest ono zalecane u kobiet, które planują ciążę. U kobiet, które mają trudności z zajściem w ciążę lub które są poddawane badaniom w związku z niepłodnością, należy rozważyć odstawienie diklofenaku.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Diklofenak nie wpływa lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane zgłaszane w trakcie badań klinicznych, w raportach spontanicznych lub w doniesieniach literaturowych wymieniono zgodnie z klasyfikacją układów i narządów MedDRA. W każdej z grup działania niepożądane przedstawiono według częstości, począwszy od najczęściej występujących. W obrębie każdej grupy o określonej częstości działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Ponadto, odpowiednia kategoria częstości dla każdego działania niepożądanego podana jest na podstawie następującego schematu: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do < 1/100); rzadko (≥1/10 000 do < 1/1 000); bardzo rzadko (<1/10 000); częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Przedstawione niżej działania niepożądane odnotowano po krótko- lub długotrwałym zastosowaniu diklofenaku w postaci czopków i innych postaci farmaceutycznych.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgDziałania niepożądane
Zaburzenia krwi i układu chłonnego Bardzo rzadko: trombocytopenia, leukopenia, niedokrwistość (w tym niedokrwistość hemolityczna i aplastyczna), agranulocytoza Zaburzenia układu immunologicznego Rzadko: nadwrażliwość, reakcje anafilaktyczne i rzekomoanafilaktyczne (w tym niedociśnienie tętnicze i wstrząs) Bardzo rzadko: obrzęk naczynioruchowy (w tym obrzęk twarzy) Zaburzenia psychiczne Bardzo rzadko: dezorientacja, depresja, bezsenność, koszmary senne, drażliwość, zaburzenia psychotyczne Zaburzenia układu nerwowego Często: ból głowy, zawroty głowy Rzadko: senność Zaburzenia oka Bardzo rzadko: zaburzenia widzenia, niewyraźne widzenie, podwójne widzenie Zaburzenia ucha i błędnika Często: zawroty głowy Bardzo rzadko: szumy uszne, zaburzenia słuchu Zaburzenia serca Niezbyt często: zawał mięśnia sercowego, niewydolność serca, kołatanie serca, ból w klatce piersiowej Częstość nieznana: Zespół Kounisa Zaburzenia naczyniowe Bardzo rzadko: nadciśnienie tętnicze, zapalenie naczyń Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Rzadko: astma (w tym duszność) Bardzo rzadko: zapalenie płuc Zaburzenia żołądka i jelit Często: nudności, wymioty, biegunka, niestrawność, ból brzucha, wzdęcia, zmniejszony apetyt Rzadko: zapalenie błony śluzowej żołądka, krwawienia z przewodu pokarmowego, krwawe wymioty, krwawe biegunka, smoliste stolce, choroba wrzodowa żołądka i (lub) dwunastnicy (z krwawieniem lub bez i z perforacją), zapalenie odbytnicy Bardzo rzadko: zapalenie okrężnicy (także krwotoczne zapalenie okrężnicy oraz zaostrzenie wrzodziejącego zapalenia okrężnicy, choroba Leśniowskiego-Crohna), zaparcie, zapalenie błony śluzowej jamy ustnej (w tym wrzodziejące zapalenie jamy ustnej), zapalenie języka, zaburzenia w obrębie przełyku, błoniaste zwężenie jelit, zapalenie trzustki, zaostrzenie guzków krwawniczych Częstość nieznana: niedokrwienne zapalenie okrężnicy Zaburzenia wątroby i dróg żółciowych Często: zwiększenie aktywności aminotransferaz Rzadko: zapalenie wątroby, żółtaczka, zaburzenia czynności wątroby Bardzo rzadko: piorunujące zapalenie wątroby, martwica wątroby, niewydolność wątroby Zaburzenia skóry i tkanki podskórnej Często: wysypka Rzadko: pokrzywka Bardzo rzadko: wysypka pęcherzowa, wyprysk, rumień, rumień wielopostaciowy, zespół Stevensa-Johnsona, toksyczne martwicze oddzielanie się naskórka (zespół Lyella), złuszczające zapalenie skóry, łysienie, reakcje nadwrażliwości na światło, plamica, choroba Schönleina-Henocha, świąd Zaburzenia nerek i dróg moczowych Bardzo rzadko: ostra niewydolność nerek, krwiomocz, białkomocz, zespół nerczycowy, śródmiąższowe zapalnie nerek, martwica brodawek nerkowych Zaburzenia ogólne i stany w miejscu podania Często: podrażnienie w miejscu podania Rzadko: obrzęk W związku z leczeniem NLPZ zgłaszano występowanie obrzęków, nadciśnienia tętniczego i niewydolności serca.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgDziałania niepożądane
Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg/dobę) i w leczeniu długotrwałym zwiększa ryzyko zakrzepicy tętnic (np. zawał serca lub udar), patrz punkty 4.3 i 4.4. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgPrzedawkowanie
4.9 Przedawkowanie Objawy Brak charakterystycznych objawów klinicznych przedawkowania diklofenaku. Przedawkowanie może wywołać takie objawy, jak wymioty, krwotok z przewodu pokarmowego, biegunka, zawroty głowy, szumy uszne lub drgawki. W przypadku znacznego zatrucia może nastąpić ostra niewydolność nerek i uszkodzenie wątroby. Leczenie przedawkowania Leczenie ostrego zatrucia niesteroidowymi lekami przeciwzapalnymi (NLPZ), w tym diklofenakiem, zasadniczo obejmuje stosowanie środków podtrzymujących czynności życiowe i leczenie objawowe. Leczenie podtrzymujące i objawowe należy zastosować w przypadku takich powikłań, jak znaczne zmniejszenie ciśnienia tętniczego krwi, niewydolność nerek, drgawki, zaburzenia żołądka i jelit oraz zaburzenia oddychania. Wymuszona diureza, dializa lub przetaczanie krwi nie przyspieszają eliminowania NLPZ (w tym diklofenaku) z organizmu ze względu na dużą zdolność wiązania z białkami i rozległy metabolizm.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu octowego. Kod ATC: M01AB05 Mechanizm działania Diklofenak sodowy jest związkiem niesteroidowym o działaniu przeciwreumatycznym, przeciwzapalnym, przeciwbólowym i przeciwgorączkowym. Wykazano doświadczalnie, że w mechanizmie działania diklofenaku istotne znaczenie ma hamowanie biosyntezy prostaglandyn. Prostaglandyny odgrywają zasadniczą rolę w patogenezie procesu zapalnego, bólu i gorączki. In vitro diklofenak sodowy w zakresie stężeń odpowiadających wartościom osiąganym w organizmie ludzkim nie hamuje biosyntezy proteoglikanów w chrząstce. Działanie farmakodynamiczne Działanie lecznicze diklofenaku w chorobach reumatycznych wynika z jego właściwości przeciwzapalnych i przeciwbólowych, które warunkują wyraźne złagodzenie takich objawów klinicznych i subiektywnych, jak ból spoczynkowy, ból podczas ruchu, sztywność poranna i obrzęk stawów oraz poprawę ogólnej sprawności fizycznej.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWłaściwości farmakodynamiczne
W pourazowych lub pooperacyjnych stanach zapalnych diklofenak szybko łagodzi zarówno ból spoczynkowy, jak i ból podczas ruchu oraz zmniejsza obrzęk powstały w wyniku stanu zapalnego i obrzęk powstały w wyniku zranienia. Dane z badań klinicznych wykazały również, że diklofenak wywiera wyraźne działanie przeciwbólowe w umiarkowanych i ciężkich stanach bólowych pochodzenia niereumatycznego. Ponadto, dane z badań klinicznych wykazały, że diklofenak zastosowany w pierwotnym bolesnym miesiączkowaniu łagodzi dolegliwości bólowe. Diclac 50 i Diclac 100 w postaci czopków działa również skutecznie w napadach migreny. Doświadczenie z badań klinicznych z zastosowaniem diklofenaku u dzieci i młodzieży z młodzieńczym reumatoidalnym zapaleniem stawów (MRZS) / młodzieńczym idiopatycznym zapaleniem stawów (MIZS) jest ograniczone.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWłaściwości farmakodynamiczne
W 2-tygodniowym, randomizowanym badaniu z podwójnie ślepą próbą w grupach równoległych z udziałem dzieci z MRZS/MIZS w wieku od 3 do 15 lat, skuteczność i bezpieczeństwo stosowania diklofenaku podawanego codziennie w dawce 2 do 3 mg/kg mc. porównywano z kwasem acetylosalicylowym, ASA (w dawce 50-100 mg/kg mc./dobę) i placebo. Każda z grup obejmowała po 15 pacjentów. Łączna ocena skuteczności leczenia wykazała poprawę u 11 z 15 pacjentów z grupy diklofenaku, u 6 z 12 pacjentów z grupy ASA oraz u 4 z 15 pacjentów z grupy placebo. Różnica ta była statystycznie znamienna (p<0, 05). Liczba bolesnych stawów zmniejszyła się po zastosowaniu diklofenaku i kwasu acetylosalicylowego, a zwiększyła się w grupie placebo. W drugim, randomizowanym, 6-tygodniowym badaniu z podwójnie ślepą próbą w grupach równoległych z udziałem dzieci z MRZS/MIZS w wieku od 4 do 15 lat, skuteczność diklofenaku (w dawce dobowej 2 do 3 mg/kg mc., n=22) była porównywalna ze skutecznością indometacyny (w dawce dobowej 2 do 3 mg/kg mc., n=23).
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Początek wchłaniania diklofenaku podanego w postaci czopków następuje szybko. Jednak szybkość tego procesu jest wolniejsza niż w przypadku podawanych doustnie tabletek dojelitowych (odpornych na działanie soku żołądkowego). Po podaniu czopków w dawce 50 mg maksymalne stężenia w osoczu krwi są osiągane średnio w ciągu 1 godziny, ale maksymalne stężenia na jednostkę dawki stanowią około 2/3 wartości uzyskiwanych po podaniu tabletek dojelitowych. Ponieważ około połowy diklofenaku jest metabolizowane w ciągu jego pierwszego przejścia przez wątrobę (efekt "pierwszego przejścia"), pole pod krzywą zależności stężenia od czasu (AUC) po podaniu doustnym lub doodbytniczym jest w przybliżeniu połową wartości występującej po pozajelitownym podaniu równoważnej dawki. Podczas ponownego podania produktu leczniczego jego farmakokinetyka pozostaje niezmieniona.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWłaściwości farmakokinetyczne
Nie dochodzi do kumulacji produktu leczniczego w organizmie, jeśli zachowane zostaną zalecane przerwy w dawkowaniu. U dzieci po podaniu odpowiedniej dawki (mg/kg mc.) stężenia osiągane w osoczu są porównywalne do stężeń uzyskiwanych u osób dorosłych. Dystrybucja Diklofenak łączy się z białkami osocza w 99,7%, głównie z albuminami (99,4%). Objętość dystrybucji ocenia się na 0,12 do 0,17 l/kg. Diklofenak przenika do płynu maziowego, gdzie maksymalne stężenie występuje po 2 do 4 godzinach od osiągnięcia maksymalnego stężenia w osoczu. Okres półtrwania w fazie eliminacji z płynu maziowego wynosi 3 do 6 godzin. Po 2 godzinach od osiągnięcia wartości maksymalnych w osoczu, wartości stężenia substancji czynnej w płynie maziowym są większe niż w osoczu i pozostają większe aż przez 12 godzin. W jednym przypadku diklofenak został wykryty w niewielkim stężeniu (100 ng/ml) w mleku kobiecym. Szacunkowa ilość spożyta przez karmione piersią niemowlę odpowiada 0,03 mg/kg mc./dawkę dobową.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWłaściwości farmakokinetyczne
Metabolizm Metabolizm diklofenaku obejmuje częściowo glukuronidację niezmienionej cząsteczki, lecz diklofenak podlega przede wszystkim pojedynczej lub wielokrotnej hydroksylacji i metoksylacji, w wyniku czego powstaje kilka pochodnych fenolowych (3'-hydroksy-, 4'-hydroksy-, 5-hydroksy-, 4',5-dwuhydroksy- i 3'-hydroksy-4'-metoksy-diklofenak), z których większość przekształcana jest do glukuronidów. Dwie spośród pochodnych fenolowych wykazują aktywność biologiczną, chociaż znacznie mniejszą niż diklofenak. Eliminacja Całkowity ogólnoustrojowy klirens osoczowy diklofenaku wynosi 263±56 ml/minutę (średnia ± SD). Okres półtrwania w fazie eliminacji w osoczu wynosi 1 do 2 godzin. Cztery metabolity, w tym dwa aktywne, mają również krótki okres półtrwania (1 do 3 godzin). Jeden metabolit, 3'-hydroksy-4'-metoksy-diklofenak, ma znacznie dłuższy okres półtrwania, ale jest praktycznie nieaktywny.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWłaściwości farmakokinetyczne
Około 60% podanej dawki wydalane jest w moczu w postaci sprzężonych z glukuronidami niezmienionych cząsteczek i metabolitów, z których większość również ulega przekształceniu do glukuronidów. Mniej niż 1% podanej dawki ulega wydaleniu w postaci niezmienionej, a pozostała część z kałem w postaci metabolitów związanych z żółcią. Liniowość lub nieliniowość Ilość wchłoniętego diklofenaku jest liniowo zależna od wielkości dawki. Szczególne grupy pacjentów Nie zaobserwowano istotnych, zależnych od wieku różnic we wchłanianiu, metabolizmie lub wydalaniu diklofenaku. U pacjentów z zaburzeniami czynności nerek badania kinetyki pojedynczej dawki z zastosowaniem typowego schematu dawkowania nie wskazują na występowanie kumulacji niezmienionej substancji czynnej. U osób z klirensem kreatyniny <10 ml/minutę stężenia hydroksypochodnych diklofenaku w osoczu obliczone w stanie równowagi dynamicznej są około 4-krotnie większe niż u osób z prawidłową czynnością nerek.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgWłaściwości farmakokinetyczne
Metabolity są jednak ostatecznie wydalane z żółcią. U pacjentów z przewlekłym zapaleniem wątroby lub wyrównaną marskością wątroby kinetyka i metabolizm diklofenaku są takie same, jak u pacjentów bez chorób wątroby.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na reprodukcję i rozwój potomstwa, nie ujawniają żadnego szczególnego zagrożenia dla człowieka. Brak danych pochodzących ze standardowych badań nieklinicznych na zwierzętach, dotyczących wpływu diklofenaku na działanie teratogenne u myszy, szczurów lub królików. Diklofenak nie wpływa na rozród szczurów. Poza minimalnym wpływem na płód w dawce toksycznej dla matki, rozwój przed-, około- i poporodowy potomstwa nie został zaburzony. Podawanie niesteroidowych leków przeciwzapalnych (w tym diklofenaku) hamuje owulację u królików oraz implantację i tworzenie się łożyska u szczurów, a także prowadzi do przedwczesnego zamknięcia przewodu tętniczego u szczurów.
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgPrzedkliniczne dane o bezpieczeństwie
Podanie diklofenaku w dawce toksycznej dla matki wiązało się z dystocją, wydłużeniem ciąży, zmniejszoną przeżywalnością płodów i wewnątrzmacicznym zahamowaniem wzrostu u szczurów. Niewielki wpływ diklofenaku na parametry reprodukcji i porodu, jak również zwężenie przewodu tętniczego w macicy, są farmakologicznymi konsekwencjami tej klasy inhibitorów syntezy prostaglandyn (patrz punkty 4.3 i 4.6).
- CHPL leku Diclac 50, czopki doodbytnicze, 50 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Tłuszcz stały 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC, chronić przed wilgocią. 6.5 Rodzaj i zawartość opakowania Blistry PVC/PE w tekturowym pudełku. Opakowanie zawiera 10 czopków. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Diclac 75 Duo, 75 mg, tabletki o zmodyfikowanym uwalnianiu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka o zmodyfikowanym uwalnianiu zawiera 75 mg diklofenaku sodowego (Diclofenacum natricum) w postaci szybko uwalnianej (12,5 mg) i wolno uwalnianej (62,5 mg). Substancja pomocnicza o znanym działaniu: Jedna tabletka o zmodyfikowanym uwalnianiu zawiera 41,75 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka o zmodyfikowanym uwalnianiu.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgWskazania do stosowania
4.1 Wskazania do stosowania Leczenie: zapalennych lub zwyrodnieniowych postaci choroby reumatycznej: reumatoidalnego zapalenia stawów, zesztywniającego zapalenia stawów kręgosłupa, choroby zwyrodnieniowej stawów, zapalenia stawów kręgosłupa, zespołów bólowych związanych ze zmianami w kręgosłupie, reumatyzmu pozastawowego; bólów spowodowanych pourazowymi i pooperacyjnymi stanami zapalnymi i obrzękami, np. po zabiegach stomatologicznych lub ortopedycznych; stanów bólowych i zapalnych w ginekologii, np. pierwotnego bolesnego miesiączkowania lub zapalenia przydatków.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Ogólnie zaleca się indywidualne ustalanie dawkowania produktu leczniczego. Występowanie działań niepożądanych można ograniczyć, stosując produkt w najmniejszej skutecznej dawce i nie dłużej niż to koniecznie do kontrolowania objawów (patrz punkt 4.4). Ogólna grupa docelowa Dorośli 75 mg diklofenaku sodowego (1 tabletka Diclac 75 Duo) jeden raz na dobę. W razie konieczności dawkê można zwiększyć do 150 mg na dobę. Nie należy stosować dawki dobowej większej niż 150 mg. Jeśli objawy choroby są nasilone w nocy lub rano, zaleca się przyjmowanie produktu leczniczego Diclac 75 Duo wieczorem. W łagodniejszych przypadkach, także w długotrwałym stosowaniu, dawkę 75 mg uważa się za wystarczającą. Szczególne grupy pacjentów Dzieci i młodzież Ze względu na wielkość dawki, stosowanie produktu leczniczego Diclac 75 Duo nie jest zalecane u dzieci i młodzieży.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgDawkowanie
Osoby w podeszłym wieku (powyżej 65 lat) Zmiana dawki początkowej u osób w podeszłym wieku nie jest konieczna (patrz punkt 4.4). Rozpoznana choroba układu krążenia lub istotne sercowo-naczyniowe czynniki ryzyka Leczenie produktem leczniczym Diclac 75 Duo nie jest na ogół zalecane u pacjentów z rozpoznaną chorobą układu krążenia lub niewyrównanym nadciśnieniem tętniczym. W razie potrzeby pacjenci z rozpoznaną chorobą układu sercowo-naczyniowego, niewyrównanym nadciśnieniem tętniczym lub istotnymi czynnikami ryzyka choroby sercowo-naczyniowej powinni być leczeni produktem leczniczym Diclac 75 Duo wyłącznie po dokonaniu wnikliwej oceny i tylko dawkami ≤100 mg na dobę, jeśli leczenie trwa dłużej niż 4 tygodnie (patrz punkt 4.4). Zaburzenia czynności nerek Stosowanie produktu leczniczego Diclac 75 Duo u pacjentów z niewydolnością nerek jest przeciwwskazane (patrz punkt 4.3).
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgDawkowanie
Nie przeprowadzono specjalnych badań u pacjentów z zaburzeniami czynności nerek, dlatego nie można sformułować odpowiednich zaleceń dotyczących dostosowania dawki. U pacjentów z lekkimi lub umiarkowanymi zaburzeniami czynności nerek zaleca się zachowanie ostrożności podczas podawania produktu leczniczego Diclac 75 Duo (patrz punkt 4.4). Zaburzenia czynności wątroby Stosowanie produktu leczniczego Diclac 75 Duo u pacjentów z niewydolnością wątroby jest przeciwwskazane (patrz punkt 4.3). Nie przeprowadzono specjalnych badań u pacjentów z zaburzeniami czynności wątroby, dlatego nie można sformułować odpowiednich zaleceń dotyczących dostosowania dawki. U pacjentów z lekkimi lub umiarkowanymi zaburzeniami czynności wątroby zaleca się zachowanie ostrożności podczas podawania produktu leczniczego Diclac 75 Duo (patrz punkt 4.4). Sposób podawania Tabletki należy połykać w całości, popijając wodą, najlepiej podczas posiłku. Tabletki nie należy dzielić ani żuć.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na diklofenak lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Czynna lub podawana w wywiadzie choroba wrzodowa żołądka i (lub) dwunastnicy, krwawienie lub perforacja (patrz punkt 4.4). Podawane w wywiadzie krwawienie z przewodu pokarmowego lub perforacja związane z wcześniejszym leczeniem niesteroidowymi lekami przeciwzapalnymi (NLPZ). Czynna lub podawana w wywiadzie nawracająca choroba wrzodowa i (lub) krwotok (co najmniej dwa odrębne przypadki potwierdzonego owrzodzenia lub krwawienia). Ostatni trymestr ciąży (patrz punkt 4.6). Niewydolność wątroby. Niewydolność nerek. Stwierdzona zastoinowa niewydolność serca (klasa II–IV wg NYHA), choroba niedokrwienna serca, choroba naczyń obwodowych i (lub) choroba naczyń mózgowych. Podobnie jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), nie należy stosować produktu leczniczego Diclac 75 Duo u osób, u których podanie kwasu acetylosalicylowego lub innych NLPZ może być przyczyną wystąpienia astmy, obrzęku naczynioruchowego, pokrzywki lub ostrego zapalenia błony śluzowej nosa (tj.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgPrzeciwwskazania
nadwrażliwości krzyżowej na NLPZ), patrz punkty 4.4 i 4.8.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ogólne Przyjmowanie produktu leczniczego w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz wpływ na przewód pokarmowy i układ krążenia poniżej). Wpływ na przewód pokarmowy Krwawienie, owrzodzenie lub perforacja przewodu pokarmowego, które mogą zakończyć się zgonem, raportowane w przypadku wszystkich NLPZ, w tym diklofenaku, mogą wystąpić w każdym okresie leczenia, z objawami poprzedzającymi lub bez, i niezależnie od ciężkich powikłań dotyczących przewodu pokarmowego w wywiadzie. Powikłania te są bardziej niebezpieczne u osób w podeszłym wieku. Jeśli u pacjenta wystąpi krwawienie lub owrzodzenie przewodu pokarmowego, stosowanie produktu leczniczego Diclac 75 Duo należy przerwać.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgSpecjalne środki ostrozności
Tak jak w przypadku innych NLPZ, w tym diklofenaku, u pacjentów z objawami wskazującymi na zaburzenia żołądka i jelit lub z wywiadem sugerującym chorobę wrzodową żołądka i (lub) dwunastnicy, krwawienia lub perforację, niezbędny jest ścisły nadzór lekarski. Produkt leczniczy Diclac 75 Duo należy zalecać tym pacjentom szczególnie ostrożnie (patrz punkt 4.8). Ryzyko krwawienia z przewodu pokarmowego jest większe w przypadku zwiększania dawek NLPZ i u pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie, szczególnie gdy przebiegała z krwotokami lub perforacją oraz u pacjentów w podeszłym wieku. U osób w podeszłym wieku, zwiększona jest częstość działań niepożądanych związanych ze stosowaniem NLPZ, zwłaszcza krwawienia i perforacji, które mogą być śmiertelne. W celu zmniejszenia ryzyka działania toksycznego na układ pokarmowy u pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie (zwłaszcza powikłaną krwotokami lub perforacją) oraz u pacjentów w podeszłym wieku należy rozpoczynać i kontynuować leczenie z zastosowaniem najmniejszych skutecznych dawek.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgSpecjalne środki ostrozności
U tych pacjentów, jak również u pacjentów, u których konieczne jest jednoczesne stosowanie produktów leczniczych zawierających małe dawki kwasu acetylosalicylowego lub innych produktów leczniczych mogących zwiększyć ryzyko powikłań żołądkowo-jelitowych, należy rozważyć leczenie skojarzone z lekami osłonowymi (np. inhibitorami pompy protonowej lub mizoprostolem). Pacjenci z zaburzeniami żołądka i jelit w wywiadzie, szczególnie pacjenci w podeszłym wieku, powinni informować lekarza o jakichkolwiek nietypowych objawach brzusznych (szczególnie o krwawieniach z przewodu pokarmowego). Należy zachować ostrożność u pacjentów otrzymujących jednocześnie leki, które mogą powodować zwiększenie ryzyka powstania owrzodzenia lub krwawienia, takie jak kortykosteroidy działające ogólnoustrojowo, leki przeciwzakrzepowe, leki przeciwpłytkowe, lub selektywne inhibitory wychwytu zwrotnego serotoniny (patrz punkt 4.5).
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgSpecjalne środki ostrozności
Pacjenci z wrzodziejącym zapaleniem okrężnicy lub z chorobą Leśniowskiego-Crohna powinni być pod ścisłą kontrolą lekarską, ze względu na możliwość zaostrzenia ogólnego stanu (patrz punkt 4.8). Wpływ na czynność wątroby Pacjenci z zaburzeniami czynności wątroby powinni przyjmować Diclac 75 Duo pod ścisłym nadzorem lekarza ze względu na możliwość pogorszenia stanu ogólnego. Tak jak niesteroidowe leki przeciwzapalne (NLPZ), diklofenak może zwiększać aktywność jednego lub więcej enzymów wątrobowych. W trakcie długotrwałego leczenia diklofenakiem należy regularnie kontrolować czynności wątroby. Stosowanie diklofenaku należy przerwać, jeśli nieprawidłowe wyniki badań czynności wątroby utrzymują się lub pogarszają, a także gdy wystąpią kliniczne oznaki lub objawy wskazujące na zaburzenia czynności wątroby oraz inne objawy (np. eozynofilia, wysypka itp.). Zapalenie wątroby spowodowane stosowaniem diklofenaku może wystąpić niepoprzedzone objawami prodromalnymi.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgSpecjalne środki ostrozności
Należy zachować ostrożność stosując Diclac 75 Duo u pacjentów z porfirią wątrobową, ponieważ może wywołać napad choroby. Wpływ na czynność nerek Podczas leczenia NLPZ, w tym diklofenakiem, odnotowano przypadki zatrzymywania płynów i powstawania obrzęków, dlatego szczególną ostrożność należy zachować u pacjentów z zaburzeniami czynności serca lub nerek, z nadciśnieniem tętniczym w wywiadzie, u osób w podeszłym wieku, u pacjentów jednocześnie otrzymujących leki moczopędne lub leki znacząco wpływające na czynność nerek oraz pacjentów z nadmierną utratą płynu pozakomórkowego o różnej etiologii, np. w fazie około- lub pooperacyjnej po dużych zabiegach chirurgicznych (patrz punkt 4.3). Podczas stosowania diklofenaku zaleca się u tych pacjentów kontrolowanie czynności nerek. Odstawienie produktu leczniczego powoduje zwykle powrót do stanu sprzed leczenia.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgSpecjalne środki ostrozności
Wpływ na skórę Bardzo rzadko po zastosowaniu NLPZ obserwowano ciężkie reakcje skórne (niektóre zakończone zgonem), w tym złuszczające zapalenie skóry, zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka (patrz punkt 4.8). Ryzyko wystąpienia tych ciężkich reakcji jest największe na początku leczenia, w większości przypadków w pierwszym miesiącu stosowania. Produkt leczniczy należy odstawić natychmiast po wystąpieniu pierwszych objawów takich jak wysypka skórna, uszkodzenie błony śluzowej lub inne objawy nadwrażliwości. Tak jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), po podaniu diklofenaku rzadko mogą wystąpić reakcje alergiczne, w tym reakcje anafilaktyczne i rzekomoanafilaktyczne, nawet wtedy, gdy ten produkt leczniczy nie był wcześniej stosowany.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgSpecjalne środki ostrozności
Wpływ na układ krążenia i naczynia zaopatrujące mózg Pacjentów z nadciśnieniem tętniczym w wywiadzie lub łagodną do umiarkowanej zastoinową niewydolnością serca, z zatrzymaniem płynów i z obrzękami należy odpowiednio kontrolować i wydawać właściwe zalecenia. Zatrzymanie płynów i obrzęki były zgłaszane w związku z leczeniem NLPZ. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg na dobę) przez długi czas może być związane z niewielkim zwiększeniem ryzyka zakrzepicy tętnic (np. zawał serca lub udar). Stosowanie diklofenaku nie jest na ogół zalecane u pacjentów z rozpoznaną chorobą układu krążenia lub niewyrównanym nadciśnieniem tętniczym. W razie potrzeby pacjentom z rozpoznaną chorobą układu sercowo-naczyniowego, niewyrównanym nadciśnieniem tętniczym lub istotnymi czynnikami ryzyka choroby sercowo-naczyniowej należy podawać diklofenak wyłącznie po dokonaniu wnikliwej oceny i tylko w dawce ≤100 mg na dobę, jeśli leczenie trwa dłużej niż 4 tygodnie (patrz punkt 4.4).
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgSpecjalne środki ostrozności
Ryzyko dla układu sercowo-naczyniowego związane ze stosowaniem diklofenaku może wzrastać wraz ze zwiększaniem dawki i czasu trwania ekspozycji, dlatego należy stosować najmniejszą skuteczną dawkę produktu leczniczego przez możliwie najkrótszy czas. Należy okresowo oceniać zapotrzebowanie pacjenta na leczenie objawowe oraz jego odpowiedź na produkt leczniczy. Diklofenak należy stosować bardzo ostrożnie u pacjentów z istotnymi czynnikami ryzyka zdarzeń dotyczących układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Produkt leczniczy należy stosować możliwie jak najkrócej i w najmniejszej skutecznej dawce dobowej ze względu na możliwość nasilenia ryzyka dotyczącego układu krążenia po zastosowaniu diklofenaku w dużych dawkach i długotrwale. Należy okresowo kontrolować konieczność kontynuacji leczenia objawowego i odpowiedź na leczenie. Pacjenci powinni być czujni wobec przedmiotowych i podmiotowych objawów ciężkich zdarzeń zakrzepowych w tętnicach (np.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgSpecjalne środki ostrozności
bólu w klatce piersiowej, duszności, osłabienia, niewyraźnej mowy), które mogą wystąpić nagle. Należy pouczyć pacjentów o konieczności natychmiastowego zgłoszenia się do lekarza w takim przypadku. Wpływ na wskaźniki hematologiczne Tak jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), podczas długotrwałego stosowania diklofenaku zaleca się kontrolowanie wskaźników hematologicznych. Tak jak inne niesteroidowe leki przeciwzapalne (NLPZ), diklofenak może przemijająco hamować agregację płytek krwi. Należy dokładnie kontrolować pacjentów z zaburzeniami hemostazy. Astma w wywiadzie U pacjentów z astmą, sezonowym alergicznym zapaleniem błony śluzowej nosa, obrzękiem błony śluzowej nosa, (np. polipy nosa), przewlekłą obturacyjną chorobą płuc lub przewlekłymi zakażeniami układu oddechowego (szczególnie z objawami podobnymi do objawów alergicznego nieżytu nosa) częściej niż u innych pacjentów występują zaostrzenia astmy w wyniku zastosowania NLPZ (nietolerancja leków przeciwbólowych), obrzęk Quinckego lub pokrzywka.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgSpecjalne środki ostrozności
Dlatego u tych pacjentów zaleca się szczególną ostrożność (należy umożliwić szybki dostęp do pomocy lekarskiej). Szczególne środki ostrożności należy zachować u pacjentów z alergią na inne substancje, np. z odczynami skórnymi, świądem lub pokrzywką. Osoby w podeszłym wieku Diklofenak należy stosować ostrożnie u osób w podeszłym wieku. U osób w podeszłym wieku i u osób z małą masą ciała zaleca się stosowanie najmniejszej skutecznej dawki. Interakcje z niesteroidowymi lekami przeciwzapalnymi (NLPZ) Należy unikać jednoczesnego stosowania produktu leczniczego Diclac 75 Duo z ogólnie działającymi NLPZ, w tym selektywnymi inhibitorami cyklooksygenazy-2, ze względu na potencjalne nasilenie działań niepożądanych (patrz punkt 4.5). Maskowanie objawów zakażenia Diklofenak, tak jak inne NLPZ, może maskować objawy zakażenia ze względu na swoje właściwości farmakodynamiczne.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgSpecjalne środki ostrozności
Produkt leczniczy zawiera laktozę i z tego powodu nie powinien być stosowany u pacjentów z rzadko występującą, dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy. Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu w tabletce, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Opisane interakcje uwzględniają obserwacje dotyczące stosowania diklofenaku w tabletkach o zmodyfikowanym uwalnianiu i (lub) w innych postaciach farmaceutycznych. Silne inhibitory CYP2C9 Należy zachować ostrożność podczas przepisywania diklofenaku wraz z silnymi inhibitorami CYP2C9 (takimi jak worykonazol), gdyż w wyniku zahamowania metabolizmu diklofenaku jego stężenie w osoczu oraz ekspozycja na lek może znacznie wzrosnąć. Lit Diklofenak może zwiększać stężenie w osoczu jednocześnie podawanego litu. Zaleca się monitorowanie stężenia litu. Digoksyna Diklofenak podawany jednocześnie z lekami zawierającymi digoksynę może zwiększać jej stężenie w osoczu. Zaleca się monitorowanie stężenia digoksyny. Leki moczopędne i leki zmniejszające ciśnienie krwi Tak jak inne NLPZ, diklofenak może osłabiać działanie przeciwnadciśnieniowe jednocześnie stosowanych leków moczopędnych lub leków zmniejszających ciśnienie tętnicze krwi (tj.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgInterakcje
leki blokujące receptory beta-adrenergiczne, inhibitory ACE). Z powodu zwiększonego ryzyka działania nefrotoksycznego, pacjentów należy odpowiednio nawadniać i okresowo kontrolować czynność nerek po rozpoczęciu leczenia skojarzonego oraz w trakcie jego trwania, szczególnie po zastosowaniu leków moczopędnych i inhibitorów konwertazy angiotensyny. U pacjentów, zwłaszcza w podeszłym wieku, należy regularnie kontrolować ciśnienie tętnicze (patrz punkt 4.4). Cyklosporyna Diklofenak, tak jak inne NLPZ, może zwiększyć nefrotoksyczność cyklosporyny ze względu na wpływ na prostaglandyny nerkowe. Dlatego diklofenak należy podawać w dawkach mniejszych niż u pacjentów nieotrzymujących cyklosporyny. Leki, które mogą wywoływać hiperkaliemię Jednoczesne stosowanie leków oszczędzających potas, cyklosporyny, takrolimusu lub trimetoprimu może być związane ze zwiększeniem stężenia potasu w surowicy, w związku z czym należy regularnie kontrolować stężenie potasu w surowicy (patrz punkt 4.4).
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgInterakcje
Chinolony przeciwbakteryjne Odnotowano pojedyncze przypadki wystąpienia drgawek, które mogły być spowodowane jednoczesnym stosowaniem chinolonów i niesteroidowych leków przeciwzapalnych (NLPZ). Przewidywane interakcje, które należy uwzględnić Niesteroidowe leki przeciwzapalne (NLPZ) i kortykosteroidy Jednoczesne podawanie diklofenaku i innych NLPZ lub kortykosteroidów może zwiększać częstość działań niepożądanych dotyczących przewodu pokarmowego (patrz punkt 4.4). Leki przeciwzakrzepowe i przeciwpłytkowe Należy zachować ostrożność, ze względu na zwiększone ryzyko krwawienia (patrz punkt 4.4). Wprawdzie badania kliniczne nie wskazują, aby diklofenak wpływał na działanie leków przeciwzakrzepowych, jednak donoszono o zwiększonym ryzyku wystąpienia krwotoku u pacjentów przyjmujących jednocześnie diklofenak i leki przeciwzakrzepowe. Pacjentów takich należy uważnie kontrolować.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgInterakcje
Selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI) Jednoczesne stosowanie NLPZ (w tym diklofenaku) i selektywnych inhibitorów wychwytu zwrotnego serotoniny może zwiększyć ryzyko krwawień z przewodu pokarmowego. Leki przeciwcukrzycowe Badania kliniczne wykazały, że diklofenak można podawać jednocześnie z doustnymi lekami przeciwcukrzycowymi bez wpływu na ich działanie kliniczne. W pojedynczych przypadkach obserwowano jednak zarówno działanie hipoglikemizujące, jak i hiperglikemizujące, które spowodowało konieczność zmiany dawkowania leków przeciwcukrzycowych w trakcie leczenia diklofenakiem. Z tego względu podczas jednoczesnego leczenia konieczne jest kontrolowanie stężenia glukozy we krwi. Fenytoina Podczas stosowania fenytoiny razem z diklofenakiem należy monitorować stężenie fenytoiny w osoczu ze względu na spodziewane zwiększenie ekspozycji na fenytoinę.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgInterakcje
Metotreksat Diklofenak może hamować klirens nerkowy metotreksatu, zwiększając przez to jego stężenie we krwi i działanie toksyczne. Zaleca się ostrożność podczas stosowania niesteroidowych leków przeciwzapalnych (w tym diklofenaku) w czasie krótszym niż 24 godziny, przed lub po leczeniu metotreksatem.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na przebieg ciąży i (lub) rozwój zarodka/płodu. Dane z badań epidemiologicznych wskazują na zwiększone ryzyko poronienia, wad rozwojowych serca i wytrzewienia jelit po zastosowaniu inhibitora syntezy prostaglandyn (tj. NLPZ) we wczesnym okresie ciąży. Wartość bezwzględnego ryzyka wystąpienia wad rozwojowych układu sercowo-naczyniowego wzrosła z mniej niż 1% do ok. 1,5%. Wartość ta może wzrosnąć wraz ze zwiększeniem dawki i wydłużeniem okresu leczenia. W badaniach na zwierzętach wykazano, że podawanie inhibitora syntezy prostaglandyn zwiększyło liczbę strat po- i przedimplantacyjnych oraz śmiertelność zarodka i płodu. Dodatkowo, zaobserwowano zwiększenie częstości różnych wad wrodzonych, w tym wad rozwojowych układu sercowo-naczyniowego u zwierząt, którym podawano inhibitor syntezy prostaglandyn w okresie organogenezy. Od 20.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgWpływ na płodność, ciążę i laktację
tygodnia ciąży stosowanie diklofenaku może powodować małowodzie wskutek zaburzeń czynności nerek płodu. Może ono wystąpić krótko po rozpoczęciu leczenia i jest zwykle odwracalne po jego przerwaniu. Ponadto, odnotowano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze, z których w większość ustąpiła po zaprzestaniu leczenia. W pierwszym i drugim trymestrze ciąży nie należy podawać diklofenaku, chyba że jest to bezwzględnie konieczne. Jeśli diklofenak jest stosowany przez kobietę starającą się o ciążę lub podczas pierwszego i drugiego trymestru ciąży, zastosowana dawka powinna być jak najmniejsza, a czas trwania leczenia jak najkrótszy. Należy rozważyć przedporodowe monitorowanie w kierunku małowodzia i zwężenia przewodu tętniczego po ekspozycji na diklofenak przez kilka dni od 20. tygodnia ciąży. W przypadku stwierdzenia małowodzia lub zwężenia przewodu należy zaprzestać stosowania diklofenaku.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgWpływ na płodność, ciążę i laktację
W trzecim trymestrze ciąży Wszystkie inhibitory syntezy prostaglandyn mogą działać na płód w następujący sposób: toksyczne działanie dotyczące płuc i serca (w tym przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne); zaburzenia czynności nerek, które mogą prowadzić do niewydolności nerek z małowodziem (patrz powyżej). U matki i noworodka Podawanie inhibitorów syntezy prostaglandyn pod koniec ciąży może prowadzić do: wydłużenia czasu krwawienia w wyniku działania antyagregacyjnego, które może wystąpić nawet po zastosowaniu bardzo małych dawek; zahamowania czynności skurczowej macicy, powodującego opóźnienie lub przedłużanie się porodu. W związku z tym diklofenak jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3). Karmienie piersi? Tak jak inne NLPZ, diklofenak przenika w niewielkich ilościach do mleka kobiet karmiących piersią.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgWpływ na płodność, ciążę i laktację
Z tego względu produktu leczniczego Diclac 75 Duo nie należy podawać kobietom karmiącym piersią w celu uniknięcia wystąpienia działań niepożądanych u dziecka. Płodność Stosowanie diklofenaku może niekorzystnie wpływać na płodność u kobiet i nie jest ono zalecane u kobiet, które planują ciążę. U kobiet, które mają trudności z zajściem w ciążę lub które są poddawane badaniom w związku z niepłodnością, należy rozważyć odstawienie diklofenaku.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Diklofenak nie wpływa lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane zgłaszane w trakcie badań klinicznych, w raportach spontanicznych lub w doniesieniach literaturowych wymieniono zgodnie z klasyfikacją układów i narządów MedDRA. W każdej z grup działania niepożądane przedstawiono według częstości, począwszy od najczęściej występujących. W obrębie każdej grupy o określonej częstości działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Ponadto, odpowiednia kategoria częstości dla każdego działania niepożądanego podana jest na podstawie następującego schematu: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do < 1/100); rzadko (≥1/10 000 do < 1/1 000); bardzo rzadko (<1/10 000); częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Przedstawione niżej działania niepożądane dotyczą diklofenaku w postaci tabletek o zmodyfikowanym uwalnianiu i innych postaci diklofenaku, stosowanych krótko- lub długotrwale.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgDziałania niepożądane
Zaburzenia krwi i układu chłonnego Bardzo rzadko: trombocytopenia, leukopenia, niedokrwistość (w tym niedokrwistość hemolityczna i aplastyczna), agranulocytoza Zaburzenia układu immunologicznego Rzadko: nadwrażliwość, reakcje anafilaktyczne i rzekomoanafilaktyczne (w tym niedociśnienie tętnicze i wstrząs) Bardzo rzadko: obrzęk naczynioruchowy (w tym obrzęk twarzy) Zaburzenia psychiczne Bardzo rzadko: dezorientacja, depresja, bezsenność, koszmary senne, drażliwość, zaburzenia psychotyczne Zaburzenia układu nerwowego Często: ból głowy, zawroty głowy Rzadko: senność Bardzo rzadko: parestezje, zaburzenia pamięci, drgawki, lęk, drżenie mięśni, jałowe zapalenie opon mózgowych, zaburzenia smaku, udar naczyniowy mózgu Zaburzenia oka Bardzo rzadko: zaburzenia widzenia, niewyraźne widzenie, podwójne widzenie Zaburzenia ucha i błędnika Często: zawroty głowy Bardzo rzadko: szumy uszne, zaburzenia słuchu Zaburzenia serca Niezbyt często: zawał mięśnia sercowego, niewydolność serca, kołatanie serca, ból w klatce piersiowej Częstość nieznana: Zespół Kounisa Zaburzenia naczyniowe Bardzo rzadko: nadciśnienie tętnicze, zapalenie naczyń Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Rzadko: astma (w tym duszność) Bardzo rzadko: zapalenie płuc Zaburzenia żołądka i jelit Często: nudności, wymioty, biegunka, niestrawność, ból brzucha, wzdęcia, zmniejszony apetyt Rzadko: zapalenie błony śluzowej żołądka, krwawienia z przewodu pokarmowego, krwawe wymioty, krwawe biegunka, smoliste stolce, choroba wrzodowa żołądka i (lub) dwunastnicy (z krwawieniem lub bez i z perforacją), zapalenie odbytnicy Bardzo rzadko: zapalenie okrężnicy (także krwotoczne zapalenie okrężnicy oraz zaostrzenie wrzodziejącego zapalenia okrężnicy, choroba Leśniowskiego-Crohna), zaparcie, zapalenie błony śluzowej jamy ustnej (w tym wrzodziejące zapalenie jamy ustnej), zapalenie języka, zaburzenia w obrębie przełyku, błoniaste zwężenie jelit, zapalenie trzustki, zaostrzenie guzków krwawniczych Częstość nieznana: niedokrwienne zapalenie okrężnicy Zaburzenia wątroby i dróg żółciowych Często: zwiększenie aktywności aminotransferaz Rzadko: zapalenie wątroby, żółtaczka, zaburzenia czynności wątroby Bardzo rzadko: piorunujące zapalenie wątroby, martwica wątroby, niewydolność wątroby Zaburzenia skóry i tkanki podskórnej Często: wysypka Rzadko: pokrzywka Bardzo rzadko: wysypka pęcherzowa, wyprysk, rumień, rumień wielopostaciowy, zespół Stevensa-Johnsona, toksyczne martwicze oddzielanie się naskórka (zespół Lyella), złuszczające zapalenie skóry, łysienie, reakcje nadwrażliwości na światło, plamica, choroba Schönleina-Henocha, świąd Zaburzenia nerek i dróg moczowych Bardzo rzadko: ostra niewydolność nerek, krwiomocz, białkomocz, zespół nerczycowy, śródmiąższowe zapalnie nerek, martwica brodawek nerkowych Zaburzenia ogólne i stany w miejscu podania Rzadko: obrzęk W związku z leczeniem NLPZ zgłaszano występowanie obrzęków, nadciśnienia tętniczego i niewydolności serca.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgDziałania niepożądane
Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg/dobę) i w leczeniu długotrwałym zwiększa ryzyko zakrzepicy tętnic (np. zawał serca lub udar) (patrz punkty 4.3 i 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgPrzedawkowanie
4.9 Przedawkowanie Objawy Brak charakterystycznych objawów klinicznych przedawkowania diklofenaku. Przedawkowanie może wywołać takie objawy, jak wymioty, krwotok z przewodu pokarmowego, biegunka, zawroty głowy, szumy uszne lub drgawki. W przypadku znacznego zatrucia może nastąpić ostra niewydolność nerek i uszkodzenie wątroby. Leczenie przedawkowania Leczenie ostrego zatrucia niesteroidowymi lekami przeciwzapalnymi (NLPZ), w tym diklofenakiem, zasadniczo obejmuje stosowanie środków podtrzymujących czynności życiowe i leczenie objawowe. Leczenie podtrzymujące i objawowe należy zastosować w przypadku takich powikłań, jak znaczne zmniejszenie ciśnienia tętniczego krwi, niewydolność nerek, drgawki, zaburzenia żołądka i jelit oraz zaburzenia oddychania. Wymuszona diureza, dializa lub przetaczanie krwi nie przyspieszają eliminowania NLPZ (w tym diklofenaku) z organizmu ze względu na dużą zdolność wiązania z białkami i rozległy metabolizm.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgPrzedawkowanie
Po przyjęciu potencjalnie toksycznej dawki należy rozważyć podanie węgla aktywnego i opróżnienie żołądka (np. sprowokowanie wymiotów, płukanie żołądka).
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu octowego. Kod ATC: M01AB05 Mechanizm działania Diklofenak sodowy jest związkiem niesteroidowym o działaniu przeciwreumatycznym, przeciwzapalnym, przeciwbólowym i przeciwgorączkowym. Wykazano doświadczalnie, że w mechanizmie działania diklofenaku istotne znaczenie ma hamowanie biosyntezy prostaglandyn. Prostaglandyny odgrywają zasadniczą rolę w patogenezie procesu zapalnego, bólu i gorączki. In vitro diklofenak sodowy w zakresie stężeń odpowiadających wartościom osiąganym w organizmie ludzkim nie hamuje biosyntezy proteoglikanów w chrząstce. Działanie farmakodynamiczne Działanie terapeutyczne diklofenaku w chorobach reumatycznych wynika z jego właściwości przeciwzapalnych i przeciwbólowych, które warunkują wyraźne złagodzenie objawów przedmiotowych i podmiotowych, takich jak ból spoczynkowy, ból podczas ruchu, sztywność poranna i obrzęk stawów oraz poprawę ogólnej sprawności fizycznej.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgWłaściwości farmakodynamiczne
W pourazowych lub pooperacyjnych stanach zapalnych diklofenak szybko łagodzi zarówno ból spoczynkowy jak i ból podczas ruchu oraz zmniejsza obrzęk powstały w wyniku stanu zapalnego i obrzęk powstały w wyniku zranienia. Produkt leczniczy Diclac 75 Duo jest wskazany dla pacjentów, dla których dawka 75 mg jest odpowiednia. Możliwość stosowania produktu leczniczego w postaci jednorazowej dawki dobowej jest udogodnieniem długotrwałego leczenia i pozwala uniknąć błędów w dawkowaniu. Produkt leczniczy Diclac 75 Duo pozwala na zwiększenie dobowej dawki do 150 mg, w dwóch dawkach po 75 mg na dobę.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Tabletki Diclac 75 Duo składają się z dwóch warstw. Warstwa różowa (tabletka zwykła) zawiera szybko uwalnianą dawkę inicjującą, która stanowi 1/6 dawki całkowitej. Pozostała część substancji czynnej znajduje się w warstwie białej (tabletka o zmodyfikowanym uwalnianiu) i stanowi 5/6 dawki całkowitej. Z tej części tabletki substancja czynna leku uwalnia się powoli. Większość substancji czynnej z warstwy o szybkim uwalnianiu wchłania się w żołądku, a z warstwy o zmodyfikowanym uwalnianiu w jelicie cienkim. Nerkowe wchłanianie zwrotne diklofenaku w formie niezmienionej i jego hydroksylowych metabolitów wskazuje, że taka sama ilość diklofenaku jest uwalniana i wchłaniana z produktu leczniczego o zmodyfikowanym uwalnianiu, jak i z tabletek dojelitowych. Jednak dostępność biologiczna diklofenaku z tabletki o zmodyfikowanym uwalnianiu stanowi przeciętnie 82% dostępności leku w postaci tabletek dojelitowych (prawdopodobnie na skutek efektu „pierwszego przejścia”).
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgWłaściwości farmakokinetyczne
Ze względu na wolniejsze uwalnianie substancji czynnej z tabletek o zmodyfikowanym uwalnianiu, osiągane stężenia maksymalne są mniejsze od stężeń uzyskiwanych po podaniu tabletek dojelitowych. Spożycie pokarmu nie ma istotnego klinicznie wpływu na wchłanianie i dostępność biologiczną leku. Częstość podawania produktu leczniczego Diclac 75 Duo jest uzasadniona uwalnianiem diklofenaku z tabletek: Czas [h] % uwolnionej substancji czynnej 1/4 10% 1 20% 2 30% 4 50% 8 70-80% 10 90% Jeśli to konieczne, po 12 godzinach można podać kolejną tabletkę Diclac 75 Duo. Ilość wchłoniętego leku wykazuje liniową zależność od dawki. Ponieważ około połowy diklofenaku jest metabolizowane w ciągu jego pierwszego przejścia przez wątrobę (efekt "pierwszego przejścia"), pole pod krzywą zależności stężenia od czasu (AUC) po podaniu doustnym lub doodbytniczym stanowi w przybliżeniu połowę wartości AUC po pozajelitowym podaniu równoważnej dawki.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgWłaściwości farmakokinetyczne
Podczas ponownego podania produktu leczniczego farmakokinetyka nie zmienia się. Nie dochodzi do kumulacji produktu leczniczego w organizmie, jeśli zachowane zostaną zalecane przerwy w dawkowaniu. Dystrybucja Diklofenak wiąże się z białkami osocza w 99,7%, głównie z albuminami (99,4%). Objętość dystrybucji wynosi od 0,12 do 0,17 l/kg. Diklofenak przenika do płynu maziowego, gdzie osiąga maksymalne stężenie po 2 do 4 godzinach od uzyskania maksymalnego stężenia w osoczu. Stężenie to jest większe niż w osoczu nawet przez 12 godzin. Okres półtrwania w fazie eliminacji z płynu maziowego wynosi od 3 do 6 godzin. Diklofenak i jego metabolity przenikają przez łożysko, a śladowe ilości diklofenaku były wykrywane w mleku kobiet karmiących piersią. Metabolizm Metabolizm diklofenaku obejmuje częściowo glukuronidację niezmienionej cząsteczki, jednak głównym szlakiem metabolicznym jest pojedyncza i wielokrotna hydroksylacja i metoksylacja z wytworzeniem kilku metabolitów fenolowych (3’-hydroksy-, 4’-hydroksy-, 5’-hydroksy-, 4’, 5’-dihydroksy-, 3’-hydroksy-4’-metoksy-diklofenak), z których większość jest przekształcana do związków sprzężonych z kwasem glukuronowym.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgWłaściwości farmakokinetyczne
Dwa spośród metabolitów fenolowych wykazują aktywność biologiczną, ale mniejszą niż diklofenak. Wydalanie Całkowity klirens ogólnoustrojowy diklofenaku wynosi 263 ± 56 ml/minutę (średnia ± SD). Okres półtrwania w fazie eliminacji w osoczu wynosi 1 do 2 godzin. Cztery metabolity, w tym dwa czynne, również charakteryzują się krótkim okresem półtrwania (1 do 3 godzin). Jeden metabolit (3’-hydroksy-4’-metoksydiklofenak) ma znacznie dłuższy okres półtrwania, ale jest on praktycznie nieaktywny. Około 60% podanej dawki wydalane jest w moczu w postaci metabolitów. Mniej niż 1% dawki wydala się w postaci niezmienionej, a pozostała część wydalana jest w postaci metabolitów poprzez żółć z kałem. Dane dotyczące pacjentów Nie obserwowano istotnych różnic we wchłanianiu, metabolizmie lub wydalaniu diklofenaku, zależnych od wieku pacjenta.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgWłaściwości farmakokinetyczne
Badania kinetyki pojedynczej dawki u pacjentów z zaburzeniami czynności nerek mogą sugerować brak kumulacji substancji czynnej w postaci niezmienionej po zastosowaniu zalecanego schematu dawkowania. Jeśli klirens kreatyniny jest mniejszy niż 10 ml/minutę, teoretyczne stężenia hydroksypochodnych diklofenaku w osoczu w stanie stacjonarnym są około 4 razy większe niż u osób zdrowych. Jednak metabolity te są ostatecznie wydalane z żółcią. U pacjentów z przewlekłym zapaleniem wątroby lub wyrównaną marskością wątroby kinetyka i metabolizm diklofenaku są takie same, jak u pacjentów bez chorób wątroby.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na reprodukcję i rozwój potomstwa, nie ujawniają żadnego szczególnego zagrożenia dla człowieka. Brak danych pochodzących ze standardowych badań nieklinicznych na zwierzętach, dotyczących wpływu diklofenaku na działanie teratogenne u myszy, szczurów lub królików. Diklofenak nie wpływa na rozród szczurów. Poza minimalnym wpływem na płód w dawce toksycznej dla matki, rozwój przed-, około- i poporodowy potomstwa nie został zaburzony. Podawanie niesteroidowych leków przeciwzapalnych (w tym diklofenaku) hamuje owulację u królików oraz implantację i tworzenie się łożyska u szczurów, a także prowadzi do przedwczesnego zamknięcia przewodu tętniczego u szczurów.
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgPrzedkliniczne dane o bezpieczeństwie
Podanie diklofenaku w dawce toksycznej dla matki wiązało się z dystocją, wydłużeniem ciąży, zmniejszoną przeżywalnością płodów i wewnątrzmacicznym zahamowaniem wzrostu u szczurów. Niewielki wpływ diklofenaku na parametry reprodukcji i porodu, jak również zwężenie przewodu tętniczego w macicy, są farmakologicznymi konsekwencjami tej klasy inhibitorów syntezy prostaglandyn (patrz punkty 4.3 i 4.6).
- CHPL leku Diclac 75 Duo, tabletki o zmodyfikowanym uwalnianiu, 75 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Warstwa o niemodyfikowanym uwalnianiu: Laktoza jednowodna Wapnia wodorofosforan dwuwodny Celuloza mikrokrystaliczna Magnezu stearynian Karboksymetyloskrobia sodowa (typ A) Krzemionka koloidalna bezwodna Skrobia kukurydziana Żelaza tlenek czerwony (E172) Warstwa o przedłużonym uwalnianiu: Laktoza jednowodna Hypromeloza Magnezu stearynian 6.2 Niezgodności farmaceutyczne Nie są znane. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych środków ostrożności dotyczących przechowywania. 6.5 Rodzaj i zawartość opakowania Blistry Aluminium/PP lub Aluminium/PVC w tekturowym pudełku, zawierające 10 lub 20 tabletek o zmodyfikowanym uwalnianiu. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg diklofenaku (Diclofenacum). Substancje pomocnicze o znanym działaniu: sodu benzoesan. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do płukania jamy ustnej i gardła
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Wskazania do stosowania
4.1 Wskazania do stosowania Leczenie objawowe stanów zapalnych błony śluzowej jamy ustnej i gardła (np. objawów zapalenia dziąseł, zapalenia jamy ustnej, zapalenia gardła, w stanach po zabiegach stomatologicznych, objawów podrażnienia mechanicznego).
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dzieci w wieku poniżej 14 lat Produkt leczniczy Glimbax jest przeciwwskazany do stosowania u dzieci w wieku poniżej 14 lat (patrz punkt 4.3). Dorośli i dzieci w wieku powyżej 14 lat Zaleca się stosowanie roztworu do płukania jamy ustnej i gardła od 2 do 3 razy na dobę. Nie ma potrzeby modyfikacji schematu dawkowania produktu leczniczego u pacjentów w podeszłym wieku. Każdorazowo należy użyć 15 ml roztworu (1 miarkę) nierozcieńczonego lub rozcieńczonego niewielką ilością wody i płukać jamę ustną i gardło przez około 30-60 sekund. Po użyciu roztwór należy wypluć. Jeśli objawy nasilą się lub nie ustępują po 7 dniach stosowania produktu Glimbax, należy skontaktować się z lekarzem.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Produkt leczniczy Glimbax jest przeciwwskazany do stosowania u dzieci w wieku poniżej 14 lat. Podobnie jak w przypadku innych niesteroidowych leków przeciwzapalnych (NLPZ), nie należy stosować produktu Glimbax u pacjentów, u których podanie kwasu acetylosalicylowego lub innych leków hamujących syntezę prostaglandyn, może być przyczyną napadu astmy, pokrzywki lub alergicznego nieżytu nosa.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas stosowania produktu leczniczego miejscowo, szczególnie długotrwale, może dojść do rozwoju nadwrażliwości. W takim przypadku należy przerwać stosowanie produktu leczniczego i zastosować odpowiednie leczenie, jeśli jest to konieczne. Należy unikać kontaktu produktu leczniczego Glimbax z oczami. Brak specjalnych zaleceń dotyczących dawkowania produktu u pacjentów z zaburzeniami czynności nerek i wątroby. Teoretycznie istnieje możliwość kumulacji produktu oraz jego metabolitów w przypadku ciężkiej niewydolności nerek, lecz jej znaczenie kliniczne jest nieznane. Produkt leczniczy zawiera 150 mg sodu benzoesanu w każdých 15 ml, co odpowiada 10 mg/ml. Sodu benzoesan może powodować miejscowe podrażnienie. W przypadku nieumyślnego połknięcia jednej dawki, patrz punkt 4.9.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie są znane interakcje tego produktu leczniczego z innymi produktami do stosowania miejscowego w jamie ustnej.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych klinicznych dotyczących stosowania produktu leczniczego Glimbax w czasie ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu produktu na przebieg ciąży, rozwój zarodka/płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3). Diklofenak podany ogólnie (podobnie jak w przypadku innych NLPZ, wykazujących działanie hamujące syntezę prostaglandyn), może prowadzić do przedwczesnego zamykania przewodu tętniczego i wystąpienia nadciśnienia płucnego u płodu, skąpomoczu, małowodzia, zwiększenia ryzyka krwawień, atonii macicy oraz nasilenia obrzęków obwodowych. Produktu Glimbax nie należy stosować w okresie ciąży. Karmienie piersi? Produktu Glimbax nie należy stosować podczas karmienia piersią.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Glimbax nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Działania niepożądane
4.8 Działania niepożądane W badaniach klinicznych nie obserwowano działań niepożądanych, które można by przypisać przyjmowaniu produktu leczniczego Glimbax. Jednak podczas stosowania produktu (zwłaszcza długotrwałego), mogą wystąpić objawy podrażnienia błony śluzowej jamy ustnej i kaszel, może również dojść do rozwoju reakcji nadwrażliwości. W takim przypadku należy przerwać stosowanie produktu i zastosować odpowiednie leczenie. Nie można wykluczyć możliwości wystąpienia ogólnoustrojowych działań niepożądanych w przypadku połknięcia lub długotrwałego stosowania produktu (patrz punkt 4.9). Zaburzenia żołądka i jelit Częstość nieznana (nie może być określona na podstawie dostępnych danych): uczucie pieczenia w jamie ustnej. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Działania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie działania niepożądane do: Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C, 02-222 Warszawa, tel. + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można również zgłaszać podmiotowi odpowiedzialnemu.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Przedawkowanie
4.9 Przedawkowanie Przypadkowe, nieumyślne połknięcie jednej dawki roztworu do płukania jamy ustnej nie stanowi zagrożenia dla pacjenta, ponieważ potencjalna połknięta dawka produktu stanowiłaby od jednej piątej do jednej szóstej dawki zalecanej do stosowania ogólnego. Nie zgłaszano przypadków przedawkowania produktu Glimbax.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: preparaty do stosowania miejscowego w jamie ustnej kod ATC: A01AD11 Glimbax zawiera jako substancję czynną diklofenak, który jest niesteroidowym lekiem przeciwzapalnym (NLPZ), będącym inhibitorem cyklooksygenazy, enzymu szlaku syntezy prostaglandyn. Podczas stosowania miejscowego w stanach zapalnych błony śluzowe jamy ustnej i gardła diklofenak wykazuje działanie przeciwbólowe i przeciwzapalne.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Badania metodą spektrofluoroskopii wykazały, że po zastosowaniu miejscowym diklofenak przenika bardzo dobrze przez powierzchnie błon śluzowych i gromadzi się w znajdujących się poniżej tkankach zmienionych zapalnie. Produkt po zastosowaniu miejscowym w minimalnym stopniu wchłania się do krążenia i praktycznie nie działa ogólnoustrojowo. Diklofenak jest wydalany częściowo z moczem, w postaci metabolitu. Pozostała część jest wydalana z żółcią i z kałem.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne pochodzące z badań toksyczności ostrej i po podaniu wielokrotnym, jak również badań genotoksyczności, mutagenności i rakotwórczości z zastosowaniem diklofenaku w dawkach terapeutycznych nie wykazały szczególnego zagrożenia dla człowieka. Nie wykazano teratogennego działania diklofenaku u myszy, szczurów lub królików. Diklofenak nie wpływa na rozród szczurów. Rozwój przed-, około- i poporodowy potomstwa nie został zaburzony.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Choliny chlorek Sodu wodorotlenek Sorbitol Sodu benzoesan Disodu edetynian Acesulfam potasowy Substancja poprawiająca smak i zapach brzoskwiniowa Substancja poprawiająca smak i zapach miętowa Czerwień Allura AC (E129) Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata Okres ważności po pierwszym otwarciu: 12 miesięcy 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Butelka przezroczysta ze szkła typu III w kolorze bursztynowym z zakrętką polietylenową z zabezpieczeniem przed dziećmi oraz miarką dozującą o pojemności 15 ml, w tekturowym pudełku. 1 butelka po 200 ml 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Glimbax, roztwór do płukania jamy ustnej i gardła, 0,74 mg/ml (0,074%)Dane farmaceutyczne
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO AKIS, 25 mg/ml, roztwór do wstrzykiwań w ampułko-strzykawce AKIS, 50 mg/ml, roztwór do wstrzykiwań w ampułko-strzykawce AKIS, 75 mg/ml, roztwór do wstrzykiwań w ampułko-strzykawce 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancją aktywną jest diklofenak sodowy. 1 ml roztworu w ampułko-strzykawce zawiera 25 mg diklofenaku sodowego, 50 mg diklofenaku sodowego lub 75 mg diklofenaku sodowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań w ampułko-strzykawce (iniekcji). Klarowny do lekko bursztynowego, przezroczysty roztwór.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Wstrzyknięcie domięśniowe lub podskórne: AKIS jest roztworem do wstrzykiwań działającym skutecznie w przypadku ostrego bólu, w tym kolki nerkowej, zaostrzenia choroby zwyrodnieniowej stawów oraz reumatoidalnego zapalenia stawów, ostrego bólu pleców, ostrej dny moczanowej, ostrych urazów i złamań oraz bólu pooperacyjnego (patrz punkt 4.3 i 4.4). Wstrzyknięcie dożylne (bolus): W leczeniu lub profilaktyce bólu pooperacyjnego w warunkach szpitalnych (patrz punkt 4.3 i 4.4). AKIS jest wskazany do stosowania u dorosłych. Nie zaleca się stosowania u dzieci i młodzieży.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Występowanie działań niepożądanych można ograniczyć stosując produkt w najmniejszej skutecznej dawce i nie dłużej niż to koniecznie do kontrolowania objawów (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Dawkowanie Dorośli Roztwór do wstrzykiwań AKIS można podawać domięśniowo, podskórnie lub dożylnie (bolus). AKIS jest przeznaczony wyłącznie do krótkotrwałego leczenia i nie należy go podawać przez więcej niż dwa dni. W przypadku łagodnego i umiarkowanego bólu mniejsze dawki mogą być wystarczające. Leczenie ciężkiego bólu, np. kolki nerkowej, może wymagać zastosowania dawki 75 mg. Wyjątkowo i w ciężkich przypadkach po 6 godzinach można podać drugą dawkę 75 mg. Nie należy przekraczać maksymalnej dawki dobowej, która wynosi 150 mg.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlDawkowanie
Jeśli wymagane jest podanie więcej niż jednej dawki produktu leczniczego AKIS na dobę w postaci iniekcji (maksymalnie 150 mg na dobę), zaleca się zmianę miejsca podania kolejnej iniekcji. Jeśli to konieczne, jedno wstrzyknięcie produktu leczniczego AKIS można stosować razem z innymi postaciami diklofenaku, przy czym nie należy przekraczać maksymalnej dawki dobowej 150 mg. Szczególne grupy pacjentów Pacjenci w podeszłym wieku U pacjentów w podeszłym wieku występuje zwiększone ryzyko poważnych działań niepożądanych (patrz punkt 4.4 i 5.2). Jeśli uzna się za konieczne zastosowanie leku z grupy NLPZ, należy podawać najmniejszą skuteczną dawkę przez jak najkrótszy możliwy okres czasu. Podczas leczenia lekami z grupy NLPZ należy regularnie monitorować pacjenta pod kątem krwawienia z przewodu pokarmowego. Zalecana maksymalna dawka dobowa AKIS wynosi 150 mg.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlDawkowanie
Pacjenci z niewydolnością nerek Hydroksypropylo-beta-cyklodekstryna, która jest substancją pomocniczą AKIS, jest wydalana głównie w procesie przesączania kłębuszkowego. Dlatego też u pacjentów z ciężką niewydolnością nerek (określoną, jako stężenie kreatyniny w surowicy poniżej 30 ml/min) nie należy stosować produktu leczniczego AKIS (patrz punkt 4.4 i 5.2). U pacjentów z niewydolnością nerek należy stosować najmniejszą skuteczną dawkę. Pacjenci z ciężką niewydolnością wątroby lub serca Produkt AKIS roztwór do wstrzykiwań jest przeciwwskazany u pacjentów z ciężkimi zaburzeniami czynności wątroby lub serca (patrz punkt 4.3). Należy zachować ostrożność podczas podawania produktu AKIS pacjentom z łagodnymi do umiarkowanych zaburzeniami czynności wątroby oraz w przypadku pacjentów z nadciśnieniem i (lub) umiarkowaną zastoinową niewydolnością serca stwierdzonymi w wywiadzie (patrz punkt 4.4).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlDawkowanie
Podobnie w przypadku pacjentów, u których istnieje znaczne ryzyko wystąpienia zdarzeń niepożądanych dotyczących układu sercowo-naczyniowego (np. nadciśnienie, hiperlipidemia, cukrzyca, palenie tytoniu), diklofenak można stosować jedynie po starannym rozważeniu celowości takiej terapii (patrz punkt 4.4). Dzieci i młodzież Nie ustalono profilu bezpieczeństwa stosowania i skuteczności produktu leczniczego AKIS u dzieci w wieku 0 - 18 lat. Sposób podawania Produkt leczniczy AKIS należy podawać wyłącznie przez personel medyczny. AKIS można podawać domięśniowo lub podskórnie do czystej zdrowej tkanki lub przez wstrzyknięcie dożylne w bolusie. Należy stosować pojedynczą ampułko-strzykawkę zamiast dwóch ampułko-strzykawek w celu podania ustalonej dawki, tj. jedną iniekcję 75 mg produktu leczniczego zamiast 2 iniekcji dawek 25 mg i 50 mg lub jedną iniekcję 50 mg, zamiast dwóch iniekcji po 25 mg.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlDawkowanie
Podanie domięśniowe Należy przestrzegać następujących wskazówek w przypadku podawania domięśniowego w celu uniknięcia uszkodzenia nerwu lub innej tkanki w miejscu podania. Roztwór należy wstrzykiwać głęboko w górny zewnętrzny kwadrat pośladka. Jeśli wymaga się zastosowania dwóch wstrzyknięć na dobę, zaleca się zmianę pośladka w celu wykonania drugiego wstrzyknięcia. Roztwór należy wstrzykiwać powoli w celu minimalizacji uszkodzenia miejscowej tkanki. Podanie podskórne Roztwór należy podawać do tkanki podskórnej, najlepiej w górną część mięśnia pośladkowego lub górną część uda. Jeśli wymaga się zastosowania dwóch wstrzyknięć na dobę, zaleca się zmianę miejsca podania pomiędzy mięśniem pośladkowym i udem. Należy całkowicie wprowadzić igłę w grubość fałdu skóry, który należy utworzyć chwytając ją między kciuk i palec wskazujący. Należy upewnić się, że produkt leczniczy nie jest wstrzykiwany do naczynia krwionośnego. Roztwór należy wstrzykiwać powoli i w równomiernym tempie.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlDawkowanie
Podczas podawania podskórnego należy przytrzymać fałd skóry między palcami. Podanie dożylne Produkt AKIS może być podany poprzez wstrzyknięcie dożylne w bolusie. Zaleca się stosowanie dwóch alternatywnych schematów: W leczeniu pooperacyjnego bólu o nasileniu umiarkowanym do ciężkiego, należy podać dożylnie 75 mg. W razie konieczności można powtórzyć leczenie po 4 do 6 godzinach, nie przekraczając dobowej dawki 150 mg. W profilaktyce bólu pooperacyjnego należy podać dawkę nasycającą 25 mg do 50 mg w 5 – 60 sekundowym wstrzyknięciu (bolus) po zabiegu, a następnie wykonywać kolejne dodatkowe wstrzyknięcia do maksymalnej dawki dobowej 150 mg. W razie konieczności można powtórzyć leczenie po 4 do 6 godzinach, nie przekraczając dawki dobowej 150 mg. Produktu leczniczego AKIS nie wolno podawać w infuzji dożylnej. Instrukcje dotyczące zastosowania i przygotowania produktu leczniczego do stosowania, patrz punkt 6.6.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Czynna choroba wrzodowa żołądka lub dwunastnicy, krwawienie lub perforacja. Krwawienie z przewodu pokarmowego w wywiadzie lub perforacja związana z uprzednim leczeniem lekami z grupy NLPZ. Czynna lub nawracająca w wywiadzie choroba wrzodowa lub krwotok (dwa lub więcej różnych epizodów owrzodzenia lub krwawienia). Ostatni trymestr ciąży (patrz punkt 4.6). Ciężka niewydolność wątroby, nerek lub serca (patrz punkt 4.4). Podobnie jak inne niesteroidowe leki przeciwzapalne (NLPZ), diklofenak jest także przeciwwskazany u pacjentów, u których kwas acetylosalicylowy lub inne leki z grupy NLPZ wywołują napady astmy, pokrzywkę lub ostry nieżyt błony śluzowej nosa. Zaburzenia homeostazy lub jednoczesne leczenie lekami przeciwzakrzepowymi (przeciwwskazanie wyłącznie do domięśniowego podawania produktu).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlPrzeciwwskazania
Stwierdzona zastoinowa niewydolność serca (klasa II–IV wg NYHA), choroba niedokrwienna serca, choroba naczyń obwodowych i (lub) choroba naczyń mózgowych. Dla podania dożylnego: Jednoczesne stosowanie NLPZ i leków przeciwzakrzepowych (w tym małych dawek heparyny). Skłonność do krwotoków oraz potwierdzone lub podejrzewane krwawienia mózgowo-naczyniowe, w wywiadzie. Operacje związane z dużym ryzykiem krwotoku. Astma w wywiadzie. Umiarkowana lub ciężka niewydolność nerek (kreatynina w surowicy > 160µmol/l). Hipowolemia lub odwodnienie z dowolnej przyczyny.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ogólne Działania niepożądane można ograniczyć stosując najmniejszą skuteczną dawkę przez jak najkrótszy okres czasu niezbędny do kontrolowania objawów (patrz punkt 4.2 i wpływ na przewód pokarmowy i układ krążenia poniżej). Należy unikać jednoczesnego stosowania diklofenaku z lekami z grupy NLPZ o działaniu ogólnoustrojowym, w tym z selektywnymi inhibitorami cyklooksygenazy-2, ze względu na brak dowodów wskazujących na korzyści wynikające z działania synergistycznego i możliwe dodatkowe działania niepożądane. Należy zachować ostrożność stosując AKIS u pacjentów w podeszłym wieku ze względów medycznych. W szczególności zaleca się stosowanie najmniejszej skutecznej dawki u osłabionych pacjentów w podeszłym wieku lub pacjentów z małą masą ciała.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlSpecjalne środki ostrozności
Podobnie jak w przypadku innych leków z grupy NLPZ, w rzadkich przypadkach, mogą wystąpić reakcje alergiczne w związku z przyjmowaniem diklofenaku bez uprzedniej ekspozycji na jego działanie, w tym reakcje anafilaktyczne/rzekomoanafilaktyczne. Reakcje nadwrażliwości mogą także rozwinąć się w zespół Kounisa, ciężką reakcję alergiczną, która może prowadzić do zawału mięśnia sercowego. Objawy takich reakcji mogą obejmować ból w klatce piersiowej występujący w związku z reakcją alergiczną na diklofenak. Podobnie jak inne leki z grupy NLPZ, diklofenak może maskować objawy przedmiotowe i podmiotowe zakażenia w związku ze swoimi właściwościami farmakodynamicznymi. Należy ściśle przestrzegać zaleceń dotyczących wykonywania wstrzyknięć domięśniowych, aby uniknąć zdarzeń niepożądanych w miejscu wstrzyknięcia, mogących doprowadzić do osłabienia mięśni, porażenia mięśni, niedoczulicy, embolia cutis medicamentosa (zespół Nicolaua) i martwicy w miejscu wstrzyknięcia.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlSpecjalne środki ostrozności
Reakcje w miejscu wstrzyknięcia Zgłaszano występowanie reakcji w miejscu wstrzyknięcia po podaniu domięśniowym diklofenaku, obejmującą martwicę w miejscu wstrzyknięcia oraz embolia cutis medicamentosa, znaną także jako zespół Nicolaua (zwłaszcza po nieumyślnym podaniu podskórnym). Podczas domięśniowego podawania diklofenaku należy stosować właściwy dobór igły i techniki wstrzykiwania (patrz punkt 4.2 i (lub) 6.6, w stosownych przypadkach). Wpływ na przewód pokarmowy W związku z przyjmowaniem wszystkich leków z grupy NLPZ, w tym diklofenaku, zgłaszano krwawienie z przewodu pokarmowego, owrzodzenie i perforację, które mogą prowadzić do zgonu i mogą pojawić się w dowolnym momencie leczenia, z lub bez objawów ostrzegawczych lub poważnych zdarzeń żołądkowo-jelitowych w wywiadzie. Ogólnie działania te mają poważniejsze konsekwencje u pacjentów w podeszłym wieku.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlSpecjalne środki ostrozności
Jeśli u pacjentów przyjmujących diklofenak wystąpi krwawienie z przewodu pokarmowego lub owrzodzenie, należy przerwać leczenie tym produktem leczniczym. Podobnie jak w przypadku wszystkich leków z grupy NLPZ, w tym diklofenaku, konieczny jest ścisły nadzór medyczny i zachowanie szczególnej ostrożności w przypadku przepisywania diklofenaku pacjentom z objawami wskazującymi na zaburzenia przewodu pokarmowego lub z zaburzeniami w wywiadzie wskazującymi na owrzodzenie żołądka lub dwunastnicy, krwawienie lub perforację (patrz punkt 4.8). Ryzyko wystąpienia krwawienia z przewodu pokarmowego jest wyższe w przypadku zwiększania dawek leków z grupy NLPZ i u pacjentów z chorobą wrzodową w wywiadzie, w szczególności, jeśli jest ona powiązana z krwotokiem lub perforacją. U pacjentów w podeszłym wieku częstość występowania działań niepożądanych związanych ze stosowaniem leków z grupy NLPZ, w szczególności krwawienia z przewodu pokarmowego i perforacji, które mogą prowadzić do zgonu, jest większa.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlSpecjalne środki ostrozności
Aby zmniejszyć ryzyko wystąpienia działania toksycznego w obrębie przewodu pokarmowego u pacjentów z chorobą wrzodową w wywiadzie, w szczególności, jeśli jest ona powiązana z krwotokiem lub perforacją oraz u pacjentów w podeszłym wieku, podczas leczenia wstępnego i podtrzymującego należy stosować najmniejszą skuteczną dawkę. U tych grup pacjentów oraz u pacjentów wymagających jednoczesnego stosowania produktów leczniczych zawierających małe dawki kwasu acetylosalicylowego (ASA)/aspiryna lub innych produktów leczniczych, które mogą zwiększać ryzyko działania toksycznego w obrębie przewodu pokarmowego, należy rozważyć leczenie skojarzone z lekami osłonowymi (np. inhibitory pompy protonowej lub mizoprostol). Pacjenci, u których występuje działanie toksyczne w obrębie przewodu pokarmowego w wywiadzie, w szczególności pacjenci w podeszłym wieku, powinni zgłaszać wszelkie nietypowe objawy występujące w zakresie jamy brzusznej (w szczególności krwawienie z przewodu pokarmowego).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlSpecjalne środki ostrozności
Zaleca się zachowanie ostrożności u pacjentów przyjmujących jednocześnie leki, które mogą zwiększać ryzyko wystąpienia owrzodzenia lub krwawienia, tj. kortykosteroidy o działaniu ogólnoustrojowym, leki przeciwzakrzepowe, leki przeciwpłytkowe lub selektywne inhibitory wychwytu zwrotnego serotoniny (patrz punkt 4.5). Należy zachować ostrożność i ściśle monitorować pacjentów z wrzodziejącym zapaleniem jelita grubego lub chorobą Crohna, ponieważ ich stan może ulec zaostrzeniu (patrz punkt 4.8). Stosowanie NLPZ, w tym diklofenaku, może wiązać się ze zwiększeniem ryzyka nieszczelności zespolenia żołądkowo-jelitowego. Zaleca się ścisły nadzór medyczny i zachowanie ostrożności podczas stosowania diklofenaku po operacjach przewodu pokarmowego. Wpływ na wątrobę Należy ściśle monitorować pacjentów z zaburzeniem czynności wątroby przyjmujących diklofenak, ponieważ ich stan może ulec zaostrzeniu.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlSpecjalne środki ostrozności
Podobnie jak w przypadku innych leków z grupy NLPZ, w tym diklofenaku, może wystąpić zwiększenie aktywności jednego lub więcej enzymów wątrobowych. Podczas długotrwałego leczenia diklofenakiem jako środek ostrożności zaleca się regularne kontrolowanie czynności wątroby. W przypadku utrzymywania się lub pogarszania nieprawidłowych wyników testów czynnościowych wątroby lub wystąpienia klinicznych objawów przedmiotowych i podmiotowych wskazujących na chorobę wątroby, lub jeśli wystąpią inne objawy (eozynofilia, wysypka), należy przerwać stosowanie diklofenaku. W przypadku stosowania diklofenaku może wystąpić zapalenie wątroby bez objawów prodromalnych. Należy zachować ostrożność stosując diklofenak u pacjentów z porfirią, ponieważ może on wywołać napad. Wpływ na nerki Ze względu na to, iż zgłaszano przypadki zatrzymania płynów i obrzęku w związku z leczeniem lekami z grupy NLPZ, w tym diklofenakiem, należy zachować szczególną ostrożność u pacjentów z zaburzeniem czynności serca i nerek, nadciśnieniem w wywiadzie, u pacjentów w podeszłym wieku, u pacjentów stosujących jednocześnie leki moczopędne lub produkty lecznicze, które istotnie wpływają na czynność nerek oraz u pacjentów ze znacznym zmniejszeniem objętości pozakomórkowej z jakiegokolwiek powodu, np.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlSpecjalne środki ostrozności
przed lub po większym zabiegu chirurgicznym (patrz punkt 4.3). W tych przypadkach jako środek ostrożności po zastosowaniu diklofenaku zaleca się monitorowanie czynności nerek. Przerwanie leczenia zazwyczaj prowadzi do powrotu do stanu zdrowia sprzed leczenia. Hydroksypropylo-beta-cyklodekstryna, która jest substancją pomocniczą, jest wydalana głównie przez nerki w procesie przesączania kłębuszkowego. Dlatego też u pacjentów z ciężką niewydolnością nerek (określoną, jako stężenie kreatyniny w surowicy poniżej 30 ml/min) nie należy stosować roztworu do wstrzykiwań AKIS. U pacjentów z niewydolnością nerek należy stosować najmniejszą skuteczną dawkę. Wpływ na skórę W związku ze stosowaniem leków z grupy NLPZ bardzo rzadko zgłaszano ciężkie reakcje skórne, niekiedy prowadzące do zgonu, w tym złuszczające zapalenie skóry, zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka (patrz punkt 4.8).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlSpecjalne środki ostrozności
Ryzyko wystąpienia tych reakcji wydaje się być wyższe w początkowej fazie leczenia: większość reakcji odnotowywano w ciągu pierwszego miesiąca leczenia. Należy przerwać leczenie produktem leczniczym AKIS po wystąpieniu pierwszych objawów wysypki skórnej, zmian na błonach śluzowych lub jakichkolwiek innych objawów nadwrażliwości. Wpływ na układ krążenia i naczynia mózgu Ze względu na to, że zgłaszano przypadki zatrzymania płynów i obrzęku w związku z leczeniem lekami z grupy NLPZ, wymagany jest odpowiedni monitoring i konsultacje u pacjentów z nadciśnieniem w wywiadzie i (lub) łagodną do umiarkowanej zastoinową niewydolnością serca. Dane z badań klinicznych i dane epidemiologiczne wskazują na prawdopodobieństwo związku między leczeniem diklofenakiem (w szczególności w dużych dawkach, 150 mg na dobę i w długotrwałym leczeniu) i niewielkim zwiększeniem ryzyka wystąpienia przypadków zakrzepicy tętniczej (np. zawał serca mięśniowego lub udar mózgu).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlSpecjalne środki ostrozności
Diklofenak należy stosować bardzo ostrożnie u pacjentów z istotnymi czynnikami ryzyka zdarzeń dotyczących układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Produkt ten należy stosować możliwie jak najkrócej i w najmniejszej skutecznej dawce dobowej, ze względu na możliwość nasilenia ryzyka dotyczącego układu krążenia po zastosowaniu diklofenaku w dużych dawkach i długotrwale. Należy okresowo kontrolować konieczność kontynuacji leczenia objawowego i odpowiedź na leczenie. Wpływ na układ krwiotwórczy Podczas długotrwałego leczenia diklofenakiem, podobnie jak w przypadku innych leków z grupy NLPZ, zaleca się monitorowanie morfologii krwi. Podobnie jak inne leki z grupy NLPZ, diklofenak może przejściowo zahamować agregację płytek krwi. Należy starannie monitorować pacjentów z zaburzeniem homeostazy. Może pojawić się niedokrwistość w związku z zatrzymaniem wody lub wpływem na erytropoezę.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlSpecjalne środki ostrozności
Dlatego też, w przypadku wykrycia objawów niedokrwistości, zalecane jest monitorowanie poziomu hemoglobiny i hematokrytu. U pacjentów chorych na cukrzycę lub pacjentów przyjmujących również leki moczopędne oszczędzające potas może wystąpić hiperkaliemia (patrz punkt 4.5). Astma w wywiadzie U pacjentów z astmą, sezonowym alergicznym zapaleniem błony śluzowej nosa, obrzękiem błony śluzowej nosa (np. polipy nosa), przewlekłą obturacyjną chorobą płuc lub przewlekłymi infekcjami dróg oddechowych (szczególnie, jeśli związane z objawami podobnymi do alergicznego zapalenia błony śluzowej nosa), reakcje na leki z grupy NLPZ, np. zaostrzenie astmy (tzw. nietolerancja leków przeciwbólowych/astma indukowana lekami przeciwbólowymi), obrzęk naczynioruchowy lub pokrzywka występują częściej w porównaniu do innych pacjentów. Dlatego też należy zachować szczególną ostrożność u tych pacjentów (zapewnić gotowość pomocy lekarskiej). Dotyczy to także pacjentów, którzy są uczuleni na inne substancje, np.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlSpecjalne środki ostrozności
pacjentów z reakcjami skórnymi, świądem lub pokrzywką. SLE i mieszana choroba tkanki łącznej U pacjentów z układowym toczniem rumieniowatym (SLE) i mieszaną chorobą tkanki łącznej może wystąpić podwyższone ryzyko aseptycznego zapalenia opon mózgowych (patrz punkt 4.8). Podanie Roztwór należy podawać przestrzegając ściśle zasad aseptyki i antyseptyki. Czas leczenia Nie należy stosować produktu leczniczego AKIS dłużej niż przez 2 dni. Po 2 dniach należy zweryfikować konieczność zastosowania alternatywnego leku z grupy NLPZ i w przypadku konieczności długotrwałego leczenia lekami z grupy NLPZ, należy monitorować pacjenta pod kątem zaburzenia czynności wątroby i nerek oraz zaburzeń morfologii krwi. Jest to szczególnie istotne w przypadku pacjentów w podeszłym wieku. Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na jednostkę dawkowania, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Poniższe interakcje obejmują interakcje obserwowane podczas stosowania diklofenaku w postaci tabletek dojelitowych i (lub) innej postaci farmaceutycznej. Lit: Leki z grupy NLPZ powodują zmniejszenie wydalania litu przez nerki i w związku z tym zwiększenie stężenia litu w osoczu. Jeśli zastosowanie tego połączenia jest konieczne, należy kontrolować stężenie litu we krwi i dostosować jego dawkę zarówno podczas leczenia wstępnego, skojarzonego, jak i po odstawieniu diklofenaku. Digoksyna: W przypadku jednoczesnego stosowania diklofenak może zwiększać stężenie digoksyny w osoczu. Zaleca się monitorowanie stężenia digoksyny w surowicy. Leki moczopędne, inhibitory ACE, antagoniści receptora angiotensyny II: Leki z grupy NLPZ mogą zmniejszać przeciwnadciśnieniowe działanie leków moczopędnych i innych leków przeciwnadciśnieniowych (tj. leki beta-adrenolityczne, inhibitory konwertazy angiotensyny [ACE]).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlInterakcje
U niektórych pacjentów z zaburzoną czynnością nerek (np. u pacjentów odwodnionych lub u pacjentów w wieku podeszłym z zaburzoną czynnością nerek) jednoczesne stosowanie inhibitora ACE lub antagonisty receptora angiotensyny II i leków hamujących cyklooksygenazę może powodować dalsze, zwykle odwracalne, zaburzenia czynności nerek, w tym możliwą ostrą niewydolność nerek. Dlatego też kombinację leków należy stosować ostrożnie, szczególnie u pacjentów w podeszłym wieku. Pacjenci powinni być odpowiednio nawodnieni. Należy też rozważyć monitorowanie czynności nerek po rozpoczęciu leczenia towarzyszącego, a także okresowo w okresie późniejszym (patrz także punkt 4.4). Jednoczesne leczenie lekami moczopędnymi oszczędzającymi potas może powodować zwiększenie poziomu potasu w osoczu, które należy regularnie monitorować (patrz punkt 4.4).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlInterakcje
Inne leki z grupy NLPZ, kortykosteroidy i kwas acetylosalicylowy: Jednoczesne podawanie diklofenaku i innych leków z grupy NLPZ o działaniu ogólnoustrojowym lub kortykosteroidów lub kwasu acetylosalicylowego może zwiększyć częstość występowania działań niepożądanych i nie jest zalecane (patrz punkt 4.4). Leki przeciwzakrzepowe i heparyna (leczenie pacjentów w podeszłym wieku lub w dawkach leczniczych): Zaleca się ostrożność, ponieważ jednoczesne podawanie z lekami z grupy NLPZ może zwiększyć ryzyko wystąpienia krwawienia poprzez hamowanie czynności płytek krwi i uszkodzenia błony śluzowej żołądka i dwunastnicy (patrz punkt 4.4). Leki z grupy NLPZ mogą nasilać działanie leków przeciwzakrzepowych, tj. warfaryna lub heparyna. Nie zaleca się podawania heparyny u pacjentów w podeszłym wieku lub w dawkach leczniczych. Należy starannie monitorować międzynarodowy współczynnik znormalizowany (INR), jeśli nie można uniknąć jednoczesnego podawania.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlInterakcje
Pomimo, iż badania kliniczne nie wskazują na to, że diklofenak wpływa na działanie leków przeciwzakrzepowych, doniesienia ujawniają zwiększone ryzyko wystąpienia krwotoku u pacjentów przyjmujących jednocześnie diklofenak i leki przeciwzakrzepowe. Stąd zaleca się ścisłe monitorowanie tych pacjentów. Leki trombolityczne i leki przeciwpłytkowe: Zaleca się ostrożność, ponieważ jednoczesne podawanie z lekami z grupy NLPZ może zwiększyć ryzyko wystąpienia krwawienia poprzez hamowanie czynności płytek krwi i uszkodzenia błony śluzowej żołądka i dwunastnicy. Selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI): Jednoczesne podawanie leków z grupy NLPZ o działaniu ogólnoustrojowym, w tym diklofenaku i SSRI może zwiększać ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.4). Leki przeciwcukrzycowe: Badania kliniczne wykazały, że diklofenak może być podawany z doustnymi lekami przeciwcukrzycowymi bez wywierania wpływu na ich działanie kliniczne.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlInterakcje
Jednakże odnotowano pojedyncze przypadki działań hipoglikemizujących i hiperglikemizujących, które wymagały dostosowania dawki leków przeciwcukrzycowych podczas leczenia diklofenakiem. Dlatego też jako środek zapobiegawczy podczas leczenia towarzyszącego zaleca się monitorowanie stężenia glukozy we krwi. Metotreksat: Diklofenak może zmniejszać klirens nerkowy metotreksatu, podnosząc tym samym poziom metotreksatu. Zaleca się ostrożność przy podawaniu leków z grupy NLPZ, w tym diklofenaku, na mniej niż 24 godziny przed lub po leczeniu metotreksatem, ponieważ w przeciwnym razie może to powodować zwiększenie stężenia metotreksatu we krwi i zwiększenie toksyczności tej substancji. Zaleca się cotygodniowe kontrolowanie morfologii krwi podczas kilku pierwszych tygodni leczenia skojarzonego. Należy zintensyfikować monitorowanie w przypadku pacjentów z zaburzeniem czynności nerek lub pacjentów w podeszłym wieku.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlInterakcje
Zastosowanie pemetreksedu u pacjentów z prawidłową czynnością nerek, klirens kreatyniny > 80 ml/min: Zwiększone ryzyko toksyczności pemetreksedu w związku z obniżeniem klirensu kreatyniny pemetreksedu. Zaleca się biologiczny monitoring czynności nerek. Inhibitory kalcyneuryny (np. cyklosporyna, takrolimus): Działanie nefrotoksyczne inhibitorów kalcyneuryny może się zwiększać pod wpływem leków z grupy NLPZ poprzez działanie za pośrednictwem prostaglandyn nerkowych. Podczas jednoczesnego leczenia zaleca się monitorowanie czynności nerek, w szczególności pacjentów w podeszłym wieku. Deferazyroks: Jednoczesne podawanie leków z grupy NLPZ o działaniu ogólnoustrojowym i deferazyroksu może zwiększać ryzyko toksycznego działania na przewód pokarmowy. Należy ściśle monitorować pacjentów, którym jednocześnie podawane są te leki. Chinolony przeciwbakteryjne: Zgłaszano pojedyncze przypadki drgawek, które mogą być związane z jednoczesnym stosowaniem chinolonów i leków z grupy NLPZ.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlInterakcje
Fenytoina: Podczas jednoczesnego stosowania fenytoiny z diklofenakiem zaleca się monitorowanie stężenia fenytoiny w osoczu w związku z nieoczekiwanym zwiększeniem jej stężenia. Kolestypol i cholestyramina: Leki te mogą powodować opóźnienie lub zmniejszenie wchłaniania diklofenaku. Dlatego też zaleca się podawanie diklofenaku przynajmniej na godzinę przed lub 4 do 6 godzin po podaniu kolestypolu/cholestyraminy. Silne inhibitory CYP2C9: Zaleca się ostrożność podczas przepisywania jednocześnie diklofenaku i silnych inhibitorów CYP2CP (tj. sulfinpirazon i worykonazol), które mogą powodować istotne zwiększenie maksymalnego stężenia w osoczu i zwiększenie stężenia diklofenaku w związku z hamowaniem jego metabolizmu. Mifepryston: Nie należy stosować leków z grupy NLPZ w ciągu 8-12 dni po podaniu mifeprystonu, ponieważ NLPZ mogą zmniejszać działanie mifepristonu. Takrolimus: Możliwe zwiększenie ryzyka nefrotoksyczności w przypadku podawania NLPZ z takrolimusem.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlInterakcje
Może to być spowodowane przez działanie przeciwko nerkowej prostaglandynie przez NLPZ, jak i inhibitora kalcyneuryny. Zydowudyna: Jednoczesne podawanie leków z grupy NLPZ z zydowudyną zwiększa ryzyko toksycznego działania na układ krwiotwórczy. Udowodniono, że jednoczesne podawanie ibuprofenu i zydowudyny zwiększa ryzyko wylewu krwi do stawu i krwiaka u pacjentów chorych na hemofilię i zakażonych wirusem HIV. Pomimo, iż AKIS w znacznym stopniu wiąże się z białkami, nie zakłóca on wiązania białka z: salicylanami, tolbutamidem i prednizolonem.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może wpływać negatywnie na ciążę i (lub) rozwój zarodka/płodu. Dane z badań epidemiologicznych wskazują na prawdopodobieństwo zwiększonego ryzyka poronienia, wady rozwojowej serca i wytrzewienia po zastosowaniu inhibitora syntezy prostaglandyn we wczesnym stadium ciąży. Ryzyko całkowite wady rozwojowej serca wzrosło z poniżej 1% do ok. 1,5%. Uważa się, że ryzyko to wzrasta wraz z dawką i czasem leczenia. Zastosowanie inhibitorów syntezy prostaglandyn u zwierząt wskazywało na zwiększoną ilość strat przed- i poimplantacyjnych oraz śmiertelność zarodków i płodów. Dodatkowo odnotowano zwiększoną częstość występowania różnych wad rozwojowych, w tym serca, u zwierząt, którym podawano inhibitory syntezy prostaglandyn w okresie organogenezy. Od 20. tygodnia ciąży stosowanie diklofenaku może powodować małowodzie wskutek zaburzeń czynności nerek płodu.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWpływ na płodność, ciążę i laktację
Może ono wystąpić krótko po rozpoczęciu leczenia i jest zwykle odwracalne po jego przerwaniu. Ponadto zgłaszano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze, z których większość ustąpiła po zaprzestaniu leczenia. Z tego względu, nie należy podawać produktu leczniczego AKIS w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. Jeśli diklofenak jest stosowany u kobiet planujących ciążę lub w pierwszym lub drugim trymestrze ciąży, należy podawać jak najmniejszą możliwą skuteczną dawkę przez możliwie jak najkrótszy okres czasu. Należy rozważyć przedporodowe monitorowanie w kierunku małowodzia oraz zwężenia przewodu tętniczego po ekspozycji na diklofenak przez kilka dni od 20. tygodnia ciąży. W przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego należy zaprzestać stosowania produktu leczniczego AKIS.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWpływ na płodność, ciążę i laktację
Podczas trzeciego trymestru ciąży wszystkie inhibitory syntezy prostaglandyn mogą działać na płód w następujący sposób: powodować toksyczne działanie na serce i płuca (przedwczesne zwężenie/zamknięciem przewodu tętniczego i nadciśnienie płucne); powodować zaburzenia nerek (patrz powyżej); U matki i noworodka pod koniec ciąży mogą prowadzić do: możliwego wydłużenia czasu krwawienia, działania hamującego agregację płytek, które mogą wystąpić nawet przy stosowaniu małych dawek; hamowanie skurczów macicy i wskutek tego opóźnionego lub wydłużonego porodu. W związku z tym, produkt leczniczy AKIS jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3). Karmienie piersi? Podobnie jak inne leki z grupy NLPZ, diklofenak przenika do mleka ludzkiego w niewielkich ilościach. Dlatego też nie należy podawać produktu leczniczego AKIS w okresie karmienia piersią w celu uniknięcia działań niepożądanych u niemowlęcia.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWpływ na płodność, ciążę i laktację
Płodność Podobnie jak w przypadku innych leków z grupy NLPZ, zastosowanie diklofenaku może zaburzać płodność i nie jest zalecane u kobiet planujących ciążę. U kobiet, które mają trudności z zajściem w ciążę lub są poddawane badaniom płodności, należy rozważyć przerwanie stosowania produktu leczniczego AKIS.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjenci, u których podczas leczenia diklofenakiem występują zaburzenia widzenia, oszołomienie, zawroty głowy, senność lub inne zaburzenia ośrodkowego układu nerwowego, nie powinni prowadzić pojazdów ani obsługiwać maszyn.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne Najczęściej występujące działania niepożądane, które obserwowano podczas badań klinicznych z produktem leczniczym AKIS obejmowały reakcje ze strony żołądka i jelit oraz reakcje w miejscu podania i ogólnie były łagodne i krótkotrwałe. Dane z badań klinicznych sugerują, że zastosowanie diklofenaku w postaci roztworu do wstrzykiwań jest związane z występowaniem reakcji w miejscu podania, takich jak: ból i krwiak. Częstość występowania działań niepożądanych w miejscu podania była istotnie mniejsza w przypadku leczenia dawkami 25 i 50 mg w porównaniu do dawki 75 mg. Po wstrzyknięciu dożylnym (bolus) dawki 75 mg w ciągu 5 do 30 sekund, odnotowano uczucie dyskomfortu w okolicy wokół miejsca wstrzyknięcia. Po podaniu diklofenaku obserwowano także: nudności, wymioty, biegunkę i zaparcie.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlDziałania niepożądane
Dane po wprowadzeniu do obrotu Znane reakcje niepożądane związane ze stosowaniem produktu AKIS, podawanego domięśniowo i podskórnie, to reakcje w miejscu wstrzyknięcia, często związane ze sposobem podawania, w tym ból w miejscu wstrzyknięcia, rumień i wysypka. W niektórych przypadkach zgłaszano reakcje nadwrażliwości wraz z uogólnionymi objawami. Działania niepożądane są przedstawione poniżej zgodnie z klasyfikacją układów i narządów MedDRA i następującą konwencją dotyczącą częstości: bardzo często (≥1/10); często (≥1/100 - <1/10); niezbyt często (≥1/1 000 - <1/100); rzadko (≥1/10 000 - <1/1 000); bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Klasyfikacja układów i narządów Częstość Działanie niepożądane Zakażenia i zarażenia pasożytnicze: częstość nieznana, martwica w miejscu wstrzyknięcia Zaburzenia układu immunologicznego: rzadko, reakcje nadwrażliwości Zaburzenia układu nerwowego: niezbyt często, oszołomienie, ból głowy Zaburzenia żołądka i jelit: często, niezbyt często, nudności, biegunka, wymioty, zaparcie, zapalenie żołądka, niedokrwienne zapalenie okrężnicy Zaburzenia wątroby i dróg żółciowych: niezbyt często, zwiększenie aktywności enzymów wątrobowych Zaburzenia skóry i tkanki podskórnej: niezbyt często, świąd Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: często, uczucie dyskomfortu w kończynach Zaburzenia ogólne i stany w miejscu podania: bardzo często, częstość nieznana, reakcje w miejscu podania, embolia cutis medicamentosa (zespół Nicolaua) Do opisu niektórych działań niepożądanych zastosowano najbardziej odpowiednie terminy MedDRA.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlDziałania niepożądane
Nie zastosowano synonimów i stanów pokrewnych, jednakże należy je także uwzględnić. Klasyfikacja układów i narządów Działania niepożądane (tabela 1) uporządkowano według częstości występowania, zaczynając od najczęściej występujących, zgodnie z następującą konwencją: bardzo często (≥1/10); często (≥1/100 - <1/10); niezbyt często (≥1/1 000 - <1/100); rzadko (≥1/10 000 - <1/1 000); bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Następujące działania niepożądane obejmują działania niepożądane zgłaszane zarówno w przypadku krótkotrwałego, jak i długotrwałego stosowania. Tabela 1 Zaburzenia krwi i układu chłonnego: bardzo rzadko, małopłytkowość, leukopenia, niedokrwistość (w tym niedokrwistość hemolityczna i aplastyczna), agranulocytoza Zaburzenia układu immunologicznego: rzadko, nadwrażliwość, reakcje anafilaktyczne i rzekomoanafilaktyczne (w tym niedociśnienie tętnicze i wstrząs), obrzęk naczynioruchowy (w tym obrzęk twarzy) Zaburzenia psychiczne: bardzo rzadko, dezorientacja, depresja, bezsenność, koszmary senne, drażliwość, zaburzenia psychotyczne Zaburzenia układu nerwowego: często, rzadko, bardzo rzadko, ból głowy, zawroty głowy, senność, parestezje, zaburzenie pamięci, drgawki, lęk, drżenie, aseptyczne zapalenie opon mózgowych, epizod naczyniowo-mózgowy Zaburzenia oka: bardzo rzadko, zaburzenia widzenia, niewyraźne widzenie, podwójne widzenie Zaburzenia ucha i błędnika: często, bardzo rzadko, zawroty głowy, szumy uszne, zaburzenie słuchu Zaburzenia serca: bardzo rzadko, palpitacje, ból w klatce piersiowej, niewydolność serca, zawał serca mięśniowego, zespół Kounisa Zaburzenia naczyniowe: bardzo rzadko, nadciśnienie tętnicze, zapalenie naczyń Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: rzadko, bardzo rzadko, astma (w tym duszność), zapalenie płuc Zaburzenia żołądka i jelit: często, rzadko, bardzo rzadko, nudności, wymioty, biegunka, dyspepsja, ból brzucha, wzdęcia, anoreksja, zapalenie żołądka, krwotok z przewodu pokarmowego, krwawe wymioty, biegunka krwotoczna, krew w kale, choroba wrzodowa przewodu pokarmowego (z krwawieniem lub perforacją albo bez), zapalenie jelita grubego (w tym krwotoczne zapalenie jelita grubego i zaostrzenie wrzodziejącego zapalenia jelita grubego lub choroby Leśniowskiego-Crohna), zaparcie, zapalenie błony śluzowej jamy ustnej (w tym wrzodziejące zapalenie błony śluzowej jamy ustnej), zapalenie języka, zaburzenia w obrębie przełyku, przeponopodobne zwężenia jelita, zapalenie trzustki Zaburzenia wątroby i dróg żółciowych: często, rzadko, zwiększenie aktywności aminotransferaz, zapalenie wątroby, żółtaczka, zaburzenie czynności wątroby, bardzo rzadko, piorunujące zapalenie wątroby, martwica wątroby, niewydolność wątroby Zaburzenia skóry i tkanki podskórnej: często, rzadko, bardzo rzadko, wysypka, pokrzywka, wysypki pęcherzowe, wyprysk, rumień, rumień wielopostaciowy, zespół Stevensa-Johnsona, martwica toksyczno-rozpływna naskórka (zespół Lyell), złuszczające zapalenie skóry, łysienie, reakcje nadwrażliwości na światło, plamica, plamica alergiczna, świąd Zaburzenia nerek i dróg moczowych: bardzo rzadko, ostra niewydolność nerek, krwiomocz, białkomocz, zespół nerczycowy, śródmiąższowe zapalenie nerek, martwica brodawek nerkowych Zaburzenia ogólne i stany w miejscu podania: często, rzadko, reakcje w miejscu podania, ból w miejscu podania, stwardnienie w miejscu podania, obrzęk, martwica w miejscu podania Zakażenia i zarażenia pasożytnicze: bardzo rzadko, ropień w miejscu podania Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg/dobę) i w leczeniu długotrwałym zwiększa ryzyko zakrzepicy tętnic (np.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlDziałania niepożądane
zawał serca lub udar) (patrz punkty 4.3 Przeciwwskazania i 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem: Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181 C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy Brak typowych objawów klinicznych związanych z przedawkowaniem diklofenaku. Przedawkowanie może powodować następujące objawy: wymioty, krwotok z przewodu pokarmowego, biegunka, oszołomienie, szum uszny lub drgawki. W przypadku znacznego zatrucia, możliwe jest wystąpienie ostrej niewydolności nerek lub uszkodzenia wątroby. Leczenie przedawkowania Postępowanie w przypadku ostrego zatrucia lekami z grupy NLPZ, w tym diklofenakiem, w szczególności polega na zastosowaniu postępowania podtrzymującego czynności organizmu i leczenia objawowego. Należy zastosować postępowanie podtrzymujące czynności organizmu i leczenie objawowe w przypadku powikłań, takich jak: niedociśnienie tętnicze niewydolność nerek zaburzenia żołądkowo-jelitowe depresja oddechowa Specjalne środki, takie jak wymuszona diureza, dializa lub hemoperfuzja prawdopodobnie nie są pomocne w eliminacji leków z grupy NLPZ, w tym diklofenaku, z uwagi na wysoki stopień wiązania z białkami osocza i rozległy metabolizm.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne (NLPZ) kod ATC: M01AB05. Klasyfikacja podgrupy terapeutycznej: leki działające na układ mięśniowo-szkieletowy/ niesteroidowe leki przeciwzapalne i przeciwreumatyczne/pochodne kwasu octowego i związki o podobnej budowie. Mechanizm działania Roztwór do wstrzykiwań AKIS jest niesteroidowym lekiem o właściwościach przeciwbólowych i przeciwzapalnych. Jest on inhibitorem syntetazy prostaglandyn (cyklooksygenazy). In vitro diklofenak sodu nie hamuje biosyntezy proteoglikanów w chrząstce przy stężeniach równoważnych ze stężeniami osiąganymi u ludzi. Po jednoczesnym stosowaniu z opioidami w celu leczenia bólu pooperacyjnego diklofenak sodowy często zmniejsza konieczność stosowania opioidów. Skuteczność kliniczna Działanie przeciwbólowe AKIS badano w dwóch głównych badaniach działania przeciwbólowego po zabiegach stomatologicznych, które obejmowały pacjentów z bólem o nasileniu umiarkowanym do ciężkiego po zabiegach usuwania zębów z powodu wklinowania.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWłaściwości farmakodynamiczne
W ramach pierwszego badania porównywano działanie przeciwbólowe AKIS podanego podskórnie z placebo. AKIS we wszystkich mocach wykazywał statystycznie znamiennie wyższe zmniejszenie bólu o nasileniu umiarkowanym do ciężkiego po zabiegu usuwania zęba z powodu wklinowania (zgodnie z pomiarami wg skali VAS) w porównaniu do placebo (p<0,001). AKIS także wykazywał znacząco większe działanie przeciwbólowe w pomiarach skuteczności wtórnej, czasu do wystąpienia działania przeciwbólowego, zastosowania leków doraźnych przez 8 godzin po podaniu produktu i odsetka pacjentów z 30% zmniejszeniem intensywności bólu po 1,5 godziny po podaniu produktu w porównaniu z placebo (p<0,001 we wszystkich porównaniach z placebo; nie wykryto statystycznej różnicy w porównaniach pomiędzy aktywnymi lekami). W ramach drugiego badania działania przeciwbólowego po zabiegach stomatologicznych porównywano działanie przeciwbólowe AKIS podanego podskórnie z lekiem Voltarol® 75 mg/3 ml podanym domięśniowo.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWłaściwości farmakodynamiczne
Badanie nie wykazało znamiennej różnicy pomiędzy dwoma lekami przeciwbólowymi w dowolnym punkcie czasu przez 8 godzin po podaniu leku. Po 1,5 godziny po podaniu leku (pierwszorzędowy punkt końcowy badania) 95% CI różnicy między dwoma lekami przeciwbólowymi był całkowicie poza ustaloną uprzednio górną granicą równoważności (-15 mm). Zatem, wykazano, że AKIS jest terapeutycznie równoważny z lekiem Voltarol. Średnie różnice i 95% CI różnicy w dowolnym punkcie czasu przez 8 godzin po podaniu leku przedstawia tabela poniżej.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Podanie domięśniowe: Po domięśniowym podaniu 75 mg/ml roztworu do wstrzykiwań AKIS, wchłanianie produktu leczniczego przebiega szybko i średnie maksymalne stężenie w osoczu wynoszące w zakresie 2,603 ± 0,959 µg/ml (2,5 ug/ml stanowi ok. 8 µmol/l) jest osiągane po 34 minutach. Obszar pod krzywą stężenia AUCo-t wynosi 250,07 ± 46,89 µg/ml.min. W porównawczych badaniach klinicznych mediana maksymalnego stężenia w osoczu w przypadku domięśniowego podania Voltarolu (75mg/3ml) wynosi 2,242 ± 0,566 µg/ml, która to wartość jest osiągana po 27 minutach, a AUCo-t wynosi 246,70± 39,74 µg/ml.min. AUC po podaniu domięśniowym jest w przybliżeniu ponad dwa razy dłuższa w porównaniu do podania doustnego lub doodbytniczego, ponieważ unika się metabolizmu pierwszego przejścia.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWłaściwości farmakokinetyczne
Podanie podskórne: Wchłanianie po podaniu podskórnym produktu leczniczego AKIS w dawce 75 mg/ml przebiega szybko i mediana maksymalnego stężenia w osoczu o wartości 2,138 ± 0,646 µg/ml (2,5 µg/ml stanowi ok. 8 µmol/l) jest osiągana po 40 minutach. Obszar pod krzywą stężenia AUCo-t wynosi 261,94 ± 53,29 µg/ml.min. W porównawczych badaniach klinicznych mediana maksymalnego stężenia w osoczu w przypadku domięśniowego podania Voltarolu wynosi 2,242 ± 0,566 µg/ml i jest osiągana po 27 minutach, a AUCo-t wynosi 246,70± 39,74 µg/ml.min. AUC i Cmax po podaniu podskórnym dawki 75 mg AKIS były biorównoważne z domięśniowo podaną dawką 75 mg/3 ml Voltarolu. AUC po podaniu podskórnym jest w przybliżeniu ponad dwa razy dłuższa w porównaniu do podania doustnego lub doodbytniczego, ponieważ unika się metabolizmu pierwszego przejścia. Liniowość dawki względem AUC i Cmax została wykazana w przypadku podskórnego podania diklofenaku.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWłaściwości farmakokinetyczne
Wykazano brak liniowej zależności pomiędzy Cmax a dawką, co oznacza odpowiednio średnią wartość Cmax 1 090 ng/ml, 1648,9 ng/ml i 1 851,1 ng/ml po dawkach AKIS 25 mg, 50 mg i 75 mg. Podanie dożylne w bolusie: Wchłanianie po podaniu dożylnym w bolusie produktu leczniczego AKIS w dawce 75 mg/ml następuje natychmiastowo i mediana maksymalnego stężenia w osoczu o wartości około 16,505 ± 2,829 µg/ml osiągana jest w ciągu 3 minut. W porównawczych badaniach farmakokinetycznych, w których diklofenak mierzono w osoczu do 8 godzin po podaniu, produkt AKIS 75 mg/ml w dożylnym bolusie okazał się być biorównoważny w stosunku do ampułki Voltarol 75 mg/3 ml podawanej jako 30-minutowa infuzja dożylna (100 ml) pod względem ekspozycji ogólnoustrojowej (AUC0-t: 5193,46 ± 1285 ng/ml.h i 4584,13 ± 1014,20 ng/ml.h, odpowiednio dla produktu AKIS i Voltarol), ale przy znacznie większej szybkości wchłaniania (Cmax dla wlewu Voltarol 75 mg/3 ml wynosiła 6,177 ± 1,051 μg/ml).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWłaściwości farmakokinetyczne
Ponadto stężenie diklofenaku w osoczu (Cmax) po podaniu produktu AKIS w dożylnym bolusie okazało się porównywalne do opisanego w literaturze podobnego roztworu zawierającego diklofenak sodu i hydroksylo-propylo-ß-cyklodekstryny do wstrzykiwań (Dyloject® 75 mg/2 ml, Javelin Pharm. Ltd., Wielka Brytania) podawanym tą samą drogą (Cmax: 15,147 ± 2,829 μg/ml). AUC diklofenaku po podaniu dożylnym w bolusie jest około dwa razy większa w porównaniu do podawania doustnego lub doodbytniczego, ponieważ unika się metabolizmu pierwszego przejścia. Dystrybucja Substancja czynna jest w 99,7% wiązana z białkami osocza, głównie z albuminami (99,4%). Diklofenak przenika do płynu maziowego, gdzie maksymalne stężenie występuje po 2 do 4 godzin od osiągnięcia maksymalnego stężenia w osoczu krwi. Okres półtrwania w fazie eliminacji z płynu maziowego wynosi od 3 do 6 godzin.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWłaściwości farmakokinetyczne
2 godziny po osiągnięciu wartości maksymalnych w osoczu krwi wartości stężenia substancji czynnej w płynie maziowym osiągają już większe wartości w porównaniu do osocza i stan ten utrzymuje się przez maksymalnie 12 godzin. Metabolizm Metabolizm diklofenaku odbywa się częściowo na drodze glukuronidacji niezmienionej cząsteczki, ale diklofenak głównie ulega pojedynczej lub wielokrotnej hydroksylacji i metoksylacji, w wyniku czego powstaje kilka pochodnych fenolowych, których większość zostaje przekształcona do postaci koniugatów glukuronidowych. Dwie pochodne fenolowe są biologicznie aktywne, jednakże w znacznie mniejszym stopniu niż diklofenak. Eliminacja Całkowity klirens układowy diklofenaku w osoczu wynosi 263 ± 56 ml/min (średnia wartość ± SD). Końcowy okres półtrwania w osoczu wynosi 1-2 godziny. Cztery z pochodnych, w tym dwie aktywne, maja także krótki okres półtrwania w osoczu, który wynosi 1-3 godziny.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWłaściwości farmakokinetyczne
Około 60% podanej dawki jest wydalane z moczem w postaci sprzężonych z glukuronidami, niezmienionych cząsteczek i metabolitów, z których większość jest przekształcana do koniugatów glukuronowych. Mniej niż 1% produktu leczniczego jest wydalane w postaci niezmienionej. Pozostała część dawki ulega wydaleniu w postaci metabolitów z żółcią w kale. Szczególne grupy pacjentów Pacjenci w podeszłym wieku: Nie obserwowano istotnych różnic zależnych od wieku w zakresie wchłaniania, metabolizmu lub wydalania. Pacjenci z niewydolnością nerek: Kinetyka pojedynczej dawki z zastosowaniem typowego schematu dawkowania u pacjentów z niewydolnością nerek nie wskazuje na występowanie kumulacji niezmienionej substancji czynnej. W przypadku klirensu kreatyniny <10 ml/min stężenie hydroksypochodnych diklofenaku w osoczu obliczone w stanie równowagi dynamicznej jest o ok. 4 razy większe w porównaniu do pacjentów z prawidłową czynnością nerek. Jednakże ostatecznie pochodne te są wydalane z żółcią.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlWłaściwości farmakokinetyczne
Pacjenci z chorobą wątroby: Kinetyka i metabolizm diklofenaku są takie same u pacjentów ze zdrową wątrobą i u pacjentów z przewlekłym zapaleniem wątroby lub wyrównaną marskością wątroby.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak nowych badań przedklinicznych dotyczących bezpieczeństwa stosowania diklofenaku sodowego. Produkt leczniczy ma dobrze ustalony profil bezpieczeństwa. Badania miejscowej tolerancji wykazały, że produkt nie wywołuje znaczącego nieoczekiwanego, miejscowego działania toksycznego zarówno w przypadku podania domięśniowego, jak i podskórnego.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Hydroksypropylobetadeks Polisorbat 20 Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonano badań dotyczących zgodności. 6.3 Okres ważności 2 lata Po otwarciu opakowania bezpośredniego: zużyć natychmiast. Należy usunąć wszelkie niewykorzystane resztki roztworu. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Nie przechowywać w lodówce ani nie zamrażać. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem. 6.5 Rodzaj i zawartość opakowania Ampułko-strzykawka z bezbarwnego szkła typu I, z osłonką zabezpieczającą wykonaną z syntetycznego izoprenu-bromobutylu oraz z tłokiem z gumy chlorobutylowej (pręt tłoka wykonany z poliestru).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 25 mg/mlDane farmaceutyczne
Zestaw do podania: 1 igła do podania podskórnego (rozmiar 27 G), szara 1 igła do podania domięśniowego lub dożylnego (rozmiar 21 G), zielona Opakowanie: 1, 3 lub 5 ampułko-strzykawek, w tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Nie należy stosować, jeśli pojawią się kryształki lub osad. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO AKIS, 25 mg/ml, roztwór do wstrzykiwań w ampułko-strzykawce AKIS, 50 mg/ml, roztwór do wstrzykiwań w ampułko-strzykawce AKIS, 75 mg/ml, roztwór do wstrzykiwań w ampułko-strzykawce 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancją aktywną jest diklofenak sodowy. 1 ml roztworu w ampułko-strzykawce zawiera 25 mg diklofenaku sodowego, 50 mg diklofenaku sodowego lub 75 mg diklofenaku sodowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań w ampułko-strzykawce (iniekcji). Klarowny do lekko bursztynowego, przezroczysty roztwór.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Wstrzyknięcie domięśniowe lub podskórne: AKIS jest roztworem do wstrzykiwań działającym skutecznie w przypadku ostrego bólu, w tym kolki nerkowej, zaostrzenia choroby zwyrodnieniowej stawów oraz reumatoidalnego zapalenia stawów, ostrego bólu pleców, ostrej dny moczanowej, ostrych urazów i złamań oraz bólu pooperacyjnego (patrz punkt 4.3 i 4.4). Wstrzyknięcie dożylne (bolus): W leczeniu lub profilaktyce bólu pooperacyjnego w warunkach szpitalnych (patrz punkt 4.3 i 4.4). AKIS jest wskazany do stosowania u dorosłych. Nie zaleca się stosowania u dzieci i młodzieży.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Występowanie działań niepożądanych można ograniczyć stosując produkt w najmniejszej skutecznej dawce i nie dłużej niż to koniecznie do kontrolowania objawów (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Dawkowanie Dorośli Roztwór do wstrzykiwań AKIS można podawać domięśniowo, podskórnie lub dożylnie (bolus). AKIS jest przeznaczony wyłącznie do krótkotrwałego leczenia i nie należy go podawać przez więcej niż dwa dni. W przypadku łagodnego i umiarkowanego bólu mniejsze dawki mogą być wystarczające. Leczenie ciężkiego bólu, np. kolki nerkowej, może wymagać zastosowania dawki 75 mg. Wyjątkowo i w ciężkich przypadkach po 6 godzinach można podać drugą dawkę 75 mg. Nie należy przekraczać maksymalnej dawki dobowej, która wynosi 150 mg.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlDawkowanie
Jeśli wymagane jest podanie więcej niż jednej dawki produktu leczniczego AKIS na dobę w postaci iniekcji (maksymalnie 150 mg na dobę), zaleca się zmianę miejsca podania kolejnej iniekcji. Jeśli to konieczne, jedno wstrzyknięcie produktu leczniczego AKIS można stosować razem z innymi postaciami diklofenaku, przy czym nie należy przekraczać maksymalnej dawki dobowej 150 mg. Szczególne grupy pacjentów Pacjenci w podeszłym wieku U pacjentów w podeszłym wieku występuje zwiększone ryzyko poważnych działań niepożądanych (patrz punkt 4.4 i 5.2). Jeśli uzna się za konieczne zastosowanie leku z grupy NLPZ, należy podawać najmniejszą skuteczną dawkę przez jak najkrótszy możliwy okres czasu. Podczas leczenia lekami z grupy NLPZ należy regularnie monitorować pacjenta pod kątem krwawienia z przewodu pokarmowego. Zalecana maksymalna dawka dobowa AKIS wynosi 150 mg.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlDawkowanie
Pacjenci z niewydolnością nerek Hydroksypropylo-beta-cyklodekstryna, która jest substancją pomocniczą AKIS, jest wydalana głównie w procesie przesączania kłębuszkowego. Dlatego też u pacjentów z ciężką niewydolnością nerek (określoną, jako stężenie kreatyniny w surowicy poniżej 30 ml/min) nie należy stosować produktu leczniczego AKIS (patrz punkt 4.4 i 5.2). U pacjentów z niewydolnością nerek należy stosować najmniejszą skuteczną dawkę. Pacjenci z ciężką niewydolnością wątroby lub serca Produkt AKIS roztwór do wstrzykiwań jest przeciwwskazany u pacjentów z ciężkimi zaburzeniami czynności wątroby lub serca (patrz punkt 4.3). Należy zachować ostrożność podczas podawania produktu AKIS pacjentom z łagodnymi do umiarkowanych zaburzeniami czynności wątroby oraz w przypadku pacjentów z nadciśnieniem i (lub) umiarkowaną zastoinową niewydolnością serca stwierdzonymi w wywiadzie (patrz punkt 4.4).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlDawkowanie
Podobnie w przypadku pacjentów, u których istnieje znaczne ryzyko wystąpienia zdarzeń niepożądanych dotyczących układu sercowo-naczyniowego (np. nadciśnienie, hiperlipidemia, cukrzyca, palenie tytoniu), diklofenak można stosować jedynie po starannym rozważeniu celowości takiej terapii (patrz punkt 4.4). Dzieci i młodzież Nie ustalono profilu bezpieczeństwa stosowania i skuteczności produktu leczniczego AKIS u dzieci w wieku 0 - 18 lat. Sposób podawania Produkt leczniczy AKIS należy podawać wyłącznie przez personel medyczny. AKIS można podawać domięśniowo lub podskórnie do czystej zdrowej tkanki lub przez wstrzyknięcie dożylne w bolusie. Należy stosować pojedynczą ampułko-strzykawkę zamiast dwóch ampułko-strzykawek w celu podania ustalonej dawki, tj. jedną iniekcję 75 mg produktu leczniczego zamiast 2 iniekcji dawek 25 mg i 50 mg lub jedną iniekcję 50 mg, zamiast dwóch iniekcji po 25 mg.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlDawkowanie
Podanie domięśniowe Należy przestrzegać następujących wskazówek w przypadku podawania domięśniowego w celu uniknięcia uszkodzenia nerwu lub innej tkanki w miejscu podania. Roztwór należy wstrzykiwać głęboko w górny zewnętrzny kwadrat pośladka. Jeśli wymaga się zastosowania dwóch wstrzyknięć na dobę, zaleca się zmianę pośladka w celu wykonania drugiego wstrzyknięcia. Roztwór należy wstrzykiwać powoli w celu minimalizacji uszkodzenia miejscowej tkanki. Podanie podskórne Roztwór należy podawać do tkanki podskórnej, najlepiej w górną część mięśnia pośladkowego lub górną część uda. Jeśli wymaga się zastosowania dwóch wstrzyknięć na dobę, zaleca się zmianę miejsca podania pomiędzy mięśniem pośladkowym i udem. Należy całkowicie wprowadzić igłę w grubość fałdu skóry, który należy utworzyć chwytając ją między kciuk i palec wskazujący. Należy upewnić się, że produkt leczniczy nie jest wstrzykiwany do naczynia krwionośnego. Roztwór należy wstrzykiwać powoli i w równomiernym tempie.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlDawkowanie
Podczas podawania podskórnego należy przytrzymać fałd skóry między palcami. Podanie dożylne Produkt AKIS może być podany poprzez wstrzyknięcie dożylne w bolusie. Zaleca się stosowanie dwóch alternatywnych schematów: W leczeniu pooperacyjnego bólu o nasileniu umiarkowanym do ciężkiego, należy podać dożylnie 75 mg. W razie konieczności można powtórzyć leczenie po 4 do 6 godzinach, nie przekraczając dobowej dawki 150 mg. W profilaktyce bólu pooperacyjnego należy podać dawkę nasycającą 25 mg do 50 mg w 5 – 60 sekundowym wstrzyknięciu (bolus) po zabiegu, a następnie wykonywać kolejne dodatkowe wstrzyknięcia do maksymalnej dawki dobowej 150 mg. W razie konieczności można powtórzyć leczenie po 4 do 6 godzinach, nie przekraczając dawki dobowej 150 mg. Produktu leczniczego AKIS nie wolno podawać w infuzji dożylnej. Instrukcje dotyczące zastosowania i przygotowania produktu leczniczego do stosowania, patrz punkt 6.6.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Czynna choroba wrzodowa żołądka lub dwunastnicy, krwawienie lub perforacja. Krwawienie z przewodu pokarmowego w wywiadzie lub perforacja związana z uprzednim leczeniem lekami z grupy NLPZ. Czynna lub nawracająca w wywiadzie choroba wrzodowa lub krwotok (dwa lub więcej różnych epizodów owrzodzenia lub krwawienia). Ostatni trymestr ciąży (patrz punkt 4.6). Ciężka niewydolność wątroby, nerek lub serca (patrz punkt 4.4). Podobnie jak inne niesteroidowe leki przeciwzapalne (NLPZ), diklofenak jest także przeciwwskazany u pacjentów, u których kwas acetylosalicylowy lub inne leki z grupy NLPZ wywołują napady astmy, pokrzywkę lub ostry nieżyt błony śluzowej nosa. Zaburzenia homeostazy lub jednoczesne leczenie lekami przeciwzakrzepowymi (przeciwwskazanie wyłącznie do domięśniowego podawania produktu).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlPrzeciwwskazania
Stwierdzona zastoinowa niewydolność serca (klasa II–IV wg NYHA), choroba niedokrwienna serca, choroba naczyń obwodowych i (lub) choroba naczyń mózgowych. Dla podania dożylnego: Jednoczesne stosowanie NLPZ i leków przeciwzakrzepowych (w tym małych dawek heparyny). Skłonność do krwotoków oraz potwierdzone lub podejrzewane krwawienia mózgowo-naczyniowe, w wywiadzie. Operacje związane z dużym ryzykiem krwotoku. Astma w wywiadzie. Umiarkowana lub ciężka niewydolność nerek (kreatynina w surowicy > 160µmol/l). Hipowolemia lub odwodnienie z dowolnej przyczyny.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ogólne Działania niepożądane można ograniczyć stosując najmniejszą skuteczną dawkę przez jak najkrótszy okres czasu niezbędny do kontrolowania objawów (patrz punkt 4.2 i wpływ na przewód pokarmowy i układ krążenia poniżej). Należy unikać jednoczesnego stosowania diklofenaku z lekami z grupy NLPZ o działaniu ogólnoustrojowym, w tym z selektywnymi inhibitorami cyklooksygenazy-2, ze względu na brak dowodów wskazujących na korzyści wynikające z działania synergistycznego i możliwe dodatkowe działania niepożądane. Należy zachować ostrożność stosując AKIS u pacjentów w podeszłym wieku ze względów medycznych. W szczególności zaleca się stosowanie najmniejszej skutecznej dawki u osłabionych pacjentów w podeszłym wieku lub pacjentów z małą masą ciała.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlSpecjalne środki ostrozności
Podobnie jak w przypadku innych leków z grupy NLPZ, w rzadkich przypadkach, mogą wystąpić reakcje alergiczne w związku z przyjmowaniem diklofenaku bez uprzedniej ekspozycji na jego działanie, w tym reakcje anafilaktyczne/rzekomoanafilaktyczne. Reakcje nadwrażliwości mogą także rozwinąć się w zespół Kounisa, ciężką reakcję alergiczną, która może prowadzić do zawału mięśnia sercowego. Objawy takich reakcji mogą obejmować ból w klatce piersiowej występujący w związku z reakcją alergiczną na diklofenak. Podobnie jak inne leki z grupy NLPZ, diklofenak może maskować objawy przedmiotowe i podmiotowe zakażenia w związku ze swoimi właściwościami farmakodynamicznymi. Należy ściśle przestrzegać zaleceń dotyczących wykonywania wstrzyknięć domięśniowych, aby uniknąć zdarzeń niepożądanych w miejscu wstrzyknięcia, mogących doprowadzić do osłabienia mięśni, porażenia mięśni, niedoczulicy, embolia cutis medicamentosa (zespół Nicolaua) i martwicy w miejscu wstrzyknięcia.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlSpecjalne środki ostrozności
Reakcje w miejscu wstrzyknięcia Zgłaszano występowanie reakcji w miejscu wstrzyknięcia po podaniu domięśniowym diklofenaku, obejmującą martwicę w miejscu wstrzyknięcia oraz embolia cutis medicamentosa, znaną także jako zespół Nicolaua (zwłaszcza po nieumyślnym podaniu podskórnym). Podczas domięśniowego podawania diklofenaku należy stosować właściwy dobór igły i techniki wstrzykiwania (patrz punkt 4.2 i (lub) 6.6, w stosownych przypadkach). Wpływ na przewód pokarmowy W związku z przyjmowaniem wszystkich leków z grupy NLPZ, w tym diklofenaku, zgłaszano krwawienie z przewodu pokarmowego, owrzodzenie i perforację, które mogą prowadzić do zgonu i mogą pojawić się w dowolnym momencie leczenia, z lub bez objawów ostrzegawczych lub poważnych zdarzeń żołądkowo-jelitowych w wywiadzie. Ogólnie działania te mają poważniejsze konsekwencje u pacjentów w podeszłym wieku.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlSpecjalne środki ostrozności
Jeśli u pacjentów przyjmujących diklofenak wystąpi krwawienie z przewodu pokarmowego lub owrzodzenie, należy przerwać leczenie tym produktem leczniczym. Podobnie jak w przypadku wszystkich leków z grupy NLPZ, w tym diklofenaku, konieczny jest ścisły nadzór medyczny i zachowanie szczególnej ostrożności w przypadku przepisywania diklofenaku pacjentom z objawami wskazującymi na zaburzenia przewodu pokarmowego lub z zaburzeniami w wywiadzie wskazującymi na owrzodzenie żołądka lub dwunastnicy, krwawienie lub perforację (patrz punkt 4.8). Ryzyko wystąpienia krwawienia z przewodu pokarmowego jest wyższe w przypadku zwiększania dawek leków z grupy NLPZ i u pacjentów z chorobą wrzodową w wywiadzie, w szczególności, jeśli jest ona powiązana z krwotokiem lub perforacją. U pacjentów w podeszłym wieku częstość występowania działań niepożądanych związanych ze stosowaniem leków z grupy NLPZ, w szczególności krwawienia z przewodu pokarmowego i perforacji, które mogą prowadzić do zgonu, jest większa.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlSpecjalne środki ostrozności
Aby zmniejszyć ryzyko wystąpienia działania toksycznego w obrębie przewodu pokarmowego u pacjentów z chorobą wrzodową w wywiadzie, w szczególności, jeśli jest ona powiązana z krwotokiem lub perforacją oraz u pacjentów w podeszłym wieku, podczas leczenia wstępnego i podtrzymującego należy stosować najmniejszą skuteczną dawkę. U tych grup pacjentów oraz u pacjentów wymagających jednoczesnego stosowania produktów leczniczych zawierających małe dawki kwasu acetylosalicylowego (ASA)/aspiryna lub innych produktów leczniczych, które mogą zwiększać ryzyko działania toksycznego w obrębie przewodu pokarmowego, należy rozważyć leczenie skojarzone z lekami osłonowymi (np. inhibitory pompy protonowej lub mizoprostol). Pacjenci, u których występuje działanie toksyczne w obrębie przewodu pokarmowego w wywiadzie, w szczególności pacjenci w podeszłym wieku, powinni zgłaszać wszelkie nietypowe objawy występujące w zakresie jamy brzusznej (w szczególności krwawienie z przewodu pokarmowego).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlSpecjalne środki ostrozności
Zaleca się zachowanie ostrożności u pacjentów przyjmujących jednocześnie leki, które mogą zwiększać ryzyko wystąpienia owrzodzenia lub krwawienia, tj. kortykosteroidy o działaniu ogólnoustrojowym, leki przeciwzakrzepowe, leki przeciwpłytkowe lub selektywne inhibitory wychwytu zwrotnego serotoniny (patrz punkt 4.5). Należy zachować ostrożność i ściśle monitorować pacjentów z wrzodziejącym zapaleniem jelita grubego lub chorobą Crohna, ponieważ ich stan może ulec zaostrzeniu (patrz punkt 4.8). Stosowanie NLPZ, w tym diklofenaku, może wiązać się ze zwiększeniem ryzyka nieszczelności zespolenia żołądkowo-jelitowego. Zaleca się ścisły nadzór medyczny i zachowanie ostrożności podczas stosowania diklofenaku po operacjach przewodu pokarmowego. Wpływ na wątrobę Należy ściśle monitorować pacjentów z zaburzeniem czynności wątroby przyjmujących diklofenak, ponieważ ich stan może ulec zaostrzeniu.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlSpecjalne środki ostrozności
Podobnie jak w przypadku innych leków z grupy NLPZ, w tym diklofenaku, może wystąpić zwiększenie aktywności jednego lub więcej enzymów wątrobowych. Podczas długotrwałego leczenia diklofenakiem jako środek ostrożności zaleca się regularne kontrolowanie czynności wątroby. W przypadku utrzymywania się lub pogarszania nieprawidłowych wyników testów czynnościowych wątroby lub wystąpienia klinicznych objawów przedmiotowych i podmiotowych wskazujących na chorobę wątroby, lub jeśli wystąpią inne objawy (eozynofilia, wysypka), należy przerwać stosowanie diklofenaku. W przypadku stosowania diklofenaku może wystąpić zapalenie wątroby bez objawów prodromalnych. Należy zachować ostrożność stosując diklofenak u pacjentów z porfirią, ponieważ może on wywołać napad. Wpływ na nerki Ze względu na to, iż zgłaszano przypadki zatrzymania płynów i obrzęku w związku z leczeniem lekami z grupy NLPZ, w tym diklofenakiem, należy zachować szczególną ostrożność u pacjentów z zaburzeniem czynności serca i nerek, nadciśnieniem w wywiadzie, u pacjentów w podeszłym wieku, u pacjentów stosujących jednocześnie leki moczopędne lub produkty lecznicze, które istotnie wpływają na czynność nerek oraz u pacjentów ze znacznym zmniejszeniem objętości pozakomórkowej z jakiegokolwiek powodu, np.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlSpecjalne środki ostrozności
przed lub po większym zabiegu chirurgicznym (patrz punkt 4.3). W tych przypadkach jako środek ostrożności po zastosowaniu diklofenaku zaleca się monitorowanie czynności nerek. Przerwanie leczenia zazwyczaj prowadzi do powrotu do stanu zdrowia sprzed leczenia. Hydroksypropylo-beta-cyklodekstryna, która jest substancją pomocniczą, jest wydalana głównie przez nerki w procesie przesączania kłębuszkowego. Dlatego też u pacjentów z ciężką niewydolnością nerek (określoną, jako stężenie kreatyniny w surowicy poniżej 30 ml/min) nie należy stosować roztworu do wstrzykiwań AKIS. U pacjentów z niewydolnością nerek należy stosować najmniejszą skuteczną dawkę. Wpływ na skórę W związku ze stosowaniem leków z grupy NLPZ bardzo rzadko zgłaszano ciężkie reakcje skórne, niekiedy prowadzące do zgonu, w tym złuszczające zapalenie skóry, zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka (patrz punkt 4.8).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlSpecjalne środki ostrozności
Ryzyko wystąpienia tych reakcji wydaje się być wyższe w początkowej fazie leczenia: większość reakcji odnotowywano w ciągu pierwszego miesiąca leczenia. Należy przerwać leczenie produktem leczniczym AKIS po wystąpieniu pierwszych objawów wysypki skórnej, zmian na błonach śluzowych lub jakichkolwiek innych objawów nadwrażliwości. Wpływ na układ krążenia i naczynia mózgu Ze względu na to, że zgłaszano przypadki zatrzymania płynów i obrzęku w związku z leczeniem lekami z grupy NLPZ, wymagany jest odpowiedni monitoring i konsultacje u pacjentów z nadciśnieniem w wywiadzie i (lub) łagodną do umiarkowanej zastoinową niewydolnością serca. Dane z badań klinicznych i dane epidemiologiczne wskazują na prawdopodobieństwo związku między leczeniem diklofenakiem (w szczególności w dużych dawkach, 150 mg na dobę i w długotrwałym leczeniu) i niewielkim zwiększeniem ryzyka wystąpienia przypadków zakrzepicy tętniczej (np. zawał serca mięśniowego lub udar mózgu).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlSpecjalne środki ostrozności
Diklofenak należy stosować bardzo ostrożnie u pacjentów z istotnymi czynnikami ryzyka zdarzeń dotyczących układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Produkt ten należy stosować możliwie jak najkrócej i w najmniejszej skutecznej dawce dobowej, ze względu na możliwość nasilenia ryzyka dotyczącego układu krążenia po zastosowaniu diklofenaku w dużych dawkach i długotrwale. Należy okresowo kontrolować konieczność kontynuacji leczenia objawowego i odpowiedź na leczenie. Wpływ na układ krwiotwórczy Podczas długotrwałego leczenia diklofenakiem, podobnie jak w przypadku innych leków z grupy NLPZ, zaleca się monitorowanie morfologii krwi. Podobnie jak inne leki z grupy NLPZ, diklofenak może przejściowo zahamować agregację płytek krwi. Należy starannie monitorować pacjentów z zaburzeniem homeostazy. Może pojawić się niedokrwistość w związku z zatrzymaniem wody lub wpływem na erytropoezę.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlSpecjalne środki ostrozności
Dlatego też, w przypadku wykrycia objawów niedokrwistości, zalecane jest monitorowanie poziomu hemoglobiny i hematokrytu. U pacjentów chorych na cukrzycę lub pacjentów przyjmujących również leki moczopędne oszczędzające potas może wystąpić hiperkaliemia (patrz punkt 4.5). Astma w wywiadzie U pacjentów z astmą, sezonowym alergicznym zapaleniem błony śluzowej nosa, obrzękiem błony śluzowej nosa (np. polipy nosa), przewlekłą obturacyjną chorobą płuc lub przewlekłymi infekcjami dróg oddechowych (szczególnie, jeśli związane z objawami podobnymi do alergicznego zapalenia błony śluzowej nosa), reakcje na leki z grupy NLPZ, np. zaostrzenie astmy (tzw. nietolerancja leków przeciwbólowych/astma indukowana lekami przeciwbólowymi), obrzęk naczynioruchowy lub pokrzywka występują częściej w porównaniu do innych pacjentów. Dlatego też należy zachować szczególną ostrożność u tych pacjentów (zapewnić gotowość pomocy lekarskiej). Dotyczy to także pacjentów, którzy są uczuleni na inne substancje, np.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlSpecjalne środki ostrozności
pacjentów z reakcjami skórnymi, świądem lub pokrzywką. SLE i mieszana choroba tkanki łącznej U pacjentów z układowym toczniem rumieniowatym (SLE) i mieszaną chorobą tkanki łącznej może wystąpić podwyższone ryzyko aseptycznego zapalenia opon mózgowych (patrz punkt 4.8). Podanie Roztwór należy podawać przestrzegając ściśle zasad aseptyki i antyseptyki. Czas leczenia Nie należy stosować produktu leczniczego AKIS dłużej niż przez 2 dni. Po 2 dniach należy zweryfikować konieczność zastosowania alternatywnego leku z grupy NLPZ i w przypadku konieczności długotrwałego leczenia lekami z grupy NLPZ, należy monitorować pacjenta pod kątem zaburzenia czynności wątroby i nerek oraz zaburzeń morfologii krwi. Jest to szczególnie istotne w przypadku pacjentów w podeszłym wieku. Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na jednostkę dawkowania, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Poniższe interakcje obejmują interakcje obserwowane podczas stosowania diklofenaku w postaci tabletek dojelitowych i (lub) innej postaci farmaceutycznej. Lit: Leki z grupy NLPZ powodują zmniejszenie wydalania litu przez nerki i w związku z tym zwiększenie stężenia litu w osoczu. Jeśli zastosowanie tego połączenia jest konieczne, należy kontrolować stężenie litu we krwi i dostosować jego dawkę zarówno podczas leczenia wstępnego, skojarzonego, jak i po odstawieniu diklofenaku. Digoksyna: W przypadku jednoczesnego stosowania diklofenak może zwiększać stężenie digoksyny w osoczu. Zaleca się monitorowanie stężenia digoksyny w surowicy. Leki moczopędne, inhibitory ACE, antagoniści receptora angiotensyny II: Leki z grupy NLPZ mogą zmniejszać przeciwnadciśnieniowe działanie leków moczopędnych i innych leków przeciwnadciśnieniowych (tj. leki beta-adrenolityczne, inhibitory konwertazy angiotensyny [ACE]).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlInterakcje
U niektórych pacjentów z zaburzoną czynnością nerek (np. u pacjentów odwodnionych lub u pacjentów w wieku podeszłym z zaburzoną czynnością nerek) jednoczesne stosowanie inhibitora ACE lub antagonisty receptora angiotensyny II i leków hamujących cyklooksygenazę może powodować dalsze, zwykle odwracalne, zaburzenia czynności nerek, w tym możliwą ostrą niewydolność nerek. Dlatego też kombinację leków należy stosować ostrożnie, szczególnie u pacjentów w podeszłym wieku. Pacjenci powinni być odpowiednio nawodnieni. Należy też rozważyć monitorowanie czynności nerek po rozpoczęciu leczenia towarzyszącego, a także okresowo w okresie późniejszym (patrz także punkt 4.4). Jednoczesne leczenie lekami moczopędnymi oszczędzającymi potas może powodować zwiększenie poziomu potasu w osoczu, które należy regularnie monitorować (patrz punkt 4.4).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlInterakcje
Inne leki z grupy NLPZ, kortykosteroidy i kwas acetylosalicylowy: Jednoczesne podawanie diklofenaku i innych leków z grupy NLPZ o działaniu ogólnoustrojowym lub kortykosteroidów lub kwasu acetylosalicylowego może zwiększyć częstość występowania działań niepożądanych i nie jest zalecane (patrz punkt 4.4). Leki przeciwzakrzepowe i heparyna (leczenie pacjentów w podeszłym wieku lub w dawkach leczniczych): Zaleca się ostrożność, ponieważ jednoczesne podawanie z lekami z grupy NLPZ może zwiększyć ryzyko wystąpienia krwawienia poprzez hamowanie czynności płytek krwi i uszkodzenia błony śluzowej żołądka i dwunastnicy (patrz punkt 4.4). Leki z grupy NLPZ mogą nasilać działanie leków przeciwzakrzepowych, tj. warfaryna lub heparyna. Nie zaleca się podawania heparyny u pacjentów w podeszłym wieku lub w dawkach leczniczych. Należy starannie monitorować międzynarodowy współczynnik znormalizowany (INR), jeśli nie można uniknąć jednoczesnego podawania.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlInterakcje
Pomimo, iż badania kliniczne nie wskazują na to, że diklofenak wpływa na działanie leków przeciwzakrzepowych, doniesienia ujawniają zwiększone ryzyko wystąpienia krwotoku u pacjentów przyjmujących jednocześnie diklofenak i leki przeciwzakrzepowe. Stąd zaleca się ścisłe monitorowanie tych pacjentów. Leki trombolityczne i leki przeciwpłytkowe: Zaleca się ostrożność, ponieważ jednoczesne podawanie z lekami z grupy NLPZ może zwiększyć ryzyko wystąpienia krwawienia poprzez hamowanie czynności płytek krwi i uszkodzenia błony śluzowej żołądka i dwunastnicy. Selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI): Jednoczesne podawanie leków z grupy NLPZ o działaniu ogólnoustrojowym, w tym diklofenaku i SSRI może zwiększać ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.4). Leki przeciwcukrzycowe: Badania kliniczne wykazały, że diklofenak może być podawany z doustnymi lekami przeciwcukrzycowymi bez wywierania wpływu na ich działanie kliniczne.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlInterakcje
Jednakże odnotowano pojedyncze przypadki działań hipoglikemizujących i hiperglikemizujących, które wymagały dostosowania dawki leków przeciwcukrzycowych podczas leczenia diklofenakiem. Dlatego też jako środek zapobiegawczy podczas leczenia towarzyszącego zaleca się monitorowanie stężenia glukozy we krwi. Metotreksat: Diklofenak może zmniejszać klirens nerkowy metotreksatu, podnosząc tym samym poziom metotreksatu. Zaleca się ostrożność przy podawaniu leków z grupy NLPZ, w tym diklofenaku, na mniej niż 24 godziny przed lub po leczeniu metotreksatem, ponieważ w przeciwnym razie może to powodować zwiększenie stężenia metotreksatu we krwi i zwiększenie toksyczności tej substancji. Zaleca się cotygodniowe kontrolowanie morfologii krwi podczas kilku pierwszych tygodni leczenia skojarzonego. Należy zintensyfikować monitorowanie w przypadku pacjentów z zaburzeniem czynności nerek lub pacjentów w podeszłym wieku.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlInterakcje
Zastosowanie pemetreksedu u pacjentów z prawidłową czynnością nerek, klirens kreatyniny > 80 ml/min: Zwiększone ryzyko toksyczności pemetreksedu w związku z obniżeniem klirensu kreatyniny pemetreksedu. Zaleca się biologiczny monitoring czynności nerek. Inhibitory kalcyneuryny (np. cyklosporyna, takrolimus): Działanie nefrotoksyczne inhibitorów kalcyneuryny może się zwiększać pod wpływem leków z grupy NLPZ poprzez działanie za pośrednictwem prostaglandyn nerkowych. Podczas jednoczesnego leczenia zaleca się monitorowanie czynności nerek, w szczególności pacjentów w podeszłym wieku. Deferazyroks: Jednoczesne podawanie leków z grupy NLPZ o działaniu ogólnoustrojowym i deferazyroksu może zwiększać ryzyko toksycznego działania na przewód pokarmowy. Należy ściśle monitorować pacjentów, którym jednocześnie podawane są te leki. Chinolony przeciwbakteryjne: Zgłaszano pojedyncze przypadki drgawek, które mogą być związane z jednoczesnym stosowaniem chinolonów i leków z grupy NLPZ.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlInterakcje
Fenytoina: Podczas jednoczesnego stosowania fenytoiny z diklofenakiem zaleca się monitorowanie stężenia fenytoiny w osoczu w związku z nieoczekiwanym zwiększeniem jej stężenia. Kolestypol i cholestyramina: Leki te mogą powodować opóźnienie lub zmniejszenie wchłaniania diklofenaku. Dlatego też zaleca się podawanie diklofenaku przynajmniej na godzinę przed lub 4 do 6 godzin po podaniu kolestypolu/cholestyraminy. Silne inhibitory CYP2C9: Zaleca się ostrożność podczas przepisywania jednocześnie diklofenaku i silnych inhibitorów CYP2CP (tj. sulfinpirazon i worykonazol), które mogą powodować istotne zwiększenie maksymalnego stężenia w osoczu i zwiększenie stężenia diklofenaku w związku z hamowaniem jego metabolizmu. Mifepryston: Nie należy stosować leków z grupy NLPZ w ciągu 8-12 dni po podaniu mifeprystonu, ponieważ NLPZ mogą zmniejszać działanie mifepristonu. Takrolimus: Możliwe zwiększenie ryzyka nefrotoksyczności w przypadku podawania NLPZ z takrolimusem.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlInterakcje
Może to być spowodowane przez działanie przeciwko nerkowej prostaglandynie przez NLPZ, jak i inhibitora kalcyneuryny. Zydowudyna: Jednoczesne podawanie leków z grupy NLPZ z zydowudyną zwiększa ryzyko toksycznego działania na układ krwiotwórczy. Udowodniono, że jednoczesne podawanie ibuprofenu i zydowudyny zwiększa ryzyko wylewu krwi do stawu i krwiaka u pacjentów chorych na hemofilię i zakażonych wirusem HIV. Pomimo, iż AKIS w znacznym stopniu wiąże się z białkami, nie zakłóca on wiązania białka z: salicylanami, tolbutamidem i prednizolonem.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może wpływać negatywnie na ciążę i (lub) rozwój zarodka/płodu. Dane z badań epidemiologicznych wskazują na prawdopodobieństwo zwiększonego ryzyka poronienia, wady rozwojowej serca i wytrzewienia po zastosowaniu inhibitora syntezy prostaglandyn we wczesnym stadium ciąży. Ryzyko całkowite wady rozwojowej serca wzrosło z poniżej 1% do ok. 1,5%. Uważa się, że ryzyko to wzrasta wraz z dawką i czasem leczenia. Zastosowanie inhibitorów syntezy prostaglandyn u zwierząt wskazywało na zwiększoną ilość strat przed- i poimplantacyjnych oraz śmiertelność zarodków i płodów. Dodatkowo odnotowano zwiększoną częstość występowania różnych wad rozwojowych, w tym serca, u zwierząt, którym podawano inhibitory syntezy prostaglandyn w okresie organogenezy. Od 20. tygodnia ciąży stosowanie diklofenaku może powodować małowodzie wskutek zaburzeń czynności nerek płodu.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWpływ na płodność, ciążę i laktację
Może ono wystąpić krótko po rozpoczęciu leczenia i jest zwykle odwracalne po jego przerwaniu. Ponadto zgłaszano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze, z których większość ustąpiła po zaprzestaniu leczenia. Z tego względu, nie należy podawać produktu leczniczego AKIS w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. Jeśli diklofenak jest stosowany u kobiet planujących ciążę lub w pierwszym lub drugim trymestrze ciąży, należy podawać jak najmniejszą możliwą skuteczną dawkę przez możliwie jak najkrótszy okres czasu. Należy rozważyć przedporodowe monitorowanie w kierunku małowodzia oraz zwężenia przewodu tętniczego po ekspozycji na diklofenak przez kilka dni od 20. tygodnia ciąży. W przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego należy zaprzestać stosowania produktu leczniczego AKIS.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWpływ na płodność, ciążę i laktację
Podczas trzeciego trymestru ciąży wszystkie inhibitory syntezy prostaglandyn mogą działać na płód w następujący sposób: powodować toksyczne działanie na serce i płuca (przedwczesne zwężenie/zamknięciem przewodu tętniczego i nadciśnienie płucne); powodować zaburzenia nerek (patrz powyżej); U matki i noworodka pod koniec ciąży mogą prowadzić do: możliwego wydłużenia czasu krwawienia, działania hamującego agregację płytek, które mogą wystąpić nawet przy stosowaniu małych dawek; hamowanie skurczów macicy i wskutek tego opóźnionego lub wydłużonego porodu. W związku z tym, produkt leczniczy AKIS jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3). Karmienie piersi? Podobnie jak inne leki z grupy NLPZ, diklofenak przenika do mleka ludzkiego w niewielkich ilościach. Dlatego też nie należy podawać produktu leczniczego AKIS w okresie karmienia piersią w celu uniknięcia działań niepożądanych u niemowlęcia.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWpływ na płodność, ciążę i laktację
Płodność Podobnie jak w przypadku innych leków z grupy NLPZ, zastosowanie diklofenaku może zaburzać płodność i nie jest zalecane u kobiet planujących ciążę. U kobiet, które mają trudności z zajściem w ciążę lub są poddawane badaniom płodności, należy rozważyć przerwanie stosowania produktu leczniczego AKIS.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjenci, u których podczas leczenia diklofenakiem występują zaburzenia widzenia, oszołomienie, zawroty głowy, senność lub inne zaburzenia ośrodkowego układu nerwowego, nie powinni prowadzić pojazdów ani obsługiwać maszyn.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne Najczęściej występujące działania niepożądane, które obserwowano podczas badań klinicznych z produktem leczniczym AKIS obejmowały reakcje ze strony żołądka i jelit oraz reakcje w miejscu podania i ogólnie były łagodne i krótkotrwałe. Dane z badań klinicznych sugerują, że zastosowanie diklofenaku w postaci roztworu do wstrzykiwań jest związane z występowaniem reakcji w miejscu podania, takich jak: ból i krwiak. Częstość występowania działań niepożądanych w miejscu podania była istotnie mniejsza w przypadku leczenia dawkami 25 i 50 mg w porównaniu do dawki 75 mg. Po wstrzyknięciu dożylnym (bolus) dawki 75 mg w ciągu 5 do 30 sekund, odnotowano uczucie dyskomfortu w okolicy wokół miejsca wstrzyknięcia. Po podaniu diklofenaku obserwowano także: nudności, wymioty, biegunkę i zaparcie.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlDziałania niepożądane
Dane po wprowadzeniu do obrotu Znane reakcje niepożądane związane ze stosowaniem produktu AKIS, podawanego domięśniowo i podskórnie, to reakcje w miejscu wstrzyknięcia, często związane ze sposobem podawania, w tym ból w miejscu wstrzyknięcia, rumień i wysypka. W niektórych przypadkach zgłaszano reakcje nadwrażliwości wraz z uogólnionymi objawami. Działania niepożądane są przedstawione poniżej zgodnie z klasyfikacją układów i narządów MedDRA i następującą konwencją dotyczącą częstości: bardzo często (≥1/10); często (≥1/100 - <1/10); niezbyt często (≥1/1 000 - <1/100); rzadko (≥1/10 000 - <1/1 000); bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Klasyfikacja układów i narządów Częstość Działanie niepożądane częstość nieznana martwica w miejscu wstrzyknięcia rzadko reakcje nadwrażliwości niezbyt często oszołomienie, ból głowy często nudności, biegunka, wymioty, zaparcie, zapalenie żołądka, niedokrwienne zapalenie okrężnicy niezbyt często zwiększenie aktywności enzymów wątrobowych niezbyt często świąd często uczucie dyskomfortu w kończynach bardzo często reakcje w miejscu podania, embolia cutis medicamentosa (zespół Nicolaua) Do opisu niektórych działań niepożądanych zastosowano najbardziej odpowiednie terminy MedDRA.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlDziałania niepożądane
Nie zastosowano synonimów i stanów pokrewnych, jednakże należy je także uwzględnić. Klasyfikacja układów i narządów Działania niepożądane (tabela 1) uporządkowano według częstości występowania, zaczynając od najczęściej występujących, zgodnie z następującą konwencją: bardzo często (≥1/10); często (≥1/100 - <1/10); niezbyt często (≥1/1 000 - <1/100); rzadko (≥1/10 000 - <1/1 000); bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Następujące działania niepożądane obejmują działania niepożądane zgłaszane zarówno w przypadku krótkotrwałego, jak i długotrwałego stosowania. Tabela 1 Zaburzenia krwi i układu chłonnego bardzo rzadko: małopłytkowość, leukopenia, niedokrwistość (w tym niedokrwistość hemolityczna i aplastyczna), agranulocytoza Zaburzenia układu immunologicznego rzadko: nadwrażliwość, reakcje anafilaktyczne i rzekomoanafilaktyczne (w tym niedociśnienie tętnicze i wstrząs), obrzęk naczynioruchowy (w tym obrzęk twarzy) Zaburzenia psychiczne bardzo rzadko: dezorientacja, depresja, bezsenność, koszmary senne, drażliwość, zaburzenia psychotyczne Zaburzenia układu nerwowego często: ból głowy, zawroty głowy, senność rzadko: parestezje, zaburzenie pamięci, drgawki, lęk, drżenie, aseptyczne zapalenie opon mózgowych, epizod naczyniowo-mózgowy Zaburzenia oka bardzo rzadko: zaburzenia widzenia, niewyraźne widzenie, podwójne widzenie Zaburzenia ucha i błędnika często: zawroty głowy bardzo rzadko: szumy uszne, zaburzenie słuchu Zaburzenia serca bardzo rzadko: palpitacje, ból w klatce piersiowej, niewydolność serca, zawał serca mięśniowego, zespół Kounisa Zaburzenia naczyniowe bardzo rzadko: nadciśnienie tętnicze, zapalenie naczyń Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia rzadko: astma (w tym duszność) bardzo rzadko: zapalenie płuc Zaburzenia żołądka i jelit często: nudności, wymioty, biegunka, dyspepsja, ból brzucha, wzdęcia, anoreksja rzadko: zapalenie żołądka, krwotok z przewodu pokarmowego, krwawe wymioty, biegunka krwotoczna, krew w kale, choroba wrzodowa przewodu pokarmowego (z krwawieniem lub perforacją albo bez) bardzo rzadko: zapalenie jelita grubego (w tym krwotoczne zapalenie jelita grubego i zaostrzenie wrzodziejącego zapalenia jelita grubego lub choroby Leśniowskiego-Crohna), zaparcie, zapalenie błony śluzowej jamy ustnej (w tym wrzodziejące zapalenie błony śluzowej jamy ustnej), zapalenie języka, zaburzenia w obrębie przełyku, przeponopodobne zwężenia jelita, zapalenie trzustki Zaburzenia wątroby i dróg żółciowych często: zwiększenie aktywności aminotransferaz rzadko: zapalenie wątroby, żółtaczka, zaburzenie czynności wątroby bardzo rzadko: piorunujące zapalenie wątroby, martwica wątroby, niewydolność wątroby Zaburzenia skóry i tkanki podskórnej często: wysypka rzadko: pokrzywka bardzo rzadko: wysypki pęcherzowe, wyprysk, rumień, rumień wielopostaciowy, zespół Stevensa-Johnsona, martwica toksyczno-rozpływna naskórka (zespół Lyell), złuszczające zapalenie skóry, łysienie, reakcje nadwrażliwości na światło, plamica, plamica alergiczna, świąd Zaburzenia nerek i dróg moczowych bardzo rzadko: ostra niewydolność nerek, krwiomocz, białkomocz, zespół nerczycowy, śródmiąższowe zapalenie nerek, martwica brodawek nerkowych Zaburzenia ogólne i stany w miejscu podania często: reakcje w miejscu podania, ból w miejscu podania, stwardnienie w miejscu podania, obrzęk, martwica w miejscu podania Zakażenia i zarażenia pasożytnicze bardzo rzadko: ropień w miejscu podania Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg/dobę) i w leczeniu długotrwałym zwiększa ryzyko zakrzepicy tętnic (np.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlDziałania niepożądane
zawał serca lub udar) (patrz punkty 4.3 Przeciwwskazania i 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem: Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181 C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy Brak typowych objawów klinicznych związanych z przedawkowaniem diklofenaku. Przedawkowanie może powodować następujące objawy: wymioty, krwotok z przewodu pokarmowego, biegunka, oszołomienie, szum uszny lub drgawki. W przypadku znacznego zatrucia, możliwe jest wystąpienie ostrej niewydolności nerek lub uszkodzenia wątroby. Leczenie przedawkowania Postępowanie w przypadku ostrego zatrucia lekami z grupy NLPZ, w tym diklofenakiem, w szczególności polega na zastosowaniu postępowania podtrzymującego czynności organizmu i leczenia objawowego. Należy zastosować postępowanie podtrzymujące czynności organizmu i leczenie objawowe w przypadku powikłań, takich jak: niedociśnienie tętnicze niewydolność nerek zaburzenia żołądkowo-jelitowe depresja oddechowa Specjalne środki, takie jak wymuszona diureza, dializa lub hemoperfuzja prawdopodobnie nie są pomocne w eliminacji leków z grupy NLPZ, w tym diklofenaku, z uwagi na wysoki stopień wiązania z białkami osocza i rozległy metabolizm.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne (NLPZ) kod ATC: M01AB05. Klasyfikacja podgrupy terapeutycznej: leki działające na układ mięśniowo-szkieletowy/ niesteroidowe leki przeciwzapalne i przeciwreumatyczne/pochodne kwasu octowego i związki o podobnej budowie. Mechanizm działania Roztwór do wstrzykiwań AKIS jest niesteroidowym lekiem o właściwościach przeciwbólowych i przeciwzapalnych. Jest on inhibitorem syntetazy prostaglandyn (cyklooksygenazy). In vitro diklofenak sodu nie hamuje biosyntezy proteoglikanów w chrząstce przy stężeniach równoważnych ze stężeniami osiąganymi u ludzi. Po jednoczesnym stosowaniu z opioidami w celu leczenia bólu pooperacyjnego diklofenak sodowy często zmniejsza konieczność stosowania opioidów. Skuteczność kliniczna Działanie przeciwbólowe AKIS badano w dwóch głównych badaniach działania przeciwbólowego po zabiegach stomatologicznych, które obejmowały pacjentów z bólem o nasileniu umiarkowanym do ciężkiego po zabiegach usuwania zębów z powodu wklinowania.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWłaściwości farmakodynamiczne
W ramach pierwszego badania porównywano działanie przeciwbólowe AKIS podanego podskórnie z placebo. AKIS we wszystkich mocach wykazywał statystycznie znamiennie wyższe zmniejszenie bólu o nasileniu umiarkowanym do ciężkiego po zabiegu usuwania zęba z powodu wklinowania (zgodnie z pomiarami wg skali VAS) w porównaniu do placebo (p<0,001). AKIS także wykazywał znacząco większe działanie przeciwbólowe w pomiarach skuteczności wtórnej, czasu do wystąpienia działania przeciwbólowego, zastosowania leków doraźnych przez 8 godzin po podaniu produktu i odsetka pacjentów z 30% zmniejszeniem intensywności bólu po 1,5 godziny po podaniu produktu w porównaniu z placebo (p<0,001 we wszystkich porównaniach z placebo; nie wykryto statystycznej różnicy w porównaniach pomiędzy aktywnymi lekami). W ramach drugiego badania działania przeciwbólowego po zabiegach stomatologicznych porównywano działanie przeciwbólowe AKIS podanego podskórnie z lekiem Voltarol® 75 mg/3 ml podanym domięśniowo.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWłaściwości farmakodynamiczne
Badanie nie wykazało znamiennej różnicy pomiędzy dwoma lekami przeciwbólowymi w dowolnym punkcie czasu przez 8 godzin po podaniu leku. Po 1,5 godziny po podaniu leku (pierwszorzędowy punkt końcowy badania) 95% CI różnicy między dwoma lekami przeciwbólowymi był całkowicie poza ustaloną uprzednio górną granicą równoważności (-15 mm). Zatem, wykazano, że AKIS jest terapeutycznie równoważny z lekiem Voltarol. Średnie różnice i 95% CI różnicy w dowolnym punkcie czasu przez 8 godzin po podaniu leku przedstawia tabela poniżej.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Podanie domięśniowe: Po domięśniowym podaniu 75 mg/ml roztworu do wstrzykiwań AKIS, wchłanianie produktu leczniczego przebiega szybko i średnie maksymalne stężenie w osoczu wynoszące w zakresie 2,603 ± 0,959 µg/ml (2,5 ug/ml stanowi ok. 8 µmol/l) jest osiągane po 34 minutach. Obszar pod krzywą stężenia AUCo-t wynosi 250,07 ± 46,89 µg/ml.min. W porównawczych badaniach klinicznych mediana maksymalnego stężenia w osoczu w przypadku domięśniowego podania Voltarolu (75mg/3ml) wynosi 2,242 ± 0,566 µg/ml, która to wartość jest osiągana po 27 minutach, a AUCo-t wynosi 246,70± 39,74 µg/ml.min. AUC po podaniu domięśniowym jest w przybliżeniu ponad dwa razy dłuższa w porównaniu do podania doustnego lub doodbytniczego, ponieważ unika się metabolizmu pierwszego przejścia.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWłaściwości farmakokinetyczne
Podanie podskórne: Wchłanianie po podaniu podskórnym produktu leczniczego AKIS w dawce 75 mg/ml przebiega szybko i mediana maksymalnego stężenia w osoczu o wartości 2,138 ± 0,646 µg/ml (2,5 µg/ml stanowi ok. 8 µmol/l) jest osiągana po 40 minutach. Obszar pod krzywą stężenia AUCo-t wynosi 261,94 ± 53,29 µg/ml.min. W porównawczych badaniach klinicznych mediana maksymalnego stężenia w osoczu w przypadku domięśniowego podania Voltarolu wynosi 2,242 ± 0,566 µg/ml i jest osiągana po 27 minutach, a AUCo-t wynosi 246,70± 39,74 µg/ml.min. AUC i Cmax po podaniu podskórnym dawki 75 mg AKIS były biorównoważne z domięśniowo podaną dawką 75 mg/3 ml Voltarolu. AUC po podaniu podskórnym jest w przybliżeniu ponad dwa razy dłuższa w porównaniu do podania doustnego lub doodbytniczego, ponieważ unika się metabolizmu pierwszego przejścia. Liniowość dawki względem AUC i Cmax została wykazana w przypadku podskórnego podania diklofenaku.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWłaściwości farmakokinetyczne
Wykazano brak liniowej zależności pomiędzy Cmax a dawką, co oznacza odpowiednio średnią wartość Cmax 1 090 ng/ml, 1648,9 ng/ml i 1 851,1 ng/ml po dawkach AKIS 25 mg, 50 mg i 75 mg. Podanie dożylne w bolusie: Wchłanianie po podaniu dożylnym w bolusie produktu leczniczego AKIS w dawce 75 mg/ml następuje natychmiastowo i mediana maksymalnego stężenia w osoczu o wartości około 16,505 ± 2,829 µg/ml osiągana jest w ciągu 3 minut. W porównawczych badaniach farmakokinetycznych, w których diklofenak mierzono w osoczu do 8 godzin po podaniu, produkt AKIS 75 mg/ml w dożylnym bolusie okazał się być biorównoważny w stosunku do ampułki Voltarol 75 mg/3 ml podawanej jako 30-minutowa infuzja dożylna (100 ml) pod względem ekspozycji ogólnoustrojowej (AUC0-t: 5193,46 ± 1285 ng/ml.h i 4584,13 ± 1014,20 ng/ml.h, odpowiednio dla produktu AKIS i Voltarol), ale przy znacznie większej szybkości wchłaniania (Cmax dla wlewu Voltarol 75 mg/3 ml wynosiła 6,177 ± 1,051 μg/ml).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWłaściwości farmakokinetyczne
Ponadto stężenie diklofenaku w osoczu (Cmax) po podaniu produktu AKIS w dożylnym bolusie okazało się porównywalne do opisanego w literaturze podobnego roztworu zawierającego diklofenak sodu i hydroksylo-propylo-ß-cyklodekstryny do wstrzykiwań (Dyloject® 75 mg/2 ml, Javelin Pharm. Ltd., Wielka Brytania) podawanym tą samą drogą (Cmax: 15,147 ± 2,829 μg/ml). AUC diklofenaku po podaniu dożylnym w bolusie jest około dwa razy większa w porównaniu do podawania doustnego lub doodbytniczego, ponieważ unika się metabolizmu pierwszego przejścia. Dystrybucja Substancja czynna jest w 99,7% wiązana z białkami osocza, głównie z albuminami (99,4%). Diklofenak przenika do płynu maziowego, gdzie maksymalne stężenie występuje po 2 do 4 godzin od osiągnięcia maksymalnego stężenia w osoczu krwi. Okres półtrwania w fazie eliminacji z płynu maziowego wynosi od 3 do 6 godzin.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWłaściwości farmakokinetyczne
2 godziny po osiągnięciu wartości maksymalnych w osoczu krwi wartości stężenia substancji czynnej w płynie maziowym osiągają już większe wartości w porównaniu do osocza i stan ten utrzymuje się przez maksymalnie 12 godzin. Metabolizm Metabolizm diklofenaku odbywa się częściowo na drodze glukuronidacji niezmienionej cząsteczki, ale diklofenak głównie ulega pojedynczej lub wielokrotnej hydroksylacji i metoksylacji, w wyniku czego powstaje kilka pochodnych fenolowych, których większość zostaje przekształcona do postaci koniugatów glukuronidowych. Dwie pochodne fenolowe są biologicznie aktywne, jednakże w znacznie mniejszym stopniu niż diklofenak. Eliminacja Całkowity klirens układowy diklofenaku w osoczu wynosi 263 ± 56 ml/min (średnia wartość ± SD). Końcowy okres półtrwania w osoczu wynosi 1-2 godziny. Cztery z pochodnych, w tym dwie aktywne, maja także krótki okres półtrwania w osoczu, który wynosi 1-3 godziny.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWłaściwości farmakokinetyczne
Około 60% podanej dawki jest wydalane z moczem w postaci sprzężonych z glukuronidami, niezmienionych cząsteczek i metabolitów, z których większość jest przekształcana do koniugatów glukuronowych. Mniej niż 1% produktu leczniczego jest wydalane w postaci niezmienionej. Pozostała część dawki ulega wydaleniu w postaci metabolitów z żółcią w kale. Szczególne grupy pacjentów Pacjenci w podeszłym wieku: Nie obserwowano istotnych różnic zależnych od wieku w zakresie wchłaniania, metabolizmu lub wydalania. Pacjenci z niewydolnością nerek: Kinetyka pojedynczej dawki z zastosowaniem typowego schematu dawkowania u pacjentów z niewydolnością nerek nie wskazuje na występowanie kumulacji niezmienionej substancji czynnej. W przypadku klirensu kreatyniny <10 ml/min stężenie hydroksypochodnych diklofenaku w osoczu obliczone w stanie równowagi dynamicznej jest o ok. 4 razy większe w porównaniu do pacjentów z prawidłową czynnością nerek. Jednakże ostatecznie pochodne te są wydalane z żółcią.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlWłaściwości farmakokinetyczne
Pacjenci z chorobą wątroby: Kinetyka i metabolizm diklofenaku są takie same u pacjentów ze zdrową wątrobą i u pacjentów z przewlekłym zapaleniem wątroby lub wyrównaną marskością wątroby.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak nowych badań przedklinicznych dotyczących bezpieczeństwa stosowania diklofenaku sodowego. Produkt leczniczy ma dobrze ustalony profil bezpieczeństwa. Badania miejscowej tolerancji wykazały, że produkt nie wywołuje znaczącego nieoczekiwanego, miejscowego działania toksycznego zarówno w przypadku podania domięśniowego, jak i podskórnego.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Hydroksypropylobetadeks Polisorbat 20 Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonano badań dotyczących zgodności. 6.3 Okres ważności 2 lata Po otwarciu opakowania bezpośredniego: zużyć natychmiast. Należy usunąć wszelkie niewykorzystane resztki roztworu. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Nie przechowywać w lodówce ani nie zamrażać. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem. 6.5 Rodzaj i zawartość opakowania Ampułko-strzykawka z bezbarwnego szkła typu I, z osłonką zabezpieczającą wykonaną z syntetycznego izoprenu-bromobutylu oraz z tłokiem z gumy chlorobutylowej (pręt tłoka wykonany z poliestru).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 50 mg/mlDane farmaceutyczne
Zestaw do podania: 1 igła do podania podskórnego (rozmiar 27 G), szara 1 igła do podania domięśniowego lub dożylnego (rozmiar 21 G), zielona Opakowanie: 1, 3 lub 5 ampułko-strzykawek, w tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Nie należy stosować, jeśli pojawią się kryształki lub osad. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO AKIS, 25 mg/ml, roztwór do wstrzykiwań w ampułko-strzykawce AKIS, 50 mg/ml, roztwór do wstrzykiwań w ampułko-strzykawce AKIS, 75 mg/ml, roztwór do wstrzykiwań w ampułko-strzykawce 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancją aktywną jest diklofenak sodowy. 1 ml roztworu w ampułko-strzykawce zawiera 25 mg diklofenaku sodowego, 50 mg diklofenaku sodowego lub 75 mg diklofenaku sodowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań w ampułko-strzykawce (iniekcji). Klarowny do lekko bursztynowego, przezroczysty roztwór.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Wstrzyknięcie domięśniowe lub podskórne: AKIS jest roztworem do wstrzykiwań działającym skutecznie w przypadku ostrego bólu, w tym kolki nerkowej, zaostrzenia choroby zwyrodnieniowej stawów oraz reumatoidalnego zapalenia stawów, ostrego bólu pleców, ostrej dny moczanowej, ostrych urazów i złamań oraz bólu pooperacyjnego (patrz punkt 4.3 i 4.4). Wstrzyknięcie dożylne (bolus): W leczeniu lub profilaktyce bólu pooperacyjnego w warunkach szpitalnych (patrz punkt 4.3 i 4.4). AKIS jest wskazany do stosowania u dorosłych. Nie zaleca się stosowania u dzieci i młodzieży.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Występowanie działań niepożądanych można ograniczyć stosując produkt w najmniejszej skutecznej dawce i nie dłużej niż to koniecznie do kontrolowania objawów (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Dawkowanie Dorośli Roztwór do wstrzykiwań AKIS można podawać domięśniowo, podskórnie lub dożylnie (bolus). AKIS jest przeznaczony wyłącznie do krótkotrwałego leczenia i nie należy go podawać przez więcej niż dwa dni. W przypadku łagodnego i umiarkowanego bólu mniejsze dawki mogą być wystarczające. Leczenie ciężkiego bólu, np. kolki nerkowej, może wymagać zastosowania dawki 75 mg. Wyjątkowo i w ciężkich przypadkach po 6 godzinach można podać drugą dawkę 75 mg. Nie należy przekraczać maksymalnej dawki dobowej, która wynosi 150 mg.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlDawkowanie
Jeśli wymagane jest podanie więcej niż jednej dawki produktu leczniczego AKIS na dobę w postaci iniekcji (maksymalnie 150 mg na dobę), zaleca się zmianę miejsca podania kolejnej iniekcji. Jeśli to konieczne, jedno wstrzyknięcie produktu leczniczego AKIS można stosować razem z innymi postaciami diklofenaku, przy czym nie należy przekraczać maksymalnej dawki dobowej 150 mg. Szczególne grupy pacjentów Pacjenci w podeszłym wieku U pacjentów w podeszłym wieku występuje zwiększone ryzyko poważnych działań niepożądanych (patrz punkt 4.4 i 5.2). Jeśli uzna się za konieczne zastosowanie leku z grupy NLPZ, należy podawać najmniejszą skuteczną dawkę przez jak najkrótszy możliwy okres czasu. Podczas leczenia lekami z grupy NLPZ należy regularnie monitorować pacjenta pod kątem krwawienia z przewodu pokarmowego. Zalecana maksymalna dawka dobowa AKIS wynosi 150 mg.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlDawkowanie
Pacjenci z niewydolnością nerek Hydroksypropylo-beta-cyklodekstryna, która jest substancją pomocniczą AKIS, jest wydalana głównie w procesie przesączania kłębuszkowego. Dlatego też u pacjentów z ciężką niewydolnością nerek (określoną, jako stężenie kreatyniny w surowicy poniżej 30 ml/min) nie należy stosować produktu leczniczego AKIS (patrz punkt 4.4 i 5.2). U pacjentów z niewydolnością nerek należy stosować najmniejszą skuteczną dawkę. Pacjenci z ciężką niewydolnością wątroby lub serca Produkt AKIS roztwór do wstrzykiwań jest przeciwwskazany u pacjentów z ciężkimi zaburzeniami czynności wątroby lub serca (patrz punkt 4.3). Należy zachować ostrożność podczas podawania produktu AKIS pacjentom z łagodnymi do umiarkowanych zaburzeniami czynności wątroby oraz w przypadku pacjentów z nadciśnieniem i (lub) umiarkowaną zastoinową niewydolnością serca stwierdzonymi w wywiadzie (patrz punkt 4.4).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlDawkowanie
Podobnie w przypadku pacjentów, u których istnieje znaczne ryzyko wystąpienia zdarzeń niepożądanych dotyczących układu sercowo-naczyniowego (np. nadciśnienie, hiperlipidemia, cukrzyca, palenie tytoniu), diklofenak można stosować jedynie po starannym rozważeniu celowości takiej terapii (patrz punkt 4.4). Dzieci i młodzież Nie ustalono profilu bezpieczeństwa stosowania i skuteczności produktu leczniczego AKIS u dzieci w wieku 0 - 18 lat. Sposób podawania Produkt leczniczy AKIS należy podawać wyłącznie przez personel medyczny. AKIS można podawać domięśniowo lub podskórnie do czystej zdrowej tkanki lub przez wstrzyknięcie dożylne w bolusie. Należy stosować pojedynczą ampułko-strzykawkę zamiast dwóch ampułko-strzykawek w celu podania ustalonej dawki, tj. jedną iniekcję 75 mg produktu leczniczego zamiast 2 iniekcji dawek 25 mg i 50 mg lub jedną iniekcję 50 mg, zamiast dwóch iniekcji po 25 mg.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlDawkowanie
Podanie domięśniowe Należy przestrzegać następujących wskazówek w przypadku podawania domięśniowego w celu uniknięcia uszkodzenia nerwu lub innej tkanki w miejscu podania. Roztwór należy wstrzykiwać głęboko w górny zewnętrzny kwadrat pośladka. Jeśli wymaga się zastosowania dwóch wstrzyknięć na dobę, zaleca się zmianę pośladka w celu wykonania drugiego wstrzyknięcia. Roztwór należy wstrzykiwać powoli w celu minimalizacji uszkodzenia miejscowej tkanki. Podanie podskórne Roztwór należy podawać do tkanki podskórnej, najlepiej w górną część mięśnia pośladkowego lub górną część uda. Jeśli wymaga się zastosowania dwóch wstrzyknięć na dobę, zaleca się zmianę miejsca podania pomiędzy mięśniem pośladkowym i udem. Należy całkowicie wprowadzić igłę w grubość fałdu skóry, który należy utworzyć chwytając ją między kciuk i palec wskazujący. Należy upewnić się, że produkt leczniczy nie jest wstrzykiwany do naczynia krwionośnego. Roztwór należy wstrzykiwać powoli i w równomiernym tempie.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlDawkowanie
Podczas podawania podskórnego należy przytrzymać fałd skóry między palcami. Podanie dożylne Produkt AKIS może być podany poprzez wstrzyknięcie dożylne w bolusie. Zaleca się stosowanie dwóch alternatywnych schematów: W leczeniu pooperacyjnego bólu o nasileniu umiarkowanym do ciężkiego, należy podać dożylnie 75 mg. W razie konieczności można powtórzyć leczenie po 4 do 6 godzinach, nie przekraczając dobowej dawki 150 mg. W profilaktyce bólu pooperacyjnego należy podać dawkę nasycającą 25 mg do 50 mg w 5 – 60 sekundowym wstrzyknięciu (bolus) po zabiegu, a następnie wykonywać kolejne dodatkowe wstrzyknięcia do maksymalnej dawki dobowej 150 mg. W razie konieczności można powtórzyć leczenie po 4 do 6 godzinach, nie przekraczając dawki dobowej 150 mg. Produktu leczniczego AKIS nie wolno podawać w infuzji dożylnej. Instrukcje dotyczące zastosowania i przygotowania produktu leczniczego do stosowania, patrz punkt 6.6.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Czynna choroba wrzodowa żołądka lub dwunastnicy, krwawienie lub perforacja. Krwawienie z przewodu pokarmowego w wywiadzie lub perforacja związana z uprzednim leczeniem lekami z grupy NLPZ. Czynna lub nawracająca w wywiadzie choroba wrzodowa lub krwotok (dwa lub więcej różnych epizodów owrzodzenia lub krwawienia). Ostatni trymestr ciąży (patrz punkt 4.6). Ciężka niewydolność wątroby, nerek lub serca (patrz punkt 4.4). Podobnie jak inne niesteroidowe leki przeciwzapalne (NLPZ), diklofenak jest także przeciwwskazany u pacjentów, u których kwas acetylosalicylowy lub inne leki z grupy NLPZ wywołują napady astmy, pokrzywkę lub ostry nieżyt błony śluzowej nosa. Zaburzenia homeostazy lub jednoczesne leczenie lekami przeciwzakrzepowymi (przeciwwskazanie wyłącznie do domięśniowego podawania produktu).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlPrzeciwwskazania
Stwierdzona zastoinowa niewydolność serca (klasa II–IV wg NYHA), choroba niedokrwienna serca, choroba naczyń obwodowych i (lub) choroba naczyń mózgowych. Dla podania dożylnego: Jednoczesne stosowanie NLPZ i leków przeciwzakrzepowych (w tym małych dawek heparyny). Skłonność do krwotoków oraz potwierdzone lub podejrzewane krwawienia mózgowo-naczyniowe, w wywiadzie. Operacje związane z dużym ryzykiem krwotoku. Astma w wywiadzie. Umiarkowana lub ciężka niewydolność nerek (kreatynina w surowicy > 160µmol/l). Hipowolemia lub odwodnienie z dowolnej przyczyny.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ogólne Działania niepożądane można ograniczyć stosując najmniejszą skuteczną dawkę przez jak najkrótszy okres czasu niezbędny do kontrolowania objawów (patrz punkt 4.2 i wpływ na przewód pokarmowy i układ krążenia poniżej). Należy unikać jednoczesnego stosowania diklofenaku z lekami z grupy NLPZ o działaniu ogólnoustrojowym, w tym z selektywnymi inhibitorami cyklooksygenazy-2, ze względu na brak dowodów wskazujących na korzyści wynikające z działania synergistycznego i możliwe dodatkowe działania niepożądane. Należy zachować ostrożność stosując AKIS u pacjentów w podeszłym wieku ze względów medycznych. W szczególności zaleca się stosowanie najmniejszej skutecznej dawki u osłabionych pacjentów w podeszłym wieku lub pacjentów z małą masą ciała.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlSpecjalne środki ostrozności
Podobnie jak w przypadku innych leków z grupy NLPZ, w rzadkich przypadkach, mogą wystąpić reakcje alergiczne w związku z przyjmowaniem diklofenaku bez uprzedniej ekspozycji na jego działanie, w tym reakcje anafilaktyczne/rzekomoanafilaktyczne. Reakcje nadwrażliwości mogą także rozwinąć się w zespół Kounisa, ciężką reakcję alergiczną, która może prowadzić do zawału mięśnia sercowego. Objawy takich reakcji mogą obejmować ból w klatce piersiowej występujący w związku z reakcją alergiczną na diklofenak. Podobnie jak inne leki z grupy NLPZ, diklofenak może maskować objawy przedmiotowe i podmiotowe zakażenia w związku ze swoimi właściwościami farmakodynamicznymi. Należy ściśle przestrzegać zaleceń dotyczących wykonywania wstrzyknięć domięśniowych, aby uniknąć zdarzeń niepożądanych w miejscu wstrzyknięcia, mogących doprowadzić do osłabienia mięśni, porażenia mięśni, niedoczulicy, embolia cutis medicamentosa (zespół Nicolaua) i martwicy w miejscu wstrzyknięcia.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlSpecjalne środki ostrozności
Reakcje w miejscu wstrzyknięcia Zgłaszano występowanie reakcji w miejscu wstrzyknięcia po podaniu domięśniowym diklofenaku, obejmującą martwicę w miejscu wstrzyknięcia oraz embolia cutis medicamentosa, znaną także jako zespół Nicolaua (zwłaszcza po nieumyślnym podaniu podskórnym). Podczas domięśniowego podawania diklofenaku należy stosować właściwy dobór igły i techniki wstrzykiwania (patrz punkt 4.2 i (lub) 6.6, w stosownych przypadkach). Wpływ na przewód pokarmowy W związku z przyjmowaniem wszystkich leków z grupy NLPZ, w tym diklofenaku, zgłaszano krwawienie z przewodu pokarmowego, owrzodzenie i perforację, które mogą prowadzić do zgonu i mogą pojawić się w dowolnym momencie leczenia, z lub bez objawów ostrzegawczych lub poważnych zdarzeń żołądkowo-jelitowych w wywiadzie. Ogólnie działania te mają poważniejsze konsekwencje u pacjentów w podeszłym wieku.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlSpecjalne środki ostrozności
Jeśli u pacjentów przyjmujących diklofenak wystąpi krwawienie z przewodu pokarmowego lub owrzodzenie, należy przerwać leczenie tym produktem leczniczym. Podobnie jak w przypadku wszystkich leków z grupy NLPZ, w tym diklofenaku, konieczny jest ścisły nadzór medyczny i zachowanie szczególnej ostrożności w przypadku przepisywania diklofenaku pacjentom z objawami wskazującymi na zaburzenia przewodu pokarmowego lub z zaburzeniami w wywiadzie wskazującymi na owrzodzenie żołądka lub dwunastnicy, krwawienie lub perforację (patrz punkt 4.8). Ryzyko wystąpienia krwawienia z przewodu pokarmowego jest wyższe w przypadku zwiększania dawek leków z grupy NLPZ i u pacjentów z chorobą wrzodową w wywiadzie, w szczególności, jeśli jest ona powiązana z krwotokiem lub perforacją. U pacjentów w podeszłym wieku częstość występowania działań niepożądanych związanych ze stosowaniem leków z grupy NLPZ, w szczególności krwawienia z przewodu pokarmowego i perforacji, które mogą prowadzić do zgonu, jest większa.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlSpecjalne środki ostrozności
Aby zmniejszyć ryzyko wystąpienia działania toksycznego w obrębie przewodu pokarmowego u pacjentów z chorobą wrzodową w wywiadzie, w szczególności, jeśli jest ona powiązana z krwotokiem lub perforacją oraz u pacjentów w podeszłym wieku, podczas leczenia wstępnego i podtrzymującego należy stosować najmniejszą skuteczną dawkę. U tych grup pacjentów oraz u pacjentów wymagających jednoczesnego stosowania produktów leczniczych zawierających małe dawki kwasu acetylosalicylowego (ASA)/aspiryna lub innych produktów leczniczych, które mogą zwiększać ryzyko działania toksycznego w obrębie przewodu pokarmowego, należy rozważyć leczenie skojarzone z lekami osłonowymi (np. inhibitory pompy protonowej lub mizoprostol). Pacjenci, u których występuje działanie toksyczne w obrębie przewodu pokarmowego w wywiadzie, w szczególności pacjenci w podeszłym wieku, powinni zgłaszać wszelkie nietypowe objawy występujące w zakresie jamy brzusznej (w szczególności krwawienie z przewodu pokarmowego).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlSpecjalne środki ostrozności
Zaleca się zachowanie ostrożności u pacjentów przyjmujących jednocześnie leki, które mogą zwiększać ryzyko wystąpienia owrzodzenia lub krwawienia, tj. kortykosteroidy o działaniu ogólnoustrojowym, leki przeciwzakrzepowe, leki przeciwpłytkowe lub selektywne inhibitory wychwytu zwrotnego serotoniny (patrz punkt 4.5). Należy zachować ostrożność i ściśle monitorować pacjentów z wrzodziejącym zapaleniem jelita grubego lub chorobą Crohna, ponieważ ich stan może ulec zaostrzeniu (patrz punkt 4.8). Stosowanie NLPZ, w tym diklofenaku, może wiązać się ze zwiększeniem ryzyka nieszczelności zespolenia żołądkowo-jelitowego. Zaleca się ścisły nadzór medyczny i zachowanie ostrożności podczas stosowania diklofenaku po operacjach przewodu pokarmowego. Wpływ na wątrobę Należy ściśle monitorować pacjentów z zaburzeniem czynności wątroby przyjmujących diklofenak, ponieważ ich stan może ulec zaostrzeniu.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlSpecjalne środki ostrozności
Podobnie jak w przypadku innych leków z grupy NLPZ, w tym diklofenaku, może wystąpić zwiększenie aktywności jednego lub więcej enzymów wątrobowych. Podczas długotrwałego leczenia diklofenakiem jako środek ostrożności zaleca się regularne kontrolowanie czynności wątroby. W przypadku utrzymywania się lub pogarszania nieprawidłowych wyników testów czynnościowych wątroby lub wystąpienia klinicznych objawów przedmiotowych i podmiotowych wskazujących na chorobę wątroby, lub jeśli wystąpią inne objawy (eozynofilia, wysypka), należy przerwać stosowanie diklofenaku. W przypadku stosowania diklofenaku może wystąpić zapalenie wątroby bez objawów prodromalnych. Należy zachować ostrożność stosując diklofenak u pacjentów z porfirią, ponieważ może on wywołać napad. Wpływ na nerki Ze względu na to, iż zgłaszano przypadki zatrzymania płynów i obrzęku w związku z leczeniem lekami z grupy NLPZ, w tym diklofenakiem, należy zachować szczególną ostrożność u pacjentów z zaburzeniem czynności serca i nerek, nadciśnieniem w wywiadzie, u pacjentów w podeszłym wieku, u pacjentów stosujących jednocześnie leki moczopędne lub produkty lecznicze, które istotnie wpływają na czynność nerek oraz u pacjentów ze znacznym zmniejszeniem objętości pozakomórkowej z jakiegokolwiek powodu, np.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlSpecjalne środki ostrozności
przed lub po większym zabiegu chirurgicznym (patrz punkt 4.3). W tych przypadkach jako środek ostrożności po zastosowaniu diklofenaku zaleca się monitorowanie czynności nerek. Przerwanie leczenia zazwyczaj prowadzi do powrotu do stanu zdrowia sprzed leczenia. Hydroksypropylo-beta-cyklodekstryna, która jest substancją pomocniczą, jest wydalana głównie przez nerki w procesie przesączania kłębuszkowego. Dlatego też u pacjentów z ciężką niewydolnością nerek (określoną, jako stężenie kreatyniny w surowicy poniżej 30 ml/min) nie należy stosować roztworu do wstrzykiwań AKIS. U pacjentów z niewydolnością nerek należy stosować najmniejszą skuteczną dawkę. Wpływ na skórę W związku ze stosowaniem leków z grupy NLPZ bardzo rzadko zgłaszano ciężkie reakcje skórne, niekiedy prowadzące do zgonu, w tym złuszczające zapalenie skóry, zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka (patrz punkt 4.8).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlSpecjalne środki ostrozności
Ryzyko wystąpienia tych reakcji wydaje się być wyższe w początkowej fazie leczenia: większość reakcji odnotowywano w ciągu pierwszego miesiąca leczenia. Należy przerwać leczenie produktem leczniczym AKIS po wystąpieniu pierwszych objawów wysypki skórnej, zmian na błonach śluzowych lub jakichkolwiek innych objawów nadwrażliwości. Wpływ na układ krążenia i naczynia mózgu Ze względu na to, że zgłaszano przypadki zatrzymania płynów i obrzęku w związku z leczeniem lekami z grupy NLPZ, wymagany jest odpowiedni monitoring i konsultacje u pacjentów z nadciśnieniem w wywiadzie i (lub) łagodną do umiarkowanej zastoinową niewydolnością serca. Dane z badań klinicznych i dane epidemiologiczne wskazują na prawdopodobieństwo związku między leczeniem diklofenakiem (w szczególności w dużych dawkach, 150 mg na dobę i w długotrwałym leczeniu) i niewielkim zwiększeniem ryzyka wystąpienia przypadków zakrzepicy tętniczej (np. zawał serca mięśniowego lub udar mózgu).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlSpecjalne środki ostrozności
Diklofenak należy stosować bardzo ostrożnie u pacjentów z istotnymi czynnikami ryzyka zdarzeń dotyczących układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Produkt ten należy stosować możliwie jak najkrócej i w najmniejszej skutecznej dawce dobowej, ze względu na możliwość nasilenia ryzyka dotyczącego układu krążenia po zastosowaniu diklofenaku w dużych dawkach i długotrwale. Należy okresowo kontrolować konieczność kontynuacji leczenia objawowego i odpowiedź na leczenie. Wpływ na układ krwiotwórczy Podczas długotrwałego leczenia diklofenakiem, podobnie jak w przypadku innych leków z grupy NLPZ, zaleca się monitorowanie morfologii krwi. Podobnie jak inne leki z grupy NLPZ, diklofenak może przejściowo zahamować agregację płytek krwi. Należy starannie monitorować pacjentów z zaburzeniem homeostazy. Może pojawić się niedokrwistość w związku z zatrzymaniem wody lub wpływem na erytropoezę.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlSpecjalne środki ostrozności
Dlatego też, w przypadku wykrycia objawów niedokrwistości, zalecane jest monitorowanie poziomu hemoglobiny i hematokrytu. U pacjentów chorych na cukrzycę lub pacjentów przyjmujących również leki moczopędne oszczędzające potas może wystąpić hiperkaliemia (patrz punkt 4.5). Astma w wywiadzie U pacjentów z astmą, sezonowym alergicznym zapaleniem błony śluzowej nosa, obrzękiem błony śluzowej nosa (np. polipy nosa), przewlekłą obturacyjną chorobą płuc lub przewlekłymi infekcjami dróg oddechowych (szczególnie, jeśli związane z objawami podobnymi do alergicznego zapalenia błony śluzowej nosa), reakcje na leki z grupy NLPZ, np. zaostrzenie astmy (tzw. nietolerancja leków przeciwbólowych/astma indukowana lekami przeciwbólowymi), obrzęk naczynioruchowy lub pokrzywka występują częściej w porównaniu do innych pacjentów. Dlatego też należy zachować szczególną ostrożność u tych pacjentów (zapewnić gotowość pomocy lekarskiej). Dotyczy to także pacjentów, którzy są uczuleni na inne substancje, np.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlSpecjalne środki ostrozności
pacjentów z reakcjami skórnymi, świądem lub pokrzywką. SLE i mieszana choroba tkanki łącznej U pacjentów z układowym toczniem rumieniowatym (SLE) i mieszaną chorobą tkanki łącznej może wystąpić podwyższone ryzyko aseptycznego zapalenia opon mózgowych (patrz punkt 4.8). Podanie Roztwór należy podawać przestrzegając ściśle zasad aseptyki i antyseptyki. Czas leczenia Nie należy stosować produktu leczniczego AKIS dłużej niż przez 2 dni. Po 2 dniach należy zweryfikować konieczność zastosowania alternatywnego leku z grupy NLPZ i w przypadku konieczności długotrwałego leczenia lekami z grupy NLPZ, należy monitorować pacjenta pod kątem zaburzenia czynności wątroby i nerek oraz zaburzeń morfologii krwi. Jest to szczególnie istotne w przypadku pacjentów w podeszłym wieku. Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na jednostkę dawkowania, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Poniższe interakcje obejmują interakcje obserwowane podczas stosowania diklofenaku w postaci tabletek dojelitowych i (lub) innej postaci farmaceutycznej. Lit: Leki z grupy NLPZ powodują zmniejszenie wydalania litu przez nerki i w związku z tym zwiększenie stężenia litu w osoczu. Jeśli zastosowanie tego połączenia jest konieczne, należy kontrolować stężenie litu we krwi i dostosować jego dawkę zarówno podczas leczenia wstępnego, skojarzonego, jak i po odstawieniu diklofenaku. Digoksyna: W przypadku jednoczesnego stosowania diklofenak może zwiększać stężenie digoksyny w osoczu. Zaleca się monitorowanie stężenia digoksyny w surowicy. Leki moczopędne, inhibitory ACE, antagoniści receptora angiotensyny II: Leki z grupy NLPZ mogą zmniejszać przeciwnadciśnieniowe działanie leków moczopędnych i innych leków przeciwnadciśnieniowych (tj. leki beta-adrenolityczne, inhibitory konwertazy angiotensyny [ACE]).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlInterakcje
U niektórych pacjentów z zaburzoną czynnością nerek (np. u pacjentów odwodnionych lub u pacjentów w wieku podeszłym z zaburzoną czynnością nerek) jednoczesne stosowanie inhibitora ACE lub antagonisty receptora angiotensyny II i leków hamujących cyklooksygenazę może powodować dalsze, zwykle odwracalne, zaburzenia czynności nerek, w tym możliwą ostrą niewydolność nerek. Dlatego też kombinację leków należy stosować ostrożnie, szczególnie u pacjentów w podeszłym wieku. Pacjenci powinni być odpowiednio nawodnieni. Należy też rozważyć monitorowanie czynności nerek po rozpoczęciu leczenia towarzyszącego, a także okresowo w okresie późniejszym (patrz także punkt 4.4). Jednoczesne leczenie lekami moczopędnymi oszczędzającymi potas może powodować zwiększenie poziomu potasu w osoczu, które należy regularnie monitorować (patrz punkt 4.4).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlInterakcje
Inne leki z grupy NLPZ, kortykosteroidy i kwas acetylosalicylowy: Jednoczesne podawanie diklofenaku i innych leków z grupy NLPZ o działaniu ogólnoustrojowym lub kortykosteroidów lub kwasu acetylosalicylowego może zwiększyć częstość występowania działań niepożądanych i nie jest zalecane (patrz punkt 4.4). Leki przeciwzakrzepowe i heparyna (leczenie pacjentów w podeszłym wieku lub w dawkach leczniczych): Zaleca się ostrożność, ponieważ jednoczesne podawanie z lekami z grupy NLPZ może zwiększyć ryzyko wystąpienia krwawienia poprzez hamowanie czynności płytek krwi i uszkodzenia błony śluzowej żołądka i dwunastnicy (patrz punkt 4.4). Leki z grupy NLPZ mogą nasilać działanie leków przeciwzakrzepowych, tj. warfaryna lub heparyna. Nie zaleca się podawania heparyny u pacjentów w podeszłym wieku lub w dawkach leczniczych. Należy starannie monitorować międzynarodowy współczynnik znormalizowany (INR), jeśli nie można uniknąć jednoczesnego podawania.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlInterakcje
Pomimo, iż badania kliniczne nie wskazują na to, że diklofenak wpływa na działanie leków przeciwzakrzepowych, doniesienia ujawniają zwiększone ryzyko wystąpienia krwotoku u pacjentów przyjmujących jednocześnie diklofenak i leki przeciwzakrzepowe. Stąd zaleca się ścisłe monitorowanie tych pacjentów. Leki trombolityczne i leki przeciwpłytkowe: Zaleca się ostrożność, ponieważ jednoczesne podawanie z lekami z grupy NLPZ może zwiększyć ryzyko wystąpienia krwawienia poprzez hamowanie czynności płytek krwi i uszkodzenia błony śluzowej żołądka i dwunastnicy. Selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI): Jednoczesne podawanie leków z grupy NLPZ o działaniu ogólnoustrojowym, w tym diklofenaku i SSRI może zwiększać ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.4). Leki przeciwcukrzycowe: Badania kliniczne wykazały, że diklofenak może być podawany z doustnymi lekami przeciwcukrzycowymi bez wywierania wpływu na ich działanie kliniczne.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlInterakcje
Jednakże odnotowano pojedyncze przypadki działań hipoglikemizujących i hiperglikemizujących, które wymagały dostosowania dawki leków przeciwcukrzycowych podczas leczenia diklofenakiem. Dlatego też jako środek zapobiegawczy podczas leczenia towarzyszącego zaleca się monitorowanie stężenia glukozy we krwi. Metotreksat: Diklofenak może zmniejszać klirens nerkowy metotreksatu, podnosząc tym samym poziom metotreksatu. Zaleca się ostrożność przy podawaniu leków z grupy NLPZ, w tym diklofenaku, na mniej niż 24 godziny przed lub po leczeniu metotreksatem, ponieważ w przeciwnym razie może to powodować zwiększenie stężenia metotreksatu we krwi i zwiększenie toksyczności tej substancji. Zaleca się cotygodniowe kontrolowanie morfologii krwi podczas kilku pierwszych tygodni leczenia skojarzonego. Należy zintensyfikować monitorowanie w przypadku pacjentów z zaburzeniem czynności nerek lub pacjentów w podeszłym wieku.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlInterakcje
Zastosowanie pemetreksedu u pacjentów z prawidłową czynnością nerek, klirens kreatyniny > 80 ml/min: Zwiększone ryzyko toksyczności pemetreksedu w związku z obniżeniem klirensu kreatyniny pemetreksedu. Zaleca się biologiczny monitoring czynności nerek. Inhibitory kalcyneuryny (np. cyklosporyna, takrolimus): Działanie nefrotoksyczne inhibitorów kalcyneuryny może się zwiększać pod wpływem leków z grupy NLPZ poprzez działanie za pośrednictwem prostaglandyn nerkowych. Podczas jednoczesnego leczenia zaleca się monitorowanie czynności nerek, w szczególności pacjentów w podeszłym wieku. Deferazyroks: Jednoczesne podawanie leków z grupy NLPZ o działaniu ogólnoustrojowym i deferazyroksu może zwiększać ryzyko toksycznego działania na przewód pokarmowy. Należy ściśle monitorować pacjentów, którym jednocześnie podawane są te leki. Chinolony przeciwbakteryjne: Zgłaszano pojedyncze przypadki drgawek, które mogą być związane z jednoczesnym stosowaniem chinolonów i leków z grupy NLPZ.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlInterakcje
Fenytoina: Podczas jednoczesnego stosowania fenytoiny z diklofenakiem zaleca się monitorowanie stężenia fenytoiny w osoczu w związku z nieoczekiwanym zwiększeniem jej stężenia. Kolestypol i cholestyramina: Leki te mogą powodować opóźnienie lub zmniejszenie wchłaniania diklofenaku. Dlatego też zaleca się podawanie diklofenaku przynajmniej na godzinę przed lub 4 do 6 godzin po podaniu kolestypolu/cholestyraminy. Silne inhibitory CYP2C9: Zaleca się ostrożność podczas przepisywania jednocześnie diklofenaku i silnych inhibitorów CYP2CP (tj. sulfinpirazon i worykonazol), które mogą powodować istotne zwiększenie maksymalnego stężenia w osoczu i zwiększenie stężenia diklofenaku w związku z hamowaniem jego metabolizmu. Mifepryston: Nie należy stosować leków z grupy NLPZ w ciągu 8-12 dni po podaniu mifeprystonu, ponieważ NLPZ mogą zmniejszać działanie mifepristonu. Takrolimus: Możliwe zwiększenie ryzyka nefrotoksyczności w przypadku podawania NLPZ z takrolimusem.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlInterakcje
Może to być spowodowane przez działanie przeciwko nerkowej prostaglandynie przez NLPZ, jak i inhibitora kalcyneuryny. Zydowudyna: Jednoczesne podawanie leków z grupy NLPZ z zydowudyną zwiększa ryzyko toksycznego działania na układ krwiotwórczy. Udowodniono, że jednoczesne podawanie ibuprofenu i zydowudyny zwiększa ryzyko wylewu krwi do stawu i krwiaka u pacjentów chorych na hemofilię i zakażonych wirusem HIV. Pomimo, iż AKIS w znacznym stopniu wiąże się z białkami, nie zakłóca on wiązania białka z: salicylanami, tolbutamidem i prednizolonem.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może wpływać negatywnie na ciążę i (lub) rozwój zarodka/płodu. Dane z badań epidemiologicznych wskazują na prawdopodobieństwo zwiększonego ryzyka poronienia, wady rozwojowej serca i wytrzewienia po zastosowaniu inhibitora syntezy prostaglandyn we wczesnym stadium ciąży. Ryzyko całkowite wady rozwojowej serca wzrosło z poniżej 1% do ok. 1,5%. Uważa się, że ryzyko to wzrasta wraz z dawką i czasem leczenia. Zastosowanie inhibitorów syntezy prostaglandyn u zwierząt wskazywało na zwiększoną ilość strat przed- i poimplantacyjnych oraz śmiertelność zarodków i płodów. Dodatkowo odnotowano zwiększoną częstość występowania różnych wad rozwojowych, w tym serca, u zwierząt, którym podawano inhibitory syntezy prostaglandyn w okresie organogenezy. Od 20. tygodnia ciąży stosowanie diklofenaku może powodować małowodzie wskutek zaburzeń czynności nerek płodu.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWpływ na płodność, ciążę i laktację
Może ono wystąpić krótko po rozpoczęciu leczenia i jest zwykle odwracalne po jego przerwaniu. Ponadto zgłaszano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze, z których większość ustąpiła po zaprzestaniu leczenia. Z tego względu, nie należy podawać produktu leczniczego AKIS w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. Jeśli diklofenak jest stosowany u kobiet planujących ciążę lub w pierwszym lub drugim trymestrze ciąży, należy podawać jak najmniejszą możliwą skuteczną dawkę przez możliwie jak najkrótszy okres czasu. Należy rozważyć przedporodowe monitorowanie w kierunku małowodzia oraz zwężenia przewodu tętniczego po ekspozycji na diklofenak przez kilka dni od 20. tygodnia ciąży. W przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego należy zaprzestać stosowania produktu leczniczego AKIS.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWpływ na płodność, ciążę i laktację
Podczas trzeciego trymestru ciąży wszystkie inhibitory syntezy prostaglandyn mogą działać na płód w następujący sposób: powodować toksyczne działanie na serce i płuca (przedwczesne zwężenie/zamknięciem przewodu tętniczego i nadciśnienie płucne); powodować zaburzenia nerek (patrz powyżej); U matki i noworodka pod koniec ciąży mogą prowadzić do: możliwego wydłużenia czasu krwawienia, działania hamującego agregację płytek, które mogą wystąpić nawet przy stosowaniu małych dawek; hamowanie skurczów macicy i wskutek tego opóźnionego lub wydłużonego porodu. W związku z tym, produkt leczniczy AKIS jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3). Karmienie piersi? Podobnie jak inne leki z grupy NLPZ, diklofenak przenika do mleka ludzkiego w niewielkich ilościach. Dlatego też nie należy podawać produktu leczniczego AKIS w okresie karmienia piersią w celu uniknięcia działań niepożądanych u niemowlęcia.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWpływ na płodność, ciążę i laktację
Płodność Podobnie jak w przypadku innych leków z grupy NLPZ, zastosowanie diklofenaku może zaburzać płodność i nie jest zalecane u kobiet planujących ciążę. U kobiet, które mają trudności z zajściem w ciążę lub są poddawane badaniom płodności, należy rozważyć przerwanie stosowania produktu leczniczego AKIS.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjenci, u których podczas leczenia diklofenakiem występują zaburzenia widzenia, oszołomienie, zawroty głowy, senność lub inne zaburzenia ośrodkowego układu nerwowego, nie powinni prowadzić pojazdów ani obsługiwać maszyn.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne Najczęściej występujące działania niepożądane, które obserwowano podczas badań klinicznych z produktem leczniczym AKIS obejmowały reakcje ze strony żołądka i jelit oraz reakcje w miejscu podania i ogólnie były łagodne i krótkotrwałe. Dane z badań klinicznych sugerują, że zastosowanie diklofenaku w postaci roztworu do wstrzykiwań jest związane z występowaniem reakcji w miejscu podania, takich jak: ból i krwiak. Częstość występowania działań niepożądanych w miejscu podania była istotnie mniejsza w przypadku leczenia dawkami 25 i 50 mg w porównaniu do dawki 75 mg. Po wstrzyknięciu dożylnym (bolus) dawki 75 mg w ciągu 5 do 30 sekund, odnotowano uczucie dyskomfortu w okolicy wokół miejsca wstrzyknięcia. Po podaniu diklofenaku obserwowano także: nudności, wymioty, biegunkę i zaparcie.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlDziałania niepożądane
Dane po wprowadzeniu do obrotu Znane reakcje niepożądane związane ze stosowaniem produktu AKIS, podawanego domięśniowo i podskórnie, to reakcje w miejscu wstrzyknięcia, często związane ze sposobem podawania, w tym ból w miejscu wstrzyknięcia, rumień i wysypka. W niektórych przypadkach zgłaszano reakcje nadwrażliwości wraz z uogólnionymi objawami. Działania niepożądane są przedstawione poniżej zgodnie z klasyfikacją układów i narządów MedDRA i następującą konwencją dotyczącą częstości: bardzo często (≥1/10); często (≥1/100 - <1/10); niezbyt często (≥1/1 000 - <1/100); rzadko (≥1/10 000 - <1/1 000); bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Klasyfikacja układów i narządów Częstość Działanie niepożądane częstość nieznana martwica w miejscu wstrzyknięcia rzadko reakcje nadwrażliwości niezbyt często oszołomienie, ból głowy często nudności, biegunka, wymioty, zaparcie, zapalenie żołądka, niedokrwienne zapalenie okrężnicy niezbyt często zwiększenie aktywności enzymów wątrobowych niezbyt często świąd często uczucie dyskomfortu w kończynach bardzo często reakcje w miejscu podania, embolia cutis medicamentosa (zespół Nicolaua) Do opisu niektórych działań niepożądanych zastosowano najbardziej odpowiednie terminy MedDRA.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlDziałania niepożądane
Nie zastosowano synonimów i stanów pokrewnych, jednakże należy je także uwzględnić. Klasyfikacja układów i narządów Działania niepożądane (tabela 1) uporządkowano według częstości występowania, zaczynając od najczęściej występujących, zgodnie z następującą konwencją: bardzo często (≥1/10); często (≥1/100 - <1/10); niezbyt często (≥1/1 000 - <1/100); rzadko (≥1/10 000 - <1/1 000); bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Następujące działania niepożądane obejmują działania niepożądane zgłaszane zarówno w przypadku krótkotrwałego, jak i długotrwałego stosowania. Tabela 1 Zaburzenia krwi i układu chłonnego bardzo rzadko małopłytkowość, leukopenia, niedokrwistość (w tym niedokrwistość hemolityczna i aplastyczna), agranulocytoza Zaburzenia układu immunologicznego rzadko nadwrażliwość, reakcje anafilaktyczne i rzekomoanafilaktyczne (w tym niedociśnienie tętnicze i wstrząs), obrzęk naczynioruchowy (w tym obrzęk twarzy) Zaburzenia psychiczne bardzo rzadko dezorientacja, depresja, bezsenność, koszmary senne, drażliwość, zaburzenia psychotyczne Zaburzenia układu nerwowego często ból głowy, zawroty głowy, senność bardzo rzadko parestezje, zaburzenie pamięci, drgawki, lęk, drżenie, aseptyczne zapalenie opon mózgowych, epizod naczyniowo-mózgowy Zaburzenia oka bardzo rzadko zaburzenia widzenia, niewyraźne widzenie, podwójne widzenie Zaburzenia ucha i błędnika często zawroty głowy bardzo rzadko szumy uszne, zaburzenie słuchu Zaburzenia serca bardzo rzadko palpitacje, ból w klatce piersiowej, niewydolność serca, zawał serca mięśniowego, zespół Kounisa Zaburzenia naczyniowe bardzo rzadko nadciśnienie tętnicze, zapalenie naczyń Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia rzadko astma (w tym duszność), zapalenie płuc Zaburzenia żołądka i jelit często nudności, wymioty, biegunka, dyspepsja, ból brzucha, wzdęcia, anoreksja rzadko zapalenie żołądka, krwotok z przewodu pokarmowego, krwawe wymioty, biegunka krwotoczna, krew w kale, choroba wrzodowa przewodu pokarmowego (z krwawieniem lub perforacją albo bez) bardzo rzadko zapalenie jelita grubego (w tym krwotoczne zapalenie jelita grubego i zaostrzenie wrzodziejącego zapalenia jelita grubego lub choroby Leśniowskiego-Crohna), zaparcie, zapalenie błony śluzowej jamy ustnej (w tym wrzodziejące zapalenie błony śluzowej jamy ustnej), zapalenie języka, zaburzenia w obrębie przełyku, przeponopodobne zwężenia jelita, zapalenie trzustki Zaburzenia wątroby i dróg żółciowych często zwiększenie aktywności aminotransferaz rzadko zapalenie wątroby, żółtaczka, zaburzenie czynności wątroby bardzo rzadko piorunujące zapalenie wątroby, martwica wątroby, niewydolność wątroby Zaburzenia skóry i tkanki podskórnej często wysypka rzadko pokrzywka bardzo rzadko wysypki pęcherzowe, wyprysk, rumień, rumień wielopostaciowy, zespół Stevensa-Johnsona, martwica toksyczno-rozpływna naskórka (zespół Lyell), złuszczające zapalenie skóry, łysienie, reakcje nadwrażliwości na światło, plamica, plamica alergiczna, świąd Zaburzenia nerek i dróg moczowych bardzo rzadko ostra niewydolność nerek, krwiomocz, białkomocz, zespół nerczycowy, śródmiąższowe zapalenie nerek, martwica brodawek nerkowych Zaburzenia ogólne i stany w miejscu podania często reakcje w miejscu podania, ból w miejscu podania, stwardnienie w miejscu podania, obrzęk, martwica w miejscu podania Zakażenia i zarażenia pasożytnicze bardzo rzadko ropień w miejscu podania Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie diklofenaku, szczególnie w dużych dawkach (150 mg/dobę) i w leczeniu długotrwałym zwiększa ryzyko zakrzepicy tętnic (np.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlDziałania niepożądane
zawał serca lub udar) (patrz punkty 4.3 Przeciwwskazania i 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem: Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181 C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy Brak typowych objawów klinicznych związanych z przedawkowaniem diklofenaku. Przedawkowanie może powodować następujące objawy: wymioty, krwotok z przewodu pokarmowego, biegunka, oszołomienie, szum uszny lub drgawki. W przypadku znacznego zatrucia, możliwe jest wystąpienie ostrej niewydolności nerek lub uszkodzenia wątroby. Leczenie przedawkowania Postępowanie w przypadku ostrego zatrucia lekami z grupy NLPZ, w tym diklofenakiem, w szczególności polega na zastosowaniu postępowania podtrzymującego czynności organizmu i leczenia objawowego. Należy zastosować postępowanie podtrzymujące czynności organizmu i leczenie objawowe w przypadku powikłań, takich jak: niedociśnienie tętnicze niewydolność nerek zaburzenia żołądkowo-jelitowe depresja oddechowa Specjalne środki, takie jak wymuszona diureza, dializa lub hemoperfuzja prawdopodobnie nie są pomocne w eliminacji leków z grupy NLPZ, w tym diklofenaku, z uwagi na wysoki stopień wiązania z białkami osocza i rozległy metabolizm.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne (NLPZ) kod ATC: M01AB05. Klasyfikacja podgrupy terapeutycznej: leki działające na układ mięśniowo-szkieletowy/ niesteroidowe leki przeciwzapalne i przeciwreumatyczne/pochodne kwasu octowego i związki o podobnej budowie. Mechanizm działania Roztwór do wstrzykiwań AKIS jest niesteroidowym lekiem o właściwościach przeciwbólowych i przeciwzapalnych. Jest on inhibitorem syntetazy prostaglandyn (cyklooksygenazy). In vitro diklofenak sodu nie hamuje biosyntezy proteoglikanów w chrząstce przy stężeniach równoważnych ze stężeniami osiąganymi u ludzi. Po jednoczesnym stosowaniu z opioidami w celu leczenia bólu pooperacyjnego diklofenak sodowy często zmniejsza konieczność stosowania opioidów. Skuteczność kliniczna Działanie przeciwbólowe AKIS badano w dwóch głównych badaniach działania przeciwbólowego po zabiegach stomatologicznych, które obejmowały pacjentów z bólem o nasileniu umiarkowanym do ciężkiego po zabiegach usuwania zębów z powodu wklinowania.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWłaściwości farmakodynamiczne
W ramach pierwszego badania porównywano działanie przeciwbólowe AKIS podanego podskórnie z placebo. AKIS we wszystkich mocach wykazywał statystycznie znamiennie wyższe zmniejszenie bólu o nasileniu umiarkowanym do ciężkiego po zabiegu usuwania zęba z powodu wklinowania (zgodnie z pomiarami wg skali VAS) w porównaniu do placebo (p<0,001). AKIS także wykazywał znacząco większe działanie przeciwbólowe w pomiarach skuteczności wtórnej, czasu do wystąpienia działania przeciwbólowego, zastosowania leków doraźnych przez 8 godzin po podaniu produktu i odsetka pacjentów z 30% zmniejszeniem intensywności bólu po 1,5 godziny po podaniu produktu w porównaniu z placebo (p<0,001 we wszystkich porównaniach z placebo; nie wykryto statystycznej różnicy w porównaniach pomiędzy aktywnymi lekami). W ramach drugiego badania działania przeciwbólowego po zabiegach stomatologicznych porównywano działanie przeciwbólowe AKIS podanego podskórnie z lekiem Voltarol® 75 mg/3 ml podanym domięśniowo.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWłaściwości farmakodynamiczne
Badanie nie wykazało znamiennej różnicy pomiędzy dwoma lekami przeciwbólowymi w dowolnym punkcie czasu przez 8 godzin po podaniu leku. Po 1,5 godziny po podaniu leku (pierwszorzędowy punkt końcowy badania) 95% CI różnicy między dwoma lekami przeciwbólowymi był całkowicie poza ustaloną uprzednio górną granicą równoważności (-15 mm). Zatem, wykazano, że AKIS jest terapeutycznie równoważny z lekiem Voltarol. Średnie różnice i 95% CI różnicy w dowolnym punkcie czasu przez 8 godzin po podaniu leku przedstawia tabela poniżej.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Podanie domięśniowe: Po domięśniowym podaniu 75 mg/ml roztworu do wstrzykiwań AKIS, wchłanianie produktu leczniczego przebiega szybko i średnie maksymalne stężenie w osoczu wynoszące w zakresie 2,603 ± 0,959 µg/ml (2,5 ug/ml stanowi ok. 8 µmol/l) jest osiągane po 34 minutach. Obszar pod krzywą stężenia AUCo-t wynosi 250,07 ± 46,89 µg/ml.min. W porównawczych badaniach klinicznych mediana maksymalnego stężenia w osoczu w przypadku domięśniowego podania Voltarolu (75mg/3ml) wynosi 2,242 ± 0,566 µg/ml, która to wartość jest osiągana po 27 minutach, a AUCo-t wynosi 246,70± 39,74 µg/ml.min. AUC po podaniu domięśniowym jest w przybliżeniu ponad dwa razy dłuższa w porównaniu do podania doustnego lub doodbytniczego, ponieważ unika się metabolizmu pierwszego przejścia.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWłaściwości farmakokinetyczne
Podanie podskórne: Wchłanianie po podaniu podskórnym produktu leczniczego AKIS w dawce 75 mg/ml przebiega szybko i mediana maksymalnego stężenia w osoczu o wartości 2,138 ± 0,646 µg/ml (2,5 µg/ml stanowi ok. 8 µmol/l) jest osiągana po 40 minutach. Obszar pod krzywą stężenia AUCo-t wynosi 261,94 ± 53,29 µg/ml.min. W porównawczych badaniach klinicznych mediana maksymalnego stężenia w osoczu w przypadku domięśniowego podania Voltarolu wynosi 2,242 ± 0,566 µg/ml i jest osiągana po 27 minutach, a AUCo-t wynosi 246,70± 39,74 µg/ml.min. AUC i Cmax po podaniu podskórnym dawki 75 mg AKIS były biorównoważne z domięśniowo podaną dawką 75 mg/3 ml Voltarolu. AUC po podaniu podskórnym jest w przybliżeniu ponad dwa razy dłuższa w porównaniu do podania doustnego lub doodbytniczego, ponieważ unika się metabolizmu pierwszego przejścia. Liniowość dawki względem AUC i Cmax została wykazana w przypadku podskórnego podania diklofenaku.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWłaściwości farmakokinetyczne
Wykazano brak liniowej zależności pomiędzy Cmax a dawką, co oznacza odpowiednio średnią wartość Cmax 1 090 ng/ml, 1648,9 ng/ml i 1 851,1 ng/ml po dawkach AKIS 25 mg, 50 mg i 75 mg. Podanie dożylne w bolusie: Wchłanianie po podaniu dożylnym w bolusie produktu leczniczego AKIS w dawce 75 mg/ml następuje natychmiastowo i mediana maksymalnego stężenia w osoczu o wartości około 16,505 ± 2,829 µg/ml osiągana jest w ciągu 3 minut. W porównawczych badaniach farmakokinetycznych, w których diklofenak mierzono w osoczu do 8 godzin po podaniu, produkt AKIS 75 mg/ml w dożylnym bolusie okazał się być biorównoważny w stosunku do ampułki Voltarol 75 mg/3 ml podawanej jako 30-minutowa infuzja dożylna (100 ml) pod względem ekspozycji ogólnoustrojowej (AUC0-t: 5193,46 ± 1285 ng/ml.h i 4584,13 ± 1014,20 ng/ml.h, odpowiednio dla produktu AKIS i Voltarol), ale przy znacznie większej szybkości wchłaniania (Cmax dla wlewu Voltarol 75 mg/3 ml wynosiła 6,177 ± 1,051 μg/ml).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWłaściwości farmakokinetyczne
Ponadto stężenie diklofenaku w osoczu (Cmax) po podaniu produktu AKIS w dożylnym bolusie okazało się porównywalne do opisanego w literaturze podobnego roztworu zawierającego diklofenak sodu i hydroksylo-propylo-ß-cyklodekstryny do wstrzykiwań (Dyloject® 75 mg/2 ml, Javelin Pharm. Ltd., Wielka Brytania) podawanym tą samą drogą (Cmax: 15,147 ± 2,829 μg/ml). AUC diklofenaku po podaniu dożylnym w bolusie jest około dwa razy większa w porównaniu do podawania doustnego lub doodbytniczego, ponieważ unika się metabolizmu pierwszego przejścia. Dystrybucja Substancja czynna jest w 99,7% wiązana z białkami osocza, głównie z albuminami (99,4%). Diklofenak przenika do płynu maziowego, gdzie maksymalne stężenie występuje po 2 do 4 godzin od osiągnięcia maksymalnego stężenia w osoczu krwi. Okres półtrwania w fazie eliminacji z płynu maziowego wynosi od 3 do 6 godzin.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWłaściwości farmakokinetyczne
2 godziny po osiągnięciu wartości maksymalnych w osoczu krwi wartości stężenia substancji czynnej w płynie maziowym osiągają już większe wartości w porównaniu do osocza i stan ten utrzymuje się przez maksymalnie 12 godzin. Metabolizm Metabolizm diklofenaku odbywa się częściowo na drodze glukuronidacji niezmienionej cząsteczki, ale diklofenak głównie ulega pojedynczej lub wielokrotnej hydroksylacji i metoksylacji, w wyniku czego powstaje kilka pochodnych fenolowych, których większość zostaje przekształcona do postaci koniugatów glukuronidowych. Dwie pochodne fenolowe są biologicznie aktywne, jednakże w znacznie mniejszym stopniu niż diklofenak. Eliminacja Całkowity klirens układowy diklofenaku w osoczu wynosi 263 ± 56 ml/min (średnia wartość ± SD). Końcowy okres półtrwania w osoczu wynosi 1-2 godziny. Cztery z pochodnych, w tym dwie aktywne, maja także krótki okres półtrwania w osoczu, który wynosi 1-3 godziny.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWłaściwości farmakokinetyczne
Około 60% podanej dawki jest wydalane z moczem w postaci sprzężonych z glukuronidami, niezmienionych cząsteczek i metabolitów, z których większość jest przekształcana do koniugatów glukuronowych. Mniej niż 1% produktu leczniczego jest wydalane w postaci niezmienionej. Pozostała część dawki ulega wydaleniu w postaci metabolitów z żółcią w kale. Szczególne grupy pacjentów Pacjenci w podeszłym wieku: Nie obserwowano istotnych różnic zależnych od wieku w zakresie wchłaniania, metabolizmu lub wydalania. Pacjenci z niewydolnością nerek: Kinetyka pojedynczej dawki z zastosowaniem typowego schematu dawkowania u pacjentów z niewydolnością nerek nie wskazuje na występowanie kumulacji niezmienionej substancji czynnej. W przypadku klirensu kreatyniny <10 ml/min stężenie hydroksypochodnych diklofenaku w osoczu obliczone w stanie równowagi dynamicznej jest o ok. 4 razy większe w porównaniu do pacjentów z prawidłową czynnością nerek. Jednakże ostatecznie pochodne te są wydalane z żółcią.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlWłaściwości farmakokinetyczne
Pacjenci z chorobą wątroby: Kinetyka i metabolizm diklofenaku są takie same u pacjentów ze zdrową wątrobą i u pacjentów z przewlekłym zapaleniem wątroby lub wyrównaną marskością wątroby.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak nowych badań przedklinicznych dotyczących bezpieczeństwa stosowania diklofenaku sodowego. Produkt leczniczy ma dobrze ustalony profil bezpieczeństwa. Badania miejscowej tolerancji wykazały, że produkt nie wywołuje znaczącego nieoczekiwanego, miejscowego działania toksycznego zarówno w przypadku podania domięśniowego, jak i podskórnego.
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Hydroksypropylobetadeks Polisorbat 20 Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonano badań dotyczących zgodności. 6.3 Okres ważności 2 lata Po otwarciu opakowania bezpośredniego: zużyć natychmiast. Należy usunąć wszelkie niewykorzystane resztki roztworu. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Nie przechowywać w lodówce ani nie zamrażać. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem. 6.5 Rodzaj i zawartość opakowania Ampułko-strzykawka z bezbarwnego szkła typu I, z osłonką zabezpieczającą wykonaną z syntetycznego izoprenu-bromobutylu oraz z tłokiem z gumy chlorobutylowej (pręt tłoka wykonany z poliestru).
- CHPL leku Akis, roztwór do wstrzykiwań w ampułko-strzykawce, 75 mg/mlDane farmaceutyczne
Zestaw do podania: 1 igła do podania podskórnego (rozmiar 27 G), szara 1 igła do podania domięśniowego lub dożylnego (rozmiar 21 G), zielona Opakowanie: 1, 3 lub 5 ampułko-strzykawek, w tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Nie należy stosować, jeśli pojawią się kryształki lub osad. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Biofenac, tabletki powlekane, 100 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Biofenac, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 100 mg aceklofenaku. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZ NA Tabletka powlekana. Białe, okrągłe, obustronnie wypukłe, tabletki powlekane o średnicy 8 mm z wytłoczonym napisem „A” po jednej stronie, druga strona jest gładka.
- CHPL leku Biofenac, tabletki powlekane, 100 mgWskazania do stosowania
4.1 Wskazania do stosowania Objawowe leczenie bólu i stanów zapalnych w chorobie zwyrodnieniowej stawów, reumatoidalnym zapaleniu stawów oraz zesztywniającym zapaleniu stawów kręgosłupa.
- CHPL leku Biofenac, tabletki powlekane, 100 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Maksymalna zalecana dawka dobowa wynosi 200 mg, stosowana w dwóch dawkach podzielonych po 100 mg, czyli jedna tabletka rano i jedna wieczorem. Pacjenci w podeszłym wieku Zwykle nie jest wymagane zmniejszenie dawki, należy jednak wziąć pod uwagę środki ostrożności opisane w punkcie 4.4. Dzieci i młodzież Nie określono bezpieczeństwa stosowania i skuteczności u dzieci i młodzieży. Niewydolność wątroby U pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności wątroby dawkę aceklofenaku należy zmniejszyć. Zalecana dawka początkowa wynosi 100 mg na dobę. Niewydolność nerek Brak danych dotyczących konieczności zmiany dawkowania aceklofenaku u pacjentów z łagodnymi zaburzeniami czynności nerek, zaleca się natomiast zachowanie ostrożności.
- CHPL leku Biofenac, tabletki powlekane, 100 mgDawkowanie
Występowanie działań niepożądanych można ograniczyć stosując produkt w najmniejszej skutecznej dawce i nie dłużej niż to konieczne do kontrolowania objawów (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Sposób podawania Tabletki produktu leczniczego Biofenac są przeznaczone do stosowania doustnego i należy je przyjmować z co najmniej połową szklanki płynu. Produkt leczniczy Biofenac może być przyjmowany z jedzeniem.
- CHPL leku Biofenac, tabletki powlekane, 100 mgPrzeciwwskazania
4.3 Przeciwwskazania Stosowanie aceklofenaku jest przeciwwskazane w następujących sytuacjach: u pacjentów z nadwrażliwością na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; u pacjentów, u których stosowanie substancji o podobnym mechanizmie działania (np. kwasu acetylosalicylowego lub innych leków z grupy niesteroidowych leków przeciwzapalnych - NLPZ) powoduje wystąpienie ataków astmy, skurcz oskrzeli, ostre zapalenie błony śluzowej nosa lub pokrzywki lub też u pacjentów, u których występuje nadwrażliwość na te leki; u pacjentów z krwawieniem lub u których występują choroby związane z krwawieniem; u pacjentów, u których występowało krwawienie lub perforacja przewodu pokarmowego związane z wcześniejszym leczeniem niesteroidowymi lekami przeciwzapalnymi; u pacjentów z czynną lub nawracającą chorobą wrzodową żołądka lub krwawieniem (dwa lub więcej odrębne epizody stwierdzonego owrzodzenia lub krwawienia); u pacjentów ze stwierdzoną zastoinową niewydolnością serca (klasa II–IV wg NYHA), chorobą niedokrwienną serca, chorobą naczyń obwodowych i (lub) chorobą naczyń mózgowych; u pacjentów z ciężkimi zaburzeniami czynności wątroby lub nerek; podczas ostatnich trzech miesięcy ciąży (patrz punkt 4.6).
- CHPL leku Biofenac, tabletki powlekane, 100 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy unikać jednoczesnego stosowania produktu leczniczego Biofenac z lekami z grupy NLPZ, w tym z selektywnymi inhibitorami cyklooksygenazy COX-2. Ryzyko wystąpienia działań niepożądanych można zmniejszyć poprzez stosowanie najmniejszych skutecznych dawek przez najkrótszy czas konieczny do kontrolowania objawów (patrz punkt 4.2 oraz ryzyko ze strony układu pokarmowego i sercowo-naczyniowego poniżej). Działanie na układ pokarmowy: Zgłaszano występowanie krwawienia, owrzodzenia lub perforacji układu pokarmowego, które mogą prowadzić do śmierci, podczas stosowania wszystkich leków NLPZ w dowolnym momencie leczenia, z objawami ostrzegawczymi lub bez nich lub u pacjentów, u których wcześniej występowały ciężkie zaburzenia dotyczące układu pokarmowego.
- CHPL leku Biofenac, tabletki powlekane, 100 mgSpecjalne środki ostrozności
Ryzyko wystąpienia krwawienia, owrzodzenia lub perforacji przewodu pokarmowego rośnie wraz ze zwiększaniem dawek leków z grupy NLPZ u pacjentów z owrzodzeniami w wywiadzie, zwłaszcza powikłanymi krwawieniem lub perforacją (patrz punkt 4.3), oraz u pacjentów w wieku podeszłym. U tych pacjentów należy rozpoczynać leczenie od najmniejszej dostępnej dawki. Należy rozważyć zastosowanie skojarzonego leczenia lekami ochronnymi (np. mizoprostol lub inhibitory pompy protonowej) u tych pacjentów, jak również u pacjentów wymagających jednoczesnego stosowania małych dawek kwasu acetylosalicylowego lub innych leków zwiększających ryzyko dotyczące układu pokarmowego (patrz niżej oraz punkt 4.5). Pacjenci, u których wystąpiły działania toksyczne na układ pokarmowy, szczególnie pacjenci w podeszłym wieku, powinni zgłaszać każde niepokojące objawy dotyczące jamy brzusznej (zwłaszcza krwawienie z przewodu pokarmowego) szczególnie w początkowym okresie leczenia.
- CHPL leku Biofenac, tabletki powlekane, 100 mgSpecjalne środki ostrozności
Należy zalecić ostrożność u pacjentów stosujących jednocześnie leki, które mogą zwiększyć ryzyko wystąpienia owrzodzenia lub krwawienia, takie jak kortykosteroidy o działaniu ogólnoustrojowym, leki przeciwzakrzepowe takie jak warfaryna, selektywne inhibitory wychwytu zwrotnego serotoniny lub leki przeciwpłytkowe, takie jak kwas acetylosalicylowy (patrz punkt 4.5). Jeżeli u pacjenta stosującego produkt leczniczy Biofenac wystąpi krwawienie lub owrzodzenie układu pokarmowego, należy przerwać leczenie. Działanie na układ sercowo-naczyniowy oraz na krążenie mózgowe: Wymagane jest odpowiednie monitorowanie i opieka u pacjentów ze stwierdzonym w wywiadzie nadciśnieniem tętniczym i (lub) łagodną do umiarkowanej zastoinową niewydolnością serca, ponieważ zgłaszano występowanie zatrzymania płynów i obrzęków w związku ze stosowaniem leków z grupy NLPZ.
- CHPL leku Biofenac, tabletki powlekane, 100 mgSpecjalne środki ostrozności
Aceklofenak należy stosować bardzo ostrożnie u pacjentów z zastoinową niewydolnością serca (klasa I wg NYHA) oraz u pacjentów z istotnymi czynnikami ryzyka zdarzeń dotyczących układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Produkt ten należy stosować możliwie jak najkrócej i w najmniejszej skutecznej dawce dobowej, ze względu na możliwość nasilenia ryzyka dotyczącego układu krążenia po zastosowaniu aceklofenaku w dużych dawkach i długotrwale. Należy okresowo kontrolować konieczność kontynuacji leczenia objawowego i odpowiedź na leczenie. Aceklofenak należy również stosować ostrożnie i pod ścisłą kontrolą lekarską u pacjentów z krwawieniem w obrębie naczyń mózgowych w wywiadzie. Działanie na nerki: Podawanie leków z grupy NLPZ może powodować zależne od dawki zmniejszanie wytwarzania prostaglandyn i wywoływać niewydolność nerek.
- CHPL leku Biofenac, tabletki powlekane, 100 mgSpecjalne środki ostrozności
Należy wziąć pod uwagę znaczenie prostaglandyn w utrzymywaniu przepływu krwi przez nerki u pacjentów z zaburzeniami czynności serca lub nerek, niewydolności wątroby, u pacjentów stosujących leki moczopędne lub po zabiegach operacyjnych oraz u pacjentów w podeszłym wieku. Należy monitorować pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności nerek oraz zachować ostrożność podczas stosowania u pacjentów z innymi chorobami predysponującymi do wystąpienia zatrzymania płynów. W tej grupie pacjentów stosowanie leków z grupy NLPZ może spowodować pogorszenie czynności nerek i zatrzymanie płynów. Ostrożnie należy stosować produkt leczniczy również u pacjentów otrzymujących diuretyki lub u których z innych powodów występuje ryzyko hipowolemii. Należy stosować najmniejszą skuteczną dawkę oraz regularnie monitorować czynność nerek. Działanie na nerki jest zazwyczaj odwracalne po zaprzestaniu stosowania aceklofenaku.
- CHPL leku Biofenac, tabletki powlekane, 100 mgSpecjalne środki ostrozności
Działanie na wątrobę: U pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności wątroby konieczny jest ścisły nadzór lekarski. Należy odstawić aceklofenak gdy utrzymują się lub pogarszają nieprawidłowe wyniki badań czynności wątroby, rozwijają się objawy podmiotowe i przedmiotowe wskazujące na chorobę wątroby lub gdy wystąpią inne objawy (eozynofilia, wysypka). Może wystąpić zapalenie wątroby bez objawów prodromalnych. Stosowanie leków z grupy NLPZ u pacjentów z porfirią wątrobową może spowodować wystąpienie ataku. Nadwrażliwość i reakcje skórne: Podobnie jak w przypadku innych leków z grupy NLPZ, mogą wystąpić reakcje alergiczne, w tym, reakcje anafilaktyczne lub anafilaktoidalne, bez wcześniejszej ekspozycji na produkt. Rzadko zgłaszano ciężkie reakcje alergiczne związane ze stosowaniem leków z grupy NLPZ, w niektórych przypadkach prowadzące do zgonu, w tym złuszczające zapalenie skóry, zespół Stevens-Johnsona oraz toksyczne martwicze oddzielanie się naskórka (patrz punkt 4.8).
- CHPL leku Biofenac, tabletki powlekane, 100 mgSpecjalne środki ostrozności
Wydaje się, że największe ryzyko wystąpienia tych reakcji występuje na początku leczenia, a w większości przypadków rozpoczynają się one w ciągu pierwszego miesiąca leczenia. Stosowanie produktu leczniczego Biofenac należy przerwać w momencie pierwszego pojawienia się wysypki skórnej, uszkodzenia błon śluzowych lub jakichkolwiek objawów nadwrażliwości. W wyjątkowych przypadkach wirus ospy wietrznej może powodować ciężkie i skomplikowane infekcje błon śluzowych i tkanek miękkich. Jak do tej pory nie można wykluczyć roli leków z grupy NLPZ w zaostrzaniu przebiegu tych infekcji. Dlatego też zaleca się unikać stosowania produktu leczniczego Biofenac w przypadku ospy wietrznej. Zaburzenia hematologiczne: Aceklofenak może odwracalnie zahamować agregację płytek krwi (patrz punkt 4.5). Zaburzenia układu oddechowego: Należy zachować ostrożność podczas stosowania u pacjentów, u których występuje lub występowała w przeszłości astma oskrzelowa, ponieważ leki z grupy NLPZ wywoływały skurcz oskrzeli u tych pacjentów.
- CHPL leku Biofenac, tabletki powlekane, 100 mgSpecjalne środki ostrozności
Pacjenci w podeszłym wieku: U pacjentów w podeszłym wieku działania niepożądane związane ze stosowanie leków z grupy NLPZ występują z większą częstością, zwłaszcza perforacja i krwawienie z przewodu pokarmowego, które mogą prowadzić do zgonu (patrz punkt 4.2). Krwawienie i (lub) perforacja przewodu pokarmowego mają często cięższy przebieg i mogą wystąpić bez objawów ostrzegawczych lub po raz pierwszy, w dowolnym momencie leczenia. Ponadto u pacjentów w podeszłym wieku istnieje większe prawdopodobieństwo zaburzenia czynności nerek, układu sercowo-naczyniowego lub wątroby. Leczenie długotrwałe: Wszystkich pacjentów, którzy stosują długotrwale leki z grupy NLPZ należy w ramach środków ostrożności monitorować (np. badania czynności nerek i wątroby i morfologia krwi). Aceklofenak należy stosować ostrożnie i pod ścisłym nadzorem lekarskim u pacjentów z toczniem rumieniowatym układowym, porfirią lub zaburzeniami hematopoezy lub krzepnięcia. 5.
- CHPL leku Biofenac, tabletki powlekane, 100 mgSpecjalne środki ostrozności
Substancje pomocnicze Sód Biofenac, 100 mg, tabletki powlekane zawiera 6,60 mg kroskarmelozy sodowej w każdej tabletce. Lek zawiera mniej niż 1 mmol (23 mg) sodu w tabletce powlekanej, to znaczy lek uznaje się za „wolny od sodu”.
- CHPL leku Biofenac, tabletki powlekane, 100 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie wykonywano badań interakcji farmakokinetycznych z wyjątkiem warfaryny. Aceklofenak jest metabolizowany przez cytochrom P450 2C9, a dane z badań in vitro wskazują, że acklofenak może być inhibitorem tego enzymu. Dlatego też możliwe jest wystąpienie interakcji farmakokinetycznej z fenytoiną, cymetydyną, tolbutamidem, fenylbutazonem, amiodaronem, mykonazolem i sulfafenazolem. Pobodnie jak w przypadku innych leków z grupy NLPZ, istnieje również ryzyko interakcji farmakokinetycznych z innymi lekami wydalanymi poprzez aktywny transport w nerkach, takimi jak metotreksat i lit. Aceklofenak wiąże się prawie całkowicie z albuminami osocza i dlatego też należy mieć na uwadze możliwość wystąpienia interakcji wypierania z połączeń białkowych z innymi lekami silnie wiążącymi się z białkami.
- CHPL leku Biofenac, tabletki powlekane, 100 mgInterakcje
Z powodu braku badań interakcji farmakokinetycznych, niżej zamieszczone dane oparte są na informacjach o innych lekach z grupy NLPZ: Należy unikać jednoczesnego stosowania z następującymi lekami: Metotreksat (w dużych dawkach): Leki z grupy NLPZ hamują wydzielanie kanalikowe metotreksatu oraz może również wystąpić nieznaczna interakcja metaboliczna, co powoduje zmniejszony klirens metotreksatu. Dlatego też należy zawsze unikać przepisywania leków z grupy NLPZ podczas stosowania dużych dawek metotreksatu. Lit i digoksyna: Niektóre leki z grupy NLPZ hamują klirens nerkowy litu i digoksyny, co powoduje zwiększenie stężenia w surowicy obu leków. Należy unikać jednoczesnego stosowania, o ile nie można prowadzić częstej obserwacji stężenia litu i digoksyny. Kortykosteroidy: Istnieje zwiększone ryzyko owrzodzenia przewodu pokarmowego lub krwawienia (patrz punkt 4.4).
- CHPL leku Biofenac, tabletki powlekane, 100 mgInterakcje
Leki przeciwzakrzepowe: Leki z grupy NLPZ mogą nasilać działanie leków przeciwzakrzepowych, takich jak warfaryna (patrz punkt 4.4). Należy prowadzić uważną obserwację pacjentów stosujących jednocześnie leki przeciwzakrzepowe i aceklofenak. Leki hamujące czynność płytek krwi i selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI): Istnieje zwiększone ryzyko wystąpienia krwawienia z przewodu pokarmowego (patrz punkt 4.4). Jednoczesne stosowanie z niżej wymienionymi lekami może wymagać dostosowania dawkowania i zachowania środków ostrożności: Metotreksat (w małych dawkach): Należy mieć na uwadze możliwą interakcję pomiędzy lekami z grupy NLPZ a metotreksatem nawet wówczas, gdy stosuje się małe dawki metotreksatu, zwłaszcza u pacjentów z upośledzoną czynnością nerek. W przypadkach gdy jednoczesne stosowanie jest konieczne, należy obserwować czynność nerek.
- CHPL leku Biofenac, tabletki powlekane, 100 mgInterakcje
Należy zachować ostrożność, gdy zarówno NLPZ jak i metotreksat są podawane w ciągu 24 godzin, ponieważ stężenie metotreksatu może się zwiększyć i powodować zwiększenie jego toksyczności. Cyklosporyna, takrolimus: Uważa się, że jednoczesne stosowanie leków z grupy NLPZ z cyklosporyną lub takrolimusem zwiększa ryzyko działania nefrotoksycznego z powodu zmniejszonej syntezy prostaglandyn w nerkach. Dlatego też istotne jest, aby uważnie obserwować czynność nerek podczas leczenia skojarzonego. Inne leki z grupy NLPZ, w tym salicylany (kwas acetylosalicylowy >3g/dobę): Jednoczesne stosowanie z kwasem acetylosalicylowym oraz innymi niesteroidowymi lekami przeciwzapalnymi może zwiększać częstość występowania działań niepożądanych i z tego powodu zaleca się ostrożność. Leki stosowane w leczeniu nadciśnienia tętniczego: Leki z grupy NLPZ mogą zmniejszać działanie produktów leczniczych stosowanych w leczeniu nadciśnienia tętniczego.
- CHPL leku Biofenac, tabletki powlekane, 100 mgInterakcje
Ryzyko wystąpienia ostrej niewydolności nerek, zwykle odwracalnej, może być zwiększone u niektórych pacjentów z upośledzoną czynnością nerek (np. pacjenci odwodnieni lub pacjenci w podeszłym wieku) podczas skojarzonego stosowania inhibitorów konwertazy angiotensyny lub antagonistów receptora angiotensyny II i leków z grupy NLPZ. Dlatego też leczenie skojarzone należy prowadzić ostrożnie, szczególnie u pacjentów w podeszłym wieku. Po rozpoczęciu skojarzonego leczenia oraz okresowo później należy odpowiednio nawadniać pacjentów oraz obserwować czynność nerek. Leki moczopędne: Aceklofenak, podobnie jak inne leki z grupy NLPZ, może hamować działanie leków moczopędnych. Jednoczesne stosowanie z lekami diuretycznymi oszczędzającymi potas może być związane ze zwiększonym stężeniem potasu i z tego powodu należy obserwować stężenie potasu w surowicy. Aceklofenak nie wpływał na ciśnienie tętnicze krwi podczas jednoczesnego stosowania z bendrofluazydem.
- CHPL leku Biofenac, tabletki powlekane, 100 mgInterakcje
Nie można jednakże wykluczyć interakcji z innymi lekami moczopędnymi. Leki przeciwcukrzycowe: Badania kliniczne wykazały, że diklofenak można podawać jednocześnie z doustnymi lekami przeciwcukrzycowymi bez wpływu na ich skuteczność. W pojedynczych przypadkach obserwowano występowanie hipoglikemii i hiperglikemii. Dlatego też w przypadku aceklofenaku należy rozważyć dostosowanie dawkowania leków, które mogą powodować hipoglikemię. Zydowudyna: Podczas jednoczesnego stosowania leków z grupy NLPZ i zydowudyny zwiększa się ryzyko działań toksycznych na układ krwiotwórczy. Istnieją przesłanki dotyczące zwiększonego ryzyka krwawienia do stawów i krwiaków u pacjentów z hemofilią i HIV otrzymujących jednocześnie zydowudynę oraz ibuprofen.
- CHPL leku Biofenac, tabletki powlekane, 100 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych klinicznych dotyczących ekspozycji na aceklofenak w ciąży. Hamowanie syntezy prostaglandyn może negatywnie wpływać na przebieg ciąży i (lub) rozwój zarodka lub płodu. Dane pochodzące z badań epidemiologicznych wskazują na zwiększone ryzyko poronienia oraz występowania wad serca oraz wad przewodu pokarmowego związane ze stosowaniem inhibitorów syntezy prostaglandyn we wczesnym okresie ciąży. Bezwzględne ryzyko występowania wad układu sercowo-naczyniowego zwiększało się w tych badaniach z wartości mniejszej niż 1% do wartości około 1,5%. Prawdopodobnie ryzyko występowania powyższych wad wrodzonych zwiększa się wraz ze stosowaniem większych dawek produktu a także wraz z wydłużaniem okresu terapii. U zwierząt podawanie inhibitorów syntezy prostaglandyn wykazało zwiększenie ilości przypadków nie zagnieżdżenia się jaja i śmiertelność zarodków lub płodów.
- CHPL leku Biofenac, tabletki powlekane, 100 mgWpływ na płodność, ciążę i laktację
Dodatkowo, u zwierząt, którym podawano inhibitory syntezy prostaglandyn w okresie organogenezy obserwowano zwiększoną częstość występowania różnych wad wrodzonych, w tym wad układu sercowo-naczyniowego. Stosowanie aceklofenaku od 20. tygodnia ciąży może powodować małowodzie wynikające z zaburzeń czynności nerek u płodu. Może to wystąpić wkrótce po rozpoczęciu leczenia i jest zazwyczaj odwracalne po jego przerwaniu. Ponadto, odnotowano przypadki zwężenia przewodu tętniczego w następstwie leczenia w drugim trymestrze ciąży, z których większość ustępowała po przerwaniu leczenia. Z tego powodu nie należy stosować produktu leczniczego Biofenac u kobiet w pierwszym i drugim trymestrze ciąży, o ile nie jest to bezwzględnie konieczne. W przypadku stosowania produktu leczniczego Biofenac u kobiet planujących ciążę oraz w pierwszym i drugim trymestrze ciąży, podawane dawki powinny być możliwie jak najmniejsze, a czas trwania leczenia możliwie najkrótszy.
- CHPL leku Biofenac, tabletki powlekane, 100 mgWpływ na płodność, ciążę i laktację
W przypadku kilkudniowego narażenia na aceklofenak od 20. tygodnia ciąży należy rozważyć monitorowanie przedporodowe pod kątem małowodzia i zwężenia przewodu tętniczego. Należy przerwać stosowanie produktu leczniczego Biofenac w przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego. W trzecim trymestrze ciąży wszystkie inhibitory syntezy prostaglandyn mogą powodować u płodu następujące uszkodzenia: Toksyczny wpływ na układ krążenia i oddechowy (przedwczesne zwężenie/ zamknięcie przewodu tętniczego i nadciśnienie płucne), zaburzenia czynności nerek, które mogą prowadzić do rozwoju niewydolności nerek z małowodziem (patrz powyżej). Ponadto podawane kobietom w końcowym okresie ciąży mogą powodować u matki i noworodka: wydłużenie czasu krwawienia oraz działanie antyagregacyjne, nawet po zastosowaniu bardzo małych dawek produktu, hamować kurczliwość macicy, co powoduje opóźnienie lub przedłużenie porodu.
- CHPL leku Biofenac, tabletki powlekane, 100 mgWpływ na płodność, ciążę i laktację
W związku z tym stosowanie produktu leczniczego Biofenac jest przeciwwskazane w trzecim trymestrze ciąży (patrz punkt 4.3 oraz punkt 5.3). Karmienie piersi? Nie wiadomo czy aceklofenak jest wydzielany z mlekiem u ludzi. Jednakże odnotowano nieznaczne przenikanie aceklofenaku znaczonego radioaktywnie (14C) do mleka u szczurów. Decyzję dotyczącą kontynuacji lub przerwania karmienia piersią lub dotyczącą kontynuacji lub przerwania stosowania produktu leczniczego Biofenac należy podjąć biorąc pod uwagę korzyści płynące z karmienia piersią dla dziecka oraz korzyści płynące ze stosowania produktu leczniczego Biofenac dla kobiety. Płodność Stosowanie produktu leczniczego Biofenac, podobnie jak w przypadku innych leków o działaniu hamującym na cyklooksygenazę i (lub) syntezę prostaglandyn, może niekorzystnie wpływać na płodność i nie jest zalecane u kobiet starających się zajść w ciążę.
- CHPL leku Biofenac, tabletki powlekane, 100 mgWpływ na płodność, ciążę i laktację
Należy rozważyć zaprzestanie stosowania produktu leczniczego Biofenac u kobiet mających trudności w zajściu w ciążę lub poddających się badaniom dotyczącym niepłodności.
- CHPL leku Biofenac, tabletki powlekane, 100 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjenci, u których podczas stosowania leków z grupy NLPZ wystąpią zawroty głowy lub inne objawy ze strony układu nerwowego nie powinni kierować pojazdami ani obsługiwać maszyn.
- CHPL leku Biofenac, tabletki powlekane, 100 mgDziałania niepożądane
4.8 Działania niepożądane Przewód pokarmowy: Najczęściej obserwowane działania niepożądane wiązały się z działaniem produktu na przewód pokarmowy. Po zastosowaniu NLPZ mogą wystąpić: owrzodzenie, perforacje, krwawienie z przewodu pokarmowego, czasami śmiertelne, zwłaszcza u osób w podeszłym wieku. Zgłaszane były także przypadki nudności, wymiotów, biegunki, wzdęć, zaparć, niestrawności, bólów brzucha, smolistych stolców, krwawych wymiotów, wrzodziejącego zapalenia jamy ustnej, zaostrzenia przebiegu wrzodziejącego zapalenia jelita i choroby Crohna (patrz punkt 4.4 - Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Znacznie rzadziej zgłaszane były przypadki zapalenia błony śluzowej żołądka. Podczas przyjmowania NLPZ zgłaszane były także obrzęki, nadciśnienie tętnicze i niewydolność serca.
- CHPL leku Biofenac, tabletki powlekane, 100 mgDziałania niepożądane
Inne bardzo rzadkie (<1/10 000) oddziaływania narządowe opisywane w związku ze stosowaniem NLPZ to: Zaburzenia nerek i układu moczowego – śródmiąższowe zapalenie nerek Reakcje pęcherzykowe w tym zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka. Wyjątkowo, stosowanie NLPZ w czasie ospy wietrznej może wywołać poważne komplikacje dotyczące naskórka i tkanek miękkich. Poniższa lista działań niepożądanych zawiera działania niepożądane zgłaszane podczas badań klinicznych i potwierdzone po wprowadzeniu leku do obrotu lub zgłaszane tylko po wprowadzeniu produktu leczniczego do obrotu. Działania niepożądane przedstawione są według klasyfikacji układów i narządów i częstości występowania. Bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100); rzadko (≥1/10 000 do <1/1 000); bardzo rzadko (<1/10 000).
- CHPL leku Biofenac, tabletki powlekane, 100 mgDziałania niepożądane
Klasyfikacja układów i narządów Często (≥1/100 do <1/10) Niezbyt często (≥1/1 000 do <1/100) Rzadko (≥1/10 000 do <1/1 000) Bardzo rzadko (<1/10 000) Zaburzenia krwi i układu chłonnego niedokrwistość zahamowanie czynności szpiku kostnego, granulocytopenia, trombocytopenia, neutropenia, niedokrwistość hemolityczna Zaburzenia układu immunologicznego reakcje anafilaktyczne (w tym wstrząs), nadwrażliwość Zaburzenia metabolizmu i odżywiania hiperkaliemia Zaburzenia psychiczne depresja, koszmary senne, bezsenność Zaburzenia układu nerwowego zawroty głowy parestezje, drżenie, senność, ból głowy, zaburzenia smaku Zaburzenia oka zaburzenia widzenia Zaburzenia ucha i błędnika zawroty głowy, szumy uszne Zaburzenia serca niewydolność serca kołatanie serca Zaburzenia naczyniowe nadciśnienie tętnicze, zaostrzone nadciśnienie tętnicze zaczerwienienie twarzy, uderzenia gorąca, zapalenie naczyń Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia duszność skurcz oskrzeli Zaburzenia żołądka i jelit niestrawność, ból brzucha, nudności, biegunka, wzdęcia z oddawaniem gazów, zapalenie błony śluzowej żołądka, zaparcia, wymioty, owrzodzenie jamy ustnej smoliste stolce, owrzodzenie przewodu pokarmowego, krwawe biegunki, krwawienie z przewodu pokarmowego, zapalenie jamy ustnej, krwawe wymioty, owrzodzenie żołądka, perforacja przewodu pokarmowego, zaostrzenie wrzodziejącego zapalenia okrężnicy i choroby Crohna, zapalenie trzustki Zaburzenia wątroby i dróg żółciowych zwiększenie aktywności aminotransferaz uszkodzenie wątroby (w tym zapalenie wątroby), zwiększenie aktywności fosfatazy zasadowej we krwi Zaburzenia skóry i tkanki podskórnej świąd, wysypka, zapalenie skóry, pokrzywka, obrzęk naczynioruchowy plamica, wyprysk, ciężkie reakcje skórne i błony śluzowej (w tym zespół Stevensa-Johnsona i martwica toksyczno-rozpływna naskórka) Zaburzenia nerek i dróg moczowych zwiększenie stężenia mocznika we krwi, zwiększenie stężenia kreatyniny we krwi zespół nerczycowy, niewydolność nerek Zaburzenia ogólne i stany w miejscu podania obrzęk, zmęczenie, skurcze mięśni nóg Badania diagnostyczne zwiększenie masy ciała Aceklofenak jest strukturalnie powiązany z diklofenakiem, jak również jest metabolizowany do tego związku.
- CHPL leku Biofenac, tabletki powlekane, 100 mgDziałania niepożądane
Wiele danych klinicznych i epidemiologicznych jednoznacznie wskazuje na zwiększone ryzyko występowania incydentów zakrzepowych dużych tętnic (zawał mięśnia sercowego lub udar, szczególnie po zastosowaniu dużych dawek i długotrwałym podawaniu) związanych ze stosowaniem diklofenaku. Dane epidemiologiczne wskazują również na zwiększone ryzyko występowania ostrego zespołu wieńcowego i zawału mięśnia sercowego związanych ze stosowaniem aceklofenaku (patrz punkty 4.3 i 4.4 „Przeciwwskazania” i „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania”). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Biofenac, tabletki powlekane, 100 mgDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49-21-301 Faks: + 48 22 49-21-309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Biofenac, tabletki powlekane, 100 mgPrzedawkowanie
4.9 Przedawkowanie Brak jest wystarczającej ilości danych dotyczących skutków przedawkowania aceklofenaku u ludzi. Objawy mogą obejmować: nudności, wymioty, ból żołądka, zawroty głowy, senność i ból głowy. Leczenie ostrego zatrucia lekami z grupy NLPZ opiera się głównie na podawaniu leków zobojętniających, o ile to konieczne, oraz na innym leczeniu podtrzymującym i objawowym komplikacji, takich jak: niedociśnienie tętnicze niewydolność nerek drgawki podrażnienie przewodu pokarmowego zahamowanie czynności oddechowej Postępowanie w przypadku ostrego przedawkowania aceklofenaku stosowanego doustnie polega na zapobieganiu wchłaniania najszybciej jak to możliwe po przedawkowaniu poprzez płukanie żołądka i podawanie węgla aktywowanego w dawkach wielokrotnych. Wymuszona diureza, dializa lub hemoperfuzja mogą nie być skuteczne w eliminacji leków z grupy NLPZ z powodu ich dużego współczynnika wiązania z białkami i szerokiemu metabolizmowi.
- CHPL leku Biofenac, tabletki powlekane, 100 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Niesteroidowe leki przeciwzapalne i przeciwreumatyczne; kod ATC: M01AB16 Aceklofenak jest substancją niesteroidową o działaniu przeciwzapalnym i przeciwbólowym. Mechanizm działania polega na zahamowaniu syntezy prostaglandyn.
- CHPL leku Biofenac, tabletki powlekane, 100 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie: Po podaniu doustnym, aceklofenak jest szybko wchłaniany, a jego dostępność biologiczna wynosi prawie 100%. Maksymalne stężenie w osoczu jest osiągane po około 1,25 do 3 godzin po przyjęciu. Podczas jednoczesnego przyjęcia posiłku Tmax jest wydłużony, podczas gdy stopień wchłaniania nie jest zmieniony. Dystrybucja: Aceklofenak wiąże się w dużym stopniu z białkami (>99,7%). Aceklofenak przenika do płynu maziowego, gdzie osiąga stężenie odpowiadające 60% stężenia w osoczu. Objętość dystrybucji wynosi około 30 l. Wydalanie: Okres półtrwania w osoczu w fazie eliminacji wynosi 4 – 4,3 godziny. Klirens wynosi 5 litrów na godzinę. Około dwóch trzecich podanej dawki jest wydalane z moczem, głównie w postaci sprzęgniętych hydroksymetabolitów. Tylko 1% pojedynczej dawki doustnej jest wydalane w postaci niezmienionej.
- CHPL leku Biofenac, tabletki powlekane, 100 mgWłaściwości farmakokinetyczne
Aceklofenak jest prawdopodobnie metabolizowany przez CYP2C9 do głównego metabolitu 4’-hydroksy-aceklofenaku, który prawdopodobnie nie posiada aktywności klinicznej. Pośród licznych metabolitów wykryto diklofenak i 4’-hydroksy-diklofenak. Szczególne grupy pacjentów: U osób w podeszłym wieku nie stwierdzono zmian w farmakokinetyce aceklofenaku. Po podaniu pojedynczej dawki aceklofenaku stwierdzono mniejszą szybkość eliminacji u pacjentów z upośledzoną czynnością wątroby. W badaniu z zastosowaniem dawki wielokrotnej z użyciem dawki 100 mg raz na dobę, nie stwierdzono różnic w zakresie parametrów farmakokinetycznych pomiędzy pacjentami z łagodną do umiarkowanej marskością wątroby a osobami zdrowymi. U pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności nerek nie stwierdzano znaczących różnic w zakresie farmakokinetyki po podaniu pojedynczej dawki.
- CHPL leku Biofenac, tabletki powlekane, 100 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Podobnie, jak ma to miejsce w przypadku innych NLPZ, aceklofenak jest słabo tolerowany przez zwierzęta doświadczalne. Dodatkowo, różnice w farmakokinetyce pomiędzy zwierzętami a człowiekiem utrudniają ocenę potencjalnej toksyczności aceklofenaku. Głównym miejscem działania toksycznego był przewód pokarmowy. Jednakże, badania nad toksycznością wykonane z zastosowaniem maksymalnych tolerowanych dawek u szczura, gatunku, który metabolizuje aceklofenak do diklofenaku, oraz u małpy (ekspozycja na niezmieniony aceklofenak) nie wykazały innych działań toksycznych, niż działania powszechnie stwierdzane dla NLPZ. Badania na zwierzętach wskazują że nie ma dowodów na działanie teratogenne u szczurów, choć ekspozycja ustrojowa była mała. U królików, stosowanie aceklofenaku (10 mg/kg/dobę) spowodowało serię zmian morfologicznych u niektórych płodów.
- CHPL leku Biofenac, tabletki powlekane, 100 mgPrzedkliniczne dane o bezpieczeństwie
Badania nad działaniem rakotwórczym u myszy (nieznana ustrojowa ekspozycja na aceklofenak) i u szczura (metabolizm do diklofenaku), nie wykazały żadnego oddziaływania rakotwórczego, natomiast badania genotoksyczności dały wynik negatywny.
- CHPL leku Biofenac, tabletki powlekane, 100 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki: Glicerolu distearynian Kroskarmeloza sodowa Powidon (K-30) Celuloza mikrokrystaliczna (typ 101) Celuloza mikrokrystaliczna (typ 102) Otoczka: Sepifilm 752: Makrogolu stearynian Tytanu dwutlenek (E 171) Celuloza mikrokrystaliczna Hypromeloza 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25C. 6.5 Rodzaj i zawartość opakowania 20, 60 tabletek powlekanych w blistrach PA/Aluminium/PVC//Aluminium i tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Ketonal, 50 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 50 mg ketoprofenu (Ketoprofenum). 1 ampułka (2 ml) zawiera 100 mg ketoprofenu (Ketoprofenum). Substancje pomocnicze o znanym działaniu: 1 ampułka (2 ml) zawiera 800 mg glikolu propylenowego, 200 mg etanolu 12,3% (v/v), 40 mg alkoholu benzylowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań. Klarowny roztwór bez widocznych cząstek.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Leczenie objawowe zapalnych i zwyrodnieniowych schorzeń reumatycznych układu kostnego oraz łagodzenie niektórych zespołów bólowych. Wskazania do podawania domięśniowego: reumatoidalne zapalenie stawów choroba zwyrodnieniowa stawów bóle o umiarkowanym nasileniu Wskazania do podawania dożylnego: bóle po zabiegach chirurgicznych
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Zalecane dawkowanie: Dorośli i dzieci w wieku powyżej 15 lat Podanie domięśniowe: 1 ampułka (100 mg ketoprofenu) jeden lub dwa razy na dobę. W razie potrzeby leczenie pozajelitowe może być uzupełnione leczeniem doustnym lub przezskórnym. Podanie dożylne: Ketoprofen w infuzji dożylnej można podawać jedynie w warunkach szpitalnych. Infuzję należy podawać w ciągu ½ do 1 godziny, przez maksymalnie 48 godzin. 1. CMDh Maksymalna dawka ketoprofenu wynosi 200 mg na dobę. Infuzja krótkotrwała: Zawartość 1 do 2 ampułek (100 mg do 200 mg ketoprofenu) należy uzupełnić do 100 ml 0,9% roztworem chlorku sodu i podawać w ciągu ½ do 1 godziny. Infuzję można powtórzyć po 8 godzinach. Maksymalna dawka wynosi 200 mg na dobę. Infuzja ciągła: Zawartość 1 do 2 ampułek (100 mg do 200 mg ketoprofenu) należy uzupełnić do 500 ml płynem infuzyjnym (0,9% roztwór chlorku sodu, mleczanowy roztwór Ringera, 5% roztwór glukozy) i podawać w ciągu 8 godzin.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlDawkowanie
Infuzję można powtórzyć po 8 godzinach. Maksymalna dawka wynosi 200 mg na dobę. Ketoprofen można podawać jednocześnie z lekami przeciwbólowymi o działaniu ośrodkowym. Roztwór można zmieszać w tej samej butelce z morfiną: 10 mg do 20 mg morfiny i 100 mg do 200 mg ketoprofenu rozcieńczyć w 500 ml 0,9% roztworu chlorku sodu lub mleczanowego roztworu Ringera. Infuzję można powtórzyć po 8 godzinach. Należy stosować najmniejszą skuteczną dawkę przez najkrótszy okres konieczny do złagodzenia objawów (patrz punkt 4.4). Podawanie produktu leczniczego w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.4). Maksymalna dawka dobowa ketoprofenu wynosi 200 mg. Przed rozpoczęciem leczenia dawką 200 mg na dobę należy dokładnie rozważyć stosunek ryzyka do korzyści, a stosowanie większej dawki nie jest zalecane (patrz również punkt 4.4).
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlDawkowanie
Pacjenci w podeszłym wieku: U pacjentów w podeszłym wieku leczenie ketoprofenem należy z zasady rozpoczynać od najmniejszej dostępnej dawki i kontynuować terapię najmniejszą dawką skuteczną. U pacjentów w podeszłym wieku ryzyko ciężkich skutków działań niepożądanych jest większe. Uwaga Nie wolno mieszać w tej samej butelce roztworu tramadolu i ketoprofenu ze względu na możliwość wytrącenia osadu. Butelki do infuzji należy owijać czarnym papierem lub folią aluminiową, gdyż ketoprofen jest wrażliwy na światło.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; Występujące u pacjenta w przeszłości reakcje nadwrażliwości, takie jak skurcz oskrzeli, napad astmy oskrzelowej, zapalenie błony śluzowej nosa, pokrzywka lub innego rodzaju reakcje alergiczne wywołane podaniem ketoprofenu, kwasu acetylosalicylowego lub innych niesteroidowych leków przeciwzapalnych (NLPZ); Trzeci trymestr ciąży (patrz punkt 4.6). Ciężka niewydolność serca. Czynna lub nawracająca choroba wrzodowa żołądka i (lub) dwunastnicy i (lub) krwawienie z przewodu pokarmowego w wywiadzie (co najmniej dwa wyraźne epizody potwierdzonego owrzodzenia lub krwawienia). Skłonność do krwawień. Ciężka niewydolność wątroby. Ciężka niewydolność nerek. 2. CMDh Stosowanie ketoprofenu jest przeciwwskazane w przypadkach krwawienia mózgowego lub jakiegokolwiek czynnego krwawienia.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlPrzeciwwskazania
Domięśniowe podawanie ketoprofenu jest przeciwwskazane u pacjentów z zaburzeniami hemostazy lub otrzymujących leczenie przeciwzakrzepowe. Produktu leczniczego nie należy stosować u dzieci w wieku poniżej 15 lat.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podawanie produktu leczniczego w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych. Maskowanie objawów zakażenia podstawowego: Ketonal może maskować objawy zakażenia, co może prowadzić do opóźnionego rozpoczęcia stosowania właściwego leczenia, a przez to pogarszać skutki zakażenia. Zjawisko to zaobserwowano w przypadku pozaszpitalnego bakteryjnego zapalenia płuc i powikłań bakteryjnych ospy wietrznej. Jeśli Ketonal stosowany jest z powodu gorączki lub bólu związanych z zakażeniem, zaleca się kontrolowanie przebiegu zakażenia. W warunkach pozaszpitalnych pacjent powinien skonsultować się z lekarzem, jeśli objawy utrzymują się lub nasilają. Zaleca się ostrożność w przypadku pacjentów otrzymujących jednocześnie produkty lecznicze, które mogą zwiększać ryzyko owrzodzenia lub krwawienia z przewodu pokarmowego, takie jak doustne kortykosteroidy, leki przeciwzakrzepowe (takie jak warfaryna), selektywne inhibitory wychwytu zwrotnego serotoniny lub leki przeciwpłytkowe (takie jak kwas acetylosalicylowy) lub nikorandyl (patrz punkt 4.5).
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Należy unikać jednoczesnego stosowania produktu Ketonal z niesteroidowymi lekami przeciwzapalnymi (NLPZ), w tym z selektywnymi inhibitorami cyklooksygenazy-2. Krwawienie z przewodu pokarmowego, owrzodzenie i perforacja: W przypadku wszystkich NLPZ opisywano występowanie krwawienia z przewodu pokarmowego, owrzodzenia lub perforacji (z możliwym skutkiem śmiertelnym), które mogą występować w dowolnym momencie leczenia, również bez objawów zwiastunowych lub ciężkich zdarzeń dotyczących przewodu pokarmowego w wywiadzie. Pewne dane epidemiologiczne sugerują, że w porównaniu z niektórymi innymi NLPZ stosowanie ketoprofenu, zwłaszcza w dużych dawkach, może wiązać się z dużym ryzykiem toksycznego wpływu na przewód pokarmowy (patrz również punkt 4.3). Ryzyko krwawienia, owrzodzenia lub perforacji w obrębie przewodu pokarmowego jest większe podczas stosowania większych dawek NLPZ, u pacjentów z przebytą chorobą wrzodową żołądka i (lub) dwunastnicy, zwłaszcza powikłaną krwawieniem lub perforacją (patrz punkt 4.3), a także u pacjentów w podeszłym wieku.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
U tych pacjentów leczenie należy rozpoczynać od najmniejszej dostępnej dawki. U tych pacjentów, a także u pacjentów, u których konieczne jest jednoczesne stosowanie kwasu acetylosalicylowego w małych dawkach lub innych produktów leczniczych potencjalnie zwiększających ryzyko powikłań dotyczących przewodu pokarmowego, należy rozważyć jednoczesne podawanie leków o działaniu ochronnym, np. mizoprostolu lub inhibitorów pompy protonowej (patrz niżej oraz punkt 4.5). Pacjenci z powikłaniami ze strony przewodu pokarmowego w wywiadzie, zwłaszcza w podeszłym wieku, powinni zgłaszać wszelkie nieprawidłowe objawy dotyczące jamy brzusznej (zwłaszcza krwawienia z przewodu pokarmowego), szczególnie w początkowym okresie leczenia. 3. CMDh Pacjenci w podeszłym wieku: U pacjentów w podeszłym wieku zwiększa się częstość działań niepożądanych związanych ze stosowaniem NLPZ, zwłaszcza krwawienia z przewodu pokarmowego i perforacji, które mogą zakończyć się zgonem.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Jeśli u pacjentów otrzymujących ketoprofen wystąpi krwawienie z przewodu pokarmowego lub choroba wrzodowej żołądka i (lub) dwunastnicy, leczenie należy przerwać. Ciężkie reakcje skórne (niektóre z możliwym skutkiem śmiertelnym), w tym złuszczające zapalenie skóry, zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka, były bardzo rzadko opisywane w związku z zastosowaniem NLPZ (patrz punkt 4.8). Ryzyko wystąpienia takich reakcji jest prawdopodobnie największe w początkowym okresie leczenia – w większości przypadków pojawiały się one w pierwszym miesiącu leczenia. Po wystąpieniu pierwszych oznak wysypki, zmian w obrębie błon śluzowych lub jakichkolwiek innych objawów nadwrażliwości ketoprofen należy odstawić. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych niesteroidowych leków przeciwzapalnych (szczególnie w dużych dawkach i długotrwale) może wiązać się ze zwiększeniem ryzyka zatorów tętnic (np.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
zawał mięśnia sercowego lub udar mózgu). Dane te są niewystarczające, aby wykluczyć takie ryzyko w przypadku przyjmowania ketoprofenu. Leki z grupy NLPZ należy stosować ostrożnie u pacjentów z chorobą przewodu pokarmowego w wywiadzie (wrzodziejącym zapaleniem okrężnicy, chorobą Leśniowskiego-Crohna), ze względu na możliwość zaostrzenia przebiegu choroby (patrz punkt 4.8). U pacjentów z niewydolnością serca, marskością i nerczycą, z zaburzeniami czynności wątroby, pacjentów otrzymujących leki moczopędne, pacjentów po dużych zabiegach chirurgicznych, z hipowolemią, pacjentów z przewlekłą niewydolnością nerek, zwłaszcza jeśli są w podeszłym wieku, konieczne jest uważne kontrolowanie ilości wydalanego moczu i czynności nerek na początku leczenia. Podanie tym pacjentom ketoprofenu może spowodować zmniejszenie perfuzji nerek na skutek hamowania syntezy prostaglandyn i prowadzić do dekompensacji czynności nerek.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Zgłaszano zwiększone ryzyko tętniczych zdarzeń zakrzepowych u pacjentów otrzymujących NLPZ inne niż kwas acetylosalicylowy w bólach okołooperacyjnych w przypadku zabiegu pomostowania tętnic wieńcowych (CABG). Należy zachować ostrożność u pacjentów z nadciśnieniem tętniczym i (lub) lekką do umiarkowanej zastoinową niewydolnością serca w wywiadzie, gdyż podczas leczenia NLPZ opisywano zatrzymanie płynów i obrzęki. Podobnie jak inne NLPZ, ketoprofen może maskować objawy rozwijającego się zakażenia (takie jak gorączka) na skutek swoich przeciwzapalnych, przeciwbólowych i przeciwgorączkowych właściwości. U pacjentów z nieprawidłowymi wynikami badań czynności wątroby lub z chorobami wątroby w wywiadzie należy okresowo kontrolować aktywność aminotransferaz, zwłaszcza podczas długotrwałego leczenia. Wpływ na płodność kobiet, patrz punkt 4.6.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
U pacjentów z astmą oskrzelową, współistniejącą z przewlekłym zapaleniem błony śluzowej nosa, przewlekłym zapaleniem zatok i (lub) polipami nosa częściej niż u innych osób mogą występować reakcje alergiczne na kwas acetylosalicylowy i (lub) niesteroidowe leki przeciwzapalne. Podanie produktu Ketonal może wywołać napad astmy lub skurcz oskrzeli, zwłaszcza u osób uczulonych na kwas acetylosalicylowy i (lub) NLPZ (patrz punkt 4.3). 4. CMDh Ryzyko krwawienia z przewodu pokarmowego: względne ryzyko jest większe u pacjentów z małą masą ciała. Jeśli wystąpi krwawienie z przewodu pokarmowego lub powstanie wrzód, leczenie należy natychmiast przerwać. Podczas długotrwałego leczenia należy badać morfologię krwi oraz czynność wątroby i nerek. U pacjentów, u których klirens kreatyniny jest mniejszy niż 20 ml/minutę (0,33 ml/sekundę), należy dostosować dawkę ketoprofenu.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Hiperkaliemia: U pacjentów z cukrzycą lub przyjmujących jednocześnie leki oszczędzające potas może się nasilić hiperkaliemia (patrz punkt 4.5). W takich warunkach konieczne jest regularne kontrolowanie stężenia potasu. Konieczne jest zachowanie ostrożności u pacjentów z zaburzeniami hemostazy, hemofilią, chorobą von Willebranda, ciężką trombocytopenią i niewydolnością nerek lub wątroby oraz u pacjentów przyjmujących leki przeciwzakrzepowe (pochodne kumaryny i heparyny, zwłaszcza heparyny niskocząsteczkowe). Przed dużym zabiegiem chirurgicznym stosowanie produktu Ketonal należy przerwać. Ketonal podawany dożylnie: W razie silnego bólu ketoprofen można stosować w skojarzeniu z pochodnymi morfiny. Ketonal zawiera 12,3% (v/v) etanolu. Każda dawka 2 ml zawiera 0,2 g etanolu, co jest równoważne 4 ml piwa (5% v/v) i 2 ml wina (12% v/v) na dawkę. Szkodliwe dla osób z chorobą alkoholową.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Należy wziąć to pod uwagę podczas stosowania u kobiet ciężarnych lub karmiących piersią, dzieci i u osób z grup wysokiego ryzyka, takich jak pacjenci z chorobą wątroby lub z padaczką. Ketonal zawiera alkohol benzylowy. Każda dawka 2 ml zawiera 40 mg alkoholu benzylowego. Alkohol benzylowy może powodować reakcje alergiczne. Kobiety w ciąży lub karmiące piersią, a także pacjenci z chorobami wątroby lub nerek powinni skontaktować się z lekarzem przed zastosowaniem tego produktu leczniczego, gdyż duża ilość alkoholu benzylowego może gromadzić się w ich organizmie i powodować działania niepożądane (tzw. kwasicę metaboliczną). Lek zawiera 800 mg glikolu propylenowego w każdej ampułce 2 ml. Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ketoprofen wiąże się w dużym stopniu z białkami osocza. Może wypierać z miejsc wiążących inne stosowane jednocześnie leki, które wiążą się z białkami (np. leki przeciwzakrzepowe, sulfonamidy, hydantoinę). Może być konieczne dostosowanie dawek tych leków, aby uniknąć zwiększonego stężenia w osoczu. Leczenie skojarzone nie jest zalecane: Inne NLPZ (w tym selektywne inhibitory cyklooksygenazy-2) i duże dawki salicylanów - Zwiększone ryzyko owrzodzenia w obrębie przewodu pokarmowego i krwawienia. Leki przeciwzakrzepowe - Zwiększone ryzyko krwawienia heparyna antagoniści witaminy K (takie jak warfaryna) inhibitory agregacji płytek (takie jak tyklopidyna, klopidogrel) inhibitory trombiny (takie jak dabigatran) bezpośrednie inhibitory czynnika Xa (takie jak apiksaban, rywaroksaban, edoksaban) - Jeśli jednoczesne podawanie jest konieczne, należy uważnie kontrolować stan pacjenta.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlInterakcje
Lit - Ryzyko zwiększenia stężenia litu w osoczu, niekiedy do wartości toksycznych, na skutek zmniejszenia jego wydalania nerkowego. W razie konieczności należy uważnie kontrolować stężenie litu w osoczu i dostosowywać jego dawkę w trakcie i po zakończeniu leczenia NLPZ. Metotreksat w dawkach większych niż 15 mg/tydzień - Jednoczesne stosowanie metotreksatu (zwłaszcza w dużych dawkach) i NLPZ, w tym ketoprofenu, powodowało ciężkie, czasami zakończone zgonem zatrucie. Istnieje zwiększone ryzyko toksyczności hematologicznej metotreksatu, zwłaszcza stosowanego w dużych dawkach (>15 mg/tydzień), prawdopodobnie na skutek wypierania metotreksatu z miejsc wiążących z białkami i zmniejszonego klirensu nerkowego. Należy zachować co najmniej 12-godzinną przerwę między odstawieniem lub rozpoczęciem stosowania ketoprofenu a podaniem metotreksatu. Leczenie skojarzone wymagające ostrożności: Leki moczopędne - Ketoprofen zmniejsza działanie leków moczopędnych.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlInterakcje
Leki moczopędne mogą zwiększyć ryzyko nefrotoksycznego działania NLPZ. U pacjentów (zwłaszcza odwodnionych) otrzymujących leki moczopędne istnieje zwiększone ryzyko rozwoju niewydolności nerek wtórnej do zmniejszonej perfuzji w wyniku zahamowania syntezy prostaglandyn. Pacjentów takich należy nawodnić przed rozpoczęciem leczenia skojarzonego i na początku leczenia kontrolować u nich czynność nerek (patrz punkt 4.4). Inhibitory ACE i antagoniści angiotensyny II - U pacjentów z zaburzeniami czynności nerek (np. odwodnionych lub w podeszłym wieku) skojarzone stosowanie inhibitora ACE lub antagonisty angiotensyny II i leku hamującego aktywność cyklooksygenazy może spowodować dalsze pogorszenie czynności nerek, z możliwością wystąpienia ostrej niewydolności nerek. Metotreksat w dawkach mniejszych niż 15 mg/tydzień - W pierwszych tygodniach skojarzonego leczenia należy raz w tygodniu kontrolować pełną morfologię krwi.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlInterakcje
Badanie należy wykonywać częściej w razie stwierdzenia jakichkolwiek zmian czynności nerek lub jeśli pacjent jest w podeszłym wieku. Tenofowir - Jednoczesne stosowanie fumaranu tenofowiru dizoproksylu i NLPZ może zwiększyć ryzyko niewydolności nerek. Nikorandyl - Jednoczesne stosowanie nikorandylu i NLPZ może zwiększyć ryzyko poważnych powikłań, takich jak owrzodzenie przewodu pokarmowego, perforacja i krwotok (patrz punkt 4.4). Glikozydy naparstnicy - Nie wykazano interakcji farmakokinetycznej między ketoprofenem a digoksyną. Jednak zaleca się ostrożność, zwłaszcza u pacjentów z zaburzeniami czynności nerek, gdyż NLPZ mogą zmniejszać czynność nerek oraz klirens nerkowy glikozydów naparstnicy. Skojarzone leczenie do rozważenia: Leki przeciwnadciśnieniowe (beta-adrenolityki, inhibitory konwertazy angiotensyny, leki moczopędne) - Zmniejszenie skuteczności działania ketoprofenu (beta-adrenolityki).
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlInterakcje
Ryzyko słabszego działania przeciwnadciśnieniowego (hamowanie przez NLPZ prostaglandyn rozszerzających naczynia krwionośne). Leki trombolityczne - Zwiększone ryzyko krwawienia (w tym z przewodu pokarmowego). Selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI) - Zwiększone ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.4). Cyklosporyna, takrolimus - Ryzyko dodatkowego działania nefrotoksycznego, zwłaszcza u pacjentów w podeszłym wieku. Ryzyko związane z hiperkaliemią - Niektóre produkty lecznicze lub klasy leków mogą wywoływać hiperkaliemię, np. sole potasu, leki moczopędne oszczędzające potas, inhibitory konwertazy angiotensyny, inhibitory receptora angiotensyny II, NLPZ, heparyny (niskocząsteczkowe lub niefrakcjonowane), cyklosporyna, takrolimus i trimetoprym. Wystąpienie hiperkaliemii może zależeć od współistnienia innych czynników. Ryzyko jest większe, gdy wymienione wyżej leki podawane są jednocześnie.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlInterakcje
Ryzyko związane z działaniem przeciwpłytkowym - Niektóre substancje wchodzą w interakcje z ketoprofenem na skutek swojego działania przeciwpłytkowego: tyrofiban, eptifibatyd, abcyksymab i iloprost. Stosowanie niektórych leków przeciwpłytkowych zwiększa ryzyko krwawienia. Ketoprofen nasila działanie doustnych leków przeciwcukrzycowych i niektórych leków przeciwpadaczkowych (np. fenytoiny). Mifepryston: NLPZ mogą osłabić działanie mifeprystonu. Po podaniu mifeprystonu należy odczekać od 8 do 12 dni przed zastosowaniem ketoprofenu. Antybiotyki z grupy chinolonów: w przypadku jednoczesnego stosowania z NLPZ istnieje zwiększone ryzyko drgawek. Ketoprofen może zmniejszyć skuteczność domacicznych środków antykoncepcyjnych.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może mieć szkodliwy wpływ na przebieg ciąży i (lub) rozwój zarodka lub płodu. Dane z badań epidemiologicznych wskazują, że stosowanie inhibitora syntezy prostaglandyn we wczesnym okresie ciąży wiąże się ze zwiększonym ryzykiem poronienia i rozwoju wad rozwojowych serca oraz wytrzewienia jelit. Bezwzględne ryzyko wad dotyczących układu sercowo-naczyniowego zwiększyło się z mniej niż 1% do około 1,5%. Uważa się, że ryzyko zwiększa się wraz ze zwiększeniem dawki i wydłużeniem czasu leczenia. Wykazano, że u zwierząt podanie inhibitora syntezy prostaglandyn powoduje zwiększoną utratę przed- i poimplantacyjną zarodków oraz zwiększenie śmiertelności zarodków i płodów. Ponadto stwierdzono, że podawanie zwierzętom inhibitora syntezy prostaglandyn w okresie organogenezy zwiększa częstość rozwoju różnych wad rozwojowych, w tym dotyczących układu sercowo-naczyniowego. Od 20.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlWpływ na płodność, ciążę i laktację
tygodnia ciąży stosowanie ketoprofenu może powodować małowodzie wskutek zaburzeń czynności nerek płodu. Może ono wystąpić krótko po rozpoczęciu leczenia i jest zwykle odwracalne po jego przerwaniu. Ponadto, odnotowano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze, z których większość ustąpiła po zaprzestaniu leczenia. W pierwszym i drugim trymestrze ciąży nie należy podawać ketoprofenu, chyba że jest to bezwzględnie konieczne. Jeśli ketoprofen jest stosowany przez kobietę starającą się o ciążę lub podczas pierwszego i drugiego trymestru ciąży, zastosowana dawka powinna być jak najmniejsza, a czas trwania leczenia jak najkrótszy. Należy rozważyć przedporodowe monitorowanie w kierunku małowodzia i zwężenia przewodu tętniczego po ekspozycji na ketoprofen przez kilka dni od 20. tygodnia ciąży. W przypadku stwierdzenia małowodzia lub zwężenia przewodu należy zaprzestać stosowania ketoprofenu. Karmienie piersi?
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlWpływ na płodność, ciążę i laktację
Brak dostępnych danych dotyczących przenikania ketoprofenu do mleka kobiecego. Nie zaleca się stosowania produktu leczniczego u kobiet karmiących piersią. Płodność Stosowanie NLPZ, w tym ketoprofenu, może niekorzystnie wpływać na płodność u kobiet i nie jest ono zalecane u kobiet, które planują ciążę. U kobiet, które mają trudności z zajściem w ciążę lub które są poddawane badaniom w związku z niepłodnością, należy rozważyć zakończenie stosowania produktu Ketonal.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjentów należy ostrzec o wpływie niesteroidowych leków przeciwzapalnych na ośrodkowy układ nerwowy i możliwości wystąpienia zawrotów głowy, senności, drgawek i zaburzeń widzenia. Pacjenci, u których wystąpią opisane objawy, nie powinni prowadzić pojazdów i obsługiwać maszyn.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane mogą występować z następującą częstością: bardzo często (≥1/10) często (≥1/100 do <1/10) niezbyt często (≥1/1000 do <1/100) rzadko (≥1/10 000 do <1/1000) bardzo rzadko (<1/10 000) częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) Następujące działania niepożądane notowano podczas stosowania ketoprofenu u osób dorosłych: Zaburzenia krwi i układu chłonnego Niezbyt często: niedokrwistość, hemoliza, plamica Rzadko: niedokrwistość pokrwotoczna Częstość nieznana: agranulocytoza, małopłytkowość, niedokrwistość hemolityczna, leukopenia Ketoprofen w dużych dawkach może hamować agregację płytek krwi, wydłużając w ten sposób czas krwawienia oraz powodować krwawienie z nosa i skłonność do powstawania siniaków. Zaburzenia układu immunologicznego Niezbyt często: skórne reakcje alergiczne (patrz „Zaburzenia skóry i tkanki podskórnej”).
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlDziałania niepożądane
Częstość nieznana: reakcje anafilaktyczne (w tym wstrząs) Reaktywność dróg oddechowych obejmuje astmę, nasilenie astmy, skurcz oskrzeli lub duszność (zwłaszcza u pacjentów z nadwrażliwością na kwas acetylosalicylowy i niesteroidowe leki przeciwzapalne). Zaburzenia metabolizmu i odżywiania Częstość nieznana: hiponatremia, hiperkaliemia (patrz punkty 4.4 i 4.5) Zaburzenia psychiczne Często: depresja, nerwowość, koszmary senne, senność. Rzadko: majaczenie z omamami wzrokowymi i słuchowymi, zaburzenia orientacji i zaburzenia mowy Częstość nieznana: splątanie, zmiany nastroju Zaburzenia układu nerwowego Często: astenia, złe samopoczucie, uczucie zmęczenia, osłabienie, parestezje Niezbyt często: ból głowy, zawroty głowy pochodzenia ośrodkowego, senność Bardzo rzadko: zgłoszono jeden przypadek rzekomego guza mózgu Częstość nieznana: jałowe zapalenie opon mózgowych, drgawki, zawroty głowy pochodzenia obwodowego Zaburzenia oka Rzadko: zaburzenia widzenia (patrz punkt 4.4) Bardzo rzadko: opisano jeden przypadek zapalenia spojówek Zaburzenia ucha i błędnika Rzadko: szumy uszne Zaburzenia serca Często: obrzęki Częstość nieznana: niewydolność serca Zaburzenia naczyniowe Częstość nieznana: nadciśnienie tętnicze, zapalenie naczyń krwionośnych (w tym leukoklastyczne zapalenie naczyń) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Niezbyt często: krwioplucie, duszność, zapalenie gardła lub obrzęk krtani (objawy reakcji anafilaktycznej) Rzadko: astma oskrzelowa Częstość nieznana: skurcz oskrzeli (zwłaszcza u pacjentów z nadwrażliwością na kwas acetylosalicylowy i inne NLPZ), zapalenie błony śluzowej nosa Zaburzenia żołądka i jelit Najczęściej obserwowane działania niepożądane dotyczą przewodu pokarmowego.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlDziałania niepożądane
Często: nudności, jadłowstręt, wymioty Niezbyt często: zaparcie, biegunka, zapalenie błony śluzowej żołądka Rzadko: zapalenie błony śluzowej jamy ustnej, wrzód żołądka i (lub) dwunastnicy, zapalenie okrężnicy Bardzo rzadko: nawrót wrzodziejącego zapalenia okrężnicy lub choroby Leśniowskiego-Crohna, enteropatia z perforacją, owrzodzeniem lub zwężeniami. Enteropatia może występować z niewielkim krwawieniem lub utratą białka. Opisano jeden przypadek perforacji okrężnicy u kobiety w podeszłym wieku. Częstość nieznana: krwawienie z przewodu pokarmowego i perforacja (niekiedy zakończone zgonem), zapalenie trzustki Notowano również przypadki uczucia dyskomfortu żołądkowo-jelitowego i bólu żołądka. Owrzodzenie, krwawienie lub perforacja może wystąpić u 1% pacjentów po upływie 3 do 6 miesięcy leczenia lub u 2% do 4% pacjentów po roku stosowania NLPZ.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlDziałania niepożądane
Zaburzenia wątroby i dróg żółciowych Rzadko: zapalenie wątroby, zwiększenie aktywności aminotransferaz, zwiększenie stężenia bilirubiny w surowicy na skutek zapalenia wątroby Zaburzenia skóry i tkanki podskórnej Niezbyt często: wysypka, łysienie, świąd, wyprysk, wysypka plamicopodobna, nadmierne pocenie się, złuszczające zapalenie skóry Częstość nieznana: nadwrażliwość na światło, łysienie, pokrzywka, zaostrzenie przewlekłej pokrzywki, obrzęk naczynioruchowy, reakcje pęcherzowe, w tym zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka, ostra uogólniona osutka krostkowa Zaburzenia nerek i dróg moczowych Bardzo rzadko: ostre odmiedniczkowe zapalenie nerek Częstość nieznana: ostra niewydolność nerek, cewkowo-śródmiąższowe zapalenie nerek, zespół nerczycowy Notowano również zatrzymanie wody/sodu z możliwością obrzęku i hiperkaliemii (patrz punkty 4.4 i 4.5), a także organiczne uszkodzenie nerek, które mogło prowadzić do ostrej niewydolności nerek, pojedyncze przypadki ostrej martwicy kanalików nerkowych i martwicy brodawek nerkowych.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlDziałania niepożądane
Zaburzenia układu rozrodczego i piersi Niezbyt często: krwotok miesiączkowy lub obfite nieregularne miesiączkowanie Badania diagnostyczne Bardzo często: zwiększenie wyników testów czynnościowych wątroby do wartości granicznych Niezbyt często: znaczne zwiększenie aktywności aminotransferaz (AspAT i AlAT). Ketoprofen zmniejsza agregację płytek krwi i powoduje w ten sposób wydłużenie czasu krwawienia. Zaburzenia ogólne i stany w miejscu podania Niezbyt często: obrzęk, uczucie zmęczenia. W miejscu podania może wystąpić uczucie pieczenia i (lub) ból. Częstość nieznana: ból i odczucie pieczenia w miejscu wstrzyknięcia, marmurkowatość skóry (livedoid dermatitis, zespół Nicolaua) Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale w dużych dawkach) może być związane ze zwiększeniem ryzyka zatorów tętnic, np. zawału serca lub udaru (patrz punkt 4.4).
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlPrzedawkowanie
4.9 Przedawkowanie U osób dorosłych głównymi objawami przedawkowania są ból głowy, zawroty głowy, senność, nudności, wymioty, biegunka i ból brzucha. W przypadku ciężkiego zatrucia pacjenta należy natychmiast przetransportować na wyspecjalizowany oddział szpitalny w celu leczenia objawowego. Nie ma specyficznej odtrutki.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu propionowego. Kod ATC: M01AE03 Mechanizm działania Ketoprofen jest niesteroidowym lekiem przeciwreumatycznym o działaniu przeciwzapalnym, przeciwbólowym i przeciwgorączkowym. Wykazano, że hamuje on syntezę prostaglandyn i leukotrienów poprzez blokowanie enzymu cyklooksygenazy (co najmniej dwóch jej izoenzymów: cyklooksygenazy-1 COX 1 oraz cyklooksygenazy-2 COX 2), która katalizuje syntezę prostaglandyn i metabolizm kwasu arachidonowego. Ketoprofen stabilizuje in vitro i in vivo błony lizosomalne, w dużych stężeniach hamuje syntezę leukotrienów oraz hamuje aktywność bradykinin. Nieznany jest mechanizm przeciwgorączkowego działania ketoprofenu. Prawdopodobnie hamuje syntezę prostaglandyn w ośrodkowym układzie nerwowym (najpewniej w podwzgórzu).
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlWłaściwości farmakodynamiczne
U niektórych kobiet ketoprofen łagodzi objawy samoistnego bolesnego miesiączkowania, prawdopodobnie na skutek zahamowania syntezy prostaglandyn i (lub) ich aktywności.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Średnie stężenie ketoprofenu w osoczu po upływie 5 minut od wlewu dożylnego i 4 minut po zakończeniu podawania wynosi 26,4 ± 5,4 mikrogramów/ml. Biodostępność wynosi 90%. Dystrybucja Ketoprofen wiąże się w 99% z białkami osocza, głównie z albuminą. Objętość dystrybucji tkankowej wynosi od 0,1 do 0,2 l/kg. Ketoprofen przenika do płynu maziowego. Po 3 godzinach od podania ketoprofenu w dawce 100 mg jego stężenie w osoczu wynosi około 3 µg/ml, a w płynie stawowym 1,5 µg/ml. Po 9 godzinach stężenia te wynoszą, odpowiednio, 0,3 µg/ml i 0,8 µg/ml. Oznacza to, że ketoprofen powoli przenika do płynu maziowego i powoli jest z niego usuwany, podczas gdy jego stężenie w osoczu zmniejsza się w dalszym ciągu. Stężenia ketoprofenu w stanie równowagi uzyskuje się po 24 godzinach od podania. U pacjentów w podeszłym wieku stężenie w stanie równowagi (6,3 µg/ml) osiągane było po upływie 8,7 godziny.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlWłaściwości farmakokinetyczne
Po 15 minutach od domięśniowego podania ketoprofenu w pojedynczej dawce 100 mg lek wykrywano w surowicy i płynie mózgowo-rdzeniowym. Ketoprofen osiągał największe stężenie w osoczu (1,3 µg/ml) w ciągu 2 godzin po podaniu. Metabolizm i eliminacja Ketoprofen jest intensywnie metabolizowany przez wątrobowe enzymy mikrosomalne. Wiąże się z kwasem glukuronowym i usuwany jest z organizmu w postaci sprzężonej. Po podaniu doustnym klirens osoczowy ketoprofenu wynosi 1,16 ml/minutę/kg. Ze względu na szybki metabolizm, okres półtrwania wynosi zaledwie 2 godziny. Do 80% dawki ketoprofenu wydala się w moczu, głównie (ponad 90%) w postaci glukuronidu ketoprofenu. Około 10 % wydalane jest z kałem. U pacjentów z niewydolnością nerek ketoprofen wydalany jest wolniej, a jego okres półtrwania jest wydłużony o 1 godzinę. U pacjentów z niewydolnością wątroby ketoprofen może gromadzić się w tkankach.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Toksyczność po podaniu jednorazowym Wartość LD₅₀ dla ketoprofenu po podaniu doustnym wynosi u myszy 360 mg/kg mc., u szczurów 160 mg/kg mc., a u świnek morskich 1300 mg/kg mc. Wartość LD₅₀ dla ketoprofenu jest wielokrotnie większa niż dla indometacyny. Toksyczność po podaniu wielokrotnym Ketoprofen w dawce 2 mg/kg mc., 6 mg/kg mc. lub 18 mg/kg mc. podawano doustnie szczurom przez 4 tygodnie. Spośród zwierząt, którym podawano ketoprofen w dawce 18 mg/kg mc. 10% padło lub zostało uśmierconych ze względów etycznych pomiędzy 6. a 30. dniem badania. U niektórych szczurów wystąpiło owrzodzenie żołądka. U psów, które otrzymywały ketoprofen w tej dawce, obserwowano jedynie wystąpienie owrzodzenia żołądka, ale wszystkie zwierzęta przeżyły. Zastosowanie indometacyny w dawce 6 mg/kg mc. spowodowało, że 50% zwierząt padło lub zostało uśmierconych, a po dawce 18 mg/kg mc. padły lub zostały uśmiercone wszystkie zwierzęta.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlPrzedkliniczne dane o bezpieczeństwie
W trwającym 6 miesięcy badaniu szczurom podawano ketoprofen w dawce 3 mg/kg mc., 6 mg/kg mc. lub 9 mg/kg mc. Po 8 tygodniach padło lub zostało uśmierconych 53% samców szczurów otrzymujących dawkę 6 mg/kg mc. oraz 67% samców i 20% samic szczurów otrzymujących dawkę 9 mg/kg mc. U zwierząt otrzymujących dawkę 9 mg/kg mc. zmniejszyło się stężenie białka w osoczu, stwierdzono również zwiększenie masy śledziony i wątroby. Nie odnotowano istotnych zmian w badaniu histopatologicznym tkanek zwierząt, które przeżyły eksperyment. Rakotwórczość, genotoksyczność, toksyczny wpływ na reprodukcję Badania toksyczności po wielokrotnym podaniu doustnym u myszy (do 32 mg/kg mc. na dobę) nie wykazały rakotwórczego działania ketoprofenu. Ketoprofen nie wykazywał działania mutagennego w teście Amesa. Podawanie ketoprofenu samcom szczurów (dawki do 9 mg/kg mc. na dobę) nie miało istotnego wpływu na zdolność reprodukcji. U samic szczurów, którym podawano 6 mg/kg mc. do 9 mg/kg mc.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlPrzedkliniczne dane o bezpieczeństwie
na dobę stwierdzano zmniejszenie liczby miejsc implantacji. U samców szczurów i psów nastąpiło zahamowanie spermatogenezy. U psów i samców małp podanie ketoprofenu w dużych dawkach spowodowało zmniejszenie masy jąder. Teratogeność U myszy, którym podawano ketoprofen w dawce do 12 mg/kg mc. na dobę oraz u szczurów otrzymujących dawkę do 9 mg/kg mc. na dobę nie obserwowano działania teratogennego lub szkodliwego działania na płód. U samic królików ketoprofen w dawkach toksycznych uszkadzających płód nie wykazywał działania teratogennego.
- CHPL leku Ketonal, roztwór do wstrzykiwań, 50 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Glikol propylenowy Etanol Alkohol benzylowy Sodu wodorotlenek Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie wolno łączyć w tej samej butelce roztworu ketoprofenu i tramadolu ze względu na wytrącanie się osadu. 6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Ampułki ze szkła oranżowego w tekturowym pudełku, zawierające 2 ml roztworu. Wielkość opakowań: 5, 10, 50 ampułek. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych zaleceń.
- CHPL leku Profenid, czopki, 100 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Profenid, 100 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera: 100 mg ketoprofenu (Ketoprofenum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Czopki
- CHPL leku Profenid, czopki, 100 mgWskazania do stosowania
4.1 Wskazania do stosowania Objawowe leczenie chorób reumatycznych, w tym: reumatoidalnego zapalenia stawów, choroby zwyrodnieniowej stawów. Objawowe leczenie ostrych stanów zapalnych narządu ruchu (zapalenie ścięgna, urazy). Bóle kostno- mięśniowe o nasileniu niewielkim do umiarkowanego, niezależnie od pochodzenia.
- CHPL leku Profenid, czopki, 100 mgDawkowanie
4.2 Dawkowanie i sposób podawania Maksymalna dawka dobowa wynosi 200 mg. Należy dokładnie rozważyć bilans korzyści do ryzyka przed rozpoczęciem leczenia dawką 200 mg. Stosowanie większych dawek nie jest zalecane (patrz punkt 4.4). Dawkowanie: w objawowym długotrwałym leczeniu: 1 do 2 czopków na dobę, tj. 100 do 200 mg na dobę; w objawowym krótkotrwałym leczeniu ostrych stanów: 2 czopki na dobę, tj. 200 mg na dobę. Należy stosować najmniejszą skuteczną dawkę przez najkrótszy okres konieczny do złagodzenia objawów (patrz punkt 4.4). Szczególne grupy pacjentów: pacjenci z niewydolnością nerek i osoby w podeszłym wieku: zaleca się zmniejszenie dawki początkowej oraz stosowanie najmniejszych dawek skutecznych (patrz punkt 5.2); pacjenci odwodnieni (patrz punkty 4.4 i 4.5); pacjenci z niewydolnością wątroby: pacjentów takich należy monitorować oraz stosować możliwie najmniejsze dawki skuteczne (patrz punkty 4.4 i 5.2); dzieci: nie ustalono bezpieczeństwa stosowania ketoprofenu u dzieci.
- CHPL leku Profenid, czopki, 100 mgPrzeciwwskazania
4.3 Przeciwwskazania Ketoprofen jest przeciwwskazany w następujących przypadkach: rozpoznana nadwrażliwość na ketoprofen lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, astma aspirynowa lub inne reakcje nadwrażliwości występujące po niesteroidowych lekach przeciwzapalnych (NLPZ). U tych pacjentów, u których występowały w wywiadzie reakcje nadwrażliwości takie jak: skurcz oskrzeli, ataki astmy, nieżyt nosa, pokrzywka lub inne reakcje typu alergicznego obserwowano ciężkie, rzadko prowadzące do zgonu reakcje anafilaktyczne (patrz punkt 4.8); czynna choroba wrzodowa żołądka i dwunastnicy, lub w wywiadzie krwawienia z żołądka i jelit, owrzodzenia lub perforacje; ciężka niewydolność wątroby lub nerek; ciężka niewydolność serca; skaza krwotoczna; III trymestr ciąży. Czopki są przeciwwskazane u osób z zapaleniem odbytu lub krwawieniem z odbytu w wywiadzie.
- CHPL leku Profenid, czopki, 100 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania U pacjentów z astmą oskrzelową oraz przewlekłym nieżytem nosa, przewlekłym zapaleniem zatok i (lub) polipami nosa występuje zwiększone ryzyko alergii na kwas acetylosalicylowy i inne niesteroidowe leki przeciwzapalne. Podanie ketoprofenu u tych pacjentów może wywołać napad astmy, skurcz oskrzeli, szczególnie u osób z nadwrażliwością na kwas acetylosalicylowy lub NLPZ (patrz punkt 4.3). Należy zachować ostrożność u pacjentów przyjmujących jednocześnie leki, które mogą zwiększać ryzyko owrzodzenia lub krwawienia, takie jak: doustne kortykosteroidy, antykoagulanty takie jak warfaryna, selektywne inhibitory wychwytu zwrotnego serotoniny, leki przeciwpłytkowe (takie jak aspiryna) i nikorandyl (patrz punkt 4.5). Należy unikać jednoczesnego stosowania ketoprofenu i innych NLPZ, włączając selektywne inhibitory cyklooksygenazy typu – 2 (COX-2).
- CHPL leku Profenid, czopki, 100 mgSpecjalne środki ostrozności
Niektóre dane epidemiologiczne sugerują, że stosowanie ketoprofenu, zwłaszcza w dużych dawkach, może być związane z wyższym ryzykiem wystąpienia poważnej toksyczności żołądkowo-jelitowej, w porównaniu do pozostałych NLPZ (patrz również punkt 4.3). Ryzyko krwawienia do przewodu pokarmowego, owrzodzeń i perforacji wzrasta z dawką ketoprofenu lub innego leku z grupy NLPZ, stosowaną u pacjentów z chorobą wrzodową w wywiadzie, szczególnie powikłaną krwawieniem i perforacją przewodu pokarmowego (patrz punkt 4.3), a także u osób w podeszłym wieku. W opisanych grupach pacjentów leczenie należy rozpocząć od możliwie najniższej dawki. W tej populacji, a także u pacjentów wymagających leczenia małymi dawkami kwasu acetylosalicylowego, lub innymi lekami mogącymi zwiększać ryzyko działań niepożądanych ze strony przewodu pokarmowego, należy również rozważyć stosowanie leków osłaniających błonę śluzową (np. mizoprostol lub inhibitory pompy protonowej) (patrz poniżej i punkt 4.5).
- CHPL leku Profenid, czopki, 100 mgSpecjalne środki ostrozności
Pacjenci z ciężkimi schorzeniami przewodu pokarmowego w wywiadzie, szczególnie osoby w podeszłym wieku, powinny poinformować o wszystkich nietypowych objawach ze strony jamy brzusznej (zwłaszcza krwawienie do przewodu pokarmowego), szczególnie w początkowym okresie leczenia. Stosowanie ketoprofenu lub innego leku z grupy NLPZ, może być przyczyną krwawienia z przewodu pokarmowego, owrzodzenia przewodu pokarmowego lub perforacji (u niektórych pacjentów ze skutkiem śmiertelnym), które mogą wystąpić podczas przyjmowania ketoprofenu w dowolnym momencie leczenia, nawet bez objawów zwiastunowych. Należy zachować ostrożność, stosując ketoprofen u pacjentów, u których w wywiadzie występowały zaburzenia żołądkowo-jelitowe. Prawdopodobieństwo wystąpienia działań niepożądanych związanych ze stosowaniem któregokolwiek z leków z grupy NLPZ, zwłaszcza krwawienia z przewodu pokarmowego lub perforacji, niekiedy ze skutkiem śmiertelnym zwiększa się u pacjentów w podeszłym wieku, którzy są bardziej podatni, pacjentów o małej masie ciała, a także u pacjentów z zaburzeniami czynności płytek krwi lub przyjmujących leki przeciwzakrzepowe lub leki antyagregacyjne (patrz punkt 4.5).
- CHPL leku Profenid, czopki, 100 mgSpecjalne środki ostrozności
Jeśli wystąpią objawy krwawienia lub owrzodzenia przewodu pokarmowego, produkt leczniczy należy natychmiast odstawić. Ketoprofen lub inne leki z grupy NLPZ, należy stosować ostrożnie u pacjentów z zaburzeniami żołądka i jelit w wywiadzie i poddać tych pacjentów szczególnej obserwacji w przypadku takich chorób jak: zapalenie błony śluzowej żołądka i (lub) dwunastnicy, wrzodziejące zapalenie okrężnicy i choroba Crohna ze względu na możliwość nasilenia choroby (patrz punkt 4.8). Bardzo rzadko donoszono o występowaniu ciężkich reakcji skórnych, czasami śmiertelnych, w tym złuszczającego zapalenia skóry, zespołu Stevensa-Johnsona lub toksycznego martwiczego oddzielania się naskórka podczas stosowania NLPZ (patrz punkt 4.8). Największe ryzyko wystąpienia tych zaburzeń występuje na początku leczenia. W większości przypadków te reakcje skórne występują podczas pierwszego miesiąca leczenia.
- CHPL leku Profenid, czopki, 100 mgSpecjalne środki ostrozności
Należy zaprzestać stosowania produktu Profenid w przypadku pojawienia się wysypki skórnej, uszkodzenia błon śluzowych, lub innych objawów nadwrażliwości. Może wystąpić hiperkaliemia, zwłaszcza u pacjentów z cukrzycą, niewydolnością nerek i (lub) leczonych jednocześnie lekami zwiększającymi stężenie potasu we krwi (patrz punkt 4.5). Należy monitorować stężenie potasu w tych przypadkach. Pacjentów z reakcjami nadwrażliwości na światło słoneczne lub fototoksycznością w wywiadzie, należy dokładnie obserwować podczas podawania ketoprofenu. U pacjentów z niewydolnością serca, marskością wątroby, zespołem nerczycowym, przewlekłymi zaburzeniami czynności nerek oraz zaburzeniami gospodarki wodnej (np. odwodnienie w wyniku stosowania leków moczopędnych, hipowolemia po zabiegu chirurgicznym lub z innych przyczyn) ketoprofen, może zmniejszać przepływ nerkowy poprzez hamowanie syntezy prostaglandyn, prowadząc do wystąpienia zaburzeń czynności nerek, zwłaszcza u pacjentów w podeszłym wieku.
- CHPL leku Profenid, czopki, 100 mgSpecjalne środki ostrozności
W początkowym okresie leczenia u tych pacjentów niezbędne jest szczegółowe monitorowanie wielkości diurezy oraz innych wskaźników czynności nerek. Zaburzenie czynności nerek może prowadzić do obrzęków i zwiększenia stężenia azotu pozabiałkowego w surowicy. U pacjentów z zaburzeniami czynności wątroby lub z chorobą wątroby w wywiadzie konieczna jest dokładna obserwacja (należy okresowo oznaczać aktywność aminotransferaz, szczególnie podczas długotrwałej terapii) i indywidualne dostosowanie dawki produktu leczniczego. Podczas długotrwałego stosowania ketoprofenu należy wykonywać badania wskaźników morfologii krwi oraz kontrolować wskaźniki czynności wątroby oraz nerek. Odnotowano bardzo rzadkie przypadki żółtaczki i zapalenia wątroby podczas leczenia ketoprofenem. W przypadku wystąpienia zaburzeń widzenia należy przerwać stosowanie produktu leczniczego. Nie ustalono bezpieczeństwa stosowania ketoprofenu u dzieci. Nie zaleca się stosowania produktu leczniczego poniżej 15 lat.
- CHPL leku Profenid, czopki, 100 mgSpecjalne środki ostrozności
U pacjentek przyjmujących przewlekle ketoprofen opisano przypadki wtórnej niepłodności bez jajeczkowania (wskutek braku pęknięcia pęcherzyka Graafa). Stosowanie ketoprofenu lub innego leku z grupy NLPZ, może niekorzystnie wpływać na płodność u kobiet i nie jest ono zalecane u kobiet, które planują zajście w ciążę. W przypadku kobiet, które mają trudności z zajściem w ciążę lub które są poddawane badaniom w związku z niepłodnością, należy rozważyć zakończenie stosowania ketoprofenu lub innego leku z grupy NLPZ. Należy stosować najmniejszą skuteczną dawkę przez najkrótszy okres konieczny do złagodzenia objawów (patrz punkt 4.2).
- CHPL leku Profenid, czopki, 100 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie zaleca się jednoczesnego stosowania ketoprofenu z następującymi lekami: innymi niesteroidowymi lekami przeciwzapalnymi (w tym selektywnymi inhibitorami cyklooksygenazy 2 – COX-2) i salicylanami w dużych dawkach Jednoczesne stosowanie prowadzi do zwiększenia działań niepożądanych (zwłaszcza ryzyka powstania owrzodzenia przewodu pokarmowego oraz krwawienia z przewodu pokarmowego). lekami przeciwzakrzepowymi: heparyn? antagonistami witaminy K (np.: warfaryna) lekami przeciwagregacyjnymi (np.: tiklopidyna, klopidogrel) inhibitorami trombiny (np.: dabigatran) bezpośrednimi inhibitorami czynnika Xa (np.: apiksaban, rywaroksaban, edoksaban) Ketoprofen hamuje agregację płytek krwi oraz podrażnia błonę śluzową żołądka, prowadząc do zwiększonego ryzyka krwawienia, zwłaszcza z przewodu pokarmowego (patrz punkt 4.4). Nie zaleca się stosowania wymienionych leków jednocześnie z ketoprofenem.
- CHPL leku Profenid, czopki, 100 mgInterakcje
Jeśli jednoczesne stosowanie tych leków jest niezbędne, należy uważnie obserwować objawy kliniczne u pacjenta oraz wykonywać okresowe kontrole wskaźników badań laboratoryjnych. Nie należy stosować terapii z NLPZ dłużej niż kilka dni. litem Podobnie do innych NLPZ, ketoprofen hamuje wydalanie litu i może zwiększać jego stężenie w osoczu nawet do wartości toksycznych. Nie zaleca się jednoczesnego stosowania ketoprofenu z solami litu. Jeśli postępowanie takie jest konieczne, należy ściśle monitorować stężenia litu w surowicy i odpowiednio modyfikować jego dawki w trakcie leczenia NLPZ oraz po zakończeniu leczenia NLPZ. metotreksatem (w dawkach większych niż 15 mg/tydzień) Jednoczesne stosowanie metotreksatu w dużych dawkach (większych niż 15 mg/tydzień) powoduje zwiększone prawdopodobieństwo toksyczności hematologicznej, które związane jest ze zwiększaniem stężenia metotreksatu w surowicy, wskutek wypierania go przez ketoprofen z połączeń z białkami osocza i zmniejszeniem jego klirensu nerkowego oraz przedłużaniem okresu półtrwania metotreksatu.
- CHPL leku Profenid, czopki, 100 mgInterakcje
Należy zachować środki ostrożności podczas jednoczesnego stosowania z następującymi lekami: lekami zwiększającymi stężenie potasu we krwi Produkty lecznicze i kategorie terapeutyczne, które mogą zwiększać stężenie potasu we krwi (tj. sole potasu, leki moczopędne oszczędzające potas, inhibitory konwertazy angiotensyny oraz leki blokujące receptory angiotensyny II, inne NLPZ, heparyny (o małej masie cząsteczkowej lub niefrakcjonowana), cyklosporyna, takrolimus i trimetoprym): Ryzyko hiperkaliemii może być zwiększone, gdy leki wymienione powyżej są podawane jednocześnie z ketoprofenem (patrz punkt 4.4). lekami moczopędnymi U pacjentów otrzymujących leki moczopędne, a szczególnie u pacjentów odwodnionych, jednoczesne stosowanie ketoprofenu może prowadzić do zmniejszenia przepływu nerkowego (wskutek hamowania syntezy prostaglandyn) i do wystąpienia niewydolności nerek.
- CHPL leku Profenid, czopki, 100 mgInterakcje
Tacy pacjenci powinni przed rozpoczęciem leczenia skojarzonego zostać nawodnieni; po rozpoczęciu leczenia należy także pamiętać o kontrolowaniu czynności nerek (patrz punkt 4.4). inhibitorami konwertazy angiotensyny oraz lekami blokującymi receptory angiotensyny II U pacjentów z zaburzoną czynnością nerek (np. u pacjentów odwodnionych lub pacjentów w podeszłym wieku) jednoczesne stosowanie inhibitorów konwertazy angiotensyny lub leków blokujących receptory angiotensyny II wraz z inhibitorami cyklooksygenazy może powodować dalsze pogorszenie czynności nerek, w tym prowadzące do możliwej ostrej niewydolności nerek. metotreksatem (w dawkach mniejszych niż 15 mg/tydzień) Podczas pierwszych tygodni jednoczesnego stosowania ketoprofenu i metotreksatu w dawkach mniejszych niż 15 mg/tydzień należy wykonywać pełne badanie wskaźników morfologii krwi co tydzień.
- CHPL leku Profenid, czopki, 100 mgInterakcje
U pacjentów z zaburzeniami czynności nerek oraz pacjentów w podeszłym wieku pełne badanie wskaźników morfologii krwi należy wykonywać częściej. kortykosteroidami Zwiększenie ryzyka wystąpienia owrzodzenia w przewodzie pokarmowym i krwawienia (patrz punkt 4.4). pentoksyfillin? Podczas jednoczesnego stosowania z ketoprofenem występuje zwiększone ryzyko krwawienia. Należy częściej obserwować pacjenta i monitorować czas krwawienia. tenofowirem Podczas jednoczesnego stosowania fumaranu dizoproksylu tenofowiru z ketoprofenem występuje zwiększone ryzyko niewydolności nerek. nikorandylem U pacjentów przyjmujących jednocześnie nikorandyl oraz leki z grupy NLPZ, istnieje zwiększone ryzyko wystąpienia ciężkich powikłań, takich jak owrzodzenie, perforacja i krwawienie z przewodu pokarmowego (patrz punkt 4.4). glikozydami nasercowymi Niesteroidowe leki przeciwzapalne mogą nasilać niewydolność serca i powodować zwiększenie stężenia glikozydów nasercowych we krwi.
- CHPL leku Profenid, czopki, 100 mgInterakcje
Zalecana jest ostrożność, zwłaszcza u pacjentów z zaburzeniami czynności nerek, z uwagi na fakt, że leki z grupy NLPZ mogą zaburzać czynność nerek oraz zmniejszać klirens nerkowy glikozydów nasercowych. cyklosporyn? Zwiększone prawdopodobieństwo działania nefrotoksycznego, zwłaszcza u pacjentów w podeszłym wieku. takrolimusem Zwiększone prawdopodobieństwo działania nefrotoksycznego, zwłaszcza u pacjentów w podeszłym wieku. antybiotykami z grupy chinolonów U pacjentów stosujących jednocześnie niesteroidowe leki przeciwzapalne i antybiotyk z grupy chinolonów jest zwiększone ryzyko wystąpienia drgawek. Należy zwrócić szczególną uwagę na stosowanie ketoprofenu jednocześnie z: lekami przeciwnadciśnieniowymi (lekami blokującymi receptory β-adrenergiczne, inhibitorami enzymu konwertującego angiotensynę, lekami moczopędnymi) - ryzyko zmniejszenia skuteczności tych leków (wskutek hamowania syntezy prostaglandyn rozszerzających naczynia przez leki z grupy NLPZ); lekami trombolitycznymi – zwiększone ryzyko krwawienia; probenecydem – jednoczesne stosowanie z ketoprofenem może znacznie zmniejszyć klirens osoczowy ketoprofenu; inhibitorami zwrotnego wychwytu serotoniny (SSRI) - zwiększone ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.4).
- CHPL leku Profenid, czopki, 100 mgInterakcje
Ketoprofen może zmniejszyć skuteczność domacicznych środków antykoncepcyjnych. 4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może mieć szkodliwy wpływ na przebieg ciąży i (lub) rozwój zarodka lub płodu. Dane z badań epidemiologicznych wskazują, że stosowanie inhibitora syntezy prostaglandyn we wczesnym okresie ciąży wiąże się ze zwiększonym ryzykiem poronienia i rozwoju wad rozwojowych serca oraz wytrzewienia jelit. Bezwzględne ryzyko wad dotyczących układu sercowo-naczyniowego zwiększyło się z mniej niż 1% do około 1,5%. Uważa się, że ryzyko zwiększa się wraz ze zwiększeniem dawki i wydłużeniem czasu leczenia. Wykazano, że u zwierząt podanie inhibitora syntezy prostaglandyn powoduje zwiększoną utratę przed- i poimplantacyjną zarodków oraz zwiększenie śmiertelności zarodków i płodów.
- CHPL leku Profenid, czopki, 100 mgInterakcje
Ponadto stwierdzono, że podawanie zwierzętom inhibitora syntezy prostaglandyn w okresie organogenezy zwiększa częstość rozwoju różnych wad rozwojowych, w tym dotyczących układu sercowo-naczyniowego. Od 20. tygodnia ciąży stosowanie ketoprofenu może powodować małowodzie wynikające z zaburzeń czynności nerek płodu. Może to wystąpić wkrótce po rozpoczęciu leczenia i zwykle ustępuje po odstawieniu leku. Ponadto odnotowano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze ciąży, z których większość ustąpiła po przerwaniu leczenia. W związku z tym ketoprofenu nie należy stosować w I i II trymestrze ciąży, jeśli nie jest to bezwzględnie konieczne. Jeśli ketoprofen stosowany jest u kobiet starających się zajść w ciążę lub u kobiet w pierwszym i drugim trymestrze ciąży, lek należy podawać w możliwie najmniejszej dawce przez możliwie najkrótszy czas. W przypadku stosowania ketoprofenu przez kilka dni w okresie od 20.
- CHPL leku Profenid, czopki, 100 mgInterakcje
tygodnia ciąży należy rozważyć monitorowanie przedporodowe pod kątem małowodzia i zwężenia przewodu tętniczego. Należy przerwać stosowanie ketoprofenu w przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego. Wszystkie inhibitory syntezy prostaglandyn: stosowane w III trymestrze ciąży mogą narazić płód na: toksyczne działanie na układ krążenia i oddechowy (przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne); zaburzenia czynności nerek (patrz powyżej); przyjmowane pod koniec ciąży mogą narazić matkę i noworodka na: wydłużenie czasu krwawienia, działanie przeciwagregacyjne, które może wystąpić nawet po zastosowaniu małych dawek ketoprofenu; zahamowanie skurczów macicy, które prowadzi do opóźnienia lub przedłużenia porodu. Z tego względu stosowanie ketoprofenu w III trymestrze ciąży jest przeciwwskazane (patrz punkt 4.3 oraz 5.3). Karmienie piersi? Brak danych dotyczących wydzielania ketoprofenu do mleka matki.
- CHPL leku Profenid, czopki, 100 mgInterakcje
Nie zaleca się stosowania ketoprofenu u kobiet karmiących piersią. Płodność Patrz punkt 4.4 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Należy ostrzec pacjenta o możliwości wystąpienia zawrotów głowy, senności oraz drgawek. Należy zalecić pacjentowi, że jeśli wystąpi którekolwiek z tych zaburzeń, aby nie prowadził pojazdów ani obsługiwał maszyn. 4.8 Działania niepożądane Następujące działania niepożądane są wymienione na podstawie klasyfikacji układów i narządów i przy użyciu następującej konwencji: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego: rzadko: niedokrwistość spowodowana krwotokiem lub krwawieniem. częstość nieznana: agranulocytoza, trombocytopenia, zahamowanie czynności szpiku, niedokrwistość hemolityczna, leukopenia.
- CHPL leku Profenid, czopki, 100 mgInterakcje
Zaburzenia układu immunologicznego: częstość nieznana: reakcje anafilaktyczne (w tym wstrząs anafilaktyczny). Zaburzenia psychiczne: częstość nieznana: depresja, omamy, stan splątania, zaburzenia nastroju. Zaburzenia układu nerwowego: niezbyt często: bóle i zawroty głowy pochodzenia ośrodkowego, senność. rzadko: parestezje. częstość nieznana: zapalenie opon mózgowych jałowe, drgawki, zaburzenia smaku, zawroty głowy pochodzenia obwodowego. Zaburzenia oka: rzadko: zaburzenia widzenia (niewyraźne widzenie) (patrz punkt 4.4). Zaburzenia ucha i błędnika: rzadko: szumy uszne. Zaburzenia serca: częstość nieznana: niewydolność serca, migotanie przedsionków. Zaburzenia naczyniowe: częstość nieznana: nadciśnienie tętnicze, rozszerzenie naczyń, zapalenie naczyń (włączając leukocytoklastyczne zapalenie naczyń). Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: rzadko: duszność, możliwość wystąpienia napadu astmy.
- CHPL leku Profenid, czopki, 100 mgInterakcje
częstość nieznana: skurcz oskrzeli (szczególnie u pacjentów z rozpoznaną nadwrażliwością na kwas acetylosalicylowy lub inne NLPZ), zapalenie błony śluzowej nosa. Zaburzenia żołądka i jelit: często: niestrawność, nudności, bóle brzucha, wymioty. niezbyt często: zaparcie, biegunka, wzdęcia, zapalenie błony śluzowej żołądka. rzadko: zapalenie błony śluzowej jamy ustnej, owrzodzenie żołądka. częstość nieznana: zaostrzenie zapalenia jelita grubego i choroba Crohna, krwawienia z przewodu pokarmowego, perforacja, zapalenie trzustki. Mogą wystąpić zaburzenia smaku. Zaburzenia wątroby i dróg żółciowych: rzadko: zapalenie wątroby, zwiększenie aktywności aminotransferaz, zwiększone stężenie bilirubiny w surowicy spowodowane zapaleniem wątroby. Zaburzenia skóry i tkanki podskórnej: niezbyt często: wysypka, zaczerwienienie, świąd.
- CHPL leku Profenid, czopki, 100 mgInterakcje
częstość nieznana: nadwrażliwość na światło, łysienie, pokrzywka, obrzęk naczynioruchowy, wykwity pęcherzowe w tym zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka, ostra uogólniona osutka krostkowa. Zaburzenia nerek i dróg moczowych: częstość nieznana: ostra niewydolność nerek, zwłaszcza u osób z istniejącymi wcześniej zaburzeniami czynności tego narządu i (lub) u pacjentów odwodnionych, cewkowo-śródmiąższowe zapalenie nerek, zespół nerczycowy, nieprawidłowe wyniki badań czynności nerek. Zaburzenia ogólne i stany w miejscu podania: niezbyt często: obrzęk, zmęczenie. Zaburzenia metabolizmu i odżywiania częstość nieznana: niedobór sodu we krwi, nadmiar potasu we krwi (patrz punkt 4.4 oraz 4.5). Badania diagnostyczne: rzadko: zwiększenie masy ciała. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np.
- CHPL leku Profenid, czopki, 100 mgInterakcje
zawał serca lub udar), patrz punkt 4.4. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego w Polsce. 4.9 Przedawkowanie Raportowano przedawkowanie po zastosowaniu dawki 2,5 g ketoprofenu.
- CHPL leku Profenid, czopki, 100 mgInterakcje
Podczas prawidłowego dawkowania produktu leczniczego przedawkowanie leku podawanego drogą doodbytniczą jest mało prawdopodobne. Zaobserwowane objawy po przedawkowaniu ketoprofenu były łagodne i ograniczały się do: letargu, senności, nudności, wymiotów, biegunki, bólu brzucha. W przypadku przedawkowania dużymi dawkami ketoprofenu mogą wystąpić: niedociśnienie tętnicze, zatrzymanie oddechu, krwawienie z przewodu pokarmowego. Brak specyficznego antidotum w przypadku przedawkowania ketoprofenu. W przypadku podejrzenia znacznego przedawkowania zaleca się wykonanie płukania żołądka oraz postępowanie objawowe i leczenie podtrzymujące czynności życiowe. Aby skompensować odwodnienie należy monitorować wydalanie z moczem i wyrównać kwasicę, jeśli wystąpiła. W przypadku wystąpienia niewydolności nerek można w celu usunięcia produktu leczniczego z krążenia zastosować hemodializę.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na układ krążenia i naczynia mózgowe Pacjentów z nadciśnieniem tętniczym w wywiadzie lub łagodną do umiarkowanej zastoinową niewydolnością serca, z zatrzymaniem płynów i z obrzękami należy odpowiednio kontrolować i wydawać właściwe zalecenia. Zatrzymanie płynów i obrzęki były zgłaszane w związku z leczeniem NLPZ. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niesteroidowych leków przeciwzapalnych innych niż kwas acetylosalicylowy (szczególnie długotrwale w dużych dawkach) jest związane ze zwiększeniem ryzyka zakrzepicy tętnic (np. zawał serca lub udar). Dane te są niewystarczające, aby wykluczyć takie ryzyko w przypadku przyjmowania ketoprofenu. Podobnie jak w przypadku wszystkich leków z grupy NLPZ, należy zachować ostrożność podczas leczenia pacjentów z niekontrolowanym nadciśnieniem tętniczym, zastoinową niewydolnością serca, rozpoznaną chorobą niedokrwienną serca, chorobą tętnic obwodowych i (lub) chorobą naczyń mózgowych, a także przed rozpoczęciem długotrwałego leczenia pacjentów z czynnikami ryzyka chorób układu krążenia (np.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
z nadciśnieniem tętniczym, hiperlipidemią, cukrzycą, palących tytoń). U pacjentów przyjmujących niesteroidowe leki przeciwzapalne inne niż kwas acetylosalicylowy w leczeniu bólu okołooperacyjnego po zabiegu pomostowania tętnic wieńcowych odnotowano wzrost ryzyka tętniczych incydentów zakrzepowych. Zwiększone ryzyko wystąpienia migotania przedsionków było zgłaszane w związku z leczeniem NLPZ. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie zaleca się jednoczesnego stosowania ketoprofenu z następującymi lekami: innymi niesteroidowymi lekami przeciwzapalnymi (w tym selektywnymi inhibitorami cyklooksygenazy 2 – COX-2) i salicylanami w dużych dawkach Jednoczesne stosowanie prowadzi do zwiększenia działań niepożądanych (zwłaszcza ryzyka powstania owrzodzenia przewodu pokarmowego oraz krwawienia z przewodu pokarmowego). lekami przeciwzakrzepowymi: heparyn?
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
antagonistami witaminy K (np.: warfaryna) lekami przeciwagregacyjnymi (np.: tiklopidyna, klopidogrel) inhibitorami trombiny (np.: dabigatran) bezpośrednimi inhibitorami czynnika Xa (np.: apiksaban, rywaroksaban, edoksaban) Ketoprofen hamuje agregację płytek krwi oraz podrażnia błonę śluzową żołądka, prowadząc do zwiększonego ryzyka krwawienia, zwłaszcza z przewodu pokarmowego (patrz punkt 4.4). Nie zaleca się stosowania wymienionych leków jednocześnie z ketoprofenem. Jeśli jednoczesne stosowanie tych leków jest niezbędne, należy uważnie obserwować objawy kliniczne u pacjenta oraz wykonywać okresowe kontrole wskaźników badań laboratoryjnych. Nie należy stosować terapii z NLPZ dłużej niż kilka dni. litem Podobnie do innych NLPZ, ketoprofen hamuje wydalanie litu i może zwiększać jego stężenie w osoczu nawet do wartości toksycznych. Nie zaleca się jednoczesnego stosowania ketoprofenu z solami litu.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
Jeśli postępowanie takie jest konieczne, należy ściśle monitorować stężenia litu w surowicy i odpowiednio modyfikować jego dawki w trakcie leczenia NLPZ oraz po zakończeniu leczenia NLPZ. metotreksatem (w dawkach większych niż 15 mg/tydzień) Jednoczesne stosowanie metotreksatu w dużych dawkach (większych niż 15 mg/tydzień) powoduje zwiększone prawdopodobieństwo toksyczności hematologicznej, które związane jest ze zwiększaniem stężenia metotreksatu w surowicy, wskutek wypierania go przez ketoprofen z połączeń z białkami osocza i zmniejszeniem jego klirensu nerkowego oraz przedłużaniem okresu półtrwania metotreksatu. Należy zachować środki ostrożności podczas jednoczesnego stosowania z następującymi lekami: lekami zwiększającymi stężenie potasu we krwi Produkty lecznicze i kategorie terapeutyczne, które mogą zwiększać stężenie potasu we krwi (tj.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
sole potasu, leki moczopędne oszczędzające potas, inhibitory konwertazy angiotensyny oraz leki blokujące receptory angiotensyny II, inne NLPZ, heparyny (o małej masie cząsteczkowej lub niefrakcjonowana), cyklosporyna, takrolimus i trimetoprym): Ryzyko hiperkaliemii może być zwiększone, gdy leki wymienione powyżej są podawane jednocześnie z ketoprofenem (patrz punkt 4.4). lekami moczopędnymi U pacjentów otrzymujących leki moczopędne, a szczególnie u pacjentów odwodnionych, jednoczesne stosowanie ketoprofenu może prowadzić do zmniejszenia przepływu nerkowego (wskutek hamowania syntezy prostaglandyn) i do wystąpienia niewydolności nerek. Tacy pacjenci powinni przed rozpoczęciem leczenia skojarzonego zostać nawodnieni; po rozpoczęciu leczenia należy także pamiętać o kontrolowaniu czynności nerek (patrz punkt 4.4). inhibitorami konwertazy angiotensyny oraz lekami blokującymi receptory angiotensyny II U pacjentów z zaburzoną czynnością nerek (np.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
u pacjentów odwodnionych lub pacjentów w podeszłym wieku) jednoczesne stosowanie inhibitorów konwertazy angiotensyny lub leków blokujących receptory angiotensyny II wraz z inhibitorami cyklooksygenazy może powodować dalsze pogorszenie czynności nerek, w tym prowadzące do możliwej ostrej niewydolności nerek. metotreksatem (w dawkach mniejszych niż 15 mg/tydzień) Podczas pierwszych tygodni jednoczesnego stosowania ketoprofenu i metotreksatu w dawkach mniejszych niż 15 mg/tydzień należy wykonywać pełne badanie wskaźników morfologii krwi co tydzień. U pacjentów z zaburzeniami czynności nerek oraz pacjentów w podeszłym wieku pełne badanie wskaźników morfologii krwi należy wykonywać częściej. kortykosteroidami Zwiększenie ryzyka wystąpienia owrzodzenia w przewodzie pokarmowym i krwawienia (patrz punkt 4.4). pentoksyfillin? Podczas jednoczesnego stosowania z ketoprofenem występuje zwiększone ryzyko krwawienia. Należy częściej obserwować pacjenta i monitorować czas krwawienia.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
tenofowirem Podczas jednoczesnego stosowania fumaranu dizoproksylu tenofowiru z ketoprofenem występuje zwiększone ryzyko niewydolności nerek. nikorandylem U pacjentów przyjmujących jednocześnie nikorandyl oraz leki z grupy NLPZ, istnieje zwiększone ryzyko wystąpienia ciężkich powikłań, takich jak owrzodzenie, perforacja i krwawienie z przewodu pokarmowego (patrz punkt 4.4). glikozydami nasercowymi Niesteroidowe leki przeciwzapalne mogą nasilać niewydolność serca i powodować zwiększenie stężenia glikozydów nasercowych we krwi. Zalecana jest ostrożność, zwłaszcza u pacjentów z zaburzeniami czynności nerek, z uwagi na fakt, że leki z grupy NLPZ mogą zaburzać czynność nerek oraz zmniejszać klirens nerkowy glikozydów nasercowych. cyklosporyn? Zwiększone prawdopodobieństwo działania nefrotoksycznego, zwłaszcza u pacjentów w podeszłym wieku. takrolimusem Zwiększone prawdopodobieństwo działania nefrotoksycznego, zwłaszcza u pacjentów w podeszłym wieku.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
antybiotykami z grupy chinolonów U pacjentów stosujących jednocześnie niesteroidowe leki przeciwzapalne i antybiotyk z grupy chinolonów jest zwiększone ryzyko wystąpienia drgawek. Należy zwrócić szczególną uwagę na stosowanie ketoprofenu jednocześnie z: lekami przeciwnadciśnieniowymi (lekami blokującymi receptory β-adrenergiczne, inhibitorami enzymu konwertującego angiotensynę, lekami moczopędnymi) - ryzyko zmniejszenia skuteczności tych leków (wskutek hamowania syntezy prostaglandyn rozszerzających naczynia przez leki z grupy NLPZ); lekami trombolitycznymi – zwiększone ryzyko krwawienia; probenecydem – jednoczesne stosowanie z ketoprofenem może znacznie zmniejszyć klirens osoczowy ketoprofenu; inhibitorami zwrotnego wychwytu serotoniny (SSRI) - zwiększone ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.4). Ketoprofen może zmniejszyć skuteczność domacicznych środków antykoncepcyjnych.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może mieć szkodliwy wpływ na przebieg ciąży i (lub) rozwój zarodka lub płodu. Dane z badań epidemiologicznych wskazują, że stosowanie inhibitora syntezy prostaglandyn we wczesnym okresie ciąży wiąże się ze zwiększonym ryzykiem poronienia i rozwoju wad rozwojowych serca oraz wytrzewienia jelit. Bezwzględne ryzyko wad dotyczących układu sercowo-naczyniowego zwiększyło się z mniej niż 1% do około 1,5%. Uważa się, że ryzyko zwiększa się wraz ze zwiększeniem dawki i wydłużeniem czasu leczenia. Wykazano, że u zwierząt podanie inhibitora syntezy prostaglandyn powoduje zwiększoną utratę przed- i poimplantacyjną zarodków oraz zwiększenie śmiertelności zarodków i płodów. Ponadto stwierdzono, że podawanie zwierzętom inhibitora syntezy prostaglandyn w okresie organogenezy zwiększa częstość rozwoju różnych wad rozwojowych, w tym dotyczących układu sercowo-naczyniowego. Od 20.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
tygodnia ciąży stosowanie ketoprofenu może powodować małowodzie wynikające z zaburzeń czynności nerek płodu. Może to wystąpić wkrótce po rozpoczęciu leczenia i zwykle ustępuje po odstawieniu leku. Ponadto odnotowano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze ciąży, z których większość ustąpiła po przerwaniu leczenia. W związku z tym ketoprofenu nie należy stosować w I i II trymestrze ciąży, jeśli nie jest to bezwzględnie konieczne. Jeśli ketoprofen stosowany jest u kobiet starających się zajść w ciążę lub u kobiet w pierwszym i drugim trymestrze ciąży, lek należy podawać w możliwie najmniejszej dawce przez możliwie najkrótszy czas. W przypadku stosowania ketoprofenu przez kilka dni w okresie od 20. tygodnia ciąży należy rozważyć monitorowanie przedporodowe pod kątem małowodzia i zwężenia przewodu tętniczego. Należy przerwać stosowanie ketoprofenu w przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
Wszystkie inhibitory syntezy prostaglandyn: stosowane w III trymestrze ciąży mogą narazić płód na: toksyczne działanie na układ krążenia i oddechowy (przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne); zaburzenia czynności nerek (patrz powyżej); przyjmowane pod koniec ciąży mogą narazić matkę i noworodka na: wydłużenie czasu krwawienia, działanie przeciwagregacyjne, które może wystąpić nawet po zastosowaniu małych dawek ketoprofenu; zahamowanie skurczów macicy, które prowadzi do opóźnienia lub przedłużenia porodu. Z tego względu stosowanie ketoprofenu w III trymestrze ciąży jest przeciwwskazane (patrz punkt 4.3 oraz 5.3). Karmienie piersi? Brak danych dotyczących wydzielania ketoprofenu do mleka matki. Nie zaleca się stosowania ketoprofenu u kobiet karmiących piersią.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
Płodność Patrz punkt 4.4 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Należy ostrzec pacjenta o możliwości wystąpienia zawrotów głowy, senności oraz drgawek. Należy zalecić pacjentowi, że jeśli wystąpi którekolwiek z tych zaburzeń, aby nie prowadził pojazdów ani obsługiwał maszyn. 4.8 Działania niepożądane Następujące działania niepożądane są wymienione na podstawie klasyfikacji układów i narządów i przy użyciu następującej konwencji: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego: rzadko: niedokrwistość spowodowana krwotokiem lub krwawieniem. częstość nieznana: agranulocytoza, trombocytopenia, zahamowanie czynności szpiku, niedokrwistość hemolityczna, leukopenia.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
Zaburzenia układu immunologicznego: częstość nieznana: reakcje anafilaktyczne (w tym wstrząs anafilaktyczny). Zaburzenia psychiczne: częstość nieznana: depresja, omamy, stan splątania, zaburzenia nastroju. Zaburzenia układu nerwowego: niezbyt często: bóle i zawroty głowy pochodzenia ośrodkowego, senność. rzadko: parestezje. częstość nieznana: zapalenie opon mózgowych jałowe, drgawki, zaburzenia smaku, zawroty głowy pochodzenia obwodowego. Zaburzenia oka: rzadko: zaburzenia widzenia (niewyraźne widzenie) (patrz punkt 4.4). Zaburzenia ucha i błędnika: rzadko: szumy uszne. Zaburzenia serca: częstość nieznana: niewydolność serca, migotanie przedsionków. Zaburzenia naczyniowe: częstość nieznana: nadciśnienie tętnicze, rozszerzenie naczyń, zapalenie naczyń (włączając leukocytoklastyczne zapalenie naczyń). Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: rzadko: duszność, możliwość wystąpienia napadu astmy.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
częstość nieznana: skurcz oskrzeli (szczególnie u pacjentów z rozpoznaną nadwrażliwością na kwas acetylosalicylowy lub inne NLPZ), zapalenie błony śluzowej nosa. Zaburzenia żołądka i jelit: często: niestrawność, nudności, bóle brzucha, wymioty. niezbyt często: zaparcie, biegunka, wzdęcia, zapalenie błony śluzowej żołądka. rzadko: zapalenie błony śluzowej jamy ustnej, owrzodzenie żołądka. częstość nieznana: zaostrzenie zapalenia jelita grubego i choroba Crohna, krwawienia z przewodu pokarmowego, perforacja, zapalenie trzustki. Mogą wystąpić zaburzenia smaku. Zaburzenia wątroby i dróg żółciowych: rzadko: zapalenie wątroby, zwiększenie aktywności aminotransferaz, zwiększone stężenie bilirubiny w surowicy spowodowane zapaleniem wątroby. Zaburzenia skóry i tkanki podskórnej: niezbyt często: wysypka, zaczerwienienie, świąd.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
częstość nieznana: nadwrażliwość na światło, łysienie, pokrzywka, obrzęk naczynioruchowy, wykwity pęcherzowe w tym zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka, ostra uogólniona osutka krostkowa. Zaburzenia nerek i dróg moczowych: częstość nieznana: ostra niewydolność nerek, zwłaszcza u osób z istniejącymi wcześniej zaburzeniami czynności tego narządu i (lub) u pacjentów odwodnionych, cewkowo-śródmiąższowe zapalenie nerek, zespół nerczycowy, nieprawidłowe wyniki badań czynności nerek. Zaburzenia ogólne i stany w miejscu podania: niezbyt często: obrzęk, zmęczenie. Zaburzenia metabolizmu i odżywiania częstość nieznana: niedobór sodu we krwi, nadmiar potasu we krwi (patrz punkt 4.4 oraz 4.5). Badania diagnostyczne: rzadko: zwiększenie masy ciała. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
zawał serca lub udar), patrz punkt 4.4. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego w Polsce. 4.9 Przedawkowanie Raportowano przedawkowanie po zastosowaniu dawki 2,5 g ketoprofenu.
- CHPL leku Profenid, czopki, 100 mgWpływ na płodność, ciążę i laktację
Podczas prawidłowego dawkowania produktu leczniczego przedawkowanie leku podawanego drogą doodbytniczą jest mało prawdopodobne. Zaobserwowane objawy po przedawkowaniu ketoprofenu były łagodne i ograniczały się do: letargu, senności, nudności, wymiotów, biegunki, bólu brzucha. W przypadku przedawkowania dużymi dawkami ketoprofenu mogą wystąpić: niedociśnienie tętnicze, zatrzymanie oddechu, krwawienie z przewodu pokarmowego. Brak specyficznego antidotum w przypadku przedawkowania ketoprofenu. W przypadku podejrzenia znacznego przedawkowania zaleca się wykonanie płukania żołądka oraz postępowanie objawowe i leczenie podtrzymujące czynności życiowe. Aby skompensować odwodnienie należy monitorować wydalanie z moczem i wyrównać kwasicę, jeśli wystąpiła. W przypadku wystąpienia niewydolności nerek można w celu usunięcia produktu leczniczego z krążenia zastosować hemodializę.
- CHPL leku Profenid, czopki, 100 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Należy ostrzec pacjenta o możliwości wystąpienia zawrotów głowy, senności oraz drgawek. Należy zalecić pacjentowi, że jeśli wystąpi którekolwiek z tych zaburzeń, aby nie prowadził pojazdów ani obsługiwał maszyn.
- CHPL leku Profenid, czopki, 100 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane są wymienione na podstawie klasyfikacji układów i narządów i przy użyciu następującej konwencji: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego: rzadko: niedokrwistość spowodowana krwotokiem lub krwawieniem. częstość nieznana: agranulocytoza, trombocytopenia, zahamowanie czynności szpiku, niedokrwistość hemolityczna, leukopenia. Zaburzenia układu immunologicznego: częstość nieznana: reakcje anafilaktyczne (w tym wstrząs anafilaktyczny). Zaburzenia psychiczne: częstość nieznana: depresja, omamy, stan splątania, zaburzenia nastroju. Zaburzenia układu nerwowego: niezbyt często: bóle i zawroty głowy pochodzenia ośrodkowego, senność. rzadko: parestezje.
- CHPL leku Profenid, czopki, 100 mgDziałania niepożądane
częstość nieznana: zapalenie opon mózgowych jałowe, drgawki, zaburzenia smaku, zawroty głowy pochodzenia obwodowego. Zaburzenia oka: rzadko: zaburzenia widzenia (niewyraźne widzenie) (patrz punkt 4.4). Zaburzenia ucha i błędnika: rzadko: szumy uszne. Zaburzenia serca: częstość nieznana: niewydolność serca, migotanie przedsionków. Zaburzenia naczyniowe: częstość nieznana: nadciśnienie tętnicze, rozszerzenie naczyń, zapalenie naczyń (włączając leukocytoklastyczne zapalenie naczyń). Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: rzadko: duszność, możliwość wystąpienia napadu astmy. częstość nieznana: skurcz oskrzeli (szczególnie u pacjentów z rozpoznaną nadwrażliwością na kwas acetylosalicylowy lub inne NLPZ), zapalenie błony śluzowej nosa. Zaburzenia żołądka i jelit: często: niestrawność, nudności, bóle brzucha, wymioty. niezbyt często: zaparcie, biegunka, wzdęcia, zapalenie błony śluzowej żołądka.
- CHPL leku Profenid, czopki, 100 mgDziałania niepożądane
rzadko: zapalenie błony śluzowej jamy ustnej, owrzodzenie żołądka. częstość nieznana: zaostrzenie zapalenia jelita grubego i choroba Crohna, krwawienia z przewodu pokarmowego, perforacja, zapalenie trzustki. Mogą wystąpić zaburzenia smaku. Zaburzenia wątroby i dróg żółciowych: rzadko: zapalenie wątroby, zwiększenie aktywności aminotransferaz, zwiększone stężenie bilirubiny w surowicy spowodowane zapaleniem wątroby. Zaburzenia skóry i tkanki podskórnej: niezbyt często: wysypka, zaczerwienienie, świąd. częstość nieznana: nadwrażliwość na światło, łysienie, pokrzywka, obrzęk naczynioruchowy, wykwity pęcherzowe w tym zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka, ostra uogólniona osutka krostkowa. Zaburzenia nerek i dróg moczowych: częstość nieznana: ostra niewydolność nerek, zwłaszcza u osób z istniejącymi wcześniej zaburzeniami czynności tego narządu i (lub) u pacjentów odwodnionych, cewkowo-śródmiąższowe zapalenie nerek, zespół nerczycowy, nieprawidłowe wyniki badań czynności nerek.
- CHPL leku Profenid, czopki, 100 mgDziałania niepożądane
Zaburzenia ogólne i stany w miejscu podania: niezbyt często: obrzęk, zmęczenie. Zaburzenia metabolizmu i odżywiania częstość nieznana: niedobór sodu we krwi, nadmiar potasu we krwi (patrz punkt 4.4 oraz 4.5). Badania diagnostyczne: rzadko: zwiększenie masy ciała. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np. zawał serca lub udar), patrz punkt 4.4. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al.
- CHPL leku Profenid, czopki, 100 mgDziałania niepożądane
Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego w Polsce.
- CHPL leku Profenid, czopki, 100 mgPrzedawkowanie
4.9 Przedawkowanie Raportowano przedawkowanie po zastosowaniu dawki 2,5 g ketoprofenu. Podczas prawidłowego dawkowania produktu leczniczego przedawkowanie leku podawanego drogą doodbytniczą jest mało prawdopodobne. Zaobserwowane objawy po przedawkowaniu ketoprofenu były łagodne i ograniczały się do: letargu, senności, nudności, wymiotów, biegunki, bólu brzucha. W przypadku przedawkowania dużymi dawkami ketoprofenu mogą wystąpić: niedociśnienie tętnicze, zatrzymanie oddechu, krwawienie z przewodu pokarmowego. Brak specyficznego antidotum w przypadku przedawkowania ketoprofenu. W przypadku podejrzenia znacznego przedawkowania zaleca się wykonanie płukania żołądka oraz postępowanie objawowe i leczenie podtrzymujące czynności życiowe. Aby skompensować odwodnienie należy monitorować wydalanie z moczem i wyrównać kwasicę, jeśli wystąpiła. W przypadku wystąpienia niewydolności nerek można w celu usunięcia produktu leczniczego z krążenia zastosować hemodializę.
- CHPL leku Profenid, czopki, 100 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Kod ATC: M01A E03 Grupa farmakoteraupetyczna: Niesteroidowe leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu propionowego. Ketoprofen jest pochodną kwasu arylokarboksylowego należącego do grupy niesteroidowych leków przeciwzapalnych pochodnych kwasu propionowego. Ketoprofen wykazuje działanie przeciwzapalne, przeciwgorączkowe i przeciwbólowe. Mechanizm działania ketoprofenu polega prawdopodobnie na hamowaniu cyklooksygenazy, enzymu odpowiedzialnego za syntezę prostaglandyn. Dopuszcza się również istnienie innych mechanizmów działania ketoprofenu. Ketoprofen hamuje również agregację płytek.
- CHPL leku Profenid, czopki, 100 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Ketoprofen wchłania się dobrze i całkowicie z przewodu pokarmowego. Maksymalne stężenie ketoprofenu w surowicy występuje w 45 do 60 min. po podaniu doodbytniczym. Leki neutralizujące nie wpływają na wchłanianie produktu leczniczego. Dystrybucja Ketoprofen jest w 99% związany z białkami osocza, głównie z albuminami. Ketoprofen przenika do płynu maziowego oraz przestrzeni okołostawowych: torebki stawowej, maziówki i tkanek ścięgnistych. Ketoprofen przenika do płynu mózgowo-rdzeniowego oraz przez barierę łożyskową. Okres połowicznej eliminacji z osocza wynosi około 2 godzin. Objętość dystrybucji wynosi około 7 l. Metabolizm Ketoprofen ulega hydroksylacji i sprzęganiu z kwasem glukuronowym (główna droga metabolizmu to sprzęganie z kwasem glukuronowym). Mniej niż 1% ketoprofenu jest wydalane w postaci niezmienionej.
- CHPL leku Profenid, czopki, 100 mgWłaściwości farmakokinetyczne
Zarówno ketoprofen jak i jego metabolity wydalane są głównie w moczu; wydalana tą drogą ilość metabolitu sprzężonego z kwasem glukuronowym wynosi około 65-85 % podanej dawki. Eliminacja 50% podanej dawki jest wydalana w moczu w ciągu 6 godzin od podania leku. Po podaniu doustnym ketoprofenu około 75% do 90% dawki zostaje wydalone w moczu po 5 dniach od podania dawki leku. Wydalanie z kałem wynosi od 1% do 8%. Szczególne grupy pacjentów Osoby w podeszłym wieku - wchłanianie ketoprofenu nie zmienia się; ulega wydłużeniu okres półtrwania produktu leczniczego (3 godziny) oraz zmniejsza się klirens nerkowy i osoczowy. Pacjenci z niewydolnością nerek - zmniejsza się klirens nerkowy i osoczowy, a ulega wydłużeniu okres półtrwania produktu leczniczego, proporcjonalnie do ciężkości niewydolności nerek.
- CHPL leku Profenid, czopki, 100 mgWłaściwości farmakokinetyczne
Pacjenci z niewydolnością wątroby - nie ulega zmianie klirens osoczowy i okres półtrwania w fazie eliminacji; około dwukrotnie zwiększa się ilość produktu leczniczego nie związanego z białkami.
- CHPL leku Profenid, czopki, 100 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Badania toksykologiczne przeprowadzono u myszy, szczurów, psów i ssaków naczelnych innych niż człowiek przez okres do 18 miesięcy. Po zastosowaniu dawek powyżej 4,5 mg/kg/dobę u szczurów, około 3 mg/kg/dobę u psów i 9 mg/kg/dobę u ssaków naczelnych innych niż człowiek, zaobserwowano zmiany w przewodzie pokarmowym (stwierdzono nadżerki, owrzodzenia i wrzody prowadzące do perforacji), bardziej widoczne i częściej występujące po zastosowaniu większych dawek. U szczurów po zastosowaniu najwyższej dawki 24 mg/kg/dobę, odnotowano zmiany w kanalikach nerkowych z martwicą brodawek nerkowych. Badania działania rakotwórczego i mutagennego wykazały, że produkt był pozbawiony działania rakotwórczego lub mutagennego. Badania za zarodkach i płodach szczurów, myszy i królików nie wykazały działania teratogennego. U królików po zastosowaniu dawki powyżej 6 mg/kg/dobę zaobserwowano niewielką embriotoksyczność.
- CHPL leku Profenid, czopki, 100 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Krzemionka hydrofobowa Glicerydy półsyntetyczne 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4. Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania W tekturowym pudełku 2 blistry po 5 czopków w każdym blistrze. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Fastum, Żel, 25 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Fastum, 25 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g żelu zawiera 2,50 g ketoprofenu (Ketoprofenum). Substancje pomocnicze o znanym działaniu: 1 g żelu zawiera 307 mg etanolu. Żel zawiera cytral, cytronellol, kumarynę, farnezol, geraniol, d-limonen i linalol (obecne w aromacie pomarańczowym i (lub) lawendowym). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel
- CHPL leku Fastum, Żel, 25 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Miejscowe leczenie bólów mięśni i stawów np. spowodowanych urazami (kontuzje wywołane uprawianiem sportu, urazy stawów z naderwaniem więzadeł bez zwichnięcia, uszkodzenia ścięgien i mięśni powstałe wskutek nadmiernego wysiłku), Miejscowe leczenie bólu w okolicy lędźwiowej w przebiegu dyskopatii.
- CHPL leku Fastum, Żel, 25 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Fastum stosuje się 1 do 2 razy na dobę, należy nanieść cienką warstwę żelu (pasek żelu o długości od 3 cm do 5 cm) na skórę w obrębie bolesnego miejsca i delikatnie wmasować w celu ułatwienia wchłaniania. Jeśli po 7 dniach stosowania produktu leczniczego objawy nie ustąpią, nasilą się lub wystąpią nowe objawy, należy dokonać ponownej oceny stanu pacjenta. Nie należy stosować produktu Fastum w postaci żelu u dzieci w wieku do 15 lat.
- CHPL leku Fastum, Żel, 25 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Ketoprofenu nie należy stosować w następujących przypadkach: nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; reakcje nadwrażliwości na światło słoneczne w wywiadzie; znane reakcje nadwrażliwości, takie jak objawy astmy, alergicznego nieżytu błony śluzowej nosa po zastosowaniu fenofibratu, kwasu tiaprofenowego, kwasu acetylosalicylowego lub innych NLPZ; alergia skórna w wywiadzie po zastosowaniu ketoprofenu, kwasu tiaprofenowego, fenofibratu lub filtrów UV lub perfum; ekspozycja na światło słoneczne (nawet wówczas gdy niebo jest zachmurzone), a także promienie UV w solarium, w trakcie leczenia i 2 tygodnie po zaprzestaniu stosowania produktu; trzeci trymestr ciąży (patrz punkt 4.6). Żelu nie należy stosować na skórę uszkodzoną lub zmienioną chorobowo np. w przypadku wyprysku, trądziku, zakażeń skóry lub otwartych ran.
- CHPL leku Fastum, Żel, 25 mg/gPrzeciwwskazania
Z uwagi na brak kontrolowanych badań klinicznych dotyczących skuteczności i bezpieczeństwa stosowania ketoprofenu u dzieci, nie należy stosować produktu leczniczego u dzieci w wieku do 15 lat.
- CHPL leku Fastum, Żel, 25 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy przerwać stosowanie produktu leczniczego w przypadku pojawienia się wysypki. Po każdorazowym zastosowaniu produktu ręce należy dokładnie umyć, chyba że to właśnie ręce są miejscem leczonym. Podczas długotrwałego stosowania zaleca się stosowanie rękawiczek ochronnych. Nie stosować pod opatrunki okluzyjne, na błony śluzowe ani w okolicy oczu. Miejscowe podanie dużych ilości produktu leczniczego może powodować ogólnoustrojowe działanie, w tym reakcje nadwrażliwości i astmę. Produkt leczniczy należy stosować ostrożnie u pacjentów z niewydolnością krążenia, ciężkimi zaburzeniami czynności nerek lub wątroby, ponieważ opisywano pojedyncze przypadki ogólnoustrojowych działań niepożądanych. Długotrwałe używanie produktów leczniczych do stosowania miejscowego może u niektórych chorych wywołać reakcje uczuleniowe lub miejscowe podrażnienia. Produktu leczniczego nie należy stosować na otwarte rany lub skaleczenia.
- CHPL leku Fastum, Żel, 25 mg/gSpecjalne środki ostrozności
Leczenie należy natychmiast przerwać w przypadku rozwoju jakichkolwiek reakcji skórnych, w tym reakcji skórnych po jednoczesnym zastosowaniu produktów zawierających oktokrylen. W celu uniknięcia reakcji nadwrażliwości skóry na światło w okresie leczenia oraz 2 tygodnie po zakończeniu leczenia należy unikać bezpośredniego światła słonecznego (także solarium). Zalecane jest chronienie leczonych obszarów skóry poprzez noszenie odzieży podczas stosowania produktu leczniczego oraz dwa tygodnie po zaprzestaniu jego aplikacji, aby uniknąć ryzyka wystąpienia nadwrażliwości na światło słoneczne. U pacjentów z astmą oraz przewlekłym zapaleniem błony śluzowej nosa, przewlekłym zapaleniem zatok i (lub) polipami nosa ryzyko wystąpienia reakcji alergicznej na aspirynę i (lub) leki z grupy NLPZ jest większe niż u reszty populacji. Specjalne ostrzeżenia dotyczące substancji pomocniczych Fastum zawiera etanol Ten produkt leczniczy zawiera 307 mg alkoholu (etanolu) w każdym 1 g żelu.
- CHPL leku Fastum, Żel, 25 mg/gSpecjalne środki ostrozności
Może powodować pieczenie uszkodzonej skóry. Fastum zawiera aromat pomarańczowy i aromat lawendowy Produkt leczniczy zawiera substancje zapachowe z cytralem, cytronellolem, kumaryną, farnezolem, geraniolem, d-limonenem i linalolem. Mogą one powodować reakcje alergiczne. U pacjentów z padaczką w wywiadzie należy zachować ostrożność podczas stosowania produktu leczniczego ze względu na zawartość substancji pomocniczej w składzie produktu - pochodnej terpenowej (aromat lawendowy).
- CHPL leku Fastum, Żel, 25 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie opisano interakcji produktu leczniczego Fastum z innymi produktami leczniczymi. Mimo to zaleca się uważne monitorowanie pacjentów przyjmujących jednocześnie doustne leki przeciwzakrzepowe.
- CHPL leku Fastum, Żel, 25 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża W badaniach na zwierzętach nie wykazano ryzyka dla płodu, jednak nie wykonano odpowiednio liczebnych, dobrze kontrolowanych obserwacji u ludzi. Nie ma danych klinicznych dotyczących stosowania w czasie ciąży produktu Fastum w postaci do stosowania miejscowego. Nawet jeżeli narażenie ogólnoustrojowe jest mniejsze niż po podaniu doustnym, nie wiadomo, czy ogólnoustrojowy wpływ produktu Fastum po podaniu miejscowym może być szkodliwy dla zarodka (płodu). W pierwszym i drugim trymestrze ciąży nie należy stosować produktu leczniczego Fastum, chyba że jest to bezwzględnie konieczne. W takim przypadku zaleca się zastosowanie jak najmniejszej dawki przez jak najkrótszy okres leczenia. Ketoprofen stosowany w postaciach o działaniu ogólnym w III trymestrze ciąży może spowodować uszkodzenie nerek, serca lub płuc u płodu, a także przedwczesne zamknięcie przewodu tętniczego.
- CHPL leku Fastum, Żel, 25 mg/gWpływ na płodność, ciążę i laktację
W trzecim trymestrze ciąży ogólnoustrojowe stosowanie inhibitorów syntetazy prostaglandyn, w tym produktu Fastum, może u płodu działać szkodliwie na płuca, serce i nerki. Pod koniec ciąży może wystąpić wydłużony czas krwawienia zarówno u matki, jak i u dziecka, a poród może się opóźnić. Z tego powodu stosowanie produktu Fastum jest przeciwwskazane w ostatnim trymestrze ciąży (patrz punkt 4.3). Karmienie piersi? Nie zaleca się stosowania produktu u kobiet karmiących piersią.
- CHPL leku Fastum, Żel, 25 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie opisano wpływu produktu leczniczego na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Fastum, Żel, 25 mg/gDziałania niepożądane
4.8 Działania niepożądane Obserwowano przypadki miejscowych reakcji skórnych mogących następnie rozprzestrzeniać się poza miejsce zastosowania produktu leczniczego. Rzadko występowały przypadki ciężkich reakcji takich jak wyprysk pęcherzowy lub pryszczykowaty, które mogą rozprzestrzeniać się lub być uogólnione. Inne ogólnoustrojowe działania niepożądane (np. dotyczące układu pokarmowego lub nerek) wywołane przez niesteroidowe leki przeciwzapalne wynikają z przenikania substancji czynnej produktu leczniczego przez skórę, są więc uzależnione od ilości zastosowanego żelu, leczonej powierzchni skóry, stopnia wchłaniania przez tkankę, czasu trwania leczenia oraz ewentualnego zastosowania opatrunku okluzyjnego (nadwrażliwość, zaburzenia żołądka i jelit oraz zaburzenia czynności nerek). Od momentu wprowadzenia produktu leczniczego do obrotu obserwowano następujące działania niepożądane, które podano poniżej, grupując je według układów narządów i częstości występowania jako: Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1 000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (< 1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych) Klasyfikacja układów i narządów Niezbyt często: Reakcja anafilaktyczna, reakcje nadwrażliwości Rzadko: Choroba wrzodowa żołądka i (lub) dwunastnicy, krwawienie z przewodu pokarmowego, biegunka Bardzo rzadko: Rumień, świąd, wyprysk, pieczenie, nadwrażliwość na światło, wyprysk pęcherzowy, pokrzywka, kontaktowe zapalenie skóry, obrzęk naczynioruchowy Niewydolność nerek lub zaostrzenie zaburzeń czynności nerek Pacjenci w podeszłym wieku są szczególnie narażeni na wystąpienie działań niepożądanych po podaniu niesteroidowych leków przeciwzapalnych.
- CHPL leku Fastum, Żel, 25 mg/gDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Fastum, Żel, 25 mg/gPrzedawkowanie
4.9 Przedawkowanie Z uwagi na małe stężenie ketoprofenu w osoczu po podaniu miejscowym, przedawkowanie lub zatrucie produktem leczniczym jest mało prawdopodobne. W przypadku omyłkowego spożycia żelu mogą wystąpić: senność, nudności, wymioty. Spożycie dużych dawek może spowodować zahamowanie czynności oddechowych, śpiączkę, drgawki, krwawienie z przewodu pokarmowego, zwiększenie lub zmniejszenie ciśnienia tętniczego, ostrą niewydolność nerek. Należy zastosować odpowiednie środki i wdrożyć leczenie objawowe zwykle stosowane w przypadku leczenia zatruć niesteroidowymi lekami przeciwzapalnymi. Jeśli od przedawkowania nie upłynęła więcej niż 1 godzina, należy wykonać płukanie żołądka i stosować leczenie objawowe.
- CHPL leku Fastum, Żel, 25 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Niesteroidowe leki przeciwzapalne do stosowania miejscowego. Kod ATC: M02AA10. Ketoprofen jest pochodną kwasu fenylopropionowego, niesteroidowym lekiem przeciwzapalnym. Stosowany w postaci żelu wykazuje działanie przeciwzapalne i przeciwbólowe.
- CHPL leku Fastum, Żel, 25 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym pojedynczej dawki ketoprofenu maksymalne stężenie w osoczu występuje w ciągu 2 godzin. Okres półtrwania w osoczu wynosi od 1 do 3 godzin; ketoprofen wiąże się z białkami osocza w 60% do 90%. Wydalanie produktu leczniczego odbywa się głównie przez nerki w postaci sprzężonej z kwasem glukuronowym: średnio 90% podanej dawki wydala się w ciągu 24 godzin. Wchłanianie ketoprofenu do krwioobiegu przez skórę zachodzi bardzo powoli. Po 5 do 8 godzinach od miejscowego podania dawki 50 mg do 150 mg ketoprofenu, stężenie ketoprofenu w osoczu wynosi od 0,08 do 0,15 μg/ml.
- CHPL leku Fastum, Żel, 25 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Badania przeprowadzone na zwierzętach nie wykazały działania toksycznego ketoprofenu na płód, ale brak jest danych epidemiologicznych dotyczących bezpieczeństwa stosowania ketoprofenu u kobiet w ciąży. W badaniach przedklinicznych i klinicznych z zastosowaniem produktu leczniczego Fastum nie zaobserwowano żadnych ciężkich działań niepożądanych, chociaż opisano pojedyncze działania ogólnoustrojowe.
- CHPL leku Fastum, Żel, 25 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Karbomer alkohol etylowy trietanoloamina aromat pomarańczowy (zawiera cytral, cytronellol, farnezol, geraniol, d-limonen i linalol) aromat lawendowy (zawiera kumarynę, geraniol, d-limonen i linalol) woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności Tuba: 5 lat Dozownik: 3 lata. Po pierwszym otwarciu opakowania bezpośredniego: 6 miesięcy 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Tuba aluminiowa pokryta od strony wewnętrznej żywicą epoksydową, w tekturowym pudełku. Tuba zawiera 20 g, 30 g, 50 g lub 100 g żelu. Dozownik wykonany z polipropylenu, polietylenu oraz poliacetalu. Dozownik zawiera 100 g żelu. 6.6 Specjalne środki ostrożności dotyczące usuwania Brak wymagań innych niż wymienione w pkt. 4.2.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Bi-Profenid, 150 mg, tabletki o zmodyfikowanym uwalnianiu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka o zmodyfikowanym uwalnianiu zawiera: 150 mg ketoprofenu (Ketoprofenum). Substancje pomocnicze o znanym działaniu: laktoza jednowodna, skrobia pszeniczna (zawiera gluten). Każda tabletka zawiera 3,8 µg skrobi pszenicznej (zawierającej gluten), patrz punkt 4.4. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka o zmodyfikowanym uwalnianiu. Tabletki składają się z dwóch warstw (warstwy białej o szybkim uwalnianiu oraz warstwy żółtej o powolnym uwalnianiu substancji czynnej); każda z warstw tabletki zawiera po 75 mg ketoprofenu.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWskazania do stosowania
4.1 Wskazania do stosowania Objawowe leczenie: chorób reumatycznych, w tym reumatoidalnego zapalenia stawów, zapalenia stawów innego pochodzenia, stanów zapalnych pozastawowych, jak zapalenie pochewek ścięgnistych lub zespół bolesnego barku, choroby zwyrodnieniowej stawów, przebiegającej z dużym nasileniem bólu i znacznie ograniczającej sprawność chorego.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgDawkowanie
4.2 Dawkowanie i sposób podawania Maksymalna dawka dobowa wynosi 200 mg. Należy dokładnie rozważyć bilans korzyści do ryzyka przed rozpoczęciem leczenia dawką 200 mg. Stosowanie większych dawek nie jest zalecane (patrz punkt 4.4). Dorośli i dzieci w wieku powyżej 15 lat: 150 mg na dobę, tj. 1 tabletka o zmodyfikowanym uwalnianiu jednorazowo. Tabletki należy przyjmować podczas posiłku, popijając szklanką wody. Tabletkę należy połknąć w całości, nie rozgryzać. W przypadku łagodnych zaburzeń żołądkowo-jelitowych, celowe może być stosowanie leków neutralizujących lub osłaniających błonę śluzową żołądka. Związki glinu o działaniu neutralizującym nie zmniejszają wchłaniania ketoprofenu. Należy stosować najmniejszą skuteczną dawkę przez najkrótszy okres konieczny do złagodzenia objawów (patrz punkt 4.4).
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgDawkowanie
Szczególne grupy pacjentów: pacjenci z niewydolnością nerek i osoby w podeszłym wieku: zaleca się zmniejszenie dawki początkowej oraz stosowanie najmniejszych dawek skutecznych (patrz punkt 5.2); pacjenci odwodnieni (patrz punkty 4.4 i 4.5); pacjenci z niewydolnością wątroby: pacjentów takich należy monitorować oraz stosować możliwie najmniejsze dawki skuteczne (patrz punkt 4.4 i 5.2); dzieci: nie ustalono bezpieczeństwa stosowania ketoprofenu u dzieci.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgPrzeciwwskazania
4.3 Przeciwwskazania Ketoprofen jest przeciwwskazany w następujących przypadkach: rozpoznana nadwrażliwość na ketoprofen lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, astma aspirynowa lub inne reakcje nadwrażliwości występujące po niesteroidowych lekach przeciwzapalnych (NLPZ). U tych pacjentów, u których występowały w wywiadzie reakcje nadwrażliwości takie jak: skurcz oskrzeli, ataki astmy, nieżyt nosa, pokrzywka lub inne reakcje typu alergicznego obserwowano ciężkie, rzadko prowadzące do zgonu reakcje anafilaktyczne (patrz punkt 4.8), czynna choroba wrzodowa żołądka i dwunastnicy, lub w wywiadzie krwawienia z żołądka i jelit, owrzodzenie lub perforacje, ciężka niewydolność wątroby lub nerek, ciężka niewydolność serca, skaza krwotoczna, rozpoznana nadwrażliwość lub nietolerancja glutenu (tabletki zawierają w składzie skrobię pszeniczną), III trymestr ciąży.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania U pacjentów z astmą oskrzelową oraz przewlekłym nieżytem nosa, przewlekłym zapaleniem zatok i (lub) polipami nosa występuje zwiększone ryzyko alergii na kwas acetylosalicylowy i (lub) niesteroidowe leki przeciwzapalne. Podanie ketoprofenu u tych pacjentów może wywołać napad astmy, skurcz oskrzeli, szczególnie u osób z nadwrażliwością na kwas acetylosalicylowy lub NLPZ (patrz punkt 4.3). Należy zachować ostrożność u pacjentów przyjmujących jednocześnie leki, które mogą zwiększać ryzyko owrzodzenia lub krwawienia, takie jak: doustne kortykosteroidy, antykoagulanty takie jak warfaryna, selektywne inhibitory wychwytu zwrotnego serotoniny, leki przeciwpłytkowe (takie jak aspiryna) i nikorandyl (patrz punkt 4.5). Należy unikać jednoczesnego stosowania ketoprofenu i innych NLPZ, włączając selektywne inhibitory cyklooksygenazy typu – 2 (COX-2).
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgSpecjalne środki ostrozności
Niektóre dane epidemiologiczne sugerują, że stosowanie ketoprofenu, zwłaszcza w dużych dawkach, może być związane z wyższym ryzykiem wystąpienia poważnej toksyczności żołądkowo-jelitowej, w porównaniu do pozostałych NLPZ (patrz również punkt 4.3). Ryzyko krwawienia do przewodu pokarmowego, owrzodzeń i perforacji wzrasta z dawką ketoprofenu lub innego leku z grupy NLPZ, stosowaną u pacjentów z chorobą wrzodową w wywiadzie, szczególnie powikłaną krwawieniem i perforacją przewodu pokarmowego (patrz punkt 4.3), a także u osób w podeszłym wieku. W opisanych grupach pacjentów leczenie należy rozpocząć od możliwie najmniejszej dawki. W tej populacji, a także u pacjentów wymagających leczenia małymi dawkami kwasu acetylosalicylowego, lub innymi lekami mogącymi zwiększać ryzyko działań niepożądanych w obrębie przewodu pokarmowego, należy również rozważyć stosowanie leków osłaniających błonę śluzową (np. mizoprostol lub inhibitory pompy protonowej) (patrz poniżej i punkt 4.5).
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgSpecjalne środki ostrozności
Pacjenci z ciężkimi schorzeniami przewodu pokarmowego w wywiadzie, szczególnie osoby w podeszłym wieku, powinny poinformować o wszystkich nietypowych objawach ze strony jamy brzusznej (zwłaszcza krwawienie do przewodu pokarmowego), szczególnie w początkowym okresie leczenia. Stosowanie ketoprofenu lub innego leku z grupy NLPZ, może być przyczyną krwawienia z przewodu pokarmowego, owrzodzenia przewodu pokarmowego lub perforacji (u niektórych pacjentów ze skutkiem śmiertelnym), które mogą wystąpić podczas przyjmowania ketoprofenu w dowolnym momencie leczenia, nawet bez objawów zwiastunowych. Należy zachować ostrożność, stosując ketoprofen u pacjentów, u których w wywiadzie występowały zaburzenia żołądkowo-jelitowe. Prawdopodobieństwo wystąpienia działań niepożądanych związanych ze stosowaniem któregokolwiek z leków z grupy NLPZ, zwłaszcza krwawienia z przewodu pokarmowego lub perforacji, niekiedy ze skutkiem śmiertelnym zwiększa się u pacjentów w podeszłym wieku, którzy są bardziej podatni, pacjentów o małej masie ciała, a także u pacjentów z zaburzeniami czynności płytek krwi lub przyjmujących leki przeciwzakrzepowe lub leki antyagregacyjne (patrz punkt 4.5).
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgSpecjalne środki ostrozności
Jeśli wystąpią objawy krwawienia lub owrzodzenia żołądka, produkt leczniczy należy natychmiast odstawić. Ketoprofen lub inne leki z grupy NLPZ, należy stosować ostrożnie u pacjentów z zaburzeniami żołądka i jelit w wywiadzie i poddać tych pacjentów szczególnej obserwacji w przypadku takich chorób jak: zapalenie błony śluzowej żołądka i (lub) dwunastnicy, wrzodziejące zapalenie okrężnicy i choroba Crohna, ze względu na możliwość nasilenia choroby (patrz punkt 4.8). Bardzo rzadko donoszono o występowaniu ciężkich reakcji skórnych, czasami śmiertelnych, w tym złuszczającego zapalenia skóry, zespołu Stevensa-Johnsona lub toksycznego martwiczego oddzielania się naskórka podczas stosowania NLPZ (patrz punkt 4.8). Największe ryzyko wystąpienia tych zaburzeń występuje na początku leczenia. W większości przypadków te reakcje skórne występują podczas pierwszego miesiąca leczenia.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgSpecjalne środki ostrozności
Należy zaprzestać stosowania produktu Bi-Profenid w przypadku pojawienia się wysypki skórnej, uszkodzenia błon śluzowych, lub innych objawów nadwrażliwości. Może wystąpić hiperkaliemia, zwłaszcza u pacjentów z cukrzycą, niewydolnością nerek i (lub) leczonych jednocześnie lekami zwiększającymi stężenie potasu we krwi (patrz punkt 4.5). Należy monitorować stężenie potasu w tych przypadkach. Pacjentów z reakcjami nadwrażliwości na światło słoneczne lub fototoksycznością w wywiadzie, należy dokładnie obserwować podczas podawania ketoprofenu. U pacjentów z niewydolnością serca, marskością wątroby, zespołem nerczycowym, przewlekłymi zaburzeniami czynności nerek oraz zaburzeniami gospodarki wodnej (np. odwodnienie w wyniku stosowania leków moczopędnych, hipowolemia po zabiegu chirurgicznym lub z innych przyczyn) ketoprofen, może zmniejszać przepływ nerkowy poprzez hamowanie syntezy prostaglandyn, prowadząc do wystąpienia zaburzeń czynności nerek, zwłaszcza u pacjentów w podeszłym wieku.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgSpecjalne środki ostrozności
W początkowym okresie leczenia u tych pacjentów niezbędne jest szczegółowe monitorowanie wielkości diurezy oraz innych wskaźników czynności nerek. Zaburzenie czynności nerek może prowadzić do obrzęków i zwiększenia stężenia azotu pozabiałkowego w surowicy. U pacjentów z zaburzeniami czynności wątroby lub z chorobą wątroby w wywiadzie konieczna jest dokładna obserwacja (należy okresowo oznaczać aktywność aminotransferaz, szczególnie podczas długotrwałej terapii) i indywidualne dostosowanie dawki produktu leczniczego. Podczas długotrwałego stosowania ketoprofenu należy wykonywać badania wskaźników morfologii krwi oraz kontrolować wskaźniki czynności wątroby oraz nerek. Odnotowano bardzo rzadkie przypadki żółtaczki i zapalenia wątroby podczas leczenia ketoprofenem. W przypadku wystąpienia zaburzeń widzenia należy przerwać stosowanie produktu leczniczego. Nie ustalono bezpieczeństwa stosowania ketoprofenu u dzieci. Nie zaleca się stosowania produktu leczniczego poniżej 15 lat.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgSpecjalne środki ostrozności
U pacjentek przyjmujących przewlekle ketoprofen opisano przypadki wtórnej niepłodności bez jajeczkowania (wskutek braku pęknięcia pęcherzyka Graafa). Stosowanie ketoprofenu lub innego leku z grupy NLPZ, może niekorzystnie wpływać na płodność u kobiet i nie jest ono zalecane u kobiet, które planują zajście w ciążę. W przypadku kobiet, które mają trudności z zajściem w ciążę lub które są poddawane badaniom w związku z niepłodnością, należy rozważyć zakończenie stosowania ketoprofenu lub innego leku z grupy NLPZ. Należy stosować najmniejszą skuteczną dawkę przez najkrótszy okres konieczny do złagodzenia objawów (patrz punkt 4.2). Maskowanie objawów zakażenia podstawowego Bi-Profenid może maskować objawy zakażenia, co może prowadzić do opóźnionego rozpoczęcia stosowania właściwego leczenia, a przez to pogarszać skutki zakażenia. Zjawisko to zaobserwowano w przypadku pozaszpitalnego bakteryjnego zapalenia płuc i powikłań bakteryjnych ospy wietrznej.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgSpecjalne środki ostrozności
Jeśli lek Bi-Profenid stosowany jest z powodu gorączki lub bólu związanych z zakażeniem, zaleca się kontrolowanie przebiegu zakażenia. W warunkach pozaszpitalnych pacjent powinien skonsultować się z lekarzem, jeśli objawy utrzymują się lub nasilają. Wpływ na układ krążenia i naczynia mózgowe Pacjentów z nadciśnieniem tętniczym w wywiadzie lub łagodną do umiarkowanej zastoinową niewydolnością serca, z zatrzymaniem płynów i z obrzękami należy odpowiednio kontrolować i wydawać właściwe zalecenia. Zatrzymanie płynów i obrzęki były zgłaszane w związku z leczeniem NLPZ. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niesteroidowych leków przeciwzapalnych innych niż kwas acetylosalicylowy (szczególnie długotrwale w dużych dawkach) jest związane ze zwiększeniem ryzyka zakrzepicy tętnic (np. zawał serca lub udar). Dane te są niewystarczające, aby wykluczyć takie ryzyko w przypadku przyjmowania ketoprofenu.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgSpecjalne środki ostrozności
Podobnie jak w przypadku wszystkich leków z grupy NLPZ, należy zachować ostrożność podczas leczenia pacjentów z niekontrolowanym nadciśnieniem tętniczym, zastoinową niewydolnością serca, rozpoznaną chorobą niedokrwienną serca, chorobą tętnic obwodowych i (lub) chorobą naczyń mózgowych, a także przed rozpoczęciem długotrwałego leczenia pacjentów z czynnikami ryzyka chorób układu krążenia (np. z nadciśnieniem tętniczym, hiperlipidemią, cukrzycą, palących tytoń). U pacjentów przyjmujących niesteroidowe leki przeciwzapalne inne niż kwas acetylosalicylowy w leczeniu bólu okołooperacyjnego po zabiegu pomostowania tętnic wieńcowych odnotowano wzrost ryzyka tętniczych incydentów zakrzepowych. Zwiększone ryzyko wystąpienia migotania przedsionków było zgłaszane w związku z leczeniem NLPZ. W związku z występowaniem w tabletkach laktozy, produkt leczniczy Bi-Profenid nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, zespołem złego wchłaniania glukozy-galaktozy lub niedoborem laktazy (typu Lapp).
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgSpecjalne środki ostrozności
Skrobia pszeniczna (zawiera gluten) Ten lek zawiera bardzo małe ilości glutenu (pochodzącego ze skrobi pszenicznej) i określa się go jako „bezglutenowy”. W związku z tym jest bardzo mało prawdopodobne, aby spowodowało to jakiekolwiek problemy u pacjentów z chorobą trzewną (celiaklią). Jedna tabletka zawiera nie więcej niż 3,8 mikrogramów glutenu. Leku nie powinni stosować pacjenci z alergią na pszenicę (inną niż choroba trzewna). Zawartość sodu Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie zaleca się jednoczesnego stosowania ketoprofenu z następującymi lekami: innymi niesteroidowymi lekami przeciwzapalnymi (w tym selektywnymi inhibitorami cyklooksygenazy 2 – COX-2) i salicylanami w dużych dawkach Jednoczesne stosowanie prowadzi do zwiększenia działań niepożądanych (zwłaszcza ryzyka powstania owrzodzenia przewodu pokarmowego oraz krwawienia z przewodu pokarmowego). lekami przeciwzakrzepowymi: heparyn? antagonistami witaminy K (np.: warfaryna) lekami przeciwagregacyjnymi (np.: tiklopidyna, klopidogrel) inhibitorami trombiny (np.: dabigatran) bezpośrednimi inhibitorami czynnika Xa (np.: apiksaban, rywaroksaban, edoksaban) Ketoprofen hamuje agregację płytek krwi oraz podrażnia błonę śluzową żołądka, prowadząc do zwiększonego ryzyka krwawienia, zwłaszcza z przewodu pokarmowego (patrz punkt 4.4). Nie zaleca się stosowania wymienionych leków jednocześnie z ketoprofenem.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgInterakcje
Jeśli jednoczesne stosowanie tych leków jest niezbędne, należy uważnie obserwować objawy kliniczne u pacjenta oraz wykonywać okresowe kontrole wskaźników badań laboratoryjnych. Nie należy stosować terapii z NLPZ dłużej niż kilka dni. litem Podobnie do innych NLPZ, ketoprofen hamuje wydalanie litu i może zwiększać jego stężenie w surowicy nawet do wartości toksycznych. Nie zaleca się jednoczesnego stosowania ketoprofenu z solami litu. Jeśli postępowanie takie jest konieczne, należy ściśle monitorować stężenia litu w surowicy i odpowiednio modyfikować jego dawki w trakcie leczenia NLPZ oraz po zakończeniu leczenia NLPZ. metotreksatem (w dawkach większych niż 15 mg/tydzień) Jednoczesne stosowanie metotreksatu w dużych dawkach (większych niż 15 mg/tydzień) powoduje zwiększone prawdopodobieństwo toksyczności hematologicznej, które związane jest ze zwiększaniem stężenia metotreksatu w surowicy, wskutek wypierania go przez ketoprofen z połączeń z białkami osocza i zmniejszeniem jego klirensu nerkowego oraz przedłużaniem okresu półtrwania metotreksatu.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgInterakcje
Należy zachować środki ostrożności podczas jednoczesnego stosowania z następującymi lekami: lekami zwiększającymi stężenie potasu we krwi Produkty lecznicze i kategorie terapeutyczne, które mogą zwiększać stężenie potasu we krwi (tj. sole potasu, leki moczopędne oszczędzające potas, inhibitory konwertazy angiotensyny oraz leki blokujące receptory angiotensyny II, inne NLPZ, heparyny (o małej masie cząsteczkowej lub niefrakcjonowana), cyklosporyna, takrolimus i trimetoprym): Ryzyko hiperkaliemii może być zwiększone, gdy leki wymienione powyżej są podawane jednocześnie z ketoprofenem (patrz punkt 4.4). lekami moczopędnymi U pacjentów otrzymujących leki moczopędne, a szczególnie u pacjentów odwodnionych, jednoczesne stosowanie ketoprofenu może prowadzić do zmniejszenia przepływu nerkowego (wskutek hamowania syntezy prostaglandyn) i do wystąpienia niewydolności nerek.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgInterakcje
Tacy pacjenci powinni przed rozpoczęciem leczenia skojarzonego zostać nawodnieni; po rozpoczęciu leczenia należy także pamiętać o kontrolowaniu czynności nerek (patrz punkt 4.4). inhibitorami konwertazy angiotensyny oraz lekami blokującymi receptory angiotensyny II U pacjentów z zaburzoną czynnością nerek (np. u pacjentów odwodnionych lub pacjentów w podeszłym wieku) jednoczesne stosowanie inhibitorów konwertazy angiotensyny lub leków blokujących receptory angiotensyny II wraz z inhibitorami cyklooksygenazy może powodować dalsze pogorszenie czynności nerek, w tym prowadzące do możliwej ostrej niewydolności nerek. metotreksatem (w dawkach mniejszych niż 15 mg/tydzień) Podczas pierwszych tygodni jednoczesnego stosowania ketoprofenu i metotreksatu w dawkach mniejszych niż 15 mg/tydzień należy wykonywać pełne badanie wskaźników morfologii krwi co tydzień.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgInterakcje
U pacjentów z zaburzeniami czynności nerek oraz pacjentów w podeszłym wieku pełne badanie wskaźników morfologii krwi należy wykonywać częściej. kortykosteroidami Zwiększenie ryzyka wystąpienia owrzodzenia w przewodzie pokarmowym i krwawienia (patrz punkt 4.4). pentoksyfilin? Podczas jednoczesnego stosowania z ketoprofenem występuje zwiększone ryzyko krwawienia. Należy częściej obserwować pacjenta i monitorować czas krwawienia. tenofowirem Podczas jednoczesnego stosowania fumaranu dizoproksylu tenofowiru z ketoprofenem występuje zwiększone ryzyko niewydolności nerek. nikorandylem U pacjentów przyjmujących jednocześnie nikorandyl oraz leki z grupy NLPZ, istnieje zwiększone ryzyko wystąpienia ciężkich powikłań, takich jak owrzodzenie, perforacja i krwawienie z przewodu pokarmowego (patrz punkt 4.4). glikozydami nasercowymi Niesteroidowe leki przeciwzapalne mogą nasilać niewydolność serca i powodować zwiększenie stężenia glikozydów nasercowych we krwi.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgInterakcje
Zalecana jest ostrożność, zwłaszcza u pacjentów z zaburzeniami czynności nerek, z uwagi na fakt, że leki z grupy NLPZ mogą zaburzać czynność nerek oraz zmniejszać klirens nerkowy glikozydów nasercowych. cyklosporyn? Zwiększone prawdopodobieństwo działania nefrotoksycznego, zwłaszcza u pacjentów w podeszłym wieku. takrolimusem Zwiększone prawdopodobieństwo działania nefrotoksycznego, zwłaszcza u pacjentów w podeszłym wieku. antybiotykami z grupy chinolonów U pacjentów stosujących jednocześnie niesteroidowe leki przeciwzapalne i antybiotyk z grupy chinolonów jest zwiększone ryzyko wystąpienia drgawek. Należy zwrócić szczególną uwagę na stosowanie ketoprofenu jednocześnie z: lekami przeciwnadciśnieniowymi (lekami blokującymi receptory β-adrenergiczne, inhibitorami enzymu konwertującego angiotensynę, lekami moczopędnymi) - ryzyko zmniejszenia skuteczności tych leków (wskutek hamowania syntezy prostaglandyn rozszerzających naczynia przez leki z grupy NLPZ); lekami trombolitycznymi – zwiększone ryzyko krwawienia; probenecydem – jednoczesne stosowanie z ketoprofenem może znacznie zmniejszyć klirens osoczowy ketoprofenu; inhibitorami zwrotnego wychwytu serotoniny (SSRI) - zwiększone ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.4).
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgInterakcje
Ketoprofen może zmniejszyć skuteczność domacicznych środków antykoncepcyjnych.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może mieć szkodliwy wpływ na przebieg ciąży i (lub) rozwój zarodka lub płodu. Dane z badań epidemiologicznych wskazują, że stosowanie inhibitora syntezy prostaglandyn we wczesnym okresie ciąży wiąże się ze zwiększonym ryzykiem poronienia i rozwoju wad rozwojowych serca oraz wytrzewienia jelit. Bezwzględne ryzyko wad dotyczących układu sercowo-naczyniowego zwiększyło się z mniej niż 1% do około 1,5%. Uważa się, że ryzyko zwiększa się wraz ze zwiększeniem dawki i wydłużeniem czasu leczenia. Wykazano, że u zwierząt podanie inhibitora syntezy prostaglandyn powoduje zwiększoną utratę przed- i poimplantacyjną zarodków oraz zwiększenie śmiertelności zarodków i płodów. Ponadto stwierdzono, że podawanie zwierzętom inhibitora syntezy prostaglandyn w okresie organogenezy zwiększa częstość rozwoju różnych wad rozwojowych, w tym dotyczących układu sercowo-naczyniowego. Od 20.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWpływ na płodność, ciążę i laktację
tygodnia ciąży stosowanie ketoprofenu może powodować małowodzie wynikające z zaburzeń czynności nerek płodu. Może to wystąpić wkrótce po rozpoczęciu leczenia i zwykle ustępuje po odstawieniu leku. Ponadto odnotowano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze ciąży, z których większość ustąpiła po przerwaniu leczenia. W związku z tym ketoprofenu nie należy stosować w I i II trymestrze ciąży, jeśli nie jest to bezwzględnie konieczne. Jeśli ketoprofen stosowany jest u kobiet starających się zajść w ciążę lub u kobiet w pierwszym i drugim trymestrze ciąży, lek należy podawać w możliwie najmniejszej dawce przez możliwie najkrótszy czas. W przypadku stosowaniu ketoprofenu przez kilka dni w okresie od 20. tygodnia ciąży należy rozważyć monitorowanie przedporodowe pod kątem małowodzia i zwężenia przewodu tętniczego. Należy przerwać stosowanie ketoprofenu w przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWpływ na płodność, ciążę i laktację
Wszystkie inhibitory syntezy prostaglandyn: stosowane w III trymestrze ciąży mogą narazić płód na: toksyczne działanie na układ krążenia i oddechowy (przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne); zaburzenia czynności nerek (patrz powyżej); przyjmowane pod koniec ciąży mogą narazić matkę i noworodka na: wydłużenie czasu krwawienia, działanie przeciwagregacyjne, które może wystąpić nawet po zastosowaniu małych dawek ketoprofenu; zahamowanie skurczów macicy, które prowadzi do opóźnienia lub przedłużenia porodu. Z tego względu stosowanie ketoprofenu w III trymestrze ciąży jest przeciwwskazane (patrz punkt 4.3 oraz 5.3). Karmienie piersi? Brak danych dotyczących wydzielania ketoprofenu do mleka matki. Nie zaleca się stosowania ketoprofenu u kobiet karmiących piersią.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWpływ na płodność, ciążę i laktację
Płodność Patrz punkt 4.4 4.7 Wpływ na zdolność do prowadzenia pojazdów i obsługiwania maszyn Należy ostrzec pacjenta o możliwości wystąpienia zawrotów głowy, senności oraz drgawek. Należy zalecić pacjentowi, że jeśli wystąpi którekolwiek z tych zaburzeń, aby nie prowadził pojazdów ani obsługiwał maszyn. 4.8 Działania niepożądane Następujące działania niepożądane są wymienione na podstawie klasyfikacji układów i narządów i przy użyciu następującej konwencji: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego: rzadko: niedokrwistość spowodowana krwotokiem lub krwawieniem. częstość nieznana: agranulocytoza, trombocytopenia, zahamowanie czynności szpiku, niedokrwistość hemolityczna, leukopenia.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWpływ na płodność, ciążę i laktację
Zaburzenia układu immunologicznego: częstość nieznana: reakcje anafilaktyczne (w tym wstrząs anafilaktyczny). Zaburzenia psychiczne: częstość nieznana: depresja, omamy, stan splątania, zaburzenia nastroju. Zaburzenia układu nerwowego: niezbyt często: bóle i zawroty głowy pochodzenia ośrodkowego, senność. rzadko: parestezje. częstość nieznana: zapalenie opon mózgowych jałowe, drgawki, zaburzenia smaku, zawroty głowy pochodzenia obwodowego. Zaburzenia oka: rzadko: zaburzenia widzenia (niewyraźne widzenie) (patrz punkt 4.4). Zaburzenia ucha i błędnika: rzadko: szumy uszne. Zaburzenia serca: częstość nieznana: niewydolność serca, migotanie przedsionków. Zaburzenia naczyniowe: częstość nieznana: nadciśnienie tętnicze, rozszerzenie naczyń, zapalenie naczyń (włączając leukocytoklastyczne zapalenie naczyń). Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: rzadko: duszność, możliwość wystąpienia napadu astmy.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWpływ na płodność, ciążę i laktację
częstość nieznana: skurcz oskrzeli (szczególnie u pacjentów z rozpoznaną nadwrażliwością na kwas acetylosalicylowy lub inne NLPZ), zapalenie błony śluzowej nosa. Zaburzenia żołądka i jelit: często: niestrawność, nudności, bóle brzucha, wymioty. niezbyt często: zaparcie, biegunka, wzdęcia, zapalenie błony śluzowej żołądka. rzadko: zapalenie błony śluzowej jamy ustnej, owrzodzenie żołądka. częstość nieznana: zaostrzenie zapalenia jelita grubego i choroba Crohna, krwawienia z przewodu pokarmowego, perforacja, zapalenie trzustki. Mogą wystąpić zaburzenia smaku. Ketoprofen podawany doustnie w dawce 200 mg na dobę zwiększa prawdopodobieństwo wystąpienia krwawienia z przewodu pokarmowego; prawdopodobieństwo zwiększa się wraz ze zwiększeniem dawki. Zaburzenia wątroby i dróg żółciowych: rzadko: zapalenie wątroby, zwiększenie aktywności aminotransferaz, zwiększone stężenie bilirubiny w surowicy spowodowane zapaleniem wątroby.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWpływ na płodność, ciążę i laktację
Zaburzenia skóry i tkanki podskórnej: niezbyt często: wysypka, zaczerwienienie, świąd. częstość nieznana: nadwrażliwość na światło, łysienie, pokrzywka, obrzęk naczynioruchowy, wykwity pęcherzowe w tym zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka, ostra uogólniona osutka krostkowa. Zaburzenia nerek i dróg moczowych: częstość nieznana: ostra niewydolność nerek, zwłaszcza u osób z istniejącymi wcześniej zaburzeniami czynności tego narządu i (lub) u pacjentów odwodnionych, cewkowo-śródmiąższowe zapalenie nerek, zespół nerczycowy, nieprawidłowe wyniki badań czynności nerek. Zaburzenia ogólne i stany w miejscu podania: niezbyt często: obrzęk, zmęczenie. Zaburzenia metabolizmu i odżywiania częstość nieznana: niedobór sodu we krwi, nadmiar potasu we krwi (patrz punkt 4.4 oraz 4.5). Badania diagnostyczne: rzadko: zwiększenie masy ciała.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWpływ na płodność, ciążę i laktację
Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np. zawał serca lub udar), patrz punkt 4.4. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWpływ na płodność, ciążę i laktację
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego w Polsce. 4.9 Przedawkowanie Raportowano przedawkowanie po zastosowaniu dawki 2,5 g ketoprofenu. Zaobserwowane objawy po przedawkowaniu ketoprofenu były łagodne i ograniczały się do: letargu, senności, nudności, wymiotów, i bólu brzucha. W przypadku przedawkowania dużymi dawkami ketoprofenu mogą wystąpić: niedociśnienie tętnicze, zatrzymanie oddechu, krwawienie z przewodu pokarmowego. Brak specyficznego antidotum w przypadku przedawkowania ketoprofenu. W przypadku podejrzenia znacznego przedawkowania zaleca się wykonanie płukania żołądka oraz postępowanie objawowe i leczenie podtrzymujące czynności życiowe. Aby skompensować odwodnienie należy monitorować wydalanie z moczem i wyrównać kwasicę, jeśli wystąpiła. W przypadku wystąpienia niewydolności nerek można w celu usunięcia produktu leczniczego z krążenia zastosować hemodializę.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność do prowadzenia pojazdów i obsługiwania maszyn Należy ostrzec pacjenta o możliwości wystąpienia zawrotów głowy, senności oraz drgawek. Należy zalecić pacjentowi, że jeśli wystąpi którekolwiek z tych zaburzeń, aby nie prowadził pojazdów ani obsługiwał maszyn.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane są wymienione na podstawie klasyfikacji układów i narządów i przy użyciu następującej konwencji: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego: rzadko: niedokrwistość spowodowana krwotokiem lub krwawieniem. częstość nieznana: agranulocytoza, trombocytopenia, zahamowanie czynności szpiku, niedokrwistość hemolityczna, leukopenia. Zaburzenia układu immunologicznego: częstość nieznana: reakcje anafilaktyczne (w tym wstrząs anafilaktyczny). Zaburzenia psychiczne: częstość nieznana: depresja, omamy, stan splątania, zaburzenia nastroju. Zaburzenia układu nerwowego: niezbyt często: bóle i zawroty głowy pochodzenia ośrodkowego, senność. rzadko: parestezje.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgDziałania niepożądane
częstość nieznana: zapalenie opon mózgowych jałowe, drgawki, zaburzenia smaku, zawroty głowy pochodzenia obwodowego. Zaburzenia oka: rzadko: zaburzenia widzenia (niewyraźne widzenie) (patrz punkt 4.4). Zaburzenia ucha i błędnika: rzadko: szumy uszne. Zaburzenia serca: częstość nieznana: niewydolność serca, migotanie przedsionków. Zaburzenia naczyniowe: częstość nieznana: nadciśnienie tętnicze, rozszerzenie naczyń, zapalenie naczyń (włączając leukocytoklastyczne zapalenie naczyń). Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: rzadko: duszność, możliwość wystąpienia napadu astmy. częstość nieznana: skurcz oskrzeli (szczególnie u pacjentów z rozpoznaną nadwrażliwością na kwas acetylosalicylowy lub inne NLPZ), zapalenie błony śluzowej nosa. Zaburzenia żołądka i jelit: często: niestrawność, nudności, bóle brzucha, wymioty. niezbyt często: zaparcie, biegunka, wzdęcia, zapalenie błony śluzowej żołądka.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgDziałania niepożądane
rzadko: zapalenie błony śluzowej jamy ustnej, owrzodzenie żołądka. częstość nieznana: zaostrzenie zapalenia jelita grubego i choroba Crohna, krwawienia z przewodu pokarmowego, perforacja, zapalenie trzustki. Mogą wystąpić zaburzenia smaku. Ketoprofen podawany doustnie w dawce 200 mg na dobę zwiększa prawdopodobieństwo wystąpienia krwawienia z przewodu pokarmowego; prawdopodobieństwo zwiększa się wraz ze zwiększeniem dawki. Zaburzenia wątroby i dróg żółciowych: rzadko: zapalenie wątroby, zwiększenie aktywności aminotransferaz, zwiększone stężenie bilirubiny w surowicy spowodowane zapaleniem wątroby. Zaburzenia skóry i tkanki podskórnej: niezbyt często: wysypka, zaczerwienienie, świąd. częstość nieznana: nadwrażliwość na światło, łysienie, pokrzywka, obrzęk naczynioruchowy, wykwity pęcherzowe w tym zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka, ostra uogólniona osutka krostkowa.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgDziałania niepożądane
Zaburzenia nerek i dróg moczowych: częstość nieznana: ostra niewydolność nerek, zwłaszcza u osób z istniejącymi wcześniej zaburzeniami czynności tego narządu i (lub) u pacjentów odwodnionych, cewkowo-śródmiąższowe zapalenie nerek, zespół nerczycowy, nieprawidłowe wyniki badań czynności nerek. Zaburzenia ogólne i stany w miejscu podania: niezbyt często: obrzęk, zmęczenie. Zaburzenia metabolizmu i odżywiania częstość nieznana: niedobór sodu we krwi, nadmiar potasu we krwi (patrz punkt 4.4 oraz 4.5). Badania diagnostyczne: rzadko: zwiększenie masy ciała. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np. zawał serca lub udar), patrz punkt 4.4. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego w Polsce.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgPrzedawkowanie
4.9 Przedawkowanie Raportowano przedawkowanie po zastosowaniu dawki 2,5 g ketoprofenu. Zaobserwowane objawy po przedawkowaniu ketoprofenu były łagodne i ograniczały się do: letargu, senności, nudności, wymiotów, i bólu brzucha. W przypadku przedawkowania dużymi dawkami ketoprofenu mogą wystąpić: niedociśnienie tętnicze, zatrzymanie oddechu, krwawienie z przewodu pokarmowego. Brak specyficznego antidotum w przypadku przedawkowania ketoprofenu. W przypadku podejrzenia znacznego przedawkowania zaleca się wykonanie płukania żołądka oraz postępowanie objawowe i leczenie podtrzymujące czynności życiowe. Aby skompensować odwodnienie należy monitorować wydalanie z moczem i wyrównać kwasicę, jeśli wystąpiła. W przypadku wystąpienia niewydolności nerek można w celu usunięcia produktu leczniczego z krążenia zastosować hemodializę.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Kod ATC: M01A E03 Grupa farmakoterapeutyczna: Niesteroidowe leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu propionowego. Ketoprofen jest pochodną kwasu arylokarboksylowego należącego do grupy niesteroidowych leków przeciwzapalnych pochodnych kwasu propionowego. Ketoprofen wykazuje działanie przeciwzapalne, przeciwgorączkowe i przeciwbólowe. Mechanizm działania ketoprofenu polega prawdopodobnie na hamowaniu cyklooksygenazy, enzymu odpowiedzialnego za syntezę prostaglandyn. Dopuszcza się również istnienie innych mechanizmów działania ketoprofenu. Ketoprofen hamuje agregację płytek krwi.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Ketoprofen jest wchłaniany z warstwy białej tabletki (szybko uwalniającej lek) z szybkością zbliżoną do wchłaniania produktów leczniczych zawierających ketoprofen o standardowym wchłanianiu w soku żołądkowym; maksymalne stężenie ketoprofenu w surowicy występuje w 1,21 ± 0,88 godziny po podaniu doustnym i wynosi 7,72 ± 1,6 mg/l. Uwalnianie ketoprofenu z warstwy żółtej, opornej na działanie kwasu żołądkowego powoduje stopniowe wchłanianie substancji czynnej. Stężenie ketoprofenu osiąga stałą wartość po 45 do 90 minut od podania doustnego produktu leczniczego, a po trzech godzinach stężenie ketoprofenu w surowicy po podaniu tabletek o zmodyfikowanym uwalnianiu, przewyższało stężenie ketoprofenu jakie obserwowano po podaniu kapsułek o standardowym uwalnianiu. Pokarm zaburza szybkość wchłaniania i zmniejsza stężenie w osoczu (Cmax), nie wpływa jednak na biodostępność ketoprofenu.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWłaściwości farmakokinetyczne
Leki neutralizujące nie wpływają na wchłanianie tego produktu leczniczego. Dystrybucja Ketoprofen jest w 99% związany z białkami osocza, głównie z albuminami. Ketoprofen przenika do płynu maziowego oraz przestrzeni stawowych: torebki stawowej, maziówki i tkanek ścięgnistych. Ketoprofen przenika do płynu mózgowo-rdzeniowego oraz przez barierę łożyskową. Okres półtrwania w fazie eliminacji wynosi 3,6 godziny. Po wielokrotnym podaniu produktu leczniczego nie dochodzi do kumulowania ketoprofenu. Objętość dystrybucji wynosi około 7 l. Metabolizm Ketoprofen ulega hydroksylacji i sprzęganiu z kwasem glukuronowym. Mniej niż 1% ketoprofenu jest wydalane w postaci niezmienionej. Zarówno ketoprofen jak i jego metabolity wydalane są głównie w moczu; wydalana tą drogą ilość metabolitu sprzężonego z kwasem glukuronowym wynosi około 65% do 85% podanej dawki. Eliminacja 50% podanej dawki jest wydalane w moczu w ciągu 6 godzin od podania produktu leczniczego.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgWłaściwości farmakokinetyczne
Po podaniu doustnym ketoprofenu około 75% do 90% dawki zostaje wydalone w moczu po 5 dniach od podania dawki produktu leczniczego. Wydalanie z kałem wynosi od 1% do 8%. Szczególne grupy pacjentów Osoby w podeszłym wieku - wchłanianie ketoprofenu nie zmienia się; ulega wydłużeniu okres półtrwania produktu leczniczego (3 godziny) oraz zmniejsza się klirens nerkowy i osoczowy. Pacjenci z niewydolnością nerek - zmniejsza się klirens nerkowy i osoczowy, a ulega wydłużeniu okres półtrwania produktu leczniczego, proporcjonalnie do ciężkości niewydolności nerek. Pacjenci z niewydolnością wątroby - nie ulega zmianie klirens osoczowy i okres półtrwania w fazie eliminacji; około dwukrotnie zwiększa się ilość produktu leczniczego niezwiązanego z białkami.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Badania toksykologiczne przeprowadzono u myszy, szczurów, psów i ssaków naczelnych innych niż człowiek przez okres do 18 miesięcy. Po zastosowaniu dawek powyżej 4,5 mg/kg/dobę u szczurów, około 3 mg/kg/dobę u psów i 9 mg/kg/dobę u ssaków naczelnych innych niż człowiek, zaobserwowano zmiany w przewodzie pokarmowym (stwierdzono nadżerki, owrzodzenia i wrzody prowadzące do perforacji), bardziej widoczne i częściej występujące po zastosowaniu większych dawek. U szczurów po zastosowaniu najwyższej dawki 24 mg/kg/dobę, odnotowano zmiany w kanalikach nerkowych z martwicą brodawek nerkowych. Badania działania rakotwórczego i mutagennego wykazały, że produkt był pozbawiony działania rakotwórczego lub mutagennego. Badania za zarodkach i płodach szczurów, myszy i królików nie wykazały działania teratogennego. U królików po zastosowaniu dawki powyżej 6 mg/kg/dobę zaobserwowano niewielką embriotoksyczność.
- CHPL leku Bi-Profenid, tabletki o zmodyfikowanym uwalnianiu, 150 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Warstwa biała: laktoza jednowodna, skrobia pszeniczna, krzemionka uwodniona, żelatyna, magnezu stearynian. Warstwa żółta: hydroksyetyloceluloza, wapnia wodorofosforan dwuwodny, sól sodowa fosforanu ryboflawiny, magnezu stearynian. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania 2 lub 10 blistrów z folii Aluminium/PVC po 10 tabletek w blistrze w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Febrofen, 200 mg, kapsułki o przedłużonym uwalnianiu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka o przedłużonym uwalnianiu zawiera 200 mg ketoprofenu (Ketoprofenum). Substancja pomocnicza o znanym działaniu: sacharoza. Każda kapsułka zawiera 76 mg sacharozy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Kapsułka o przedłużonym uwalnianiu. Twarde żelatynowe kapsułki, rozmiar 1, o przejrzystym denku i różowym wieczku, zawierające białe lub prawie białe kuliste mikrogranulki.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgWskazania do stosowania
4.1 Wskazania do stosowania Objawowe leczenie przewlekłych zapalnych chorób reumatycznych, zwłaszcza reumatoidalnego zapalenia stawów. Objawowe leczenie ciężkich zmian zwyrodnieniowych stawów, jeśli niezbędna dawka wynosi 200 mg na dobę.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie W celu zmniejszenia ryzyka działań niepożądanych należy stosować najmniejszą skuteczną dawkę przez najkrótszy okres konieczny do złagodzenia objawów (patrz punkt 4.4). Dorośli Jedna kapsułka 200 mg raz na dobę Przed rozpoczęciem leczenia dawką 200 mg na dobę należy dokładnie rozważyć stosunek ryzyka do korzyści, a stosowanie większej dawki nie jest zalecane (patrz również punkt 4.4). Maksymalna dawka dobowa ketoprofenu wynosi 200 mg. W przypadku łagodnych zaburzeń żołądkowo-jelitowych, celowe może być stosowanie leków neutralizujących lub osłaniających błonę śluzową żołądka. Związki glinu o działaniu neutralizującym nie zmniejszają wchłaniania ketoprofenu. Dzieci i młodzież Dotychczas nie ustalono bezpieczeństwa stosowania ketoprofenu u dzieci. Nie należy stosować u pacjentów w wieku poniżej 15 lat. Pacjenci w podeszłym wieku U pacjentów w podeszłym wieku ryzyko wystąpienia ciężkich działań niepożądanych jest zwiększone.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgDawkowanie
Jeżeli zachodzi konieczność zastosowania leku z grupy niesteroidowych leków przeciwzapalnych (NLPZ), należy stosować najmniejszą skuteczną dawkę przez możliwie najkrótszy czas. W trakcie leczenia lekami z grupy NLPZ należy regularnie monitorować stan pacjenta, ze względu na możliwość wystąpienia krwawień z przewodu pokarmowego. Sposób podawania Podanie doustne. Kapsułkę należy przyjmować podczas posiłku. Kapsułkę należy połknąć w całości, popijając szklanką wody.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgPrzeciwwskazania
4.3 Przeciwwskazania Występujące u pacjenta w przeszłości reakcje nadwrażliwości, takie jak skurcz oskrzeli, napad astmy oskrzelowej, nieżyt nosa, obrzęk naczynioruchowy, pokrzywka lub innego rodzaju reakcje alergiczne wywołane podaniem ketoprofenu, kwasu acetylosalicylowego lub innych niesteroidowych leków przeciwzapalnych. U takich pacjentów notowano ciężkie, rzadko zakończone zgonem, przypadki reakcji anafilaktycznych (patrz punkt 4.8). Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Czynna choroba wrzodowa żołądka i (lub) dwunastnicy lub jakiekolwiek przypadki krwawienia z przewodu pokarmowego, owrzodzenia lub perforacji w wywiadzie. Ciężka niewydolność wątroby lub nerek. Trzeci trymestr ciąży. Ciężka niewydolność serca. Skaza krwotoczna.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Występowanie działań niepożądanych oraz ryzyko żołądkowo-jelitowe i sercowo-naczyniowe (patrz poniżej) można zminimalizować poprzez stosowanie możliwie najmniejszych skutecznych dawek przez możliwie najkrótszy czas konieczny do złagodzenia objawów (patrz także punkt 4.2). Należy unikać stosowania ketoprofenu jednocześnie z lekami z grupy NLPZ, w tym selektywnymi inhibitorami cyklooksygenazy-2 (COX-2) i salicylanami w dużych dawkach ze względu na możliwość zwiększenia działań niepożądanych (patrz punkt 4.5). Pacjenci w podeszłym wieku U pacjentów w podeszłym wieku odnotowano zwiększoną częstość występowania działań niepożądanych, będących wynikiem stosowania NLPZ, szczególnie krwawienia z przewodu pokarmowego i perforacji, które mogą być śmiertelne (patrz punkt 4.2).
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgSpecjalne środki ostrozności
Zaburzenia krążenia, zaburzenia czynności nerek i wątroby U pacjentów w podeszłym wieku, a także u pacjentów z niewydolnością serca lub zaburzeniami czynności wątroby, marskością wątroby, zespołem nerczycowym, przewlekłymi zaburzeniami czynności nerek oraz zaburzeniami gospodarki wodnej (np. odwodnienie w wyniku stosowania leków moczopędnych, hipowolemia po zabiegu chirurgicznym lub z innych przyczyn) ketoprofen, poprzez hamowanie syntezy prostaglandyn, może zaburzać czynność nerek (patrz punkt 4.3). W początkowym okresie leczenia u tych pacjentów niezbędne jest szczegółowe monitorowanie wielkości diurezy oraz innych wskaźników czynności nerek. Zaburzenie czynności nerek może prowadzić do obrzęków i zwiększenia stężenia azotu pozabiałkowego w surowicy. Stosowanie leków z grupy NLPZ może również powodować występującą w różnych postaciach nefrotoksyczność, co może prowadzić do śródmiąższowego zapalenia nerek, zespołu nerczycowego oraz niewydolności nerek.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgSpecjalne środki ostrozności
U pacjentów z nieprawidłowymi wynikami badań czynności wątroby lub z chorobami wątroby w wywiadzie konieczna jest okresowa kontrola aktywności aminotransferaz, zwłaszcza podczas długotrwałego leczenia. Zaleca się także indywidualne dostosowanie dawki. Podczas leczenia ketoprofenem opisywano rzadkie przypadki żółtaczki i zapalenia wątroby. Podczas długotrwałego leczenia ketoprofenem należy wykonywać badania wskaźników morfologii krwi oraz kontrolować wskaźniki czynności wątroby oraz nerek. Wpływ na układ krążenia i naczynia mózgowe Pacjentów z nadciśnieniem tętniczym i (lub) łagodną do umiarkowanej zastoinową niewydolnością serca w wywiadzie należy odpowiednio kontrolować i wydawać właściwe zalecenia, ponieważ w związku z leczeniem NLPZ zgłaszano zatrzymanie płynów i obrzęki. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych niesteroidowych leków przeciwzapalnych (szczególnie długotrwale i w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgSpecjalne środki ostrozności
zawał serca lub udar). Dane te są niewystarczające, aby wykluczyć takie ryzyko w przypadku przyjmowania ketoprofenu. Pacjenci z niekontrolowanym nadciśnieniem tętniczym, zastoinową niewydolnością serca, chorobą niedokrwienną serca, chorobą tętnic obwodowych lub chorobą naczyń mózgowych powinni być leczeni ketoprofenem bardzo rozważnie. Podobną rozwagę należy zachować przed rozpoczęciem długotrwałego leczenia pacjentów z czynnikami ryzyka chorób układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Zaburzenia oddychania U pacjentów z astmą oskrzelową oraz przewlekłym nieżytem nosa, przewlekłym zapaleniem zatok i (lub) polipowatością nosa występuje zwiększone ryzyko alergii na kwas acetylosalicylowy i (lub) inne leki z grupy NLPZ w stosunku do reszty populacji. Podanie ketoprofenu u tych pacjentów może wywołać napad astmy, skurcz oskrzeli, szczególnie u osób z nadwrażliwością na kwas acetylosalicylowy lub leki z grupy NLPZ (patrz punkt 4.3).
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgSpecjalne środki ostrozności
Krwawienia z przewodu pokarmowego, owrzodzenia, perforacja W przypadku wszystkich NLPZ opisywano występowanie krwawień z przewodu pokarmowego, owrzodzeń lub perforacji, mogących zakończyć się zgonem, które mogą wystąpić w dowolnym momencie leczenia, w tym również bez objawów zwiastunowych oraz ciężkich zdarzeń dotyczących przewodu pokarmowego w wywiadzie. Dane epidemiologiczne sugerują, że stosowanie ketoprofenu, zwłaszcza w dużych dawkach, może być związane z wyższym ryzykiem toksycznego wpływu na przewód pokarmowy, w stosunku do innych NLPZ (patrz punkt 4.2 i 4.3). Ryzyko krwawienia z przewodu pokarmowego, owrzodzenia lub perforacji jest zwiększone w przypadku stosowania większych dawek NLPZ, u pacjentów z owrzodzeniem przewodu pokarmowego w wywiadzie, szczególnie powikłanym krwawieniem lub perforacją (patrz punkt 4.3), oraz u pacjentów w podeszłym wieku. U tych pacjentów leczenie należy rozpoczynać od najmniejszej dostępnej dawki.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgSpecjalne środki ostrozności
U tych pacjentów, jak również u pacjentów wymagających jednoczesnego leczenia małymi dawkami kwasu acetylosalicylowego lub innymi lekami mogącymi zwiększać ryzyko zmian w obrębie przewodu pokarmowego (patrz punkt 4.5) należy rozważyć leczenie skojarzone z lekami osłonowymi (np. mizoprostol lub inhibitory pompy protonowej). Ketoprofen nie powienien być stosowany u pacjentów z chorobą wrzodową w wywiadzie (patrz punkt 4.3). Należy zachować ostrożność stosując leki z grupy NLPZ u pacjentów z chorobami przewodu pokarmowego w wywiadzie (zapaleniem żołądka, dwunastnicy, wrzodziejącym zapaleniem okrężnicy, chorobą Leśniowskiego-Crohna), ze względu na możliwość zaostrzenia objawów choroby (patrz punkt 4.8). Pacjenci z zaburzeniami przewodu pokarmowego w wywiadzie, szczególnie w podeszłym wieku, powinni informować lekarza o jakichkolwiek nietypowych objawach brzusznych (szczególnie o krwawieniach z przewodu pokarmowego) zwłaszcza na początku leczenia.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgSpecjalne środki ostrozności
Należy zachować ostrożność u pacjentów przyjmujących leki, które mogą zwiększać ryzyko owrzodzenia lub krwawienia z przewodu pokarmowego, takich jak doustne kortykosteroidy, leki przeciwzakrzepowe takie jak warfaryna, selektywne inhibitory zwrotnego wychwytu serotoniny lub leki przeciwpłytkowe, takie jak kwas acetylosalicylowy (patrz punkt 4.5). W przypadku wystąpienia krwawienia lub owrzodzenia w obrębie przewodu pokarmowego u pacjentów otrzymujących ketoprofen, produkt leczniczy należy odstawić. Toczeń rumieniowaty układowy i mieszana choroba tkanki łącznej Należy zachować ostrożność podczas stosowania produktu leczniczego u pacjentów z toczniem rumieniowatym układowym (SLE) oraz mieszaną chorobą tkanki łącznej. Istnieje podwyższone ryzyko wystąpienia aseptycznego zapalenia opon mózgowo-rdzeniowych (patrz punkt 4.8). Płodność u kobiet Stosowanie ketoprofenu może niekorzystnie wpływać na płodność u kobiet i nie jest zalecane u kobiet, które planują zajść w ciążę.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgSpecjalne środki ostrozności
W przypadku kobiet, które mają trudności z zajściem w ciążę lub które są poddawane badaniom w związku z niepłodnością, należy rozważyć zakończenie stosowania ketoprofenu. Reakcje skórne Pacjentów z reakcjami nadwrażliwości na światło słoneczne lub fototoksycznością w wywiadzie, należy dokładnie obserwować podczas podawania ketoprofenu. W związku ze stosowaniem leków z grupy NLPZ bardzo rzadko raportowano ciężkie reakcje skórne, niektóre z nich śmiertelne, włączając zapalenie skóry złuszczające, zespół Stevensa-Johnsona i zespół Lyella (patrz punkt 4.8). Największe ryzyko wystąpienia tych ciężkich reakcji występuje na początku leczenia, w większości przypadków w pierwszym miesiącu stosowania produktu leczniczego. Należy zaprzestać stosowania produktu leczniczego po wystąpieniu pierwszych objawów: wysypki skórnej, uszkodzenia błony śluzowej jamy ustnej lub innych objawów nadwrażliwości.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgSpecjalne środki ostrozności
Choroby zakaźne Podobnie jak inne NLPZ, ketoprofen może maskować zwykle występujące objawy rozwijającego się zakażenia (takie jak gorączka) na skutek swoich przeciwzapalnych, przeciwbólowych i przeciwgorączkowych właściwości. Zaburzenia widzenia W przypadku wystąpienia zaburzeń widzenia takich jak nieostre widzenie należy przerwać stosowanie produktu leczniczego. Maskowanie objawów zakażenia podstawowego Febrofen może maskować objawy zakażenia, co może prowadzić do opóźnionego rozpoczęcia stosowania właściwego leczenia, a przez to pogarszać skutki zakażenia. Zjawisko to zaobserwowano w przypadku pozaszpitalnego bakteryjnego zapalenia płuc i powikłań bakteryjnych ospy wietrznej. Jeśli Febrofen stosowany jest z powodu gorączki lub bólu związanych z zakażeniem, zaleca się kontrolowanie przebiegu zakażenia. W warunkach pozaszpitalnych pacjent powinien skonsultować się z lekarzem, jeśli objawy utrzymują się lub nasilają.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgSpecjalne środki ostrozności
Dzieci i młodzież Nie ustalono bezpieczeństwa stosowania ketoprofenu u dzieci. Nie należy stosować u pacjentów w wieku poniżej 15 lat. Specjalne ostrzeżenia dotyczące substancji pomocniczych Sacharoza Pacjenci z rzadkimi dziedzicznymi zaburzeniami związanymi z nietolerancją fruktozy, zespołem złego wchłaniania glukozy-galaktozy lub niedoborem sacharazy-izomaltazy, nie powinni przyjmować produktu leczniczego.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Leczenie skojarzone nie jest zalecane. Inne leki przeciwbólowe/NLPZ (w tym selektywne inhibitory cyklooksygenazy 2 – COX-2) i salicylany w dużych dawkach: Jednoczesne stosowanie dwóch lub większej liczby NLPZ (włącznie z kwasem acetylosalicylowym) może zwiększać ryzyko wystąpienia działań niepożądanych, zwłaszcza ryzyka owrzodzenia przewodu pokarmowego oraz krwawienia z przewodu pokarmowego (patrz punkt 4.4). Leki przeciwzakrzepowe (heparyna i warfaryna) oraz inhibitory agregacji płytek (tj. tyklopidyna, klopidogrel): Zwiększone ryzyko krwawienia (patrz punkt 4.4). Jeśli jednoczesne podawanie jest konieczne, należy uważnie kontrolować stan pacjenta. NLPZ mogą nasilać działanie leków przeciwzakrzepowych. Lit: Podobnie do innych leków z grupy NLPZ, ketoprofen zmniejsza wydalanie litu i może zwiększać jego stężenie w surowicy nawet do wartości toksycznych.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgInterakcje
Nie zaleca się jednoczesnego stosowania ketoprofenu z solami litu. Jeśli podawanie takie jest konieczne, należy monitorować stężenia litu w surowicy i odpowiednio modyfikować jego dawki podczas terapii NLPZ jak i po jej zakończeniu. Metotreksat (w dawkach większych niż 15 mg na tydzień): Podczas jednoczesnego stosowania wysokich dawek metotreksatu z NLPZ (również z ketoprofenem) odnotowano występowanie poważnych interakcji. Jednoczesne stosowanie metotreksatu w dużych dawkach (większych niż 15 mg na tydzień) powoduje zwiększone ryzyko toksyczności hematologicznej, które związane jest ze zwiększaniem stężenia metotreksatu w surowicy, prawdopodobnie wskutek wypierania go przez ketoprofen z połączeń z białkami surowicy i zmniejszeniem klirensu nerkowego metotreksatu. U pacjentów, którzy byli leczeni wcześniej ketoprofenem, należy odstawić ketoprofen przynajmniej 12 godzin przed podaniem metotreksatu; jeśli po zakończeniu terapii metotreksatem istnieje konieczność podania ketoprofenu, to również należy zachować 12-godzinny odstęp między zakończeniem leczenia metotreksatem, a podaniem ketoprofenu.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgInterakcje
Leczenie skojarzone wymagające ostrożności: Leki moczopędne: Ketoprofen zmniejsza działanie leków moczopędnych. U pacjentów (zwłaszcza odwodnionych) otrzymujących leki moczopędne istnieje zwiększone ryzyko rozwoju niewydolności nerek wtórnej do zmniejszenia przepływu nerkowego w wyniku zahamowania syntezy prostaglandyn. Pacjentów takich należy nawodnić przed rozpoczęciem leczenia skojarzonego i na początku leczenia kontrolować u nich czynność nerek (patrz punkt 4.4). Inhibitory ACE i antagoniści receptora angiotensyny II: U pacjentów z zaburzeniami czynności nerek (np. odwodnionych lub w podeszłym wieku) skojarzone stosowanie inhibitora ACE lub antagonisty angiotensyny II i leków hamujących aktywność cyklooksygenazy może spowodować dalsze pogorszenie czynności nerek, z możliwością wystąpienia ostrej niewydolności nerek.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgInterakcje
Metotreksat (w dawkach mniejszych niż 15 mg na tydzień): Podczas pierwszych tygodni jednoczesnego stosowania ketoprofenu i metotreksatu w dawkach mniejszych niż 15 mg na tydzień należy raz w tygodniu kontrolować pełną morfologię krwi. Badanie należy wykonywać częściej w razie stwierdzenia jakichkolwiek zmian czynności nerek lub jeśli pacjent jest w podeszłym wieku. Kortykosteroidy: Zwiększone ryzyko owrzodzenia oraz krwawienia z przewodu pokarmowego (patrz punkt 4.4). Pentoksyfilina: Podczas jednoczesnego stosowania z ketoprofenem występuje zwiększone ryzyko krwawienia. Należy obserwować pacjenta i monitorować czas krwawienia. Antybiotyki z grupy chinolonów: Dane z badań na zwierzętach wskazują, że przyjmowanie NLPZ może zwiększyć ryzyko wystąpienia drgawek związanych z przyjmowaniem antybiotyków z grupy chinolonów. U pacjentów stosujących jednocześnie NLPZ i antybiotyk z grupy chinolonów zwiększa się ryzyko wystąpienia drgawek.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgInterakcje
Skojarzone leczenie do rozważenia: Leki przeciwnadciśnieniowe (beta-adrenolityki, inhibitory konwertazy angiotensyny, leki moczopędne): Ryzyko słabszego działania przeciwnadciśnieniowego (hamowanie przez NLPZ syntezy prostaglandyn rozszerzających naczynia krwionośne). Leki trombolityczne: Zwiększone ryzyko krwawienia. Selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI): Zwiększone ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.4). Probenecyd: Jednoczesne stosowanie z ketoprofenem może znacznie zmniejszyć klirens osoczowy ketoprofenu. Cyklosporyna, takrolimus: Zwiększone ryzyko nefrotoksyczności, zwłaszcza u pacjentów w podeszłym wieku. Inne leki wywołujące hiperkaliemię (sole potasu, leki moczopędne, inhibitory konwertazy angiotensyny, antagoniści receptora angiotensyny II, inne NLPZ, heparyny (drobnocząsteczkowe lub niefrakcjonowane), cyklosporyna, takrolimus, trimetoprim): Ryzyko wystąpienia hiperkaliemi.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgInterakcje
Wystąpienie hiperkaliemi może zależeć od obecności czynników dodatkowych. Ryzyko wystąpienia hiperkaliemi zwiększa się, gdy wyżej wymienione leki stosowane są jednocześnie. Leki przeciwcukrzycowe: Podawanie ketoprofenu łącznie z doustnymi lekami przeciwcukrzycowymi może spowodować zwiększenie ich działania hipoglikemizującego. Glikozydy nasercowe: NLPZ mogą nasilać niewydolność serca, zmniejszyć wskaźnik przesączania kłębuszkowego i zwiększyć stężenie glikozydów nasercowych we krwi. Mifepryston: NLPZ mogą osłabiać działanie mifeprystonu. Po podaniu mifeprystonu należy odczekać od 8 do 12 dni przed zastosowaniem ketoprofenu. Domaciczne środki antykoncepcyjne: Ketoprofen może zmniejszyć skuteczność domacicznych środków antykoncepcyjnych. Zydowudyna: Jednoczesne przyjmowanie NLPZ z zydowudyną zwiększa ryzyko wystąpienia toksyczności hematologicznej.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgInterakcje
Udowodniono, że u chorych na hemofilię (z pozytywnym wynikiem testu na obecność wirusa HIV), którzy jednocześnie są leczeni zydowudyną i ibuprofenem ryzyko powstawania wylewów dostawowych i krwiaków jest zwiększone. Związki glinu o działaniu neutralizującym: Związki glinu o działaniu neutralizującym nie zmniejszają wchłaniania ketoprofenu.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może wpływać na przebieg ciąży i (lub) rozwój zarodka lub płodu. Z przeprowadzonych badań epidemiologicznych wynika, że podczas przyjmowania inhibitorów syntezy prostaglandyn w początkowym okresie ciąży, zwiększa się ryzyko poronienia, wystąpienia wad rozwojowych serca i przewodu pokarmowego płodu. Bezwzględne ryzyko wystąpienia wad układu sercowo-naczyniowego z <1% wzrosło do około 1,5%. Ryzyko to wzrasta wraz z dawką i czasem leczenia. Wykazano, że u zwierząt podanie inhibitora syntezy prostaglandyn powoduje zwiększenie częstości przed- i poimplantacyjnych strat ciąż oraz obumarcia zarodka i płodu. Przyjmowanie inhibitorów syntezy prostaglandyn w trakcie organogenezy płodu zwiększa częstość występowania różnych wad rozwojowych, wliczając w to wady układu sercowo-naczyniowego. Od 20. tygodnia ciąży stosowanie ketoprofenu może powodować małowodzie wskutek zaburzeń czynności nerek płodu.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgWpływ na płodność, ciążę i laktację
Może ono wystąpić krótko po rozpoczęciu leczenia i jest zwykle odwracalne po jego przerwaniu. Ponadto zgłaszano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze ciąży, z których większość ustąpiła po zaprzestaniu leczenia. W związku z tym, nie należy podawać ketoprofenu w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. Jeśli ketoprofen jest stosowany u kobiet planujących ciążę oraz w pierwszym i drugim trymestrze ciąży, należy stosować możliwie jak najmniejszą dawkę, a czas trwania leczenia powinien być jak najkrótszy. Należy rozważyć przedporodowe monitorowanie w kierunku małowodzia oraz zwężenia przewodu tętniczego po ekspozycji na ketoprofen przez kilka dni od 20. tygodnia ciąży. W przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego należy zaprzestać stosowania ketoprofenu.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgWpływ na płodność, ciążę i laktację
W trzecim trymestrze ciąży wszystkie inhibitory syntezy prostaglandyn mogą wywołać u płodu: toksyczne działanie na płuca i serce (przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne); zaburzenia czynności nerek (patrz powyżej); pod koniec ciąży u matki i noworodka: wydłużenie czasu krwawienia, działanie antyagregacyjne, które może wystąpić nawet przy bardzo małych dawkach; zahamowanie skurczów macicy skutkujące opóźnieniem lub przedłużeniem porodu. W związku z tym ketoprofen jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkt 4.3). Karmienie piersi? Brak dostępnych danych dotyczących przenikania ketoprofenu do mleka kobiecego. Nie zaleca się stosowania ketoprofenu u kobiet karmiących piersią. Płodność Istnieją pewne dowody, iż leki hamujące cyklooksygenazę (odpowiedzialną za syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet poprzez oddziaływanie na owulację.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgWpływ na płodność, ciążę i laktację
Działanie to jest przemijające po zakończeniu leczenia (patrz punkt 4.4).
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjentów należy ostrzec o potencjalnej możliwości wystąpienia senności, zawrotów głowy lub drgawek, zmęczenia i zaburzeń widzenia. W razie wystąpienia opisanych objawów nie należy prowadzić pojazdów ani obsługiwać maszyn.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane mogą występować z następującą częstością: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Następujące działania niepożądane notowano podczas stosowania ketoprofenu u osób dorosłych: Zaburzenia krwi i układu chłonnego Rzadko: anemia krwotoczna, anemia spowodowana krwawieniem, leukopenia z możliwą agranulocytozą; Częstość nieznana: agranulocytoza, trombocytopenia, zahamowanie czynności szpiku, neutropenia. Zaburzenia układu immunologicznego Rzadko: reakcje anafilaktyczne (w tym wstrząs anafilaktyczny). Zaburzenia psychiczne Częstość nieznana: zaburzenia nastroju, depresja, splątanie, halucynacje.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgDziałania niepożądane
Zaburzenia układu nerwowego Niezbyt często: bóle i zawroty głowy, senność; Rzadko: parestezje; Częstość nieznana: zapalenie nerwu wzrokowego, drgawki, zaburzenia smaku, zawroty głowy pochodzenia błędnikowego. Przypadki aseptycznego zapalenia opon mózgowych (zwłaszcza u pacjentów z chorobą autoimmunologiczną jak toczeń rumieniowaty układowy, mieszana choroba tkanki łącznej) z objawami, takimi jak sztywność karku, ból głowy, nudności, wymioty, gorączka lub uczucie dezorientacji (patrz punkt 4.4). Zaburzenia oka Rzadko: zaburzenia widzenia tj. niewyraźne widzenie (patrz punkt 4.4). Zaburzenia ucha i błędnika Rzadko: szumy uszne. Zaburzenia serca Częstość nieznana: niewydolność serca. Zaburzenia naczyniowe Częstość nieznana: rozszerzenie naczyń krwionośnych, nadciśnienie tętnicze.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgDziałania niepożądane
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Rzadko: astma oskrzelowa, napady astmatyczne; Częstość nieznana: skurcz oskrzeli (szczególnie u pacjentów z rozpoznaną nadwrażliwością na kwas acetylosalicylowy i inne niesteroidowe leki przeciwzapalne), duszność, niespecyficzne reakcje alergiczne. Zaburzenia żołądka i jelit Często: niestrawność, nudności, ból brzucha, wymioty; Niezbyt często: zaparcia, biegunka, wzdęcia, zapalenie błony śluzowej żołądka; Rzadko: zapalenia błony śluzowej jamy ustnej, choroba wrzodowa żołądka i (lub) dwunastnicy; Bardzo rzadko: zapalenia trzustki (odnotowano bardzo rzadkie przypadki zapalenia trzustki związane z przyjmowaniem NLPZ); Częstość nieznana: zaostrzenie zapalenia okrężnicy i choroby Leśniowskiego-Crohna, krwawienie z przewodu pokarmowego i jego perforacja (niekiedy ze skutkiem śmiertelnym szczególnie u osób w podeszłym wieku) (patrz punkt 4.4), ból brzucha, zgaga, smołowate stolce, krwawe wymioty.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgDziałania niepożądane
Najczęściej obserwowane objawy niepożądane dotyczą układu pokarmowego. Szczególnie u osób w podeszłym wieku mogą wystąpić wrzody żołądka, perforacja lub krwawienie z przewodu pokarmowego, czasem ze skutkiem śmiertelnym (patrz punkt 4.4). Ketoprofen podawany doustnie w dawce 200 mg na dobę zwiększa ryzyko wystąpienia krwawienia z przewodu pokarmowego, ryzyko zwiększa się wraz ze zwiększaniem dawki. Zaburzenia wątroby i dróg żółciowych Rzadko: zapalenie wątroby, zwiększenie aktywności aminotransferaz, zwiększenie stężenia bilirubiny w surowicy związane z zapaleniem wątroby; Częstość nieznana: zaburzenia czynności wątroby, żółtaczka. Zaburzenia skóry i tkanki podskórnej Niezbyt często: wysypka, świąd; Częstość nieznana: zaczerwienienie, nadwrażliwość na światło, wypadanie włosów, pokrzywka, wykwity pęcherzowe skóry, w tym zespół Stevensa-Johnsona oraz zespół Lyella, złuszczające i pęcherzowe choroby skórne (w tym martwica toksyczna rozpływna naskórka, rumień wielopostaciowy), plamica, obrzęk naczynioruchowy.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgDziałania niepożądane
Zaburzenia nerek i dróg moczowych Częstość nieznana: ostra niewydolność nerek (zwłaszcza u osób z istniejącymi wcześniej zaburzeniami czynności nerek i (lub) u pacjentów odwodnionych), śródmiąższowe zapalenie nerek, zespół nerczycowy, nieprawidłowe wyniki badań czynności nerek. Zaburzenia ogólne i stany w miejscu podania Niezbyt często: uczucie zmęczenia, obrzęki; Częstość nieznana: złe samopoczucie. Zakażenia i zarażenia pasożytnicze Częstość nieznana: nieżyt nosa. Badania diagnostyczne Rzadko: zwiększenie masy ciała; Częstość nieznana: hiperkaliemia (patrz punkt 4.5). Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale i w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np. zawał serca lub udar), patrz punkt 4.4. W każdym przypadku wystąpienia poważnych działań niepożądanych, należy natychmiast zaprzestać przyjmowania ketoprofenu.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgPrzedawkowanie
4.9 Przedawkowanie Opisywano przypadki przedawkowania ketoprofenu po zastosowaniu dawek do 2,5 g. W większości z nich objawy były łagodne i ograniczały się do letargu, senności, nudności, wymiotów i bólu w nadbrzuszu. Mogą również wystąpić ból głowy, rzadko biegunka, dezorientacja, ekscytacja, śpiączka, zawroty głowy, szumy uszne, omdlenie oraz sporadycznie drgawki. Należy spodziewać się obserwowanych po przyjmowaniu pochodnych kwasu propionowego działań niepożądanych tj. niedociśnienia tętniczego, skurczu oskrzeli i krwawienia z przewodu pokarmowego. W przypadku znacznego zatrucia możliwe jest wystąpienie ostrej niewydolności nerek i uszkodzenia wątroby. Postępowanie w przypadku podejrzenia znacznego przedawkowania: należy natychmiast odstawić produkt leczniczy. Jeżeli od przedawkowania produktu leczniczego nie upłynęła godzina, należy rozważyć płukanie żołądka i podanie węgla aktywowanego w ilości od 60 g do 100 g u osób dorosłych, od 1 g/kg mc. do 2 g/kg mc.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgPrzedawkowanie
u dzieci oraz rozpocząć leczenie objawowe i podtrzymujące czynności życiowe w celu nawodnienia pacjenta, kontroli wydalania moczu i wyrównania ewentualnej kwasicy. Wskazane może być zwiększenie diurezy. W przypadku wystąpienia niewydolności nerek można w celu usunięcia produktu leczniczego z krążenia zastosować hemodializę. Brak specyficznego antidotum. Z uwagi na wydłużony czas uwalniania kapsułek ketoprofenu, należy spodziewać się, że ketoprofen będzie wchłaniany nawet do 16 godzin po jego zażyciu. Należy wziąć pod uwagę potrzebę wyrównania poważnych zaburzeń elektrolitowych. Należy upewnić się, że pacjent wydala odpowiednią ilość moczu. Należy ściśle monitorować czynność nerek i wątroby. Pacjenci powinni znajdować się pod obserwacją przez co najmniej 4 godziny po zażyciu potencjalnie toksycznej dawki produktu leczniczego. Częste i przedłużające się napady drgawek należy leczyć za pomocą podawanego dożylnie diazepamu. Korzyści wynikające z dekontaminacji żołądka nie są pewne.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgPrzedawkowanie
W zależności od stanu pacjenta mogą zostać podjęte inne kroki.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu propionowego, kod ATC: M01AE03. Ketoprofen, pochodna kwasu fenylopropionowego, należy do grupy niesteroidowych leków o działaniu przeciwzapalnym, przeciwbólowym i przeciwgorączkowym. Mechanizm działania Mechanizm działania polega na hamowaniu cyklooksygenazy, enzymu odpowiedzialnego za syntezę prostaglandyn. Jest również antagonistą bradykininy. Hamuje syntezę leukotrienów, zmniejsza agregację płytek krwi, wywiera stabilizujący wpływ na błony otaczające lizosomy. Produkt leczniczy Febrofen 200 mg jest postacią charakteryzującą się kontrolowanym uwalnianiem substancji czynnej, określonym w jednostce czasu; uwalnianie substancji czynnej następuje w zasadowym środowisku jelita cienkiego.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Ketoprofen dobrze się wchłania z przewodu pokarmowego. Maksymalne stężenie we krwi po podaniu doustnym występuje po około 7 godzinach. Biodostępność ketoprofenu wynosi około 90%. Pokarm nie wpływa na biodostępność produktu leczniczego jednak zmniejsza szybkość wchłaniania i maksymalne stężenie produktu leczniczego we krwi. Leki neutralizujące nie wpływają na wchłanianie produktu leczniczego. Dystrybucja Ketoprofen jest w 99% związany z białkami osocza, głównie z albuminami. Ketoprofen przenika do płynu maziowego oraz przestrzeni stawowych: torebki stawowej, maziówki i tkanek ścięgnistych. Ketoprofen przenika również do płynu mózgowo-rdzeniowego oraz przez barierę łożyskową. Po wielokrotnym podaniu produktu leczniczego ketoprofen nie ulega kumulacji. Metabolizm Ketoprofen jest metabolizowany w wątrobie, głównie przez sprzęganie z kwasem glukuronowym i w niewielkim stopniu przez hydroksylację.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgWłaściwości farmakokinetyczne
Mniej niż 1% ketoprofenu jest wydalane w postaci niezmienionej. Zarówno ketoprofen jak i jego metabolity wydalane są głównie w moczu; wydalana tą drogą ilość metabolitu sprzężonego z kwasem glukuronowym wynosi około 65% do 85% podanej dawki. Eliminacja Po 5 dniach po podaniu doustnym dawki produktu leczniczego około 75% do 90% dawki ketoprofenu zostaje wydalone w moczu. Metabolity są nieaktywne farmakologicznie. Wydalanie z kałem wynosi od 1% do 8%. Szczególne grupy pacjentów Pacjenci w podeszłym wieku - wchłanianie ketoprofenu nie zmienia się; ulega wydłużeniu okres półtrwania leku oraz zmniejsza się klirens nerkowy i osoczowy. Pacjenci z niewydolnością nerek - zmniejsza się klirens nerkowy i osoczowy, a ulega wydłużeniu okres półtrwania leku, proporcjonalnie do ciężkości niewydolności nerek.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgWłaściwości farmakokinetyczne
Pacjenci z niewydolnością wątroby - nie ulega zmianie klirens osoczowy i okres półtrwania w fazie eliminacji; około dwukrotnie zwiększa się ilość produktu leczniczego nie związanego z białkami.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak danych.
- CHPL leku Febrofen, kapsułki o przedłużonym uwalnianiu, 200 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Makrogol 4000 Etyloceluloza Kwas stearynowy Amoniowego metakrylanu kopolimer (typ B) – Eudragit RS Szelak Talk Peletki neutralne (sacharoza, skrobia kukurydziana) Erytrozyna (E 127) Tytanu dwutlenek (E 171) Żelatyna 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. Chronić przed dostępem światła i wilgoci. 6.5 Rodzaj i zawartość opakowania Blistry z folii Aluminium/PVC. Wielkość opakowania: 20, 30, 60 lub 90 kapsułek w tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Ketonal, 25 mg/g (2,5%), żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram 2,5% żelu zawiera 25 mg ketoprofenu (Ketoprofenum). Substancja pomocnicza o znanym działaniu: 1 g żelu zawiera 271,32 mg etanolu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel. Jednorodny, przejrzysty żel o zapachu lawendy i alkoholu.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Wskazania do stosowania
4.1 Wskazania do stosowania Żel Ketonal jest niesteroidowym produktem leczniczym przeciwzapalnym, działającym miejscowo przeciwbólowo i przeciwzapalnie. Wskazaniami do stosowania żelu Ketonal są: ból okolicy lędźwiowo-krzyżowej, ból mięśni i ból reumatyczny, skręcenia i uszkodzenia powysiłkowe. ból mięśniowo-szkieletowy i obrzęk spowodowany urazami sportowymi. ból w zapaleniu stawów o nasileniu łagodnym do umiarkowanego.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Dawkowanie
4.2 Dawkowanie i sposób podawania Żel Ketonal przeznaczony jest do stosowania u osób dorosłych. Żel Ketonal jest produktem leczniczym do stosowania miejscowego na skórę. Dorośli i młodzież w wieku powyżej 15 lat: Stosować od 2 do 3 razy na dobę. Niewielką ilość żelu nanosić na skórę w obrębie bolesnego miejsca i wmasowywać przez kilka minut. Ilość użytego żelu zależy od powierzchni bolącego miejsca. Maksymalna dobowa dawka wynosi 15 g, co odpowiada 375 mg substancji czynnej – ketoprofenu (7,5 g odpowiada około 9 cm wyciśniętego paska żelu). Należy unikać kontaktu produktu z oczami i błonami śluzowymi. Nie zaleca się jednoczesnego stosowania opatrunków okluzyjnych (patrz punkt 4.3). Po każdym nałożeniu żelu należy niezwłocznie dokładnie umyć ręce. Jeśli po 7 dniach stosowania produktu leczniczego objawy nie ustąpią, nasilą się lub wystąpią nowe objawy, należy dokonać ponownej oceny stanu pacjenta.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Dawkowanie
Pacjenci w podeszłym wieku: Brak szczególnych zaleceń dotyczących dawkowania produktu u pacjentów w podeszłym wieku. Należy stosować najmniejszą dawkę skuteczną, gdyż pacjenci w podeszłym wieku są bardziej narażeni na występowanie działań niepożądanych. Dzieci: Nie ustalono bezpieczeństwa stosowania, skuteczności i dawkowania produktu leczniczego u dzieci.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Przeciwwskazania
4.3 Przeciwwskazania Znane reakcje nadwrażliwości (np. objawy astmy, alergiczne zapalenie błony śluzowej nosa, pokrzywka) po podaniu ketoprofenu, fenofibratu, kwasu tiaprofenowego, kwasu acetylosalicylowego lub innych niesteroidowych leków przeciwzapalnych. Nadwrażliwość na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Uszkodzenia lub chorobowe zmiany na skórze, takie jak wyprysk, trądzik, różne dermatozy, otwarte rany lub rany zakażone. Stosowanie opatrunku okluzyjnego. Trzeci trymestr ciąży. Reakcje nadwrażliwości na światło słoneczne w wywiadzie. Alergia skórna w wywiadzie po zastosowaniu ketoprofenu, kwasu tiaprofenowego, fenofibratu, filtrów UV lub perfum. Ekspozycja w trakcie leczenia na światło słoneczne (nawet wówczas, gdy niebo jest zachmurzone), a także na promienie UV w solarium i 2 tygodnie po zaprzestaniu stosowania produktu Ketonal. Nie stosować u dzieci w wieku poniżej 15 lat.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Stosowanie produktu leczniczego w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych. Nie należy przekraczać zalecanego czasu leczenia ze względu na zwiększające się z czasem ryzyko kontaktowego zapalenia skóry i reakcji nadwrażliwości na światło. Żelu Ketonal nie należy stosować na błony śluzowe (w tym okolice odbytu i narządów płciowych). Należy unikać kontaktu żelu z oczami lub okolicą oczu. Chociaż ogólnoustrojowe działania niepożądane ketoprofenu stosowanego miejscowo powinny być niewielkie, żel należy stosować ostrożnie u pacjentów z zaburzeniami czynności nerek, serca lub wątroby, chorobą wrzodową lub zapalną chorobą jelit w wywiadzie, krwotokiem mózgowym lub skłonnością do krwawień, gdyż opisywano pojedyncze przypadki ogólnoustrojowych działań niepożądanych. W razie rozwoju jakichkolwiek reakcji skórnych (np.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Specjalne środki ostrozności
wysypki), w tym reakcji skórnych po jednoczesnym zastosowaniu produktów zawierających oktokrylen, leczenie należy natychmiast przerwać. Miejscowe stosowanie ketoprofenu może wywołać u predysponowanych osób napad astmy. Duże ilości miejscowo stosowanego żelu mogą powodować działania ogólne, w tym reakcje nadwrażliwości i astmę. Po każdorazowym zastosowaniu produktu należy dokładnie umyć ręce. W trakcie leczenia i przez 2 tygodnie po zakończeniu stosowania produktu leczniczego zaleca się chronienie leczonych obszarów skóry przez noszenie odzieży, aby uniknąć ryzyka wystąpienia nadwrażliwości na światło słoneczne (patrz punkt 4.3). U pacjentów z astmą i przewlekłym zapaleniem błony śluzowej nosa, przewlekłym zapaleniem zatok i (lub) polipami nosa ryzyko uczulenia na kwas acetylosalicylowy i (lub) niesteroidowe leki przeciwzapalne (NLPZ) jest większe niż u reszty populacji. Dzieci Nie ustalono bezpieczeństwa stosowania i skuteczności ketoprofenu w żelu u dzieci.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Specjalne środki ostrozności
Specjalne ostrzeżenia dotyczące substancji pomocniczych Etanol Żel Ketonal zawiera około 4,07 g etanolu w maksymalnej dawce dobowej (15 g żelu), co jest równoważne około 271,32 mg etanolu w 1g żelu. Może powodować pieczenie uszkodzonej skóry.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Interakcje ketoprofenu zawartego w żelu z innymi produktami leczniczymi są mało prawdopodobne ze względu na niewielkie jego stężenie osiągane w surowicy po podaniu miejscowym. Wpływ ketoprofenu w żelu na wydalanie innych produktów leczniczych jest niewielki. Ketoprofen podawany ogólnie, tak jak inne niesteroidowe leki przeciwzapalne, zmniejsza wydalanie metotreksatu, powodując jego ciężką toksyczność. Z tego względu nie zaleca się jednoczesnego stosowania produktu z metotreksatem w dużych dawkach. Zaleca się kontrolowanie pacjentów otrzymujących pochodne kumaryny.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Wobec braku doświadczenia dotyczącego ketoprofenu w postaci żelu, poniżej przedstawiono dane odnoszące się do postaci podawanych ogólnie. Ciąża Nie ma danych klinicznych dotyczących stosowania w czasie ciąży produktu Ketonal w postaci do stosowania miejscowego. Nawet jeżeli narażenie ogólnoustrojowe jest mniejsze niż po podaniu doustnym, nie wiadomo, czy ogólnoustrojowy wpływ produktu Ketonal po podaniu miejscowym może być szkodliwy dla zarodka (płodu). W pierwszym i drugim trymestrze ciąży nie należy stosować produktu leczniczego Ketonal, chyba że jest to bezwzględnie konieczne. W takim przypadku zaleca się zastosowanie jak najmniejszej dawki przez jak najkrótszy okres leczenia. W trzecim trymestrze ciąży ogólnoustrojowe stosowanie inhibitorów syntetazy prostaglandyn, w tym produktu Ketonal, może u płodu działać szkodliwie na płuca, serce i nerki.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Wpływ na płodność, ciążę i laktację
Pod koniec ciąży może wystąpić wydłużony czas krwawienia zarówno u matki, jak i u dziecka, a poród może się opóźnić. Z tego powodu stosowanie produktu Ketonal jest przeciwwskazane w ostatnim trymestrze ciąży (patrz punkt 4.3). Pierwszy i drugi trymestr Nie oceniano bezpieczeństwa stosowania ketoprofenu w okresie ciąży, dlatego należy unikać jego stosowania w dwóch pierwszych trymestrach ciąży. Trzeci trymestr Wszystkie inhibitory syntezy prostaglandyn (w tym ketoprofen) stosowane w trzecim trymestrze ciąży mogą być przyczyną toksycznego działania na serce, układ oddechowy i czynność nerek płodu. Podawane pod koniec ciąży mogą spowodować u matki i noworodka wydłużenie czasu krwawienia. NLPZ mogą również opóźnić poród. Stosowanie ketoprofenu w III trymestrze ciąży jest przeciwwskazane (patrz punkt 4.3). Karmienie piersi? Brak dostępnych danych dotyczących przenikania ketoprofenu do mleka kobiecego. Nie zaleca się stosowania żelu Ketonal w okresie karmienia piersią.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie jest znany wpływ żelu Ketonal na sprawność umysłową i (lub) fizyczną pacjentów oraz na zdolność kierowania pojazdami i obsługiwania maszyn.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Działania niepożądane
4.8 Działania niepożądane Najczęściej występujące działania niepożądane związane ze stosowaniem ketoprofenu w żelu mają charakter miejscowy. Klasyfikacja działań niepożądanych według konwencji MedDRA i częstości: bardzo często (≥1/10); często (≥1/100, <1/10); niezbyt często (≥1/1000, <1/100); rzadko (≥1/10 000, < 1/1000); bardzo rzadko (<1/10 000); częstość nieznana (częstość nie może być określona na podstawie dostępnych danych); Zaburzenia układu immunologicznego Częstość nieznana: wstrząs anafilaktyczny, obrzęk naczynioruchowy, reakcje nadwrażliwości. Istnieją pojedyncze doniesienia o występowaniu reakcji anafilaktycznych. Zaburzenia skóry i tkanki podskórnej Niezbyt często: miejscowe reakcje skórne, takie jak rumień, wyprysk, świąd, odczucie pieczenia i łagodne, przemijające zapalenie skóry.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Działania niepożądane
Rzadko: nadwrażliwość na światło, wysypka, pokrzywka, ciężkie reakcje, takie jak wyprysk pęcherzowy lub pryszczykowaty, które mogą się rozprzestrzeniać lub być uogólnione. Bardzo rzadko: jeden przypadek ciężkiego kontaktowego zapalenia skóry wywołanego brakiem higieny i ekspozycją na światło słoneczne i jeden przypadek ciężkiej, rozsianej, długotrwałej reakcji fotoalergicznej. Czasami nawet jednorazowe zastosowanie ketoprofenu może spowodować długotrwałą nadwrażliwość na światło. Opisano występowanie toksycznego martwiczego oddzielania się naskórka. Zaburzenia nerek i dróg moczowych Bardzo rzadko: nasilenie przewlekłej niewydolności nerek. Miejscowo stosowane niesteroidowe leki przeciwzapalne mogą wywołać śródmiąższowe zapalenie nerek. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Działania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa tel.: + 48 22 49 21 301/faks: + 48 22 49 21 309/e-mail: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Przedawkowanie
4.9 Przedawkowanie Przedawkowanie ketoprofenu po zastosowaniu miejscowym jest mało prawdopodobne. Jeśli żel z ketoprofenem zostanie nieumyślnie spożyty, mogą wystąpić ogólnoustrojowe działania niepożądane, których zakres i nasilenie zależą od ilości przyjętego doustnie produktu leczniczego. W razie ich wystąpienia należy zastosować leczenie objawowe i wspomagające właściwe dla przedawkowania niesteroidowych leków przeciwzapalnych.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne do stosowania miejscowego w bólach stawów i mięśni. Kod ATC: M02AA10 Ketoprofen jest inhibitorem cyklooksygenazy. Hamuje także aktywność lipooksygenazy i syntezę bradykininy. Stabilizuje błony lizosomalne, zapobiegając w ten sposób uwalnianiu enzymów biorących udział w procesie zapalnym. Właściwości farmakodynamiczne ketoprofenu i jego działanie są podobne do wykazywanych przez inne niesteroidowe leki przeciwzapalne. Ketoprofen działa przeciwbólowo, przeciwzapalnie i przeciwgorączkowo, co udowodniono w badaniach na zwierzętach i licznych badaniach klinicznych u ludzi.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Ketoprofen stosowany miejscowo w postaci żelu wchłania się bardzo wolno i nie kumuluje w organizmie. Jego biodostępność ustrojowa po podaniu miejscowym stanowi około 5% biodostępności produktu podanego doustnie. Mała biodostępność ustrojowa wskazuje, że działanie ogólnoustrojowe jest mało prawdopodobne.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, uwzględniające wyniki konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości i toksycznego wpływu na reprodukcję nie ujawniają występowania szczególnego zagrożenia dla ludzi. Wszystkie istotne informacje zawarte zostały w innych punktach Charakterystyki Produktu Leczniczego.
- CHPL leku Ketonal, Żel, 25 mg/g (2,5%)Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Karbomer Trolamina Etanol 96% Esencja lawendowa Woda oczyszczona 6.2 Niezgodności farmaceutyczne Brak 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Tuba Al wewnątrz lakierowana z membraną oraz zakrętką PE, w tekturowym pudełku, zawierająca 50 g lub 100 g żelu. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Dexak 50 50 mg/2ml roztwór do wstrzykiwań lub infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda 2 ml ampułka zawiera: deksketoprofen 50 mg (w postaci soli deksketoprofenu z trometamolem). Każdy 1 ml roztworu do wstrzykiwań zawiera: deksketoprofen 25 mg (w postaci soli deksketoprofenu z trometamolem). Substancje pomocnicze o znanym działaniu: Każda 2 ml ampułka zawiera 200 mg etanolu (96 %). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań lub infuzji. Przezroczysty i bezbarwny roztwór. pH (7,0 – 8,0) Osmolarność (270 – 328 mOsmol/l)
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgWskazania do stosowania
4.1. Wskazania do stosowania Objawowe leczenie ostrego bólu o nasileniu umiarkowanym do ciężkiego gdy doustne podawanie nie jest odpowiednie np. bólu pooperacyjnego, bólu w przebiegu kolki nerkowej i bólu okolicy lędźwiowo-krzyżowej.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgDawkowanie
4.2. Dawkowanie i sposób podawania Dawkowanie Dorośli: Zalecana dawka wynosi 50 mg co 8 do 12 godzin. Jeżeli jest to konieczne, podawanie można powtarzać co 6 godzin. Nie należy stosować całkowitej dawki dobowej większej niż 150 mg. Produkt leczniczy Dexak 50 roztwór do wstrzykiwań lub infuzji jest przeznaczony do krótkotrwałego stosowania, a leczenie należy ograniczyć do okresu występowania ostrych objawów (nie dłużej niż 2 doby). U pacjentów należy wprowadzić leczenie doustnymi lekami przeciwbólowymi, gdy tylko jest to możliwe. Przyjmowanie produktu leczniczego w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.4). W przypadku bólu pooperacyjnego o nasileniu umiarkowanym do ciężkiego produkt leczniczy Dexak 50 roztwór do wstrzykiwań lub infuzji może być stosowany jednocześnie z opioidowymi lekami przeciwbólowymi, jeżeli istnieją wskazania, w takich samych zalecanych dawkach u dorosłych (patrz punkt 5.1).
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgDawkowanie
Osoby w podeszłym wieku: U osób w podeszłym wieku modyfikacja dawki nie jest konieczna. Jednakże ze względu na fizjologiczne zmniejszenie czynności nerek u pacjentów w podeszłym wieku, w przypadku łagodnych zaburzeń czynności nerek zalecana jest mniejsza dawka produktu leczniczego: całkowita dawka dobowa 50 mg (patrz punkt 4.4). Zaburzenia czynności wątroby: U pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności wątroby (wskaźnik Child-Pugh 5 do 9) dawkę produktu leczniczego należy zmniejszyć do całkowitej dawki dobowej 50 mg a czynność wątroby należy starannie monitorować (patrz punkt 4.4). Dexak 50 roztwór do wstrzykiwań lub infuzji nie powinien być stosowany u pacjentów z ciężkimi zaburzeniami czynności wątroby (wskaźnik Child – Pugh 10 do 15) (patrz punkt 4.3). Zaburzenia czynności nerek: U pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny 60 do 89 ml/min) dawkowanie należy zmniejszyć do całkowitej dawki dobowej 50 mg (patrz punkt 4.4).
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgDawkowanie
Dexak 50 roztwór do wstrzykiwań lub infuzji nie należy stosować u pacjentów z umiarkowanymi i ciężkimi zaburzeniami czynności nerek (klirens kreatyniny ≤ 59 ml / min) (patrz punkt 4.3). Dzieci i młodzież: Nie badano stosowania produktu leczniczego Dexak 50 roztwór do wstrzykiwań lub infuzji u dzieci i młodzieży. Dlatego też nie ustalono bezpieczeństwa stosowania i skuteczności u dzieci i młodzieży, produktu nie należy stosować u dzieci i młodzieży. Sposób podawania: Produkt leczniczy Dexak 50 roztwór do wstrzykiwań lub infuzji może być podawany domięśniowo lub dożylnie: Podawanie domięśniowe: zawartość 1 ampułki (2 ml) Dexak 50 roztworu do wstrzykiwań lub infuzji należy podawać w powolnym wstrzyknięciu głęboko w mięsień. Podawanie dożylne: Infuzja dożylna: rozcieńczony roztwór, przygotowany, jak opisano w punkcie 6.6, należy podawać w postaci powolnej infuzji dożylnej, trwającej od 10 do 30 minut. Roztwór należy zawsze chronić przed światłem dziennym.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgDawkowanie
Bolus dożylny: w razie konieczności zawartość 1 ampułki (2 ml) Dexak 50 roztworu do wstrzykiwań lub infuzji można podać w powolnym bolusie dożylnym, nie krócej niż przez 15 sekund. Instrukcja dotycząca postępowania z produktem leczniczym: Podczas podawania produktu leczniczego Dexak 50 domięśniowo lub w postaci dożylnego bolusa, roztwór należy wstrzykiwać niezwłocznie po pobraniu z barwionej ampułki (patrz także punkt 6.2 i 6.6). W przypadku podawania w postaci wlewu dożylnego roztwór należy rozcieńczyć w warunkach aseptycznych i chronić przed dziennym światłem (patrz także punkt 6.3 i 6.6). Instrukcja dotycząca rozcieńczania produktu leczniczego przed podaniem, patrz punkt 6.6.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgPrzeciwwskazania
4.3. Przeciwwskazania Nie wolno stosować produktu leczniczego Dexak 50 roztwór do wstrzykiwań lub infuzji w następujących przypadkach: nadwrażliwość na substancję czynną, inne leki z grupy niesteroidowych leków przeciwzapalnych (NLPZ) lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; u pacjentów, u których substancje o podobnym mechanizmie działania (np. kwas acetylosalicylowy lub inne NLPZ) wywołują napad astmy, skurcz oskrzeli, ostry nieżyt błony śluzowej nosa lub powodują wystąpienie polipów nosa, pokrzywki lub obrzęku naczynioruchowego; u pacjentów z reakcjami fotoalergicznymi lub fototoksycznymi podczas stosowania ketoprofenu lub fibratów w wywiadzie; u pacjentów, u których w wywiadzie stwierdzono krwawienie z przewodu pokarmowego lub perforację, związane z wcześniejszym leczeniem NLPZ; u pacjentów z czynną chorobą wrzodową żołądka lub krwawieniem lub ich podejrzeniem, jak również wywiadem krwawienia z przewodu pokarmowego lub perforacji; u pacjentów z przewlekłą niestrawnością; u pacjentów, u których występuje inne czynne krwawienie lub zaburzenia przebiegające z krwawieniami; u pacjentów z chorobą Leśniowskiego-Crohna lub wrzodziejącym zapaleniem jelita grubego; u pacjentów z ciężką niewydolnością serca; u pacjentów z umiarkowaną lub ciężką niewydolnością nerek (klirens kreatyniny ≤59 ml/min); u pacjentów z ciężkimi zaburzeniami czynności wątroby (wskaźnik Child-Pugh 10 do 15); u pacjentów ciężko odwodnionych (z powodu wymiotów, biegunki lub przyjmowania niedostatecznej ilości płynów); u pacjentów ze skazą krwotoczną i innymi zaburzeniami krzepnięcia; u kobiet w trzecim trymestrze ciąży i w okresie laktacji (patrz punkt 4.6).
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgPrzeciwwskazania
Centralne (dokanałowe lub nadtwardówkowe) podawanie produktu leczniczego Dexak 50 roztwór do wstrzykiwań lub infuzji jest przeciwwskazane ze względu na zawartość etanolu w produkcie.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt leczniczy należy podawać ostrożnie pacjentom z alergią w wywiadzie. Należy unikać jednoczesnego stosowania produktu leczniczego Dexak 50 z innymi lekami z grupy NLPZ w tym selektywnymi inhibitorami cyklooksygenazy-2. Przyjmowanie leku w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz wpływ na przewód pokarmowy i układ krążenia poniżej). Wpływ na bezpieczeństwo stosowania dotyczące przewodu pokarmowego Dla wszystkich leków z grupy NLPZ istnieją doniesienia o spowodowaniu wystąpienia krwawienia z przewodu pokarmowego, owrzodzenia lub perforacji ze skutkiem śmiertelnym. Mogą one występować w dowolnym okresie leczenia, z objawami ostrzegawczymi lub bez jak również bez wcześniejszego wywiadu dotyczącego ciężkich objawów dotyczących przewodu pokarmowego.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
W przypadku wystąpienia krwawienia z przewodu pokarmowego lub owrzodzenia u pacjentów przyjmujących Dexak 50, produkt należy odstawić. U pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie, szczególnie w połączeniu z krwawieniem lub perforacją (patrz punkt 4.3) oraz u osób w podeszłym wieku, ryzyko krwawienia z przewodu pokarmowego, owrzodzenia lub perforacji jest zwiększone podczas przyjmowania dużych dawek NLPZ. Tacy pacjenci powinni rozpoczynać leczenie od możliwie najmniejszej dostępnej dawki. Tak jak w przypadku wszystkich leków z grupy NLPZ, przed rozpoczęciem leczenia trometamolem deksketoprofenu należy zebrać wywiad dotyczący zapalenia przełyku, zapalenia błony śluzowej żołądka i (lub) choroby wrzodowej żołądka, aby upewnić się, że zostały całkowicie wyleczone. Pacjentów z objawami dotyczącymi żołądka i jelit lub zaburzeniami żołądka i jelit w wywiadzie należy kontrolować pod względem zaburzeń żołądkowo-jelitowych, szczególnie pod względem krwawienia z przewodu pokarmowego.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Leki z grupy NLPZ należy podawać ostrożnie pacjentom z chorobami przewodu pokarmowego (wrzodziejące zapalenie okrężnicy, choroba Leśniowskiego-Crohna) w wywiadzie, ponieważ stan pacjentów może ulec pogorszeniu (patrz punkt 4.8). W przypadku tych pacjentów oraz pacjentów wymagających równoczesnego podawania małych dawek kwasu acetylosalicylowego lub innych leków zwiększających prawdopodobieństwo ryzyka zaburzeń żołądka i jelit (patrz poniżej oraz punkt 4.5) należy rozważyć jednoczesne stosowanie produktu leczniczego Dexak 50 z innymi lekami o ochronnym mechanizmie działania (np. mizoprostolem lub inhibitorami pompy protonowej). Pacjenci z działaniami niepożądanymi dotyczącymi układu pokarmowego w wywiadzie, szczególnie pacjenci w podeszłym wieku, powinni zgłaszać każde niepokojące objawy brzuszne (szczególnie krwawienie z przewodu pokarmowego) przede wszystkim w początkowej fazie leczenia.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Zaleca się zachowanie ostrożności u pacjentów otrzymujących równocześnie leki mogące zwiększać ryzyko wystąpienia owrzodzenia lub krwawienia, takich jak: doustne leki antykoncepcyjne, leki przeciwzakrzepowe takie jak warfaryna, selektywne inhibitory wychwytu zwrotnego serotoniny lub leki antyagregacyjne takie jak kwas acetylosalicylowy (patrz punkt 4.5). Wpływ na bezpieczeństwo stosowania dotyczące nerek Należy zachować ostrożność w przypadku pacjentów z zaburzeniami czynności nerek. U tych pacjentów stosowanie leków z grupy NLPZ może prowadzić do pogorszenia czynności nerek, zatrzymania płynów i obrzęków. Należy również zachować ostrożność w przypadku pacjentów otrzymujących leki moczopędne lub u pacjentów zagrożonych hipowolemią gdyż w takich przypadkach istnieje zwiększone ryzyko wystąpienia działań nefrotoksycznych. Podczas leczenia należy przyjmować odpowiednią ilość płynów aby zapobiec odwodnieniu i związanym z tym zwiększeniem nefrotoksyczności.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Tak jak wszystkie leki z grupy NLPZ, ten produkt leczniczy może prowadzić do zwiększenia w osoczu stężenia azotu mocznikowego i kreatyniny. Tak jak w przypadku innych inhibitorów syntezy prostaglandyn, niepożądane działania mogą dotyczyć nerek i mogą prowadzić do kłębuszkowego zapalenia nerek, śródmiąższowego zapalenia nerek, martwicy brodawek nerkowych, zespołu nerczycowego i ostrej niewydolności nerek. U pacjentów w podeszłym wieku istnieje większe prawdopodobieństwo występowania zaburzeń czynności nerek (patrz punkt 4.2). Wpływ na bezpieczeństwo stosowania dotyczące wątroby W przypadku pacjentów z uszkodzeniem czynności wątroby należy zachować ostrożność. Tak jak inne NLPZ ten produkt leczniczy może powodować przemijające niewielkie zwiększenie niektórych wskaźników czynności wątroby, a także znaczące zwiększenie aktywności AspAT i AlAT. W przypadku wystąpienia istotnego zwiększenia wartości tych wskaźników należy przerwać leczenie tym produktem leczniczym.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
U pacjentów w podeszłym wieku istnieje większe prawdopodobieństwo występowania zaburzeń czynności wątroby (patrz punkt 4.2). Wpływ na układ krążenia i naczynia mózgowe Pacjentów z nadciśnieniem tętniczym w wywiadzie i (lub) łagodną do umiarkowanej niewydolnością serca w wywiadzie należy odpowiednio kontrolować i wydawać właściwe zalecenia. Szczególną ostrożność należy zachować u pacjentów z chorobami serca w wywiadzie, w szczególności u tych, u których wcześniej stwierdzono niewydolność serca, gdyż występuje u nich podwyższone ryzyko nasilenia objawów niewydolności serca gdyż odnotowano przypadki zatrzymania płynów i obrzęków związanych z leczeniem NLPZ. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych leków z grupy NLPZ (szczególnie w dużych dawkach i przez długi okres czasu) może być związane z niewielkim zwiększeniem ryzyka zdarzeń zakrzepowych tętnic (np. zawał serca lub udar).
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Brak wystarczających danych, aby wykluczyć takie ryzyko dla deksketoprofenu. W związku z powyższym, pacjenci z niekontrolowanym nadciśnieniem tętniczym, zastoinową niewydolnością serca, chorobą niedokrwienną serca, chorobą tętnic obwodowych i (lub) chorobą naczyń mózgowych powinni być leczeni deksketoprofenem bardzo rozważnie. Podobną rozwagę należy zachować przed rozpoczęciem długotrwałego leczenia pacjentów z czynnikami ryzyka chorób układu krążenia (np. nadciśnienie tętnicze, hiperlipidemią, cukrzycą, palenie tytoniu). Wszystkie nieselektywne leki z grupy NLPZ mogą hamować agregację płytek i wydłużać czas krwawienia przez hamowanie syntezy prostaglandyn. Równoczesne stosowanie deksketoprofenu i heparyny drobnocząsteczkowej w dawkach profilaktycznych w okresie pooperacyjnym było oceniane w kontrolowanych badaniach klinicznych i nie zaobserwowano zmian parametrów krzepnięcia.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Dlatego nie zaleca się stosowania deksketoprofenu u pacjentów otrzymujących inne leki, które wpływają na hemostazę, takie jak warfaryna i inne pochodne kumaryny lub heparyny (patrz punkt 4.5). Reakcje skórne Po podaniu NLPZ zgłaszano w bardzo rzadkich przypadkach występowanie ciężkich reakcji skórnych (niektóre z nich śmiertelne), włączając złuszczające zapalenie skóry, zespół Stevens-Johnsona i toksyczne martwicze oddzielanie się naskórka. Wydaje się, iż większe ryzyko wystąpienia tych reakcji u pacjentów związane jest z początkowym okresem leczenia, w większości przypadków objawy te wystąpiły w ciągu pierwszego miesiąca od rozpoczęcia leczenia. Produkt leczniczy Dexak 50 roztwór do wstrzykiwań lub infuzji należy odstawić natychmiast po pojawieniu się pierwszych objawów wysypki skórnej, zmian błon śluzowych lub jakiegokolwiek innego objawu nadwrażliwości.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Maskowanie objawów zakażenia podstawowego Deksketoprofen może maskować objawy zakażenia, co może prowadzić do opóźnionego rozpoczęcia stosowania właściwego leczenia, a przez to pogarszać skutki zakażenia. Zjawisko to zaobserwowano w przypadku pozaszpitalnego bakteryjnego zapalenia płuc i powikłań bakteryjnych ospy wietrznej. Jeśli ten lek stosowany jest z powodu bólu związanego z zakażeniem, zaleca się kontrolowanie przebiegu zakażenia. W warunkach pozaszpitalnych pacjent powinien skonsultować się z lekarzem, jeśli objawy utrzymują się lub nasilają. W wyjątkowych przypadkach, ospa wietrzna może być przyczyną powikłań prowadzących do ciężkich infekcji skóry i tkanek miękkich. W związku z tym, że nie można wykluczyć wpływu leków z grupy NLPZ na pogorszenie przebiegu tych infekcji zaleca się unikanie stosowania produktu Dexak 50 w przypadku ospy wietrznej.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Inne informacje Szczególną ostrożność należy zachować w przypadku pacjentów z: wrodzonymi zaburzeniami metabolizmu porfiryn (ostra porfiria przerywana); odwodnieniem; bezpośrednio po dużych zabiegach chirurgicznych. Jeżeli w opinii lekarza konieczne jest długotrwałe stosowanie produktu leczniczego, wymagane jest regularne kontrolowanie wskaźników czynności wątroby, czynności nerek oraz morfologii krwi. Ciężkie i ostre reakcje nadwrażliwości (np. wstrząs anafilaktyczny) obserwuje się bardzo rzadko. Po wystąpieniu pierwszych objawów nadwrażliwości po podaniu produktu leczniczego Dexak 50, należy przerwać stosowanie produktu leczniczego. Właściwe leczenie, odpowiednie do objawów, powinno zostać zastosowane przez personel medyczny. U pacjentów z astmą oraz przewlekłym nieżytem nosa, przewlekłym zapaleniem zatok i (lub) polipami nosa, ryzyko wystąpienia uczulenia na kwas acetylosalicylowy i (lub) leki z grupy NLPZ jest wyższe niż u reszty populacji.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Podanie tego leku może spowodować wystąpienie ataków astmy lub skurcz oskrzeli, szczególnie u pacjentów z uczuleniem na kwas acetylosalicylowy i (lub) leki z grupy NLPZ (patrz punkt 4.3). Dexak 50 roztwór do wstrzykiwań lub infuzji należy podawać ostrożnie pacjentom z zaburzeniami hematopoezy, układowym toczniem rumieniowatym i mieszaną chorobą tkanki łącznej. W pojedynczych przypadkach opisywano zwiększone nasilenie objawów zakażenia tkanki łącznej pozostające w czasowym związku z zastosowaniem NLPZ. Dlatego zaleca się, aby w przypadku pojawienia się lub pogorszenia objawów zakażenia bakteryjnego podczas leczenia, pacjent niezwłocznie skonsultował się z lekarzem. Ten produkt leczniczy zawiera 200 mg alkoholu (etanolu) w każdej 2 ml ampułce, co jest równoważne 3 mg /kg/ dawkę (10% w/v). Ilość alkoholu w jednej ampułce (2 ml) tego leku jest równoważna mniej niż 5 ml piwa lub 2 ml wina. Mała ilość alkoholu w tym leku nie będzie powodowała zauważalnych skutków.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) na dawkę, co oznacza, iż można go oznaczyć jako „niezawierający sodu”. Dzieci i młodzież Bezpieczeństwo stosowania produktu leczniczego u dzieci i młodzieży nie zostało ustalone.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Następujące interakcje dotyczą całej grupy niesteroidowych leków przeciwzapalnych (NLPZ): Nie należy jednocześnie stosować: Inne NLPZ (w tym selektywne inhibitory cyklooksygenazy2) i duże dawki salicylanów ( 3 g/dobę): jednoczesne podawanie kilku NLPZ może poprzez działanie synergistyczne zwiększać ryzyko wystąpienia choroby wrzodowej żołądka i (lub) dwunastnicy oraz krwawienia z przewodu pokarmowego. Leki przeciwzakrzepowe: NLPZ mogą zwiększać działanie leków przeciwzakrzepowych, takich jak warfaryna (patrz punkt 4.4), ze względu na wysoki stopień wiązania deksketoprofenu z białkami osocza i hamowanie czynności płytek oraz uszkodzenie błony śluzowej żołądka i (lub) dwunastnicy. Jeżeli konieczne jest stosowanie takiego połączenia leków, należy prowadzić dokładną obserwację kliniczną i monitorowanie wyników badań laboratoryjnych.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
Heparyny: zwiększone ryzyko krwotoku (ze względu na hamowanie czynności płytek i uszkodzenie błony śluzowej żołądka i (lub) dwunastnicy). Jeżeli nie można uniknąć stosowania takiego połączenia, należy prowadzić staranną obserwację kliniczną i monitorowanie wyników badań laboratoryjnych. Kortykosteroidy: zwiększone ryzyko wystąpienia owrzodzenia przewodu pokarmowego oraz krwawienia (patrz punkt 4.4). Sole litu (interakcje opisywane dla kilku NLPZ): NLPZ zwiększają stężenie litu we krwi, które może osiągnąć wartości toksyczne (zmniejszone wydalanie litu przez nerki). Z tego powodu ten wskaźnik wymaga monitorowania na początku, podczas modyfikacji i przerwania leczenia deksketoprofenem. Metotreksat, stosowany w dużych dawkach 15 mg/tydzień lub większych: zwiększone działanie toksyczne metotreksatu na układ krwiotwórczy w wyniku zmniejszenia klirensu nerkowego metotreksatu przez niesteroidowe leki przeciwzapalne.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
Pochodne hydantoin i sulfonamidy: może nastąpić zwiększenie działania toksycznego tych substancji. Jednoczesne stosowanie wymagające zachowania środków ostrożności: Leki moczopędne, ACE inhibitory, antybiotyki aminoglikozydowe i antagoniści receptora angiotensyny II: deksketoprofen może zmniejszać działanie leków moczopędnych i leków hipotensyjnych. U niektórych pacjentów z zaburzeniami czynności nerek (np. pacjentów odwodnionych lub pacjentów w podeszłym wieku z zaburzeniami czynności nerek) jednoczesne podawanie leków hamujących cyklooksygenazę i ACE inhibitorów, antagonistów receptora angiotensyny II lub antybiotyków aminoglikozydowych może prowadzić do dodatkowego pogorszenia czynności nerek, które zazwyczaj jest przemijające. W przypadku jednoczesnego podawania deksketoprofenu i leku moczopędnego kluczowe jest zapewnienie odpowiedniego nawodnienia pacjenta i kontrola czynności nerek na początku leczenia (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania).
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
Metotreksat stosowany w małych dawkach, mniejszych niż 15 mg/tydzień: zwiększone działanie toksyczne metotreksatu na układ krwiotwórczy w wyniku zmniejszenia klirensu nerkowego przez niesteroidowe leki przeciwzapalne. Konieczna jest cotygodniowa kontrola wskaźników morfologii krwi podczas pierwszych tygodni stosowania skojarzonego. Należy zachować szczególną ostrożność w przypadku zaburzeń czynności nerek nawet jeśli są łagodne oraz u pacjentów w podeszłym wieku. Pentoksyfilina: zwiększone ryzyko krwawienia. Należy prowadzić dokładną obserwację kliniczną i częściej kontrolować czas krwawienia. Zydowudyna: ryzyko zwiększenia toksycznego działania na układ czerwonokrwinkowy. W wyniku niekorzystnego wpływu na retikulocyty w okresie jednego tygodnia od rozpoczęcia stosowania NLPZ może wystąpić ciężka niedokrwistość. Należy kontrolować wskaźniki morfologii krwi i liczbę retikulocytów w okresie od jednego do dwóch tygodni od rozpoczęcia leczenia NLPZ.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
Pochodne sulfonylomocznika: NLPZ mogą zwiększać działanie hipoglikemizujące pochodnych sulfonylomocznika przez wypieranie ich z połączeń z białkami osocza. Jednoczesne stosowanie wymagające rozważenia: Leki beta-adrenolityczne: podawanie NLPZ może zmniejszać działanie hipotensyjne w wyniku hamowania syntezy prostaglandyn. Cyklosporyna i takrolimus: działanie nefrotoksyczne może się zwiększać w wyniku zahamowania przez NLPZ syntezy prostaglandyn nerkowych. Należy kontrolować czynność nerek podczas leczenia skojarzonego. Leki trombolityczne: zwiększone ryzyko krwawienia. Leki przeciwpłytkowe i selektywne inhibitory wychwytu zwrotnego serotoniny: zwiększone ryzyko krwawienia z żołądka i (lub) dwunastnicy (patrz punkt 4.4). Probenecyd: stężenie deksketoprofenu w osoczu może się zwiększyć; interakcja ta może być spowodowana hamującym wpływem probenecydu na wydalanie cewkowe w nerce oraz sprzęganie z glukuronianami i wymaga modyfikacji dawki deksketoprofenu.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
Glikozydy nasercowe: NLPZ mogą zwiększać stężenie glikozydów w osoczu. Mifepryston: teoretycznie istnieje ryzyko, że niesteroidowe leki przeciwzapalne mogą zmieniać skuteczność mifeprystonu. Ograniczone dane wskazują, że jednoczesne stosowanie NLPZ w dniu podania prostaglandyn nie ma negatywnego wpływu na działanie mifeprystonu lub prostaglandyn na dojrzewanie szyjki macicy i kurczliwość macicy oraz nie zmniejsza skuteczności klinicznej farmakologicznego przerwania ciąży. Antybiotyki chinolonowe: dane z badań u zwierząt wskazują, że duże dawki chinolonów podawane w połączeniu z NLPZ mogą zwiększać ryzyko wystąpienia drgawek. Tenofowir: jednoczesne stosowanie leków z grupy NLPZ może zwiększać stężenie azotu mocznikowego i kreatyniny w osoczu. W związku z tym czynność nerek powinna być monitorowana w celu kontroli potencjalnego synergicznego wpływu na funkcjonowanie nerek. Deferazyroks: jednoczesne stosowanie leków z grupy NLPZ może zwiększać ryzyko toksycznego wpływu na układ pokarmowy.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
Wymagane jest ścisłe monitorowanie kliniczne pacjentów, gdy stosuje się deferazyroks łącznie z tą grupą leków. Pemetreksed: jednoczesne stosowanie leków z grupy NLPZ może zmniejszyć eliminację pemetreksedu, dlatego należy zachować ostrożność w czasie stosowania wyższych dawek NLPZ. Pacjentom z łagodną lub umiarkowaną niewydolnością nerek (klirens kreatyniny od 45 do 79 ml/min), nie należy podawać jednocześnie pemetreksedu z lekami z grupy NLPZ na 2 dni przed i przez 2 dni po podaniu pemetreksedu.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Produkt leczniczy Dexak 50 roztwór do wstrzykiwań lub infuzji jest przeciwwskazany podczas trzeciego trymestru ciąży i laktacji (patrz punkt 4.3). Ciąża Działanie hamujące na syntezę prostaglandyn może mieć negatywny wpływ na przebieg ciąży i (lub) rozwój embrionu lub płodu. Dane z badań farmakoepidemiologicznych sugerują zwiększone ryzyko poronienia i zaburzeń budowy serca oraz wytrzewienia po zastosowaniu inhibitora syntezy prostaglandyn we wczesnej ciąży. Całkowite ryzyko zaburzeń budowy układu sercowo-naczyniowego zwiększało się z mniej niż 1% do około 1,5%. Uważa się, iż ryzyko zwiększa się wraz ze zwiększaniem dawki i czasu trwania leczenia. W badaniach na zwierzętach wykazano, że podawanie inhibitora syntezy prostaglandyn powodowało poronienie przed lub po zagnieżdżeniu się jaja płodowego oraz śmiertelność embrionu lub płodu.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgWpływ na płodność, ciążę i laktację
Dodatkowo u zwierząt, którym podawano inhibitor syntezy prostaglandyn w okresie organogenezy obserwowano zwiększoną częstość występowania różnych wad płodu włączając zaburzenia budowy układu sercowo-naczyniowego. Mimo to, badania na zwierzętach, którym podawano deksketoprofen nie wykazały toksycznego wpływu na reprodukcję (patrz punkt 5.3). Podczas pierwszego i drugiego trymestru ciąży deksketoprofen należy podawać tylko w przypadku zdecydowanej konieczności. Jeżeli deksketoprofen jest stosowany u kobiet planujących zajście w ciążę lub podczas pierwszego lub drugiego trymestru ciąży należy stosować możliwie najmniejszą dawkę przez możliwie najkrótszy okres. Karmienie piersi? Nie wiadomo, czy deksketoprofen przenika do mleka kobiet karmiących piersią. Stosowanie produktu leczniczego Dexak 50 podczas trzeciego trymestru ciąży i karmienia piersią jest przeciwwskazane (patrz punkt 4.3).
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgWpływ na płodność, ciążę i laktację
Płodność Tak jak w przypadku innych leków z grupy NLPZ, stosowanie produktu Dexak 50 może zaburzać płodność kobiet i nie jest zalecane u kobiet planujących ciążę. Należy rozważyć odstawienie deksketoprofenu u kobiet, które mają problemy z zajściem w ciążę lub które są poddawane badaniom z powodu niepłodności.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn Dexak 50 roztwór do wstrzykiwań lub infuzji może powodować działania niepożądane, takie jak zawroty głowy, zaburzenia widzenia lub senność. W takim przypadku czas reakcji oraz zdolność do aktywnego uczestniczenia w ruchu drogowym i obsługiwania maszyn może być ograniczona.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgDziałania niepożądane
4.8 Działania niepożądane Zdarzenia niepożądane, które zgłaszano w badaniach klinicznych jak również po wprowadzeniu produktu Dexak 50 mg/ 2 ml roztwór do wstrzykiwań lub infuzji do obrotu, których związek z podawaniem trometamolu deksketoprofenu uznano za co najmniej możliwy, podano poniżej grupując je według układów narządów i częstości występowania: KLASYFIKACJA UKŁADÓW I NARZĄDÓW Często (≥1/100 do <1/10) Niezbyt często (≥1/1 000 do <1/100) Rzadko (≥1/10 000 do <1/1 000) Bardzo rzadko (<1/10 000) Zaburzenia krwi i układu chłonnego --- Niedokrwistość --- Neutropenia, małopłytkowość Zaburzenia układu immunologicznego --- --- Obrzęk gardła Reakcje anafilaktyczne, obejmujące wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania --- --- Hiperglikemia, hipoglikemia, hipertriglicerydemia, jadłowstręt --- Zaburzenia psychiczne --- Bezsenność --- --- Zaburzenia układu nerwowego --- Bóle głowy, zawroty głowy, senność Parestezje, omdlenia --- Zaburzenia oka --- Nieostre widzenie --- --- Zaburzenia ucha i błędnika --- --- Szumy uszne --- Zaburzenia serca --- --- Skurcze dodatkowe, tachykardia --- Zaburzenia naczyniowe --- Hipotonia, zaczerwienienie twarzy Nadciśnienie tętnicze, zakrzepowe zapalenie żył powierzchownych --- Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia --- --- Zwolnienie częstości oddechów Skurcz oskrzeli, duszność Zaburzenia żołądka i jelit Nudności, wymioty Ból brzucha, niestrawność, biegunka, zaparcia, wymioty z krwią, suchość błony śluzowej jamy ustnej Choroba wrzodowa żołądka, krwawienie lub perforacja (patrz punkt 4.4) Zapalenie trzustki Zaburzenia wątroby i dróg żółciowych --- --- Miąższowe wątrobowokomórkowe uszkodzenie wątroby --- Zaburzenia skóry i tkanki podskórnej --- Zapalenie skóry, świąd, wysypka, nasilone pocenie Pokrzywka, trądzik Zespół Stevens-Johnsona, toksyczne martwicze oddzielanie się naskórka (zespół Lyell'a), obrzęk naczynioruchowy, obrzęk twarzy, reakcje nadwrażliwości na światło Zaburzenia mięśniowo-szkieletowe i tkanki łącznej --- --- Sztywność mięśni, sztywność stawów, kurcze mięśni, ból pleców --- Zaburzenia nerek i dróg moczowych --- --- Ciężkie zaburzenia czynności nerek, wielomocz, ból w okolicy nerek, ketonuria, białkomocz Zapalenie nerek lub zespół nerczycowy Zaburzenia układu rozrodczego i piersi --- --- Zaburzenia miesiączkowania, łagodny rozrost gruczołu krokowego --- Zaburzenia ogólne i stany w miejscu podania Ból w miejscu wstrzyknięcia, reakcje w miejscu wstrzyknięcia, obejmujące zapalenie, krwiaki lub krwotok Gorączka, zmęczenie, ból, uczucie zimna Sztywność, obrzęki obwodowe --- Badania --- --- Nieprawidłowe wskaźniki czynności wątroby --- Najczęściej obserwowano działania niepożądane dotyczące żołądka i (lub) dwunastnicy.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgDziałania niepożądane
Szczególnie u osób w podeszłym wieku może wystąpić choroba wrzodowa żołądka, perforacja lub krwawienia z żołądka i (lub) dwunastnicy, w niektórych przypadkach ze skutkiem śmiertelnym (patrz punkt 4.4). Po zastosowaniu produktu leczniczego występowały: nudności, wymioty, biegunka, wzdęcia, zaparcia, niestrawność, ból w podbrzuszu, smoliste stolce, krwawe wymioty, wrzodziejące zapalenie błony śluzowej jamy ustnej, zaostrzenie zapalenia okrężnicy oraz choroby Leśniowskiego-Crohna (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Rzadziej obserwowano zapalenie błony śluzowej żołądka. Po zastosowaniu leków z grupy NLPZ obserwowano obrzęki, nadciśnienie krwi i niewydolność serca. Tak jak w przypadku innych NLPZ mogą wystąpić następujące działania niepożądane: jałowe zapalenie opon mózgowo-rdzeniowych, głównie u pacjentów z toczniem rumieniowatym układowym lub mieszaną chorobą tkanki łącznej; oraz reakcje hematologiczne (plamica, niedokrwistość aplastyczna i hemolityczna, rzadko agranulocytoza i hipoplazja szpiku).
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgDziałania niepożądane
Reakcje pęcherzowe łącznie z zespołem Stevensa Johnsona i toksycznym martwiczym oddzielaniem się naskórka (bardzo rzadko). Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwałe w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zdarzeń zakrzepowych tętnic (np. zawał serca lub udar), patrz punkt 4.4. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgDziałania niepożądane
Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można również zgłaszać podmiotowi odpowiedzialnemu.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedawkowania są nieznane. Podobne produkty lecznicze wywoływały zaburzenia żołądkowo-jelitowe (wymioty, jadłowstręt, ból brzucha) i neurologiczne (senność, zawroty głowy, dezorientacja, ból głowy). W przypadku przypadkowego zażycia produktu leczniczego lub przedawkowania, niezwłocznie wdrożyć leczenie objawowe dostosowane do stanu pacjenta. Trometamol deksketoprofenu można usunąć z organizmu na drodze dializy.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Niesteroidowe leki przeciwzapalne i przeciwreumatyczne, Pochodne kwasu propionowego. Kod ATC: M 01 AE 17. Trometamol deksketoprofenu jest solą trometaminową kwasu S-(+)-2-(3-benzoilofenylo)propionowego, jest lekiem przeciwbólowym, przeciwzapalnym i przeciwgorączkowym, który należy do niesteroidowych leków przeciwzapalnych (M01AE). Mechanizm działania Mechanizm działania niesteroidowych leków przeciwzapalnych jest związany ze zmniejszeniem syntezy prostaglandyn w wyniku zahamowania aktywności cyklooksygenazy. NLPZ hamują przekształcanie kwasu arachidonowego do cyklicznych endonadtlenków, PGG2 i PGH2, z których powstają prostaglandyny PGE1, PGE2, PGF2α i PGD2 oraz także prostacyklina PGI2 i tromboksany (TxA2 i TxB2). Ponadto zahamowanie syntezy prostaglandyn może wpływać na inne mediatory stanu zapalnego, takie jak kininy, powodując pośrednie działania, które mogą być dodatkowe w stosunku do działania bezpośredniego.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgWłaściwości farmakodynamiczne
Działanie farmakodynamiczne W badaniach wykazano, że deksketoprofen hamuje aktywność COX-1 i COX-2 u zwierząt i u ludzi. Skuteczność kliniczna i bezpieczeństwo stosowania Badania kliniczne przeprowadzone na kilku modelach bólu wykazały skuteczne działanie przeciwbólowe deksketoprofenu. Skuteczność przeciwbólową podawanego domięśniowo i dożylnie deksketoprofenu w leczeniu umiarkowanego i ciężkiego bólu badano w kilku modelach bólu chirurgicznego (zabiegi ortopedyczne, ginekologiczne i brzuszne) oraz bólu mięśniowo-kostnego (model ostrego bólu okolicy lędźwiowo-krzyżowej) oraz kolki nerkowej. W przeprowadzonych badaniach początek działania przeciwbólowego następował szybko a maksymalne działanie przeciwbólowe pojawiało się w ciągu pierwszych 45 minut. Czas trwania działania przeciwbólowego po podaniu 50 mg deksketoprofenu zazwyczaj wynosi 8 godzin.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgWłaściwości farmakodynamiczne
Badania kliniczne przeprowadzone w opanowaniu bólu pooperacyjnego wykazały, że Dexak 50 roztwór do wstrzykiwań lub infuzji, podawany jednocześnie z opioidami pozwalał na istotne zmniejszenie dawki opioidów. W badaniach nad bólem pooperacyjnym, w których pacjenci otrzymywali morfinę za pomocą pompy infuzyjnej, kontrolowanej przez pacjenta, pacjenci leczeni deksketoprofenem wymagali istotnie mniejszej dawki morfiny (od 30% do 45% mniej), niż pacjenci w grupie placebo.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Wchłanianie Maksymalne stężenie produktu leczniczego występuje po 20 minutach (zakres od 10 do 45 minut) od domięśniowego podania trometamolu deksketoprofenu. Dla pojedynczych dawek 25 mg do 50 mg wykazano, że pole powierzchni pod krzywą (AUC) jest proporcjonalne do dawki, zarówno po podaniu domięśniowym jak i dożylnym. Dystrybucja Tak jak w przypadku innych produktów leczniczych charakteryzujących się dużym stopniem wiązania z białkami osocza (99%), średnia objętość dystrybucji jest mniejsza od 0,25 l/kg. Okres półtrwania w fazie dystrybucji wynosił około 0,35 godzin a okres półtrwania w fazie eliminacji od 1 do 2,7 godzin. W badaniu farmakokinetyki po podaniu dawek wielokrotnych obserwowano, że stężenie maksymalne Cmax i AUC po ostatnim podaniu domięśniowym lub dożylnym nie różniły się od uzyskanych po podaniu pojedynczej dawki, co wskazuje, że produkt leczniczy nie kumuluje się w organizmie.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgWłaściwości farmakokinetyczne
Biotransformacja i eliminacja Po podaniu trometamolu deksketoprofenu w moczu występuje tylko S-(+) enancjomer, co oznacza, że u ludzi nie występuje przekształcanie go do R-(-) enancjomeru. Główną drogą eliminacji deksketoprofenu jest sprzęganie z glukuronidami a następnie wydalanie przez nerki. Osoby w podeszłym wieku U zdrowych osób w podeszłym wieku (65 lat i starszych), po podaniu dawki pojedynczej i dawek wielokrotnych doustnych, ekspozycja na produkt leczniczy była istotnie wyższa, niż u młodych ochotników (do 55%), natomiast nie obserwowano statystycznie istotnej różnicy pod względem maksymalnego stężenia i czasu do osiągnięcia maksymalnego stężenia. Średni okres półtrwania w fazie eliminacji po podaniu dawki pojedynczej i dawek wielokrotnych był wydłużony (do 48%) a całkowity rzeczywisty klirens był zmniejszony.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań dotyczących farmakologii bezpieczeństwa, genotoksyczności i immunofarmakologii nie ujawniły występowania szczególnego zagrożenia dla człowieka. Badania przewlekłej toksyczności przeprowadzone na myszach i małpach wykazały poziom NOAEL (poziom, na którym nie obserwowano żadnych działań niepożądanych) przy podawaniu dawek dwukrotnie większych niż maksymalne dawki zalecane u ludzi. Głównymi działaniami niepożądanymi obserwowanymi po podaniu większych dawek u małp były krew w kale, wolniejszy przyrost masy ciała i, po podaniu najwyższej dawki, nadżerki błony śluzowej żołądka i (lub) dwunastnicy. Objawy te występowały po podaniu dawek stanowiących 14-18 krotnie wyższą ekspozycję niż dawki maksymalne zalecane do stosowania u ludzi. Nie ma badań oceniających potencjał kancerogenny u zwierząt.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgPrzedkliniczne dane o bezpieczeństwie
Jak stwierdzono dla całej grupy farmakologicznej NLPZ, deksketoprofen może powodować zmiany czasu przeżycia zarodka-płodu w modelach zwierzęcych, zarówno pośrednio, w wyniku działania toksycznego na żołądek i jelita u ciężarnych matek, i bezpośrednio poprzez wpływ na rozwój płodu.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Etanol (96 %) Sodu chlorek Sodu wodorotlenek Woda do wstrzykiwań 6.2. Niezgodności farmaceutyczne Produktu leczniczego Dexak 50 roztwór do wstrzykiwań lub infuzji nie wolno mieszać w niewielkiej objętości (np. w strzykawce) z roztworami dopaminy, prometazyny, pentazocyny, petydyny ani hydroksyzyny, gdyż doprowadzi to do strącenia roztworu. Rozcieńczonego roztworu do wstrzykiwań, uzyskanego jak podano w punkcie 6.6, nie wolno mieszać z prometazyną ani pentazocyną. Niniejszego produktu leczniczego nie wolno mieszać z innymi produktami leczniczymi, poza tymi wymienionymi w punkcie 6.6. 6.3. Okres ważności 4 lata. Wykazano, że po rozcieńczeniu zgodnie z zaleceniami podanymi w punkcie 6.6, rozcieńczony roztwór, przechowywany w temperaturze 25C, zachowuje chemiczną stabilność przez 24 godziny, pod warunkiem, że jest chroniony przed światłem dziennym.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgDane farmaceutyczne
Z mikrobiologicznego punktu widzenia produkt leczniczy należy zużyć bezpośrednio po rozcieńczeniu. Jeżeli produkt leczniczy nie zostanie zużyty bezpośrednio po rozcieńczeniu, okres i warunki przechowywania przed użyciem zależą od użytkownika i zwykle nie powinny przekraczać 24 godzin w temperaturze 2C do 8C, chyba że rozcieńczenie odbyło się w kontrolowanych i zwalidowanych warunkach aseptycznych. 6.4. Specjalne środki ostrożności podczas przechowywania Ampułki przechowywać w opakowaniu zewnętrznym w celu ochrony przed światłem. W celu zapoznania się z warunkami przechowywania produktu leczniczego po rozcieńczeniu patrz punkt 6.3. Warunki przechowywania produktu leczniczego po rozcieńczeniu, patrz 6.3. 6.5. Rodzaj i zawartość opakowania Barwione, szklane ampułki typu I, zawierające 2 ml roztworu do wstrzykiwań lub infuzji. Ampułki znajdują się w blistrze PVC/Aluminium. Opakowanie zewnętrzne – pudełko tekturowe. Opakowania zawierające: 1, 5, 6, 10, 20, 50 lub 100 ampułek.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgDane farmaceutyczne
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6. Specjalne środki ostrożności dotyczące usuwania Wykazano, że Dexak 50 roztwór do wstrzykiwań lub infuzji jest zgodny, gdy zostanie wymieszany w niewielkich objętościach (np. w strzykawce) z roztworami do wstrzykiwań heparyny, lidokainy, morfiny i teofiliny. W celu podania w postaci wlewu dożylnego zawartość 1 ampułki (2 ml) Dexak 50 roztworu do wstrzykiwań lub infuzji należy rozcieńczyć w objętości 30 ml do 100 ml roztworu soli fizjologicznej, glukozy lub roztworu Ringera. Roztwór należy rozcieńczyć w warunkach aseptycznych i chronić od naturalnego dziennego światła (patrz także punkt 6.3). Rozcieńczony roztwór jest przezroczysty. Wykazano, że Dexak 50 roztwór do wstrzykiwań lub infuzji, rozcieńczony w objętości 100 ml normalnego roztworu soli fizjologicznej lub roztworu glukozy, jest zgodny z następującymi lekami: dopaminą, heparyną, hydroksyzyną, lidokainą, morfiną, petydyną i teofiliną.
- CHPL leku Dexak 50, roztwór do wstrzykiwań / do infuzji, 50 mgDane farmaceutyczne
Nie stwierdzono wchłaniania substancji czynnej, gdy rozcieńczone roztwory produktu leczniczego Dexak 50 roztworu do wstrzykiwań lub infuzji przechowywano w plastikowych torebkach lub urządzeniach do podawania sporządzonych z octanu etylowinylu (EVA), propionianu celulozy (CP), polietylenu o niskiej gęstości (LDPE) i chlorku poliwinylu (PVC). Dexak 50 roztwór do wstrzykiwań lub infuzji jest przeznaczony wyłącznie do jednokrotnego zastosowania i całość nieużytego roztworu należy usunąć w sposób zgodny z lokalnymi przepisami. Przed zastosowaniem produktu, roztwór należy obejrzeć, aby się upewnić, że jest przezroczysty i bezbarwny: nie wolno stosować, jeżeli występują jakiekolwiek zanieczyszczenia. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Ketospray Forte, 100 mg/ml, aerozol na skórę, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 100 mg ketoprofenu (Ketoprofenum). Jedna dawka z dozownika (0,2 ml) zawiera 20 mg ketoprofenu. Substancje pomocnicze: 100 mg glikolu propylenowego /mililitr płynu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Aerozol na skórę, roztwór. Bezbarwny do lekko żółtawego, przejrzysty roztwór.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlWskazania do stosowania
4.1. Wskazania do stosowania Miejscowe, objawowe leczenie bólu i zapalenia tkanek miękkich (w tym w następstwie zwichnięć, skręceń i stłuczeń).
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dorośli i dzieci w wieku powyżej 15 lat: Od 3 do 6 dawek produktu leczniczego rozpylić na okolicę objętą dolegliwościami, dwa do trzech razy na dobę, przez okres do 7 dni. Po rozpyleniu produkt leczniczy należy delikatnie rozetrzeć i pozostawić do wyschnięcia. Po wmasowaniu produktu leczniczego w skórę należy umyć ręce. Należy unikać kontaktu z oczami, błonami śluzowymi i uszkodzoną skórą. Maksymalna dawka dobowa wynosi 18 dawek z dozownika, co odpowiada 360 mg ketoprofenu. Dzieci: Z uwagi na niedostateczne dane kliniczne nie zaleca się stosowania produktu leczniczego Ketospray Forte u dzieci w wieku poniżej 15 lat.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na ketoprofen lub którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1 w wywiadzie. Nadwrażliwość na światło słoneczne w wywiadzie. Znane reakcje nadwrażliwości takie jak: astma, alergiczny nieżyt błony śluzowej nosa po zastosowaniu ketoprofenu, fenofibratu, kwasu tiaprofenowego, kwasu acetylosalicylowego lub innych niesteroidowych leków przeciwzapalnych (NLPZ). Alergia skórna w wywiadzie po zastosowaniu ketoprofenu, kwasu tiaprofenowego, fenofibratu, a także filtrów UV lub perfum. Światło słoneczne, nawet wówczas gdy niebo jest zachmurzone, a także promienie UV w solarium, w trakcie leczenia oraz do dwóch tygodni po jego zakończeniu. Stosowanie na obszary skóry, na których występują zmiany chorobowe takie jak: wysypka lub trądzik, zakażenie skóry lub otwarte rany. Trzeci trymestr ciąży (patrz sekcja 4.6).
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ketospray Forte należy stosować ostrożnie u pacjentów z ciężką niewydolnością nerek, niewydolnością układu krążenia oraz zaburzeniami czynności wątroby, ponieważ istnieje możliwość wystąpienia ogólnych działań niepożądanych. Zgłaszano pojedyncze przypadki ogólnych działań niepożądanych związanych z zaburzeniami czynności nerek. Po każdorazowym zastosowaniu produktu leczniczego Ketospray Forte należy dokładnie umyć ręce. Produkt leczniczy należy natychmiast odstawić w przypadku rozwoju jakichkolwiek reakcji skórnych, w tym reakcji skórnych po jednoczesnym zastosowaniu produktów zawierających oktokrylen. Produktu leczniczego Ketospray Forte nie należy stosować pod opatrunki okluzyjne, oraz na duże powierzchnie ciała. Stosowanie, zwłaszcza długotrwałe, produktów leczniczych o działaniu miejscowym, może spowodować reakcję alergiczną, szczególnie w okresie intensywnego nasłonecznienia.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlSpecjalne środki ostrozności
Nie należy przekraczać zalecanego czasu leczenia ze względu na zwiększone ryzyko wystąpienia kontaktowego zapalenia skóry oraz reakcji nadwrażliwości na światło słoneczne. Zalecane jest chronienie leczonych obszarów skóry poprzez noszenie odzieży, podczas stosowania produktu leczniczego oraz do dwóch tygodni po zakończeniu leczenia, aby uniknąć ryzyka wystąpienia nadwrażliwości na światło słoneczne. Pacjenci z astmą współistniejącą z przewlekłym zapaleniem błony śluzowej nosa, przewlekłym zapaleniem zatok i (lub) z polipami nosa, są szczególnie narażeni na wystąpienie reakcji alergicznych po zastosowaniu kwasu acetylosalicylowego lub innych niesteroidowych leków przeciwzapalnych (NLPZ). Pacjenci z astmą oskrzelową lub alergią w wywiadzie, mogą stosować Ketospray Forte wyłącznie pod ścisłą kontrolą lekarza. Należy rozważyć konieczność stosowania produktu leczniczego Ketospray Forte podczas współistniejącego krwawienia o dowolnej lokalizacji.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlSpecjalne środki ostrozności
Produktu leczniczego nie należy stosować na obszary skóry, na których występują: zmiany wysiękowe, wyprysk, owrzodzenie lub zakażenie skóry, a także naruszenie jej ciągłości, oraz na: błony śluzowe (jamy ustnej, okolicy narządów płciowych lub odbytu), oczy lub uszy. Specjalne ostrzeżenia o niektórych substancjach pomocniczych: Produkt leczniczy Ketospray Forte zawiera glikol propylenowy, który może powodować podrażnienie skóry.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Wystąpienie interakcji jest bardzo mało prawdopodobne, ponieważ stężenie ketoprofenu w osoczu po zastosowaniu miejscowym jest bardzo małe. Zgłaszano ciężkie interakcje podczas jednoczesnego ogólnego stosowania metotreksatu i niesteroidowych leków przeciwzapalnych, w tym ketoprofenu.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację W związku z brakiem danych klinicznych dotyczących ketoprofenu stosowanego miejscowo, poniższe informacje dotyczą ketoprofenu o działaniu ogólnym. Ciąża: Nie ma danych klinicznych dotyczących stosowania w czasie ciąży produktu Ketospray Forte w postaci do stosowania miejscowego. Nawet jeżeli narażenie ogólnoustrojowe jest mniejsze niż po podaniu doustnym, nie wiadomo, czy ogólnoustrojowy wpływ produktu Ketospray Forte po podaniu miejscowym może być szkodliwy dla zarodka (płodu). W pierwszym i drugim trymestrze ciąży nie należy stosować produktu leczniczego Ketospray Forte, chyba że jest to bezwzględnie konieczne. W takim przypadku zaleca się zastosowanie jak najmniejszej dawki przez jak najkrótszy okres leczenia. III trymestr ciąży: stosowanie ketoprofenu o działaniu ogólnym jest przeciwwskazane.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlWpływ na płodność, ciążę i laktację
Zastosowanie inhibitorów syntezy prostaglandyn, w tym ketoprofenu, w trzecim trymestrze ciąży może powodować działanie toksyczne na płuca i serce płodu, niewydolność nerek płodu oraz zwiększone prawdopodobieństwo wystąpienia krwawień u matki i dziecka pod koniec ciąży. Produkt leczniczy Ketospray Forte jest przeciwwskazany od szóstego miesiąca ciąży (III trymestr). (patrz punkt 4.3). Karmienie piersią: Brak danych dotyczących przenikania ketoprofenu do mleka kobiet. Dlatego nie zaleca się stosowania produktu leczniczego Ketospray Forte u kobiet karmiących piersią.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie opisano negatywnego wpływu ketoprofenu, stosowanego miejscowo na skórę, na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlDziałania niepożądane
4.8. Działania niepożądane Działania niepożądane po miejscowym zastosowaniu ketoprofenu występują niezbyt często lub rzadko. Należą do nich odczyny uczuleniowe: miejscowe reakcje skórne jak rumień, świąd i pieczenie oraz dotyczące dróg oddechowych (istnieje możliwość wystąpienia ataku astmy, szczególnie u osób z alergią na kwas acetylosalicylowy i (lub) inne niesteroidowe leki przeciwzapalne). W takich przypadkach stosowanie produktu leczniczego jest przeciwwskazane. Działania niepożądane podzielono ze względu na częstość występowania według następującej skali: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100); rzadko (≥1/10 000 do <1/1 000); bardzo rzadko (<1/10 000); częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia układu immunologicznego Częstość nieznana: Wstrząs anafilaktyczny, obrzęk naczynioruchowy, reakcje nadwrażliwości.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlDziałania niepożądane
Zaburzenia skóry i tkanki podskórnej Niezbyt często: Rumień, wyprysk, świąd i pieczenie. Rzadko: Reakcje nadwrażliwości na światło, pokrzywka. Ciężkie reakcje takie jak wyprysk pęcherzowy lub pryszczykowaty, które mogą rozprzestrzeniać się poza miejsce zastosowania lub przybierać postać reakcji uogólnionej. Zaburzenia nerek i dróg moczowych Bardzo rzadko: Przypadki zaostrzenia przewlekłej niewydolności nerek. Inne możliwe działania niepożądane (dotyczące przewodu pokarmowego i nerek) wynikają z przenikania substancji czynnej przez skórę, a więc są uzależnione od: zastosowanej dawki ketoprofenu, powierzchni skóry, stopnia wchłaniania przez tkankę, okresu leczenia oraz zastosowania lub nie, opatrunku.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlPrzedawkowanie
4.9. Przedawkowanie Przedawkowanie produktu leczniczego jest mało prawdopodobne w związku z miejscową drogą podania. W przypadku zastosowania nadmiernej ilości produktu leczniczego, zaleca się umyć powierzchnię skóry wodą. W razie przypadkowego połknięcia produktu leczniczego Ketospray Forte mogą wystąpić ogólne działania niepożądane o różnym nasileniu, w zależności od ilości przyjętego produktu leczniczego (bóle i zawroty głowy, wymioty, bóle brzucha, senność). Spożycie dużych dawek może spowodować zahamowanie czynności oddechowej, śpiączkę, drgawki, krwawienie z przewodu pokarmowego, zwiększenie lub zmniejszenie ciśnienia tętniczego, ostrą niewydolność nerek. Nie istnieje specyficzne antidotum. Należy zastosować leczenie podtrzymujące i objawowe takie jak przy przypadku przedawkowania doustnych leków przeciwzapalnych.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Niesteroidowe leki przeciwzapalne do stosowania miejscowego. Kod ATC: M02AA10 Mechanizm działania Substancją czynną produktu leczniczego Ketospray Forte jest ketoprofen (pochodna kwasu fenylopropionowego) - z grupy niesteroidowych leków przeciwzapalnych, o działaniu przeciwzapalnym i przeciwbólowym. Ketoprofen hamuje aktywność cyklooksygenazy, zmniejsza syntezę prostaglandyn PgF2 i PgE2. Hamuje migrację leukocytów i zmniejsza przepuszczalność naczyń włosowatych.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Stężenia ketoprofenu w osoczu badano w grupie 12 ochotników. Po wielokrotnym zastosowaniu produktu leczniczego Ketospray Forte na skórę, uzyskano maksymalne stężenia ketoprofenu w osoczu 16 do 25 razy mniejsze (132 ± 71 ng/ml) od stężeń stwierdzanych po doustnym przyjęciu pojedynczej dawki ketoprofenu (1000 – 5000 ng/ml). Dostępność ketoprofenu po zastosowaniu miejscowym wynosi około 5% w porównaniu do postaci ketoprofenu podawanych doustnie. Ketoprofen wiąże się z białkami osocza w około 99%. Wydalany jest głównie przez nerki, w postaci glukuronidu.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Po długotrwałym doustnym podawaniu ketoprofenu u zwierząt obserwowano zmiany w przewodzie pokarmowym oraz w nerkach, typowe dla niesteroidowych leków przeciwzapalnych.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Glikol propylenowy alkohol izopropylowy makrogolu 15 hydroksystearynian sodu diwodorofosforan dwuwodny disodu fosforan dwunastowodny sodu wodorotlenek olejek miętowy woda oczyszczona 6.2. Niezgodności farmaceutyczne Nie są znane. 6.3. Okres ważności 4 lata. 6 miesięcy po pierwszym otwarciu opakowania. 6.4. Specjalne środki ostrożności podczas przechowywania Brak szczególnych środków ostrożności dotyczących przechowywania. Przechowywać w opakowaniu zewnętrznym. 6.5. Rodzaj i zawartość opakowania Butelki ze szkła oranżowego o pojemności 15 ml i 30 ml zamknięte plastikowo-metalową pompką dozującą zabezpieczoną wieczkiem, zawierające odpowiednio 12,5 ml oraz 25 ml produktu leczniczego Ketospray Forte, w tekturowym pudełku. 6.6. Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Instrukcja stosowania: Butelkę trzymać w pozycji pionowej.
- CHPL leku Ketospray forte, aerozol na skórę, roztwór, 100 mg/mlDane farmaceutyczne
Stosując produkt leczniczy po raz pierwszy, należy nacisnąć przycisk pompki dozującej od 3 do 4 razy w celu wypełnienia dozownika i uzyskania prawidłowego rozpylenia. Wylot pompki dozującej skierować na okolicę objętą dolegliwościami i nacisnąć tłoczek. Jedno naciśnięcie uwalnia jedną dawkę leku. Produkt leczniczy delikatnie rozetrzeć i pozostawić do wyschnięcia, a końcówkę pompki wytrzeć delikatną tkaniną, aby zapobiec jej zatkaniu się. Nie stosować w pobliżu otwartych źródeł ognia. Po zastosowaniu produktu leczniczego umyć ręce. Należy unikać kontaktu z oczami, błonami śluzowymi i uszkodzoną skórą. Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Ketoprofen-SF, 50 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 50 mg ketoprofenu. Jedna ampułka 2 ml zawiera 100 mg ketoprofenu. Substancja pomocnicza o znanym działaniu: Produkt zawiera 50 mg alkoholu benzylowego w każdej ampułce, co odpowiada 25 mg/ml roztworu do wstrzykiwań. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań. Przezroczysty, bezbarwny do jasnożółtego roztwór o pH 5,5 – 7,5.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Objawowe leczenie ostrego silnego bólu w przypadku: ostrego zapalenia stawów, przewlekłego zapalenia stawów, zwłaszcza reumatoidalnego zapalenia stawów, zesztywniającego zapalenia stawów kręgosłupa (choroba Bechterewa) i innych reumatoidalnych stanów zapalnych kręgosłupa, zaostrzenia choroby zwyrodnieniowej stawów i kręgosłupa (przypadki zapalenia kości i stawów oraz zapalenia stawów kręgosłupa). Stosowanie ketoprofenu w postaci pozajelitowej jest wskazane w przypadku konieczności uzyskania szybkiego działania lub w przypadku, gdy podanie doustne lub doodbytnicze nie jest możliwe. W takiej sytuacji stosowanie ketoprofenu w postaci pozajelitowej powinno ograniczać się jedynie do pojedynczego wstrzyknięcia w celu rozpoczęcia leczenia.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Należy stosować najmniejszą skuteczną dawkę przez najkrótszy okres konieczny do złagodzenia objawów (patrz punkt 4.4). Produkt Ketoprofen-SF jest szczególnie przydatny w leczeniu ostrego bólu. Dawkowanie należy ustalać indywidualnie w oparciu o zaobserwowane objawy. Maksymalna dawka dobowa wynosi 200 mg ketoprofenu. Przed rozpoczęciem leczenia z użyciem dawki dobowej 200 mg ketoprofenu należy dokładnie rozważyć stosunek korzyści do ryzyka, zaś większe dawki nie są zalecane (patrz również punkt 4.4). Obowiązują następujące wytyczne dotyczące dawkowania u dorosłych: Podanie pozajelitowe produktu Ketoprofen-SF powinno mieć formę pojedynczego wstrzyknięcia. W ciężkich przypadkach produkt Ketoprofen-SF może być podawany dwa razy na dobę (za każdym razem należy zmieniać miejsce wstrzyknięcia). Jednocześnie nie należy przekraczać dawki dobowej 200 mg ketoprofenu.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlDawkowanie
W przypadku stwierdzenia konieczności zmiany leczenia, należy zastosować podanie doustne lub doodbytnicze. Szczególne grupy pacjentów Pacjenci w podeszłym wieku: Ze względu na możliwe działania niepożądane (patrz punkt 4.4), pacjenci w podeszłym wieku wymagają szczególnej obserwacji. Pacjenci w podeszłym wieku z zaburzeniami czynności nerek: Zaleca się zmniejszenie dawki początkowej i podtrzymanie najmniejszej skutecznej dawki. Indywidualne dostosowanie dawki należy rozważyć tylko po zapewnieniu stanu dobrej tolerancji produktu (patrz punkt 5.2). Pacjenci z zaburzeniami czynności wątroby: Pacjentów takich należy uważnie monitorować oraz stosować u nich najmniejsze skuteczne dawki. Dzieci i młodzież (do 18 lat): Produkt Ketoprofen-SF nie jest zalecany do stosowania u dzieci i młodzieży poniżej 18 lat (patrz punkt 4.3). Sposób i czas podawania Podanie domięśniowe. Produkt Ketoprofen-SF powinien być wstrzykiwany powoli i głęboko w pośladek. Okres podawania określa lekarz prowadzący.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlDawkowanie
Przyjmowanie produktu leczniczego w najmniejszej skutecznej dawce przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.4). Produkty lecznicze przeznaczone do podawania pozajelitowego należy obejrzeć przed użyciem. Należy stosować wyłącznie przejrzyste roztwory bez widocznych cząstek.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, alkohol benzylowy lub na którąkolwiek substancję pomocniczą, wymienioną w punkcie 6.1 reakcje nadwrażliwości w wywiadzie, takie jak skurcz oskrzeli, napady astmy oskrzelowej, zapalenie błony śluzowej nosa, pokrzywka lub inne reakcje alergiczne w następstwie stosowania ketoprofenu, kwasu acetylosalicylowego lub innych niesteroidowych leków przeciwzapalnych (NLPZ), znane reakcje fotoalergiczne lub fototoksyczne podczas stosowania ketoprofenu lub fibratów, niewyjaśnione zaburzenia układu krwiotwórczego, czynna choroba wrzodowa żołądka lub jakiekolwiek przypadki krwawień z przewodu pokarmowego, owrzodzenia lub perforacji przewodu pokarmowego w wywiadzie, skaza krwotoczna, zaburzenia hemostazy lub leczenie lekami przeciwzakrzepowymi, krwawienie z naczyń mózgowych lub inne czynne krwawienie, ciężka niewydolność serca, ciężka niewydolność wątroby lub nerek, trzeci trymestr ciąży (patrz punkt 4.6), dzieci i młodzież poniżej 18 lat.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podobnie jak w przypadku innych niesteroidowych leków przeciwzapalnych, należy obserwować pacjenta co najmniej przez godzinę po podaniu produktu Ketoprofen-SF oraz przygotować zestaw ratunkowy, ze względu na możliwość wystąpienia reakcji anafilaktycznych, a nawet wstrząsu anafilaktycznego. Należy poinformować pacjenta o konieczności podjęcia tego typu środków ostrożności. Przyjmowanie produktu leczniczego w najmniejszej skutecznej dawce przez jak najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz „Wpływ na przewód pokarmowy” i „Wpływ na układ krążenia i naczynia mózgowe” poniżej). Wpływ na przewód pokarmowy Należy unikać jednoczesnego stosowania produktu leczniczego Ketoprofen-SF wraz z innymi lekami z grupy NLPZ, w tym z selektywnymi inhibitorami cyklooksygenazy-2.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Pacjenci w podeszłym wieku: Podczas stosowania leków z grupy NLPZ ryzyko wystąpienia działań niepożądanych, zwłaszcza krwawień z przewodu pokarmowego lub perforacji przewodu pokarmowego, które mogą zakończyć się zgonem, jest większe w przypadku osób w podeszłym wieku (patrz też punkt 4.2). Krwawienia z przewodu pokarmowego, owrzodzenia i perforacje przewodu pokarmowego: Krwawienia z przewodu pokarmowego i powstawanie owrzodzeń lub perforacji, które mogą zakończyć się zgonem, raportowano dla wszystkich NLPZ w każdym okresie leczenia, z objawami ostrzegawczymi lub bez, lub u pacjentów z poważnymi zdarzeniami dotyczącymi przewodu pokarmowego w wywiadzie. Dane epidemiologiczne wskazują, że stosowanie ketoprofenu może być związane ze zwiększonym, w porównaniu do innych NLPZ, działaniem toksycznym na przewód pokarmowy, zwłaszcza w przypadku stosowania większych dawek (patrz też punkty 4.2 i 4.3).
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Ryzyko krwawienia z przewodu pokarmowego, owrzodzenia lub perforacji jest większe w przypadku stosowania większych dawek NLPZ u pacjentów z chorobą wrzodową w wywiadzie, w szczególności w przypadkach powikłanych krwawieniem lub perforacją (patrz punkt 4.3) oraz u osób w podeszłym wieku. U tych pacjentów należy zatem rozpoczynać leczenie od najmniejszej dostępnej dawki). Należy rozważyć u tych pacjentów, jak również w grupie pacjentów wymagających jednoczesnego leczenia małymi dawkami kwasu acetylosalicylowego oraz innymi lekami zwiększającymi ryzyko działań niepożądanych dotyczących przewodu pokarmowego (patrz poniżej i punkt 4.5), stosowanie skojarzonego leczenia lekami osłaniającymi (np. mizoprostolem lub inhibitorami pompy protonowej). Pacjenci z objawami toksycznego wpływu na układ pokarmowy w wywiadzie, zwłaszcza w podeszłym wieku, powinni zgłaszać wszelkie nietypowe objawy w obrębie jamy brzusznej (zwłaszcza krwawienia z przewodu pokarmowego), szczególnie na początku leczenia.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Zaleca się zachowanie ostrożności u pacjentów stosujących jednocześnie leki, które mogą zwiększać ryzyko powstawania owrzodzeń lub krwawienia, takie jak doustne kortykosteroidy, leki przeciwzakrzepowe, takie jak warfaryna, selektywne inhibitory wychwytu zwrotnego serotoniny lub leki hamujące agregację płytek krwi, takie jak kwas acetylosalicylowy (patrz punkt 4.5). Względne ryzyko wystąpienia krwawienia z przewodu pokarmowego jest większe u pacjentów z niską masą ciała. W przypadku wystąpienia krwawienia z przewodu pokarmowego lub owrzodzenia przewodu pokarmowego u pacjentów stosujących produkt Ketoprofen-SF, należy natychmiast przerwać leczenie. Leki z grupy NLPZ należy stosować z ostrożnością w przypadku pacjentów z chorobami przewodu pokarmowego w wywiadzie (wrzodziejące zapalenie jelita grubego, choroba Crohna), ponieważ leki te mogą zaostrzyć przebieg tych chorób (patrz punkt 4.8).
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Wpływ na układ krążenia i naczynia mózgowe Pacjentów z nadciśnieniem tętniczym i (lub) łagodną do umiarkowanej zastoinową niewydolnością serca w wywiadzie należy odpowiednio monitorować i udzielać właściwych zaleceń, ponieważ w związku z leczeniem NLPZ zgłaszane były zatrzymanie płynów i obrzęki. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych niesteroidowych leków przeciwzapalnych (szczególnie długotrwale w dużych dawkach) jest związane ze zwiększeniem ryzyka zaburzeń zakrzepowych w obrębie tętnic (np. zawał serca lub udar). Dane te są niewystarczające, aby wykluczyć takie ryzyko w przypadku przyjmowania ketoprofenu. Pacjenci z niekontrolowanym nadciśnieniem tętniczym, zastoinową niewydolnością serca, rozpoznaną chorobą niedokrwienną serca, chorobą tętnic obwodowych i (lub) chorobą naczyń mózgowych powinni być leczeni ketoprofenem bardzo rozważnie.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Podobną rozwagę należy zachować przed rozpoczęciem długotrwałego leczenia pacjentów z czynnikami ryzyka chorób układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Zalecana jest ostrożność u pacjentów z nadciśnieniem tętniczym i (lub) łagodną do umiarkowanej zastoinową niewydolnością serca w wywiadzie, ponieważ zgłaszane były zatrzymanie płynów oraz obrzęki w związku z leczeniem NLPZ. Reakcje skórne W czasie leczenia NLPZ odnotowano bardzo rzadkie przypadki wystąpienia ciężkich reakcji skórnych, niektóre ze skutkiem śmiertelnym, w tym złuszczające zapalenie skóry, zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka (patrz punkt 4.8). Prawdopodobnie największe ryzyko tych działań niepożądanych u pacjentów występuje na początku leczenia, ponieważ w większości przypadków reakcje te występowały w pierwszym miesiącu leczenia.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
W przypadku pierwszych objawów wysypki skórnej, zmian w obrębie błon śluzowych i jakichkolwiek innych objawów reakcji nadwrażliwości należy przerwać stosowanie produktu Ketoprofen-SF. Reakcje fotoalergiczne spowodowane stosowaniem NLPZ są dobrze znanymi działaniami niepożądanymi leków tej grupy i są najczęściej przypisywane promieniowaniu UV. Ketoprofen powoduje zwiększone ryzyko fotoalergicznego kontaktowego zapalenia skóry. Reakcja fotoalergiczna występuje na skutek nadwrażliwości na poziomie komórkowym obejmującej reakcje immunologiczne. Dlatego też występuje jedynie u pacjentów wcześniej uczulonych i wymaga okresu utajenia nadwrażliwości. Ustąpienie objawów skórnych po odstawieniu produktu może trwać kilka miesięcy. Mogą wystąpić reakcje nadwrażliwości krzyżowej z innymi związkami kwasu arylopropionowego, fenofibratami lub związkami benzoilu lub benzofenonu zabezpieczonych oksybenzonem.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Nie można wykluczyć, że powszechne oraz powtarzające się stosowanie tych związków może prowadzić do nadwrażliwości. W przypadku wystąpienia reakcji fotoalergicznej u pacjentów stosujących produkt Ketoprofen-SF, należy przerwać jego stosowanie. Maskowanie objawów zakażenia podstawowego Ketoprofen-SF może maskować objawy podmiotowe zakażenia, co może prowadzić do opóźnionego rozpoczęcia stosowania właściwego leczenia, a przez to pogarszać skutki zakażenia. Zjawisko to zaobserwowano w przypadku pozaszpitalnego bakteryjnego zapalenia płuc i powikłań bakteryjnych ospy wietrznej. Jeśli lek Ketoprofen-SF stosowany jest z powodu gorączki lub bólu związanych z zakażeniem, zaleca się kontrolowanie przebiegu zakażenia. W warunkach pozaszpitalnych pacjent powinien skonsultować się z lekarzem, jeśli objawy utrzymują się lub nasilają. Pozostałe informacje Ketoprofen-SF powinien być stosowany tylko po dokładnym rozważeniu stosunku korzyści do ryzyka: w przypadkach nabytej porfirii.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Szczególnie w następujących przypadkach wymagany jest dokładny nadzór lekarza: występujące uprzednio uszkodzenie nerek, zaburzenia czynności wątroby, stosowanie bezpośrednio po poważnym zabiegu chirurgicznym, u pacjentów z katarem siennym, polipami nosa oraz przewlekłą obturacyjną chorobą płuc, z uwagi na zwiększone ryzyko zapoczątkowania reakcji alergicznej. Może się to objawiać w postaci ataków astmy (tzw. astma aspirynowa), wystąpienia obrzęku naczynioworuchowego lub pokrzywki, u pacjentów wykazujących reakcję alergiczną na inne substancje, ponieważ istnieje również ryzyko reakcji nadwrażliwości w czasie stosowania produktu Ketoprofen-SF, intensywne leczenie lekami moczopędnymi, leczenie lekami z grupy NLPZ lub innymi lekami przeciwbólowymi, zaburzenia krzepnięcia krwi, leczenie lekami przeciwzakrzepowymi. Ostre reakcje nadwrażliwości (np.: wstrząs anafilaktyczny) obserwowano w bardzo rzadkich przypadkach.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
W przypadku wystąpienia pierwszych objawów poważnych reakcji nadwrażliwości po zastosowaniu Ketoprofen-SF, należy przerwać stosowanie produktu. W zależności od objawów, jakakolwiek interwencja medyczna musi być przeprowadzona przez specjalistę. U pacjentów z astmą w połączeniu z przewlekłym zapaleniem błony śluzowej nosa, przewlekłym zapaleniem zatok i (lub) polipowatością nosa występuje większe niż u pozostałej części populacji ryzyko uczulenia na kwas acetylosalicylowy i (lub) leki z grupy NLPZ. Przyjmowanie tego leku może powodować napady astmy lub skurcz oskrzeli, szczególnie u osób uczulonych na kwas acetylosalicylowy lub leki z grupy NLPZ (patrz punkt 4.3). W przypadku wystąpienia zaburzeń takich jak niewyraźne widzenie, należy przerwać stosowanie produktu. Podobnie jak w przypadku stosowania innych NLPZ podczas choroby zakaźnej, przeciwzapalne, przeciwbólowe i przeciwgorączkowe właściwości ketoprofenu mogą maskować występujące zazwyczaj objawy postępowania infekcji takie jak gorączka.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
U pacjentów, szczególnie w podeszłym wieku, z niewydolnością serca, marskością wątroby i nerczycą, stosujących leki moczopędne oraz z przewlekłym zaburzeniem czynności nerek, należy uważnie monitorować czynność nerek na skutek hamowania prostaglandyn i przez to prowadzić do uszkodzenia nerek. Produkt Ketoprofen-SF może tymczasowo hamować agregację płytek. Pacjenci z zaburzeniami krzepnięcia krwi powinni być poddani ścisłej obserwacji. U pacjentów z nieprawidłowymi wynikami badań czynności wątroby lub chorobami wątroby w wywiadzie należy okresowo badać aktywność aminotransferaz, szczególnie podczas długotrwałego leczenia. Podczas dłuższego stosowania ketoprofenu wymagane jest regularne badanie aktywności enzymów wątrobowych, czynności nerek oraz morfologii krwi z rozmazem. Cukrzyca lub jednoczesne stosowanie leków oszczędzających potas może prowadzić do hiperkaliemii (patrz punkt 4.5). W takich przypadkach należy regularnie kontrolować stężenie potasu we krwi.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Podczas dłuższego stosowania leków analgetycznych może wystąpić ból głowy, którego nie należy leczyć poprzez zwiększenie dawki produktu leczniczego. Zasadniczo nałogowe przyjmowanie leków analgetycznych, w szczególności, gdy jednocześnie podaje się kilka substancji przeciwbólowych, może prowadzić do trwałego uszkodzenia nerek w tym niewydolności nerek (nefropatia polekowa). W czasie stosowania leków z grupy NLPZ działania niepożądane, zwłaszcza te dotyczące przewodu pokarmowego i ośrodkowego układu nerwowego, nasilają się, gdy jednocześnie jest spożywany alkohol. Stosowanie leków z grupy NLPZ może zaburzać płodność u kobiet, dlatego też ten produkt nie jest zalecany u kobiet planujących ciążę. U kobiet, które mają trudności z zajściem w ciążę lub które są poddawane badaniom w związku z niepłodnością, należy rozważyć zakończenie stosowania leków z grupy NLPZ (patrz punkt 4.6).
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlSpecjalne środki ostrozności
Duże objętości alkoholu benzylowego należy podawać z ostrożnością i tylko w razie konieczności, zwłaszcza u pacjentów z zaburzeniami czynności wątroby lub nerek oraz kobiet w ciąży i karmiących piersią z powodu ryzyka kumulacji i toksyczności (kwasica metaboliczna).
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie zaleca się stosowania z następującymi produktami: Inne NLPZ (w tym selektywne inhibitory cyklooksygenazy-2) oraz salicylany w dużych dawkach Jednoczesne stosowanie kilku leków z grupy NLPZ, w wyniku działania synergistycznego, może zwiększać ryzyko owrzodzenia przewodu pokarmowego i krwawień z przewodu pokarmowego. Z tego względu należy unikać jednoczesnego stosowania produktu Ketoprofen-SF wraz z innymi NLPZ (patrz punkt 4.4). Leki przeciwzakrzepowe (heparyna, warfaryna, acenokumarol) i leki hamujące agregację płytek krwi (tyklopidyna, klopidogrel) - Zwiększone ryzyko krwawienia. Leki z grupy NLPZ mogą wzmagać działanie leków przeciwzakrzepowych, takich jak warfaryna (patrz punkt 4.4). Jeżeli jednoczesne stosowanie jest konieczne, należy dokładnie monitorować stan zdrowia pacjenta.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlInterakcje
Lit - Istnieje ryzyko wzrostu stężenia litu w osoczu, a niekiedy prowadzące do toksycznego stężenia litu z powodu obniżonego stopnia wydalania litu przez nerki. Należy w związku z tym uważnie monitorować stężenie litu w surowicy krwi i dostosować jego dawkowanie w czasie leczenia NLPZ oraz po jego zakończeniu. Metotreksat w dawkach większych niż 15 mg/tydzień - W szczególności podczas podawania wysokich dawek (> 15 mg/tydzień) występuje zwiększone ryzyko toksycznego działania metotreksatu na krew i układ krwiotwórczy. Jest to prawdopodobnie związane z uwolnieniem metotreksatu z postaci związanej z białkami oraz jego zmniejszonego klirensu nerkowego. Należy zachować co najmniej 12-godzinny odstęp pomiędzy zakończeniem lub rozpoczęciem stosowania ketoprofenu a podaniem metotreksatu. Należy zachować ostrożność podczas stosowania z następującymi produktami: Leki moczopędne, inhibitory ACE i antagoniści angiotensyny II - Pacjenci, w szczególności pacjenci odwodnieni, przyjmujący leki moczopędne są narażeni na zwiększone ryzyko wystąpienia niewydolności nerek w następstwie zmniejszenia przepływu krwi przez nerki spowodowanego zahamowaniem prostaglandyn.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlInterakcje
Przed rozpoczęciem jednoczesnego stosowania tacy pacjenci powinni zostać nawodnieni, a następnie należy monitorować czynność nerek po rozpoczęciu leczenia (patrz punkt 4.4). U pacjentów z zaburzeniami czynności nerek (np. odwodnionych lub w podeszłym wieku) jednoczesne stosowanie inhibitorów ACE lub antagonistów angiotensyny II z produktami hamującymi cyklooksygenazę może prowadzić do dalszego pogorszenia czynności nerek, w tym ostrej niewydolności nerek, które jest zazwyczaj odwracalne. Należy zachować ostrożność podczas stosowania takiego połączenia, w szczególności u osób w podeszłym wieku. Należy pouczyć pacjenta o konieczności przyjmowania odpowiedniej ilości płynów oraz należy rozważyć regularną kontrolę czynności nerek po rozpoczęciu leczenia skojarzonego. Jednoczesne stosowanie produktu Ketoprofen-SF i diuretyków oszczędzających potas może prowadzić do hiperkaliemii. Należy kontrolować stężenie potasu we krwi.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlInterakcje
Metotreksat w dawkach mniejszych niż 15 mg/tydzień - W pierwszym tygodniu jednoczesnego stosowania, należy cotygodniowo wykonywać pełną morfologię krwi. Badanie należy wykonywać częściej w przypadku jakiegokolwiek zaburzenia czynności nerek i u pacjentów w podeszłym wieku. Podawanie produktu Ketoprofen-SF w ciągu 24 godzin przed lub po podaniu metotreksatu może prowadzić do zwiększenia stężenia metotreksatu i wzrostu jego toksycznego działania. Glikokortykosteroidy - Występuje zwiększone ryzyko owrzodzenia przewodu pokarmowego lub krwawień z przewodu pokarmowego (patrz punkt 4.4). Diuretyki pętlowe - Jednoczesne stosowanie diuretyków pętlowych może zwiększać częstość występowania zaburzeń czynności nerek. Pentoksyfilina - Występuje zwiększone ryzyko krwawienia. Konieczne jest częstsze monitorowanie kliniczne stanu pacjenta i kontrolowanie czasu krwawienia.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlInterakcje
Należy wziąć pod uwagę interakcje z następującymi produktami: Leki hipotensyjne (leki beta-adrenolityczne, inhibitory konwertazy angiotensyny, diuretyki) - Ryzyko zmniejszenia działania hipotensyjnego (hamowanie prostaglandyn rozszerzających naczynia). Antybiotyki – pochodne chinolonu: Istnieje zwiększone ryzyko wystąpienia drgawek u pacjentów stosujących NLPZ i chinoliny. Fenytoina - Jednoczesne stosowanie produktu Ketoprofen-SF wraz z lekami zawierającymi fenytoinę może zwiększać ich stężenie fenytoiny w surowicy krwi. Zaleca się monitorowanie stężenia fenytoiny w surowicy. Digoksyna - Leki z grupy NLPZ mogą zaostrzyć niewydolność serca oraz zwiększać stężenie digoksyny w surowicy krwi. Zaleca się monitorowanie stężenia digoksyny w surowicy. Heparyna w dawkach profilaktycznych - Zwiększone ryzyko krwawienia. Cyklosporyna, takrolimus - Ryzyko wystąpienia addycyjnego działania nefrotoksycznego, w szczególności u osób w podeszłym wieku. Trombolityki - Zwiększone ryzyko krwawienia.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlInterakcje
Probenecid i sulfinpirazon - Produkty lecznicze zawierające probenecid i sulfinpirazon mogą opóźniać wydalanie ketoprofenu. Selektywne inhibitory wychwytu zwrotnego serotoniny (ang. SSRI) - Występuje zwiększone ryzyko krwawień z przewodu pokarmowego (patrz punkt 4.4). Leki zobojętniające sok żołądkowy - Produkty zobojętniające sok żołądkowy mogą prowadzić do zmniejszenia wchłaniania produktu Ketoprofen-SF. Doustne leki przeciwcukrzycowe - Do chwili obecnej, badania kliniczne nie wykazały interakcji pomiędzy ketoprofenem a doustnymi lekami przeciwcukrzycowymi. Niemniej jednak zaleca się profilaktycznie kontrolę stężenia cukru w czasie skojarzonego leczenia. Ryzyko związane z hiperkaliemią - Niektóre produkty lecznicze lub grupy terapeutyczne leków mogą wywołać hiperkaliemię, np. sole potasu, leki moczopędne oszczędzające potas, inhibitory konwertazy angiotensyny, inhibitory receptora angiotensyny II, NLPZ, heparyny (niskocząsteczkowe lub niefrakcjonowane), cyklosporyna, takrolimus i trimetoprym.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlInterakcje
Wystąpienie hiperkaliemii może zależeć od współistnienia innych czynników. Ryzyko to jest większe, gdy wyżej wymienione leki są stosowane jednocześnie. Ryzyko związane z działaniem przeciwpłytkowym - Niektóre substancje powodują interakcje z ketoprofenem na skutek ich działania przeciwpłytkowego: tyrofiban, eptifibatyd, abcyksymab i iloprost. Stosowanie niektórych leków przeciwpłytkowych zwiększa ryzyko krwawienia.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może mieć negatywny wpływ na przebieg ciąży i (lub) rozwój zarodka i płodu. Dane z badań epidemiologicznych wskazują na zwiększone ryzyko poronienia, jak również wad serca i wytrzewienia, po użyciu inhibitorów syntezy prostaglandyn we wczesnej ciąży. Całkowite ryzyko wystąpienia sercowo-naczyniowych wad rozwojowych zwiększa się z poniżej 1% do około 1,5%. Ryzyko zwiększa się wraz z dawką i czasem trwania leczenia. U zwierząt wykazano, że podanie inhibitora syntezy prostaglandyn prowadzi do zwiększonej utraty zarodka przed i po jego zagnieżdżeniu oraz zwiększonej śmiertelności zarodków i płodów. Ponadto, zwiększona ilość wad rozwojowych, w tym wady sercowo-naczyniowe, była raportowana u zwierząt, którym podawano inhibitor syntezy prostaglandyn podczas fazy organogenezy. Od 20. tygodnia ciąży stosowanie ketoprofenu może powodować małowodzie spowodowane zaburzeniami czynności nerek płodu.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlWpływ na płodność, ciążę i laktację
Może ono wystąpić krótko po rozpoczęciu leczenia i zwykle ustępuje po jego przerwaniu. Ponadto zgłaszano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze, z których większość ustąpiła po zaprzestaniu leczenia. W związku z tym, w czasie pierwszego i drugiego trymestru ciąży ketoprofen należy podawać jedynie w przypadku zdecydowanej konieczności. Jeżeli ketoprofen podawany jest kobiecie, która zamierza zajść w ciążę, oraz gdy jest podawany w pierwszym lub drugim trymestrze ciąży, dawka powinna być możliwie najmniejsza, a czas leczenia możliwie jak najkrótszy. Kilka dni po 20. tygodniu ciąży należy rozważyć przedporodową obserwację w celu wykrycia małowodzia i zwężenia przewodu tętniczego po narażeniu na ketoprofen. W razie stwierdzenia małowodzia lub zwężenia przewodu tętniczego należy zaprzestać stosowania ketoprofenu.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlWpływ na płodność, ciążę i laktację
W czasie trzeciego trymestru ciąży, wszystkie inhibitory prostaglandyn mogą narazić płód na: d działanie toksyczne na układ krążenia i płuca (przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne), zaburzenia czynności nerek (patrz powyżej). Można również narazić matkę i dziecko pod koniec trwania ciąży na: możliwość przedłużenia czasu krwawienia, hamujący wpływ na agregację płytek, który może wystąpić nawet po bardzo małych dawkach, hamowanie skurczów macicy mogące powodować opóźnienie lub przedłużenie porodu. W związku z powyższym ketoprofen jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3 oraz 5.3). Karmienie piersi? Brak danych dotyczących przenikania ketoprofenu do mleka ludzkiego. Nie zaleca się stosowania ketoprofenu w okresie karmienia piersią.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlWpływ na płodność, ciążę i laktację
Płodność Podobnie jak w przypadku innych produktów leczniczych, o których wiadomo, że hamują cyklooksygenazy/syntezę prostaglandyn, stosowanie ketoprofenu może zaburzać płodność u kobiet dlatego też nie jest zalecany u kobiet planujących ciążę. U kobiet, które mają trudności z zajściem w ciążę lub które są poddawane badaniom w związku z niepłodnością, należy rozważyć zakończenie stosowania ketoprofenu.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Należy poinformować pacjentów o możliwości wystąpienia senności, zawrotów głowy lub drgawek i odradzić im prowadzenie pojazdów oraz obsługiwanie maszyn w przypadku pojawienia się takich objawów. Należy poinformować pacjentów o możliwości wystąpienia zaburzeń widzenia. Jeżeli wystąpią one u pacjenta, nie powinien on prowadzić pojazdów ani obsługiwać maszyn. Ponieważ w czasie stosowania dużych dawek produktu Ketoprofen-SF mogą wystąpić działania niepożądane dotyczące ośrodkowego układu nerwowego (np.: zmęczenie, zawroty głowy), zdolność reakcji może być zmieniona w pojedynczych przypadkach oraz zdolność prowadzenia pojazdów i obsługiwania maszyn może być ograniczona. W szczególności odnosi się to do interakcji z alkoholem.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlDziałania niepożądane
4.8 Działania niepożądane W odniesieniu do wymienionych działań niepożądanych produktu leczniczego należy pamiętać, iż są one głównie zależne od dawki oraz występuje różnica międzyosobnicza w ich występowaniu. Najczęstszymi obserwowanymi działaniami niepożądanymi są działania dotyczące przewodu pokarmowego. Owrzodzenie żołądka, perforacja lub krwawienie z przewodu pokarmowego, również ze skutkiem śmiertelnym, mogą wystąpić, szczególnie u pacjentów w podeszłym wieku (patrz punkt 4.4). Po podaniu produktu leczniczego odnotowano nudności, wymioty, biegunki, wzdęcia, zaparcia, niestrawność, ból brzucha, smołowate stolce, krwawe wymioty, wrzodziejące zapalenie jamy ustnej, pogorszenie przebiegu zapalenia jelita grubego i choroby Crohna (patrz punkt 4.4). Rzadziej obserwowano zapalenie błony śluzowej żołądka. Ryzyko wystąpienia krwawienia z przewodu pokarmowego w szczególności zależy od dawki i czasu trwania leczenia.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlDziałania niepożądane
W związku z leczeniem NLPZ zgłaszano występowanie obrzęków, nadciśnienia i niewydolności serca. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zaburzeń zakrzepowych w obrębie tętnic (np. zawał serca lub udar), patrz punkt 4.4. Zgłaszano następujące działania niepożądane związane ze stosowaniem ketoprofenu u osób dorosłych:
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy Jako objawy przedawkowania mogą wystąpić zaburzenia ośrodkowego układu nerwowego z bólem głowy, zawrotami głowy, sennością, otępieniem i utratą przytomności jak również ból brzucha, biegunka, nudności i wymioty. Ponadto mogą wystąpić niedociśnienie tętnicze, depresja oddechowa, krwawienie z przewodu pokarmowego i sinica. Sposób postępowania Brak specyficznej odtrutki. Pacjenta należy natychmiast przetransportować do wyspecjalizowanego oddziału szpitalnego, gdzie można rozpocząć leczenie objawowe.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Niesteroidowe leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu propionowego kod ATC: M01A E03. Ketoprofen jest niesteroidowym lekiem przeciwzapalnym (NLPZ), który okazał się być skuteczny w tradycyjnych modelach stanu zapalnego u zwierząt, poprzez hamowanie syntezy prostaglandyn. U ludzi ketoprofen zmniejsza ból, obrzęk i gorączkę, wywołane stanem zapalnym. Ponadto, ketoprofen hamuje indukowaną kolagenem agregację płytek.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Ketoprofen po podaniu doustnym ulega szybkiemu wchłanianiu po przejściu do jelita cienkiego. Maksymalne stężenie w osoczu następuje po 1 – 2 godzin od podania doustnego i doodbytniczego oraz po 20 – 30 minutach od podania domięśniowego. Dostępność ogólnoustrojowa wynosi ponad 90% po podaniu doustnym oraz ponad 70% po podaniu domięśniowym i doodbytniczym. Po metabolizmie w wątrobie (hydroksylacja, sprzęganie), farmakologicznie nieaktywne metabolity są wydalane głównie przez nerki (92 – 98%), a pozostałość z żółcią. U zdrowych osobników okres półtrwania wynosi 1,5 – 2,5 h, ale może również wynosić 8 godzin. U pacjentów z zaburzeniami czynności nerek, wydalanie może być wydłużone proporcjonalnie do stopnia zaburzeń. Stopień wiązania z białkami osocza wynosi około 99%.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach, toksyczność subchroniczna i przewlekła objawiały się głównie jako rany i owrzodzenia przewodu pokarmowego oraz jako uszkodzenia nerek. W serii standardowych testów in vitro i in vivo dotyczących mutagenności nie wykazano działania mutagennego. Badania długotrwałe na szczurach i myszach nie wykazały potencjalnego działania kancerogennego ketoprofenu. W dawce ≥6 mg/kg mc./dobę ketoprofen może prowadzić do zaburzeń dotyczących zagnieżdżenia, płodności oraz porodu u samic szczura. Potencjał embriotoksyczny ketoprofenu został zbadany na kilku gatunkach zwierząt. Brak dowodu na jakiekolwiek teratogenne działanie ketoprofenu.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Arginina Alkohol benzylowy Kwas cytrynowy jednowodny Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata. Należy zużyć natychmiast po otwarciu. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem. 6.5 Rodzaj i zawartość opakowania Ampułki z oranżowego szkła typu I zawierające po 2 ml roztworu do wstrzykiwań: Opakowanie zawierające 1; 5; 10; 20; 30; 50 ampułek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami. Produkty lecznicze przeznaczone do podawania pozajelitowego należy obejrzeć przed użyciem.
- CHPL leku Ketoprofen-SF, roztwór do wstrzykiwań, 50 mg/mlDane farmaceutyczne
Należy stosować wyłącznie przejrzyste roztwory bez widocznych cząstek.
- CHPL leku o rpl_id: 100380703Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Ketonal Fast, 25 mg, granulat do sporządzania roztworu doustnego, w saszetce Ketonal Fast, 50 mg, granulat do sporządzania roztworu doustnego, w saszetce 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Ketonal Fast, 25 mg Każda saszetka zawiera 25 mg ketoprofenu (Ketoprofenum) w postaci ketoprofenu z lizyną (40 mg). Ketonal Fast, 50 mg Każda dwudzielna saszetka zawiera 50 mg ketoprofenu (Ketoprofenum) w postaci ketoprofenu z lizyną (80 mg). Pełny wykaz substancji pomocniczych: patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Granulat do sporządzania roztworu doustnego, w saszetce. Granulat o barwie białej lub żółtawej.
- CHPL leku o rpl_id: 100380703Wskazania do stosowania
4.1 Wskazania do stosowania Dorośli Produkt leczniczy Ketonal Fast jest wskazany do stosowania u dorosłych w objawowym leczeniu bólu i zapalenia w następujących stanach: zapalenie występujące po urazie bolesne stany zapalne w stomatologii, otolaryngologii, urologii i pulmonologii ból w przebiegu choroby zwyrodnieniowej stawów reumatoidalne zapalenie stawów zesztywniające zapalenie stawów kręgosłupa choroby reumatyczne obejmujące tkanki pozastawowe Dzieci i młodzież Produkt leczniczy Ketonal Fast jest wskazany do stosowania u młodzieży w wieku 16 lat i starszej w objawowym i krótkotrwałym leczeniu bólu oraz zapalenia przebiegającego z gorączką lub bez gorączki, w stanach, które dotyczą np. układu kostno-stawowego, bólu pooperacyjnego i zapalenia ucha.
- CHPL leku o rpl_id: 100380703Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Przyjmowanie produktu leczniczego przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.4). Dorośli oraz młodzież w wieku 16 lat i starsza Ketonal Fast, 25 mg Dwie saszetki zawierające łącznie 50 mg ketoprofenu trzy razy na dobę, co odpowiada 80 mg ketoprofenu z lizyną trzy razy na dobę. Ketonal Fast, 50 mg Jedna saszetka zawierająca 50 mg ketoprofenu trzy razy na dobę, co odpowiada 80 mg ketoprofenu z lizyną trzy razy na dobę. Maksymalna dawka dobowa ketoprofenu wynosi 200 mg. Przed rozpoczęciem leczenia dawką 200 mg na dobę należy dokładnie rozważyć stosunek ryzyka do korzyści, a stosowanie większej dawki ketoprofenu niż maksymalna nie jest zalecane (patrz również punkt 4.4). Osoby w podeszłym wieku U pacjentów w podeszłym wieku lekarz powinien ostrożnie ustalać dawkę i w razie konieczności zalecić stosowanie dawki mniejszej niż wyżej wskazana.
- CHPL leku o rpl_id: 100380703Dawkowanie
Dzieci i młodzież Ten produkt leczniczy nie jest przeznaczony dla dzieci i młodzieży w wieku poniżej 16 lat. Zaburzenia czynności wątroby U pacjentów z lekkimi do umiarkowanych zaburzeń czynności wątroby zaleca się zmniejszenie dawki początkowej i kontynuowanie leczenia najmniejszą dawką skuteczną (patrz punkt 4.4). U pacjentów z ciężkimi zaburzeniami czynności wątroby stosowanie ketoprofenu jest przeciwwskazane (patrz punkt 4.3). Zaburzenia czynności nerek U pacjentów z lekkimi lub umiarkowanymi zaburzeniami czynności nerek zaleca się zmniejszenie dawki początkowej i kontynuowanie terapii najmniejszą dawką skuteczną. Indywidualne dostosowanie dawki należy rozważyć dopiero po ustaleniu dobrej tolerancji dawki początkowej. Należy kontrolować czynność nerek (patrz punkt 4.4). U pacjentów z ciężkimi zaburzeniami czynności nerek stosowanie ketoprofenu jest przeciwwskazane (patrz punkt 4.3). Sposób stosowania Podanie doustne.
- CHPL leku o rpl_id: 100380703Dawkowanie
Ketonal Fast, 25 mg Saszetka zawiera granulat z 25 mg ketoprofenu (co odpowiada 40 mg ketoprofenu z lizyną). Przygotowanie roztworu doustnego, patrz punkt 6.6. Roztwór należy przyjmować podczas posiłku. Ketonal Fast, 50 mg Po otwarciu saszetki wzdłuż linii oznaczonej „pół dawki” uzyskuje się granulat z 25 mg ketoprofenu (co odpowiada 40 mg ketoprofenu z lizyną). Po otwarciu saszetki wzdłuż linii oznaczonej „pełna dawka” uzyskuje się granulat z 50 mg ketoprofenu (co odpowiada 80 mg ketoprofenu z lizyną). Przygotowanie roztworu doustnego, patrz punkt 6.6. Roztwór należy przyjmować podczas posiłku.
- CHPL leku o rpl_id: 100380703Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, na kwas acetylosalicylowy (ASA) lub inne niesteroidowe leki przeciwzapalne (NLPZ), lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Obejmuje to występujące w wywiadzie reakcje nadwrażliwości, takie jak skurcz oskrzeli, napad astmy oskrzelowej, zapalenie błony śluzowej nosa, pokrzywka lub innego rodzaju reakcje alergiczne wywołane podaniem ketoprofenu, kwasu acetylosalicylowego lub innych NLPZ. U takich pacjentów notowano ciężkie, rzadko zakończone zgonem przypadki reakcji anafilaktycznych (patrz punkt 4.8). Astma oskrzelowa w wywiadzie. Czynna choroba wrzodowa żołądka i (lub) dwunastnicy lub krwawienie z przewodu pokarmowego, owrzodzenie albo perforacja przewodu pokarmowego w wywiadzie. Choroba Leśniowskiego-Crohna lub wrzodziejące zapalenie jelita grubego. Ciężka niewydolność serca. Ciężka niewydolność wątroby. Ciężka niewydolność nerek. Skaza krwotoczna. Trzeci trymestr ciąży.
- CHPL leku o rpl_id: 100380703Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ostrzeżenia Przyjmowanie produktu leczniczego w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz niżej: ryzyko powikłań ze strony układu pokarmowego i sercowo-naczyniowego). Należy unikać jednoczesnego stosowania ketoprofenu z niesteroidowymi lekami przeciwzapalnymi (NLPZ), w tym z selektywnymi inhibitorami cyklooksygenazy-2. Krwawienie z przewodu pokarmowego, owrzodzenie i perforacja. W przypadku wszystkich NLPZ opisywano występowanie krwawienia z przewodu pokarmowego, owrzodzenia lub perforacji (z możliwym skutkiem śmiertelnym), które mogą występować w dowolnym momencie leczenia, również bez objawów zwiastunowych lub ciężkich zdarzeń dotyczących przewodu pokarmowego w wywiadzie.
- CHPL leku o rpl_id: 100380703Specjalne środki ostrozności
Dane epidemiologiczne sugerują, że stosowanie ketoprofenu (zwłaszcza dużych dawek) może wiązać się z większym ryzykiem toksycznego wpływu na przewód pokarmowy w porównaniu z niektórymi innymi NLPZ (patrz również punkt 4.3). Zaleca się ostrożność w przypadku pacjentów otrzymujących jednocześnie produkty lecznicze, które mogą zwiększać ryzyko owrzodzenia lub krwawienia z przewodu pokarmowego, takie jak doustne kortykosteroidy, leki przeciwzakrzepowe (takie jak warfaryna), selektywne inhibitory wychwytu zwrotnego serotoniny, leki przeciwpłytkowe (takie jak kwas acetylosalicylowy) lub nikorandyl (patrz punkt 4.5). Ryzyko krwawienia, owrzodzenia lub perforacji w obrębie przewodu pokarmowego jest większe podczas stosowania większych dawek NLPZ, u pacjentów z przebytą chorobą wrzodową żołądka i (lub) dwunastnicy, zwłaszcza powikłaną krwawieniem lub perforacją (patrz punkt 4.3), a także u pacjentów w podeszłym wieku. U tych pacjentów leczenie należy rozpoczynać od najmniejszej dostępnej dawki.
- CHPL leku o rpl_id: 100380703Specjalne środki ostrozności
U tych pacjentów, a także u pacjentów, u których konieczne jest jednoczesne stosowanie kwasu acetylosalicylowego w małych dawkach lub innych leków potencjalnie zwiększających ryzyko powikłań dotyczących przewodu pokarmowego, należy rozważyć jednoczesne podawanie leków o działaniu ochronnym, np. mizoprostolu lub inhibitorów pompy protonowej (patrz niżej oraz punkt 4.5). Pacjenci z powikłaniami ze strony przewodu pokarmowego w wywiadzie, zwłaszcza w podeszłym wieku, powinni zgłaszać wszelkie nietypowe objawy dotyczące jamy brzusznej (zwłaszcza krwawienie z przewodu pokarmowego), szczególnie w początkowym okresie leczenia. Pacjenci w podeszłym wieku: u pacjentów w podeszłym wieku zwiększa się częstość działań niepożądanych związanych ze stosowaniem NLPZ, zwłaszcza krwawienia z przewodu pokarmowego i perforacji, które może zakończyć się zgonem.
- CHPL leku o rpl_id: 100380703Specjalne środki ostrozności
Jeśli u pacjentów otrzymujących ketoprofen wystąpi krwawienie z przewodu pokarmowego lub choroba wrzodowej żołądka i (lub) dwunastnicy, leczenie należy przerwać. Ciężkie reakcje skórne (niektóre z możliwym skutkiem śmiertelnym), w tym złuszczające zapalenie skóry, zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka, były bardzo rzadko opisywane w związku z zastosowaniem NLPZ (patrz punkt 4.8). Ryzyko takich reakcji jest prawdopodobnie największe w początkowym okresie leczenia – w większości przypadków pojawiały się one w pierwszym miesiącu leczenia. Po wystąpieniu pierwszych oznak wysypki, zmian w obrębie błon śluzowych lub jakichkolwiek innych objawów nadwrażliwości, ketoprofen należy odstawić. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych niesteroidowych leków przeciwzapalnych (szczególnie w dużych dawkach i długotrwale) może wiązać się ze zwiększeniem ryzyka tętniczych incydentów zatorowo-zakrzepowych (np.
- CHPL leku o rpl_id: 100380703Specjalne środki ostrozności
zawał mięśnia sercowego lub udar mózgu). Dane te są niewystarczające, aby wykluczyć takie ryzyko w przypadku przyjmowania ketoprofenu. Zgłaszano także zwiększone ryzyko tętniczych zdarzeń zakrzepowych u pacjentów leczonych NLPZ (z wyłączeniem kwasu acetylosalicylowego) w bólu okołooperacyjnym po pomostowaniu aortalno-wieńcowym (ang. coronary artery bypass surgery, CABG). Dzieci i młodzież U niektórych dzieci i młodzieży otrzymujących ketoprofen z lizyną zgłaszano krwawienie z przewodu pokarmowego (czasami poważne) i owrzodzenie (patrz punkt 4.8). Z tego względu produkt leczniczy należy stosować u tych pacjentów pod ścisłym nadzorem medycznym, a lekarz powinien oceniać stosowany schemat leczenia indywidualnie u każdego pacjenta. Ten produkt leczniczy nie jest przeznaczony dla dzieci i młodzieży w wieku poniżej 16 lat.
- CHPL leku o rpl_id: 100380703Specjalne środki ostrozności
Środki ostrożności U pacjentów z niewydolnością serca, marskością i nerczycą, pacjentów otrzymujących leki moczopędne, pacjentów z przewlekłą niewydolnością nerek, zwłaszcza jeśli są w podeszłym wieku, konieczne jest uważne kontrolowanie czynności nerek na początku leczenia. Podanie tym pacjentom ketoprofenu może spowodować zmniejszenie perfuzji nerek na skutek hamowania syntezy prostaglandyn i prowadzić do dekompensacji czynności nerek. Należy zachować ostrożność u pacjentów z nadciśnieniem tętniczym i (lub) lekką do umiarkowanej zastoinową niewydolnością serca w wywiadzie, gdyż podczas leczenia NLPZ opisywano zatrzymanie płynów i obrzęki. Maskowanie objawów zakażenia podstawowego. Ketoprofen może maskować objawy zakażenia, co może prowadzić do opóźnionego rozpoczęcia stosowania właściwego leczenia, a przez to pogarszać skutki zakażenia. Zjawisko to zaobserwowano w przypadku pozaszpitalnego bakteryjnego zapalenia płuc i powikłań bakteryjnych ospy wietrznej.
- CHPL leku o rpl_id: 100380703Specjalne środki ostrozności
Jeśli ketoprofen stosowany jest z powodu gorączki lub bólu związanych z zakażeniem, zaleca się kontrolowanie przebiegu zakażenia. W warunkach pozaszpitalnych pacjent powinien skonsultować się z lekarzem, jeśli objawy utrzymują się lub nasilają. U pacjentów z nieprawidłowymi wynikami badań czynności wątroby lub z chorobami wątroby w wywiadzie należy okresowo kontrolować aktywność aminotransferaz, zwłaszcza podczas długotrwałego leczenia. W razie znacznego zwiększenia ich aktywności, leczenie trzeba przerwać. Podczas leczenia ketoprofenem opisywano rzadkie przypadki żółtaczki i zapalenia wątroby. NLPZ mogą zaburzać płodność u kobiet (patrz punkt 4.6). U pacjentów z astmą oskrzelową współistniejącą z przewlekłym zapaleniem błony śluzowej nosa, przewlekłym zapaleniem zatok i (lub) polipami nosa częściej niż u innych osób mogą występować reakcje alergiczne na kwas acetylosalicylowy i (lub) NLPZ.
- CHPL leku o rpl_id: 100380703Specjalne środki ostrozności
Podanie produktu Ketonal Fast może wywołać napad astmy lub skurcz oskrzeli, zwłaszcza u osób uczulonych na kwas acetylosalicylowy lub NLPZ (patrz punkt 4.3). Możliwe jest wystąpienie hiperkaliemii, szczególnie u pacjentów z cukrzycą, niewydolnością nerek i (lub) jednocześnie leczonych lekami sprzyjającymi wystąpieniu hiperkaliemii (patrz punkt 4.5). W takich okolicznościach należy kontrolować stężenie potasu. Podobnie jak w przypadku wszystkich NLPZ, należy zachować ostrożność podczas leczenia pacjentów z niekontrolowanym nadciśnieniem tętniczym, zastoinową niewydolnością serca, chorobą niedokrwienną serca, chorobą tętnic obwodowych i (lub) chorobą naczyń mózgowych, a także przed rozpoczęciem długotrwałego leczenia pacjentów z czynnikami ryzyka chorób układu krążenia (np. z nadciśnieniem tętniczym, hiperlipidemią, cukrzycą, palących tytoń). W razie wystąpienia zaburzeń wzroku (takich jak niewyraźne widzenie), leczenie należy przerwać.
- CHPL leku o rpl_id: 100380703Specjalne środki ostrozności
Produkt leczniczy Ketonal Fast zawiera mniej niż 1 mmol (23 mg) sodu na saszetkę, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
- CHPL leku o rpl_id: 100380703Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Niezalecane leczenie skojarzone Inne NLPZ (w tym z selektywne inhibitory cyklooksygenazy-2) i duże dawki salicylanów: Zwiększone ryzyko owrzodzenia w obrębie przewodu pokarmowego oraz krwawienia. Leki przeciwzakrzepowe (heparyna i antagoniści witaminy K [np. warfaryna], inhibitory agregacji płytek [np. tyklopidyna, klopidogrel], inhibitory trombiny [np. dabigatran], bezpośrednie inhibitory czynnika Xa [np. apiksaban, rywaroksaban, edoksaban]): Zwiększone ryzyko krwawienia (patrz punkt 4.4). Jeśli jednoczesne podawanie jest konieczne, należy uważnie kontrolować stan pacjenta. Lit: Ryzyko zwiększenia stężenia litu w osoczu (niekiedy do wartości toksycznych) na skutek zmniejszenia jego wydalania nerkowego. Jeśli to konieczne, zaleca się uważne kontrolowanie stężenia litu w osoczu oraz dostosowanie jego dawki na początku i po zakończeniu leczenia NLPZ.
- CHPL leku o rpl_id: 100380703Interakcje
Metotreksat w dawce 15 mg/tydzień lub większej: Zwiększone ryzyko toksyczności hematologicznej metotreksatu, zwłaszcza stosowanego w dużych dawkach (≥15 mg/tydzień), prawdopodobnie na skutek wypierania metotreksatu z miejsc wiążących z białkami i zmniejszonego klirensu nerkowego. Pochodne hydantoiny (np. fenytoina) i sulfonamidy: Ketoprofen może nasilić toksyczne działanie tych substancji. Leczenie skojarzone wymagające ostrożności Produkty lecznicze i grupy leków, które mogą sprzyjać wystąpieniu hiperkaliemii (tj. sole potasu, leki moczopędne oszczędzające potas, inhibitory ACE i antagoniści receptora angiotensyny II, NLPZ, heparyny (drobnocząsteczkowe lub niefrakcjonowane), cyklosporyna, takrolimus i trymetoprym): Ryzyko hiperkaliemii może być zwiększone, kiedy produkty lecznicze wymienione wyżej są stosowane jednocześnie. Inhibitory ACE i antagoniści angiotensyny II: U pacjentów z zaburzeniami czynności nerek (np.
- CHPL leku o rpl_id: 100380703Interakcje
odwodnionych lub w podeszłym wieku) jednoczesne podawanie inhibitora ACE lub antagonisty angiotensyny II i leku hamującego aktywność cyklooksygenazy może spowodować dalsze pogorszenie czynności nerek, z możliwością wystąpienia ostrej niewydolności nerek. Kortykosteroidy: Zwiększone ryzyko owrzodzenia w obrębie przewodu pokarmowego lub krwawienia (patrz punkt 4.4). Leki moczopędne: U pacjentów (zwłaszcza odwodnionych) otrzymujących leki moczopędne istnieje zwiększone ryzyko rozwoju niewydolności nerek wtórnej do zmniejszonej perfuzji w wyniku zahamowania syntezy prostaglandyn. Pacjentów takich należy nawodnić przed rozpoczęciem leczenia skojarzonego i na początku leczenia kontrolować u nich czynność nerek (patrz punkt 4.4). Metotreksat w dawkach mniejszych niż 15 mg/tydzień: W pierwszych tygodniach skojarzonego leczenia należy raz w tygodniu kontrolować pełną morfologię krwi.
- CHPL leku o rpl_id: 100380703Interakcje
Badanie należy wykonywać częściej w razie stwierdzenia jakichkolwiek zmian czynności nerek lub jeśli pacjent jest w podeszłym wieku. Pentoksyfilina: Istnieje zwiększone ryzyko krwawienia. Konieczne jest częstsze monitorowanie kliniczne stanu pacjenta i kontrolowanie czasu krwawienia. Tenofowir: Jednoczesne stosowanie fumaranu dizoproksylu tenofowiru i NLPZ może zwiększać ryzyko niewydolności nerek. Nikorandyl: Jednoczesne stosowanie nikorandylu i NLPZ może zwiększać ryzyko ciężkich powikłań, takich jak owrzodzenie przewodu pokarmowego, perforacja i krwawienie (patrz punkt 4.4). Glikozydy naparstnicy: NLPZ mogą zaostrzać niewydolność serca, zmniejszać przesączanie kłębuszkowe i zwiększać stężenie glikozydów w osoczu. Nie wykazano jednak interakcji farmakokinetycznej między ketoprofenem a digoksyną.
- CHPL leku o rpl_id: 100380703Interakcje
Zydowudyna: Istnieje ryzyko zwiększenia toksycznego działania na układ czerwonokrwinkowy w wyniku niekorzystnego wpływu na retikulocyty, z możliwością wystąpienia ciężkiej niedokrwistości w ciągu jednego tygodnia od rozpoczęcia stosowania NLPZ. W okresie od 1 do 2 tygodni od rozpoczęcia stosowania soli lizynowej ketoprofenu należy kontrolować pełną morfologię krwi oraz liczbę retikulocytów. Pochodne sulfonylomocznika: NLPZ mogą zwiększać hipoglikemizujące działanie pochodnych sulfonylomocznika, wypierając je z połączeń z białkami osocza. Skojarzone leczenie do rozważenia Leki przeciwnadciśnieniowe (leki beta-adrenolityczne, inhibitory konwertazy angiotensyny, leki moczopędne): Ryzyko słabszego działania przeciwnadciśnieniowego (hamowanie przez NLPZ prostaglandyn rozszerzających naczynia krwionośne). Cyklosporyna, takrolimus: Ryzyko dodatkowego działania nefrotoksycznego, zwłaszcza u pacjentów w podeszłym wieku.
- CHPL leku o rpl_id: 100380703Interakcje
Probenecyd: Jednoczesne stosowanie probenecydu może znacząco zmniejszyć klirens ketoprofenu z osocza. Selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI): Zwiększone ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.4). Leki trombolityczne: Zwiększone ryzyko krwawienia.
- CHPL leku o rpl_id: 100380703Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może mieć szkodliwy wpływ na przebieg ciąży i (lub) rozwój zarodka lub płodu. Dane z badań epidemiologicznych wskazują, że stosowanie inhibitora syntezy prostaglandyn we wczesnym okresie ciąży wiąże się ze zwiększonym ryzykiem poronienia i rozwoju wad rozwojowych serca oraz wytrzewienia jelit. Bezwzględne ryzyko wad dotyczących układu sercowo-naczyniowego zwiększyło się z mniej niż 1% do około 1,5%. Uważa się, że ryzyko zwiększa się wraz ze zwiększeniem dawki i wydłużeniem czasu leczenia. Wykazano, że u zwierząt podanie inhibitora syntezy prostaglandyn powoduje zwiększoną utratę przed- i poimplantacyjną zarodków oraz zwiększenie śmiertelności zarodków i płodów. Ponadto stwierdzono, że podawanie zwierzętom inhibitora syntezy prostaglandyn w okresie organogenezy zwiększa częstość rozwoju różnych wad rozwojowych, w tym dotyczących układu sercowo-naczyniowego.
- CHPL leku o rpl_id: 100380703Wpływ na płodność, ciążę i laktację
Ketoprofenu nie należy stosować w pierwszym i drugim trymestrze ciąży, jeśli nie jest to bezwzględnie konieczne. Jeśli ketoprofen stosowany jest u kobiet usiłujących zajść w ciążę lub u kobiet w pierwszym i drugim trymestrze ciąży, należy go podawać w możliwie najmniejszej dawce przez możliwie najkrótszy czas. Wszystkie inhibitory syntezy prostaglandyn: stosowane w trzecim trymestrze ciąży mogą narazić płód na: toksyczne działanie na układ sercowy i płucny (z przedwczesnym zamknięciem przewodu tętniczego i nadciśnieniem płucnym); zaburzenia czynności nerek, które mogą postępować do niewydolności nerek z małowodziem; przyjmowane pod koniec ciąży mogą narazić matkę i noworodka na: wydłużenie czasu krwawienia, działanie przeciwagregacyjne, które może wystąpić nawet po zastosowaniu małych dawek ketoprofenu; zahamowanie skurczów macicy, które prowadzi do opóźnienia lub przedłużenia porodu.
- CHPL leku o rpl_id: 100380703Wpływ na płodność, ciążę i laktację
Z tego względu stosowanie ketoprofenu w trzecim trymestrze ciąży jest przeciwwskazane. Karmienie piersi? Brak dostępnych danych dotyczących przenikania ketoprofenu do mleka kobiecego. Nie zaleca się stosowania produktu leczniczego u kobiet karmiących piersią. Płodność Stosowanie NLPZ może osłabiać płodność u kobiet i nie jest ono zalecane u kobiet, które planują ciążę. U kobiet, które mają trudności z zajściem w ciążę lub które są poddawane badaniom w związku z niepłodnością, należy rozważyć odstawienie NLPZ.
- CHPL leku o rpl_id: 100380703Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy Ketonal Fast nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Jednak pacjentów należy ostrzec o możliwości wystąpienia działań niepożądanych, takich jak senność, zawroty głowy, drgawki lub niewyraźne widzenie i odradzić w takim przypadku prowadzenie pojazdów lub obsługiwanie maszyn.
- CHPL leku o rpl_id: 100380703Działania niepożądane
4.8 Działania niepożądane Najczęściej obserwowane działania niepożądane dotyczą przewodu pokarmowego. Możliwe jest wystąpienie choroby wrzodowej żołądka i (lub) dwunastnicy, perforacji lub krwawienia z przewodu pokarmowego (niekiedy zakończonego zgonem), zwłaszcza u osób w podeszłym wieku (patrz punkt 4.4). Zgłaszano również nudności, wymioty, biegunkę, wzdęcia, zaparcie, niestrawność, ból brzucha, smoliste stolce, krwawe wymioty, wrzodziejące zapalenie błony śluzowej jamy ustnej, zaostrzenie zapalenia jelita grubego i choroby Leśniowskiego-Crohna (patrz punkt 4.4). Rzadziej notowano zapalenie błony śluzowej żołądka. W badaniach klinicznych u niemowląt i dzieci zgłaszano wymioty, biegunkę i reakcje nadwrażliwości. Klasyfikacja częstości działań niepożądanych: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych).
- CHPL leku o rpl_id: 100380703Działania niepożądane
Następujące działania niepożądane notowano podczas stosowania ketoprofenu u dorosłych: Klasyfikacja układów i narządów Często Niedokrwistość pokrwotoczna Niezbyt często Agranulocytoza, małopłytkowość, niewydolność szpiku kostnego, niedokrwistość hemolityczna, leukopenia Zaburzenia układu immunologicznego Reakcje anafilaktyczne (w tym wstrząs), obrzęk jamy ustnej Zaburzenia metabolizmu i odżywiania Hiponatremia, hiperkaliemia (patrz punkt 4.4) Zaburzenia psychiczne Splątanie, zmiany nastroju, pobudliwość, bezsenność Zaburzenia układu nerwowego Ból głowy, zawroty głowy pochodzenia ośrodkowego, senność, zawroty głowy pochodzenia obwodowego Parestezje Dyskineza, omdlenie Jałowe zapalenie opon mózgowo-rdzeniowych, drgawki, zaburzenia smaku Zaburzenia oka Niewyraźne widzenie (patrz punkt 4.4) Obrzęk okołooczodołowy Zaburzenia ucha i błędnika Szumy uszne Zaburzenia serca Niewydolność serca, kołatanie serca, migotanie przedsionków Zaburzenia naczyniowe Niedociśnienie tętnicze Nadciśnienie tętnicze, rozszerzenie naczyń krwionośnych, tachykardia, zapalenie naczyń (w tym leukocytoklastyczne zapalenie naczyń) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Astma oskrzelowa Obrzęk krtani Skurcz oskrzeli (zwłaszcza u pacjentów z nadwrażliwością na ASA i inne NLPZ), zapalenie błony śluzowej nosa, duszność, skurcz krtani Zaburzenia żołądka i jelit Niestrawność, nudności, ból brzucha, wymioty Zaparcie, biegunka, wzdęcia, zapalenie błony śluzowej żołądka Zapalenie błony śluzowej jamy ustnej, wrzód trawienny Zaostrzenie zapalenia jelita grubego i choroby Leśniowskiego-Crohna, krwawienie z przewodu pokarmowego i perforacja, zapalenie trzustki, gorączka Zaburzenia wątroby i dróg żółciowych Zapalenie wątroby, zwiększenie aktywności aminotransferaz, zwiększenie stężenia bilirubiny w surowicy w wyniku zaburzeń czynności wątroby Zaburzenia skóry i tkanki podskórnej Wysypka, świąd Nadwrażliwość na światło, łysienie, pokrzywka, obrzęk naczynioruchowy, reakcje pęcherzowe, w tym zespół Stevensa-Johnsona, toksyczne martwicze oddzielanie się naskórka, ostra uogólniona osutka krostkowa, rumień, osutka, wysypka grudkowo-plamista, zapalenie skóry Zaburzenia nerek i dróg moczowych Krwiomocz Ostra niewydolność nerek, cewkowo-śródmiąższowe zapalenie nerek, zespół nerczycowy, nieprawidłowe wyniki badań czynności nerek Zaburzenia ogólne i stany w miejscu podania Obrzęk, zmęczenie Astenia, obrzęk twarzy Badania diagnostyczne Zwiększenie masy ciała Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale w dużych dawkach) może być związane ze zwiększeniem ryzyka zatorów tętnic (np.
- CHPL leku o rpl_id: 100380703Działania niepożądane
zawału serca lub udaru), patrz punkt 4.4. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku o rpl_id: 100380703Przedawkowanie
4.9 Przedawkowanie Objawy Opisywano przypadki przedawkowania ketoprofenu po zastosowaniu dawek do 2,5 g. W większości z nich objawy były łagodne i ograniczały się do letargu, senności, nudności, wymiotów i bólu w nadbrzuszu. Postępowanie Nie ma szczególnej odtrutki w przypadku przedawkowania ketoprofenu. W razie znacznego przedawkowania pacjenta należy niezwłocznie przewieźć do szpitala. Należy szybko usunąć zawartość żołądka. Należy zastosować leczenie objawowe i podtrzymujące w celu wyrównania odwodnienia, kontroli wydalania moczu i wyrównania ewentualnej kwasicy. Należy ściśle kontrolować czynność nerek i wątroby. W razie niewydolności nerek substancje czynną można usunąć z krążenia metodą hemodializy.
- CHPL leku o rpl_id: 100380703Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu propionowego. Kod ATC: M01AE03 Mechanizm działania Mechanizm działania NLPZ wiąże się ze zmniejszeniem syntezy prostaglandyn przez zahamowanie aktywności enzymu cyklooksygenazy. Szczególnie można obserwować hamowanie przekształcenia kwasu arachidonowego do cyklicznych endonadtlenków prostaglandynowych G2 (PGG2) i H2 (PGH2), prekursorów prostaglandyn PGE1, PGE2, PGF2 i PGD2, a także prostacykliny PGI2 i tromboksanów (TxA2 i TxB2). Ponadto zahamowanie syntezy prostaglandyn może zakłócać czynność innych mediatorów zapalenia, takich jak kininy, powodując pośrednie działania, dodane do działania bezpośredniego. Działania farmakodynamiczne Sól lizynowa ketoprofenu (kwasu 2-(3-benzoilofenylo) propionowego) ma działanie przeciwbólowe, przeciwzapalne i przeciwgorączkowe. Należy do klasy niesteroidowych leków przeciwzapalnych (NLPZ).
- CHPL leku o rpl_id: 100380703Właściwości farmakodynamiczne
Ketoprofen z lizyną jest lepiej rozpuszczalny niż postać kwasowa. Ketoprofen z lizyną ma silne działanie przeciwbólowe, które koreluje z działaniem zarówno przeciwzapalnym, jak i ośrodkowym. Działa przeciwgorączkowo bez zaburzania fizjologicznych procesów termoregulacyjnych. Powoduje ustąpienie lub złagodzenie bolesnych stanów zapalnych, co sprzyja ruchomości stawów.
- CHPL leku o rpl_id: 100380703Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Ketoprofen z lizyną jest lepiej rozpuszczalny niż postać kwasowa. Wchłanianie Postać farmaceutyczna (granulat do sporządzania roztworu doustnego) pozwala na przyjęcie substancji czynnej w roztworze wodnym. Prowadzi to do szybkiego zwiększenia stężenia substancji czynnej w osoczu i szybkie uzyskanie jej stężenia maksymalnego. Skutkiem klinicznym jest szybki początek działania oraz nasilone działanie przeciwbólowe i przeciwzapalne. Dystrybucja Wielokrotne podawanie nie zmienia kinetyki produktu leczniczego i nie powoduje jego kumulacji. Ketoprofen wiąże się w 95-99% z białkami osocza. Po podaniu ogólnym znaczące stężenia ketoprofenu stwierdzono w migdałkach i w płynie maziowym. Metabolizm Ketoprofen podlega znacznemu metabolizmowi: 60-80% substancji czynnej podanej ogólnie stwierdza się w moczu w postaci metabolitów.
- CHPL leku o rpl_id: 100380703Właściwości farmakokinetyczne
Wydalanie Ketoprofen wydalany jest szybko, głównie przez nerki: 50% substancji czynnej podanej ogólnie wydalane jest w moczu w ciągu 6 godzin. Dzieci i młodzież Profil kinetyczny u dzieci jest taki sam, jak u dorosłych.
- CHPL leku o rpl_id: 100380703Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Po podaniu doustnym wartość LD50 ketoprofenu z lizyną u szczurów i myszy wynosiła, odpowiednio 102 i 444 mg/kg, co odpowiada 30-120-krotności aktywnej dawki o działaniu przeciwzapalnym i przeciwbólowym u badanych zwierząt. Po podaniu dootrzewnowym LD50 ketoprofenu z lizyną u szczurów i myszy miała wartość odpowiednio 104 i 610 mg/kg. U szczurów, psów i małp długotrwałe podawanie doustne ketoprofenu z lizyną w dawkach równych lub większych od zalecanych dawek leczniczych nie powodowało wstąpienia żadnych działań toksycznych. Po podaniu dużych dawek stwierdzano zmiany dotyczące przewodu pokarmowego i nerek związane ze znanymi działaniami niepożądanymi wywoływanymi u zwierząt przez niesteroidowe leki przeciwzapalne. W przeprowadzonym na królikach badaniu długotrwałej toksyczności wykazano, że ketoprofen podawany doodbytniczo jest lepiej tolerowany niż podawany doustnie.
- CHPL leku o rpl_id: 100380703Przedkliniczne dane o bezpieczeństwie
W badaniach tolerancji przeprowadzonych na królikach ketoprofen z lizyną podawany domięśniowo był dobrze tolerowany. W badaniach in vitro i in vivo nie wykazano mutagennego działania ketoprofenu z lizyną. W badaniach na myszach i szczurach nie stwierdzono, aby ketoprofen miał działanie rakotwórcze. Dane dotyczące toksycznego działania NLPZ na zarodek i płód oraz dotyczące działania teratogennego, patrz punkt 4.6.
- CHPL leku o rpl_id: 100380703Dane farmaceutyczne
6. SZCZEGÓŁOWE DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Mannitol (E 421) Powidon K30 Aromat miętowy (zawiera maltodekstrynę i gumę arabską) Sodu chlorek Sacharyna sodowa Krzemionka koloidalna bezwodna 6.2 Niezgodności farmaceutyczne Nie są znane. 6.3 Okres ważności 3 lata Roztwór uzyskany po rozpuszczeniu granulatu należy użyć natychmiast po przygotowaniu. 6.4 Specjalne środki ostrożności podczas przechowywania Brak szczególnych zaleceń dotyczących przechowywania. 6.5 Rodzaj i zawartość opakowania Ketonal Fast, 25 mg Produkt leczniczy pakowany jest w saszetki papier/Aluminium/PE, w tekturowym pudełku. Wielkość opakowań: 12, 15, 18 i 30 saszetek. Ketonal Fast, 50 mg Produkt leczniczy pakowany jest w dwudzielne saszetki papier/Aluminium/PE, w tekturowym pudełku. Wielkość opakowań: 30 dwudzielnych saszetek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
- CHPL leku o rpl_id: 100380703Dane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Ketonal Fast, 25 mg Wsypać zawartość saszetki do szklanki w połowie wypełnionej wodą (50 ml) i dokładnie mieszać przez około 30 sekund, aż do rozpuszczenia granulatu. Ketonal Fast, 50 mg Wsypać zawartość saszetki do szklanki z wodą (100 ml) i dokładnie mieszać przez około 30 sekund, aż do rozpuszczenia granulatu. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Auxilen, 50 mg/2 mL, roztwór do wstrzykiwań/do infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 mL roztworu zawiera trometamol deksketoprofenu co odpowiada 25 mg deksketoprofenu. Jedna ampułka (2 mL) zawiera trometamol deksketoprofenu co odpowiada 50 mg deksketoprofenu. Substancje pomocnicze o znanym działaniu Każda ampułka zawiera 200 mg etanolu (96 %) i 8,0 mg sodu chlorku. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań/do infuzji. Przezroczysty, bezbarwny roztwór, wolny od widocznych cząstek. pH 7,0 – 8,0 Osmolarność 270 – 328 mOsmol/L
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlWskazania do stosowania
4.1. Wskazania do stosowania Objawowe leczenie ostrego bólu o nasileniu umiarkowanym do ciężkiego gdy doustne podawanie nie jest odpowiednie np. bólu pooperacyjnego, bólu w przebiegu kolki nerkowej i bólu okolicy lędźwiowo-krzyżowej.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlDawkowanie
4.2. Dawkowanie i sposób podawania Dawkowanie Dorośli: Zalecana dawka wynosi 50 mg co 8 do 12 godzin. Jeżeli jest to konieczne, podawanie można powtarzać co 6 godzin. Nie należy stosować całkowitej dawki dobowej większej niż 150 mg. Produkt leczniczy Auxilen jest przeznaczony do krótkotrwałego stosowania, a leczenie należy ograniczyć do okresu występowania ostrych objawów (nie dłużej niż 2 doby). U pacjentów należy wprowadzić leczenie doustnymi lekami przeciwbólowymi, gdy tylko jest to możliwe. Działania niepożądane można ograniczyć, stosując najmniejszą skuteczną dawkę przez najkrótszy okres konieczny do łagodzenia objawów (patrz punkt 4.4). W przypadku bólu pooperacyjnego o nasileniu umiarkowanym do ciężkiego produkt leczniczy Auxilen może być stosowany jednocześnie z opioidowymi lekami przeciwbólowymi, jeżeli istnieją wskazania, w takich samych zalecanych dawkach u dorosłych (patrz punkt 5.1).
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlDawkowanie
Dzieci i młodzież: Nie badano stosowania produktu leczniczego Auxilen u dzieci i młodzieży. Dlatego też nie ustalono bezpieczeństwa stosowania i skuteczności u dzieci i młodzieży, produktu nie należy stosować u dzieci i młodzieży. Osoby w podeszłym wieku: U osób w podeszłym wieku modyfikacja dawki nie jest konieczna. Jednakże ze względu na fizjologiczne zmniejszenie czynności nerek u pacjentów w podeszłym wieku, w przypadku łagodnych zaburzeń czynności nerek zalecana jest mniejsza dawka produktu leczniczego: całkowita dawka dobowa 50 mg (patrz punkt 4.4). Zaburzenie czynności wątroby: U pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności wątroby (wskaźnik Child-Pugh 5 do 9) dawkę produktu leczniczego należy zmniejszyć do całkowitej dawki dobowej 50 mg, a czynność wątroby należy starannie monitorować (patrz punkt 4.4). Produktu leczniczego Auxilen nie należy stosować u pacjentów z ciężkimi zaburzeniami czynności wątroby (wskaźnik Child-Pugh 10 do 15) (patrz punkt 4.3).
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlDawkowanie
Zaburzenie czynności nerek: U pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny 60 do 89 mL/min) dawkę należy zmniejszyć do całkowitej dawki dobowej 50 mg (patrz punkt 4.4). Produkt leczniczy Auxilen infuzji nie należy stosować u pacjentów z umiarkowanymi i ciężkimi zaburzeniami czynności nerek (klirens kreatyniny ≤ 59 mL/min) (patrz punkt 4.3). Sposób podawania: Produkt leczniczy Auxilen może być podawany domięśniowo lub dożylnie: Podanie domięśniowe: zawartość 1 ampułki (2 mL) produktu leczniczego Auxilen należy podawać w powolnym wstrzyknięciu głęboko w mięsień. Podanie dożylne: Infuzja dożylna: rozcieńczony roztwór, przygotowany, jak opisano w punkcie 6.6, należy podawać w postaci powolnego wlewu dożylnego, trwającej od 10 do 30 minut. Roztwór należy zawsze chronić przed światłem dziennym.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlDawkowanie
Bolus dożylny: w razie konieczności zawartość 1 ampułki (2 mL) produktu leczniczego Auxilen można podać w powolnym bolusie dożylnym, nie krócej niż przez 15 sekund. Instrukcja dotycząca postępowania z produktem leczniczym: Podczas podawania produktu leczniczego Auxilen domięśniowo lub w postaci dożylnego bolusa, roztwór należy wstrzykiwać niezwłocznie po pobraniu z ampułki (patrz także punkt 6.2 i 6.6). W przypadku podawania w postaci wlewu dożylnego roztwór należy rozcieńczyć w warunkach aseptycznych i chronić przed dziennym światłem (patrz także punkt 6.3 i 6.6). Instrukcja dotycząca rozcieńczania produktu leczniczego przed podaniem, patrz punkt 6.6.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlPrzeciwwskazania
4.3. Przeciwwskazania Nie wolno stosować produktu leczniczego Auxilen w następujących przypadkach: nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; u pacjentów, u których substancje o podobnym mechanizmie działania (np. kwas acetylosalicylowy lub inne NLPZ) wywołują napad astmy, skurcz oskrzeli, ostry nieżyt błony śluzowej nosa lub powodują wystąpienie polipów nosa, pokrzywki lub obrzęku naczynioruchowego; u pacjentów z reakcjami fotoalergicznymi lub fototoksycznymi podczas stosowania ketoprofenu lub fibratów w wywiadzie; u pacjentów, u których w wywiadzie stwierdzono krwawienie z przewodu pokarmowego lub perforację, związane z wcześniejszym leczeniem NLPZ; u pacjentów z czynną chorobą wrzodową żołądka lub krwawieniem lub ich podejrzeniem, jak również krwawienia z przewodu pokarmowego lub perforacji w wywiadzie; u pacjentów z przewlekłą niestrawnością; u pacjentów, u których występuje inne czynne krwawienie lub zaburzenia przebiegające z krwawieniami; u pacjentów z chorobą Leśniowskiego-Crohna lub wrzodziejącym zapaleniem jelita grubego; u pacjentów z ciężką niewydolnością serca; u pacjentów z umiarkowaną lub ciężką niewydolnością nerek (klirens kreatyniny ≤59 mL/min); u pacjentów z ciężkimi zaburzeniami czynności wątroby (wskaźnik Child-Pugh 10 do 15); u pacjentów ze skazą krwotoczną i innymi zaburzeniami krzepnięcia; u pacjentów ciężko odwodnionych (z powodu wymiotów, biegunki lub przyjmowania niedostatecznej ilości płynów); u kobiet w trzecim trymestrze ciąży i w okresie laktacji (patrz punkt 4.6).
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlPrzeciwwskazania
Centralne (dokanałowe lub nadtwardówkowe) podanie produktu leczniczego Auxilen jest przeciwwskazane ze względu na zawartość etanolu w produkcie.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt leczniczy należy podawać ostrożnie pacjentom z alergią w wywiadzie. Należy unikać jednoczesnego stosowania produktu leczniczego Auxilen z innymi lekami z grupy NLPZ w tym selektywnymi inhibitorami cyklooksygenazy-2. Przyjmowanie produktu leczniczego w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz wpływ na przewód pokarmowy i układ krążenia poniżej). Wpływ na bezpieczeństwo stosowania dotyczące przewodu pokarmowego. Dla wszystkich produktów leczniczych z grupy NLPZ istnieją doniesienia o spowodowaniu wystąpienia krwawienia z przewodu pokarmowego, owrzodzenia lub perforacji ze skutkiem śmiertelnym. Mogą one występować w dowolnym okresie leczenia, z objawami ostrzegawczymi lub bez jak również bez wcześniejszego wywiadu dotyczącego ciężkich objawów dotyczących przewodu pokarmowego.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlSpecjalne środki ostrozności
W przypadku wystąpienia krwawienia z przewodu pokarmowego lub owrzodzenia u pacjentów przyjmujących Auxilen, produkt należy odstawić. U pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie, szczególnie w połączeniu z krwawieniem lub perforacją (patrz punkt 4.3) oraz u osób w podeszłym wieku, ryzyko krwotoku z przewodu pokarmowego, owrzodzenia lub perforacji jest zwiększone podczas przyjmowania dużych dawek NLPZ. Szczególnie u osób w podeszłym wieku może wystąpić choroba wrzodowa żołądka, perforacja lub krwawienia z przewodu pokarmowego, w niektórych przypadkach ze skutkiem śmiertelnym (patrz punkt 4.2). Tacy pacjenci powinni rozpoczynać leczenie od możliwie najmniejszej dostępnej dawki. Produkty lecznicze z grupy NLPZ należy podawać ostrożnie pacjentom z chorobami przewodu pokarmowego (wrzodziejące zapalenie okrężnicy, choroba Leśniowskiego-Crohna) w wywiadzie, ponieważ stan pacjentów może ulec pogorszeniu (patrz punkt 4.8).
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlSpecjalne środki ostrozności
Tak jak w przypadku wszystkich produktów leczniczych z grupy NLPZ, przed rozpoczęciem leczenia trometamolem deksketoprofenu należy zebrać wywiad dotyczący zapalenia przełyku, zapalenia błony śluzowej żołądka i (lub) choroby wrzodowej żołądka, aby upewnić się, że zostały całkowicie wyleczone. Pacjentów z objawami dotyczącymi żołądka i jelit lub zaburzeniami żołądka i jelit w wywiadzie należy kontrolować pod względem zaburzeń żołądkowo-jelitowych, szczególnie pod względem krwawienia z przewodu pokarmowego. W przypadku tych pacjentów oraz pacjentów wymagających równoczesnego podawania małych dawek kwasu acetylosalicylowego lub innych leków zwiększających prawdopodobieństwo ryzyka zaburzeń żołądka i jelit (patrz poniżej oraz punkt 4.5) należy rozważyć jednoczesne stosowanie produktu leczniczego Auxilen z innymi lekami o ochronnym mechanizmie działania (np. mizoprostolem lub inhibitorami pompy protonowej).
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlSpecjalne środki ostrozności
Pacjenci z działaniami niepożądanymi dotyczącymi układu pokarmowego w wywiadzie, szczególnie pacjenci w podeszłym wieku, powinni zgłaszać każde niepokojące objawy brzuszne (szczególnie krwawienie z przewodu pokarmowego) przede wszystkim w początkowej fazie leczenia. Zaleca się zachowanie ostrożności u pacjentów otrzymujących równocześnie leki mogące zwiększać ryzyko wystąpienia owrzodzenia lub krwawienia, takich jak: doustne kortykosteroidy, leki przeciwzakrzepowe takie jak warfaryna, selektywne inhibitory wychwytu zwrotnego serotoniny lub leki przeciwagregacyjne takie jak kwas acetylosalicylowy (patrz punkt 4.5).
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Następujące interakcje dotyczą całej grupy niesteroidowych leków przeciwzapalnych (NLPZ): Nie należy jednocześnie stosować: Inne NLPZ, w tym duże dawki salicylanów (≥ 3 g/dobę): jednoczesne podawanie kilku NLPZ może poprzez działanie synergistyczne zwiększać ryzyko wystąpienia choroby wrzodowej żołądka i (lub) dwunastnicy oraz krwawienia z przewodu pokarmowego. Leki przeciwzakrzepowe: NLPZ mogą zwiększać działanie leków przeciwzakrzepowych, takich jak warfaryna (patrz punkt 4.4), ze względu na wysoki stopień wiązania deksketoprofenu z białkami osocza i hamowanie czynności płytek oraz uszkodzenie błony śluzowej żołądka i (lub) dwunastnicy. Jeżeli konieczne jest stosowanie takiego połączenia leków, należy prowadzić dokładną obserwację kliniczną i monitorować wyniki badań laboratoryjnych.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlInterakcje
Heparyny: zwiększone ryzyko krwotoku (ze względu na hamowanie czynności płytek i uszkodzenie błony śluzowej żołądka i (lub) dwunastnicy). Jeżeli nie można uniknąć stosowania takiego połączenia, należy prowadzić staranną obserwację kliniczną i monitorowanie wyników badań laboratoryjnych. Kortykosteroidy: zwiększone ryzyko wystąpienia owrzodzenia przewodu pokarmowego oraz krwawienia (patrz punkt 4.4). Sole litu (interakcje opisywane dla kilku NLPZ): NLPZ zwiększają stężenie litu we krwi, które może osiągnąć wartości toksyczne (zmniejszone wydalanie litu przez nerki). Z tego powodu ten wskaźnik wymaga monitorowania na początku, podczas modyfikacji i przerwania leczenia deksketoprofenem. Metotreksat, stosowany w dużych dawkach 15 mg/tydzień lub większych: zwiększone działanie toksyczne metotreksatu na układ krwiotwórczy w wyniku zmniejszenia klirensu nerkowego metotreksatu przez niesteroidowe leki przeciwzapalne.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlInterakcje
Pochodne hydantoin i sulfonamidy: może nastąpić zwiększenie działania toksycznego tych substancji. Jednoczesne stosowanie wymagające zachowania środków ostrożności: Leki moczopędne, ACE inhibitory, antybiotyki aminoglikozydowe i antagoniści receptora angiotensyny II: deksketoprofen może zmniejszać działanie leków moczopędnych i leków hipotensyjnych. U niektórych pacjentów z zaburzeniami czynności nerek (np. pacjentów odwodnionych lub pacjentów w podeszłym wieku z zaburzeniami czynności nerek) jednoczesne podawanie leków hamujących cyklooksygenazę i ACE inhibitorów, antagonistów receptora angiotensyny II lub antybiotyków aminoglikozydowych może prowadzić do dodatkowego pogorszenia czynności nerek, które zazwyczaj jest przemijające. W przypadku jednoczesnego podawania deksketoprofenu i leku moczopędnego kluczowe jest zapewnienie odpowiedniego nawodnienia pacjenta i kontrola czynności nerek na początku leczenia (patrz punkt 4.4).
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlInterakcje
Metotreksat stosowany w małych dawkach, mniejszych niż 15 mg/tydzień: zwiększone działanie toksyczne metotreksatu na układ krwiotwórczy w wyniku zmniejszenia klirensu nerkowego przez niesteroidowe leki przeciwzapalne. Konieczna jest cotygodniowa kontrola wskaźników morfologii krwi podczas pierwszych tygodni stosowania skojarzonego. Należy zachować szczególną ostrożność w przypadku zaburzeń czynności nerek nawet jeśli są łagodne oraz u pacjentów w podeszłym wieku. Pentoksyfilina: zwiększone ryzyko krwawienia. Należy prowadzić dokładną obserwację kliniczną i częściej kontrolować czas krwawienia. Zydowudyna: ryzyko zwiększenia toksycznego działania na układ czerwonokrwinkowy. W wyniku niekorzystnego wpływu na retikulocyty w okresie jednego tygodnia od rozpoczęcia stosowania NLPZ może wystąpić ciężka niedokrwistość. Należy kontrolować wskaźniki morfologii krwi i liczbę retikulocytów w okresie od jednego do dwóch tygodni od rozpoczęcia leczenia NLPZ.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlInterakcje
Pochodne sulfonylomocznika: NLPZ mogą zwiększać działanie hipoglikemizujące pochodnych sulfonylomocznika przez wypieranie ich z połączeń z białkami osocza. Jednoczesne stosowanie wymagające rozważenia: Leki beta-adrenolityczne: podawanie NLPZ może zmniejszać działanie hipotensyjne w wyniku hamowania syntezy prostaglandyn. Cyklosporyna i takrolimus: działanie nefrotoksyczne może się zwiększać w wyniku zahamowania przez NLPZ syntezy prostaglandyn nerkowych. Należy kontrolować czynność nerek podczas leczenia skojarzonego. Leki trombolityczne: zwiększone ryzyko krwawienia. Leki przeciwpłytkowe i selektywne inhibitory wychwytu zwrotnego serotoniny: zwiększone ryzyko krwawienia z żołądka i (lub) dwunastnicy (patrz punkt 4.4). Probenecyd: stężenie deksketoprofenu w osoczu może się zwiększyć; interakcja ta może być spowodowana hamującym wpływem probenecydu na wydalanie cewkowe w nerce oraz sprzęganie z glukuronianami i wymaga modyfikacji dawki deksketoprofenu.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlInterakcje
Glikozydy nasercowe: NLPZ mogą zwiększać stężenie glikozydów w osoczu. Mifepryston: ponieważ teoretycznie istnieje ryzyko, że niesteroidowe leki przeciwzapalne mogą zmieniać skuteczność mifeprystonu, nie powinno się stosować NLPZ przez 8 do 12 dni od podania mifeprystonu. Antybiotyki chinolonowe: dane z badań u zwierząt wskazują, że duże dawki chinolonów podawane w połączeniu z NLPZ mogą zwiększać ryzyko wystąpienia drgawek.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Produkt leczniczy Auxilen jest przeciwwskazany podczas trzeciego trymestru ciąży i laktacji (patrz punkt 4.3). Ciąża Działanie hamujące na syntezę prostaglandyn może mieć negatywny wpływ na przebieg ciąży i (lub) rozwój embrionu lub płodu. Dane z badań farmakoepidemiologicznych sugerują zwiększone ryzyko poronienia i zaburzeń budowy serca oraz wytrzewienia po zastosowaniu inhibitora syntezy prostaglandyn we wczesnej ciąży. Całkowite ryzyko zaburzeń budowy układu sercowo-naczyniowego zwiększało się z mniej niż 1% do około 1,5%. Uważa się, iż ryzyko zwiększa się wraz ze zwiększaniem dawki i czasu trwania leczenia. W badaniach na zwierzętach wykazano, że podawanie inhibitora syntezy prostaglandyn powodowało poronienie przed lub po zagnieżdżeniu się jaja płodowego oraz śmiertelność embrionu lub płodu.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlWpływ na płodność, ciążę i laktację
Dodatkowo u zwierząt, którym podawano inhibitor syntezy prostaglandyn w okresie organogenezy obserwowano zwiększoną częstość występowania różnych wad płodu włączając zaburzenia budowy układu sercowo-naczyniowego. Od 20. tygodnia ciąży stosowanie deksketoprofenu może powodować małowodzie spowodowane zaburzeniami czynności nerek płodu. Może ono wystąpić krótko po rozpoczęciu leczenia i zwykle ustępuje po jego przerwaniu. Podczas pierwszego i drugiego trymestru ciąży trometamol deksketoprofenu należy podawać tylko w przypadku zdecydowanej konieczności. Jeżeli trometamol deksketoprofenu jest stosowany u kobiet planujących zajście w ciążę lub podczas pierwszego lub drugiego trymestru ciąży należy stosować możliwie najmniejszą dawkę przez możliwie najkrótszy okres.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn Produkt leczniczy Auxilen wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn w związku z możliwością wystąpienia zawrotów głowy lub senności.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlDziałania niepożądane
4.8 Działania niepożądane Zdarzenia niepożądane, które zgłaszano w badaniach klinicznych jak również po wprowadzeniu produktu leczniczego Auxilen do obrotu, których związek z podawaniem trometamolu deksketoprofenu uznano za co najmniej możliwy, podano poniżej grupując je według układów narządów i częstości występowania. Klasyfikacja układów i narządów Często (≥1/100 do <1/10): Niedokrwistość Niezbyt często (≥1/1 000 do <1/100): Neutropenia, małopłytkowość Bardzo rzadko (<1/10 000): Obrzęk gardła, reakcje anafilaktyczne, obejmujące wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania: Hiperglikemia, hipoglikemia, hipertriglicerydemia, jadłowstręt Zaburzenia psychiczne: Bezsenność Zaburzenia układu nerwowego: Bóle głowy, zawroty głowy, senność, parestezja, omdlenia Zaburzenia oka: Nieostre widzenie Zaburzenia ucha i błędnika: Szumy uszne Zaburzenia serca: Skurcze dodatkowe, tachykardia Zaburzenia naczyniowe: Hipotonia, zaczerwienienie twarzy, nadciśnienie tętnicze, zakrzepowe zapalenie żył powierzchownych Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Zwolnienie częstości oddechów, skurcz oskrzeli, duszność Zaburzenia żołądka i jelit: Nudności, wymioty, ból brzucha, niestrawność, biegunka, zaparcia, wymioty z krwią, suchość błony śluzowej jamy ustnej, choroba wrzodowa żołądka, krwawienie lub perforacja, zapalenie trzustki Zaburzenia wątroby i dróg żółciowych: Zapalenie wątroby, żółtaczka, miąższowe wątrobowokomórkowe uszkodzenie wątroby Zaburzenia skóry i tkanki podskórnej: Zapalenie skóry, świąd, wysypka, nasilone pocenie, pokrzywka, trądzik, zespół Stevensa Johnsona, toksyczne martwicze oddzielanie się naskórka, obrzęk naczynioruchowy, obrzęk twarzy, reakcje nadwrażliwości na światło Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Sztywność mięśni, sztywność stawów, kurcze mięśni, ból pleców Zaburzenia nerek i dróg moczowych: Ciężkie zaburzenia czynności nerek, wielomocz, ból w okolicy nerek, ketonuria, białkomocz, zapalenie nerek lub zespół nerczycowy Zaburzenia układu rozrodczego i piersi: Zaburzenia miesiączkowania, łagodny rozrost gruczołu krokowego Zaburzenia ogólne i stany w miejscu podania: Ból w miejscu wstrzyknięcia, reakcje w miejscu wstrzyknięcia, obejmujące zapalenie, krwiaki lub krwotok, gorączka, zmęczenie, ból, uczucie zimna, sztywność, obrzęki obwodowe Badania: Nieprawidłowe wskaźniki czynności wątroby Zaburzenia dotyczące przewodu pokarmowego: najczęściej obserwowano działania niepożądane dotyczące przewodu pokarmowego.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlDziałania niepożądane
Szczególnie u osób w podeszłym wieku może wystąpić choroba wrzodowa żołądka, perforacja lub krwawienia z przewodu pokarmowego, w niektórych przypadkach ze skutkiem śmiertelnym. Po zastosowaniu produktu leczniczego występowały: nudności, wymioty, biegunka, wzdęcia, zaparcia, niestrawność, ból w podbrzuszu, smoliste stolce, krwawe wymioty, wrzodziejące zapalenie błony śluzowej jamy ustnej, zaostrzenie zapalenia okrężnicy oraz choroby Leśniowskiego-Crohna. Rzadziej obserwowano zapalenie błony śluzowej żołądka. Po zastosowaniu leków z grupy NLPZ obserwowano obrzęki, nadciśnienie krwi i niewydolność serca. Tak jak w przypadku innych NLPZ mogą wystąpić następujące działania niepożądane: jałowe zapalenie opon mózgowo-rdzeniowych, głównie u pacjentów z toczniem rumieniowatym układowym lub mieszaną chorobą tkanki łącznej; oraz reakcje hematologiczne (plamica, niedokrwistość aplastyczna i hemolityczna, rzadko agranulocytoza i hipoplazja szpiku).
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlDziałania niepożądane
Reakcje pęcherzowe łącznie z zespołem Stevensa Johnsona i toksycznym martwiczym oddzielaniem się naskórka (bardzo rzadko). Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwałe w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka tętniczych incydentów zatorowo-zakrzepowych (np. zawał serca lub udar).
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlPrzedawkowanie
4.9 Przedawkowanie Objawy przedawkowania są nieznane. Podobne produkty lecznicze wywoływały zaburzenia żołądkowo-jelitowe (wymioty, jadłowstręt, ból brzucha) i neurologiczne (senność, zawroty głowy, dezorientacja, ból głowy). W przypadku przypadkowego zażycia produktu leczniczego lub przedawkowania, niezwłocznie wdrożyć leczenie objawowe dostosowane do stanu pacjenta. Trometamol deksketoprofenu można usunąć z organizmu na drodze dializy.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Niesteroidowe leki przeciwzapalne i przeciwreumatyczne, Pochodne kwasu propionowego. Kod ATC: M01AE17. Trometamol deksketoprofenu jest solą trometaminową kwasu S-(+)-2-(3-benzoilofenylo) propionowego, jest lekiem przeciwbólowym, przeciwzapalnym i przeciwgorączkowym, który należy do niesteroidowych leków przeciwzapalnych, pochodnych kwasu propionowego. Mechanizm działania Mechanizm działania niesteroidowych leków przeciwzapalnych jest związany ze zmniejszeniem syntezy prostaglandyn w wyniku zahamowania aktywności cyklooksygenazy. NLPZ hamują przekształcanie kwasu arachidonowego do cyklicznych endonadtlenków, PGG2 i PGH2, z których powstają prostaglandyny PGE1, PGE2, PGF2α i PGD2 oraz także prostacyklina PGI2 i tromboksany (TxA2 i TxB2).
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlWłaściwości farmakodynamiczne
Ponadto zahamowanie syntezy prostaglandyn może wpływać na inne mediatory stanu zapalnego, takie jak kininy, powodując pośrednie działania, które mogą być dodatkowe w stosunku do działania bezpośredniego. Działanie farmakodynamiczne W badaniach wykazano, że deksketoprofen hamuje aktywność COX-1 i COX-2 u zwierząt i u ludzi. Skuteczność kliniczna i bezpieczeństwo stosowania Badania kliniczne przeprowadzone na kilku modelach bólu wykazały skuteczne działanie przeciwbólowe trometamolu deksketoprofenu. Skuteczność przeciwbólową podawanego domięśniowo i dożylnie trometamolu deksketoprofenu w leczeniu umiarkowanego i ciężkiego bólu badano w kilku modelach bólu chirurgicznego (zabiegi ortopedyczne, ginekologiczne i brzuszne) oraz bólu mięśniowo-kostnego (model ostrego bólu okolicy lędźwiowo-krzyżowej) oraz kolki nerkowej. W przeprowadzonych badaniach początek działania przeciwbólowego następował szybko a maksymalne działanie przeciwbólowe pojawiało się w ciągu pierwszych 45 minut.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlWłaściwości farmakodynamiczne
Czas trwania działania przeciwbólowego po podaniu 50 mg deksketoprofenu zazwyczaj wynosi 8 godzin. Badania kliniczne przeprowadzone w opanowaniu bólu pooperacyjnego wykazały, że produkt leczniczy Auxilen, podawany jednocześnie z opioidami pozwalał na istotne zmniejszenie dawki opioidów. W badaniach nad bólem pooperacyjnym, w których pacjenci otrzymywali morfinę za pomocą pompy infuzyjnej, kontrolowanej przez pacjenta, pacjenci leczeni deksketoprofenem wymagali istotnie mniejszej dawki morfiny (od 30% do 45% mniej), niż pacjenci w grupie placebo.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Wchłanianie Maksymalne stężenie produktu leczniczego występuje po 20 minutach (zakres od 10 do 45 minut) od domięśniowego podania trometamolu deksketoprofenu. Dla pojedynczych dawek 25 mg do 50 mg wykazano, że pole powierzchni pod krzywą (AUC) jest proporcjonalne do dawki, zarówno po podaniu domięśniowym jak i dożylnym. Dystrybucja Tak jak w przypadku innych produktów leczniczych charakteryzujących się dużym stopniem wiązania z białkami osocza (99%), średnia objętość dystrybucji jest mniejsza od 0,25 L/kg. Okres półtrwania w fazie dystrybucji wynosił około 0,35 godzin a okres półtrwania w fazie eliminacji od 1 do 2,7 godzin. W badaniu farmakokinetyki po podaniu dawek wielokrotnych obserwowano, że stężenie maksymalne Cmax i AUC po ostatnim podaniu domięśniowym lub dożylnym nie różniły się od uzyskanych po podaniu pojedynczej dawki, co wskazuje, że produkt leczniczy nie kumuluje się w organizmie.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlWłaściwości farmakokinetyczne
Biotransformacja i eliminacja Po podaniu trometamolu deksketoprofenu w moczu występuje tylko S-(+) enancjomer, co oznacza, że u ludzi nie występuje przekształcanie go do R-(-) enancjomeru. Główną drogą eliminacji deksketoprofenu jest sprzęganie z glukuronidami a następnie wydalanie przez nerki. Osoby w podeszłym wieku U zdrowych osób w podeszłym wieku (65 lat i starszych), po podaniu dawki pojedynczej i dawek wielokrotnych doustnych, ekspozycja na produkt leczniczy była istotnie wyższa, niż u młodych ochotników (do 55%), natomiast nie obserwowano statystycznie istotnej różnicy pod względem maksymalnego stężenia i czasu do osiągnięcia maksymalnego stężenia. Średni okres półtrwania w fazie eliminacji po podaniu dawki pojedynczej i dawek wielokrotnych był wydłużony (do 48%) a całkowity rzeczywisty klirens był zmniejszony.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Dane przedkliniczne, uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności, toksycznego wpływu na reprodukcję i immunofarmakologii nie ujawniły występowania szczególnych zagrożeń dla człowieka poza tymi już wymienionymi w innych punktach Charakterystyki Produktu Leczniczego. Badania przewlekłej toksyczności przeprowadzone na myszach i małpach wykazały poziom, na którym nie obserwowano żadnych działań niepożądanych podczas podawania dawki 3 mg/kg/dobę. Głównym działaniem niepożądanym obserwowanym po podaniu dużych dawek produktu leczniczego były nadżerki błony śluzowej żołądka i (lub) dwunastnicy oraz choroba wrzodowa, występujące w sposób zależny od dawki.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlPrzedkliniczne dane o bezpieczeństwie
Jak stwierdzono dla całej grupy farmakologicznej NLPZ, trometamol deksketoprofenu może powodować zmiany czasu przeżycia zarodka-płodu w modelach zwierzęcych, zarówno pośrednio, w wyniku działania toksycznego na żołądek i jelita u ciężarnych matek, i bezpośrednio poprzez wpływ na rozwój płodu.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Sodu chlorek Etanol (96 %) Sodu wodorotlenek (do regulacji pH) Woda do wstrzykiwań 6.2. Niezgodności farmaceutyczne Produktu leczniczego Auxilen nie wolno mieszać w niewielkiej objętości (np. w strzykawce) z roztworami dopaminy, prometazyny, pentazocyny, petydyny ani hydroksyzyny, gdyż doprowadzi to do strącenia roztworu. Rozcieńczonego roztworu do wstrzykiwań, uzyskanego jak podano w punkcie 6.6, nie wolno mieszać z prometazyną ani pentazocyną. Niniejszego produktu leczniczego nie wolno mieszać z innymi produktami leczniczymi, poza tymi wymienionymi w punkcie 6.6. 6.3. Okres ważności 5 lat. Wykazano, że roztwór w 0,9% chlorku sodu, 5% glukozie i roztworze mleczanu Ringera, przechowywany w temperaturze 25°C i 2-8°C, zachowuje chemiczną stabilność przez 18 godzin, pod warunkiem, że jest chroniony przed światłem dziennym.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlDane farmaceutyczne
Z mikrobiologicznego punktu widzenia, chyba że metoda rozcieńczania wyklucza ryzyko skażenia mikrobiologicznego, produkt powinien być zużyty natychmiast. Jeśli nie jest zużyty natychmiast, za czas i warunki przechowywania odpowiada użytkownik. 6.4. Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących temperatury przechowywania produktu leczniczego. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem. Nie zamrażać. Warunki przechowywania produktu leczniczego po rozcieńczeniu, patrz 6.3. 6.5. Rodzaj i zawartość opakowania Ampułka z oranżowego szkła typu I, o pojemności 2 mL. Opakowania zawierające: 1, 5, 6, 10, 25 lub 100 ampułek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6. Specjalne środki ostrożności dotyczące usuwania Wykazano, że produkt leczniczy Auxilen jest zgodny, gdy zostanie wymieszany w niewielkich objętościach (np.
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlDane farmaceutyczne
w strzykawce) z roztworami do wstrzykiwań heparyny, lidokainy, morfiny i teofiliny. W celu podania w postaci wlewu dożylnego zawartość 1 ampułki (2 mL) produktu leczniczego Auxilen należy rozcieńczyć w objętości 30 mL do 100 mL 0,9% roztworu chlorku sodu, 5% roztworu glukozy lub roztworu Ringera z mleczanem. Roztwór należy rozcieńczyć w warunkach aseptycznych i chronić od naturalnego dziennego światła (patrz także punkt 6.3). Rozcieńczony roztwór jest przezroczysty. Wykazano, że produkt leczniczy Auxilen, rozcieńczony w objętości 100 mL 0,9% roztworu chlorku sodu lub 5% roztworu glukozy, jest zgodny z następującymi lekami: dopaminą, heparyną, hydroksyzyną, lidokainą, morfiną, petydyną i teofiliną. Nie stwierdzono wchłaniania substancji czynnej, gdy rozcieńczone roztwory produktu leczniczego Auxilen przechowywano w plastikowych torebkach lub urządzeniach do podawania sporządzonych z octanu etylowinylu (EVA), propionianu celulozy (CP), polietylenu o niskiej gęstości (LDPE) i chlorku poliwinylu (PVC).
- CHPL leku Auxilen, roztwór do wstrzykiwań / do infuzji, 50 mg/2 mlDane farmaceutyczne
Produkt leczniczy Auxilen jest przeznaczony wyłącznie do jednokrotnego zastosowania i całość nieużytego roztworu należy usunąć. Przed zastosowaniem produktu, roztwór należy obejrzeć, aby się upewnić, że jest przezroczysty i bezbarwny: nie wolno stosować, jeżeli występują jakiekolwiek zanieczyszczenia. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Dexketoprofen Adamed, 50 mg/2 ml, roztwór do wstrzykiwań / do infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda ampułka 2 ml zawiera 50 mg deksketoprofenu (w postaci soli deksketoprofenu z trometamolem). Każdy 1 ml roztworu do wstrzykiwań zawiera 25 mg deksketoprofenu (w postaci soli deksketoprofenu z trometamolem). Substancje pomocnicze o znanym działaniu: każda ampułka 2 ml zawiera 200 mg etanolu (96 %) i mniej niż 23 mg (0,147 mmol) sodu (w postaci chlorku sodu i pirosiarczynu sodu). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań / do infuzji. Klarowny i bezbarwny roztwór. pH (6,5 – 8,5) Osmolarność: 270 – 328 mOsmol/l
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgWskazania do stosowania
4.1. Wskazania do stosowania Objawowe leczenie ostrego bólu o nasileniu umiarkowanym do ciężkiego, gdy doustne podawanie nie jest odpowiednie np. bólu pooperacyjnego, bólu w przebiegu kolki nerkowej i bólu okolicy lędźwiowo-krzyżowej.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgDawkowanie
4.2. Dawkowanie i sposób podawania Dawkowanie Dorośli: Zalecana dawka wynosi 50 mg co 8-12 godzin. Jeżeli jest to konieczne, podawanie można powtarzać co 6 godzin. Nie należy stosować całkowitej dawki dobowej większej niż 150 mg. Produkt leczniczy Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji jest przeznaczony do krótkotrwałego stosowania, a leczenie należy ograniczyć do okresu występowania ostrych objawów (nie dłużej niż 2 doby). U pacjentów należy wprowadzić leczenie doustnymi lekami przeciwbólowymi, gdy tylko jest to możliwe. Przyjmowanie produktu leczniczego w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.4). W przypadku bólu pooperacyjnego o nasileniu umiarkowanym do ciężkiego produkt leczniczy Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji może być stosowany jednocześnie z opioidowymi lekami przeciwbólowymi, jeżeli istnieją wskazania, w takich samych zalecanych dawkach u dorosłych (patrz punkt 5.1).
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgDawkowanie
Osoby w podeszłym wieku: U osób w podeszłym wieku modyfikacja dawki nie jest konieczna. Jednakże, ze względu na fizjologiczne pogorszenie czynności nerek u pacjentów w podeszłym wieku, w przypadku łagodnych zaburzeń czynności nerek zalecana jest mniejsza dawka: całkowita dawka dobowa 50 mg (patrz punkt 4.4). Zaburzenia czynności wątroby: U pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności wątroby (5-9 punktów w skali Child-Pugh) dawkę produktu leczniczego należy zmniejszyć do całkowitej dawki dobowej 50 mg, a czynność wątroby należy starannie monitorować (patrz punkt 4.4). Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji nie powinien być stosowany u pacjentów z ciężkimi zaburzeniami czynności wątroby (10-15 punktów w skali Child-Pugh) (patrz punkt 4.3). Zaburzenia czynności nerek: U pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny 60 do 89 ml/min) dawkę należy zmniejszyć do całkowitej dawki dobowej 50 mg (patrz punkt 4.4).
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgDawkowanie
Produktu leczniczego Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji nie należy stosować u pacjentów z umiarkowanymi i ciężkimi zaburzeniami czynności nerek (klirens kreatyniny <59 ml/min) (patrz punkt 4.3). Dzieci i młodzież: Nie przeprowadzono badań dotyczących stosowania produktu leczniczego Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji u dzieci i młodzieży. Dlatego nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego u dzieci i młodzieży; produktu nie należy stosować u dzieci i młodzieży. Sposób podawania: Produkt leczniczy Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji może być podawany domięśniowo lub dożylnie: Podanie domięśniowe: zawartość 1 ampułki (2 ml) produktu Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji należy podawać w powolnym wstrzyknięciu głęboko w mięsień.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgDawkowanie
Podanie dożylne: Infuzja dożylna: rozcieńczony roztwór, przygotowany zgodnie z opisem w punkcie 6.6, należy podawać w postaci powolnej infuzji dożylnej, trwającej od 10 do 30 minut. Roztwór należy zawsze chronić przed światłem słonecznym. Bolus dożylny: w razie konieczności zawartość 1 ampułki (2 ml) produktu Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji można podać w powolnym bolusie dożylnym, trwającym nie krócej niż 15 sekund. Instrukcje dotyczące postępowania z produktem: Podczas podawania produktu leczniczego Dexketoprofen Adamed domięśniowo lub w postaci dożylnego bolusa, roztwór należy wstrzykiwać niezwłocznie po pobraniu z ampułki (patrz także punkty 6.2 i 6.6). W przypadku podawania w postaci wlewu dożylnego roztwór należy rozcieńczyć w warunkach aseptycznych i chronić przed światłem słonecznym (patrz także punkty 6.3 i 6.6). Instrukcje dotyczące rozcieńczania produktu leczniczego przed podaniem, patrz punkt 6.6.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgPrzeciwwskazania
4.3. Przeciwwskazania Nie wolno stosować produktu leczniczego Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji w następujących przypadkach: pacjenci z nadwrażliwością na substancję czynną, inne leki z grupy niesteroidowych leków przeciwzapalnych (NLPZ) lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; pacjenci, u których substancje o podobnym mechanizmie działania (np. kwas acetylosalicylowy lub inne NLPZ) wywołują napad astmy, skurcz oskrzeli, ostry nieżyt błony śluzowej nosa lub powodują wystąpienie polipów nosa, pokrzywki lub obrzęku naczynioruchowego; stwierdzone reakcje fotoalergiczne lub fototoksyczne podczas stosowania ketoprofenu lub fibratów; pacjenci, u których w wywiadzie stwierdzono krwawienie z przewodu pokarmowego lub perforację, związane z wcześniejszym leczeniem NLPZ; pacjenci z czynną chorobą wrzodową żołądka, krwawieniem z przewodu pokarmowego, jak również z jakimkolwiek krwawieniem, chorobą wrzodową lub perforacją przewodu pokarmowego w wywiadzie; pacjenci z przewlekłą niestrawnością; pacjenci, u których występuje inne czynne krwawienie lub choroby przebiegające z krwawieniami; pacjenci z chorobą Leśniowskiego-Crohna lub wrzodziejącym zapaleniem jelita grubego; pacjenci z ciężką niewydolnością serca; pacjenci z umiarkowaną lub ciężką niewydolnością nerek (klirens kreatyniny <59 ml/min); pacjenci z ciężkimi zaburzeniami czynności wątroby (10 do 15 punktów w skali Child-Pugh); pacjenci ze skazą krwotoczną i innymi zaburzeniami krzepnięcia; pacjenci ciężko odwodnieni (z powodu wymiotów, biegunki lub przyjmowania niedostatecznej ilości płynów); kobiety w trzecim trymestrze ciąży i w okresie laktacji (patrz punkt 4.6).
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgPrzeciwwskazania
Centralne (dokanałowe lub nadtwardówkowe) podawanie produktu leczniczego Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji jest przeciwwskazane ze względu na zawartość etanolu w produkcie.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy zachować ostrożność podając produkt leczniczy pacjentom z alergią w wywiadzie. Należy unikać jednoczesnego stosowania produktu leczniczego Dexketoprofen Adamed z innymi lekami z grupy NLPZ w tym selektywnymi inhibitorami cyklooksygenazy-2. Przyjmowanie leku w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz wpływ na przewód pokarmowy i układ krążenia poniżej). Wpływ na bezpieczeństwo stosowania dotyczące przewodu pokarmowego: Dla wszystkich leków z grupy NLPZ istnieją doniesienia o spowodowaniu krwawienia z przewodu pokarmowego, owrzodzenia lub perforacji ze skutkiem śmiertelnym. Mogą one występować w dowolnym okresie leczenia, z objawami ostrzegawczymi lub bez jak również bez ciężkich objawów ze strony przewodu pokarmowego w wywiadzie.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
W przypadku wystąpienia krwawienia z przewodu pokarmowego lub owrzodzenia u pacjentów przyjmujących Dexketoprofen Adamed, produkt należy odstawić. U pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie, szczególnie w połączeniu z krwawieniem lub perforacją (patrz punkt 4.3) oraz u osób w podeszłym wieku, ryzyko krwawienia z przewodu pokarmowego, owrzodzenia lub perforacji jest zwiększone podczas przyjmowania dużych dawek NLPZ. Pacjenci w podeszłym wieku: U pacjentów w podeszłym wieku z większą częstością występują działania niepożądane leków z grupy NLPZ, a w szczególności krwawienia oraz perforacje przewodu pokarmowego, które mogą prowadzić do zgonu (patrz punkt 4.2). Tacy pacjenci powinni rozpoczynać leczenie od możliwie najmniejszej dostępnej dawki. Należy zachować ostrożność podając leki z grupy NLPZ pacjentom z chorobami przewodu pokarmowego (wrzodziejące zapalenie okrężnicy, choroba Leśniowskiego-Crohna) w wywiadzie, ponieważ stan pacjentów może ulec pogorszeniu (patrz punkt 4.8).
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Tak jak w przypadku wszystkich leków z grupy NLPZ, przed rozpoczęciem leczenia deksketoprofenem z trometamolem należy zebrać wywiad dotyczący zapalenia przełyku, zapalenia błony śluzowej żołądka i (lub) choroby wrzodowej żołądka, aby upewnić się, że zostały całkowicie wyleczone. Pacjentów z objawami dotyczącymi żołądka i jelit lub zaburzeniami żołądka i jelit w wywiadzie należy kontrolować pod względem zaburzeń żołądkowo-jelitowych, szczególnie pod względem krwawienia z przewodu pokarmowego. W przypadku tych pacjentów oraz pacjentów wymagających równoczesnego podawania małych dawek kwasu acetylosalicylowego lub innych leków zwiększających prawdopodobieństwo ryzyka zaburzeń żołądka i jelit (patrz poniżej oraz punkt 4.5) należy rozważyć jednoczesne stosowanie produktu leczniczego Dexketoprofen Adamed z innymi lekami o działaniu ochronnym (np. mizoprostolem lub inhibitorami pompy protonowej).
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Pacjenci z działaniami niepożądanymi dotyczącymi układu pokarmowego w wywiadzie, szczególnie pacjenci w podeszłym wieku, powinni zgłaszać każde niepokojące objawy brzuszne (szczególnie krwawienie z przewodu pokarmowego) przede wszystkim w początkowej fazie leczenia. Zaleca się zachowanie ostrożności u pacjentów otrzymujących równocześnie leki mogące zwiększać ryzyko wystąpienia owrzodzenia lub krwawienia, takich jak: doustne leki antykoncepcyjne, leki przeciwzakrzepowe takie jak warfaryna, selektywne inhibitory wychwytu zwrotnego serotoniny lub leki przeciwpłytkowe takie jak kwas acetylosalicylowy (patrz punkt 4.5). Wpływ na bezpieczeństwo stosowania dotyczące nerek: Należy zachować ostrożność w przypadku pacjentów z zaburzeniami czynności nerek. U tych pacjentów stosowanie leków z grupy NLPZ może prowadzić do pogorszenia czynności nerek, zatrzymania płynów i obrzęków.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Należy również zachować ostrożność w przypadku pacjentów otrzymujących leki moczopędne lub u pacjentów zagrożonych hipowolemią, gdyż w takich przypadkach istnieje zwiększone ryzyko wystąpienia działań nefrotoksycznych. Podczas leczenia należy przyjmować odpowiednią ilość płynów, aby zapobiec odwodnieniu i związanym z tym zwiększeniem nefrotoksyczności. Tak jak wszystkie leki z grupy NLPZ, ten produkt leczniczy może prowadzić do zwiększenia w osoczu stężenia azotu mocznikowego i kreatyniny. Tak jak w przypadku innych inhibitorów syntezy prostaglandyn, niepożądane działania mogą dotyczyć nerek i mogą prowadzić do kłębuszkowego zapalenia nerek, śródmiąższowego zapalenia nerek, martwicy brodawek nerkowych, zespołu nerczycowego i ostrej niewydolności nerek. U pacjentów w podeszłym wieku istnieje większe prawdopodobieństwo występowania zaburzeń czynności nerek (patrz punkt 4.2).
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Wpływ na bezpieczeństwo stosowania dotyczące wątroby: W przypadku pacjentów z uszkodzeniem czynności wątroby należy zachować ostrożność. Tak jak inne leki z grupy NLPZ ten produkt leczniczy może powodować przemijający, niewielki wzrost niektórych wskaźników czynności wątroby, a także znaczące zwiększenie aktywności AspAT i AlAT. W przypadku wystąpienia istotnego zwiększenia wartości tych wskaźników należy przerwać leczenie. U pacjentów w podeszłym wieku istnieje większe prawdopodobieństwo występowania zaburzeń czynności wątroby (patrz punkt 4.2). Wpływ na układ krążenia i naczynia mózgowe: Pacjentów z nadciśnieniem tętniczym i (lub) łagodną do umiarkowanej zastoinową niewydolnością serca w wywiadzie należy odpowiednio kontrolować i wydawać właściwe zalecenia. Szczególną ostrożność należy zachować u pacjentów z chorobami serca w wywiadzie, w szczególności u tych, u których wcześniej stwierdzono niewydolność serca, gdyż występuje u nich podwyższone ryzyko nasilenia objawów niewydolności serca, gdyż odnotowano przypadki zatrzymania płynów i obrzęków związanych z leczeniem NLPZ.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Dane pochodzące z badań klinicznych i danych epidemiologicznych wskazują, że przyjmowanie niektórych leków z grupy NLPZ (szczególnie w dużych dawkach i przez długi okres czasu) może się wiązać z niewielkim zwiększeniem ryzyka zdarzeń zakrzepowych tętnic (np. zawał serca lub udar). Brak wystarczających danych do wykluczenia takiego ryzyka w przypadku deksketoprofenu z trometamolem. W związku z powyższym, deksketoprofen z trometamolem należy stosować bardzo rozważnie u pacjentów z niekontrolowanym nadciśnieniem tętniczym, zastoinową niewydolnością serca, chorobą niedokrwienną serca, chorobą tętnic obwodowych i (lub) chorobą naczyń mózgowych. Podobnie, rozwagę należy zachować przed rozpoczęciem długotrwałego leczenia pacjentów z czynnikami ryzyka chorób układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Wszystkie nieselektywne leki z grupy NLPZ mogą hamować agregację płytek i wydłużać czas krwawienia przez hamowanie syntezy prostaglandyn.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Równoczesne stosowanie deksketoprofenu z trometamolem i heparyny drobnocząsteczkowej w dawkach profilaktycznych w okresie pooperacyjnym oceniano w kontrolowanych badaniach klinicznych i nie zaobserwowano zmian parametrów krzepnięcia. Niemniej jednak, pacjentów otrzymujących inne leki, które wpływają na hemostazę, takie jak warfaryna i inne pochodne kumaryny lub heparyny należy uważnie obserwować w trakcie stosowania deksketoprofenu z trometamolem (patrz punkt 4.5). U pacjentów w podeszłym wieku istnieje większe prawdopodobieństwo zaburzeń czynności nerek, wątroby lub sercowo-naczyniowych (patrz punkt 4.2). Reakcje skórne: Po podaniu NLPZ zgłaszano bardzo rzadko przypadki ciężkich reakcji skórnych (niektórych z nich śmiertelnych), włączając złuszczające zapalenie skóry, zespół Stevens-Johnsona i toksyczne martwicze oddzielanie się naskórka (patrz punkt 4.8).
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Wydaje się, iż większe ryzyko wystąpienia tych reakcji u pacjentów związane jest z początkowym okresem leczenia, w większości przypadków objawy te wystąpiły w ciągu pierwszego miesiąca od rozpoczęcia leczenia. Produkt leczniczy Dexketoprofen Adamed należy odstawić natychmiast po pojawieniu się pierwszych objawów wysypki skórnej, zmian błon śluzowych lub jakiegokolwiek innego objawu nadwrażliwości. Inne informacje: Szczególną ostrożność należy zachować w przypadku pacjentów: z wrodzonymi zaburzeniami metabolizmu porfiryn (ostra porfiria przerywana); odwodnionych; bezpośrednio po ciężkich zabiegach chirurgicznych. Jeżeli w opinii lekarza konieczne jest długotrwałe stosowanie deksketoprofenu, wymagane jest regularne kontrolowanie wskaźników czynności wątroby, czynności nerek oraz morfologii krwi. Ciężkie i ostre reakcje nadwrażliwości (np. wstrząs anafilaktyczny) obserwowano bardzo rzadko.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
Po wystąpieniu pierwszych objawów nadwrażliwości po podaniu produktu leczniczego Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, leczenie należy przerwać. Właściwe leczenie, odpowiednie do objawów, powinno być zastosowane przez wykwalifikowany personel medyczny. U pacjentów z astmą oraz przewlekłym nieżytem błony śluzowej nosa, przewlekłym zapaleniem zatok i (lub) polipami nosa, ryzyko wystąpienia uczulenia na kwas acetylosalicylowy i (lub) leki z grupy NLPZ jest wyższe niż u reszty populacji. Podanie tego produktu leczniczego może spowodować wystąpienie napadów astmy lub skurcz oskrzeli, szczególnie u pacjentów z uczuleniem na kwas acetylosalicylowy lub leki z grupy NLPZ (patrz punkt 4.3). W wyjątkowych przypadkach, ospa wietrzna może być przyczyną powikłań prowadzących do ciężkich zakażeń skóry i tkanek miękkich.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
W związku z tym, że nie można wykluczyć wpływu leków z grupy NLPZ na pogorszenie przebiegu tych infekcji zaleca się unikanie stosowania produktu leczniczego Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji w przypadku ospy wietrznej. Należy zachować ostrożność podając Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji pacjentom z zaburzeniami hematopoezy, układowym toczniem rumieniowatym i mieszaną chorobą tkanki łącznej. Maskowanie objawów zakażenia podstawowego: Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji może maskować objawy zakażenia, co może prowadzić do opóźnionego rozpoczęcia stosowania właściwego leczenia, a przez to pogarszać skutki zakażenia. Zjawisko to zaobserwowano w przypadku pozaszpitalnego bakteryjnego zapalenia płuc i powikłań bakteryjnych ospy wietrznej. Jeśli lek Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji stosowany jest z powodu gorączki lub bólu związanych z zakażeniem, zaleca się kontrolowanie przebiegu zakażenia.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgSpecjalne środki ostrozności
W warunkach pozaszpitalnych pacjent powinien skonsultować się z lekarzem, jeśli objawy utrzymują się lub nasilają. Każda ampułka produktu leczniczego Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji zawiera 200 mg etanolu, co odpowiada 5 ml piwa lub 2 ml wina na dawkę. Mała ilość alkoholu w tym leku nie będzie powodowała zauważalnych skutków. Należy to wziąć pod uwagę u kobiet w ciąży, karmiących piersią, dzieci i osób z grupy wysokiego ryzyka, takich jak pacjenci z chorobami wątroby lub padaczką. Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) na dawkę, to znaczy lek uznaje się za „wolny od sodu”. Dzieci i młodzież: Nie ustalono bezpieczeństwa stosowania produktu leczniczego u dzieci i młodzieży.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Następujące interakcje dotyczą całej grupy niesteroidowych leków przeciwzapalnych (NLPZ): Nie należy jednocześnie stosować: Innych leków z grupy NLPZ, w tym selektywnych inhibitorów cyklooksygenazy-2, lub dużych dawek salicylanów (>3 g/dobę): jednoczesne podawanie kilku NLPZ może poprzez działanie synergistyczne zwiększać ryzyko wystąpienia choroby wrzodowej żołądka i (lub) dwunastnicy oraz krwawienia z przewodu pokarmowego. Leków przeciwzakrzepowych: NLPZ, ze względu na wysoki stopień wiązania deksketoprofenu z białkami osocza i hamowanie czynności płytek oraz możliwość uszkodzenia błony śluzowej żołądka i (lub) dwunastnicy, mogą nasilać działanie leków przeciwzakrzepowych, takich jak warfaryna (patrz punkt 4.4). Jeżeli nie można uniknąć takiego stosowania leków, należy prowadzić dokładną obserwację kliniczną i monitorowanie wyników badań laboratoryjnych.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
Heparyny: zwiększone ryzyko krwotoku (ze względu na hamowanie czynności płytek i uszkodzenie błony śluzowej żołądka i (lub) dwunastnicy). Jeżeli nie można uniknąć stosowania takiego połączenia, należy prowadzić staranną obserwację kliniczną i monitorowanie wyników badań laboratoryjnych. Kortykosteroidów: zwiększone ryzyko wystąpienia owrzodzenia przewodu pokarmowego oraz krwawienia (patrz punkt 4.4). Litu (interakcje opisywane dla kilku leków z grupy NLPZ): NLPZ zwiększają stężenie litu we krwi, które może osiągnąć wartości toksyczne (zmniejszone wydalanie litu przez nerki). Metotreksatu, stosowany w dużych dawkach 15 mg/tydzień lub większych: zwiększone działanie toksyczne metotreksatu na układ krwiotwórczy w wyniku zmniejszenia klirensu nerkowego metotreksatu przez niesteroidowe leki przeciwzapalne. Pochodnych hydantoin i sulfonamidów: może nastąpić zwiększenie działania toksycznego tych substancji.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
Jednoczesne stosowanie wymagające zachowania środków ostrożności: Leki moczopędne, ACE inhibitory, antybiotyki aminoglikozydowe i antagoniści receptora angiotensyny II: deksketoprofen może zmniejszać działanie leków moczopędnych i leków hipotensyjnych. U niektórych pacjentów z zaburzeniami czynności nerek (np. pacjentów odwodnionych lub pacjentów w podeszłym wieku z zaburzeniami czynności nerek) jednoczesne podawanie leków hamujących cyklooksygenazę i ACE inhibitorów, antagonistów receptora angiotensyny II lub antybiotyków aminoglikozydowych może prowadzić do dodatkowego pogorszenia czynności nerek, które zazwyczaj jest przemijające. W przypadku jednoczesnego podawania deksketoprofenu i leku moczopędnego kluczowe jest zapewnienie odpowiedniego nawodnienia pacjenta i kontrola czynności nerek na początku leczenia (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania).
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
Metotreksat stosowany w małych dawkach, mniejszych niż 15 mg/tydzień: zwiększone działanie toksyczne metotreksatu na układ krwiotwórczy w wyniku zmniejszenia klirensu nerkowego przez niesteroidowe leki przeciwzapalne. Konieczna jest cotygodniowa kontrola wskaźników morfologii krwi podczas pierwszych tygodni stosowania leczenia skojarzonego. Należy zachować szczególną ostrożność w przypadku zaburzeń czynności nerek, nawet jeśli są łagodne oraz u pacjentów w podeszłym wieku. Pentoksyfilina: zwiększone ryzyko krwawienia. Należy prowadzić dokładną obserwację kliniczną i częściej kontrolować czas krwawienia. Zydowudyna: ryzyko zwiększenia toksycznego działania na układ czerwonokrwinkowy. W wyniku niekorzystnego wpływu na retikulocyty w okresie jednego tygodnia od rozpoczęcia stosowania NLPZ może wystąpić ciężka niedokrwistość. Należy kontrolować wskaźniki morfologii krwi i liczbę retikulocytów w okresie od jednego do dwóch tygodni od rozpoczęcia leczenia NLPZ.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
Pochodne sulfonylomocznika: NLPZ mogą zwiększać działanie hipoglikemizujące pochodnych sulfonylomocznika przez wypieranie ich z połączeń z białkami osocza. Jednoczesne stosowanie wymagające rozważenia: Leki beta-adrenolityczne: podawanie NLPZ może zmniejszać działanie hipotensyjne w wyniku hamowania syntezy prostaglandyn. Cyklosporyna i takrolimus: działanie nefrotoksyczne może się nasilać w wyniku zahamowania przez NLPZ syntezy prostaglandyn nerkowych. Należy kontrolować czynność nerek podczas leczenia skojarzonego. Leki trombolityczne: zwiększone ryzyko krwawienia. Leki przeciwpłytkowe i selektywne inhibitory wychwytu zwrotnego serotoniny: zwiększone ryzyko krwawienia z żołądka i (lub) dwunastnicy (patrz punkt 4.4). Probenecyd: stężenie deksketoprofenu w osoczu może się zwiększyć; interakcja ta może być spowodowana hamującym wpływem probenecydu na wydalanie cewkowe w nerce oraz sprzęganie z glukuronianami i wymaga modyfikacji dawki deksketoprofenu.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
Glikozydy nasercowe: NLPZ mogą zwiększać stężenie glikozydów w osoczu. Mifepryston: teoretycznie istnieje ryzyko, że niesteroidowe leki przeciwzapalne mogą zmieniać skuteczność mifeprystonu. Ograniczone dane wskazują, że jednoczesne stosowanie NLPZ w dniu podania prostaglandyn nie ma negatywnego wpływu na działanie mifeprystonu lub prostaglandyn na dojrzewanie szyjki macicy i kurczliwość macicy oraz nie zmniejsza skuteczności klinicznej farmakologicznego przerwania ciąży. Antybiotyki chinolonowe: dane z badań na zwierzętach wskazują, że duże dawki chinolonów podawane w połączeniu z NLPZ mogą zwiększać ryzyko wystąpienia drgawek. Tenofowir: jednoczesne stosowanie leków z grupy NLPZ może zwiększać stężenie azotu mocznikowego i kreatyniny w osoczu. W związku z tym czynność nerek powinna być monitorowana w celu kontroli potencjalnego synergicznego wpływu na funkcjonowanie nerek.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgInterakcje
Deferazyroks: jednoczesne stosowanie leków z grupy NLPZ może zwiększać ryzyko toksycznego wpływu na układ pokarmowy. Wymagane jest ścisłe monitorowanie kliniczne pacjentów, gdy stosuje się deferazyroks łącznie z tą grupą leków. Pemetreksed: jednoczesne stosowanie leków z grupy NLPZ może zmniejszyć eliminację pemetreksedu, dlatego należy zachować ostrożność w czasie stosowania wyższych dawek NLPZ. Pacjentom z łagodną lub umiarkowaną niewydolnością nerek (klirens kreatyniny od 45 do 79 ml/min), nie należy podawać jednocześnie pemetreksedu z lekami z grupy NLPZ na 2 dni przed i przez 2 dni po podaniu pemetreksedu.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji jest przeciwwskazany do stosowania podczas trzeciego trymestru ciąży i karmienia piersią (patrz punkt 4.3 i 5.3). Ciąża Hamowanie syntezy prostaglandyn może wpływać negatywnie na przebieg ciąży i (lub) rozwój embrionu lub płodu. Dane otrzymane z badań farmakoepidemiologicznych wskazują na zwiększone ryzyko poronienia i zaburzeń budowy serca oraz wytrzewienia po zastosowaniu inhibitora syntezy prostaglandyn we wczesnej ciąży. Całkowite ryzyko zaburzeń budowy układu sercowo-naczyniowego zwiększało się z mniej niż 1% do około 1,5%. Uważa się, iż ryzyko zwiększa się wraz ze zwiększaniem dawki i czasu trwania leczenia. Wykazano, że u zwierząt podawanie inhibitora syntezy prostaglandyn powodowało poronienie przed lub po zagnieżdżeniu się jaja płodowego oraz śmiertelność embrionu lub płodu.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgWpływ na płodność, ciążę i laktację
Dodatkowo u zwierząt, którym podawano inhibitor syntezy prostaglandyn w okresie organogenezy obserwowano zwiększoną częstość występowania różnych wad płodu włączając zaburzenia budowy układu sercowo-naczyniowego. Mimo to, badania na zwierzętach, którym podawano deksketoprofen nie wykazały toksycznego wpływu na reprodukcję (patrz punkt 5.3). Od 20. tygodnia ciąży stosowanie deksketoprofenu może powodować małowodzie spowodowane zaburzeniami czynności nerek płodu. Może ono wystąpić krótko po rozpoczęciu leczenia i zwykle ustępuje po jego przerwaniu. Ponadto zgłaszano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze ciąży, z których większość ustępowała po zaprzestaniu leczenia. Dlatego w pierwszym i drugim trymestrze ciąży nie należy podawać produktu leczniczego Dexketoprofen Adamed, chyba że jest to bezwzględnie konieczne.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgWpływ na płodność, ciążę i laktację
Heśli deksketoprofen stosuje kobieta starającą się zajść w ciążę lub podczas pierwszego i drugiego trymestru ciąży, należy zastosować dawkę jak najmniejszą, a czas trwania leczenia jak najkrótszy. Kilka dni po 20. tygodniu ciąży należy rozważyć przedporodową obserwację w celu wykrycia małowodzia po narażeniu na produkt leczniczy Dexketoprofen Adamed. W razie stwierdzenia małowodzia należy zaprzestać stosowania produktu Dexketoprofen Adamed. W trzecim trymestrze ciąży Wszystkie inhibitory syntezy prostaglandyn mogą działać na płód w następujący sposób: toksyczne działanie dotyczące płuc i serca (w tym przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne); zaburzenia czynności nerek, które mogą prowadzić do niewydolności nerek z małowodzianem (patrz powyżej). U matki i noworodka pod koniec ciąży może dojść do: wydłużenia czasu krwawienia w wyniku działania antyagregacyjnego, które może wystąpić nawet po zastosowaniu bardzo małych dawek; hamowania czynności skurczowej macicy powodującego opóźnienie lub przedłużanie się porodu.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgWpływ na płodność, ciążę i laktację
W związku z tym produkt Dexketoprofen Adamed jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3). Karmienie piersi? Nie wiadomo, czy deksketoprofen przenika do mleka ludzkiego. Stosowanie produktu leczniczego Dexketprofen Adamed podczas karmienia piersią jest przeciwwskazane (patrz punkt 4.3). Płodność Tak jak w przypadku innych leków z grupy NLPZ, stosowanie deksketoprofenu z trometamolem może zaburzać płodność kobiet i nie jest zalecane u kobiet planujących ciążę. Należy rozważyć odstawienie deksketoprofenu u kobiet, które mają problemy z zajściem w ciążę lub które są poddawane badaniom z powodu niepłodności.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji może powodować działania niepożądane, takie jak zawroty głowy, zaburzenia widzenia lub senność. W takim przypadku czas reakcji oraz zdolność do aktywnego uczestniczenia w ruchu drogowym i obsługiwania maszyn może być ograniczona.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgDziałania niepożądane
4.8. Działania niepożądane Zdarzenia niepożądane, które zgłaszano w badaniach klinicznych jak również po wprowadzeniu deksketoprofenu z trometamolem do obrotu, których związek z podawaniem deksketoprofenu z trometamolem uznano za co najmniej możliwy, podano w tabeli poniżej zgodnie z klasyfikacją układów i narządów oraz zgodnie z częstością występowania: KLASYFIKACJA UKŁADÓW I NARZĄDÓW Często (≥1/100 do <1/10) Niedokrwistość Niezbyt często (≥1/1 000 do <1/100) Neutropenia, małopłytkowość Obrzęk gardła Reakcja anafilaktyczna, w tym wstrząs anafilaktyczny Rzadko (≥1/10 000 do <1/1 000) Hiperglikemia, hipoglikemia, hipertriglicerydemia, jadłowstręt Bezsenność Ból głowy, zawroty głowy, senność Parestezje, omdlenia Nieostre widzenie Szumy uszne Skurcze dodatkowe, tachykardia Hipotonia, zaczerwienienie twarzy Nadciśnienie tętnicze, zakrzepowe zapalenie żył powierzchownych Zwolnienie częstości oddechów Skurcz oskrzeli, duszność Nudności, wymioty Ból brzucha, niestrawność, biegunka, zaparcia, wymioty z krwią, suchość błony śluzowej jamy ustnej Choroba wrzodowa żołądka, krwotok lub perforacja (patrz punkt 4.4) Zapalenie trzustki Zapalenie wątroby, żółtaczka Miąższowe wątrobowokomórkowe uszkodzenie wątroby Zapalenie skóry, świąd, wysypka, nasilone pocenie Pokrzywka, trądzik Zespół Stevens-Johnsona, toksyczne martwicze oddzielanie się naskórka (zespół Lyell'a), obrzęk naczynioruchowy, obrzęk twarzy, reakcje nadwrażliwości na światło Sztywność mięśni, sztywność stawów, kurcze mięśni, ból pleców Ostra niewydolność nerek, wielomocz, ból w okolicy nerek, ketonuria, białkomocz Zaburzenia miesiączkowania, zaburzenia gruczołu krokowego Ból w miejscu wstrzyknięcia, reakcja w miejscu wstrzyknięcia, w tym zapalenie, krwiaki lub krwotok Gorączka, zmęczenie, ból, uczucie zimna Sztywność, obrzęki obwodowe Nieprawidłowe wskaźniki czynności wątroby Bardzo rzadko (<1/10 000) Jałowe zapalenie opon mózgowo-rdzeniowych, głównie u pacjentów z toczniem rumieniowatym układowym lub mieszaną chorobą tkanki łącznej; oraz reakcje hematologiczne (plamica, niedokrwistość aplastyczna i hemolityczna, rzadko agranulocytoza i hipoplazja szpiku) Reakcje pęcherzowe łącznie z zespołem Stevensa Johnsona i toksycznym martwiczym oddzielaniem się naskórka Dane pochodzące z badań klinicznych i epidemiologicznych wskazują, że przyjmowanie niektórych NLPZ (szczególnie długotrwałe w dużych dawkach) może się wiązać z niewielkim wzrostem ryzyka zdarzeń zakrzepowych tętnic (np.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgDziałania niepożądane
zawał serca lub udar) (patrz punkt 4.4) Zgłaszanie podejrzewanych działań niepożądanych: Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: +48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgPrzedawkowanie
4.9. Przedawkowanie Objawy przedawkowania nie są znane. Podobne produkty lecznicze wywoływały zaburzenia żołądkowo-jelitowe (wymioty, jadłowstręt, ból brzucha) i neurologiczne (senność, zawroty głowy, dezorientacja, ból głowy). W przypadku przypadkowego zażycia produktu leczniczego lub przedawkowania, należy niezwłocznie wdrożyć leczenie objawowe dostosowane do stanu pacjenta. Deksketoprofen z trometamolem można usunąć z organizmu na drodze dializy.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Pochodne kwasu propionowego. Kod ATC: M 01 AE 17. Deksketoprofen z trometamolem jest solą trometaminową kwasu S-(+)-2-(3-benzoilofenylo)propionowego, jest lekiem przeciwbólowym, przeciwzapalnym i przeciwgorączkowym, który należy do niesteroidowych leków przeciwzapalnych (M01AE). Mechanizm działania Mechanizm działania niesteroidowych leków przeciwzapalnych jest związany ze zmniejszeniem syntezy prostaglandyn w wyniku zahamowania aktywności cyklooksygenazy. NLPZ hamują przekształcanie kwasu arachidonowego do cyklicznych endonadtlenków, PGG2 i PGH2, z których powstają prostaglandyny PGE1, PGE2, PGF2α i PGD2 oraz także prostacyklina PGI2 i tromboksany (TxA2 i TxB2). Ponadto zahamowanie syntezy prostaglandyn może wpływać na inne mediatory stanu zapalnego, takie jak kininy, powodując pośrednie działania, które mogą być dodatkowe w stosunku do działania bezpośredniego.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgWłaściwości farmakodynamiczne
Działanie farmakodynamiczne W badaniach wykazano, że deksketoprofen hamuje aktywność COX-1 i COX-2 u zwierząt i u ludzi. Skuteczność kliniczna i bezpieczeństwo stosowania Badania kliniczne przeprowadzone na kilku modelach bólu wykazały skuteczne działanie przeciwbólowe deksketoprofenu z trometamolem. Przeprowadzono badania skuteczności przeciwbólowej podawanego domięśniowo i dożylnie deksketoprofenu z trometamolem w leczeniu umiarkowanego i ciężkiego bólu, z zastosowaniem kilku modeli bólu chirurgicznego (zabiegi ortopedyczne, ginekologiczne i brzuszne) oraz bólu mięśniowo-kostnego (model ostrego bólu okolicy lędźwiowo-krzyżowej) oraz kolki nerkowej. W przeprowadzonych badaniach początek działania przeciwbólowego następował szybko, a maksymalne działanie przeciwbólowe pojawiało się w ciągu pierwszych 45 minut. Czas trwania działania przeciwbólowego po podaniu 50 mg deksketoprofenu zazwyczaj wynosi 8 godzin.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgWłaściwości farmakodynamiczne
Badania kliniczne przeprowadzone w opanowaniu bólu pooperacyjnego wykazały, że deksketoprofen podawany jednocześnie z opioidami pozwalał na istotne zmniejszenie dawki opioidów. W badaniach nad bólem pooperacyjnym, w których pacjenci otrzymywali morfinę za pomocą pompy infuzyjnej kontrolowanej przez pacjenta, pacjenci leczeni deksketoprofenem wymagali istotnie mniejszej dawki morfiny (od 30% do 45% mniej), niż pacjenci w grupie placebo.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Wchłanianie Po domięśniowym podaniu u ludzi maksymalne stężenie deksketoprofenu z trometamolem występuje po 20 minutach (zakres od 10 do 45 minut) od podania. Dla pojedynczych dawek 25 mg do 50 mg wykazano, że pole powierzchni pod krzywą (AUC) jest proporcjonalne do dawki, zarówno po podaniu domięśniowym jak i dożylnym. Dystrybucja W badaniu farmakokinetyki po podaniu dawek wielokrotnych obserwowano, że stężenie maksymalne Cmax i AUC po ostatnim podaniu domięśniowym lub dożylnym nie różniły się od wartości uzyskanych po podaniu pojedynczej dawki, co wskazuje, że produkt leczniczy nie kumuluje się w organizmie. Tak jak w przypadku innych produktów leczniczych charakteryzujących się dużym stopniem wiązania z białkami osocza (99%), średnia objętość dystrybucji jest mniejsza od 0,25 l/kg. Okres półtrwania w fazie dystrybucji wynosił około 0,35 godziny, a okres półtrwania w fazie eliminacji od 1 do 2,7 godzin.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgWłaściwości farmakokinetyczne
Metabolizm i eliminacja Po podaniu deksketoprofenu z trometamolem w moczu występuje tylko S-(+) enancjomer, co oznacza, że u ludzi nie występuje przekształcanie go do R-(-) enancjomeru. Główną drogą eliminacji deksketoprofenu jest sprzęganie z glukuronidami, a następnie wydalanie przez nerki. Osoby w podeszłym wieku U zdrowych osób w podeszłym wieku (65 lat i starszych), po podaniu dawki pojedynczej i dawek wielokrotnych doustnych, ekspozycja na produkt leczniczy była istotnie wyższa, niż u młodych ochotników (do 55%), natomiast nie obserwowano statystycznie istotnej różnicy pod względem maksymalnego stężenia i czasu do osiągnięcia maksymalnego stężenia. Średni okres półtrwania w fazie eliminacji po podaniu dawki pojedynczej i dawek wielokrotnych był wydłużony (do 48%), a całkowity rzeczywisty klirens był zmniejszony.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań dotyczących farmakologii bezpieczeństwa, toksyczności po podaniu dawek wielokrotnych, genotoksyczności, toksyczności reprodukcyjnej i immunofarmakologii nie ujawniają szczególnych zagrożeń dla człowieka. Badania przewlekłej toksyczności przeprowadzone na myszach i małpach wykazały poziom NOAEL (poziom, na którym nie obserwowano żadnych działań niepożądanych) przy podawaniu dawek dwukrotnie większych niż maksymalne dawki zalecane u ludzi. Głównymi działaniami niepożądanymi obserwowanymi po podaniu większych dawek u małp były: krew w kale, wolniejszy przyrost masy ciała i, po podaniu najwyższej dawki, nadżerki błony śluzowej żołądka i (lub) dwunastnicy. Objawy te występowały po podaniu dawek stanowiących 14-18 krotnie wyższą ekspozycję niż dawki maksymalne zalecane do stosowania u ludzi. Nie ma badań oceniających potencjał kancerogenny u zwierząt.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgPrzedkliniczne dane o bezpieczeństwie
Jak stwierdzono dla całej grupy farmakologicznej NLPZ, deksketoprofen z trometamolem może powodować zmiany czasu przeżycia zarodka/płodu w modelach zwierzęcych, zarówno pośrednio, w wyniku działania toksycznego na żołądek i jelita u ciężarnych matek, jak i bezpośrednio poprzez wpływ na rozwój płodu.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Etanol 96 % Sodu chlorek Sodu pirosiarczyn Sodu wodorotlenek (do ustalenia pH) Woda do wstrzykiwań 6.2. Niezgodności farmaceutyczne Produktu leczniczego Dexketoprofen Adamed roztwór do wstrzykiwań / do infuzji nie wolno mieszać w niewielkiej objętości (np. w strzykawce) z roztworami dopaminy, prometazyny, pentazocyny, petydyny ani hydroksyzyny, gdyż doprowadzi to do strącenia roztworu. Rozcieńczonego roztworu do wstrzykiwań, uzyskanego jak podano w punkcie 6.6, nie wolno mieszać z prometazyną ani pentazocyną. Produktu leczniczego nie wolno mieszać z innymi produktami leczniczymi, innymi niż wymienione w punkcie 6.6. 6.3. Okres ważności Nieotwarta ampułka: 2 lata. Okres ważności po rozcieńczeniu: Po rozcieńczeniu 5% roztworem glukozy lub roztworem Ringera, produkt leczniczy Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji przechowywany w temperaturze od 2ºC do 8ºC, zachowuje stabilność przez 24 godziny.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgDane farmaceutyczne
Po rozcieńczeniu zgodnie z zaleceniami zawartymi w punkcie 6.6., rozcieńczony roztwór, przechowywany w temperaturze 2ºC do 8ºC, zachowuje stabilność przez 24 godziny. Z mikrobiologicznego punktu widzenia produkt leczniczy należy zużyć bezpośrednio po rozcieńczeniu. Jeżeli produkt leczniczy nie zostanie zużyty bezpośrednio po rozcieńczeniu, użytkownik odpowiada za okres i warunki przechowywania przed użyciem, a okres przechowywania nie powinien przekraczać 24 godzin w temperaturze 2ºC do 8ºC, chyba że rozcieńczenie odbyło się w kontrolowanych i zwalidowanych warunkach aseptycznych. 6.4. Specjalne środki ostrożności podczas przechowywania Przechowywać ampułki w opakowaniu zewnętrznym w celu ochrony przed światłem. Brak specjalnych zaleceń dotyczących temperatury przechowywania produktu leczniczego. 6.5.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgDane farmaceutyczne
Rodzaj i zawartość opakowania Opakowanie bezpośrednie produktu leczniczego Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mg/2 ml: Ampułki z barwionego szkła typu I, zawierające 2 ml roztworu do wstrzykiwań lub infuzji. Opakowanie zawiera 5 lub 10 ampułek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6. Specjalne środki ostrożności dotyczące usuwania Wykazano, że Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji jest zgodny, gdy zostanie wymieszany w niewielkich objętościach (np. w strzykawce) z roztworami do wstrzykiwań heparyny, lidokainy, morfiny i teofiliny. W celu podania w postaci wlewu dożylnego zawartość 1 ampułki (2 ml) produktu Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji należy rozcieńczyć w objętości 30 ml do 100 ml roztworu soli fizjologicznej, glukozy lub roztworu Ringera z dodatkiem mleczanu. Roztwór należy rozcieńczyć w warunkach aseptycznych i chronić przed naturalnym światłem dziennym.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgDane farmaceutyczne
Rozcieńczony roztwór jest klarowny. Wykazano, że Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, rozcieńczony w objętości 100 ml roztworu soli fizjologicznej lub roztworu glukozy, jest zgodny z następującymi lekami: dopaminą, heparyną, hydroksyzyną, lidokainą, morfiną, petydyną i teofiliną. Nie stwierdzono wchłaniania substancji czynnej, gdy rozcieńczony roztwór produktu leczniczego Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji przechowywano w plastikowych torebkach lub urządzeniach do podawania sporządzonych z octanu etylowinylu (EVA), propionianu celulozy (CP), polietylenu o niskiej gęstości (LDPE) i chlorku poliwinylu (PVC). Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji jest przeznaczony wyłącznie do jednokrotnego zastosowania i całość nieużytego roztworu należy usunąć.
- CHPL leku Dexketoprofen Adamed, roztwór do wstrzykiwań / do infuzji, 50 mgDane farmaceutyczne
Przed zastosowaniem produktu, roztwór należy ocenić wzrokowo, aby się upewnić, że jest klarowny i bezbarwny: nie wolno stosować produktu, jeżeli stwierdzono jakiekolwiek cząstki stałe. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Zobacz również:
- Dawkowanie leku
Diklofenak to substancja czynna o szerokim zastosowaniu w leczeniu bólu, stanów zapalnych oraz obrzęków. Dostępny jest w różnych postaciach, takich jak tabletki, żele, czopki, krople do oczu czy roztwory do wstrzykiwań. Schemat dawkowania zależy od wieku pacjenta, drogi podania, rodzaju dolegliwości oraz ogólnego stanu zdrowia. W opisie znajdziesz szczegółowe informacje, jak bezpiecznie i skutecznie stosować diklofenak w poszczególnych przypadkach.
- Działania niepożądane i skutki uboczne
Diklofenak to popularna substancja przeciwbólowo-przeciwzapalna, stosowana w różnych postaciach – od tabletek, przez żele, aż po krople do oczu i zastrzyki. W zależności od sposobu podania i dawki może wywoływać różnorodne działania niepożądane, od łagodnych objawów skórnych po poważniejsze zaburzenia układu pokarmowego czy sercowo-naczyniowego. Warto poznać, jak mogą różnić się te działania w zależności od stosowanej formy leku oraz które objawy powinny szczególnie zwrócić uwagę pacjenta.
- Mechanizm działania
Diklofenak to substancja czynna, która skutecznie łagodzi ból, zmniejsza stany zapalne i obrzęki, dzięki czemu znajduje szerokie zastosowanie w leczeniu różnych dolegliwości, takich jak bóle mięśni, stawów czy stany zapalne po urazach. Mechanizm działania diklofenaku opiera się na hamowaniu powstawania substancji wywołujących ból i zapalenie. Szybkość działania i sposób wchłaniania diklofenaku zależy od postaci leku i drogi podania, co pozwala na dostosowanie terapii do indywidualnych potrzeb pacjenta.
- Porównanie substancji czynnych
Diklofenak, aceklofenak i ketoprofen to popularne niesteroidowe leki przeciwzapalne (NLPZ) wykorzystywane w leczeniu bólu oraz stanów zapalnych. Różnią się między sobą m.in. zakresem wskazań, dostępnymi postaciami leków, bezpieczeństwem stosowania u osób w różnym wieku czy u kobiet w ciąży. Poznaj podobieństwa i różnice między tymi substancjami, by świadomie rozmawiać z lekarzem o wyborze najlepszego leku przeciwbólowego lub przeciwzapalnego.
- Profil bezpieczeństwa
Diklofenak to popularna substancja o działaniu przeciwbólowym i przeciwzapalnym, stosowana w różnych postaciach – od tabletek, przez żele, czopki, krople do oczu, aż po iniekcje. Bezpieczeństwo jego stosowania zależy jednak od drogi podania, wieku pacjenta oraz obecności chorób współistniejących. Poznaj najważniejsze zasady bezpiecznego użycia diklofenaku w zależności od formy leku i sytuacji zdrowotnej.
- Przeciwwskazania
Diklofenak to popularny niesteroidowy lek przeciwzapalny (NLPZ), stosowany w łagodzeniu bólu i stanów zapalnych w różnych schorzeniach. Jednak nie każdy może go bezpiecznie stosować – istnieją sytuacje, w których diklofenak jest przeciwwskazany lub wymaga szczególnej ostrożności. Poznaj najważniejsze przeciwwskazania i środki ostrożności, które powinien znać każdy pacjent rozważający terapię tym lekiem.
- Stosowanie u dzieci
Stosowanie diklofenaku u dzieci wymaga szczególnej ostrożności, ponieważ bezpieczeństwo i skuteczność tej substancji czynnej różnią się w zależności od postaci leku i drogi podania. W większości preparatów diklofenak nie jest zalecany dla dzieci poniżej określonego wieku, a niektóre formy są całkowicie przeciwwskazane w tej grupie wiekowej. Poznaj szczegółowe zasady bezpieczeństwa oraz ograniczenia dotyczące stosowania diklofenaku w terapii dzieci.
- Stosowanie u kierowców
Diklofenak to popularna substancja przeciwzapalna i przeciwbólowa, stosowana w różnych postaciach, takich jak żele, tabletki, czopki, roztwory do wstrzykiwań czy krople do oczu. Jego wpływ na zdolność do prowadzenia pojazdów i obsługi maszyn zależy od drogi podania i indywidualnej reakcji organizmu. W opisie znajdziesz szczegółowe informacje, które pomogą ocenić bezpieczeństwo stosowania diklofenaku w codziennych sytuacjach wymagających koncentracji i koordynacji.
- Stosowanie w ciąży
Stosowanie diklofenaku w okresie ciąży i karmienia piersią wymaga szczególnej ostrożności, ponieważ lek ten, podobnie jak inne niesteroidowe leki przeciwzapalne, może mieć wpływ na zdrowie matki oraz dziecka. Bezpieczeństwo stosowania zależy od drogi podania, dawki oraz okresu ciąży. Przed użyciem diklofenaku w tych szczególnych okresach zawsze należy dokładnie rozważyć potencjalne ryzyko i korzyści.
- Wskazania - na co działa?
Diklofenak to wszechstronnie stosowana substancja czynna o działaniu przeciwbólowym i przeciwzapalnym. Występuje w różnych postaciach – od żeli i tabletek po czopki, roztwory do wstrzykiwań i krople do oczu. Dzięki temu może być skutecznie wykorzystywany w leczeniu wielu dolegliwości, takich jak bóle mięśni i stawów, stany zapalne, migreny czy bóle pooperacyjne. Poznaj, w jakich wskazaniach diklofenak znajduje zastosowanie i na co warto zwrócić uwagę przy jego stosowaniu.
- Rzedawkowanie substancji
Przedawkowanie diklofenaku, popularnego leku przeciwbólowego i przeciwzapalnego, może prowadzić do poważnych skutków zdrowotnych, zwłaszcza gdy jest przyjmowany doustnie, w postaci iniekcji lub czopków. W przypadku stosowania miejscowego ryzyko jest niewielkie, jednak przypadkowe połknięcie większej ilości żelu lub roztworu może skutkować objawami typowymi dla przedawkowania leków z tej grupy. Poznaj, jakie symptomy mogą świadczyć o przedawkowaniu, jak wygląda postępowanie w takiej sytuacji oraz na co szczególnie zwrócić uwagę.
REKLAMA