Kapsaicyna to substancja stosowana miejscowo w leczeniu bólu neuropatycznego u dorosłych. Działa poprzez wpływ na receptory bólu w skórze, przynosząc ulgę w przewlekłym bólu, zwłaszcza u osób z neuropatią cukrzycową lub po przebytym półpaścu. Leczenie kapsaicyną odbywa się za pomocą specjalnych plastrów, które nakładane są wyłącznie przez personel medyczny.
Jak działa kapsaicyna?
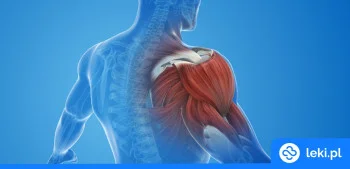
Kapsaicyna to substancja pochodzenia naturalnego, należąca do grupy leków miejscowo znieczulających. Wykazuje działanie przeciwbólowe poprzez wpływ na receptory odpowiedzialne za odczuwanie bólu w skórze. Stosuje się ją w leczeniu obwodowego bólu neuropatycznego u dorosłych1.
Dostępne postacie leku i dawki
- Plaster leczniczy: 179 mg kapsaicyny w jednym plastrze o powierzchni 280 cm² (8% kapsaicyny, czyli 640 mikrogramów/cm²)2.
Brak innych postaci oraz połączeń z innymi substancjami czynnymi w dostępnych źródłach.
Najważniejsze wskazania do stosowania
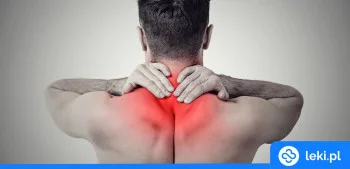
- Leczenie obwodowego bólu neuropatycznego u dorosłych, zarówno samodzielnie, jak i w połączeniu z innymi lekami przeciwbólowymi1.
Podstawowe informacje o dawkowaniu
Plaster nakłada się na bolesne miejsce na skórze, zwykle na 30-60 minut. Maksymalnie można użyć 4 plastrów podczas jednej sesji. Leczenie można powtarzać co 90 dni, w niektórych przypadkach po indywidualnej ocenie lekarza — nie częściej niż co 60 dni3.
Kiedy nie stosować kapsaicyny?
- Nadwrażliwość na kapsaicynę lub inne składniki preparatu4.
Profil bezpieczeństwa kapsaicyny
Nie ma wystarczających danych dotyczących bezpieczeństwa stosowania u kobiet w ciąży i karmiących piersią. Brak informacji o wpływie na zdolność prowadzenia pojazdów i obsługę maszyn, jednak reakcje miejscowe mogą być uciążliwe. U osób starszych i z zaburzeniami nerek lub wątroby nie jest wymagane dostosowanie dawki5.
Przedawkowanie kapsaicyny
Przedawkowanie jest mało prawdopodobne, gdyż lek stosuje wyłącznie personel medyczny. Objawy mogą obejmować silniejsze reakcje skórne, takie jak ból, rumień i świąd w miejscu nałożenia. W razie podejrzenia przedawkowania należy usunąć plaster i oczyścić skórę zgodnie z instrukcją6.
Interakcje z innymi lekami
Nie odnotowano istotnych interakcji kapsaicyny z innymi lekami, ponieważ jej wchłanianie do organizmu jest bardzo niewielkie7.
Najczęstsze działania niepożądane
- Ból, pieczenie, rumień i świąd w miejscu nałożenia plastra
- Suchość, opuchlizna, pęcherze lub grudki w miejscu nałożenia
- Nadciśnienie tętnicze
- Nudności, kaszel
- Rzadziej: zaburzenia czucia, podrażnienie oka, półpasiec8
Mechanizm działania kapsaicyny
Kapsaicyna działa poprzez pobudzenie określonych receptorów bólu (TRPV1) w skórze, co początkowo wywołuje uczucie pieczenia, a następnie prowadzi do zmniejszenia wrażliwości tych receptorów i złagodzenia bólu9.
Stosowanie w ciąży
Brak wystarczających danych dotyczących bezpieczeństwa stosowania kapsaicyny u kobiet w ciąży. Stosowanie jest możliwe wyłącznie po ocenie ryzyka przez lekarza5.
Stosowanie u dzieci
Nie określono bezpieczeństwa ani skuteczności stosowania kapsaicyny u dzieci i młodzieży poniżej 18 roku życia5.
Stosowanie przez kierowców
Nie ma szczegółowych danych dotyczących wpływu kapsaicyny na zdolność prowadzenia pojazdów. Jednak miejscowe reakcje skórne mogą być uciążliwe i powinny być brane pod uwagę5.
Kapsaicyna – porównanie substancji czynnych
Kapsaicyna, mentol i lidokaina to substancje miejscowo działające przeciwbólowo i znieczulająco. Porównanie ich zastosowań, mechanizmów działania, bezpieczeństwa i przeciwwskazań pomaga wybrać odpowie...
czytaj więcej ❯❯- CHPL leku Qutenza, plaster leczniczy, 179 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Qutenza 179 mg plastry lecznicze 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy plaster leczniczy o powierzchni 280 cm 2 zawiera 179 mg kapsaicyny, to jest 640 mikrogramów kapsaicyny na cm 2 plastra. Substancja pomocnicza o znanym działaniu: Każda tuba żelu oczyszczającego 50 g dla produktu Qutenza zawiera 0,2 mg/g butylohydroksyanizolu (E320) Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Plaster leczniczy. Każdy plaster leczniczy ma wymiary 14 cm x 20 cm (280 cm 2 ) i składa się ze strony przylegającej zawierającej substancję czynną i zewnętrznej, powierzchniowej warstwy podkładowej. Strona przylegająca pokryta jest usuwalną, przezroczystą, niezadrukowaną, poprzecznie naciętą folią ochronną. Na zewnętrznej powierzchni warstwy podkładowej znajduje się nadruk „capsaicin 8%”.
- CHPL leku Qutenza, plaster leczniczy, 179 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt Qutenza jest wskazany w leczeniu obwodowego bólu neuropatycznego u dorosłych pacjentów w monoterapii lub w skojarzeniu z innymi lekami przeciwbólowymi.
- CHPL leku Qutenza, plaster leczniczy, 179 mgDawkowanie
4.2 Dawkowanie i sposób podawania Plaster Qutenza powinien być nakładany przez lekarza lub fachowy personel medyczny pod nadzorem lekarza. Dawkowanie Plaster leczniczy powinien być nałożony na najbardziej bolesne miejsca na skórze (z zastosowaniem maksymalnie 4 plastrów). Lekarz lub inny specjalista ochrony zdrowia powinien określić bolesne miejsce i zaznaczyć je na skórze.Plaster Qutenza należy nałożyć na nieuszkodzoną, niepodrażnioną, suchą skórę i pozostawić na 30 minut na stopach (np. w neuropatii w przebiegu zakażenia HIV, w bolesnej obwodowej neuropatii cukrzycowej) i na 60 minut w innych miejscach (np. w neuralgii popółpaścowej). Jeśli ból utrzymuje się lub nawraca, leczenie plastrem Qutenza można powtarzać co 90 dni. Ponowne leczenie po mniej niż 90 dniach może być rozważane dla poszczegolnych pacjentów tylko po starannej ocenie przez lekarza (zob. też punkt 5.1). Należy przestrzegać przynajmniej 60-dniowego odstępu między tymi terapiami.
- CHPL leku Qutenza, plaster leczniczy, 179 mgDawkowanie
Zaleca się odpowiednio długie leczenie i indywidualną ponowną ocenę skuteczności po 3 takich terapiach. W celu zmniejszenia mogącego wystąpić dyskomfortu związanego z nałożeniem plastra Qutenza przed zabiegiem, na leczone miejsce można nanieść środek miejscowo znieczulający lub podać pacjentowi doustny środek przeciwbólowy. Środek miejscowo znieczulający należy nałożyć na całą powierzchnię leczonego miejsca i do 1 cm lub 2 cm wokół niego. Przed nałożeniem plastra Qutenza środki miejscowo znieczulające należy usunąć, a skórę należy dokładnie umyć i wysuszyć. Zaburzenia czynności nerek i (lub) wątroby Nie ma konieczności dostosowania dawki u pacjentów z zaburzeniami czynności nerek lub wątroby. Dzieci i młodzież Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Qutenza u dzieci w wieku od urodzenia do 18 lat. Brak dostępnych badań. Sposób podawania Podanie wyłącznie na skórę.
- CHPL leku Qutenza, plaster leczniczy, 179 mgDawkowanie
Środki ostrożności, które należy podjąć przed przygotowaniem lub podaniem produktu leczniczego Zaleca się stosowanie plastra Qutenza w dobrze wentylowanym miejscu. Podczas przygotowywania, nakładania i usuwania plastra Qutenza oraz oczyszczania leczonych miejsc, należy zawsze zakładać rękawiczki nitrylowe. NIE należy stosować rękawiczek lateksowych, ponieważ nie stanowią one odpowiedniego zabezpieczenia. Zaleca się zastosowanie maski i okularów ochronnych, w szczególności podczas nakładania i zdejmowania plastra. Należy przestrzegać powyższych środków ostrożoności aby uniknąć niezamierzonego kontaktu z plastrami lub innymi materiałami, które miały styczność z leczonym miejscem. Niezamierzony kontakt z produktem może wywołać przemijający rumień i uczucie pieczenia (na co wrażliwe są szczególnie błony śluzowe), ból oka oraz podrażnienie gardła i kaszel. Nie należy trzymać plastrów w pobliżu oczu lub błon śluzowych.
- CHPL leku Qutenza, plaster leczniczy, 179 mgDawkowanie
Jeśli to konieczne, w celu poprawy przylegania plastra, należy obciąć włosy w miejscu leczenia (nie należy golić włosów). Miejsce(a) leczenia należy delikatnie przemyć wodą i mydłem. Po usunięciu włosów i obmyciu, skórę należy dokładnie osuszyć. Instrukcja użycia Qutenza to plaster do jednorazowego użytku, który może być przycięty do określonego rozmiaru i kształtu leczonej powierzchni. Plaster Qutenza należy przyciąć przed zdjęciem folii ochronnej. NIE należy zdejmować folii ochronnej do momentu bezpośrednio poprzedzającego nałożenie plastra. Na folii ochronnej znajduje się poprzeczne nacięcie ułatwiające jej usuwanie. Należy odkleić i zwinąć część folii ochronnej i umieścić plaster stroną przylegającą w miejscu leczenia. Plaster należy przytrzymać. Jedną ręką należy powoli i ostrożnie odklejać folię ochronną od spodu i w tym samym czasie drugą ręką wygładzać plaster na skórze aby zapewnić całkowity kontakt plastra ze skórą, bez pęcherzyków powietrza i bez wilgoci.
- CHPL leku Qutenza, plaster leczniczy, 179 mgDawkowanie
W przypadku stosowania na stopy, plastry Qutenza można owinąć dookoła powierzchni grzbietowej, bocznej i podeszwowej stopy, aby całkowicie pokryć leczoną powierzchnię. Aby zapewnić stały kontakt plastra Qutenza z miejscem leczenia, można wykorzystać elastyczne skarpetki lub bandaż. Plastry Qutenza należy zdejmować delikatnie i powoli, zwijając je do wewnątrz, aby zminimalizować ryzyko aerozolizacji kapsaicyny. Po usunięciu plastra na miejsce leczenia należy nałożyć żel oczyszczający w dużej ilości i pozostawić na około 1 minutę. Za pomocą suchej gazy należy wytrzeć żel oczyszczający w celu usunięcia pozostałej na skórze kapsaicyny. Po wytarciu żelu oczyszczającego miejsce leczenia należy delikatnie umyć mydłem i wodą. Pacjenci, u których wystąpi ból podczas nakładania plastra i po jego nałożeniu, powinni otrzymać leczenie wspomagające (patrz punkt 4.4) Instrukcje dotyczące przygotowania i usuwania stosowanych materiałów zamieszczono w punkcie 6.6.
- CHPL leku Qutenza, plaster leczniczy, 179 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Qutenza, plaster leczniczy, 179 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ocena stanu skóry Plastry Qutenza muszą być nakładane wyłącznie na suchą, nienaruszoną (nieuszkodzoną) skórę. Nie należy ich stosować na skórę twarzy, w okolicy ponad linią włosów i (lub) w okolicy błon śluzowych. U pacjentów z bolesną obwodową neuropatią cukrzycową, przed każdym podaniem plastra oraz podczas kolejnych wizyt należy dokładnie obejrzeć stopy w celu wykrycia zmian chorobowych na skórze wynikających z neuropatii oraz niewydolności naczyniowej. Zaburzenia czucia Donoszono o zmniejszeniu czucia skórnego po zastosowaniu plastra Qutenza. Zmniejszenie czucia skórnego (w tym odczuwanie bodźców termicznych i kłucia) było zazwyczaj nieznaczne i przemijające. W badaniu klinicznym z zastosowaniem plastra Qutenza w bolesnej neuropatii cukrzycowej, donoszono jednak o jednym przypadku przewlekłej niedoczulicy, w którym nie można wykluczyć związku pomiędzy jej wystąpieniem a zastosowaniem plastra Qutenza.
- CHPL leku Qutenza, plaster leczniczy, 179 mgSpecjalne środki ostrozności
Należy zachować ostrożność u pacjentów ze zmniejszonym czuciem w stopach oraz u pacjentów ze zwiększonym ryzykiem jego wystąpienia. U pacjentów, u których w przeszłości występowały zaburzenia czucia skórnego przed każdym zastosowaniem plastra Qutenza należy ocenić stopień czucia skórnego i w przypadku jego braku lub pogorszenia, ponownie rozważyć zasadność zastosowania plastra Qutenza. Monitorowanie i sposób postępowania w przypadku reakcji w miejscu podania Reakcje w miejscu podania, takie jak przemijające uczucie pieczenia, ból, rumień i wysypka w miejscu podania występują często lub bardzo często. Ponadto, u pacjentów leczonych plastrami z kapsaicyną, zgłaszano przypadki oparzeń, w tym oparzeń drugiego i trzeciego stopnia - (patrz punkt 4.8). W przypadku pacjentów zgłaszających ostry ból, należy usunąć plaster i zbadać pacjenta w kierunku poparzenia chemicznego.
- CHPL leku Qutenza, plaster leczniczy, 179 mgSpecjalne środki ostrozności
Niezamierzona ekspozycja Niezamierzona ekspozycja na kapsaicynę może wywołać podrażnienie oczu, błon śluzowych, dróg oddechowych oraz skóry u pacjentów i fachowego personelu medycznego. Fachowy personel medyczny powinien zapewnić odpowiednie stosowanie środków ostrożności podanych w punkcie 4.2. Jeśli dojdzie do kontaktu plastra Qutenza ze skórą w okolicy innej niż miejsce leczenia, należy nałożyć na nią żel oczyszczający na 1 minutę, a następnie - aby usunąć pozostałości kapsaicyny z powierzchni skóry - zetrzeć go za pomocą suchej gazy. Po wytarciu żelu oczyszczającego miejsce kontaktu należy delikatnie umyć mydłem i wodą. Jeśli kapsaicyna dostanie się do oczu lub na błony śluzowe, należy je przepłukać lub przemyć zimną wodą. Gdy dojdzie do podrażenienia dróg oddechowych, oczu lub błon śluzowych osoba, której to dotyczy, powinna oddalić się z miejsca, gdzie podawany jest produkt Qutenza. Jeśli wystąpi duszność, należy zapewnić odpowiednią pomoc lekarską.
- CHPL leku Qutenza, plaster leczniczy, 179 mgSpecjalne środki ostrozności
W razie pogorszenia się lub nieustąpienia podrażnienia dróg oddechowych (patrz także punkt 4.8), należy dokładnie rozważyć ponowną ekspozycję na plaster Qutenza u takiej osoby. Zwiększenie ciśnienia tętniczego krwi W wyniku związanego z leczeniem nasilenia bólu, podczas stosowania plastra Qutenza i na krótko po jego zastosowaniu, może dojść do przejściowego podwyższenia ciśnienia krwi (średnio < 8,0 mm Hg). Podczas zabiegu leczniczego należy monitorować ciśnienie tętnicze krwi. Upacjentów z niestabilnym lub źle kontrolowanym nadciśnieniem tętniczym lub chorobami sercowo-naczyniowymi w wywiadzie, przed wdrożeniem leczenia za pomocą plastra Qutenza należy rozważyć ryzyko wystąpienia incydentów sercowo-naczyniowych w wyniku możliwego stresu związanego z zabiegiem. Należy zwrócić szczególną uwagę na pacjentów z cukrzycą, u których występuje choroba wieńcowa, nadciśnienie i neuropatia autonomiczna układu sercowo-naczyniowego.
- CHPL leku Qutenza, plaster leczniczy, 179 mgSpecjalne środki ostrozności
Dyskomfort związany z leczeniem Pacjenci, u których wystąpi ból podczas nakładania plastra i po jego nałożeniu, powinni otrzymać leczenie objawowe (takie jak zimny okład) lub doustne leki przeciwbólowe. Żel oczyszczający Zawarty w zestawie produktu Qutenza żel oczyszczający zawiera butylohydroksyanizol, który może wywoływać miejscowe reakcje skórne (np. kontaktowe zapalenie skóry) lub podrażnienie oczu i błon śluzowych.
- CHPL leku Qutenza, plaster leczniczy, 179 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji z innymi produktami leczniczymi, ponieważ po zastosowaniu produktu Qutenza obserwowano jedynie przemijające, niewielkie wchłanianie substancji czynnej do krążenia ogólnego.
- CHPL leku Qutenza, plaster leczniczy, 179 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych lub istnieją tylko ograniczone dane dotyczące stosowania kapsaicyny u kobiet w okresie ciąży. Na podstawie właściwości farmakokinetycznych u ludzi, które wskazują na przejściową, małą ekspozycję ogólnoustrojową na kapsaicynę, prawdopodobieństwo, że plastry Qutenza zwiększają ryzyko nieprawidłowości rozwojowych podczas stosowania w okresie ciąży jest niskie. Jednakże należy zachować ostrożność przepisując lek kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kapsaicyna i (lub) jej metabolity przenikają do mleka ludzkiego. Na podstawie dostępnych danych farmakodynamicznych i (lub) toksykologicznych dotyczących zwierząt stwierdzono przenikanie kapsaicyny i (lub) jej metabolitów do mleka (szczegóły patrz 5.3.). Nie można wykluczyć zagrożenia dla noworodków i (lub) dzieci. Podczas leczenia produktem Qutenza należy przerwać karmienie piersią. Płodność Brak dostępnych danych dotyczących wpływu na płodność u ludzi.
- CHPL leku Qutenza, plaster leczniczy, 179 mgWpływ na płodność, ciążę i laktację
W badaniach szkodliwego wpływu na reprodukcję przeprowadzonych na szczurach wykazano zmniejszenie liczby i odsetka ruchomych plemników oraz zmniejszenie liczby ciąż (patrz punkt 5.3).
- CHPL leku Qutenza, plaster leczniczy, 179 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Qutenza nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowdzenia pojazdów i obsługiwania maszyn.
- CHPL leku Qutenza, plaster leczniczy, 179 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Najczęściej zgłaszanymi reakcjami niepożądanymi były przemijające uczucie pieczenia, ból, rumień i świąd w miejscu nałożenia. Tabelaryczne zestawienie działań niepożądanych W tabeli 1 poniżej zamieszczonowszystkie działania niepożądane, które wystąpiły z częstością większą niż w grupie kontrolnej i u więcej niż jednego pacjenta podczas badań klinicznych z grupami kontrolnymi u pacjentów z nerwobólem popółpaścowym (ang. Postherpetic neuralgia, PHN) i bolesną neuropatią w przebiegu zakażenia HIV (ang. Human Imunnodeficiency Virus – Associated Neuropathy, HIV-AN) oraz bolesną obwodową neuropatią cukrzycową, wg klasyfikacji układów i narządów i częstości występowania: bardzo często (≥ 1/10), często (≥ 1/100 do <1/10), niezbyt często (≥ 1/1000 do < 1/100) oraz nieznana (częstość nie może być określona na podstawie dostępnych danych.
- CHPL leku Qutenza, plaster leczniczy, 179 mgDziałania niepożądane
W obrębie każdej grupy o określonej częstości występowania objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Tabela 1: Tabelaryczne zestawienie działań niepożądanych
- CHPL leku Qutenza, plaster leczniczy, 179 mgDziałania niepożądane
Klasy organów i narządów i częstość występowania Reakcje niepożądane Zakażenia i zarażenia pasożytnicze Niezbyt często Półpasiec Zaburzenia układu nerwowego Często Uczucie pieczenia Niezbyt często Zaburzenia smaku, niedoczulica Zaburzenia oka Niezbyt często Podrażnienie oka Zaburzenia serca Niezbyt często Blok przedsionkowo-komorowy I stopnia, tachykardia, kołatanie serca Zaburzenia naczyniowe Często Nadciśnienie tętnicze Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Często Kaszel Niezbyt często Podrażnienie gardła Zaburzenia żołądka i jelit Często Nudności Zaburzenia skóry i tkanki podskórnej Często Świąd Zaburzenia mięśniowo- szkieletowe i tkanki łącznej Często Ból kończyn, skurcze mięśni Zaburzenia ogólne i stany w miejscu podania Bardzo często Ból w miejscu nałożenia, rumień w miejscu nałożenia Często Świąd w miejscu nałożenia, grudki w miejscu nałożenia, pęcherzykiw miejscu nałożenia, obrzęk w miejscu nałożenia, opuchlizna w miejscu nałożenia, suchość w miejscu nałożenia, obrzęki obwodowe Niezbyt często Pokrzywka w miejscu nałożenia, parastezje w miejscu nałożenia, zapalenie skóry w miejscu nałożenia, przeczulica w miejscu nałożenia, stan zapalny w miejscu nałożenia, reakcja w miejscu nałożenia, podrażnienie w miejscunałożenia, zasinienie w miejscu nałożenia Badania diagnostyczne Często Podwyższone ciśnienie tętnicze krwi Urazy, zatrucia i powikłania po zabiegach Nieznana Oparzenia w miejscu nałożenia (w tym oparzenia drugiego i trzeciego stopnia), przypadkowe narażenie na produkt (w tym ból oka, podrażnienie oka oraz podrażnienie gardła i kaszel) - CHPL leku Qutenza, plaster leczniczy, 179 mgDziałania niepożądane
Opis wybranych działań niepożądanych Reakcje niepożądane były przemijające, samoograniczające się i zazwyczaj o łagodnym lub umiarkowanym nasileniu. W badaniach z grupami kontrolnymi częstość przerywania leczenia z powodu reakcji niepożądanych wyniosła 2% w grupie pacjentów leczonych plastrami Qutenza i 0,9% w grupie kontrolnej. W badaniach klinicznych z udziałem zdrowych ochotników okresowo występowały małego stopnia zaburzenia odczuwania gorąca (1°C - 2°C) i uczucie kłucia w miejscu nałożenia plastra Qutenza. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania wymienionego w załączniku V .
- CHPL leku Qutenza, plaster leczniczy, 179 mgPrzedawkowanie
4.9 Przedawkowanie Nie zgłoszono żadnego przypadku przedawkowania. Plastry Qutenza powinny być nakładane przez lekarza lub pod nadzorem lekarza. Dlatego wystąpienie przedawkowania jest mało prawdopodobne. Przedawkowanie może objawiać się nasilonymi reakcjami w miejscu leczenia, jak np.: ból w miejscu nałożenia, rumień w miejscu nałożenia, świąd w miejscu nałożenia. W przypadku podejrzenia przedawkowania należy delikatnie usunąć plaster, nałożyć żel oczyszczający na 1 minutę i następnie usunąć go suchą gazą, a miejsce leczenia delikatnie umyć mydłem i wodą. W razie konieczności należy zastosować leczenie objawowe, zgodnie ze wskazaniami klinicznymi. Brak antidotum dla kapsaicyny.
- CHPL leku Qutenza, plaster leczniczy, 179 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki znieczulające; inne leki znieczulające działające miejscowo. Kod ATC: N01BX04 Mechanizm działania Kapsaicyna, czyli, 8-metylo-N-[(4-hydroksy-3-metoksyfenylo)metylo]-6-nonenamid , (6E), jest wysoko wybiórczym agonistą receptora waniloidowego z grupy receptorów przejściowego potencjału (ang. transient potential vanilloid 1 receptor - TRPV1). Początkowy wpływ kapsaicyny polega na aktywacji nocyceptorów TPRV1 w skórze, co wywołuje podrażnienie i rumień w wyniku uwolnienia neuropeptydów wazoaktywnych. Działanie farmakodynamiczne Po ekspozycji na kapsaicynę nocyceptory skóry stają się mniej czułe na różne bodźce. Późne działania kapsaicyny są często określane jako „znieczulenie” i uważa się, że to one odpowiadają za ustąpienie bólu.
- CHPL leku Qutenza, plaster leczniczy, 179 mgWłaściwości farmakodynamiczne
Odczucia z nerwów skórnych bez ekspresji TPRV1 pozostają niezmienione, włącznie ze zdolnością odczuwania bodźców mechanicznych i wibracyjnych.Indukowane kapsaicyną zmiany w nocyceptorach skóry są odwracalne, co wykazano w badaniach z udziałem zdrowych ochotników, u których obserwowano powrót normalnej funkcji (odczuwanie nieprzyjemnych odczuć) na przestrzeni tygodni. Skuteczność kliniczna i bezpieczeństwo stosowania W kontrolowanych badaniach klinicznych trwających 12 tygodni wykazano skuteczność plastra Qutenza po jednorazowym nałożeniu na 30 minut na stopy u pacjentów z bolesną neuropatią w przebiegu zakażenia HIV (HIV-AN) oraz z bolesną obwodową neuropatią cukrzycową (ang. painful diabetic peripheral neuropathy , pDPN). Przeciętne zmniejszenie bólu po pojedynczym zastosowaniu plastra Qutenza w porównaniu ze stanem początkowym w tygodniu od 2 do 12 w głównych badaniach klinicznych wynosiła od -22,8% do -32,3%, w porównaniu z zakresem od -10,7% do -25,0% w przypadku plastrów kontrolnych.
- CHPL leku Qutenza, plaster leczniczy, 179 mgWłaściwości farmakodynamiczne
Wskaźniki odpowiedzi (odpowiedź definiowana jako 30% spadek przeciętnego wyniku punktowego skali bólu w stosunku do stanu początkowego) wynosiły od 34% do 47%, w porównaniu z zakresem od 18% do 36% w przypadku plastrów kontrolnych. Te wyniki były statystycznie istotne w porównaniu z niską dawką kapsaicyny (PHN i HIV-AN) lub placebo (pDPN). Zmniejszenie bólu, które obserwowano w 1. tygodniu u pacjentów z PHN, w 2. tygodniu u pacjentów z HIV-AN oraz w 3. tygodniu u pacjentów z pDPN, utrzymywało się przez okres 12 tygodni badania we wszystkich trzech grupach. Spójną i powtarzalną skuteczność oraz tolerancję wykazano dla powtarzających się terapii w okresie 52 tygodni w dwóch badaniach klinicznych (STRIDE i PACE). W tych dwóch badaniach, jednym z udziałem pacjentów z pDPN (PACE) i jednym z udziałem pacjentów z HIV-AN, pourazowym uszkodzeniem nerwu (ang.
- CHPL leku Qutenza, plaster leczniczy, 179 mgWłaściwości farmakodynamiczne
Post traumatic nerve injury , PNI) i PHN (STRIDE), średni czas (odchylenie standardowe) do ponownego leczenia wynosił odpowiednio 68,4 (23,31) i 107 (43,58) dni. W tych badaniach u 25% pacjentów czas ponownego leczenia był odpowiednio krótszy niż 61,5 dni i krótszy niż 78,8 dni, a u 25% pacjentów czas ponownego leczenia był odpowiednio dłuższy niż 64,6 i 118,7 dni. Wzrost częstości znanych reakcji w miejscu podania, takich jak ból i uczucie pieczenia, do około 5%, znanych reakcji w miejscu zastosowania, takich jak ból lub uczucie pieczenia, był zgłaszany u pacjentów ponownie leczonych plastrem Qutenza wcześniej niż po 90 dniach. Profil bezpieczeństwa produktu leczncziego Qutenza u pacjentów z cukrzycą był zgodny z profilem obserwowanym u pacjentów bez cukrzycy.
- CHPL leku Qutenza, plaster leczniczy, 179 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Kapsaicyna zawarta w plastrach Qutenza ma być dostarczona do skóry. Wyniki badań in vitro (badania rozpadu substancji czynnej i przenikania przez skórę) wskazują na liniowy przebieg uwalniania kapsaicyny z plastrów Qutenza w czasie podawania. Na podstawie badań in vitro ocenia się, że podczas jednogodzinnej aplikacji do warstw naskórka i skóry wchłania się w przybliżeniu 1% kapsaicyny. Biorąc pod uwagę, że ilość kapsaicyny uwolnionej z plastra jest proporcjonalna do powierzchni aplikacji, szacunkowa całkowita maksymalna możliwa dawka na powierzchni 1000 cm 2 wyniesie w przybliżeniu 7 mg. Przy założeniu, że z plastra o powierzchni 1000 cm 2 około 1% kapsaicyny zostanie dostarczony osobie o masie ciała 60 kg, maksymalna możliwa dawka kapsaicyny wyniesie 0,12 mg/kg, raz na 3 miesiące.
- CHPL leku Qutenza, plaster leczniczy, 179 mgWłaściwości farmakokinetyczne
Zgodnie z Komitetem Naukowym KE ds.Żywności, średnie europejskie doustne spożycie kapsaicyny wynosi 1,5 mg/dobę (0,025 mg/kg/dobę dla osoby o masie ciała 60 kg), a największa podaż kapsaicyny w pożywieniu wynosi 25 do 200 mg/dobę (do 3,3 mg/kg/dobę dla osoby ważącej 60 kg). W badaniach farmakokinetycznych u ludzi po 60-minutowej aplikacji plastra Qutenza wykazano przemijające, małe (< 5 ng/ml) ogólnoustrojowe stężenie kapsaicyny u około jednej trzeciej pacjentów z PHN, u 3% pacjentów z bolesną obwodową neuropatią cukrzycową, a nie stwierdzono obecności kapsaicyny u pacjentów z HIV-AN. Brak danych po leczeniu trwającym 30 minut. Ogólnie zwiększeniu powierzchni leczenia i wydłużeniu czasu leczenia towarzyszyło proporcjonalne zwiększenie odsetka pacjentów z PHN, u których stwierdzano obecnośc kapsaicyny w krążeniu ogólnym. Największe wykryte stężenia kapsaicyny u pacjentów leczonych przez 60 minut wyniosło 4,6 ng/ml i wystąpiło bezpośrednio po usunięciu plastra Qutenza.
- CHPL leku Qutenza, plaster leczniczy, 179 mgWłaściwości farmakokinetyczne
Najbardziej mierzalne stężenia obserwowano w czasie usuwania plastra z wyraźną tendencją do zanikania w czasie 3-6 godzin po usunięciu plastra Qutenza. U żadnego pacjenta nie wykryto metabolitów kapsaicyny. Analiza danych farmakokinetycznych w populacji pacjentów leczonych przez okres od 60 do 90 minut wskazuje, że maksymalne stężenia kapsaicyny w surowicy występują po około 20 minutach po usunięciu plastra i zmniejszają się bardzo szybko, ze średnim okresem półtrwania wynoszącym około 130 minut.
- CHPL leku Qutenza, plaster leczniczy, 179 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu jednorazowym, badań toksyczności po podaniu wielokrotnym, nie ujawniają szczególnego zagrożenia dla człowieka. W badaniach genotoksyczności przeprowadzonych z kapsaicyną wykryto słabą odpowiedź mutagenną w komórkach chłoniaka myszy i brak odpowiedzi w testach Ames’a, teście mikrojąderkowym u myszy oraz aberracje chromosomalne w ludzkich limfocytach krwi obwodowej. W badaniu potencjalnego wpływu rakotwórczego przeprowadzonym na myszach, wykazano, że kapsaicyna nie jest rakotwórcza. W badaniach toksycznego wpływu na reprodukcję przeprowadzonych na szczurach wykazano statystycznie istotne zmniejszenie liczby i odsetka ruchomych plemników u szczurów leczonych przez 3 godziny dziennie począwszy od 28. dnia przed umieszczeniem zwierząt we wspólnym stadzie, przez okres wspólnego pożycia do dnia przed uśmierceniem.
- CHPL leku Qutenza, plaster leczniczy, 179 mgPrzedkliniczne dane o bezpieczeństwie
Chociaż nie było to ani statystycznie istotnie, ani zależne od dawki, we wszystkich grupach leczonych kapsaicyną doszło do obniżenia wskaźnika płodności i liczby ciąż na liczbę szczurów we współżyjącym stadzie. W badaniach teratologicznych przeprowadzonych na królikach nie wykryto żadnych potencjalnych działań toksycznych na płód. W badaniach teratologicznych przeprowadzonych na szczurach obserwowano opóźnienie kostnienia szkieletowego (zmniejszone kostnienie kości śródstopia) podczas stosowania dawek większych niż stężenia terapeutyczne u ludzi; znaczenie tego odkrycia dla ludzi jest nieznane. W badaniach toksykologicznych w okresie około- i postnatalnym przeprowadzonych na szczurach nie wykazano toksycznego wpływu na reprodukcję. U szczurów w okresie laktacji narażonych na działanie produktu leczniczego Qutenza przez 3 godziny dziennie wykazano mierzalne stężenia kapsaicyny w mleku matek. W badaniu uczuleń skórnych u świnek morskich obserwowano łagodne uczulenie.
- CHPL leku Qutenza, plaster leczniczy, 179 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Plaster Matryca silikonowa warstwa przylegająca eter monoetylowy glikolu dietylenowego olej silikonowy etyloceluloza N50 (E462) Warstwa podkładowa folia z politereftalanu etylenu (PET), wewnętrzna strona silikonowana farba drukarska zawierająca biały pigment 6 Usuwalna warstwa ochronna (warstwa uwalniająca) folia poliestrowa z powłoką fluoropolimerową Żel oczyszczający makrogol 300 karbomer woda oczyszczona sodu wodorotlenek (E524) disodu edetynian butylohydroksyanizol (E320) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 4 lata Po otwarciu saszetki: plaster Qutenza należy nałożyć w ciągu 2 godzin. 6.4 Specjalne środki ostrożności podczas przechowywania Plaster leczniczy Qutenza: przechowywać w pozycji leżącej w oryginalnej saszetce i pudełku tekturowym. Przechowywać w temperaturze poniżej 25°C. Żel oczyszczający: przechowywać w temperaturze poniżej 25°C.
- CHPL leku Qutenza, plaster leczniczy, 179 mgDane farmaceutyczne
6.5 Rodzaj i zawartość opakowania Plaster leczniczy jest umieszczony w saszetce z papieru, politereftalanu etylenu i folii aluminiowej z warstwą ekstraktu kopolimeru i cykloolefiny. Żel oczyszczający jest dostarczany w tubie z polietylenu wysokiej gęstości z nakrętką polipropylenową. Produkt Qutenza jest dostępny w opakowaniach zawierających jedną lub dwie saszetki osobno zapakowanych plastrów leczniczych i tubę żelu oczyszczającego 50 g. Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania W czasie przygotowywania plastrów i mycia miejsc leczonych personel medyczny powinien zakładać rękawiczki nitrylowe. Zaleca się zastosowanie maski i okularów ochronnych, patrz punkt 4.2. Zużyte i niezużyte plastry oraz wszystkie materiały, które miały kontakt z miejscem leczenia, należy niezwłocznie po użyciu włożyć do szczelnej, poliestrowej torby na odpady medyczne i umieścić w odpowiednim pojemniku na odpady medyczne.
- CHPL leku Afronis, płyn do stosowania na skórę, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNI CZEGO AFRONIS, płyn do stosowania na skórę. 2. SKŁAD JAKOŚCIOWY I IL OŚCIOWY 100 g płynu do stosowania na skórę zawiera: kwas borowy (Acidum boricum) 3 g rezorcynol (Resorcinolum) 2 g lewomentol (Levomentholum) 0,2 g tymol (Thymolum) 0,05 g Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Płyn na skórę. Przezroczysty bezbarwny płyn przechodzący do barwy różowej.
- CHPL leku Afronis, płyn do stosowania na skórę, -Wskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy o działaniu przeciwbakteryjnym, słabo znieczulającym i przeciwświądowym. Afronis jest wskazany do stosowania pomocniczo w trądziku pospolitym.
- CHPL leku Afronis, płyn do stosowania na skórę, -Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i młodzież powyżej 12 lat: Stosować 1-2 razy na dobę w zależności od nasilenia objawów chorobowych. Dzieci: Ze względu na brak dostępnych danych, nie zaleca się stosowania u dzieci w wieku poniżej 12 lat. Sposób podawania Płyn na skórę. Produkt przeznaczony wyłącznie do stosowania zewnętrznego. Po dokładnym umyciu i wysuszeniu skóry twarzy ręcznikiem, odczekać kilkanaście minut dla uniknięcia efektu drażniącego. Następnie zwilżyć tamponik płynem i przemywać wyłącznie miejsca chorobowo zmienione.
- CHPL leku Afronis, płyn do stosowania na skórę, -Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na lewomentol, rezorcynol, kwas borowy, tymol lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować na otwarte rany, błony śluzowe i skórę uszkodzoną, doustnie, u pacjentek w ciąży, u pacjentek karmiących piersią. Ze względu na brak dostępnych danych, nie zaleca się stosowania u dzieci poniżej 12 lat.
- CHPL leku Afronis, płyn do stosowania na skórę, -Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku nadwrażliwości na którykolwiek ze składników, produkt może wywołać zmiany alergiczne skórne. W przypadku wystąpienia nadwrażliwości na którykolwiek ze składników produktu (utrzymujące się zaczerwienienie skóry) należy przerwać stosowanie produktu i skonsultować się z lekarzem. W przypadku wystąpienia objawów nadmiernego wysuszenia i złuszczenia skóry należy zmniejszyć częstość stosowania produktu. Produktu nie wolno stosować doustnie, na otwarte rany i błony śluzowe.
- CHPL leku Afronis, płyn do stosowania na skórę, -Interakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Nie stosować z innymi preparatami zawierającymi składniki złuszczające, np. kwas salicylowy, siarkę, ponieważ może wystąpić podrażnienie skóry.
- CHPL leku Afronis, płyn do stosowania na skórę, -Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie stosować. Karmienie piersi? Nie stosować.
- CHPL leku Afronis, płyn do stosowania na skórę, -Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Afronis nie ma wpływu na zdolności prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Afronis, płyn do stosowania na skórę, -Działania niepożądane
4.8 Działania niepożądane Działania niepożądane leku przedstawiono zgodnie z klasyfikacją narządów i układów wg MedDRA oraz częstością występowania: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000); nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia skóry i tkanki podskórnej: Częstość nieznana: Podrażnienie skóry Zaburzenia układu immunologicznego: Częstość nieznana: Reakcje alergiczne
- CHPL leku Afronis, płyn do stosowania na skórę, -Przedawkowanie
4.9 Przedawkowanie Nie zgłoszono przypadku przedawkowania.
- CHPL leku Afronis, płyn do stosowania na skórę, -Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna, kod ATC: nie przydzielony. Działanie farmakodynamiczne: Zawarty w produkcie lewomentol działa bakteriobójczo, słabo znieczulająco i przeciwświądowo. Tymol i rezorcynol zwiększają działanie przeciwbakteryjne produktu, a kwas borowy działa bakteriostatycznie i nasila antyseptyczne działanie leku.
- CHPL leku Afronis, płyn do stosowania na skórę, -Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Składniki produktu, z wyjątkiem rezorcyolu, nie wchłaniają się przez nieuszkodzoną skórę. Produkt stosowany zewnętrznie zgodnie z zaleceniami nie powoduje działań niepożądanych ze względu na słabe wchłanianie produktu z nieuszkodzonej skóry. Kwas borowy bardzo łatwo wchłania się z przewodu pokarmowego i przez uszkodzoną skórę. Tymol podany doustnie wchłania się z jelit. Metabolizm Kwas borowy ulega kumulacji. Tymol pobudza ruchy robaczkowe. Eliminacja Kwas borowy wydala się powoli. Tymol wydala się przez nerki.
- CHPL leku Afronis, płyn do stosowania na skórę, -Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach wykazano, że lewomentol działa hepatoksycznie. Podawany szczurom dożołądkowo przez 28 dni powodował uszkodzenie wątroby. Rezorcynol wywołuje objawy zatrucia podobne do zatrucia fenolem, z jednoczesnym wytworzeniem methemoglobiny. Podany doustnie hamuje czynność tarczycy, w dawce 1-2 g wywołuje objawy zatrucia. Kwas borowy nawet w niewielkich ilościach wywołuje ostre zatrucie. Występują wymioty, nudności może dojść do uszkodzenia nerek. Tymol może działać drażniąco na nerki i powodować białkomocz. W ostrych zatruciach występują objawy ze strony przewodu pokarmowego.
- CHPL leku Afronis, płyn do stosowania na skórę, -Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych etanol 96 % woda oczyszczona. 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25 °C. Chronić od światła. 6.5 Rodzaj i zawartość opakowania Butelka ze szkła brunatnego z zakrętką z polietylenu z kroplomierzem w tekturowym pudełku. Dostępne są opakowania po 100 g. 6.6 Specjalne środki ostrożności dotyczące usuwania produktu leczniczego Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Amol, produkt złożony, płyn doustny, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g produktu zawiera: Mentholum (mentol) 17,23 mg Citronellae aetheroleum (olejek cytronelowy) 1,00 mg Caryophylli floris aetheroleum (olejek goździkowy) 1,00 mg Cinnamomi zeylanici corticis aetheroleum (olejek cynamonowy) 2,40 mg Limonis aetheroleum (olejek cytrynowy) 5,70 mg Menthae piperitae aetheroleum (olejek mięty pieprzowej) 2,40 mg Lavandulae aetheroleum (olejek lawendowy) 2,40 mg Substancja pomocnicza o znanym działaniu: etanol (96% v/v) 638 mg w 1 g. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Płyn doustny, płyn na skórę.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Wskazania do stosowania
4.1 Wskazania do stosowania Produkt przeznaczony jest do tradycyjnego stosowania w wymienionych wskazaniach i jego skuteczność opiera się wyłącznie na długim okresie stosowania i doświadczeniu. Amol stosowany jest tradycyjnie w następujących wskazaniach: zewnętrznie: w celu poprawy złego samopoczucia np. w przebiegu przeziębienia, w bólach głowy, bólach mięśniowych; w celu zmniejszenia dolegliwości po ukąszeniach owadów; wewnętrznie: w dolegliwościach trawiennych (dyspeptycznych) np. wzdęcia i niestrawność.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Dawkowanie
4.2 Dawkowanie i sposób podawania Produktu nie należy stosować pod opatrunkiem okluzyjnym lub w postaci okładów. Dawkowanie i sposób stosowania Dorośli i młodzież powyżej 12 lat: Zewnętrznie do nacierań w celu poprawy złego samopoczucia (np. w przebiegu przeziębienia, w bólach głowy, bólach mięśniowych) Nacierać niewielką ilością produktu w formie nierozcieńczonej kilka razy na dobę. Zewnętrznie w celu zmniejszenia dolegliwości po ukąszeniach owadów Miejsce po ukąszeniu przetrzeć wacikiem nasączonym produktem w formie nierozcieńczonej. Doustnie w dolegliwościach trawiennych (dyspeptycznych) Od 10 do 15 kropli produktu z płynem lub z cukrem, należy przyjmować doraźnie w przypadku wystąpienia dolegliwości, do 3 razy na dobę.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Astma oskrzelowa i inne schorzenia dróg oddechowych, którym towarzyszy silna nadwrażliwość dróg oddechowych. Dzieci poniżej 12 lat, ze względu na brak wystarczających danych na temat stosowania produktu Amol w tej grupie wiekowej. Wewnętrznie: niedrożność dróg żółciowych (np. w przebiegu kamicy żółciowej), zapalenie pęcherzyka żółciowego; przewlekłe choroby wątroby; uzależnienie od alkoholu. Zewnętrznie: uszkodzona skóra np. przy oparzeniach, wypryskach i ranach otwartych; choroby skóry przebiegające z wysypką; stosowanie na błony śluzowe oraz w okolicach oczu.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt Amol zawiera 67% v/v etanolu. Przy zastosowaniu zalecanego dawkowania po każdym przyjęciu doustnym leku w ilości 10-15 kropli do organizmu zostanie wprowadzone do 0,46 g etanolu, co jest równoważne 8-11 ml piwa (5% v/v) i 3–5 ml wina (12% v/v). Może to mieć znaczenie w przypadku kobiet w ciąży lub karmiących piersią, dzieci, osób z grupy wysokiego ryzyka, takich jak pacjenci z chorobą wątroby lub z padaczką. Szkodliwe dla osób z chorobą alkoholową. Należy chronić oczy przed kontaktem z produktem. W przypadku dostania się produktu Amol do oczu należy obficie przemyć je wodą. W przypadku nie ustąpienia objawów zastosować leczenie miejscowe. W przypadku wystąpienia trudności w oddychaniu (np. skurcz oskrzeli) lub zmian skórnych należy zastosować leczenie objawowe. Po natarciu roztworem produktu Amol należy starannie umyć ręce. Produktu nie należy stosować pod opatrunkiem okluzyjnym lub w postaci okładów.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Alkohol zawarty w produkcie może wzmacniać lub osłabiać działanie innych leków. Jednoczesne podawanie z lekami zawierającymi, np. glikol propylenowy lub etanol może prowadzić do kumulacji etanolu i wywoływać działania niepożądane.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Brak danych klinicznych dotyczących stosowania produktu w okresie ciąży i karmienia piersią. Ze względu na brak danych dotyczących bezpieczeństwa nie zaleca się stosowania produktu Amol w okresie ciąży i karmienia piersią.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Ze względu na zawartość etanolu, Amol może wywierać wpływ na ośrodkowy układ nerwowy. Dlatego też nie zaleca się prowadzenia pojazdów i obsługi maszyn po zastosowaniu doustnym produktu.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Działania niepożądane
4.8 Działania niepożądane Częstość możliwych działań niepożądanych wymienionych poniżej określono następująco: bardzo rzadko (<1/10 000) Zaburzenia żołądka i jelit: podrażnienie żołądka Zaburzenia skóry i tkanki podskórnej: podrażnienia skóry i błon śluzowych, wyprysk kontaktowy, reakcje nadwrażliwości Zaburzenia układu oddechowego, klatki piersiowej i śródpiersi: kaszel (suchy), skurcz oskrzeli Częstość nieznana Zaburzenia ogólne i stany w miejscu podania: oparzenia w miejscu stosowania. W takich przypadkach należy przerwać stosowanie produktu i zastosować odpowiednie leczenie. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Działania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Przedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania należy wziąć pod uwagę ilość etanolu zawartego w produkcie i zastosować leczenie objawowe. Objawy przedawkowania są typowe dla przedawkowania alkoholu.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Produkt leczniczy o działaniu rozkurczającym stosowany tradycyjnie w łagodnych dolegliwościach trawiennych lub zewnętrznie do nacierań skóry jako środek rozgrzewający i powodujący przekrwienie skóry. Ze względu na to, że Amol jest produktem złożonym nie określono dokładnie jego mechanizmu działania. Działanie leku wynika z działania poszczególnych substancji czynnych.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Brak danych.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak danych.
- CHPL leku Amol, płyn doustny, płyn na skórę, -Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych 96% etanol (638 mg/1 g produktu) Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Butelka z bezbarwnego szkła z kroplomierzem i zakrętką z polietylenu lub polipropylenu w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ARGOL®ESSENZA BALSAMICA 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Skład płynu w przeliczeniu na 100 g: Mentol (Mentholum) 1,500 g Olejek melisy lekarskiej (Melissae officinalis aetheroleum) 0,340 g Olejek cynamonowca chińskiego (Cinnamomi cassiae aetheroleum) 0,465 g Olejek goździkowy (Caryophylli floris aetheroleum) 0,290 g Olejek cytrynowy (Limonis aetheroleum) 0,290 g Olejek osnówki muszkatołowca (Myristicae fragrantis aetheroleum) 0,260 g Olejek tymianku pospolitego (Thymi aetheroleum) 0,240 g Olejek kolendry siewnej (Coriandri aetheroleum) 0,240 g Olejek miętowy (Menthae piperitae aetheroleum) 0,375 g Płyn zawiera 57 – 63% etanolu. Substancje pomocnicze patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA 3.1. Dla produktu w butelce ze szkła brunatnego o zawartości 50 ml, 75 ml, 100 ml, 200 ml, z zakrętką, z kroplomierzem: Płyn doustny, płyn do stosowania w jamie ustnej, płyn do sporządzania inhalacji parowej i do stosowania na skórę.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
3.2. Dla produktu w butelce ze szkła bezbarwnego o zawartości 8 ml i 18 ml, z pompką rozpylającą: Płyn doustny. Płyn do stosowania w jamie ustnej. Płyn na skórę.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Wskazania do stosowania
4.1. Wskazania do stosowania 4.1.1. Dla produktu w butelce ze szkła brunatnego o zawartości 50 ml, 75 ml, 100 ml, 200 ml z zakrętką z kroplomierzem: Doustnie: pomocniczo w łagodzeniu objawów towarzyszących przeziębieniu i grypie Doustnie: w zaburzeniach trawienia i niestrawności Do sporządzania inhalacji parowej: w nieżytach górnych dróg oddechowych z towarzyszącym katarem Do płukania jamy ustnej i gardła: w stanach zapalnych gardła i jamy ustnej, bólach gardła, chrypce Do płukania jamy ustnej i gardła: pomocniczo w aftach i stanach zapalnych dziąseł Miejscowo na błony śluzowe jamy ustnej: w pojedynczych, łagodnych zmianach zapalnych i owrzodzeniach błony śluzowej jamy ustnej np. afty Miejscowo na skórę: w świądzie i podrażnieniu skóry po ukąszeniach przez owady lub dotknięciu pokrzyw Miejscowo do nacierania: w bólach głowy o charakterze migrenowym do nacierania skroni i czoła Miejscowo do nacierania: w przeziębieniach i objawach grypy z towarzyszącym nieżytem górnych dróg oddechowych do nacierania szyi, karku, klatki piersiowej i pleców Miejscowo do masażu: w bólach stawowo-mięśniowych i dolegliwościach reumatycznych oraz w celu ukrwienia skóry 4.1.2.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Wskazania do stosowania
Dla produktu w butelce ze szkła bezbarwnego o zawartości 8 ml i 18 ml, z pompką rozpylającą: Miejscowo na błony śluzowe jamy ustnej i gardła: w bólach gardła, doraźnie w podrażnieniu strun głosowych i chrypce Miejscowo na błony śluzowe jamy ustnej i gardła: w pojedynczych łagodnych zmianach zapalnych i owrzodzeniach błony śluzowej jamy ustnej np. afty Miejscowo na skórę: w świądzie i podrażnieniu skóry po ukąszeniach przez owady lub dotknięciu pokrzyw
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Dawkowanie
4.2. Dawkowanie i sposoby stosowania 4.2.1. Dawkowanie i sposoby stosowania produktu w butelkach ze szkła brunatnego o zawartościach 50 ml, 75 ml, 100 ml, 200 ml z zakrętką z kroplomierzem: Lek jest przeznaczony dla osób dorosłych i dzieci powyżej 12 roku życia. Doustnie: pomocniczo w łagodzeniu objawów towarzyszących przeziębieniu i grypie: 10-15 kropli preparatu na cukrze lub na miodzie, do 3 razy dziennie Doustnie: w zaburzeniach trawienia i niestrawności: 10-15 kropli preparatu w ½ szklanki wody, do 3 razy dziennie Do sporządzania inhalacji parowej: w nieżytach górnych dróg oddechowych z towarzyszącym katarem: ½ - 1 łyżeczki preparatu (2,5 – 5 ml) na filiżankę (150 – 200 ml) gorącej wody, wykonywać inhalację wdychając opary do ochłodzenia roztworu. Do 3 razy dziennie. Do płukania jamy ustnej i gardła: w stanach zapalnych gardła i jamy ustnej, w bólach gardła, chrypce, pomocniczo w aftach i stanach zapalnych dziąseł: ½ łyżeczki preparatu (ok.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Dawkowanie
2,5 ml) w ½ szklanki letniej wody, płukać do 3 razy dziennie Do płukania jamy ustnej i gardła: zapobiegawczo: 5 – 7 kropli preparatu w 1/3 szklanki letniej wody, do 2 razy dziennie Miejscowo na błony śluzowe jamy ustnej: w pojedynczych, łagodnych zmianach zapalnych i owrzodzeniach błony śluzowej jamy ustnej np. afty: nanosić kilka kropli preparatu przy pomocy patyczków higienicznych. Miejscowo na skórę: w świądzie i podrażnieniu skóry po ukąszeniach przez owady lub dotknięciu pokrzyw – nanosić na wacie kilka kropli preparatu. Miejscowo do nacierania: w bólach głowy o charakterze migrenowym do nacierania skroni i czoła: wcierać kilka kropli preparatu w skronie i czoło Miejscowo do nacierania: w przeziębieniach i objawach grypy z towarzyszącym nieżytem górnych dróg oddechowych do nacierania szyi, karku, klatki piersiowej i pleców: wcierać 10 - 15 kropli preparatu w szyję, kark, klatkę piersiową i plecy.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Dawkowanie
Miejscowo do masażu: w bólach stawowo-mięśniowych i dolegliwościach reumatycznych oraz w celu ukrwienia skóry: wmasować w skórę od kilku kropli do ½ łyżki stołowej preparatu w zależności od masowanej powierzchni aż do uzyskania rozgrzania. Okryć ciepło. 4.2.2. Dawkowanie i sposoby stosowania produktu w butelkach ze szkła bezbarwnego o zawartościach 8 ml i 18 ml, z pompką rozpylającą: Lek jest przeznaczony dla osób dorosłych i dzieci powyżej 12 roku życia. Miejscowo na błony śluzowe jamy ustnej i gardła: w bólach gardła, doraźnie w podrażnieniu strun głosowych i chrypce, w pojedynczych łagodnych zmianach zapalnych i owrzodzeniach błony śluzowej jamy ustnej np. afty: spryskać gardło i jamę ustną naciskając silnie główkę pompki rozpylającej, do 3 razy dziennie. Miejscowo na skórę: w świądzie i podrażnieniu skóry po ukąszeniach przez owady lub dotknięciu pokrzyw: spryskać skórę naciskając silnie główkę pompki rozpylającej, wmasować w skórę.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Przeciwwskazania
4.3. Przeciwwskazania 4.3.1. Dla produktu w butelce ze szkła brunatnego o zawartości 50 ml, 75 ml, 100 ml, 200 ml, z zakrętką z kroplomierzem: Preparat nie powinien być stosowany w osobniczej nadwrażliwości na którykolwiek składnik produktu. Nie stosować na oparzenia, otwarte rany i ostre stany zapalne skóry. 4.3.2. Dla produktu w butelce ze szkła bezbarwnego o zawartości 8 ml i 18 ml, z pompką rozpylającą: Preparat nie powinien być stosowany w osobniczej nadwrażliwości na którykolwiek składnik produktu. Nie stosować na oparzenia, otwarte rany i ostre stany zapalne skóry. Nie stosować na błony śluzowe u pacjentów ze zdiagnozowanymi stanami zanikowymi błony śluzowej jamy ustnej.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Specjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania 4.4.1. Dla produktu w butelce ze szkła brunatnego o zawartości 50 ml, 75 ml, 100 ml, 200 ml, z zakrętką z kroplomierzem: Nie stosować leku na śluzówkę nosa. Nie stosować leku w okolicy oka. W przypadku dostania się preparatu do oka należy przemyć oko wodą. Ze względu na brak danych i zawartość etanolu nie zaleca się stosowania leku u dzieci poniżej 12 roku życia. Lek zawiera 60% etanolu (alkoholu). W zalecanej doustnej dawce leku w ilości 10-15 kropli znajduje się średnio 0,37 g alkoholu etylowego, co jest równoważne 5,8 ml - 8,7 ml piwa (5% v/v) lub 2,4 ml – 3,6 ml wina (12% v/v) na dawkę. Ze względu na zawartość etanolu nie zaleca się doustnego stosowania u osób z chorobami wątroby (kamica żółciowa, zapalenie pęcherzyka żółciowego, ciężkie uszkodzenia wątroby), z wrzodami żołądka i dwunastnicy, u osób z padaczką oraz u osób uzależnionych od alkoholu. 4.4.2.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Specjalne środki ostrozności
Dla produktu w butelce ze szkła bezbarwnego o zawartości 8 ml i 18 ml, z pompką rozpylającą: Nie stosować leku na śluzówkę nosa. Nie stosować leku w okolicy oka. W przypadku dostania się preparatu do oka należy przemyć oko wodą. Ze względu na brak danych i zawartość etanolu nie zaleca się stosowania leku u dzieci poniżej 12 roku życia. Lek zawiera małe ilości etanolu (alkoholu), mniej niż 100 mg na dawkę.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Interakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Brak danych o interakcjach z innymi lekami i innych rodzajach interakcji.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Wpływ na płodność, ciążę i laktację
4.6. Ciąża lub laktacja Ze względu na brak danych klinicznych nie zaleca się doustnego stosowania leku w okresie ciąży i karmienia piersią. Brak danych dotyczących stosowania zewnętrznego u kobiet w ciąży i karmiących piersią.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Wpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem produktu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu. Ze względu na zawartość alkoholu etylowego po stosowaniu doustnym leku nie zaleca się prowadzenia pojazdów i obsługi maszyn.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Działania niepożądane
4.8. Działania niepożądane Jak każdy lek, płyn ARGOL®ESSENZA BALSAMICA może powodować działania niepożądane, np. spowodowane nadwrażliwością na mentol lub olejki eteryczne. W takim przypadku należy przerwać stosowanie leku.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Przedawkowanie
4.9. Przedawkowanie Nie zgłoszono żadnego przypadku przedawkowania leku. Przedawkowanie leku przy zastosowaniu doustnym może wpłynąć na zdolność kierowania pojazdami, ze względu na przedawkowanie alkoholu etylowego.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Właściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Stosowanie produktu opiera się na długim okresie stosowania i doświadczeniu. W badaniach aktywności przeciwdrobnoustrojowej, przeprowadzonych w warunkach in vitro stwierdzono działania bakteriobójcze i grzybobójcze leku wobec najczęstszych patogenów górnych dróg oddechowych, gardła, jamy ustnej i przewodu pokarmowego. W badaniach wykazano także działanie przeciwbólowe i przeciwzapalne produktu leczniczego ARGOL®ESSENZA BALSAMICA. Opinie naukowe oraz obserwacje kliniczne wskazują, że stosowanie produktu leczniczego było korzystne w wymienionych w punkcie 4.1 wskazaniach.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Właściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Brak badań farmakokinetycznych dla produktu. Uważa się, że olejki eteryczne ze względu na charakter lipofilny wchłaniają się w znacznym stopniu przez śluzówkę jamy ustnej i skórę. Mentol, podobnie jak inne terpeny zawarte w olejkach eterycznych, przenika do krwioobiegu i podobnie jak olejki jest wydalany z moczem w postaci pochodnych kwasu glukuronowego.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Przedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie W badaniach przedklinicznych nie zaobserwowano działania drażniącego po wielokrotnym miejscowym podaniu leku. Lek stosowany był przez wiele dziesięcioleci. Dane literaturowe dla pojedynczych składników, dziesiątki lat stosowania leku (w Polsce od 1913 r.) oraz brak informacji o wystąpieniu działań niepożądanych nie wskazują na szczególne ryzyko stosowania.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Etanol 96 % v/v, woda oczyszczona, sól sodowa sacharyny (korektor smaku) 6.2. Niezgodności farmaceutyczne Nie dotyczy. 6.3. Okres ważności 3 lata 6.4. Specjalne środki ostrożności przy przechowywaniu Lek należy przechowywać w miejscu niedostępnym i niewidocznym dla dzieci. Nie należy stosować leku po upływie terminu ważności, zamieszczonym na opakowaniu. Przechowywać w temperaturze nie wyższej niż 25ºC. 6.5. Rodzaj i zawartość opakowania 6.5.1. Opakowanie bezpośrednie produktu do stosowania w kroplach Butelka ze szkła brunatnego o zawartości 50 ml, 75 ml, 100 ml, 200 ml, z zakrętką z kroplomierzem z polietylenu, w pudełku tekturowym. 6.5.2. Opakowanie bezpośrednie produktu do stosowania w rozpyleniu Butelka ze szkła bezbarwnego o zawartości 8 ml i 18 ml, z pompką rozpylającą z polietylenu, w pudełku tekturowym. 6.6.
- CHPL leku Argol Essenza Balsamica, płyn doustny, do sporządzania inhalacji parowej i na skórę, -Dane farmaceutyczne
Instrukcja dotycząca przygotowania produktu leczniczego do stosowania i usuwania jego pozostałości. Brak szczególnych wymagań.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO AROMATOL, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g roztworu zawiera: Levomentholum 1,72 g (Lewomentol) Limonis aetheroleum 0,57 g (olejek cytrynowy) Cinnamomi zeylanici corticis aetheroleum 0,24 g (olejek z kory cynamonowca cejlońskiego) Menthae arvensis aetheroleum partim mentholi privum 0,24 g (olejek mięty polnej z obniżoną zawartością mentolu) Lavandulae aetheroleum 0,24 g (olejek lawendowy) Citronellae aetheroleum 0,1 g (olejek cytronelowy) Caryophylli floris aetheroleum 0,1 g (olejek goździkowy) Substancja pomocnicza o znanym działaniu: etanol. Produkt zawiera 63% – 72 % (V/V) etanolu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
POSTAĆ FARMACEUTYCZNA Koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej. Bezbarwny, klarowny płyn.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Wskazania do stosowania
4.1 Wskazania do stosowania Zewnętrznie: w celu poprawy złego samopoczucia np. przy przeziębieniu, (do nacierań, do inhalacji lub płukania gardła), w bólach głowy, bólach mięśniowych; po ukąszeniach przez owady. Wewnętrznie: w dolegliwościach trawiennych (zaburzeniach dyspeptycznych) np. wzdęciach, niestrawności.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie: Produkt przeznaczony dla osób dorosłych i młodzieży powyżej 12 lat. 1 g roztworu odpowiada objętości ok. 1,1 mililitra lub 27 kroplom produktu. Podanie doustne W dolegliwościach trawiennych (zaburzeniach dyspeptycznych): np. niestrawności, wzdęciach: 1 do 3 razy na dobę przyjmować 10 do 15 kropli produktu Aromatol zmieszanych z wodą. Podanie na skórę Do nacierań: 1 do 3 razy na dobę nacierać produktem, aż powierzchnia skóry stanie się sucha. W celu zmniejszenia dolegliwości po ukąszeniach owadów miejsce po ukąszeniu przetrzeć wacikiem nasączonym produktem Aromatol. Do płukania gardła Około 5 ml (1 łyżeczka) produktu Aromatol rozcieńczyć w około 250 ml (szklanka) ciepłej wody, płukać gardło i jamę ustną 1 do 3 razy na dobę. Stosowanie w postaci inhalacji (przy przeziębieniu) Około 5 ml (1 łyżeczka) produktu Aromatol rozcieńczyć w około 250 ml (szklanka) gorącej wody i wdychać przez kilka minut powstające opary.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Dawkowanie
Inhalacje powtarzać do 3 razy na dobę. Sposób podawania Podanie doustne, podanie na skórę, do płukania gardła, lub w postaci inhalacji z parą wodną.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Astma oskrzelowa i inne schorzenia układu oddechowego, którym towarzyszy silna nadwrażliwość dróg oddechowych. Stosowanie u dzieci poniżej 12 lat, ze względu na zawartość etanolu oraz niepełne dane dotyczące bezpieczeństwa i skuteczności. Stosowanie wewnętrzne: niedrożności dróg żółciowych (np. w przebiegu kamicy żółciowej), zapalenia pęcherzyka żółciowego, ciężkie uszkodzenia wątroby, uzależnienie od alkoholu. Stosowanie zewnętrzne: uszkodzenia skóry np. przy oparzeniach, wypryskach i otwartych ranach, choroby skóry przebiegających z wysypką, stosowanie na błonę śluzową oraz w okolicach oczu.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt zawiera etanol i jego częste stosowanie zewnętrzne może powodować podrażnienie i suchość skóry. Chronić oczy przed kontaktem z produktem. W przypadku dostania się roztworu Aromatol do oczu, należy przemyć je obficie wodą i zwrócić się do lekarza. W przypadku wystąpienia objawów nadwrażliwości: trudności w oddychaniu (np. skurcz oskrzeli) należy niezwłocznie wezwać lekarza, a w przypadku wystąpienia zmian skórnych należy zasięgnąć porady lekarza. Po nacieraniu produktem lub jego roztworem należy starannie umyć ręce. Produktu nie należy stosować pod opatrunkiem utrudniającym dostęp powietrza lub pod ciepłym okładem. Jeden mililitr produktu zawiera ok. 0,57 g etanolu, 10 kropli zawiera etanol w ilości odpowiadającej około 2,2 ml wina o zawartości 12% (V/V) alkoholu lub około 5,3 ml piwa o zawartości 5% (V/V) alkoholu, co należy wziąć pod uwagę podczas stosowania u dzieci i osób ze schorzeniami wątroby lub padaczką.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Specjalne środki ostrozności
Nie należy stosować produktu u osób z chorobą alkoholową.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Alkohol zawarty w produkcie może wpływać na działanie innych równocześnie stosowanych produktów leczniczych.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Ze względu na brak pełnej oceny bezpieczeństwa stosowania oraz zawartość etanolu, nie zaleca się stosowania u kobiet w ciąży. Karmienie piersi? Ze względu na brak pełnej oceny bezpieczeństwa stosowania oraz zawartość etanolu, nie zaleca się stosowania u kobiet karmiących piersią.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt zawiera etanol. Stosowanie produktu może ograniczać zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Działania niepożądane
4.8 Działania niepożądane Składniki olejków eterycznych mogą być alergenami lub wywoływać fotosensybilizację oraz powodować podrażnienia skóry i błon śluzowych. Dlatego niekiedy u osób wrażliwych kontakt z olejkami eterycznymi może spowodować skórne odczyny uczuleniowe, a czasami także zaburzenia układu oddechowego (np. kaszel, skurcz oskrzeli). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181 C, 02-222 Warszawa, tel.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Działania niepożądane
+48 22 49 21 301, fax: + 48 22 49 21 309, e-mail: ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Przedawkowanie
4.9 Przedawkowanie Nie zgłoszono przypadków przedawkowania produktu Aromatol.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Mieszanina etanolowa lewomentolu i olejków eterycznych: olejku cytrynowego z cytryny zwyczajnej (Citrus limon), olejku cynamonowego z kory cynamonowca cejlońskiego (Cinnamomum zeylanicum), olejku z mięty polnej (Mentha arvensis), olejku lawendowego z lawendy lekarskiej (Lavandula officinalis), olejku cytronelowego z palczatki cytronelowej (Cymbopogon nardus) i olejku goździkowego z goździkowca korzennego (Caryophylus aromaticus). Mentol wykazuje działanie żółciopędne i spazmolityczne. Skuteczność produktu opiera się wyłącznie na długim okresie stosowania w lecznictwie i doświadczeniu.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Brak danych.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Nie przeprowadzono nieklinicznych badań dotyczących bezpieczeństwa stosowania produktu Aromatol.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Etanol 96 % Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie są znane niezgodności farmaceutyczne z innymi lekami. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze nie wyższej niż 25 oC. W temperaturze poniżej 15 oC może wystąpić opalizacja roztworu. Proces ten jest odwracalny w temperaturze pokojowej i nie ma wpływu na jakość produktu końcowego. 6.5 Rodzaj i zawartość opakowania Butelka ze szkła bezbarwnego zawierająca 100 ml produktu, z kroplomierzem z polietylenu lub z polipropylenu, zamknięta zakrętką aluminiową z pierścieniem gwarancyjnym, umieszczona w tekturowym pudełku. Butelka ze szkła bezbarwnego zawierająca 150 ml lub 250 ml produktu, z kroplomierzem z polietylenu lub z polipropylenu, zamknięta zakrętką aluminiową z pierścieniem gwarancyjnym, umieszczona w tekturowym pudełku.
- CHPL leku Aromatol, koncentrat do sporządzania roztworu do płukania jamy ustnej i gardła, roztwór doustny, do stosowania na skórę i do sporządzania inhalacji parowej, -Dane farmaceutyczne
Butelka ze szkła bezbarwnego zawierająca 150 ml lub 250 ml produktu, zamknięta zakrętką z polietylenu z pierścieniem gwarancyjnym i kroplomierzem z polietylenu, umieszczona w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Bengay Maść Przeciwbólowa, (150 mg + 100 mg)/g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram maści zawiera 150 mg salicylanu metylu + 100 mg mentolu (Methylis salicylas + Mentholum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gWskazania do stosowania
4.1. Wskazania do stosowania Bengay Maść Przeciwbólowa przeznaczona jest dla dorosłych i dzieci powyżej 12 lat i wskazana w celu łagodzenia: bólów i sztywności mięśni oraz stawów spowodowanych przeciążeniem, urazem lub stanem zapalnym, bólów odcinka lędźwiowo-krzyżowego kręgosłupa.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gDawkowanie
4.2. Dawkowanie i sposób podawania Dawkowanie Dorośli i dzieci w wieku powyżej 12 lat stosować na chorobowo zmienione miejsce 3 do 4 razy na dobę. Stosowanie produktu leczniczego Bengay Maść Przeciwbólowa bez zalecenia lekarza nie powinno przekraczać 7 dni. Sposób podawania Maść do stosowania miejscowego, na skórę. Odpowiednią ilość maści nałożyć na chore miejsce i wcierać, delikatnie masując do całkowitego wchłonięcia. Stosować tylko na chorobowo zmienione miejsce.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować na uszkodzoną skórę i rany. Nie stosować u dzieci w wieku poniżej 12 lat.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stosować pod opatrunek okluzyjny lub pod okład rozgrzewający. Należy przerwać stosowanie, jeżeli wystąpi nadmierne podrażnienie skóry (patrz punkt 4.8). Należy unikać kontaktu z oczami i błonami śluzowymi. Produkt leczniczy zawiera lanolinę, która może powodować miejscowe reakcje skórne (np. kontaktowe zapalenie skóry).
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Kwas acetylosalicylowy: jednoczesne stosowanie może prowadzić do wystąpienia działań toksycznych salicylanu. Ze względu na zawartość salicylanu u pacjentów przyjmujących leki przeciwzakrzepowe, takie jak warfaryna, może wystąpić krwawienie.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Brak wystarczających danych, potwierdzających bezpieczne stosowanie mentolu i salicylanu metylu podawanego miejscowo u kobiet w ciąży i karmiących piersią. Stosowanie u kobiet w ciąży i karmiących piersią powinno odbywać się pod nadzorem lekarza.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Bengay Maść Przeciwbólowa nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gDziałania niepożądane
4.8. Działania niepożądane Działania niepożądane stwierdzone w okresie po wprowadzeniu produktu leczniczego do obrotu przedstawiono w poniższej tabeli. Częstość występowania określono zgodnie z następującym schematem: Bardzo często 1/10 Często 1/100 i < 1/10 Niezbyt często 1/1000 i <1/100 Rzadko 1/10 000 i <1/1000 Bardzo rzadko <1/10 000 Częstość nieznana częstość nie może być określona na podstawie dostępnych danych Tabela 1: Działania niepożądane stwierdzone po wprowadzeniu produktu leczniczego do obrotu według kategorii częstości występowania, oszacowane na podstawie spontanicznych zgłoszeń: Zaburzenia układu immunologicznego: Bardzo rzadko - Obrzęk naczynioruchowy Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Bardzo rzadko - Duszność* Zaburzenia ogólne i stany w miejscu podania: Bardzo rzadko - Reakcje w miejscu podania (w tym pęcherze, pieczenie, rumień, podrażnienie, ból, parestezja, świąd i wysypka) Częstość nieznana - Oparzenia w miejscu stosowania *w odniesieniu do nadwrażliwości Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49-21-301, fax: +48 22 49-21-309, e-mail:ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gPrzedawkowanie
4.9. Przedawkowanie Nadużywanie może prowadzić do wystąpienia działań toksycznych salicylanu. W przypadku spożycia należy poradzić się lekarza.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Kod ATC: M02AX10 (leki do stosowania miejscowego w bólach stawów i mięśni). Podstawą skuteczności terapeutycznej produktu leczniczego zawierającego mentol/salicylan metylu jest przenikanie substancji czynnych po zastosowaniu miejscowym do tkanki podskórnej. Mentol i salicylan metylu działają jako leki powodujące łagodny terapeutyczny odczyn zapalny, które po zastosowaniu na skórę pokrywającą bolesny obszar, zapewniają złagodzenie bólu poprzez wywołanie łagodnej reakcji zapalnej w obrębie struktur podskórnych.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Mentol Wchłanianie: Wchłanianie mentolu może nastąpić po zastosowaniu miejscowym. Dystrybucja i wydalanie: Mentol charakteryzuje się wysoką rozpuszczalnością w tłuszczach, dlatego też jest szybko wchłaniany i częściowo wydalany z moczem i żółcią w postaci glukuronidu. Metabolizm: Mentol był szybko metabolizowany i jedynie glukuronid mentolu, tj. główny metabolit mentolu, występował w wykrywalnym stężeniu w osoczu lub w moczu. Okres półtrwania glukuronidu mentolu w osoczu wynosił średnio 56,2 minuty (95% przedział ufności [CI], od 51,0 do 61,5) oraz 42,6 minuty (95% CI, od 32,5 do 52,7) w przypadku podania - odpowiednio - mentolu w postaci kapsułek oraz cukierków miętowych/herbaty miętowej (P < 0,05). Salicylan metylu Salicylan metylu jest wchłaniany przez nieuszkodzoną skórę i może również występować w wykrywalnym stężeniu w krążeniu układowym. Wchłanianie i metabolizm zachodzą szybko.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gWłaściwości farmakokinetyczne
Wchłanianie: Stężenie salicylanu pochodzącego z preparatu zawierającego salicylan metylu w tkankach było około 30-krotnie wyższe niż stężenie osoczowe i było wykrywalne w ciągu 1 godziny po zastosowaniu preparatu na obszar skóry o powierzchni 16 cm2. Zaobserwowano, że zarówno prędkość, jak i stopień wchłaniania, ulegają zwiększeniu w wyniku wielokrotnego zastosowania produktu. Dystrybucja: Salicylan jest rozprowadzany do większości tkanek organizmu oraz płynów transcelularnych, głównie w drodze zależnych od wartości pH biernych procesów. Metabolizm: Salicylan metylu jest metabolizowany w dużym stopniu do kwasu salicylowego (czynny metabolit salicylanu) w skórze właściwej i tkance podskórnej, po zastosowaniu miejscowym. Wydalanie: Salicylany są wydalane z moczem w postaci wolnego kwasu salicylowego (10%), kwasu salicylurowego (75%), glukuronidu salicylo-fenolowego (10%), glukuronidu acylowego (5%) i kwasu gentyzynowego (poniżej 1%).
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gWłaściwości farmakokinetyczne
Jednakże stopień wydalania wolnego kwasu salicylowego jest bardzo zmienny i zależy zarówno od dawki preparatu, jak i pH moczu. Okres półtrwania salicylanu w osoczu wynosi 2-3 godziny w przypadku zastosowania dawek o działaniu przeciwpłytkowym oraz około 12 godzin w przypadku zastosowania standardowych dawek o działaniu przeciwzapalnym. Okres półtrwania może wynosić nawet 15-30 godzin po podaniu wysokich dawek terapeutycznych lub w przypadku zatrucia.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Brak istotnych danych nieklinicznych nieujętych w pozostałych punktach Charakterystyki Produktu Leczniczego.
- CHPL leku Bengay Maść Przeciwbólowa, maść, (150 mg + 100 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Stearynowy kwas Glicerolu monostearynian Lanolina bezwodna Polisorbat 85 Sorbitolu tristearynian Trietyloamina Woda oczyszczona 6.2. Niezgodności farmaceutyczne Nie stwierdzono. 6.3. Okres ważności 2 lata 6.4. Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5. Rodzaj i zawartość opakowania Tuba aluminiowa 50 g w tekturowym pudełku. 6.6. Specjalne środki ostrożności dotyczące usuwania Brak specjalnych zaleceń.
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gargarin, proszek do sporządzania roztworu do płukania gardła. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 5 g proszku do sporządzania roztworu do płukania gardła zawiera: boraks (Borax) 1,74 g sodu wodorowęglan (Natrii hydrogenocarbonas) 1,74 g sodu chlorek (Natrii chloridum) 750 mg sodu benzoesan (Natrii benzoas) 750 mg lewomentol (Levomentholum) 20 mg Pełny wykaz substancji pomocniczych: produkt leczniczy nie zawiera substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Proszek do sporządzania roztworu do płukania gardła
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Wskazania do stosowania
4.1 Wskazania do stosowania Pomocniczo w stanach zapalnych gardła i jamy ustnej.
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Dawkowanie
4.2 Dawkowanie i sposób podawania Do płukania gardła i jamy ustnej: 5 g proszku (1 łyżeczkę lub 1 saszetkę) rozpuścić w szklance ciepłej wody i płukać jamę ustną. Czynność powtórzyć 2 do 3 razy na dobę.
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na którykolwiek ze składników leku. Uszkodzona błona śluzowa jamy ustnej.
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie połykać! Stosowanie długotrwałe i na rozległe uszkodzenia błony śluzowej może powodować kumulowanie się boraksu w organizmie i wywoływać zatrucie. Benzoesan sodu po podaniu miejscowym może powodować niewielkiego stopnia podrażnienie oczu, skóry i błon śluzowych.
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Brak danych.
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Brak danych.
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Gargarin nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Działania niepożądane
4.8 Działania niepożądane Zaburzenia ogólne i stany w miejscu podania Częstość nieznana: podrażnienie błon śluzowych.
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Przedawkowanie
4.9 Przedawkowanie Objawami przedawkowania są: brak łaknienia, zaburzenia żołądkowo-jelitowe, osłabienie, bóle głowy. Po wcześniejszym zaczerwienieniu skóry następuje intensywne jej złuszczanie, zwłaszcza w obrębie dłoni, stóp, pośladków, zmianami tymi mogą być również objęte gardło i błona bębenkowa. Inne objawy to drgawki, zapalenie skóry. Leczenie przedawkowania: przerwać stosowanie produktu leczniczego, podjąć leczenie objawowe.
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki antyseptyczne stosowane w chorobach gardła, kod ATC: R02AA20. Boraks, trucizna protoplazmatyczna, działa odkażająco i słabo bakteriostatycznie dzięki swoistej właściwości jonu boranowego, który łączy się z grupami alkoholowymi pirydoksyny i ryboflawiny, blokując ich działanie jako koenzymów w komórkach. Chlorek sodu działa ściągająco, powoduje przekrwienie błony śluzowej i usuwa toksyny. Benzoesan sodu wykazuje działanie odkażające i słabe działanie bakteriobójcze. Lewomentol drażni zakończenia włókien czuciowych przewodzących zimno, wywołuje na skórze wrażenie chłodu. Równocześnie następuje zmniejszenie wrażliwości zakończeń włókien czuciowych przewodzących ból. Lewomentol wykazuje więc działanie znieczulające.
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Boraks jest łatwo wchłaniany z uszkodzonej skóry, błon śluzowych i przewodu pokarmowego. Wydalany jest powoli, co może prowadzić do zatruć na skutek kumulacji. Chlorek sodu łatwo wchłania się do krwi po podaniu doustnym, wydala się z moczem średnio w ilości 10 g do 16 g na dobę. Benzoesan sodu wchłonięty do krwioobiegu wydalany jest z żółcią i częściowo przez płuca. Lewomentol wydalany jest z żółcią.
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane przedkliniczne, uwzględniające wyniki konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, badań toksyczności po podaniu wielokrotnym, genotoksyczności, możliwego działania rakotwórczego i toksycznego wpływu na reprodukcję, nie ujawniają występowania szczególnego zagrożenia dla człowieka.
- CHPL leku Gargarin, proszek do sporządzania płynu do płukania gardła, -Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Wszystkie składniki produktu leczniczego są substancjami czynnymi. 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. 6.5 Rodzaj i zawartość opakowania Saszetka z folii wielowarstwowej w tekturowym pudełku 30 g (6 saszetek po 5 g) Pojemnik polietylenowy 30 g (1 pojemnik po 30 g) 6.6 Specjalne środki ostrożności dotyczące usuwania Brak szczególnych wymagań
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Neo-angin, 1,2 mg + 0,6 mg + 5,9 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka do ssania zawiera 1,2 mg alkoholu 2,4-dichlorobenzylowego (Alcohol 2,4-dichlorobenzylicus), 0,6 mg amylometakrezolu (Amylmetacresolum) i 5,9 mg lewomentolu (Levomentholum). Substancje pomocnicze o znanym działaniu: Każda tabletka do ssania zawiera syrop glukozowy (może zawierać dwutlenek siarki (E 220)), w tym 1,14 g glukozy (sucha masa), 1,42 g sacharozy (może zawierać siarczyny) oraz 0,35 mg czerwieni koszenilowej A (E 124). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki do ssania. Okrągłe, lekko dwustronnie wypukłe tabletki o czerwonej rowkowanej powierzchni i charakterystycznym zapachu. Dopuszczalne są: rozbieżność koloru, obecność pęcherzyków powietrza w gotowanej masie i lekko nieregularne krawędzie. Możliwa jest cienka warstwa białego nalotu.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt Neo-angin jest zalecany do wspomagania leczenia stanów zapalnych jamy ustnej i gardła, przebiegających z objawami, takimi jak: ból gardła, zaczerwienienie, obrzęk. Neo-angin jest wskazany do stosowania u dorosłych, młodzieży i dzieci w wieku powyżej 6 lat.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli, młodzież i dzieci w wieku powyżej 6 lat: Powoli ssać lub rozpuszczać w jamie ustnej jedną tabletkę co 2-3 godziny. Nie należy połykać tabletek w całości. Nie żuć. Maksymalna dobowa dawka to 6 tabletek do ssania. Bez zalecenia lekarza Neo-angin nie należy przyjmować dłużej niż 3 do 4 dni. Nie stosować u dzieci w wieku poniżej 6 lat. Sposób podawania Podanie doustne.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Neo-angin zawiera czerwień koszenilową A (E 124), która może powodować reakcje alergiczne. Barwnik czerwień koszenilowa A w tym produkcie leczniczym zawiera mniej niż 1 mmol (23 mg) sodu w jednej tabletce do ssania, to znaczy lek uznaje się za „wolny od sodu”. Neo-angin zawiera także 1,14 g glukozy (sucha masa) oraz 1,42 g sacharozy w jednej tabletce do ssania, co odpowiada ok. 10 kcal (42 kJ). Należy to wziąć pod uwagę u pacjentów z cukrzycą. Pacjenci z rzadko występującą dziedziczną nietolerancją fruktozy, zespołem złego wchłaniania glukozy-galaktozy lub niedoborem sacharazy-izomaltazy nie powinni przyjmować tego produktu leczniczego. Ten produkt leczniczy może zawierać dwutlenek siarki lub siarczyny, które rzadko mogą powodować ciężkie reakcje nadwrażliwości i skurcz oskrzeli. W przypadku leczenia produktem Neo-angin dzieci muszą umieć ssać tabletkę w sposób kontrolowany.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Dotychczas nie stwierdzono klinicznie istotnych interakcji z innymi lekami podawanymi doustnie.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych lub istnieją tylko ograniczone dane dotyczące stosowania substancji czynnych u kobiet w okresie ciąży. Badania na zwierzętach nie wykazały bezpośredniego lub pośredniego szkodliwego wpływu na reprodukcję (patrz punkt 5.3). Ze względu na niewystarczające dane nie można całkowicie wykluczyć ryzyka dla płodu, dlatego nie zaleca się stosowania tego produktu leczniczego w czasie ciąży. Karmienie piersi? Brak wystarczających danych dotyczących przenikania substancji czynnych i (lub) ich metabolitów do mleka ludzkiego. Dlatego nie należy stosować Neo-angin w okresie karmienia piersią. Płodność Nie przeprowadzono badań oceniających wpływ na płodność.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie dotyczy.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane wymieniono poniżej według klasyfikacji układów i narządów oraz konwencji dotyczącej częstości. Częstość występowania definiuje się w następujący sposób: Bardzo często (≥1/10) Często (≥1/100 do <1/10) Niezbyt często (≥1/1 000 do <1/100) Rzadko (≥1/10 000 do <1/1 000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych). Możliwe działania niepożądane: Zaburzenia układu immunologicznego: Częstość nieznana: reakcje alergiczne, takie jak obrzęk ust, języka i warg, wysypka Zaburzenia żołądka i jelit: Bardzo rzadko: podrażnienie błony śluzowej jamy ustnej i przewodu pokarmowego, takie jak niestrawność, nudności. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgPrzedawkowanie
4.9 Przedawkowanie Nie odnotowano przypadków przedawkowania produktu. W bardzo mało prawdopodobnym przypadku przedawkowania, opisane działania niepożądane mogą się nasilić. W takim przypadku zaleca się leczenie objawowe.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: układ oddechowy, preparaty stosowane w chorobach gardła, środek antyseptyczny Kod ATC: R02AA20 Mechanizm działania W oparciu o badania in vitro, produkt Neo-angin wykazuje działanie przeciwwirusowe, przeciwbakteryjne i przeciwgrzybicze o charakterze miejscowym, jednak takiego działania nie wykazano w szerszych badaniach in vivo; w związku z tym znaczenie kliniczne tych obserwacji nie zostało potwierdzone. Neuraminidaza to enzym, który ma kluczowe znaczenie w rozprzestrzenianiu się wirusa grypy. Połączone substancje lecznicze zastosowane w produkcie Neo-angin wykazały działanie hamujące na neuraminidazy wirusa grypy H1N1 w warunkach in vitro. Działanie hamujące przypisuje się dwóm elementom składowym: alkoholowi 2,4-dichlorobenzylowemu oraz amylometakrezolowi.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgWłaściwości farmakodynamiczne
Działanie to było bardziej widoczne w przypadku połączenia substancji leczniczych zastosowanych w produkcie Neo-angin w porównaniu do działania pojedynczych składników, co sugeruje efekt synergistyczny. Dowiedziono, że w warunkach in vitro produkt Neo-angin po kilku minutach wykazuje działanie wirusobójcze na wirusy z otoczką. Badanie wykonano zgodnie z oficjalnymi rekomendacjami (metoda zawiesinowa RKI/DVV), z wykorzystaniem wirusa krowianki. W trakcie badania in vitro dotyczącego skuteczności przeciwdrobnoustrojowej połączone substancje lecznicze produktu Neo-angin wykazały działanie bakteriobójcze oraz grzybobójcze na 5 bakterii (wymienionych poniżej) oraz na drożdżaki z gatunku Candida albicans, które wywołują zapalenia gardła. W badaniach w warunkach in vitro wykazano, że substancje czynne znajdujące się w tabletkach do ssania Neo-angin działają szczególnie silnie na Mycoplasma pneumoniae oraz Moraxella catarrhalis, silnie na Streptococcus pyogenes, a nawet na gronkowca złocistego opornego na metycylinę (ang.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgWłaściwości farmakodynamiczne
methicyllin-resistant Staphylococcus aureus, MRSA) oraz Candida albicans, natomiast umiarkowanie silnie na bakterie z grupy Klebsiella pneumoniae. Podczas analizy działania na szczepy Klebsiella pneumoniae, Mycoplasma pneumoniae oraz Moraxella catarrhalis, a także Candida albicans, w warunkach in vitro, połączone substancje lecznicze w produkcie Neo-angin były bardziej skuteczne niż każda z nich oddzielnie, co sugeruje efekt synergistyczny. Niezmienne zmniejszenie liczby bakterii w fizjologicznej florze jamy ustnej u zdrowych osób utrzymujące się do 5 godzin po zastosowaniu, wspomaga długotrwałe działanie antyseptyczne produktu Neo-angin. W przypadku bólu gardła, bez względu na to, czy jest on spowodowany przez wirusy czy bakterie, odczucia takie jak podrażnienie i ból są najprawdopodobniej spowodowane przez mediatory zapalne. Mediatory te to prostaglandyny (PG) oraz bradykinina, które działają na zakończenia nerwów czuciowych w jamie gardłowej i nosowo-gardłowej.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgWłaściwości farmakodynamiczne
Ponadto uważa się, że interleukiny (np. IL-6) wyzwalają syntezę PGE2, a zatem odgrywają ważną rolę w fizjologii nocycepcji i bólu. W różnych modelach in vitro (monocyty, komórki nabłonka A549) alkohol 2,4-dichlorobenzylowy, amylometakrezol oraz lewomentol wykazywały synergistyczne działanie hamujące na spowodowane przez IL-1 uwalnianie IL-6 i PGE2, a także IL-8. Takie silne działanie hamujące aktywność zarówno mediatorów, interleukin, jak i prostaglandyn zaobserwowano wyłącznie w przypadku połączenia substancji leczniczych zastosowanych w Neo-angin, w porównaniu do innych badanych połączeń substancji leczniczych wskazanych w bólu gardła. W warunkach in vitro dowiedziono, że lewomentol jest silnym inhibitorem syntezy IL-6 w komórkach nabłonka A549. Ponadto, ma on działanie przeciwbólowe, które opiera się na stymulacji receptorów wrażliwych na zimno (TRPM8) znajdujących się w śluzówce.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgWłaściwości farmakodynamiczne
Amylometakrezol hamuje również spowodowaną przez IL-1 ekspresję COX-2, enzymu, który przyczynia się do uwalniania prostaglandyn w trakcie procesu zapalnego. Skuteczność kliniczna i bezpieczeństwo stosowania W badaniach u ludzi dowiedziono, że działanie tabletek do ssania Neo-angin jest klinicznie i statystycznie istotne w porównaniu z placebo, w zakresie objawów takich jak: trudności w połykaniu, nasilenie objawów bólu gardła (np. miejscowe objawy tj.: zaczerwienienie i obrzęk gardła) oraz czasu występowania dolegliwości związanych z ostrym zapaleniem gardła w przebiegu ostrej choroby dróg oddechowych. Wykazano, że po 72 godzinach leczenia pacjenci odczuwali znacznie większą ulgę (ustąpienie bólu gardła / trudności w połykaniu) niż w przypadku tabletek do ssania niezawierających substancji leczniczych. Początek działania obserwowano po 5 minutach, a jego długość wynosiła do 3 godzin. Produkt cechował się dobrą tolerancją.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Substancje czynne produktu są szybko wchłaniane i szybko wydalane. Alkohol 2,4-dichlorobenzylowy jest przekształcany do kwasu 2,4-dichlorobenzoesowego, który jest wydalany przez nerki albo w postaci kwasu (np. benzoesowego) albo w postaci sprzężonej z glicyną. Amylometakrezol jest częściowo utleniany do odpowiedniego kwasu karboksylowego, a następnie wydalany przez nerki w postaci glukuronianu. Lewomentol jest wydalany z moczem oraz z żółcią, również w postaci glukuronianu.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Nie jest znane szczególne ryzyko związane ze stosowaniem skojarzenia substancji czynnych zawartych w produkcie. Wyniki badań przeprowadzonych z zastosowaniem alkoholu 2,4-dichlorobenzylowego oraz amylometakrezolu wykazały, iż te substancje stosowane oddzielnie bądź w skojarzeniu, nie wywierają działania toksycznego ani mutagennego. Badania toksyczności alkoholu 2,4-dichlorobenzylowego oraz amylometakrezolu nie wykazały właściwości mutagennych. W badaniach toksycznego wpływu na reprodukcję nie wykazano działania embriotoksycznego ani teratogennego lewomentolu.
- CHPL leku Neo-Angin, tabletki do ssania, 1,2 mg + 0,6 mg + 5,9 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Olejek z anyżu gwiaździstego Olejek miętowy Sacharoza (może zawierać siarczyny) Syrop glukozowy (zawiera glukozę i może zawierać dwutlenek siarki (E 220)) Kwas winowy Czerwień koszenilowa A (E 124), zawiera m.in. sód 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z PVC/PVdC i folii aluminiowej w pudełku tekturowym. Wielkość opakowania: 12, 24, 36 lub 48 tabletek do ssania. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Neo-angin Spray, (14,58 mg + 2,92 mg + 0,87 mg)/ml, roztwór do stosowania na błonę śluzową jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu zawiera 14,58 mg alkoholu 2,4-dichlorobenzylowego (Alcohol 2,4- dichlorobenzylicus), 2,92 mg amylometakrezolu (Amylmetacresolum) i 0,87 mg lewomentolu (Levomentholum). Substancje pomocnicze o znanym działaniu: 0,2 g etanolu 96% 0,76 g glikolu propylenowego na 1 ml. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do stosowania na błonę śluzową jamy ustnej i gardła
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlWskazania do stosowania
4.1 Wskazania do stosowania Produkt Neo-angin Spray jest zalecany do wspomagania leczenia stanów zapalnych jamy ustnej i gardła, przebiegających z objawami, takimi jak: ból gardła, zaczerwienienie, obrzęk. Neo-angin Spray jest wskazany do stosowania u dorosłych i dzieci w wieku powyżej 6 lat.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i dzieci w wieku powyżej 6 lat: Należy stosować jedną dawkę produktu do 6 razy na dobę. Pacjent nie powinien przyjmować produktu dłużej niż 3-4 dni bez zalecenia lekarza. Produktu leczniczego Neo-angin Spray nie należy stosować u dzieci w wieku poniżej 6 lat. Sposób podawania W celu podania dawki produktu należy zdjąć nasadkę ochronną, wstrzymać oddech i nacisnąć dwukrotnie głowicę pojemnika, wprowadzając roztwór do jamy ustnej.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować u dzieci w wieku poniżej 6 lat. Nie stosować u pacjentów z astmą oskrzelową lub innymi schorzeniami dróg oddechowych w przebiegu których dochodzi do stanów spastycznych, gdyż podanie produktu może spowodować skurcz oskrzeli.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt leczniczy zawiera 35 mg alkoholu (etanolu) w każdej jednostce dawkowania- dwa rozpylenia odpowiadające 0,18 ml. Ilość alkoholu w jednej dawce tego produktu leczniczego jest równoważna mniej niż 1 ml piwa lub wina. Mała ilość alkoholu w tym produkcie leczniczym nie będzie powodowała zauważalnych skutków. Produkt leczniczy zawiera ok. 137 mg glikolu propylenowego w każdej dawce (2 rozpylenia odpowiadające 0,18 ml). Dzieci powinny stosować produkt leczniczy pod nadzorem osoby dorosłej.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Dotychczas nie stwierdzono klinicznie istotnych interakcji z innymi lekami stosowanymi doustnie.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak wystarczających danych klinicznych dotyczących stosowania produktu u kobiet w ciąży. Ze względu na zawartość etanolu produktu nie stosować u kobiet w ciąży. Karmienie piersi? Ze względu na zawartość etanolu produktu nie stosować u kobiet karmiących piersią.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie przeprowadzono badań nad wpływem produktu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane wymieniono poniżej według częstości występowania. Częstość występowania określa się następująco: Bardzo często (≥1/10) Często (≥1/100 do <1/10) Niezbyt często (≥1/1 000 do <1/100) Rzadko (≥1/10 000 do <1/1 000) Bardzo rzadko (<1/10 000) Po podaniu produktu Neo-angin Spray obserwowano następujące działania niepożądane: Bardzo rzadko (<1/10 000): podrażnienie błony śluzowej jamy ustnej i przewodu pokarmowego. Mogą również wystąpić reakcje alergiczne. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlPrzedawkowanie
4.9 Przedawkowanie Nie odnotowano przypadków przedawkowania produktu. W przypadku zastosowania znacznie większej dawki leku niż zalecana może wystąpić podrażnienie błony śluzowej żołądka i jelit. W takim przypadku zaleca się leczenie objawowe.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki stosowane w chorobach gardła. Środki antyseptyczne. Kod ATC: R02AA20. Neo-angin Spray jest produktem działającym antyseptycznie oraz łagodzącym ból gardła, zawierającym trzy substancje czynne: alkohol 2,4-dichlorobenzylowy, amylometakrezol i lewomentol. Alkohol 2,4-dichlorobenzylowy jest pochodną benzenu, amylometakrezol jest pochodną fenolu, zaś lewomentol cyklicznym monoterpenem. Alkohol 2,4-dichlorobenzylowy oraz amylometakrezol działają głównie powierzchniowo. Obydwie substancje wywierają wpływ na transport lipidów przez błonę komórkową, co tłumaczy ich aktywność przeciwbakteryjną i przeciwgrzybiczą. Lewomentol uzupełnia działanie pozostałych dwóch substancji czynnych. Podrażnia zakończenia czuciowe receptorów zimna wywołując na błonach śluzowych uczucie chłodu. Zmniejsza także wrażliwość włókien czuciowych przewodzących ból w związku z tym wywołuje słabe działanie znieczulające miejscowo.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlWłaściwości farmakodynamiczne
Neo-angin Spray jest zalecany do leczenia lekkich zakażeń jamy ustnej i gardła, jest skuteczny we wczesnej fazie zakażenia.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Substancje czynne produktu są szybko wchłaniane i szybko wydalane. Alkohol 2,4-dichlorobenzylowy jest przekształcany do kwasu 2,4-dichlorobenzoesowego, który jest wydalany przez nerki albo w postaci kwasu (np. benzoesowego) albo w postaci sprzężonej z glicyną. Amylometakrezol jest częściowo utleniany do odpowiedniego kwasu karboksylowego, a następnie wydalany przez nerki w postaci glukuronianu. Lewomentol jest wydalany z moczem oraz z żółcią, również w postaci glukuronianu.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Nie jest znane szczególne ryzyko związane ze stosowaniem skojarzenia substancji czynnych zawartych w produkcie. Wyniki badań przeprowadzonych z zastosowaniem alkoholu 2,4-dichlorobenzylowego oraz amylometakrezolu wykazały, iż te substancje stosowane oddzielnie bądź w skojarzeniu, nie wywierają działania toksycznego ani mutagennego. Badania toksyczności alkoholu 2,4-dichlorobenzylowego oraz amylometakrezolu nie wykazały właściwości mutagennych. W badaniach toksycznego wpływu na reprodukcję nie wykazano działania embriotoksycznego ani teratogennego lewomentolu.
- CHPL leku Neo-Angin Spray, roztwór do stosowania na błonę śluzową jamy ustnej i gardła, (14,58 mg + 2,92 mg + 0,87 mg)/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Olejek z anyżu gwiaździstego Olejek miętowy Glikol propylenowy Etanol 96% (nie więcej niż 100 mg na dawkę) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 5 lat 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Butelka ze szkła oranżowego z rozpylaczem w tekturowym pudełku. Wielkość opakowania: 15 lub 30 ml. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Neo-angin bez cukru, 1,2 mg + 0,6 mg + 5,72 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 1,2 mg alkoholu 2,4-dichlorobenzylowego (Alcohol 2,4-dichlorobenzylicus), 0,6 mg amylometakrezolu (Amylmetacresolum) i 5,72 mg lewomentolu (Levomentholum). Substancje pomocnicze o znanym działaniu: Jedna tabletka do ssania zawiera 2,58 g izomaltu (E 953) i 0,44 mg czerwieni koszenilowej A (E 124). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki do ssania. Okrągłe, lekko dwustronnie wypukłe tabletki o czerwonej rowkowanej powierzchni i charakterystycznym zapachu. Dopuszczalne są: rozbieżność koloru, obecność pęcherzyków powietrza w gotowanej masie i lekko nieregularne krawędzie. Możliwa jest cienka warstwa białego nalotu.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt Neo-angin bez cukru jest zalecany do wspomagania leczenia stanów zapalnych jamy ustnej i gardła, przebiegających z objawami, takimi jak: ból gardła, zaczerwienienie, obrzęk.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dorośli i dzieci w wieku powyżej 6 lat: Powoli ssać lub rozpuszczać w jamie ustnej 1 tabletkę co 2-3 godziny. Nie należy połykać tabletek w całości. Nie żuć. Nie należy stosować więcej niż 6 tabletek w ciągu doby. Pacjent nie powinien przyjmować produktu dłużej niż 4-5 dni bez zalecenia lekarza. Nie stosować u dzieci w wieku poniżej 6 lat.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nietolerancja fruktozy. Nie stosować u dzieci w wieku poniżej 6 lat.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Neo-angin bez cukru zawiera barwnik czerwień koszenilową (E 124), który może powodować reakcje alergiczne. Zawiera także 2,58 g izomaltu (E 953) w jednej tabletce do ssania, co odpowiada 6 kcal (26 kJ). Należy to wziąć pod uwagę u pacjentów z cukrzycą. Pacjenci z rzadko występującą dziedziczną nietolerancją fruktozy nie powinni przyjmować tego produktu leczniczego. Izomalt może mieć lekkie działanie przeczyszczające.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Dotychczas nie stwierdzono klinicznie istotnych interakcji z innymi lekami podawanymi doustnie.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Brak wystarczających danych klinicznych dotyczących stosowania produktu u kobiet w ciąży. Badania przeprowadzone na zwierzętach nie wykazały bezpośredniego lub pośredniego szkodliwego wpływu na rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy. Ze względu na niewystarczające dane niemożliwe jest dokładne określenie potencjalnego ryzyka dla płodu, dlatego kobiety w ciąży powinny skonsultować się z lekarzem przed przyjęciem produktu. Należy zachować ostrożność zalecając lek kobietom w ciąży lub karmiącym piersią.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie przeprowadzono badań nad wpływem produktu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane wymieniono poniżej według częstości występowania. Częstość występowania określa się następująco: Bardzo często (≥1/10) Często (≥1/100 do <1/10) Niezbyt często (≥1/1 000 do <1/100) Rzadko (≥1/10 000 do <1/1 000) Bardzo rzadko (<1/10 000) Po podaniu produktu Neo-angin bez cukru obserwowano następujące działania niepożądane: Bardzo rzadko (<1/10 000): podrażnienie błony śluzowej jamy ustnej i przewodu pokarmowego. Mogą również wystąpić reakcje alergiczne. Zgłaszanie podejrzewanych działań niepożądanych: Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgDziałania niepożądane
Jerozolimskie 181 C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgPrzedawkowanie
4.9 Przedawkowanie Nie odnotowano przypadków przedawkowania produktu. W przypadku zażycia znacznie większej dawki leku niż zalecana może wystąpić podrażnienie błony śluzowej żołądka i jelit. W takim przypadku zaleca się leczenie objawowe.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: układ oddechowy, preparaty stosowane w chorobach gardła, środek antyseptyczny Kod ATC: R02AA20 Mechanizm działania W oparciu o badania in vitro, produkt Neo-angin bez cukru wykazuje działanie przeciwwirusowe, przeciwbakteryjne i przeciwgrzybicze o charakterze miejscowym, jednak takiego działania nie wykazano w szerszych badaniach in vivo; w związku z tym znaczenie kliniczne tych obserwacji nie zostało potwierdzone. Neuraminidaza to enzym, który ma kluczowe znaczenie w rozprzestrzenianiu się wirusa grypy. Połączone substancje lecznicze zastosowane w produkcie Neo-angin bez cukru wykazały działanie hamujące na neuraminidazy wirusa grypy H1N1 w warunkach in vitro. Działanie hamujące przypisuje się dwóm elementom składowym: alkoholowi 2,4-dichlorobenzylowemu oraz amylometakrezolowi.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgWłaściwości farmakodynamiczne
Działanie to było bardziej widoczne w przypadku połączenia substancji leczniczych zastosowanych w produkcie Neo-angin bez cukru w porównaniu do działania pojedynczych składników, co sugeruje efekt synergistyczny. Dowiedziono, że w warunkach in vitro produkt Neo-angin bez cukru po kilku minutach wykazuje działanie wirusobójcze na wirusy z otoczką. Badanie wykonano zgodnie z oficjalnymi rekomendacjami (metoda zawiesinowa RKI/DVV), z wykorzystaniem wirusa krowianki. W trakcie badania in vitro dotyczącego skuteczności przeciwdrobnoustrojowej połączone substancje lecznicze produktu Neo-angin bez cukru wykazały działanie bakteriobójcze oraz grzybobójcze na 5 bakterii (wymienionych poniżej) oraz na drożdżaki z gatunku Candida albicans, które wywołują zapalenia gardła. W badaniach w warunkach in vitro wykazano, że substancje czynne znajdujące się w tabletkach do ssania Neo-angin bez cukru działają szczególnie silnie na Mycoplasma pneumoniae oraz Moraxella catarrhalis, silnie na Streptococcus pyogenes, a nawet na gronkowca złocistego opornego na metycylinę (ang.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgWłaściwości farmakodynamiczne
methicyllin-resistant Staphylococcus aureus, MRSA) oraz Candida albicans, natomiast umiarkowanie silnie na bakterie z grupy Klebsiella pneumoniae. Podczas analizy działania na szczepy Klebsiella pneumoniae, Mycoplasma pneumoniae oraz Moraxella catarrhalis, a także Candida albicans, w warunkach in vitro, połączone substancje lecznicze w produkcie Neo-angin bez cukru były bardziej skuteczne niż każda z nich oddzielnie, co sugeruje efekt synergistyczny. Niezmienne zmniejszenie liczby bakterii w fizjologicznej florze jamy ustnej u zdrowych osób utrzymujące się do 5 godzin po zastosowaniu, wspomaga długotrwałe działanie antyseptyczne produktu Neo-angin bez cukru. W przypadku bólu gardła, bez względu na to, czy jest on spowodowany przez wirusy czy bakterie, odczucia takie jak podrażnienie i ból są najprawdopodobniej spowodowane przez mediatory zapalne. Mediatory te to prostaglandyny (PG) oraz bradykinina, które działają na zakończenia nerwów czuciowych w jamie gardłowej i nosowo-gardłowej.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgWłaściwości farmakodynamiczne
Ponadto uważa się, że interleukiny (np. IL-6) wyzwalają syntezę PGE2, a zatem odgrywają ważną rolę w fizjologii nocycepcji i bólu. W różnych modelach in vitro (monocyty, komórki nabłonka A549) alkohol 2,4-dichlorobenzylowy, amylometakrezol oraz lewomentol wykazywały synergistyczne działanie hamujące na spowodowane przez IL-1 uwalnianie IL-6 i PGE2, a także IL-8. Takie silne działanie hamujące aktywność zarówno mediatorów, interleukin, jak i prostaglandyn zaobserwowano wyłącznie w przypadku połączenia substancji leczniczych zastosowanych w Neo-angin bez cukru, w porównaniu do innych badanych połączeń substancji leczniczych wskazanych w bólu gardła. W warunkach in vitro dowiedziono, że lewomentol jest silnym inhibitorem syntezy IL-6 w komórkach nabłonka A549. Ponadto, ma on działanie przeciwbólowe, które opiera się na stymulacji receptorów wrażliwych na zimno (TRPM8) znajdujących się w śluzówce.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgWłaściwości farmakodynamiczne
Amylometakrezol hamuje również spowodowaną przez IL-1 ekspresję COX-2, enzymu, który przyczynia się do uwalniania prostaglandyn w trakcie procesu zapalnego. Skuteczność kliniczna i bezpieczeństwo stosowania W badaniach u ludzi dowiedziono, że działanie tabletek do ssania Neo-angin bez cukru jest klinicznie i statystycznie istotne w porównaniu z placebo, w zakresie objawów takich jak: trudności w połykaniu, nasilenie objawów bólu gardła (np. miejscowe objawy tj.: zaczerwienienie i obrzęk gardła) oraz czasu występowania dolegliwości związanych z ostrym zapaleniem gardła w przebiegu ostrej choroby dróg oddechowych. Wykazano, że po 72 godzinach leczenia pacjenci odczuwali znacznie większą ulgę (ustąpienie bólu gardła / trudności w połykaniu) niż w przypadku tabletek do ssania niezawierających substancji leczniczych. Początek działania obserwowano po 5 minutach, a jego długość wynosiła do 3 godzin. Produkt cechował się dobrą tolerancją.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Substancje czynne produktu są szybko wchłaniane i szybko wydalane. Alkohol 2,4-dichlorobenzylowy jest przekształcany do kwasu 2,4-dichlorobenzoesowego, który jest wydalany przez nerki albo w postaci kwasu (np. benzoesowego) albo w postaci sprzężonej z glicyną. Amylometakrezol jest częściowo utleniany do odpowiedniego kwasu karboksylowego, a następnie wydalany przez nerki w postaci glukuronianu. Lewomentol jest wydalany z moczem oraz z żółcią, również w postaci glukuronianu.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Nie jest znane szczególne ryzyko związane ze stosowaniem skojarzenia substancji czynnych zawartych w produkcie. Wyniki badań przeprowadzonych z zastosowaniem alkoholu 2,4-dichlorobenzylowego oraz amylometakrezolu wykazały, iż te substancje stosowane oddzielnie bądź w skojarzeniu, nie wywierają działania toksycznego ani mutagennego. Badania toksyczności alkoholu 2,4-dichlorobenzylowego oraz amylometakrezolu nie wykazały właściwości mutagennych. W badaniach toksycznego wpływu na reprodukcję nie wykazano działania embriotoksycznego ani teratogennego lewomentolu.
- CHPL leku Neo-Angin bez cukru, tabletki do ssania, 1,2 mg + 0,6 mg + 5,7 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Olejek z anyżu gwiaździstego Olejek miętowy Izomalt (E 953) Kwas winowy Czerwień koszenilowa A (E 124) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 5 lat 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. 6.5 Rodzaj i zawartość opakowania Blistry z PVC/PVdC/Al w pudełku tekturowym. Wielkość opakowania: 12, 16, 24 lub 48 tabletek do ssania. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA WŁASNA PRODUKTU LECZNICZEGO PUDER PŁYNNY, (180 mg + 10 mg)/g, zawiesina na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g zawiesiny na skórę zawiera 180 mg cynku tlenku (Zinci oxidum) i 10 mg mentolu (Mentholum) Pełny wykaz substancji pomocniczych, patrz: punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Zawiesina na skórę
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Puder płynny jest wskazany do stosowania miejscowego jako środek uśmierzający świąd skóry, kojący i wysuszający w dermatozach, półpaścu, ospie wietrznej i po ukąszeniu owadów.
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Podanie na skórę. Nanosić na zmienione chorobowo miejsca na skórze kilka razy na dobę. Przed użyciem wstrząsnąć.
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nie stosować produktu leczniczego: w nadwrażliwości na cynku tlenek, mentol lub na którykolwiek ze składników produktu leczniczego; na uszkodzoną skórę.
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Chronić oczy i błony śluzowe przed kontaktem z produktem leczniczym.
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie są znane.
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Brak wpływu.
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt nie ma wpływu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn.
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gDziałania niepożądane
4.8 Działania niepożądane Produkt może powodować objawy nadwrażliwości (np. podrażnienie skóry).
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gPrzedawkowanie
4.9 Przedawkowanie Nie zachodzi możliwość przedawkowania przy stosowaniu zgodnie ze wskazaniami i zalecanym sposobem stosowania.
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Puder płynny zawiera substancje czynne cynku tlenek i mentol. Stosowany na skórę łagodzi świąd, działa wysuszająco, osłaniająco, słabo odkażająco i słabo znieczulająco miejscowo.
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Jeśli jest zachowana ciągłość skóry, produkt leczniczy zastosowany na skórę nie wchłania się do krwiobiegu.
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Nie prowadzono badań przedklinicznych. Z danych literaturowych wynika, że mentol i tlenek cynku charakteryzują się niską toksycznością. W żadnym z badań nie odnotowano bezpośredniego działania rakotwórczego ani mutagennego tlenku cynku i mentolu.
- CHPL leku Puder płynny, zawiesina na skórę, (180 mg + 10 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Glicerol 86% Woda oczyszczona Talk 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Butelka z polietylenu z dodatkiem białego pigmentu, zamykana zakrętką z kroplomierzem 100 g (1 butelka po 100 g) 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Przed użyciem wstrząsnąć.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Pudroderm, (9,8 mg + 9,8 mg + 245 mg)/g, zawiesina na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g zawiesiny na skórę zawiera 9,8 mg benzokainy (Benzocainum), 9,8 mg lewomentolu (Levomentholum) i 245 mg cynku tlenku (Zinci oxidum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Zawiesina na skórę
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gWskazania do stosowania
4.1. Wskazania do stosowania Pomocniczo w ospie wietrznej, półpaścu, w stanach zapalnych skóry przebiegających z wysypką, świądem, obrzękiem, w świądzie neurogennym. Po ukąszeniach owadów (np. przez komary, osy, meszki). Pod kontrolą lekarza po naświetlaniach radiologicznych.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gDawkowanie
4.2. Dawkowanie i sposób podawania Dawkowanie Dzieci i młodzież Produktu leczniczego Pudroderm nie należy stosować u dzieci w wieku do 2 lat. Sposób podawania Podanie na skórę. Wstrząsnąć przed każdym użyciem. Na zmienione chorobowo miejsca na skórze nakładać niezbyt cienką warstwę zawiesiny 2 do 3 razy na dobę, lub w razie konieczności częściej. Nie należy wcierać w skórę ani przykrywać opatrunkiem.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gPrzeciwwskazania
4.3. Przeciwwskazania Nie stosować: w nadwrażliwości na benzokainę, lewomentol, cynku tlenek lub na którąkolwiek substancję pomocniczą produktu wymienioną w punkcie 6.1.; na rany; duże powierzchnie skóry; na skórę uszkodzoną, np. pozbawioną naskórka; długotrwale; pod opatrunki okluzyjne.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Dzieci i młodzież Nie zaleca się stosowania u dzieci w wieku do 2 lat, gdyż miejscowe stosowanie benzokainy może prowadzić do methemoglobinemii i wystąpienia reakcji nadwrażliwości. Ostrożnie stosować u dzieci powyżej 2 lat. Chronić oczy i błony śluzowe przed kontaktem z produktem.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Benzokaina zaburza działanie sulfonoamidów. Miejscowo znieczulające działanie benzokainy ulega osłabieniu w obecności nadtlenku benzoilu, który często jest składnikiem stosowanych miejscowo leków przeciwtrądzikowych. Z tego powodu przed aplikacją produktu Pudroderm u pacjentów stosujących produkty zawierające nadtlenek benzoilu, należy dokładnie oczyścić skórę z ich pozostałości.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Ciąża Brak danych potwierdzających bezpieczeństwo stosowania produktu u kobiet w ciąży. Laktacja Brak danych potwierdzających bezpieczeństwo stosowania produktu w okresie laktacji. Płodność Brak danych potwierdzających wpływ produktu na płodność.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brak danych dotyczących wpływu produktu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gDziałania niepożądane
4.8. Działania niepożądane Po zastosowaniu leku mogą wystąpić objawy miejscowego podrażnienia skóry. Jeżeli objawy podrażnienia nasilą się lub nie ustąpią po kilku dniach, należy zaprzestać stosowania produktu leczniczego. Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (Aleje Jerozolimskie 181C, 02-222 Warszawa, tel. (22) 49 21 301, faks (22) 49 21 309), e-mail: ndl@urpl.gov.pl
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gPrzedawkowanie
4.9. Przedawkowanie Nie odnotowano przypadków przedawkowania w przypadku stosowania zgodnie ze wskazaniami oraz zalecanym dawkowaniem i sposobem użycia.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki stosowane w dermatologii Kod ATC: brak kodu ATC wg WHO Pudroderm jest złożonym produktem leczniczym o synergicznym działaniu składników: miejscowo znieczulającym, przeciwświądowym, osłaniającym i ściągającym. Benzokaina działa miejscowo znieczulająco. Tlenek cynku jest substancją o silnym działaniu ściągającym, osłaniającym i słabym działaniu przeciwbakteryjnym. Lewomentol wywołuje miejscowe uczucie chłodu i działa przeciwświądowo.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Nie badano farmakokinetyki produktu leczniczego Pudroderm. Zamieszczono dane na temat poszczególnych składników. Wchłanianie i dystrybucja Benzokaina Benzokaina zastosowana na skórę słabo się wchłania do krwiobiegu, występuje głównie w warstwach naskórka. Tlenek cynku W badaniach dotyczących wchłaniania tlenku cynku po podaniu na skórę nie obserwowano przenikania cynku do krwi, lecz tylko jego penetrację do warstw naskórka, głównie stratum corneum. W badaniach dotyczących przenikania do krwi jonów Zn2+ po aplikacji tlenku cynku na skórę nieuszkodzoną lub ze zmianami łuszczycowymi wykazano praktycznie niezmienione, utrzymujące się na poziomie fizjologicznym stężenia cynku we krwi, nawet po zastosowaniu na duże powierzchnie skóry maści o zawartości 40% tlenku cynku. Biodostępność tlenku cynku zwiększa się po zastosowaniu na skórę uszkodzoną lub pod opatrunkiem okluzyjnym.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gWłaściwości farmakokinetyczne
Jedynie w przypadku bardzo ciężkich zmian skórnych lub znacznych niedoborów, cynk przenikał przez skórę do krążenia. Lewomentol Lipofilny charakter lewomentolu oraz działanie rozszerzające naczynia krwionośne, wywierane po podaniu dużych dawek, ułatwiają jego przenikanie przez skórę do krążenia. Lewomentol wchłonięty przez skórę przenika do krwi, skąd jest transportowany do wątroby i szybko metabolizowany. W badaniach wykazano, że nawet po podaniu bardzo dużych dawek na skórę stężenia lewomentolu we krwi są małe.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Nie prowadzono badań toksyczności produktu leczniczego Pudroderm. Zamieszczono dane na temat poszczególnych składników. Toksyczność po podaniu jednorazowym Benzokaina Benzokaina jest związkiem o małej toksyczności ostrej. Tlenek cynku Tlenek cynku jest związkiem o bardzo małej toksyczności, a wg klasyfikacji Hodge’a i Stemera - praktycznie nietoksycznym. Wziewne podanie tlenku cynku powodowało kaszel, duszność i inne zaburzenia oddychania. Lewomentol Lewomentol jest związkiem o małej toksyczności ostrej. Toksyczność po podaniu wielokrotnym Brak danych dotyczących toksyczności benzokainy i tlenku cynku po doustnym podaniu wielokrotnym. Doustne podawanie lewomentolu przez 28 dni w dawkach 200, 400 lub 800 mg/kg mc./dobę powodowało zwiększenie masy wątroby i nasilonej wakuolizacji hepatocytów, prawdopodobnie wskutek indukcji enzymów wątrobowych. Genotoksyczność Brak danych dotyczących genotoksyczności benzokainy.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gPrzedkliniczne dane o bezpieczeństwie
W badaniach in vitro wykazano mutagenne działanie (fotomutagenność) tlenku cynku, związane prawdopodobnie ze zdolnością generowania wolnych rodników pod wpływem UV. W badaniach in vitro prowadzonych na tkankach zwierzęcych i ludzkich nie wykazano uszkodzenia chromosomów przez lewomentol. Rakotwórczość Brak danych dotyczących potencjalnego działania rakotwórczego benzokainy, tlenku cynku i lewomentolu. Badania in vitro lewomentolu nie wykazały działania uszkadzającego chromosomy. Wyniki badań epidemiologicznych u ludzi nie wykazały związku między występowaniem raka przełyku a obecnością lewomentolu w papierosach. Wpływ na reprodukcję i rozwój potomstwa Brak danych dotyczących wpływu benzokainy i lewomentolu na reprodukcję i przebieg ciąży u zwierząt. Podawano tlenek cynku szczurom w dawkach 100 lub 200 mg/kg mc./dobę przez 21 dni przed zapłodnieniem oraz w czasie ciąży, co prowadziło do zwiększonej śmiertelności płodów i zmniejszenia urodzeniowej masy ciała potomstwa w grupie zwierząt przyjmujących większą dawkę tlenku cynku.
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gPrzedkliniczne dane o bezpieczeństwie
Toksyczność około- i poporodowa Brak danych odnośnie badań na zwierzętach, dotyczących toksyczności około- i poporodowej benzokainy, tlenku cynku i lewomentolu oraz ich wpływu na ocenę potomstwa. Inne badania toksyczności Tlenek cynku jest związkiem o słabym działaniu drażniącym i niskiej toksyczności po zastosowaniu na skórę, nawet w bardzo dużych stężeniach. W przeciwieństwie do innych pochodnych cynku, tlenek nie ma zdolności wiązania się z keratyną naskórka. W badaniach toksyczności dermalnej przeprowadzonych na zwierzętach tlenek cynku charakteryzował się najlepszą tolerancją spośród badanych związków cynku (chlorek, octan, siarczan, undecylenian, pirytion).
- CHPL leku Pudroderm, zawiesina na skórę, (9,8 mg + 245 mg + 9,8 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Talk Glicerol 99,5% Woda oczyszczona 6.2. Niezgodności farmaceutyczne Nie dotyczy. 6.3. Okres ważności 2 lata 6.4. Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25°C. 6.5. Rodzaj i zawartość opakowania Butelka z polietylenu z dozownikiem i nakrętką. 1 butelka 140 g 6.6. Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Przed zastosowaniem zawartość opakowania należy dokładnie wymieszać przez energiczne wstrząsanie. Wstrząsnąć przed każdym użyciem. Pozostałości leku na skórze zmywa się łatwo bieżącą, ciepłą wodą. Brak szczególnych wymagań odnośnie usuwania pozostałości produktu leczniczego.
- CHPL leku Pudrospan - Puder płynny, zawiesina na skórę, (10 mg + 200 mg + 10 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO PUDROSPAN – Puder płynny, (10 mg + 200 mg + 10 mg)/g, zawiesina na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g zawiesiny na skórę zawiera 10 mg beznokainy (Benzocainum), 200 mg cynku tlenku (Zinci oxidum) i 10 mg mentolu (Mentholum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Zawiesina na skórę. Biała zawiesina o charakterystycznym zapachu.
- CHPL leku Pudrospan - Puder płynny, zawiesina na skórę, (10 mg + 200 mg + 10 mg)/gWskazania do stosowania
4.1. Wskazania do stosowania Produkt leczniczy do stosowania miejscowego w pokrzywce i innych stanach zapalnych skóry przebiegających ze świądem. Pomocniczo w łagodzeniu objawów ospy wietrznej, półpaśca, po ukąszeniach owadów.
- CHPL leku Pudrospan - Puder płynny, zawiesina na skórę, (10 mg + 200 mg + 10 mg)/gDawkowanie
4.2. Dawkowanie i sposób podawania Podanie na skórę. Smarować zmienioną chorobowo powierzchnię skóry 3 do 4 razy na dobę. Przed użyciem wstrząsnąć. Dzieci: Nie należy stosować, ze względu na brak danych.
- CHPL leku Pudrospan - Puder płynny, zawiesina na skórę, (10 mg + 200 mg + 10 mg)/gPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować: na rany, w przypadku otarć skóry, na zmiany sączące; długotrwale; na duże powierzchnie skóry; u małych dzieci, ze względu na ryzyko methemoglobinemii.
- CHPL leku Pudrospan - Puder płynny, zawiesina na skórę, (10 mg + 200 mg + 10 mg)/gSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Unikać kontaktu produktu leczniczego z oczami i błonami śluzowymi. W przypadku dostania się preparatu w okolice oczu, natychmiast przemyć dużą ilością wody.
- CHPL leku Pudrospan - Puder płynny, zawiesina na skórę, (10 mg + 200 mg + 10 mg)/gInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Pudrospan - Puder płynny, zawiesina na skórę, (10 mg + 200 mg + 10 mg)/gWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Nie ustalono bezpieczeństwa stosowania podczas ciąży i laktacji.
- CHPL leku Pudrospan - Puder płynny, zawiesina na skórę, (10 mg + 200 mg + 10 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Sonol (21 mg + 21 mg + 2 mg)/1ml, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml leku zawiera: Substancje czynne Lewomentol (Levomentholum) 21 mg Kwas salicylowy (Acidum salicylicum) 21 mg Tymol (Thymolum) 2 mg Pełny wykaz substancji pomocniczych, patrz punkt 6.1. Substancje pomocnicze o znanym działaniu: glikol propylenowy. 3. POSTAĆ FARMACEUTYCZNA Płyn na skórę.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlWskazania do stosowania
4.1 Wskazania do stosowania Produkt Sonol jest wskazany jako środek pomocniczy do stosowania w leczeniu chorób infekcyjnych skóry.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Młodzież powyżej 12 lat i dorośli: Stosować początkowo 4-5 razy na dobę, gdy nastąpi poprawa 2-3 razy na dobę. Dzieci: Nie stosować u dzieci w wieku poniżej 12 lat. Sposób podawania Płyn na skórę. Produkt przeznaczony wyłącznie do stosowania zewnętrznego. Miejsca swędzące i wykwity na wargach smarować cienko i równomiernie.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na składniki produktu lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować na otwarte rany, błony śluzowe i skórę uszkodzoną. Nie stosować u dzieci poniżej 12 lat. Nie stosować w przypadku rozległych zmian złuszczających (np. w łuszczycy).
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenie i środki ostrożności dotyczące stosowania W przypadku wystąpienia nadwrażliwości na którykolwiek ze składników produktu (utrzymujące się zaczerwienienie skóry) należy przerwać stosowanie produktu i skontaktować się z lekarzem. Ponieważ kwas salicylowy bardzo łatwo wchłania się w przez skórę nie powinien być stosowany na dużych obszarach skóry przez długi czas, szczególnie u dzieci. Tymol podany doustnie wchłania się z jelit i pobudza ruchy robaczkowe. Wydala się przez nerki. Może działać drażniąco na nerki i powodować białkomocz. W ostrych zatruciach występują objawy ze strony przewodu pokarmowego. Glikol propylenowy może powodować podrażnienie skóry.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Nie stosować z innymi preparatami zawierającymi składniki złuszczające, np. rezorcynol, siarkę, ponieważ może wystąpić podrażnienie skóry. Preparatów zawierających kwas salicylowy nie powinno się stosować razem z preparatami przeciwtrądzikowymi lub zawierającymi czynniki pilingujące (np. rezorcynol, siarkę) ze względu na możliwość podrażnienia skóry.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie stosować u kobiet w ciąży, jeśli nie jest to bezwzględnie konieczne. Karmienie piersi? Nie stosować u kobiet karmiących piersią, jeśli nie jest to bezwzględnie konieczne.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Sonol nie ma wpływu na zdolności prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane leku przedstawiono zgodnie z klasyfikacją narządów i układów wg MedDRA oraz częstością występowania: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000); nieznana ( nie może być określona na podstawie dostępnych danych). Zaburzenia skóry i tkanki podskórnej: Częstość nieznana: Podrażnienie skóry.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlPrzedawkowanie
4.9 Przedawkowanie Opisano 1 przypadek intoksykacji kwasem salicylowym u pacjenta z dużymi zmianami łuszczycowymi. Kwas salicylowy łatwo wchłania się przez skórę i przedawkowany wywołuje objawy zatrucia salicylanami objawiające się zawrotami głowy, szumem w uszach, wymiotami, bólami głowy, zaburzeniami świadomości. Po dużych dawkach mogą wystąpić ciężkie zatrucia z objawami porażenia ośrodka oddechowego, gorączką, osłabieniem, kwasicą ketonową. Może również dojść do uszkodzenia centralnego układu nerwowego, układu oddechowego i krążenia. Szczególnie narażone na jego działanie są dzieci.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna, kod ATC: nie przydzielony. Zawarty w produkcie lewomentol posiada właściwości bakteriobójcze, znieczulające i przeciwświądowe. Tymol i kwas salicylowy wzmagają je i zapobiegają namnażaniu się bakterii i potęgują antyseptyczne działanie leku. Tymol posiada właściwości przeciwwirusowe, w tym wykazano jego działanie hamujące na rozwój infekcji wywołanej wirusem opryszczki pospolitej HHV-1 (HSV-1, herpes labialis - opryszczka wargowa).
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Lek bardzo słabo wchłania się przez nieuszkodzoną skórę. Za wyjątkiem kwasu salicylowego pozostałe składniki leku nie są wchłaniane.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach wykazano, że lewomentol działa hepatoksycznie. Podawany szczurom dożołądkowo przez 28 dni powodował uszkodzenie wątroby. W badaniach na zwierzętach wykazano, iż salicylany łatwo przenikają przez łożysko i działają teratogennie. Brak danych dotyczących stosowania preparatów kwasu salicylowego w okresie ciąży i karmienia piersią u ludzi. Potencjalne zagrożenie dla człowieka nie jest znane.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych glikol propylenowy 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w pomieszczeniach suchych, w temperaturze poniżej 25 °C, chronić od światła. 6.5 Rodzaje i zawartość opakowania Butelka (HDPE) zakończona zamknięciem typu roll-on i zakrętką (PP) oraz obejmą z kulką (LDPE, PP) w tekturowym pudełku. Dostępne opakowanie po 8 g. 6.6 Specjalne środki ostrożności dotyczące usuwania produktu leczniczego Brak szczególnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Validol, tabletki do ssania, 60 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Validol, 60 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: mieszanina mentolu i izowalerianianu mentylu 1 tabletka do ssania zawiera 60 mg mieszaniny mentolu (Mentholum) i izowalerianianu mentylu (Menthyli valeras). Substancja pomocnicza o znanym działaniu: 1 tabletka do ssania zawiera 1,158 g sacharozy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka do ssania Okrągłe, białe lub żółto-białe tabletki, o płaskiej powierzchni, z rowkiem i skosem, o zapachu mentolu.
- CHPL leku Validol, tabletki do ssania, 60 mgWskazania do stosowania
4.1 Wskazania do stosowania Łagodzenie stanów napięcia nerwowego oraz uczucia niepokoju. Optymalny efekt działania występuje po 2-4 tygodniach stosowania, dlatego produkt nie powinien być stosowany doraźnie. Jeżeli dolegliwości utrzymują się lub nasilają po 2 tygodniach stosowania, należy zwrócić się do lekarza.
- CHPL leku Validol, tabletki do ssania, 60 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli: 1 tabletka do ssania 3 razy na dobę. Z uwagi na brak doświadczenia dotyczącego stosowania, nie zaleca się stosowania produktu leczniczego u dzieci i młodzieży. Sposób podawania Podanie doustne.
- CHPL leku Validol, tabletki do ssania, 60 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Validol, tabletki do ssania, 60 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania U pacjentów ze zgagą lub z przepukliną rozworu przełykowego dolegliwości mogą się niekiedy nasilić pod wpływem mentolu. W takiej sytuacji należy zaprzestać stosowania produktu. Należy zachować ostrożność u pacjentów z chorobą wrzodową lub zmianami zapalnymi przewodu pokarmowego. Pacjenci z rzadkimi dziedzicznymi zaburzeniami związanymi z nietolerancją fruktozy, zespołem złego wchłaniania glukozy-galaktozy lub niedoborem sacharazy-izomaltazy, nie powinni przyjmować produktu leczniczego.
- CHPL leku Validol, tabletki do ssania, 60 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Produkt leczniczy może nasilać działanie leków uspokajających. Nie podawać z inhibitorami MAO.
- CHPL leku Validol, tabletki do ssania, 60 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Brak wystarczających danych dotyczących stosowania mentolu i izowalerianianu mentylu u kobiet w ciąży. Brak danych dotyczących przenikania mentolu i izowalerianianu mentylu do mleka kobiecego. Nie zaleca się stosowania produktu Validol w okresie ciąży i laktacji.
- CHPL leku Validol, tabletki do ssania, 60 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Ze względu na obecność izowalerianianu mentylu Validol może wywierać niewielki wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Validol, tabletki do ssania, 60 mgDziałania niepożądane
4.8 Działania niepożądane Przy długotrwałym stosowaniu produktu leczniczego mogą pojawić się następujące działania niepożądane, które ustępują samorzutnie po zaprzestaniu stosowania: miejscowy odczyn alergiczny w obrębie jamy ustnej (alergia kontaktowa); zgłaszano reakcje nadwrażliwości na mentol, z objawami bólu głowy, bradykardią, drżeniem mięśniowym, ataksją, wstrząsem anafilaktycznym, wysypką skórną. Brak danych dotyczących częstości występowania działań niepożądanych. Zgłaszanie podejrzewanych działań niepożądanych: Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al.
- CHPL leku Validol, tabletki do ssania, 60 mgDziałania niepożądane
Jerozolimskie 181C, 02-222 Warszawa, tel. 22 49 21 301, faks 22 49 21 309. Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Validol, tabletki do ssania, 60 mgPrzedawkowanie
4.9 Przedawkowanie Brak danych.
- CHPL leku Validol, tabletki do ssania, 60 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki nasenne i uspokajające, kod ATC: brak kodu ATC wg WHO. Validol wykazuje skojarzone działanie kwasu izowalerianowego i mentolu. Prawdopodobnie kwas izowalerianowy wpływa jako agonista na receptory adenozynowe A1, działając hamująco na czynność kory mózgowej, w związku z czym wywiera działanie uspokajające oraz nasenne. Mentol poprzez wpływ na receptory zimna daje uczucie świeżości i hiperwentylacji, przez co wykazuje działanie lekko tonizujące.
- CHPL leku Validol, tabletki do ssania, 60 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Izowalerianian mentylu jako lipofilowa substancja wchłania się szybko, a następnie poprzez działanie esteraz ulega hydrolizie z powstaniem dwóch związków: mentolu oraz kwasu izowalerianowego. Mentol jest głównie wydalany z żółcią. Podstawowym metabolitem jest glukuronian mentylu, który przechodzi do obiegu wewnątrzwątrobowego. Metabolity wydalane z moczem powstają wskutek hydroksylacji mentolu, wydalane są częściowo jako produkty sprzęgania z kwasem glukuronowym. Brak szczegółowych badań na temat metabolizmu kwasu izowalerianowego.
- CHPL leku Validol, tabletki do ssania, 60 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Izowalerianian mentylu Badania toksyczności izowalerianianu mentylu zostały przeprowadzone na myszach, szczurach. LD50 dla izowalerianianu mentylu wynosi 4 g/kg. Jednorazowe podania w dawkach 1.25-11.8 mg/kg nie wykazało efektów toksycznych. Gdy podawano szczurom izowalerianian mentylu przez długi okres, obserwowano zaburzenia motoryki oraz pogorszenie orientacji w terenie. Poza wymienionymi efektami izowalerianian mentylu nie wykazywał negatywnego wpływu na stan zdrowia zwierząt. Badania wykonane na psach wykazały brak wpływu na skład krwi (badano m.in. stężenie hemoglobiny, liczbę leukocytów i erytrocytów). W badaniach tych nie obserwowano również hepatotoksyczności produktu Validol. W podaniach długotrwałych (3 tygodnie) oraz po jednorazowej dawce wykazano bardzo niską toksyczność izowalerianianu mentylu.
- CHPL leku Validol, tabletki do ssania, 60 mgPrzedkliniczne dane o bezpieczeństwie
Mentol W badaniach toksyczności miejscowej na oku królika, mentol powodował poważne uszkodzenie (wynik 9 w skali 1-10) po 24 godzinnej ekspozycji na czynnik drażniący. Podanie 10 mg mentolu na 5 minut powodowało lekkie zamglenie rogówki oraz zwężenie źrenicy. Po podaniu ogólnoustrojowym u szczurów, nie zaobserwowano encefalopatii. Wartość NOEL wynosi < 200 mg/kg. Odnotowane zostały przypadki nadwrażliwości u ludzi związane z używaniem produktów zawierających mentol (np. papierosy mentolowe). Odnotowano również przypadki skurczu krtani oraz zaburzeń ze strony układu nerwowego i pokarmowego u niemowląt, którym podano krople do nosa zawierające mentol. Dopuszczalne dzienne spożycie mentolu jako dodatku do żywności (ADI - ang. Acceptable Daily Intake) wynosi 0 – 4 mg/kg mc./dobę. Kwas izowalerianowy Kwas izowalerianowy, obok kwasu walerianowego oraz walepotriatów, jest jednym z podstawowych składników wyciągu z korzenia kozłka lekarskiego (Valerianae radix).
- CHPL leku Validol, tabletki do ssania, 60 mgPrzedkliniczne dane o bezpieczeństwie
Podawanie szczurom wyciągu z korzenia kozłka lekarskiego przez okres 4-8 tygodni wykazało niską toksyczność.
- CHPL leku Validol, tabletki do ssania, 60 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sacharoza Wapnia stearynian 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze od 8°C do 15°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii Aluminium/PVC w tekturowym pudełku. 10 szt. (1 blister po 10 szt.) 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak specjalnych wymagań.
- CHPL leku Vicks VapoRub, maść, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Vicks VapoRub, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Składnik Ilość w 100 g Lewomentol (Levomentholum) 2.75 g Kamfora racemiczna (Camphora racemica) 5.00 g Olejek eukaliptusowy (Eucalypti aetheroleum) 1.50 g Olejek terpentynowy (Terebinthini aetheroleum a Pino pinastro) 5.00 g Zawiera tymol i olejek cedrowy. Pełen wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść.
- CHPL leku Vicks VapoRub, maść, -Wskazania do stosowania
4.1 Wskazania do stosowania Vicks VapoRub jest maścią stosowaną w objawach podrażnień i stanów zapalnych błony śluzowej nosa i gardła (np. w przebiegu przeziębień): kaszlu, katarze z obrzękiem błon śluzowych nosa i uczuciem utrudnienia oddychania ("zatkanego nosa").
- CHPL leku Vicks VapoRub, maść, -Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Maść do nacierania klatki piersiowej i pleców. Dzięki temu, że substancje czynne produktu leczniczego są lotne, dostają się one jednocześnie do dróg oddechowych podczas aplikacji maści na skórę. Wcierać odpowiednią ilość maści w skórę klatki piersiowej i pleców, czynność tę powtarzać 2 do 3 razy na dobę, jeśli jest potrzeba. Przewiewne ubranie sprzyja skuteczniejszej inhalacji dzięki parującym składnikom lotnym. Dorośli i młodzież w wieku powyżej 12 lat: 1 łyżeczkę maści (około 7,5 g) nakładać na klatkę piersiową i plecy od 2 do 4 razy na dobę. Dzieci w wieku od 5 do 12 lat: ½ łyżeczki maści (około 3,75 g) nakładać na klatkę piersiową i plecy 2 do 3 razy na dobę. Dzieci w wieku poniżej 5 lat: Produktu leczniczego Vicks VapoRub nie zaleca się stosować u dzieci poniżej 5 lat. Sposób podawania Na skórę, wziewna. Dorośli i młodzież w wieku powyżej 12 lat: Wetrzeć maść Vicks VapoRub dokładnie w skórę klatki piersiowej i pleców.
- CHPL leku Vicks VapoRub, maść, -Dawkowanie
Używać przewiewnych ubrań w celu skuteczniejszej inhalacji poprzez parujące składniki lotne maści. Dzieci w wieku od 5 do 12 lat: Delikatnie wetrzeć maść Vicks VapoRub na klatkę piersiową i plecy. Używać lekkich ubrań w celu skuteczniejszej inhalacji poprzez parujące składniki lotne maści. Czas stosowania: Jeśli po upływie 7 dni nie nastąpiła poprawa lub pacjent czuje się gorzej, należy skontaktować się z lekarzem.
- CHPL leku Vicks VapoRub, maść, -Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Czynna astma oskrzelowa lub inne choroby dróg oddechowych oraz stwierdzona nadwrażliwość dróg oddechowych.
- CHPL leku Vicks VapoRub, maść, -Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Pacjenci z następujących grup powinni stosować lek ze szczególną ostrożnością: pacjenci z reakcją nadwrażliwości na perfumy i rozpuszczalniki, pacjenci cierpiący na epilepsję i u których występują drgawki. Nie połykać!!! Nie stosować na uszkodzoną skórę, skaleczenia i błony śluzowe. Nie połykać i nie nakładać bezpośrednio do nosa, oczu, jamy ustnej, na twarz lub szyję. Chronić oczy. Tylko do użytku zewnętrznego. Produkt leczniczy nie jest przeznaczony do sporządzania inhalacji z parą wodną. Nie należy bandażować miejsca nałożenia maści. Nie stosować ciepłych okładów ani żadnego innego rodzaju ciepła. Jeśli po upływie 7 dni nie nastąpiła poprawa lub pacjent czuje się gorzej, należy skontaktować się z lekarzem. Dzieci: Nie zaleca się stosowania u dzieci w wieku poniżej 5 lat.
- CHPL leku Vicks VapoRub, maść, -Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie obserwowano. Istnieje teoretycznie ryzyko wystąpienia interakcji przy jednoczesnym stosowaniu kamfory z innymi lekami obniżającymi próg drgawkowy (np. leki antyhistaminowe, leki zwężające naczynia krwionośne, pochodne piperazyny, amylokaina). Stosowanie produktu leczniczego zgodnie z zaleceniami powoduje minimalną systemową ekspozycję na kamforę i lewomentol (znacznie poniżej stężeń mogących wpływać na ryzyko wystąpienia drgawek).
- CHPL leku Vicks VapoRub, maść, -Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Produktu leczniczego Vicks VapoRub nie należy stosować w czasie ciąży bez konsultacji z lekarzem. Vicks VapoRub nie powinien być stosowany na klatkę piersiową kobiet karmiących piersią ze względu na ryzyko wystąpienia bezdechu u dziecka. Brak danych na temat wpływu na płodność.
- CHPL leku Vicks VapoRub, maść, -Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Vicks VapoRub nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Vicks VapoRub, maść, -Działania niepożądane
4.8 Działania niepożądane Reakcje miejscowe: Zaczerwienienia, podrażnienia skóry, podrażnienie oczu (przez parujące składniki lotne), alergiczne zapalenie skóry, oparzenia kontaktowe (częstość nieznana), reakcje miejscowe spowodowane nadwrażliwością na składniki leku. Podrażnienia lub reakcje alergiczne są zwykle łagodne i występują rzadko. W takich przypadkach należy przerwać stosowanie produktu leczniczego Vicks VapoRub, usunąć pozostałości ręcznikiem papierowym i podjąć właściwe leczenie dla reakcji skórnych. Reakcje ogólnoustrojowe: Ogólnoustrojowe reakcje toksyczne wynikające z przedawkowania leku rozpatrywane są jako nieprawdopodobne (patrz punkt 5.2). Jeśli lek stosowany jest zgodnie z zalecaną drogą podania, ekspozycja ogólnoustrojowa na działanie leku jest niska i nie obserwuje się żadnych działań niepożądanych z nią związanych.
- CHPL leku Vicks VapoRub, maść, -Działania niepożądane
Niewłaściwe zastosowanie: Po przypadkowym spożyciu znaczącej ilości maści Vicks VapoRub obserwowano ostre zatrucia z objawami nudności, wymiotów, bólu brzucha, bólu i zawrotów głowy, uderzeń gorąca, drgawek, a w ciężkich przypadkach porażenia oddychania i śpiączki (Patrz punkt 4.9). W przypadku wystąpienia innych poważnych działań niepożądanych jak skurcz krtani lub drgawki należy natychmiast usunąć maść ze skóry i wezwać lekarza. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al.
- CHPL leku Vicks VapoRub, maść, -Działania niepożądane
Jerozolimskie 181C, 02-222 Warszawa. Tel.: + 48 22 49 21 301. Faks: + 48 22 49 21 309. e-mail: ndl@urpl.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Vicks VapoRub, maść, -Przedawkowanie
4.9 Przedawkowanie Przedawkowanie może powodować podrażnienie skóry. Ogólnoustrojowe reakcje toksyczne wynikające z przedawkowania leku zdarzają się bardzo rzadko. Niewłaściwe zastosowanie Połknięcie maści może powodować objawy ze strony układu pokarmowego, takie jak mdłości, wymioty i biegunka powodowane głównie obecnością kamfory. Leczenie powinno mieć charakter objawowy. Klinicznie znacząca toksyczność kamfory nie była odnotowana poniżej 30 mg/kg masy ciała i jest rzadko spotykana w przedziale 30-50 mg/kg m.c. Po przypadkowym spożyciu znaczącej ilości maści Vicks VapoRub obserwowano ostre zatrucia z objawami nudności, wymiotów, bólu brzucha, bólu i zawrotów głowy, uderzeń gorąca, drgawek, a w ciężkich przypadkach porażenia oddychania i śpiączki. W takich przypadkach należy jak najwcześniej zastosować płukanie żołądka (do godziny), podać węgiel i stosować aspirację.
- CHPL leku Vicks VapoRub, maść, -Przedawkowanie
Pacjenci z ciężkimi objawami zatrucia ze strony układu pokarmowego lub z objawami neurologicznymi powinni być poddani obserwacji oraz leczeniu objawowemu, jeśli będzie taka potrzeba. Nie należy wywoływać wymiotów.
- CHPL leku Vicks VapoRub, maść, -Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Inne leki złożone stosowane w przeziębieniu. Kod ATC: nie przydzielono. Główne składniki aktywne produktu leczniczego to: kamfora, lewomentol oraz olejki eteryczne: eukaliptusowy i terpentynowy. Substancje te znajdują się w użyciu terapeutycznym od czasów starożytnych, a produkt dostępny jest na rynkach całego świata od ponad 40 lat. Kamfora, olejek eukaliptusowy i olejek terpentynowy jako składniki maści do nacierania mają szerokie zastosowanie w łagodzeniu kaszlu i objawów przeziębienia. Lewomentol, używany do łagodzenia objawów przeziębienia przez inhalację lub jako maść, działa miejscowo poprzez rozszerzenie naczyń krwionośnych dając uczucie chłodu oraz działając łagodnie znieczulająco. Zmniejszenie obrzęku błony śluzowej nosa dowiedziono w dwóch badaniach klinicznych (na 92 pacjentach z zapaleniem błony śluzowej nosa).
- CHPL leku Vicks VapoRub, maść, -Właściwości farmakodynamiczne
W jednym badaniu uzyskano poprawę subiektywnych odczuć pacjentów, w drugim poprawę parametrów obiektywnych (ocenianych w badaniu rynomanometrycznym i rynoskopowym). Powyższe dane kliniczne wskazują, że uzyskane udrożnienie dróg oddechowych utrzymuje się przez 8 godzin (efekt uzyskano w badaniu z pojedynczą dawką lub tylko po pierwszej aplikacji, nie był istotny statystycznie podczas dłuższej terapii). Efekt łagodzenia kaszlu uzyskano w 4 badaniach klinicznych. W badaniach wzięło udział 138 osób, zarówno zdrowych ochotników u których indukowano kaszel, jak i pacjentów z objawami ostrego zapalenia górnych dróg oddechowych. Badany produkt silniej hamował kaszel indukowany w porównaniu z kontrolą (wazeliną). U pacjentów z zapaleniem górnych dróg oddechowych udało się istotnie statystycznie zwiększyć przepływ powietrza i objętość wdechową (po pierwszej dawce) oraz uzyskać poprawę objętości wydechowej i oporu oskrzelowego, w porównaniu z kontrolą (wazelina).
- CHPL leku Vicks VapoRub, maść, -Właściwości farmakodynamiczne
Wpływ na zaleganie wydzieliny w drogach oddechowych oceniano w dwóch badaniach klinicznych, w których udział wzięło 42 pacjentów z przewlekłym kaszlem i zapaleniem oskrzeli. W jednym badaniu dowiedziono, że stosowanie produktu wiązało się ze zmniejszeniem gęstości plwociny, poprawą oczyszczania śluzowo-rzęskowego i łagodzeniem objawów, takich jak częstotliwość kaszlu, łatwość odkrztuszania i drożność nosa.
- CHPL leku Vicks VapoRub, maść, -Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Kamfora jest szybko wchłaniana, niezależnie czy podawana jest na skórę czy poprzez inhalację. Podana zewnętrznie trafia do krążenia ogólnego, jest metabolizowana w wątrobie (głównie procesy utleniania i glukuronizacji) i dystrybuowana w tkankach. Nieaktywne metabolity wydalane są przez nerki. Okres półtrwania wynosi 167 minut. Lewomentol, jako substancja mocno lipofilna, szybko przenika przez błony śluzowe. Niezależnie od drogi podania (przewód pokarmowy, skóra, drogi oddechowe) lewomentol obecny w krążeniu ogólnym jest metabolizowany w wątrobie (głównie procesy hydroksylacji i glukoronizacji) do nieaktywnych metabolitów, które są wydzielane przez nerki. 1,8-cineol (eukaliptol), główny składnik olejku eukaliptusowego jest szybko wchłaniany zarówno po podaniu doustnym jak i po podaniu na skórę lub podczas inhalacji. Metabolizowany jest w wątrobie (procesy utleniania i glukoronizacji), a nieaktywne metabolity wydalane są głównie przez nerki.
- CHPL leku Vicks VapoRub, maść, -Właściwości farmakokinetyczne
Niewielka ilość substancji jest wydalana również przez płuca z wydychanym powietrzem. Tmax po podaniu w inhalacji wynosi średnio 18 minut. Okres półtrwania ustalono na 104,6 minut. Badania farmakokinetyczne olejku terpentynowego wykazały, że średnie wchłanianie głównych substancji czynnych (alfa-pinen, beta-pinen i delta-karen) podczas inhalacji wynosi odpowiednio 62, 66 i 68%. Średni okres półtrwania dla tych substancji ustalono na odpowiednio 32, 25 i 42 godziny. Pomiędzy 2 a 5% wchłoniętych z olejku terpentynowego substancji jest wydalana w postaci niezmienionej z wydychanym powietrzem. Należy zwrócić uwagę, że profile farmakokinetyczne opisanych substancji zależą w pewnym stopniu od nośnika, w którym zostały rozpuszczone. Oczekuje się, że wysoce lipofilna baza wazelinowa maści, wstrzyma uwalnianie olejków eterycznych, opóźniając w ten sposób wchłanianie przez skórę, lub w przypadku przypadkowego połknięcia.
- CHPL leku Vicks VapoRub, maść, -Właściwości farmakokinetyczne
Badania farmakokinetyczne wykazały niezwykle niskie stężenia terpenów w krążeniu ogólnym podczas terapeutycznego stosowania produktu leczniczego. Sprawdzano profil farmakokinetyczny kamfory i lewomentolu, po zastosowaniu maści na poziomie przekraczającym klinicznie zalecany. Stężenie w osoczu pozostało niskie, jak również nie nastąpiła żadna kumulacja składników przez czas badań. Te dane zapewniają margines bezpieczeństwa, który powoduje, że jakiekolwiek ogólnoustrojowe działania toksyczne jest mało prawdopodobne.
- CHPL leku Vicks VapoRub, maść, -Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Vicks VapoRub, maść, -Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Tymol Olejek cedrowy Wazelina biała 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 4 lata 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25 °C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Produkt leczniczy w postaci maści dostępny jest w słoiku polipropylenowym z zakrętką polipropylenowo-polietylenową, w tekturowym pudełku. Dostępne opakowania: 50 g, 100 g. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowywania leku do stosowania Brak szczególnych wymagań.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO SALVIASEPT, koncentrat do sporządzania roztworu do płukania gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g produktu zawiera: Syzygium aromaticum L., Merill et L. M. Perry, aetheroleum (olejek goździkowy) 2,0 g mentol (Mentholum) 2,0 g Mentha x piperita L., aetheroleum (olejek miętowy) 1,1 g cineol (Cineolum) 0,6 g Thymus vulgaris L., Thymus zygis Loefl. ex L.; aetheroleum (olejek tymiankowy) 0,3 g Origanum majorana L., aetheroleum (olejek majerankowy) 0,3 g Salvia officinalis L., aetheroleum (olejek szałwiowy) 0,2 g oraz 93,5 g wyciągu płynnego złożonego (extractum liquidum compositum) (1:3,3), z: Matricaria recutita L., flos (koszyczek rumianku) 18,7 cz. Salvia officinalis L., folium (liść szałwii) 18,7 cz. Achillea millefolium L., herba (ziele krwawnika) 18,7 cz. Mentha x piperita L., herba (ziele mięty pieprzowej) 18,7 cz. Thymus vulgaris L., Thymus zygis Loefl. ex L; herba (ziele tymianku) 9,35 cz.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
Foeniculum vulgare Miller subsp. vulgare var. vulgare, fructus (owoc kopru (odmiany gorzkiej)) 9,35 cz. rozpuszczalnik ekstrakcyjny: etanol 70% (V/V). Produkt zawiera etanol 58% (V/V) ± 10%. 3. POSTAĆ FARMACEUTYCZNA Koncentrat do sporządzania roztworu do płukania gardła
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Wskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy przeznaczony jest do tradycyjnego stosowania w wymienionych wskazaniach i jego skuteczność opiera się wyłącznie na długim okresie stosowania i doświadczeniu. Produkt stosuje się tradycyjnie w stanach zapalnych jamy ustnej i gardła.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli: 50 kropli koncentratu rozcieńczyć w ½ szklanki ciepłej wody. Tak przygotowanym roztworem płukać jamę ustną i gardło 3 razy na dobę. Dzieci i młodzież: Stosowanie u dzieci i młodzieży w wieku poniżej 18 lat nie jest zalecane (patrz punkt 4.4). Czas stosowania Produktu nie należy stosować dłużej niż 1 tydzień. Jeśli objawy utrzymują się podczas stosowania produktu leczniczego, należy skonsultować się z lekarzem lub innym wykwalifikowanym pracownikiem służby zdrowia. Sposób podawania Podanie na śluzówkę jamy ustnej oraz dogardłowo.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na rośliny z rodziny astrowatych (Asteraceae, dawniej złożonych Compositae), jasnotowatych (Lamiacae, dawniej wargowych Labiatae), selerowatych (Apiaceae, dawniej baldaszowatych Umbelliferae) (anyż, kminek, seler, kolendra, koper) lub na anetol, balsam peruwiański, olejek mięty pieprzowej lub na mentol. Astma oskrzelowa, ze względu na możliwość wywołania skurczu tchawicy i oskrzeli o różnej intensywności.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ze względu na brak danych nie zaleca się stosowania u dzieci i młodzieży poniżej 18 lat. W przypadku podrażnienia śluzówki jamy ustnej i gardła należy zaprzestać stosowania produktu. Jeśli objawy nasilają się podczas stosowania produktu leczniczego, należy skonsultować się z lekarzem lub innym wykwalifikowanym pracownikiem służby zdrowia.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie zgłoszono.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ze względu na brak wystarczających danych na temat bezpieczeństwa produktu leczniczego nie należy stosować produktu w okresie ciąży oraz karmienia piersią. Płodność Brak danych dotyczących wpływu na płodność.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie wykonano badań wpływu produktu leczniczego na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Działania niepożądane
4.8 Działania niepożądane Działania niepożądane zostały sklasyfikowane według układów i narządów zgodnie z następującą konwencją zgodnie z MedDRA: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), nieznana (częstość nie może być określona na podstawie dostępnych danych) Zaburzenia układu immunologicznego Częstość nieznana: reakcje nadwrażliwości, w tym ciężkie reakcje alergiczne (duszność, obrzęk Quinckego, zapaść naczyniowa, wstrząs anafilaktyczny). Zaburzenia układu nerwowego Częstość nieznana: uczucie pieczenia (przy silniejszym podrażnieniu błony śluzowej jamy ustnej), bóle głowy, drżenie mięśni, ataksja. Zaburzenia serca Częstość nieznana: bradykardia. Zaburzenia żołądka i jelit Częstość nieznana: podrażnienie błony śluzowej jamy ustnej.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Działania niepożądane
Zaburzenia skóry i tkanki podskórnej Częstość nieznana: kontaktowe zapalenie skóry, kontaktowe zapalenie błony śluzowej jamy ustnej, swędzenie, wysypka rumieniowa. Kontaktowe zapalenie błony śluzowej jamy ustnej obserwowano m.in. u pacjentów z zespołem pieczenia jamy ustnej, nawracającym owrzodzeniem jamy ustnej lub reakcją liszajową. W przypadku wystąpienia innych działań niepożądanych, nie wymienionych powyżej, pacjent powinien skonsultować się z lekarzem lub farmaceutą. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Działania niepożądane
Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: ndl@urpl.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Przedawkowanie
4.9 Przedawkowanie Produkt nie jest przeznaczony do stosowania doustnego. Po doustnym podaniu 5-10 ml olejku goździkowego dzieciom w wieku poniżej 2 lat, obserwowano stany zagrażające życiu. Przedawkowanie może prowadzić do depresji ośrodkowego układu nerwowego, zaburzeń układu moczowego, kwasicy z luką anionową, pogorszenia funkcji wątroby, śpiączki, drgawek i zmniejszenia poziomu glukozy we krwi. Leczenie powinno być objawowe i wspomagające. Istnieją doniesienia z literatury o stosowaniu N-acetylocysteiny jako skutecznej odtrutki.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Brak danych.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Brak danych.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Eugenol, główny składnik olejku goździkowego, wykazał niejednoznaczne wyniki w różnych testach genotoksyczności i rakotwórczości. Odpowiednie badania toksyczności reprodukcyjnej, genotoksyczności oraz kancerogenności nie zostały wykonane dla olejku goździkowego. Olejek miętowy w dwóch potwierdzonych badaniach genotoksyczności, teście Amesa oraz teście na komórkach chłoniaka myszy nie wykazał właściwości mutagennych. W innych, niepotwierdzonych testach wykazywał słabe i niespójne działanie genotoksyczne, prawdopodobnie toksykologicznie nieistotne. Istnieje więcej dowodów na potencjał genotoksyczny mentolu, przez co wydaje się, że istnieje rozbieżność pomiędzy olejkiem z mięty pieprzowej i jego najważniejszym składnikiem - mentolem. Jednakże obecne dane wskazują na bardzo słabe lub całkowity brak działania genotoksycznego olejku z mięty pieprzowej.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Przedkliniczne dane o bezpieczeństwie
Olejek tymiankowy nie wykazał działania mutagennego ani uszkadzającego DNA zarówno w teście Amesa (szczepy TA1535, TA1537, TA98, TA100, z lub bez aktywacji metabolicznej) jak i teście Bacillus subtilis rec. Odpowiednie badania toksyczności reprodukcyjnej oraz kancerogenności nie zostały wykonane. Wodny wyciąg z owocu kopru włoskiego badany był testem Amesa na szczepach Salmonella typhimurium TA98 i TA100 i dał wynik negatywny. Badania przeprowadzone na zwierzętach laboratoryjnych wykazały słabe działanie mutagenne anetolu. Ryzyko genotoksyczności związanej z estragolem nie jest uważane za istotne ze względu na fakt, iż w naparach z kopru znajdują się niewielkie jego ilości. Tujon, składnik liścia szałwii, ma działanie neurotoksyczne, wobec tego wskazane jest stosowanie chemotypów o niskiej zawartości tujonu. Dzienne spożycie tujonu 5,0 mg/osobę jest akceptowalne przez maksymalny okres stosowania 2 tygodni.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Przedkliniczne dane o bezpieczeństwie
Badania toksyczności reprodukcyjnej, genotoksyczności oraz kancerogenności nie zostały wykonywane dla przetworów z liści szałwii.
- CHPL leku Salviasept, koncentrat do sporządzania roztworu do płukania gardła, -Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Nie zawiera. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w opakowaniach szczelnie zamkniętych, w temperaturze nie wyższej niż 25°C. 6.5 Rodzaj i zawartość opakowania Butelka ze szkła barwnego z zakrętką polietylenową z pierścieniem gwarancyjnym i kroplomierzem w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO DIP RILIF, (50 mg + 30 mg)/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram żelu zawiera 50 mg ibuprofenu (Ibuprofenum) i 30 mg mentolu (Mentholum). Substancje pomocnicze o znanym działaniu: 1 gram żelu zawiera 100 mg glikolu propylenowego oraz 300 mg etanolu 96%. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel Bezbarwny żel
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Miejscowe leczenie przeciwbólowe i przeciwzapalne. Bóle reumatyczne, w tym bóle stawów spowodowane zmianami zapalnymi i zwyrodnieniowymi, bóle pleców, lumbago (postrzał), bóle mięśniowe, bóle w tkance włóknistej, ścięgnach i więzadłach. Ból i obrzęk wskutek uszkodzeń powysiłkowych, urazów stawów z naderwaniem więzadeł (skręcenia stawów), kontuzji sportowych.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Dorośli i dzieci w wieku powyżej 12 lat: Cienką warstwę żelu nałożyć na bolesne miejsce i delikatnie wmasować aż do wchłonięcia produktu leczniczego. Powtarzać nie częściej niż 3 razy na dobę, zachowując co najmniej 4-godzinną przerwę w stosowaniu. W przypadku tubek zawierających 30 g, 50 g lub 100 g produktu leczniczego należy jednorazowo stosować od 1 do 4 cm żelu, a w przypadku tubek zawierających 15 g leku 4 – 10 cm żelu. Nie stosować dawki większej niż zalecana. Dzieci w wieku poniżej 12 lat: Nie zaleca się stosowania u dzieci w wieku poniżej 12 lat.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne, inne niesteroidowe leki przeciwzapalne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. U osób z astmą, u których występowały w przeszłości napady duszności, wysypka, nieżyt nosa lub inne objawy alergiczne po zastosowaniu kwasu acetylosalicylowego lub innych niesteroidowych leków przeciwzapalnych.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stosować żelu na i w okolicach błon śluzowych oraz w okolicach oczu. Unikać kontaktu ze skórą uszkodzoną lub zmienioną zapalnie. Przerwać stosowanie, jeśli wystąpi pokrzywka lub podrażnienie skóry. Nie stosować pod opatrunkami okluzyjnymi. Jeśli objawy nie ustępują po dwóch tygodniach, pacjenci powinni zasięgnąć porady lekarza. Ponieważ wiadomo, że ibuprofen podany doustnie może nasilać istniejącą niewydolność nerek, pacjenci z chorobami nerek przed zastosowaniem miejscowym leków zawierających ibuprofen takich, jak DIP RILIF, powinni zasięgnąć porady lekarza. Należy dokładnie umyć dłonie po zastosowaniu żelu DIP RILIF, jeśli to nie dłonie są leczone. W przypadku połknięcia żelu należy natychmiast skontaktować się z lekarzem. Wyłącznie do użytku zewnętrznego.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gSpecjalne środki ostrozności
Specjalne ostrzeżenia dotyczące substancji pomocniczych Glikol propylenowy Produkt leczniczy zawiera 100 mg glikolu propylenowego w każdym gramie żelu. Produkt leczniczy może powodować podrażnienie skóry. Etanol Produkt leczniczy zawiera 300 mg etanolu w każdym gramie żelu. Produkt leczniczy może powodować pieczenie uszkodzonej skóry. Produkt leczniczy jest łatwopalny, nie używać w pobliżu otwartego ognia, zapalonego papierosa.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Jednoczesne stosowanie z kwasem acetylosalicylowym lub innymi niesteroidowymi lekami przeciwzapalnymi może zwiększać ryzyko wystąpienia objawów niepożądanych.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak jest danych klinicznych dotyczących stosowania miejscowo, na skórę ibuprofenu i mentolu w okresie ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka/płodu, przebieg porodu lub rozwój pourodzeniowy (patrz 5.3). W oparciu o wiedzę teoretyczną stosowanie produktu leczniczego może opóźnić wystąpienie akcji porodowej i wydłużyć czas trwania porodu. Należy zachować ostrożność w przypadku przepisywaniu produktu leczniczego kobietom w ciąży. Karmienie piersi? Ibuprofen przenika do mleka matki w stosunkowo małym stężeniu i raczej nie powoduje objawów niepożądanych u niemowląt karmionych piersią.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy nie ma wpływu na zdolność do prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gDziałania niepożądane
4.8 Działania niepożądane Do najczęściej występujących działań niepożądanych należą: Zaburzenia skóry i tkanki podskórnej: podrażnienie i zaczerwienienie skóry, wysypka, świąd, pieczenie, pokrzywka, oparzenia w miejscu stosowania; Zaburzenia żołądka i jelit: bóle brzucha, niestrawność; Zaburzenia układu immunologicznego: mogą to być reakcje nadwrażliwości po zastosowaniu ibuprofenu takie jak: a) niespecyficzne reakcje alergiczne, anafilaksja; b) napady astmy, napady duszności, skurcz oskrzeli; c) reakcje skórne różnego typu, wysypka, świąd, pokrzywka, obrzęk naczynioruchowy i znacznie rzadziej, pęcherzyca (włączając martwicę skórną i rumień wielopostaciowy). Zaburzenia skóry i tkanki podskórnej: reakcje nadwrażliwości na światło - częstość występowania nieznana. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gPrzedawkowanie
4.9 Przedawkowanie Wystąpienie objawów niepożądanych po zastosowaniu miejscowym jest mało prawdopodobne. Objawami przedawkowania ibuprofenu są bóle głowy, wymioty, senność, spadek ciśnienia krwi. Poważne zaburzenia elektrolitowe powinny być wyrównane.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Ibuprofen, pochodna kwasu fenylopropionowego jest inhibitorem syntetazy prostaglandynowej wykazującym po zastosowaniu miejscowym działanie przeciwbólowe i przeciwzapalne. Mentol działa na poziomie zakończeń nerwowych skóry. Mentol po zastosowaniu na skórę powoduje zaczerwienienie skóry poprzez wywoływanie łagodnego podrażnienia zmniejsza dolegliwości bólowe mięśni, ścięgien i stawów.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Ibuprofen jest wchłaniany przez skórę w ilości stanowiącej około 5% absorpcji po podaniu doustnym. We krwi osiąga stężenie maksymalne około 0,6 mikrogramów/ml po około 2 godzinach od aplikacji. Mentol stymuluje receptory bodźców urazowych (nocyceptory) powodując wzrost temperatury mięśni powierzchniowych. Stymulacja nocyceptorów inicjuje reakcję, w wyniku której uwalniane są peptydy rozszerzające naczynia krwionośne, co daje efekt podrażnienia skóry.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Prowadzone badania nie wykazały działania o istotnym znaczeniu dla bezpieczeństwa stosowania.
- CHPL leku Dip Rilif, Żel, (50 mg + 30 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Glikol propylenowy Diizopropanolamina Karbomer Etanol 96% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata. Okres ważności po pierwszym otwarciu produktu: 3 miesiące. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowań Tuba aluminiowa z membraną, wewnętrznie pokryta żywicą, zamknięta polietylenową nakrętką, w tekturowym pudełku. Opakowanie zawiera 15 g, 30 g, 50 g lub 100 g żelu. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych zaleceń dotyczących usuwania. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZGO Medispirant stepspray, (10 mg + 10 mg + 20 mg)/g, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu na skórę zawiera 10 mg mentolu (Mentholum), 10 mg kwasu salicylowego (Acidum salicylicum) i 20 mg metenaminy (Methenaminum). Substancja pomocnicza o znanym działaniu: 1 g płynu zawiera 376,04 mg etanolu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Płyn na skórę Roztwór etanolowy, przezroczysty, optycznie jednorodny o zapachu charakterystycznym dla składników.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy przeznaczony jest do stosowania zewnętrznego na skórę, w przypadku nadmiernego pocenia się stóp.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i młodzież w wieku powyżej 12 lat: przez kilka dni spryskiwać stopy płynem, najlepiej wieczorem po umyciu nóg. Sposób podawania Podanie na skórę.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować produktu leczniczego na uszkodzoną skórę. Nie stosować u dzieci w wieku poniżej 12 lat. Nie stosować produktu leczniczego długotrwale i na duże powierzchnie skóry. Nie stosować na błony śluzowe.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy przerwać stosowanie produktu leczniczego przy skłonnościach do uczuleń. Należy unikać kontaktu z błonami śluzowymi oczu, ust i nosa. W razie potrzeby zmyć produkt leczniczy ze skóry lub błon śluzowych wodą. Specjalne ostrzeżenia dotyczące substancji pomocniczych Etanol Ten produkt leczniczy zawiera 376,04 mg alkoholu (etanolu) w każdym 1 g płynu. Produkt leczniczy może powodować pieczenie uszkodzonej skóry. Produkt leczniczy łatwopalny. Nie stosować w pobliżu otwartego ognia, zapalonego papierosa lub niektórych urządzeń (np. suszarki do włosów).
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Dotychczas nie stwierdzono.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ze względu na brak danych dotyczących bezpieczeństwa, nie zaleca się stosowania produktu leczniczego w okresie ciąży i karmienia piersią.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Medispirant stepspray nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gDziałania niepożądane
4.8 Działania niepożądane W trakcie stosowania produktu leczniczego mogą wystąpić reakcje uczuleniowe skóry. W przypadku wystąpienia takich objawów należy zaprzestać stosowania produktu leczniczego. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: +48 22 49 21 301 Fax: +48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gPrzedawkowanie
4.9 Przedawkowanie Brak danych na temat przedawkowania produktu leczniczego stosowanego miejscowo. W przypadku zaobserwowania jakichkolwiek niepokojących objawów należy zaprzestać stosowania produktu leczniczego i skontaktować się z lekarzem.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: środki przeciw nadmiernemu poceniu się Kod ATC: D 11 AX Produkt leczniczy stosowany zewnętrznie na skórę stóp. Zmniejsza nadmierne wydzielanie potu poprzez hamowanie aktywności gruczołów potowych. Likwiduje przykry zapach potu poprzez hamowanie rozwoju bakterii. Działa dezynfekująco, przeciwgrzybiczo, przeciwzapalnie i wysuszająco. Pobudza zakończenia nerwów czuciowych, wywołując uczucie chłodu. Wykazuje łagodne miejscowe działanie znieczulające, zmniejsza dolegliwości objawiające się świądem skóry.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Brak danych.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Przeprowadzone badania aplikacyjne wykazały, że produkt leczniczy nie wywiera efektu drażniącego, ani alergizującego w obrębie skóry poddanej aplikacji, jak i w miejscach odległych.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Etanol 96% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Butelka polietylenowa (HDPE) z pompką rozpylającą, składająca się z materiałów: polipropylen (PP), polietylen (LDPE, LDPE/HDPE, LDPE(EPE)), polioksymetylen (POM), szkło bezbarwne oraz stal w tekturowym pudełku z ulotką dla pacjenta. 1 op. – 100 g 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Reumatol, maść, (15 g + 10 g)/100 gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO REUMATOL, (150 mg + 100 mg)/g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g maści zawiera 150 mg metylu salicylanu (Methylis salicylas) i 100 mg lewomentolu (Levomentholum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść Biała lub jasnożółta maść o charakterystycznym zapachu
- CHPL leku Reumatol, maść, (15 g + 10 g)/100 gWskazania do stosowania
4.1 Wskazania do stosowania Ból i sztywność mięśni oraz stawów, spowodowane zwyrodniającym zapaleniem stawów, przeciążeniem lub urazem. Ból okolicy lędźwiowo-krzyżowej kręgosłupa, spowodowany napięciem mięśni.
- CHPL leku Reumatol, maść, (15 g + 10 g)/100 gDawkowanie
4.2 Dawkowanie i sposób podawania Cienką warstwę maści nałożyć na bolące miejsca na skórze i wmasować. Stosować 3-4 razy na dobę, w zależności od potrzeby.
- CHPL leku Reumatol, maść, (15 g + 10 g)/100 gPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na substancję czynną, salicylany lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie należy stosować maści na otwarte rany oraz na podrażnioną skórę.
- CHPL leku Reumatol, maść, (15 g + 10 g)/100 gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stosować na większą powierzchnię skóry. Nie stosować w postaci okładów, pod opatrunek rozgrzewający. Ostrożnie stosować u pacjentów z zaburzeniami czynności nerek. Osoby z ostrymi schorzeniami nerek przed zastosowaniem powinny zasięgnąć porady lekarza. W przypadku wystąpienia duszności lub innych niepokojących objawów należy przerwać stosowanie leku i bezzwłocznie skontaktować się z lekarzem. W razie wystąpienia podrażnienia skóry należy przerwać stosowanie maści. Jeśli ból utrzymuje się dłużej niż 14 dni i stosowanie maści nie przynosi ulgi, należy porozumieć się z lekarzem. Należy unikać kontaktu maści z okiem, błonami śluzowymi, podrażnioną skórą. Po każdorazowym nałożeniu maści dokładnie umyć ręce. W razie kontaktu maści z błonami śluzowymi lub dostania się do oka, należy starannie przemyć dużą ilością ciepłej wody i w razie nie ustąpienia objawów porozumieć się z lekarzem.
- CHPL leku Reumatol, maść, (15 g + 10 g)/100 gSpecjalne środki ostrozności
Nie stosować u dzieci w wieku poniżej 12 lat.
- CHPL leku Reumatol, maść, (15 g + 10 g)/100 gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji. Nie należy stosować maści u pacjentów otrzymujących leki przeciwzakrzepowe (warfaryna, acenokumarol), gdyż istnieje niebezpieczeństwo wystąpienia krwawienia.
- CHPL leku Reumatol, maść, (15 g + 10 g)/100 gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Nie ustalono bezpieczeństwa stosowania podczas ciąży i laktacji.
- CHPL leku Reumatol, maść, (15 g + 10 g)/100 gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Lek nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO DIP HOT ROZGRZEWAJĄCY krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera: Salicylan metylu (Methylis salicylas) 128 mg Mentol (Mentholum) 59,1 mg Olejek eukaliptusowy (Eucalypti aetheroleum) 19,7 mg Olejek terpentynowy (Terebinthini aetheroleum) (stabilizowany BHT) 14,7 mg Substancje pomocnicze o znanym działaniu: alkohol cetostearylowy, glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem. Jednorodny, biały krem o zapachu mentolu i salicylanu metylu.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy DIP HOT ROZGRZEWAJĄCY stosuje się objawowo w bólach mięśniowych i stawowych, rwie kulszowej: pomocniczo w gośćcu, bólach reumatycznych, stłuczeniach i skręceniach stawów oraz u sportowców po treningu.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Dorośli i młodzież powyżej 12-go roku życia: Nanieść cienką warstwę preparatu na bolące miejsce, delikatnie wmasować. Powtarzać 2-3 razy na dobę. Nie stosować u dzieci poniżej 12-go roku życia.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na salicylany, mentol lub którąkolwiek substancję pomocniczą. Nie stosować u dzieci w wieku poniżej 12 lat.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Lek zawiera lanolinę, alkohol cetostearylowy, i może zawierać BHT (stabilizator stosowany do produkcji olejku terpentynowego). Te składniki mogą powodować miejscowe reakcje skórne (np. kontaktowe zapalenie skóry) lub podrażnienie oczu i błon śluzowych. Unikać kontaktu z oczami i innymi wrażliwymi partiami skóry. Przed użyciem należy wypróbować produkt leczniczy na małej powierzchni skóry, w celu zminimalizowania ryzyka wystąpienia alergii. Nie stosować na uszkodzoną skórę. Przerwać stosowanie produktu leczniczego w przypadku utrzymującego się zaczerwienienia skóry. Po użyciu dokładnie umyć ręce, chyba że są one miejscem stosowania preparatu. U pacjentów cierpiących na astmę oskrzelową może wystąpić odruchowy skurcz oskrzeli, dlatego przed zastosowaniem produktu leczniczego powinni oni upewnić się, czy nie są uczuleni na jego składniki.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gSpecjalne środki ostrozności
W przypadku kontaktu oczu z produktem leczniczym należy je natychmiast przemyć dużą ilością wody i skontaktować się z lekarzem. Jeżeli objawy bólowe nie ustępują, należy skonsultować się z lekarzem. Nie przekraczać zalecanej dawki. Tylko do użytku zewnętrznego.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji W przypadku doustnego przyjmowania leków zmniejszających krzepliwość krwi, stosowanie produktu leczniczego może nasilać ich działanie, dlatego pacjent powinien w tym przypadku zasięgnąć opinii lekarza prowadzącego.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na ciążę i laktację Ze względu na brak wystarczających danych dotyczących bezpieczeństwa stosowania należy rozważyć czy korzyści wynikające z zastosowania produktu leczniczego Dip Hot Rozgrzewający u kobiet w ciąży są większe niż możliwe ryzyko dla płodu. Nie należy stosować produktu leczniczego u kobiet karmiących, szczególnie w obrębie klatki piersiowej (piersi).
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy nie wywiera wpływu na zdolność prowadzenia pojazdów i obsługiwania urządzeń mechanicznych w ruchu.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gDziałania niepożądane
4.8 Działania niepożądane Reakcja alergiczna na salicylany lub mentol (zaczerwienienie skóry, pokrzywka), oparzenia w miejscu stosowania (częstość nieznana - nie może być określona na podstawie dostępnych danych). U osób cierpiących na astmę oskrzelową może wystąpić odruchowy skurcz oskrzeli i w konsekwencji duszność. Zgłaszanie podejrzewanych działań niepożądanych: Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gDziałania niepożądane
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gPrzedawkowanie
4.9 Przedawkowanie Objawów przedawkowania dotychczas nie stwierdzono, jednak w przypadku takiego podejrzenia zaleca się leczenie objawowe.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki stosowane miejscowo w bólach mięśni i stawów Kod ATC: M 02 AC Olejek eukaliptusowy i terpentynowy rozszerzają obwodowe naczynia krwionośne, wywołując miejscowe przekrwienie tkanek i uczucie rozgrzania. Mentol działa doraźnie znieczulająco, wywołuje uczucie rozgrzania a następnie, w miarę narastania stężenia leku w tkankach, zmniejszenie odczuwanego bólu. Salicylan metylu działa miejscowo przeciwzapalnie.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Produkt leczniczy przeznaczony jest do użytku zewnętrznego. Producent nie przeprowadził żadnych badań dotyczących absorpcji i dalszych przemian ustrojowych preparatu.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Nie przeprowadzono badań przedklinicznych preparatu. Bezpieczeństwo stosowania preparatu potwierdza fakt, iż składniki w nim zawarte od kilkudziesięciu lat stosowane są u ludzi.
- CHPL leku Dip Hot Rozgrzewający, krem, (128 mg + 59,1 mg + 19,7 mg + 14,7 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Substancje pomocnicze: Glikol propylenowy Parafina ciekła Alkohol cetostearylowy Cetostearylosiarczan sodowy Lanolina Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie są znane 6.3 Okres ważności 3 lata Okres ważności produktu po pierwszym otwarciu: 18 miesięcy 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowań Tuba aluminiowa, zabezpieczona membraną, z zakrętką z HDPE, o pojemności 15 g, 35g, 67 g, lub 100 g w opakowaniu tekturowym z ulotką informacyjną. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Arthryl Fast, (400 mg + 10 mg)/2 ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda ampułka A zawiera: Glukozaminy siarczan (Glucosamini sulfas) 400 mg w postaci glukozaminy siarczanu z sodu chlorkiem 502,5 mg Lidokainy chlorowodorek (Lidocaini hydrochloridum) 10 mg Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWskazania do stosowania
4.1 Wskazania do stosowania Leczenie łagodnej lub umiarkowanej postaci choroby zwyrodnieniowej stawów kolanowych u pacjentów, u których stosowanie doustne siarczanu glukozaminy jest przeciwwskazane.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zalecane dawkowanie wynosi 1 lub 2 ampułki domięśniowo, 3 razy w tygodniu, przez 4 do 6 tygodni. Glukozamina nie jest zalecana w leczeniu ostrego bólu. Złagodzenie objawów (szczególnie bólu) może nastąpić dopiero po kilku tygodniach leczenia, a w niektórych przypadkach nawet po dłuższym okresie czasu. Produktu leczniczego Arthryl Fast, roztwór do wstrzykiwań nie należy stosować u pacjentów, którzy mogą przyjmować siarczan glukozaminy doustnie. Dzieci i młodzież Nie jest zalecane stosowanie glukozaminy u dzieci i młodzieży w wieku poniżej 18 lat (patrz punkt 4.4). Osoby w podeszłym wieku Nie przeprowadzono badań klinicznych u osób w podeszłym wieku, doświadczenie kliniczne wskazuje, iż nie ma potrzeby dostosowania dawki podczas leczenia pacjentów w podeszłym wieku.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlDawkowanie
Pacjenci z zaburzeniami czynności nerek i (lub) wątroby Nie określono specjalnego dawkowania u pacjentów z zaburzeniami czynności nerek i (lub) wątroby, ponieważ nie przeprowadzono żadnych badań klinicznych w tych grupach pacjentów (patrz także punkt 4.4 oraz 5.2). Sposób podawania Podanie domięśniowe. Zawartość ampułki A (koloru brązowego) należy połączyć w jednej strzykawce z zawartością ampułki B (bezbarwnej). Żółtawy kolor powstałego roztworu nie ma wpływu na skuteczność i bezpieczeństwo stosowania produktu.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na glukozaminę lub lidokainę lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Produkt leczniczy nie może być stosowany u pacjentów z alergią na skorupiaki, gdyż substancja czynna produktu – glukozamina jest otrzymywana z owoców morza. Ze względu na zawartość lidokainy przeciwwskazane jest podawanie produktu leczniczego w postaci roztworu do wstrzykiwań u pacjentów z zaburzeniami rytmu serca, ostrą niewydolnością serca oraz u pacjentów z nadwrażliwością na lidokainę.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy zachować ostrożność w przypadku stosowania produktu leczniczego u pacjentów chorych na astmę, ponieważ osoby te mogą cechować się większą skłonnością do reakcji alergicznej na glukozaminę, co wiąże się z potencjalnym zaostrzeniem objawów chorobowych. Nie przeprowadzono badań klinicznych u chorych z niewydolnością nerek lub wątroby. Profil toksykologiczny i farmakokinetyczny (patrz punkt 5.2) produktu nie wskazuje na konieczność zmiany dawkowania w tych grupach chorych. Jednak u pacjentów z ciężką niewydolnością wątroby lub nerek należy go podawać pod nadzorem lekarza. Zaleca się ostrożność podczas leczenia pacjentów z zaburzeniami tolerancji glukozy. U osób chorych na cukrzycę na początku leczenia może być konieczna ścisła kontrola stężenia glukozy we krwi.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlSpecjalne środki ostrozności
Dzieci i młodzież Produktu leczniczego Arthryl Fast w postaci roztworu do wstrzykiwań nie należy stosować u dzieci i młodzieży w wieku poniżej 18 lat, gdyż nie określono u nich bezpieczeństwa stosowania i skuteczności glukozaminy. Ze względu na zawartość lidokainy należy zachować ostrożność w przypadku stosowania produktu u pacjentów z miastenią, padaczką, zastoinową niewydolnością serca, bradykardią lub niewydolnością układu oddechowego, włącznie z przypadkami, w których podawane są środki znane z interakcji z lidokainą, prowadzące do zwiększenia jej dostępności biologicznej lub wystąpienia efektu addycyjnego (np. fenytoina) albo wydłużenia czasu eliminacji z organizmu (np. w niewydolności wątroby lub nerek, gdy może dojść do akumulacji metabolitów lidokainy). Lidokaina jest metabolizowana w wątrobie i należy zachować ostrożność w przypadku jej stosowania u pacjentów z zaburzeniami czynności wątroby. Pacjentów przyjmujących leki przeciwarytmiczne klasy III (np.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlSpecjalne środki ostrozności
amiodaron) należy ściśle monitorować. Można rozważyć u nich wykonanie EKG, ponieważ podczas przyjmowania leków przeciwarytmicznych klasy III wpływ lidokainy na mięsień sercowy może być nasilony (patrz punkt 4.5). U pacjentów z hipowolemią o różnej etiologii (krwotok, odwodnienie) lub u osób z zaburzeniami powrotu żylnego krwi związanymi np. z wodobrzuszem albo obecnością dużego guza w jamie brzusznej może wystąpić ciężka hipotensja (niedociśnienie tętnicze). Po podaniu lidokainy domięśniowo możliwy jest wzrost stężenia kinazy fosfokreatynowej, co może kolidować z rozpoznaniem ostrego zawału mięśnia sercowego. Wykazano, że lidokaina u zwierząt ma działanie porfirynogenne i należy unikać jej podawania osobom chorym na porfirię. Wstrzyknięcie lidokainy w miejsce objęte procesem zapalnym lub zakażeniem może spowodować osłabienie działania lidokainy.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji produktów leczniczych. Jednak cechy fizykochemiczne i farmakokinetyczne glukozaminy wskazują na niewielką możliwość interakcji. Ponadto stwierdzono, że siarczan glukozaminy nie hamuje ani nie indukuje aktywności żadnego z głównych enzymów CYP450 u ludzi. W rzeczywistości ten związek chemiczny nie konkuruje o mechanizmy wchłaniania i po wchłonięciu nie wiąże się z białkami osocza. Natomiast ze względu na to, że w przemianach metabolicznych uczestniczy jako substancja endogenna wbudowywana w cząsteczki proteoglikanów lub rozkładana niezależnie od układu enzymów cytochromowych, mało prawdopodobne jest, aby wchodził w interakcje z innymi produktami leczniczymi. Dane dotyczące możliwych interakcji produktów leczniczych z glukozaminą są ograniczone, ale notowano zwiększanie się wartości parametru INR podczas stosowania jej z doustnymi antagonistami witaminy K.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlInterakcje
Z tego względu pacjentów leczonych doustnymi antagonistami witaminy K należy ściśle kontrolować podczas rozpoczynania oraz kończenia leczenia glukozaminą. Jednoczesne stosowanie glukozaminy z tetracyklinami może zwiększać ich wchłanianie i stężenie w surowicy, choć znaczenie kliniczne tej interakcji prawdopodobnie jest ograniczone. Steroidowe lub niesteroidowe leki przeciwbólowe albo przeciwzapalne można podawać razem z siarczanem glukozaminy. Leczenie farmakologiczne siarczanem glukozaminy można łączyć z fizykoterapią i ćwiczeniami fizycznymi. Arthryl Fast w postaci roztworu do wstrzykiwań zawiera lidokainę i dlatego uwzględniono możliwość interakcji lidokainy z innymi substancjami czynnymi. Pochodne hydantoiny (np. fenytoina) stosowane w leczeniu drgawek mogą nasilać kardiodepresyjne działanie lidokainy, ale w wyniku indukowania aktywności enzymatycznej mogą także przyspieszać jej metabolizm.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlInterakcje
Nie przeprowadzono szczegółowych badań interakcji lidokainy z lekami przeciwarytmicznymi klasy III; zaleca się jednak zachowanie ostrożności w przypadku jednoczesnego stosowania tych leków (patrz punkt 4.4). Cymetydyna hamuje metabolizm lidokainy, zmniejsza jej klirens wątrobowy i powoduje podwyższenie jej stężenia w osoczu. Leki beta-adrenolityczne mogą hamować metabolizm lidokainy w wątrobie i zwiększać jej działanie toksyczne. Lidokaina w dużych dawkach może nasilić działanie leków rozluźniających mięśnie.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak wystarczających danych klinicznych dotyczących stosowania glukozaminy u kobiet w ciąży. Dostępne badania na zwierzętach są niewystarczające. Glukozaminy nie należy stosować podczas ciąży. Brak odpowiednich danych dotyczących stosowania lidokainy u kobiet w ciąży. Lidokaina przenika przez łożysko. Można przyjąć, że lidokaina zaburza procesy reprodukcji lub zwiększa ilość przypadków wystąpienia wad rozwojowych, czy w jakikolwiek pośredni lub bezpośredni sposób oddziałuje na płód. Jednakże nie przeprowadzono dostatecznych badań ryzyka u ludzi. W przypadku stosowania u kobiet w ciąży należy rozważyć czy oczekiwane korzyści przeważają nad potencjalnym ryzykiem. Karmienie piersi? Nie ma danych dotyczących przenikania glukozaminy do mleka kobiet karmiących. Stosowanie glukozaminy w okresie karmienia piersią nie jest zalecane, gdyż nie ma danych dotyczących bezpieczeństwa noworodków.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWpływ na płodność, ciążę i laktację
Lidokaina przenika w małym stopniu do mleka kobiecego i może powodować wystąpienie reakcji alergicznych u noworodka, dlatego też stosowanie u kobiet karmiących piersią wymaga zachowania ostrożności.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie jest znany istotny wpływ działania glukozaminy na ośrodkowy układ nerwowy lub motoryczny, który mógłby upośledzać zdolność prowadzenia pojazdów i obsługiwania urządzeń mechanicznych. Jednakże zaleca się ostrożność w przypadku bólu głowy, senności, zmęczenia, zawrotów głowy lub zaburzenia widzenia. Wstrzyknięcie lidokainy w obszar ciała związany z prowadzeniem pojazdów i obsługą maszyn powoduje znieczulenie tego miejsca. Należy poinformować pacjentów aby unikali prowadzenia pojazdów i obsługiwania maszyn, aż do czasu kiedy prawidłowe funkcjonowanie tego obszaru ciała zostanie przywrócone.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlDziałania niepożądane
4.8 Działania niepożądane Leczenie systemowe glukozaminą wiązało się z występowaniem działań niepożądanych przedstawionych w poniższej tabeli, gdzie działania niepożądane zostały pogrupowane na podstawie klasyfikacji układów i narządów Med DRA - (SOC) oraz zgodnie z częstością występowania według konwencji MedDRA. Odnotowane reakcje niepożądane mają zazwyczaj charakter łagodny i są przemijające. Specyficzne dla podania domięśniowego są nudności i bardzo rzadko wymioty, które mogą wystąpić z powodu zawartości lidokainy w produkcie leczniczym. Ponadto, podanie w postaci roztworu do wstrzykiwań może czasami powodować reakcje w miejscu wstrzyknięcia (np. ropień i zapalenie tkanki podskórnej). Klasyfikacja układów i narządów MedDRA Bardzo często (≥ 1/10) Często (≥ 1/100 do <1/10) Niezbyt często (≥1/1 000 do <1/100) Rzadko (≥1/10 000 do <1/1000) Bardzo rzadko (< 1/10 000) Częstość nieznana* Zaburzenia układu immunologicznego: reakcje alergiczne (nadwrażliwość) Zaburzenia metabolizmu i odżywiania: niedostateczna kontrola cukrzycy Zaburzenia psychiczne: bezsenność Zaburzenia układu nerwowego: ból głowy, senność, zawroty głowy Zaburzenia oka: zaburzenia widzenia Zaburzenia naczyniowe: uderzenia gorąca Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: astma, zaostrzenie astmy Zaburzenia żołądka i jelit: biegunka, zaparcie, nudności, wzdęcia, ból brzucha, niestrawność, wymioty Zaburzenia wątroby i dróg żółciowych: żółtaczka Zaburzenia skóry i tkanki podskórnej: rumień, świąd, wysypka, wypadanie włosów, obrzęk naczynioruchowy, pokrzywka Zaburzenia ogólne i stany w miejscu podania: zmęczenie, reakcja w miejscu wstrzyknięcia, obrzęk/obrzęki obwodowe Badania diagnostyczne: zwiększenie aktywności enzymów wątrobowych, zwiększenie stężenia glukozy we krwi, wahania wartości międzynarodowego współczynnika znormalizowanego (INR) * Częstość występowania nie może być określona na podstawie dostępnych danych ** Specyficzne dla roztworu do wstrzykiwań Były zgłaszane przypadki hipercholesterolemii, ale związek przyczynowo-skutkowy nie został wykazany.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych: Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02 222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlPrzedawkowanie
4.9 Przedawkowanie Nie są znane przypadki nieumyślnego lub celowego przedawkowania produktu. Na podstawie badań toksyczności ostrej i przewlekłej u zwierząt można stwierdzić, że mało prawdopodobne jest wystąpienie objawów toksyczności nawet po podaniu siarczanu glukozaminy w dawkach do 200-krotnie wyższych niż dawki terapeutyczne. Jednak w przypadku przedawkowania należy zakończyć leczenie i w razie konieczności zastosować leczenie objawowe i standardowe środki wspomagające, np. w celu przywrócenia równowagi wodno-elektrolitowej. Arthryl Fast w postaci roztworu do wstrzykiwań zawiera lidokainę i dlatego uwzględniono objawy i leczenie przedawkowania lidokainy. Przedawkowanie lidokainy może powodować objawy ze strony ośrodkowego układu nerwowego (OUN) i zaburzenia przewodzenia w sercu. W większości przypadków objawy ustępują po odstawieniu lidokainy.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlPrzedawkowanie
Podczas ciężkiego przedawkowania lidokainy mogą wystąpić drgawki, zaburzenia świadomości i śpiączka, zaburzenia układu oddechowego lub bezdech, wstrząs, zaburzenia przewodzenia impulsów w mięśniu sercowym albo blok serca. Leczenie polega na powstrzymaniu drgawek i zapewnieniu odpowiedniej wentylacji tlenem, w razie potrzeby wspomaganej lub kontrolowanej. W leczeniu drgawek należy podać dożylnie diazepam lub krótko działające barbiturany. W przypadku nagłego spadku ciśnienia tętniczego pacjenta należy ułożyć we właściwej pozycji (z głową niżej); należy podać lek obkurczający naczynia krwionośne, najlepiej o działaniu inotropowym, oraz płyny uzupełniające objętość wewnątrznaczyniową. Jeśli wystąpi bradykardia, należy podać atropinę dożylnie, a w przypadku bloku przedsionkowo-komorowego można zastosować orcyprenalinę. W leczeniu ostrego przedawkowania lidokainy dializoterapia ma nieistotne znaczenie.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inne niesteroidowe leki przeciwzapalne i przeciwreumatyczne; Kod ATC: M 01 AX 05. Mechanizm działania Substancja czynna siarczan glukozaminy jest so lą aminomonosacharydu glukozaminy, która fizjologicznie występuje w ludzkim organizmie i łącznie z siarczanami wykorzystywana jest w biosyntezie kwasu hialuronowego płynu maziówkowego oraz glikozaminoglikanów substancji podstawowej chrząstki stawowej. Z tego względu początkowo sugerowano, że siarczan glukozaminy pobudza syntezę glikozaminoglikanów i w ten sposób także proteoglikanów chrząstki stawowej. Niedawno wykazano jednak, że glukozamina hamuje wewnątrzkomórkowy szlak sygnalizacyjny interleukiny 1 (IL-1), a zatem indukowaną przez IL-1 ekspresję genów, co z jednej strony mogłoby potwierdzać jej wpływ na objawy zapalenia kości i stawów (przypuszczalnie związany z wynikającym z tej aktywności łagodnym działaniem przeciwzapalnym) po podaniu we wstrzyknięciu domięśniowym lub drogą doustną, a z drugiej strony możliwość opóźnienia procesu niszczenia struktur stawowych dowiedzioną w długotrwałych badaniach klinicznych z zastosowaniem produktów podawanych doustnie (przypuszczalnie w wyniku zahamowania pobudzanego przez IL-1 wytwarzania mediatorów procesu niszczenia chrząstki).
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWłaściwości farmakodynamiczne
Działanie farmakodynamiczne We wstępnych badaniach in vitro i in vivo wykazano, że podanie zewnątrzpochodnego siarczanu glukozaminy pobudza biosyntezę proteoglikanów, których ilość w zapaleniu kości i stawów jest niewystarczająca, sprzyja wiązaniu siarki w procesie syntezy glikozaminoglikanów i wywiera wpływ troficzny na chrząstkę stawową. Te działania same w sobie powinny zmniejszyć podrażnienie i w ten sposób ograniczyć łagodny stan zapalny stawu towarzyszący zmianom zwyrodnieniowym w zapaleniu kości i stawów. Późniejsze wyniki badań wskazywały na to, że siarczan glukozaminy hamuje również wytwarzanie takich substancji niszczących tkanki, jak rodniki nadtlenkowe, a także aktywność enzymów lizosomalnych, poza enzymami niszczącymi chrząstkę stawową, takimi jak kolagenaza i fosfolipaza A2. Taka aktywność przyczynia się do łagodnego działania przeciwzapalnego obserwowanego in vivo w modelach zwierzęcych, w tym także w doświadczalnych modelach zapalenia kości i stawów.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWłaściwości farmakodynamiczne
Inaczej niż NLPZ, glukozamina nie hamuje bezpośrednio aktywności cyklooksygenaz. Przeciwnie, w nowszych badaniach wykazano, że większość ze wspomnianych powyżej działań metabolicznych, a zatem przeciwzapalnych, jest skutkiem zahamowania wewnątrzkomórkowego przewodzenia impulsu pobudzenia IL-1, jednej z cytokin biorących udział w patogenezie zapalenia kości i stawów oraz w konsekwencji zahamowania indukowanej przez tę cytokinę transkrypcji genów. Faktycznie siarczan glukozaminy może hamować indukowaną przez IL-1 ekspresję genów dla szeregu enzymów o działaniu prozapalnym w tkankach stawu i enzymów sprzyjających niszczeniu chrząstki, takich jak niektóre metaloproteinazy, z agrekanazami włącznie. Zakładany wkład jonów siarki w te farmakodynamiczne działania glukozaminy nie jest w pełni znany, ale wykazano, że siarczan glukozaminy chroni skuteczniej niż inne sole glukozaminy, na przykład chlorowodorek.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWłaściwości farmakodynamiczne
Wszystkie opisane wyżej działania mają korzystny wpływ na procesy degeneracyjne chrząstki leżące u podłoża zapalenia kości i stawów, a także na symptomatykę choroby. Działania te opisano w warunkach in vivo i in vitro w stężeniach mieszczących się w zakresie 10 µM, a w stężeniach wynoszących co najmniej 100 µM są jeszcze silniejsze. Jak podano w punkcie 5.2, ten pierwszy zakres stężeń osiągany jest w osoczu i płynie maziówkowym u pacjentów z zapaleniem kości i stawów długotrwale przyjmujących codziennie siarczan glukozaminy doustnie, natomiast ten drugi (tj. co najmniej 100 µM) osiągany jest po podaniu domięśniowym produktu Arthryl Fast w roztworze do wstrzykiwań, co umożliwia zachowanie dłuższych odstępów między dawkami (3 razy w tygodniu) i złagodzenie objawów choroby przez okres 4-6 tygodni.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWłaściwości farmakodynamiczne
Skuteczność kliniczna i bezpieczeństwo stosowania W decydującym badaniu skuteczności u pacjentów z zapaleniem kości i stawów kolana wykazano, że Arthryl Fast w postaci roztworu do wstrzykiwań domięśniowych może w sposób nieprzerwany łagodzić objawy choroby w czasie kuracji trwającej 4-6 tygodni i jest dobrze tolerowany (patrz punkt 4.8). Średnie nasilenie bólu i niesprawność zaczynają się zmniejszać w ciągu pierwszych dwóch tygodni leczenia, przy czym począwszy od czwartego tygodnia poprawa jest istotna statystycznie i klinicznie (w porównaniu z placebo). Złagodzenie objawów utrzymuje się po zaprzestaniu leczenia.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Po podaniu domięśniowym bezwzględna biodostępność u ludzi wynosi około 93% w porównaniu z podaniem dawki dożylnie. Po podaniu domięśniowym 400 mg glukozaminy znakowanej izotopem 14C szczytowa wartość stężenia związku radioaktywnego ustalona u zdrowych ochotników wynosiła średnio 135±33 µM, tj. była wyższa niż po podaniu doustnym w dawce 1500 mg, gdzie wyniosła 7,2 µM, podobnie jak Cmax u zdrowych ochotników, natomiast średnie stężenie w płynie maziówkowym także mieściło się w zakresie 10 µM, przy czym stosunek stężenia w osoczu do stężenia w płynie maziówkowym wynosił prawie 1:1, co odnosi się również do innych dróg podania. Prawdopodobnie wynika to z tego, że preparat podawany domięśniowo nie ulega efektowi pierwszego przejścia przez wątrobę, który uważany jest za odpowiedzialny za niepełną biodostępność ustrojową glukozaminy u ludzi po podaniu doustnym.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWłaściwości farmakokinetyczne
Umożliwia to zachowanie dłuższych odstępów między dawkami (3 razy w tygodniu) podawanymi domięśniowo w porównaniu z codziennym podawaniem doustnym i krótkotrwałe opanowanie objawów choroby przez 4-6 tygodni. Dystrybucja W badaniach na zwierzętach przeprowadzonych z zastosowaniem glukozaminy znakowanej izotopem 14C wykazano, że po podaniu dożylnym glukozamina szybko znika z krwi i jest wbudowywana w różne tkanki. Niektóre narządy i tkanki, takie jak wątroba, nerki i chrząstka stawowa, wychwytują ją w sposób aktywny. W chrząstce radioaktywność ze znakowanej glukozaminy utrzymuje się długo, przy czym biologiczny okres półtrwania wynosi około 70 godzin. Po domięśniowym podaniu u ludzi glukozaminy znakowanej izotopem 14C profil zależności stężenia osoczowego związku radioaktywnego od czasu był podobny do obserwowanego po podaniu dożylnym, co dodatkowo wskazuje na brak wpływu drogi podania (domięśniowo lub dożylnie) na dystrybucję glukozaminy.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWłaściwości farmakokinetyczne
Objętość dystrybucji glukozaminy po podaniu domięśniowym określona metodą radiometryczną wynosiła u ludzi średnio 9,1 l. Ta wartość – wyższa niż objętość osocza – wskazuje na dystrybucję glukozaminy także w kompartmentach pozanaczyniowych, co oznacza brak różnicy w stosunku do dystrybucji obserwowanej w badaniach na zwierzętach. Glukozamina nie wiąże się z białkami osocza. Zatem bardzo mało prawdopodobna jest możliwość interakcji dotyczących wypierania z miejsc wiązania stosowanych jednocześnie innych leków w znacznym stopniu wiążących się z białkami osocza. Metabolizm Glukozamina jest substancją endogenną wykorzystywaną w metabolizmie chrząstki lub rozkładaną w cyklu Krebsa. Jako aminocukier glukozamina nie jest substratem układu cytochromu P450 (CYP 450) i z tego powodu mało prawdopodobne jest wystąpienie interakcji metabolicznych z innymi lekami podczas klinicznego stosowania glukozaminy.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWłaściwości farmakokinetyczne
Mimo że glukozamina nie jest substratem enzymów układu CYP450, może działać jak inhibitor i (lub) induktor enzymów cytochromowych, wywołując potencjalnie interakcje z innymi lekami na etapie metabolizmu. Żeby wykluczyć ryzyko interakcji wynikających z zahamowania metabolizmu, rekombinowane ludzkie enzymy CYP3A4, 1A2, 2E1, 2C9 i 2D6 inkubowano z krystalicznym siarczanem glukozaminy w stężeniach dochodzących do 3 mM (wyrażonych jako stężenie wolnej zasady), tj. znacznie wyższych niż obserwowane po podaniu w dawkach terapeutycznych u ludzi. Krystaliczny siarczan glukozaminy nie hamował aktywności żadnej z badanych izoform CYP450. Żeby wykluczyć ryzyko interakcji wynikających z pobudzenia metabolizmu, ludzkie hepatocyty inkubowano z krystalicznym siarczanem glukozaminy w stężeniach dochodzących do 3 mM. Produkt leczniczy nie indukował ekspresji mRNA żadnego z badanych enzymów CYP (CYP1A2, 2B6, 2C9, 2C19 i 3A4).
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWłaściwości farmakokinetyczne
Dlatego krystaliczny siarczan glukozaminy nie działa ani jako inhibitor, ani jako induktor badanych ludzkich izoform CYP450, nawet gdy stężenie glukozaminy 300-krotnie przekracza maksymalne wartości obserwowane u ludzi po podaniu krystalicznego siarczanu glukozaminy w dawkach terapeutycznych. Podsumowując, można stwierdzić, że nie są spodziewane żadne znaczące klinicznie interakcje wynikające z zahamowania i (lub) pobudzenia metabolizmu pomiędzy krystalicznym siarczanem glukozaminy a podawanymi jednocześnie lekami będącymi substratami badanych ludzkich izoform CYP450. Eliminacja Po podaniu domięśniowym glukozaminy znakowanej izotopem 14C szacunkowy półokres eliminacji glukozaminy wynosił 42 godziny, co uzasadnia możliwość podawania leku 3 razy w tygodniu, a nie codziennie. Szczególne grupy pacjentów Nie badano farmakokinetyki glukozaminy u pacjentów z niewydolnością nerek lub wątroby.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlWłaściwości farmakokinetyczne
Badania z udziałem pacjentów z zaburzeniami czynności nerek uznano za nieistotne ze względu na niewielki udział nerek w procesie eliminacji glukozaminy. Z podobnej przyczyny nie przeprowadzono badań u osób z zaburzeniami czynności wątroby, biorąc pod uwagę metaboliczne przemiany glukozaminy jako substancji endogennej wstępującej na szlak heksozaminy w procesie biosyntezy glikozaminoglikanów i proteoglikanów, jej rozkład w cyklu Krebsa z pominięciem metabolizmu przy udziale układu CYP450, a zatem praktycznie zerowy udział wątroby w proces eliminacji leku z organizmu. Dlatego, ze względu na zjawiska opisane powyżej oraz w kontekście korzystnego profilu bezpieczeństwa i tolerancji glukozaminy, nie uważa się za konieczną modyfikację dawki u osób z niewydolnością nerek lub wątroby.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Wyniki badań toksykologicznych wskazują na duży margines bezpieczeństwa stosowania produktu leczniczego. Przeprowadzono następujące badania przedkliniczne. Po maksymalnych badanych dawkach wymienionych poniżej nie zauważono lub odnotowano minimalne skutki toksyczne, które były odwracalne oraz nie wykryto objawów toksyczności na narządy docelowe: Badania toksyczności ostrej prowadzono u myszy i szczurów podając dawki dożylnie, domięśniowo i doustnie, z dawką do 5000 mg/kg mc podawaną drogą doustną; Badania toksyczności podostrej prowadzono: a) przez 4 tygodnie u królików podając dożylnie dawki do 80 mg/kg mc.; b) u szczurów podając przez 13 tygodni doustnie dawki do 240 mg/kg mc.; c) u psów podając dożylnie przez 13 tygodni dawki do 300 mg/kg mc.; Badania toksyczności przewlekłej prowadzono: a) przez 52 tygodnie u szczurów podając doustnie dawki do 2700 mg/kg mc.; b) przez 26 tygodni u psów podając doustnie dawki do 2149 mg/kg mc.; Badania embriotoksyczności prowadzono u szczurów i królików podając dawkę do 2500 mg/kg mc., a badania wpływu na rozród – u szczurów podając dawki 2149 mg/kg mc.; Właściwości mutagenne badano in vitro stosując stężenia do 5000 μg/ml oraz in vivo po doustnym podaniu dawki 1592 mg/kg mc.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlPrzedkliniczne dane o bezpieczeństwie
u szczurów i dawki 7169 mg/kg mc u myszy. Podawane dawki były wielokrotnością dawki terapeutycznej stosowanej u ludzi, która wynosi około 20-25 mg/kg mc.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Ampułka A (koloru brązowego) Kwas siarkowy do regulacji pH Woda do wstrzykiwań Ampułka B (bezbarwna) Dietanoloamina Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Należy unikać łączenia produktu leczniczego z innymi produktami leczniczymi podawanymi w postaci wstrzykiwań. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania 6 ampułek A ze szkła oranżowego typu I, zawierających roztwór do wstrzykiwań oraz 6 ampułek B ze szkła bezbarwnego typu I, zawierających rozcieńczalnik, umieszczone w formie z PCV w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące przygotowania produktu leczniczego do stosowania Przed zastosowaniem, zawartość ampułki A (koloru brązowego), zawierającej siarczan glukozaminy i lidokainę, należy połączyć w jednej strzykawce z zawartością ampułki B (bezbarwnej), zawierającej bufor do rozcieńczenia roztworu.
- CHPL leku Arthryl Fast, roztwór do wstrzykiwań, (400 mg + 10 mg)/2 mlDane farmaceutyczne
Z mikrobiologicznego punktu widzenia, powstały roztwór należy zużyć bezpośrednio po przygotowaniu.
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO AESCULAN (62,5 mg + 5 mg)/g, maść doodbytnicza 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g maści zawiera substancje czynne: 62,5 mg wyciągu suchego z Aesculus hippocastanum L., cortex, kora (kora kasztanowca) (40-90:1). Rozpuszczalnik ekstrakcyjny: metanol 90 % (v/v). 5 mg lidokainy chlorowodorku jednowodnego (Lidocaini hydrochloridum monohydratum). Substancje pomocnicze o znanym działaniu: bronopol, lanolina. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść doodbytnicza
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Aesculan stosowany jest tradycyjnie u dorosłych w chorobie hemoroidalnej.
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli: o ile lekarz nie zaleci inaczej, należy za pomocą załączonej kaniuli nałożyć maść na chore miejsce lub wcisnąć do odbytnicy ok. 0,5 - 1,0 g (pasmo maści o długości ok. 2 cm), 2 - 3 razy dziennie, aż do ustąpienia ostrych objawów. Następnie dawkę można zmniejszyć stosując maść raz na dobę. Preparat należy stosować do ustąpienia objawów. Jeżeli po 7 dniach stosowania preparatu nie ma poprawy lub gdy nastąpi zaostrzenie dolegliwości związanych z chorobą hemoroidalną, należy skontaktować się z lekarzem. Sposób podawania Podanie doodbytnicze. Należy umyć ręce po każdorazowym zastosowaniu produktu. Nie określono bezpieczeństwa stosowania preparatu u dzieci i młodzieży. Zastosowanie preparatu u osób poniżej 18 roku życia wymaga wcześniejszej konsultacji z lekarzem.
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nie należy stosować leku Aesculan, jeśli występuje nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Produktu nie należy także stosować u osób uczulonych na amidowe środki miejscowo znieczulające i/lub gdy stwierdzono nadwrażliwość na rośliny z rodziny Asteraceae (dawniej Compositae) np. rumianek.
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku wystąpienia nasilonego krwawienia z odbytu, krwi w stolcu lub silnych dolegliwości bólowych należy skonsultować się z lekarzem. Bronopol i lanolina mogą wywołać miejscowe podrażnienie skóry (zapalenie skóry kontaktowe).
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie zaleca się równoczesnego stosowania doodbytniczo innych leków miejscowo znieczulających. Istnieje teoretyczne ryzyko nasilenia działania preparatów przeciwzakrzepowych przy równoczesnym stosowaniu wyciągu z kasztanowca. Brak bezpośrednich dowodów eksperymentalnych lub klinicznych. Zaleca się, aby pacjenci stosujący wyciąg z kasztanowca równocześnie z preparatami przeciwzakrzepowymi, np. warfaryną, dokładnie obserwowali występujące objawy w celu wykrycia ewentualnych oznak nasilonego krwawienia. Brak doniesień o przypadkach klinicznych.
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Nie wykonano kontrolowanych badań klinicznych u kobiet w ciąży i kobiet w okresie laktacji. Preparat może być stosowany po uprzedniej konsultacji z lekarzem.
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Aesculan nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gDziałania niepożądane
4.8 Działania niepożądane Dotychczas nie stwierdzono występowania działań niepożądanych preparatu Aesculan. Użycie miejscowe preparatów z lidokainą może powodować sporadycznie wystąpienie reakcji uczuleniowej, rzadko wstrząs anafilaktyczny. Olejek eteryczny rumiankowy może wywołać reakcje alergiczne (mogą być spóźnione). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gDziałania niepożądane
48 22 49 21 301, fax 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gPrzedawkowanie
4.9 Przedawkowanie Nie ma doniesień na temat przedawkowania produktu leczniczego.
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna (kod ATC): jeszcze nieprzydzielony. Produkt leczniczy Aesculan jest maścią doodbytniczą stosowaną w łagodzeniu objawów choroby hemoroidalnej występujących w pierwszej fazie choroby, charakteryzującej się występowaniem słabo nasilonych objawów bólowych i świądu. Skuteczność preparatu w wymienionych wskazaniach opiera się wyłącznie na długim okresie stosowania w lecznictwie i doświadczeniu. Przyjmuje się, że preparat wykazywać będzie działanie miejscowo znieczulające oraz łagodne przeciwzapalne i ściągające.
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Nie przeprowadzono badań farmakokinetycznych produktu leczniczego Aesculan.
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Aesculan jest produktem leczniczym tradycyjnie stosowanym od 1965 r. Brak danych przedklinicznych o bezpieczeństwie stosowania. Brak badań oraz danych literaturowych na temat toksyczności reprodukcyjnej, genotoksyczności oraz karcynogenności wyciągu z kory kasztanowca. Istnieją dane świadczące o tym, że powstający u szczura i prawdopodobnie u człowieka metabolit lidokainy, 2,6-ksylidina, może wywierać działanie mutagenne. Dane te uzyskano w badaniach in vitro, w których stosowano ten metabolit w bardzo dużych, zbliżonych do toksycznych stężeniach. Jak dotąd brak danych wskazujących na to, że substancja macierzysta – lidokaina, również działa mutagennie. W badaniu, dotyczącym działania rakotwórczego, przeprowadzonym u szczurów z zastosowaniem 2,6-ksylidyny, w testach o wysokiej czułości (przezłożyskowa ekspozycja i leczenie zwierząt po ich urodzeniu się, przez 2 lata bardzo dużymi dawkami), zaobserwowano występowanie złośliwych i łagodnych nowotworów w jamach nosowych (w małżowinie nosowej sitowej).
- CHPL leku Aesculan, maść doodbytnicza, (62,5 mg + 5 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Tanina Olejek eteryczny rumiankowy Makrogol 300 Wazelina biała Lanolina Parafina ciekła Bronopol Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie stwierdzono. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze nie wyższej niż 25°C. 6.5 Rodzaj i zawartość opakowania Tuba aluminiowa, zawierająca 30 g maści, z membraną wykonaną z aluminium i zakrętką polietylenową HDPE wraz z dołączoną kaniulą w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Przed pierwszym użyciem należy przebić odwrotną stroną zakrętki membranę zabezpieczającą tubę. Przed aplikacją produktu leczniczego nakręcić na końcówkę tuby kaniulę.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Dentinox N, 15 % + 0,34% + 0,32%, żel do stosowania na dziąsła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 10g żelu zawiera: Chamomillae tinctura (nalewka z rumianku) (1:4-4,5) 1500 mg Ekstrahent etanol 70% (V/V) Lidocaini hydrochloridum (lidokainy chlorowodorek) 34mg Macrogoli aether laurilicum (makrogolu eter laurylowy) 32 mg Zawartość etanolu w produkcie max 9,5% Substancje pomocnicze o znanym działaniu: glikol propylenowy 1500 mg, sorbitol ciekły niekrystalizujący 1000 mg. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel do stosowania na dziąsła.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Wskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy tradycyjnie stosowany w wymienionych wskazaniach, którego skuteczność opiera się wyłącznie na długim okresie stosowania i doświadczeniu. Produkt leczniczy tradycyjnie stosowany w łagodzeniu dolegliwości związanych z bolesnym wyrzynaniem się zębów mlecznych (podrażnienia dziąseł i dolegliwości bólowe). W przypadku pojawienia się silniejszego zaczerwienienia lub obrzęku dziąseł oraz w razie wystąpienia reakcji nadwrażliwości na skórze lub błonach śluzowych należy skontaktować się z lekarzem. To samo odnosi się do wystąpienia wtórnych dolegliwości towarzyszących.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Stosować krótkotrwale w przypadku pojawienia się ostrych objawów ząbkowania. Produkt leczniczy Dentinox N nie powinien być stosowany u niemowląt poniżej 3 miesiąca życia. Produkt leczniczy Dentinox N nie powinien być stosowany również u niemowląt poniżej 12 miesiąca życia, jednocześnie leczonych środkami wywołującymi methemoglobinemię. Sposób podawania Podanie na dziąsła. Smarować dziąsła niewielką ilością żelu (wielkości ziarnka grochu) przy pomocy czystego palca lub bawełnianego patyczka i lekko wmasować. Ta czynność powinna być powtarzana 2-3 razy dziennie, zwłaszcza po jedzeniu lub po wykonaniu zabiegów higienicznych w jamie ustnej przed pójściem spać. Jeśli po upływie 7 dni nie nastąpiła poprawa lub pacjent poczuje się gorzej, należy zwrócić się do lekarza. Okres podawania Produkt leczniczy Dentinox N powinien być stosowany tylko w razie konieczności.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Dawkowanie
Żel na dziąsła Dentinox N może być stosowany przez cały okres wyrzynania się zębów mlecznych. To samo dotyczy wyrzynania się zębów trzonowych. Należy również zwrócić uwagę na informacje zawarte w punkcie „Wskazania do stosowania”.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nietolerancja rumianku lub innych roślin z rodziny Asteraceae, lidokainy lub podobnych środków miejscowo znieczulających (typu amidowego). Reakcje nadwrażliwości na rumianek (np. kontaktowe zapalenie skóry) są bardzo rzadkie. Reakcja krzyżowa może wystąpić u ludzi uczulonych na rośliny z rodziny Asteraceae (np. bylica). Ze względu na zawartość sorbitolu, lek nie powinien być używany przez pacjentów cierpiących na rzadką wrodzoną nietolerancję fruktozy. Produkt leczniczy Dentinox N nie powinien być stosowany u niemowląt poniżej 3 miesiąca życia. Produkt leczniczy Dentinox N nie powinien być stosowany również u niemowląt poniżej 12 miesiąca życia, jednocześnie leczonych środkami wywołującymi methemoglobinemię.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Unikać kontaktu z oczami. Po przypadkowym kontakcie leku z oczami należy przemyć je obficie wodą lub solą fizjologiczną. Ze względu na zawartość glikolu propylenowego, po naniesieniu produktu leczniczego Dentinox N na błony śluzowe jamy ustnej, może wystąpić miejscowe podrażnienie. W przypadku pojawienia się silniejszego zaczerwienienia lub obrzęku dziąseł oraz w razie wystąpienia reakcji nadwrażliwości na skórze lub błonach śluzowych należy skontaktować się z lekarzem. To samo odnosi się do wystąpienia wtórnych dolegliwości towarzyszących. Należy zachować ostrożność u pacjentów z wrodzoną lub nabytą methemoglobinemią bądź u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej, z powodu zwiększonego ryzyka polekowej methemoglobinemii.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Specjalne środki ostrozności
U noworodków i niemowląt poniżej 3 miesiąca życia zaobserwowano przemijające i nieistotne klinicznie zwiększenie stężenia methemoglobiny w osoczu, trwające do 12 godzin po zastosowaniu produktów leczniczych zawierających lidokainę. Ze względu na to produkt leczniczy Dentinox N nie powinien być stosowany u niemowląt poniżej 3 miesiąca życia (patrz punkt 4.3). To samo dotyczy niemowląt poniżej 12 miesiąca życia, jednocześnie leczonych środkami wywołującymi methemoglobinemię. Każde 10 g żelu zawiera: 1 g sorbitolu (co odpowiada 0,25 g fruktozy), tj. mniej niż 0,1 jednostki chlebowej. Wartość kaloryczna: 2,6 kcal/g sorbitolu. Ze względu na zawartość sorbitolu, lek nie powinien być używany przez pacjentów cierpiących na rzadką wrodzoną nietolerancję fruktozy. Lek zawiera małe ilości etanolu (alkoholu), mniej niż 100 mg na dawkę.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie zaleca się jednoczesnego stosowania z innymi środkami miejscowo znieczulającymi.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Lek przeznaczony jest dla dzieci, jednak w przypadku zastosowania go przez osobę dorosłą brak danych dotyczących bezpieczeństwa stosowania podczas ciąży oraz w okresie karmienia piersią, dlatego nie zaleca się stosowania leku w ciąży oraz w okresie karmienia piersią.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie dotyczy.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Działania niepożądane
4.8 Działania niepożądane Mogą pojawić się reakcje alergiczne szczególnie związane z zawartością lidokainy. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa Tel. (22) 49 21 301, Faks (22) 49 21 309 e-mail: ndl@urpl.gov.pl
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Przedawkowanie
4.9 Przedawkowanie Nie stwierdzono przypadków przedawkowania produktu leczniczego.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: kod ATC: A01AD11
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Brak danych.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak danych.
- CHPL leku Dentinox N, Żel do stosowania na dziąsła, 15% + 0,34% + 0,32%Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych karbomer (934 P) lewomentol wersenian dwusodowy sodu wodorotlenek 10% polisorbat 20 glikol propylenowy sól sodowa sacharyny sorbitol ciekły niekrystalizujący woda oczyszczona ksylitol 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 5 lat 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Tuba aluminiowa z zakrętką polietylenową w tekturowym pudełku. Wielkość opakowania: 10 g. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO DEPO-MEDROL Z LIDOKAINĄ, (40 mg + 10 mg)/ml, zawiesina do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda fiolka zawiera 40 mg metyloprednizolonu octanu (Methylprednisoloni acetas) oraz 10 mg lidokainy chlorowodorku jednowodnego (Lidocaini hydrochloridum monohydricum). Substancje pomocnicze o znanym działaniu Depo-Medrol z lidokainą, (40 mg +10 mg)/ml, zawiesina do wstrzykiwań zawiera 8,7 mg alkoholu benzylowego w każdym 1 ml, co odpowiada 8,7 mg/ml. Pełny wykaz substancji pomocniczych: patrz punkt 6.1 3. POSTAĆ FARMACEUTYCZNA Zawiesina do wstrzykiwań.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWskazania do stosowania
4.1 Wskazania do stosowania Glikokortykosteroidy powinny być stosowane jedynie jako terapia objawowa. Metyloprednizolonu octan z lidokainą jest wskazany do krótkotrwałego podawania miejscowego jako terapia uzupełniająca w okresie ostrego epizodu lub zaostrzenia w następujących schorzeniach: zapalenie błony maziowej w przebiegu choroby zwyrodnieniowej stawów reumatoidalne zapalenie stawów pourazowa choroba zwyrodnieniowa stawów ostre i podostre zapalenie kaletki maziowej zapalenie nadkłykcia ostre nieswoiste zapalenie pochewki ścięgna ostre dnawe zapalenie stawów Metyloprednizolonu octan z lidokainą może mieć również zastosowanie w leczeniu guzów torbielowatych, zapaleń rozścięgien lub zapaleń ścięgien (ganglionów).
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDawkowanie
4.2 Dawkowanie i sposób podawania Depo-Medrol z lidokainą podaje się okołostawowo lub dostawowo (patrz punkt 4.4). Metyloprednizolonu octanu z lidokainą nie należy rozcieńczać ani mieszać z innymi roztworami ze względu na możliwe niezgodności fizyczne. Produkty lecznicze do podawania pozajelitowego należy przed podaniem sprawdzić czy nie zawierają cząstek stałych i nie zmieniły zabarwienia, o ile pozwalają na to roztwór i pojemnik. W przypadku stosowania fiolek wielodawkowych, należy zachować szczególne środki ostrożności aby zapobiec zanieczyszczeniu zawartości fiolki (patrz punkt 4.4). 1. Leczenie metyloprednizolonem octatu z lidokainą nie eliminuje potrzeby zastosowania innych leków. Chociaż ta metoda leczenia prowadzi do złagodzenia objawów, nie zapewnia pod żadnym względem wyleczenia, a hormon nie wpływa na przyczynę zapalenia. 1.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDawkowanie
Reumatoidalne zapalenie stawów i choroba zwyrodnieniowa stawów Wielkość dawki metyloprednizolonu do podania dostawowego zależy od wielkości stawu i ciężkości leczonego stanu u danego pacjenta. W przypadkach schorzeń przewlekłych wstrzyknięcia można powtarzać w odstępach od jednego do pięciu lub więcej tygodni, zależnie od stopnia zmniejszenia objawów uzyskanego dzięki podaniu pierwszego wstrzyknięcia. Dawki metyloprednizolonu w poniższej tabeli podano orientacyjnie: Wielkość stawu Duży Średni Mały Przykłady: Stawy kolanowe Stawy skokowe Stawy barkowe Stawy łokciowe Nadgarstki Stawy śródręczno-paliczkowe Stawy międzypaliczkowe Stawy mostkowo-obojczykowe Stawy barkowo-obojczykowe Zakres dawkowania metyloprednizolonu od 20 do 80 mg od 10 do 40 mg od 4 do 10 mg Zaleca się, aby przed wykonaniem wstrzyknięcia dostawowego dokładnie zapoznać się z anatomią danego stawu.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDawkowanie
Aby uzyskać optymalne działanie przeciwzapalne, wstrzyknięcie należy wykonać do przestrzeni maziówkowej. Z zastosowaniem jałowej techniki typowej dla wykonywania nakłucia lędźwiowego, należy szybko wprowadzić do przestrzeni maziówkowej jałową igłę rozmiaru od 20 do 24 (założoną na suchą strzykawkę). W celu sprawdzenia, czy igła została wprowadzona do przestrzeni stawowej, należy wykonać aspirację tylko kilku kropel płynu stawowego. Wstrzyknięcie do każdego stawu wykonuje się w miejscu, w którym jama maziówkowa znajduje się najbardziej powierzchniowo i jest w największej mierze wolna od dużych naczyń i nerwów. Po wprowadzeniu igły w miejsce wstrzyknięcia wyjmuje się strzykawkę, do której wykonano aspirację, i zastępuje ją drugą strzykawką zawierającą pożądaną ilość metyloprednizolonu octanu z lidokainą. Następnie wykonuje się aspirację niewielkiej ilości płynu stawowego, aby upewnić się, czy igła nadal znajduje się w przestrzeni maziówkowej.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDawkowanie
Po wykonaniu wstrzyknięcia należy kilka razy łagodnie poruszyć stawem, co pomaga w wymieszaniu zawiesiny z płynem stawowym. Miejsce wstrzyknięcia przykrywa się następnie niewielkim, jałowym opatrunkiem. Właściwymi miejscami wykonywania wstrzyknięć dostawowych są stawy kolanowe, skokowe, nadgarstkowe, łokciowe, barkowe, międzypaliczkowe i biodrowe. Wprowadzenie igły do stawu biodrowego jest często trudne; należy uważać, aby nie przebić dużych naczyń krwionośnych, które przebiegają w tej okolicy. Stawy niedostępne anatomicznie, takie jak stawy kręgosłupa i stawy krzyżowo-biodrowe, w których brak jest przestrzeni maziówkowej nie są odpowiednim miejscem do wykonania wstrzyknięcia. Niepowodzenia leczenia najczęściej wynikają z tego, że nie udało się podać leku do przestrzeni stawowej, chociaż w niektórych przypadkach leczenie może nie powieść się również pomimo prawidłowego wykonania wstrzyknięcia do jamy stawowej potwierdzonego aspiracją płynu.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDawkowanie
Leczenie miejscowe nie wpływa na podstawowy proces chorobowy, w związku z czym zawsze, gdy jest to możliwe, należy je uzupełnić fizykoterapią i korekcją ortopedyczną. 2. Zapalenie kaletki maziowej Należy starannie oczyścić obszar wokół miejsca wstrzyknięcia i w razie potrzeby zastosować znieczulenie miejscowe. Do kaletki stawowej wprowadza się jałową igłę o rozmiarze od 20 do 24 założoną na suchą strzykawkę, po czym aspiruje się płyn. Igłę należy pozostawić w miejscu a strzykawkę wymienić na kolejną, zawierającą pożądaną dawkę produktu. Po wykonaniu wstrzyknięcia należy wyjąć igłę i nałożyć niewielki opatrunek. 3. Pozostałe stany: ganglion, zapalenie ścięgna, zapalenie nadkłykcia W leczeniu, takich stanów jak zapalenie ścięgna lub zapalenie pochewki ścięgna, po zastosowaniu odpowiedniego środka antyseptycznego, należy uważać, aby wprowadzić zawiesinę do pochewki ścięgna, a nie do samej jego tkanki. Ścięgno łatwiej jest wyczuć dotykiem w pozycji rozciągniętej.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDawkowanie
W przypadku leczenia zapalenia nadkłykcia należy ostrożnie wyznaczyć granice obszaru największej bolesności i wstrzyknąć zawiesinę do tej okolicy. W przypadku ganglionów pochewek ścięgna zawiesinę należy wstrzyknąć bezpośrednio do torbieli. W wielu przypadkach, pojedyncze wstrzyknięcie produktu znacznie zmniejsza wielkość torbieli stawowej, a nawet może spowodować jej zniknięcie. Zależnie od ciężkości leczonego stanu, podawane dawki mogą wynosić od 4 do 30 mg. W leczeniu stanów nawracających lub przewlekłych konieczne może być powtórne wykonanie wstrzyknięcia. Każde wstrzyknięcie należy wykonywać w warunkach jałowych.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlPrzeciwwskazania
4.3 Przeciwwskazania Stosowanie metyloprednizolonu octanu z lidokainą jest przeciwwskazane: u pacjentów z nadwrażliwością na metyloprednizolon lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, u pacjentów z nadwrażliwością na lidokainę lub inne leki miejscowo znieczulające typu amidowego, u pacjentów z układowymi zakażeniami grzybiczymi, w podaniu dooponowym (dokanałowym), w podaniu donaczyniowym (np. dożylnym), w podaniu domięśniowym, w podaniu nadtwardówkowym, w podaniu do nosa i gałki ocznej, a także do innych miejsc (skóra pokrywająca czaszkę, jama ustno-gardłowa, zwój klinowo-podniebienny), u wcześniaków i noworodków (patrz punkt 4.4).
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt zawiera alkohol benzylowy. Zawartość alkoholu benzylowego wynosi 8,7 mg w 1ml fiolce. Po wstrzyknięciu do tkanki nerwowej lub w jej pobliżu alkohol benzylowy może wykazywać toksyczne działanie na tę tkankę. GRUPY ZWIĘKSZONEGO RYZYKA Konieczna jest obserwacja kliniczna i zastosowanie jak najkrótszego okresu leczenia u pacjentów należących do następujących grup zwiększonego ryzyka: Pacjenci z cukrzycą: ujawnienie się cukrzycy utajonej lub zwiększenie zapotrzebowania na insulinę lub doustne leki przeciwcukrzycowe. Pacjenci z nadciśnieniem: nasilenie nadciśnienia tętniczego. Zaburzenia metabolizmu i odżywiania Kortykosteroidy, w tym metyloprednizolon, mogą zwiększać stężenie glukozy we krwi, prowadzić do pogłębienia istniejącej uprzednio cukrzycy oraz zwiększać ryzyko wystąpienia cukrzycy u osób długotrwale przyjmujących kortykosteroidy.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Zaburzenia psychiczne Pacjenci z chorobami psychicznymi w wywiadzie: stosowanie glikokortykosteroidów może doprowadzić do pogorszenia istniejącej niestabilności emocjonalnej lub skłonności psychotycznych. W trakcie stosowania systemowych steroidów mogą wystąpić potencjalnie ciężkie psychiatryczne reakcje niepożądane. Objawy pojawiają się zwykle w ciągu kilku dni lub tygodni od rozpoczęcia leczenia. Większość reakcji ustępuje po zmniejszeniu dawki lub odstawieniu produktu, ale może być konieczne podjęcie właściwego leczenia. Po odstawieniu kortykosteroidów zgłaszano zaburzenia psychotyczne, ale częstość przypadków nie jest znana. Pacjentów i (lub) opiekunów należy zachęcać, aby kontaktowali się z lekarzem w przypadku wystąpienia u pacjenta objawów psychotycznych, zwłaszcza w przypadku podejrzenia nastroju depresyjnego lub myśli samobójczych.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Pacjenci i (lub) opiekunowie powinni być poinformowani o możliwości wystąpienia ewentualnych zaburzeń psychicznych w trakcie lub bezpośrednio po zakończeniu zmniejszania dawki/odstawiania kortykosteroidów systemowych. Wpływ na układ nerwowy Należy zachować ostrożność podczas stosowania kortykosteroidów u pacjentów z zaburzeniami przebiegającymi z drgawkami. Należy zachować ostrożność podczas stosowania kortykosteroidów u pacjentów z miastenią (patrz również ostrzeżenie o miopatii w punkcie dotyczącym wpływu na układ mięśniowo-szkieletowy). Odnotowano przypadki tłuszczakowatości nadtwardówkowej u pacjentów przyjmujących kortykosteroidy, zwykle w przypadku długotrwałego stosowania dużych dawek. Wpływ na narząd wzroku Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów. Centralna chorioretinopatia surowicza może prowadzić do odwarstwienia siatkówki. Długotrwałe stosowanie kortykosteroidów może prowadzić do rozwoju zaćmy tylnej podtorebkowej i zaćmy jądrowej (w szczególności u dzieci), wytrzeszczu oczu lub zwiększenia ciśnienia wewnątrzgałkowego, co może prowadzić do jaskry z możliwym uszkodzeniem nerwów wzrokowych, a także sprzyjać rozwojowi wtórnych zakażeń oczu wywoływanych przez grzyby lub wirusy. Należy uważnie stosować kortykosteroidy u pacjentów z opryszczką oczną lub półpaścem ocznym ze względu na ryzyko perforacji rogówki.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Wpływ na serce Ze względu na niekorzystny wpływ glikokortykosteroidów na układ sercowo-naczyniowy, co obejmuje dyslipidemię i nadciśnienie tętnicze, pacjenci z istniejącymi czynnikami ryzyka sercowo-naczyniowego mogą być narażeni na dodatkowy wpływ na układ sercowo-naczyniowy w przypadku stosowania wysokich dawek i długotrwałego leczenia. W związku z tym, takim pacjentom kortykosteroidy należy podawać z zachowaniem ostrożności i należy uwzględnić modyfikację ryzyka oraz, jeśli to konieczne, dodatkowe monitorowanie układu sercowo-naczyniowego. W przypadkach zastoinowej niewydolności serca należy zachować ostrożność przy stosowaniu układowych kortykosteroidów i podawać je wyłącznie, jeśli jest to absolutnie niezbędne. Wpływ na układ naczyniowy Podczas stosowania kortykosteroidów zgłaszano występowanie zakrzepicy, w tym żylnej choroby zakrzepowo-zatorowej.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
W związku z tym kortykosteroidy powinny być stosowane ostrożnie u pacjentów, u których występują zaburzenia zakrzepowo-zatorowe lub, którzy mogą być predysponowani do ich wystąpienia. Należy zachować ostrożność podczas stosowania kortykosteroidów u pacjentów z nadciśnieniem tętniczym. Zaburzenia endokrynologiczne Jeżeli u pacjentów poddawanych leczeniu kortykosteroidami wystąpi silny stres, wskazane jest zwiększenie dawkowania szybko działających kortykosteroidów przed, w okresie trwania i po zakończeniu sytuacji stresowej. Długotrwałe podawanie dawek terapeutycznych kortykosteroidów może prowadzić do zahamowania osi podwzgórzowo-przysadkowo-nadnerczowej (PPN) (wtórna niedoczynność kory nadnerczy). Stopień i czas trwania wywołanej niedoczynności nadnerczy są zmienne u poszczególnych pacjentów i zależą od dawki, częstości dawkowania, czasu podawania i czasu trwania leczenia glikokortykosteroidami.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Po nagłym przerwaniu leczenia glikokortykosteroidami może także wystąpić „zespół odstawienia” steroidów, pozornie niezwiązany z niewydolnością kory nadnerczy. Zespół ten obejmuje takie objawy, jak: brak łaknienia, nudności, wymioty, letarg, ból głowy, gorączka, ból stawów, łuszczenie się skóry, ból mięśni, zmniejszenie masy ciała i (lub) niedociśnienie tętnicze. Uważa się, że te działania wynikają raczej z nagłej zmiany stężenia glikokortykosteroidów niż z małego stężenia kortykosteroidów. Ponieważ glikokortykosteroidy mogą wywoływać lub nasilać zespół Cushinga, należy unikać ich podawania pacjentom z chorobą Cushinga. Kortykosteroidy mają nasilone działanie u pacjentów z niedoczynnością tarczycy. Działania immunosupresyjne/zwiększona podatność na infekcje Kortykosteroidy mogą zwiększać podatność na infekcje oraz mogą maskować niektóre objawy zakażenia. Ponadto podczas ich stosowania mogą się pojawiać nowe zakażenia.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
W trakcie stosowania kortykosteroidów może wystąpić zmniejszenie odporności organizmu i niezdolność do ograniczenia miejscowego zakażeń. Ze stosowaniem kortykosteroidów w monoterapii lub w skojarzeniu z innymi lekami immunosupresyjnymi wywierającymi wpływ na odporność komórkową, humoralną lub czynność granulocytów obojętnochłonnych mogą wiązać się zakażenia dowolnym mikroorganizmem chorobotwórczym, w tym zakażenia wirusowe, bakteryjne, grzybicze, pierwotniakowe lub choroby pasożytnicze, w dowolnej okolicy organizmu. Zakażenia te mogą być łagodne, a także ciężkie, czasami śmiertelne. Częstość występowania powikłań zakaźnych wzrasta w miarę zwiększania dawek kortykosteroidów. U osób z zakażeniem należy unikać wykonywania dostawowych, dokaletkowych lub dościęgnistych wstrzyknięć tych hormonów. Pacjenci przyjmujący leki immunosupresyjne są bardziej narażeni na infekcje niż osoby zdrowe np.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
ospa wietrzna i odra mogą mieć cięższy przebieg, a nawet przebiegać ze skutkiem śmiertelnym u nieszczepionych dzieci lub osób dorosłych przyjmujących kortykosteroidy. U pacjentów przyjmujących immunosupresyjne dawki kortykosteroidów przeciwwskazane jest stosowanie szczepionek na bazie żywych, osłabionych wirusów. Pacjentom tym można podać szczepionki inaktywowane lub wytworzone przy użyciu technologii biogenetycznych. Jednak odpowiedź na takie szczepionki może być osłabiona lub mogą się one okazać nieskuteczne. Można wykonywać wskazane zabiegi immunizacji u pacjentów otrzymujących kortykosteroidy w dawkach, które nie powodują immunosupresji. Stosowanie metyloprednizolonu octanu z lidokaną u osób z czynną gruźlicą należy ograniczyć do przypadków o przebiegu piorunującym lub rozsianym. Kortykosteroidy stosuje się wtedy w leczeniu choroby w skojarzeniu z odpowiednimi lekami przeciwgruźliczymi.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Gdy podanie kortykosteroidów jest wskazane u pacjentów z gruźlicą utajoną lub z dodatnim wynikiem próby tuberkulinowej, konieczna jest ścisła obserwacja pacjentów, gdyż może dojść do reaktywacji choroby. U tych pacjentów w trakcie długotrwałej kortykosteroidoterapii należy stosować chemioprofilaktykę. U pacjentów przyjmujących kortykosteroidy zgłaszano przypadki wystąpienia mięsaka Kaposiego. Przerwanie stosowania kortykosteroidów może prowadzić do remisji klinicznej. Rola glikokortykosteroidów w leczeniu wstrząsu septycznego jest kontrowersyjna, przy czym we wczesnych badaniach opisywano zarówno ich korzystne, jak i szkodliwe działania. Niedawno zasugerowano, że uzupełniające podawanie kortykosteroidów jest korzystne u pacjentów z rozwiniętym wstrząsem septycznym, u których występowały objawy niewydolności kory nadnerczy. Nie zaleca się jednak ich rutynowego stosowania w leczeniu wstrząsu septycznego.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
W przeglądzie systematycznym przedstawiono wniosek, że krótkoterminowe stosowanie dużych dawek kortykosteroidów nie jest uzasadnione. Jednak metaanaliza i badania przeglądowe wskazują, że dłuższe stosowanie (przez 5–11 dni) małych dawek kortykosteroidów może zmniejszyć umieralność, zwłaszcza wśród pacjentów ze wstrząsem septycznym, u których niezbędne jest stosowanie leków presyjnych w celu utrzymania odpowiedniego ciśnienia krwi. Wpływ na układ immunologiczny Mogą wystąpić reakcje alergiczne. U pacjentów leczonych kortykosteroidami w rzadkich przypadkach dochodziło do wystąpienia reakcji skórnych i anafilaktycznych i (lub) anafilaktoidalnych, dlatego przed podaniem produktu należy podjąć odpowiednie środki ostrożności, szczególnie jeśli w przeszłości u pacjentów występowały reakcje alergiczne na jakikolwiek lek. Wpływ na żołądek i jelita Duże dawki kortykosteroidów mogą wywoływać ostre zapalenie trzustki.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Nie ma wspólnego stanowiska na temat tego, czy kortykosteroidy są odpowiedzialne za powstawanie wrzodów trawiennych stwierdzanych w trakcie leczenia; niemniej jednak leczenie glikokortykosteroidami może maskować objawy wrzodów trawiennych, w związku z czym może wystąpić perforacja lub krwotok bez towarzyszącego znacznego bólu. Leczenie glikokortykosteroidami może maskować zapalenie otrzewnej lub inne objawy przedmiotowe lub podmiotowe związane z wystąpieniem zaburzeń żołądka i jelit, takie jak: perforacja, zaparcie lub zapalenie trzustki. W połączeniu z NLPZ wzrasta ryzyko rozwoju choroby wrzodowej żołądka i jelit. Glikokortykosteroidy należy stosować ostrożnie w leczeniu nieswoistego wrzodziejącego zapalenia jelita grubego, jeżeli istnieje zagrożenie perforacją, bądź też wystąpieniem ropnia lub innej postaci zakażenia ropnego.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Należy również zachować ostrożność w przypadku zapalenia uchyłków, świeżych zespoleń jelitowych, czynnej lub utajonej choroby wrzodowej, gdy steroidy są stosowane jako leczenie podstawowe lub uzupełniające. Wpływ na wątrobę i drogi żółciowe Zgłaszano, że zaburzenia wątroby i dróg żółciowych mogą być odwracalne po zakończeniu leczenia. W związku z tym wymagana jest właściwa kontrola. 6. Wpływ na układ mięśniowo-szkieletowy W trakcie stosowania dużych dawek kortykosteroidów zgłaszano przypadki ostrej miopatii, najczęściej u pacjentów z zaburzeniami przewodnictwa nerwowo-mięśniowego (np. miastenia), lub u pacjentów leczonych równocześnie lekami przeciwcholinergicznymi, takimi jak leki blokujące przewodnictwo nerwowo-mięśniowe (np. pankuronium). Taka ostra postać miopatii jest uogólniona, może obejmować mięśnie oczne i oddechowe oraz prowadzić do niedowładu czterokończynowego. Może wystąpić wzrost aktywności kinazy kreatynowej.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Poprawa stanu klinicznego lub powrót do zdrowia po przerwaniu stosowania kortykosteroidów mogą pojawić się po kilku tygodniach lub nawet latach. Osteoporoza jest częstym, ale rzadko rozpoznawanym działaniem niepożądanym związanym z przewlekłym przyjmowaniem dużych dawek glikokortykosteroidów. Zaburzenia czynności nerek i dróg moczowych Należy zachować ostrożność u pacjentów z twardziną układową, ponieważ zwiększona częstość występowania twardzinowej kryzy nerkowej była obserwowana z kortykosteroidami, w tym metyloprednizolonem. Należy zachować ostrożność podczas stosowania kortykosteroidów u pacjentów z niewydolnością nerek. Badania diagnostyczne Umiarkowane i duże dawki hydrokortyzonu lub kortyzonu mogą powodować wzrost ciśnienia krwi, zatrzymanie wody i soli oraz zwiększone wydalanie potasu. Takie działania niepożądane występują rzadziej w przypadku stosowania syntetycznych pochodnych, jeżeli nie będą podawane w wysokich dawkach.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Konieczne może okazać się ograniczenie podaży soli w diecie oraz suplementacja potasem. Wszystkie kortykosteroidy zwiększają wydalanie wapnia. Urazy, zatrucia i powikłania po zabiegach Stosowanie kortykosteroidów o działaniu ogólnoustrojowym nie jest zalecane do leczenia urazowego uszkodzenia mózgu, i dlatego nie należy ich stosować w leczeniu urazowego uszkodzenia mózgu. Wyniki badania wieloośrodkowego wykazały zwiększenie śmiertelności po 2 tygodniach lub 6 miesiącach od wystąpienia urazu u pacjentów leczonych solą sodową bursztynianu metyloprednizolonu, w porównaniu do pacjentów otrzymujących placebo. Związek przyczynowy związany z leczeniem solą sodową bursztynianu metyloprednizolonu nie został ustalony. Inne Powikłania związane z leczeniem glikokortykosteroidami zależą od dawki i od czasu leczenia.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Decyzje dotyczące wielkości dawki, czasu trwania leczenia, stosowania produktu codziennie lub z przerwami należy podjąć indywidualnie w każdym przypadku, zależnie od oceny stosunku korzyści do ryzyka. Należy zachować ostrożność w przypadku podawania kwasu acetylosalicylowego i niesteroidowych leków przeciwzapalnych w połączeniu z kortykosteroidami. W celu ograniczenia częstości przypadków zaniku skóry i tkanki podskórnej nie należy przekraczać zalecanej dawki. Kiedy tylko jest to możliwe, należy wykonywać wielokrotnie wstrzyknięcia małych dawek na danym obszarze ze zmianami. W technice wstrzyknięć dostawowych należy zastosować środki ostrożności mające na celu zapobieżenie wyciekowi lub wstrzyknięciu produktu w skórę właściwą. Brak danych wskazujących na to, aby kortykosteroidy wywierały działanie kancerogenne, mutagenne lub wywierały niekorzystny wpływ na płodność. 7. Należy wziąć pod uwagę leczenie kortykosteroidami podczas interpretowania wyników badań biologicznych (np.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
testów skórnych, oznaczeń stężenia hormonów tarczycy). Po podaniu kortykosteroidów o działaniu ogólnoustrojowym zgłaszano przełom w przebiegu guza chromochłonnego, niekiedy zakończony zgonem. Kortykosteroidy należy stosować tylko po odpowiedniej ocenie stosunku korzyści do ryzyka w przypadku pacjentów, u których podejrzewa się lub stwierdzono występowanie guza chromochłonnego. Stosowanie u dzieci U dzieci poddawanych długotrwałemu leczeniu glikokortykosteroidami w dobowych dawkach podzielonych może dochodzić do zahamowania wzrostu. Stosowanie tego typu schematu dawkowania powinno być ograniczone do najcięższych wskazań. Niemowlęta i dzieci poddawane długotrwałemu leczeniu kortykosteroidami są szczególnie narażone na wystąpienie zwiększonego ciśnienia śródczaszkowego. Wysokie dawki kortykosteroidów mogą wywoływać u dzieci zapalenie trzustki.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
PODANIE DOSTAWOWE W przypadku podawania dostawowego i (lub) innego podawania miejscowego konieczne jest przestrzeganie zasad postępowania aseptycznego, aby uniknąć zakażeń jatrogennych. Po dostawowym podaniu kortykosteroidów należy uważać, aby uniknąć przeciążania stawów, w obrębie których uzyskano złagodzenie objawów. Zaniedbania pod tym względem mogą nasilać niszczenie stawu, które zdecydowanie przeważy nad korzyściami z podania steroidu. Nie należy wykonywać wstrzyknięć do stawów niestabilnych. W niektórych przypadkach powtarzane wstrzyknięcia dostawowe mogą spowodować niestabilność stawu. W wybranych przypadkach sugeruje się wykonanie kontrolnego badania RTG w celu wykrycia ewentualnego pogorszenia stanu stawu. W PRZYPADKU POZAJELITOWEGO PODANIA KORTYKOSTEROIDÓW NALEŻY ZASTOSOWAĆ NASTĘPUJĄCE DODATKOWE ŚRODKI OSTROŻNOŚCI: Domaziówkowe wstrzykiwanie kortykosteroidu może wywołać działania ogólne i miejscowe.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
W celu wykluczenia ewentualnego zakażenia konieczne jest odpowiednie przebadanie płynu stawowego. Znaczny wzrost natężenia bólu z towarzyszącym miejscowym obrzękiem, ograniczeniem ruchów w stawie, gorączką i pogorszeniem samopoczucia są potencjalnymi objawami ostrego ropnego zapalenia stawów. W przypadku wystąpienia tego powikłania i potwierdzenia rozpoznania posocznicy należy zaprzestać wykonywania miejscowych wstrzyknięć glikokortykosteroidów i wdrożyć odpowiednie leczenie przeciwdrobnoustrojowe. Należy unikać miejscowego podawania steroidów do stawu objętego w przeszłości zakażeniem. Glikokortykosteroidów nie należy wstrzykiwać do stawów niestabilnych. Bezwzględnie konieczne jest zastosowanie jałowej techniki, aby zapobiec zakażeniom i zanieczyszczeniu produktu. STOSOWANIE FIOLKI WIELODAWKOWEJ Pobieranie kilku dawek metyloprednizolonu octanu z lidokainą z jednej fiolki wymaga zachowania szczególnej ostrożności, w celu uniknięcia zanieczyszczenia produktu.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Produkt jest sterylny, jednak wykorzystywanie fiolek do pobierania wielu dawek może prowadzić do zanieczyszczenia, chyba że stosuje się ścisłą technikę aseptyczną. Należy zachować szczególną ostrożność w przypadku podawania leku wewnątrzmaziówkowo – w tym celu należy stosować strzykawki i igły jednorazowego użytku. Istnieją dane wskazujące, że chlorek benzalkonium nie jest odpowiednim środkiem antyseptycznym do sterylizacji fiolek metyloprednizolonu octanu z lidokainą wykorzystywanych do podawania wielu dawek. Zaleca się stosowanie roztworu jodopowidonu lub innego podobnego produktu do oczyszczenia górnej części fiolek przed aspiracją ich zawartości. Nie zaleca się pobierania wielu dawek metyloprednizolonu octanu z lidokainą z jednej fiolki w przypadku wstrzykiwania wewnątrzmaziówkowo. 8. MOŻLIWE DZIAŁANIA NIEPOŻĄDANE WYSTĘPUJĄCE PO PODANIU LEKU PRZECIWWSKAZANYMI DROGAMI − Zgłaszano ciężkie zdarzenia medyczne w związku z podaniem dooponowym/nadtwardówkowym (patrz punkt 4.8 Działania niepożądane).
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Należy podjąć odpowiednie środki, aby uniknąć wstrzyknięcia dożylnego lub domięśniowego (patrz punkt 4.9 „Przedawkowanie”). − Podanie donosowe: Przemijające lub trwałe pogorszenie widzenia z utratą wzroku włącznie; reakcje uczuleniowe; nieżyt nosa. − Podanie do gałki ocznej: Przemijające lub trwałe pogorszenie widzenia z utratą wzroku włącznie, podwyższenie ciśnienia wewnątrzgałkowego, zapalenie gałki ocznej, zapalenie okołogałkowe z reakcjami uczuleniowymi włącznie; zakażenia, złogi lub martwica w miejscu wstrzyknięcia. − Inne miejsca wstrzyknięcia (skóra pokrywająca czaszkę, migdałki gardłowe, zwój klinowo-podniebienny): utrata wzroku. Specjalne środki ostrożności dotyczące stosowania lidokainy do znieczulenia miejscowego Podawanie leków miejscowo znieczulających, takich jak lidokaina wchodząca w skład metyloprednizolonu z lidokainą w postaci roztworu do wstrzykiwań, powinno odbywać się w warunkach, w których możliwe jest natychmiastowe przystąpienie do resuscytacji.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Niektóre procedury znieczulenia miejscowego mogą wiązać się z wystąpieniem ciężkich działań niepożądanych niezależnie od zastosowanego leku do znieczulenia miejscowego i są zazwyczaj wynikiem zwiększonego stężenia leku w osoczu spowodowanego przypadkowym wstrzyknięciem donaczyniowym, podaniem zbyt dużej dawki lub szybkim wchłanianiem z silnie unaczynionych okolic ciała. Mogą one również wystąpić w wyniku nadwrażliwości, idiosynkrazji lub zmniejszonej tolerancji ze strony pacjenta. Ogólnoustrojowe działania toksyczne dotyczą głównie ośrodkowego układu nerwowego i (lub) układu krążenia (patrz punkty 4.8 i 4.9). Podobnie jak w przypadku innych leków miejscowo znieczulających, lidokainę należy stosować ostrożnie u pacjentów z padaczką, nużliwością mięśni, zaburzeniami przewodzenia serca, zastoinową niewydolnością serca, hipowolemią i bradykardią.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Dzieci i młodzież, pacjenci w podeszłym wieku i pacjenci z osłabionym układem odpornościowym wymagają stosowania mniejszych dawek odpowiednio do wieku i stanu fizycznego. Informacja dotycząca substancji pomocniczych Alkohol benzylowy: Produkt Depo-Medrol z lidokainą zawiera alkohol benzylowy (patrz punkt 2). Środek konserwujący - alkohol benzylowy może powodować reakcje nadwrażliwości. Dożylne podawanie alkoholu benzylowego pacjentom pediatrycznym, w tym noworodkom wiąże się z ryzykiem występowania ciężkich działań niepożądanych i śmierci (zespołem niewydolności oddechowej, tzw. gasping syndrome). Chociaż standardowe dawki terapeutyczne tego produktu zwykle zawierają ilości alkoholu benzylowego znacznie mniejsze niż zgłaszane w związku ze wspomnianym zespołem niewydolności oddechowej, minimalna ilość alkoholu benzylowego, przy której mogą wystąpić objawy toksyczności, jest nieznana.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlSpecjalne środki ostrozności
Postaci produktów leczniczych zawierające alkohol benzylowy należy stosować u noworodków wyłącznie wtedy, gdy jest to konieczne i nie ma dostępnych alternatywnych metod leczenia. U wcześniaków i noworodków o niskiej masie urodzeniowej istnieje większe prawdopodobieństwo toksycznego działania. Postaci produktów leczniczych zawierających alkohol benzylowy nie należy podawać małym dzieciom w wieku poniżej 3 lat dłużej niż przez 1 tydzień, chyba że jest to konieczne. Należy wziąć pod uwagę całkowitą ilość alkoholu benzylowego przyjmowanego ze wszystkich źródeł, a duże objętości alkoholu benzylowego podawać ze szczególną ostrożnością i tylko w razie konieczności, zwłaszcza u pacjentów z zaburzeniami czynności wątroby lub nerek, jak również u kobiet w ciąży lub karmiących piersią, z powodu ryzyka kumulacji i toksycznego działania (kwasicy metabolicznej). 9. Sód Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na każdą fiolkę, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Metyloprednizolon Metyloprednizolon jest substratem enzymów cytochromu P450 (CYP) i jest metabolizowany głównie przez enzym CYP3A. CYP3A4 jest dominującym enzymem najliczniejszej podrodziny enzymów CYP w wątrobie osób dorosłych. Enzym ten katalizuje 6β-hydroksylowanie steroidów, niezbędny etap metabolizmu I fazy dla endogennych i syntetycznych kortykosteroidów. Wiele innych związków jest także substratami CYP3A4, przy czym wykazano, że niektóre z nich (a także inne leki) zmieniają metabolizm glikokortykosteroidów poprzez indukcję (aktywacja) lub hamowanie enzymu CYP3A4 (Tabela 1). INHIBITORY CYP3A4 Leki hamujące aktywność CYP3A4 zmniejszają klirens wątrobowy i zwiększają stężenie w osoczu leków będących substratami CYP3A4, takich jak metyloprednizolon. W obecności inhibitora CYP3A4 może wystąpić konieczność dostosowania dawki metyloprednizolonu w celu uniknięcia toksycznego działania steroidów (Tabela 1).
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlInterakcje
INDUKTORY CYP3A4 Leki indukujące aktywność CYP3A4 zwykle zwiększają klirens wątrobowy, co powoduje zmniejszenie stężenia w osoczu leków będących substratami CYP3A4. Jednoczesne stosowanie tych związków może wymagać zwiększenia dawki metyloprednizolonu w celu osiągnięcia pożądanych rezultatów (Tabela 1). SUBSTRATY CYP3A4 Obecność substratu CYP3A4 może mieć wpływ na klirens wątrobowy metyloprednizolonu, co może wymagać odpowiedniego dostosowania dawki. W przypadku jednoczesnego podawania istnieje możliwość zwiększenia prawdopodobieństwa wystąpienia działań niepożądanych związanych ze stosowaniem któregokolwiek z leków oddzielnie (Tabela 1). DZIAŁANIA ZACHODZĄCE BEZ POŚREDNICTWA CYP3A4 Inne interakcje i działania związane ze stosowaniem metyloprednizolonu zostały opisane poniżej (Tabela 1). Tabela 1.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlInterakcje
Istotne interakcje lub działania metyloprednizolonu z innymi lekami lub substancjami Klasa lub rodzaj leku – LEK lub SUBSTANCJA Leki antybakteryjne – IZONIAZYD Antybiotyki, leki przeciwgruźlicze – RIFAMPICYNA Leki przeciwzakrzepowe (doustne) Lek przeciwdrgawkowy – KARBAMAZEPINA Leki przeciwdrgawkowe – FENOBARBITAL – FENYTOINA Leki antycholinergiczne – BLOKERY NERWOWO- Interakcja lub działanie INHIBITOR CYP3A4. Ponadto metyloprednizolon ma potencjalny wpływ na wzrost szybkości acetylowania i klirensu izoniazydu. INDUKTOR CYP3A4 Wpływ metyloprednizolonu na doustne leki przeciwzakrzepowe jest zmienny. Donoszono o zwiększonym i zmniejszonym działaniu leków przeciwzakrzepowych podawanych jednocześnie z kortykosteroidami. W związku z tym, aby zapewnić odpowiednie działanie przeciwzakrzepowe należy kontrolować wskaźniki krzepnięcia krwi. INDUKTOR CYP3A4 (i SUBSTRAT) INDUKTORY CYP3A4 Kortykosteroidy mogą wpływać na działanie leków przeciwcholinergicznych.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Płodność W badaniach na zwierzętach wykazano, że kortykosteroidy mają działanie upośledzające płodność (patrz punkt 5.3 Przedkliniczne dane o bezpieczeństwie). Ciąża Metyloprednizolon Niektóre badania na zwierzętach wykazały, że kortykosteroidy podawane matce mogą powodować wady rozwojowe płodu. Natomiast nie wykazano, aby kortykosteroidy powodowały występowanie wad wrodzonych u płodów, których matki przyjmowały kortykosteroidy w okresie ciąży. Kortykosteroidy przenikają przez barierę łożyskową. W jednym retrospektywnym badaniu stwierdzono większą częstość przypadków niskich mas urodzeniowych niemowląt urodzonych przez matki przyjmujące kortykosteroidy. U ludzi, ryzyko wystąpienia niskiej masy urodzeniowej wykazuje zależność od podawanej dawki. Ryzyko to może być zmniejszone poprzez podawanie niższych dawek kortykosteroidów.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWpływ na płodność, ciążę i laktację
Noworodki urodzone przez matki, które otrzymywały znaczne dawki glikokortykosteroidów w trakcie ciąży, należy starannie obserwować i badać pod kątem objawów niewydolności kory nadnerczy, mimo, że u niemowląt, które były narażone na kortykosteroidy in utero, rzadko występuje noworodkowa niewydolność kory nadnerczy. Lidokaina Lidokaina łatwo przenika przez barierę łożyskową. Stosowanie miejscowe anestetyków, takich jak lidokaina podczas ciąży i porodu, może wiązać się z występowaniem działań niepożądanych u matki i płodu. Metyloprednizolonu octan z lidokain? Dopóki nie zostaną przeprowadzone odpowiednie badania dotyczące wpływu metyloprednizolonu octanu z lidokainą na procesy rozrodcze u ludzi, produkt ten nie powinien być podawany kobietom ciężarnym, chyba że po dokonaniu dokładnej oceny stosunku korzyści do ryzyka dla matki i płodu. Nie stwierdzono wpływu kortykosteroidów na przebieg porodu.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWpływ na płodność, ciążę i laktację
U niemowląt urodzonych przez matki długotrwale stosujące kortykosteroidy w okresie ciąży obserwowano rozwój zaćmy. Produkt Depo-Medrol z lidokainą zawiera alkohol benzylowy jako środek konserwujący. Alkohol benzylowy może przenikać przez łożysko (patrz punkt 4.4). Karmienie piersi? Metyloprednizolon Kortykosteroidy przenikają do mleka matki. U dzieci karmionych piersią kortykosteroidy, które przeniknęły do mleka matki mogą hamować wzrost i zakłócać wytwarzanie endogennych glikokortykosteroidów. Lidokaina Lidokaina przenika do mleka matki. Metyloprednizolonu octan z lidokain? Produkt ten może być stosowany przez kobiety karmiące piersią, tylko po dokładnej ocenie stosunku korzyści do ryzyka u matki i niemowlęcia. Produkt Depo-Medrol z lidokainą zawiera alkohol benzylowy jako środek konserwujący (patrz punkt 4.4).
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie przeprowadzono systematycznej oceny wpływu kortykosteroidów na zdolność prowadzenia pojazdów i obsługiwania maszyn. Leczenie kortykosteroidami może powodować działania niepożądane, takie jak: zawroty głowy, zaburzenia równowagi, zaburzenia wzroku i zmęczenie, a ponadto ze względu na miejscowe działanie znieczulające lidokainy mogą również wystąpić tymczasowe zaburzenia poruszania się i upośledzenie koordynacji ruchowej. Jeżeli znieczulenie w warunkach ambulatoryjnych, ze względu na miejsce znieczulenia, wpływa na zdolność pacjentów do prowadzenia pojazdów lub obsługiwania maszyn, pacjentom należy doradzić, aby unikali tych czynności do czasu pełnego powrotu do normalnego funkcjonowania.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDziałania niepożądane
4.8 Działania niepożądane W trakcie leczenia metyloprednizolonem w skojarzeniu z lidokainą obserwowano i zgłaszano następujące działania niepożądane występujące z następującą częstością: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (≤1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zgłaszano następujące działania niepożądane, związane ze stosowaniem metyloprednizolonu octanu, następującymi przeciwwskazanymi drogami podania: dooponowo/nadtwardówkowo: zapalenie pajęczynówki, zaburzenia czynności żołądka i jelit lub pęcherza moczowego, ból głowy, zapalenie opon mózgowo-rdzeniowych, niedowład poprzeczny/porażenie poprzeczne, napady drgawkowe, zaburzenia czucia. Podobnie jak w przypadku innych leków miejscowo znieczulających, działania niepożądane lidokainy występują rzadko i zazwyczaj wiążą się ze zwiększonym stężeniem w osoczu spowodowanym przypadkowym wstrzyknięciem donaczyniowym, podaniem zbyt dużej dawki lub szybkim wchłanianiem z silnie unaczynionych okolic ciała.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDziałania niepożądane
Działania te mogą występować również w wyniku nadwrażliwości, idiosynkrazji lub zmniejszonej tolerancji ze strony pacjenta. Ogólnoustrojowe działania toksyczne dotyczą głównie ośrodkowego układu nerwowego i (lub) układu krążenia. Do objawów neurologicznych ogólnoustrojowego działania toksycznego należą: zawroty głowy lub uczucie oszołomienia, nerwowość, drżenie, parestezje okołoustne, drętwienie języka, senność, drgawki, śpiączka. Reakcje ze strony układu krążenia mają charakter hamujący i mogą objawiać się: niedociśnieniem tętniczym, bradykardią, zahamowaniem czynności mięśnia sercowego, zaburzeniami rytmu serca i w niektórych przypadkach zatrzymaniem akcji serca lub zasłabnięciem na tle krążeniowym. Objawami toksycznego działania lidokainy mogą być: niewyraźne widzenie, podwójne widzenie i ślepota przejściowa.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDziałania niepożądane
Klasyfikacja układów i narządów Zakażenia i zarażenia pasożytnicze Zaburzenia krwi i układu chłonnego Zaburzenia układu immunologicznego Zaburzenia endokrynologiczne Zaburzenia metabolizmu i odżywiania Zaburzenia psychiczne Zaburzenia układu nerwowego Zaburzenia oka Zaburzenia ucha i błędnika Zaburzenia serca Zaburzenia naczyniowe Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zaburzenia żołądka i jelit Zaburzenia skóry i tkanki podskórnej Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Zaburzenia układu rozrodczego i piersi Zaburzenia ogólne i stany w miejscu podania Badania diagnostyczne Urazy, zatrucia i powikłania po zabiegach Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych): Lipomatoza nadtwardówkowa, zwiększenie ciśnienia śródczaszkowego (z obrzękiem tarczy nerwu wzrokowego [łagodne nadciśnienie śródczaszkowe]), utrata przytomności, napady drgawkowe, amnezja, zaburzenia poznawcze, drżenie, senność, hipoestezja, zawroty głowy, ból głowy, chorioretinopatia, zaćma, jaskra, wytrzeszcz, podwójne widzenie, zaburzenia widzenia, rzadko (≥ 1/10 000 do < 1/1 000) nieostre widzenie (patrz także punkt 4.4).
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDziałania niepożądane
Zawroty głowy (pochodzenia błędnikowego), szumy uszne. Zatrzymanie akcji serca, zaburzenia rytmu serca, zastoinowa niewydolność serca (u podatnych pacjentów), zapaść krążeniowa, zakrzepica, nadciśnienie tętnicze, niedociśnienie tętnicze, uderzenia gorąca. Zatrzymanie oddechu, depresja oddechowa, zator tętnicy płucnej, czkawka, skurcz oskrzeli, duszność. Wrzody trawienne, perforacja jelit, krwawienie z żołądka, zapalenie trzustki, wrzodziejące zapalenie przełyku, zapalenie przełyku, rozdęcie brzucha, ból brzucha, biegunka, niestrawność, nudności, wymioty. Obrzęk naczynioruchowy, obrzęk twarzy, nadmierne owłosienie, wybroczyny, wylew krwawy podskórny lub dotkankowy, zanik skóry, rumień, nadmierne pocenie się, rozstępy skórne, wysypka, świąd, pokrzywka, trądzik, hiperpigmentacja skóry, hipopigmentacja skóry, zmiany skórne.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDziałania niepożądane
Osłabienie mięśniowe, ból mięśniowy, miopatia, zanik lub utrata tkanki mięśniowej, osteoporoza, martwica kości, złamania patologiczne, neuropatia stawowa, ból stawów, zahamowanie wzrostu, drżenie mięśni, zaostrzenie bólu po wstrzyknięciu (po podaniu dostawowym, okołostawowym i do pochewki ścięgna). Nieregularne miesiączkowanie. Jałowy ropień, utrudnione gojenie się ran, obrzęk, zmęczenie, złe samopoczucie, reakcje w miejscu wstrzyknięcia, uczucie zimna, uczucie gorąca. Zwiększenie ciśnienia wewnątrzgałkowego, zmniejszenie tolerancji węglowodanów, zmniejszenie stężenia potasu we krwi, zwiększenie stężenia wapnia w moczu, zwiększenie aktywności aminotransferazy alaninowej, zwiększenie aktywności aminotransferazy asparaginianowej, zwiększenie aktywności fosfatazy zasadowej we krwi, zwiększenie stężenia mocznika we krwi, zahamowanie reakcji w testach skórnych. Kompresyjne złamania kręgów, zerwanie ścięgna. Termin nie jest terminem preferowanym wg MedDRA.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDziałania niepożądane
Perforacja wrzodu trawiennego i krwotok z wrzodu trawiennego. Zapalenie otrzewnej może być pierwszym objawem przedmiotowym lub podmiotowym zaburzeń żołądka i jelit, takich jak perforacja, zaparcie lub zapalenie trzustki (patrz sekcja 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). 15 Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDziałania niepożądane
Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlPrzedawkowanie
4.9 Przedawkowanie Metyloprednizolon Długotrwałe stosowanie leku w dawkach często powtarzanych (raz na dobę lub kilka razy w tygodniu) może wywołać zespół Cushinga i inne reakcje związane z przewlekłym stosowaniem leczenia steroidami. Rzadko zgłaszano przypadki ostrej toksyczności i (lub) zgonu po przedawkowaniu kortykosteroidów. W przypadku przedawkowania brak jest swoistego antidotum, stosuje się leczenie podtrzymujące i objawowe. Lidokaina Objawy ostrej toksyczności ogólnoustrojowej działanie toksyczne na ośrodkowy układ nerwowy manifestuje się objawami o narastającym nasileniu. U pacjentów mogą początkowo występować: parestezje okołoustne, drętwienie języka, zawroty głowy, przeczulica słuchowa i szumy uszne. Zaburzenia widzenia i drżenie lub drganie mięśni należą do cięższych objawów i mogą poprzedzać wystąpienie drgawek uogólnionych. Nie należy ich mylić z zachowaniami neurotycznymi.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlPrzedawkowanie
U pacjenta może wystąpić utrata przytomności i duże napady padaczkowe (typu grand mal), które mogą trwać od kilku sekund do kilku minut. Ze względu na zwiększoną aktywność mięśniową podczas drgawek szybko dochodzi do niedotlenienia i hiperkapnii oraz zaburzenia prawidłowych procesów oddychania i niedrożności dróg oddechowych. W ciężkich przypadkach może dojść do zatrzymania oddechu. Toksyczne działanie leków miejscowo znieczulających nasilane jest przez kwasicę metaboliczną. W ciężkich przypadkach mogą wystąpić objawy ze strony układu krążenia. W wyniku dużych stężeń ogólnoustrojowych może dojść do: niedociśnienia tętniczego, bradykardii, arytmii i zatrzymania akcji serca, co może prowadzić do zgonu. O ile nie wstrzyknięto zbyt dużej dawki leku miejscowo znieczulającego, powrót do stanu sprzed podania leku następuje szybko w wyniku jego redystrybucji z ośrodkowego układu nerwowego oraz metabolizmu.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlPrzedawkowanie
Leczenie objawów ostrej toksyczności W przypadku pojawienia się objawów ostrej toksyczności ogólnoustrojowej należy natychmiast przerwać wstrzykiwanie leku znieczulającego. W przypadku wystąpienia drgawek i depresji ośrodkowego układu nerwowego konieczne będzie poddanie pacjenta odpowiedniemu leczeniu, które ma na celu natlenienie, zatrzymanie drgawek i wspomaganie krążenia. Należy zapewnić drożność dróg oddechowych i podać tlen oraz, jeśli zajdzie taka potrzeba, zastosować wentylację wspomaganą (za pomocą maski twarzowej i worka samorozprężalnego). Krążenie należy podtrzymywać za pomocą infuzji osocza lub płynów dożylnych. W sytuacjach, gdy wymagane jest dalsze leczenie wspomagające z powodu wystąpienia depresji układu krążenia, można rozważyć zastosowanie środka wazopresyjnego, chociaż wiąże się to z ryzykiem pobudzenia ośrodkowego układu nerwowego.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlPrzedawkowanie
Drgawki można kontrolować poprzez dożylne podanie diazepamu lub tiopentalu sodu, pamiętając jednak, że leki przeciwdrgawkowe mogą również osłabiać proces oddychania i krążenia. Długotrwałe drgawki mogą pogarszać wentylację i natlenianie pacjenta. W takich przypadkach należy rozważyć wczesną intubację dotchawiczą. Jeśli u pacjenta wystąpi zatrzymanie krążenia, należy zastosować standardowe procedury resuscytacji krążeniowo-oddechowej. Niezmiernie istotne jest nieustanne optymalne dotlenianie oraz wentylacja pacjenta, jak również wspomaganie krążenia oraz leczenie objawów kwasicy metabolicznej. W leczeniu ostrego przedawkowania lidokainy dializa nie jest skuteczna.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Metyloprednizolon Metyloprednizolonu octan ma ogólne właściwości glikokortykosteroidu metyloprednizolonu, jednak jest od niego słabiej rozpuszczalny i wolniej metabolizowany, dzięki czemu działa dłużej. Wykazuje silniejsze działanie przeciwzapalne niż prednizolon, a także mniejszą niż prednizolon tendencję do indukowania retencji sodu i wody, utraty potasu i nadciśnienia tętniczego. Podobnie jak w przypadku metyloprednizolonu, przewaga metyloprednizolonu octanu nad starszymi kortykosteroidami polega na jego zdolności do wykazywania równoważnego działania przeciwzapalnego przy mniejszych dawkach. Uważa się, że dawka 4,4 mg metyloprednizolonu wywiera takie samo działanie przeciwzapalne jak 20 mg hydrokortyzonu. Glikokortykosteroidy przechodzą przez błony komórkowe i wiążą się ze specyficznymi receptorami zlokalizowanymi w cytoplazmie.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWłaściwości farmakodynamiczne
Następnie kompleksy te wnikają do jądra komórkowego, wiążą się z DNA (chromatyna) i stymulują transkrypcję mRNA i dalszą syntezę różnych enzymów, które są prawdopodobnie odpowiedzialne za liczne efekty glikokortykosteroidów, obserwowane po zastosowaniu ogólnym. Maksymalna aktywność farmakologiczna kortykosteroidów występuje później niż osiągnięcie szczytowego stężenia we krwi, co sugeruje, że większość efektów działania kortykosteroidów wynika raczej z modyfikacji aktywności enzymów niż z bezpośredniego działania. Lidokaina Lidokainy chlorowodorek jednowodny powoduje zmniejszenie czucia powierzchownego i eliminuje ból bez utraty kontroli nerwowej, zapobiegając lub zmniejszając przewodnictwo impulsów przez nerwy czuciowe wzdłuż włókien nerwowych i na zakończeniach nerwowych. Działanie lidokainy chlorowodorku jednowodnego pojawia się szybko po wstrzyknięciu, jest ono silniejsze i trwa dłużej niż w przypadku prokainy; działanie to jest odwracalne.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Nie przeprowadzono badań farmakokinetycznych produktu skojarzonego składającego się z metyloprednizolonu i lidokainy, jednak dostępne są dane z badań farmakokinetycznych poszczególnych składników produktu — metyloprednizolonu i lidokainy. Wchłanianie Metyloprednizolon W jednym wewnętrznym badaniu z udziałem ośmiu ochotników określono właściwości farmakokinetyczne pojedynczej dawki 40 mg metyloprednizolonu octanu podawanego domięśniowo. Średnia z poszczególnych maksymalnych stężeń w osoczu wynosiła 14,8 ± 8,6 ng/ml, średnia z poszczególnych czasów wystąpienia maksymalnego stężenia (Tmax) wynosiła 7,25 ± 1,04 godziny, a średnie pole powierzchni pod krzywą (AUC) wynosiło 1354,2 ± 424,1 ng/ml x godziny (Dzień 1-21). Lidokaina Przeprowadzone badania właściwości farmakokinetycznych lidokainy po absorpcji w płynie stawowym po dostawowym wstrzyknięciu bolusa u pacjentów poddanych artroskopii stawu kolanowego wykazały różne wartości maksymalnego stężenia (Cmax).
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWłaściwości farmakokinetyczne
Po podaniu lidokainy w dawkach 7 mg/kg oraz 400 mg wartości Cmax wynosiły odpowiednio 2,18 µg/ml po 1 h (w surowicy) oraz 0,63 µg/ml po 0,5 h (w osoczu). Inne zgłoszone wartości Cmax w surowicy po podaniu lidokainy w dawkach 25 ml roztworu 1% oraz 20 ml roztworu 1,5% wynosiły odpowiednio 0,69 µg/ml po 5 min oraz 0,278 µg/ml po 2 h. Dane farmakokinetyczne dotyczące działania miejscowego lidokainy po podaniach dokaletkowym i bezpośrednio do torbieli nie są dostępne. Dystrybucja Metyloprednizolon Metyloprednizolon jest szeroko dystrybuowany do tkanek, przenika przez barierę krew-mózg i jest wydzielany do mleka matki. Jego pozorna objętość dystrybucji wynosi około 1,4 l/kg. Stopień wiązania metyloprednizolonu z białkami osocza u ludzi wynosi około 77%. Lidokaina Stopień wiązania lidokainy z białkami osocza zależy od jej stężenia; stopień wiązania zmniejsza się wraz ze wzrostem stężenia. Przy stężeniach od 1 do 5 µg/ml stopień wiązania lidokainy z białkami wynosi 60%–80%.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWłaściwości farmakokinetyczne
Stopień wiązania zależy również od stężenia alfa 1-kwaśnej glikoproteiny w osoczu. Objętość dystrybucji lidokainy w stanie stacjonarnym wynosi 91 l. Lidokaina łatwo przenika przez łożysko i szybko osiągana jest równowaga stężenia niezwiązanego leku. Stopień wiązania z białkami osocza u płodu jest mniejszy niż u matki, w wyniku czego całkowite stężenie w osoczu u płodu jest niższe. Metabolizm Metyloprednizolon U ludzi, metyloprednizolon jest metabolizowany w wątrobie do nieaktywnych metabolitów; głównymi metabolitami są 20-alfa-hydroksymetyloprednizolon i 20-beta-hydroksymetyloprednizolon. Metabolizm w wątrobie zachodzi głównie z udziałem enzymu CYP3A4 (Wykaz interakcji produktów leczniczych związanych z metabolizmem z udziałem enzymu CYP3A4, patrz punkt 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji).
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWłaściwości farmakokinetyczne
Metyloprednizolon, podobnie jak wiele innych substratów enzymu CYP3A4, może być także substratem dla glikoproteiny P należącej do białek transportowych ABC, wpływając na dystrybucję tkankową i interakcje z innymi lekami modulowanymi przez glikoproteinę P. Lidokaina Lidokaina jest metabolizowana głównie w wątrobie. Głównymi metabolitami lidokainy są monoetyloglicynian ksylidyny, glicynoksylidyna, 2,6-dimetyloanilina oraz 4-hydroksy-2,6-dimetyloanilina. Uważa się, że N-odalkilowanie lidokainy do monoetyloglicynianu ksylidyny zachodzi przy udziale zarówno enzymu CYP1A2, jak i CYP3A4. Metabolit 2,6-dimetyloanilina jest przekształcany do 4-hydroksy-2,6-dimetyloaniliny przez enzymy CYP2A6 i CYP2E1. Eliminacja Metyloprednizolon Średni okres półtrwania w fazie eliminacji całkowitego metyloprednizolonu wynosi od 1,8 do 5,2 godzin. Całkowity klirens wynosi około 5 do 6 ml/min/kg. Lidokaina Klirens lidokainy w osoczu po podaniu dożylnym w bolusie wynosi od 9 do 10 ml/min/kg.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWłaściwości farmakokinetyczne
Okres półtrwania w fazie eliminacji lidokainy po dożylnym wstrzyknięciu bolusa wynosi zazwyczaj od 1,5 do 2 godzin. Działanie farmakologiczne monoetyloglicynianu ksylidyny i glicynoksylidyny jest podobne, ale słabsze niż lidokainy. Okres półtrwania monoetyloglicynianu ksylidyny wynosi około 2,3 godziny, a okres półtrwania glicynoksylidyny wynosi około 10 godzin i może ona gromadzić się po długotrwałym podawaniu. Tylko 3% lidokainy jest wydalane przez nerki w postaci niezmienionej. Około 73% lidokainy trafia do moczu w postaci 4-hydroksy-2,6-dimetyloaniliny. Szczególne populacje Metyloprednizolon Nie przeprowadzono badań farmakokinetycznych metyloprednizolonu w szczególnych populacjach. Lidokaina Zaburzenia czynności wątroby: U pacjentów z zaburzeniami czynności wątroby okres półtrwania lidokainy po podaniu dożylnym jest około 3-krotnie dłuższy.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWłaściwości farmakokinetyczne
Dane farmakokinetyczne dotyczące działania miejscowego lidokainy u pacjentów z zaburzeniami czynności wątroby po podaniach dostawowym, dokaletkowym i bezpośrednio do torbieli nie są dostępne. Zaburzenia czynności nerek: Łagodne do umiarkowanych zaburzenia czynności nerek (klirens kreatyniny 30–60 ml/min) nie mają wpływu na farmakokinetykę lidokainy, ale mogą zwiększać gromadzenie się metabolitu glicynoksylidyny po podaniu dożylnym. Jednak u pacjentów z ciężkimi zaburzeniami czynności nerek klirens lidokainy zmniejsza się o połowę, a jej okres półtrwania zwiększa się około dwukrotnie wraz ze zwiększonym gromadzeniem się metabolitu glicynoksylidyny (klirens kreatyniny <30 ml/min). Farmakokinetyka lidokainy i jej głównego metabolitu monoetyloglicynianu ksylidyny nie ulega znaczącej zmianie u pacjentów poddawanych hemodializie, którzy otrzymują dożylną dawkę lidokainy.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlWłaściwości farmakokinetyczne
Dane farmakokinetyczne dotyczące działania miejscowego lidokainy u pacjentów z zaburzeniami czynności nerek po podaniach dostawowym, dokaletkowym i bezpośrednio do torbieli nie są dostępne.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Metyloprednizolon W oparciu o konwencjonalne badania farmakologiczne dotyczące bezpieczeństwa oraz badania toksyczności po podaniu wielokrotnym, nie stwierdzono nieoczekiwanych zagrożeń. Działania toksyczne obserwowane w badaniach z podaniem wielokrotnym były zgodne z oczekiwanymi w wyniku długotrwałego narażenia na egzogenne adrenokortykosteroidy. Potencjał rakotwórczy Metyloprednizolonu nie oceniano formalnie w badaniach, dotyczących potencjalnego działania rakotwórczego, przeprowadzonych u gryzoni. Zmienne wyniki uzyskiwano po zastosowaniu innych glikokortykosteroidów, badanych pod względem potencjalnego działania rakotwórczego u myszy i szczurów. Jednakże opublikowane dane wskazują, że kilka powiązanych glikokortykosteroidów, w tym budezonid, prednizolon i acetonid triamcynolonu, może zwiększać częstość występowania gruczolaków i nowotworów wątrobowokomórkowych, po podaniu doustnym w wodzie pitnej samcom szczura.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlPrzedkliniczne dane o bezpieczeństwie
Ten tumorogenny wpływ, występował w dawkach niższych niż typowe dawki kliniczne ustalone na podstawie powierzchni ciała (mg/m²). Potencjał mutagenny Metyloprednizolonu nie oceniano formalnie w badaniach dotyczących genotoksyczności. Jednakże metyloprednizolonu sulfonian, który jest strukturalnie podobny do metyloprednizolonu, nie wykazywał działania mutagennego po aktywacji metabolicznej lub bez aktywacji metabolicznej u Salmonella typhimurium w dawce od 250 do 2000 µg/płytka lub w badaniu mutacji genetycznych in vitro w komórkach ssaków z wykorzystaniem komórek jajnika chomika chińskiego w dawce od 2000 do 10 000 µg/ml. Metyloprednizolonu suleptanian nie wywoływał nieplanowej syntezy DNA w pierwotnych hepatocytach szczura, w dawce od 5 do 1000 µg/ml. Ponadto w przeglądzie publikacji wykazano, że prednizolonu farnezylan (PNF), który jest strukturalnie podobny do metyloprednizolonu, nie wykazywał działania mutagennego po aktywacji metabolicznej lub bez aktywacji metabolicznej u Salmonella typhimurium i szczepów Escherichia coli w dawce od 312 do 5000 µg/płytka.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlPrzedkliniczne dane o bezpieczeństwie
W linii komórkowej fibroblastów chomika chińskiego PNF doprowadził do wzrostu częstości występowania strukturalnych aberracji chromosomowych przy aktywacji metabolicznej w najwyższym badanym stężeniu 1500 µg/ml. Toksyczny wpływ na reprodukcję Przy podawaniu szczurom wykazano, że kortykosteroidy zmniejszają płodność. Samcom szczura podawano kortykosteron w dawkach 0, 10 i 25 mg/kg/doba drogą iniekcji podskórnej raz na dobę przez 6 tygodni oraz parowano je z samicami, którym nie podawano tej substancji. Po Dniu 15 wysoką dawkę zmniejszono do 20 mg/kg/doba. Zaobserwowano zmniejszenie ilości czopu kopulacyjnego, co mogłoby być wtórne do zmniejszenia masy dodatkowego gruczołu. Liczba implantacji i płodów żywych uległa zmniejszeniu. Wykazano teratogenne działanie kortykosteroidów u wielu gatunków zwierząt w przypadku stosowania dawek odpowiadającym dawkom stosowanym u ludzi.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlPrzedkliniczne dane o bezpieczeństwie
W badaniach na zwierzętach dotyczących wpływu na rozrodczość wykazano, że glikokortykosteroidy, takie jak metyloprednizolon, powodują zwiększenie występowania wad rozwojowych (rozszczep podniebienia, wady rozwojowe szkieletu), śmiertelność płodów (np. zwiększenie resorpcji) i hipotrofię wewnątrzmaciczną. Lidokaina Potencjał rakotwórczy Nie prowadzono długotrwałych badań na zwierzętach w celu oceny potencjalnego działania rakotwórczego lidokainy. Wykazano rakotwórcze działanie metabolitu lidokainy, 2,6-ksylidyny, u szczurów; znaczenie kliniczne w odniesieniu do krótkotrwałego/okresowego stosowania lidokainy jako miejscowego leku znieczulającego pozostaje nieznane. Potencjał mutagenny Badania genotoksyczności lidokainy nie wykazały potencjalnego działania mutagennego. W badaniach wykonanych in vitro i in vivo metabolit lidokainy, 2,6-ksylidyny, wykazał niewielkie potencjalne działanie genotoksyczne.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlPrzedkliniczne dane o bezpieczeństwie
Toksyczny wpływ na reprodukcję W ramach badania przeprowadzonego na samcach i samicach szczurów podawano doustnie lidokainę w dawce 30 mg/kg masy ciała codziennie przez 8 miesięcy. W tym okresie przeprowadzono 3 krycia i przeanalizowano parametry reprodukcyjne dla każdej ciąży, a także rozwój potomstwa aż do zakończenia karmienia mlekiem matki. Nie stwierdzono żadnego wpływu. Metyloprednizolon z lidokain? Potencjał rakotwórczy Nie prowadzono długoterminowych badań na zwierzętach w celu oceny potencjalnego działania rakotwórczego. Ustalono, że dawka LD50 samej lidokainy podawanej dootrzewnowo białym myszom wynosi 126 ± 4,6 mg/kg. Premedykacja tych myszy z zastosowaniem nawet 0,5 mg/kg metyloprednizolonu nie miała istotnego wpływu na toksyczność ostrą lidokainy. Badania dotyczące ostrego działania drażniącego przy podawaniu dostawowym przeprowadzane na białych królikach z zastosowaniem 0,25 ml każdego z materiałów — metyloprednizolonu octanu z lidokainy chlorowodorkiem jednowodnym, samego metyloprednizolonu octanu lub soli fizjologicznej — przez cztery dni po wstrzyknięciu jednego z tych materiałów nie wykazały żadnych znaczących nieprawidłowości w płynie stawowym, błonach maziowych czy powierzchniach artykulacji tych stawów.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlPrzedkliniczne dane o bezpieczeństwie
W ramach sześciotygodniowego badania toksyczności przy podawaniu pozajelitowym u szczurów, mającego na celu ustalenie układowej toksyczności podostrej wywoływanej produktem skojarzonym składającym się z metyloprednizolonu octanu i lidokainy, nie uzyskano wyników innych niż te przypisywane obecności glukokortykoidów w produkcie, ani też nie stwierdzono żadnych zmian histologicznych u tych zwierząt, których nie można by przypisać leczeniu samym metyloprednizolonem lub samą lidokainą. Potencjał mutagenny Nie przeprowadzono badań genotoksyczności produktu skojarzonego składającego się z metyloprednizolonu i lidokainy (patrz powyższe informacje na temat genotoksyczności w odniesieniu do poszczególnych leków). Toksyczny wpływ na reprodukcję Nie przeprowadzono badań dotyczących toksycznego wpływu na reprodukcję z zastosowaniem produktu skojarzonego składającego się z metyloprednizolonu i lidokainy (patrz powyższe informacje na temat toksycznego wpływu na reprodukcję w odniesieniu do poszczególnych leków).
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Substancje pomocnicze: makrogol, alkohol benzylowy (E1519), sodu chlorek, mirystylo-gamma pikoliny chlorek, sodu wodorotlenek (do odpowiedniego pH), kwas solny (do odpowiedniego pH), woda do wstrzykiwań. 6.2 Niezgodności farmaceutyczne Ze względu na możliwość wystąpienia niezgodności farmaceutycznych, produktu Depo-Medrol z lidokainą nie należy rozcieńczać innymi roztworami ani mieszać z innymi roztworami. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania 1 fiolka ze szkła bezbarwnego, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Produkty lecznicze do podawania pozajelitowego należy przed podaniem obejrzeć pod kątem obecności cząstek stałych i zmiany barwy.
- CHPL leku Depo-Medrol z Lidokainą, zawiesina do wstrzykiwań, (40 mg + 10 mg)/mlDane farmaceutyczne
Aby zapobiec zakażeniom jatrogennym, konieczne jest ścisłe przestrzeganie zasad postępowania aseptycznego. Produkt nie nadaje się do podawania dożylnego ani dokanałowego. Po podaniu potrzebnej dawki należy wyrzucić wszelkie pozostałości zawiesiny. Przed użyciem wstrząsnąć energicznie, tak aby uzyskać jednolitą zawiesinę.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO EMLA, 25 mg/g + 25 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 25 mg lidokainy i 25 mg prylokainy. Substancja pomocnicza o znanym działaniu: makrogologlicerolu hydroksystearynian 19 mg/g (patrz punkt 4.4). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, jednorodny krem.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy EMLA jest wskazany do stosowania: W celu miejscowego znieczulenia skóry: przed nakłuciem i cewnikowaniem żył, pobieraniem krwi do badań; przed powierzchownymi zabiegami chirurgicznymi (w obrębie skóry); u dorosłych, a także u dzieci i młodzieży. W celu miejscowego znieczulenia błony śluzowej narządów płciowych np. przed powierzchownymi zabiegami chirurgicznymi lub znieczuleniem nasiękowym; u dorosłych oraz u młodzieży w wieku 12 lat i starszych. W celu miejscowego znieczulenia owrzodzeń kończyn dolnych dla ułatwienia mechanicznego oczyszczenia lub opracowania chirurgicznego rany; wyłącznie u dorosłych.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i młodzież Szczegóły dotyczące wskazań czy procedur stosowania produktu leczniczego wraz z dawkowaniem i czasem stosowania podano w tabelach 1 i 2. W celu uzyskania dalszych wskazówek dotyczących właściwego zastosowania tych procedur należy zapoznać się z częścią Sposób podawania. Tabela 1. Dorośli oraz młodzież w wieku 12 lat i starszych Wskazanie/zabieg (procedura) tDawkowanie i czas stosowania Skóra Niewielkie zabiegi, np. nakłucie żyły lub leczenie chirurgiczne niedużych zmian. Dawka: 2 g (około połowa tubki 5 g) lub około 1,5 g/10 cm2 przez 1 do 5 godzin. Zabiegi na świeżoogolonej skórze większych obszarów ciała, np. depilacja laserowa (krem stosowany samodzielnie przez pacjenta). Maksymalna zalecana dawka: 60 g. Maksymalna powierzchnia poddawana działaniu leku: 600 cm2 przez co najmniej 1 godzinę, a nie dłużej niż przez 5 godzin. Zabiegi na skórze większych obszarów ciała w warunkach szpitalnych, np.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gDawkowanie
pobieranie przeszczepu skórnego pośredniej grubości. Dawka: w przybliżeniu 1,5-2 g/10 cm2 przez 2 do 5 godzin. Skóra męskich narządów płciowych Przed iniekcją środków miejscowo znieczulających. Dawka: 1 g/10 cm2 przez 15 minut. Skóra żeńskich narządów płciowych Przed iniekcją środków miejscowo znieczulających. Dawka: 1-2 g/10 cm2 przez 60 minut. Śluzówka narządów płciowych Chirurgiczne leczenie zlokalizowanych zmian, np. wycięcie kłykcin kończystych oraz przed iniekcją leków miejscowo znieczulających. Dawka: około 5-10 g kremu przez 5-10 minut. Przed wykonaniem łyżeczkowania kanału szyjki macicy. 10 g kremu należy nałożyć w bocznych sklepieniach pochwy na 10 minut. Owrzodzenia kończyn dolnych Tylko u dorosłych Mechaniczne czyszczenie lub opracowanie chirurgiczne rany. Dawka: około 1-2 g/10 cm2 do dawki maksymalnej 10 g na owrzodzenie(a) kończyn dolnych. Czas stosowania: 30-60 minut.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na lidokainę i (lub) prylokainę lub na inne leki miejscowo znieczulające o budowie amidowej albo na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Pacjenci z dziedzicznym niedoborem dehydrogenazy glukozo-6-fosforanowej oraz samoistną methemoglobinemią są bardziej podatni na występowanie objawów methemoglobinemii indukowanej przez substancję czynną produktu. U pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej antidotum w postaci błękitu metylenowego jest nieskuteczne w redukowaniu methemoglobiny i może prowadzić do oksydacji hemoglobiny; z tego względu terapia błękitem metylenowym nie może być stosowana. Ze względu na niewystarczającą ilość danych dotyczących wchłaniania, produktu leczniczego EMLA nie należy stosować na otwarte rany (z wyjątkiem owrzodzeń kończyn dolnych). Ze względu na potencjalnie zwiększone wchłanianie z powierzchni skóry świeżo ogolonej ważne jest, aby przestrzegać zalecanego dawkowania, obszaru stosowania oraz czasu ekspozycji (patrz punkt 4.2).
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gSpecjalne środki ostrozności
Należy zachować ostrożność podczas stosowania produktu leczniczego EMLA u pacjentów z atopowym zapaleniem skóry. Wystarczający może być krótszy czas stosowania kremu, wynoszący 15 do 30 minut (patrz punkt 5.1). U pacjentów z atopowym zapaleniem skóry czas stosowania kremu dłuższy niż 30 minut może skutkować częstszym występowaniem miejscowych reakcji naczyniowych, szczególnie zaczerwienieniem miejsca aplikacji a w niektórych przypadkach powstawaniem wybroczyn i plamicy (patrz punkt 4.8). Przed usunięciem zmian mięczakowych u dzieci z atopowym zapaleniem skóry zaleca się zastosowanie kremu przez 30 minut. Podczas stosowania produktu leczniczego EMLA w okolicy oczu należy zachować szczególną ostrożność, ponieważ może on powodować podrażnienie oczu i oparzenia chemiczne oczu (patrz punkt 4.8). Również utrata odruchów obronnych może ułatwić podrażnienie rogówki i potencjalne jej uszkodzenie (zadrapanie).
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gSpecjalne środki ostrozności
W razie kontaktu kremu z okiem należy natychmiast przemyć oko wodą lub roztworem chlorku sodu oraz chronić do czasu powrotu czucia. W przypadku stosowania produktu leczniczego EMLA u dzieci na dowolnej części ciała, należy uważać na dzieci, aby zapobiec przypadkowemu wprowadzeniu przez dziecko produktu leczniczego EMLA do oczu. Produktu leczniczego EMLA nie należy stosować na uszkodzoną błonę bębenkową. Badania przeprowadzone na zwierzętach laboratoryjnych wykazały, że produkt leczniczy EMLA ma działanie ototoksyczne, gdy dostanie się do ucha środkowego. Jednakże, nie stwierdzono żadnych nieprawidłowości u zwierząt z niezmienioną błoną bębenkową, u których stosowano produkt leczniczy EMLA w kanale słuchowym zewnętrznym. 5 Pacjenci przyjmujący leki przeciwarytmiczne klasy III (np. amiodaron), u których stosowany jest produkt leczniczy EMLA, powinni znajdować się pod ścisłą obserwacją i należy u nich rozważyć monitorowanie zapisu EKG, gdyż wpływ na serce może się sumować.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gSpecjalne środki ostrozności
Lidokaina i prylokaina w stężeniu większym niż 0,5%-2% wykazują działanie bakteriostatyczne i przeciwwirusowe. Z tego względu, mimo że wyniki jednego badania klinicznego sugerują, że na odpowiedź na szczepienie, ocenianą na podstawie wielkości bąbla skórnego, nie ma wpływu użycie produktu leczniczego EMLA przed szczepieniem BCG, zalecane jest monitorowanie wyników śródskórnych iniekcji żywych szczepionek. Produkt leczniczy EMLA zawiera hydroksystearynian makrogologlicerolu, który może powodować odczyny skórne. 6 Dzieci i młodzież W badaniach nie zdołano wykazać skuteczności produktu leczniczego EMLA w znieczuleniu do nakłucia pięty u noworodków. U noworodków lub niemowląt w wieku poniżej 3 miesięcy zwykle obserwuje się przemijające, klinicznie nieistotne zwiększenie zawartości methemoglobiny w czasie do 12 godzin po zastosowaniu produktu leczniczego EMLA w zakresie zalecanych dawek.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gSpecjalne środki ostrozności
W razie przekroczenia zalecanej dawki pacjent powinien być obserwowany w kierunku wystąpienia działań niepożądanych wtórnych do methemoglobinemii (patrz punkty 4.2, 4.8 oraz 4.9). Produktu leczniczego EMLA nie należy stosować: U noworodków lub niemowląt w wieku do 12 miesięcy leczonych jednocześnie produktami indukującymi powstawanie methemoglobiny. U noworodków urodzonych przedwcześnie w wieku ciążowym poniżej 37 tygodni, ponieważ występuje u nich ryzyko zwiększenia stężenia methemoglobiny. Bezpieczeństwo i skuteczność stosowania produktu leczniczego EMLA na skórę i błonę śluzową narządów płciowych nie zostały określone u dzieci w wieku poniżej 12 lat. Dostępne dane dotyczące dzieci i młodzieży nie wykazują wystarczającej skuteczności znieczulenia na potrzeby zabiegu obrzezania.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Prylokaina w dużych dawkach może powodować zwiększenie stężenia methemoglobiny, szczególnie w połączeniu ze stosowanymi jednocześnie produktami leczniczymi indukującymi powstawanie methemoglobiny (np. sulfonamidami, nitrofurantoiną, fenytoiną, fenobarbitalem). Podane przykłady nie stanowią pełnej listy takich produktów. Podczas jednoczesnego stosowania dużych dawek produktu leczniczego EMLA należy wziąć pod uwagę ryzyko wystąpienia dodatkowych oznak toksyczności ogólnoustrojowej u pacjentów przyjmujących inne leki miejscowo znieczulające lub produkty lecznicze strukturalnie spokrewnione z anestetykami miejscowymi, ponieważ działania toksyczne tych leków mogą się sumować. Nie przeprowadzono swoistych badania interakcji lidokainy/prylokainy z lekami przeciwarytmicznymi klasy III (np. amiodaron), jednak podczas jednoczesnego stosowania obu leków należy zachować ostrożność (patrz punkt 4.4).
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gInterakcje
Produkty lecznicze, które zmniejszają klirens lidokainy (np. cymetydyna lub leki beta-aderenolityczne) mogą prowadzić do potencjalnie toksycznych stężeń lidokainy w osoczu, gdy lidokaina jest podawana w dużych dawkach powtarzanych w długim okresie. 6 Dzieci i młodzież Nie przeprowadzono konkretnych badań dotyczących interakcji u dzieci. Można spodziewać się, że interakcje u dzieci i młodzieży są podobne jak u dorosłych.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Choć podczas stosowania miejscowego produkt leczniczy jest w małym stopniu wchłaniany ogólnoustrojowo, stosowanie produktu leczniczego EMLA u kobiet w ciąży należy podejmować z ostrożnością ze względu na niewystarczającą ilość danych dostępnych na temat stosowania tego produktu u kobiet w ciąży. Jednakże, wyniki badań na zwierzętach nie wskazują na jakikolwiek bezpośredni lub pośredni ujemny wpływ leku na ciążę, rozwój zarodka i płodu, przebieg porodu czy rozwój pourodzeniowy potomstwa. Wykazano występowanie toksycznego oddziaływania na czynność rozrodczą (płodność) stosując podskórnie lub domięśniowo duże dawki lidokainy lub prylokainy, znacznie przewyższające ekspozycję na produkt leczniczy podczas stosowania miejscowego na skórę (patrz punkt 5.3). Lidokaina i prylokaina przenikają przez barierę łożyskową i mogą ulegać wchłanianiu przez tkanki płodu.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWpływ na płodność, ciążę i laktację
Rozsądnym i uzasadnionym jest przyjęcie założenia, że lidokaina i prylokaina były dotąd stosowane u wielu kobiet w ciąży oraz kobiet w wieku rozrodczym. Jak dotąd nie zgłaszano żadnych konkretnych zaburzeń rozrodu, np. zwiększonej częstości występowania wad i zaburzeń rozwojowych lub innych bezpośrednich lub pośrednich oddziaływań szkodliwych względem płodu. Karmienie piersi? Lidokaina oraz, zapewne również, prylokaina są wydzielane do mleka kobiety, lecz w ilościach tak małych, że zasadniczo nie ma ryzyka zagrożenia dla dziecka podczas stosowania produktu w dawkach leczniczych. Produkt leczniczy EMLA może być stosowany w okresie karmienia piersią, jeżeli jest to klinicznie wskazane. Płodność Badania na zwierzętach nie wykazały jakiegokolwiek zaburzenia płodności samców lub samic szczura (patrz punkt 5.3).
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Podczas stosowania w zalecanych dawkach produkt leczniczy EMLA nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Najczęściej obserwowane działania niepożądane produktu leczniczego wiążą się z zaburzeniami w miejscu podania (przemijające reakcje miejscowe w miejscu zastosowania), należą one do kategorii często występujących. Tabelaryczne zestawienie działań niepożądanych Częstości występowania działań niepożądanych produktu leczniczego (ang. Adverse Drug Reactions - ADRs) związanych ze stosowaniem produktu leczniczego EMLA podano w tabeli poniżej. Zestawienie to jest oparte na zdarzeniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu produktu leczniczego do obrotu. Częstości występowania działań niepożądanych są podane według klasyfikacji układów i narządów MedDRA oraz z użyciem preferowanego nazewnictwa.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gDziałania niepożądane
W każdej klasie układów i narządów działania niepożądane zostały wyszczególnione w kategoriach częstości występowania: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000), nieznana (częstość nie może być określona na podstawie dostępnych danych). W każdej kategorii częstości działania niepożądane przedstawiono w kolejności malejącej ciężkości działania. Tabela 3. Działania niepożądane Klasyfikacja układów i narządów Często Methemoglobinemia Niezbyt często Reakcje nadwrażliwości Rzadko Oparzenia chemiczne oczu (patrz punkt 4.4) Nieznana Podrażnienie rogówki Zaburzenia skóry i tkanki podskórnej Plamica, wybroczyny (szczególnie po dłuższym czasie stosowania u dzieci z atopowym zapaleniem skóry lub mięczakiem zakaźnym) Zaburzenia ogólne i stany w miejscu podania Uczucie pieczenia, Świąd w miejscu podania, Rumień w miejscu podania, Obrzęk w miejscu podania, Odczucie ciepła w miejscu podania, Bladość w miejscu podania, Uczucie pieczenia, Podrażnienie w miejscu podania, Świąd w miejscu podania, Parestezje, zaburzenia czucia w miejscu podania takie jak uczucie mrowienia, Odczucie ciepła w miejscu podania Dzieci i młodzież Częstość występowania, rodzaj i nasilenie działań niepożądanych są podobne w grupie wiekowej dorosłych i dzieci i młodzieży, z wyjątkiem methemoglobinemii, która jest obserwowana częściej, często w związku z przedawkowaniem (patrz punkt 4.9), u noworodków i niemowląt w wieku 0 do 12 miesięcy.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: +48 22 49 21 301, faks: +48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gPrzedawkowanie
4.9 Przedawkowanie Zgłaszano rzadkie przypadki klinicznie istotnej methemoglobinemii. Prylokaina w dużych dawkach może powodować zwiększenie stężenia methemoglobiny, szczególnie u osób podatnych (patrz punkt 4.4), podczas zbyt częstego stosowania u noworodków i niemowląt poniżej 12 miesiąca życia (patrz punkt 4.2) oraz w połączeniu ze stosowaniem jednocześnie produktów leczniczych indukujących powstawanie methemoglobiny (np. sulfonamidów, nitrofurantoiny, fenytoiny oraz fenobarbitalu). Należy wziąć pod uwagę, że przy zwiększonej frakcji methemoglobiny odczyty z pulsooksymetru mogą zawyżać wysycenie hemoglobiny tlenem; z tego względu, gdy podejrzewa się methemoglobinemię bardziej użyteczne może być monitorowanie wysycenia krwi tlenem przy użyciu co-oksymetrii. Klinicznie istotną methemoglobinemię należy leczyć z zastosowaniem powolnej iniekcji dożylnej błękitu metylenowego (patrz również punkt 4.4).
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gPrzedawkowanie
W razie wystąpienia innych ogólnoustrojowych objawów toksyczności, spodziewane oznaki powinny być podobnej natury jak obserwowane po podaniu anestetyków miejscowych innymi drogami podania. Toksyczne oddziaływanie leku miejscowo znieczulającego manifestuje się objawami pobudzenia ośrodkowego układu nerwowego oraz, w ciężkich przypadkach, zahamowaniem ośrodkowego układu nerwowego i czynności układu krążenia. Ciężkie objawy neurologiczne (drgawki, zahamowanie OUN) muszą być leczone objawowo poprzez stosowanie oddechu wspomaganego oraz podawanie leków przeciwdrgawkowych; w odniesieniu do objawów ze strony układu krążenia należy postępować zgodnie z zaleceniami dotyczącymi postępowania resuscytacyjnego. Ze względu na to, że wchłanianie leku z powierzchni nieuszkodzonej skóry jest powolne, pacjent z oznakami toksyczności powinien pozostawać pod obserwacją przez kilka godzin po zastosowaniu leczenia doraźnego.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki znieczulające miejscowo; amidy; kod ATC: N01B B20 Mechanizm działania Produkt leczniczy EMLA zapewnia znieczulenie skóry poprzez uwalnianie lidokainy i prylokainy z kremu do warstw naskórka i skóry właściwej w okolicy skórnych receptorów i zakończeń nerwowych pośredniczących w odczuwaniu bólu. Lidokaina i prylokaina są amidowymi lekami miejscowo znieczulającymi. Oba związki powodują stabilizację błon neuronów przez hamowanie przepływu jonów koniecznego dla zainicjowania i przewodzenia impulsów nerwowych, co skutkuje miejscowym znieczuleniem okolicy poddanej działaniu leku. Jakość znieczulenia zależy od czasu zastosowania leku oraz jego dawki. Skóra Produkt leczniczy EMLA stosuje się na nieuszkodzoną skórę pod opatrunkiem okluzyjnym. Czas potrzebny do uzyskania odpowiedniego znieczulenia skóry nieuszkodzonej wynosi od 1 do 2 godzin, w zależności od rodzaju zabiegu lub procedury przewidzianej do wykonania.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Miejscowy skutek znieczulający poprawia się wraz z wydłużeniem czasu stosowania leku w zakresie od 1 do 2 godzin w przypadku większości części ciała, z wyjątkiem skóry twarzy oraz męskich narządów płciowych. Ze względu na to, że skóra twarzy jest cienka a ukrwienie duże, maksymalny skutek anestetyczny uzyskuje się po 30-60 minutach na czole oraz na policzkach. Podobnie, znieczulenie miejscowe męskich narządów płciowych uzyskuje się po 15 minutach stosowania produktu. Czas trwania znieczulenia po zastosowaniu produktu leczniczego EMLA przez 1 do 2 godzin wynosi co najmniej 2 godziny od zdjęcia opatrunku, z wyjątkiem twarzy, gdzie czas trwania znieczulenia jest krótszy. Produkt leczniczy EMLA jest równie skuteczny i wykazuje początek działania po takim samym czasie dla wszystkich rodzajów pigmentacji skóry (typy skóry od I do VI).
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakodynamiczne
W badaniach klinicznych z zastosowaniem produktu leczniczego EMLA na nieuszkodzoną skórę nie obserwowano żadnych różnic w odniesieniu do bezpieczeństwa lub skuteczności (w tym w odniesieniu do czasu do początku znieczulenia) między pacjentami w podeszłym wieku (od 65 do 96 lat) a pacjentami młodszymi. Produkt leczniczy EMLA powoduje dwufazową odpowiedź naczyniową, która obejmuje początkowe zwężenie naczyń, po którym następuje rozszerzenie naczyń w miejscu zastosowania leku (patrz punkt 4.8). Niezależnie od odpowiedzi naczyniowej, produkt leczniczy EMLA ułatwia procedurę nakłucia żyły w porównaniu z kremem placebo. U pacjentów z atopowym zapaleniem skóry obserwuje się podobną, lecz bardziej krótkotrwałą reakcję, z pojawianiem się zaczerwienienia po 30-60 minutach, co wskazuje na szybsze wchłanianie produktu przez skórę (patrz punkt 4.4). Produkt leczniczy EMLA może powodować przemijające zwiększenie grubości skóry, częściowo spowodowane uwodnieniem skóry pod opatrunkiem okluzyjnym.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Grubość skóry zmniejsza się następnie w okresie 15 minut kontaktu skóry z powietrzem. Głębokość (stopień) znieczulenia skóry zwiększa się wraz z wydłużeniem czasu stosowania. U 90% pacjentów znieczulenie jest wystarczające do wprowadzenia sztancy biopsyjnej (o średnicy 4 mm) na głębokość 2 mm po 60 minutach, a na głębokość 3 mm po 120 minutach stosowania produktu leczniczego EMLA. Stosowanie produktu leczniczego EMLA przed podaniem szczepionek przeciwko odrze-śwince-różyczce lub domięśniowych szczepionek przeciwko błonicy-krztuścowi-tężcowi, unieczynnionego wirusa polio, bakterii Haemophilus influenzae b lub szczepionki przeciwko zapaleniu wątroby B nie wpływa na średnie miana przeciwciał, tempo serokonwersji lub odsetek pacjentów osiągających ochronne lub dodatnie miana przeciwciał po immunizacji, w porównaniu z pacjentami, u których stosowano placebo.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Błona śluzowa narządów płciowych Wchłanianie z błony śluzowej narządów płciowych przebiega szybciej i początek znieczulenia następuje wcześniej niż po zastosowaniu kremu na skórę. Po zastosowaniu produktu leczniczego EMLA przez 5-10 minut na błonę śluzową żeńskich narządów płciowych średni czas trwania skutecznego znieczulenia na stymulację laserem argonowym, która wywoływała ostry, kłujący ból wynosił 15-20 minut (czas osobniczo zmienny w zakresie od 5 do 45 minut). Owrzodzenia kończyn dolnych U większości pacjentów skuteczne znieczulenie umożliwiające oczyszczenie owrzodzeń kończyn dolnych uzyskuje się po 30 minutach stosowania produktu leczniczego EMLA. Zastosowanie kremu przez 60 minut może jeszcze polepszyć stopień znieczulenia. Procedura oczyszczania owrzodzenia powinna rozpocząć się w czasie do 10 minut po usunięciu kremu. Dane kliniczne dotyczące dłuższego czasu odroczenia początku procedury oczyszczania nie są dostępne.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Produkt leczniczy EMLA zmniejsza ból pozabiegowy przez okres do 4 godzin po oczyszczeniu owrzodzenia z martwych tkanek. Produkt leczniczy EMLA pozwala na zmniejszenie liczby zabiegów oczyszczania owrzodzenia wymaganych dla uzyskania czystego owrzodzenia w porównaniu z oczyszczaniem z zastosowaniem kremu placebo. Nie zaobserwowano żadnego ujemnego wpływu stosowania produktu leczniczego EMLA na gojenie owrzodzeń lub florę bakteryjną w tych miejscach. Dzieci i młodzież Przeprowadzono badania kliniczne z udziałem łącznie ponad 2 300 dzieci i młodzieży ze wszystkich grup wiekowych; wykazały one skuteczność w zmniejszaniu bólu związanego z wkłuciem igły (nakłucie żyły, kaniulacja, podawanie szczepionek podskórnie i domięśniowo, nakłucie lędźwiowe), leczeniem laserowym zmian naczyniowych, a także z procedurą łyżeczkowania zmian mięczakowych (mięczak zakaźny). Produkt leczniczy EMLA zmniejsza ból związany zarówno z wprowadzaniem igły jak i z iniekcją szczepionek.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Skuteczność analgetyczna zwiększa się wraz z wydłużeniem czasu zastosowania kremu w zakresie od 15 do 90 minut w przypadku skóry niezmienionej, lecz w przypadku zmian naczyniowych skóry nie wykazano, aby zastosowanie kremu przez 90 minut skutkowało lepszym znieczuleniem niż z zastosowaniem kremu przez 60 minut. Nie stwierdzono przewagi produktu leczniczego EMLA nad placebo w odniesieniu do znieczulenia przed krioterapią brodawek pospolitych (kurzajek) przy użyciu ciekłego azotu. Nie zdołano wykazać odpowiedniej skuteczności produktu leczniczego EMLA w odniesieniu do znieczulenia do zabiegu obrzezania. W jedenastu badaniach klinicznych u noworodków wykazano, że maksymalne stężenia methemoglobiny występujące po około 8 godzinach od zastosowania produktu leczniczego EMLA na powierzchnię skóry, są klinicznie nieistotne przy stosowaniu zalecanych dawek kremu i powracają do prawidłowego poziomu po około 12-13 godzinach.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Powstawanie methemoglobiny jest związane z kumulacją prylokainy wchłanianej przez skórę i może dlatego nasilać się przy dłuższym czasie stosowania produktu leczniczego EMLA. Stosowanie produktu leczniczego EMLA przed podaniem szczepionek przeciwko odrze-śwince-różyczce lub domięśniowej szczepionki przeciwko błonicy-krztuścowi-tężcowi, inaktywowanego wirusa polio, szczepionki Haemophilus influenzae b lub szczepionek przeciwko zapaleniu wątroby B nie wpływało na średnie miana przeciwciał, tempo serokonwersji lub odsetek pacjentów osiągających ochronne lub dodatnie miana przeciwciał po immunizacji, w porównaniu z pacjentami otrzymującymi placebo.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie, dystrybucja, metabolizm i eliminacja. Wchłanianie ogólnoustrojowe lidokainy i prylokainy z produktu leczniczego EMLA zależy od zastosowanej dawki, powierzchni skóry, na którą zastosowano produkt oraz czasu kontaktu kremu ze skórą. Dodatkowymi czynnikami są grubość skóry (która jest różna w różnych częściach ciała), a także inne warunki, takie jak choroby skóry oraz obecność owłosienia lub stopień wygolenia. Po zastosowaniu kremu na owrzodzenia kończyn dolnych, wpływ na wchłanianie składników kremu może mieć również charakterystyka samego owrzodzenia. Stężenia w osoczu po zastosowaniu produktu leczniczego EMLA są 20-60% mniejsze w przypadku prylokainy niż w przypadku lidokainy ze względu na większą objętość dystrybucji i szybszy klirens. Główną drogę eliminacji lidokainy i prylokainy z ustroju stanowi metabolizm wątrobowy, a metabolity są wydalane z moczem.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakokinetyczne
Jednakże, tempo metabolizmu i eliminacji leków miejscowo znieczulających po miejscowym zastosowaniu produktu leczniczego EMLA są zależne od tempa wchłaniania. Dlatego zmniejszenie klirensu, jak to ma miejsce u pacjentów z ciężkim zaburzeniem czynności wątroby, ma jedynie ograniczony wpływ na stężenia tych anestetyków w osoczu po zastosowaniu pojedynczej dawki produktu leczniczego EMLA oraz po powtarzanym zastosowaniu dawek pojedynczych raz na dobę w krótkim okresie (do 10 dni). Objawy toksyczności anestetyków miejscowych stają się coraz bardziej widoczne po wzrastających stężeniach w osoczu od 5 do 10 μg/ml którejkolwiek z substancji czynnych. Należy zakładać, że toksyczność lidokainy oraz prylokainy podlegają sumowaniu. Nieuszkodzona skóra Po zastosowaniu na udo u pacjentów dorosłych (60 g kremu/400 cm2 przez 3 godziny), stopień wchłaniania lidokainy i prylokainy wynosił w przybliżeniu 5%.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakokinetyczne
Maksymalne stężenia w osoczu (średnio 0,12 oraz 0,07 µg/ml) były osiągane po około 2-6 godzinach od zastosowania. Stopień wchłaniania ogólnoustrojowego wynosił w przybliżeniu 10% po zastosowaniu kremu na skórę twarzy (10 g/100 cm2 przez 2 godziny). Maksymalne stężenia w osoczu (średnio 0,16 oraz 0,06 µg/ml) były osiągane po około 1,5-3 godzinach od zastosowania. W badaniach u dorosłych pacjentów, u których wykonywano przeszczep skóry pośredniej grubości, zastosowanie kremu przez okres do 7 godzin 40 minut na udo lub górną część ramienia na powierzchnię do 1500 cm2 skutkowało maksymalnymi stężeniami w osoczu nieprzekraczającymi 1,1 µg/ml w przypadku lidokainy oraz 0,2 µg/ml w przypadku prylokainy. Błona śluzowa narządów płciowych Po zastosowaniu 10 g produktu leczniczego EMLA przez 10 minut na błonę śluzową pochwy maksymalne stężenia w osoczu lidokainy i prylokainy wynosiły odpowiednio (średnio 0,18 oraz 0,15 µg/ml) i były osiągane po 20-45 minutach od zastosowania.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakokinetyczne
Owrzodzenia kończyn dolnych Po jednorazowym zastosowaniu 5 do 10 g produktu leczniczego EMLA na owrzodzenia kończyn dolnych na powierzchnię do 64 cm2 przez 30 minut, maksymalne stężenia w osoczu wynosiły: w przypadku lidokainy mieściły się w zakresie 0,05-0,25 µg/ml, jeden wynik 0,84 µg/ml; a w przypadku prylokainy mieściły się w zakresie 0,02-0,08 µg/ml; i były osiągane po 1 do 2,5 godzinach od zastosowania. Po zastosowaniu produktu leczniczego EMLA przez 24 godziny na owrzodzenia kończyn dolnych o powierzchni 50-100 cm2 maksymalne stężenia w osoczu wynosiły: w przypadku lidokainy mieściły się w zakresie 0,19-0,71 µg/ml; a w przypadku prylokainy mieściły się w zakresie 0,06-0,28 µg/ml; i były zwykle osiągane po 2 do 4 godzinach od zastosowania. Po powtarzanym stosowaniu 2-10 g produktu leczniczego EMLA na owrzodzenia kończyn dolnych o powierzchni do 62 cm2 przez 30-60 minut 3-7 razy w tygodniu i do 15 dawek w okresie jednego miesiąca, nie stwierdzono wyraźnej kumulacji w osoczu lidokainy i jej metabolitów monoglicynoksylidydu oraz 2,6-ksylidyny lub prylokainy i jej metabolitu orto-toluidyny.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakokinetyczne
Maksymalne obserwowane stężenia w osoczu lidokainy, monoglicynoksylidydu oraz 2,6-ksylidyny wynosiły odpowiednio 0,41, 0,03 oraz 0,01 µg/ml. Maksymalne obserwowane stężenia w osoczu prylokainy i orto-toluidyny wynosiły odpowiednio 0,08 µg/ml oraz 0,01 µg/ml. Po powtarzanym stosowaniu 10 g produktu leczniczego EMLA na przewlekłe owrzodzenia kończyn dolnych o powierzchni 62-160 cm2 przez 60 minut raz na dobę w 10 kolejnych dniach średnie maksymalne stężenie w osoczu lidokainy i prylokainy łącznie wynosiło 0,6 µg/ml. Maksymalne stężenie nie zależy od wieku pacjenta, lecz jest istotnie (p<0,01) zależne od wielkości powierzchni owrzodzenia. Zwiększenie powierzchni owrzodzenia o 1 cm2 skutkuje zwiększeniem Cmax sumarycznego stężenia lidokainy i prylokainy o 7,2 ng/ml. Suma maksymalnych stężeń w osoczu lidokainy i prylokainy jest mniejsza niż jedna trzecia stężenia, z którym związane jest występowanie reakcji toksycznych, bez widocznej kumulacji w okresie 10 dni.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gWłaściwości farmakokinetyczne
Szczególne grupy pacjentów Pacjenci w wieku podeszłym Zarówno u pacjentów w podeszłym wieku jak i u pacjentów młodszych stężenia w osoczu lidokainy i prylokainy po zastosowaniu produktu leczniczego EMLA na nieuszkodzoną skórę są bardzo małe i znacznie poniżej poziomów potencjalnie toksycznych. Dzieci i młodzież Maksymalne stężenia w osoczu lidokainy i prylokainy po zastosowaniu produktu leczniczego EMLA u dzieci i młodzieży w różnym wieku były również na poziomie niższym niż powodujący potencjalnie skutki toksyczne. Patrz Tabela 4. Tabela 4. Stężenia w osoczu lidokainy i prylokainy u dzieci w grupach wiekowych od 0 miesięcy do 8 lat 0-3 miesiące: 1 g/10 cm2, 1 godzina, lidokaina 135 ng/ml, prylokaina 107 ng/ml 3-12 miesięcy: 2 g/16 cm2, 4 godziny, lidokaina 155 ng/ml, prylokaina 131 ng/ml 2-3 lata: 10 g/100 cm2, 2 godziny, lidokaina 315 ng/ml, prylokaina 215 ng/ml 6-8 lat: 10 - 16 g/100-160 cm2 (1 g/10 cm2), 2 godziny, lidokaina 299 ng/ml, prylokaina 110 ng/ml
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach skutki toksyczne odnotowane po zastosowaniu dużych dawek lidokainy lub prylokainy, każdej z osobna lub łącznie, obejmowały objawy ze strony ośrodkowego układu nerwowego i układu krążenia. Po zastosowaniu lidokainy i prylokainy jednocześnie obserwowano sumowanie się skutków obu leków, lecz bez oznak synergizmu lub nieoczekiwanych objawów toksyczności. Zarówno lidokaina, jak i prylokaina charakteryzują się małą toksycznością ostrą po przyjęciu doustnym, co gwarantuje dobry margines bezpieczeństwa w sytuacji przypadkowego połknięcia. W badaniach dotyczących wpływu lidokainy i prylokainy na rozród stwierdzono występowanie działań embriotoksycznych lub fetotoksycznych lidokainy z zastosowaniem dawek 25 mg/kg podskórnie u królika, a w przypadku prylokainy od dawek 100 mg/kg domięśniowo u szczura.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gPrzedkliniczne dane o bezpieczeństwie
Po stosowaniu dawek poniżej zakresu toksyczności dla samicy ciężarnej u szczura lidokaina nie wywiera żadnego wpływu na pourodzeniowy rozwój potomstwa. Nie obserwowano zaburzenia płodności samców lub samic szczurów pod wpływem stosowania lidokainy lub prylokainy. Lidokaina przenika przez barierę łożyskową drogą prostej dyfuzji. Proporcja ekspozycji zarodka i płodu na lidokainę względem jej stężenia w surowicy matki mieści się w zakresie od 0,4 do 1,3. W badaniach nad genotoksycznością wykonanych zarówno in vitro, jak i in vivo nie stwierdzono potencjalnego działania genotoksycznego żadnego z tych anestetyków, tj. lidokainy i prylokainy. Ze względu na rodzaj wskazań do stosowania i czas stosowania produktu u pacjentów nie wykonywano badań dotyczących rakotwórczości lidokainy i prylokainy. Metabolit lidokainy, 2,6-dimetyloanilina, a także metabolit prylokainy, σ-toluidyna, wykazywały oznaki działania genotoksycznego.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gPrzedkliniczne dane o bezpieczeństwie
W przedklinicznych badaniach toksykologicznych służących ocenie przewlekłej ekspozycji wykazano, że te metabolity mają właściwości rakotwórcze. Ocena ryzyka obejmująca porównanie obliczonych maksymalnych ekspozycji u ludzi w związku z przerywanym stosowaniem lidokainy i prylokainy z ekspozycją stosowaną w badaniach nieklinicznych wskazuje na szeroki margines bezpieczeństwa w zastosowaniach klinicznych. Badania tolerancji miejscowej z zastosowaniem mieszaniny 1:1 (wagowo) lidokainy i prylokainy w postaci emulsji, kremu lub żelu wskazują, że te postaci farmaceutyczne są dobrze tolerowane po stosowaniu na nieuszkodzoną skórę i błony śluzowe. Reakcję w postaci znacznego podrażnienia obserwowano po jednorazowym podaniu do oka emulsji lidokainy i prylokainy 1:1 50 mg/g w badaniu na zwierzętach. Jest to takie samo stężenie anestetyków miejscowych i podobna postać farmaceutyczna jak w przypadku produktu leczniczego EMLA.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gPrzedkliniczne dane o bezpieczeństwie
Na taką reakcję oka mogło mieć wpływ wysokie pH postaci emulsji (wynoszące w przybliżeniu 9), lecz jest prawdopodobnie częściowo również wynikiem właściwości drażniących samych anestetyków miejscowych.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Karbomery Makrogologlicerolu hydroksystearynian Sodu wodorotlenek Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Nie zamrażać. Przechowywać tubę szczelnie zamkniętą. 6.5 Rodzaj i zawartość opakowania Aluminiowa tuba z membraną, pokryta wewnątrz ochronnym lakierem na bazie żywicy epoksydowej z nakrętką z polipropylenu z funkcją przekłuwania. Produkt leczniczy EMLA jest dostępny w opakowaniach: 1 tuba zawierająca 5 g kremu 1 tuba zawierająca 5 g kremu i 2 opatrunki 1 tuba zawierająca 5 g kremu i 3 opatrunki 3 tuby zawierające po 5 g kremu i 8 opatrunków 5 tub zawierających po 5 g kremu 5 tub zawierających po 5 g kremu i 10 opatrunków 5 tub zawierających po 5 g kremu i 12 opatrunków 1 tuba zawierająca 30 g kremu Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
- CHPL leku EMLA, krem, 25 mg/g + 25 mg/gDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Środki ostrożności, które należy podjąć przy kontakcie z produktem leczniczym i podczas stosowania produktu leczniczego. Osoby, które często nakładają lub usuwają krem z ciała pacjenta powinny upewnić się, że skutecznie unikają kontaktu z kremem, aby zapobiec rozwojowi nadwrażliwości. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Lignocain 2%, 20 mg/ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 ml zawiera 20 mg Lidocaini hydrochloridum (lidokainy chlorowodorku)* 1 ampułka 5 ml zawiera 100 mg Lidocaini hydrochloridum (lidokainy chlorowodorku) 1 pojemnik 5 ml zawiera 100 mg Lidocaini hydrochloridum (lidokainy chlorowodorku) 1 pojemnik 10 ml zawiera 200 mg Lidocaini hydrochloridum (lidokainy chlorowodorku) 1 pojemnik 20 ml zawiera 400 mg Lidocaini hydrochloridum (lidokainy chlorowodorku) Substancje pomocnicze, patrz: pkt 6.1 * Zgodnie z Farmakopą Europejską V i Farmakopeą Polską VI nazwa Lidocaini hydrochloridum (lidokainy chlorowodorek) dotyczy związku jednowodnego 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań (przezroczysty, bezbarwny roztwór wodny)
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Znieczulenie miejscowe (roztwór 2% nie nadaje się do stosowania w odcinkowym znieczuleniu dożylnym) Ostry, objawowy częstoskurcz komorowy lub tachyarytmia, w przypadku, gdy zdaniem lekarza zaburzenia te zagrażają życiu pacjenta.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Zalecane dawkowanie Znieczulenie miejscowe Z reguły, należy podać najmniejszą możliwą dawkę, która zapewnia wystarczające znieczulenie. Dawka powinna być indywidualnie dostosowana do wieku i masy ciała pacjenta oraz do okoliczności każdego przypadku. Przy wstrzykiwaniu do tkanek charakteryzujących się znacznym wchłanianiem ogólnoustrojowym, bez jednoczesnego podania leku zwężającego naczynia krwionośne, pojedyncza dawka lidokainy nie powinna przekroczyć 300 mg. Jeśli stosuje się w mieszaninie z lekiem zwężającym naczynia, nie należy przekraczać 500 mg w jednej dawce. U pacjentów w podeszłym wieku oraz u dzieci dawkę należy dostosować indywidualnie. W wymienionych poniżej zastosowaniach klinicznych, u pacjentów dorosłych i młodzieży w wieku powyżej 15 lat zalecane są następujące pojedyncze dawki roztworu do wstrzyknięć i substancji czynnej: Znieczulenie powierzchniowe: do 15 ml do 300 mg Znieczulenie nasiękowe: do 15 ml do 300 mg Znieczulenie nasiękowe i przewodowe w stomatologii: do 15 ml do 300 mg Blokada nerwów obwodowych: do 15 ml do 300 mg Znieczulenie zewnątrzoponowe: do 15 ml do 300 mg Znieczulenie miejscowe infiltracyjne: do 25 ml do 500 mg W celu przedłużenia znieczulenia, lidokainę można stosować w mieszaninie z lekiem zwężającym naczynia krwionośne, np.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
epinefryną. Udowodniono, że korzystne jest dodanie epinefryny w stężeniu 1 : 100 000 do 1 : 200 000. Szczególnie w stomatologii konieczne może być stosowanie znieczulenia miejscowego w połączeniu ze środkiem zwężającym naczynia krwionośne. Jednakże lidokaina w połączeniu z epinefryną powinna być stosowana wyłącznie w znieczuleniu w obrębie twarzy (zęby, jama ustna, szczęki). U dzieci należy stosować niższe stężenia leku znieczulającego miejscowo. Dawki należy obliczać indywidualnie, biorąc pod uwagę wiek i masę ciała pacjenta. Niższe dawki należy stosować u pacjentów w złym ogólnym stanie zdrowia oraz przy obniżonej zdolności wiązania z białkami (w wyniku np. niewydolności nerek, niewydolności wątroby, chorób nowotworowych lub ciąży). U pacjentów z niewydolnością nerek obserwowano krótsze działanie znieczulenia miejscowego. Efekt ten można przypisywać przyspieszonemu wchłanianiu ogólnoustrojowemu wynikającemu z kwasicy lub zwiększonej minutowej objętości serca.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Pacjenci z chorobami wątroby wykazują obniżoną tolerancję na środki miejscowo znieczulające o budowie amidowej, ze względu na obniżony metabolizm wątrobowy i ograniczoną syntezę białek skutkującą mniejszym stopniem wiązania środka znieczulającego z białkami. W takich przypadkach zaleca się zmniejszenie dawek. Niższa dawka powinna również być stosowana u pacjentów wykazujących kliniczne objawy niewydolności serca lub generowania i przewodzenia impulsów. W przypadku takich pacjentów zaleca się monitorowanie czynności serca, również po ustaniu działania znieczulenia miejscowego. Niezależnie od tego, preferowaną metodą znieczulenia u takich pacjentów może być miejscowa blokada nerwów. W zastosowaniach okołoporodowych, dawka powinna zostać zmniejszona o mniej więcej jedną trzecią ze względu na zmienioną charakterystykę anatomiczną w późnym okresie ciąży.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Leczenie ostrego częstoskurczu komorowego lub tachyarytmii Dorośli: Początkowo 70 do 100 mg (1 do 1,5 mg/kg masy ciała) jednowodnego chlorowodorku lidokainy, co odpowiada 3,5 do 5 ml (0,05 do 0,075 ml/kg masy ciała) preparatu Lignocain 2%, powoli dożylnie. Szybkość podawania nie powinna przekraczać 25 mg/minutę, co odpowiada 1,25 ml preparatu Lignocain 2% / minutę. Jeśli efekt terapeutyczny pierwszej dawki jest niewystarczający, po 10-15 minutach można podać drugą dawkę, równą od jednej trzeciej do połowy dawki początkowej. W ciągu jednej godziny można podać nie więcej niż 200 do 300 mg chlorowodorku lidokainy (jednowodnego), co odpowiada 10 do 15 ml preparatu Lignocain 2%. Aby utrzymywać terapeutyczne stężenie lidokainy w osoczu (1,5 – 5 mg/l), podaje się chlorowodorek lidokainy (jednowodny) we wlewie dożylnym z szybkością 20 do 50 mikrogramów / kg masy ciała / minutę, co odpowiada 0,001 do 0,0025 ml preparatu Lignocain 2% / kg masy ciała / min.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Wlew można sporządzić dodając 1000 mg chlorowodorku lidokainy (jednowodnego), co odpowiada 50 ml preparatu Lignocain 2%, do 500 ml roztworu glukozy lub roztworu fizjologicznego soli. Pacjent ważący 70 kg powinien otrzymywać 1 do 2 ml tego roztworu na minutę, co odpowiada w 2 do 4 mg jednowodnego chlorowodorku lidokainy na minutę. Dawkę należy dostosować do indywidualnego zapotrzebowania i działania terapeutycznego. Po długotrwałym wlewie lidokainy (ponad 12 godzin) należy spodziewać się kumulacji ze względu na przedłużony okres biologicznego półtrwania lidokainy, i trzeba odpowiednio zmniejszyć dawkę. Dawkę należy również zmniejszyć w przypadku pacjentów z niewydolnością serca lub chorobami wątroby, u pacjentów przyjmujących leki nasilające działanie lidokainy (patrz punkt 4.5 Interakcje), w trakcie ciąży oraz u pacjentów w wieku powyżej 60 lat.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Niewydolność nerek nie wymaga zasadniczo specjalnego dostosowania dawki, jednak pacjenci z tej grupy powinni być monitorowani w celu wykrycia toksycznych skutków spowodowanych gromadzeniem aktywnych metabolitów. Dostosowanie dawki leków przeciwarytmicznych wymaga starannej obserwacji kardiologicznej. Należy zapewnić dostęp do aparatury resuscytacyjnej oraz umożliwić kontrolę czynności serca na monitorze. W trakcie terapii czynność serca powinna być kontrolowana w regularnych odstępach czasu, np. standardowe EKG raz na miesiąc lub długoterminowe EKG raz na trzy miesiące. W razie potrzeby należy również wykonać elektrokardiografię wysiłkową. Jeżeli jeden lub kilka parametrów będzie wskazywać na pogorszenie czynności serca, np. wydłużenie czasu QRS lub QT o ponad 25%, wydłużenie czasu PQ o ponad 50%, zwiększenie QT powyżej 500 ms, lub też gdy wzrośnie liczba i (lub) stopień ciężkości epizodów arytmii serca, niezbędna jest zmiana leczenia.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Dzieci: Nie ustalono jednoznacznie bezpieczeństwa i skuteczności stosowania lidokainy u dzieci. Amerykańskie Towarzystwo Kardiologiczne (American Heart Association) w swoich Standardach i zaleceniach dot. resuscytacji sercowo-płucnej i kardiologii w stanach zagrożenia z roku 1992 zaleca początkową dawkę 1 mg/kg masy ciała, a następnie – w razie potrzeby – wlew dożylny 20 do 50 mikrogramów / kg masy ciała / minutę. Aby zapewnić odpowiednio wysokie stężenie lidokainy w osoczu, przed infuzją można wstrzyknąć drugą dawkę 1 mg/kg masy ciała. Szczególne zalecenia dotyczące dawkowania: W krytycznych przypadkach oraz przy długotrwałym leczeniu zaleca się monitorowanie stężenia lidokainy w osoczu, utrzymując je na poziomie 3 (1,5 – 5) mg/l. Dokładne dawkowanie należy określić indywidualnie dla każdego pacjenta. Czas stosowania: Infuzję należy przerwać niezwłocznie po ustabilizowaniu rytmu serca lub po zaobserwowaniu pierwszych objawów przedawkowania.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Sposób podawania Znieczulenie miejscowe W zależności od procedury anestezjologicznej, roztwór podawany jest poprzez wstrzyknięcie śródskórne, podskórne lub zewnątrzoponowe, wstrzykiwany do ograniczonej przestrzeni tkankowej (znieczulenie nasiękowe) lub podawany miejscowo przez nakłucie odpowiednie do danej sytuacji anatomicznej. Wszystkie zabiegi znieczulenia powinny być przeprowadzane przez personel odpowiednio wykwalifikowany w zakresie danej techniki anestezjologicznej. Z reguły, w przypadku znieczulenia ciągłego zaleca się stosowanie niższych stężeń. Leczenie ostrej tachyarytmii komorowej Powolne wstrzyknięcie dożylne lub wlew dożylny po rozcieńczeniu w odpowiednim roztworze pomocniczym. Podawaniu lidokainy powinno towarzyszyć stałe monitorowanie EKG, ciśnienia i oddychania pacjenta.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
W przypadku zaobserwowania wydłużenia czasu P-Q, poszerzenia QRS lub dalszego zwiększenia wcześniej poszerzonego kompleksu QRS podczas podawania lidokainy (co może być pierwszym objawem przedawkowania), lub w przypadku zaostrzenia arytmii serca, podawanie lidokainy należy przerwać. W sytuacjach krytycznych, jeżeli wykluczy się bradykardię, lidokainę można podawać przy jednoczesnym ciągłym monitorowaniu częstości akcji serca. Ze względu na stosunkowo krótki czas działania lidokainy, po wstrzyknięciu należy zastosować wlew ciągły, o ile to możliwe przy użyciu pompy infuzyjnej. Stosując preparaty zawierające lidokainę należy mieć na uwadze fakt, iż dotychczas nie udowodniono, że leczenie lekami przeciwarytmicznymi klasy I odnosi skutek w zakresie przedłużania życia. Uwaga: U pacjentów pod narkozą, ośrodkowe zaburzenia czynności układu nerwowego mogą się nie ujawniać i może dojść do nagłego wystąpienia kardiologicznych działań niepożądanych.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Preparatu Lignocain 2% nie wolno stosować w następujących przypadkach: nadwrażliwość na środki miejscowo znieczulające typu amidowego, o ile nie jest możliwe przeprowadzenie testu ze stopniowo zwiększanymi dawkami w warunkach optymalnego bezpieczeństwa poważne zaburzenia przewodzenia w układzie przewodzącym serca, np. ciężki blok węzłowo-przedsionkowy lub przedsionkowo-komorowy (II lub III stopnia) nagła niewydolność serca (ostra dekompensacja serca). Dalsze przeciwwskazania do stosowania w znieczuleniu miejscowym Nie wstrzykiwać domięśniowo. Preparatu Lignocain 2% nie należy podawać w celu zmniejszenia bólu w położnictwie. Należy również przestrzegać specjalnych przeciwwskazań dotyczących znieczulenia podpajęczynówkowego (rdzeniowego) i zewnątrzoponowego (nadtwardówkowego) np. niewyrównana hipowolemia, zaburzenia krzepnięcia krwi, podwyższone ciśnienie śródczaszkowe.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlPrzeciwwskazania
Znieczulenia podpajęczynówkowego nie należy wykonywać u młodzieży oraz osób dorosłych w wieku poniżej 30 lat, ze względu na popunkcyjny ból głowy często występujący w tej grupie pacjentów. Zalecenia dotyczące bezpieczeństwa zabiegów znieczulenia zewnątrzoponowego lub podpajęczynówkowego w warunkach prowadzonej profilaktyki zakrzepów i zatorów znaleźć można w punkcie 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania”. Dalsze przeciwwskazania do stosowania w leczeniu przeciwarytmicznym Preparatu Lignocain 2% nie wolno stosować w następujących przypadkach: ciężki blok węzłowo-przedsionkowy lub przedsionkowo-komorowy (II lub III stopnia) w ciągu trzech miesięcy po zawale serca wyraźnie obniżona pojemność minutowa serca (lewokomorowa pojemność wyrzutowa serca poniżej 35% normalnej wartości), o ile nie wystąpi komorowa arytmia serca wyraźnie zagrażająca życiu.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Specjalne ostrzeżenia Pacjenci chorzy na padaczkę powinni być uważnie monitorowani w celu wykrycia objawów toksycznego wpływu na ośrodkowy układ nerwowy. Należy brać pod uwagę zwiększone prawdopodobieństwo wystąpienia drgawek, nawet w przypadku dawek nie przekraczających maksymalnych. U pacjentów z zespołem Melkerssona-Rosenthala może być zwiększona częstość występowania toksycznych reakcji alergicznych. Może wystąpić nagłe niedociśnienie tętnicze jako powikłanie po znieczuleniu zewnątrzoponowym, szczególnie u starszych pacjentów. Szczególną ostrożność należy zachować podczas stosowania lidokainy u pacjentów z chorobami wątroby lub myashtenia gravis oraz w przypadku wstrzykiwania leku miejscowo znieczulającego do tkanki w stanie zapalnym (z infekcją).
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Preparat Lignocain 2% należy podawać z zachowaniem szczególnej ostrożności pacjentom w następujących przypadkach: zespół chorej zatoki (sick sinus syndrome) bradykardia (mniej niż 50 uderzeń na minutę) ciężkie niedociśnienie (skurczowe ciśnienie krwi poniżej 90 mmHg) choroby wątroby i nerek. W przypadkach rozpoznanej alergii na lidokainę, należy brać pod uwagę alergię grupową na wszystkie środki miejscowo znieczulające o budowie amidowej. Środki ostrożności dotyczące stosowania U pacjentów leczonych lekami przeciwzakrzepowymi (np. heparynami), niesteroidowymi lekami przeciwzapalnymi lub środkami osoczozastępczymi, po wstrzyknięciu środka miejscowo znieczulającego należy liczyć się ze zwiększonym ryzykiem krwawienia. Dlatego też w przypadku tych pacjentów wymagane jest uprzednie sprawdzenie stanu układu krzepnięcia (patrz także poniżej). W przypadku kwasicy, wiązanie lidokainy z białkami osocza jest zmniejszone, co powoduje wzrost stężenia niezwiązanej lidokainy.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
W takich sytuacjach działanie lidokainy może być nasilone. Środki ostrożności dotyczące stosowania w znieczuleniu miejscowym Przed rozpoczęciem każdego zabiegu znieczulania należy zapewnić odpowiednie uzupełnienie objętości wewnątrznaczyniowej oraz, w razie potrzeby, skorygować hipowolemię. W trakcie znieczulania obszarów w okolicy szyi i głowy, pacjenci narażeni są na większe ryzyko toksycznego działania leku na ośrodkowy układ nerwowy. Krążenie u pacjentów otrzymujących lek powinno być uważnie monitorowane. Muszą być dostępne wszystkie instrumenty i leki niezbędne do ratowania życia, z uwzględnieniem sztucznego oddychania, leków przeciwdrgawkowych i aparatury resuscytacyjnej. Analogicznie, przed wstrzyknięciem znieczulenia zewnątrzoponowego należy zapewnić dostęp do kompletnej aparatury resuscytacyjnej, np. sprzętu do intubacji, podawania tlenu i środków doraźnych przeciwko toksycznym reakcjom.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Aby uniknąć niepożądanych działań, należy zwrócić uwagę na następujące zalecenia: Stworzyć dostęp dożylny u pacjentów z grupy ryzyka, gdy stosowane są dawki przekraczające o ponad 25% maksymalne zalecane dawki. Stosować najniższe możliwe dawki. Nie stosować rutynowo leków zwężających naczynia krwionośne w połączeniu ze znieczuleniem miejscowym. Zapewnić właściwe ułożenie pacjenta. Wykonywać aspirację w dwóch kierunkach (obracać igłę!). O ile to możliwe, unikać wstrzyknięć w okolice objęte stanem zapalnym, ze względu na możliwość zwiększonego wchłaniania ogólnoustrojowego i słabsze działanie. Wstrzykiwać środek znieczulający miejscowo powoli! Monitorować ciśnienie krwi, puls i szerokość źrenic. Przestrzegać wszystkich ogólnych i specyficznych przeciwwskazań oraz interakcji z innymi lekami. U pacjentów leczonych lekami przeciwzakrzepowymi (np.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
heparynami), niesteroidowymi lekami przeciwzapalnymi oraz środkami osoczozastępczymi, przypadkowe nakłucie naczynia krwionośnego podczas zabiegu znieczulania może spowodować poważne powikłania w postaci krwawienia; u takich pacjentów należy także brać pod uwagę zwiększone ogólne ryzyko krwawienia podczas wstrzykiwania środka miejscowo znieczulającego. W razie potrzeby, należy u tych pacjentów dokonać odpowiednio pomiaru częściowego czasu tromboplastyny (PTT) lub czasu kaolinowo-kefalinowego (aPTT) oraz wskaźnika Quicka i ustalić liczbę płytek. Te same badania należy przeprowadzić u pacjentów, którzy mają otrzymać znieczulenie podpajęczynówkowe lub zewnątrzoponowe w trakcie kuracji profilaktycznej przeciwko zaburzeniom zakrzepowo-zatorowym przy użyciu heparyn w niskich dawkach. Znieczulenie miejscowe powinno być wykonywane z zachowaniem szczególnej ostrożności u pacjentów otrzymujących heparyny małocząsteczkowe LMWH w ramach prewencji zdarzeń zakrzepowo-zatorowych.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Ustalenie czasu krwawienia jest niezbędne w przypadku pacjentów przyjmujących niesteroidowe leki przeciwzapalne w ciągu pięciu dni bezpośrednio poprzedzających znieczulenie podpajęczynówkowe lub zewnątrzoponowe. Środki ostrożności dotyczące stosowania w leczeniu przeciwarytmicznym Podczas długotrwałego podawania lidokainy droga pozajelitową należy regularnie monitorować bilans wody, stężenie elektrolitów w surowicy oraz równowagę kwasowo-zasadową.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Należy zachować ostrożność przy podawaniu lidokainy pacjentom przyjmującym leki uspokajające, mające wpływ na czynność ośrodkowego układu nerwowego. Występuje antagonizm między środkami miejscowo znieczulającymi a lekami uspokajającymi lub nasennymi (np. diazepam). Te ostatnie powodują podwyższenie progu drgawkowego w ośrodkowym układzie nerwowym. Należy to uwzględnić monitorując pacjentów w celu wykrycia objawów toksyczności lidokainy. Ostrożność wskazana jest również w przypadku pacjentów leczonych propranololem, diltiazemem, werapamilem i norepinefryną. Leki te zmniejszają klirens lidokainy i podwyższają jej stężenie w osoczu, przyczyniając się do wydłużenia okresu półtrwania lidokainy. W związku z tym należy wziąć pod uwagę możliwość kumulacji lidokainy. Lidokaina powinna być podawana ze szczególną ostrożnością pacjentom przyjmującym jednocześnie cymetydynę.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlInterakcje
Ze względu na zmniejszenie perfuzji wątroby i zahamowanie mikrosomalnych enzymów wątrobowych, może dojść do wystąpienia toksycznych stężeń lidokainy w osoczu nawet w przypadku stosowania normalnych dawek podawanych w blokadzie nerwów międzyżebrowych. Jednoczesne podanie lidokainy i apryndyny może prowadzić do sumowania niepożądanych działań. Ze względu na podobną budowę chemiczną, działania niepożądane apryndyny i lidokainy są podobne. Zgłaszano synergizm środków miejscowo znieczulających i leków przeciwbólowych o działaniu ośrodkowym, chloroformu, eteru i tiopentalu, w zakresie działań ośrodkowo depresyjnych. Glikozydy nasercowe obniżają toksyczność lidokainy. Pod wpływem lidokainy wydłuża się działanie niedepolaryzujących środków zwiotczających mięśnie, szczególnie chlorku suksametoniowego. Środki pobudzające metabolizm wątrobowy leków poprzez indukcję enzymów mikrosomalnych, np.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlInterakcje
barbiturany (głównie fenobarbital) lub fenytoina, zwiększają klirens lidokainy z osocza, przez co obniżają jej skuteczność. W przypadku jednoczesnego podania lidokainy i wziewnych środków znieczulających ogólnie, działanie depresyjne może ulec nasileniu. Inne interakcje istotne podczas stosowania w znieczuleniu miejscowym Miejscowe działanie znieczulające ulega wydłużeniu po podaniu w mieszaninie z lekiem zwężającym naczynia krwionośne. Podawanie alkaloidów sporyszu, np. ergotaminy, jednocześnie z epinefryną, która może występować w mieszaninie ze środkiem miejscowo znieczulającym, może wywołać znaczne niedociśnienie. Łączenie różnych środków miejscowo znieczulających może prowadzić do sumowania oddziaływań na układ sercowo-krążeniowy i ośrodkowy układ nerwowy. Działanie miejscowo znieczulające lidokainy może zostać wydłużone poprzez dodanie niewielkich ilości atropiny. Przypuszczalnie wynika to ze zmniejszenia przepuszczalności tkanek pod wpływem atropiny.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlInterakcje
Niskie dawki fizostygminy mogą chronić przed toksycznymi skutkami działania lidokainy. Inne interakcje istotne podczas stosowania w leczeniu przeciwarytmicznym Jeśli lidokaina jest podawana jednocześnie z innymi lekami przeciwarytmicznymi, takimi jak blokery receptorów beta lub blokery kanału wapniowego, efekt hamujący przewodzenie przedsionkowo-komorowe i wewnątrzkomorowe może się nasilić. Dodatkowe podanie epinefryny lub norepinefryny może prowadzić do znacznego nasilenia niepożądanych działań kardiologicznych.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlWpływ na płodność, ciążę i laktację
4.6 Ciąża lub laktacja Brak wystarczających danych, aby jednoznacznie ocenić bezpieczeństwo stosowania lidokainy w trakcie ciąży. Odnośnie stosowania w leczeniu przeciwarytmicznym, lidokainę można podać kobietom w ciąży jedynie w bardzo istotnych wskazaniach i w najmniejszych możliwych dawkach. Odnośnie stosowania w miejscowej blokadzie nerwów podczas ciąży, należy zauważyć, że chociaż technika ta łączy się z najniższym ryzykiem spośród różnorodnych interwencji medycznych, lidokainę należy podawać jedynie po wnikliwej analizie możliwych korzyści i zagrożeń, jeżeli brak jest bezpieczniejszych metod postępowania. Znieczulenie nadtwardówkowe w zastosowaniach położniczych jest niewskazane w przypadkach, gdy można przewidywać duże krwawienie lub gdy łożysko jest głęboko zagnieżdżone. W rzadkich przypadkach, podczas porodu, przy którym stosowano znieczulenie miejscowe lidokainą, u noworodka mogą wystąpić objawy toksyczności: bradykardia, blokada przedsionkowo-komorowa i tachykardia komorowa.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlWpływ na płodność, ciążę i laktację
Nie wiadomo, czy lidokaina przenika do mleka kobiecego. W związku z tym, stosowanie lidokainy podczas karmienia piersią wymaga zachowania ostrożności.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Po zastosowaniu lidokainy w zabiegach chirurgicznych, stomatologicznych lub po zabiegach, w których środek stosowany był na dużych powierzchniach ciała, lekarz musi ocenić, czy pacjent jest zdolny do prowadzenia pojazdu lub obsługiwania urządzeń mechanicznych.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
4.8 Działania niepożądane Możliwe działania niepożądane lidokainy są w dużej mierze takie same jak w przypadku innych środków miejscowo znieczulających o budowie amidowej. Niepożądane działania ogólnoustrojowe, których można spodziewać się przy stężeniach w osoczu przekraczających 5-10 mg/l, związane są ze szczegółami zastosowanej techniki wstrzyknięcia, z zaburzeniami farmakokinetyki lub farmakodynamiki. Manifestują się one zarówno objawami neurologicznymi jak i kardiologicznymi. Ciśnienie krwi zazwyczaj wzrasta jedynie nieznacznie przy stężeniach lidokainy w osoczu stosowanych standardowo w praktyce klinicznej, co jest wynikiem dodatniego działania inotropowego i chronotropowego. Nagłe niedociśnienie jako objaw działania kardiotoksycznego może być pierwszą oznaką względnego przedawkowania leku. Podobnie jak w przypadku innych leków miejscowo znieczulających, stosując lidokainę nie można wykluczyć wystąpienia złośliwej hipertermii.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
Zasadniczo, stosowanie lidokainy uznawane jest za bezpieczne u pacjentów ze skłonnością lub hipertermią złośliwą w wywiadzie, chociaż wystąpienie tego powikłania zostało odnotowane u jednego pacjenta, który otrzymał znieczulenie zewnątrzoponowe przy użyciu lidokainy. Po znieczuleniu rdzeniowym często występują przejściowe bóle w kończynach dolnych i w dolnej części grzbietu. Taki ból może utrzymywać się do 5 dni i ustąpi samoistnie. Po blokadach centralnych nerwów – głównie po znieczuleniu podpajęczynówkowym – występują rzadko powikłania neurologiczne, takie jak utrzymujące się parestazje lub porażenia kończyn dolnych oraz nietrzymanie moczu (np. zespół ogona końskiego). W bardzo rzadkich przypadkach, alergia na leki miejscowo znieczulające o budowie amidowej może przejawiać się w postaci pokrzywki, obrzęku, skurczu oskrzeli, zaburzeń oddychania lub krążenia.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
Działanie proarytmiczne, uwidaczniające się w postaci zmian w przebiegu lub zaostrzenia występującej wcześniej arytmii, mogą prowadzić do poważnych zaburzeń czynności serca, grożących możliwym zatrzymaniem akcji serca. Miejscowe zakrzepowe zapalenie żył może wystąpić wskutek długotrwałej infuzji. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 strona internetowa: https://smz.ezdrowie.gov.pl
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy Niskie dawki toksyczne lidokainy powodują pobudzenie ośrodkowego układu nerwowego. Duże przedawkowanie, prowadzące do wysokich stężeń toksycznych w osoczu, powoduje depresję czynności ośrodkowych. Wyróżnia się dwie fazy zatrucia lidokainą: a) Pobudzenie OUN: Nieprzyjemne uczucie w jamie ustnej, parestezja języka, niepokój, delirium, drgawki Układ krążenia: Tachykardia, nadciśnienie, uderzenia gorąca b) Depresja OUN: Śpiączka, zatrzymanie oddychania Układ krążenia: Niewyczuwalny puls, bladość, zatrzymanie akcji serca W początkowym etapie zatrucia środkami miejscowo znieczulającymi u pacjentów występują głównie objawy pobudzenia: niepokój, zawroty głowy, zaburzenia słuchu i wzroku, mrowienie (głównie w języku i ustach), zaburzenie wymowy (dyzartria). Drżenie ciała lub drganie mięśni może być objawem zbliżającego się napadu drgawek.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
Stężenia lidokainy w osoczu nie powodujące drgawek mogą również wywoływać senność lub działać uspokajająco. W trakcie postępującego zatrucia układu ośrodkowego, po fazie drgawek, następuje narastające zaburzenie czynności pnia mózgu w postaci depresji oddychania i śpiączki, a nawet zgonu. Nagłe niedociśnienie jest często pierwszym objawem toksycznego wpływu lidokainy na układ sercowo-naczyniowy. Niedociśnienie jest spowodowane głównie przez ujemnie inotropowe działanie lidokainy i ograniczenie pojemności serca. Te działania toksyczne są jednak mniej groźne niż wpływ na ośrodkowy układ nerwowy. Leczenie doraźne, odtrutki Wystąpienie objawów neurologicznych lub kardiologicznych wymaga podjęcia natychmiastowych działań. Przerwać podawanie środka znieczulającego. Dopilnować, aby drogi oddechowe pozostawały otwarte. Zapewnić wentylację tlenem (100% O2) – wspomaganą lub kontrolowaną – początkowo przy użyciu maski oddechowej, a następnie – w razie potrzeby – również drogą intubacji.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
Podawanie tlenu należy kontynuować aż do przywrócenia normalnego stanu wszystkich krytycznych czynności życiowych. Uważnie monitorować ciśnienie krwi, puls i szerokość źrenic. Środki te należy również zastosować w sytuacji przypadkowego, ogólnego znieczulenia rdzeniowego, co przejawia się najpierw niepokojem, szepczącym głosem i sennością, która może prowadzić do utraty przytomności i zatrzymania oddychania. Ponadto, stosuje się następujące, dodatkowe działania terapeutyczne: W przypadku dużego spadku ciśnienia krwi należy niezwłocznie obniżyć pozycję głowy pacjenta i podać powoli, dożylnie, lek alfa-sympatomimetyczny (na przykład 10 do 20 kropel roztworu 1 mg izoprenaliny w 200 ml roztworu glukozy). Dodatkowo podać również płyn (np. roztwór elektrolitów). Przy nasileniu wagotonii (bradykardia) należy podać dożylnie 0,5 do 1 mg atropiny. W przypadku drgawek, wstrzykiwać dożylnie małe dawki barbituranu o ultrakrótkim działaniu, np.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
tiopentalu (50 do 100 mg), lub diazepamu (5 do 10 mg), lecz tylko do opanowania drgawek. Jeśli drgawki utrzymują się, podać tiopental (250 mg) oraz krótko działający środek zwiotczający mięśnie, przeprowadzić intubację i zapewnić sztuczne oddychanie 100% tlenem. Należy zwrócić uwagę, że sama wentylacja tlenem może stanowić wystarczające leczenie, jeśli zauważy się pierwsze oznaki drgawek. Zakłada się, że zasady postępowania w przypadku zatrzymania akcji serca są znane. W ciężkich przypadkach zaleca się kontakt ze specjalista w dziedzinie anestezjologii i intensywnej terapii. Stosowanie ośrodkowo działających leków analeptycznych jest przeciwwskazane! Brak specyficznej odtrutki. Lidokaina nie jest usuwana podczas dializy.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki miejscowo znieczulające; amidy; lidokaina; kod ATC: N01BB02 Lidokaina jest środkiem miejscowo znieczulającym o budowie amidowej. Hamuje ona czynność struktur przewodzących bodźce, takich jak włókna nerwowe czuciowe, ruchowe i autonomiczne, oraz układu przewodzącego serca. Lidokaina w sposób odwracalny hamuje przewodzenie bodźców we włóknach nerwowych w miejscu zastosowania. Kolejność blokowania czynności nerwów jest następująca: ból, temperatura, dotyk i ucisk. Lidokaina zmniejsza przepuszczalność błony komórkowej dla jonów sodowych, a w wyższych stężeniach również dla jonów potasowych. Prowadzi to do ograniczenia pobudliwości włókien nerwowych, ponieważ wzrost przepuszczalności dla jonów sodowych, generujący potencjał czynnościowy, zostaje spowolniony. Stabilizacja błony komórkowej następuje dzięki wbudowywaniu lipofilnych cząsteczek środka miejscowo znieczulającego do błony komórkowej.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
To wywołuje niespecyficzną ekspansję błony komórkowej i zablokowanie kanałów sodowych. Ponadto, hydrofilne fragmenty cząsteczek, które sięgają do wnętrza porów przewodzących wodę, dodatkowo hamują przepływ elektrolitów. Dlatego też działanie środka znieczulającego zależy od jego pKa oraz od pH środowiska, tzn. od ilości wolnej zasady, której cząsteczki są głównie wbudowywane do lipofilnych błon włókien nerwowych. W tkance objętej stanem zapalnym działanie środka znieczulającego jest osłabione ze względu na niższe pH środowiska. Miejscowe działanie znieczulające lidokainy utrzymuje się przez około 30 minut. Lidokaina jest również lekiem przeciwarytmicznym z grupy Ib (wg Vaughana-Williamsa). W błonach włókien mięśnia sercowego lidokaina hamuje szybki napływ sodu i zwiększa napływ potasu. We włóknach Purkinjego czas trwania potencjału czynnościowego oraz efektywne czasy refrakcji ulegają skróceniu a przewodzenie bodźców jest spowolnione.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
Przewodzenie bodźców w węźle zatokowym i w okolicach nadkomorowych pozostaje praktycznie niezmienione. W mięśniu sercowym zwiększają się progi pobudliwości i fibrylacji. Lidokaina hamuje heterotopowe ośrodki generujące bodźce, potencjały czynnościowe pochodzące z potencjałów opóźnionych i tachyarytmie spowodowane rytmem nawrotnym. Działanie przeciwarytmiczne jest szczególnie silne w przypadku tachykardii. Działanie lidokainy nasila się, jeżeli potencjał spoczynkowy jest mniej negatywny, np. przy hiperkaliemii oraz (lub) niedokrwieniu mięśnia sercowego. W przypadku bardziej negatywnego potencjału spoczynkowego lub hiperpolaryzacji, np. w wyniku hipokaliemii, działanie lidokainy jest słabsze. Działanie lidokainy na kurczliwość mięśnia sercowego, ciśnienie krwi i pojemność minutową serca jest nieznaczne. Pacjenci z zaburzoną czynnością węzła zatokowego mogą jednak reagować dość silnie na działanie lidokainy hamujące przewodzenie.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
Zmniejszony przepływ wieńcowy może ulec zwiększeniu po skorygowaniu arytmii.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Po podaniu dożylnym, przeciwarytmiczne działanie lidokainy rozpoczyna się szybko. Maksymalne stężenie w osoczu występuje po 1-2 minutach. Działanie bolusa utrzymuje się przez 10-20 minut. Aby podtrzymać przeciwarytmiczny efekt lidokainy, podawanie leku musi być kontynuowane w postaci wlewu dożylnego. Terapeutyczne stężenie w osoczu powinno wahać się od 1,5 do 6 mg/l. Powyżej 6 mg/l można spodziewać się toksycznych działań niepożądanych o charakterze neurologicznym i kardiologicznym. Po podaniu dożylnym lek najpierw dociera szybko do narządów intensywnie perfundowanych, po czym ulega redystrybucji do mięśni szkieletowych i tkanki tłuszczowej. Okres półtrwania w fazie alfa-dystrybucji wynosi w przybliżeniu 6-9 minut. Po podaniu domięśniowym 400 mg jednowodnego chlorowodorku lidokainy podczas blokady nerwów międzyżebrowych, maksymalne stężenie w osoczu (Cmax) wynosi 6,48 mg/l i osiągane jest po 5-15 minutach (tmax).
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
Po wlewie ciągłym stężenia stanu równowagi w osoczu osiągano nie wcześniej niż po 6 godzinach (przedział od 5 do 7 godzin). Jednak stężenie lecznicze w surowicy krwi uzyskano już po 15 – 60 minutach. Po podaniu podskórnym wartości Cmax wynosiły odpowiednio 4,91 mg/l (wstrzyknięcie dopochwowe) lub 1,95 mg/l (wstrzyknięcie brzuszne). W badaniu z udziałem pięciu zdrowych ochotników, po policzkowo-szczękowym znieczuleniu nasiękowym przy użyciu 36 mg jednowodnego chlorowodorku lidokainy w 2% roztworze, wartość Cmax wyniosła 0,31 mg/l. Przy wstrzyknięciu nadtwardówkowym, stężenie w osoczu wydaje się być niezależne od zastosowanej dawki. Podanie 400 mg lidokainy dawało wartości Cmax 4,27 mg/l lub 2,65 mg/l. Brak danych na temat farmakokinetyki po podaniu dooponowym. Biodostępność po podaniu doustnym wynosi około 35%, ze względu na efekt pierwszego przejścia. U zdrowych osób objętość dystrybucji lidokainy wynosi 1,5 l/kg (przedział od 1,3 – 1,7 l/kg).
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
Objętość ta jest niższa (0,8 – 1,1 l/kg) w przypadku niewydolności serca, a wyższa (około 2,3 l/kg) w przypadku niewydolności wątroby. U noworodków objętość dystrybucji wynosi w przybliżeniu 2,7 l/kg. Lidokaina i jej metabolit, monoetyloglicynoksylidyd (MEGX), powoli przenikają przez barierę krew-mózg. Lidokaina jest związana z kwaśną glikoproteiną alfa1 w 60-80%. Lidokaina jest szybko metabolizowana w wątrobie przez monooksygenazy, głównie poprzez dealkilację utleniającą, wprowadzanie grup wodorotlenowych do pierścienia aromatycznego i hydrolizę wiązania amidowego. Hydroksylowane pochodne ulegają sprzęganiu. Ogółem, około 90% lidokainy jest metabolizowane do 4-hydroksy-2,6-ksylidyny, glukuronidu 4-hydroksy-2,6-ksylidyny oraz, na dalszym etapie, do monoetyloglicynoksylidydu (MEGX) i glicynoksylidydu (GX), które mogą kumulować się podczas długotrwałej infuzji lub w przypadku niewydolności nerek, ze względu na dłuższy okres półtrwania w porównaniu z samą lidokainą.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
W przypadkach niewydolności wątroby szybkość metabolizmu może być zmniejszona do 10% - 50% wartości normalnej. 5-10% lidokainy wydalane jest z moczem w postaci niezmienionego związku, a pozostała część w postaci metabolitów. Okres półtrwania eliminacji wynosi 1,5 – 2 godzin u osób dorosłych i w przybliżeniu 3 godziny u noworodków. Czas ten ulega wydłużeniu do 4-10 godzin (a nawet do 12 godzin) w przypadku ciężkiej niewydolności serca oraz do 4,5 – 6 godzin w przypadku przewlekłych chorób wątroby wywołanych nadużywaniem alkoholu. Okresy półtrwania aktywnych metabolitów, monoetyloglicynoksylidydu (MEGX) i glicynoksylidydu (GX) wynoszą odpowiednio 2 i 10 godzin. Ulegają one wydłużeniu po zawale serca skutkującym niewydolnością. W przypadku niewydolności nerek, okres półtrwania w osoczu glicynoksylidydu (GX) wynosi w przybliżeniu 10 godzin, a okres półtrwania w osoczu lidokainy wynosi 2-3 godziny.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
W związku z powyższym, w przypadku wielokrotnego podawania dożylnego leku występuje ryzyko kumulacji. Szybkość eliminacji zależy od pH i może zostać zwiększona pod wpływem zakwaszenia moczu. Klirens osocza wynosi 0,95 ml/minutę. Lidokaina przenika przez barierę łożyska. Wskaźnik stężenia dla embriona lub płodu, w stosunku do stężenia w osoczu matki, wynosi 0,4 do 1,3. U noworodków, których matki poddano znieczuleniu przy użyciu lidokainy, stwierdzono poziom stężenia lidokainy w osoczu odpowiadający 40-45% stężenia w osoczu matki. W przypadku noworodków, 50-75% lidokainy jest usuwane przez nerki pod postacią związku niezmienionego. Nie wiadomo, czy lidokaina przenika do mleka kobiecego.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Testy mutagenności lidokainy miały ujemne wyniki. Badania in vitro z podaniem dużych, prawie toksycznych dawek metabolitu lidokainy: 2,6-ksylidyny, wykrywanej u szczurów i ludzi wykazują, że po dalszym metabolizmie może ona działać mutagennie. W długookresowych badaniach rakotwórczości u szczurów, po ekspozycji przez łożysko oraz podawaniu 2,6-ksylidyny po porodzie przez 2 lata w dużych dawkach obserwowano w tym wysoce wrażliwym układzie badawczym powstawanie złośliwych i łagodnych guzów, zwłaszcza jamy nosowej (ethmoturbinalia). Te wyniki mogą mieć znaczenie dla ludzi. W związku z powyższym, nie należy stosować lidokainy w dużych dawkach przez długi okres. W badaniach przeprowadzonych na zwierzętach, po prenatalnej ekspozycji na lidokainę nie stwierdzono dowodów na działanie teratogenne lub działań niepożądanych wpływających na rozwój potomstwa.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedkliniczne dane o bezpieczeństwie
Ekspozycja płodu na duże stężenia lidokainy zaburzała przepływ krwi przez macicę i powodowała drgawki u płodu. Możliwy wpływ na zachowanie potomstwa po prenatalnej ekspozycji nie był wystarczająco badany u zwierząt.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDane farmaceutyczne
6. SZCZEGÓŁOWE DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych sodu chlorek sodu wodorotlenek woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Preparat Lignocain 2% wykazuje niezgodność z roztworami zawierającymi wodorowęglan sodu lub z innymi roztworami zasadowymi i nie powinien być z nimi mieszany. 6.3 Okres ważności Okres ważności produktu leczniczego w opakowaniu do sprzedaży: 3 lata. Trwałość produktu leczniczego po pierwszym otwarciu opakowania: W przypadku podawania leku drogą wlewu ciągłego, produkt powinien zostać podany niezwłocznie po przygotowaniu roztworu. 6.4 Specjalne środki ostrożności przy przechowywaniu Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Ampułki z bezbarwnego szkła lub pojemniki z tworzywa (Mini-Plasco lub Mini-Plasco Connect) w tekturowym pudełku.
- CHPL leku Lignocain 2%, roztwór do wstrzykiwań, 20 mg/mlDane farmaceutyczne
10 ampułek 5 ml 20 pojemników 5 ml 20 pojemników 10 ml 20 pojemników 20 ml 6.6 Instrukcje dotyczące przygotowania produktu leczniczego do stosowania i usuwania jego pozostałości Produkt nadaje się do użycia tylko, gdy roztwór jest przezroczysty a opakowanie nieuszkodzone. Produkt dostarczany jest w pojemnikach jednodawkowych. Niewykorzystaną zawartość należy wyrzucić.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO LIGNOCAINUM HYDROCHLORICUM WZF 1% , 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 10 mg lidokainy chlorowodorku jednowodnego (Lidocaini hydrochloridum). Każda ampułka 2 ml zawiera 20 mg lidokainy chlorowodorku jednowodnego. Każda fiolka 20 ml zawiera 200 mg lidokainy chlorowodorku jednowodnego. Substancja pomocnicza o znanym działaniu: Każdy ml roztworu zawiera 2,75 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań Bezbarwny, przezroczysty płyn.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Znieczulenie regionalne - nasiękowe, blokady nerwów, pni nerwowych i splotów nerwowych, podpajęczynówkowe, zewnątrzoponowe - w chirurgii ogólnej, urologii, ortopedii, ginekologii, położnictwie, ponadto w różnych procedurach diagnostycznych i terapeutycznych. Komorowe zaburzenia rytmu serca (przedwczesne skurcze komorowe, częstoskurcz komorowy), zwłaszcza w przebiegu ostrego zawału mięśnia sercowego lub po przedawkowaniu glikozydów nasercowych. Leczenie bólu w okresie okołooperacyjnym, jako składnik analgezji prewencyjnej (zapobiegawczej) i analgezji multimodalnej (wielokierunkowej). Leczenie bólu neuropatycznego, jako lek drugiego rzutu.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Znieczulenie regionalne Maksymalna dawka jednorazowa lidokainy dla dorosłego pacjenta wynosi 200 mg (4,5 mg/kg mc.). Podane dawki mają charakter orientacyjny i dotyczą osób dorosłych, w dobrym stanie ogólnym, bez chorób współistniejących. U dzieci nie należy przekraczać dawki 3 mg/kg mc. Lidokainę należy dawkować indywidualnie, kierując się masą ciała i stanem ogólnym pacjenta. W trakcie znieczulenia pacjenta należy nadzorować oraz monitorować czynności życiowe. Siła i czas działania lidokainy zależą od stężenia i objętości zastosowanego roztworu. Zwiększenie objętości i stężenia przyspiesza, wydłuża i nasila działanie miejscowo znieczulające. Lidokainę, podobnie jak inne środki miejscowo znieczulające, należy podawać powoli, po uprzednim wykonaniu próby aspiracji, co pozwala uniknąć niezamierzonego podania donaczyniowego.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
Podczas wykonywania znieczulenia zewnątrzoponowego podanie zasadniczej dawki środka znieczulającego należy poprzedzić dawką testową (3 do 5 ml chlorowodorku lidokainy z dodatkiem adrenaliny). Po omyłkowym, donaczyniowym podaniu dawki testowej zawarta w niej adrenalina wywołuje wyraźne przyspieszenie czynności serca. Dlatego przez 5 minut po podaniu należy obserwować zapis EKG na ekranie monitora. Negatywny wynik testu uprawnia do wstrzyknięcia (z szybkością 25 do 50 mg/min) pozostałej dawki środka znieczulającego. W tym czasie należy utrzymywać stały, słowny kontakt z pacjentem i jeżeli pojawią się nawet łagodne objawy przedawkowania, należy natychmiast przerwać iniekcję. Dawka testowa pozwala również uniknąć niebezpieczeństw związanych z niezamierzonym, podpajęczynówkowym wstrzyknięciem produktu z następowym całkowitym znieczuleniem rdzeniowym. Odstępy między kolejnymi, podawanymi zewnątrzoponowo dawkami produktu nie powinny być krótsze niż 90 minut.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
Maksymalna dawka lidokainy podawana w trakcie blokady okołoszyjkowej (podczas porodu i w ginekologii) nie powinna przekraczać 200 mg co 90 minut. Należy zawsze stosować najmniejsze skuteczne dawki lidokainy, aby ograniczyć ryzyko przedawkowania. Produkt można rozcieńczać 0,9% roztworem chlorku sodu. Stężenie leku Rodzaj znieczulenia Dawka maksymalna 0,5 do 2% Znieczulenie nasiękowe Do 200 mg 0,5 do 2% Blokady pni i splotów nerwowych Do 200 mg 0,5 do 2% Znieczulenie zewnątrzoponowe Do 200 mg 1 do 2% Znieczulenie podpajęczynówkowe Do 80 mg (1,5 do 4 ml) 0,5 do 1% Znieczulenie odcinkowe dożylne Do 200 mg Zaburzenia rytmu serca W celu leczenia zaburzeń rytmu u osób dorosłych podaje się dożylnie lidokainę w jednorazowej dawce wynoszącej od 50 do 100 mg, lub w dawkach podzielonych po 25 do 50 mg na minutę. Jeśli początkowa dawka nie była skuteczna, kolejną (50 do 100 mg) można podać po upływie 5 minut. Nie należy przekraczać dawki 200 do 300 mg w ciągu godziny.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
U chorych z tendencją do nawrotów zaburzeń rytmu lub opornych na działanie doustnych leków przeciwarytmicznych można zastosować ciągłą infuzję dożylną lidokainy z szybkością od 1 do 4 mg/min (20 do 50 g/kg mc./min) pod stałą kontrolą EKG. Infuzję należy przerwać, gdy ustąpią zaburzenia rytmu lub pojawią się objawy przedawkowania. U osób w wieku podeszłym należy dawkę dostosować do ogólnego stanu pacjenta. Natomiast zaburzenia rytmu serca u dzieci leczy się lidokainą podawaną dożylnie w dawce 0,8 do 1 mg/kg mc., którą w razie potrzeby można powtarzać do łącznej dawki 3 do 5 mg/kg mc. Lidokainę można również podawać w ciągłej infuzji dożylnej z szybkością 10 do 50 g/kg mc./min. Leczenie bólu w okresie okołooperacyjnym Lidokaina podawana dożylnie w okresie okołooperacyjnym jest stosowana u pacjentów dorosłych jako adiuwant w terapii multimodalnej (wielokierunkowej) i w analgezji prewencyjnej (zapobiegawczej).
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
Lidokainę podaje się dożylnie w zabiegach operacyjnych z niewielkim do znacznego i rozległego urazem tkanek. Zazwyczaj stosowane dawkowanie: dawka nasycająca 1,5 mg/kg mc. podawana w bolusie, a następnie 1,5 do 3 mg/kg mc./godz. w infuzji ciągłej w trakcie operacji; zalecane jest rozpoczęcie podawania lidokainy 30 minut przed indukcją znieczulenia, jednak nie później niż w czasie indukcji znieczulenia; w okresie pooperacyjnym: 1 do 3 mg/kg mc./godz. w infuzji ciągłej przez 24 do 48 godz. Jeśli u pacjenta lidokaina stosowana jest jednocześnie jako lek znieczulający miejscowo (nasiękowo), np. w celu ostrzyknięcia przewidywanej linii cięcia oraz w infuzji dożylnej, całkowitą dawkę lidokainy należy zmniejszyć. Jeśli istnieje taka konieczność, infuzję dożylną lidokainy można rozpocząć 4 do 8 godzin po podaniu ostatniej dawki (w bolusie) leku stosowanego w znieczuleniu regionalnym.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
W przypadku nieudanego znieczulenia zewnątrzoponowego, po zatrzymaniu infuzji ciągłej do przestrzeni zewnątrzoponowej i bez podania dawki do przestrzeni zewnątrzoponowej w bolusie, ciągła infuzja dożylna lidokainy może być rozpoczęta natychmiast, ale bez podania dożylnego w bolusie. Dawkę lidokainy należy zmniejszyć w stanach, w których może dojść do zwiększenia wolnej frakcji leku w surowicy – kwasicy, hiperkapnii, hipoksji, hipoproteinemii oraz zaburzeń czynności wątroby i (lub) nerek. U pacjentów z niewydolnością krążenia, wątroby i (lub) nerek należy zmniejszyć dawkę lidokainy i monitorować czynność układu krążenia. Leczenie pacjentów z bólem neuropatycznym Dorośli: Infuzja ciągła dożylna w dawce 3-5 mg/kg mc. przez minimum 30 minut, ale nie dłużej niż 6 godzin, raz na dobę. Sposób podawania Produkt można stosować dożylnie, nasiękowo, podpajęczynówkowo i zewnątrzoponowo.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub inne leki miejscowo znieczulające o budowie amidowej, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Ogólne przeciwwskazania do wykonywania znieczulenia podpajęczynówkowego i zewnątrzoponowego, niezależnie od rodzaju środka znieczulającego: ostre choroby ośrodkowego układu nerwowego (np. zapalenie opon mózgowo-rdzeniowych, guzy, zapalenie istoty szarej rdzenia, krwawienie śródczaszkowe); zwężenie kanału rdzenia kręgowego, czynne choroby kręgosłupa (np. proces zapalny, gruźlica kręgosłupa, guzy) lub niedawno przebyte urazy kręgosłupa (np. złamania); posocznica; podostre zwyrodnienie rdzenia kręgowego w przebiegu niedokrwistości złośliwej; zakażenie skóry w miejscu wykonywania znieczulenia lub w jego okolicy; wstrząs kardiogenny lub hipowolemiczny; zaburzenia krzepnięcia lub leczenie lekami przeciwzakrzepowymi.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlPrzeciwwskazania
Infuzja dożylna lidokainy stosowanej w leczeniu bólu w okresie okołooperacyjnym jest przeciwwskazana, jeżeli jednocześnie stosowane jest znieczulenie regionalne, szczególnie takie, w którym podaje się lek znieczulenia miejscowego w bolusie lub w dużych dawkach (np. znieczulenie zewnątrzoponowe, znieczulenia pni i splotów nerwowych).
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Znieczulenie miejscowe za pomocą lidokainy może być wykonywane wyłącznie przez lekarzy dobrze znających technikę znieczuleń oraz przeszkolonych w diagnostyce i leczeniu następstw przedawkowania lidokainy, które mogą pojawić się w trakcie znieczulenia regionalnego. W pomieszczeniu, w którym wykonywane są znieczulenia, musi znajdować się źródło tlenu, sprzęt resuscytacyjny i niezbędne leki. Przed przystąpieniem do znieczulenia należy zapewnić dostęp do żyły. Opóźnienie podjęcia działań resuscytacyjnych może prowadzić do niedotlenienia, kwasicy, zatrzymania czynności serca, a nawet zgonu pacjenta. Każde wstrzyknięcie lidokainy w celu znieczulenia należy poprzedzić próbą aspiracji, aby uniknąć niezamierzonego podania donaczyniowego. Warunki bezpiecznego stosowania lidokainy: odpowiednie dawkowanie, poprawna technika znieczulenia, przestrzeganie środków ostrożności oraz gotowość do podjęcia postępowania resuscytacyjnego.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Powtarzanie dawek lidokainy może doprowadzić do niebezpiecznie wysokiego wzrostu stężenia w surowicy. Ponieważ ogólna reakcja na wysokie stężenie zależy od stanu pacjenta, u osób wyniszczonych, w podeszłym wieku oraz dzieci należy dostosować dawkę do masy ciała i stanu zdrowia. Lidokaina jest metabolizowana w wątrobie, dlatego w przypadkach niewydolności wątroby należy uwzględnić możliwość zwiększenia stężenia lidokainy w płynach ustrojowych. Podczas znieczulenia należy stale monitorować stan świadomości oraz czynność układów krążenia i oddychania. Wczesnymi objawami toksycznych stężeń lidokainy w ośrodkowym układzie nerwowym są: metaliczny smak w ustach, niepokój, szumy uszne, zawroty głowy, zaburzenia widzenia, drżenia mięśniowe lub senność. Przestrzeganie środków ostrożności jest szczególnie ważne podczas wykonywania znieczuleń w obrębie głowy i szyi. Znieczulenie w obrębie głowy i szyi może wywołać objawy zatrucia mimo zastosowania dopuszczalnej dawki środka znieczulającego.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Opisywano w tych przypadkach zaburzenia świadomości, drgawki, depresję układów oddechowego i krążenia. Powyższe reakcje mogą być następstwem niezamierzonego donaczyniowego podania lidokainy. Szczególnie groźne mogą być konsekwencje wstrzyknięcia produktu do światła tętnicy zaopatrującej ośrodkowy układ nerwowy. Należy zachować ostrożność podając lidokainę zewnątrzoponowo pacjentom z blokiem serca, a także ciężkim nadciśnieniem tętniczym. Przed wykonaniem znieczulenia podpajęczynówkowego, bez względu na zastosowany środek miejscowo znieczulający, należy rozważyć potencjalne ryzyko i korzyść dla pacjenta. Groźnym powikłaniem znieczuleń centralnych jest całkowite znieczulenie rdzeniowe, które jest następstwem podania do przestrzeni podpajęczynówkowej zbyt dużej dawki środka miejscowo znieczulającego. W rezultacie dochodzi do niewydolności układów krążenia i oddechowego.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Niewydolność krążenia jest spowodowana rozległą blokadą układu współczulnego, której objawami są niedociśnienie, znaczna bradykardia lub nawet zatrzymanie pracy serca. Niewydolność oddechowa jest spowodowana porażeniem mięśni oddechowych w wyniku zahamowania przewodnictwa w nerwach zaopatrujących mięśnie oddechowe, w tym również przeponę. Ryzyko wystąpienia wysokiego znieczulenia podpajęczynówkowego jest większe u pacjentów otyłych, z nadciśnieniem wewnątrzbrzusznym oraz u kobiet w zaawansowanej ciąży. W tych przypadkach należy zmniejszyć dawkę środka miejscowo znieczulającego. Natomiast całkowite znieczulenie rdzeniowe jest zazwyczaj rezultatem niezamierzonego, omyłkowego podania do przestrzeni podpajęczynówkowej dawki leku przeznaczonej do znieczulenia zewnątrzoponowego. Wykonanie znieczulenia podpajęczynówkowego u pacjenta z hipowolemią (niezależnie od rodzaju i dawki zastosowanego środka miejscowo znieczulającego) może doprowadzić do nagłego i znacznego obniżenia ciśnienia tętniczego.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Trwałe powikłania neurologiczne (brak czucia, zaburzenia czynności ruchowych lub porażenia) bardzo rzadko są następstwem znieczulenia podpajęczynówkowego. Zaleca się zachowanie ostrożności u pacjentów z zaburzeniami neurologicznymi, takimi jak stwardnienie rozsiane, porażenie połowicze, porażenie poprzeczne, zaburzenia nerwowo-mięśniowe, mimo że nie obserwowano nasilenia tych zaburzeń po wykonaniu znieczulenia podpajęczynówkowego. Przed podaniem lidokainy w leczeniu bólu w okresie okołooperacyjnym oraz w leczeniu bólu neuropatycznego, jako leku drugiego rzutu, należy u pacjenta wykluczyć i (lub) wyrównać zaburzenia gospodarki wodno-elektrolitowej. Produkt leczniczy zawiera 2,75 mg sodu na każdy ml roztworu, co odpowiada 0,14% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych. Ampułki 2 ml: Produkt leczniczy zawiera 5,5 mg sodu na ampułkę 2 ml, co odpowiada 0,28% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Fiolki 20 ml: Produkt leczniczy zawiera 55 mg sodu na fiolkę 20 ml, co odpowiada 2,75% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych. Produkt może być rozcieńczany w 0,9% roztworze chlorku sodu. Zawartość sodu pochodzącego z rozcieńczalnika powinna być brana pod uwagę w obliczeniu całkowitej zawartości sodu w przygotowanym rozcieńczeniu produktu. W celu uzyskania dokładnej informacji dotyczącej zawartości sodu w roztworze wykorzystanym do rozcieńczenia produktu, należy zapoznać się z charakterystyką produktu leczniczego stosowanego rozcieńczalnika. U pacjentów ze zmniejszoną czynnością nerek należy uwzględnić zawartość sodu w produkcie gotowym do podania.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Stosowane w celu leczenia drgawek pochodne hydantoiny (np. fenytoina) mogą nasilać kardiodepresyjne działanie lidokainy, ale mogą również przyspieszać jej metabolizm na skutek indukcji enzymatycznej. Jednoczesne, uzasadnione terapeutycznie stosowanie lidokainy z innymi lekami przeciwarytmicznymi może nasilać jej niepożądane działania. Leki beta-adrenolityczne mogą spowolniać metabolizm lidokainy w wątrobie i nasilać jej toksyczność. Cymetydyna hamuje metabolizm lidokainy, zmniejsza jej klirens wątrobowy i zwiększa stężenie w osoczu. Duże dawki lidokainy mogą nasilać działanie środków zwiotczających mięśnie. Lidokaina podawana dożylnie może nasilić działanie analgetyczne leków przeciwbólowych stosowanych w monoterapii. Okołooperacyjne zastosowanie lidokainy zmniejsza zapotrzebowanie na opioidy.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Badania przeprowadzone na zwierzętach nie wykazały teratogennego działania lidokainy. Nie przeprowadzono jednak dostatecznie dużych, dobrze kontrolowanych badań u ciężarnych kobiet. W związku z tym, tylko w wyjątkowych przypadkach produkt może być stosowany u ciężarnych w czasie trwania organogenezy. Okres porodu Środki miejscowo znieczulające podawane w trakcie porodu z łatwością przenikają przez łożysko, w związku z czym mogą wywoływać objawy zatrucia zarówno u matki jak i płodu. Toksyczność lidokainy zależy od metody i techniki znieczulenia oraz zastosowanej dawki. Zatrucie lidokainą wywołuje u płodu zaburzenia czynności serca. Zastosowanie środków o budowie amidowej do blokady okołoszyjkowej w trakcie porodu wywołuje bradykardię u około 30% płodów. Dlatego wskazane jest stałe monitorowanie tętna płodu. Zbyt wysokie stężenie lidokainy we krwi matki może wywołać spadek ciśnienia tętniczego.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlWpływ na płodność, ciążę i laktację
Znieczulenie może też hamować czynność skurczową macicy i przedłużać poród. Podejmując decyzję o zastosowaniu znieczulenia okołoszyjkowego w szczególnych sytuacjach położniczych, takich jak: poród przedwczesny, zatrucie ciążowe oraz stan wewnątrzmacicznego zagrożenia płodu, należy rozważyć, czy oczekiwane korzyści przeważają nad potencjalnym ryzykiem. U noworodków, których matki otrzymywały podczas porodu niektóre środki miejscowo znieczulające, obserwowano w pierwszych dwu dniach życia obniżone napięcie mięśni szkieletowych. Jednak nie wiadomo, czy wiąże się to z jakimiś odległymi skutkami. Karmienie piersi? Ponieważ lidokaina przenika do mleka, stosowanie u kobiet karmiących piersią wymaga zachowania ostrożności.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Wpływ lidokainy na zdolność prowadzenia pojazdów i obsługiwania maszyn zależy od rodzaju przeprowadzanego zabiegu i ilości zastosowanej lidokainy. Po znieczuleniu lidokainą pacjent nie powinien prowadzić pojazdów i obsługiwać maszyn przez co najmniej 24 godziny po zakończeniu zabiegu.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane lidokainy są zazwyczaj rezultatem jej nadmiernego stężenia w płynach ustrojowych w wyniku zastosowania zbyt dużej dawki (przedawkowanie względne lub bezwzględne), zaburzeń kinetyki lub niewłaściwej techniki wstrzykiwania. Działania niepożądane zostały podzielone ze względu na częstość występowania: bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia układu immunologicznego Bardzo rzadko: reakcje nadwrażliwości (zwykle zmiany skórne, pokrzywka, obrzęki); Częstość nieznana: reakcje anafilaktoidalne. Zaburzenia układu nerwowego Bardzo rzadko: brak czucia, zaburzenia czynności ruchowych lub porażenia (są następstwem znieczulenia podpajęczynówkowego); Częstość nieznana: metaliczny smak w ustach, uczucie oszołomienia, pobudzenie, niepokój, euforia, drżenia mięśniowe, senność, zaburzenia świadomości, bóle i zawroty głowy, szumy uszne, parestezje, utrata świadomości, drgawki, całkowite znieczulenie rdzeniowe (w następstwie omyłkowego podania do przestrzeni podpajęczynówkowej zbyt dużej dawki lidokainy), wysokie znieczulenie podpajęczynówkowe (w następstwie podania do przestrzeni podpajęczynówkowej zbyt dużej dawki lidokainy).
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlDziałania niepożądane
Zaburzenia oka Częstość nieznana: zaburzenia widzenia. Zaburzenia serca Częstość nieznana: bradykardia, zatrzymanie czynności serca (w skrajnie ciężkich przypadkach). Zaburzenia naczyniowe Częstość nieznana: niedociśnienie. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Częstość nieznana: zaburzenia oddychania, w tym zatrzymanie oddechu. Zaburzenia żołądka i jelit Częstość nieznana: nudności, wymioty. Po dożylnym zastosowaniu lidokainy w analgezji multimodalnej (wielokierunkowej) najczęściej występowały: senność, uczucie zmęczenia, nudności, drętwienie warg, metaliczny smak w ustach i zawroty głowy. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy toksyczne pojawiają się po przekroczeniu określonego stężenia lidokainy w surowicy i zależą od podanej dawki, dodatku leków obkurczających naczynia krwionośne, miejsca wstrzyknięcia, dystrybucji w tkankach, metabolizmu i stanu ogólnego pacjenta. Przedawkowanie może być rezultatem: przedawkowania względnego, gdy lek zostaje podany bezpośrednio do naczynia krwionośnego lub w okolicę bogato unaczynioną; przedawkowania bezwzględnego, gdy zostaje przekroczona dawka dopuszczalna. Objawy przedawkowania: faza pobudzenia ośrodkowego układu nerwowego - zaburzenia czucia w obrębie warg i języka, metaliczny smak w ustach, niespójność mowy, zawroty głowy, szumy uszne, zaburzenia widzenia, dreszcze, pobudzenie ruchowe, drżenia mięśni, drgawki; faza depresji ośrodkowego układu nerwowego - śpiączka, depresja oddychania i krążenia.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlPrzedawkowanie
Ponadto mogą wystąpić: tachykardia, wzrost ciśnienia tętniczego i oporu naczyniowego, osłabienie automatyzmu serca, bradykardia, asystolia, rozszerzenie oskrzeli. Objawy zatrucia są wskazaniem do natychmiastowego przerwania podawania leku. Jeżeli ich natężenie jest niewielkie (zaburzenia widzenia, zawroty głowy) należy uspokoić pacjenta, podać mu tlen do oddychania i sprawdzić dostęp do żyły. W przypadku silniejszej reakcji toksycznej (ograniczenie świadomości i drżenia mięśni), gdy to konieczne, należy zastosować wentylację zastępczą płuc, dożylnie podać leki podwyższające ciśnienie tętnicze (efedryna, katecholaminy) oraz leki przeciwdrgawkowe (midazolam lub diazepam). Jeśli dochodzi do utraty świadomości z drgawkami kloniczno-tonicznymi, należy natychmiast zaintubować pacjenta i podjąć wentylację zastępczą płuc 100% tlenem, podać dożylnie leki przeciwdrgawkowe (diazepam, propofol, tiopental), korygować kwasicę i leczyć objawowo zgodnie z zasadami intensywnej terapii.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlPrzedawkowanie
Dializa w przypadkach ostrego przedawkowania lidokainy nie jest skuteczna.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwarytmiczne klasy IB, kod ATC: C01BB01 Grupa farmakoterapeutyczna: leki miejscowo znieczulające; amidy, kod ATC: N01BB02 Lidokaina jest środkiem miejscowo znieczulającym i przeciwarytmicznym o budowie amidowej. Hamuje powstawanie i przewodzenie bodźców we włóknach nerwowych i układzie przewodzącym serca. Lidokaina blokuje kanały sodowe błon komórek nerwowych. Zahamowanie napływu jonów Na+ uniemożliwia generowanie i przewodzenie impulsów pojawiających się w odpowiedzi na depolaryzację. Wzrasta próg pobudliwości włókien nerwowych aż do całkowitego zablokowania przewodzenia. Stężenie lidokainy blokujące przewodnictwo jest odwrotnie proporcjonalne do średnicy włókna. W pierwszej kolejności blokowane są cienkie włókna bólowe, następnie grubsze czuciowe. Do zablokowania włókien ruchowych (najgrubszych) konieczne są najwyższe stężenia lidokainy.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakodynamiczne
Przeciwarytmiczne działanie lidokainy jest rezultatem blokowania kanału sodowego. Lidokaina zaliczana jest do leków przeciwarytmicznych grupy I B wg Vaughna - Williamsa (nie wpływa na czas trwania potencjału czynnościowego). Lidokaina blokuje kanały sodowe i hamuje aktywność bioelektryczną w zdepolaryzowanym mięśniu serca. Natomiast w niewielkim stopniu wpływa na mięsień niezdepolaryzowany oraz na układ przewodzący. Dlatego jest skuteczna w leczeniu zaburzeń rytmu, związanych z depolaryzacją (np. niedokrwienie, przedawkowanie glikozydów nasercowych), natomiast jej działanie w zaburzeniach rytmu powstających w tkance niezdepolaryzowanej jest niewielkie. Lidokaina hamuje depolaryzację diastoliczną i automatyzm komór w układzie przewodzącym. Lidokaina w stężeniach terapeutycznych: nieznaczne obniża rzut serca, opór obwodowy i ciśnienie tętnicze; nie wykazuje wpływu na przedsionki, kurczliwość mięśnia sercowego oraz przewodnictwo przedsionkowo-komorowe.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakodynamiczne
Badania kliniczne wykazały skuteczność analgetyczną lidokainy podawanej w okresie okołooperacyjnym i poprawę czynności motorycznej jelit po zabiegach radykalnej prostatektomii, a w operacjach brzusznych (laparoskopowych i laparotomiach), mniejszy odsetek atonii i niedrożności pooperacyjnej jelit, nudności i wymiotów, co przełożyło się na skrócenie czasu hospitalizacji. Okołooperacyjne zastosowanie lidokainy zmniejsza zapotrzebowanie na opioidy. Oprócz działania analgetycznego, lidokaina stosowana dożylnie hamuje reakcję zapalną indukowaną zabiegiem operacyjnym. Uważa się, że wynikiem jej stosowania w okresie pooperacyjnym jest zmniejszenie osoczowych stężeń, m.in. IL-6, IL-8, C3a, IL-1ra, CD11b, L- i P-selektyny. Ponadto skuteczność analgetyczna lidokainy może być znacząco większa w bólu trzewnym niż w bólu somatycznym.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Lidokaina wchłania się całkowicie z miejsca zdeponowania w tkankach. Szybkość narastania stężenia we krwi zależy od wielu czynników, spośród których ważne jest miejsce podania. Najwyższe stężenie lidokainy w osoczu (poza przypadkami, gdy podawana jest dożylnie) stwierdza się w trakcie blokady nerwów międzyżebrowych, nieco niższe w trakcie znieczulenia zewnątrzoponowego, natomiast najniższe w trakcie znieczulenia nasiękowego. Stopień wiązania lidokainy z białkami zależy od stężenia w osoczu. Przy stężeniach od 1 μg/ml do 4 μg/ml z białkami wiąże się od 40% do 80% środka. Lidokaina przenika przez barierę krew-mózg i przez łożysko, docierając do krążenia płodu. Lidokaina jest bardzo szybko metabolizowana w wątrobie do kilku pochodnych N-dealkilowanych, które wykazują słabszą aktywność farmakologiczną. Lek jest wydalany przez nerki przede wszystkim w postaci metabolitów, a tylko 10% w postaci niezmienionej.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakokinetyczne
Po wstrzyknięciu dożylnym okres półtrwania w surowicy wynosi 1,6 godz. Kinetyka zmienia się u osób z upośledzoną czynnością wątroby, u których okres półtrwania może być wydłużony nawet dwukrotnie. Upośledzenie czynności nerek nie ma wpływu na kinetykę lidokainy, jakkolwiek w tych przypadkach stwierdza się podwyższone stężenie metabolitów we krwi. Po przekroczeniu stężenia 6 μg/ml surowicy krwi występuje toksyczne działanie na ośrodkowy układ nerwowy w postaci drgawek. Objawy zatrucia może potęgować kwasica oraz stosowanie leków pobudzających aktywność OUN. Dodanie noradrenaliny ogranicza szybkość wchłaniania z tkanek do krwiobiegu, dzięki czemu wydłuża się czas działania oraz zmniejsza stężenie w surowicy; pozwala to na zastosowanie większej dawki. Skuteczne działanie przeciwbólowe lidokainy podawanej dożylnie w okresie okołooperacyjnym uzyskiwane jest po osiągnięciu stężenia w surowicy wynoszącego 1,1-4,2 μg/ml.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach lidokaina nie wywołuje teratogennego działania w dawkach przekraczających dawki stosowane u ludzi 6,6-krotnie. Nie prowadzono badań dotyczących działania rakotwórczego i mutagennego oraz wpływu na płodność u zwierząt.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Sodu wodorotlenek 10% (do ustalenia pH) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Produkt wykazuje niezgodność i nie powinien być mieszany w jednej strzykawce z roztworami zawierającymi wodorowęglan sodu oraz innymi roztworami o odczynie zasadowym. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem, w temperaturze poniżej 25°C. Nie zamrażać. 6.5 Rodzaj i zawartość opakowania 10 ampułek z bezbarwnego szkła po 2 ml w tekturowym pudełku. 5 fiolek z bezbarwnego szkła po 20 ml w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Po pobraniu pierwszej dawki niezużytą w ciągu 24 godzin zawartość fiolki należy zniszczyć.
- CHPL leku Lignocainum hydrochloricum WZF 1%, roztwór do wstrzykiwań, 10 mg/mlDane farmaceutyczne
Instrukcja otwierania ampułki Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu. Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia. Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki. Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3. Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO LIGNOCAINUM HYDROCHLORICUM WZF 1% , 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 10 mg lidokainy chlorowodorku jednowodnego (Lidocaini hydrochloridum). Każda ampułka 2 ml zawiera 20 mg lidokainy chlorowodorku jednowodnego. Każda fiolka 20 ml zawiera 200 mg lidokainy chlorowodorku jednowodnego. Substancja pomocnicza o znanym działaniu: Każdy ml roztworu zawiera 2,75 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań Bezbarwny, przezroczysty płyn.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Znieczulenie regionalne - nasiękowe, blokady nerwów, pni nerwowych i splotów nerwowych, podpajęczynówkowe, zewnątrzoponowe - w chirurgii ogólnej, urologii, ortopedii, ginekologii, położnictwie, ponadto w różnych procedurach diagnostycznych i terapeutycznych. Komorowe zaburzenia rytmu serca (przedwczesne skurcze komorowe, częstoskurcz komorowy), zwłaszcza w przebiegu ostrego zawału mięśnia sercowego lub po przedawkowaniu glikozydów nasercowych. Leczenie bólu w okresie okołooperacyjnym, jako składnik analgezji prewencyjnej (zapobiegawczej) i analgezji multimodalnej (wielokierunkowej). Leczenie bólu neuropatycznego, jako lek drugiego rzutu.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Znieczulenie regionalne Maksymalna dawka jednorazowa lidokainy dla dorosłego pacjenta wynosi 200 mg (4,5 mg/kg mc.). Podane dawki mają charakter orientacyjny i dotyczą osób dorosłych, w dobrym stanie ogólnym, bez chorób współistniejących. U dzieci nie należy przekraczać dawki 3 mg/kg mc. Lidokainę należy dawkować indywidualnie, kierując się masą ciała i stanem ogólnym pacjenta. W trakcie znieczulenia pacjenta należy nadzorować oraz monitorować czynności życiowe. Siła i czas działania lidokainy zależą od stężenia i objętości zastosowanego roztworu. Zwiększenie objętości i stężenia przyspiesza, wydłuża i nasila działanie miejscowo znieczulające. Lidokainę, podobnie jak inne środki miejscowo znieczulające, należy podawać powoli, po uprzednim wykonaniu próby aspiracji, co pozwala uniknąć niezamierzonego podania donaczyniowego.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
Podczas wykonywania znieczulenia zewnątrzoponowego podanie zasadniczej dawki środka znieczulającego należy poprzedzić dawką testową (3 do 5 ml chlorowodorku lidokainy z dodatkiem adrenaliny). Po omyłkowym, donaczyniowym podaniu dawki testowej zawarta w niej adrenalina wywołuje wyraźne przyspieszenie czynności serca. Dlatego przez 5 minut po podaniu należy obserwować zapis EKG na ekranie monitora. Negatywny wynik testu uprawnia do wstrzyknięcia (z szybkością 25 do 50 mg/min) pozostałej dawki środka znieczulającego. W tym czasie należy utrzymywać stały, słowny kontakt z pacjentem i jeżeli pojawią się nawet łagodne objawy przedawkowania, należy natychmiast przerwać iniekcję. Dawka testowa pozwala również uniknąć niebezpieczeństw związanych z niezamierzonym, podpajęczynówkowym wstrzyknięciem produktu z następowym całkowitym znieczuleniem rdzeniowym. Odstępy między kolejnymi, podawanymi zewnątrzoponowo dawkami produktu nie powinny być krótsze niż 90 minut.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
Maksymalna dawka lidokainy podawana w trakcie blokady okołoszyjkowej (podczas porodu i w ginekologii) nie powinna przekraczać 200 mg co 90 minut. Należy zawsze stosować najmniejsze skuteczne dawki lidokainy, aby ograniczyć ryzyko przedawkowania. Produkt można rozcieńczać 0,9% roztworem chlorku sodu. Stężenie leku Rodzaj znieczulenia Dawka maksymalna 0,5 do 2% Znieczulenie nasiękowe - Do 200 mg 0,5 do 2% Blokady pni i splotów nerwowych - Do 200 mg 0,5 do 2% Znieczulenie zewnątrzoponowe - Do 200 mg 1 do 2% Znieczulenie podpajęczynówkowe - Do 80 mg (1,5 do 4 ml) 0,5 do 1% Znieczulenie odcinkowe dożylne - Do 200 mg Zaburzenia rytmu serca W celu leczenia zaburzeń rytmu u osób dorosłych podaje się dożylnie lidokainę w jednorazowej dawce wynoszącej od 50 do 100 mg, lub w dawkach podzielonych po 25 do 50 mg na minutę. Jeśli początkowa dawka nie była skuteczna, kolejną (50 do 100 mg) można podać po upływie 5 minut.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
Nie należy przekraczać dawki 200 do 300 mg w ciągu godziny. U chorych z tendencją do nawrotów zaburzeń rytmu lub opornych na działanie doustnych leków przeciwarytmicznych można zastosować ciągłą infuzję dożylną lidokainy z szybkością od 1 do 4 mg/min (20 do 50 µg/kg mc./min) pod stałą kontrolą EKG. Infuzję należy przerwać, gdy ustąpią zaburzenia rytmu lub pojawią się objawy przedawkowania. U osób w wieku podeszłym należy dawkę dostosować do ogólnego stanu pacjenta. Natomiast zaburzenia rytmu serca u dzieci leczy się lidokainą podawaną dożylnie w dawce 0,8 do 1 mg/kg mc., którą w razie potrzeby można powtarzać do łącznej dawki 3 do 5 mg/kg mc. Lidokainę można również podawać w ciągłej infuzji dożylnej z szybkością 10 do 50 µg/kg mc./min. Leczenie bólu w okresie okołooperacyjnym Lidokaina podawana dożylnie w okresie okołooperacyjnym jest stosowana u pacjentów dorosłych jako adiuwant w terapii multimodalnej (wielokierunkowej) i w analgezji prewencyjnej (zapobiegawczej).
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
Lidokainę podaje się dożylnie w zabiegach operacyjnych z niewielkim do znacznego i rozległego urazem tkanek. Zazwyczaj stosowane dawkowanie: dawka nasycająca 1,5 mg/kg mc. podawana w bolusie, a następnie 1,5 do 3 mg/kg mc./godz. w infuzji ciągłej w trakcie operacji; zalecane jest rozpoczęcie podawania lidokainy 30 minut przed indukcją znieczulenia, jednak nie później niż w czasie indukcji znieczulenia; w okresie pooperacyjnym: 1 do 3 mg/kg mc./godz. w infuzji ciągłej przez 24 do 48 godz. Jeśli u pacjenta lidokaina stosowana jest jednocześnie jako lek znieczulający miejscowo (nasiękowo), np. w celu ostrzyknięcia przewidywanej linii cięcia oraz w infuzji dożylnej, całkowitą dawkę lidokainy należy zmniejszyć. Jeśli istnieje taka konieczność, infuzję dożylną lidokainy można rozpocząć 4 do 8 godzin po podaniu ostatniej dawki (w bolusie) leku stosowanego w znieczuleniu regionalnym.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
W przypadku nieudanego znieczulenia zewnątrzoponowego, po zatrzymaniu infuzji ciągłej do przestrzeni zewnątrzoponowej i bez podania dawki do przestrzeni zewnątrzoponowej w bolusie, ciągła infuzja dożylna lidokainy może być rozpoczęta natychmiast, ale bez podania dożylnego w bolusie. Dawkę lidokainy należy zmniejszyć w stanach, w których może dojść do zwiększenia wolnej frakcji leku w surowicy – kwasicy, hiperkapnii, hipoksji, hipoproteinemii oraz zaburzeń czynności wątroby i (lub) nerek. U pacjentów z niewydolnością krążenia, wątroby i (lub) nerek należy zmniejszyć dawkę lidokainy i monitorować czynność układu krążenia. Leczenie pacjentów z bólem neuropatycznym Dorośli: Infuzja ciągła dożylna w dawce 3-5 mg/kg mc. przez minimum 30 minut, ale nie dłużej niż 6 godzin, raz na dobę. Sposób podawania Produkt można stosować dożylnie, nasiękowo, podpajęczynówkowo i zewnątrzoponowo.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub inne leki miejscowo znieczulające o budowie amidowej, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Ogólne przeciwwskazania do wykonywania znieczulenia podpajęczynówkowego i zewnątrzoponowego, niezależnie od rodzaju środka znieczulającego: ostre choroby ośrodkowego układu nerwowego (np. zapalenie opon mózgowo-rdzeniowych, guzy, zapalenie istoty szarej rdzenia, krwawienie śródczaszkowe); zwężenie kanału rdzenia kręgowego, czynne choroby kręgosłupa (np. proces zapalny, gruźlica kręgosłupa, guzy) lub niedawno przebyte urazy kręgosłupa (np. złamania); posocznica; podostre zwyrodnienie rdzenia kręgowego w przebiegu niedokrwistości złośliwej; zakażenie skóry w miejscu wykonywania znieczulenia lub w jego okolicy; wstrząs kardiogenny lub hipowolemiczny; zaburzenia krzepnięcia lub leczenie lekami przeciwzakrzepowymi.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlPrzeciwwskazania
Infuzja dożylna lidokainy stosowanej w leczeniu bólu w okresie okołooperacyjnym jest przeciwwskazana, jeżeli jednocześnie stosowane jest znieczulenie regionalne, szczególnie takie, w którym podaje się lek znieczulenia miejscowego w bolusie lub w dużych dawkach (np. znieczulenie zewnątrzoponowe, znieczulenia pni i splotów nerwowych).
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Znieczulenie miejscowe za pomocą lidokainy może być wykonywane wyłącznie przez lekarzy dobrze znających technikę znieczuleń oraz przeszkolonych w diagnostyce i leczeniu następstw przedawkowania lidokainy, które mogą pojawić się w trakcie znieczulenia regionalnego. W pomieszczeniu, w którym wykonywane są znieczulenia, musi znajdować się źródło tlenu, sprzęt resuscytacyjny i niezbędne leki. Przed przystąpieniem do znieczulenia należy zapewnić dostęp do żyły. Opóźnienie podjęcia działań resuscytacyjnych może prowadzić do niedotlenienia, kwasicy, zatrzymania czynności serca, a nawet zgonu pacjenta. Każde wstrzyknięcie lidokainy w celu znieczulenia należy poprzedzić próbą aspiracji, aby uniknąć niezamierzonego podania donaczyniowego. Warunki bezpiecznego stosowania lidokainy: odpowiednie dawkowanie, poprawna technika znieczulenia, przestrzeganie środków ostrożności oraz gotowość do podjęcia postępowania resuscytacyjnego.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Powtarzanie dawek lidokainy może doprowadzić do niebezpiecznie wysokiego wzrostu stężenia w surowicy. Ponieważ ogólna reakcja na wysokie stężenie zależy od stanu pacjenta, u osób wyniszczonych, w podeszłym wieku oraz dzieci należy dostosować dawkę do masy ciała i stanu zdrowia. Lidokaina jest metabolizowana w wątrobie, dlatego w przypadkach niewydolności wątroby należy uwzględnić możliwość zwiększenia stężenia lidokainy w płynach ustrojowych. Podczas znieczulenia należy stale monitorować stan świadomości oraz czynność układów krążenia i oddychania. Wczesnymi objawami toksycznych stężeń lidokainy w ośrodkowym układzie nerwowym są: metaliczny smak w ustach, niepokój, szumy uszne, zawroty głowy, zaburzenia widzenia, drżenia mięśniowe lub senność. Przestrzeganie środków ostrożności jest szczególnie ważne podczas wykonywania znieczuleń w obrębie głowy i szyi. Znieczulenie w obrębie głowy i szyi może wywołać objawy zatrucia mimo zastosowania dopuszczalnej dawki środka znieczulającego.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Opisywano w tych przypadkach zaburzenia świadomości, drgawki, depresję układów oddechowego i krążenia. Powyższe reakcje mogą być następstwem niezamierzonego donaczyniowego podania lidokainy. Szczególnie groźne mogą być konsekwencje wstrzyknięcia produktu do światła tętnicy zaopatrującej ośrodkowy układ nerwowy. Należy zachować ostrożność podając lidokainę zewnątrzoponowo pacjentom z blokiem serca, a także ciężkim nadciśnieniem tętniczym. Przed wykonaniem znieczulenia podpajęczynówkowego, bez względu na zastosowany środek miejscowo znieczulający, należy rozważyć potencjalne ryzyko i korzyść dla pacjenta. Groźnym powikłaniem znieczuleń centralnych jest całkowite znieczulenie rdzeniowe, które jest następstwem podania do przestrzeni podpajęczynówkowej zbyt dużej dawki środka miejscowo znieczulającego. W rezultacie dochodzi do niewydolności układów krążenia i oddechowego.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Niewydolność krążenia jest spowodowana rozległą blokadą układu współczulnego, której objawami są niedociśnienie, znaczna bradykardia lub nawet zatrzymanie pracy serca. Niewydolność oddechowa jest spowodowana porażeniem mięśni oddechowych w wyniku zahamowania przewodnictwa w nerwach zaopatrujących mięśnie oddechowe, w tym również przeponę. Ryzyko wystąpienia wysokiego znieczulenia podpajęczynówkowego jest większe u pacjentów otyłych, z nadciśnieniem wewnątrzbrzusznym oraz u kobiet w zaawansowanej ciąży. W tych przypadkach należy zmniejszyć dawkę środka miejscowo znieczulającego. Natomiast całkowite znieczulenie rdzeniowe jest zazwyczaj rezultatem niezamierzonego, omyłkowego podania do przestrzeni podpajęczynówkowej dawki leku przeznaczonej do znieczulenia zewnątrzoponowego. Wykonanie znieczulenia podpajęczynówkowego u pacjenta z hipowolemią (niezależnie od rodzaju i dawki zastosowanego środka miejscowo znieczulającego) może doprowadzić do nagłego i znacznego obniżenia ciśnienia tętniczego.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Trwałe powikłania neurologiczne (brak czucia, zaburzenia czynności ruchowych lub porażenia) bardzo rzadko są następstwem znieczulenia podpajęczynówkowego. Zaleca się zachowanie ostrożności u pacjentów z zaburzeniami neurologicznymi, takimi jak stwardnienie rozsiane, porażenie połowicze, porażenie poprzeczne, zaburzenia nerwowo-mięśniowe, mimo że nie obserwowano nasilenia tych zaburzeń po wykonaniu znieczulenia podpajęczynówkowego. Przed podaniem lidokainy w leczeniu bólu w okresie okołooperacyjnym oraz w leczeniu bólu neuropatycznego, jako leku drugiego rzutu, należy u pacjenta wykluczyć i (lub) wyrównać zaburzenia gospodarki wodno-elektrolitowej. Produkt leczniczy zawiera 2,75 mg sodu na każdy ml roztworu, co odpowiada 0,14% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych. Ampułki 2 ml: Produkt leczniczy zawiera 5,5 mg sodu na ampułkę 2 ml, co odpowiada 0,28% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Fiolki 20 ml: Produkt leczniczy zawiera 55 mg sodu na fiolkę 20 ml, co odpowiada 2,75% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych. Produkt może być rozcieńczany w 0,9% roztworze chlorku sodu. Zawartość sodu pochodzącego z rozcieńczalnika powinna być brana pod uwagę w obliczeniu całkowitej zawartości sodu w przygotowanym rozcieńczeniu produktu. W celu uzyskania dokładnej informacji dotyczącej zawartości sodu w roztworze wykorzystanym do rozcieńczenia produktu, należy zapoznać się z charakterystyką produktu leczniczego stosowanego rozcieńczalnika. U pacjentów ze zmniejszoną czynnością nerek należy uwzględnić zawartość sodu w produkcie gotowym do podania.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Stosowane w celu leczenia drgawek pochodne hydantoiny (np. fenytoina) mogą nasilać kardiodepresyjne działanie lidokainy, ale mogą również przyspieszać jej metabolizm na skutek indukcji enzymatycznej. Jednoczesne, uzasadnione terapeutycznie stosowanie lidokainy z innymi lekami przeciwarytmicznymi może nasilać jej niepożądane działania. Leki beta-adrenolityczne mogą spowolniać metabolizm lidokainy w wątrobie i nasilać jej toksyczność. Cymetydyna hamuje metabolizm lidokainy, zmniejsza jej klirens wątrobowy i zwiększa stężenie w osoczu. Duże dawki lidokainy mogą nasilać działanie środków zwiotczających mięśnie. Lidokaina podawana dożylnie może nasilić działanie analgetyczne leków przeciwbólowych stosowanych w monoterapii. Okołooperacyjne zastosowanie lidokainy zmniejsza zapotrzebowanie na opioidy.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Badania przeprowadzone na zwierzętach nie wykazały teratogennego działania lidokainy. Nie przeprowadzono jednak dostatecznie dużych, dobrze kontrolowanych badań u ciężarnych kobiet. W związku z tym, tylko w wyjątkowych przypadkach produkt może być stosowany u ciężarnych w czasie trwania organogenezy. Okres porodu Środki miejscowo znieczulające podawane w trakcie porodu z łatwością przenikają przez łożysko, w związku z czym mogą wywoływać objawy zatrucia zarówno u matki jak i płodu. Toksyczność lidokainy zależy od metody i techniki znieczulenia oraz zastosowanej dawki. Zatrucie lidokainą wywołuje u płodu zaburzenia czynności serca. Zastosowanie środków o budowie amidowej do blokady okołoszyjkowej w trakcie porodu wywołuje bradykardię u około 30% płodów. Dlatego wskazane jest stałe monitorowanie tętna płodu. Zbyt wysokie stężenie lidokainy we krwi matki może wywołać spadek ciśnienia tętniczego.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlWpływ na płodność, ciążę i laktację
Znieczulenie może też hamować czynność skurczową macicy i przedłużać poród. Podejmując decyzję o zastosowaniu znieczulenia okołoszyjkowego w szczególnych sytuacjach położniczych, takich jak: poród przedwczesny, zatrucie ciążowe oraz stan wewnątrzmacicznego zagrożenia płodu, należy rozważyć, czy oczekiwane korzyści przeważają nad potencjalnym ryzykiem. U noworodków, których matki otrzymywały podczas porodu niektóre środki miejscowo znieczulające, obserwowano w pierwszych dwu dniach życia obniżone napięcie mięśni szkieletowych. Jednak nie wiadomo, czy wiąże się to z jakimiś odległymi skutkami. Karmienie piersi? Ponieważ lidokaina przenika do mleka, stosowanie u kobiet karmiących piersią wymaga zachowania ostrożności.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Wpływ lidokainy na zdolność prowadzenia pojazdów i obsługiwania maszyn zależy od rodzaju przeprowadzanego zabiegu i ilości zastosowanej lidokainy. Po znieczuleniu lidokainą pacjent nie powinien prowadzić pojazdów i obsługiwać maszyn przez co najmniej 24 godziny po zakończeniu zabiegu.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane lidokainy są zazwyczaj rezultatem jej nadmiernego stężenia w płynach ustrojowych w wyniku zastosowania zbyt dużej dawki (przedawkowanie względne lub bezwzględne), zaburzeń kinetyki lub niewłaściwej techniki wstrzykiwania. Działania niepożądane zostały podzielone ze względu na częstość występowania: bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia układu immunologicznego Bardzo rzadko: reakcje nadwrażliwości (zwykle zmiany skórne, pokrzywka, obrzęki); Częstość nieznana: reakcje anafilaktoidalne. Zaburzenia układu nerwowego Bardzo rzadko: brak czucia, zaburzenia czynności ruchowych lub porażenia (są następstwem znieczulenia podpajęczynówkowego); Częstość nieznana: metaliczny smak w ustach, uczucie oszołomienia, pobudzenie, niepokój, euforia, drżenia mięśniowe, senność, zaburzenia świadomości, bóle i zawroty głowy, szumy uszne, parestezje, utrata świadomości, drgawki, całkowite znieczulenie rdzeniowe (w następstwie omyłkowego podania do przestrzeni podpajęczynówkowej zbyt dużej dawki lidokainy), wysokie znieczulenie podpajęczynówkowe (w następstwie podania do przestrzeni podpajęczynówkowej zbyt dużej dawki lidokainy).
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlDziałania niepożądane
Zaburzenia oka Częstość nieznana: zaburzenia widzenia. Zaburzenia serca Częstość nieznana: bradykardia, zatrzymanie czynności serca (w skrajnie ciężkich przypadkach). Zaburzenia naczyniowe Częstość nieznana: niedociśnienie. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Częstość nieznana: zaburzenia oddychania, w tym zatrzymanie oddechu. Zaburzenia żołądka i jelit Częstość nieznana: nudności, wymioty. Po dożylnym zastosowaniu lidokainy w analgezji multimodalnej (wielokierunkowej) najczęściej występowały: senność, uczucie zmęczenia, nudności, drętwienie warg, metaliczny smak w ustach i zawroty głowy. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy toksyczne pojawiają się po przekroczeniu określonego stężenia lidokainy w surowicy i zależą od podanej dawki, dodatku leków obkurczających naczynia krwionośne, miejsca wstrzyknięcia, dystrybucji w tkankach, metabolizmu i stanu ogólnego pacjenta. Przedawkowanie może być rezultatem: przedawkowania względnego, gdy lek zostaje podany bezpośrednio do naczynia krwionośnego lub w okolicę bogato unaczynioną; przedawkowania bezwzględnego, gdy zostaje przekroczona dawka dopuszczalna. Objawy przedawkowania: faza pobudzenia ośrodkowego układu nerwowego - zaburzenia czucia w obrębie warg i języka, metaliczny smak w ustach, niespójność mowy, zawroty głowy, szumy uszne, zaburzenia widzenia, dreszcze, pobudzenie ruchowe, drżenia mięśni, drgawki; faza depresji ośrodkowego układu nerwowego - śpiączka, depresja oddychania i krążenia.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlPrzedawkowanie
Ponadto mogą wystąpić: tachykardia, wzrost ciśnienia tętniczego i oporu naczyniowego, osłabienie automatyzmu serca, bradykardia, asystolia, rozszerzenie oskrzeli. Objawy zatrucia są wskazaniem do natychmiastowego przerwania podawania leku. Jeżeli ich natężenie jest niewielkie (zaburzenia widzenia, zawroty głowy) należy uspokoić pacjenta, podać mu tlen do oddychania i sprawdzić dostęp do żyły. W przypadku silniejszej reakcji toksycznej (ograniczenie świadomości i drżenia mięśni), gdy to konieczne, należy zastosować wentylację zastępczą płuc, dożylnie podać leki podwyższające ciśnienie tętnicze (efedryna, katecholaminy) oraz leki przeciwdrgawkowe (midazolam lub diazepam). Jeśli dochodzi do utraty świadomości z drgawkami kloniczno-tonicznymi, należy natychmiast zaintubować pacjenta i podjąć wentylację zastępczą płuc 100% tlenem, podać dożylnie leki przeciwdrgawkowe (diazepam, propofol, tiopental), korygować kwasicę i leczyć objawowo zgodnie z zasadami intensywnej terapii.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlPrzedawkowanie
Dializa w przypadkach ostrego przedawkowania lidokainy nie jest skuteczna.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwarytmiczne klasy IB, kod ATC: C01BB01 Grupa farmakoterapeutyczna: leki miejscowo znieczulające; amidy, kod ATC: N01BB02 Lidokaina jest środkiem miejscowo znieczulającym i przeciwarytmicznym o budowie amidowej. Hamuje powstawanie i przewodzenie bodźców we włóknach nerwowych i układzie przewodzącym serca. Lidokaina blokuje kanały sodowe błon komórek nerwowych. Zahamowanie napływu jonów Na+ uniemożliwia generowanie i przewodzenie impulsów pojawiających się w odpowiedzi na depolaryzację. Wzrasta próg pobudliwości włókien nerwowych aż do całkowitego zablokowania przewodzenia. Stężenie lidokainy blokujące przewodnictwo jest odwrotnie proporcjonalne do średnicy włókna. W pierwszej kolejności blokowane są cienkie włókna bólowe, następnie grubsze czuciowe. Do zablokowania włókien ruchowych (najgrubszych) konieczne są najwyższe stężenia lidokainy.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakodynamiczne
Przeciwarytmiczne działanie lidokainy jest rezultatem blokowania kanału sodowego. Lidokaina zaliczana jest do leków przeciwarytmicznych grupy I B wg Vaughna - Williamsa (nie wpływa na czas trwania potencjału czynnościowego). Lidokaina blokuje kanały sodowe i hamuje aktywność bioelektryczną w zdepolaryzowanym mięśniu serca. Natomiast w niewielkim stopniu wpływa na mięsień niezdepolaryzowany oraz na układ przewodzący. Dlatego jest skuteczna w leczeniu zaburzeń rytmu, związanych z depolaryzacją (np. niedokrwienie, przedawkowanie glikozydów nasercowych), natomiast jej działanie w zaburzeniach rytmu powstających w tkance niezdepolaryzowanej jest niewielkie. Lidokaina hamuje depolaryzację diastoliczną i automatyzm komór w układzie przewodzącym. Lidokaina w stężeniach terapeutycznych: nieznaczne obniża rzut serca, opór obwodowy i ciśnienie tętnicze; nie wykazuje wpływu na przedsionki, kurczliwość mięśnia sercowego oraz przewodnictwo przedsionkowo-komorowe.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakodynamiczne
Badania kliniczne wykazały skuteczność analgetyczną lidokainy podawanej w okresie okołooperacyjnym i poprawę czynności motorycznej jelit po zabiegach radykalnej prostatektomii, a w operacjach brzusznych (laparoskopowych i laparotomiach), mniejszy odsetek atonii i niedrożności pooperacyjnej jelit, nudności i wymiotów, co przełożyło się na skrócenie czasu hospitalizacji. Okołooperacyjne zastosowanie lidokainy zmniejsza zapotrzebowanie na opioidy. Oprócz działania analgetycznego, lidokaina stosowana dożylnie hamuje reakcję zapalną indukowaną zabiegiem operacyjnym. Uważa się, że wynikiem jej stosowania w okresie pooperacyjnym jest zmniejszenie osoczowych stężeń, m.in. IL-6, IL-8, C3a, IL-1ra, CD11b, L- i P-selektyny. Ponadto skuteczność analgetyczna lidokainy może być znacząco większa w bólu trzewnym niż w bólu somatycznym.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Lidokaina wchłania się całkowicie z miejsca zdeponowania w tkankach. Szybkość narastania stężenia we krwi zależy od wielu czynników, spośród których ważne jest miejsce podania. Najwyższe stężenie lidokainy w osoczu (poza przypadkami, gdy podawana jest dożylnie) stwierdza się w trakcie blokady nerwów międzyżebrowych, nieco niższe w trakcie znieczulenia zewnątrzoponowego, natomiast najniższe w trakcie znieczulenia nasiękowego. Stopień wiązania lidokainy z białkami zależy od stężenia w osoczu. Przy stężeniach od 1 μg/ml do 4 μg/ml z białkami wiąże się od 40% do 80% środka. Lidokaina przenika przez barierę krew-mózg i przez łożysko, docierając do krążenia płodu. Lidokaina jest bardzo szybko metabolizowana w wątrobie do kilku pochodnych N-dealkilowanych, które wykazują słabszą aktywność farmakologiczną. Lek jest wydalany przez nerki przede wszystkim w postaci metabolitów, a tylko 10% w postaci niezmienionej.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakokinetyczne
Po wstrzyknięciu dożylnym okres półtrwania w surowicy wynosi 1,6 godz. Kinetyka zmienia się u osób z upośledzoną czynnością wątroby, u których okres półtrwania może być wydłużony nawet dwukrotnie. Upośledzenie czynności nerek nie ma wpływu na kinetykę lidokainy, jakkolwiek w tych przypadkach stwierdza się podwyższone stężenie metabolitów we krwi. Po przekroczeniu stężenia 6 μg/ml surowicy krwi występuje toksyczne działanie na ośrodkowy układ nerwowy w postaci drgawek. Objawy zatrucia może potęgować kwasica oraz stosowanie leków pobudzających aktywność OUN. Dodanie noradrenaliny ogranicza szybkość wchłaniania z tkanek do krwiobiegu, dzięki czemu wydłuża się czas działania oraz zmniejsza stężenie w surowicy; pozwala to na zastosowanie większej dawki. Skuteczne działanie przeciwbólowe lidokainy podawanej dożylnie w okresie okołooperacyjnym uzyskiwane jest po osiągnięciu stężenia w surowicy wynoszącego 1,1-4,2 μg/ml.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach lidokaina nie wywołuje teratogennego działania w dawkach przekraczających dawki stosowane u ludzi 6,6-krotnie. Nie prowadzono badań dotyczących działania rakotwórczego i mutagennego oraz wpływu na płodność u zwierząt.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Sodu wodorotlenek 10% (do ustalenia pH) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Produkt wykazuje niezgodność i nie powinien być mieszany w jednej strzykawce z roztworami zawierającymi wodorowęglan sodu oraz innymi roztworami o odczynie zasadowym. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem, w temperaturze poniżej 25°C. Nie zamrażać. 6.5 Rodzaj i zawartość opakowania 10 ampułek z bezbarwnego szkła po 2 ml w tekturowym pudełku. 5 fiolek z bezbarwnego szkła po 20 ml w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Po pobraniu pierwszej dawki niezużytą w ciągu 24 godzin zawartość fiolki należy zniszczyć.
- CHPL leku Lignocainum hydrochloricum 1%, roztwór do wstrzykiwań, 10 mg/mlDane farmaceutyczne
Instrukcja otwierania ampułki Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu. Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia. Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki. Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3. Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO LIGNOCAINUM HYDROCHLORICUM WZF 2% , 20 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg lidokainy chlorowodorku jednowodnego (Lidocaini hydrochloridum). Każda ampułka 2 ml zawiera 40 mg lidokainy chlorowodorku jednowodnego. Każda fiolka 20 ml zawiera 400 mg lidokainy chlorowodorku jednowodnego. Substancja pomocnicza o znanym działaniu: Każdy ml roztworu zawiera 2,36 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań Bezbarwny, przezroczysty płyn.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Znieczulenie regionalne - nasiękowe, blokady nerwów, pni nerwowych i splotów nerwowych, podpajęczynówkowe, zewnątrzoponowe - w chirurgii ogólnej, urologii, ortopedii, ginekologii, położnictwie, ponadto w różnych procedurach diagnostycznych i terapeutycznych. Komorowe zaburzenia rytmu serca (przedwczesne skurcze komorowe, częstoskurcz komorowy), zwłaszcza w przebiegu ostrego zawału mięśnia sercowego lub po przedawkowaniu glikozydów nasercowych. Leczenie bólu w okresie okołooperacyjnym, jako składnik analgezji prewencyjnej (zapobiegawczej) i analgezji multimodalnej (wielokierunkowej). Leczenie bólu neuropatycznego, jako lek drugiego rzutu.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Znieczulenie regionalne Maksymalna dawka jednorazowa lidokainy dla dorosłego pacjenta wynosi 200 mg (4,5 mg/kg mc.). Podane dawki mają charakter orientacyjny i dotyczą osób dorosłych, w dobrym stanie ogólnym, bez chorób współistniejących. U dzieci nie należy przekraczać dawki 3 mg/kg mc. Lidokainę należy dawkować indywidualnie, kierując się masą ciała i stanem ogólnym pacjenta. W trakcie znieczulenia pacjenta należy nadzorować oraz monitorować czynności życiowe. Siła i czas działania lidokainy zależą od stężenia i objętości zastosowanego roztworu. Zwiększenie objętości i stężenia przyspiesza, wydłuża i nasila działanie miejscowo znieczulające. Lidokainę, podobnie jak inne środki miejscowo znieczulające, należy podawać powoli, po uprzednim wykonaniu próby aspiracji, co pozwala uniknąć niezamierzonego podania donaczyniowego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Podczas wykonywania znieczulenia zewnątrzoponowego podanie zasadniczej dawki środka znieczulającego należy poprzedzić dawką testową (3 do 5 ml chlorowodorku lidokainy z dodatkiem adrenaliny). Po omyłkowym, donaczyniowym podaniu dawki testowej zawarta w niej adrenalina wywołuje wyraźne przyspieszenie czynności serca. Dlatego przez 5 minut po podaniu należy obserwować zapis EKG na ekranie monitora. Negatywny wynik testu uprawnia do wstrzyknięcia (z szybkością 25 do 50 mg/min) pozostałej dawki środka znieczulającego. W tym czasie należy utrzymywać stały, słowny kontakt z pacjentem i jeżeli pojawią się nawet łagodne objawy przedawkowania, należy natychmiast przerwać iniekcję. Dawka testowa pozwala również uniknąć niebezpieczeństw związanych z niezamierzonym, podpajęczynówkowym wstrzyknięciem produktu z następowym całkowitym znieczuleniem rdzeniowym. Odstępy między kolejnymi, podawanymi zewnątrzoponowo dawkami produktu nie powinny być krótsze niż 90 minut.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Maksymalna dawka lidokainy podawana w trakcie blokady okołoszyjkowej (podczas porodu i w ginekologii) nie powinna przekraczać 200 mg co 90 minut. Należy zawsze stosować najmniejsze skuteczne dawki lidokainy, aby ograniczyć ryzyko przedawkowania. Produkt można rozcieńczać 0,9% roztworem chlorku sodu. Stężenie leku Rodzaj znieczulenia: Znieczulenie nasiękowe, Dawka maksymalna: Do 200 mg Rodzaj znieczulenia: Blokady pni i splotów nerwowych, Dawka maksymalna: Do 200 mg Rodzaj znieczulenia: Znieczulenie zewnątrzoponowe, Dawka maksymalna: Do 200 mg Rodzaj znieczulenia: Znieczulenie podpajęczynówkowe, Dawka maksymalna: Do 80 mg (1,5 do 4 ml) Rodzaj znieczulenia: Znieczulenie odcinkowe dożylne, Dawka maksymalna: Do 200 mg Zaburzenia rytmu serca W celu leczenia zaburzeń rytmu u osób dorosłych podaje się dożylnie lidokainę w jednorazowej dawce wynoszącej od 50 do 100 mg, lub w dawkach podzielonych po 25 do 50 mg na minutę.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Jeśli początkowa dawka nie była skuteczna, kolejną (50 do 100 mg) można podać po upływie 5 minut. Nie należy przekraczać dawki 200 do 300 mg w ciągu godziny. U chorych z tendencją do nawrotów zaburzeń rytmu lub opornych na działanie doustnych leków przeciwarytmicznych można zastosować ciągłą infuzję dożylną lidokainy z szybkością od 1 do 4 mg/min (20 do 50 µg/kg mc./min) pod stałą kontrolą EKG. Infuzję należy przerwać, gdy ustąpią zaburzenia rytmu lub pojawią się objawy przedawkowania. U osób w wieku podeszłym należy dawkę dostosować do ogólnego stanu pacjenta. Natomiast zaburzenia rytmu serca u dzieci leczy się lidokainą podawaną dożylnie w dawce 0,8 do 1 mg/kg mc., którą w razie potrzeby można powtarzać do łącznej dawki 3 do 5 mg/kg mc. Lidokainę można również podawać w ciągłej infuzji dożylnej z szybkością 10 do 50 µg/kg mc./min.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Leczenie bólu w okresie okołooperacyjnym Lidokaina podawana dożylnie w okresie okołooperacyjnym jest stosowana u pacjentów dorosłych jako adiuwant w terapii multimodalnej (wielokierunkowej) i w analgezji prewencyjnej (zapobiegawczej). Lidokainę podaje się dożylnie w zabiegach operacyjnych z niewielkim do znacznego i rozległego urazem tkanek. Zazwyczaj stosowane dawkowanie: dawka nasycająca 1,5 mg/kg mc. podawana w bolusie, a następnie 1,5 do 3 mg/kg mc./godz. w infuzji ciągłej w trakcie operacji; zalecane jest rozpoczęcie podawania lidokainy 30 minut przed indukcją znieczulenia, jednak nie później niż w czasie indukcji znieczulenia; w okresie pooperacyjnym: 1 do 3 mg/kg mc./godz. w infuzji ciągłej przez 24 do 48 godz. Jeśli u pacjenta lidokaina stosowana jest jednocześnie jako lek znieczulający miejscowo (nasiękowo), np. w celu ostrzyknięcia przewidywanej linii cięcia oraz w infuzji dożylnej, całkowitą dawkę lidokainy należy zmniejszyć.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Jeśli istnieje taka konieczność, infuzję dożylną lidokainy można rozpocząć 4 do 8 godzin po podaniu ostatniej dawki (w bolusie) leku stosowanego w znieczuleniu regionalnym. W przypadku nieudanego znieczulenia zewnątrzoponowego, po zatrzymaniu infuzji ciągłej do przestrzeni zewnątrzoponowej i bez podania dawki do przestrzeni zewnątrzoponowej w bolusie, ciągła infuzja dożylna lidokainy może być rozpoczęta natychmiast, ale bez podania dożylnego w bolusie. Dawkę lidokainy należy zmniejszyć w stanach, w których może dojść do zwiększenia wolnej frakcji leku w surowicy – kwasicy, hiperkapnii, hipoksji, hipoproteinemii oraz zaburzeń czynności wątroby i (lub) nerek. U pacjentów z niewydolnością krążenia, wątroby i (lub) nerek należy zmniejszyć dawkę lidokainy i monitorować czynność układu krążenia. Leczenie pacjentów z bólem neuropatycznym Dorośli Infuzja ciągła dożylna w dawce 3-5 mg/kg mc. przez minimum 30 minut, ale nie dłużej niż 6 godzin, raz na dobę.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Sposób podawania Produkt można stosować dożylnie, nasiękowo, podpajęczynówkowo i zewnątrzoponowo.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub inne leki miejscowo znieczulające o budowie amidowej, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Ogólne przeciwwskazania do wykonywania znieczulenia podpajęczynówkowego i zewnątrzoponowego, niezależnie od rodzaju środka znieczulającego: ostre choroby ośrodkowego układu nerwowego (np. zapalenie opon mózgowo-rdzeniowych, guzy, zapalenie istoty szarej rdzenia, krwawienie śródczaszkowe); zwężenie kanału rdzenia kręgowego, czynne choroby kręgosłupa (np. proces zapalny, gruźlica kręgosłupa, guzy) lub niedawno przebyte urazy kręgosłupa (np. złamania); posocznica; podostre zwyrodnienie rdzenia kręgowego w przebiegu niedokrwistości złośliwej; zakażenie skóry w miejscu wykonywania znieczulenia lub w jego okolicy; wstrząs kardiogenny lub hipowolemiczny; zaburzenia krzepnięcia lub leczenie lekami przeciwzakrzepowymi.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlPrzeciwwskazania
Infuzja dożylna lidokainy stosowanej w leczeniu bólu w okresie okołooperacyjnym jest przeciwwskazana jeżeli jednocześnie stosowane jest znieczulenie regionalne, szczególnie takie, w którym podaje się lek znieczulenia miejscowego w bolusie lub w dużych dawkach (np. znieczulenie zewnątrzoponowe, znieczulenia pni i splotów nerwowych).
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Znieczulenie miejscowe za pomocą lidokainy może być wykonywane wyłącznie przez lekarzy dobrze znających technikę znieczuleń oraz przeszkolonych w diagnostyce i leczeniu następstw przedawkowania lidokainy, które mogą pojawić się w trakcie znieczulenia regionalnego. W pomieszczeniu, w którym wykonywane są znieczulenia, musi znajdować się źródło tlenu, sprzęt resuscytacyjny i niezbędne leki. Przed przystąpieniem do znieczulenia należy zapewnić dostęp do żyły. Opóźnienie podjęcia działań resuscytacyjnych może prowadzić do niedotlenienia, kwasicy, zatrzymania czynności serca, a nawet zgonu pacjenta. Każde wstrzyknięcie lidokainy w celu znieczulenia należy poprzedzić próbą aspiracji, aby uniknąć niezamierzonego podania donaczyniowego. Warunki bezpiecznego stosowania lidokainy: odpowiednie dawkowanie, poprawna technika znieczulenia, przestrzeganie środków ostrożności oraz gotowość do podjęcia postępowania resuscytacyjnego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Powtarzanie dawek lidokainy może doprowadzić do niebezpiecznie wysokiego wzrostu stężenia w surowicy. Ponieważ ogólna reakcja na wysokie stężenie zależy od stanu pacjenta, u osób wyniszczonych, w podeszłym wieku oraz dzieci należy dostosować dawkę do masy ciała i stanu zdrowia. Lidokaina jest metabolizowana w wątrobie, dlatego w przypadkach niewydolności wątroby należy uwzględnić możliwość zwiększenia stężenia lidokainy w płynach ustrojowych. Podczas znieczulenia należy stale monitorować stan świadomości oraz czynność układów krążenia i oddychania. Wczesnymi objawami toksycznych stężeń lidokainy w ośrodkowym układzie nerwowym są: metaliczny smak w ustach, niepokój, szumy uszne, zawroty głowy, zaburzenia widzenia, drżenia mięśniowe lub senność. Przestrzeganie środków ostrożności jest szczególnie ważne podczas wykonywania znieczuleń w obrębie głowy i szyi. Znieczulenie w obrębie głowy i szyi może wywołać objawy zatrucia mimo zastosowania dopuszczalnej dawki środka znieczulającego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Opisywano w tych przypadkach zaburzenia świadomości, drgawki, depresję układów oddechowego i krążenia. Powyższe reakcje mogą być następstwem niezamierzonego donaczyniowego podania lidokainy. Szczególnie groźne mogą być konsekwencje wstrzyknięcia produktu do światła tętnicy zaopatrującej ośrodkowy układ nerwowy. Należy zachować ostrożność podając lidokainę zewnątrzoponowo pacjentom z blokiem serca, a także ciężkim nadciśnieniem tętniczym. Przed wykonaniem znieczulenia podpajęczynówkowego, bez względu na zastosowany środek miejscowo znieczulający, należy rozważyć potencjalne ryzyko i korzyść dla pacjenta. Groźnym powikłaniem znieczuleń centralnych jest całkowite znieczulenie rdzeniowe, które jest następstwem podania do przestrzeni podpajęczynówkowej zbyt dużej dawki środka miejscowo znieczulającego. W rezultacie dochodzi do niewydolności układów krążenia i oddechowego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Niewydolność krążenia jest spowodowana rozległą blokadą układu współczulnego, której objawami są niedociśnienie, znaczna bradykardia lub nawet zatrzymanie pracy serca. Niewydolność oddechowa jest spowodowana porażeniem mięśni oddechowych w wyniku zahamowania przewodnictwa w nerwach zaopatrujących mięśnie oddechowe, w tym również przeponę. Ryzyko wystąpienia wysokiego znieczulenia podpajęczynówkowego jest większe u pacjentów otyłych, z nadciśnieniem wewnątrzbrzusznym oraz u kobiet w zaawansowanej ciąży. W tych przypadkach należy zmniejszyć dawkę środka miejscowo znieczulającego. Natomiast całkowite znieczulenie rdzeniowe jest zazwyczaj rezultatem niezamierzonego, omyłkowego podania do przestrzeni podpajęczynówkowej dawki leku przeznaczonej do znieczulenia zewnątrzoponowego. Wykonanie znieczulenia podpajęczynówkowego u pacjenta z hipowolemią (niezależnie od rodzaju i dawki zastosowanego środka miejscowo znieczulającego) może doprowadzić do nagłego i znacznego obniżenia ciśnienia tętniczego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Trwałe powikłania neurologiczne (brak czucia, zaburzenia czynności ruchowych lub porażenia) bardzo rzadko są następstwem znieczulenia podpajęczynówkowego. Zaleca się zachowanie ostrożności u pacjentów z zaburzeniami neurologicznymi takimi jak stwardnienie rozsiane, porażenie połowicze, porażenie poprzeczne, zaburzenia nerwowo-mięśniowe, mimo że nie obserwowano nasilenia tych zaburzeń po wykonaniu znieczulenia podpajęczynówkowego. Przed podaniem lidokainy w leczeniu bólu w okresie okołooperacyjnym oraz w leczeniu bólu neuropatycznego, jako leku drugiego rzutu, należy u pacjenta wykluczyć i (lub) wyrównać zaburzenia gospodarki wodno-elektrolitowej. Produkt leczniczy zawiera 2,36 mg sodu na każdy ml roztworu, co odpowiada 0,12% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych. Ampułki 2 ml: Produkt leczniczy zawiera 4,72 mg sodu na ampułkę 2ml, co odpowiada 0,24% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Fiolki 20 ml: Produkt leczniczy zawiera 47,2 mg sodu na fiolkę 20 ml, co odpowiada 2,36% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych. Produkt może być rozcieńczany w 0,9% roztworze chlorku sodu. Zawartość sodu pochodzącego z rozcieńczalnika, powinna być brana pod uwagę w obliczeniu całkowitej zawartości sodu w przygotowanym rozcieńczeniu produktu. W celu uzyskania dokładnej informacji dotyczącej zawartości sodu w roztworze wykorzystanym do rozcieńczenia produktu, należy zapoznać się z charakterystyką produktu leczniczego stosowanego rozcieńczalnika. U pacjentów ze zmniejszoną czynnością nerek należy uwzględnić zawartość sodu w produkcie gotowym do podania.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Stosowane w celu leczenia drgawek pochodne hydantoiny (np. fenytoina) mogą nasilać kardiodepresyjne działanie lidokainy, ale mogą również przyspieszać jej metabolizm na skutek indukcji enzymatycznej. Jednoczesne, uzasadnione terapeutycznie stosowanie lidokainy z innymi lekami przeciwarytmicznymi może nasilać jej niepożądane działania. Leki beta-adrenolityczne mogą spowolniać metabolizm lidokainy w wątrobie i nasilać jej toksyczność. Cymetydyna hamuje metabolizm lidokainy, zmniejsza jej klirens wątrobowy i zwiększa stężenie w osoczu. Duże dawki lidokainy mogą nasilać działanie środków zwiotczających mięśnie. Lidokaina podawana dożylnie może nasilić działanie analgetyczne leków przeciwbólowych stosowanych w monoterapii. Okołooperacyjne zastosowanie lidokainy zmniejsza zapotrzebowanie na opioidy.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Badania przeprowadzone na zwierzętach nie wykazały teratogennego działania lidokainy. Nie przeprowadzono jednak dostatecznie dużych, dobrze kontrolowanych badań u ciężarnych kobiet. W związku z tym, tylko w wyjątkowych przypadkach produkt może być stosowany u ciężarnych w czasie trwania organogenezy. Okres porodu Środki miejscowo znieczulające podawane w trakcie porodu z łatwością przenikają przez łożysko, w związku z czym mogą wywoływać objawy zatrucia zarówno u matki jak i płodu. Toksyczność lidokainy zależy od metody i techniki znieczulenia oraz zastosowanej dawki. Zatrucie lidokainą wywołuje u płodu zaburzenia czynności serca. Zastosowanie środków o budowie amidowej do blokady okołoszyjkowej w trakcie porodu wywołuje bradykardię u około 30% płodów. Dlatego wskazane jest stałe monitorowanie tętna płodu. Zbyt wysokie stężenie lidokainy we krwi matki może wywołać spadek ciśnienia tętniczego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWpływ na płodność, ciążę i laktację
Znieczulenie może też hamować czynność skurczową macicy i przedłużać poród. Podejmując decyzję o zastosowaniu znieczulenia okołoszyjkowego w szczególnych sytuacjach położniczych, takich jak: poród przedwczesny, zatrucie ciążowe oraz stan wewnątrzmacicznego zagrożenia płodu, należy rozważyć, czy oczekiwane korzyści przeważają nad potencjalnym ryzykiem. U noworodków, których matki otrzymywały podczas porodu niektóre środki miejscowo znieczulające, obserwowano w pierwszych dwu dniach życia obniżone napięcie mięśni szkieletowych. Jednak nie wiadomo, czy wiąże się to z jakimiś odległymi skutkami. Karmienie piersi? Ponieważ lidokaina przenika do mleka, stosowanie u kobiet karmiących piersią wymaga zachowania ostrożności.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Wpływ lidokainy na zdolność prowadzenia pojazdów i obsługiwania maszyn zależy od rodzaju przeprowadzanego zabiegu i ilości zastosowanej lidokainy. Po znieczuleniu lidokainą pacjent nie powinien prowadzić pojazdów i obsługiwać maszyn przez co najmniej 24 godziny po zakończeniu zabiegu.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane lidokainy są zazwyczaj rezultatem jej nadmiernego stężenia w płynach ustrojowych w wyniku zastosowania zbyt dużej dawki (przedawkowanie względne lub bezwzględne), zaburzeń kinetyki lub niewłaściwej techniki wstrzykiwania. Działania niepożądane zostały podzielone ze względu na częstość występowania: bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia układu immunologicznego Bardzo rzadko: reakcje nadwrażliwości (zwykle zmiany skórne, pokrzywka, obrzęki); Częstość nieznana: reakcje anafilaktoidalne. Zaburzenia układu nerwowego Bardzo rzadko: brak czucia, zaburzenia czynności ruchowych lub porażenia (są następstwem znieczulenia podpajęczynówkowego); Częstość nieznana: metaliczny smak w ustach, uczucie oszołomienia, pobudzenie, niepokój, euforia, drżenia mięśniowe, senność, zaburzenia świadomości, bóle i zawroty głowy, szumy uszne, parestezje, utrata świadomości, drgawki, całkowite znieczulenie rdzeniowe (w następstwie omyłkowego podania do przestrzeni podpajęczynówkowej zbyt dużej dawki lidokainy), wysokie znieczulenie podpajęczynówkowe (w następstwie podania do przestrzeni podpajęczynówkowej zbyt dużej dawki lidokainy).
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
Zaburzenia oka Częstość nieznana: zaburzenia widzenia. Zaburzenia serca Częstość nieznana: bradykardia, zatrzymanie czynności serca (w skrajnie ciężkich przypadkach). Zaburzenia naczyniowe Częstość nieznana: niedociśnienie. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Częstość nieznana: zaburzenia oddychania, w tym zatrzymanie oddechu. Zaburzenia żołądka i jelit Częstość nieznana: nudności, wymioty. Po dożylnym zastosowaniu lidokainy w analgezji multimodalnej (wielokierunkowej) najczęściej występowały: senność, uczucie zmęczenia, nudności, drętwienie warg, metaliczny smak w ustach i zawroty głowy. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy toksyczne pojawiają się po przekroczeniu określonego stężenia lidokainy w surowicy i zależą od podanej dawki, dodatku leków obkurczających naczynia krwionośne, miejsca wstrzyknięcia, dystrybucji w tkankach, metabolizmu i stanu ogólnego pacjenta. Przedawkowanie może być rezultatem: przedawkowania względnego, gdy lek zostaje podany bezpośrednio do naczynia krwionośnego lub w okolicę bogato unaczynioną; przedawkowania bezwzględnego, gdy zostaje przekroczona dawka dopuszczalna. Objawy przedawkowania: faza pobudzenia ośrodkowego układu nerwowego - zaburzenia czucia w obrębie warg i języka, metaliczny smak w ustach, niespójność mowy, zawroty głowy, szumy uszne, zaburzenia widzenia, dreszcze, pobudzenie ruchowe, drżenia mięśni, drgawki; faza depresji ośrodkowego układu nerwowego - śpiączka, depresja oddychania i krążenia.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
Ponadto mogą wystąpić: tachykardia, wzrost ciśnienia tętniczego i oporu naczyniowego, osłabienie automatyzmu serca, bradykardia, asystolia, rozszerzenie oskrzeli. Objawy zatrucia są wskazaniem do natychmiastowego przerwania podawania leku. Jeżeli ich natężenie jest niewielkie (zaburzenia widzenia, zawroty głowy) należy uspokoić pacjenta, podać mu tlen do oddychania i sprawdzić dostęp do żyły. W przypadku silniejszej reakcji toksycznej (ograniczenie świadomości i drżenia mięśni), gdy to konieczne, należy zastosować wentylację zastępczą płuc, dożylnie podać leki podwyższające ciśnienie tętnicze (efedryna, katecholaminy) oraz leki przeciwdrgawkowe (midazolam lub diazepam). Jeśli dochodzi do utraty świadomości z drgawkami kloniczno-tonicznymi, należy natychmiast zaintubować pacjenta i podjąć wentylację zastępczą płuc 100% tlenem, podać dożylnie leki przeciwdrgawkowe (diazepam, propofol, tiopental), korygować kwasicę i leczyć objawowo zgodnie z zasadami intensywnej terapii.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
Dializa w przypadkach ostrego przedawkowania lidokainy nie jest skuteczna.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwarytmiczne klasy IB, kod ATC: C01BB01 Grupa farmakoterapeutyczna: leki miejscowo znieczulające; amidy, kod ATC: N01BB02 Lidokaina jest środkiem miejscowo znieczulającym i przeciwarytmicznym o budowie amidowej. Hamuje powstawanie i przewodzenie bodźców we włóknach nerwowych i układzie przewodzącym serca. Lidokaina blokuje kanały sodowe błon komórek nerwowych. Zahamowanie napływu jonów Na+ uniemożliwia generowanie i przewodzenie impulsów pojawiających się w odpowiedzi na depolaryzację. Wzrasta próg pobudliwości włókien nerwowych aż do całkowitego zablokowania przewodzenia. Stężenie lidokainy blokujące przewodnictwo jest odwrotnie proporcjonalne do średnicy włókna. W pierwszej kolejności blokowane są cienkie włókna bólowe, następnie grubsze czuciowe. Do zablokowania włókien ruchowych (najgrubszych) konieczne są najwyższe stężenia lidokainy.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
Przeciwarytmiczne działanie lidokainy jest rezultatem blokowania kanału sodowego. Lidokaina zaliczana jest do leków przeciwarytmicznych grupy I B wg Vaughna - Williamsa (nie wpływa na czas trwania potencjału czynnościowego). Lidokaina blokuje kanały sodowe i hamuje aktywność bioelektryczną w zdepolaryzowanym mięśniu serca. Natomiast w niewielkim stopniu wpływa na mięsień niezdepolaryzowany oraz na układ przewodzący. Dlatego jest skuteczna w leczeniu zaburzeń rytmu, związanych z depolaryzacją (np. niedokrwienie, przedawkowanie glikozydów nasercowych), natomiast jej działanie w zaburzeniach rytmu powstających w tkance niezdepolaryzowanej jest niewielkie. Lidokaina hamuje depolaryzację diastoliczną i automatyzm komór w układzie przewodzącym. Lidokaina w stężeniach terapeutycznych: nieznaczne obniża rzut serca, opór obwodowy i ciśnienie tętnicze; nie wykazuje wpływu na przedsionki, kurczliwość mięśnia sercowego oraz przewodnictwo przedsionkowo-komorowe.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
Badania kliniczne wykazały skuteczność analgetyczną lidokainy podawanej w okresie okołooperacyjnym i poprawę czynności motorycznej jelit po zabiegach radykalnej prostatektomii, a w operacjach brzusznych (laparoskopowych i laparotomiach), mniejszy odsetek atonii i niedrożności pooperacyjnej jelit, nudności i wymiotów, co przełożyło się na skrócenie czasu hospitalizacji. Okołooperacyjne zastosowanie lidokainy zmniejsza zapotrzebowanie na opioidy. Oprócz działania analgetycznego, lidokaina stosowana dożylnie hamuje reakcję zapalną indukowaną zabiegiem operacyjnym. Uważa się, że wynikiem jej stosowania w okresie pooperacyjnym jest zmniejszenie osoczowych stężeń, m.in., IL-6, IL-8, C3a, IL-1ra, CD11b, L- i P-selektyny. Ponadto skuteczność analgetyczna lidokainy może być znacząco większa w bólu trzewnym niż w bólu somatycznym.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Lidokaina wchłania się całkowicie z miejsca zdeponowania w tkankach. Szybkość narastania stężenia we krwi zależy od wielu czynników, spośród których ważne jest miejsce podania. Najwyższe stężenie lidokainy w osoczu (poza przypadkami, gdy podawana jest dożylnie) stwierdza się w trakcie blokady nerwów międzyżebrowych, nieco niższe w trakcie znieczulenia zewnątrzoponowego, natomiast najniższe w trakcie znieczulenia nasiękowego. Stopień wiązania lidokainy z białkami zależy od stężenia w osoczu. Przy stężeniach od 1 μg/ml do 4 μg/ml z białkami wiąże się od 40% do 80% środka. Lidokaina przenika przez barierę krew-mózg i przez łożysko, docierając do krążenia płodu. Lidokaina jest bardzo szybko metabolizowana w wątrobie do kilku pochodnych N-dealkilowanych, które wykazują słabszą aktywność farmakologiczną. Lek jest wydalany przez nerki przede wszystkim w postaci metabolitów, a tylko 10% w postaci niezmienionej.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
Po wstrzyknięciu dożylnym okres półtrwania w surowicy wynosi 1,6 godz. Kinetyka zmienia się u osób z upośledzoną czynnością wątroby, u których okres półtrwania może być wydłużony nawet dwukrotnie. Upośledzenie czynności nerek nie ma wpływu na kinetykę lidokainy, jakkolwiek w tych przypadkach stwierdza się podwyższone stężenie metabolitów we krwi. Po przekroczeniu stężenia 6 μg/ml surowicy krwi występuje toksyczne działanie na ośrodkowy układ nerwowy w postaci drgawek. Objawy zatrucia może potęgować kwasica oraz stosowanie leków pobudzających aktywność OUN. Dodanie noradrenaliny ogranicza szybkość wchłaniania z tkanek do krwiobiegu, dzięki czemu wydłuża się czas działania oraz zmniejsza stężenie w surowicy; pozwala to na zastosowanie większej dawki. Skuteczne działanie przeciwbólowe lidokainy podawanej dożylnie w okresie okołooperacyjnym uzyskiwane jest po osiągnięciu stężenia w surowicy wynoszącego 1,1-4,2 μg/ml.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach lidokaina nie wywołuje teratogennego działania w dawkach przekraczających dawki stosowane u ludzi 6,6-krotnie. Nie prowadzono badań dotyczących działania rakotwórczego i mutagennego oraz wpływu na płodność u zwierząt.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Sodu wodorotlenek 10% (do ustalenia pH) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Produkt wykazuje niezgodność i nie powinien być mieszany w jednej strzykawce z roztworami zawierającymi wodorowęglan sodu oraz innymi roztworami o odczynie zasadowym. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem, w temperaturze poniżej 25°C. Nie zamrażać. 6.5 Rodzaj i zawartość opakowania 10 ampułek z bezbarwnego szkła po 2 ml w tekturowym pudełku. 5 fiolek z bezbarwnego szkła po 20 ml w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Po pobraniu pierwszej dawki niezużytą w ciągu 24 godzin zawartość fiolki należy zniszczyć.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDane farmaceutyczne
Instrukcja otwierania ampułki Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu. Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia. Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki. Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3. Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami. Rysunek 1 Rysunek 2 Rysunek 3
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO LIGNOCAINUM HYDROCHLORICUM WZF 2% , 20 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg lidokainy chlorowodorku jednowodnego (Lidocaini hydrochloridum). Każda ampułka 2 ml zawiera 40 mg lidokainy chlorowodorku jednowodnego. Każda fiolka 20 ml zawiera 400 mg lidokainy chlorowodorku jednowodnego. Substancja pomocnicza o znanym działaniu: Każdy ml roztworu zawiera 2,36 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań Bezbarwny, przezroczysty płyn.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Znieczulenie regionalne - nasiękowe, blokady nerwów, pni nerwowych i splotów nerwowych, podpajęczynówkowe, zewnątrzoponowe - w chirurgii ogólnej, urologii, ortopedii, ginekologii, położnictwie, ponadto w różnych procedurach diagnostycznych i terapeutycznych. Komorowe zaburzenia rytmu serca (przedwczesne skurcze komorowe, częstoskurcz komorowy), zwłaszcza w przebiegu ostrego zawału mięśnia sercowego lub po przedawkowaniu glikozydów nasercowych. Leczenie bólu w okresie okołooperacyjnym, jako składnik analgezji prewencyjnej (zapobiegawczej) i analgezji multimodalnej (wielokierunkowej). Leczenie bólu neuropatycznego, jako lek drugiego rzutu.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Znieczulenie regionalne Maksymalna dawka jednorazowa lidokainy dla dorosłego pacjenta wynosi 200 mg (4,5 mg/kg mc.). Podane dawki mają charakter orientacyjny i dotyczą osób dorosłych, w dobrym stanie ogólnym, bez chorób współistniejących. U dzieci nie należy przekraczać dawki 3 mg/kg mc. Lidokainę należy dawkować indywidualnie, kierując się masą ciała i stanem ogólnym pacjenta. W trakcie znieczulenia pacjenta należy nadzorować oraz monitorować czynności życiowe. Siła i czas działania lidokainy zależą od stężenia i objętości zastosowanego roztworu. Zwiększenie objętości i stężenia przyspiesza, wydłuża i nasila działanie miejscowo znieczulające. Lidokainę, podobnie jak inne środki miejscowo znieczulające, należy podawać powoli, po uprzednim wykonaniu próby aspiracji, co pozwala uniknąć niezamierzonego podania donaczyniowego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Podczas wykonywania znieczulenia zewnątrzoponowego podanie zasadniczej dawki środka znieczulającego należy poprzedzić dawką testową (3 do 5 ml chlorowodorku lidokainy z dodatkiem adrenaliny). Po omyłkowym, donaczyniowym podaniu dawki testowej zawarta w niej adrenalina wywołuje wyraźne przyspieszenie czynności serca. Dlatego przez 5 minut po podaniu należy obserwować zapis EKG na ekranie monitora. Negatywny wynik testu uprawnia do wstrzyknięcia (z szybkością 25 do 50 mg/min) pozostałej dawki środka znieczulającego. W tym czasie należy utrzymywać stały, słowny kontakt z pacjentem i jeżeli pojawią się nawet łagodne objawy przedawkowania, należy natychmiast przerwać iniekcję. Dawka testowa pozwala również uniknąć niebezpieczeństw związanych z niezamierzonym, podpajęczynówkowym wstrzyknięciem produktu z następowym całkowitym znieczuleniem rdzeniowym. Odstępy między kolejnymi, podawanymi zewnątrzoponowo dawkami produktu nie powinny być krótsze niż 90 minut.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Maksymalna dawka lidokainy podawana w trakcie blokady okołoszyjkowej (podczas porodu i w ginekologii) nie powinna przekraczać 200 mg co 90 minut. Należy zawsze stosować najmniejsze skuteczne dawki lidokainy, aby ograniczyć ryzyko przedawkowania. Produkt można rozcieńczać 0,9% roztworem chlorku sodu. Stężenie leku Rodzaj znieczulenia: Znieczulenie nasiękowe, Dawka maksymalna: Do 200 mg Rodzaj znieczulenia: Blokady pni i splotów nerwowych, Dawka maksymalna: Do 200 mg Rodzaj znieczulenia: Znieczulenie zewnątrzoponowe, Dawka maksymalna: Do 200 mg Rodzaj znieczulenia: Znieczulenie podpajęczynówkowe, Dawka maksymalna: Do 80 mg (1,5 do 4 ml) Rodzaj znieczulenia: Znieczulenie odcinkowe dożylne, Dawka maksymalna: Do 200 mg Zaburzenia rytmu serca W celu leczenia zaburzeń rytmu u osób dorosłych podaje się dożylnie lidokainę w jednorazowej dawce wynoszącej od 50 do 100 mg, lub w dawkach podzielonych po 25 do 50 mg na minutę.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Jeśli początkowa dawka nie była skuteczna, kolejną (50 do 100 mg) można podać po upływie 5 minut. Nie należy przekraczać dawki 200 do 300 mg w ciągu godziny. U chorych z tendencją do nawrotów zaburzeń rytmu lub opornych na działanie doustnych leków przeciwarytmicznych można zastosować ciągłą infuzję dożylną lidokainy z szybkością od 1 do 4 mg/min (20 do 50 µg/kg mc./min) pod stałą kontrolą EKG. Infuzję należy przerwać, gdy ustąpią zaburzenia rytmu lub pojawią się objawy przedawkowania. U osób w wieku podeszłym należy dawkę dostosować do ogólnego stanu pacjenta. Natomiast zaburzenia rytmu serca u dzieci leczy się lidokainą podawaną dożylnie w dawce 0,8 do 1 mg/kg mc., którą w razie potrzeby można powtarzać do łącznej dawki 3 do 5 mg/kg mc. Lidokainę można również podawać w ciągłej infuzji dożylnej z szybkością 10 do 50 µg/kg mc./min.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Leczenie bólu w okresie okołooperacyjnym Lidokaina podawana dożylnie w okresie okołooperacyjnym jest stosowana u pacjentów dorosłych jako adiuwant w terapii multimodalnej (wielokierunkowej) i w analgezji prewencyjnej (zapobiegawczej). Lidokainę podaje się dożylnie w zabiegach operacyjnych z niewielkim do znacznego i rozległego urazem tkanek. Zazwyczaj stosowane dawkowanie: dawka nasycająca 1,5 mg/kg mc. podawana w bolusie, a następnie 1,5 do 3 mg/kg mc./godz. w infuzji ciągłej w trakcie operacji; zalecane jest rozpoczęcie podawania lidokainy 30 minut przed indukcją znieczulenia, jednak nie później niż w czasie indukcji znieczulenia; w okresie pooperacyjnym: 1 do 3 mg/kg mc./godz. w infuzji ciągłej przez 24 do 48 godz. Jeśli u pacjenta lidokaina stosowana jest jednocześnie jako lek znieczulający miejscowo (nasiękowo), np. w celu ostrzyknięcia przewidywanej linii cięcia oraz w infuzji dożylnej, całkowitą dawkę lidokainy należy zmniejszyć.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Jeśli istnieje taka konieczność, infuzję dożylną lidokainy można rozpocząć 4 do 8 godzin po podaniu ostatniej dawki (w bolusie) leku stosowanego w znieczuleniu regionalnym. W przypadku nieudanego znieczulenia zewnątrzoponowego, po zatrzymaniu infuzji ciągłej do przestrzeni zewnątrzoponowej i bez podania dawki do przestrzeni zewnątrzoponowej w bolusie, ciągła infuzja dożylna lidokainy może być rozpoczęta natychmiast, ale bez podania dożylnego w bolusie. Dawkę lidokainy należy zmniejszyć w stanach, w których może dojść do zwiększenia wolnej frakcji leku w surowicy – kwasicy, hiperkapnii, hipoksji, hipoproteinemii oraz zaburzeń czynności wątroby i (lub) nerek. U pacjentów z niewydolnością krążenia, wątroby i (lub) nerek należy zmniejszyć dawkę lidokainy i monitorować czynność układu krążenia. Leczenie pacjentów z bólem neuropatycznym Dorośli Infuzja ciągła dożylna w dawce 3-5 mg/kg mc. przez minimum 30 minut, ale nie dłużej niż 6 godzin, raz na dobę.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Sposób podawania Produkt można stosować dożylnie, nasiękowo, podpajęczynówkowo i zewnątrzoponowo.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub inne leki miejscowo znieczulające o budowie amidowej, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Ogólne przeciwwskazania do wykonywania znieczulenia podpajęczynówkowego i zewnątrzoponowego, niezależnie od rodzaju środka znieczulającego: ostre choroby ośrodkowego układu nerwowego (np. zapalenie opon mózgowo-rdzeniowych, guzy, zapalenie istoty szarej rdzenia, krwawienie śródczaszkowe); zwężenie kanału rdzenia kręgowego, czynne choroby kręgosłupa (np. proces zapalny, gruźlica kręgosłupa, guzy) lub niedawno przebyte urazy kręgosłupa (np. złamania); posocznica; podostre zwyrodnienie rdzenia kręgowego w przebiegu niedokrwistości złośliwej; zakażenie skóry w miejscu wykonywania znieczulenia lub w jego okolicy; wstrząs kardiogenny lub hipowolemiczny; zaburzenia krzepnięcia lub leczenie lekami przeciwzakrzepowymi.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlPrzeciwwskazania
Infuzja dożylna lidokainy stosowanej w leczeniu bólu w okresie okołooperacyjnym jest przeciwwskazana jeżeli jednocześnie stosowane jest znieczulenie regionalne, szczególnie takie, w którym podaje się lek znieczulenia miejscowego w bolusie lub w dużych dawkach (np. znieczulenie zewnątrzoponowe, znieczulenia pni i splotów nerwowych).
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Znieczulenie miejscowe za pomocą lidokainy może być wykonywane wyłącznie przez lekarzy dobrze znających technikę znieczuleń oraz przeszkolonych w diagnostyce i leczeniu następstw przedawkowania lidokainy, które mogą pojawić się w trakcie znieczulenia regionalnego. W pomieszczeniu, w którym wykonywane są znieczulenia, musi znajdować się źródło tlenu, sprzęt resuscytacyjny i niezbędne leki. Przed przystąpieniem do znieczulenia należy zapewnić dostęp do żyły. Opóźnienie podjęcia działań resuscytacyjnych może prowadzić do niedotlenienia, kwasicy, zatrzymania czynności serca, a nawet zgonu pacjenta. Każde wstrzyknięcie lidokainy w celu znieczulenia należy poprzedzić próbą aspiracji, aby uniknąć niezamierzonego podania donaczyniowego. Warunki bezpiecznego stosowania lidokainy: odpowiednie dawkowanie, poprawna technika znieczulenia, przestrzeganie środków ostrożności oraz gotowość do podjęcia postępowania resuscytacyjnego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Powtarzanie dawek lidokainy może doprowadzić do niebezpiecznie wysokiego wzrostu stężenia w surowicy. Ponieważ ogólna reakcja na wysokie stężenie zależy od stanu pacjenta, u osób wyniszczonych, w podeszłym wieku oraz dzieci należy dostosować dawkę do masy ciała i stanu zdrowia. Lidokaina jest metabolizowana w wątrobie, dlatego w przypadkach niewydolności wątroby należy uwzględnić możliwość zwiększenia stężenia lidokainy w płynach ustrojowych. Podczas znieczulenia należy stale monitorować stan świadomości oraz czynność układów krążenia i oddychania. Wczesnymi objawami toksycznych stężeń lidokainy w ośrodkowym układzie nerwowym są: metaliczny smak w ustach, niepokój, szumy uszne, zawroty głowy, zaburzenia widzenia, drżenia mięśniowe lub senność. Przestrzeganie środków ostrożności jest szczególnie ważne podczas wykonywania znieczuleń w obrębie głowy i szyi. Znieczulenie w obrębie głowy i szyi może wywołać objawy zatrucia mimo zastosowania dopuszczalnej dawki środka znieczulającego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Opisywano w tych przypadkach zaburzenia świadomości, drgawki, depresję układów oddechowego i krążenia. Powyższe reakcje mogą być następstwem niezamierzonego donaczyniowego podania lidokainy. Szczególnie groźne mogą być konsekwencje wstrzyknięcia produktu do światła tętnicy zaopatrującej ośrodkowy układ nerwowy. Należy zachować ostrożność podając lidokainę zewnątrzoponowo pacjentom z blokiem serca, a także ciężkim nadciśnieniem tętniczym. Przed wykonaniem znieczulenia podpajęczynówkowego, bez względu na zastosowany środek miejscowo znieczulający, należy rozważyć potencjalne ryzyko i korzyść dla pacjenta. Groźnym powikłaniem znieczuleń centralnych jest całkowite znieczulenie rdzeniowe, które jest następstwem podania do przestrzeni podpajęczynówkowej zbyt dużej dawki środka miejscowo znieczulającego. W rezultacie dochodzi do niewydolności układów krążenia i oddechowego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Niewydolność krążenia jest spowodowana rozległą blokadą układu współczulnego, której objawami są niedociśnienie, znaczna bradykardia lub nawet zatrzymanie pracy serca. Niewydolność oddechowa jest spowodowana porażeniem mięśni oddechowych w wyniku zahamowania przewodnictwa w nerwach zaopatrujących mięśnie oddechowe, w tym również przeponę. Ryzyko wystąpienia wysokiego znieczulenia podpajęczynówkowego jest większe u pacjentów otyłych, z nadciśnieniem wewnątrzbrzusznym oraz u kobiet w zaawansowanej ciąży. W tych przypadkach należy zmniejszyć dawkę środka miejscowo znieczulającego. Natomiast całkowite znieczulenie rdzeniowe jest zazwyczaj rezultatem niezamierzonego, omyłkowego podania do przestrzeni podpajęczynówkowej dawki leku przeznaczonej do znieczulenia zewnątrzoponowego. Wykonanie znieczulenia podpajęczynówkowego u pacjenta z hipowolemią (niezależnie od rodzaju i dawki zastosowanego środka miejscowo znieczulającego) może doprowadzić do nagłego i znacznego obniżenia ciśnienia tętniczego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Trwałe powikłania neurologiczne (brak czucia, zaburzenia czynności ruchowych lub porażenia) bardzo rzadko są następstwem znieczulenia podpajęczynówkowego. Zaleca się zachowanie ostrożności u pacjentów z zaburzeniami neurologicznymi takimi jak stwardnienie rozsiane, porażenie połowicze, porażenie poprzeczne, zaburzenia nerwowo-mięśniowe, mimo że nie obserwowano nasilenia tych zaburzeń po wykonaniu znieczulenia podpajęczynówkowego. Przed podaniem lidokainy w leczeniu bólu w okresie okołooperacyjnym oraz w leczeniu bólu neuropatycznego, jako leku drugiego rzutu, należy u pacjenta wykluczyć i (lub) wyrównać zaburzenia gospodarki wodno-elektrolitowej. Produkt leczniczy zawiera 2,36 mg sodu na każdy ml roztworu, co odpowiada 0,12% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych. Ampułki 2 ml: Produkt leczniczy zawiera 4,72 mg sodu na ampułkę 2ml, co odpowiada 0,24% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Fiolki 20 ml: Produkt leczniczy zawiera 47,2 mg sodu na fiolkę 20 ml, co odpowiada 2,36% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych. Produkt może być rozcieńczany w 0,9% roztworze chlorku sodu. Zawartość sodu pochodzącego z rozcieńczalnika, powinna być brana pod uwagę w obliczeniu całkowitej zawartości sodu w przygotowanym rozcieńczeniu produktu. W celu uzyskania dokładnej informacji dotyczącej zawartości sodu w roztworze wykorzystanym do rozcieńczenia produktu, należy zapoznać się z charakterystyką produktu leczniczego stosowanego rozcieńczalnika. U pacjentów ze zmniejszoną czynnością nerek należy uwzględnić zawartość sodu w produkcie gotowym do podania.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Stosowane w celu leczenia drgawek pochodne hydantoiny (np. fenytoina) mogą nasilać kardiodepresyjne działanie lidokainy, ale mogą również przyspieszać jej metabolizm na skutek indukcji enzymatycznej. Jednoczesne, uzasadnione terapeutycznie stosowanie lidokainy z innymi lekami przeciwarytmicznymi może nasilać jej niepożądane działania. Leki beta-adrenolityczne mogą spowolniać metabolizm lidokainy w wątrobie i nasilać jej toksyczność. Cymetydyna hamuje metabolizm lidokainy, zmniejsza jej klirens wątrobowy i zwiększa stężenie w osoczu. Duże dawki lidokainy mogą nasilać działanie środków zwiotczających mięśnie. Lidokaina podawana dożylnie może nasilić działanie analgetyczne leków przeciwbólowych stosowanych w monoterapii. Okołooperacyjne zastosowanie lidokainy zmniejsza zapotrzebowanie na opioidy.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Badania przeprowadzone na zwierzętach nie wykazały teratogennego działania lidokainy. Nie przeprowadzono jednak dostatecznie dużych, dobrze kontrolowanych badań u ciężarnych kobiet. W związku z tym, tylko w wyjątkowych przypadkach produkt może być stosowany u ciężarnych w czasie trwania organogenezy. Okres porodu Środki miejscowo znieczulające podawane w trakcie porodu z łatwością przenikają przez łożysko, w związku z czym mogą wywoływać objawy zatrucia zarówno u matki jak i płodu. Toksyczność lidokainy zależy od metody i techniki znieczulenia oraz zastosowanej dawki. Zatrucie lidokainą wywołuje u płodu zaburzenia czynności serca. Zastosowanie środków o budowie amidowej do blokady okołoszyjkowej w trakcie porodu wywołuje bradykardię u około 30% płodów. Dlatego wskazane jest stałe monitorowanie tętna płodu. Zbyt wysokie stężenie lidokainy we krwi matki może wywołać spadek ciśnienia tętniczego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWpływ na płodność, ciążę i laktację
Znieczulenie może też hamować czynność skurczową macicy i przedłużać poród. Podejmując decyzję o zastosowaniu znieczulenia okołoszyjkowego w szczególnych sytuacjach położniczych, takich jak: poród przedwczesny, zatrucie ciążowe oraz stan wewnątrzmacicznego zagrożenia płodu, należy rozważyć, czy oczekiwane korzyści przeważają nad potencjalnym ryzykiem. U noworodków, których matki otrzymywały podczas porodu niektóre środki miejscowo znieczulające, obserwowano w pierwszych dwu dniach życia obniżone napięcie mięśni szkieletowych. Jednak nie wiadomo, czy wiąże się to z jakimiś odległymi skutkami. Karmienie piersi? Ponieważ lidokaina przenika do mleka, stosowanie u kobiet karmiących piersią wymaga zachowania ostrożności.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Wpływ lidokainy na zdolność prowadzenia pojazdów i obsługiwania maszyn zależy od rodzaju przeprowadzanego zabiegu i ilości zastosowanej lidokainy. Po znieczuleniu lidokainą pacjent nie powinien prowadzić pojazdów i obsługiwać maszyn przez co najmniej 24 godziny po zakończeniu zabiegu.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane lidokainy są zazwyczaj rezultatem jej nadmiernego stężenia w płynach ustrojowych w wyniku zastosowania zbyt dużej dawki (przedawkowanie względne lub bezwzględne), zaburzeń kinetyki lub niewłaściwej techniki wstrzykiwania. Działania niepożądane zostały podzielone ze względu na częstość występowania: bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia układu immunologicznego Bardzo rzadko: reakcje nadwrażliwości (zwykle zmiany skórne, pokrzywka, obrzęki); Częstość nieznana: reakcje anafilaktoidalne. Zaburzenia układu nerwowego Bardzo rzadko: brak czucia, zaburzenia czynności ruchowych lub porażenia (są następstwem znieczulenia podpajęczynówkowego); Częstość nieznana: metaliczny smak w ustach, uczucie oszołomienia, pobudzenie, niepokój, euforia, drżenia mięśniowe, senność, zaburzenia świadomości, bóle i zawroty głowy, szumy uszne, parestezje, utrata świadomości, drgawki, całkowite znieczulenie rdzeniowe (w następstwie omyłkowego podania do przestrzeni podpajęczynówkowej zbyt dużej dawki lidokainy), wysokie znieczulenie podpajęczynówkowe (w następstwie podania do przestrzeni podpajęczynówkowej zbyt dużej dawki lidokainy).
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
Zaburzenia oka Częstość nieznana: zaburzenia widzenia. Zaburzenia serca Częstość nieznana: bradykardia, zatrzymanie czynności serca (w skrajnie ciężkich przypadkach). Zaburzenia naczyniowe Częstość nieznana: niedociśnienie. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Częstość nieznana: zaburzenia oddychania, w tym zatrzymanie oddechu. Zaburzenia żołądka i jelit Częstość nieznana: nudności, wymioty. Po dożylnym zastosowaniu lidokainy w analgezji multimodalnej (wielokierunkowej) najczęściej występowały: senność, uczucie zmęczenia, nudności, drętwienie warg, metaliczny smak w ustach i zawroty głowy. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy toksyczne pojawiają się po przekroczeniu określonego stężenia lidokainy w surowicy i zależą od podanej dawki, dodatku leków obkurczających naczynia krwionośne, miejsca wstrzyknięcia, dystrybucji w tkankach, metabolizmu i stanu ogólnego pacjenta. Przedawkowanie może być rezultatem: przedawkowania względnego, gdy lek zostaje podany bezpośrednio do naczynia krwionośnego lub w okolicę bogato unaczynioną; przedawkowania bezwzględnego, gdy zostaje przekroczona dawka dopuszczalna. Objawy przedawkowania: faza pobudzenia ośrodkowego układu nerwowego - zaburzenia czucia w obrębie warg i języka, metaliczny smak w ustach, niespójność mowy, zawroty głowy, szumy uszne, zaburzenia widzenia, dreszcze, pobudzenie ruchowe, drżenia mięśni, drgawki; faza depresji ośrodkowego układu nerwowego - śpiączka, depresja oddychania i krążenia.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
Ponadto mogą wystąpić: tachykardia, wzrost ciśnienia tętniczego i oporu naczyniowego, osłabienie automatyzmu serca, bradykardia, asystolia, rozszerzenie oskrzeli. Objawy zatrucia są wskazaniem do natychmiastowego przerwania podawania leku. Jeżeli ich natężenie jest niewielkie (zaburzenia widzenia, zawroty głowy) należy uspokoić pacjenta, podać mu tlen do oddychania i sprawdzić dostęp do żyły. W przypadku silniejszej reakcji toksycznej (ograniczenie świadomości i drżenia mięśni), gdy to konieczne, należy zastosować wentylację zastępczą płuc, dożylnie podać leki podwyższające ciśnienie tętnicze (efedryna, katecholaminy) oraz leki przeciwdrgawkowe (midazolam lub diazepam). Jeśli dochodzi do utraty świadomości z drgawkami kloniczno-tonicznymi, należy natychmiast zaintubować pacjenta i podjąć wentylację zastępczą płuc 100% tlenem, podać dożylnie leki przeciwdrgawkowe (diazepam, propofol, tiopental), korygować kwasicę i leczyć objawowo zgodnie z zasadami intensywnej terapii.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
Dializa w przypadkach ostrego przedawkowania lidokainy nie jest skuteczna.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwarytmiczne klasy IB, kod ATC: C01BB01 Grupa farmakoterapeutyczna: leki miejscowo znieczulające; amidy, kod ATC: N01BB02 Lidokaina jest środkiem miejscowo znieczulającym i przeciwarytmicznym o budowie amidowej. Hamuje powstawanie i przewodzenie bodźców we włóknach nerwowych i układzie przewodzącym serca. Lidokaina blokuje kanały sodowe błon komórek nerwowych. Zahamowanie napływu jonów Na+ uniemożliwia generowanie i przewodzenie impulsów pojawiających się w odpowiedzi na depolaryzację. Wzrasta próg pobudliwości włókien nerwowych aż do całkowitego zablokowania przewodzenia. Stężenie lidokainy blokujące przewodnictwo jest odwrotnie proporcjonalne do średnicy włókna. W pierwszej kolejności blokowane są cienkie włókna bólowe, następnie grubsze czuciowe. Do zablokowania włókien ruchowych (najgrubszych) konieczne są najwyższe stężenia lidokainy.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
Przeciwarytmiczne działanie lidokainy jest rezultatem blokowania kanału sodowego. Lidokaina zaliczana jest do leków przeciwarytmicznych grupy I B wg Vaughna - Williamsa (nie wpływa na czas trwania potencjału czynnościowego). Lidokaina blokuje kanały sodowe i hamuje aktywność bioelektryczną w zdepolaryzowanym mięśniu serca. Natomiast w niewielkim stopniu wpływa na mięsień niezdepolaryzowany oraz na układ przewodzący. Dlatego jest skuteczna w leczeniu zaburzeń rytmu, związanych z depolaryzacją (np. niedokrwienie, przedawkowanie glikozydów nasercowych), natomiast jej działanie w zaburzeniach rytmu powstających w tkance niezdepolaryzowanej jest niewielkie. Lidokaina hamuje depolaryzację diastoliczną i automatyzm komór w układzie przewodzącym. Lidokaina w stężeniach terapeutycznych: nieznacznie obniża rzut serca, opór obwodowy i ciśnienie tętnicze; nie wykazuje wpływu na przedsionki, kurczliwość mięśnia sercowego oraz przewodnictwo przedsionkowo-komorowe.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
Badania kliniczne wykazały skuteczność analgetyczną lidokainy podawanej w okresie okołooperacyjnym i poprawę czynności motorycznej jelit po zabiegach radykalnej prostatektomii, a w operacjach brzusznych (laparoskopowych i laparotomiach), mniejszy odsetek atonii i niedrożności pooperacyjnej jelit, nudności i wymiotów, co przełożyło się na skrócenie czasu hospitalizacji. Okołooperacyjne zastosowanie lidokainy zmniejsza zapotrzebowanie na opioidy. Oprócz działania analgetycznego, lidokaina stosowana dożylnie hamuje reakcję zapalną indukowaną zabiegiem operacyjnym. Uważa się, że wynikiem jej stosowania w okresie pooperacyjnym jest zmniejszenie osoczowych stężeń, m.in., IL-6, IL-8, C3a, IL-1ra, CD11b, L- i P-selektyny. Ponadto skuteczność analgetyczna lidokainy może być znacząco większa w bólu trzewnym niż w bólu somatycznym.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Lidokaina wchłania się całkowicie z miejsca zdeponowania w tkankach. Szybkość narastania stężenia we krwi zależy od wielu czynników, spośród których ważne jest miejsce podania. Najwyższe stężenie lidokainy w osoczu (poza przypadkami, gdy podawana jest dożylnie) stwierdza się w trakcie blokady nerwów międzyżebrowych, nieco niższe w trakcie znieczulenia zewnątrzoponowego, natomiast najniższe w trakcie znieczulenia nasiękowego. Stopień wiązania lidokainy z białkami zależy od stężenia w osoczu. Przy stężeniach od 1 μg/ml do 4 μg/ml z białkami wiąże się od 40% do 80% środka. Lidokaina przenika przez barierę krew-mózg i przez łożysko, docierając do krążenia płodu. Lidokaina jest bardzo szybko metabolizowana w wątrobie do kilku pochodnych N-dealkilowanych, które wykazują słabszą aktywność farmakologiczną. Lek jest wydalany przez nerki przede wszystkim w postaci metabolitów, a tylko 10% w postaci niezmienionej.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
Po wstrzyknięciu dożylnym okres półtrwania w surowicy wynosi 1,6 godz. Kinetyka zmienia się u osób z upośledzoną czynnością wątroby, u których okres półtrwania może być wydłużony nawet dwukrotnie. Upośledzenie czynności nerek nie ma wpływu na kinetykę lidokainy, jakkolwiek w tych przypadkach stwierdza się podwyższone stężenie metabolitów we krwi. Po przekroczeniu stężenia 6 μg/ml surowicy krwi występuje toksyczne działanie na ośrodkowy układ nerwowy w postaci drgawek. Objawy zatrucia może potęgować kwasica oraz stosowanie leków pobudzających aktywność OUN. Dodanie noradrenaliny ogranicza szybkość wchłaniania z tkanek do krwiobiegu, dzięki czemu wydłuża się czas działania oraz zmniejsza stężenie w surowicy; pozwala to na zastosowanie większej dawki. Skuteczne działanie przeciwbólowe lidokainy podawanej dożylnie w okresie okołooperacyjnym uzyskiwane jest po osiągnięciu stężenia w surowicy wynoszącego 1,1-4,2 μg/ml.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach lidokaina nie wywołuje teratogennego działania w dawkach przekraczających dawki stosowane u ludzi 6,6-krotnie. Nie prowadzono badań dotyczących działania rakotwórczego i mutagennego oraz wpływu na płodność u zwierząt.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Sodu wodorotlenek 10% (do ustalenia pH) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Produkt wykazuje niezgodność i nie powinien być mieszany w jednej strzykawce z roztworami zawierającymi wodorowęglan sodu oraz innymi roztworami o odczynie zasadowym. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem, w temperaturze poniżej 25°C. Nie zamrażać. 6.5 Rodzaj i zawartość opakowania 10 ampułek z bezbarwnego szkła po 2 ml w tekturowym pudełku. 5 fiolek z bezbarwnego szkła po 20 ml w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Po pobraniu pierwszej dawki niezużytą w ciągu 24 godzin zawartość fiolki należy zniszczyć.
- CHPL leku Lignocainum hydrochloricum WZF 2%, roztwór do wstrzykiwań, 20 mg/mlDane farmaceutyczne
Instrukcja otwierania ampułki Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu. Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia. Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki. Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3. Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami. Rysunek 1 Rysunek 2 Rysunek 3
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO LIGNOCAINUM 2% c. NORADRENALINO 0,00125% WZF (20 mg + 0,025 mg)/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg lidokainy chlorowodorku jednowodnego (Lidocaini hydrochloridum monohydricum) i 0,025 mg noradrenaliny winianu (Noradrenalini tartras). Substancja pomocnicza o znanym działaniu: sodu pirosiarczyn (E 223), sód. Każdy ml zawiera 1 mg sodu pirosiarczynu, 2 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań Bezbarwny lub prawie bezbarwny, przezroczysty płyn
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWskazania do stosowania
4.1 Wskazania do stosowania Znieczulenie regionalne – nasiękowe, blokady nerwów, pni nerwowych i splotów nerwowych – w chirurgii ogólnej, urologii, ortopedii, ginekologii, położnictwie, stomatologii, ponadto w różnych procedurach diagnostycznych i terapeutycznych.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlDawkowanie
4.2 Dawkowanie i sposób podawania Maksymalna, jednorazowa dawka lidokainy z dodatkiem noradrenaliny dla dorosłego pacjenta, w dobrym stanie ogólnym i bez chorób współistniejących wynosi 500 mg i nie powinna przekraczać 7 mg/kg mc. Lidokainę należy dawkować indywidualnie, kierując się masą ciała pacjenta i jego stanem ogólnym. W trakcie znieczulenia pacjent musi być nadzorowany i należy monitorować jego czynności życiowe. Siła i czas działania lidokainy zależą od stężenia i objętości podanego roztworu. Zwiększenie objętości i stężenia przyspiesza, wydłuża i nasila działanie miejscowo znieczulające. Dodatek noradrenaliny ma na celu spowolnienie wchłaniania lidokainy z miejsca podania. Należy zawsze stosować minimalne skuteczne dawki lidokainy, aby ograniczyć ryzyko przedawkowania. Produkt można rozcieńczać 0,9% roztworem chlorku sodu.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlDawkowanie
Znieczulenie regionalne Stężenie leku: 0,5 - 2% Rodzaj znieczulenia: Znieczulenie nasiękowe Maksymalna dawka lidokainy z dodatkiem noradrenaliny: Do 500 mg Rodzaj znieczulenia: Blokady pni i splotów nerwowych Maksymalna dawka lidokainy z dodatkiem noradrenaliny: Do 500 mg
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na lidokainę lub inne leki miejscowo znieczulające o budowie amidowej, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować do znieczuleń obszarów ciała z anatomicznym lub czynnościowym unaczynieniem końcowym (np. palców u rąk i nóg, czubka nosa, uszu, penisa) ze względu na naczyniokurczowe działanie noradrenaliny mogące doprowadzić do niedokrwienia i martwicy tkanek.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Znieczulenie miejscowe przy pomocy lidokainy powinno być wykonywane wyłącznie przez lekarzy dobrze znających technikę wykonania znieczulenia oraz przeszkolonych w diagnostyce i leczeniu następstw przedawkowania lidokainy, które mogą pojawić się w trakcie znieczulenia regionalnego. W pomieszczeniu, w którym wykonywane są znieczulenia musi znajdować się źródło tlenu, sprzęt resuscytacyjny i niezbędne leki. Przed przystąpieniem do znieczulenia należy zapewnić dostęp do żyły. Opóźnienie podjęcia działań resuscytacyjnych może prowadzić do niedotlenienia, kwasicy, zatrzymania czynności serca, a nawet zgonu pacjenta. Każde wstrzyknięcie lidokainy należy poprzedzić próbą aspiracji, aby uniknąć niezamierzonego podania donaczyniowego.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlSpecjalne środki ostrozności
Warunkami bezpiecznego stosowania lidokainy są: odpowiednie dawkowanie, poprawna technika znieczulenia, przestrzeganie środków ostrożności oraz gotowość do podjęcia postępowania resuscytacyjnego. Należy unikać wstrzykiwania w miejscach objętych stanem zapalnym lub zakażeniem, ponieważ stany te mogą zmniejszyć skuteczność znieczulania miejscowego. Powtarzanie dawek lidokainy może doprowadzić do niebezpiecznego wzrostu jej stężenia w surowicy krwi. Ponieważ ogólna reakcja na wysokie stężenie tego środka zależy od stanu pacjenta, u osób wyniszczonych, w podeszłym wieku oraz dzieci dawkę lidokainy należy dostosować do masy ciała i stanu zdrowia. Lidokaina jest metabolizowana w wątrobie, dlatego w przypadkach jej niewydolności należy liczyć się z wyższym stężeniem tego środka w płynach ustrojowych.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlSpecjalne środki ostrozności
Pomimo że znieczulenie miejscowe uznawane jest za optymalną technikę znieczulenia, u niektórych pacjentów należy zachować szczególną ostrożność, aby zmniejszyć ryzyko wystąpienia ciężkich działań niepożądanych. Są to pacjenci: z padaczką; z zaburzeniami układu oddechowego; w podeszłym wieku i chorzy w złym stanie ogólnym; z częściowym lub całkowitym blokiem przewodzenia, ponieważ środki miejscowo znieczulające mogą hamować czynność układu przewodzącego serca; z zaawansowaną chorobą wątroby lub ciężkimi zaburzeniami czynności nerek; stosujący leki przeciwarytmiczne klasy III (np. amiodaron) - powinni oni znajdować pod ścisłą obserwacją i należy u tych pacjentów rozważyć monitorowanie zapisu EKG, ponieważ działania lidokainy i leków przeciwarytmicznych klasy III na mięsień sercowy mogą się sumować (patrz punkt 4.5); z ostrą porfirią.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlSpecjalne środki ostrozności
Lidokaina przypuszczalnie zwiększa syntezę porfiryn, dlatego należy go stosować u pacjentów z ostrą porfirią wyłącznie w uzasadnionych lub nagłych wskazaniach. Wobec wszystkich pacjentów z porfirią należy zachować odpowiednie środki ostrożności. Określone metody znieczulenia miejscowego mogą się wiązać z ciężkimi działaniami niepożądanymi, niezależnie od rodzaju użytego środka miejscowo znieczulającego, np.: Przy wstrzykiwaniu w okolice głowy i szyi można omyłkowo podać lek do tętnicy, powodując objawy ze strony ośrodkowego układu nerwowego nawet przy małych dawkach leku. Blokada okołoszyjkowa może niekiedy wywoływać bradykardię lub tachykardię u płodu, dlatego konieczne jest dokładne monitorowanie czynności serca płodu. Istnieją doniesienia postmarketingowe o przypadkach chondrolizy u pacjentów otrzymujących pooperacyjnie dostawowo ciągły wlew środków miejscowo znieczulających. Większość doniesień dotyczyła chondrolizy w obrębie stawu barkowego.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlSpecjalne środki ostrozności
Ze względu na wiele czynników mogących się przyczyniać do wystąpienia chondrolizy i niespójności w piśmiennictwie naukowym związek przyczynowo-skutkowy nie został ustalony. Ciągły wlew dostawowy nie został zatwierdzony jako wskazanie do stosowania lidokainy. Należy zachować ostrożność stosując produkt lidokainy z dodatkiem noradrenaliny u pacjentów z ciężkimi schorzeniami układu sercowo-naczyniowego (nadciśnienie tętnicze, choroba wieńcowa, stenoza mitralna), z nadczynnością tarczycy, cukrzycą, guzem chromochłonnym nadnerczy, jaskrą z wąskim kątem. Podczas znieczulenia należy stale monitorować zarówno stan świadomości, jak i czynność układów krążenia i oddychania. Wczesnymi objawami toksycznych stężeń lidokainy w ośrodkowym układzie nerwowym są: metaliczny smak w ustach, niepokój, szumy uszne, zawroty głowy, zaburzenia widzenia, drżenia mięśniowe lub senność. Produkt przeznaczony do wykonywania znieczuleń miejscowych.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlSpecjalne środki ostrozności
Roztworów zawierających środki konserwujące nie należy podawać do przestrzeni podpajęczynówkowej, zewnątrzoponowej, do zbiornika móżdżkowo-rdzeniowego ani jakąkolwiek inną drogą, w której dochodziłoby do kontaktu z płynem mózgowo-rdzeniowym, jak również śródgałkowo czy pozagałkowo. Ze względu na zawartość sodu pirosiarczynu, produkt rzadko może powodować ciężkie reakcje nadwrażliwości i skurcz oskrzeli. Produkt leczniczy zawiera 4 mg sodu na każdej ampułce (2 ml) co odpowiada 0,2% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych. Produkt może być rozcieńczany w 0,9% roztworze NaCl. Zawartość sodu pochodzącego z rozcieńczalnika powinna być brana pod uwagę w obliczeniu całkowitej zawartości sodu w przygotowanym rozcieńczeniu produktu. W celu uzyskania dokładnej informacji dotyczącej zawartości sodu w roztworze wykorzystanym do rozcieńczenia produktu, należy zapoznać się z charakterystyką produktu leczniczego stosowanego rozcieńczalnika.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Należy zachować szczególne środki ostrożności, jeżeli lidokaina jest stosowana u pacjentów, u których jednocześnie są stosowane inne środki miejscowo znieczulające lub leki o budowie chemicznej podobnej do amidowych środków miejscowo znieczulających jak np. leki przeciwarytmiczne (np. meksyletyna), ponieważ działania toksyczne tych leków mogą się sumować. Badania interakcji lidokainy z lekami przeciwarytmicznymi klasy III (np. amiodaron) nie były prowadzone, jednak podczas jednoczesnego stosowania obu leków należy zachować ostrożność (patrz punkt 4.4). Stosowane w leczeniu przeciwdrgawkowym pochodne hydantoiny (np. fenytoina) mogą nasilać kardiodepresyjne działanie lidokainy, ale mogą również przyspieszać jej metabolizm dzięki indukcji enzymatycznej. Jednoczesne, uzasadnione terapeutycznie stosowanie lidokainy z innymi lekami przeciwarytmicznymi może nasilać jej niepożądane działania.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlInterakcje
Leki beta-adrenolityczne mogą spowolniać metabolizm lidokainy w wątrobie i nasilać jej toksyczność. Cymetydyna hamuje metabolizm lidokainy, zmniejsza jej klirens wątrobowy i podwyższa stężenie w osoczu. Duże dawki lidokainy mogą nasilać działanie środków zwiotczających mięśnie. Noradrenalina może powodować nagły wzrost ciśnienia tętniczego u pacjentów stosujących trójpierścieniowe leki przeciwdepresyjne, inhibitory MAO lub guanetydynę. Może też osłabiać działanie doustnych leków przeciwcukrzycowych i powodować zaburzenia rytmu serca.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Badania przeprowadzone na zwierzętach nie wykazały teratogennego działania lidokainy. Nie przeprowadzono dotychczas dostatecznie dużych, dobrze kontrolowanych badań u ciężarnych kobiet. W związku z tym, produkt może być stosowany u ciężarnych w czasie trwania organogenezy tylko w wyjątkowych przypadkach. Okres porodu Środki miejscowo znieczulające podawane w trakcie porodu z łatwością przenikają przez łożysko w związku z czym mogą wywoływać objawy zatrucia zarówno u matki, jak i płodu. Toksyczność lidokainy zależy od metody i techniki znieczulenia oraz zastosowanej dawki. Zatrucie lidokainą wywołuje u płodu zaburzenia czynności serca. Zastosowanie środków o budowie amidowej do blokady okołoszyjkowej w trakcie porodu wywołuje bradykardię u około 30% płodów. Dlatego w tych przypadkach wskazane jest stałe monitorowanie tętna płodu. Zbyt wysokie stężenie lidokainy we krwi matki może wywołać spadek ciśnienia tętniczego.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWpływ na płodność, ciążę i laktację
Znieczulenie może też hamować czynność skurczową macicy i przedłużać poród. Podejmując decyzję o zastosowaniu znieczulenia okołoszyjkowego w szczególnych sytuacjach położniczych, takich jak: poród przedwczesny, zatrucie ciążowe oraz stan wewnątrzmacicznego zagrożenia płodu należy rozważyć, czy oczekiwane korzyści przeważają nad potencjalnym ryzykiem. U noworodków, których matki otrzymywały podczas porodu niektóre środki miejscowo znieczulające, obserwowano w pierwszych dwu dniach życia obniżone napięcie mięśni szkieletowych. Jednak nie wiadomo, czy to zjawisko wiąże się z jakimiś odległymi konsekwencjami. Okres karmienia Ponieważ lidokaina w niewielkich ilościach przenika do mleka kobiecego, jej stosowanie u matek karmiących piersią wymaga zachowania ostrożności.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjent znieczulany lidokainą nie powinien prowadzić i obsługiwać pojazdów i maszyn przez co najmniej 24 godziny po zakończeniu zabiegu.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane lidokainy są zazwyczaj rezultatem nadmiernego wzrostu jej stężenia w płynach ustrojowych w wyniku zastosowania zbyt dużej dawki (przedawkowanie względne lub bezwzględne), zaburzeń kinetyki lub niewłaściwej techniki wstrzykiwania. Zaburzenia naczyniowe obniżenie ciśnienia tętniczego. Zaburzenia żołądka i jelit nudności, wymioty. Zaburzenia układu nerwowego metaliczny smak w ustach, uczucie oszołomienia, pobudzenie, niepokój, euforia, drżenia mięśniowe, zaburzenia świadomości, utrata świadomości, bóle i zawroty głowy, szumy uszne, zaburzenia widzenia, uczucie gorąca, chłodu lub odrętwienia, drgawki, depresja ośrodkowego układu nerwowego. Zaburzenia serca bradykardia, zatrzymanie czynności serca (w skrajnie ciężkich przypadkach). Zaburzenia układu immunologicznego zmiany skórne, pokrzywka, obrzęk, objawy anafilaktoidalne.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlPrzedawkowanie
4.9 Przedawkowanie Objawy toksyczne pojawiają się po przekroczeniu określonego stężenia lidokainy w surowicy krwi i zależą od podanej dawki, dodatku leków obkurczających naczynia krwionośne, miejsca wstrzyknięcia, dystrybucji w tkankach, metabolizmu i stanu ogólnego pacjenta. Przedawkowanie może być rezultatem: przedawkowania względnego, gdy lek zostaje podany bezpośrednio do naczynia krwionośnego lub w okolicę bogato unaczynioną; przedawkowania bezwzględnego, gdy zostaje przekroczona dawka dopuszczalna. Objawy przedawkowania: faza pobudzenia ośrodkowego układu nerwowego - zaburzenia czucia w obrębie warg i języka, metaliczny smak w ustach, niespójność mowy, zawroty głowy, szumy uszne, zaburzenia widzenia, dreszcze, pobudzenie ruchowe, drżenia mięśni, drgawki; faza depresji ośrodkowego układu nerwowego - śpiączka, depresja oddychania i krążenia.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlPrzedawkowanie
Ponadto mogą wystąpić: tachykardia, wzrost ciśnienia tętniczego i oporu naczyniowego, osłabienie automatyzmu serca, bradykardia, asystolia, rozszerzenie oskrzeli. Objawy zatrucia są wskazaniem do natychmiastowego przerwania podawania leku. Jeżeli ich natężenie jest niewielkie (zaburzenia widzenia, zawroty głowy) należy uspokoić pacjenta, podać mu tlen do oddychania i sprawdzić dostęp do żyły. W przypadku silniejszej reakcji toksycznej (ograniczenie świadomości i drżenia mięśni), gdy to konieczne, należy zastosować wentylację zastępczą płuc, dożylnie podać leki podwyższające ciśnienie krwi (atropina, efedryna, katecholaminy) oraz leki przeciwdrgawkowe (midazolam lub diazepam). Jeżeli dochodzi do utraty świadomości z drgawkami kloniczno-tonicznymi należy natychmiast zaintubować tchawicę i podjąć wentylację zastępczą płuc 100% tlenem, podać dożylnie leki przeciwdrgawkowe (diazepam, tiopental), korygować kwasicę i leczyć objawowo zgodnie z zasadami intensywnej terapii.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlPrzedawkowanie
Duże dawki noradrenaliny mogą wywołać objawy ogólne ze strony układu krążenia: tachykardię, wzrost ciśnienia, zaburzenia rytmu serca. W tych przypadkach należy zastosować leczenie objawowe. Dializa w przypadkach ostrego przedawkowania lidokainy nie jest skuteczna.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: lidokaina w skojarzeniu z innymi lekami, kod ATC: N01BB52 Lidokaina jest środkiem miejscowo znieczulającym i przeciwarytmicznym o budowie amidowej. Hamuje ona powstawanie i przewodzenie bodźców we włóknach nerwowych i układzie bodźco-przewodzącym serca. Lidokaina blokuje kanały sodowe błon komórek nerwowych. Zahamowanie napływu jonów Na+ uniemożliwia generowanie i przewodzenie impulsów pojawiających się w odpowiedzi na depolaryzację. Wzrasta próg pobudliwości włókien nerwowych aż do całkowitego zablokowania przewodzenia. Stężenie lidokainy blokujące przewodnictwo jest odwrotnie proporcjonalne do średnicy włókna. W pierwszej kolejności blokowane są cienkie włókna tzw. bólowe, następnie grubsze - czuciowe. Dla zablokowania włókien ruchowych (najgrubszych) konieczne są najwyższe stężenia lidokainy. Noradrenalina obkurcza naczynia krwionośne.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWłaściwości farmakodynamiczne
Dodatek leku sympatykomimetycznego ma na celu zmniejszenie wchłaniania lidokainy z miejsca podania. W wyższych dawkach może wystąpić działanie ogólnoustrojowe noradrenaliny.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Lidokaina wchłania się całkowicie z miejsca zdeponowania w tkankach. Szybkość narastania jej stężenia we krwi zależy od wielu czynników, z których ważnym jest miejsce podania. Najwyższe stężenie lidokainy w osoczu (poza przypadkami, gdy podawana jest dożylnie) stwierdza się w trakcie blokady nerwów międzyżebrowych, nieco niższe u pacjentów znieczulanych zewnątrzoponowo, natomiast najniższe stężenie obserwuje się w trakcie znieczulenia nasiękowego. Stopień wiązania lidokainy z białkami zależy od jej stężenia w osoczu. Przy stężeniach od 1 μg/ml do 4 μg/ml, z białkami wiąże się od 40% do 80% środka. Lidokaina przenika przez barierę krew-mózg i przez łożysko, docierając do krążenia płodu. Lidokaina jest gwałtownie metabolizowana w wątrobie do kilku metabolitów, pochodnych N-dealkilowanych, które wykazują farmakologiczną aktywność, jednak słabszą niż lidokaina.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWłaściwości farmakokinetyczne
Lek jest wydalany przez nerki przede wszystkim w postaci metabolitów, a tylko 10% w postaci niezmienionej. Po wstrzyknięciu dożylnym okres półtrwania lidokainy w surowicy wynosi 1,6 godz. Kinetyka lidokainy zmienia się u osób z upośledzoną czynnością wątroby i w tych przypadkach okres półtrwania może być wydłużony nawet dwukrotnie. Natomiast na kinetykę lidokainy nie ma wpływu upośledzenie czynności nerek, jakkolwiek w tych przypadkach stwierdza się podwyższone stężenie metabolitów we krwi. Toksyczne działanie lidokainy na ośrodkowy układ nerwowy manifestuje się drgawkami, które pojawiają się po przekroczeniu stężenia 6 μg/ml w surowicy. Objawy zatrucia może nasilać kwasica oraz stosowanie leków pobudzających aktywność OUN. Dodanie noradrenaliny ogranicza szybkość wchłaniania lidokainy z tkanek do krwioobiegu, dzięki czemu wydłuża się czas działania oraz zmniejsza jej stężenie w surowicy, co pozwala na zastosowanie większej dawki.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach przedklinicznych nie wykazano działania teratogennego i mutagennego lidokainy ani wpływu na płodność zwierząt. Nie przeprowadzono badań rakotwórczości lidokainy.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Sodu pirosiarczyn (E 223) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Ze względu na noradrenaliny winian znajdujący się w składzie, produktu nie należy mieszać ze środkami o odczynie zasadowym lub właściwościach utleniających, ponieważ mogą wystąpić niezgodności. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać ampułki w oryginalnym opakowaniu w celu ochrony przed światłem, w lodówce (2C-8C). Nie zamrażać. 6.5 Rodzaj i zawartość opakowania 10 ampułek z bezbarwnego szkła o pojemności 2 ml, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Roztwór należy zużyć natychmiast po otwarciu ampułki. Pozostałą, niewykorzystaną część roztworu należy wylać.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlDane farmaceutyczne
Instrukcja otwierania ampułki Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu. Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia. Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki. Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3. Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO LIGNOCAINUM JELFA, 20 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 20 mg lidokainy chlorowodorku (Lidocaini hydrochloridum). Substancje pomocnicze o znanym działaniu: metylu parahydroksybenzoesan, propylu parahydroksybenzoesan. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel Przezroczysta lub lekko opalizująca, bezbarwna, jednolita masa
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy LIGNOCAINUM JELFA żel typu A przeznaczony jest do stosowania w anestezjologii i laryngologii: do pokrywania rurek intubacyjnych i tracheotomijnych, sond żołądkowych, zgłębników; do powierzchniowego znieczulania błon śluzowych nosa, jamy nosowo –gardłowej przed wziernikowaniem krtani, operacją polipów przewodów nosowych, usunięciem przerosłego migdałka gardłowego; jako wstępne znieczulenie do intubacji osób przytomnych. Produkt leczniczy LIGNOCAINUM JELFA żel typu U przeznaczony jest do stosowania w urologii: do znieczulenia cewki moczowej przed zabiegami (cewnikowanie pęcherza moczowego, cystoskopia, kruszenie kamieni w pęcherzu moczowym, elektrokoagulacja brodawczaka pęcherza moczowego, rozszerzenie zwężenia cewki moczowej); jałowa kaniula, zakładana na tubę, umożliwia podanie żelu bezpośrednio do cewki moczowej; do pokrywania powierzchni narzędzi (cewniki, cystoskopy).
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Podanie na śluzówkę jamy ustnej lub na powierzchnię narzędzi medycznych. Dawkowanie i sposób podawania Anestezjologia i laryngologia Przed zabiegami laryngologicznymi żel wprowadza się na błony śluzowe przez pędzlowanie. Urologia Celem znieczulenia cewki moczowej żel wprowadza się (z użyciem jałowej kaniuli) do światła cewki, w ilości około 15 – 20 ml, aż do uczucia wypełnienia cewki. U mężczyzn zaciska się ujście cewki moczowej na 5 minut. Po tym okresie zdejmuje się zacisk i przystępuje do zabiegu. Po użyciu zarówno kaniula urologiczna jak i kontaktujący się z nią żel przestają być jałowe i dlatego nie należy ich powtórnie stosować. Uwaga! Lidokaina łatwo i szybko wchłania się z błon śluzowych. W przypadku stosowania u dzieci, pacjentów z małą masą ciała, osłabionych, w podeszłym wieku lub w przypadku stosowania dużych dawek wskazane jest wyliczenie dawki w zależności od masy ciała. Nie należy przekraczać dawki 3 mg/kg mc.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub inne leki miejscowo znieczulające o budowie amidowej oraz którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie należy stosować żelu do smarowania metalowego usztywniacza rurki dotchawiczej. Należy uważać, aby lidokaina nie dostała się do światła rurki tracheotomijnej. Ostrożnie stosować u osób leczonych trójcyklicznymi lekami przeciwdepresyjnymi lub inhibitorami MAO. Lidokainę należy stosować bardzo ostrożnie na zakażoną lub uszkodzoną błonę śluzową. Należy stosować najniższe skuteczne dawki w celu uniknięcia dużego stężenia lidokainy we krwi i ciężkich działań niepożądanych. Produkty lecznicze zawierające lidokainę należy stosować ostrożnie u pacjentów z chorobami serca i zaburzeniami ze strony układu krążenia. Ze względu na zawartość parahydroksybenzoesanu metylu i parahydroksybenzoesanu propylu, produkt leczniczy może powodować reakcje alergiczne (możliwe reakcje typu późnego) i wyjątkowo skurcz oskrzeli.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Lidokaina nasila działanie leków zwiotczających mięśnie poprzecznie prążkowane. Osłabia działanie sulfonamidów.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża W badaniach na zwierzętach nie wykazano ryzyka dla płodu, jednak nie wykonano odpowiednio liczebnych dobrze kontrolowanych badań u kobiet w ciąży. Lek może być stosowany w ciąży po rozważeniu korzyści wynikających z jego zastosowania i ryzyka związanego ze stosowaniem. Karmienie piersi? Lidokaina stosowana w dawkach terapeutycznych w znikomej ilości przenika do mleka i nie powinna mieć wpływu na dziecko karmione piersią. Należy zachować ostrożność podczas stosowania lidokainy u kobiet karmiących piersią.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy Lignocainum Jelfa może wywierać niewielki wpływ na prowadzenie pojazdów i obsługiwanie maszyn.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gDziałania niepożądane
4.8 Działania niepożądane Lidokaina po podaniu miejscowym może być przyczyną reakcji uczuleniowych oraz, po wchłonięciu, działań ogólnoustrojowych. Wystąpienie i nasilenie działań ogólnoustrojowych zależy od stężenia lidokainy w surowicy (na co wpływa dawka i miejsca podania), stanu ogólnego pacjenta, wydolności wątroby, wieku, masy ciała, ewentualnych chorób serca i nadczynności tarczycy. Zaburzenia serca: bradykardia, zapaść sercowo – naczyniowa prowadząca do zatrzymania akcji serca. Zaburzenia naczyniowe: zmniejszenie ciśnienia krwi. Zaburzenia układu nerwowego: zawroty głowy, parastezje. Senność po podaniu lidokainy jest zwykle wczesnym objawem jej dużego stężenia we krwi, np. w wyniku bardzo szybkiego wchłonięcia. Zaburzenia psychiczne: pobudzenie, niepokój, dezorientacja. Zaburzenia skóry i tkanki podskórnej: zmiany skórne, pokrzywka, obrzęki. Zaburzenia układu immunologicznego: reakcje anafilaktyczne.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49-21-301, faks: + 48 22 49-21-309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gPrzedawkowanie
4.9 Przedawkowanie Podczas stosowania lidokainy mogą wystąpić objawy zatrucia związane z przedawkowaniem bezwzględnym (zastosowania zbyt dużej dawki preparatu). Należy wówczas monitorować ciśnienie tętnicze; ponadto należy obserwować objawy ze strony ośrodkowego układu nerwowego. W razie wystąpienia objawów pobudzenia OUN, skurczów kloniczno-tonicznych należy podać tlen do oddychania oraz zastosować dożylnie diazepam w dawce 0,1 – 0,2 mg/kg mc. lub tiopental w dawce 1 – 2 mg/kg mc. W razie wystąpienia poważnych objawów ze strony układu sercowo-naczyniowego postępowanie jest objawowe. Pacjentowi należy podać tlen, przetaczać płyny izotoniczne, w razie konieczności stosować oddech kontrolowany. W razie zatrzymania krążenia należy bezzwłocznie zastosować zabiegi resuscytacyjne.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki miejscowo znieczulające, amidy; kod ATC: N01BB02. Mechanizm działania Lidokaina należy do grupy leków miejscowo znieczulających o budowie amidowej o krótkim czasie działania. Powoduje odwracalne zahamowanie przewodnictwa we włóknach nerwowych poprzez blokowanie pompy sodowo – potasowej i zahamowanie przepuszczalności błony komórkowej dla jonów. Przewodnictwo w cienkich włóknach nerwowych, bez osłonki mielinowej (np. włókna przewodzące czucie bólu i dotyku) może być zahamowane niskimi stężeniami lidokainy, blokada w osłonce mielinowej wymaga stężeń wyższych. Działanie farmakodynamiczne Produkt leczniczy Lignocainum Jelfa żel stosowany jest do znieczulania miejscowego, nasiękowego błony śluzowej lub skóry. W działaniu miejscowym lidokaina nie drażni tkanek i nie rozszerza naczyń krwionośnych.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gWłaściwości farmakodynamiczne
Żel obok działania znieczulającego odznacza się dużą lepkością i niskim napięciem powierzchniowym, co znacznie zmniejsza współczynnik tarcia między błoną śluzową a dotykającymi ją narzędziami medycznymi.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Początek działania produktu leczniczego występuje po 2 – 3 minutach od aplikacji; działanie utrzymuje się przez około 30 – 60 minut. Lidokaina po podaniu miejscowym wchłania się do krążenia ogólnego, najszybciej z błon śluzowych. Dystrybucja Niezależnie od drogi podania, lidokaina ulega dystrybucji we wszystkich tkankach, przechodzi przez barierę krew – mózg i barierę łożyskową. Stopień wiązania z białkami krwi zależy od stężenia w osoczu. Z białkami krwi wiąże się w 33 – 66%. Objętość dystrybucji wynosi 1,7 l/kg, w niewydolności serca ok. 1,0l/kg. Okres półtrwania w fazie eliminacji u dorosłych wynosi 1,4 – 2,2 h. U pacjentów z niewydolnością wątroby lub niewydolnością serca ulega on wydłużeniu nawet do 5 h, jest także dłuższy u noworodków. Okres półtrwania aktywnych metabolitów jest dłuższy niż związku macierzystego.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gWłaściwości farmakokinetyczne
Metabolizm Lidokaina metabolizowana jest w ponad 90% przez enzymy mikrosomalne w wątrobie, częściowo do aktywnych metabolitów. Jeden z metabolitów pośrednich wykazuje działanie antyarytmiczne i wpływ drgawkotwórczy na OUN.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Nie prowadzono badań rakotwórczości, mutagenności ani wpływu na płodność.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Hydroksyetyloceluloza Metylu parahydroksybenzoesan Propylu parahydroksybenzoesan Sodu wodorotlenek (do ustalenia pH) Kwas solny stężony (do ustalenia pH) Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 2 lata. Okres ważności po pierwszym otwarciu tuby - 6 miesięcy. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Nie zamrażać. 6.5 Rodzaj i zawartość opakowania Typ A do stosowania w anestezjologii i laryngologii: tuba aluminiowa z kaniulą oraz plastikową zakrętką z HDPE w tekturowym pudełku. 1 tuba 30 g. Typ U do stosowania w urologii: tuba aluminiowa z membraną oraz plastikową zakrętką z HDPE w tekturowym pudełku. Do opakowania dołączono jałową kaniulę urologiczną. 1 tuba 30 g.
- CHPL leku Lignocainum Jelfa, Żel, 20 mg/gDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowywania produktu leczniczego do stosowania Opakowanie typu U – przed zastosowaniem (znieczulenie cewki moczowej) jałową kaniulę należy połączyć z tubą, przestrzegając zasad aseptyki. Przed zastosowaniem należy sprawdzić termin ważności podany na opakowaniu i nie stosować produktu leczniczego po jego upływie.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Xylocaine 2%, 20 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu do wstrzykiwań zawiera 20 mg chlorowodorku lidokainy. Każda fiolka po 50 ml roztworu do wstrzykiwań zawiera 1000 mg chlorowodorku lidokainy. Substancje pomocnicze o znanym działaniu: Jeden ml roztworu do wstrzykiwań zawiera 2,49 mg sodu oraz 1 mg metylu parahydroksybenzoesanu (E 218). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań. Klarowny, bezbarwny roztwór.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy Xylocaine 2% jest wskazany do stosowania u dorosłych i młodzieży w wieku powyżej 12 lat w: znieczuleniu nasiękowym; blokadach nerwów obwodowych jak blokada splotu ramiennego, blokada międzyżebrowa; blokadach centralnych ze znieczuleniem zewnątrzoponowym i krzyżowym włącznie. U dzieci w wieku od 1 roku życia do 12 lat zaleca się stosowanie innego produktu leczniczego - roztworu do wstrzykiwań o mniejszym stężeniu chlorowodorku lidokainy.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Podczas wykonywania wszystkich rodzajów znieczuleń z użyciem lidokainy należy stosować wszelkie środki ostrożności, aby uniknąć niezamierzonego donaczyniowego podania produktu leczniczego. Zaleca się uważną aspirację przed podaniem i podczas podawania produktu leczniczego w celu uniknięcia podania donaczyniowego. Jeśli podaje się duże dawki, np. w blokadzie zewnątrzoponowej, zaleca się zastosowanie dawki próbnej od 3 do 5 ml roztworu lidokainy z epinefryną. Niezamierzone podanie donaczyniowe produktu leczniczego można rozpoznać na podstawie przemijającego przyspieszenia czynności serca. Po podaniu dawki próbnej należy przez 5 minut uważnie kontrolować czynności fizjologiczne pacjenta i utrzymywać z nim kontakt słowny. Dawkę główną należy wstrzykiwać powoli, z szybkością od 25 do 50 mg/min lub podawać w dawkach podzielonych. Jednocześnie należy uważnie kontrolować czynności fizjologiczne pacjenta i utrzymywać z nim kontakt słowny.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
W razie wystąpienia nawet łagodnych objawów toksyczności należy natychmiast przerwać podawanie produktu leczniczego. Zaleca się również podanie dawki próbnej (3 do 5 ml lidokainy), aby uniknąć nieumyślnej blokady podpajęczynówkowej. Dawka produktu leczniczego, która ma być podana pacjentowi, zależy od wielkości obszaru, który ma być znieczulony, jego unaczynienia, liczby segmentów, które mają być znieczulone, techniki znieczulenia oraz indywidualnej tolerancji produktu leczniczego przez pacjenta. Obowiązuje zasada podawania najmniejszej dawki skutecznej. Zalecenia dotyczące dawkowania W poniższej tabeli przedstawiono zalecenia dotyczące dawkowania produktu leczniczego Xylocaine 2% i innego produktu leczniczego - 1% roztworu chlorowodorku lidokainy do wstrzykiwań w najczęściej wykonywanych znieczuleniach u dorosłych i młodzieży w wieku powyżej 12 lat. U młodzieży, pacjentów w podeszłym wieku i pacjentów w złym stanie ogólnym dawkę produktu leczniczego należy zmniejszyć.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, produkty lecznicze miejscowo znieczulające z grupy amidów lub którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nadwrażliwość na metylu i (lub) propylu parahydroksybenzoesan [metylo- i (lub) propyloparaben] lub na ich metabolit, kwas paraaminobenzoesowy (PABA). Należy unikać stosowania roztworu lidokainy zawierającego parabeny u pacjentów z nadwrażliwością na estry miejscowo działających produktów leczniczych znieczulających i ich metabolit, PABA. Ogólne przeciwwskazania do stosowania poszczególnych rodzajów znieczulenia miejscowego. Lidokainy nie należy stosować do znieczulenia zewnątrzoponowego u pacjentów ze znaczną hipotensją (np. we wstrząsie kardiogennym lub hipowolemicznym).
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Znieczulenia regionalne powinny być wykonywane w ośrodkach zatrudniających przeszkolony personel, dysponujący wyposażeniem i produktami leczniczymi koniecznymi do monitorowania i resuscytacji pacjenta. Podczas wykonywania większości blokad należy przed zabiegiem zapewnić dostęp do żyły pacjenta. Lekarz prowadzący znieczulenie powinien być odpowiednio wyszkolony oraz znać metody diagnozowania działań niepożądanych i (lub) ostrych objawów toksyczności oraz postępowania w razie ich wystąpienia. W każdym przypadku przedawkowania preparatu lub niezamierzonego podania donaczyniowego mogą wystąpić ostre, ogólnoustrojowe objawy toksyczności. Należy zachować szczególną ostrożność stosując znieczulenie zewnątrzoponowe u pacjentów z zaburzeniami czynności układu krążenia, ze względu na mniejsze możliwości kompensowania zmian związanych z wydłużonym czasem przewodzenia przedsionkowo-komorowego, które mogą wystąpić po zastosowaniu produktów leczniczych miejscowo znieczulających.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Lidokaina jest metabolizowana w wątrobie. Dlatego lidokainę należy stosować ostrożnie u pacjentów z ciężkimi chorobami wątroby lub ze zmniejszonym przepływem wątrobowym. Lidokainę należy stosować ostrożnie u pacjentów z ciężkimi zaburzeniami czynności nerek. W czasie trwania znieczulenia zewnątrzoponowego może wystąpić hipotensja oraz bradykardia. Ryzyko wystąpienia takich objawów można zmniejszyć, np. przez wstrzyknięcie produktu leczniczego wywołującego skurcz naczyń. Niedociśnienie tętnicze należy leczyć niezwłocznie, podając dożylnie sympatykomimetyk, z powtórzeniem w razie potrzeby. U pacjentów z hipowolemią o różnej etiologii (krwawienia, odwodnienie) lub u pacjentów z zaburzonym powrotem żylnym, spowodowanym np. przez znaczne wodobrzusze, duży guz w jamie brzusznej lub zaawansowaną ciążę, może dojść do znacznego obniżenia ciśnienia tętniczego. U pacjentów z niewydolnością krążenia należy unikać istotnej klinicznie hipotensji, ze względu na zaburzone mechanizmy kompensacyjne.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
U pacjentów z hipowolemią podczas znieczulenia zewnątrzoponowego może dojść do nagłego i znacznego obniżenia ciśnienia tętniczego. Podczas znieczulenia zewnątrzoponowego może dojść do porażenia mięśni międzyżebrowych, co u pacjentów z wysiękiem opłucnowym może doprowadzić do zaburzeń oddechowych. Jeżeli znieczulenie zewnątrzoponowe jest wykonywane u pacjenta z posocznicą, zwiększa się ryzyko wystąpienia ropnia wewnątrz kanału kręgowego w okresie pooperacyjnym. Znieczulenie okołoszyjkowe wykonywane u kobiet w ciąży może doprowadzić do wystąpienia u płodu działań niepożądanych (tachykardia lub bradykardia) częściej niż po stosowaniu innych technik znieczulenia. Znieczulenia regionalne wykonywane w okolicy głowy i szyi (włącznie ze znieczuleniem pozagałkowym, znieczuleniami stomatologicznymi i znieczuleniem zwoju gwiaździstego) są związane z większym ryzykiem dotętniczego podania produktu leczniczego.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
W tych przypadkach nawet po podaniu małych dawek produktów leczniczych miejscowo znieczulających mogą wystąpić ogólnoustrojowe objawy toksyczności. W rzadkich przypadkach, w trakcie znieczulenia pozagałkowego może dojść do przedostania się produktu do przestrzeni podpajęczynówkowej, co może doprowadzić do przemijającej ślepoty, zatrzymania krążenia, bezdechu i drgawek. Dlatego podczas wykonywania znieczulenia pozagałkowego, podobnie jak w przypadku innych znieczuleń regionalnych, powinien być obecny przeszkolony personel dysponujący niezbędnym sprzętem i produktami leczniczymi. Stosowanie produktów leczniczych miejscowo znieczulających do znieczuleń okołogałkowych i pozagałkowych może powodować także trwałą dysfunkcję mięśni ocznych. Należy zachować ostrożność, stosując lidokainę u pacjentów z blokiem przedsionkowo-komorowym II lub III stopnia, ponieważ produkty lecznicze miejscowo znieczulające mogą hamować czynność układu przewodzącego serca.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Pacjenci przyjmujący produkty lecznicze przeciwarytmiczne klasy III (np. amiodaron), u których stosowany jest produkt leczniczy Xylocaine 2%, powinni znajdować się pod ścisłą obserwacją i należy rozważyć u nich monitorowanie zapisu EKG. Działania lidokainy i produktów leczniczych przeciwarytmicznych klasy III mogą się sumować. Produkty lecznicze zmniejszające klirens lidokainy (np. cymetydyna lub beta-adrenolityki) mogą powodować potencjalnie toksyczne stężenie lidokainy w osoczu, szczególnie gdy jest ona podawana w dużych dawkach powtarzanych, przez długi czas. Interakcja ta wydaje się nie mieć znaczenia klinicznego, kiedy lidokaina jest podawana krótkotrwale w zalecanych dawkach. U pacjentów z ostrą porfirią należy zastosować odpowiednie środki ostrożności. Jest prawdopodobne, że produkt leczniczy Xylocaine 2% może nasilać objawy porfirii, dlatego należy go stosować u pacjentów z ostrą porfirią tylko w przypadku poważnych wskazań.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Po dopuszczeniu produktu do obrotu zgłaszano przypadki chondrolizy u pacjentów otrzymujących w okresie pooperacyjnym produkty lecznicze miejscowo znieczulające poprzez ciągły wlew dostawowy. Większość zgłaszanych przypadków chondrolizy dotyczyło stawu ramiennego. Ciągły wlew dostawowy nie jest zatwierdzonym wskazaniem dla produktu leczniczego Xylocaine 2%. Dzieci i młodzież Produkt leczniczy Xylocaine 2% jest wskazany do stosowania u młodzieży w wieku powyżej 12 lat. Produkt leczniczy Xylocaine 2%, zawiera metylu parahydroksybenzoesan (E 218) jako środek konserwujący. Produkt leczniczy może powodować reakcje alergiczne (możliwe reakcje typu późnego) i wyjątkowo skurcz oskrzeli. Produktu leczniczego Xylocaine 2% nie należy stosować w znieczuleniu podawanym dooponowo, do przestrzeni podpajęczynówkowej, do- lub zagałkowo. Produkt leczniczy zawiera 124,5 mg sodu na fiolkę (50 ml), co odpowiada 6,23% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Należy zachować szczególną ostrożność, jeżeli lidokaina jest stosowana u pacjentów, u których jednocześnie są stosowane produkty lecznicze przeciwarytmiczne klasy IB lub inne produkty lecznicze miejscowo znieczulające. Działania toksyczne tych produktów leczniczych mogą się sumować. Nie przeprowadzono badań dotyczących interakcji lidokainy z produktami leczniczymi przeciwarytmicznymi klasy III (np. amiodaron), jednak podczas jednoczesnego stosowania obu produktów leczniczych należy zachować ostrożność (patrz punkt 4.4). Produkty lecznicze zmniejszające klirens lidokainy (np. cymetydyna lub beta-adrenolityki) mogą potencjalnie prowadzić do wystąpienia toksycznego stężenia lidokainy, jeśli jest ona podawana w dużych, powtarzanych dawkach, przez długi czas. Ta interakcja nie powinna mieć znaczenia klinicznego podczas krótkotrwałego podawania lidokainy w zalecanych dawkach.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Lidokaina była stosowana u dużej liczby kobiet w ciąży i kobiet podczas porodu. Nie zaobserwowano, aby lidokaina miała wpływ na reprodukcję u ludzi, zwiększenie częstości występowania wad rozwojowych czy inny bezpośredni lub pośredni wpływ na płód/noworodka. W przypadku znieczulenia okołoszyjkowego, częściej niż po stosowaniu innych technik znieczulenia, może dochodzić do wystąpienia działań niepożądanych u płodu, takich jak bradykardia. Mogą być one wywołane dużym stężeniem lidokainy u płodu. Karmienie piersi? Lidokaina przenika do mleka ludzkiego w tak małej ilości, że jest mało prawdopodobne by stwarzała ryzyko dla dziecka karmionego piersią podczas stosowania zalecanych dawek.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Zależnie od dawki, produkty lecznicze miejscowo znieczulające mogą wywierać nieznaczny wpływ na funkcje psychiczne, jak również mogą wpływać na funkcje motoryczne i koordynację ruchową.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane wywołane bezpośrednio przez produkt leczniczy są niekiedy trudne do odróżnienia od fizjologicznych skutków blokady nerwów (np. spadek ciśnienia tętniczego, bradykardia), bezpośredniego skutku nakłucia igłą (np. uszkodzenie nerwu) lub stanowią pośredni skutek nakłucia (np. krwiak podtwardówkowy). Tabelaryczne zestawienie działań niepożądanych Działania niepożądane uporządkowano według klasyfikacji układów i narządów MedDRA. Częstości występowania działań niepożądanych zdefiniowano następująco: bardzo często (≥ 1/10), często (≥ 1/100 do < 1/10), niezbyt często (≥ 1/1000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1000). Klasyfikacja układów i narządów MedDRA Częstość Działania niepożądane Zaburzenia układu immunologicznego Rzadko Reakcje alergiczne (w najcięższych przypadkach wstrząs anafilaktyczny) Zaburzenia układu nerwowego Często Parestezje, zawroty głowy Niezbyt często Objawy toksyczności ze strony ośrodkowego układu nerwowego (drgawki, parestezje okołoustne, drętwienie języka, nadwrażliwość słuchowa, zaburzenia widzenia, utrata przytomności, drżenie mięśniowe, szumy uszne, dyzartria) Rzadko Neuropatia, uszkodzenia nerwów obwodowych, zapalenie pajęczynówki Zaburzenia oka Rzadko Podwójne widzenie Zaburzenia serca Często Bradykardia Rzadko Zatrzymanie akcji serca, zaburzenia rytmu serca Zaburzenia naczyniowe Bardzo często Niedociśnienie tętnicze Często Nadciśnienie tętnicze Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Rzadko Depresja oddechowa Zaburzenia żołądka i jelit Bardzo często Nudności Często Wymioty Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa tel.: +48 22 49 21 301 faks: +48 22 49 21 309 strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy Objawy przedawkowania dotyczą przede wszystkim układu krążenia oraz ośrodkowego układu nerwowego. Wystąpienie działań toksycznych wiąże się z dużym stężeniem lidokainy w osoczu, co może być spowodowane podaniem bardzo dużej dawki produktu leczniczego, szybkim wchłonięciem się produktu leczniczego do krążenia ogólnoustrojowego lub niezamierzonym podaniem donaczyniowym (patrz punkt 4.4). Objawy ze strony układu nerwowego są podobne dla wszystkich produktów leczniczych miejscowo znieczulających o budowie amidowej, przy czym zależnie od zastosowanego produktu leczniczego różne jest nasilenie objawów (zarówno ilościowe, jak i jakościowe) ze strony układu krążenia. Przypadkowe podanie donaczyniowe może wywołać natychmiastowe wystąpienie objawów zatrucia (w ciągu kilku sekund do kilku minut od podania).
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
W razie przedawkowania produktu leczniczego objawy zatrucia występują później (15 do 60 minut od podania), gdyż w takiej sytuacji stężenie produktu leczniczego we krwi zwiększa się wolniej. Objawy zatrucia ze strony ośrodkowego układu nerwowego narastają stopniowo. Początkowo obserwuje się takie objawy, jak drętwienie ust i wokół ust, drętwienie języka, zawroty głowy, szumy w uszach i przeczulica słuchowa, zaburzenia widzenia. Następnie występują zaburzenia artykulacji i skurcze mięśni, które mogą poprzedzać wystąpienie uogólnionych drgawek. Do kolejnych objawów należą: utrata przytomności i drgawki typu grand mal, które trwają od kilku sekund do kilku minut. Ze względu na zwiększoną aktywność mięśniową oraz zaburzenia oddychania podczas drgawek szybko dochodzi do hipoksji i hiperkapnii. W ciężkich przypadkach może nawet dojść do zatrzymania oddechu. Kwasica nasila działanie toksyczne produktów leczniczych miejscowo znieczulających.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
Objawy zatrucia ze strony układu sercowo-naczyniowego występują w razie dużego ogólnoustrojowego stężenia lidokainy. Do objawów tych należą: znaczne obniżenie ciśnienia tętniczego, bradykardia, zaburzenia rytmu serca (blok przedsionkowo-komorowy, częstoskurcz komorowy, migotanie przedsionków) oraz zatrzymanie czynności serca. Jeśli pacjent nie otrzymuje produktów leczniczych znieczulających ogólnie lub dużych dawek produktów leczniczych uspokajających, np. pochodnych benzodiazepiny lub barbituranów, to objawy zatrucia ze strony układu sercowo-naczyniowego są zwykle poprzedzone wystąpieniem objawów zatrucia ze strony ośrodkowego układu nerwowego. Objawy ustępują po redystrybucji produktu leczniczego z ośrodkowego układu nerwowego oraz w wyniku jego metabolizmu i wydalania. Powrót do stanu sprzed podania produktu leczniczego następuje szybko, o ile nie podano bardzo dużych dawek produktu leczniczego.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
Postępowanie w razie wystąpienia ostrych objawów toksyczności Leczenie pacjentów, u których wystąpiły ostre objawy toksyczności, ma na celu przede wszystkim przerwanie napadu drgawek oraz zapewnienie odpowiedniego natlenowania pacjenta. Jeśli jest to konieczne, należy zastosować wentylację wspomaganą lub kontrolowaną. W razie wystąpienia drgawek należy podać dożylnie produkt leczniczy przeciwdrgawkowy, np. tiopental w dawce od 100 do 200 mg lub diazepam w dawce od 5 do 10 mg. Można również podać dożylnie sukcynylocholinę w dawce od 50 do 100 mg, jednak w tym przypadku należy pacjenta zaintubować dotchawiczo i wdrożyć pełne postępowanie jak u pacjenta po zwiotczeniu mięśni. Po ustąpieniu drgawek i zapewnieniu prawidłowej wentylacji płuc nie jest konieczne wdrożenie innego leczenia. W razie wystąpienia hipotensji należy zastosować produkty lecznicze obkurczające naczynia, najlepiej o działaniu inotropowym dodatnim, np. efedrynę w dawce od 5 do 10 mg dożylnie.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
W razie zatrzymania czynności serca po zastosowaniu lidokainy należy rozpocząć resuscytację. Jeśli jest to konieczne, należy zastosować również defibrylację elektryczną. Aby uzyskać powrót hemodynamicznie wydolnej czynności serca, może być konieczne prowadzenie resuscytacji przez długi czas. Należy także rozpocząć leczenie kwasicy.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki miejscowo znieczulające, amidy, kod ATC: N01BB02. Mechanizm działania i działanie farmakodynamiczne Lidokaina jest środkiem miejscowo znieczulającym o budowie amidowej, charakteryzującym się szybkim początkiem i średnim czasem działania. Roztwór 2% podany zewnątrzoponowo działa od 1,5 do 2 godzin i do 5 godzin w przypadku blokady nerwów odwodowych. Roztwór 1% ma mniejszy wpływ na włókna ruchowe i krótszy czas działania. Początek działania i czas działania lidokainy zależą od dawki i miejsca podania. Lidokaina, tak jak inne produkty lecznicze miejscowo znieczulające, powoduje odwracalne zahamowanie przewodzenia impulsów nerwowych na skutek zmniejszenia przepuszczalności błony komórkowej neuronu dla jonów sodowych. Uważa się, że kanały sodowe błony komórkowej neuronu są receptorami dla produktów leczniczych miejscowo znieczulających.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
Podobne działanie wywołuje lidokaina w pobudliwych błonach komórek mózgu i mięśnia sercowego. Jeśli lidokaina w dużych dawkach znajdzie się w układzie krążenia mogą wystąpić objawy jej toksycznego działania. Dotyczą one przede wszystkim układu nerwowego i krążenia. Objawy toksyczności ze strony układu nerwowego pojawiają się jako pierwsze, ponieważ do ich wystąpienia wystarczy mniejsze stężenie lidokainy w osoczu. Do objawów bezpośredniego działania na mięsień serca należą zwolnienie przewodnictwa, ujemny wpływ inotropowy, zatrzymanie serca. Pośredni wpływ na układ sercowo-naczyniowy tj. hipotensja i bradykardia może wystąpić podczas znieczulenia zewnątrzoponowego i zależy od rozległości współistniejącej blokady współczulnej.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne pKa dla lidokainy wynosi 7,9, współczynnik podziału olej-woda 2,9. Lidokaina wiąże się z białkami osocza w 65% (głównie z kwaśną alfa-1-glikoproteiną). Szybkość wchłaniania i ilość wchłoniętej lidokainy zależą od podanej dawki całkowitej, miejsca i drogi podania oraz unaczynienia miejsca podania. Lidokaina wchłania się z przestrzeni zewnątrzoponowej dwufazowo, a okresy półtrwania wynoszą odpowiednio 9,3 i 82 minuty. Szybkość wchłaniania wpływa na szybkość eliminacji podczas znieczulenia zewnątrzoponowego. W związku z tym szybkość eliminacji lidokainy po podaniu zewnątrzoponowym jest mniejsza niż po podaniu dożylnym. Wchłanianie lidokainy z przestrzeni podpajęczynówkowej jest jednofazowe, a okres półtrwania wynosi 71 minut. Klirens lidokainy wynosi 0,95 l/min, objętość dystrybucji w stanie stacjonarnym wynosi 91 l, okres półtrwania w fazie eliminacji wynosi 1,6 godziny, a szacowany współczynnik wydalania wątrobowego 0,65.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
Lidokaina jest eliminowana z organizmu na drodze metabolizmu w wątrobie i zależy od przepływu wątrobowego oraz aktywności enzymów wątrobowych. Okres półtrwania w fazie eliminacji u noworodków jest dwukrotnie większy niż u dorosłych i wynosi 3,2 godziny, natomiast klirens jest podobny (10,2 ml/min/kg mc.). Lidokaina łatwo przenika przez łożysko, a stężenie niezwiązanej lidokainy jest takie samo u matki i płodu. Jednak całkowite stężenie w osoczu jest niższe u płodu, ponieważ stopień wiązania się lidokainy z białkami osocza jest mniejszy u płodu. Lidokaina przenika do mleka matek karmiących w bardzo niewielkiej ilości, co nie powoduje ryzyka dla dziecka, jeśli jest ona stosowana w zalecanych dawkach. Głównym metabolitem lidokainy jest monoetyloglicynian ksylidyny (MEGX), 2,6-ksylidyna, 4-hydroksy-2,6-ksylidyna. N-dealikilacja do MEGX zachodzi przy udziale CYP1A2 i CYP3A4.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
2,6-ksylidyna jest metabolizowana do 4-hydroksy-2,6-ksylidyny, która jest wydalana w postaci związanej i stanowi główny metabolit stwierdzany w moczu (około 70%). Tylko 3% lidokainy jest wydalane w postaci niezmienionej. Zdolność do wywoływania drgawek przez MEGX jest porównywalna z lidokainą, przy nieco dłuższym okresie półtrwania. GX nie ma zdolności do wywoływania drgawek, jego okres półtrwania wynosi mniej więcej 10 godzin. Metabolizm lidokainy polega przede wszystkim na N-dealkilacji do monoetyloglicynianu ksylidyny (MEGX).
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach objawy toksyczności stwierdzone po podaniu dużych dawek lidokainy dotyczyły wpływu na ośrodkowy układ nerwowy i układ krążenia. Nie stwierdzono wpływu lidokainy na rozród i rozwój potomstwa, ani działania mutagennego w wykonanych in vitro i in vivo badaniach. Nie wykonano badań działania rakotwórczego ze względu na zakres i czas działania terapeutycznego. Przeprowadzone badania genotoksyczności nie wykazały mutagennego wpływu lidokainy. Jeden z metabolitów, 2,6-ksylidyna wykazywał niewielki wpływ genotoksyczny. W przedklinicznych badaniach toksyczności po długotrwałym podawaniu 2,6-ksylidyna wykazywała działanie rakotwórcze. Maksymalne stężenie w osoczu po przerywanym podaniu lidokainy u ludzi, wyliczone na podstawie ekspozycji stwierdzonej w badaniach przedklinicznych wskazuje na szeroki zakres bezpieczeństwa w praktyce klinicznej.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Metylu parahydroksybenzoesan (E 218) Sodu wodorotlenek 2 mol/l i (lub) 2 mol/l kwas solny do uzyskania pH od 5,0 do 7,0 Woda oczyszczona 6.2 Niezgodności farmaceutyczne pH roztworu wynosi od 5,0 do 7,0. Alkalizacja roztworu (zwiększenie pH) może spowodować wytrącenie osadu. W otwartej fiolce nie należy pozostawiać igieł ani jakichkolwiek przedmiotów metalowych. Może wtedy dojść do uwalniania się jonów metalu, co może być przyczyną powstawania obrzęków w miejscu wstrzyknięcia. 6.3 Okres ważności 3 lata Po pierwszym otwarciu fiolki: 3 doby (72 godziny). 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25C. 6.5 Rodzaj i zawartość opakowania Fiolka z bezbarwnego szkła w tekturowym pudełku. Wielkość opakowania: 5 fiolek po 50 ml.
- CHPL leku Xylocaine 2%, roztwór do wstrzykiwań, 20 mg/mlDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO XYLODONT 2%, 20 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg lidokainy chlorowodorku (Lidocaini hydrochloridum). 1,8 ml roztworu (1 wkład) zawiera 36 mg lidokainy chlorowodorku (Lidocaini hydrochloridum). Pełny wykaz substancji pomocniczych: patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań Wkład zawierający 1,8 ml roztworu do użytku stomatologicznego
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Znieczulenie miejscowe (nasiękowe i blokady nerwów) do wszelkich zabiegów zachowawczych i chirurgicznych w stomatologii.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania 1 do 2 ml lub więcej, w zależności od potrzeb związanych z zabiegiem, nasiękowo lub jako blokada nerwu obwodowego. Roztwór znieczulający należy wstrzykiwać małymi dawkami z szybkością ok. 1 ml/min., po uprzedniej aspiracji. U zdrowej osoby dorosłej, która nie otrzymała środków uspokajających, maksymalna dawka podana jednorazowo albo w kilku kolejnych wstrzyknięciach przez okres nie dłuższy niż 120 minut wynosi 300 mg chlorowodorku lidokainy. W przeliczeniu na masę ciała maksymalna dawka lidokainy nie powinna przekraczać 4,4 mg/kg, przy maksymalnej dawce całkowitej 300 mg. Nie podawać więcej niż zawartość 8,3 wkładu produktu XYLODONT 2%. U dzieci podane dawki należy zmniejszyć w zależności od masy ciała i wieku.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na którykolwiek ze składników leku.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Opisywano rzadkie przypadki śmierci osób, u których nie stwierdzono uprzednio nadwrażliwości. Skuteczność i bezpieczeństwo stosowania lidokainy w stomatologii zależy od właściwego doboru dawki i sposobu podania leku, oraz od zachowania odpowiednich środków ostrożności. W każdym przypadku należy stosować najniższe dawki i stężenia konieczne do osiągnięcia pożądanego działania. Pacjenta należy starannie obserwować i natychmiast przerwać podawanie leku po wystąpieniu pierwszego niepokojącego objawu (np. zaburzenia narządów zmysłów).
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Lidokainę należy stosować z zachowaniem ostrożności u pacjentów otrzymujących związki o strukturze chemicznej podobnej do leków miejscowo znieczulających, w związku z możliwością nasilenia reakcji toksycznych.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Produktu leczniczego XYLODONT 2% nie należy stosować w okresie ciąży.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn XYLODONT 2% wywiera niewielki wpływ na zdolność prowadzenia pojazdów oraz obsługi maszyn. Lekarz powinien zadecydować, czy pacjent może prowadzić pojazd lub obsługiwać maszyny po podaniu leku.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane, które mogą wystąpić podczas stosowania lidokainy, są podobne do obserwowanych podczas stosowania innych środków miejscowo znieczulających o budowie amidowej. Działania te zależą od dawki i mogą być spowodowane dużym stężeniem leku w osoczu, będącym następstwem przedawkowania, szybkiego wchłaniania lub przypadkowego wstrzyknięcia do naczynia, mogą też być spowodowane nadwrażliwością, idiosynkrazją lub zmniejszoną tolerancją pacjenta. Opisywano następujące działania niepożądane: Działania niepożądane przedstawiono zgodnie z klasyfikacją układów i narządów oraz częstością występowania: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100); rzadko (≥1/10 000 do <1/1 000); bardzo rzadko (<1/10 000), nie znana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
Zaburzenia układu nerwowego (rzadko): pobudzenie ośrodkowego układu nerwowego ze stanem podniecenia, drżenia, dezorientacja, zawroty głowy, rozszerzenie źrenic, przyspieszony metabolizm oraz podwyższona temperatura ciała. Po bardzo dużych dawkach: szczękościsk i drgawki. Zaburzenia naczyniowe (rzadko): rozszerzenie naczyń, nadciśnienie. Zaburzenia serca (rzadko): zaburzenia rytmu serca, bradykardia. Zaburzenia układu immunologicznego: reakcje alergiczne (w najcięższych przypadkach wstrząs anafilaktyczny). Reakcje uczuleniowe na lidokainę występują bardzo rzadko (<1/10 000); jeśli wystąpią, należy postępować w sposób typowy. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia (rzadko): przyspieszenie oddechu, rozszerzenie oskrzeli. Zaburzenia żołądka i jelit (często): nudności, wymioty. Zaburzenia skóry i tkanki podskórnej (częstość nie znana): zmiany skórne, pokrzywka, obrzęk, pocenie się.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, Tel.: + 48 22 49 21 301, Faks: + 48 22 49 21 309. Strona internetowa: https://smz.ezdrowie.gov.pl.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
4.9 Przedawkowanie Stany nagłe będące następstwem stosowania miejscowych środków znieczulających związane są z dużymi stężeniami leku w osoczu, spowodowanymi przypadkowym wstrzyknięciem dożylnym. Opisywano następujące działania toksyczne w wyniku przedawkowania: pobudzenie ośrodkowego układu nerwowego ze stanem podniecenia, drżenia, dezorientacją, zawrotami głowy, rozszerzeniem źrenic, przyspieszonym metabolizmem oraz podwyższoną temperaturą ciała; po bardzo dużych dawkach: szczękościsk i drgawki. Postępowanie: Po wystąpieniu pierwszego niepokojącego objawu należy przerwać podawanie leku. Należy ułożyć pacjenta w pozycji poziomej i upewnić się, że oddycha swobodnie; jeśli nie, należy podać tlen, a w przypadku bezdechu zastosować sztuczne oddychanie. Należy unikać stosowania analeptyków działających na rdzeń przedłużony, by nie pogarszać stanu pacjenta poprzez zwiększenie zużycia tlenu. Drgawki można opanować podaniem diazepamu w dawkach od 10-20 mg i.v.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
Nie zaleca się stosowania barbituranów, by nie pogarszać depresji rdzenia przedłużonego. Poprawę stanu krążenia można uzyskać przez dożylne zastosowanie glikokortykosteroidów w odpowiednich dawkach. Dodatkowo można włączyć rozcieńczone roztwory środków pobudzających receptory alfa i beta o działaniu obkurczającym naczynia (np. mefentermina, metaraminol, itp.) lub siarczanu atropiny.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: środki miejscowo znieczulające, amidy. Kod ATC: N01BB02 Lidokaina jest środkiem miejscowo znieczulającym o budowie amidowej. Jej właściwości wynikają z hamowania prądów jonowych odpowiedzialnych za powstawanie i rozprzestrzenianie się bodźców w błonie komórkowej neuronu. Działanie znieczulające rozpoczyna się szybko. Czas skutecznego działania leku zależy od miejsca wstrzyknięcia, stężenia oraz obecności lub braku środka obkurczającego naczynia krwionośne.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Lidokaina jest szybko metabolizowana w wątrobie (jej główne metabolity to monoetyloglicynoksylidyd i glicynoksylidyd). Metabolity i lek w postaci niezmienionej wydalane są z moczem. Wiązanie z białkami surowicy wynosi od 60% do 80%, przy stężeniu lidokainy od 1 do 4 μg/ml. Po podaniu dożylnym w postaci bolusa okres półtrwania wynosi 1,5-2 godzin.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Działania przedkliniczne obserwowano jedynie w przypadku zastosowania dawek, które uznano za przekraczające maksymalną dawkę u ludzi wystarczająco, by uznać, że ma to niewielkie znaczenie dla zastosowania klinicznego. LD50 wynosi: u myszy: 278 mg/kg s.c.; 27 mg/kg i.v. u szczurów: 167 mg/kg i.p.; 469 mg/kg s.c. Adrenalina nie zmienia toksycznego działania lidokainy. U szczurów, którym podawano 2% chlorowodorek lidokainy z adrenaliną lub bez, w dawce 40 mg/kg/dzień przez 4 tygodnie, obserwowano gwałtowne pogorszenie się stanu ogólnego, pobudzenie i sporadycznie drgawki. Nie obserwowano działania toksycznego po zastosowaniu niższych dawek (5-15 mg/kg/dzień). U szczurów, którym podawano 2% chlorowodorek lidokainy w dawce 20 mg/kg/dzień przez 6 miesięcy, obserwowano zwiększenie masy nadnerczy, związane z rozrostem kory. Nie obserwowano działania toksycznego po zastosowaniu niższych dawek (5-10 mg/kg/dzień).
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlPrzedkliniczne dane o bezpieczeństwie
U psów podawanie 2% chlorowodorku lidokainy w dawce 5-10 mg/kg/dzień i.m. przez 16 tygodni nie wywołało działania toksycznego. Toksyczne działanie na płód: badania na zwierzętach nie wykazały wpływu lidokainy na czynności rozrodcze, ani działania teratogennego.
- CHPL leku Xylodont 2%, roztwór do wstrzykiwań, 20 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonano badań dotyczących zgodności. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Wkład ze szkła typu I o pojemności 1,8 ml zamknięty tłokiem i uszczelką z elastomeru. Tekturowe pudełko zawierające 50 wkładów pakowanych w blistry. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak szczególnych wymagań.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO EMLA PLASTER, 25 mg + 25 mg, plaster leczniczy 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden plaster leczniczy o powierzchni około 10 cm², zawiera 25 mg lidokainy (Lidocainum) i 25 mg prylokainy (Prilocainum). Substancja pomocnicza o znanym działaniu: makrogologlicerolu hydroksystearynian. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Plaster leczniczy. Plaster leczniczy EMLA PLASTER składa się z części naklejanej na skórę i folii ochronnej. Część naklejana na skórę ma barwę jasnobeżową. Na środku plastra znajduje się okrągły, biały krążek z celulozy nasączony 1 g emulsji zawierającej substancje czynne i pomocnicze. Pozostała część plastra jest pokryta klejem akrylowym. Powierzchnia kontaktowa krążka nasyconego produktu EMLA PLASTER wynosi około 10 cm². Emulsja EMLA PLASTER powstała przez zawieszenie substancji oleistej w wodzie.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
Faza oleista składa się z eutektycznej mieszaniny form zasadowych lidokainy oraz prylokainy w stosunku 1:1.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt EMLA PLASTER jest wskazany do stosowania: W celu miejscowego znieczulenia skóry: przed nakłuciem i cewnikowaniem żył, pobieraniem krwi do badań; przed powierzchownymi zabiegami chirurgicznymi (w obrębie skóry); u osób dorosłych, a także u dzieci i młodzieży.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i młodzież Szczegóły dotyczące wskazań czy procedur stosowania produktu leczniczego wraz z dawkowaniem i czasem stosowania podano w tabelach 1 i 2. W celu uzyskania dalszych wskazówek dotyczących właściwego zastosowania tych procedur należy zapoznać się z częścią Sposób podawania. Tabela 1. Dorośli i młodzież w wieku 12 lat i starsza Wskazanie/zabieg (procedura) tDawkowanie i czas stosowania Skóra Niewielkie zabiegi, np. nakłucie żyły lub leczenie chirurgiczne niedużych zmian. 1 lub więcej plastrów stosuje się na wybrane obszary skóry przez okres 1-5 godzin. 1) Po dłuższym czasie stosowania plastra stopień znieczulenia ulega zmniejszeniu. Dzieci i młodzież Tabela 2. Dzieci w wieku od 0 do 11 lat Grupa wiekowa Zabieg (procedura) Dawkowanie i czas stosowania Drobne zabiegi i procedury, np. nakłucie żyły lub leczenie chirurgiczne niedużych zmian.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgDawkowanie
1 lub więcej plastrów przez jedną godzinę (patrz informacje szczegółowe poniżej). Noworodki i niemowlęta w wieku 0-2 miesiące Nie więcej niż 1 plaster przez jedną godzinę. Niemowlęta w wieku 3-11 miesięcy Do 2 plastrów przez jedną godzinę. Małe dzieci w wieku 1-5 lat Do 10 plastrów przez 1-5 godzin. Dzieci w wieku 6-11 lat Do 20 plastrów przez 1-5 godzin. Dzieci i młodzież z atopowym zapaleniem skóry Przed usunięciem zmian mięczakowych Czas stosowania: 30 minut. 1) U noworodków urodzonych o czasie oraz u niemowląt w wieku poniżej 3 miesięcy, w każdym dowolnym okresie 24-godzinnym należy podać tylko jedną pojedynczą dawkę. U dzieci w wieku 3 miesięcy i starszych, w każdym dowolnym okresie 24-godzinnym należy podać maksymalnie 2 dawki, w odstępie co najmniej 12 godzin; patrz punkty 4.4 oraz 4.8.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgDawkowanie
2) Ze względów bezpieczeństwa produkt EMLA PLASTER nie powinien być stosowany u niemowląt w wieku do 12 miesięcy, leczonych produktami indukującymi powstawanie methemoglobiny, patrz punkty 4.4 oraz 4.8. 3) Ze względów bezpieczeństwa produktu EMLA PLASTER nie należy stosować u dzieci w wieku ciążowym poniżej 37 tygodni, patrz punkt 4.4. 4) Nie udokumentowano stosowania przez dłużej niż 1 godzinę. 5) Nie obserwowano klinicznie istotnego zwiększenia frakcji methemoglobiny stosując 2 g produktu EMLA w kremie przez czas do 4 godzin na powierzchni 16 cm². 6) Po dłuższym czasie stosowania stopień znieczulenia zmniejsza się. 7) Rozmiar plastra czyni go mniej odpowiednim do stosowania na pewnych częściach ciała noworodków i niemowląt. Pacjenci w podeszłym wieku U pacjentów w podeszłym wieku nie jest konieczna redukcja dawki (patrz punkty 5.1 oraz 5.2).
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgDawkowanie
Pacjenci z zaburzeniem czynności wątroby Redukcja dawki jednorazowej nie jest konieczna u pacjentów z zaburzeniem czynności wątroby (patrz punkt 5.2). Pacjenci z zaburzeniem czynności nerek Redukcja dawki nie jest konieczna u pacjentów z zaburzeniem czynności nerek. Sposób podawania Podanie na skórę. Po oddzieleniu warstwy ochronnej i umieszczeniu plastra na skórze, plaster należy docisnąć do skóry tylko na jego krawędziach. Nie należy uciskać środkowej części plastra. Uciśnięcie może spowodować rozprzestrzenienie się emulsji produktu EMLA PLASTER pod warstwą przylepną i zmniejszyć przylepność plastra. Produkt EMLA PLASTER należy zastosować co najmniej 1 godzinę przed zabiegiem. Jeżeli to konieczne, przed zastosowaniem plastra należy wygolić owłosienie w miejscu przyklejenia plastra. Plastra nie wolno przecinać lub dzielić na mniejsze fragmenty.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na lidokainę i (lub) prylokainę lub na inne leki miejscowo znieczulające o budowie amidowej lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Pacjenci z dziedzicznym niedoborem dehydrogenazy glukozo-6-fosforanowej oraz samoistną methemoglobinemią są bardziej podatni na występowanie objawów methemoglobinemii indukowanej przez substancję czynną produktu. U pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej, antidotum w postaci błękitu metylenowego jest nieskuteczne w redukowaniu methemoglobiny i może prowadzić do oksydacji hemoglobiny; z tego względu terapia błękitem metylenowym nie może być stosowana. Ze względu na niewystarczającą ilość danych dotyczących wchłaniania, produktu EMLA PLASTER nie należy stosować na otwarte rany. Należy zachować ostrożność podczas stosowania produktu EMLA PLASTER u pacjentów z atopowym zapaleniem skóry. Wystarczający może być krótszy czas stosowania plastra, wynoszący 15 do 30 minut (patrz punkt 5.1).
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgSpecjalne środki ostrozności
U pacjentów z atopowym zapaleniem skóry czas stosowania dłuższy niż 30 minut może skutkować częstszym występowaniem miejscowych reakcji naczyniowych, szczególnie zaczerwienieniem miejsca aplikacji a w niektórych przypadkach powstawaniem wybroczyn i plamicy (patrz punkt 4.8). Przed usunięciem zmian mięczakowych u dzieci z atopowym zapaleniem skóry zaleca się zastosowanie plastra przez 30 minut. Podczas stosowania produktu EMLA PLASTER w okolicy oczu należy zachować szczególną ostrożność, ponieważ może on powodować podrażnienie oczu. Również utrata odruchów obronnych może ułatwić podrażnienie rogówki i potencjalne jej uszkodzenie (zadrapanie). W razie kontaktu plastra z okiem należy natychmiast przemyć oko wodą lub roztworem chlorku sodu oraz chronić do czasu powrotu czucia. Lidokaina i prylokaina w stężeniu większym niż 0,5%-2% wykazują działanie bakteriobójcze i przeciwwirusowe.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgSpecjalne środki ostrozności
Z tego względu, mimo że wyniki jednego badania klinicznego sugerują, że na odpowiedź na szczepienie, ocenianą na podstawie wielkości bąbla skórnego, nie ma wpływu użycie produktu EMLA PLASTER przed szczepieniem BCG, zalecane jest monitorowanie wyników śródskórnych iniekcji żywych szczepionek. Produkt EMLA PLASTER zawiera makrogologlicerolu hydroksystearynian, który może powodować reakcje skórne. Dzieci i młodzież W badaniach nie zdołano wykazać skuteczności produktu EMLA PLASTER w znieczuleniu do nakłucia pięty u noworodków. U noworodków lub niemowląt w wieku poniżej 3 miesięcy zwykle obserwuje się przemijające, klinicznie nieistotne zwiększenie zawartości frakcji methemoglobiny w czasie do 12 godzin po zastosowaniu produktu EMLA PLASTER w zakresie zalecanych dawek. W razie przekroczenia zalecanej dawki pacjent powinien być obserwowany pod względem wystąpienia ogólnoustrojowych działań niepożądanych wtórnych do methemoglobinemii (patrz punkty 4.2, 4.8 oraz 4.9).
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgSpecjalne środki ostrozności
Produktu EMLA PLASTER nie należy stosować: U noworodków lub niemowląt w wieku do 12 miesięcy leczonych jednocześnie produktami indukującymi powstawanie methemoglobiny. U noworodków urodzonych przedwcześnie w wieku ciążowym poniżej 37 tygodni, ponieważ występuje u nich ryzyko zwiększenia stężenia methemoglobiny.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Prylokaina w dużych dawkach może powodować zwiększenie stężenia frakcji methemoglobiny, szczególnie w połączeniu ze stosowanymi jednocześnie produktami leczniczymi indukującymi powstawanie methemoglobiny (np. sulfonamidami, nitrofurantoiną, fenytoiną, fenobarbitalem). Podane przykłady nie stanowią pełnej listy takich produktów. Podczas jednoczesnego stosowania dużych dawek produktu EMLA PLASTER należy wziąć pod uwagę ryzyko wystąpienia dodatkowych oznak toksyczności ogólnoustrojowej u pacjentów przyjmujących inne leki miejscowo znieczulające lub produkty lecznicze strukturalnie spokrewnione z anestetykami miejscowymi, ponieważ działania toksyczne tych leków mogą się sumować. Produkty lecznicze, które zmniejszają klirens lidokainy (np.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgInterakcje
cymetydyna lub leki beta-aderenolityczne) mogą prowadzić do potencjalnie toksycznych stężeń lidokainy w osoczu, gdy lidokaina jest podawana w dużych dawkach powtarzanych w długim okresie. Takie interakcje nie powinny zatem być istotne klinicznie po krótkotrwałym stosowaniu lidokainy (np. produktem EMLA PLASTER) w zalecanych dawkach. Dzieci i młodzież Nie przeprowadzono konkretnych badań dotyczących interakcji u dzieci. Można spodziewać się, że interakcje u dzieci i młodzieży są podobne jak u osób dorosłych.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Stosowanie produktu EMLA PLASTER u kobiet w ciąży należy podejmować z ostrożnością ze względu na niewystarczającą ilość danych dostępnych na temat stosowania tego produktu leczniczego u kobiet w ciąży, chociaż podczas stosowania miejscowego jest on w małym stopniu wchłaniany ogólnoustrojowo. Jednakże, wyniki badań na zwierzętach nie wskazują na jakikolwiek bezpośredni lub pośredni negatywny wpływ produktu leczniczego na ciążę, rozwój zarodka i płodu, przebieg porodu czy rozwój pourodzeniowy potomstwa. Wykazano toksyczny wpływ na reprodukcję stosując podskórnie lub domięśniowo duże dawki lidokainy lub prylokainy, znacznie przewyższające ekspozycję na produkt leczniczy podczas stosowania miejscowego na skórę (patrz punkt 5.3). Lidokaina i prylokaina przenikają przez barierę łożyskową i mogą ulegać wchłanianiu przez tkanki płodu.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgWpływ na płodność, ciążę i laktację
Rozsądnym i uzasadnionym jest przyjęcie założenia, że lidokaina i prylokaina były dotąd stosowane u wielu kobiet w ciąży oraz kobiet w wieku rozrodczym. Jak dotąd nie zgłaszano żadnych konkretnych zaburzeń rozrodu, np. zwiększonej częstości występowania wad i zaburzeń rozwojowych lub innych bezpośrednich lub pośrednich oddziaływań szkodliwych względem płodu. Karmienie piersi? Lidokaina oraz, zapewne również, prylokaina są wydzielane do mleka kobiety, lecz w ilościach tak małych, że zasadniczo nie ma ryzyka zagrożenia dla dziecka podczas stosowania produktu w dawkach terapeutycznych. Produkt EMLA PLASTER może być stosowany w okresie karmienia piersią, jeżeli jest to klinicznie wskazane. Płodność Badania na zwierzętach nie wykazały jakiegokolwiek zaburzenia płodności samców lub samic szczura (patrz punkt 5.3).
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt EMLA PLASTER podczas stosowania w zalecanych dawkach nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Najczęściej obserwowane działania niepożądane produktu leczniczego wiążą się z zaburzeniami w miejscu podania (przemijające reakcje miejscowe w miejscu zastosowania), należą one do kategorii często występujących. Tabelaryczne zestawienie działań niepożądanych Częstości występowania działań niepożądanych produktu leczniczego (ang. Adverse Drug Reactions - ADRs) związanych ze stosowaniem produktu EMLA PLASTER podano w tabeli poniżej. Zestawienie to jest oparte na zdarzeniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu produktu leczniczego do obrotu. Częstości występowania działań niepożądanych są podane według klasyfikacji układów i narządów wg MedDRA oraz z użyciem preferowanego nazewnictwa.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgDziałania niepożądane
W każdej klasie układów narządów działania niepożądane zostały wyszczególnione w kategoriach częstości występowania: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000). W każdej kategorii częstości działania niepożądane przedstawiono w kolejności malejącej ciężkości działania. Tabela 3. Działania niepożądane Klasyfikacja układów i narządów Często Niezbyt często Rzadko Zaburzenia krwi i układu chłonnego Methemoglobinemia Zaburzenia układu immunologicznego Reakcje nadwrażliwości Zaburzenia oka Podrażnienie rogówki Zaburzenia skóry i tkanki podskórnej Plamica, wybroczyny (szczególnie po dłuższym czasie stosowania u dzieci z atopowym zapaleniem skóry lub mięczakiem zakaźnym) Zaburzenia ogólne i stany w miejscu podania Rumień w miejscu podania Obrzęk w miejscu podania Bladość w miejscu podania Uczucie pieczenia Świąd w miejscu podania Odczucie ciepła w miejscu podania Dzieci i młodzież Częstość występowania, rodzaj i nasilenie działań niepożądanych są podobne w grupie wiekowej osób dorosłych oraz dzieci i młodzieży, z wyjątkiem methemoglobinemii, która jest obserwowana częściej, często w związku z przedawkowaniem (patrz punkt 4.9), u noworodków i niemowląt w wieku 0 do 12 miesięcy.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309. Strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można także zgłaszać do podmiotu odpowiedzialnego.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgPrzedawkowanie
4.9 Przedawkowanie Zgłaszano rzadkie przypadki klinicznie istotnej methemoglobinemii. Prylokaina w dużych dawkach może powodować zwiększenie stężenia frakcji methemoglobiny, szczególnie u osób podatnych (patrz punkt 4.4), podczas zbyt częstego stosowania u noworodków i niemowląt w wieku poniżej 12 miesiąca życia (patrz punkt 4.2) oraz w połączeniu ze stosowaniem jednocześnie produktów leczniczych indukujących powstawanie methemoglobiny (np. sulfonamidów, nitrofurantoiny, fenytoiny oraz fenobarbitalu). Należy wziąć pod uwagę, że przy zwiększonej frakcji methemoglobiny odczyty z pulsooksymetru mogą zawyżać wysycenie hemoglobiny tlenem; z tego względu, gdy podejrzewa się methemoglobinemię, bardziej użyteczne może być monitorowanie wysycenia krwi tlenem przy użyciu CO-oksymetrii. Klinicznie istotną methemoglobinemię należy leczyć z zastosowaniem powolnej iniekcji dożylnej błękitu metylenowego (patrz również punkt 4.4).
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgPrzedawkowanie
W razie wystąpienia innych ogólnoustrojowych objawów toksyczności, spodziewane objawy powinny być podobnej natury jak obserwowane po podaniu anestetyków miejscowych innymi drogami podania. Toksyczne oddziaływanie leku miejscowo znieczulającego manifestuje się objawami pobudzenia ośrodkowego układu nerwowego oraz, w ciężkich przypadkach, zahamowaniem ośrodkowego układu nerwowego i czynności układu krążenia. Ciężkie objawy neurologiczne (drgawki, zahamowanie OUN) muszą być leczone objawowo poprzez stosowanie oddechu wspomaganego oraz podawanie leków przeciwdrgawkowych; w odniesieniu do objawów ze strony układu krążenia należy postępować zgodnie z zaleceniami dotyczącymi postępowania resuscytacyjnego. Ze względu na to, że wchłanianie leku z powierzchni nieuszkodzonej skóry jest powolne, pacjent z oznakami toksyczności powinien pozostawać pod obserwacją przez kilka godzin po zastosowaniu leczenia doraźnego.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki znieczulające miejscowo; amidy. Kod ATC: N01B B20. Mechanizm działania Produkt EMLA PLASTER zapewnia znieczulenie skóry poprzez uwalnianie lidokainy i prylokainy do warstw naskórka i skóry właściwej w okolicy skórnych receptorów i zakończeń nerwowych pośredniczących w odczuwaniu bólu. Lidokaina i prylokaina są amidowymi lekami miejscowo znieczulającymi. Oba związki powodują stabilizację błon neuronów przez hamowanie przepływu jonów koniecznego dla zainicjowania i przewodzenia impulsów nerwowych, co skutkuje miejscowym znieczuleniem okolicy poddanej działaniu leku. Jakość znieczulenia zależy od czasu zastosowania produktu leczniczego oraz jego dawki. Skóra Produkt EMLA PLASTER stosuje się na nieuszkodzoną skórę. Czas potrzebny do uzyskania odpowiedniego znieczulenia skóry nieuszkodzonej wynosi od 1 do 2 godzin, w zależności od rodzaju zabiegu lub procedury przewidzianej do wykonania.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgWłaściwości farmakodynamiczne
Miejscowy skutek znieczulający poprawia się wraz z wydłużeniem czasu stosowania produktu leczniczego w zakresie od 1 do 2 godzin w przypadku większości części ciała, z wyjątkiem skóry twarzy. Ze względu na to, że skóra twarzy jest cienka a ukrwienie duże, maksymalny skutek anestetyczny uzyskuje się po 30-60 minutach na czole oraz na policzkach. Czas trwania znieczulenia po zastosowaniu produktu EMLA PLASTER przez 1 do 2 godzin wynosi co najmniej 2 godziny od zdjęcia opatrunku, z wyjątkiem twarzy, gdzie czas trwania znieczulenia jest krótszy. Produkt EMLA PLASTER jest równie skuteczny i wykazuje początek działania po takim samym czasie dla wszystkich rodzajów pigmentacji skóry (typy skóry od I do VI). W badaniach klinicznych z zastosowaniem produktu EMLA PLASTER na nieuszkodzoną skórę nie obserwowano żadnych różnic w odniesieniu do bezpieczeństwa lub skuteczności (w tym w odniesieniu do czasu do początku znieczulenia) między pacjentami w podeszłym wieku (od 65 do 96 lat) a pacjentami młodszymi.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgWłaściwości farmakodynamiczne
Produkt EMLA PLASTER powoduje dwufazową odpowiedź naczyniową, która obejmuje początkowe zwężenie naczyń, po którym następuje rozszerzenie naczyń w miejscu zastosowania produktu leczniczego (patrz punkt 4.8). Niezależnie od odpowiedzi naczyniowej, produkt EMLA PLASTER ułatwia procedurę nakłucia żyły w porównaniu z placebo. U pacjentów z atopowym zapaleniem skóry obserwuje się podobną, lecz bardziej krótkotrwałą reakcję, z pojawianiem się zaczerwienienia po 30-60 minutach, co wskazuje na szybsze wchłanianie produktu przez skórę (patrz punkt 4.4). Produkt EMLA PLASTER może powodować przemijające zwiększenie grubości skóry, częściowo spowodowane uwodnieniem skóry pod plastrem. Grubość skóry zmniejsza się następnie w okresie 15 minut kontaktu skóry z powietrzem. Głębokość (stopień) znieczulenia skóry zwiększa się wraz z wydłużeniem czasu stosowania.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgWłaściwości farmakodynamiczne
U 90% pacjentów znieczulenie jest wystarczające do wprowadzenia sztancy biopsyjnej (o średnicy 4 mm) na głębokość 2 mm po 60 minutach, a na głębokość 3 mm po 120 minutach stosowania produktu EMLA PLASTER. Dzieci i młodzież Przeprowadzono badania kliniczne z udziałem łącznie ponad 2 300 dzieci i młodzieży ze wszystkich grup wiekowych; wykazały one skuteczność w zmniejszaniu bólu związanego z wkłuciem igły (nakłucie żyły, kaniulacja, podawanie szczepionek podskórnie i domięśniowo, nakłucie lędźwiowe), leczeniem laserowym zmian naczyniowych, a także z procedurą łyżeczkowania zmian mięczakowych (mięczak zakaźny). Produkt EMLA PLASTER zmniejsza ból związany zarówno z wprowadzaniem igły jak i z iniekcją szczepionek. Skuteczność analgetyczna zwiększa się wraz z wydłużeniem czasu zastosowania plastra w zakresie od 15 do 90 minut w przypadku skóry niezmienionej, lecz w przypadku zmian naczyniowych skóry nie wykazano, aby zastosowanie produktu przez 90 minut skutkowało lepszym znieczuleniem niż stosując przez 60 minut.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgWłaściwości farmakodynamiczne
Nie stwierdzono przewagi produktu EMLA PLASTER nad placebo w odniesieniu do znieczulenia przed krioterapią brodawek pospolitych (kurzajek) przy użyciu ciekłego azotu. W jedenastu badaniach klinicznych u noworodków i niemowląt wykazano, że maksymalne stężenia methemoglobiny występujące po około 8 godzinach od zastosowania produktu EMLA PLASTER na powierzchnię skóry, są klinicznie nieistotne przy stosowaniu zalecanych dawek i powracają do prawidłowego poziomu po około 12-13 godzinach. Powstawanie methemoglobiny jest związane z kumulacją prylokainy wchłanianej przez skórę i może dlatego nasilać się przy dłuższym czasie stosowania produktu EMLA PLASTER. Stosowanie produktu EMLA PLASTER przed podaniem szczepionek przeciwko odrze-śwince-różyczce lub domięśniowej szczepionki przeciwko błonicy-krztuścowi-tężcowi, inaktywowanego wirusa polio, szczepionki Haemophilus influenzae b lub szczepionek przeciwko zapaleniu wątroby B nie wpływało na średnie miana przeciwciał, tempo serokonwersji lub odsetek pacjentów osiągających ochronne lub dodatnie miana przeciwciał po immunizacji, w porównaniu z pacjentami otrzymującymi placebo.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie, dystrybucja, metabolizm i eliminacja Wchłanianie ogólnoustrojowe lidokainy i prylokainy z produktu EMLA PLASTER zależy od zastosowanej dawki, powierzchni skóry, na którą zastosowano produkt oraz czasu kontaktu ze skórą. Dodatkowymi czynnikami są grubość skóry (która jest różna w różnych częściach ciała), a także inne warunki, takie jak choroby skóry oraz obecność owłosienia lub stopień wygolenia. Stężenia w osoczu po zastosowaniu produktu EMLA PLASTER są 20-60% mniejsze w przypadku prylokainy niż w przypadku lidokainy ze względu na większą objętość dystrybucji i szybszy klirens. Główną drogę eliminacji lidokainy i prylokainy z ustroju stanowi metabolizm wątrobowy a metabolity są wydalane z moczem. Jednakże, tempo metabolizmu i eliminacji leków miejscowo znieczulających po miejscowym zastosowaniu produktu EMLA PLASTER są zależne od tempa wchłaniania.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgWłaściwości farmakokinetyczne
Dlatego zmniejszenie klirensu, jak to ma miejsce u pacjentów z ciężkim zaburzeniem czynności wątroby, ma jedynie ograniczony wpływ na stężenia tych anestetyków w osoczu po zastosowaniu pojedynczej dawki produktu EMLA PLASTER oraz po powtarzanym zastosowaniu dawek pojedynczych raz na dobę w krótkim okresie (do 10 dni). Objawy toksyczności anestetyków miejscowych stają się coraz bardziej widoczne przy wzrastających stężeniach w osoczu od 5 do 10 μg/ml którejkolwiek z substancji czynnych. Należy zakładać, że toksyczność lidokainy oraz prylokainy podlegają sumowaniu. Nieuszkodzona skóra Dostępne dane farmakokinetyczne odnoszą się do stosowania produktu EMLA w kremie 5% na skórę nieuszkodzoną. Po zastosowaniu na udo u pacjentów dorosłych (60 g kremu/400 cm2 przez 3 godziny), stopień wchłaniania lidokainy i prylokainy wynosił w przybliżeniu 5%. Maksymalne stężenia w osoczu (średnio 0,12 oraz 0,07 µg/ml) były osiągane po około 2-6 godzinach od zastosowania.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgWłaściwości farmakokinetyczne
Stopień wchłaniania ogólnoustrojowego wynosił w przybliżeniu 10% po zastosowaniu kremu na skórę twarzy (10 g/100 cm2 przez 2 godziny). Maksymalne stężenia w osoczu (średnio 0,16 oraz 0,06 µg/ml) były osiągane po około 1,5-3 godzinach od zastosowania. Szczególne grupy pacjentów Pacjenci w wieku podeszłym Zarówno u pacjentów w podeszłym wieku jak i u pacjentów młodszych stężenia w osoczu lidokainy i prylokainy po zastosowaniu produktu EMLA PLASTER na nieuszkodzoną skórę są bardzo małe i znacznie poniżej stężeń potencjalnie toksycznych. Po powtarzanym stosowaniu produktu EMLA PLASTER codziennie przez 10 kolejnych dni maksymalne stężenie w osoczu nie zależy od wieku pacjenta, lecz jest istotnie (p<0.01) związane z wielkością powierzchni, na którą zastosowano produkt. Dzieci i młodzież Maksymalne stężenia w osoczu lidokainy i prylokainy po zastosowaniu produktu EMLA w kremie u dzieci i młodzieży w różnym wieku były również na poziomie mniejszym niż powodujący potencjalnie działania toksyczne.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgWłaściwości farmakokinetyczne
Patrz Tabela 4. Tabela 4. Stężenia w osoczu lidokainy i prylokainy u dzieci w grupach wiekowych od 0 miesięcy do 8 lat Wiek: 0-3 miesiące, Zastosowana ilość kremu: 1 g/10 cm2, Czas stosowania kremu na skórze: 1 godzina, Stężenie w osoczu [ng/ml]: lidokaina 135, prylokaina 107 Wiek: 3-12 miesięcy, Zastosowana ilość kremu: 2 g/16 cm2, Czas stosowania kremu na skórze: 4 godziny, Stężenie w osoczu [ng/ml]: lidokaina 155, prylokaina 131 Wiek: 2-3 lata, Zastosowana ilość kremu: 10 g/100 cm2, Czas stosowania kremu na skórze: 2 godziny, Stężenie w osoczu [ng/ml]: lidokaina 315, prylokaina 215 Wiek: 6-8 lat, Zastosowana ilość kremu: 10 - 16 g/100-160 cm2 (1 g/10 cm2), Czas stosowania kremu na skórze: 2 godziny, Stężenie w osoczu [ng/ml]: lidokaina 299, prylokaina 110
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach działanie toksyczne odnotowane po zastosowaniu dużych dawek lidokainy lub prylokainy, każdej z osobna lub łącznie, obejmowało objawy ze strony ośrodkowego układu nerwowego i układu krążenia. Po zastosowaniu lidokainy i prylokainy jednocześnie obserwowano sumowanie się działań obu leków, lecz bez oznak synergizmu lub nieoczekiwanych objawów toksyczności. Zarówno lidokaina, jak i prylokaina charakteryzują się małą toksycznością po doustnym podaniu jednorazowym, co gwarantuje dobry margines bezpieczeństwa w sytuacji przypadkowego połknięcia. W badaniach dotyczących wpływu lidokainy i prylokainy na rozród nie obserwowano działań niepożądanych związanych ze stosowaniem którejkolwiek z obydwu substancji oddzielnie lub w skojarzeniu w dawkach istotnych klinicznie.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgPrzedkliniczne dane o bezpieczeństwie
W badaniach dotyczących wpływu lidokainy i prylokainy na reprodukcję stwierdzono występowanie działań embriotoksycznych lub fetotoksycznych lidokainy z zastosowaniem dawek 25 mg/kg podskórnie u królika, a wodonercze płodu w przypadku prylokainy od dawek 100 mg/kg domięśniowo u szczura. Po stosowaniu dawek poniżej zakresu toksyczności dla samicy ciężarnej u szczura lidokaina lub prylokaina nie wywiera żadnego wpływu na pourodzeniowy rozwój potomstwa. Nie obserwowano zaburzenia płodności samców lub samic szczurów pod wpływem stosowania lidokainy lub prylokainy. Lidokaina przenika przez barierę łożyskową drogą prostej dyfuzji. Proporcja ekspozycji zarodka i płodu na lidokainę względem jej stężenia w surowicy matki mieści się w zakresie od 0,4 do 1,3. W badaniach dotyczących genotoksyczności wykonanych zarówno in vitro, jak i in vivo, nie stwierdzono potencjalnego działania genotoksycznego żadnego z tych anestetyków, tj. lidokainy i prylokainy.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgPrzedkliniczne dane o bezpieczeństwie
Ze względu na rodzaj wskazań do stosowania i czas stosowania produktu u pacjentów nie wykonywano badań dotyczących rakotwórczości lidokainy i prylokainy. Metabolit lidokainy, 2,6-dimetyloanilina, a także metabolit prylokainy, σ-toluidyna, wykazywały oznaki działania genotoksycznego. W przedklinicznych badaniach toksykologicznych służących ocenie przewlekłej ekspozycji wykazano, że te metabolity mają właściwości rakotwórcze. Ocena ryzyka obejmująca porównanie obliczonych maksymalnych ekspozycji u ludzi w związku z przerywanym stosowaniem lidokainy i prylokainy z ekspozycją stosowaną w badaniach nieklinicznych wskazuje na szeroki margines bezpieczeństwa w zastosowaniach klinicznych. Badania tolerancji miejscowej z zastosowaniem mieszaniny 1:1 (wagowo) lidokainy i prylokainy w postaci emulsji, kremu lub żelu wskazują, że te postaci farmaceutyczne są dobrze tolerowane po stosowaniu na nieuszkodzoną skórę i błony śluzowe.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgPrzedkliniczne dane o bezpieczeństwie
Reakcję w postaci znacznego podrażnienia obserwowano po jednorazowym podaniu do oka emulsji lidokainy i prylokainy 1:1 50 mg/g w badaniu na zwierzętach. Jest to takie samo stężenie anestetyków miejscowych i podobna postać farmaceutyczna jak w przypadku produktu EMLA PLASTER. Na taką reakcję oka mogło mieć wpływ wysokie pH postaci emulsji (wynoszące w przybliżeniu 9), lecz jest prawdopodobnie częściowo również wynikiem właściwości drażniących samych anestetyków miejscowych. Badania przedkliniczne materiału samoprzylepnego zastosowanego w plastrach nie wykazały żadnego zagrożenia dla bezpieczeństwa.
- CHPL leku Emla Plaster, plaster leczniczy, 25 mg + 25 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Makrogologlicerolu hydroksystearynian, karboksypolimetylen (Carbopol 974P), sodu wodorotlenek do uzyskania pH od 8,7 do 9,7, woda oczyszczona. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania 2 plastry, zabezpieczone z jednej strony folią aluminiową, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Instrukcja stosowania produktu EMLA PLASTER w postaci plastra znajduje się w każdym opakowaniu.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Orofar Total Action, (2 mg + 1,5 mg)/ml, aerozol do stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu zawiera 2 mg benzoksoniowego chlorku (Benzoxonii chloridum) i 1,5 mg lidokainy chlorowodorku (Lidocaini hydrochloridum). Jedna dawka zawiera 0,2798 mg benzoksoniowego chlorku i 0,2098 mg lidokainy chlorowodorku. Substancje pomocnicze o znanym działaniu: Każdy ml roztworu zawiera 100 mg etanolu 96% oraz olejek miętowy (zawierający 0,0035 mg limonenu). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Aerozol do stosowania w jamie ustnej Przezroczysty, bezbarwny roztwór
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlWskazania do stosowania
4.1 Wskazania do stosowania infekcje gardła; infekcje jamy ustnej (stany zapalne dziąseł, zakażenia i owrzodzenia błony śluzowej jamy ustnej - afty); ból gardła towarzyszący przeziębieniom, zapaleniu gardła, zapaleniu krtani; pomocniczo może być stosowany w leczeniu zapalenia migdałków (angina). Orofar Total Action jest wskazany do stosowania u dorosłych i dzieci w wieku powyżej 6 lat.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli: Orofar Total Action aerozol rozpylać w jamie ustnej lub na tylną ścianę gardła. Trzymając pojemnik pionowo rozpylić dwa do czterech razy przy każdym użyciu. Dawkowanie można powtarzać w razie potrzeby, od trzech do sześciu razy na dobę, zachowując minimum dwie do trzech godzin przerwy pomiędzy dawkami. Dzieci w wieku powyżej 6 lat: Przy każdym użyciu rozpylać dwa – trzy razy w jamie ustnej lub na tylną ścianę gardła. Dawkowanie można powtarzać w razie potrzeby, od trzech do sześciu razy na dobę, zachowując minimum dwie do trzech godzin przerwy pomiędzy dawkami. Produktu leczniczego Orofar Total Action nie należy stosować u dzieci w wieku poniżej 6 lat, gdyż leki miejscowo znieczulające mogą powodować przemijające zaburzenia połykania i zwiększać ryzyko zachłyśnięcia. U dzieci produkt należy stosować pod kontrolą osoby dorosłej. Nie należy stosować u dzieci, które w czasie podawania produktu nie potrafią wstrzymać oddechu.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlDawkowanie
Nie należy przekraczać podanej dawki lub dopuszczalnej częstości dawkowania. Nie należy stosować produktu Orofar Total Action podczas ani tuż przed jedzeniem i piciem. Nie stosować z innymi środkami antyseptycznymi. Należy stosować możliwie najniższą skuteczną dawkę leku, przez możliwie najkrótszy czas. Nie stosować dłużej niż 7 dni bez konsultacji z lekarzem. Dzieci w wieku poniżej 6 lat Produktu nie należy stosować u dzieci w wieku poniżej 6 lat. Osoby w podeszłym wieku Brak danych dotyczących stosowania produktu u osób w podeszłym wieku. Sposób podawania: zdjąć z pojemnika zatyczkę ochronną, lekko dociskając nałożyć na pojemnik końcówkę dozownika, przed pierwszym użyciem należy kilka razy nacisnąć pompkę z dala od twarzy do czasu rozpylenia jednej dawki aerozolu w powietrze, butelkę należy trzymać pionowo, a aerozol rozpylać na tylną ścianę gardła; w czasie podawania preparatu należy wstrzymać oddech, po każdorazowym użyciu końcówka dozownika powinna być zdezynfekowana (za pomocą chusteczki zwilżonej niewielką ilością płynu Orofar Total Action) i wysuszona, w celu uniknięcia rozprzestrzeniania się zakażenia dozownik powinien być stosowany przez jedną osobę, po zastosowaniu preparatu zdjąć końcówkę dozownika i przechowywać ją razem z produktem w opakowaniu zewnętrznym, nie należy stosować, gdy dozownik jest zniszczony.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na chlorek benzoksoniowy i inne czwartorzędowe sole amoniowe. Nadwrażliwość na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nadwrażliwość na lidokainy chlorowodorek lub inne substancje miejscowo znieczulające z grupy amidów.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku, gdy bólowi gardła towarzyszy wysoka gorączka, poważne trudności w przełykaniu lub objawy nie ulegają poprawie lub utrzymują się przez dłużej niż 3 dni należy skonsultować się z lekarzem. Aerozolu nie należy rozpylać w pobliżu oczu ani wdychać. W przypadku, gdy Orofar Total Action jest stosowany dłużej niż dwa tygodnie, możliwe jest wystąpienie odwracalnego, brązowego zabarwienia języka lub zębów. Przebarwienia te mają charakter przejściowy i ustępują po zaprzestaniu stosowania produktu. Nie stosować u osób z tendencją do zachłystywania, zwłaszcza u osób w wieku powyżej 60 lat. Ze względu na ryzyko zachłyśnięcia, produktu leczniczego Orofar Total Action nie należy stosować bezpośrednio przed ani w trakcie jedzenia lub picia. Zawarta w produkcie lidokaina może powodować przemijające drętwienie w jamie ustnej i gardle i utrudniać przełykanie.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlSpecjalne środki ostrozności
Produkt leczniczy Orofar Total Action należy stosować ostrożnie u pacjentów z ranami i uszkodzeniami błony śluzowej. Produktu leczniczego Orofar Total Action nie należy stosować z anionowymi środkami, na przykład pastami do zębów. Środki anionowe mogą zmniejszać działanie chlorku benzoksoniowego. Dlatego też nie należy stosować tego produktu bezpośrednio przed lub po umyciu zębów. Lek przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji. Benzoksoniowy chlorek Ze względu na bardzo małe wchłanianie ogólnoustrojowe, nie należy spodziewać się wystąpienia interakcji. Lidokainy chlorowodorek Lidokaina teoretycznie może wchodzić w interakcje z innymi, jednocześnie stosowanymi lekami, np. z innymi lekami przeciwarytmicznymi. Ze względu na małe dawki zawarte w produkcie, nie należy spodziewać się wystąpienia interakcji. 4.6 Wpływ na płodność, ciążę i laktację Ciąża Dane dotyczące stosowania produktu u kobiet w ciąży są niewystarczające. Badania na zwierzętach nie wykazały wyników, które mają znaczenie dla zalecanego dawkowania i stosowania produktu (patrz punkt 5.3 Przedkliniczne dane o bezpieczeństwie). Należy unikać stosowania tego produktu w czasie ciąży, dlatego też produkt może być stosowany w okresie ciąży jedynie w przypadku, gdy korzyść dla matki przewyższa ryzyko dla płodu.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlInterakcje
Jeżeli produkt jest stosowany, należy rozważyć najniższą skuteczną dawkę i najkrótszy czas trwania leczenia. Benzoksoniowy chlorek Brak odpowiednich danych. Chlorowodorek lidokainy Lidokaina przekracza barierę łożyskową. Nie ma jednak dowodów na niekorzystny wpływ lidokainy na płód. Karmienie piersi? Dane dotyczące stosowania produktu u matek karmiących piersią są niewystarczające. Produktu tego nie należy stosować w okresie laktacji, chyba że spodziewane korzyści dla matki przeważają nad ryzykiem dla niemowlęcia. W przypadku zastosowania należy rozważyć najniższą skuteczną dawkę i najkrótszy czas trwania leczenia. Benzoksoniowy chlorek Nie wiadomo, czy benzoksoniowy chlorek przenika do mleka kobiecego, jednak ze względu na małą absorbcję i bardzo małą biodostępność substancji, ilość dostępna dla dziecka byłaby nieistotna.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlInterakcje
Lidokainy chlorowodorek Niewielkie ilości lidokainy przenikają do mleka kobiecego jednak po zastosowaniu dawek terapeutycznych potencjalne zagrożenie dla dziecka jest mało prawdopodobne. W czasie karmienia piersią Orofar Total Action należy stosować ostrożnie i wówczas, gdy jest to bezwzględnie konieczne. Płodność Nie ma dostępnych danych dotyczących wpływu produktu na płodność. Badania toksycznego wpływu na reprodukcję przeprowadzone na zwierzętach nie wykazały wpływu benzoksoniowego chlorku i lidokainy chlorowodorku stosowanych osobno lub w połączeniu na płodność. 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Orofar Total Action nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. 4.8 Działania niepożądane Działania niepożądane zestawione poniżej zostały uporządkowane zgodnie z częstością występowania.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlInterakcje
Częstość występowania została przedstawiona według następującej konwencji: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100); rzadko (≥1/10 000 do <1/1 000); bardzo rzadko (<1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych). Działania niepożądane wymieniono zgodnie z klasyfikacją układów i narządów MedDRA. W obrębie każdej grupy układów i narządów działania niepożądane uszeregowano według częstości występowania. Klasyfikacja układów i narządów MedDRA Zaburzenia układu immunologicznego Nadwrażliwość (obejmująca obrzęk twarzy, ust, języka i gardła) - Bardzo rzadko Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Duszność - Bardzo rzadko Zaburzenia żołądka i jelit Dyskomfort w jamie ustnej - Często Zaburzenia skóry i tkanki podskórnej Wysypka, świąd - Bardzo rzadko Dzieci: Należy spodziewać się, że częstość, rodzaj oraz nasilenie występowania działań niepożądanych u dzieci będzie taka sama jak u dorosłych.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlInterakcje
Zgłaszanie podejrzewanych działań niepożądanych: Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel. +48 22 49 21 301, fax. +48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. 4.9 Przedawkowanie Benzoksoniowy chlorek Podobnie jak w przypadku innych czwartorzędowych soli amoniowych, połknięcie dużej ilości chlorku benzoksoniowego może spowodować wymioty i nudności.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlInterakcje
Leczenie przedawkowania jest objawowe, w razie konieczności należy podać środki łagodzące. Należy unikać prowokowania wymiotów i płukania żołądka. Zaleca się natychmiastowe podanie mleka lub białek jaj zmieszanych z wodą. Nie należy pić alkoholu, ponieważ zwiększa on wchłanianie chlorku benzoksoniowego. Lidokainy chlorowodorek Do zatrucia lidokainą dochodzi głównie podczas niewłaściwego podawania dożylnego. Wywiera ono groźne działanie na ośrodkowy układ nerwowy (OUN) oraz układ sercowo-naczyniowy, takie jak: niedociśnienie, asystolia, bradykardia, bezdech, drgawki, śpiączka, zatrzymanie akcji serca, zatrzymanie czynności oddechowej i śmierć. Przedawkowanie wywołane doustnym podaniem roztworów do stosowania zewnętrznego jest mniej prawdopodobne ze względu na dużą ilość roztworu, którą należałoby przyjąć oraz silny efekt pierwszego przejścia lidokainy. Pomimo, że biodostępność lidokainy podawanej doustnie jest mała, połknięcie jej może spowodować wystąpienie znacznej toksyczności.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlInterakcje
Po połknięciu lepkich roztworów zawierających lidokainę, jak również 4% roztworu lidokainy do płukania gardła odnotowano jej wpływ na OUN w postaci drgawek i śmierci u dzieci i dorosłych. Leczenie zatrucia lidokainą jest objawowe i obejmuje kontrolę czynności układu krążenia i oddechowego oraz drgawek. Wszyscy pacjenci, którzy przypadkowo lub celowo zażyli duże ilości produktu Orofar Total Action powinni niezwłocznie udać się do lekarza lub na oddział toksykologii w celu oceny zagrożenia. Postępowanie przy przedawkowaniu Leczenie powinno być objawowe i wspomagające. Dalsze postępowanie powinno być zgodne ze wskazówkami klinicznymi lub zgodne z zaleceniami ośrodka leczenia zatruć.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Dane dotyczące stosowania produktu u kobiet w ciąży są niewystarczające. Badania na zwierzętach nie wykazały wyników, które mają znaczenie dla zalecanego dawkowania i stosowania produktu (patrz punkt 5.3 Przedkliniczne dane o bezpieczeństwie). Należy unikać stosowania tego produktu w czasie ciąży, dlatego też produkt może być stosowany w okresie ciąży jedynie w przypadku, gdy korzyść dla matki przewyższa ryzyko dla płodu. Jeżeli produkt jest stosowany, należy rozważyć najniższą skuteczną dawkę i najkrótszy czas trwania leczenia. Benzoksoniowy chlorek Brak odpowiednich danych. Chlorowodorek lidokainy Lidokaina przekracza barierę łożyskową. Nie ma jednak dowodów na niekorzystny wpływ lidokainy na płód. Karmienie piersi? Dane dotyczące stosowania produktu u matek karmiących piersią są niewystarczające.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlWpływ na płodność, ciążę i laktację
Produktu tego nie należy stosować w okresie laktacji, chyba że spodziewane korzyści dla matki przeważają nad ryzykiem dla niemowlęcia. W przypadku zastosowania należy rozważyć najniższą skuteczną dawkę i najkrótszy czas trwania leczenia. Benzoksoniowy chlorek Nie wiadomo, czy benzoksoniowy chlorek przenika do mleka kobiecego, jednak ze względu na małą absorbcję i bardzo małą biodostępność substancji, ilość dostępna dla dziecka byłaby nieistotna. Lidokainy chlorowodorek Niewielkie ilości lidokainy przenikają do mleka kobiecego jednak po zastosowaniu dawek terapeutycznych potencjalne zagrożenie dla dziecka jest mało prawdopodobne. W czasie karmienia piersią Orofar Total Action należy stosować ostrożnie i wówczas, gdy jest to bezwzględnie konieczne. Płodność Nie ma dostępnych danych dotyczących wpływu produktu na płodność.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlWpływ na płodność, ciążę i laktację
Badania toksycznego wpływu na reprodukcję przeprowadzone na zwierzętach nie wykazały wpływu benzoksoniowego chlorku i lidokainy chlorowodorku stosowanych osobno lub w połączeniu na płodność.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Orofar Total Action nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane zestawione poniżej zostały uporządkowane zgodnie z częstością występowania. Częstość występowania została przedstawiona według następującej konwencji: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100); rzadko (≥1/10 000 do <1/1 000); bardzo rzadko (<1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych). Działania niepożądane wymieniono zgodnie z klasyfikacją układów i narządów MedDRA. W obrębie każdej grupy układów i narządów działania niepożądane uszeregowano według częstości występowania. Klasyfikacja układów i narządów MedDRA Zaburzenia układu immunologicznego Nadwrażliwość (obejmująca obrzęk twarzy, ust, języka i gardła) - Bardzo rzadko Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Duszność - Bardzo rzadko Zaburzenia żołądka i jelit Dyskomfort w jamie ustnej - Często Zaburzenia skóry i tkanki podskórnej Wysypka, świąd - Bardzo rzadko Dzieci: Należy spodziewać się, że częstość, rodzaj oraz nasilenie występowania działań niepożądanych u dzieci będzie taka sama jak u dorosłych.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych: Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel. +48 22 49 21 301, fax. +48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlPrzedawkowanie
4.9 Przedawkowanie Benzoksoniowy chlorek Podobnie jak w przypadku innych czwartorzędowych soli amoniowych, połknięcie dużej ilości chlorku benzoksoniowego może spowodować wymioty i nudności. Leczenie przedawkowania jest objawowe, w razie konieczności należy podać środki łagodzące. Należy unikać prowokowania wymiotów i płukania żołądka. Zaleca się natychmiastowe podanie mleka lub białek jaj zmieszanych z wodą. Nie należy pić alkoholu, ponieważ zwiększa on wchłanianie chlorku benzoksoniowego. Lidokainy chlorowodorek Do zatrucia lidokainą dochodzi głównie podczas niewłaściwego podawania dożylnego. Wywiera ono groźne działanie na ośrodkowy układ nerwowy (OUN) oraz układ sercowo-naczyniowy, takie jak: niedociśnienie, asystolia, bradykardia, bezdech, drgawki, śpiączka, zatrzymanie akcji serca, zatrzymanie czynności oddechowej i śmierć.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlPrzedawkowanie
Przedawkowanie wywołane doustnym podaniem roztworów do stosowania zewnętrznego jest mniej prawdopodobne ze względu na dużą ilość roztworu, którą należałoby przyjąć oraz silny efekt pierwszego przejścia lidokainy. Pomimo, że biodostępność lidokainy podawanej doustnie jest mała, połknięcie jej może spowodować wystąpienie znacznej toksyczności. Po połknięciu lepkich roztworów zawierających lidokainę, jak również 4% roztworu lidokainy do płukania gardła odnotowano jej wpływ na OUN w postaci drgawek i śmierci u dzieci i dorosłych. Leczenie zatrucia lidokainą jest objawowe i obejmuje kontrolę czynności układu krążenia i oddechowego oraz drgawek. Wszyscy pacjenci, którzy przypadkowo lub celowo zażyli duże ilości produktu Orofar Total Action powinni niezwłocznie udać się do lekarza lub na oddział toksykologii w celu oceny zagrożenia. Postępowanie przy przedawkowaniu Leczenie powinno być objawowe i wspomagające.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlPrzedawkowanie
Dalsze postępowanie powinno być zgodne ze wskazówkami klinicznymi lub zgodne z zaleceniami ośrodka leczenia zatruć.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki stosowane w chorobach gardła. Kod ATC: R02AA Benzoksoniowy chlorek Chlorek benzoksoniowy jest czwartorzędową solą amoniową o właściwościach bakteriostatycznych i bakteriobójczych w stosunku do bakterii Gram dodatnich i Gram ujemnych. Działa skutecznie zwłaszcza wobec bakterii odpowiedzialnych za infekcje jamy ustnej i gardła oraz uczestniczących w tworzeniu płytki nazębnej. Chlorek benzoksoniowy wywiera także działanie grzybobójcze i słabe przeciwwirusowe wobec wirusów posiadających otoczkę lipidową, takich jak wirusy grypy, paragrypy oraz herpeswirusy. Jest on kationowo czynnym środkiem antyseptycznym, posiadającym właściwości powierzchniowo czynne, co zapewnia preparatowi dobrą penetrację. Lidokaina Lidokaina jest środkiem miejscowo znieczulającym. Łagodzi ból gardła oraz spowodowany infekcją ból towarzyszący przełykaniu. Orofar Total Action stosuje się w stanach zapalnych gardła oraz jamy ustnej.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlWłaściwości farmakodynamiczne
Lidokainy chlorowodorek łagodzi ból gardła towarzyszący zapaleniu gardła i infekcjom w jamie ustnej.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Benzoksoniowy chlorek Chlorek benzoksoniowy praktycznie nie wchłania się. U człowieka, jego wydalanie z moczem jest niewielkie (około 1% podanej dawki na 24 godziny). Stężenie we krwi pozostaje na granicy oznaczalności. U zwierząt w około 95% podanej doustnie dawki jest wydalane z kałem. Nie obserwowano gromadzenia się składników produktu w tkankach. Lidokainy chlorowodorek Chlorowodorek lidokainy wchłania się szybko z przewodu pokarmowego, przez błonę śluzową oraz zranioną skórę. Po przyjęciu doustnym jest wchłaniany i ulega efektowi pierwszego przejścia w wątrobie. Biodostępność po podaniu doustnym wynosi ok 35%. Metabolity usuwane są z moczem. Mniej niż 10% zostaje usunięte w postaci niezmienionej.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań toksyczności po podaniu jednorazowym oraz wielokrotnym, genotoksyczności, toksycznego wpływu na rozród z zastosowaniem benzoksoniowego chlorku i lidokainy chlorowodorku osobno lub w połączeniu nie ujawniają szczególnego zagrożenia dla ludzi.
- CHPL leku Orofar Total Action, aerozol do stosowania w jamie ustnej, (2 mg + 1,5 mg)/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Etanol 96% v/v Glicerol Olejek miętowy Mentol Kwas solny 0,1 N Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. 6.5 Rodzaj i zawartość opakowania Butelka PE o pojemności 30 ml zabezpieczona zatyczką ochronną, z końcówką dozownika, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania Brak szczególnych wymagań.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Lidocain-EGIS, 10%, aerozol na skórę, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: 38 g roztworu alkoholowego (1 opakowanie produktu) zawiera 3,8 g lidokainy. Jedno rozpylenie zawiera 4,6 mg lidokainy. Substancje pomocnicze o znanym działaniu: Etanol 96%, glikol propylenowy i olejek mięty pieprzowej (zawiera d-limonen jako składnik). Każda jednostka dawkowania (rozpylenie) zawiera 34,61 mg etanolu oraz 9,08 mg glikolu propylenowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Aerozol na skórę, roztwór Bezbarwny lub lekko żółty roztwór alkoholowy o charakterystycznym zapachu mięty.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Wskazania do stosowania
4.1 Wskazania do stosowania Produkt Lidocain-EGIS może być stosowany we wszystkich przypadkach, w których wymagane jest znieczulenie skóry lub błon śluzowych. Stomatologia i chirurgia szczękowa: Znieczulenie miejsca wstrzyknięcia przed znieczuleniem miejscowym, otwieranie ropni powierzchownych, usuwanie ruszających się zębów mlecznych, fragmentów kości oraz szycie ran błony śluzowej. Znieczulenie dziąseł przed umocowaniem koron oraz mostów dentystycznych. Produkt leczniczy można także stosować w przypadku usuwania kamienia nazębnego, ręcznego oraz za pomocą narzędzi, a także wycinania powiększonych brodawek międzyzębowych. Produkt Lidocain-EGIS zmniejsza lub hamuje nadmierny odruch gardłowy przy przygotowywaniu wycisków stomatologicznych oraz umieszczaniu błony do zdjęć RTG. Należy go stosować wyłącznie z elastycznymi materiałami do wycisków. U dzieci Lidocain-EGIS można stosować przy wycinaniu wędzidełka oraz otwieraniu torbieli ślinianek.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Wskazania do stosowania
Usuwanie powierzchownych łagodnych nowotworów błon śluzowych. Choroby uszu, nosa i gardła: W leczeniu krwawień z nosa przed zabiegami elektrokauteryzacji (przyżegania prądem elektrycznym), wycięcia przegrody oraz usunięcia polipów nosa, również przed zabiegiem wycięcia migdałków w celu zahamowania odruchu gardłowego oraz znieczulenia miejsca wstrzyknięcia leku znieczulającego. Znieczulenie uzupełniające przed otwarciem ropnia okołomigdałkowego oraz przed nakłuciem (punkcją) zatoki szczękowej. Znieczulenie przed płukaniem zatok. Zabiegi endoskopowe oraz badania z użyciem narzędzi: Znieczulenie gardła przed wprowadzeniem rurek i zgłębników przez nos lub usta (zgłębnik żołądkowo-dwunastniczy, zgłębnik Sengstakena). Wymiana rurki do tracheostomii. Ginekologia i położnictwo: Znieczulenie krocza oraz wykonywanie i pielęgnacja nacięcia krocza przy porodzie. Usuwanie szwów. Znieczulenie pola operacyjnego w zabiegach chirurgicznych pochwy i szyjki macicy.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Wskazania do stosowania
Produkt Lidocain-EGIS można także stosować w przypadku nacięcia i leczenia rozdarcia błony dziewiczej oraz ropnia w miejscu szwu. Dermatologia: Znieczulenie skóry i błon śluzowych przed małymi zabiegami chirurgicznymi.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie: Dawkowanie może różnić się w znacznym zakresie w zależności od wskazania oraz wielkości znieczulanego obszaru. Jedno rozpylenie aerozolu uwalnianego przez uruchomienie zaworu dozującego zawiera 4,6 mg lidokainy. W celu uniknięcia wysokich stężeń w osoczu krwi, istotne znaczenie ma stosowanie najmniejszej dawki dającej zadowalające działanie lecznicze. Zazwyczaj wystarcza od 1 do 3 rozpyleń, chociaż w położnictwie stosuje się od 15 do 20 i więcej rozpyleń (maksymalnie 40 rozpyleń/70 kg masy ciała). Wskazówki dotyczące dawkowania przy różnych wskazaniach: Stomatologia: 1 do 3 Chirurgia szczękowa: 1 do 4 Choroby uszu, nosa i gardła: 1 do 4 Endoskopia: 2 do 3 Położnictwo: 15 do 20 Ginekologia: 4 do 5 Dermatologia: 1 do 3 Dzieci i młodzież: Na podstawie danych przedstawionych w piśmiennictwie, produkt Lidocain-EGIS można także stosować w stomatologii i chirurgii szczękowej u dzieci, najlepiej w postaci pędzlowania.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Dawkowanie
Eliminuje to strach wywoływany rozpylaniem aerozolu oraz uczucie kłucia odbierane zazwyczaj jako zdarzenie niepożądane. Produkt leczniczy można także stosować w tej postaci u dzieci w wieku poniżej 2 lat. Sposób podawania: Podanie na skórę i błony śluzowe. Produkt leczniczy można także stosować w postaci pędzlowania nasączonym wacikiem. Po zdjęciu nasadki i przymocowaniu końcówki do dozowania, przed pierwszym użyciem pompka dozująca powinna zostać napełniona (kilkakrotnie pompując, aż pojawi się aerozol). Jeżeli pompka dozująca nie była używana przez dłuższy czas, konieczne może być powtórzenie czynności, w celu ponownego napełnienia.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Z powodu ryzyka aspiracji, produkt leczniczy Lidocain-EGIS jest przeciwwskazany do stosowania, gdy jako materiału do wycisku używa się gipsu.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Istotne jest zapobieganie przedostaniu się lidokainy do dróg oddechowych (ryzyko aspiracji). Stosowanie w okolicy gardła wymaga szczególnej ostrożności. Należy zachować ostrożność przy stosowaniu lidokainy na uszkodzone błony śluzowe i (lub) obszary zakażone. Wymagane jest zachowanie ostrożności przy stosowaniu produktu leczniczego u pacjentów z padaczką, a także w przypadkach rzadkoskurczu, zaburzeń przewodnictwa sercowego, niskiego ciśnienia tętniczego, upośledzenia czynności wątroby lub nerek, porfirii oraz ciężkiego wstrząsu, zwłaszcza gdy na podstawie zastosowanej dawki oraz wielkości znieczulanego obszaru można spodziewać się wchłonięcia znacznej ilości lidokainy. Gdy tylko to możliwe, przy stosowaniu produktu Lidocain-EGIS należy trzymać butelkę pionowo. Aerozol nie powinien dostać się do oczu.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Specjalne środki ostrozności
Dzieci i młodzież: Przed zastosowaniem produktu Lidocain-EGIS w zabiegach chirurgicznych gardła lub jamy nosowo-gardłowej należy brać pod uwagę, że przez hamowanie odruchu gardłowego oraz przedostanie się do krtani i tchawicy lidokaina hamuje także odruch kaszlowy, co może spowodować odoskrzelowe zapalenie płuc. Ma to szczególne znaczenie u dzieci, z powodu częściej występującego odruchu połykania produktu. Z tego powodu, nie zaleca się aerozolu Lidocain-EGIS do stosowania w znieczuleniu miejscowym przed zabiegami wycinania migdałków oraz adenoidów u dzieci w wieku poniżej 8 lat. Stosowanie w okolicy policzków zagraża wystąpieniem utrudnienia połykania i w konsekwencji aspirację produktu, zwłaszcza u dzieci. Z powodu drętwienia języka i błony śluzowej policzków istnieje ryzyko ich urazu przez ugryzienie. Lidokaina dobrze się wchłania przez błony śluzowe (zwłaszcza tchawicy), a także przez uszkodzoną skórę.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Specjalne środki ostrozności
Należy wziąć to pod uwagę, zwłaszcza przy stosowaniu na duże powierzchnie ciała u dzieci. Należy stosować mniejsze dawki produktu w leczeniu pacjentów wyniszczonych, w podeszłym wieku, ciężko chorych oraz dzieci, odpowiednio do ich wieku i ogólnego stanu zdrowia. U dzieci w wieku poniżej 2 lat najlepiej stosować produkt Lidocain-EGIS w postaci pędzlowania wacikiem nasączonym roztworem. Produkt leczniczy Lidocain-EGIS zawiera etanol (alkohol), glikol propylenowy i olejek mięty pieprzowej (zawierający d-limonen jako składnik). Etanol (alkohol): Produkt leczniczy zawiera 34,61 mg etanolu (alkoholu) w każdej jednostce dawkowania (rozpyleniu). W przypadku stosowania na skórę: Może powodować pieczenie uszkodzonej skóry. W przypadku stosowania na błony śluzowe: Ilość etanolu w dawce tego produktu leczniczego jest równoważna z mniej niż 1 ml piwa lub 1 ml wina. Mała ilość alkoholu w tym produkcie leczniczym nie będzie powodowała zauważalnych skutków.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Specjalne środki ostrozności
Glikol propylenowy: Produkt leczniczy zawiera 9,08 mg glikolu propylenowego w każdej jednostce dawkowania (rozpyleniu). W przypadku stosowania na skórę: Glikol propylenowy może powodować podrażnienie skóry. W przypadku stosowania na błony śluzowe: Glikol propylenowy jest metabolizowany głównie przez dehydrogenazę alkoholową. Jednoczesne podawanie z innymi substratami dehydrogenazy alkoholowej, takimi jak etanol może powodować ciężkie działania niepożądane u noworodków. Substancja zapachowa (olejek mięty pieprzowej): Produkt leczniczy zawiera substancję zapachową z d-limonenem. D-limonen może powodować reakcje alergiczne.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Lidokainę należy stosować z zachowaniem ostrożności u pacjentów otrzymujących leki przeciwarytmiczne z grupy 1B (np. tokainid), z powodu ryzyka sumowania się działania toksycznego.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Dane z badań u ludzi. Nie ma dostępnych danych pochodzących z kontrolowanych badań klinicznych. Pomimo to, lidokaina była stosowana przez długi czas bez żadnego niekorzystnego wpływu na proces rozrodu u ludzi. Przy braku bardziej bezpiecznego sposobu leczenia lidokaina może być także stosowana w ciąży. Karmienie piersi? Lidokaina przenika do mleka kobiecego, jednak przy stosowaniu zwykłych dawek leczniczych, jej ilość w mleku jest tak mała, że nie stanowi zagrożenia dla dziecka karmionego piersią.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Zależnie od wielkości dawki leki miejscowo znieczulające mogą wywierać nieznaczny wpływ na funkcje psychiczne, jak również mogą przejściowo zaburzać funkcje motoryczne i koordynację ruchową.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Działania niepożądane
4.8 Działania niepożądane Brak jest dokładnych danych klinicznych odnośnie częstości występowania działań niepożądanych. Działania niepożądane sklasyfikowano zgodnie z częstością występowania, w oparciu o następujące zasady: bardzo często (> 1/10) często (> 1/100 do < 1/10) niezbyt często (> 1/1 000 do < 1/100) rzadko (> 1/10 000 do < 1/1 000) bardzo rzadko (< 1/10 000) częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) Podczas stosowania produktu Lidocain-EGIS aerozol zgodnie z zaleceniami, częstość występowania działania ogólnoustrojowego jest bardzo mała, ponieważ ilość substancji czynnej przenikającej do krążenia jest bardzo mała. W razie stosowania dużych dawek, szybkiego wchłaniania, nadwrażliwości, idiosynkrazji lub zmniejszonej tolerancji na produkt leczniczy, u pacjenta mogą wystąpić następujące działania niepożądane: Zaburzenia układu immunologicznego W skrajnie ciężkich przypadkach wstrząs.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Działania niepożądane
W razie wystąpienia reakcji nadwrażliwości należy przerwać stosowanie produktu. Zaburzenia psychiczne Bardzo rzadko objawy ze strony OUN, pobudzenie, nerwowość. Zaburzenia układu nerwowego Bardzo rzadko: objawy zahamowania ośrodkowego układu nerwowego, zawroty głowy, senność, drgawki, utrata przytomności. Zaburzenia serca Osłabienie mięśnia sercowego, rzadkoskurcz, zatrzymanie czynności serca. Zaburzenia naczyniowe Niedociśnienie tętnicze. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Skurcz oskrzeli, porażenie czynności oddechowej. Zaburzenia skóry i tkanki podskórnej Pokrzywka, obrzęk naczynioruchowy. Urazy, zatrucie i powikłania zabiegowe Łagodne uczucie kłucia w momencie rozpylania preparatu. Uczucie to ustępuje, gdy lidokaina zaczyna działać (w ciągu 1 minuty). W miejscu zastosowania aerozolu może wystąpić przemijający rumień, obrzęk i zaburzenia czucia.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Działania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Przedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą wystąpić objawy ze strony ośrodkowego układu nerwowego oraz sercowo-naczyniowego opisane szczegółowo w punkcie 4.8 (Działania niepożądane). Należy utrzymywać drożność dróg oddechowych, w razie potrzeby podawać tlen i stosować sztuczne oddychanie. W razie wystąpienia (rzadko) drgawek należy jak najszybciej podać od 50 do 100 mg sukcynylocholiny i (lub) od 5 do 15 mg diazepamu. Ponieważ sukcynylocholina może spowodować zatrzymanie oddechu, powinna być podawana wyłącznie przez specjalistów z doświadczeniem w wykonywaniu intubacji dotchawiczej oraz postępowaniu z pacjentem z porażeniem czynności oddechowej. Przydatne może być także podanie krótko działającego barbituranu – tiopentalu. W leczeniu objawów sercowo-naczyniowych (rzadkoskurcz, zaburzenia przewodnictwa) wskazane jest podanie atropiny (od 0,5 do 1 mg dożylnie) oraz leków pobudzających układ współczulny (sympatykomimetyków).
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Przedawkowanie
Migotanie komór i zatrzymanie czynności serca wymaga resuscytacji.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: lek do znieczulenia miejscowego, kod ATC: N01BB02 Mechanizm działania Mechanizm działania leków miejscowo znieczulających polega na hamowaniu niezbędnego do powstania bodźca przepływu jonów przez błonę komórki nerwowej. Lidokaina hamuje pobudzony przez bodziec przejściowy wzrost przepuszczalności błony komórkowej dla jonów sodowych, a w mniejszym zakresie zmniejsza także przepuszczalność spoczynkową błony dla jonów potasowych i sodowych, przez co stabilizuje błonę komórkową neuronów. Lidokaina zmniejsza szybkość depolaryzacji występującej pod wpływem bodźców fizjologicznych oraz amplitudę potencjału czynnościowego, a to hamuje przewodnictwo nerwowe. Działanie farmakodynamiczne Substancja czynna, lidokaina, jest amidowym lekiem miejscowo znieczulającym, który stabilizuje błonę komórkową.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Właściwości farmakodynamiczne
Leki miejscowo znieczulające hamują przewodzenie impulsów nerwowych w zakończeniach nerwów czuciowych skóry i błon śluzowych, tzn. hamują przewodnictwo nerwowe (w neuronach, aksonach i synapsach). Wśród efektów działania na poszczególne elementy zmysłu czucia, leki miejscowo znieczulające najpierw hamują odczuwanie bólu, a następnie ciepła i dotyku. W razie wchłonięcia po stosowaniu miejscowym, lidokaina może wywołać zarówno pobudzenie, jak i zahamowanie ośrodkowego układu nerwowego. Wpływ na układ sercowo-naczyniowy przejawia się zaburzeniami przewodnictwa sercowego i rozszerzeniem naczyń obwodowych.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Lidokaina łatwo wchłania się z błony śluzowej oraz uszkodzonej skóry, natomiast źle się wchłania ze skóry niezmienionej. Szybkość wchłaniania oraz ilość substancji czynnej dostającej się do krążenia zależy od dawki, powierzchni oraz stanu miejsca zastosowania (skóra lub błona śluzowa) oraz czasu ekspozycji na działanie produktu. Dystrybucja Działanie produktu Lidocain-EGIS rozpoczyna się w ciągu 1 minuty i trwa od 5 do 6 minut. Metabolizm Lidokaina jest metabolizowana w wątrobie. Najpierw ulega dealkilacji, a następnie hydrolizie. Eliminacja Zarówno niezmieniony lek, jak i jego metabolity są wydalane głównie przez nerki. Okres półtrwania w fazie eliminacji wynosi 1,6 godziny. Zależność farmakokinetyka/farmakodynamika Po stosowaniu miejscowym lidokaina przenika do tkanek i wywiera miejscowe działanie znieczulające. Subiektywny objaw drętwienia ustępuje powoli w ciągu około 15 minut.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane z badań przedklinicznych W badaniach przedklinicznych nie wykazano działania toksycznego lidokainy na płód. W badaniach toksykologicznych nie stwierdzono objawów działania mutagennego, rakotwórczego i teratogennego.
- CHPL leku Lidocain-Egis, aerozol, roztwór, 10% (100 mg/ml)Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Etanol 96 % Glikol propylenowy Olejek mięty pieprzowej (zawiera d-limonen jako składnik) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 5 lat 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25 °C. 6.5 Rodzaj i zawartość opakowania Butelka z oranżowego szkła typu III wyposażona w pompkę dozującą i dyszę rozpylającą, zabezpieczona nasadką z LDPE, w tekturowym pudełku. Opakowanie zawiera 38 g roztworu. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania. Brak szczególnych wymagań dotyczących usuwania. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Orofar Junior, 1 mg + 1 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1 mg benzoksoniowego chlorku (Benzoxonii chloridum) i 1 mg lidokainy chlorowodorku (Lidocaini hydrochloridum). Substancje pomocnicze o znanym działaniu: Każda tabletka do ssania zawiera 1 g sorbitolu oraz 40 mg aromatu pomarańczowego 55607 TP.05.51 (zawiera m.in. cytral, cytronellol, geraniol, limonen i linalol). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki do ssania. Białe do lekko żółtych, okrągłe, obustronnie wypukłe tabletki z wytłoczeniem „Zyma” po jednej stronie i oznaczeniem OR po drugiej.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgWskazania do stosowania
4.1 Wskazania do stosowania infekcje gardła; infekcje jamy ustnej (stany zapalne dziąseł, zakażenia i owrzodzenia błony śluzowej jamy ustnej - afty); ból gardła towarzyszący przeziębieniom, zapaleniu gardła, zapaleniu krtani; pomocniczo może być stosowany w leczeniu zapalenia migdałków (angina). Orofar Junior jest wskazany do stosowania u dorosłych, młodzieży i dzieci powyżej 6 lat.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dorośli oraz młodzież w wieku powyżej 12 lat: Ssać powoli jedną tabletkę co dwie – trzy godziny. W przypadku nasilonej infekcji dawkę można zwiększyć do jednej tabletki, co jedną lub dwie godziny. Nie należy przyjmować więcej niż dziesięć tabletek na dobę. W przypadku leczenia aft należy pozwolić tabletce rozpuszczać się powoli, w pobliżu miejsca zmienionego chorobowo. Dzieci w wieku powyżej 6 lat: Ssać powoli jedną tabletkę co dwie – trzy godziny. Dzieci w wieku powyżej 6 lat nie powinny przyjmować więcej niż sześć tabletek na dobę. Nie należy stosować produktu leczniczego Orofar Junior u dzieci w wieku poniżej 6 lat, gdyż leki miejscowo znieczulające mogą powodować przemijające zaburzenia połykania i zwiększać ryzyko zachłyśnięcia. Tabletek nie należy żuć ani połykać. Nie należy przekraczać podanej dawki lub dopuszczalnej częstości dawkowania. Nie należy stosować produktu Orofar Junior podczas ani tuż przed jedzeniem i piciem.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgDawkowanie
Nie stosować z innymi środkami antyseptycznymi. Należy stosować możliwie najniższą skuteczną dawkę produktu leczniczego, przez możliwie najkrótszy czas. Nie stosować dłużej niż 7 dni bez konsultacji z lekarzem. Dzieci w wieku poniżej 6 lat: Produktu nie należy stosować u dzieci w wieku poniżej 6 lat. Osoby w podeszłym wieku: Brak danych dotyczących stosowania produktu u osób w podeszłym wieku.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na chlorek benzoksoniowy i inne czwartorzędowe sole amoniowe. Nadwrażliwość na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nadwrażliwość na lidokainy chlorowodorek lub inne substancje miejscowo znieczulające z grupy amidów.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku gdy bólowi gardła towarzyszy wysoka gorączka, poważne trudności w przełykaniu lub objawy nie ulegają poprawie lub utrzymują się przez dłużej niż 3 dni należy skonsultować się z lekarzem. Produktu Orofar Junior nie należy stosować dłużej niż 7 dni bez konsultacji z lekarzem. Stosowanie u pacjentów w wieku powyżej 60 lat: Nie stosować u osób z tendencją do zachłystywania, zwłaszcza u osób w wieku powyżej 60 lat. Produktu leczniczego Orofar Junior nie należy stosować bezpośrednio przed ani w trakcie jedzenia lub picia. Zawarta w produkcie lidokaina może powodować przemijające zdrętwienie w jamie ustnej i gardle i utrudniać przełykanie. Produkt leczniczy Orofar Junior należy stosować ostrożnie u pacjentów z ranami i uszkodzeniami błony śluzowej. Produktu leczniczego Orofar Junior nie należy stosować z anionowymi środkami, na przykład pastami do zębów.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgSpecjalne środki ostrozności
Środki anionowe mogą zmniejszać działanie chlorku benzoksoniowego. Dlatego też nie należy stosować tego produktu bezpośrednio przed lub po umyciu zębów. Lek przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Dzieci i młodzież: Produktu nie należy stosować u dzieci w wieku poniżej 6 lat.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji. Benzoksoniowy chlorek: Ze względu na bardzo małe wchłanianie ogólnoustrojowe, nie należy spodziewać się wystąpienia interakcji. Lidokainy chlorowodorek: Lidokaina teoretycznie może wchodzić w interakcje z innymi jednocześnie stosowanymi lekami, np. z innymi lekami przeciwarytmicznymi. Ze względu na małe dawki zawarte w produkcie, nie należy spodziewać się wystąpienia interakcji.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Dane dotyczące stosowania produktu u kobiet w ciąży są niewystarczające. Badania na zwierzętach nie wykazały wyników, które mają znaczenie dla zalecanego dawkowania i stosowania produktu (patrz punkt 5.3 Przedkliniczne dane o bezpieczeństwie). Należy unikać stosowania tego produktu w czasie ciąży, dlatego też produkt może być stosowany w okresie ciąży jedynie w przypadku, gdy korzyść dla matki przewyższa ryzyko dla płodu. Jeżeli produkt jest stosowany, należy rozważyć najniższą skuteczną dawkę i najkrótszy czas trwania leczenia. Benzoksoniowy chlorek Brak odpowiednich danych. Chlorowodorek lidokainy Lidokaina przekracza barierę łożyskową. Nie ma jednak dowodów na niekorzystny wpływ lidokainy na płód. Karmienie piersi? Dane dotyczące stosowania produktu u matek karmiących piersią są niewystarczające.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgWpływ na płodność, ciążę i laktację
Produktu tego nie należy stosować w okresie laktacji, chyba że spodziewane korzyści dla matki przeważają nad ryzykiem dla niemowlęcia. W przypadku zastosowania należy rozważyć najniższą skuteczną dawkę i najkrótszy czas trwania leczenia. Benzoksoniowy chlorek Nie wiadomo, czy benzoksoniowy chlorek przenika do mleka kobiecego, jednak ze względu na małą absorbcję i bardzo małą biodostępność substancji, ilość dostępna dla dziecka byłaby nieistotna. Lidokainy chlorowodorek Niewielkie ilości lidokainy przenikają do mleka kobiecego, jednak po zastosowaniu dawek terapeutycznych potencjalne zagrożenie dla dziecka jest mało prawdopodobne. W czasie karmienia piersią Orofar Junior należy stosować ostrożnie i wówczas, gdy jest to bezwzględnie konieczne. Płodność Nie ma dostępnych danych dotyczących wpływu produktu na płodność.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgWpływ na płodność, ciążę i laktację
Badania toksycznego wpływu na reprodukcję przeprowadzone na zwierzętach nie wykazały wpływu benzoksoniowego chlorku i lidokainy chlorowodorku stosowanych osobno lub w połączeniu na płodność.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Orofar Junior nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane zestawione poniżej zostały uporządkowane zgodnie z częstością występowania. Częstość występowania została przedstawiona według następującej konwencji: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100); rzadko (≥1/10 000 do <1/1 000); bardzo rzadko (<1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych). Działania niepożądane wymieniono zgodnie z klasyfikacją układów i narządów MedDRA. W obrębie każdej grupy układów i narządów działania niepożądane uszeregowano według częstości występowania. Klasyfikacja układów i narządów MedDRA Działanie niepożądane: Nadwrażliwość (obejmująca obrzęk twarzy, ust, języka i gardła) - Bardzo rzadko Działanie niepożądane: Duszność - Bardzo rzadko Działanie niepożądane: Dyskomfort w jamie ustnej - Często Działanie niepożądane: Wysypka, świąd - Bardzo rzadko Dzieci: Należy spodziewać się, że częstość, rodzaj oraz nasilenie występowania działań niepożądanych u dzieci będzie taka sama jak u dorosłych.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel. +48 22 49 21 301, fax. +48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgPrzedawkowanie
4.9 Przedawkowanie Benzoksoniowy chlorek Podobnie jak w przypadku innych czwartorzędowych soli amoniowych, połknięcie dużej ilości chlorku benzoksoniowego może spowodować wymioty i nudności. Leczenie przedawkowania jest objawowe, w razie konieczności należy podać środki łagodzące. Należy unikać prowokowania wymiotów i płukania żołądka. Zaleca się natychmiastowe podanie mleka lub białek jaj zmieszanych z wodą. Nie należy pić alkoholu, ponieważ zwiększa on wchłanianie chlorku benzoksoniowego. Lidokainy chlorowodorek Do zatrucia lidokainą dochodzi głównie podczas niewłaściwego podawania dożylnego. Wywiera ono silne działanie na ośrodkowy układ nerwowy (OUN) oraz układ sercowo-naczyniowy, takie jak: niedociśnienie, asystolia, bradykardia, bezdech, drgawki, śpiączka, zatrzymanie akcji serca, zatrzymanie czynności oddechowej i śmierć.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgPrzedawkowanie
Przedawkowanie wywołane doustnym podaniem roztworu do stosowania zewnętrznego jest mniej prawdopodobne ze względu na dużą ilość roztworu, którą należałoby przyjąć oraz silny efekt pierwszego przejścia lidokainy. Pomimo, że biodostępność lidokainy podawanej doustnie jest mała, połknięcie jej może spowodować wystąpienie znacznej toksyczności. Po połknięciu lepkich roztworów zawierających lidokainę, jak również 4% roztworu lidokainy do płukania gardła odnotowano jej wpływ na OUN w postaci drgawek i śmierci u dzieci i dorosłych. Leczenie zatrucia lidokainą jest objawowe i obejmuje kontrolę czynności układu krążenia i oddechowego oraz drgawek. Wszyscy pacjenci, którzy przypadkowo lub celowo zażyli duże ilości produktu Orofar Junior powinni niezwłocznie udać się do lekarza lub na oddział toksykologii w celu oceny zagrożenia. Postępowanie przy przedawkowaniu Leczenie powinno być objawowe i wspomagające.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgPrzedawkowanie
Dalsze postępowanie powinno być zgodne ze wskazówkami klinicznymi lub zgodne z zaleceniami ośrodka leczenia zatruć.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki stosowane w chorobach gardła. Kod ATC: R02AA Benzoksoniowy chlorek Chlorek benzoksoniowy jest czwartorzędową solą amoniową o właściwościach bakteriostatycznych i bakteriobójczych w stosunku do bakterii Gram-dodatnich i Gram-ujemnych. Działa skutecznie zwłaszcza wobec bakterii odpowiedzialnych za infekcje jamy ustnej i gardła oraz uczestniczących w tworzeniu płytki nazębnej. Chlorek benzoksoniowy wywiera także działanie grzybobójcze i słabe przeciwwirusowe wobec wirusów posiadających otoczkę lipidową, takich jak wirusy grypy, paragrypy oraz herpeswirusy. Jest on kationowo czynnym środkiem antyseptycznym, posiadającym właściwości powierzchniowo czynne, co zapewnia preparatowi dobrą penetrację. Lidokaina Lidokaina jest środkiem miejscowo znieczulającym. Łagodzi ból gardła oraz spowodowany infekcją, ból towarzyszący przełykaniu. Orofar Junior stosuje się w stanach zapalnych gardła oraz jamy ustnej.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Benzoksoniowy chlorek Chlorek benzoksoniowy praktycznie nie wchłania się. U człowieka, jego wydalanie z moczem jest niewielkie (około 1% podanej dawki na 24 godziny). Stężenie we krwi pozostaje na granicy oznaczalności. U zwierząt około 95% podanej doustnie dawki jest wydalane z kałem. Nie obserwowano gromadzenia się składników produktu w tkankach. Lidokainy chlorowodorek Chlorowodorek lidokainy szybko wchłania się z przewodu pokarmowego, przez błonę śluzową oraz zranioną skórę. Po przyjęciu doustnym jest wchłaniany i ulega efektowi pierwszego przejścia w wątrobie. Biodostępność po podaniu doustnym wynosi ok. 35%. Metabolity usuwane są z moczem. Mniej niż 10% zostaje usunięte w postaci niezmienionej.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań toksyczności po podaniu jednorazowym oraz wielokrotnym, genotoksyczności, toksycznego wpływu na rozród z zastosowaniem benzoksoniowego chlorku i lidokainy chlorowodorku osobno lub w połączeniu nie ujawniają szczególnego zagrożenia dla ludzi.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sorbitol Celuloza mikrokrystaliczna Makrogol 6000 Skrobia kukurydziana Sacharyna sodowa Kwas cytrynowy jednowodny Sodu chlorek Aromat pomarańczowy 55607 TP.05.51 (zawiera maltodekstrynę kukurydzianą, aromaty (naturalne kompleksy aromatyczne, syntetyczne substancje aromatyczne, naturalne substancje aromatyczne) zawierające między innymi cytral, cytronello l, geraniol, limonen i linalol) Magnezu stearynian. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Chronić przed wilgocią. 6.5 Rodzaj i zawartość opakowania Blistry z folii Aluminium/PVC/PE/PVDC, 3 blistry po 8 szt. (24 szt.) w tekturowym pudełku, Blistry z folii Aluminium/PVC/PE/PVDC, 2 blistry po 8 szt. (16 szt.) w tekturowym pudełku, Blistry z folii Aluminium/PVC/PE/PVDC, 1 blister po 8 szt.
- CHPL leku Orofar Junior, tabletki do ssania, 1 mg + 1 mgDane farmaceutyczne
(8 szt.) w tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Brak szczególnych wymagań.
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO LIGNOX, 50 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 50 mg lidokainy chlorowodorku (Lidocaini hydrochloridum). Substancja pomocnicza o znanym działaniu: czerwień koszenilowa (E 124). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel Jednolity, miękki, nieprzezroczysty żel barwy od jasnoróżowej do czerwonej, o zapachu poziomkowym.
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Powierzchniowe znieczulenie błon śluzowych i skóry: znieczulenia powierzchniowe błon śluzowych przed iniekcją w celu zmniejszenia bólu występującego w momencie nakłucia, szczególnie u pacjentów wrażliwych na ból; znieczulenie powierzchniowe w zabiegach stomatologicznych, np. w skalingu, nacięciach powierzchownych ropni; przy ekstrakcji mocno rozchwianych zębów mlecznych i zębów stałych (w chorobach przyzębia); w protetyce: zapobiegawczo w celu wyeliminowania odruchu wymiotnego pacjenta przy pobieraniu wycisków w jamie ustnej.
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Na osuszoną błonę śluzową nałożyć przy pomocy wacika 0,1 do 0,2 g żelu (tj. około 2 do 3 mm wyciśniętego żelu), co odpowiada 4 do 8 mg lidokainy. Nie należy przekraczać dawki 3 mg/kg mc. Lidokaina łatwo i szybko wchłania się z błon śluzowych – w przypadku stosowania u dzieci, u dorosłych chorych o małej masie ciała lub w przypadku użycia znacznych ilości wskazane jest przeliczenie dawki na masę ciała pacjenta. U dzieci i pacjentów w złym stanie ogólnym maksymalna dobowa dawka wynosi 2,9 mg/kg masy ciała i powinna być wyliczana dla każdego przypadku osobno. Maksymalna dobowa dawka dla dorosłych, której nie należy przekraczać, wynosi 200 mg lidokainy, co odpowiada 4,5 g żelu Lignox (tj. około 8,5 cm wyciśniętego żelu). Lidokaina podana w żelu zaczyna działać po 2 - 5 minutach; działanie utrzymuje się przez 10 do 15 minut.
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na chlorowodorek lidokainy oraz na inne środki miejscowo znieczulające o budowie amidowej lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Względne przeciwwskazania to: wstrząs, blok przewodnictwa przedsionkowo-komorowego II i III, miastenia, ciężkie uszkodzenia wątroby. Ostrożnie stosować u chorych leczonych trójpierścieniowymi lekami przeciwdepresyjnymi i inhibitorami MAO. Nie stosować u dzieci poniżej 4. roku życia.
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie wolno dopuścić do połknięcia żelu, nadmiar należy wypluć. Lek zawiera źródło fenyloalaniny. Może być szkodliwy dla pacjentów z fenyloketonurią. Lek może powodować reakcje alergiczne. UWAGA: Preparat zawiera substancję czynną, która może dawać dodatni wynik w badaniach antydopingowych.
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Lidokaina nasila działanie środków zwiotczających mięśnie poprzeczne prążkowane. Osłabia działanie sulfonamidów.
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Brak wystarczających dowodów dotyczących bezpieczeństwa stosowania żelu Lignox u kobiet w okresie ciąży. Produktu leczniczego nie należy stosować u kobiet w okresie ciąży. Nie określono bezpieczeństwa stosowania u kobiet karmiących piersią. W badaniach eksperymentalnych na szczurach stwierdzono, że stosowanie chlorowodorku lidokainy w dawkach 6,6 raza większych niż u ludzi nie ma wpływu na płodność i nie zaburza rozwoju płodu. Nie stwierdzono działania mutagennego lidokainy w teście Amesa, teście aberracji chromosomów i teście mikrojąderkowym.
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Lignox powoduje łagodne, przemijające zaburzenie sprawności psychofizycznej, wywiera niewielki wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gDziałania niepożądane
4.8 Działania niepożądane Bardzo często≥1/10 Często ≥1/100 do <1/10 Niezbyt często≥1/1 000 do <1/100 Rzadko ≥1/10 000 do <1/1 000 Bardzo rzadko<1/10 000 Zaburzenia układu immunologicznego: Sporadycznie produkt leczniczy może wywołać reakcję uczuleniową, rzadko wstrząs anafilaktyczny. Zaburzenia ogólne i stany w miejscu podania: Objawy niepożądane (zaburzenia smaku, drętwienie języka, bóle i zawroty głowy, uczucie niepokoju, przyspieszony oddech) mogą wystąpić w przypadku przedawkowania leku, tj. przy podaniu zbyt dużej dawki w stosunku do masy ciała. Objawy związane z działaniem ogólnym zależą od stężenia lidokainy w surowicy, co jest wypadkową podanej dawki, miejsca podania, miejscowego przepływu krwi, masy ciała, stanu ogólnego chorego. Prawdopodobieństwo wystąpienia objawów ze strony układu krążenia lub o.u.n. po prawidłowym stosowaniu żelu jest znikome. Niepożądanym działaniem występującym po zastosowaniu lidokainy może być senność o różnym nasileniu.
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gPrzedawkowanie
4.9 Przedawkowanie Lidokaina łatwo i szybko wchłania się z błon śluzowych; w przypadku stosowania u dzieci, u chorych o małej masie ciała lub w przypadku użycia znacznych ilości wskazane jest przeliczenie dawki na masę ciała pacjenta. U dzieci i pacjentów w złym stanie ogólnym maksymalna dobowa dawka wynosi 2,9 mg/kg masy ciała i powinna być wyliczona dla każdego przypadku osobno. Nie należy przekraczać dawki lidokainy 3 mg/kg mc. Maksymalna dobowa dawka dla dorosłych, której nie należy przekraczać, wynosi 200 mg lidokainy, co odpowiada 4,5 g żelu (około 8,5 cm wyciśniętego żelu). W razie wystąpienia objawów toksycznych ze strony układu nerwowego, oddechowego lub krążenia musi być podjęte natychmiastowe postępowanie resuscytacyjne: należy zapewnić prawidłową wentylację przy użyciu tlenu, podać leki przeciwdrgawkowe i podwyższające ciśnienie tętnicze.
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: preparaty stomatologiczne; preparaty do miejscowego stosowania w jamie ustnej; inne; kod ATC: A01AD11; leki miejscowo znieczulające; amidy; kod ATC: N01BB02. Lidokaina, substancja czynna produktu leczniczego, jest środkiem miejscowo znieczulającym o budowie amidowej, wykazującym krótki czas działania. Środki znieczulające o działaniu powierzchniowym dyfundują przez nabłonek śluzówki i docierają do receptorów bólu położonych w błonie podśluzowej. Powodują miejscowe, powierzchniowe wyłączenie odczuwania bólu na śluzówce (np. jamy ustnej), powierzchni ran i skórze. Zastosowane w małych ilościach na skórę lub błony śluzowe wykazują tylko miejscowe działanie znieczulające, bez działania ogólnego. Znieczulenie powierzchniowe polega na blokowaniu wrażliwych włókien nerwowych lub receptorów bólowych, występujących w powierzchniowych tkankach zdolnych do wchłaniania leku (takich jak błony śluzowe i skóra).
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gWłaściwości farmakodynamiczne
Następuje odwracalne zahamowanie przewodnictwa we włóknach nerwowych poprzez blokowanie pompy sodowo – potasowej i zahamowanie przepuszczalności błony komórkowej dla jonów. Przewodnictwo w cienkich włóknach nerwowych, bez osłonki mielinowej (np. włókna przewodzące czucie bólu i dotyku), może być zahamowane niskimi stężeniami środka miejscowo znieczulającego, blokada nerwów w osłonce mielinowej wymaga wyższych stężeń. Przy blokowaniu małych nerwów działanie występuje po 2 - 3 minutach, najsilniejsze jest po 2 - 5 minutach i utrzymuje się około 30 - 60 minut. Lidokaina wykazuje działanie ogólne: wpływa stabilizująco na błony komórkowe i bezpośrednio na układ bodźcoprzewodzący serca (działanie antyarytmiczne), osłabia automatyzm, skraca czas trwania potencjału czynnościowego, zmniejsza okres refrakcji komórek Purkinjego (nie zmniejszając szybkości przewodzenia impulsów w tych komórkach).
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Lidokaina wchłania się szybko z miejsca podania (zwłaszcza z błon śluzowych), w 60 - 75% wiąże się z białkami osocza, przenika przez barierę krew – mózg. Stopień wchłaniania po podaniu miejscowym zależy od unaczynienia danego obszaru. Wchłanianie przez nieuszkodzoną skórę jest niewielkie. W organizmie lidokaina ulega demetylacji i rozkładowi hydrolitycznemu pod wpływem enzymów mikrosomalnych wątroby z szybkością zależną od przepływu wątrobowego (około 70% w czasie tzw. pierwszego przejścia). Około 3% lidokainy wydalane jest przez nerki w formie niezmienionej. Okres półtrwania wynosi około 30 minut. Ponieważ lidokaina metabolizowana jest w wątrobie, może wykazywać większą toksyczność u osób z zaburzoną czynnością wątroby.
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają żadnego szczególnego zagrożenia dla człowieka. Lidokaina nie wykazuje dużej toksyczności ostrej po podaniu jednorazowym drogą doustną. W badaniach na zwierzętach wykazane zostało działanie ototoksyczne. Nie stwierdzono działania mutagennego i genotoksycznego. Nie stwierdzono także działania rakotwórczego ani wpływu na reprodukcję. Słabe działanie mutagenne wykazuje natomiast 2,6-dimetyloanilina (zanieczyszczenie), potwierdzono również działanie rakotwórcze tego związku.
- CHPL leku Lignox, Żel do stosowania w jamie ustnej, 50 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Makrogol 400 Makrogol 4000 Cetylopirydyniowy chlorek Aspartam (E 951) Czerwień koszenilowa (E 124) Aromat poziomkowy Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Nie zamrażać. Przechowywać tubę szczelnie zamkniętą. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuba laminatowa z zakrętką z polietylenu lub polipropylenu w tekturowym pudełku. 20 g żelu. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO DEVIPASTA, (450 mg + 370 mg)/g, pasta 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g pasty zawiera 450 mg paraformaldehydu (Paraformaldehydum) i 370 mg lidokainy (Lidocainum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Pasta Dość twarda biała masa o charakterystycznym zapachu paraformaldehydu
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gWskazania do stosowania
4.1. Wskazania do stosowania Produkt leczniczy jest bezarsenową pastą stosowaną w endodoncji do dewitalizacji miazgi zębowej w mortalnych metodach leczenia nieodwracalnych zapaleń miazgi.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gDawkowanie
4.2. Dawkowanie i sposób podawania Wykonać trepanację sklepienia komory. Jeśli dno ubytku oddziela gruba warstwa zębiny można wykonać znieczulenie, nawiercanie tkanek będzie wówczas bezbolesne. W przypadku, gdy warstwa ta jest cienka lub zmieniona próchnicowo to odsłonięcia można dokonać bez znieczulenia, ból jest wtedy krótkotrwały. W każdym przypadku wejście do komory powinno być na tyle duże, by wysięk mógł się z niej wydostać, zapewni to, że po założeniu nie wystąpią dolegliwości bólowe. Na odkrytą miazgę (w punkcie trepanacyjnym) nałożyć za pomocą zgłębnika około 2 do 4 mg pasty tj. kuleczkę o średnicy 1,5 do 2 mm, zależnie od wielkości zęba, lekko, bez ucisku. Wprawdzie nie należy obawiać się przedawkowania, to jednak pasta powinna być zakładana na obnażenie w ilości 2 do 4 mg. Bezpośrednio na pastę położyć kuleczkę waty uważając, by nie wtłoczyć środka dewitalizującego do jamy zęba, a następnie bez ucisku założyć szczelny opatrunek tymczasowy, np.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gDawkowanie
z cementu szkło-jonomerowego. Wypełnienie należy nałożyć szczelnie, by zapobiec wypływaniu środka dewitalizującego w kierunku przyzębia brzeżnego. Wkładka powinna pozostać w zębie 10 do 14 dni. Po 6–8 dniach produkt powoduje martwicę miazgi, po dalszych 2–6 dniach następuje mumifikacja miazgi. Produkt leczniczy można zakładać powtórnie, jeśli miazga nie uległa dewitalizacji, lecz nigdy w obręb kanału korzeniowego. Produkt leczniczy należy stosować wyłącznie w przypadku braku możliwości leczenia stanów zapalnych miazgi metodą amputacji i ekstyrpacji przyżyciowej.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na paraformaldehyd i lidokainę, jak również na inne środki znieczulenia miejscowego o budowie amidowej lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Możliwość biologicznego leczenia stanów zapalnych miazgi metodą amputacji i ekstyrpacji przyżyciowej wyklucza celowość stosowania produktu. Nie stosować u dzieci poniżej 4–go roku życia.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy zwracać szczególną uwagę na datę ważności leku. Nie stosować leku przeterminowanego. Nie stosować u dzieci w wieku poniżej 4 lat.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Brak.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Brak wystarczających dowodów dotyczących bezpieczeństwa stosowania bezarsenowych past dewitalizacyjnych, w tym produktu Devipasta u kobiet w ciąży, dlatego leku nie należy stosować u kobiet w ciąży. Nie zostało określone bezpieczeństwo stosowania u kobiet karmiących piersią.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Devipasta nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gDziałania niepożądane
4.8. Działania niepożądane Może wystąpić przemijający ból po zastosowaniu pasty. Rzadko: nadwrażliwość na paraformaldehyd. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: ndl@urpl.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gPrzedawkowanie
4.9. Przedawkowanie Nie zgłoszono żadnego przypadku przedawkowania.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: przewód pokarmowy i metabolizm; preparaty stomatologiczne; inne środki do miejscowego stosowania doustnego; kod ATC: A01AD11 Paraformaldehyd będący produktem polimeryzacji aldehydu mrówkowego ulega w komorze zęba powolnej depolimeryzacji, wskutek czego do miazgi przenikają stopniowo cząsteczki formaldehydu, powodując po 6–8 dniach jej całkowitą martwicę. Żywa tkanka pod wpływem formaldehydu ulega najpierw podrażnieniu, a później martwicy i mumifikacji; działanie rozwija się powoli i łagodnie w miarę stopniowej depolimeryzacji paraformaldehydu w komorze zęba, co zmniejsza prawdopodobieństwo podrażnienia ozębnej. Tak więc oprócz działania dewitalizującego, paraformaldehyd mumifikuje miazgę i wytwarza linię demarkacyjną na granicy ozębnej. Stosowanie go skraca więc leczenie o tę wizytę, która ma na celu założenie środka mumifikującego.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gWłaściwości farmakodynamiczne
Wadą paraformaldehydu jest występowanie ataków bólu w czasie jego stosowania; dzięki zawartości silnego środka znieczulającego tj. lidokainy, który współdziała także z paraformaldehydem w dewitalizacji miazgi, lek po założeniu nie wywołuje bólu. Lidokaina jest środkiem miejscowo znieczulającym (analgetyk miejscowy) z grupy pochodnych amidowych o krótkim czasie działania. Powoduje odwracalne zahamowanie przewodnictwa we włóknach nerwowych poprzez blokowanie pompy sodowo–potasowej i zahamowanie przepuszczalności błony komórkowej dla jonów. Pozostałe składniki leku są substancjami pomocniczymi i nadają paście odpowiednią, wymaganą konsystencję.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Po założeniu produktu leczniczego Devipasta do otwartej komory zębowej i przykryciu komory zęba cementem dentystycznym, z paraformaldehydu uwalnia się powoli formaldehyd i działa denaturująco na naczynia krwionośne oraz niszczy zakończenie nerwu zęba. Wytworzona linia demarkacyjna denaturowanej zębiny zapobiega wchłanianiu paraformaldehydu do organizmu i zapobiega wchłanianiu lidokainy, która działa tylko miejscowo. Lidokaina w postaci zasady nie jest rozpuszczalna w wodzie i po wytworzeniu linii demarkacyjnej przez paraformaldehyd również nie ulega wchłanianiu do organizmu. Po założeniu produktu leczniczego Devipasta do komory zębowej, występujący w tym produkcie paraformaldehyd działa denaturująco na miazgę zębową oraz dentocyty i nie ulega dystrybucji do innych tkanek organizmu. Również lidokaina zastosowana łącznie z paraformaldehydem nie ulega wchłanianiu z komory zębowej do tkanek.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają żadnego szczególnego zagrożenia dla człowieka.
- CHPL leku Devipasta, pasta, (450 mg + 370 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Glicerol Wata celulozowa oczyszczona 6.2. Niezgodności farmaceutyczne Nie dotyczy. 6.3. Okres ważności 18 miesięcy 6.4. Specjalne środki ostrożności podczas przechowywania Przechowywać w lodówce (2C – 8C). Nie zamrażać. Przechowywać pojemnik szczelnie zamknięty. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5. Rodzaj i zawartość opakowania Pojemnik z PP z zakrętką z PP z uszczelnieniem z polipropylenu, zawierający 5 g pasty. Pojemnik wraz z ulotką, umieszczony jest w tekturowym pudełku. 6.6. Szczególne środki ostrożności dotyczące usuwania Brak szczególnych wymagań.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Lidocaine Grindeks, 20 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg chlorowodorku lidokainy. Każda ampułka 5 ml zawiera 100 mg chlorowodorku lidokainy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań. Klarowny, bezbarwny lub jasnożółty płyn, bez widocznych cząstek. pH roztworu 5,0 – 7,0. Osmolalność roztworu 0,310-0,340 Osmol/kg.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Dożylne znieczulenie miejscowe, znieczulenie nasiękowe, blokady nerwów i znieczulenie nadtwardówkowe. Lidocaine Grindeks jest wskazany do leczenia dorosłych.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Lidocaine Grindeks może być podawany tylko przez lekarza z doświadczeniem w znieczulaniu miejscowym lub pod jego nadzorem. Należy podawać najmniejszą możliwie dawkę na zapewnienie pożądanego efektu. Przed wstrzyknięciem pełnej dawki zaleca się kontrolną aspirację w celu zapobieżenia przypadkowemu podaniu dożylnemu produktu. Wstrzykiwać powoli i utrzymywać kontakt z pacjentem podczas wstrzykiwania. W wypadku podania nadtwardówkowego zaleca się zastosowanie małej dawki próbnej 3-5 ml. Należy unikać wstrzyknięciu zimnego roztworu poniżej temperatury ciała, ponieważ może to być bolesne. Dożylne znieczulenie miejscowe Ramię: 5-10 ml roztworu (100-200 mg chlorowodorku lidokainy). Noga: 10 ml roztworu (200 mg chlorowodorku lidokainy). Blokady nerwów 1-2 ml roztworu (20-40 mg chlorowodorku lidokainy). Znieczulenie nadtwardówkowe Znieczulenie lędźwiowe: 12,5-20 ml roztworu (250-400 mg chlorowodorku lidokainy).
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Znieczulenie w odcinku piersiowym: 10-15 ml roztworu (200-300 mg chlorowodorku lidokainy). Znieczulenie krzyżowe w chirurgii: 20 ml roztworu (400 mg chlorowodorku lidokainy). Znieczulenie krzyżowe w położnictwie: 10-15 ml roztworu (200-300 mg chlorowodorku lidokainy). Maksymalna dawka jednorazowa chlorowodorku lidokainy dla dorosłego pacjenta nie powinna przekroczyć 400 mg. U pacjentów w złym stanie ogólnym należy zmniejszyć dawkę. Dzieci i młodzież Inne postacie farmaceutyczne i moce są bardziej odpowiednie do podawania tym grupom pacjentów. Sposób podawania Sposób podawania lidokainy różni się w zależności od wybranej procedury (dożylne znieczulenie miejscowe, znieczulenie nasiękowe, blokada nerwów lub znieczulenie nadtwardówkowe). Lidocaine Grindeks może być podawany dożylnie, domięśniowo, podskórnie lub nadtwardówkowo.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, amidowe środki znieczulające miejscowo lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Lidocaine Grindeks nie należy stosować do znieczulenia nadtwardówkowego u pacjentów ze znacznym niedociśnieniem lub we wstrząsie kardiogennym lub hipowolemicznym.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Lidokainę powinny podawać osoby umiejące reanimować i mające sprzęt do resuscytacji. Aparatura do resuscytacji powinna być dostępna podczas znieczulenia miejscowego. Przy jakiejkolwiek dużej blokadzie, należy przed wprowadzeniem leku miejscowo znieczulającego wprowadzić do żyły kaniulę. Jak każdy lek miejscowo znieczulający, lidokaina może powodować ostre reakcje toksyczności ze strony centralnego układu nerwowego oraz układu sercowo-naczyniowego, jeżeli jej stężenie we krwi będzie wysokie, szczególnie podczas podania donaczyniowego. Szczególną ostrożność należy zachować w przypadku znieczulania następujących grup pacjentów: pacjenci w podeszłym wieku i ogólnie osłabionych pacjenci, pacjenci z blokiem AV typu II i III, ponieważ miejscowe znieczulenie może powodować obniżenie przewodnictwa mięśnia sercowego, pacjenci z zastoinową niewydolnością serca, bradykardią, zaburzoną funkcją oddechową, pacjenci z ciężkim uszkodzeniem wątroby lub niewydolnością nerek, pacjenci z padaczką, pacjenci leczeni lekami przeciwarytmicznymi klasy III (np.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
amiodaronem), którzy wymagają stałego monitorowania w tym monitorowania EKG, ponieważ oddziaływanie lidokainy na mięsień sercowy może nasilać się przy stosowaniu leków przeciwarytmicznych klasy III (patrz punkt 4.5). Znieczulenie nadtwardówkowe może powodować ciężkie działania niepożądane takie jak niewydolność sercowo-naczyniowa, szczególnie przy współistniejącej hipowolemii. Szczególne środki ostrożności należy zachować zawsze u pacjentów z zaburzoną funkcją układu sercowo-naczyniowego. Głównymi przyczynami są pourazowe uszkodzenia nerwów i/lub lokalnie toksyczny wpływ na mięśnie i nerwy spowodowane znieczuleniem miejscowym. Zakres uszkodzeń tkanek zależy od ciężkości urazów, stężenia leku miejscowo znieczulającego oraz czasu jego oddziaływania na poszczególne tkanki. Dlatego należy stosować zawsze najniższą skuteczną dawkę znieczulenia. Rozległe wstrzyknięcia donaczyniowe w obrębie głowy i szyi mogą powodować wystąpienie objawów mózgowych nawet przy zastosowaniu niskich dawek.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Skuteczność znieczulenia miejscowego może się zmniejszyć po wstrzyknięciu w obszar zakażony lub zmieniony zapalnie. Znieczulenie nadtwardówkowe może prowadzić do spadku ciśnienia krwi i bradykardii. Ryzyko to zmniejsza podanie dożylne płynu w postaci krystaloidalnej lub koloidalnej. Spadek ciśnienia krwi wymaga natychmiastowego zastosowania np. efedryny 5-10 mg dożylnie, powtórzonego jeśli konieczne. Domięśniowo podana lidokaina może powodować zwiększenie stężenia fosfokinazy kreatyniny, co może wpływać równocześnie na diagnozę ostrego zawału mięśnia sercowego. Prawdopodobnie lidokaina ma działanie porfirogenne i nie powinna być stosowana u pacjentów z ostrą porfirią, chyba że jest to absolutnie konieczne. Szczególną ostrożność należy zachować podczas stosowania lidokainy u pacjentów z porfirią.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Leki spowalniające metabolizm lidokainy (np. cymetydyna) mogą powodować uzyskanie potencjalnie toksycznego stężenia lidokainy w surowicy, w przypadku szybkiego podania dużych dawek przez dłuższy okres czasu. Efekt ten nie ma klinicznego znaczenia, jeśli lidokaina podawana jest w krótkim czasie w zalecanych dawkach. Lidocaine Grindeks powinien być ostrożnie stosowany w połączeniu z innymi lekami znieczulającymi miejscowo oraz lekami przeciwarytmicznymi klasy IB, jako że sumuje się efekt toksyczny obu leków. Dotychczas nie zostały przeprowadzone badania specyficznych interakcji z miejscowymi lekami znieczulającymi i lekami przeciwarytmicznymi klasy III (np. amiodaronem), jednak zalecana jest ostrożność w tych przypadkach (patrz punkt 4.4).
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich danych dotyczących stosowania lidokainy u kobiet w ciąży. Lidokaina przenika przez łożysko. Można przyjąć, że lidokaina była stosowana u dużej liczby kobiet w ciąży i kobiet w wieku rozrodczym. Nie ma dowodów, że lidokaina zaburza procesy reprodukcji lub zwiększa ilość przypadków wystąpienia wad rozwojowych, czy w jakikolwiek pośredni lub bezpośredni sposób oddziałuje na płód. Jednakże nie przeprowadzono dostatecznych badań ryzyka u ludzi. Badania na zwierzętach są niekompletne w odniesieniu do wpływu lidokainy na ciążę, rozwój embrionu i płodu, poród oraz rozwój dziecka po urodzeniu (patrz punkt 5.3). W przypadku stosowania krótkoterminowego lidokainy podczas ciąży i porodu należy rozważyć czy oczekiwane korzyści przeważają nad potencjalnym ryzykiem. Zastosowanie lidokainy do blokady okołoszyjkowej lub blokady sromu podczas porodu zwiększa ryzyko wystąpienia u płodu reakcji takich jak bradykardia lub tachykardia.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlWpływ na płodność, ciążę i laktację
Dlatego należy monitorować z dużą ostrożnością tętno płodu (patrz punkt 5.2). Karmienie piersi? Lidokaina przenika w małym stopniu do mleka kobiecego. Wpływ na dziecko jest nieznaczny, podczas stosowania zalecanych dawek. Dlatego nie ma potrzeby przerwania karmienia piersią w trakcie stosowania Lidocaine Grindeks.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn W zależności od dawki i drogi podania, lidokaina może przejściowo wpływać na ruch i koordynację.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Działania niepożądane spowodowane wyłącznie przez lidokainę są trudne do odróżnienia od takich efektów fizjologicznych jak blokada nerwowa (np. obniżenie ciśnienia krwi, bradykardia) oraz stanów spowodowanych bezpośrednio przez ukłucie igłą (np. uszkodzenie nerwów) lub pośrednio (np. ropień nadtwardówkowy). Działania niepożądane wymieniono w Tabeli 1 z zastosowaniem konwencji częstości występowania MedDRA: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000), nie znana (częstość nie może być określona na podstawie dostępnych danych). Tabela 1 Tabelaryczne zestawienie działań niepożądanych Bardzo często Zaburzenia naczyniowe: Niedociśnienie Zaburzenia żołądka i jelit: Nudności Często Zaburzenia układu nerwowego: Parestezja, zawroty głowy Zaburzenia serca: Bradykardia Zaburzenia naczyniowe: Nadciśnienie Zaburzenia żołądka i jelit: Wymioty Niezbyt często Zaburzenia układu nerwowego: Objawy toksyczności ze strony OUN (drgawki, parestezje okołoustne, drętwienie języka, zwiększona ostrość słuchu, zaburzenia widzenia, utrata przytomności, drżenie mięśniowe, senność, uczucie pustki w głowie, szumy w uszach, uczucie zatrucia, zaburzenia mowy) Rzadko Zaburzenia układu immunologicznego: Reakcje nadwrażliwości, pokrzywka, wysypka, obrzęk naczynioruchowy, w ciężkich przypadkach wstrząs anafilaktyczny Zaburzenia układu nerwowego: Neuropatia, uszkodzenie nerwów obwodowych, zapalenie pajęczynówki Zaburzenia oka: Podwójne widzenie Zaburzenia serca: Zatrzymanie akcji serca, arytmia Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Zahamowanie oddechu Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, PL-02 222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, e-mail: ndl@urpl.gov.pl.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
4.9 Przedawkowanie W rzadkich przypadkach wstrzyknięcie dożylne leku miejscowo znieczulającego może powodować natychmiastową reakcję toksyczności (w ciągu kilku sekund lub minut). Objawy te w wyniku przedawkowania występują znacznie później (15-60 minut po wstrzyknięciu), w wyniku stopniowego narastania w surowicy stężenia leku miejscowo znieczulającego (patrz punkt 4.8). Jeżeli wystąpią objawy zatrucia ogólnoustrojowego należy natychmiast wstrzymać podawanie leku. Toksyczność: Podanie doustne: Wydaje się, że podanie małym dzieciom mniej niż 50 mg nie stwarza ryzyka zatrucia. Podanie 75 mg 2-letniemu dziecku zmniejszyło ból, 100 mg podawane 5-miesięcznemu dziecku spowodowało ciężkie zatrucie, podanie 300 mg + 300 mg w ciągu 4 godzin 3,5-rocznemu dziecku spowodowało ciężkie lub bardzo ciężkie zatrucie, 400-500 mg podawane 2-letniemu dziecku i 1 g w ciągu 12 godzin rocznemu dziecku spowodowało bardzo ciężkie zatrucie.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
Podanie 600 mg osobie dorosłej zmniejszyło ból, 2 g podane osobie dorosłej spowodowało umiarkowane zatrucie. Podanie pozajelitowe: Dożylne podanie 50 mg miesięcznemu dziecku spowodowało bardzo poważne zatrucie. Nasiękowe podanie 200-400 mg dorosłemu pacjentowi spowodowało ciężkie zatrucie a 500 mg - 80-letniej osobie oraz dożylne podanie osobom dorosłym 1 g spowodowało bardzo ciężkie zatrucie. Podanie miejscowe: Podanie 8,6-17,2 mg/kg mc. małym dzieciom, gdy zastosowano do ran po oparzeniach skóry spowodowało ciężkie zatrucie. Objawy Najpierw występują objawy pobudzenia ze strony ośrodkowego układu nerwowego a następnie następuje spowolnienie (depresja). Przy dużych dawkach szybkie wystąpienie konwulsji może być pierwszym objawem. Innymi objawami po przedawkowaniu mogą być: uczucie zmęczenia, zawroty głowy, zaburzenia widzenia, parestezja okołoustna, nudności.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
Dalszymi objawami są: ataksja, zmiany nastroju, euforia, splątanie, trudności w mówieniu, bladość, nadmierne pocenie, drżenie, konwulsje, śpiączka, zatrzymanie akcji serca. Dużym dawkom może towarzyszyć wystąpienie arytmii, szczególnie bradyarytmii, także tachykardia komorowa, migotanie komór, poszerzenie QRS, AV blok, niewydolność serca, obniżenie ciśnienia krwi (opisywano pojedyncze przypadki methemoglobinemii). Leczenie W razie przedawkowania po podaniu doustnym należy zastosować węgiel aktywny. (Sprowokowanie wymioty może być niebezpieczne ze względu na ryzyko znieczulenia śluzówki i drgawek na wczesnym etapie. Jeśli płukanie żołądka jest konieczne, należy przeprowadzić je za pomocą rury i po intubacji dotchawiczej.) W przypadku przedawkowania należy niezwłocznie podjąć kroki w celu zapewnienia właściwego krążenia i oddychania oraz kontrolowania konwulsji. Należy podać pacjentowi tlen i stosować wspomagające wentylowanie, jeżeli konieczne.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
Krążenie należy utrzymywać poprzez wstrzyknięcie surowicy lub dożylnie płynów takich jak dobutamina i jeśli konieczne noradrenalina (początkowo 0,05 µg/kg/min, podwyższając w razie potrzeby o dalsze 0,05 µg/kg/min. co 10 minut), łącznie ze stałym monitoringiem hemodynamicznym w cięższych przypadkach. Można także zastosować efedrynę. Konwulsje można opanować podając dożylnie diazepam lub tiopental sodu, uwzględniając, że czynnik zapobiegający konwulsjom może spowodować depresję oddychania oraz krążenia. W przypadku wystąpienia bradykardii można zastosować atropinę. Jeżeli nastąpi zatrzymanie akcji serca należy zastosować standardowe procedury resuscytacji. Dializa w przypadkach ostrego przedawkowania nie jest skuteczna.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki miejscowo znieczulające, amidy; kod ATC: N01BB02 Lidocaine Grindeks 20 mg/ml roztwór do wstrzykiwań zawiera lidokainę, która jest lekiem miejscowo znieczulającym o budowie amidu. Lidokaina hamuje odwracalnie powstawanie i przewodzenie bodźców we włóknach nerwowych poprzez blokowanie kanałów sodowych błon komórek nerwowych. Podobny efekt jest obserwowany w pobudzonych błonach komórek mózgu i mięśnia sercowego. Lidokaina wykazuje szybką odpowiedź na zastosowanie, wysoką zdolność znieczulenia oraz niską toksyczność. Im mniejsze stężenie lidokainy tym mniejsza zdolność blokowania nerwowych włókien ruchowych.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie i dystrybucja Szybkość wchłaniania zależy od wielkości dawki, drogi podania i perfuzji w miejscu podania. Blokada nerwów międzyżebrowych prowadzi do najwyższego stężenia w osoczu (ok. 1,5 µg/ml na 100 jednostek wstrzykniętych), podczas gdy wstrzyknięcie podskórne w obrębie brzucha prowadzi do najmniejszego stężenia w surowicy (ok. 0,5 µg/ml na 100 jednostek wstrzykniętych). Objętość dystrybucji w stanie równowagi wynosi 91 litrów, natomiast wiązanie z białkami osocza głównie z kwasem alfa-1-glikoproteinowym wynosi 65%. Z przestrzeni nadtwardówkowej absorpcja jest całkowita i dwufazowa z okresem półtrwania odpowiednio ok. 9,3 minut i 82 minuty. Powolna absorpcja jest czynnikiem limitującym czas eliminacji lidokainy, co wyjaśnia wolniejszą eliminację po wstrzyknięciu nadtwardówkowo niż po podaniu dożylnym.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
Metabolizm i eliminacja Eliminacja lidokainy następuje zwłaszcza poprzez metabolizm, głównie poprzez dealkilację do monoetyloglicynoksylidydu (MEGX) katalizowanego za pomocą CYP1A2 oraz CYP3A4. MEGX jest metabolizowany do 2,6–dimetyloaniliny i ksylidydu glicyny (GX). 2,6-dimetyloanilina jest dalej przekształcana za pomocą CYP2A6 do 4-hydroksy-2,6-dimetyloaniliny, która jest głównym metabolitem wydalanym z moczem (80%) w postaci koniugatu. MEGX wykazuje aktywność do wywoływania konwulsji, podobnie do lidokainy, podczas gdy GX nie wykazuje takiej aktywności. MEGX występuje w osoczu w podobnych stężeniach jak substancja wyjściowa. Szybkość eliminacji lidokainy i MEGX wynosi po podaniu dożylnym odpowiednio 1,5-2 godzin i 2,5 godziny. Ze względu na szybki metabolizm w wątrobie, kinetyka zależy od wszystkich stanów wątrobowych. Lidokaina przenika przez barierę łożyska i u płodu stężenie we krwi niezwiązanej lidokainy jest takie samo jak w organizmie matki.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
Jednakże, całkowite stężenie w osoczu będzie niższe u płodu, ze względu na mniejsze wiązanie z białkami. Zaburzenia czynności wątroby Okres półtrwania może być dwukrotnie dłuższy u pacjentów z niewydolnością wątroby. Zaburzenia czynności nerek Niewydolność nerek nie wpływa na kinetykę, ale może powodować kumulację metabolitów we krwi.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Toksyczny wpływ na reprodukcję W badaniach nad rozwojem embrionu/płodu u szczurów i królików, podczas podawania leku w czasie organogenezy nie stwierdzono działania teratogennego. Embriotoksyczność występowała u królików w przypadku zastosowania dawek toksycznych dla matek. Młode króliki po zastosowaniu dawek toksycznych dla matek w późnej ciąży i laktacji wykazywały mniejszą przeżywalność w okresie pourodzeniowym. Genotoksyczność i kancerogenność W świetle przeprowadzonych badań stwierdzono, że lidokaina nie powoduje mutacji genowych. Nie przeprowadzono badań kancerogenności lidokainy. Metabolit lidokainy 2,6-dimetyloanilina in vitro wykazuje potencjał genotoksyczny. W badaniach kancerogenności 2,6-dimetyloaniliny przeprowadzonych u szczurów, poddając je działaniu metabolitu w macicy, w okresie pourodzeniowym i podczas całego cyklu życia, zaobserwowano guzy w nozdrzach, tkance podskórnej i wątrobie.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlPrzedkliniczne dane o bezpieczeństwie
Nie jest jednak znany związek kliniczny tych zmian chorobowych z ekspozycją na krótkoterminowe/sporadyczne stosowanie lidokainy.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Sodu wodorotlenek (1 M) (do ustalenia pH) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Odnotowano niezgodność chlorowodorku lidokainy z roztworem amfoterycyny B, sulfadiazyny sodu, metoheksytalu sodu, kafazoliny sodu oraz fenytoiny sodu. Leki stabilne w środowisku kwaśnym takie jak: chlorowodorek adrenaliny, winian noradrenaliny lub izoprenalina mogą ulegać rozkładowi w ciągu kilku godzin od zmieszania z chlorowodorkiem lidokainy, ponieważ roztwory lidokainy mogą podwyższać pH końcowego roztworu powyżej maksymalnego pH, przy którym są stabilne. Alkalizacja może spowodować precypitację, ponieważ lidokaina jest słabo rozpuszczalna przy pH powyżej 6,5. 6.3 Okres ważności 5 lat. 6.4 Specjalne środki ostrożności podczas przechowywania Nie zamrażać. 6.5 Rodzaj i zawartość opakowania Ampułki z bezbarwnego szkła zawierające 5 ml roztworu. 10 ampułek po 5 ml w tekturowym pudełku.
- CHPL leku Lidocaine Grindeks, roztwór do wstrzykiwań, 20 mg/mlDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Lek należy użyć bezpośrednio po otwarciu. Roztworu do wstrzykiwań nie można przechowywać w kontakcie z metalami, np. igłami lub metalowymi częściami strzykawek, ponieważ rozpuszczone jony metalu mogą powodować obrzęk w miejscu wstrzyknięcia. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO LIGNOX SPRAY, 100 mg/g, aerozol, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g leku zawiera 100 mg lidokainy (Lidocainum). Jedna dawka (rozpylenie) zawiera 8,7 mg lidokainy. Substancje pomocnicze o znanym działaniu: glikol propylenowy – 214 mg/g roztworu, etanol – 680 mg/g roztworu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Aerozol, roztwór. Bezbarwny, przeźroczysty roztwór alkoholowy o charakterystycznym miętowym zapachu.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy Lignox Spray jest wskazany do stosowania u dorosłych i dzieci w wieku powyżej 4 lat we wszystkich przypadkach, w których wymagane jest znieczulenie skóry lub błon śluzowych, a w szczególności: W stomatologii: przed wstrzyknięciami, otwieraniem ropni powierzchownych, usuwaniem ruszających się zębów mlecznych, fragmentów kości, kamienia nazębnego, jako znieczulenie dziąseł przed umocowaniem koron i mostów dentystycznych, przed przygotowaniem wycisków stomatologicznych lub zdjęciem rentgenowskim w celu zahamowania odruchu gardłowego, W otorynolaryngologii: przed zabiegami elektrokauteryzacji (przyżegania prądem elektrycznym), przed zabiegami wycięcia przegrody oraz usunięcia polipów nosa, przed zabiegami wycięcia migdałków w celu zahamowania odruchu gardłowego, jak również znieczulenia miejsca wstrzyknięcia leku znieczulającego, jako znieczulenie uzupełniające przed otwarciem ropnia okołomigdałkowego, przed nakłuciem (punkcją) zatoki szczękowej, przed płukaniem zatok, W położnictwie: podczas ostatniego etapu porodu, przed nacięciem i szyciem krocza jako uzupełniający środek przeciwbólowy, podczas usuwania szwów, W endoskopii oraz w badaniach z użyciem narzędzi: jako powierzchniowe znieczulenie okolicy gardła i tchawicy oraz w celu osłabienia odruchów i zmniejszenia reakcji hemodynamicznej podczas wprowadzania różnego typu narzędzi w obrębie dróg oddechowych i przewodu pokarmowego.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Produkt leczniczy Lignox Spray należy stosować u pacjentów dorosłych oraz dzieci w wieku powyżej 4 lat. Należy zawsze stosować najmniejszą skuteczną dawkę produktu. Produktu leczniczego Lignox Spray nie należy stosować na powierzchnię narzędzi wykonanych z tworzywa sztucznego (patrz punkt 4.4). Jedna dawka (jedno rozpylenie) produktu Lignox Spray zawiera 8,7 mg lidokainy. Z jednego opakowania (38 g produktu) można wykonać około 430 rozpyleń. Nie jest konieczne wcześniejsze osuszanie miejsca zabiegu przed zastosowaniem produktu leczniczego Lignox Spray. Dawkowanie Dorośli U pacjentów osłabionych, ciężko chorych i w podeszłym wieku sposób dawkowania należy dobierać odpowiednio do wieku i stanu ogólnego pacjenta. Nie należy podawać dorosłym pacjentom maksymalnej dobowej dawki większej niż 200 mg lidokainy, co odpowiada 2,2 ml produktu (około 22 rozpyleń).
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gDawkowanie
Sposób dawkowania produktu różni się w zależności od wskazania do stosowania i wielkości znieczulanego obszaru. Wskazówki dotyczące dawkowania przy różnych wskazaniach: Stomatologia: 8,7-26,1 mg (1-3 rozpyleń) Otorynolaryngologia: 8,7-26,1 mg (1-3 rozpyleń) Położnictwo: 87-130,5 mg (10-15 rozpyleń), maksymalnie około 200 mg (22 rozpylenia) Endoskopia oraz badania z użyciem narzędzi: 8,7-26,1 mg (1-3 rozpyleń) Dzieci w wieku powyżej 4 lat Sposób dawkowania produktu różni się w zależności od wieku i masy ciała dziecka, stanu ogólnego pacjenta, wielkości znieczulanego obszaru i rodzaju wykonywanego zabiegu. Średnia dawka stosowana to 16,2 mg do 24,3 mg lidokainy na sesję. Zalecaną dawkę w mg lidokainy, która może być stosowana u dzieci oblicza się ze wzoru: masa dziecka (w kg) x 1,33. Nie należy podawać dawki lidokainy większej niż 2,2 mg/kg mc. Sposób podawania Podanie na skórę i (lub) na błony śluzowe.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gDawkowanie
Przed pierwszym użyciem należy kilkakrotnie nacisnąć pompkę rozpylającą, aby wypełnić ją płynem. Gdy tylko to możliwe, podczas stosowania produktu Lignox Spray należy trzymać butelkę pionowo. Nie wdychać, nie połykać. Chronić oczy.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na lidokainę oraz na inne środki miejscowo znieczulające o budowie amidowej lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Z powodu ryzyka aspiracji, nie należy stosować produktu leczniczego Lignox Spray, gdy jako materiał wyciskowy używany jest gips. Lignox Spray można stosować, gdy do wycisków używa się elastyczny materiał. Względne przeciwwskazania to: hypowolemia, wstrząs, blok przewodnictwa przedsionkowo-komorowego II i III, miastenia, ciężkie uszkodzenia wątroby.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Zastosowanie produktu Lignox Spray w dawce większej niż zalecana lub za częste podawanie produktu może spowodować zwiększenie stężenia lidokainy we krwi i wystąpienie poważnych działań niepożądanych. Wchłanianie lidokainy zależy od miejsca podania produktu. Lidokaina łatwo i szybko wchłania się przez błony śluzowe. Wchłanianie szczególnie dużych ilości lidokainy obserwowano po jej zastosowaniu w obrębie drzewa oskrzelowego, co zwiększa ryzyko wystąpienia objawów toksyczności (np. drgawek). Należy zachować szczególną ostrożność podczas stosowania na duże powierzchnie u dzieci. Produkt leczniczy należy stosować ostrożnie u pacjentów z ranami lub zapaleniami błony śluzowej w obszarze planowanego zastosowania. Uszkodzona śluzówka powoduje zwiększenie wchłaniania ogólnoustrojowego.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gSpecjalne środki ostrozności
Postępowanie w przypadku poważnych działań niepożądanych może wymagać użycia sprzętu do resuscytacji, tlenu i leków do resuscytacji (patrz punkt 4.9). U pacjentów w znieczuleniu ogólnym mogą wystąpić większe stężenia lidokainy we krwi niż u pacjentów swobodnie oddychających. Pacjenci swobodnie oddychający z większym prawdopodobieństwem połkną dużą część zastosowanej dawki, która po absorpcji z jelita ulega metabolizmowi w efekcie pierwszego przejścia w wątrobie. Zastosowanie środków miejscowo znieczulających w obrębie gardła może zaburzać proces połykania, a tym samym zwiększać ryzyko aspiracji. Jest to szczególnie ważne w przypadku stosowania produktu leczniczego w okolicy gardła i policzków u dzieci. Z powodu drętwienia języka i błony śluzowej policzków istnieje ryzyko ich urazu przez ugryzienie. Przez hamowanie odruchu gardłowego oraz przedostanie się do krtani i tchawicy lidokaina hamuje odruch kaszlowy, co może spowodować odoskrzelowe zapalenie płuc.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gSpecjalne środki ostrozności
Nie stosować produktu w znieczuleniu miejscowym przed zabiegami wycinania migdałków oraz adenoidów u dzieci w wieku poniżej 8 lat, ze względu na częściej występujący u dzieci odruch połykania produktu. Jeśli ze względu na miejsce podania, zastosowaną dawkę oraz wielkość znieczulanego obszaru można spodziewać się zwiększenia stężenia lidokainy we krwi, należy stosować mniejsze dawki produktu. Sposób dawkowania należy ustalać indywidualnie, w zależności od wieku i stanu ogólnego pacjenta. Szczególną ostrożność należy zachować przy stosowaniu produktu u pacjentów: z padaczką; z chorobami układu krążenia i niewydolnością serca; z zaburzeniami przewodnictwa serca lub bradykardią; z ciężką niewydolnością nerek; z zaburzeniami czynności wątroby; w stanie ciężkiego wstrząsu; w podeszłym wieku, ciężko chorych i w złym ogólnym stanie zdrowia; z zespołem nerczycowym; ze zmniejszonym stężeniem białka w surowicy. Lignox Spray nie powinien dostać się do oczu.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gSpecjalne środki ostrozności
Należy chronić oczy przed kontaktem z produktem. Pacjenci leczeni lekami przeciwarytmicznymi klasy III (np. amiodaron) powinni być pod ścisłym nadzorem połączonym z monitorowaniem elektrokardiograficznym (EKG), ponieważ działanie obu leków na czynność serca może się sumować. Ostrożnie stosować u chorych leczonych trójpierścieniowymi lekami przeciwdepresyjnymi i inhibitorami MAO. Lignox Spray nie powinien być stosowany na mankiety rurek wewnątrztchawicznych (ETT) wykonanych z tworzywa sztucznego. Lidokaina w kontakcie z mankietami rurek intubacyjnych (wykonanych zarówno z PVC jak i innych tworzyw sztucznych) może doprowadzić do uszkodzenia mankietu. Powstające otworki mogą powodować wyciek, a w konsekwencji spadek ciśnienia w mankiecie. Produkt leczniczy wykazuje potencjalne działanie porfirynogenne. U pacjentów z ostrą porfirią Lignox Spray można stosować jedynie w nagłych wskazaniach i z zastosowaniem odpowiednich środków ostrożności.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gSpecjalne środki ostrozności
Podczas stosowania produktu Lignox Spray powinny być dostępne sprzęt i leki niezbędne do leczenia objawów toksyczności. W razie wystąpienia objawów toksycznych ze strony układu nerwowego, oddechowego lub krążenia musi być podjęte natychmiastowe postępowanie resuscytacyjne: należy zapewnić prawidłową wentylację przy użyciu tlenu, podać leki przeciwdrgawkowe i podwyższające ciśnienie tętnicze. W skład produktu leczniczego wchodzi glikol propylenowy i etanol. Produkt może powodować podrażnienie skóry i błon śluzowych. UWAGA! Lidokaina może dawać dodatni wynik w badaniach antydopingowych.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Szczególną ostrożność należy zachować u pacjentów otrzymujących inne środki miejscowo znieczulające, leki będące strukturalnymi analogami lidokainy tj. leki antyarytmiczne (np. meksyletyna, tokainid). Działania toksyczne tych leków mogą się sumować. Nie prowadzono badań nad specyficznymi interakcjami lidokainy i leków przeciwarytmicznych (np. amiodaronu), ale podczas ich stosowania należy zachować szczególną ostrożność (patrz punkt 4.4). Ostrożnie stosować u chorych leczonych trójpierścieniowymi lekami przeciwdepresyjnymi i inhibitorami MAO. Leki, które zmniejszają klirens lidokainy (np. cymetydyna lub beta-blokery) mogą powodować potencjalnie toksyczne stężenia lidokainy w osoczu, szczególnie przy powtarzających się dużych dawkach w ciągu długiego okresu. Takie interakcje nie powinny mieć znaczenia klinicznego przy krótkotrwałym leczeniu przy użyciu produktu Lignox Spray w zalecanych dawkach.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gInterakcje
Lidokaina nasila działanie środków zwiotczających mięśnie poprzecznie prążkowane.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak wystarczających dowodów dotyczących bezpieczeństwa stosowania lidokainy u kobiet w okresie ciąży. Stosowanie lidokainy przez wiele lat w praktyce klinicznej, jak i badania przeprowadzane na zwierzętach nie wykazują szczególnego zagrożenia. W związku z tym, po rozważeniu korzyści do ryzyka, Lignox Spray można stosować u kobiet w ciąży, jedynie, gdy będzie to niezbędne, w przypadku braku alternatywnego, bezpieczniejszego sposobu leczenia. Karmienie piersi? Nie zostało określone bezpieczeństwo stosowania u kobiet karmiących piersią. Lidokaina jest wykrywana w mleku matki, ale po podaniu miejscowym jest mało prawdopodobne, by lek w ilości, która może znaleźć się w mleku matki miał wpływ na dziecko.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Leki miejscowo znieczulające w zależności od wielkości dawki mogą wywierać nieznaczny wpływ na funkcje psychiczne, jak również mogą przejściowo zaburzać funkcje motoryczne i koordynację ruchową.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gDziałania niepożądane
4.8 Działania niepożądane Ogólnoustrojowe działania niepożądane są rzadkie i mogą wynikać z: wysokiego poziomu lidokainy we krwi na skutek nadmiernego dozowania lub szybkiego wchłaniania (na przykład po zastosowaniu w obszarze poniżej strun głosowych) lub nadwrażliwości, idiosynkrazji lub obniżonej tolerancji pacjenta. Reakcje te mogą obejmować ośrodkowy układ nerwowy lub układ krążenia. Zaburzenia układu immunologicznego W bardzo rzadkich przypadkach leki znieczulające typu amidowego powodowały reakcje alergiczne, a w skrajnych przypadkach wstrząs anafilaktyczny. Zaburzenia ogólne i stany w miejscu podania Opisano przypadki miejscowego podrażnienia w miejscu zastosowania. Po podaniu na błony śluzowe krtani przed intubacją, występowały odwracalne objawy, takie jak ból gardła, chrypka i utrata głosu. Zastosowanie produktu leczniczego Lignox Spray zapewnia znieczulenie powierzchniowe podczas badań z użyciem narzędzi, ale nie zmniejsza bólu po wykonanej intubacji.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gDziałania niepożądane
Zaburzenia układu nerwowego Produkt leczniczy może wywoływać pobudzające lub hamujące reakcje ze strony ośrodkowego układu nerwowego. Reakcje te mogą objawiać się nerwowością, zawrotami głowy, drgawkami, utratą przytomności i możliwością zatrzymania oddechu. Objawy te mogą być bardzo krótkie lub mogą nie pojawić się wcale. W takich przypadkach pierwszymi objawami toksyczności będą senność, utrata przytomności i zatrzymanie oddechu. Zaburzenia naczyniowe Ze strony układu krążenia może wystąpić niedociśnienie, niedotlenienie mięśnia sercowego, bradykardia i zatrzymanie akcji serca. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa Tel: + 48 22 49 21 301 Fax: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gPrzedawkowanie
4.9 Przedawkowanie Ostra toksyczność układowa. Reakcje toksyczne pochodzą głównie z ośrodkowego układu nerwowego i układu sercowo-naczyniowego. Pierwsze objawy ze strony ośrodkowego układu nerwowego to mrowienie w okolicy ust, drętwienie języka, zawroty głowy, przeczulica słuchowa i szum w uszach. Zaburzenia widzenia i drżenie mięśni są bardziej poważne i poprzedzają wystąpienie uogólnionych drgawek. Następnie mogą wystąpić utrata przytomności lub napady toniczno-kloniczne (drgawki typu grand mal). Mogą one trwać od kilku sekund do kilku minut. Bardzo szybko dochodzi do niedotlenienia i hiperkapnii w wyniku zwiększonej aktywności mięśni i zaburzeń oddychania. W ciężkich przypadkach może wystąpić bezdech. Pojawiająca się kwasica zwiększa toksyczne skutki znieczulenia miejscowego. Wpływ produktu na układ krążenia obserwuje się jedynie w przypadkach wysokich stężeń ogólnoustrojowych.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gPrzedawkowanie
W takich przypadkach może pojawić się ciężkie niedociśnienie tętnicze, bradykardia, zaburzenia rytmu serca i zapaść. Sercowo-naczyniowe efekty toksyczne zazwyczaj poprzedzone są oznakami toksyczności w ośrodkowym układzie nerwowym, o ile pacjent nie otrzymuje znieczulenia ogólnego lub leków silnie uspokajających takich jak benzodiazepiny lub barbiturany. Leczenie toksyczności ostrej W razie wystąpienia objawów toksycznych ze strony układu nerwowego, oddechowego lub krążenia, najpóźniej w chwili wystąpienia drgawek, należy podjąć natychmiastowe postępowanie resuscytacyjne. Niezbędne leki i sprzęt powinny być natychmiast dostępne. Należy zapewnić prawidłową wentylację przy użyciu tlenu i zastosować sztuczne oddychanie. W przypadku wystąpienia drgawek, które nie ustępują spontanicznie w czasie 15-30 sek., należy podać leki przeciwdrgawkowe. Tiopental sodu podany dożylnie w ilości 1-3 mg/kg przerywa drgawki natychmiast.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gPrzedawkowanie
Alternatywnie można zastosować diazepam w ilości 0,1 mg/kg mc., choć jego działanie będzie powolne. Przedłużające się drgawki mogą zagrażać niedotlenieniem pacjenta. W takich przypadkach dożylnie podaje się środek zwiotczający mięśnie np. 1 mg/kg mc. sukcynylocholiny. Sukcynylocholina może spowodować zatrzymanie oddechu, dlatego powinna być podawana wyłącznie przez specjalistów z doświadczeniem w przeprowadzaniu intubacji dotchawiczej oraz postępowaniu z pacjentem z porażeniem czynności oddechowej. W przypadku objawów sercowo-naczyniowych (niedociśnienie tętnicze, bradykardia) wskazane jest dożylne podanie efedryny w ilości 5-10 mg/kg, w razie potrzeby dawkę powtórzyć po 2-3 minutach. W przypadku migotania komór i zatrzymania krążenia należy natychmiast wdrożyć pełne postępowanie resuscytacyjne.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Ośrodkowy układ nerwowy, Leki znieczulające, Środki do znieczulenia miejscowego, Amidy, kod ATC: N01 BB02. Mechanizm działania Lidokaina, podobnie jak inne środki miejscowo znieczulające, powoduje odwracalną blokadę przewodnictwa impulsów wzdłuż włókien nerwowych, zapobiegając przemieszczaniu się jonów sodowych do wewnątrz przez membranę komórek nerwowych. Środki miejscowo znieczulające typu amidowego prawdopodobnie działają w kanałach sodowych błony nerwowej. Działanie farmakodynamiczne Leki miejscowo znieczulające mogą mieć analogiczny wpływ na błony komórkowe mózgu oraz mięśnia sercowego. W przypadku uwolnienia zbyt dużej ilości leku do krążenia ogólnoustrojowego w krótkim czasie, mogą pojawić się objawy toksyczności ze strony ośrodkowego układu nerwowego i sercowo-naczyniowego.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gWłaściwości farmakodynamiczne
Objawy toksyczności ze strony ośrodkowego układu nerwowego zwykle poprzedzają objawy ze strony układu sercowo-naczyniowego, ze względu na niższe stężenia substancji w osoczu. Bezpośredni wpływ leków miejscowo znieczulających na serce to opóźnione przewodzenie, inotropizm ujemny i zatrzymanie akcji serca.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Lidokaina wchłania się po podaniu na błony śluzowe. Szybkość i stopień wchłaniania po podaniu miejscowym zależy od stężenia i zastosowanej dawki, miejsca aplikacji i czasu trwania wystawienia na działanie leku. Środki miejscowo znieczulające najszybciej wchłaniają się z błony śluzowej tchawicy i oskrzeli. Lidokaina również dobrze wchłania się z żołądka oraz jelit, ale we krwi pojawia się mała ilość leku w formie niezmienionej z powodu metabolizmu w wątrobie. Dystrybucja Wiązanie lidokainy przez białka osocza jest zależne od stężenia, przy czym część związana zmniejsza się wraz ze wzrostem stężenia. Przy stężeniach od 1 do 4 μg/ml około 60 do 80% lidokainy wiąże się z białkami osocza. Stopień wiązania zależy także od stężenia kwaśnej α1-glikoproteiny (AAG). Lidokaina w wyniku dyfuzji biernej przenika przez barierę krew-mózg oraz przez łożysko. Metabolizm W organizmie lidokaina jest szybko metabolizowana w wątrobie.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gWłaściwości farmakokinetyczne
Metabolity i lek w postaci niezmienionej wydalane są z moczem. Substancja ulega oksydacyjnej N-dealkilacji, hydroksylacji pierścieniowej, rozszczepieniu wiązania amidowego oraz reakcji sprzężenia. W wyniku N-dealkilacji, szlaku metabolicznego o głównym znaczeniu, powstają metabolity – monoetyloglicynoksylidyd i glicynoksylidyd. W porównaniu z lidokainą charakteryzują je słabsze działania metaboliczne i toksyczne. Ponieważ lidokaina metabolizowana jest w wątrobie, może wykazywać większą toksyczność u osób z zaburzoną czynnością wątroby, ze względu na zmianę kinetyki oraz ponad dwukrotne wydłużenie okresu półtrwania. Niewydolność nerek nie wpływa na kinetykę lidokainy, ale może zwiększyć stopień akumulacji metabolitów. Eliminacja Około 90% lidokainy jest eliminowane w postaci różnych metabolitów, mniej niż 10% jest wydalane bez zmian. Głównym metabolitem w moczu jest sprzężona 4-hydroksy-2,6-dimetyloanilina.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gWłaściwości farmakokinetyczne
Po podaniu dożylnym w postaci bolusa okres półtrwania w fazie eliminacji wynosi 1,5-2 godzin. Czynniki takie jak kwasica, stosowanie środków pobudzających oraz hamujących ośrodkowy układ nerwowy wpływają na ilość lidokainy, przy której ujawniają się skutki działania ogólnoustrojowego. Wraz ze wzrostem stężenia lidokainy w osoczu krwi żylnej powyżej 6 μg/ml coraz bardziej uwidaczniają się niepożądane objawy przedmiotowe.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Lidokaina jest dobrze poznaną substancją czynną. Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają żadnego szczególnego zagrożenia dla człowieka. Lidokaina nie wykazuje dużej toksyczności ostrej po podaniu jednorazowym drogą doustną. W badaniach na zwierzętach wykazane zostało działanie ototoksyczne. Nie stwierdzono działania mutagennego i genotoksycznego. Nie stwierdzono także działania rakotwórczego ani wpływu na reprodukcję. Słabe działanie mutagenne wykazuje natomiast 2,6-dimetyloanilina (zanieczyszczenie), potwierdzono również działanie rakotwórcze tego związku.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Etanol Glikol propylenowy Olejek mięty pieprzowej Sacharyna 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata Okres ważności po pierwszym otwarciu opakowania: 12 miesięcy. Po pierwszym otwarciu przechowywać w dokładnie zamkniętej butelce. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać butelkę szczelnie zamkniętą. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Butelka ze szkła brunatnego typu III, zamykana pompką rozpylającą z HDPE/POM/LDPE/Stal nierdzewna/EVA/IIR/mieszanina LDPE i HDPE z aplikatorem z PP/HDPE, zawierająca 38 g płynu. Butelka wraz z ulotką dla pacjenta umieszczona jest w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań.
- CHPL leku Lignox Spray, aerozol, roztwór, 100 mg/gDane farmaceutyczne
Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Mydrane, (0,2 mg + 3,1 mg + 10 mg)/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 0,2 mg tropikamidu, 3,1 mg fenylefryny chlorowodorku i 10 mg lidokainy chlorowodorku jednowodnego. Jedna dawka 0,2 ml roztworu zawiera 0,04 mg tropikamidu, 0,62 mg fenylefryny chlorowodorku i 2 mg lidokainy chlorowodorku jednowodnego. Substancja pomocnicza o znanym działaniu: sód (0,59 mg na dawkę; patrz punkt 4.4). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań Klarowny, nieznacznie brązowawo-żółty roztwór, praktycznie wolny od widocznych cząstek pH: 6,9 – 7,5 Osmolalność: 290 – 350 mOsmol/kg
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy Mydrane jest przeznaczony do stosowania podczas operacji zaćmy w celu uzyskania rozszerzenia źrenicy (mydriazy) i wewnątrzgałkowego znieczulenia w trakcie zabiegu operacyjnego. Mydrane jest wskazany do stosowania wyłącznie u dorosłych.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlDawkowanie
4.2 Dawkowanie i sposób podawania Podanie do komory przedniej oka (dokomorowe). Zawartość jednej ampułki podaje się do jednego oka. Produkt leczniczy Mydrane musi być podawany przez chirurga okulistę. Dawkowanie Mydrane należy stosować tylko u pacjentów, u których podczas badania przedoperacyjnego uzyskano dostateczne rozszerzenie źrenicy po zastosowaniu kropli do oczu rozszerzających źrenicę. Dorośli: Na początku zabiegu operacyjnego podać 0,2 ml Mydrane do komory przedniej oka w powolnym jednorazowym wstrzyknięciu. Szczególne grupy pacjentów Osoby w podeszłym wieku: Nie jest wymagane dostosowanie dawki. Dzieci i młodzież: Bezpieczeństwo i skuteczność produktu leczniczego Mydrane u dzieci i młodzieży w wieku od urodzenia do 18 lat nie zostały określone. Pacjenci z zaburzeniem czynności nerek: Ze względu na małą dawkę i bardzo niską ekspozycję ogólnoustrojową (patrz punkt 5.2) nie jest wymagane dostosowanie dawki.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlDawkowanie
Pacjenci z zaburzeniem czynności wątroby: Ze względu na małą dawkę i bardzo niską ekspozycję ogólnoustrojową (patrz punkt 5.2) nie jest wymagane dostosowanie dawki. Sposób podawania Stosowanie do komory przedniej oka (dokomorowe) Należy postępować zgodnie z poniższą procedurą: Pięć minut przed wykonaniem przedoperacyjnej procedury antyseptycznej i przed pierwszym cięciem należy podać do worka spojówkowego jedną do dwóch kropli środka znieczulającego do oczu. Na początku operacji chirurg okulista wykonuje powoli iniekcję dokomorową (do komory przedniej oka) 0,2 ml Mydrane w jednorazowym wstrzyknięciu przez nacięcie boczne lub nacięcie główne. Instrukcja dotycząca przygotowania produktu leczniczego przed podaniem, patrz punkt 6.6.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne (tropikamid, fenylefryny chlorowodorek i lidokainy chlorowodorek jednowodny) lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Znana nadwrażliwość na środki znieczulające typu amidowego. Znana nadwrażliwość na pochodne atropiny.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Specjalne ostrzeżenia: Zalecana dawka wynosi 0,2 ml Mydrane; nie należy wstrzykiwać dodatkowej dawki, ponieważ nie wykazano znaczącego działania dodatkowego i zaobserwowano zwiększoną utratę komórek śródbłonka (patrz też punkt 4.9). Nie obserwowano działania toksycznego na śródbłonek rogówki podczas stosowania zalecanej dawki Mydrane; jednakże z powodu ograniczonych danych nie można wykluczyć tego ryzyka. Brak danych klinicznych związanych ze stosowaniem Mydrane: u pacjentów stosujących insulinę lub pacjentów z niekontrolowaną cukrzycą, u pacjentów z chorobą rogówki, zwłaszcza u pacjentów z współwystępującą zmniejszoną liczbą komórek śródbłonka, u pacjentów z zapaleniem błony naczyniowej oka w wywiadzie, u pacjentów z nieprawidłowościami źrenicy lub po urazach narządu wzroku, u pacjentów z bardzo ciemnymi tęczówkami, w przypadku operacji zaćmy połączonej z przeszczepem rogówki.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlSpecjalne środki ostrozności
Brak doświadczeń związanych ze stosowaniem Mydrane u pacjentów zagrożonych zespołem wiotkiej tęczówki. U tych pacjentów korzystne może być stopniowe rozszerzanie źrenicy, rozpoczynające się od podawania kropli rozszerzających źrenice. Brak doświadczeń klinicznych ze stosowaniem Mydrane w czasie operacji usunięcia zaćmy u pacjentów leczonych miejscowo działającymi preparatami rozszerzającymi źrenice, u których w czasie operacji występuje zwężenie źrenicy (lub nawet mioza). Mydrane nie jest zalecany do stosowania podczas operacji zaćmy, która jest połączona z witrektomią, z powodu zwężającego naczynia działania fenylefryny. Mydrane nie jest zalecany u osób z płytką komorą przednią i u pacjentów z jaskrą z ostrym zamknięciem kąta przesączania w wywiadzie. Stosowanie produktu Mydrane u pacjentów z płytką komorą przednią, pacjentów z jaskrą z ostrym zamknięciem kąta przesączania w wywiadzie i (lub) niewystarczającym rozszerzeniem źrenic może zwiększać ryzyko zarówno wypadnięcia tęczówki, jak i zespołu wiotkiej tęczówki.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlSpecjalne środki ostrozności
Specjalne środki ostrożności dotyczące stosowania: Po podaniu Mydrane w organizmie nie wykrywa się zupełnie albo wykrywa się bardzo niskie stężenia substancji czynnych (patrz punkt 5.2). Ponieważ działanie ogólnoustrojowe fenylefryny i lidokainy zależy od dawki, jest mało prawdopodobne, aby działania takie wystąpiły podczas stosowania Mydrane. Jednakże, ponieważ nie można tego ryzyka wykluczyć, należy pamiętać, że: Fenylefryna ma działanie sympatykomimetyczne, które mogłoby mieć wpływ na pacjentów z nadciśnieniem, zaburzeniami rytmu serca, nadczynnością tarczycy, miażdżycą tętnic lub zaburzeniami gruczołu krokowego oraz na wszystkie osoby z przeciwwskazaniami do ogólnoustrojowego stosowania amin presyjnych. Lidokaina powinna być stosowana ostrożnie u osób z epilepsją, miastenią, zaburzeniami przewodzenia w sercu, zastoinową niewydolnością serca, bradykardią, ciężkim wstrząsem, zaburzeniem czynności oddechowej lub zaburzeniem czynności nerek z klirensem kreatyniny mniejszym niż 10 ml/min.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlSpecjalne środki ostrozności
Lek zawiera mniej niż 1 mmol sodu (23 mg) w dawce, to znaczy lek uznaje się za „wolny od sodu”.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji produktu leczniczego Mydrane. Ponieważ oczekuje się, że ekspozycja układowa jest bardzo niska (patrz punkt 5.2), wystąpienie interakcji ogólnoustrojowych jest mało prawdopodobne.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak wystarczających danych dotyczących stosowania fenylefryny i tropikamidu u kobiet w ciąży. Badania na zwierzętach dotyczące wpływu na ciążę, rozwój zarodka/płodu, poród i rozwój pourodzeniowy są niewystarczające. Chociaż badania na zwierzętach nie wykazały szkodliwego działania na płód, to lidokaina przenika przez łożysko i nie powinna być podawana w czasie ciąży. Mimo iż przewiduje się, że wchłanianie ogólnoustrojowe jest nieistotne, nie można wykluczyć niewielkiej ekspozycji ogólnoustrojowej. Dlatego nie należy stosować produktu leczniczego Mydrane w okresie ciąży. Karmienie piersi? Brak danych dotyczących przenikania fenylefryny lub tropikamidu do mleka matki. Fenylefryna jest słabo wchłaniana po podaniu doustnym, co oznacza, że wchłanianie u niemowląt byłoby nieistotne.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlWpływ na płodność, ciążę i laktację
Jednak niemowlęta mogą być bardzo wrażliwe na środki antycholinergiczne, dlatego stosowanie tropikamidu nie jest zalecane w czasie karmienia piersią, pomimo nieistotnej ekspozycji ogólnoustrojowej. Niewielkie ilości lidokainy przenikają do mleka ludzkiego i istnieje możliwość wystąpienia reakcji alergicznych u niemowląt. Dlatego nie należy stosować produktu leczniczego Mydrane w czasie karmienia piersią. Płodność Brak informacji o tym, czy Mydrane może wpływać na płodność u mężczyzn i kobiet.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Mydrane ma umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn z powodu działania rozszerzającego źrenice. Dlatego też po wykonaniu operacji zaćmy z zastosowaniem jednej iniekcji Mydrane należy poinformować pacjenta, aby nie kierował pojazdem i (lub) nie obsługiwał maszyn, jeśli utrzymują się zaburzenia widzenia.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych podczas stosowania produktu leczniczego Mydrane zgłaszano działania niepożądane (patrz punkt 5.1). Większość z nich dotyczyła oczu i miała nasilenie od łagodnego do umiarkowanego. Podsumowanie profilu bezpieczeństwa: Przerwanie tylnej torebki i torbielowaty obrzęk plamki to dobrze znane powikłania występujące w czasie lub po operacji usunięcia zaćmy. Mogą one wystąpić niezbyt często (mniej niż 1 przypadek na 100 pacjentów). Tabelaryczne zestawienie działań niepożądanych: Działania niepożądane są skategoryzowane na podstawie częstości występowania w następujący sposób: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10000 do <1/1000); bardzo rzadko (<1/10000); nieznana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlDziałania niepożądane
Działania niepożądane zgłoszone podczas badań klinicznych przedstawione są zgodnie z Klasyfikacją układów i narządów (System Organ Class) w poniższej tabeli i są uporządkowane według malejącego nasilenia w każdej grupie częstości. Klasyfikacja układów i narządów Częstość: niezbyt częste Reakcja niepożądana: Ból głowy Częstość: niezbyt częste Reakcja niepożądana: Zapalenie rogówki, torbielowaty obrzęk plamki, podwyższone ciśnienie wewnątrzgałkowe, przerwanie tylnej torebki, przekrwienie oka Częstość: niezbyt częste Reakcja niepożądana: Nadciśnienie Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: +48 22 49 21 301 faks: +48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlPrzedawkowanie
4.9 Przedawkowanie Działanie ogólnoustrojowe Ze względu na jednorazowe podawanie i przewidywany niski pasaż ogólnoustrojowy produktu leczniczego Mydrane, ryzyko skutków ogólnoustrojowych spowodowanych przedawkowaniem uważa się za minimalne. Objawy przedawkowania fenylefryny w oku prawdopodobnie wynikają z absorpcji ogólnoustrojowej i obejmują bardzo duże zmęczenie, pocenie się, zawroty głowy, zwolnienie akcji serca i śpiączkę. Ponieważ ostra reakcja toksyczna na fenylefrynę ma szybki początek i trwa krótko, stosuje się głównie leczenie podtrzymujące. Zalecane było natychmiastowe wstrzyknięcie szybko działającego środka blokującego receptory alfa-adrenergiczne, takiego jak fentolamina (dawka 2 do 5 mg podana dożylnie). Objawy przedawkowania tropikamidu w oku obejmują ból głowy, szybką pracę serca, suchość ust i skóry, nietypowe zawroty głowy i zaczerwienienie twarzy. Nie przewiduje się działania ogólnoustrojowego tropikamidu.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlPrzedawkowanie
W przypadku wystąpienia przedawkowania powodującego skutki miejscowe, np. utrzymujące się rozszerzenie źrenic, należy podać pilokarpinę lub fizostygminę o stężeniu 0,25% wag./obj. W przypadku nadmiernej absorpcji lidokainy do krwiobiegu objawy mogą obejmować działanie na ośrodkowy układ nerwowy (takie jak drgawki, utrata przytomności i możliwe zatrzymanie oddychania) oraz reakcje sercowo-naczyniowe (takie jak obniżenie ciśnienia, depresja mięśnia sercowego, bradykardia i możliwe zatrzymanie pracy serca). Leczenie pacjenta w przypadku wystąpienia ogólnoustrojowego toksycznego działania lidokainy polega na powstrzymaniu drgawek i zapewnieniu odpowiedniej wentylacji tlenem, a w razie potrzeby na wspomaganej lub kontrolowanej wentylacji (oddychanie). Działanie miejscowe Przedawkowanie może powodować utratę komórek śródbłonka (patrz punkt 4.4 i 5.1).
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: ŚRODKI ROZSZERZAJĄCE ŹRENICE i PORAŻAJĄCE AKOMODACJĘ, tropikamid w połączeniach, kod ATC: S01FA56. Produkt leczniczy Mydrane jest roztworem do wstrzykiwania dokomorowego (do komory przedniej oka), w skład którego wchodzą dwie syntetyczne substancje rozszerzające źrenice (tropikamid – o działaniu antycholinergicznym i fenylefryna – o działaniu alfa-sympatykomimetycznym) i jedna substancja znieczulająca o działaniu miejscowym (lidokainy chlorowodorek jednowodny). Mechanizm działania: Fenylefryna jest działającym bezpośrednio środkiem sympatykomimetycznym. Powoduje rozszerzenie źrenic poprzez stymulację receptorów alfa-adrenergicznych rozwieracza źrenicy (skurcz rozwieracza źrenicy powoduje rozszerzenie źrenicy). Nie ma prawie żadnego wpływu na porażenie akomodacji. Tropikamid jest środkiem parasympatykolitycznym, który działa poprzez wiązanie się do receptorów muskarynowych M4 oraz ich blokowanie.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlWłaściwości farmakodynamiczne
Powoduje to brak odpowiedzi na stymulację cholinergiczną mięśnia zwieracza źrenicy i mięśnia ciała rzęskowego, czego rezultatem jest rozszerzenie źrenicy i porażenie mięśnia rzęskowego (cykloplegia). Lidokaina jest miejscowym środkiem znieczulającym typu amidowego. Działa na drodze hamowania przewodnictwa impulsów we włóknach nerwowych poprzez zahamowanie przepuszczalności błony neuronu, zwłaszcza dla jonów sodu. Działanie farmakodynamiczne Chociaż tropikamid stosowany w monoterapii powoduje rozszerzenie źrenicy i porażenie akomodacji, dodatkowe rozszerzenie źrenicy występuje, gdy równocześnie stosowane są substancje sympatykomimetyczne, takie jak fenylefryna. Takie działające synergistycznie połączenia są często zalecane w celu osiągnięcia maksymalnego rozszerzenia źrenicy podczas operacji usuwania zaćmy. W badaniach klinicznych II fazy osiągnięto średnio rozszerzenie na poziomie 95% w ciągu 30 sekund po pojedynczym wstrzyknięciu dokomorowym 200 µl Mydrane.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlWłaściwości farmakodynamiczne
Pomiar był dokonany przed podaniem wiskoelastyku. W badaniach klinicznych II i III fazy odnotowano następujące pomiary wielkości źrenicy (pacjenci, u których wykonano pojedyncze wstrzyknięcie dokomorowe 200 µl Mydrane): Badanie II Fazy, n=24 Badanie III Fazy, n=181 W ciągu 30 sekund po wstrzyknięciu Mydrane: Po wstrzyknięciu Mydrane i wykonanej następnie iniekcji wiskoelastyku Tuż przed wszczepieniem implantu wewnątrzgałkowego Pomiary wielkości źrenicy (mm): Średnia (odchylenie standardowe) Mediana 6,7 (0,7) 6,7 7,7 (0,7) 7,7 7,8 (0,8) 7,8 7,9 (0,9) 7,9 W badaniu III fazy, po wykonaniu pojedynczego wstrzyknięcia 200 µl Mydrane i wstrzyknięciu wiskoelastyku (tuż przed kapsuloreksją), szerokość źrenicy wynosiła co najmniej 7 mm u 86,7% pacjentów. W badaniach II i III fazy wykazano, że rozszerzenie źrenicy przy zastosowaniu produktu leczniczego Mydrane było stabilne do końca zabiegu chirurgicznego.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlWłaściwości farmakodynamiczne
Wiadomo, że powrót do normalnej szerokości źrenicy osiągany jest po 5-7 godzinach. Skuteczność kliniczna i bezpieczeństwo Skuteczność kliniczna: Działanie rozszerzające źrenice i znieczulające produktu leczniczego Mydrane oceniono w porównaniu do standardowego podawania kropli (fenylefryna i tropikamid) u 555 pacjentów ze źrenicami o szerokości ≥7 mm, u których wykonano operację usunięcia zaćmy po zastosowaniu miejscowego środka rozszerzającego źrenice, w wieloośrodkowym, randomizowanym, otwartym badaniu III fazy. Krople do oczu zawierające 1% tetrakainę podano na 5 minut i na 1 minutę przed rozpoczęciem operacji u obydwu grup. Rozszerzenie źrenic: Produkt leczniczy Mydrane wykazał podobną skuteczność jak leczenie referencyjne (krople do oczu z 0,5% tropikamidu i krople do oczu z 10% fenylefryny, podawanie jednej kropli każdego produktu 3 razy przed operacją) dla głównych i równorzędnych głównych kryteriów skuteczności w zmodyfikowanej populacji ITT (patrz poniższa tabela).
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlWłaściwości farmakodynamiczne
Zmodyfikowana populacja ITT Mydrane Leczenie referencyjne Różnica (%) pomiędzy grupami (Mydrane – leczenie referencyjne) [Przedział ufności 95%] Główne kryterium skuteczności: Liczba (%) osób reagujących* Przedział ufności 95% N=268 265 (98,9) [96,8 ; 99,8] N=281 266 (94,7) [91,3 ; 97,0] 4,2 [-4,2 ; 12,6] Główne równorzędne kryterium skuteczności: Liczba (%) osób reagujących** Przedział ufności 95% N=250 246 (98,4) [96,0 ; 99,6] N=261 246 (94,3) [90,7 ; 96,7] 4,1 [-4,5 ; 12,8] * Osoba reagująca była zdefiniowana jako pacjent, u którego wykonano kapsuloreksję bez zastosowania jakiegokolwiek dodatkowego środka rozszerzającego źrenice. ** Osoba reagująca była zdefiniowana jako pacjent, u którego wykonano kapsuloreksję bez zastosowania jakiegokolwiek dodatkowego środka rozszerzającego źrenice, i u którego szerokość źrenicy tuż przed kapsuloreksją wynosiła ≥ 5,5 mm.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlWłaściwości farmakodynamiczne
W trakcie badania III fazy w grupie otrzymującej Mydrane (N=268) u 197 pacjentów wykonano pojedyncze wstrzyknięcie dokomorowe 200 µl, a u 71 pacjentów dodatkowe wstrzyknięcie dokomorowe o objętości 100 µl, które nie wykazało istotnego dodatkowego wpływu, ale zaobserwowano zwiększoną utratę komórek śródbłonka w tej grupie (patrz też punkt 4.9). Analiza danych pacjentów, którzy otrzymali pojedyncze wstrzyknięcie dokomorowe 200 µl, u których wykonano kapsuloreksję bez zastosowania jakiegokolwiek dodatkowego środka rozszerzającego źrenicę, i u których szerokość źrenic tuż przed kapsuloreksją wynosiła >6 mm, jest przedstawiona w poniższej tabeli. Znieczulenie: Przed wszczepieniem implantu wewnątrzgałkowego komfort pacjentów był statystycznie istotnie lepszy przy zastosowaniu Mydrane (p=0,034). Nie obserwowano statystycznie istotnej różnicy pomiędzy grupami na innych etapach zabiegu chirurgicznego (przed wstrzyknięciem wiskoelastyku, kapsuloreksją i wstrzyknięciem cefuroksymu).
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Brak danych farmakokinetycznych dotyczących oczu przy stosowaniu produktu leczniczego Mydrane. Mydrane 200 µl Leczenie referencyjne Różnica (%) pomiędzy grupami (200 µl Mydrane - leki referencyjne) [Przedział ufności 95%] N Liczba (%) pacjentów bez zastosowania dodatkowego środka rozszerzającego źrenice i z szerokością źrenic tuż przed kapsuloreksją >6 mm Przedział ufności 95% N=181 180 (99,4) [97,0; 100,0] N=261 246 (94,3) [90,7; 96,7] 5,2 [-4,3; 14,6] Po wykonaniu dokomorowej iniekcji Mydrane u 15 pacjentów operowanych z powodu zaćmy porównano stężenia substancji czynnych oznaczonych w osoczu 2, 12 i 30 min. po wstrzyknięciu ze stężeniami w przypadku zastosowania leków o działaniu miejscowym (krople do oczu zawierające 10% fenylefryny i krople do oczu zawierające 0,5% tropikamidu).
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlWłaściwości farmakokinetyczne
W odniesieniu do tropikamidu u wszystkich pacjentów w grupie stosującej Mydrane stężenia były poniżej granicy oznaczalności (<0,1 ng/ml), natomiast u wszystkich pacjentów w grupie referencyjnej stężenie było powyżej tego poziomu. Poziom fenylefryny (granica oznaczania ilościowego <0,1 ng/ml) był praktycznie niewykrywalny u pacjentów w grupie Mydrane z wyjątkiem dwóch pacjentów (maksimum 0,59 ng/ml) w porównaniu do wszystkich pacjentów w grupie referencyjnej z poziomem powyżej granicy oznaczenia ilościowego (maksimum 1,42 ng/ml). Stężenie lidokainy w osoczu było mierzone u wszystkich pacjentów, którym podano Mydrane, z najwyższym stężeniem o wartości 1,45 ng/ml (znacznie poniżej wartości mających pewne działanie ogólnoustrojowe: pomiędzy 1500 i 5000 µg/ml).
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie U królików tolerancja oczna (przeprowadzono badanie w lampie szczelinowej, ocenę tyndalizacji w przedniej komorze, ocenę grubości rogówki, gęstości komórek śródbłonka, elektroretinografię i badanie histologiczne) po pojedynczym podaniu dokomorowym 200 µl Mydrane, z płukaniem lub bez, była bardzo dobra w okresie siedmiu dni po podaniu. Miejscowe objawy nietolerancji były obserwowane jedynie w przypadku produktów z większymi stężeniami tych trzech substancji czynnych (o wartościach będących pięciokrotnością (lub wyższych) stężenia w Mydrane). Najwyższe badane stężenie (dziesięciokrotność) wykazało zwiększenie grubości rogówki i ostre zmiany oczne, które wystąpiły u jednego zwierzęcia, które zostało uśmiercone w 3. dniu. Toksyczność ogólnoustrojowa roztworu zawierającego ustalone stężenia fenylefryny, tropikamidu i lidokainy nie była badana.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlPrzedkliniczne dane o bezpieczeństwie
Jednakże nie przewiduje się szczególnego ryzyka dla tego połączenia, ponieważ profil bezpieczeństwa w przypadku narządu wzroku tych trzech pojedynczych substancji uważa się za ustalony, a produkt leczniczy Mydrane jest podawany tylko w postaci pojedynczego dokomorowego wstrzyknięcia. Podobnie bezpieczeństwo farmakologiczne, genotoksyczność i toksyczność reprodukcyjna pojedynczych substancji tego leku złożonego nie były oceniane. U szczurów podanie fenylefryny (12,5 mg/kg podskórnie) powodowało zmniejszenie szybkości przepływu krwi w macicy (zmniejszenie o 86,8% po około 15 min.), przez co wykazało właściwości toksyczne dla płodu i współwystępujące właściwości teratogenne. Nie obserwowano żadnego działania teratogennego lidokainy w badaniach nad rozwojem zarodka/płodu u szczurów i królików. Toksyczność dla zarodka i zmniejszenie przeżywalności pourodzeniowej były obserwowane tylko przy dawkach toksycznych dla matek. Lidokaina również nie była genotoksyczna.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Disodu fosforan dwunastowodny Disodu fosforan dwuwodny Disodu edetynian Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie podano w literaturze oraz nie stwierdzono w trakcie badań klinicznych żadnej niezgodności z substancjami czynnymi większości produktów powszechnie stosowanych podczas operacji zaćmy. Zostało to również potwierdzone dla zwykle stosowanych materiałów wiskoelastycznych, przez badanie interakcji farmaceutycznych. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Jeden blister Papier/PVC zawierający jedną jałową ampułkę o objętości 1 ml z brunatnego szkła (typ I) napełnioną 0,6 ml roztworu do wstrzykiwań, w tekturowym pudełku.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlDane farmaceutyczne
Oddzielnie dostarczane są jałowe igły z filtrem o średnicy 5 mikrometrów zapakowane w pojedyncze blistry. Pudełko z 20 i 100 jałowymi ampułkami razem z, odpowiednio, 20 i 100 jałowymi igłami z filtrem o średnicy 5 mikrometrów. Zestaw złożony z blistra Papier/PVC zawierającego jedną jałową ampułkę o objętości 1 ml z brunatnego szkła (typ I) napełnioną 0,6 ml roztworu do wstrzykiwań i jedną jałową igłę z filtrem o średnicy 5 mikrometrów. Pudełko z 20 i 100 zestawami (tj. blistrami zawierającymi każdy po jednej jałowej ampułce i jednej jałowej igle z filtrem 5 mikrometrów). Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Tylko do jednorazowego użytku. Użyć niezwłocznie po pierwszym otwarciu ampułki. Tylko w przypadku zestawu (tj. blistra zawierającego ampułkę i igłę): przykleić banderolę (etykietę blistra) w dokumentacji pacjenta.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlDane farmaceutyczne
Ostrzeżenie: Nie używać, jeżeli blister lub zrywalna podklejka są uszkodzone lub rozerwane. Otwierać wyłącznie w warunkach jałowych. Gwarantuje się, że zawartość blistra jest jałowa. Roztwór należy skontrolować wzrokowo i można go zastosować wyłącznie wtedy, gdy jest klarowny i nieznacznie brązowawo-żółty; roztwór powinien być praktycznie wolny od widocznych cząstek. Produkt leczniczy Mydrane musi być podawany we wstrzyknięciu dokomorowym (do komory przedniej oka) przez chirurga okulistę w zalecanych jałowych warunkach podczas operacji zaćmy. Aby przygotować produkt do podania do komory przedniej oka, należy stosować się do następujących instrukcji: Skontrolować nieotwarty blister, aby upewnić się, że jest nienaruszony. Otworzyć blister przez zerwanie folii w warunkach aseptycznych gwarantujących zachowanie sterylności zawartości. Otworzyć jałową ampułkę zawierającą produkt leczniczy przez złamanie.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlDane farmaceutyczne
Ampułka z nacięciem jednopunktowym musi być otwarta w następujący sposób: Przytrzymać dolną część ampułki przy pomocy kciuka skierowanego w stronę barwnego punktu. Uchwycić górę ampułki przy pomocy drugiej ręki umieszczając kciuk przy barwnym punkcie i nacisnąć do tyłu, aby przełamać istniejące nacięcie pod tym punktem. Zamontować jałową igłę z filtrem 5 mikrometrów (dostarczona w zestawie) na jałowej strzykawce. Zdjąć zabezpieczenie jałowej igły z filtrem o średnicy 5 mikrometrów i pobrać co najmniej 0,2 ml roztworu do wstrzykiwań z ampułki. Odłączyć igłę od strzykawki i nałożyć na strzykawkę odpowiednią kaniulę przeznaczoną do podawania do przedniej komory oka. Ostrożnie usunąć powietrze ze strzykawki. Wyregulować objętość do 0,2 ml. Strzykawka jest gotowa do wstrzyknięcia. Powoli wstrzyknąć zawartość strzykawki o objętości 0,2 ml do przedniej komory oka, wykonując pojedynczą iniekcję przez nacięcie boczne lub nacięcie główne.
- CHPL leku Mydrane, roztwór do wstrzykiwań, (0,2 mg + 3,1 mg + 10 mg)/mlDane farmaceutyczne
Po użyciu należy odpowiednio zutylizować pozostałość przygotowanego roztworu. Nie należy przechowywać pozostałości roztworu w celu późniejszego użycia. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami. Zużyte igły należy wyrzucić do pojemnika na ostre odpady medyczne.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Lidocaine Accord, 10 mg/ml, roztwór do wstrzykiwań Lidocaine Accord, 20 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 10 mg/ml: 1 ml roztworu zawiera 10 mg lidokainy chlorowodorku. Jedna fiolka 2 ml zawiera 20 mg lidokainy chlorowodorku Jedna fiolka 5 ml zawiera 50 mg lidokainy chlorowodorku Jedna fiolka 10 ml zawiera 100 mg lidokainy chlorowodorku Jedna fiolka 20 ml zawiera 200 mg lidokainy chlorowodorku 20 mg/ml: 1 ml roztworu zawiera 20 mg lidokainy chlorowodorku. Jedna fiolka 2 ml zawiera 40 mg lidokainy chlorowodorku Jedna fiolka 5 ml zawiera 100 mg lidokainy chlorowodorku Jedna fiolka 10 ml zawiera 200 mg lidokainy chlorowodorku Jedna fiolka 20 ml zawiera 400 mg lidokainy chlorowodorku Substancje pomocnicze o znanym działaniu: 10 mg/ml: 1 ml roztworu zawiera około 0,118 mmola sodu 20 mg/ml: 1 ml roztworu zawiera około 0,082 mmola sodu Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań Roztwór przejrzysty, bezbarwny, bez widocznych cząstek stałych. pH roztworu: 4,0-5,5 Osmolalność roztworu: 270-320 mOsmol/kg H2O.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy Lidocaine Accord wskazany jest do znieczulenia nasiękowego, dożylnego znieczulenia miejscowego, blokady nerwów i znieczulenia nadtwardówkowego. Produkt leczniczy Lidocaine Accord 10 mg/ml jest przeznaczony do stosowania u dorosłych i dzieci w wieku powyżej 1 roku życia. Produkt leczniczy Lidocaine Accord 20 mg/ml jest przeznaczony do stosowania u dorosłych.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Produkt leczniczy Lidocaine Accord powinien być stosowany wyłącznie przez lub pod nadzorem lekarza posiadającego doświadczenie w podawaniu znieczulenia miejscowego oraz prowadzeniu resuscytacji. Niezbędny sprzęt do resuscytacji powinien być dostępny podczas podawania znieczulenia miejscowego. Należy podawać najmniejszą możliwą dawkę zapewniającą uzyskanie pożądanego działania. Poniższa tabela może służyć, jako wytyczne dotyczące dawkowania dla pacjentów o masie ciała około 70 kg. Dawkę należy dostosować w zależności od wieku, masy ciała i stanu pacjenta. Droga podania lub procedura Znieczulenie nasiękowe: Małe procedury: 10 mg/ml, 2-10 ml, 20-100 mg Duże procedury: 10 mg/ml, 10-20 ml, 100-200 mg 20 mg/ml, 5-10 ml, 100-200 mg Dożylne znieczulenie miejscowe: Kończyna górna: 10 mg/ml, 10-20 ml, 100-200 mg 20 mg/ml, 5-10 ml, 100-200 mg Kończyna dolna: 10 mg/ml, 20 ml, 200 mg 20 mg/ml, 10 ml, 200 mg Blokada nerwów: 10 mg/ml, 2-20 ml, 20-200 mg 20 mg/ml, 1-10 ml, 20-200 mg Znieczulenie nadtwardówkowe: Znieczulenie lędźwiowe: 10 mg/ml, 25-40 ml, 250-400 mg 20 mg/ml, 12,5-20 ml, 250-400 mg Znieczulenie w odcinku piersiowym: 10 mg/ml, 20-30 ml, 200-300 mg 20 mg/ml, 10-15 ml, 200-300 mg Znieczulenie krzyżowe w chirurgii: 10 mg/ml, 40 ml, 400 mg 20 mg/ml, 20 ml, 400 mg Znieczulenie krzyżowe w położnictwie: 10 mg/ml, 20-30 ml, 200-300 mg 20 mg/ml, 10-15 ml, 200-300 mg Maksymalna pojedyncza dawka lidokainy chlorowodorku nie może przekroczyć 400 mg.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
Dzieci i młodzież Dawkę należy zmniejszyć w przypadku podawania dzieciom oraz pacjentom w złym stanie ogólnym. Szczególną ostrożność należy zachować w trakcie leczenia dzieci w wieku poniżej 4 lat. Ilość leku, która ma być wstrzyknięta powinna być określona na podstawie wieku, masy ciała dziecka i rozległości planowanego zabiegu. Należy starannie dobierać metodę znieczulenia, unikając metod bolesnych. W trakcie podawania znieczulenia należy ze szczególną uwagą obserwować zachowanie dziecka. Zazwyczaj podawana pojedyncza dawka mieści się w granicach od 20 mg do 30 mg lidokainy chlorowodorku. Dawkę lidokainy chlorowodorku (w mg), jaka ma być podana dziecku można również wyliczyć ze wzoru: masa ciała dziecka (w kg) x 1,33. Nie należy przekraczać dawki 5 mg lidokainy chlorowodorku na kilogram masy ciała. Nie zaleca się stosowania iniekcji lidokainy u noworodków (patrz punkt 5.2).
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlDawkowanie
Optymalne stężenie w osoczu pozwalające uniknąć wystąpienia objawów toksyczności takich jak drgawki i zaburzenia rytmu serca dla takich pacjentów nie jest znane. Specjalne grupy pacjentów Należy zmniejszyć dawkę u pacjentów z niewydolnością nerek, wątroby, u osób w podeszłym wieku, proporcjonalnie do wieku i stanu ogólnego pacjenta (patrz punkt 4.4). Sposób podawania Sposób podawania lidokainy różni się w zależności od typu znieczulenia (znieczulenie nasiękowe, dożylne znieczulenie miejscowe, blokada nerwów, znieczulenie nadtwardówkowe). Lidokaina Accord może być podawana dożylnie, domięśniowo, podskórnie i nadtwardówkowo.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, leki znieczulające miejscowo o budowie amidowej lub na którąkolwiek substancję pomocniczą, wymienioną w punkcie 6.1. Produktu Lidocaine Accord nie należy stosować do znieczulenia nadtwardówkowego u pacjentów ze znacząco obniżonym ciśnieniem lub we wstrząsie kardiogennym lub hipowolemicznym.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Z wyjątkiem najprostszych procedur, procedury regionalne i lokalne podawania, znieczulenie należy zawsze prowadzić przy zapewnieniu odpowiedniego sprzętu do resuscytacji. Przy jakiejkolwiek dużej blokadzie, należy przed wprowadzeniem leku miejscowo znieczulającego wprowadzić do żyły kaniulę. Jak każdy lek miejscowo znieczulający, lidokaina, jeżeli jej stężenie we krwi będzie duże może powodować ostre reakcje toksyczności ze strony centralnego układu nerwowego oraz układu sercowo-naczyniowego, szczególnie podczas podania dożylnego. Szczególną ostrożność należy zachować w przypadku znieczulania następujących grup pacjentów: pacjenci w podeszłym wieku i w złym stanie ogólnym, pacjenci z blokiem AV typu II i III, ponieważ miejscowe znieczulenie może powodować osłabienie przewodzenia w mięśniu sercowym, pacjenci z zastoinową niewydolnością serca, bradykardią, zaburzoną czynnością oddechową, pacjenci z ciężką chorobą wątroby lub niewydolnością nerek, pacjenci z padaczką, pacjenci z koagulopatią.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Leczenie lekami przeciwzakrzepowymi np. heparyną, niesteroidowymi lekami przeciwzapalnymi lub substytutami osocza nasila skłonność do krwawień. Przypadkowe uszkodzenie naczynia krwionośnego może prowadzić do ciężkich krwawień. W razie konieczności należy oznaczyć czas krwawienia, czas częściowej tromboplastyny po aktywacji (ang. aPTT- activated partial thromboplastin time), wskaźnik Quicka i liczbę płytek krwi. Pacjentki w trzecim trymestrze ciąży Pacjenci leczeni lekami przeciwarytmicznymi klasy III (np. amiodaronem), którzy wymagają stałego monitorowania w tym monitorowania EKG, ponieważ działanie lidokainy na mięsień sercowy może nasilać się podczas stosowania leków przeciwarytmicznych klasy III (patrz punkt 4.5). Po wprowadzeniu produktu do obrotu zgłaszano przypadki chondrolizy u pacjentów otrzymujących pooperacyjnie, dostawowo ciągły wlew leków miejscowo znieczulających. Większość przypadków chondrolizy dotyczyła stawu barkowego.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Z powodu wielu czynników przyczynowych i sprzecznych danych w literaturze naukowej, dotyczących mechanizmu działania, częstość występowania nie została ustalona. Dostawowa ciągła infuzja nie jest zatwierdzonym sposobem podania lidokainy. Znieczulenie nadtwardówkowe może powodować ciężkie działania niepożądane takie jak niewydolność sercowo-naczyniowa, szczególnie przy współistniejącej hipowolemii. Szczególne środki ostrożności należy zachować zawsze u pacjentów z zaburzoną czynnością układu sercowo-naczyniowego. Głównymi przyczynami są pourazowe uszkodzenia nerwów i (lub) miejscowy, toksyczny wpływ na mięśnie i nerwy spowodowany znieczuleniem miejscowym. Urazowe uszkodzenia nerwów i (lub) miejscowe, toksyczne działanie na mięśnie i nerwy spowodowane są głównie przez wstrzyknięcie znieczulenia miejscowego. Zakres tych uszkodzeń zależy od ciężkości urazów, stężenia leku miejscowo znieczulającego oraz czasu jego oddziaływania na poszczególne tkanki.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Dlatego należy stosować zawsze najmniejszą skuteczną dawkę. Przypadkowe wstrzyknięcia dożylne w obrębie głowy i szyi mogą powodować wystąpienie objawów mózgowych, nawet po zastosowaniu małych dawek. Lek podany pozagałkowo, może w bardzo rzadkich przypadkach przeniknąć do przestrzeni podpajęczynówkowej mózgu powodując nasilone/ciężkie reakcje takie jak zapaść krążeniowa, bezdech, drgawki i czasową ślepotę. W przypadku znieczulenia okołogałkowego i pozagałkowego istnieje ryzyko trwałego zaburzenia czynności mięśni oka. Jest to związane przede wszystkim z uszkodzeniem i (lub) miejscowym działaniem toksycznym na nerw i (lub) mięśnie. Skuteczność znieczulenia miejscowego może się zmniejszyć po wstrzyknięciu w obszar zakażony lub zmieniony zapalnie. Domięśniowo podana lidokaina może powodować zwiększenie stężenia fosfokinazy kreatynowej, co może mieć wpływ na diagnozę ostrego zawału mięśnia sercowego.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlSpecjalne środki ostrozności
Wykazano porfiriogenne działanie lidokaniny u zwierząt, dlatego nie powinna być ona stosowana u pacjentów z ostrą porfirią, chyba, że jest to absolutnie konieczne. Szczególną ostrożność należy zachować podczas stosowania lidokainy u pacjentów z porfirią. Znieczulenie nadtwardówkowe może prowadzić do niedociśnienia i bradykardii. Ryzyko to zmniejsza podanie dożylne roztworów krystaloidów lub koloidów. Spadek ciśnienia krwi wymaga natychmiastowego zastosowania np. efedryny 5-10 mg dożylnie, powtórzonego, jeśli konieczne. Znieczulenie okołoszyjkowe może czasami powodować bradykardię lub tachykardię u płodu, dlatego konieczne jest uważne monitorowanie tętna płodu (patrz punkt 4.6). Jeden ml roztworu do wstrzykiwań zawiera około 0,118 mmola sodu (w przypadku użycia roztworu o mocy 10 mg/ml) lub 0,082 mmola sodu (w przypadku użycia roztworu o mocy 20 mg/ml). Należy to wziąć pod uwagę przez osoby kontrolujące zawartość sodu w diecie.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Leki spowalniające metabolizm lidokainy (np. cymetydyna) mogą powodować uzyskanie potencjalnie toksycznego stężenia lidokainy w osoczu, w przypadku szybkiego podania dużych dawek przez dłuższy czas. Efekt ten nie ma klinicznego znaczenia, jeśli lidokaina podawana jest w krótkim czasie w zalecanych dawkach. Lidokainę należy stosować ostrożnie w skojarzeniu z innymi lekami miejscowo znieczulającymi oraz lekami przeciwarytmicznymi klasy IB, jako że sumują się działania toksyczne obu leków. Dotychczas nie zostały przeprowadzone badania specyficznych interakcji z lekami miejscowo znieczulającymi i lekami przeciwarytmicznymi klasy III (np. amiodaronem), jednak zalecana jest ostrożność w tych przypadkach (patrz punkt 4.4).
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich danych dotyczących stosowania lidokainy u kobiet w ciąży. Lidokaina przenika przez łożysko (patrz punkt 5.2). Można przyjąć, że lidokaina była stosowana u dużej liczby kobiet w ciąży i kobiet w wieku rozrodczym. Nie ma dowodów, że lidokaina zaburza procesy rozmnażania lub zwiększa ilość przypadków wystąpienia wad rozwojowych, czy w jakikolwiek pośredni lub bezpośredni sposób oddziałuje na płód. Jednakże nie przeprowadzono dostatecznych badań ryzyka u ludzi. Badania na zwierzętach wykazały szkodliwy wpływ lidokainy na reprodukcję (patrz punkt 5.3). W przypadku krótkotrwałego stosowania lidokainy podczas ciąży i porodu należy rozważyć czy oczekiwane korzyści przeważają potencjalne ryzyko. Zastosowanie lidokainy do znieczulenia okołoszyjkowego lub znieczulenia sromu podczas porodu zwiększa ryzyko wystąpienia u płodu reakcji takich jak bradykardia/tachykardia.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlWpływ na płodność, ciążę i laktację
Dlatego należy starannie monitorować tętno płodu (patrz punkt 5.2). Karmienie piersi? Lidokaina przenika w małym stopniu do mleka kobiecego. Wpływ na dziecko jest nieznaczny, podczas stosowania zalecanych dawek. Dlatego nie ma potrzeby przerwania karmienia piersią w trakcie stosowania Lidocaine Accord.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn W zależności od dawki i drogi podania, lidokaina może czasowo wpływać na ruch i koordynację, wpływając tym samym na zdolność prowadzenia pojazdów i obsługiwania maszyn. Należy poinformować pacjentów, że powinni unikać tych aktywności do czasu powrotu prawidłowego funkcjonowania organizmu.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane spowodowane wyłącznie przez lidokainę są trudne do odróżnienia od fizjologicznych skutków blokady nerwowej (np. niedociśnienie, bradykardia) oraz stanów spowodowanych bezpośrednio przez wkłucie igły (np. uszkodzenie nerwów) lub pośrednio (np. ropień nadtwardówkowy). Bardzo często (≥1/10) Zaburzenia naczyniowe: Niedociśnienie Zaburzenia żołądka i jelit: Nudności Często (≥1/100 do <1/10) Zaburzenia układu nerwowego: Parestezje, zawroty głowy Zaburzenia serca: Bradykardia Zaburzenia naczyniowe: Nadciśnienie Zaburzenia żołądka i jelit: Wymioty Niezbyt często (≥1/1000 do <1/100) Zaburzenia układu nerwowego: Objawy toksycznego działania na OUN (drgawki, parestezje wokół ust, drętwienie języka, nadwrażliwość na dźwięki, zaburzenia widzenia, utrata przytomności, drżenie mięśniowe, senność, oszołomienie, szumy uszne, uczucie zatrucia, zaburzenia mowy) Rzadko (≥1/10 000 do <1/1000) Zaburzenia układu immunologicznego: Reakcje nadwrażliwości, pokrzywka, wysypka, obrzęk naczynioruchowy, w ciężkich przypadkach wstrząs anafilaktyczny Zaburzenia układu nerwowego: Neuropatia, uszkodzenie nerwów obwodowych, zapalenie pajęczynówki Zaburzenia oka: Podwójne widzenie Zaburzenia serca: Zatrzymanie akcji serca, zaburzenia rytmu Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Zahamowanie oddychania Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa tel.: + 48 22 49 21 301 faks: + 48 22 49 21 309 strona internetowa: https://smz.ezdrowie.gov.pl
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlPrzedawkowanie
4.9 Przedawkowanie W sporadycznych przypadkach wstrzyknięcie dożylne leku miejscowo znieczulającego może spowodować natychmiastową ogólną reakcję toksyczności (w ciągu kilku sekund lub minut). Objawy te w wyniku przedawkowania występują znacznie później (15-60 minut po wstrzyknięciu), w wyniku stopniowego narastania we krwi stężenia leku miejscowo znieczulającego (patrz punkt 4.8). Jeżeli wystąpią objawy zatrucia ogólnoustrojowego należy natychmiast przerwać podawanie leku. Toksyczność: Podanie doustne: podanie mniej niż 50 mg wydaje się nie być ryzykowne dla małych dzieci. 75 mg dla 2-letniego dziecka zmniejszało ból, 100 mg dla 5-miesięcznego dziecka spowodowało ciężkie zatrucie, 300 mg + 300 mg w ciągu 4 godzin dla 3,5-letniego dziecka spowodowało ciężkie do bardzo ciężkiego zatrucie, 400-500 mg dla 2-letniego dziecka i 1 g na 12 godzin dla rocznego dziecka spowodowało bardzo ciężkie zatrucie.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlPrzedawkowanie
600 mg dla osoby dorosłej zmniejszało ból, 2 g dla dorosłego spowodowało umiarkowane zatrucie. Podanie pozajelitowe: 50 mg dożylnie dla 1-miesięcznego dziecka spowodowało bardzo ciężkie zatrucie. 200-400 mg podane miejscowo poprzez infiltrację u dorosłego spowodowało ciężkie zatrucie, 500 mg dla osób w wieku powyżej 80 lat i 1 g dożylnie dla osób dorosłych spowodowało bardzo ciężkie zatrucie. Podanie miejscowe: 8,6-17,2 mg/kg dla młodych dzieci, gdy zastosowano do ran po oparzeniach skóry, powodowało ciężkie zatrucie. Objawy Najpierw występują objawy pobudzenia ośrodkowego układu nerwowego, a następnie zahamowanie. Po dużych dawkach szybkie wystąpienie drgawek może być pierwszym objawem. Innymi objawami po przedawkowaniu mogą być: uczucie zmęczenia, zawroty głowy, zaburzenia widzenia, parestezje wokół ust, nudności. Dalszymi objawami są: ataksja, zmiany nastroju, euforia, splątanie, trudności w mówieniu, bladość, nadmierne pocenie, drżenie, drgawki, śpiączka, zatrzymanie oddechu.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlPrzedawkowanie
Po dużych dawkach mogą wystąpić: zaburzenia rytmu serca, szczególnie bradykardia, także tachykardia komorowa, migotanie komór, poszerzenie QRS, AV blok przedsionkowo-komorowy, niewydolność serca, niedociśnienie (opisywano pojedyncze przypadki methemoglobinemii). Leczenie Węgiel aktywowany w przypadku doustnego przedawkowania. Prowokowanie wymiotów może być niebezpieczne ze względu na ryzyko znieczulenia śluzówki i drgawek na wczesnym etapie. Jeśli płukanie żołądka jest konieczne, powinno zostać przeprowadzone za pomocą rurki i po intubacji dotchawiczej. W przypadku przedawkowania należy natychmiast podjąć kroki w celu zapewnienia właściwego krążenia i oddychania oraz kontrolowania drgawek. Należy podać pacjentowi tlen i stosować wspomagające wentylowanie, jeżeli konieczne. Krążenie należy utrzymywać poprzez wlew dożylny płynów, dobutaminy i jeśli konieczne noradrenaliny (początkowo 0,05 μg/kg mc./min, zwiększając w razie potrzeby o dalsze 0,05 μg/kg mc./min.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlPrzedawkowanie
co 10 minut), jednocześnie ze stałym monitoringiem hemodynamicznym w cięższych przypadkach. Można także zastosować efedrynę. Drgawki można opanować podając dożylnie diazepam lub sodu tiopental, mając na uwadze, że leki przeciwdrgawkowe mogą spowodować depresję oddychania oraz krążenia. W przypadku wystąpienia bradykardii można zastosować atropinę. Jeżeli nastąpi zatrzymanie akcji serca należy zastosować standardowe procedury resuscytacji. Dializa w przypadkach ostrego przedawkowania nie jest skuteczna.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki miejscowo znieczulające, amidy; kod ATC: N01B B02 Lidokaina jest lekiem miejscowo znieczulającym o budowie amidowej. Mechanizm działania opiera się na zmniejszeniu przepuszczalności błony neuronu dla jonów sodowych. W konsekwencji następuje zmniejszenie szybkości depolaryzacji błony, zwiększa się próg pobudzenia, co powoduje odwracalne miejscowe znieczulenie. Lek stosowany jest w celu uzyskania znieczulenia miejscowego poprzez blokadę nerwów w różnych częściach ciała, a także kontroli arytmii. Działa poprzez hamowanie przepływu jonów niezbędnych do powstania i rozprzestrzeniania się bodźców stabilizując błonę neuronu. Oprócz blokowania przewodzenia bodźców nerwowych w obwodowym układzie nerwowym, lidokaina ma istotny wpływ na ośrodkowy układ nerwowy i układ sercowo-naczyniowy.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakodynamiczne
Po wchłonięciu lidokaina może powodować pobudzenie OUN, a następnie jego zahamowanie; na układ sercowo-naczyniowy działa głównie na mięsień sercowy, gdzie może powodować zmniejszenie pobudliwości elektrycznej, szybkości przewodzenia oraz siły skurczu. Działanie znieczulające rozpoczyna się szybko (około minutę po wstrzyknięciu dożylnym i piętnastu minutach po wstrzyknięciu domięśniowym) oraz szybko rozprzestrzenia się w tkankach otaczających. Działanie znieczulające utrzymuje się około dziesięciu do dwudziestu minut po podaniu dożylnym i około sześćdziesięciu do dziewięćdziesięciu minut po podaniu domięśniowym.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Szybkość wchłaniania zależy od wielkości dawki, drogi podania i perfuzji w miejscu podania. Blokada nerwów międzyżebrowych prowadzi do największego stężenia w osoczu (ok. 1,5 μg/ml na 100 mg wstrzykniętych), podczas gdy wstrzyknięcie podskórne w obrębie brzucha prowadzi do najmniejszego stężenia w osoczu (ok. 0,5 μg/ml na 100 mg wstrzykniętych). Objętość dystrybucji w stanie równowagi wynosi 91 litrów, natomiast wiązanie z białkami osocza głównie z kwasem alfa-1- glikoproteinowym wynosi 65%. Z przestrzeni nadtwardówkowej wchłanianie jest całkowite i dwufazowe z okresem półtrwania odpowiednio ok. 9,3 minut i 82 minuty. Powolne wchłanianie jest czynnikiem limitującym czas eliminacji lidokainy, co wyjaśnia wolniejszą eliminację po wstrzyknięciu nadtwardówkowo niż po podaniu dożylnym. Eliminacja lidokainy następuje głównie poprzez metabolizm, szczególnie poprzez dealkilację do monoetyloglicynoksylidydu (MEGX) katalizowanego za pomocą CYP1A2 oraz CYP3A4.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakokinetyczne
MEGX jest metabolizowany do 2,6–dimetyloaniliny i ksylidydu glicyny (GX). 2,6-dimetyloanilina jest dalej przekształcana za pomocą CYP2A6 do 4-hydroksy-2,6-dimetyloaniliny, która jest głównym metabolitem wydalanym z moczem (80%) w postaci koniugatu. MEGX wykazuje działanie prodrgawkowe, podobnie do lidokainy, podczas gdy GX nie wykazuje takiej aktywności. MEGX występuje w osoczu w podobnych stężeniach jak substancja wyjściowa. Szybkość eliminacji lidokainy i MEGX wynosi po podaniu dożylnym odpowiednio 1,5-2 godzin i 2,5 godziny. Ze względu na szybki metabolizm w wątrobie, kinetyka zależy od stanu wątroby. Okres półtrwania może być dwukrotnie dłuższy u pacjentów z niewydolnością wątroby. Niewydolność nerek nie wpływa na kinetykę, ale może powodować kumulację metabolitów we krwi. Lidokaina przenika przez barierę łożyska i u płodu stężenie we krwi niezwiązanej lidokainy jest takie samo jak w organizmie matki.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlWłaściwości farmakokinetyczne
Jednakże, całkowite stężenie w osoczu będzie mniejsze u płodu, ze względu na mniejsze wiązanie z białkami.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach objawy toksyczności po zastosowaniu dużych dawek lidokainy dotyczyły ośrodkowego układu nerwowego i układu sercowo-naczyniowego. W badaniach toksyczności reprodukcyjnej u królików wykazano toksyczne działanie lidokainy na zarodek i płód po podaniu podskórnie dawki 25 mg/kg. W dawkach mniejszych niż dawki toksyczne dla matki u szczurów, lidokaina nie ma wpływu na pourodzeniowy rozwój potomstwa. Nie zaobserwowano wpływu lidokainy na płodność samic i samców szczura. Lidokaina przenika przez barierę łożyskową drogą dyfuzji prostej. W przeprowadzonych badaniach in vitro i in vivo lidokaina nie wykazała właściwości genotoksycznych, aczkolwiek jeden z jej metabolitów - 2,6-dimetyloanilina wykazuje taki potencjał. Nie przeprowadzono badań rakotwórczości lidokainy. 2,6-dimetyloanilina wykazała działanie rakotwórcze w przedklinicznych badaniach toksykologicznych oceniających skutki przewlekłej ekspozycji na lek.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlPrzedkliniczne dane o bezpieczeństwie
Kliniczne znaczenie tej obserwacji nie jest znane.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Sodu wodorotlenek Kwas solny stężony Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne W związku z brakiem badań dotyczących zgodności, produktu leczniczego nie wolno mieszać z innymi produktami leczniczymi. 6.3 Okres ważności 3 lata Należy zużyć bezpośrednio po pierwszym otwarciu. 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących warunków przechowywania. 6.5 Rodzaj i zawartość opakowania Produkt leczniczy pakowany jest we fiolki lub ampułki. Ampułka z przezroczystego szkła typu I. Fiolka z przezroczystego szkła typu I, zamknięta korkiem z gumy chlorobutylowej i aluminiowym uszczelnieniem (zamknięcie typu flip-off). Lidocaine Accord, 10 mg/mL jest dostępny w opakowaniach: 5 ampułek po 2 mL, w tekturowym pudełku 10 ampułek po 2 mL, w tekturowym pudełku 20 ampułek po 2 mL, w tekturowym pudełku 5 ampułek po 5 mL, w tekturowym pudełku 10 ampułek po 5 mL, w tekturowym pudełku 20 ampułek po 5 mL, w tekturowym pudełku 10 ampułek po 10 mL, w tekturowym pudełku 20 ampułek po 10 mL w tekturowym pudełku 1 fiolka po 20 mL, w tekturowym pudełku Lidocaine Accord, 20 mg/ml jest dostępny w opakowaniach: 5 ampułek po 2 mL, w tekturowym pudełku 10 ampułek po 2 mL, w tekturowym pudełku 20 ampułek po 2 mL, w tekturowym pudełku 5 ampułek po 5 mL, w tekturowym pudełku 10 ampułek po 5 mL, w tekturowym pudełku 20 ampułek po 5 mL, w tekturowym pudełku 5 ampułek po 10 mL, w tekturowym pudełku 10 ampułek po 10 mL, w tekturowym pudełku 20 ampułek po 10 mL w tekturowym pudełku 1 fiolka po 20 mL, w tekturowym pudełku Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 10 mg/mlDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Stosować zgodnie z zaleceniami lekarza. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Wyłącznie do jednorazowego użytku. Niewykorzystaną cześć roztworu należy zniszczyć. Roztworu nie należy używać, jeśli widoczne są stałe cząstki.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Lidocaine Accord, 10 mg/ml, roztwór do wstrzykiwań Lidocaine Accord, 20 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 10 mg/ml: 1 ml roztworu zawiera 10 mg lidokainy chlorowodorku. Jedna fiolka 2 ml zawiera 20 mg lidokainy chlorowodorku Jedna fiolka 5 ml zawiera 50 mg lidokainy chlorowodorku Jedna fiolka 10 ml zawiera 100 mg lidokainy chlorowodorku Jedna fiolka 20 ml zawiera 200 mg lidokainy chlorowodorku 20 mg/ml: 1 ml roztworu zawiera 20 mg lidokainy chlorowodorku. Jedna fiolka 2 ml zawiera 40 mg lidokainy chlorowodorku Jedna fiolka 5 ml zawiera 100 mg lidokainy chlorowodorku Jedna fiolka 10 ml zawiera 200 mg lidokainy chlorowodorku Jedna fiolka 20 ml zawiera 400 mg lidokainy chlorowodorku Substancje pomocnicze o znanym działaniu: 10 mg/ml: 1 ml roztworu zawiera około 0,118 mmola sodu 20 mg/ml: 1 ml roztworu zawiera około 0,082 mmola sodu Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań Roztwór przejrzysty, bezbarwny, bez widocznych cząstek stałych. pH roztworu: 4,0-5,5 Osmolalność roztworu: 270-320 mOsmol/kg H2O.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy Lidocaine Accord wskazany jest do znieczulenia nasiękowego, dożylnego znieczulenia miejscowego, blokady nerwów i znieczulenia nadtwardówkowego. Produkt leczniczy Lidocaine Accord 10 mg/ml jest przeznaczony do stosowania u dorosłych i dzieci w wieku powyżej 1 roku życia. Produkt leczniczy Lidocaine Accord 20 mg/ml jest przeznaczony do stosowania u dorosłych.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Produkt leczniczy Lidocaine Accord powinien być stosowany wyłącznie przez lub pod nadzorem lekarza posiadającego doświadczenie w podawaniu znieczulenia miejscowego oraz prowadzeniu resuscytacji. Niezbędny sprzęt do resuscytacji powinien być dostępny podczas podawania znieczulenia miejscowego. Należy podawać najmniejszą możliwą dawkę zapewniającą uzyskanie pożądanego działania. Poniższa tabela może służyć, jako wytyczne dotyczące dawkowania dla pacjentów o masie ciała około 70 kg. Dawkę należy dostosować w zależności od wieku, masy ciała i stanu pacjenta. Droga podania lub procedura Znieczulenie nasiękowe: Małe procedury: 10 mg/ml, 2-10 ml, 20-100 mg Duże procedury: 10 mg/ml, 10-20 ml, 100-200 mg 20 mg/ml, 5-10 ml, 100-200 mg Dożylne znieczulenie miejscowe: Kończyna górna: 10 mg/ml, 10-20 ml, 100-200 mg 20 mg/ml, 5-10 ml, 100-200 mg Kończyna dolna: 10 mg/ml, 20 ml, 200 mg 20 mg/ml, 10 ml, 200 mg Blokada nerwów: 10 mg/ml, 2-20 ml, 20-200 mg 20 mg/ml, 1-10 ml, 20-200 mg Znieczulenie nadtwardówkowe: Znieczulenie lędźwiowe: 10 mg/ml, 25-40 ml, 250-400 mg 20 mg/ml, 12,5-20 ml, 250-400 mg Znieczulenie w odcinku piersiowym: 10 mg/ml, 20-30 ml, 200-300 mg 20 mg/ml, 10-15 ml, 200-300 mg Znieczulenie krzyżowe w chirurgii: 10 mg/ml, 40 ml, 400 mg 20 mg/ml, 20 ml, 400 mg Znieczulenie krzyżowe w położnictwie: 10 mg/ml, 20-30 ml, 200-300 mg 20 mg/ml, 10-15 ml, 200-300 mg Maksymalna pojedyncza dawka lidokainy chlorowodorku nie może przekroczyć 400 mg.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Dzieci i młodzież Dawkę należy zmniejszyć w przypadku podawania dzieciom oraz pacjentom w złym stanie ogólnym. Szczególną ostrożność należy zachować w trakcie leczenia dzieci w wieku poniżej 4 lat. Ilość leku, która ma być wstrzyknięta powinna być określona na podstawie wieku, masy ciała dziecka i rozległości planowanego zabiegu. Należy starannie dobierać metodę znieczulenia, unikając metod bolesnych. W trakcie podawania znieczulenia należy ze szczególną uwagą obserwować zachowanie dziecka. Zazwyczaj podawana pojedyncza dawka mieści się w granicach od 20 mg do 30 mg lidokainy chlorowodorku. Dawkę lidokainy chlorowodorku (w mg), jaka ma być podana dziecku można również wyliczyć ze wzoru: masa ciała dziecka (w kg) x 1,33. Nie należy przekraczać dawki 5 mg lidokainy chlorowodorku na kilogram masy ciała. Nie zaleca się stosowania iniekcji lidokainy u noworodków (patrz punkt 5.2).
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlDawkowanie
Optymalne stężenie w osoczu pozwalające uniknąć wystąpienia objawów toksyczności takich jak drgawki i zaburzenia rytmu serca dla takich pacjentów nie jest znane. Specjalne grupy pacjentów Należy zmniejszyć dawkę u pacjentów z niewydolnością nerek, wątroby, u osób w podeszłym wieku, proporcjonalnie do wieku i stanu ogólnego pacjenta (patrz punkt 4.4). Sposób podawania Sposób podawania lidokainy różni się w zależności od typu znieczulenia (znieczulenie nasiękowe, dożylne znieczulenie miejscowe, blokada nerwów, znieczulenie nadtwardówkowe). Lidokaina Accord może być podawana dożylnie, domięśniowo, podskórnie i nadtwardówkowo.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, leki znieczulające miejscowo o budowie amidowej lub na którąkolwiek substancję pomocniczą, wymienioną w punkcie 6.1. Produktu Lidocaine Accord nie należy stosować do znieczulenia nadtwardówkowego u pacjentów ze znacząco obniżonym ciśnieniem lub we wstrząsie kardiogennym lub hipowolemicznym.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Z wyjątkiem najprostszych procedur, procedury regionalne i lokalne podawania, znieczulenie należy zawsze prowadzić przy zapewnieniu odpowiedniego sprzętu do resuscytacji. Przy jakiejkolwiek dużej blokadzie, należy przed wprowadzeniem leku miejscowo znieczulającego wprowadzić do żyły kaniulę. Jak każdy lek miejscowo znieczulający, lidokaina, jeżeli jej stężenie we krwi będzie duże może powodować ostre reakcje toksyczności ze strony centralnego układu nerwowego oraz układu sercowo-naczyniowego, szczególnie podczas podania dożylnego. Szczególną ostrożność należy zachować w przypadku znieczulania następujących grup pacjentów: pacjenci w podeszłym wieku i w złym stanie ogólnym, pacjenci z blokiem AV typu II i III, ponieważ miejscowe znieczulenie może powodować osłabienie przewodzenia w mięśniu sercowym, pacjenci z zastoinową niewydolnością serca, bradykardią, zaburzoną czynnością oddechową, pacjenci z ciężką chorobą wątroby lub niewydolnością nerek, pacjenci z padaczką, pacjenci z koagulopatią.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Leczenie lekami przeciwzakrzepowymi np. heparyną, niesteroidowymi lekami przeciwzapalnymi lub substytutami osocza nasila skłonność do krwawień. Przypadkowe uszkodzenie naczynia krwionośnego może prowadzić do ciężkich krwawień. W razie konieczności należy oznaczyć czas krwawienia, czas częściowej tromboplastyny po aktywacji (ang. aPTT- activated partial thromboplastin time), wskaźnik Quicka i liczbę płytek krwi. Pacjentki w trzecim trymestrze ciąży Pacjenci leczeni lekami przeciwarytmicznymi klasy III (np. amiodaronem), którzy wymagają stałego monitorowania w tym monitorowania EKG, ponieważ działanie lidokainy na mięsień sercowy może nasilać się podczas stosowania leków przeciwarytmicznych klasy III (patrz punkt 4.5). Po wprowadzeniu produktu do obrotu zgłaszano przypadki chondrolizy u pacjentów otrzymujących pooperacyjnie, dostawowo ciągły wlew leków miejscowo znieczulających. Większość przypadków chondrolizy dotyczyła stawu barkowego.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Z powodu wielu czynników przyczynowych i sprzecznych danych w literaturze naukowej, dotyczących mechanizmu działania, częstość występowania nie została ustalona. Dostawowa ciągła infuzja nie jest zatwierdzonym sposobem podania lidokainy. Znieczulenie nadtwardówkowe może powodować ciężkie działania niepożądane takie jak niewydolność sercowo-naczyniowa, szczególnie przy współistniejącej hipowolemii. Szczególne środki ostrożności należy zachować zawsze u pacjentów z zaburzoną czynnością układu sercowo-naczyniowego. Głównymi przyczynami są pourazowe uszkodzenia nerwów i (lub) miejscowy, toksyczny wpływ na mięśnie i nerwy spowodowany znieczuleniem miejscowym. Urazowe uszkodzenia nerwów i (lub) miejscowe, toksyczne działanie na mięśnie i nerwy spowodowane są głównie przez wstrzyknięcie znieczulenia miejscowego. Zakres tych uszkodzeń zależy od ciężkości urazów, stężenia leku miejscowo znieczulającego oraz czasu jego oddziaływania na poszczególne tkanki.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Dlatego należy stosować zawsze najmniejszą skuteczną dawkę. Przypadkowe wstrzyknięcia dożylne w obrębie głowy i szyi mogą powodować wystąpienie objawów mózgowych, nawet po zastosowaniu małych dawek. Lek podany pozagałkowo, może w bardzo rzadkich przypadkach przeniknąć do przestrzeni podpajęczynówkowej mózgu powodując nasilone/ciężkie reakcje takie jak zapaść krążeniowa, bezdech, drgawki i czasową ślepotę. W przypadku znieczulenia okołogałkowego i pozagałkowego istnieje ryzyko trwałego zaburzenia czynności mięśni oka. Jest to związane przede wszystkim z uszkodzeniem i (lub) miejscowym działaniem toksycznym na nerw i (lub) mięśnie. Skuteczność znieczulenia miejscowego może się zmniejszyć po wstrzyknięciu w obszar zakażony lub zmieniony zapalnie. Domięśniowo podana lidokaina może powodować zwiększenie stężenia fosfokinazy kreatynowej, co może mieć wpływ na diagnozę ostrego zawału mięśnia sercowego.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlSpecjalne środki ostrozności
Wykazano porfiriogenne działanie lidokaniny u zwierząt, dlatego nie powinna być ona stosowana u pacjentów z ostrą porfirią, chyba, że jest to absolutnie konieczne. Szczególną ostrożność należy zachować podczas stosowania lidokainy u pacjentów z porfirią. Znieczulenie nadtwardówkowe może prowadzić do niedociśnienia i bradykardii. Ryzyko to zmniejsza podanie dożylne roztworów krystaloidów lub koloidów. Spadek ciśnienia krwi wymaga natychmiastowego zastosowania np. efedryny 5-10 mg dożylnie, powtórzonego, jeśli konieczne. Znieczulenie okołoszyjkowe może czasami powodować bradykardię lub tachykardię u płodu, dlatego konieczne jest uważne monitorowanie tętna płodu (patrz punkt 4.6). Jeden ml roztworu do wstrzykiwań zawiera około 0,118 mmola sodu (w przypadku użycia roztworu o mocy 10 mg/ml) lub 0,082 mmola sodu (w przypadku użycia roztworu o mocy 20 mg/ml). Należy to wziąć pod uwagę przez osoby kontrolujące zawartość sodu w diecie.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Leki spowalniające metabolizm lidokainy (np. cymetydyna) mogą powodować uzyskanie potencjalnie toksycznego stężenia lidokainy w osoczu, w przypadku szybkiego podania dużych dawek przez dłuższy czas. Efekt ten nie ma klinicznego znaczenia, jeśli lidokaina podawana jest w krótkim czasie w zalecanych dawkach. Lidokainę należy stosować ostrożnie w skojarzeniu z innymi lekami miejscowo znieczulającymi oraz lekami przeciwarytmicznymi klasy IB, jako że sumują się działania toksyczne obu leków. Dotychczas nie zostały przeprowadzone badania specyficznych interakcji z lekami miejscowo znieczulającymi i lekami przeciwarytmicznymi klasy III (np. amiodaronem), jednak zalecana jest ostrożność w tych przypadkach (patrz punkt 4.4).
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich danych dotyczących stosowania lidokainy u kobiet w ciąży. Lidokaina przenika przez łożysko (patrz punkt 5.2). Można przyjąć, że lidokaina była stosowana u dużej liczby kobiet w ciąży i kobiet w wieku rozrodczym. Nie ma dowodów, że lidokaina zaburza procesy rozmnażania lub zwiększa ilość przypadków wystąpienia wad rozwojowych, czy w jakikolwiek pośredni lub bezpośredni sposób oddziałuje na płód. Jednakże nie przeprowadzono dostatecznych badań ryzyka u ludzi. Badania na zwierzętach wykazały szkodliwy wpływ lidokainy na reprodukcję (patrz punkt 5.3). W przypadku krótkotrwałego stosowania lidokainy podczas ciąży i porodu należy rozważyć czy oczekiwane korzyści przeważają potencjalne ryzyko. Zastosowanie lidokainy do znieczulenia okołoszyjkowego lub znieczulenia sromu podczas porodu zwiększa ryzyko wystąpienia u płodu reakcji takich jak bradykardia/tachykardia.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlWpływ na płodność, ciążę i laktację
Dlatego należy starannie monitorować tętno płodu (patrz punkt 5.2). Karmienie piersi? Lidokaina przenika w małym stopniu do mleka kobiecego. Wpływ na dziecko jest nieznaczny, podczas stosowania zalecanych dawek. Dlatego nie ma potrzeby przerwania karmienia piersią w trakcie stosowania Lidocaine Accord.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn W zależności od dawki i drogi podania, lidokaina może czasowo wpływać na ruch i koordynację, wpływając tym samym na zdolność prowadzenia pojazdów i obsługiwania maszyn. Należy poinformować pacjentów, że powinni unikać tych aktywności do czasu powrotu prawidłowego funkcjonowania organizmu.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane spowodowane wyłącznie przez lidokainę są trudne do odróżnienia od fizjologicznych skutków blokady nerwowej (np. niedociśnienie, bradykardia) oraz stanów spowodowanych bezpośrednio przez wkłucie igły (np. uszkodzenie nerwów) lub pośrednio (np. ropień nadtwardówkowy). Bardzo często (≥1/10) Zaburzenia naczyniowe: Niedociśnienie Zaburzenia żołądka i jelit: Nudności Często (≥1/100 do <1/10) Zaburzenia układu nerwowego: Parestezje, zawroty głowy Zaburzenia serca: Bradykardia Zaburzenia naczyniowe: Nadciśnienie Zaburzenia żołądka i jelit: Wymioty Niezbyt często (≥1/1000 do <1/100) Zaburzenia układu nerwowego: Objawy toksycznego działania na OUN (drgawki, parestezje wokół ust, drętwienie języka, nadwrażliwość na dźwięki, zaburzenia widzenia, utrata przytomności, drżenie mięśniowe, senność, oszołomienie, szumy uszne, uczucie zatrucia, zaburzenia mowy) Rzadko (≥1/10 000 do <1/1000) Zaburzenia układu immunologicznego: Reakcje nadwrażliwości, pokrzywka, wysypka, obrzęk naczynioruchowy, w ciężkich przypadkach wstrząs anafilaktyczny Zaburzenia układu nerwowego: Neuropatia, uszkodzenie nerwów obwodowych, zapalenie pajęczynówki Zaburzenia oka: Podwójne widzenie Zaburzenia serca: Zatrzymanie akcji serca, zaburzenia rytmu Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Zahamowanie oddychania Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa tel.: + 48 22 49 21 301 faks: + 48 22 49 21 309 strona internetowa: https://smz.ezdrowie.gov.pl
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
4.9 Przedawkowanie W sporadycznych przypadkach wstrzyknięcie dożylne leku miejscowo znieczulającego może spowodować natychmiastową ogólną reakcję toksyczności (w ciągu kilku sekund lub minut). Objawy te w wyniku przedawkowania występują znacznie później (15-60 minut po wstrzyknięciu), w wyniku stopniowego narastania we krwi stężenia leku miejscowo znieczulającego (patrz punkt 4.8). Jeżeli wystąpią objawy zatrucia ogólnoustrojowego należy natychmiast przerwać podawanie leku. Toksyczność: Podanie doustne: podanie mniej niż 50 mg wydaje się nie być ryzykowne dla małych dzieci. 75 mg dla 2-letniego dziecka zmniejszało ból, 100 mg dla 5-miesięcznego dziecka spowodowało ciężkie zatrucie, 300 mg + 300 mg w ciągu 4 godzin dla 3,5-letniego dziecka spowodowało ciężkie do bardzo ciężkiego zatrucie, 400-500 mg dla 2-letniego dziecka i 1 g na 12 godzin dla rocznego dziecka spowodowało bardzo ciężkie zatrucie.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
600 mg dla osoby dorosłej zmniejszało ból, 2 g dla dorosłego spowodowało umiarkowane zatrucie. Podanie pozajelitowe: 50 mg dożylnie dla 1-miesięcznego dziecka spowodowało bardzo ciężkie zatrucie. 200-400 mg podane miejscowo poprzez infiltrację u dorosłego spowodowało ciężkie zatrucie, 500 mg dla osób w wieku powyżej 80 lat i 1 g dożylnie dla osób dorosłych spowodowało bardzo ciężkie zatrucie. Podanie miejscowe: 8,6-17,2 mg/kg dla młodych dzieci, gdy zastosowano do ran po oparzeniach skóry, powodowało ciężkie zatrucie. Objawy Najpierw występują objawy pobudzenia ośrodkowego układu nerwowego, a następnie zahamowanie. Po dużych dawkach szybkie wystąpienie drgawek może być pierwszym objawem. Innymi objawami po przedawkowaniu mogą być: uczucie zmęczenia, zawroty głowy, zaburzenia widzenia, parestezje wokół ust, nudności. Dalszymi objawami są: ataksja, zmiany nastroju, euforia, splątanie, trudności w mówieniu, bladość, nadmierne pocenie, drżenie, drgawki, śpiączka, zatrzymanie oddechu.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
Po dużych dawkach mogą wystąpić: zaburzenia rytmu serca, szczególnie bradykardia, także tachykardia komorowa, migotanie komór, poszerzenie QRS, AV blok przedsionkowo-komorowy, niewydolność serca, niedociśnienie (opisywano pojedyncze przypadki methemoglobinemii). Leczenie Węgiel aktywowany w przypadku doustnego przedawkowania. Prowokowanie wymiotów może być niebezpieczne ze względu na ryzyko znieczulenia śluzówki i drgawek na wczesnym etapie. Jeśli płukanie żołądka jest konieczne, powinno zostać przeprowadzone za pomocą rurki i po intubacji dotchawiczej. W przypadku przedawkowania należy natychmiast podjąć kroki w celu zapewnienia właściwego krążenia i oddychania oraz kontrolowania drgawek. Należy podać pacjentowi tlen i stosować wspomagające wentylowanie, jeżeli konieczne. Krążenie należy utrzymywać poprzez wlew dożylny płynów, dobutaminy i jeśli konieczne noradrenaliny (początkowo 0,05 μg/kg mc./min, zwiększając w razie potrzeby o dalsze 0,05 μg/kg mc./min.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlPrzedawkowanie
co 10 minut), jednocześnie ze stałym monitoringiem hemodynamicznym w cięższych przypadkach. Można także zastosować efedrynę. Drgawki można opanować podając dożylnie diazepam lub sodu tiopental, mając na uwadze, że leki przeciwdrgawkowe mogą spowodować depresję oddychania oraz krążenia. W przypadku wystąpienia bradykardii można zastosować atropinę. Jeżeli nastąpi zatrzymanie akcji serca należy zastosować standardowe procedury resuscytacji. Dializa w przypadkach ostrego przedawkowania nie jest skuteczna.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki miejscowo znieczulające, amidy; kod ATC: N01B B02 Lidokaina jest lekiem miejscowo znieczulającym o budowie amidowej. Mechanizm działania opiera się na zmniejszeniu przepuszczalności błony neuronu dla jonów sodowych. W konsekwencji następuje zmniejszenie szybkości depolaryzacji błony, zwiększa się próg pobudzenia, co powoduje odwracalne miejscowe znieczulenie. Lek stosowany jest w celu uzyskania znieczulenia miejscowego poprzez blokadę nerwów w różnych częściach ciała, a także kontroli arytmii. Działa poprzez hamowanie przepływu jonów niezbędnych do powstania i rozprzestrzeniania się bodźców stabilizując błonę neuronu. Oprócz blokowania przewodzenia bodźców nerwowych w obwodowym układzie nerwowym, lidokaina ma istotny wpływ na ośrodkowy układ nerwowy i układ sercowo-naczyniowy.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakodynamiczne
Po wchłonięciu lidokaina może powodować pobudzenie OUN, a następnie jego zahamowanie; na układ sercowo-naczyniowy działa głównie na mięsień sercowy, gdzie może powodować zmniejszenie pobudliwości elektrycznej, szybkości przewodzenia oraz siły skurczu. Działanie znieczulające rozpoczyna się szybko (około minutę po wstrzyknięciu dożylnym i piętnastu minutach po wstrzyknięciu domięśniowym) oraz szybko rozprzestrzenia się w tkankach otaczających. Działanie znieczulające utrzymuje się około dziesięciu do dwudziestu minut po podaniu dożylnym i około sześćdziesięciu do dziewięćdziesięciu minut po podaniu domięśniowym.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Szybkość wchłaniania zależy od wielkości dawki, drogi podania i perfuzji w miejscu podania. Blokada nerwów międzyżebrowych prowadzi do największego stężenia w osoczu (ok. 1,5 μg/ml na 100 mg wstrzykniętych), podczas gdy wstrzyknięcie podskórne w obrębie brzucha prowadzi do najmniejszego stężenia w osoczu (ok. 0,5 μg/ml na 100 mg wstrzykniętych). Objętość dystrybucji w stanie równowagi wynosi 91 litrów, natomiast wiązanie z białkami osocza głównie z kwasem alfa-1- glikoproteinowym wynosi 65%. Z przestrzeni nadtwardówkowej wchłanianie jest całkowite i dwufazowe z okresem półtrwania odpowiednio ok. 9,3 minut i 82 minuty. Powolne wchłanianie jest czynnikiem limitującym czas eliminacji lidokainy, co wyjaśnia wolniejszą eliminację po wstrzyknięciu nadtwardówkowo niż po podaniu dożylnym. Eliminacja lidokainy następuje głównie poprzez metabolizm, szczególnie poprzez dealkilację do monoetyloglicynoksylidydu (MEGX) katalizowanego za pomocą CYP1A2 oraz CYP3A4.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
MEGX jest metabolizowany do 2,6–dimetyloaniliny i ksylidydu glicyny (GX). 2,6-dimetyloanilina jest dalej przekształcana za pomocą CYP2A6 do 4-hydroksy-2,6-dimetyloaniliny, która jest głównym metabolitem wydalanym z moczem (80%) w postaci koniugatu. MEGX wykazuje działanie prodrgawkowe, podobnie do lidokainy, podczas gdy GX nie wykazuje takiej aktywności. MEGX występuje w osoczu w podobnych stężeniach jak substancja wyjściowa. Szybkość eliminacji lidokainy i MEGX wynosi po podaniu dożylnym odpowiednio 1,5-2 godzin i 2,5 godziny. Ze względu na szybki metabolizm w wątrobie, kinetyka zależy od stanu wątroby. Okres półtrwania może być dwukrotnie dłuższy u pacjentów z niewydolnością wątroby. Niewydolność nerek nie wpływa na kinetykę, ale może powodować kumulację metabolitów we krwi. Lidokaina przenika przez barierę łożyska i u płodu stężenie we krwi niezwiązanej lidokainy jest takie samo jak w organizmie matki.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlWłaściwości farmakokinetyczne
Jednakże, całkowite stężenie w osoczu będzie mniejsze u płodu, ze względu na mniejsze wiązanie z białkami. Specjalne grupy pacjentów Ze względu na szybki metabolizm w wątrobie, kinetyka zależy od stanu wątroby. Okres półtrwania może być dwukrotnie dłuższy u pacjentów z niewydolnością wątroby. Niewydolność nerek nie wpływa na kinetykę, ale może powodować kumulację metabolitów we krwi. U noworodków poziom α-1 kwaśnej glikoproteiny jest mały i wiązanie z białkami może być zmniejszone. W związku z tym, że stężenie wolnej frakcji może być większe, nie zaleca się stosowania lidokainy u noworodków. Pacjenci w podeszłym wieku: Okres półtrwania w fazie eliminacji oraz objętość dystrybucji mogą być odpowiednio wydłużone i zwiększone w tej grupie pacjentów z powodu zmniejszonej pojemności minutowej serca i (lub) wątrobowego przepływu krwi.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach objawy toksyczności po zastosowaniu dużych dawek lidokainy dotyczyły ośrodkowego układu nerwowego i układu sercowo-naczyniowego. W badaniach toksyczności reprodukcyjnej u królików wykazano toksyczne działanie lidokainy na zarodek i płód po podaniu podskórnie dawki 25 mg/kg. W dawkach mniejszych niż dawki toksyczne dla matki u szczurów, lidokaina nie ma wpływu na pourodzeniowy rozwój potomstwa. Nie zaobserwowano wpływu lidokainy na płodność samic i samców szczura. Lidokaina przenika przez barierę łożyskową drogą dyfuzji prostej. W przeprowadzonych badaniach in vitro i in vivo lidokaina nie wykazała właściwości genotoksycznych, aczkolwiek jeden z jej metabolitów - 2,6-dimetyloanilina wykazuje taki potencjał. Nie przeprowadzono badań rakotwórczości lidokainy. 2,6-dimetyloanilina wykazała działanie rakotwórcze w przedklinicznych badaniach toksykologicznych oceniających skutki przewlekłej ekspozycji na lek.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlPrzedkliniczne dane o bezpieczeństwie
Kliniczne znaczenie tej obserwacji nie jest znane.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Sodu wodorotlenek Kwas solny stężony Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne W związku z brakiem badań dotyczących zgodności, produktu leczniczego nie wolno mieszać z innymi produktami leczniczymi. 6.3 Okres ważności 3 lata Należy zużyć bezpośrednio po pierwszym otwarciu. 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących warunków przechowywania. 6.5 Rodzaj i zawartość opakowania Produkt leczniczy pakowany jest we fiolki lub ampułki. Ampułka z przezroczystego szkła typu I. Fiolka z przezroczystego szkła typu I, zamknięta korkiem z gumy chlorobutylowej i aluminiowym uszczelnieniem (zamknięcie typu flip-off). Lidocaine Accord, 10 mg/mL jest dostępny w opakowaniach: 5 ampułek po 2 mL, w tekturowym pudełku 10 ampułek po 2 mL, w tekturowym pudełku 20 ampułek po 2 mL, w tekturowym pudełku 5 ampułek po 5 mL, w tekturowym pudełku 10 ampułek po 5 mL, w tekturowym pudełku 20 ampułek po 5 mL, w tekturowym pudełku 10 ampułek po 10 mL, w tekturowym pudełku 20 ampułek po 10 mL w tekturowym pudełku 1 fiolka po 20 mL, w tekturowym pudełku Lidocaine Accord, 20 mg/ml jest dostępny w opakowaniach: 5 ampułek po 2 mL, w tekturowym pudełku 10 ampułek po 2 mL, w tekturowym pudełku 20 ampułek po 2 mL, w tekturowym pudełku 5 ampułek po 5 mL, w tekturowym pudełku 10 ampułek po 5 mL, w tekturowym pudełku 20 ampułek po 5 mL, w tekturowym pudełku 5 ampułek po 10 mL, w tekturowym pudełku 10 ampułek po 10 mL, w tekturowym pudełku 20 ampułek po 10 mL w tekturowym pudełku 1 fiolka po 20 mL, w tekturowym pudełku Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
- CHPL leku Lidocaine Accord, roztwór do wstrzykiwań, 20 mg/mlDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Stosować zgodnie z zaleceniami lekarza. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Wyłącznie do jednorazowego użytku. Niewykorzystaną cześć roztworu należy zniszczyć. Roztworu nie należy używać, jeśli widoczne są stałe cząstki.
Zobacz również:
- Dawkowanie leku
Kapsaicyna w postaci plastrów leczniczych to nowoczesna metoda łagodzenia bólu neuropatycznego u dorosłych. Terapia polega na jednorazowym, precyzyjnie kontrolowanym nakładaniu plastra na bolesne miejsce, co pozwala zmniejszyć odczuwanie bólu nawet na kilka miesięcy. Dawkowanie oraz czas trwania zabiegu dostosowywane są do lokalizacji bólu i indywidualnych potrzeb pacjenta. Sprawdź, jak wygląda schemat dawkowania kapsaicyny, kto może skorzystać z tej metody oraz na co należy zwrócić szczególną uwagę przy stosowaniu tej substancji.
- Działania niepożądane i skutki uboczne
Kapsaicyna to substancja znana głównie ze swojego działania rozgrzewającego i łagodzącego ból, jednak jej stosowanie – zwłaszcza w postaci plastrów – może powodować różne działania niepożądane. Objawy te są zazwyczaj łagodne i ograniczają się do miejsca aplikacji, ale warto wiedzieć, czego można się spodziewać i jak reagować w razie ich wystąpienia. Sprawdź, jakie reakcje mogą pojawić się podczas leczenia kapsaicyną i na co zwrócić szczególną uwagę.
- Mechanizm działania
Kapsaicyna to substancja znana z ostrego smaku papryczek chili, ale wykorzystywana jest również w medycynie do łagodzenia bólu neuropatycznego. Jej działanie opiera się na wpływie na receptory w skórze, co prowadzi do zmniejszenia odczuwania bólu. Kapsaicyna, stosowana w postaci plastrów, działa miejscowo i jej mechanizm został dokładnie zbadany zarówno w badaniach klinicznych, jak i przedklinicznych. Poznaj, jak kapsaicyna oddziałuje na organizm, jak długo utrzymuje się jej efekt i jakie są wyniki badań bezpieczeństwa.
- Porównanie substancji czynnych
Kapsaicyna, mentol i lidokaina to substancje często stosowane w leczeniu bólu, stanów zapalnych i podrażnień skóry oraz błon śluzowych. Choć należą do tej samej grupy leków miejscowo działających, różnią się między sobą wskazaniami, sposobem działania, bezpieczeństwem oraz przeciwwskazaniami. Poznaj ich podobieństwa i różnice, by świadomie wybrać odpowiednią terapię dla siebie lub swoich bliskich.
- Profil bezpieczeństwa
Kapsaicyna, znana z zastosowania w plastrach leczniczych, może skutecznie łagodzić ból neuropatyczny, jednak jej użycie wymaga zachowania szczególnej ostrożności u wybranych grup pacjentów. W niniejszym opisie znajdziesz praktyczne informacje na temat bezpieczeństwa kapsaicyny, w tym ryzyka reakcji skórnych, zaleceń dla kobiet w ciąży, seniorów oraz osób z chorobami nerek i wątroby. Dowiedz się, jakie środki ostrożności warto zachować i dla kogo stosowanie kapsaicyny może być ograniczone.
- Przeciwwskazania
Kapsaicyna to substancja o silnym działaniu miejscowym, wykorzystywana w leczeniu bólu neuropatycznego. Choć jej skuteczność jest potwierdzona, nie każdy pacjent może z niej bezpiecznie korzystać. Istnieją sytuacje, w których stosowanie kapsaicyny jest przeciwwskazane lub wymaga szczególnej ostrożności. Poznaj najważniejsze przeciwwskazania i środki ostrożności związane z kapsaicyną, aby zadbać o swoje bezpieczeństwo.
- Stosowanie u dzieci
Bezpieczeństwo stosowania kapsaicyny u dzieci budzi wiele pytań ze względu na specyficzne potrzeby tej grupy wiekowej. Kapsaicyna w postaci plastrów leczniczych jest stosowana wyłącznie u dorosłych, a brak danych klinicznych dotyczących dzieci sprawia, że nie jest ona zalecana w leczeniu pacjentów pediatrycznych. W opisie znajdziesz podsumowanie dostępnych informacji dotyczących bezpieczeństwa, przeciwwskazań oraz możliwych reakcji na lek, z naciskiem na różnice w metabolizmie i wrażliwości dzieci na działanie leków.
- Stosowanie u kierowców
Kapsaicyna, znana z działania miejscowego, jest wykorzystywana w leczeniu bólu neuropatycznego. W przypadku plastrów leczniczych z kapsaicyną, jej wpływ na zdolność do prowadzenia pojazdów i obsługi maszyn jest minimalny lub nieistotny, co potwierdzają badania kliniczne. Sprawdź, co warto wiedzieć na temat bezpieczeństwa stosowania kapsaicyny w codziennym funkcjonowaniu.
- Stosowanie w ciąży
Stosowanie leków w czasie ciąży i karmienia piersią wymaga szczególnej ostrożności, ponieważ wiele substancji może wpływać na zdrowie dziecka. Kapsaicyna, znana głównie z działania przeciwbólowego w plastrach stosowanych miejscowo, to substancja, której bezpieczeństwo stosowania w tych wyjątkowych okresach życia kobiety nie zostało w pełni potwierdzone. Poznaj aktualne zalecenia i środki ostrożności związane ze stosowaniem kapsaicyny podczas ciąży oraz karmienia piersią.
- Wskazania - na co działa?
Kapsaicyna, znana z działania rozgrzewającego, jest stosowana w leczeniu bólu neuropatycznego u dorosłych. Jej unikalny sposób działania polega na zmniejszaniu wrażliwości nerwów odpowiedzialnych za przekazywanie bólu. Dzięki specjalnym plastrów, kapsaicyna może przynieść ulgę osobom cierpiącym na przewlekły ból związany z uszkodzeniem nerwów, szczególnie w przypadku cukrzycy lub innych chorób nerwów obwodowych.
- Rzedawkowanie substancji
Kapsaicyna, stosowana miejscowo w formie plastrów, działa poprzez wpływ na zakończenia nerwowe w skórze. Przedawkowanie tej substancji jest mało prawdopodobne, jednak może prowadzić do silniejszych niż zwykle reakcji miejscowych, takich jak ból, rumień czy świąd. W przypadku wystąpienia niepożądanych objawów ważne jest szybkie usunięcie plastra oraz odpowiednie postępowanie, aby złagodzić dolegliwości.
REKLAMA