Arypiprazol to nowoczesna substancja czynna, wykorzystywana głównie w leczeniu schizofrenii i zaburzeń afektywnych dwubiegunowych. Charakteryzuje się szeroką gamą dostępnych postaci leku, co pozwala na indywidualne dostosowanie terapii do potrzeb pacjenta. Bezpieczeństwo stosowania oraz skuteczność arypiprazolu zostały potwierdzone w licznych badaniach klinicznych zarówno u dorosłych, jak i młodzieży. Zastosowanie arypiprazolu wiąże się z określonymi zasadami dawkowania, możliwymi działaniami niepożądanymi i przeciwwskazaniami, dlatego istotne jest, by pacjent znał podstawowe informacje na temat tej substancji.
Jak działa arypiprazol?
Arypiprazol należy do grupy leków przeciwpsychotycznych nowej generacji. Jego działanie polega na wpływie na określone przekaźniki w mózgu, co pomaga łagodzić objawy schizofrenii i zaburzeń afektywnych dwubiegunowych, takie jak urojenia, omamy czy wahania nastroju12.
Dostępne postacie arypiprazolu
- Tabletki: 5 mg, 10 mg, 15 mg, 30 mg12
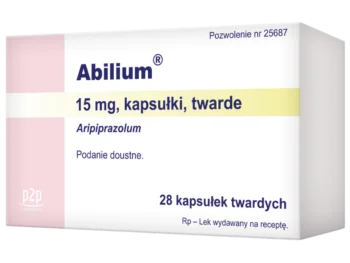
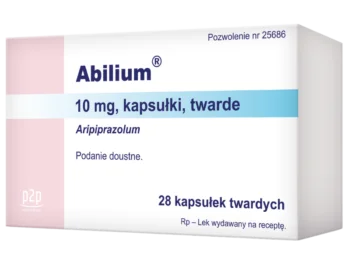
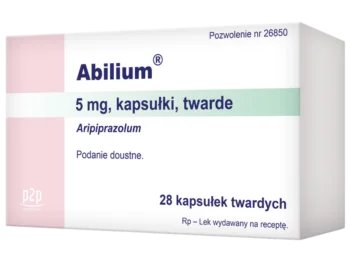
- Kapsułki: 10 mg, 15 mg3
- Tabletki ulegające rozpadowi w jamie ustnej: 10 mg, 15 mg, 30 mg4
- Roztwór doustny: 1 mg/ml5
- Roztwór do wstrzykiwań: 7,5 mg/ml (ampułka 9,75 mg)6
- Zawiesina do wstrzykiwań o przedłużonym uwalnianiu (Abilify Maintena): 300 mg, 400 mg (miesięczne), 720 mg, 960 mg (co dwa miesiące)78
Arypiprazol występuje także w połączeniach z innymi substancjami czynnymi, na przykład z litem lub walproinianem w leczeniu zaburzeń afektywnych dwubiegunowych910.
Najważniejsze wskazania
- Leczenie schizofrenii u dorosłych oraz młodzieży od 15. roku życia1
- Leczenie umiarkowanych i ciężkich epizodów maniakalnych w zaburzeniu afektywnym dwubiegunowym typu I (u dorosłych i młodzieży od 13. roku życia)1
- Zapobieganie nowym epizodom maniakalnym u dorosłych1
Podstawowe zasady dawkowania
Najczęściej stosowana dawka początkowa u dorosłych w leczeniu schizofrenii to 10 mg lub 15 mg na dobę, przyjmowane raz dziennie. Maksymalna dawka dobowa nie powinna przekraczać 30 mg. U młodzieży dawkowanie ustala się indywidualnie, zwykle zaczynając od mniejszej dawki i stopniowo ją zwiększając12.
Kiedy nie stosować arypiprazolu?
- U osób z nadwrażliwością na arypiprazol lub jakikolwiek składnik leku1
- W przypadku niektórych rzadkich zaburzeń związanych z nietolerancją laktozy lub innych składników pomocniczych (w zależności od postaci leku)2
Bezpieczeństwo stosowania arypiprazolu
Stosowanie arypiprazolu w ciąży i podczas karmienia piersią wymaga szczególnej ostrożności i indywidualnej oceny przez lekarza1. Arypiprazol może wpływać na zdolność prowadzenia pojazdów oraz obsługi maszyn, zwłaszcza na początku leczenia lub po zmianie dawki2. U osób starszych oraz u pacjentów z zaburzeniami pracy nerek lub wątroby konieczna jest ostrożność i ewentualna modyfikacja dawki3.
Przedawkowanie arypiprazolu
Przedawkowanie może prowadzić do objawów takich jak senność, przyspieszone bicie serca, nudności, wymioty lub biegunka. W przypadku podejrzenia przedawkowania należy niezwłocznie zwrócić się o pomoc medyczną. Leczenie polega na monitorowaniu i wsparciu podstawowych funkcji życiowych12.
Najważniejsze interakcje
- Niektóre leki przeciwdepresyjne i przeciwgrzybicze mogą zwiększać stężenie arypiprazolu we krwi (np. chinidyna, ketokonazol, fluoksetyna)1
- Leki przeciwpadaczkowe (np. karbamazepina) mogą zmniejszać stężenie arypiprazolu2
- Arypiprazol może nasilać działanie leków obniżających ciśnienie krwi3
- Nie zaleca się łączenia z alkoholem4
Najczęstsze działania niepożądane
- Akatyzja (uczucie niepokoju ruchowego)
- Nudności
- Bezsenność
- Lęk
- Zawroty głowy
- Bóle głowy
- Senność
- Zmęczenie
Większość działań niepożądanych jest łagodna i przemijająca, ale w razie ich wystąpienia należy skonsultować się z lekarzem12.
Mechanizm działania arypiprazolu
Arypiprazol działa poprzez wpływ na receptory dopaminowe i serotoninowe w mózgu. Jego szczególna budowa sprawia, że działa zarówno jako częściowy pobudzacz, jak i blokuje niektóre receptory, co pomaga przywrócić równowagę chemiczną w układzie nerwowym12.
Stosowanie arypiprazolu w ciąży
Stosowanie arypiprazolu w ciąży powinno być zawsze uzgodnione z lekarzem, ponieważ bezpieczeństwo nie zostało w pełni potwierdzone. Lekarz oceni, czy korzyści dla matki przeważają nad potencjalnym ryzykiem dla dziecka1.
Arypiprazol u dzieci i młodzieży
Arypiprazol może być stosowany u młodzieży powyżej 13. lub 15. roku życia (w zależności od wskazania i postaci leku). U młodszych dzieci nie zaleca się stosowania tej substancji ze względu na brak wystarczających danych dotyczących bezpieczeństwa i skuteczności12.
Arypiprazol a prowadzenie pojazdów
W początkowym okresie leczenia arypiprazolem oraz po zmianie dawki mogą wystąpić zawroty głowy, senność lub zaburzenia koncentracji, które mogą utrudniać bezpieczne prowadzenie pojazdów lub obsługę maszyn. Każda osoba powinna indywidualnie ocenić swoją reakcję na lek przed podjęciem takich czynności1.
Arypiprazol – porównanie substancji czynnych
Arypiprazol, brekspiprazol i zyprazydon to leki przeciwpsychotyczne stosowane głównie w leczeniu schizofrenii i epizodów maniakalnych. Różnią się wskazaniami, profilem bezpieczeństwa i zaleceniami dla...
czytaj więcej ❯❯- CHPL leku Abilify, tabletki, 5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ABILIFY 5 mg tabletki ABILIFY 10 mg tabletki ABILIFY 15 mg tabletki ABILIFY 30 mg tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ABILIFY 5 mg tabletki Każda tabletka zawiera 5 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 63,65 mg laktozy (w postaci jednowodnej) w tabletce ABILIFY 10 mg tabletki Każda tabletka zawiera 10 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 59,07 mg laktozy (w postaci jednowodnej) w tabletce ABILIFY 15 mg tabletki Każda tabletka zawiera 15 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 54,15 mg laktozy (w postaci jednowodnej) w tabletce ABILIFY 30 mg tabletki Każda tabletka zawiera 30 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 177,22 mg laktozy (w postaci jednowodnej) w tabletce Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka ABILIFY 5 mg tabletki Prostokątna i niebieska, oznaczona na jednej stronie symbolem „A-007” i cyfrą „5”.
- CHPL leku Abilify, tabletki, 5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
ABILIFY 10 mg tabletki Prostokątna i różowa, oznaczona na jednej stronie symbolem „A-008” i liczbą „10”. ABILIFY 15 mg tabletki Okrągła i żółta, oznaczona na jednej stronie symbolem „A-009” i liczbą „15”. ABILIFY 30 mg tabletki Okrągła i różowa, oznaczona na jednej stronie symbolem „A-011” i liczbą „30”.
- CHPL leku Abilify, tabletki, 5 mgWskazania do stosowania
4.1 Wskazania do stosowania ABILIFY jest wskazany do leczenia schizofrenii u dorosłych i u młodzieży w wieku 15 lat i starszej. ABILIFY jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym lub ciężkim w przebiegu zaburzenia afektywnego dwubiegunowego typu I oraz w zapobieganiu nowym epizodom maniakalnym u dorosłych, u których występują głównie epizody maniakalne i którzy odpowiadają na leczenie arypiprazolem (patrz punkt 5.1). ABILIFY jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym lub ciężkim w przebiegu zaburzenia afektywnego dwubiegunowego typu I u młodzieży w wieku 13 lat i starszej, w leczeniu trwającym do 12 tygodni (patrz punkt 5.1).
- CHPL leku Abilify, tabletki, 5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Schizofrenia: zalecana dawka początkowa produktu ABILIFY to 10 mg na dobę lub 15 mg na dobę z dawką podtrzymującą 15 mg na dobę. Lek należy podawać raz na dobę o stałej porze, niezależnie od posiłków. ABILIFY jest skuteczny w dawkach od 10 mg na dobę do 30 mg na dobę. Chociaż nie potwierdzono większej skuteczności dawek większych niż dawka dobowa 15 mg, to jednak u poszczególnych pacjentów większa dawka może być korzystna. Maksymalna dawka dobowa nie może być większa niż 30 mg. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I: zalecana dawka początkowa to 15 mg produktu ABILIFY podawana w schemacie raz na dobę, niezależnie od posiłków jako monoterapia lub w leczeniu skojarzonym (patrz punkt 5.1). U niektórych pacjentów może być korzystne zastosowanie większej dawki. Maksymalna dawka dobowa nie może być większa niż 30 mg.
- CHPL leku Abilify, tabletki, 5 mgDawkowanie
Zapobieganie nawrotom epizodów maniakalnych w zaburzeniu afektywnym dwubiegunowym typu I: w celu zapobiegania nawrotom epizodów maniakalnych u pacjentów, którzy stosują arypiprazol w monoterapii lub w terapii skojarzonej, należy kontynuować leczenie stosując ustaloną dawkę. Dostosowanie dawki dobowej, w tym jej zmniejszenie, należy rozważyć na podstawie stanu klinicznego. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej : zalecana dawka produktu ABILIFY, to 10 mg na dobę podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie powinno być rozpoczęte od dawki 2 mg (stosując ABILIFY 1 mg/ml roztwór doustny) przez 2 dni, stopniowo zwiększanej do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. W przypadkach, w których zwiększenie dawki jest właściwe, należy podawać kolejne dawki zwiększone jednorazowo o 5 mg, nie przekraczając maksymalnej dawki dobowej 30 mg (patrz punkt 5.1).
- CHPL leku Abilify, tabletki, 5 mgDawkowanie
ABILIFY jest skuteczny w przedziale dawek od 10 mg na dobę do 30 mg na dobę. Nie wykazano większej skuteczności przy zastosowaniu dawek dobowych większych niż 10 mg, chociaż indywidualni pacjenci mogą odnieść korzyść z zastosowania większych dawek. ABILIFY nie jest zalecany do stosowania u pacjentów ze schizofrenią w wieku poniżej 15 lat, z powodu braku wystarczających danych dotyczących bezpieczeństwa stosowania i skuteczności (patrz punkty 4.8 i 5.1). Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej: zalecana dawka produktu ABILIFY to 10 mg na dobę, podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie należy rozpocząć od dawki 2 mg (stosując ABILIFY roztwór doustny 1 mg/ml) przez 2 dni, stopniowo zwiększać do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg.
- CHPL leku Abilify, tabletki, 5 mgDawkowanie
Czas trwania leczenia powinien być możliwie najkrótszy konieczny do uzyskania kontroli objawów i nie może być dłuższy niż 12 tygodni. Nie wykazano większej skuteczności po zastosowaniu dawek dobowych większych niż 10 mg, a dawka dobowa wynosząca 30 mg jest związana ze znacząco większą częstością występowania istotnych reakcji niepożądanych, w tym zdarzeń związanych z objawami pozapiramidowymi (ang. EPS), senności, zmęczenia oraz zwiększenia masy ciała (patrz punkt 4.8). Z tego powodu dawki większe niż 10 mg na dobę należy stosować tylko w wyjątkowych przypadkach oraz z zachowaniem ścisłej kontroli klinicznej (patrz punkty 4.4, 4.8 i 5.1). Młodsi pacjenci są narażeni na zwiększone ryzyko działań niepożądanych związanych z arypiprazolem. Z tego powodu produkt ABILIFY nie jest zalecany do stosowania u pacjentów w wieku poniżej 13 lat (patrz punkty 4.8 i 5.1).
- CHPL leku Abilify, tabletki, 5 mgDawkowanie
Drażliwość związana z zaburzeniami autystycznymi: nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego ABILIFY u dzieci i młodzieży w wieku poniżej 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących dawkowania. Tiki związane z zespołem Tourette’a: nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego ABILIFY u dzieci i młodzieży w wieku od 6 do 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących dawkowania. Szczególne grupy pacjentów Zaburzenia czynności wątroby Nie ma konieczności modyfikacji dawki u osób z zaburzeniami czynności wątroby o nasileniu lekkim lub umiarkowanym. Nie ma wystarczających danych do ustalenia dawkowania u pacjentów z ciężką niewydolnością wątroby. W tej grupie pacjentów należy ostrożnie ustalać dawkowanie.
- CHPL leku Abilify, tabletki, 5 mgDawkowanie
Niemniej jednak, w grupie pacjentów z ciężkimi zaburzeniami czynności wątroby największą dawkę dobową 30 mg należy stosować ze szczególną ostrożnością (patrz punkt 5.2). Zaburzenia czynności nerek Nie ma konieczności modyfikacji dawki u pacjentów z zaburzeniami czynności nerek. Pacjenci w podeszłym wieku Bezpieczeństwo i skuteczność stosowania produktu ABILIFY w leczeniu schizofrenii i w epizodach manii w przebiegu zaburzenia afektywnywnego dwubiegunowego typu I nie zostały zbadane u pacjentów w wieku 65 lat i starszych. Jednak z powodu większej wrażliwości tych pacjentów, należy rozważyć zastosowanie mniejszej dawki początkowej, jeśli pozwalają na to okoliczności kliniczne (patrz punkt 4.4). Płeć Nie ma konieczności modyfikacji dawek leku w zależności od płci (patrz punkt 5.2). Palacze tytoniu Biorąc pod uwagę metabolizm arypiprazolu nie ma konieczności modyfikacji dawek u palaczy (patrz punkt 4.5).
- CHPL leku Abilify, tabletki, 5 mgDawkowanie
Dostosowanie dawki z powodu interakcji Dawkę arypiprazolu należy zmniejszyć w przypadku równoczesnego podawania leku o silnym działaniu hamującym w stosunku do cytochromu CYP3A4 lub CYP2D6. Po zakończeniu jednoczesnego stosowania inhibitora CYP3A4 lub CYP2D6 należy ponownie zwiększyć dawkę arypiprazolu (patrz punkt 4.5). Dawkę arypiprazolu należy zwiększyć w przypadku równoczesnego podawania leków silnie indukujących CYP3A4. Po odstawieniu leku indukującego CYP3A4, dawkę arypiprazolu należy ponownie zmniejszyć do zalecanej (patrz punkt 4.5). Sposób podawania Produkt leczniczy ABILIFY jest przeznaczony do podawania doustnego. Tabletki ulegające rozpadowi w jamie ustnej lub roztwór doustny mogą być stosowane alternatywnie do tabletek ABILIFY u pacjentów, którzy mają trudności w połykaniu tabletek ABILIFY (patrz także punkt 5.2).
- CHPL leku Abilify, tabletki, 5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Abilify, tabletki, 5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić w ciągu od kilku dni do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Prawdopodobieństwo podjęcia próby samobójczej Występowanie zachowań samobójczych jest związane z chorobami psychicznymi oraz zaburzeniami nastroju i w niektórych przypadkach było zgłaszane wkrótce po rozpoczęciu lub zmianie leczenia przeciwpsychotycznego, w tym leczenia arypiprazolem (patrz punkt 4.8). Leczenie przeciwpsychotyczne pacjentów wysokiego ryzyka powinno odbywać się pod ścisłym nadzorem. Zaburzenia sercowo-naczyniowe Arypiprazol należy stosować ostrożnie u pacjentów z chorobą sercowo-naczyniową (zawał mięśnia sercowego lub choroba niedokrwienna, niewydolność serca lub zaburzenia przewodzenia w wywiadzie), chorobą naczyń mózgu, w stanach predysponujących do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie przeciwnadciśnieniowymi produktami leczniczymi) lub z nadciśnieniem tętniczym, w tym postępującym lub złośliwym.
- CHPL leku Abilify, tabletki, 5 mgSpecjalne środki ostrozności
Po zastosowaniu leków przeciwpsychotycznych obserwowano przypadki żylnej choroby zakrzepowo-zatorowej (VTE - ang. venous thromboembolism ). Ponieważ u pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE przed rozpoczęciem oraz w czasie leczenia arypiprazolem i wdrożyć odpowiednie środki zapobiegawcze. Wydłużenie odstępu QT W badaniach klinicznych arypiprazolu częstość występowania wydłużenia odstępu QT była porównywalna z placebo. Arypiprazol należy stosować ostrożnie u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy W badaniach klinicznych trwających nie dłużej niż rok, w trakcie leczenia arypiprazolem zgłaszano niezbyt częste przypadki dyskinez związane z leczeniem.
- CHPL leku Abilify, tabletki, 5 mgSpecjalne środki ostrozności
Jeśli objawy przedmiotowe lub podmiotowe późnych dyskinez wystąpią u pacjentów leczonych arypiprazolem, należy rozważyć zmniejszenie dawki lub odstawienie leku (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Inne objawy pozapiramidowe W pediatrycznych badaniach klinicznych z zastosowaniem arypiprazolu obserwowano akatyzję oraz parkinsonizm. Jeśli u pacjenta przyjmującego arypiprazol wystąpią objawy przedmiotowe i podmiotowe innych zaburzeń pozapiramidowych, należy rozważyć zmniejszenie dawki oraz wprowadzenie ścisłej kontroli klinicznej. Złośliwy Zespół Neuroleptyczny (NMS ) NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z podawaniem leków przeciwpsychotycznych. W badaniach klinicznych, odnotowano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku Abilify, tabletki, 5 mgSpecjalne środki ostrozności
Klinicznymi objawami NMS są bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz objawy niestabilności autonomicznego układu nerwowego (nieregularne tętno lub wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Jednakże, obserwowano także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę, niekoniecznie związane z NMS. Jeśli wystąpiły wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS, bądź niewyjaśnionego pochodzenia wysoka gorączka, bez innych objawów NMS, należy przerwać leczenie wszystkimi lekami przeciwpsychotycznymi, w tym także arypiprazolem. Drgawki W badaniach klinicznych odnotowano niezbyt częste przypadki napadów drgawek w czasie leczenia arypiprazolem.
- CHPL leku Abilify, tabletki, 5 mgSpecjalne środki ostrozności
Z tego powodu arypiprazol należy stosować z zachowaniem ostrożności u pacjentów, u których w przeszłości występowały napady drgawek lub u których występują choroby wiążące się ze skłonnością do takich napadów (patrz punkt 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencją Zwiększona śmiertelność W trzech badaniach kontrolowanych placebo (n = 938, średnia wieku: 82,4; zakres: od 56 do 99 lat), u pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera, leczonych arypiprazolem, występowało zwiększone ryzyko zgonu w porównaniu z grupą otrzymującą placebo. Częstość zgonów u pacjentów leczonych arypiprazolem wynosiła 3,5% w porównaniu do 1,7% w grupie placebo. Chociaż przyczyny zgonów były zróżnicowane to większość zgonów wydawała się być związana albo z chorobami układu krążenia (np. niewydolność serca, nagłe zgony) albo z chorobami zakaźnymi (np. zapalenie płuc) (patrz punkt 4.8).
- CHPL leku Abilify, tabletki, 5 mgSpecjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego U pacjentów w tych samych badaniach odnotowano działania niepożądane dotyczące krążenia mózgowego (np. udar, przejściowe napady niedokrwienia) w tym o przebiegu zakończonym zgonem (średnia wieku: 84 lata; zakres od 78 do 88 lat). Ogólnie w tych badaniach 1,3% wszystkich pacjentów leczonych arypiprazolem zgłaszało działania niepożądane dotyczące krążenia mózgowego w porównaniu do 0,6% pacjentów otrzymujących placebo. Różnica ta nie była istotna statystycznie. Jednakże w jednym z tych badań z zastosowaniem ustalonego dawkowania u pacjentów leczonych arypiprazolem występowała istotna zależność odpowiedzi od dawki dla działań niepożądanych dotyczących krążenia mózgowego (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów z psychozą związaną z demencją.
- CHPL leku Abilify, tabletki, 5 mgSpecjalne środki ostrozności
Hiperglikemia i cukrzyca U pacjentów leczonych nietypowymi lekami przeciwpsychotycznymi, w tym arypiprazolem, opisywano hiperglikemię, w niektórych przypadkach bardzo wysoką z kwasicą ketonową i śpiączką hiperosmotyczną lub zgonem. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. W badaniach klinicznych z arypiprazolem nie było istotnych różnic w częstości występowania działań niepożądanych związanych z hiperglikemią (w tym cukrzycy) lub nieprawidłowych wartości laboratoryjnych stężenia glukozy w porównaniu do placebo. Nie jest dostępna dokładna ocena ryzyka wystąpienia działań niepożądanych związanych z hiperglikemią, która pozwalałaby na dokonanie bezpośredniego porównania leczenia arypiprazolem i innymi atypowymi lekami przeciwpsychotycznymi.
- CHPL leku Abilify, tabletki, 5 mgSpecjalne środki ostrozności
Pacjenci leczeni jakimikolwiek lekami przeciwpsychotycznymi, włącznie z arypiprazolem, powinni być obserwowani, czy nie występują u nich objawy podmiotowe i przedmiotowe związane z hiperglikemią (takie jak nadmierne pragnienie, wielomocz, nadmierny apetyt i osłabienie), a pacjenci z cukrzycą lub czynnikami ryzyka wystąpienia cukrzycy powinni być regularnie monitorowani pod względem pogorszenia kontroli glikemii (patrz punkt 4.8). Nadwrażliwość Podczas przyjmowania arypiprazolu mogą wystąpić reakcje nadwrażliwości charakteryzujące się objawami reakcji uczuleniowych (patrz punkt 4.8). Zwiększenie masy ciała Obserwowane u pacjentów ze schizofrenią i zaburzeniem afektywnym dwubiegunowym zwiększenie masy ciała jest zwykle spowodowane współistniejącymi chorobami, stosowaniem leków przeciwpsychotycznych, o których wiadomo, że powodują zwiększenie masy ciała, niewłaściwym stylem życia i może prowadzić do ciężkich powikłań.
- CHPL leku Abilify, tabletki, 5 mgSpecjalne środki ostrozności
Po wprowadzeniu leku do obrotu obserwowano zwiększenie masy ciała u pacjentów otrzymujących arypiprazol. Jeśli występowało, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych arypiprazol nie powodował klinicznie istotnego zwiększenia masy ciała u dorosłych (patrz punkt 5.1). W badaniach klinicznych z udziałem młodzieży z zaburzeniem afektywnym dwubiegunowym wykazano, że stosowanie arypiprazolu ma związek ze zwiększeniem masy ciała po 4 tygodniach leczenia. U młodzieży z zaburzeniem afektywnym dwubiegunowym należy kontrolować przyrost masy ciała. Jeśli przyrost masy ciała jest znaczący klinicznie, należy rozważyć zmniejszenie dawki (patrz punkt 4.8). Dysfagia Ze stosowaniem leków przeciwpsychotycznych, w tym arypiprazolu, wiąże się spowolnienie motoryki przełyku i ryzyko aspiracji. Arypiprazol należy stosować ostrożnie u pacjentów z ryzykiem wystąpienia zachłystowego zapalenia płuc.
- CHPL leku Abilify, tabletki, 5 mgSpecjalne środki ostrozności
Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Podczas przyjmowania arypiprazolu u pacjentów mogą występować zwiększone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy obejmują: zwiększenie popędów seksualnych, kompulsywną potrzebę wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania. Ważne jest, aby lekarze przepisujący lek pytali pacjentów lub opiekunów w szczególności o pojawienie się nowego lub zwiększonego popędu do hazardu, popędów seksualnych, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa lub kompulsywnego objadania się, lub innych popędów podczas leczenia arypiprazolem. Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu leku.
- CHPL leku Abilify, tabletki, 5 mgSpecjalne środki ostrozności
Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Lekarz rozważy zmianę dawki lub odstawienie leku, jeśli u pacjenta wystąpią takie popędy podczas przyjmowania arypiprazolu (patrz punkt 4.8). Laktoza ABILIFY tabletki zawierają laktozę. Lek nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy. Pacjenci ze współistniejącym zespołem nadpobudliwości psychoruchowej (ang. attention deficit hyperactivity disorder , ADHD) Pomimo wysokiej częstości współistnienia zaburzenia afektywnego dwubiegunowego typu I oraz zespołu ADHD, dane dotyczące bezpieczeństwa jednoczesnego stosowania arypiprazolu oraz stymulantów są bardzo ograniczone; dlatego też należy zachować wyjątkową ostrożność w razie podawania tych produktów jednocześnie.
- CHPL leku Abilify, tabletki, 5 mgSpecjalne środki ostrozności
Upadki Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków. Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2).
- CHPL leku Abilify, tabletki, 5 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na antagonistyczne działanie na receptor adrenergiczny α 1 , arypiprazol może nasilać działanie niektórych przeciwnadciśnieniowych produktów leczniczych. Ze względu na pierwotne działanie arypiprazolu na OUN, należy zachować ostrożność, jeśli arypiprazol jest podawany razem z alkoholem lub z innymi produktami leczniczymi działającymi na OUN, wywołującymi zbliżone działania niepożądane, takie jak sedacja (patrz punkt 4.8). Należy zachować ostrożność podając arypiprazol równocześnie z produktami leczniczymi, o których wiadomo, że powodują wydłużenie odstępu QT lub zaburzenia elektrolitowe. Możliwy wpływ innych produktów leczniczych na arypiprazol Antagonista receptora H 2 - famotydyna, lek hamujący uwalnianie kwasu żołądkowego, zmniejsza szybkość wchłaniania arypiprazolu, jednak działanie to nie ma znaczenia klinicznego.
- CHPL leku Abilify, tabletki, 5 mgInterakcje
Arypiprazol jest metabolizowany na wiele sposobów, w tym także przez enzymy, takie jak CYP2D6 i CYP3A4. Nie jest jednak metabolizowany przez enzymy z grupy CYP1A, a więc nie jest konieczne stosowanie specjalnych dawek u palaczy tytoniu. Chinidyna i inne silne inhibitory CYP2D6 Wyniki badań klinicznych z udziałem zdrowych osób wykazały, że silny inhibitor enzymu CYP2D6 (chinidyna) zwiększa wartość AUC arypiprazolu o 107%, podczas gdy wartość C max nie zmienia się. Wartości AUC i C max dehydroarypiprazolu, aktywnego metabolitu, były zmniejszone odpowiednio o 32% i 47%. W przypadku jednoczesnego podawania chinidyny i arypiprazolu, należy zmniejszyć dawkę arypiprazolu o około połowę w stosunku do przepisanej dawki. Inne silne inhibitory grupy enzymów CYP2D6, takie jak fluoksetyna i paroksetyna, mogą powodować podobne skutki i w takich sytuacjach należy podobnie zmniejszyć dawkę leku.
- CHPL leku Abilify, tabletki, 5 mgInterakcje
Ketokonazol i inne silne inhibitory CYP3A4 Wyniki badań klinicznych z udziałem zdrowych osób wskazują, że silny inhibitor CYP3A4 (ketokonazol) zwiększa wartości AUC i C max arypiprazolu odpowiednio o 63% i 37%, zaś wartości AUC i C max dehydroarypiprazolu odpowiednio o 77% i 43%. W grupie osób o obniżonej aktywności CYP2D6, równoczesne stosowanie silnych inhibitorów CYP3A4 może powodować zwiększenie stężenia arypiprazolu w osoczu, w porównaniu do osób o podwyższonej aktywności CYP2D6. W przypadku jednoczesnego stosowania ketokonazolu albo innych silnych inhibitorów CYP3A4 z arypiprazolem, zakładane korzyści powinny przeważyć potencjalne ryzyko dla pacjenta. W przypadku jednoczesnego stosowania ketokonazolu z arypiprazolem, przepisaną dawkę arypiprazolu należy zmniejszyć o około połowę. Inne leki silnie hamujące aktywność CYP3A4, takie jak itrakonazol oraz inhibitory proteazy HIV, mogą powodować podobne skutki jak ketokonazol i w takich przypadkach należy podobnie zmniejszyć dawkę (patrz punkt 4.2).
- CHPL leku Abilify, tabletki, 5 mgInterakcje
Po odstawieniu inhibitora CYP2D6 lub CYP3A4, dawkę arypiprazolu należy zwiększyć do tej, jaką stosowano przed rozpoczęciem terapii skojarzonej. W czasie równoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazemu) lub CYP2D6 (np. escytalopramu) z arypiprazolem, można spodziewać się niewielkiego zwiększenia stężenia arypiprazolu w osoczu. Karbamazepina i inne leki indukujące CYP3A4 Po jednoczesnym podaniu karbamazepiny, leku silnie indukującego CYP3A4 w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnie geometryczne wartości C max i AUC arypiprazolu zmniejszyły się odpowiednio o 68% i 73%, w stosunku do wartości tych parametrów podczas stosowania arypiprazolu (30 mg) w monoterapii. Podobnie, w przypadku dehydroarypiprazolu średnie geometryczne wartości C max i AUC po jednoczesnym podaniu karbamazepiny zmniejszają się odpowiednio o 69% i 71%, w stosunku do ich wartości podczas stosowania arypiprazolem w monoterapii.
- CHPL leku Abilify, tabletki, 5 mgInterakcje
Zatem dawkę arypiprazolu należy podwoić, gdy jednocześnie podaje się go z karbamazepiną. Można się spodziewać, że jednoczesne podawanie arypiprazolu i innych leków silnie indukujących CYP3A4 (takich jak ryfampicyna , ryfabutyna, fenytoina, fenobarbital, prymidon, efawirenz, newirapina i ziele dziurawca) może działać podobnie i dlatego należy podobnie zwiększyć dawkę. Po zakończeniu podawania leku silnie indukującego CYP3A4, należy zmniejszyć dawkę arypiprazolu do zalecanej. Walproinian i lit Skojarzone stosowanie walproinianów lub litu z arypiprazolem nie powodowało żadnych istotnych klinicznie zmian stężenia arypiprazolu i w związku z tym nie jest konieczne dostosowanie dawki podczas podawania walproinianu lub litu w skojarzeniu z arypiprazolem. Możliwy wpływ arypiprazolu na inne produkty lecznicze W czasie badań klinicznych, dawki arypiprazolu od 10 mg na dobę do 30 mg na dobę nie wywierały istotnego wpływu na metabolizm substratów CYP2D6 (stosunek dekstrometorfan/3- metoksymorfinan), CYP2C9 (warfaryna), CYP2C19 (omeprazol) i CYP3A4 (dekstrometorfan).
- CHPL leku Abilify, tabletki, 5 mgInterakcje
Ponadto w warunkach in vitro , arypiprazol i dehydroarypiprazol nie zmieniały metabolizmu zachodzącego z udziałem CYP1A2. Istnieje zatem małe prawdopodobieństwo wystąpienia istotnych klinicznie interakcji między produktami leczniczymi metabolizowanymi przez te enzymy. Kiedy arypiprazol był podawany z walproinianem, litem lub lamotryginą nie stwierdzono klinicznie istotnej zmiany w stężeniach walproinianu, litu lub lamotryginy. Zespół serotoninowy Obserwowano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol, a możliwe objawy przedmiotowe oraz podmiotowe dla tego stanu mogą wystąpić szczególnie w przypadku jednoczesnego stosowania innych leków serotoninergicznych, takich jak SSRI/SNRI (selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny) lub leków, o których wiadomo, że zwiększają stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Abilify, tabletki, 5 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie przeprowadzono dotychczas odpowiednich badań z grupą kontrolną otrzymującą placebo dotyczących działania arypiprazolu u kobiet w ciąży. Notowano występowanie wad wrodzonych, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. Na podstawie wyników badań przeprowadzonych na zwierzętach nie można wykluczyć potencjalnego toksycznego wpływu leku na płód (patrz punkt 5.3). Pacjentki należy poinformować o konieczności powiadomienia swojego lekarza, jeśli w trakcie leczenia arypiprazolem zajdą w ciąże lub planują zajście w ciążę. Ze względu na niewystarczające dane dotyczące bezpieczeństwa u ludzi oraz budzące wątpliwości wyniki badań wpływu na rozród na zwierzętach, ten lek nie może być stosowany w okresie ciąży, chyba że spodziewane korzyści wyraźnie przewyższają potencjalne ryzyko dla płodu.
- CHPL leku Abilify, tabletki, 5 mgWpływ na płodność, ciążę i laktację
Noworodki narażone na działanie leków przeciwpsychotycznych (w tym arypiprazolu) w czasie trzeciego trymestru ciąży są w grupie ryzyka, w której mogą wystąpić działania niepożądane, w tym zaburzenia pozapiramidowe i (lub) objawy odstawienne, które po porodzie mogą różnić się ciężkością przebiegu oraz czasem trwania. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być uważnie monitorowane (patrz punkt 4.8). Karmienie piersią Arypiprazol/metabolity przenikają do mleka ludzkiego. Należy podjąć decyzję czy przerwać karmienie piersią, czy przerwać podawanie arypiprazolu biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem na reprodukcję.
- CHPL leku Abilify, tabletki, 5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe (sedacja), senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku Abilify, tabletki, 5 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Najczęściej notowanymi działaniami niepożądanymi w badaniach prowadzonych z grupą kontrolną otrzymującą placebo były akatyzja i nudności, każde występujące częściej niż u 3% pacjentów leczonych arypiprazolem podawanym doustnie. Tabelaryczne zestawienie działań niepożądanych Częstość występowania działań niepożądanych związanych z leczeniem arypiprazolem podano w poniższej tabeli. Dane w tabeli oparto na działaniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układ/narząd i częstości: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000); nie znana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Abilify, tabletki, 5 mgDziałania niepożądane
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Nie można określić częstości działań niepożądanych zgłaszanych po wprowadzeniu do obrotu, ponieważ pochodzą one ze spontanicznych zgłoszeń. Z tego względu częstość takich działań niepożądanych określono jako „nieznana”.
- CHPL leku Abilify, tabletki, 5 mgDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia krwii układu chłonnego LeukopeniaNeutropenia Trombocytopenia Zaburzenia układu immunologicznego Reakcje uczuleniowe (np. reakcja anafilaktyczna, obrzęk naczynioruchowy obejmujący obrzęk języka, obrzęk twarzy,świąd alergiczny lub pokrzywkę) Zaburzenia endokrynologiczne Hiperprolaktynemia Zmniejszenie stężenia prolaktynywe krwi Cukrzycowa śpiączka hiperosmolarnaCukrzycowa kwasica ketonowa Zaburzenia metabolizmu iodżywiania Cukrzyca Hiperglikemia Hiponatremia Anoreksja - CHPL leku Abilify, tabletki, 5 mgDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia psychiczne Bezsenność LękNiepokój, zwł. ruchowy Depresja Hiperseksualność Próby samobójcze, myśli samobójcze i dokonane samobójstwa (patrz punkt 4.4) Patologiczne uzależnienie od hazarduZaburzenie kontroli impulsów ObżarstwoKompulsywna potrzeba wydawania pieniędzy Poriomania Zachowania agresywne Nadmierne pobudzenieNerwowość Zaburzenia układu nerwowego Akatyzja Zaburzenia pozapiramidowe DrżenieBóle głowy Sedacja SennośćZawroty głowy Późne dyskinezy DystoniaZespół„niespokojnych nóg” Złośliwy zespół neuroleptyczny Drgawki typu grand mal Zespół serotoninowy Zaburzenia mowy Zaburzenia oka Niewyraźne widzenie Podwójne widzenie Światłowstręt (fotofobia) Napad przymusowego patrzenia z rotacją gałek ocznych Zaburzenia serca Tachykardia Nagły zgon niewyjaśniony Torsades de pointes Arytmia komorowa Zatrzymanie akcji sercaBradykardia Zaburzenia naczyniowe Hipotensja ortostatyczna Choroba zakrzepowo-zatorowa żył (w tym zator płucny i zakrzepica żył głębokich) Nadciśnienie tętniczeOmdlenia Zaburzenia układu oddechowego, klatki piersiowej iśródpiersia Czkawka Zachłystowe zapalenie płuc Skurcz krtaniSkurcz części ustnej gardła Zaburzenia żołądka i jelit Zaparcia Niestrawność Nudności Nadmierne wydzielanie ślinyWymioty Zapalenie trzustki Dysfagia BiegunkaDyskomfort w jamie brzusznej Dyskomfort w obrębie żołądka Zaburzeniawątroby i dróg żółciowych Niewydolność wątrobyZapalenie wątroby Żółtaczka Zaburzenia skóry i tkanki podskórnej WysypkaReakcja fotoalergiczna ŁysienieNadmierne pocenie sięWysypka polekowa z eozynofiliąi objawami ogólnoustrojowymi (zespół DRESS) - CHPL leku Abilify, tabletki, 5 mgDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia mięśniowo- szkieletowe itkanki łącznej Rozpad mięśni poprzecznie prążkowanych (rabdomioliza) Bóle mięśnioweSztywność Zaburzenia nereki dróg moczowych Nietrzymanie moczu Zatrzymanie moczu Ciąża, połóg iokresokołoporodowy Zespół abstynencyjny u noworodków (patrz punkt 4.6) Zaburzenia układu rozrodczego ipiersi Priapizm Zaburzenia ogólne i stany w miejscu podania Zmęczenie Zaburzenia regulacji temperatury (np. hipotermia, gorączka)Ból w klatce piersiowej Obrzęk obwodowy Badaniadiagnostyczne Zmniejszenie masy ciała Zwiększenie masy ciała Zwiększenie aktywności aminotransferazy alaninowej Zwiększenie aktywności aminotransferazy asparaginianowej Zwiększenie aktywności gammaglutamylotransferazy Zwiększenie aktywności fosfatazy alkalicznej Wydłużenie odstępu QTZwiększenie stężenia glukozy we krwiZwiększenie stężenia glikozylowanej hemoglobiny Wahania stężenia glukozy we krwiZwiększona aktywność fosfokinazy kreatynowej - CHPL leku Abilify, tabletki, 5 mgDziałania niepożądane
Opis wybranych działań niepożądanych Dorośli Objawy pozapiramidowe (ang. EPS) Schizofrenia: w długookresowym 52-tygodniowym badaniu prowadzonym z grupą kontrolną, u pacjentów leczonych arypiprazolem ogólnie rzadziej występowały EPS (25,8%), w tym parkinsonizm, akatyzja, dystonia i dyskineza, w porównaniu do pacjentów leczonych haloperydolem (57,3%). W długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, częstość występowania EPS wynosiła 19% w przypadku pacjentów leczonych arypiprazolem i 13,1% w przypadku pacjentów otrzymujących placebo. W innym długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną częstość występowania EPS wynosiła 14,8% w przypadku pacjentów leczonych arypiprazolem i 15,1% w przypadku pacjentów otrzymujących olanzapinę. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I: w 12- tygodniowym badaniu prowadzonym z grupą kontrolną przypadki EPS stwierdzano u 23,5% pacjentów leczonych arypiprazolem i u 53,3% pacjentów leczonych haloperydolem.
- CHPL leku Abilify, tabletki, 5 mgDziałania niepożądane
W innym 12- tygodnowym badaniu przypadki EPS stwierdzano u 26,6% pacjentów leczonych arypiprazolem i u 17,6% pacjentów leczonych litem. W długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo podczas fazy leczenia podtrzymującego przypadki EPS wystąpiły u 18,2% pacjentów leczonych arypiprazolem i u 15,7% pacjentów otrzymujących placebo. Akatyzja W badaniach prowadzonych z grupą kontrolną otrzymującą placebo przypadki akatyzji u pacjentów z zaburzeniami afektywnymi dwubiegunowymi występowały u 12,1% pacjentów leczonych arypiprazolem i u 3,2% pacjentów otrzymujących placebo. U pacjentów ze schizofrenią liczba przypadków akatyzji wynosiła 6,2% w grupie arypiprazolu i 3,0% w grupie placebo. Dystonia Efekt klasy terapeutycznej: objawy dystonii, długotrwałe nieprawidłowe skurcze grup mięśni, mogą występować u wrażliwych pacjentów w ciągu pierwszych kilku dni leczenia.
- CHPL leku Abilify, tabletki, 5 mgDziałania niepożądane
Do objawów dystonii należą: skurcze mięśni szyi, czasami postępujące do ucisku w gardle, trudności z przełykaniem, trudności z oddychaniem i (lub) zaburzenia ruchów języka. Chociaż objawy te mogą występować po zastosowaniu małych dawek, występują częściej i o większym nasileniu podczas stosowania leków przeciwpsychotycznych pierwszej generacji o dużych mocach i w większych dawkach. Obserwowano zwiększone ryzyko ostrej dystonii u mężczyzn i w młodszych grupach wiekowych. Prolaktyna Podczas badań klinicznych w zakresie zarejestrowanych wskazań i po wprowadzeniu produktu leczniczego do obrotu u pacjentów otrzymujących arypiprazol obserwowano zarówno zwiększenie, jak i zmniejszenie stężenia prolaktyny w surowicy w porównaniu do pomiarów początkowych (punkt 5.1). Parametry laboratoryjne Porównania pomiędzy arypiprazolem i placebo dotyczące odsetka pacjentów, u których wystąpiły potencjalnie istotne zmiany rutynowych parametrów laboratoryjnych i lipidowych (patrz punkt 5.1), nie wykazały medycznie istotnych różnic (patrz punkt 5.1).
- CHPL leku Abilify, tabletki, 5 mgDziałania niepożądane
Ogólnie przejściowe i bezobjawowe zwiększenie aktywności CPK (fosfokinazy kreatynowej) obserwowano u 3,5% pacjentów leczonych arypiprazolem w porównaniu do 2,0% pacjentów otrzymujących placebo. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej W krótkoterminowym badaniu z kontrolą placebo, w którym udział wzięło 302 nastolatków (od 13 do 17 lat) chorych na schizofrenię, częstość występowania i rodzaj reakcji niepożądanych były podobne do występujących u dorosłych, z wyjątkiem następujących działań niepożądanych zgłaszanych częściej u nastolatków otrzymujących arypiprazol niż u dorosłych otrzymujących arypiprazol (i częściej niż placebo): Senność/sedacja i zaburzenia pozapiramidowe były zgłaszane bardzo często (≥1/10), oraz suchość w jamie ustnej, zwiększony apetyt, niedociśnienie ortostatyczne były zgłaszane często (≥1/100, <1/10).
- CHPL leku Abilify, tabletki, 5 mgDziałania niepożądane
Profil bezpieczeństwa w 26-tygodniowym badaniu prowadzonym na zasadzie próby otwartej, był podobny do obserwowanego w badaniu krótkoterminowym z kontrolą placebo. Profil bezpieczeństwa w długoterminowym badaniu prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo był podobny z wyjątkiem następujących reakcji, które były zgłaszane częściej, niż w grupie dzieci i młodzieży przyjmujących placebo: często zgłaszano zmniejszenie masy ciała, zwiększenie stężenia insuliny we krwi, arytmię i leukopenię (≥1/100, <1/10). W zebranej populacji nastolatków (od 13 do 17 lat) chorych na schizofrenię, leczonych do 2 lat, przypadki małego stężenia prolaktyny w surowicy stwierdzono u 29,5% dziewcząt (<3 ng/ml) i 48,3% chłopców (<2 ng/ml). W grupie młodzieży (w wieku od 13 do 17 lat) ze schizofrenią, otrzymującej dawki arypiprazolu od 5 mg do 30 mg przez okres maksymalnie do 72 miesięcy, częstość występowania niskich stężeń prolaktyny w surowicy u kobiet (<3 ng/ml) i u mężczyzn (<2 ng/ml) wynosiła odpowiednio 25,6% i 45,0%.
- CHPL leku Abilify, tabletki, 5 mgDziałania niepożądane
Podczas dwóch długoterminowych badań z udziałem młodzieży (od 13 do 17 lat) ze schizofrenią i pacjentów z chorobą afektywną dwubiegunową leczonych arypiprazolem, częstość występowania małych stężeń prolaktyny w surowicy u kobiet (<3 ng/ml) i mężczyzn (<2 ng/ml) wynosiła odpowiednio 37,0% i 59,4%. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej Częstość występowania i rodzaj reakcji niepożądanych u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I były podobne do występujących u dorosłych, z wyjątkiem następujących działań niepożądanych: senność (23,0%), zaburzenia pozapiramidowe (18.4%), akatyzja (16.0%) i zmęczenie (11.8%) były zgłaszane bardzo często (≥1/10); natomiast ból w górnej części brzucha, zwiększenie częstości akcji serca, zwiększenie masy ciała, zwiększenie apetytu, drżenie mięśni oraz dyskineza były zgłaszane często (≥1/100, <1/10).
- CHPL leku Abilify, tabletki, 5 mgDziałania niepożądane
Następujące reakcje niepożądane miały prawdopodobnie związek z zastosowaną dawką: zaburzenia pozapiramidowe (częstość występowania w przypadku dawki 10 mg wynosiła 9,1%; w przypadku dawki 30 mg 28,8%; w przypadku placebo 1,7%); i akatyzja (częstość występowania w przypadku dawki 10 mg wynosiła 12,1%; w przypadku dawki 30 mg 20,3%; w przypadku placebo 1,7%). Średnie zmiany masy ciała u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I po 12. oraz 30. tygodniu wynosiły odpowiednio w przypadku arypiprazolu 2,4 kg oraz 5,8 kg, a w przypadku placebo 0,2 kg oraz 2,3 kg. W populacji dzieci i młodzieży senność oraz zmęczenie obserwowano częściej u pacjentów z zaburzeniem afektywnym dwubiegunowym, w porównaniu do pacjentów ze schizofrenią. W populacji dzieci i młodzieży z zaburzeniem afektywnym dwubiegunowym (od 10 do 17 lat), leczonych do 30 tygodni, przypadki małego stężenia prolaktyny w surowicy stwierdzono u 28,0% dziewcząt (<3 ng/ml) i 53,3% chłopców (<2 ng/ml).
- CHPL leku Abilify, tabletki, 5 mgDziałania niepożądane
Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Patologiczne uzależnienie od hazardu, hiperseksualność, kompulsywna potrzeba wydawania pieniędzy i obżarstwo lub kompulsywne objadanie się mogą wystąpić u pacjentów leczonych arypiprazolem (patrz punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania wymienionego w załączniku V .
- CHPL leku Abilify, tabletki, 5 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedmiotowe i podmiotowe W badaniach klinicznych i po wprowadzeniu produktu do obrotu przypadkowe bądź zamierzone przedawkowanie samego arypiprazolu stwierdzono u dorosłych pacjentów po oszacowanej dawce do 1260 mg niezakończone zgonem. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: letarg, wzrost ciśnienia tętniczego krwi, senność, przyspieszona czynność serca (tachykardia), nudności, wymioty i biegunka. Ponadto zgłaszano przypadkowe przedawkowanie samego arypiprazolu (do 195 mg) u dzieci, bez zgonów. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: senność, przejściowa utrata świadomości i objawy pozapiramidowe. Postępowanie po przedawkowaniu W przypadku przedawkowania leku stosuje się leczenie podtrzymujące, polegające na utrzymaniu drożności dróg oddechowych, dotlenianiu i wentylacji oraz leczeniu objawowym. Należy wziąć pod uwagę możliwość wpływu wielu produktów leczniczych.
- CHPL leku Abilify, tabletki, 5 mgPrzedawkowanie
Z tego względu należy niezwłocznie rozpocząć monitorowanie czynności układu krążenia, obejmujące stałe monitorowanie zapisu elektrokardiograficznego, w celu wykrycia możliwych zaburzeń rytmu serca. W przypadku potwierdzonego lub podejrzewanego przedawkowania arypiprazolu należy objąć pacjenta ścisłą kontrolą i obserwować go do czasu poprawy jego stanu. Aktywowany węgiel (50 g), podany w godzinę po zażyciu arypiprazolu, obniża wartość C max leku o około 41%, a wartość AUC o około 51%, co wskazuje na jego skuteczność w leczeniu przedawkowania. Hemodializa Pomimo że brak informacji dotyczących wpływu hemodializ w leczeniu przedawkowania arypiprazolu, to jednak istnieje małe prawdopodobieństwo, by hemodializy były użyteczne w takich przypadkach, ze względu na znaczny stopień wiązania arypiprazolu z białkami osocza.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12 Mechanizm działania Uważa się, że skuteczność arypiprazolu w leczeniu schizofrenii i zaburzenia afektywnego dwubiegunowego typu I jest związana ze skojarzonym działaniem częściowo agonistycznym w stosunku do receptora dopaminowego D 2 i serotoninowego 5-HT 1A oraz antagonistycznym w stosunku do receptora serotoninowego 5-HT 2A . Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D 2 i D 3 , serotoninowych 5-HT 1A i 5-HT 2A oraz umiarkowane powinowactwo do receptorów dopaminowych D 4 , serotoninowych 5-HT 2C i 5-HT 7 , a także adrenergicznych alfa-1 i histaminowych H 1 .
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Arypiprazol w dawkach od 0,5 mg do 30 mg, podawany raz na dobę przez 2 tygodnie osobom zdrowym powoduje zależne od dawki zmniejszenie wiązania rakloprydu znakowanego 11 C, ligandu receptora D 2 /D 3 , w jądrze ogoniastym i skorupie, co można wykryć za pomocą pozytonowej tomografii emisyjnej. Skuteczność kliniczna i bezpieczeństwo stosowania Dorośli Schizofrenia Wyniki trzech krótkoterminowych badań (od 4 do 6 tygodni) z grupą kontrolną otrzymującą placebo, w których udział wzięło 1 228 dorosłych chorych na schizofrenię, u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
Arypiprazol jest skuteczny w podtrzymywaniu poprawy klinicznej podczas kontynuacji leczenia u tych dorosłych pacjentów, u których obserwowano wstępną dobrą reakcję na lek. W badaniu z grupą kontrolną przyjmującą haloperydol, odsetek pacjentów, u których udało się utrzymać dobrą reakcję na produkt leczniczy, w ciągu 52 tygodni był podobny w obu grupach (arypiprazol 77% i haloperydol 73%). Badanie ukończyła istotnie większa grupa pacjentów leczonych arypiprazolem (43%) niż haloperydolem (30%). Wyniki uzyskane w skalach ocen stosowanych jako drugorzędowe punkty końcowe skuteczności, w tym w skali PANSS i w skali oceny depresji Montgomery-Asberg [ang. Montgomery–Åsberg-Depression-Rating-Scale, MADRS], wskazują na istotną poprawę w stosunku do haloperydolu. W trwającym 26 tygodni badaniu prowadzonym z grupą kontrolną otrzymującą placebo, z udziałem pacjentów dorosłych z ustabilizowaną przewlekłą schizofrenią stwierdzono w wyniku leczenia arypiprazolem większe zmniejszenie częstości nawrotów, 34% w grupie leczonych arypiprazolem i 57% w grupie otrzymującej placebo.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
Przyrost masy ciała Wyniki badań klinicznych wskazują, że arypiprazol nie powoduje klinicznie istotnego przyrostu masy ciała. W trwającym 26 tygodni badaniu z grupą kontrolną leczonych olanzapiną i wykorzystaniem podwójnie ślepej próby, przeprowadzonym w wielu krajach, udział wzięło 314 dorosłych pacjentów ze schizofrenią. Pierwszorzędowym punktem końcowym była ocena przyrostu masy ciała. U istotnie mniejszej liczby pacjentów leczonych arypiprazolem w porównaniu z otrzymującymi olanzapinę, stwierdzono przyrost masy ciała o co najmniej 7% w porównaniu z pomiarem początkowym (tzn. przyrost masy ciała o co najmniej 5,6 kg przy średniej początkowej masie wynoszącej ok. 80,5 kg) w grupie leczonych arypiprazolem (n = 18 lub 13% pacjentów nadających się do oceny), w porównaniu z grupą otrzymującą olanzapinę (n = 45 lub 33% pacjentów nadających się do oceny).
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
Stężenia lipidów W zbiorczej analizie wyników stężeń lipidów pochodzących z badań klinicznych prowadzonych z grupą kontrolną otrzymującą placebo u dorosłych, arypiprazol nie powodował klinicznie istotnych zmian stężeń cholesterolu całkowitego, triglicerydów, cholesterolu frakcji lipoprotein o dużej gęstości (HDL) i cholesterolu frakcji lipoprotein o małej gęstości (LDL). Prolaktyna Stężenia prolaktyny oceniono podczas wszystkich badań z zastosowaniem wszystkich dawek arypiprazolu (n = 28 242). Częstość występowania hiperprolaktynemii lub zwiększenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem (0,3%) była podobna do częstości występowania hiperprolaktynemii w grupie otrzymującej placebo (0,2%). U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia hiperprolaktynemii wynosiła 42 dni, a mediana czasu trwania wynosiła 34 dni.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
Częstość występowania hiperprolaktynemii lub zmniejszenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem wynosiła 0,4% w porównaniu do 0,02% w grupie otrzymującej placebo. U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 30 dni, a mediana czasu trwania wynosiła 194 dni. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I W dwóch 3-tygodniowych badaniach, prowadzonych z grupą kontrolną otrzymującą placebo, z zastosowaniem zmiennej dawki, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol był znacząco bardziej skuteczny niż placebo w zmniejszaniu objawów maniakalnych w ciągu 3 tygodni. Badania te obejmowały pacjentów z objawami lub bez objawów psychotycznych oraz pacjentów z szybką zmianą fazy lub bez szybkiej zmiany fazy (przebieg typu rapid-cycling).
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
W jednym 3-tygodniowym badaniu, prowadzonym z grupą kontrolną otrzymującą placebo, z zastosowaniem stałej dawki w monoterapii, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol nie wykazał większej skuteczności niż placebo. W dwóch 12-tygodniowych badaniach, prowadzonych z grupą kontrolną otrzymującą placebo oraz inne substancje czynne, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, arypiprazol był skuteczniejszy niż placebo w 3. tygodniu badania, a wynik leczenia podtrzymującego był w 12. tygodniu badania porównywalny z wynikiem dla litu lub haloperydolu. W 12. tygodniu arypiprazol powodował także remisję objawów maniakalnych u porównywalnej liczby pacjentów co lit lub haloperydol.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
W 6-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, którzy częściowo nie reagowali na monoterapię litem lub walproinianem przez 2 tygodnie przy terapeutycznych stężeniach w surowicy, zastosowanie arypiprazolu jako dodatkowego leku w większym stopniu zwiększyło skuteczność zapobiegania objawom maniakalnym niż stosowanie litu lub walproinianu w monoterapii. W 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, które przedłużono o 74 tygodnie, u pacjentów z objawami maniakalnymi, którzy osiągnęli remisję w trakcie stosowania arypiprazolu w czasie fazy stabilizacji przed randomizacją, arypiprazol był bardziej skuteczny niż placebo w zapobieganiu nawrotowi chorobie dwubiegunowej, głównie w zapobieganiu nawrotowi objawów maniakalnych, ale nie wykazał przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
W 52-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, u pacjentów z obecnym epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, którzy osiągnęli trwałą remisję (w skali oceny manii Younga [ang. Young Mania Rating Scale, YMRS] oraz w skali oceny depresji MADRS z całkowitą ilością punktów ≤ 12) w trakcie stosowania arypiprazolu (w dawce od 10 mg na dobę do 30 mg na dobę) w skojarzeniu z litem lub walproinianem przez 12 kolejnych tygodni, połączenie z arypiprazolem wykazało przewagę nad placebo w zapobieganiu nawrotowi choroby afektywnej dwubiegunowej zmniejszając ryzyko o 46% (współczynnik ryzyka 0,54) i w zapobieganiu nawrotom manii zmniejszając ryzyko o 65% (współczynnik ryzyka 0,35), ale nie wykazało przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
Zastosowanie arypiprazolu jako dodatkowego leku wykazało przewagę wobec placebo w przypadku drugorzędowego pomiaru wyniku leczenia w ocenach ogólnego wrażenia klinicznego w wersji dla ChAD (ang. Clinical Global Impression - Bipolar version, CGI-BP) nasilenia choroby (mania) (ang. Severity of illness , SOI [mania]). W tym badaniu, pacjenci zostali przydzieleni przez badaczy do badania prowadzonego metodą próby otwartej, z zastosowaniem litu lub walproinianu w monoterapii, w celu oceny częściowego braku odpowiedzi. Pacjenci byli stabilizowani przez co najmniej 12 kolejnych tygodni za pomocą skojarzenia arypiprazolu i stosowanego wcześniej stabilizatora nastroju. Pacjenci stabilni byli następnie losowo przydzielani do grupy kontynuującej stosowanie tego samego stabilizatora nastroju z arypiprazolem lub placebo w badaniu metodą podwójnie ślepej próby.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
W fazie randomizowanej oceniano cztery podgrupy stabilizatora nastroju: arypiprazol + lit; arypiprazol + walproinian; placebo + lit; placebo + walproinian. Odsetki Kaplana- Meiera dla nawrotu jakiegokolwiek zaburzenia nastroju w przypadku zastosowania dodatkowego leku były następujące: 16% w grupie stosującej arypiprazol + lit i 18% w grupie stosującej arypiprazol + walproinian, w porównaniu do 45% w grupie stosującej placebo + lit i 19% w grupie stosującej placebo + walproinian. Populacja dzieci i młodzieży Schizofrenia u młodzieży Wyniki 6-tygodniowego badania z grupą kontrolną otrzymującą placebo, w którym udział wzięło 302 nastoletnich pacjentów chorych na schizofrenię (od 13 do 17 lat), u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje statystycznie istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
W czasie trwania 26-tygodniowego badania prowadzonego metodą otwartej próby w analizie podgrupy nastoletnich pacjentów w wieku od 15 do 17 lat obserwowano utrzymywanie się działania u 74% całkowitej populacji włączonej do badania. W badaniu z randomizacją, prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo, trwającym od 60 do 89 tygodni, które prowadzono z udziałem młodzieży ze schizofrenią (n = 146; w wieku od 13 do 17 lat) występowała statystycznie znamienna różnica w zakresie odsetka nawrotów objawów psychotycznych pomiędzy grupą otrzymującą arypiprazol (19,39%) a grupą otrzymującą placebo (37,5%). Punkt szacunkowy współczynnika ryzyka (HR) w całej populacji wynosił 0,461 (95% przedział ufności, od 0,242 do 0,879). W analizach w podgrupach punkt szacunkowy współczynnika ryzyka wynosił 0,495 wśród uczestników w wieku od 13 do 14 lat w porównaniu do 0,454 wśród uczestników w wieku od 15 do 17 lat.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
Jednak ocena szacunkowa współczynnika ryzyka w grupie młodszych uczestników (od 13 do 14 lat) nie była precyzyjna, odzwierciedlając mniejszą liczebność uczestników w tej grupie (arypiprazol, n = 29; placebo, n = 12) i przedział ufności dla tej oceny szacunkowej (wynoszący od 0,151 do 1,628) uniemożliwiał wyciągnięcie wniosków odnośnie występowania wyniku leczenia. Natomiast 95% przedział ufności dla współczynnika ryzyka w podgrupie starszych uczestników (arypiprazol, n = 69; placebo, n = 36) wynosił od 0,242 do 0,879 i dlatego można wyciągnąć wnioski odnośnie wyników leczenia u starszych pacjentów. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u dzieci i młodzieży Arypiprazol badano w 30-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, w którym udział wzięło 296 dzieci i młodzieży (od 10 do 17 lat), którzy spełnili kryteria diagnostyczne według DSM-IV (ang.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
Diagnostic and Statistical Manual of Mental Disorders ) dla zaburzenia afektywnego dwubiegunowego typu I z epizodami maniakalnymi lub mieszanymi z objawami psychotycznymi lub bez tych objawów oraz wyjściowo mieli wynik ≥20 w skali manii według Younga (Y-MRS). Wśród pacjentów włączonych do podstawowej analizy skuteczności, 139 pacjentów miało postawioną diagnozę aktualnie współistniejącego ADHD. Arypiprazol wykazał przewagę w stosunku do placebo w odniesieniu do zmiany wartości wyjściowej w 4. oraz 12. tygodniu jako wynik całościowy wg Y-MRS. W analizie post-hoc przewaga nad placebo była bardziej wyraźna u pacjentów ze współistniejącym zespołem ADHD w porównaniu do pacjentów bez ADHD, gdzie nie zaobserwowano różnicy w stosunku do placebo. Zapobieganie nawrotom nie zostało określone. Do najczęstszych zdarzeń niepożądanych występujących w trakcie leczenia, wśród pacjentów otrzymujących dawkę 30 mg, były zaburzenia pozapiramidowe (28,3%), senność (27,3%), ból głowy (23,2%) oraz nudności (14,1%).
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
Średni przyrost masy ciała w 30-tygodniowm okresie leczenia wynosił 2,9 kg, w porównaniu do 0,98 kg u pacjentów, u których stosowano placebo. Drażliwość związana z zaburzeniami autystycznymi u dzieci i młodzieży (patrz punkt 4.2) U pacjentów w wieku od 6 do 17 lat arypiprazol badano w dwóch 8-tygodniowych badaniach prowadzonych z grupą kontrolną otrzymującą placebo [w jednym badaniu stosowano zmienną dawkę (od 2 mg na dobę do 15 mg na dobę), a w drugim stałą dawkę (5 mg na dobę, 10 mg na dobę lub 15 mg na dobę)] oraz jednym 52-tygodniowym badaniu otwartym. Dawkowanie w tych badaniach rozpoczynano od dawki 2 mg na dobę, po tygodniu zwiększanej do 5 mg na dobę, a następnie zwiększanej w odstępach tygodniowych o 5 mg na dobę do czasu osiągnięcia dawki docelowej. Ponad 75% pacjentów miało mniej niż 13 lat. Arypiprazol wykazał statystycznie większą skuteczność w porównaniu do placebo w podskali dotyczącej drażliwości Listy Zachowań Aberracyjnych (ang.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
Aberrant Behaviour Checklist Irritability subscale ). Jednakże, nie ustalono znaczenia klinicznego tej obserwacji. Profil bezpieczeństwa obejmował przyrost masy ciała i zmianę stężenia prolaktyny. Czas trwania długoterminowego badania dotyczącego bezpieczeństwa był ograniczony do 52-tygodni. W zebranych badaniach, częstość występowania małego stężenia prolaktyny u dziewcząt (<3 ng/ml) i u chłopców (<2 ng/ml) leczonych arypiprazolem wynosiła odpowiednio, 27/46 (58,7%) i 258/298 (86,6%). W badaniach prowadzonych z grupą kontrolną otrzymującą placebo średni przyrost masy ciała wynosił 0,4 kg w grupie placebo i 1,6 kg w grupie arypiprazolu. Arypiprazol badano także w długoterminowym badaniu leczenia podtrzymującego, prowadzonym z grupą kontrolną otrzymującą placebo. Po od 13- do 26-tygodniowej stabilizacji z zastosowaniem arypiprazolu (w dawkach od 2 mg na dobę do 15 mg na dobę), pacjenci z trwałą odpowiedzią albo kontynuowali leczenie arypiprazolem, albo otrzymywali placebo przez kolejne 16 tygodni.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
Odsetki Kaplana-Meiera dla nawrotu w tygodniu 16. były następujące: 35% dla grupy stosującej arypiprazol oraz 52% dla grupy placebo; współczynnik ryzyka nawrotu w 16 tygodniu (arypiprazol/placebo) wynosił 0,57 (różnica nieistotna statystycznie). Średni przyrost masy ciała w fazie stabilizacji (do 26 tygodni) w grupie otrzymującej arypiprazol wynosił 3,2 kg, natomiast w drugiej fazie badania (16 tygodni) obserwowano dalszy średni wzrost o 2,2 kg w grupie otrzymującej arypiprazol w porównaniu do 0,6 kg w grupie placebo. Objawy pozapiramidowe były zgłaszane głównie w fazie stabilizacji, u 17% pacjentów, z drgawkami stanowiącymi 6,5%. Tiki związane z zespołem Tourette’a u dzieci i młodzieży (patrz punkt 4.2) Skuteczność arypiprazolu badano u dzieci i młodzieży z zespołem Tourette’a (arypiprazol: n = 99, placebo: n = 44) w trwającym 8 tygodni, randomizowanym badaniu prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo w schemacie leczenia w grupach z użyciem stałej dawki zależnej od masy ciała od 5 mg na dobę do 20 mg na dobę i dawki początkowej wynoszącej 2 mg.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
Pacjenci byli w wieku od 7 do 17 lat i przed rozpoczęciem leczenia uzyskali średni wynik 30 na łącznej skali tików w Globalnej Skali Nasilenia Tików z Yale ( Total Tic Score on the Yale Global Tic Severity Scale , TTS-YGTSS). Grupa pacjentów otrzymująca arypiprazol wykazywała poprawę mierzoną zmianą wyniku na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 8 tygodniu leczenia, która wynosiła 13,35 w grupie otrzymującej małą dawkę (5 mg lub 10 mg) i 16,94 w grupie otrzymującej dużą dawkę (10 mg lub 20 mg) w porównaniu do poprawy odnotowanej u pacjentów otrzymujących placebo i zmiany wynoszącej 7,09. Skuteczność arypiprazolu u dzieci i młodzieży z zespołem Touretta (arypiprazol: n = 32, placebo: n = 29) oceniano również w przypadku podawania zmiennych dawek od 2 mg na dobę do 20 mg na dobę z dawką początkową wynoszącą 2 mg w trwającym 10 tygodni, randomizowanym badaniu prowadzonym w Korei Południowej prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakodynamiczne
Pacjenci w wieku od 6 do 18 lat uzyskali średni wynik 29 na skali TTS-YGTSS w pomiarze początkowym. Pacjenci otrzymujący arypiprazol wykazywali poprawę mierzoną zmianą wyniku o 14,97 na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 10 tygodniu w porównaniu do poprawy wynoszącej 9,62 w grupie placebo. W obu wspomnianych badaniach krótkoterminowych nie określono klinicznego znaczenia wyników dotyczących skuteczności, biorąc pod uwagę wielkość działania terapeutycznego w porównaniu do dużego wpływu efektu placebo i niejasne skutki w zakresie funkcjonowania psychospołecznego. Brak danych długoterminowych dotyczących skuteczności i bezpieczeństwa stosowania arypiprazolu w tej niestabilnej chorobie. Europejska Agencja Leków wstrzymała obowiązek dołączania wyników badań produktu leczniczego ABILIFY w jednej lub kilku podgrupach populacji dzieci i młodzieży w leczeniu schizofrenii oraz w leczeniu choroby afektywnej dwubiegunowej (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Arypiprazol jest dobrze wchłaniany, maksymalne stężenie w osoczu osiąga w ciągu od 3 do 5 godzin po podaniu. Arypiprazol w minimalnym stopniu ulega metabolizmowi przedukładowemu. Bezwzględna dostępność po doustnym podaniu jednej tabletki wynosi 87%. Spożywanie posiłków o dużej zawartości tłuszczu nie wpływa na farmakokinetykę arypiprazolu. Dystrybucja Arypiprazol jest rozmieszczany w całym organizmie, pozorna objętość dystrybucji wynosi 4,9 l/kg, co wskazuje na znaczną dystrybucję pozanaczyniową. W stężeniach terapeutycznych arypiprazol i dehydroarypiprazol wiążą się w ponad 99% z białkami surowicy, głównie z albuminami. Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie. Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakokinetyczne
Jak wynika z badań in vitro , enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N- dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. W stanie stacjonarnym aktywny metabolit, dehydroarypiprazol, stanowi około 40% AUC arypiprazolu w osoczu. Eliminacja Średni okres półtrwania arypiprazolu w fazie eliminacji wynosi około 75 godzin u osób o podwyższonej aktywności CYP2D6 i około 146 godzin u osób o obniżonej aktywności CYP2D6. Całkowity klirens arypiprazolu wynosi 0,7 ml/min/kg i jest to głównie klirens wątrobowy. Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [ 14 C], stwierdza się odpowiednio 27% i 60% podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1% niezmienionego arypiprazolu zostaje wydalone z moczem i około 18% z kałem.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakokinetyczne
Dzieci i młodzież Farmakokinetyka arypiprazolu i dehydroarypiprazolu u dzieci w wieku od 10 do 17 lat była podobna do farmakokinetyki u dorosłych, po uwzględnieniu różnic w masie ciała. Farmakokinetyka w szczególnych grupach pacjentów Pacjenci w podeszłym wieku Nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi, nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Nie stwierdzono, aby farmakokinetyka arypiprazolu różniła się u zdrowych kobiet i zdrowych mężczyzn. Nie stwierdzono także żadnego mierzalnego wpływu płci na farmakokinetykę leku u pacjentów ze schizofrenią. Palenie tytoniu Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie wpływów na farmakokinetykę arypiprazolu, zależnych od palenia tytoniu.
- CHPL leku Abilify, tabletki, 5 mgWłaściwości farmakokinetyczne
Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy. Zaburzenia czynności nerek Stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u osób z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badania obejmujące podanie pojedynczej dawki leku, przeprowadzone u osób z różnego stopnia marskością wątroby (klasy Childa-Pugha A, B i C) nie wykazały, by zaburzenia czynności wątroby wpływały istotnie na farmakokinetykę arypiprazolu i dehydroarypiprazolu, jednak w badaniu wzięło udział tylko 3 chorych z marskością wątroby klasy C, co jest liczbą niewystarczającą do wyciągnięcia wniosków dotyczących zdolności metabolicznych tych pacjentów.
- CHPL leku Abilify, tabletki, 5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Istotne działanie toksyczne stwierdzano jedynie po podaniu dawek lub przy stopniu narażenia wyraźnie przekraczającym maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza (gromadzenie barwnika lipofuscyny i (lub) obumieranie komórek miąższowych) stwierdzany u szczurów po 104 tygodniach podawania arypiprazolu w dawce od 20 mg/kg mc. na dobę do 60 mg/kg mc.
- CHPL leku Abilify, tabletki, 5 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała od 3 do 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki) i zwiększenie częstości występowania raków nadnerczy, a także skojarzonej częstości występowania gruczolaków lub raków nadnerczy u samic szczurów otrzymujących lek w dawce 60 mg/kg mc. na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki). Największa ekspozycja nie powodująca powstawania nowotworów u samic szczurów odpowiadała 7- krotnie większej ekspozycji niż ekspozycja występująca u ludzi po zastosowaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych sprzężonych związków hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 mg/kg mc. na dobę do 125 mg/kg mc.
- CHPL leku Abilify, tabletki, 5 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym była od 1 do 3 razy wyższa niż wartość występująca u ludzi po podaniu maksymalnej zalecanej dawki klinicznej lub od 16 do 81 razy wyższa niż po podaniu maksymalnej dawki zalecanej na podstawie przeliczenia mg/m 2 pc.). Jednak stężenie sprzężonych związków siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania najwyższej proponowanej dawki 30 mg na dobę, nie przekraczało 6% stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie mniejsze (6%) niż granica rozpuszczalności określona in vitro . W badaniach toksykologicznych po podaniu wielokrotnym u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt oraz brak jest dowodów neurotoksyczności i niepożądanego wpływu na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych.
- CHPL leku Abilify, tabletki, 5 mgPrzedkliniczne dane o bezpieczeństwie
Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowano toksyczny wpływ na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po zastosowaniu dawek maksymalnych zalecanych u ludzi). Toksyczny wpływ na ciężarne samice obserwowano podczas podawania dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Abilify, tabletki, 5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki Laktoza jednowodna Skrobia kukurydziana Celuloza mikrokrystaliczna Hydroksypropyloceluloza Magnezu stearynian Otoczka tabletki ABILIFY 5 mg tabletki Lak aluminiowy z indygotyną (E 132) ABILIFY 10 mg tabletki Żelaza tlenek czerwony (E 172) ABILIFY 15 mg tabletki Żelaza tlenek żółty (E 172) ABILIFY 30 mg tabletki Żelaza tlenek czerwony (E 172) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Aluminiowe blistry perforowane, podzielne na dawki pojedyncze, w pudełkach tekturowych zawierających 14 × 1, 28 × 1, 49 × 1, 56 × 1, 98 × 1 tabletek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
- CHPL leku Abilify, tabletki, 5 mgDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Abilify, tabletki, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ABILIFY 5 mg tabletki ABILIFY 10 mg tabletki ABILIFY 15 mg tabletki ABILIFY 30 mg tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ABILIFY 5 mg tabletki Każda tabletka zawiera 5 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 63,65 mg laktozy (w postaci jednowodnej) w tabletce ABILIFY 10 mg tabletki Każda tabletka zawiera 10 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 59,07 mg laktozy (w postaci jednowodnej) w tabletce ABILIFY 15 mg tabletki Każda tabletka zawiera 15 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 54,15 mg laktozy (w postaci jednowodnej) w tabletce ABILIFY 30 mg tabletki Każda tabletka zawiera 30 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 177,22 mg laktozy (w postaci jednowodnej) w tabletce Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka ABILIFY 5 mg tabletki Prostokątna i niebieska, oznaczona na jednej stronie symbolem „A-007” i cyfrą „5”.
- CHPL leku Abilify, tabletki, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
ABILIFY 10 mg tabletki Prostokątna i różowa, oznaczona na jednej stronie symbolem „A-008” i liczbą „10”. ABILIFY 15 mg tabletki Okrągła i żółta, oznaczona na jednej stronie symbolem „A-009” i liczbą „15”. ABILIFY 30 mg tabletki Okrągła i różowa, oznaczona na jednej stronie symbolem „A-011” i liczbą „30”.
- CHPL leku Abilify, tabletki, 10 mgWskazania do stosowania
4.1 Wskazania do stosowania ABILIFY jest wskazany do leczenia schizofrenii u dorosłych i u młodzieży w wieku 15 lat i starszej. ABILIFY jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym lub ciężkim w przebiegu zaburzenia afektywnego dwubiegunowego typu I oraz w zapobieganiu nowym epizodom maniakalnym u dorosłych, u których występują głównie epizody maniakalne i którzy odpowiadają na leczenie arypiprazolem (patrz punkt 5.1). ABILIFY jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym lub ciężkim w przebiegu zaburzenia afektywnego dwubiegunowego typu I u młodzieży w wieku 13 lat i starszej, w leczeniu trwającym do 12 tygodni (patrz punkt 5.1).
- CHPL leku Abilify, tabletki, 10 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Schizofrenia: zalecana dawka początkowa produktu ABILIFY to 10 mg na dobę lub 15 mg na dobę z dawką podtrzymującą 15 mg na dobę. Lek należy podawać raz na dobę o stałej porze, niezależnie od posiłków. ABILIFY jest skuteczny w dawkach od 10 mg na dobę do 30 mg na dobę. Chociaż nie potwierdzono większej skuteczności dawek większych niż dawka dobowa 15 mg, to jednak u poszczególnych pacjentów większa dawka może być korzystna. Maksymalna dawka dobowa nie może być większa niż 30 mg. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I: zalecana dawka początkowa to 15 mg produktu ABILIFY podawana w schemacie raz na dobę, niezależnie od posiłków jako monoterapia lub w leczeniu skojarzonym (patrz punkt 5.1). U niektórych pacjentów może być korzystne zastosowanie większej dawki. Maksymalna dawka dobowa nie może być większa niż 30 mg.
- CHPL leku Abilify, tabletki, 10 mgDawkowanie
Zapobieganie nawrotom epizodów maniakalnych w zaburzeniu afektywnym dwubiegunowym typu I: w celu zapobiegania nawrotom epizodów maniakalnych u pacjentów, którzy stosują arypiprazol w monoterapii lub w terapii skojarzonej, należy kontynuować leczenie stosując ustaloną dawkę. Dostosowanie dawki dobowej, w tym jej zmniejszenie, należy rozważyć na podstawie stanu klinicznego. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej : zalecana dawka produktu ABILIFY, to 10 mg na dobę podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie powinno być rozpoczęte od dawki 2 mg (stosując ABILIFY 1 mg/ml roztwór doustny) przez 2 dni, stopniowo zwiększanej do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. W przypadkach, w których zwiększenie dawki jest właściwe, należy podawać kolejne dawki zwiększone jednorazowo o 5 mg, nie przekraczając maksymalnej dawki dobowej 30 mg (patrz punkt 5.1).
- CHPL leku Abilify, tabletki, 10 mgDawkowanie
ABILIFY jest skuteczny w przedziale dawek od 10 mg na dobę do 30 mg na dobę. Nie wykazano większej skuteczności przy zastosowaniu dawek dobowych większych niż 10 mg, chociaż indywidualni pacjenci mogą odnieść korzyść z zastosowania większych dawek. ABILIFY nie jest zalecany do stosowania u pacjentów ze schizofrenią w wieku poniżej 15 lat, z powodu braku wystarczających danych dotyczących bezpieczeństwa stosowania i skuteczności (patrz punkty 4.8 i 5.1). Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej: zalecana dawka produktu ABILIFY to 10 mg na dobę, podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie należy rozpocząć od dawki 2 mg (stosując ABILIFY roztwór doustny 1 mg/ml) przez 2 dni, stopniowo zwiększać do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg.
- CHPL leku Abilify, tabletki, 10 mgDawkowanie
Czas trwania leczenia powinien być możliwie najkrótszy konieczny do uzyskania kontroli objawów i nie może być dłuższy niż 12 tygodni. Nie wykazano większej skuteczności po zastosowaniu dawek dobowych większych niż 10 mg, a dawka dobowa wynosząca 30 mg jest związana ze znacząco większą częstością występowania istotnych reakcji niepożądanych, w tym zdarzeń związanych z objawami pozapiramidowymi (ang. EPS), senności, zmęczenia oraz zwiększenia masy ciała (patrz punkt 4.8). Z tego powodu dawki większe niż 10 mg na dobę należy stosować tylko w wyjątkowych przypadkach oraz z zachowaniem ścisłej kontroli klinicznej (patrz punkty 4.4, 4.8 i 5.1). Młodsi pacjenci są narażeni na zwiększone ryzyko działań niepożądanych związanych z arypiprazolem. Z tego powodu produkt ABILIFY nie jest zalecany do stosowania u pacjentów w wieku poniżej 13 lat (patrz punkty 4.8 i 5.1).
- CHPL leku Abilify, tabletki, 10 mgDawkowanie
Drażliwość związana z zaburzeniami autystycznymi: nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego ABILIFY u dzieci i młodzieży w wieku poniżej 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących dawkowania. Tiki związane z zespołem Tourette’a: nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego ABILIFY u dzieci i młodzieży w wieku od 6 do 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących dawkowania. Szczególne grupy pacjentów Zaburzenia czynności wątroby Nie ma konieczności modyfikacji dawki u osób z zaburzeniami czynności wątroby o nasileniu lekkim lub umiarkowanym. Nie ma wystarczających danych do ustalenia dawkowania u pacjentów z ciężką niewydolnością wątroby. W tej grupie pacjentów należy ostrożnie ustalać dawkowanie.
- CHPL leku Abilify, tabletki, 10 mgDawkowanie
Niemniej jednak, w grupie pacjentów z ciężkimi zaburzeniami czynności wątroby największą dawkę dobową 30 mg należy stosować ze szczególną ostrożnością (patrz punkt 5.2). Zaburzenia czynności nerek Nie ma konieczności modyfikacji dawki u pacjentów z zaburzeniami czynności nerek. Pacjenci w podeszłym wieku Bezpieczeństwo i skuteczność stosowania produktu ABILIFY w leczeniu schizofrenii i w epizodach manii w przebiegu zaburzenia afektywnywnego dwubiegunowego typu I nie zostały zbadane u pacjentów w wieku 65 lat i starszych. Jednak z powodu większej wrażliwości tych pacjentów, należy rozważyć zastosowanie mniejszej dawki początkowej, jeśli pozwalają na to okoliczności kliniczne (patrz punkt 4.4). Płeć Nie ma konieczności modyfikacji dawek leku w zależności od płci (patrz punkt 5.2). Palacze tytoniu Biorąc pod uwagę metabolizm arypiprazolu nie ma konieczności modyfikacji dawek u palaczy (patrz punkt 4.5).
- CHPL leku Abilify, tabletki, 10 mgDawkowanie
Dostosowanie dawki z powodu interakcji Dawkę arypiprazolu należy zmniejszyć w przypadku równoczesnego podawania leku o silnym działaniu hamującym w stosunku do cytochromu CYP3A4 lub CYP2D6. Po zakończeniu jednoczesnego stosowania inhibitora CYP3A4 lub CYP2D6 należy ponownie zwiększyć dawkę arypiprazolu (patrz punkt 4.5). Dawkę arypiprazolu należy zwiększyć w przypadku równoczesnego podawania leków silnie indukujących CYP3A4. Po odstawieniu leku indukującego CYP3A4, dawkę arypiprazolu należy ponownie zmniejszyć do zalecanej (patrz punkt 4.5). Sposób podawania Produkt leczniczy ABILIFY jest przeznaczony do podawania doustnego. Tabletki ulegające rozpadowi w jamie ustnej lub roztwór doustny mogą być stosowane alternatywnie do tabletek ABILIFY u pacjentów, którzy mają trudności w połykaniu tabletek ABILIFY (patrz także punkt 5.2).
- CHPL leku Abilify, tabletki, 10 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Abilify, tabletki, 10 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić w ciągu od kilku dni do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Prawdopodobieństwo podjęcia próby samobójczej Występowanie zachowań samobójczych jest związane z chorobami psychicznymi oraz zaburzeniami nastroju i w niektórych przypadkach było zgłaszane wkrótce po rozpoczęciu lub zmianie leczenia przeciwpsychotycznego, w tym leczenia arypiprazolem (patrz punkt 4.8). Leczenie przeciwpsychotyczne pacjentów wysokiego ryzyka powinno odbywać się pod ścisłym nadzorem. Zaburzenia sercowo-naczyniowe Arypiprazol należy stosować ostrożnie u pacjentów z chorobą sercowo-naczyniową (zawał mięśnia sercowego lub choroba niedokrwienna, niewydolność serca lub zaburzenia przewodzenia w wywiadzie), chorobą naczyń mózgu, w stanach predysponujących do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie przeciwnadciśnieniowymi produktami leczniczymi) lub z nadciśnieniem tętniczym, w tym postępującym lub złośliwym.
- CHPL leku Abilify, tabletki, 10 mgSpecjalne środki ostrozności
Po zastosowaniu leków przeciwpsychotycznych obserwowano przypadki żylnej choroby zakrzepowo-zatorowej (VTE - ang. venous thromboembolism ). Ponieważ u pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE przed rozpoczęciem oraz w czasie leczenia arypiprazolem i wdrożyć odpowiednie środki zapobiegawcze. Wydłużenie odstępu QT W badaniach klinicznych arypiprazolu częstość występowania wydłużenia odstępu QT była porównywalna z placebo. Arypiprazol należy stosować ostrożnie u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy W badaniach klinicznych trwających nie dłużej niż rok, w trakcie leczenia arypiprazolem zgłaszano niezbyt częste przypadki dyskinez związane z leczeniem.
- CHPL leku Abilify, tabletki, 10 mgSpecjalne środki ostrozności
Jeśli objawy przedmiotowe lub podmiotowe późnych dyskinez wystąpią u pacjentów leczonych arypiprazolem, należy rozważyć zmniejszenie dawki lub odstawienie leku (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Inne objawy pozapiramidowe W pediatrycznych badaniach klinicznych z zastosowaniem arypiprazolu obserwowano akatyzję oraz parkinsonizm. Jeśli u pacjenta przyjmującego arypiprazol wystąpią objawy przedmiotowe i podmiotowe innych zaburzeń pozapiramidowych, należy rozważyć zmniejszenie dawki oraz wprowadzenie ścisłej kontroli klinicznej. Złośliwy Zespół Neuroleptyczny (NMS ) NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z podawaniem leków przeciwpsychotycznych. W badaniach klinicznych, odnotowano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku Abilify, tabletki, 10 mgSpecjalne środki ostrozności
Klinicznymi objawami NMS są bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz objawy niestabilności autonomicznego układu nerwowego (nieregularne tętno lub wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Jednakże, obserwowano także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę, niekoniecznie związane z NMS. Jeśli wystąpiły wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS, bądź niewyjaśnionego pochodzenia wysoka gorączka, bez innych objawów NMS, należy przerwać leczenie wszystkimi lekami przeciwpsychotycznymi, w tym także arypiprazolem. Drgawki W badaniach klinicznych odnotowano niezbyt częste przypadki napadów drgawek w czasie leczenia arypiprazolem.
- CHPL leku Abilify, tabletki, 10 mgSpecjalne środki ostrozności
Z tego powodu arypiprazol należy stosować z zachowaniem ostrożności u pacjentów, u których w przeszłości występowały napady drgawek lub u których występują choroby wiążące się ze skłonnością do takich napadów (patrz punkt 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencją Zwiększona śmiertelność W trzech badaniach kontrolowanych placebo (n = 938, średnia wieku: 82,4; zakres: od 56 do 99 lat), u pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera, leczonych arypiprazolem, występowało zwiększone ryzyko zgonu w porównaniu z grupą otrzymującą placebo. Częstość zgonów u pacjentów leczonych arypiprazolem wynosiła 3,5% w porównaniu do 1,7% w grupie placebo. Chociaż przyczyny zgonów były zróżnicowane to większość zgonów wydawała się być związana albo z chorobami układu krążenia (np. niewydolność serca, nagłe zgony) albo z chorobami zakaźnymi (np. zapalenie płuc) (patrz punkt 4.8).
- CHPL leku Abilify, tabletki, 10 mgSpecjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego U pacjentów w tych samych badaniach odnotowano działania niepożądane dotyczące krążenia mózgowego (np. udar, przejściowe napady niedokrwienia) w tym o przebiegu zakończonym zgonem (średnia wieku: 84 lata; zakres od 78 do 88 lat). Ogólnie w tych badaniach 1,3% wszystkich pacjentów leczonych arypiprazolem zgłaszało działania niepożądane dotyczące krążenia mózgowego w porównaniu do 0,6% pacjentów otrzymujących placebo. Różnica ta nie była istotna statystycznie. Jednakże w jednym z tych badań z zastosowaniem ustalonego dawkowania u pacjentów leczonych arypiprazolem występowała istotna zależność odpowiedzi od dawki dla działań niepożądanych dotyczących krążenia mózgowego (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów z psychozą związaną z demencją.
- CHPL leku Abilify, tabletki, 10 mgSpecjalne środki ostrozności
Hiperglikemia i cukrzyca U pacjentów leczonych nietypowymi lekami przeciwpsychotycznymi, w tym arypiprazolem, opisywano hiperglikemię, w niektórych przypadkach bardzo wysoką z kwasicą ketonową i śpiączką hiperosmotyczną lub zgonem. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. W badaniach klinicznych z arypiprazolem nie było istotnych różnic w częstości występowania działań niepożądanych związanych z hiperglikemią (w tym cukrzycy) lub nieprawidłowych wartości laboratoryjnych stężenia glukozy w porównaniu do placebo. Nie jest dostępna dokładna ocena ryzyka wystąpienia działań niepożądanych związanych z hiperglikemią, która pozwalałaby na dokonanie bezpośredniego porównania leczenia arypiprazolem i innymi atypowymi lekami przeciwpsychotycznymi.
- CHPL leku Abilify, tabletki, 10 mgSpecjalne środki ostrozności
Pacjenci leczeni jakimikolwiek lekami przeciwpsychotycznymi, włącznie z arypiprazolem, powinni być obserwowani, czy nie występują u nich objawy podmiotowe i przedmiotowe związane z hiperglikemią (takie jak nadmierne pragnienie, wielomocz, nadmierny apetyt i osłabienie), a pacjenci z cukrzycą lub czynnikami ryzyka wystąpienia cukrzycy powinni być regularnie monitorowani pod względem pogorszenia kontroli glikemii (patrz punkt 4.8). Nadwrażliwość Podczas przyjmowania arypiprazolu mogą wystąpić reakcje nadwrażliwości charakteryzujące się objawami reakcji uczuleniowych (patrz punkt 4.8). Zwiększenie masy ciała Obserwowane u pacjentów ze schizofrenią i zaburzeniem afektywnym dwubiegunowym zwiększenie masy ciała jest zwykle spowodowane współistniejącymi chorobami, stosowaniem leków przeciwpsychotycznych, o których wiadomo, że powodują zwiększenie masy ciała, niewłaściwym stylem życia i może prowadzić do ciężkich powikłań.
- CHPL leku Abilify, tabletki, 10 mgSpecjalne środki ostrozności
Po wprowadzeniu leku do obrotu obserwowano zwiększenie masy ciała u pacjentów otrzymujących arypiprazol. Jeśli występowało, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych arypiprazol nie powodował klinicznie istotnego zwiększenia masy ciała u dorosłych (patrz punkt 5.1). W badaniach klinicznych z udziałem młodzieży z zaburzeniem afektywnym dwubiegunowym wykazano, że stosowanie arypiprazolu ma związek ze zwiększeniem masy ciała po 4 tygodniach leczenia. U młodzieży z zaburzeniem afektywnym dwubiegunowym należy kontrolować przyrost masy ciała. Jeśli przyrost masy ciała jest znaczący klinicznie, należy rozważyć zmniejszenie dawki (patrz punkt 4.8). Dysfagia Ze stosowaniem leków przeciwpsychotycznych, w tym arypiprazolu, wiąże się spowolnienie motoryki przełyku i ryzyko aspiracji. Arypiprazol należy stosować ostrożnie u pacjentów z ryzykiem wystąpienia zachłystowego zapalenia płuc.
- CHPL leku Abilify, tabletki, 10 mgSpecjalne środki ostrozności
Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Podczas przyjmowania arypiprazolu u pacjentów mogą występować zwiększone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy obejmują: zwiększenie popędów seksualnych, kompulsywną potrzebę wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania. Ważne jest, aby lekarze przepisujący lek pytali pacjentów lub opiekunów w szczególności o pojawienie się nowego lub zwiększonego popędu do hazardu, popędów seksualnych, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa lub kompulsywnego objadania się, lub innych popędów podczas leczenia arypiprazolem. Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu leku.
- CHPL leku Abilify, tabletki, 10 mgSpecjalne środki ostrozności
Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Lekarz rozważy zmianę dawki lub odstawienie leku, jeśli u pacjenta wystąpią takie popędy podczas przyjmowania arypiprazolu (patrz punkt 4.8). Laktoza ABILIFY tabletki zawierają laktozę. Lek nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy. Pacjenci ze współistniejącym zespołem nadpobudliwości psychoruchowej (ang. attention deficit hyperactivity disorder , ADHD) Pomimo wysokiej częstości współistnienia zaburzenia afektywnego dwubiegunowego typu I oraz zespołu ADHD, dane dotyczące bezpieczeństwa jednoczesnego stosowania arypiprazolu oraz stymulantów są bardzo ograniczone; dlatego też należy zachować wyjątkową ostrożność w razie podawania tych produktów jednocześnie.
- CHPL leku Abilify, tabletki, 10 mgSpecjalne środki ostrozności
Upadki Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków. Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2).
- CHPL leku Abilify, tabletki, 10 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na antagonistyczne działanie na receptor adrenergiczny α 1 , arypiprazol może nasilać działanie niektórych przeciwnadciśnieniowych produktów leczniczych. Ze względu na pierwotne działanie arypiprazolu na OUN, należy zachować ostrożność, jeśli arypiprazol jest podawany razem z alkoholem lub z innymi produktami leczniczymi działającymi na OUN, wywołującymi zbliżone działania niepożądane, takie jak sedacja (patrz punkt 4.8). Należy zachować ostrożność podając arypiprazol równocześnie z produktami leczniczymi, o których wiadomo, że powodują wydłużenie odstępu QT lub zaburzenia elektrolitowe. Możliwy wpływ innych produktów leczniczych na arypiprazol Antagonista receptora H 2 - famotydyna, lek hamujący uwalnianie kwasu żołądkowego, zmniejsza szybkość wchłaniania arypiprazolu, jednak działanie to nie ma znaczenia klinicznego.
- CHPL leku Abilify, tabletki, 10 mgInterakcje
Arypiprazol jest metabolizowany na wiele sposobów, w tym także przez enzymy, takie jak CYP2D6 i CYP3A4. Nie jest jednak metabolizowany przez enzymy z grupy CYP1A, a więc nie jest konieczne stosowanie specjalnych dawek u palaczy tytoniu. Chinidyna i inne silne inhibitory CYP2D6 Wyniki badań klinicznych z udziałem zdrowych osób wykazały, że silny inhibitor enzymu CYP2D6 (chinidyna) zwiększa wartość AUC arypiprazolu o 107%, podczas gdy wartość C max nie zmienia się. Wartości AUC i C max dehydroarypiprazolu, aktywnego metabolitu, były zmniejszone odpowiednio o 32% i 47%. W przypadku jednoczesnego podawania chinidyny i arypiprazolu, należy zmniejszyć dawkę arypiprazolu o około połowę w stosunku do przepisanej dawki. Inne silne inhibitory grupy enzymów CYP2D6, takie jak fluoksetyna i paroksetyna, mogą powodować podobne skutki i w takich sytuacjach należy podobnie zmniejszyć dawkę leku.
- CHPL leku Abilify, tabletki, 10 mgInterakcje
Ketokonazol i inne silne inhibitory CYP3A4 Wyniki badań klinicznych z udziałem zdrowych osób wskazują, że silny inhibitor CYP3A4 (ketokonazol) zwiększa wartości AUC i C max arypiprazolu odpowiednio o 63% i 37%, zaś wartości AUC i C max dehydroarypiprazolu odpowiednio o 77% i 43%. W grupie osób o obniżonej aktywności CYP2D6, równoczesne stosowanie silnych inhibitorów CYP3A4 może powodować zwiększenie stężenia arypiprazolu w osoczu, w porównaniu do osób o podwyższonej aktywności CYP2D6. W przypadku jednoczesnego stosowania ketokonazolu albo innych silnych inhibitorów CYP3A4 z arypiprazolem, zakładane korzyści powinny przeważyć potencjalne ryzyko dla pacjenta. W przypadku jednoczesnego stosowania ketokonazolu z arypiprazolem, przepisaną dawkę arypiprazolu należy zmniejszyć o około połowę. Inne leki silnie hamujące aktywność CYP3A4, takie jak itrakonazol oraz inhibitory proteazy HIV, mogą powodować podobne skutki jak ketokonazol i w takich przypadkach należy podobnie zmniejszyć dawkę (patrz punkt 4.2).
- CHPL leku Abilify, tabletki, 10 mgInterakcje
Po odstawieniu inhibitora CYP2D6 lub CYP3A4, dawkę arypiprazolu należy zwiększyć do tej, jaką stosowano przed rozpoczęciem terapii skojarzonej. W czasie równoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazemu) lub CYP2D6 (np. escytalopramu) z arypiprazolem, można spodziewać się niewielkiego zwiększenia stężenia arypiprazolu w osoczu. Karbamazepina i inne leki indukujące CYP3A4 Po jednoczesnym podaniu karbamazepiny, leku silnie indukującego CYP3A4 w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnie geometryczne wartości C max i AUC arypiprazolu zmniejszyły się odpowiednio o 68% i 73%, w stosunku do wartości tych parametrów podczas stosowania arypiprazolu (30 mg) w monoterapii. Podobnie, w przypadku dehydroarypiprazolu średnie geometryczne wartości C max i AUC po jednoczesnym podaniu karbamazepiny zmniejszają się odpowiednio o 69% i 71%, w stosunku do ich wartości podczas stosowania arypiprazolem w monoterapii.
- CHPL leku Abilify, tabletki, 10 mgInterakcje
Zatem dawkę arypiprazolu należy podwoić, gdy jednocześnie podaje się go z karbamazepiną. Można się spodziewać, że jednoczesne podawanie arypiprazolu i innych leków silnie indukujących CYP3A4 (takich jak ryfampicyna , ryfabutyna, fenytoina, fenobarbital, prymidon, efawirenz, newirapina i ziele dziurawca) może działać podobnie i dlatego należy podobnie zwiększyć dawkę. Po zakończeniu podawania leku silnie indukującego CYP3A4, należy zmniejszyć dawkę arypiprazolu do zalecanej. Walproinian i lit Skojarzone stosowanie walproinianów lub litu z arypiprazolem nie powodowało żadnych istotnych klinicznie zmian stężenia arypiprazolu i w związku z tym nie jest konieczne dostosowanie dawki podczas podawania walproinianu lub litu w skojarzeniu z arypiprazolem. Możliwy wpływ arypiprazolu na inne produkty lecznicze W czasie badań klinicznych, dawki arypiprazolu od 10 mg na dobę do 30 mg na dobę nie wywierały istotnego wpływu na metabolizm substratów CYP2D6 (stosunek dekstrometorfan/3- metoksymorfinan), CYP2C9 (warfaryna), CYP2C19 (omeprazol) i CYP3A4 (dekstrometorfan).
- CHPL leku Abilify, tabletki, 10 mgInterakcje
Ponadto w warunkach in vitro , arypiprazol i dehydroarypiprazol nie zmieniały metabolizmu zachodzącego z udziałem CYP1A2. Istnieje zatem małe prawdopodobieństwo wystąpienia istotnych klinicznie interakcji między produktami leczniczymi metabolizowanymi przez te enzymy. Kiedy arypiprazol był podawany z walproinianem, litem lub lamotryginą nie stwierdzono klinicznie istotnej zmiany w stężeniach walproinianu, litu lub lamotryginy. Zespół serotoninowy Obserwowano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol, a możliwe objawy przedmiotowe oraz podmiotowe dla tego stanu mogą wystąpić szczególnie w przypadku jednoczesnego stosowania innych leków serotoninergicznych, takich jak SSRI/SNRI (selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny) lub leków, o których wiadomo, że zwiększają stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Abilify, tabletki, 10 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie przeprowadzono dotychczas odpowiednich badań z grupą kontrolną otrzymującą placebo dotyczących działania arypiprazolu u kobiet w ciąży. Notowano występowanie wad wrodzonych, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. Na podstawie wyników badań przeprowadzonych na zwierzętach nie można wykluczyć potencjalnego toksycznego wpływu leku na płód (patrz punkt 5.3). Pacjentki należy poinformować o konieczności powiadomienia swojego lekarza, jeśli w trakcie leczenia arypiprazolem zajdą w ciąże lub planują zajście w ciążę. Ze względu na niewystarczające dane dotyczące bezpieczeństwa u ludzi oraz budzące wątpliwości wyniki badań wpływu na rozród na zwierzętach, ten lek nie może być stosowany w okresie ciąży, chyba że spodziewane korzyści wyraźnie przewyższają potencjalne ryzyko dla płodu.
- CHPL leku Abilify, tabletki, 10 mgWpływ na płodność, ciążę i laktację
Noworodki narażone na działanie leków przeciwpsychotycznych (w tym arypiprazolu) w czasie trzeciego trymestru ciąży są w grupie ryzyka, w której mogą wystąpić działania niepożądane, w tym zaburzenia pozapiramidowe i (lub) objawy odstawienne, które po porodzie mogą różnić się ciężkością przebiegu oraz czasem trwania. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być uważnie monitorowane (patrz punkt 4.8). Karmienie piersią Arypiprazol/metabolity przenikają do mleka ludzkiego. Należy podjąć decyzję czy przerwać karmienie piersią, czy przerwać podawanie arypiprazolu biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem na reprodukcję.
- CHPL leku Abilify, tabletki, 10 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe (sedacja), senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku Abilify, tabletki, 10 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Najczęściej notowanymi działaniami niepożądanymi w badaniach prowadzonych z grupą kontrolną otrzymującą placebo były akatyzja i nudności, każde występujące częściej niż u 3% pacjentów leczonych arypiprazolem podawanym doustnie. Tabelaryczne zestawienie działań niepożądanych Częstość występowania działań niepożądanych związanych z leczeniem arypiprazolem podano w poniższej tabeli. Dane w tabeli oparto na działaniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układ/narząd i częstości: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000); nie znana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Abilify, tabletki, 10 mgDziałania niepożądane
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Nie można określić częstości działań niepożądanych zgłaszanych po wprowadzeniu do obrotu, ponieważ pochodzą one ze spontanicznych zgłoszeń. Z tego względu częstość takich działań niepożądanych określono jako „nieznana”.
- CHPL leku Abilify, tabletki, 10 mgDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia krwii układu chłonnego LeukopeniaNeutropenia Trombocytopenia Zaburzenia układu immunologicznego Reakcje uczuleniowe (np. reakcja anafilaktyczna, obrzęk naczynioruchowy obejmujący obrzęk języka, obrzęk twarzy,świąd alergiczny lub pokrzywkę) Zaburzenia endokrynologiczne Hiperprolaktynemia Zmniejszenie stężenia prolaktynywe krwi Cukrzycowa śpiączka hiperosmolarnaCukrzycowa kwasica ketonowa Zaburzenia metabolizmu iodżywiania Cukrzyca Hiperglikemia Hiponatremia Anoreksja - CHPL leku Abilify, tabletki, 10 mgDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia psychiczne Bezsenność LękNiepokój, zwł. ruchowy Depresja Hiperseksualność Próby samobójcze, myśli samobójcze i dokonane samobójstwa (patrz punkt 4.4) Patologiczne uzależnienie od hazarduZaburzenie kontroli impulsów ObżarstwoKompulsywna potrzeba wydawania pieniędzy Poriomania Zachowania agresywne Nadmierne pobudzenieNerwowość Zaburzenia układu nerwowego Akatyzja Zaburzenia pozapiramidowe DrżenieBóle głowy Sedacja SennośćZawroty głowy Późne dyskinezy DystoniaZespół„niespokojnych nóg” Złośliwy zespół neuroleptyczny Drgawki typu grand mal Zespół serotoninowy Zaburzenia mowy Zaburzenia oka Niewyraźne widzenie Podwójne widzenie Światłowstręt (fotofobia) Napad przymusowego patrzenia z rotacją gałek ocznych Zaburzenia serca Tachykardia Nagły zgon niewyjaśniony Torsades de pointes Arytmia komorowa Zatrzymanie akcji sercaBradykardia Zaburzenia naczyniowe Hipotensja ortostatyczna Choroba zakrzepowo-zatorowa żył (w tym zator płucny i zakrzepica żył głębokich) Nadciśnienie tętniczeOmdlenia Zaburzenia układu oddechowego, klatki piersiowej iśródpiersia Czkawka Zachłystowe zapalenie płuc Skurcz krtaniSkurcz części ustnej gardła Zaburzenia żołądka i jelit Zaparcia Niestrawność Nudności Nadmierne wydzielanie ślinyWymioty Zapalenie trzustki Dysfagia BiegunkaDyskomfort w jamie brzusznej Dyskomfort w obrębie żołądka Zaburzeniawątroby i dróg żółciowych Niewydolność wątrobyZapalenie wątroby Żółtaczka Zaburzenia skóry i tkanki podskórnej WysypkaReakcja fotoalergiczna ŁysienieNadmierne pocenie sięWysypka polekowa z eozynofiliąi objawami ogólnoustrojowymi (zespół DRESS) - CHPL leku Abilify, tabletki, 10 mgDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia mięśniowo- szkieletowe itkanki łącznej Rozpad mięśni poprzecznie prążkowanych (rabdomioliza) Bóle mięśnioweSztywność Zaburzenia nereki dróg moczowych Nietrzymanie moczu Zatrzymanie moczu Ciąża, połóg iokresokołoporodowy Zespół abstynencyjny u noworodków (patrz punkt 4.6) Zaburzenia układu rozrodczego ipiersi Priapizm Zaburzenia ogólne i stany w miejscu podania Zmęczenie Zaburzenia regulacji temperatury (np. hipotermia, gorączka)Ból w klatce piersiowej Obrzęk obwodowy Badaniadiagnostyczne Zmniejszenie masy ciała Zwiększenie masy ciała Zwiększenie aktywności aminotransferazy alaninowej Zwiększenie aktywności aminotransferazy asparaginianowej Zwiększenie aktywności gammaglutamylotransferazy Zwiększenie aktywności fosfatazy alkalicznej Wydłużenie odstępu QTZwiększenie stężenia glukozy we krwiZwiększenie stężenia glikozylowanej hemoglobiny Wahania stężenia glukozy we krwiZwiększona aktywność fosfokinazy kreatynowej - CHPL leku Abilify, tabletki, 10 mgDziałania niepożądane
Opis wybranych działań niepożądanych Dorośli Objawy pozapiramidowe (ang. EPS) Schizofrenia: w długookresowym 52-tygodniowym badaniu prowadzonym z grupą kontrolną, u pacjentów leczonych arypiprazolem ogólnie rzadziej występowały EPS (25,8%), w tym parkinsonizm, akatyzja, dystonia i dyskineza, w porównaniu do pacjentów leczonych haloperydolem (57,3%). W długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, częstość występowania EPS wynosiła 19% w przypadku pacjentów leczonych arypiprazolem i 13,1% w przypadku pacjentów otrzymujących placebo. W innym długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną częstość występowania EPS wynosiła 14,8% w przypadku pacjentów leczonych arypiprazolem i 15,1% w przypadku pacjentów otrzymujących olanzapinę. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I: w 12- tygodniowym badaniu prowadzonym z grupą kontrolną przypadki EPS stwierdzano u 23,5% pacjentów leczonych arypiprazolem i u 53,3% pacjentów leczonych haloperydolem.
- CHPL leku Abilify, tabletki, 10 mgDziałania niepożądane
W innym 12- tygodnowym badaniu przypadki EPS stwierdzano u 26,6% pacjentów leczonych arypiprazolem i u 17,6% pacjentów leczonych litem. W długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo podczas fazy leczenia podtrzymującego przypadki EPS wystąpiły u 18,2% pacjentów leczonych arypiprazolem i u 15,7% pacjentów otrzymujących placebo. Akatyzja W badaniach prowadzonych z grupą kontrolną otrzymującą placebo przypadki akatyzji u pacjentów z zaburzeniami afektywnymi dwubiegunowymi występowały u 12,1% pacjentów leczonych arypiprazolem i u 3,2% pacjentów otrzymujących placebo. U pacjentów ze schizofrenią liczba przypadków akatyzji wynosiła 6,2% w grupie arypiprazolu i 3,0% w grupie placebo. Dystonia Efekt klasy terapeutycznej: objawy dystonii, długotrwałe nieprawidłowe skurcze grup mięśni, mogą występować u wrażliwych pacjentów w ciągu pierwszych kilku dni leczenia.
- CHPL leku Abilify, tabletki, 10 mgDziałania niepożądane
Do objawów dystonii należą: skurcze mięśni szyi, czasami postępujące do ucisku w gardle, trudności z przełykaniem, trudności z oddychaniem i (lub) zaburzenia ruchów języka. Chociaż objawy te mogą występować po zastosowaniu małych dawek, występują częściej i o większym nasileniu podczas stosowania leków przeciwpsychotycznych pierwszej generacji o dużych mocach i w większych dawkach. Obserwowano zwiększone ryzyko ostrej dystonii u mężczyzn i w młodszych grupach wiekowych. Prolaktyna Podczas badań klinicznych w zakresie zarejestrowanych wskazań i po wprowadzeniu produktu leczniczego do obrotu u pacjentów otrzymujących arypiprazol obserwowano zarówno zwiększenie, jak i zmniejszenie stężenia prolaktyny w surowicy w porównaniu do pomiarów początkowych (punkt 5.1). Parametry laboratoryjne Porównania pomiędzy arypiprazolem i placebo dotyczące odsetka pacjentów, u których wystąpiły potencjalnie istotne zmiany rutynowych parametrów laboratoryjnych i lipidowych (patrz punkt 5.1), nie wykazały medycznie istotnych różnic (patrz punkt 5.1).
- CHPL leku Abilify, tabletki, 10 mgDziałania niepożądane
Ogólnie przejściowe i bezobjawowe zwiększenie aktywności CPK (fosfokinazy kreatynowej) obserwowano u 3,5% pacjentów leczonych arypiprazolem w porównaniu do 2,0% pacjentów otrzymujących placebo. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej W krótkoterminowym badaniu z kontrolą placebo, w którym udział wzięło 302 nastolatków (od 13 do 17 lat) chorych na schizofrenię, częstość występowania i rodzaj reakcji niepożądanych były podobne do występujących u dorosłych, z wyjątkiem następujących działań niepożądanych zgłaszanych częściej u nastolatków otrzymujących arypiprazol niż u dorosłych otrzymujących arypiprazol (i częściej niż placebo): Senność/sedacja i zaburzenia pozapiramidowe były zgłaszane bardzo często (≥1/10), oraz suchość w jamie ustnej, zwiększony apetyt, niedociśnienie ortostatyczne były zgłaszane często (≥1/100, <1/10).
- CHPL leku Abilify, tabletki, 10 mgDziałania niepożądane
Profil bezpieczeństwa w 26-tygodniowym badaniu prowadzonym na zasadzie próby otwartej, był podobny do obserwowanego w badaniu krótkoterminowym z kontrolą placebo. Profil bezpieczeństwa w długoterminowym badaniu prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo był podobny z wyjątkiem następujących reakcji, które były zgłaszane częściej, niż w grupie dzieci i młodzieży przyjmujących placebo: często zgłaszano zmniejszenie masy ciała, zwiększenie stężenia insuliny we krwi, arytmię i leukopenię (≥1/100, <1/10). W zebranej populacji nastolatków (od 13 do 17 lat) chorych na schizofrenię, leczonych do 2 lat, przypadki małego stężenia prolaktyny w surowicy stwierdzono u 29,5% dziewcząt (<3 ng/ml) i 48,3% chłopców (<2 ng/ml). W grupie młodzieży (w wieku od 13 do 17 lat) ze schizofrenią, otrzymującej dawki arypiprazolu od 5 mg do 30 mg przez okres maksymalnie do 72 miesięcy, częstość występowania niskich stężeń prolaktyny w surowicy u kobiet (<3 ng/ml) i u mężczyzn (<2 ng/ml) wynosiła odpowiednio 25,6% i 45,0%.
- CHPL leku Abilify, tabletki, 10 mgDziałania niepożądane
Podczas dwóch długoterminowych badań z udziałem młodzieży (od 13 do 17 lat) ze schizofrenią i pacjentów z chorobą afektywną dwubiegunową leczonych arypiprazolem, częstość występowania małych stężeń prolaktyny w surowicy u kobiet (<3 ng/ml) i mężczyzn (<2 ng/ml) wynosiła odpowiednio 37,0% i 59,4%. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej Częstość występowania i rodzaj reakcji niepożądanych u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I były podobne do występujących u dorosłych, z wyjątkiem następujących działań niepożądanych: senność (23,0%), zaburzenia pozapiramidowe (18.4%), akatyzja (16.0%) i zmęczenie (11.8%) były zgłaszane bardzo często (≥1/10); natomiast ból w górnej części brzucha, zwiększenie częstości akcji serca, zwiększenie masy ciała, zwiększenie apetytu, drżenie mięśni oraz dyskineza były zgłaszane często (≥1/100, <1/10).
- CHPL leku Abilify, tabletki, 10 mgDziałania niepożądane
Następujące reakcje niepożądane miały prawdopodobnie związek z zastosowaną dawką: zaburzenia pozapiramidowe (częstość występowania w przypadku dawki 10 mg wynosiła 9,1%; w przypadku dawki 30 mg 28,8%; w przypadku placebo 1,7%); i akatyzja (częstość występowania w przypadku dawki 10 mg wynosiła 12,1%; w przypadku dawki 30 mg 20,3%; w przypadku placebo 1,7%). Średnie zmiany masy ciała u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I po 12. oraz 30. tygodniu wynosiły odpowiednio w przypadku arypiprazolu 2,4 kg oraz 5,8 kg, a w przypadku placebo 0,2 kg oraz 2,3 kg. W populacji dzieci i młodzieży senność oraz zmęczenie obserwowano częściej u pacjentów z zaburzeniem afektywnym dwubiegunowym, w porównaniu do pacjentów ze schizofrenią. W populacji dzieci i młodzieży z zaburzeniem afektywnym dwubiegunowym (od 10 do 17 lat), leczonych do 30 tygodni, przypadki małego stężenia prolaktyny w surowicy stwierdzono u 28,0% dziewcząt (<3 ng/ml) i 53,3% chłopców (<2 ng/ml).
- CHPL leku Abilify, tabletki, 10 mgDziałania niepożądane
Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Patologiczne uzależnienie od hazardu, hiperseksualność, kompulsywna potrzeba wydawania pieniędzy i obżarstwo lub kompulsywne objadanie się mogą wystąpić u pacjentów leczonych arypiprazolem (patrz punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania wymienionego w załączniku V .
- CHPL leku Abilify, tabletki, 10 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedmiotowe i podmiotowe W badaniach klinicznych i po wprowadzeniu produktu do obrotu przypadkowe bądź zamierzone przedawkowanie samego arypiprazolu stwierdzono u dorosłych pacjentów po oszacowanej dawce do 1260 mg niezakończone zgonem. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: letarg, wzrost ciśnienia tętniczego krwi, senność, przyspieszona czynność serca (tachykardia), nudności, wymioty i biegunka. Ponadto zgłaszano przypadkowe przedawkowanie samego arypiprazolu (do 195 mg) u dzieci, bez zgonów. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: senność, przejściowa utrata świadomości i objawy pozapiramidowe. Postępowanie po przedawkowaniu W przypadku przedawkowania leku stosuje się leczenie podtrzymujące, polegające na utrzymaniu drożności dróg oddechowych, dotlenianiu i wentylacji oraz leczeniu objawowym. Należy wziąć pod uwagę możliwość wpływu wielu produktów leczniczych.
- CHPL leku Abilify, tabletki, 10 mgPrzedawkowanie
Z tego względu należy niezwłocznie rozpocząć monitorowanie czynności układu krążenia, obejmujące stałe monitorowanie zapisu elektrokardiograficznego, w celu wykrycia możliwych zaburzeń rytmu serca. W przypadku potwierdzonego lub podejrzewanego przedawkowania arypiprazolu należy objąć pacjenta ścisłą kontrolą i obserwować go do czasu poprawy jego stanu. Aktywowany węgiel (50 g), podany w godzinę po zażyciu arypiprazolu, obniża wartość C max leku o około 41%, a wartość AUC o około 51%, co wskazuje na jego skuteczność w leczeniu przedawkowania. Hemodializa Pomimo że brak informacji dotyczących wpływu hemodializ w leczeniu przedawkowania arypiprazolu, to jednak istnieje małe prawdopodobieństwo, by hemodializy były użyteczne w takich przypadkach, ze względu na znaczny stopień wiązania arypiprazolu z białkami osocza.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12 Mechanizm działania Uważa się, że skuteczność arypiprazolu w leczeniu schizofrenii i zaburzenia afektywnego dwubiegunowego typu I jest związana ze skojarzonym działaniem częściowo agonistycznym w stosunku do receptora dopaminowego D 2 i serotoninowego 5-HT 1A oraz antagonistycznym w stosunku do receptora serotoninowego 5-HT 2A . Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D 2 i D 3 , serotoninowych 5-HT 1A i 5-HT 2A oraz umiarkowane powinowactwo do receptorów dopaminowych D 4 , serotoninowych 5-HT 2C i 5-HT 7 , a także adrenergicznych alfa-1 i histaminowych H 1 .
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Arypiprazol w dawkach od 0,5 mg do 30 mg, podawany raz na dobę przez 2 tygodnie osobom zdrowym powoduje zależne od dawki zmniejszenie wiązania rakloprydu znakowanego 11 C, ligandu receptora D 2 /D 3 , w jądrze ogoniastym i skorupie, co można wykryć za pomocą pozytonowej tomografii emisyjnej. Skuteczność kliniczna i bezpieczeństwo stosowania Dorośli Schizofrenia Wyniki trzech krótkoterminowych badań (od 4 do 6 tygodni) z grupą kontrolną otrzymującą placebo, w których udział wzięło 1 228 dorosłych chorych na schizofrenię, u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
Arypiprazol jest skuteczny w podtrzymywaniu poprawy klinicznej podczas kontynuacji leczenia u tych dorosłych pacjentów, u których obserwowano wstępną dobrą reakcję na lek. W badaniu z grupą kontrolną przyjmującą haloperydol, odsetek pacjentów, u których udało się utrzymać dobrą reakcję na produkt leczniczy, w ciągu 52 tygodni był podobny w obu grupach (arypiprazol 77% i haloperydol 73%). Badanie ukończyła istotnie większa grupa pacjentów leczonych arypiprazolem (43%) niż haloperydolem (30%). Wyniki uzyskane w skalach ocen stosowanych jako drugorzędowe punkty końcowe skuteczności, w tym w skali PANSS i w skali oceny depresji Montgomery-Asberg [ang. Montgomery–Åsberg-Depression-Rating-Scale, MADRS], wskazują na istotną poprawę w stosunku do haloperydolu. W trwającym 26 tygodni badaniu prowadzonym z grupą kontrolną otrzymującą placebo, z udziałem pacjentów dorosłych z ustabilizowaną przewlekłą schizofrenią stwierdzono w wyniku leczenia arypiprazolem większe zmniejszenie częstości nawrotów, 34% w grupie leczonych arypiprazolem i 57% w grupie otrzymującej placebo.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
Przyrost masy ciała Wyniki badań klinicznych wskazują, że arypiprazol nie powoduje klinicznie istotnego przyrostu masy ciała. W trwającym 26 tygodni badaniu z grupą kontrolną leczonych olanzapiną i wykorzystaniem podwójnie ślepej próby, przeprowadzonym w wielu krajach, udział wzięło 314 dorosłych pacjentów ze schizofrenią. Pierwszorzędowym punktem końcowym była ocena przyrostu masy ciała. U istotnie mniejszej liczby pacjentów leczonych arypiprazolem w porównaniu z otrzymującymi olanzapinę, stwierdzono przyrost masy ciała o co najmniej 7% w porównaniu z pomiarem początkowym (tzn. przyrost masy ciała o co najmniej 5,6 kg przy średniej początkowej masie wynoszącej ok. 80,5 kg) w grupie leczonych arypiprazolem (n = 18 lub 13% pacjentów nadających się do oceny), w porównaniu z grupą otrzymującą olanzapinę (n = 45 lub 33% pacjentów nadających się do oceny).
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
Stężenia lipidów W zbiorczej analizie wyników stężeń lipidów pochodzących z badań klinicznych prowadzonych z grupą kontrolną otrzymującą placebo u dorosłych, arypiprazol nie powodował klinicznie istotnych zmian stężeń cholesterolu całkowitego, triglicerydów, cholesterolu frakcji lipoprotein o dużej gęstości (HDL) i cholesterolu frakcji lipoprotein o małej gęstości (LDL). Prolaktyna Stężenia prolaktyny oceniono podczas wszystkich badań z zastosowaniem wszystkich dawek arypiprazolu (n = 28 242). Częstość występowania hiperprolaktynemii lub zwiększenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem (0,3%) była podobna do częstości występowania hiperprolaktynemii w grupie otrzymującej placebo (0,2%). U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia hiperprolaktynemii wynosiła 42 dni, a mediana czasu trwania wynosiła 34 dni.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
Częstość występowania hiperprolaktynemii lub zmniejszenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem wynosiła 0,4% w porównaniu do 0,02% w grupie otrzymującej placebo. U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 30 dni, a mediana czasu trwania wynosiła 194 dni. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I W dwóch 3-tygodniowych badaniach, prowadzonych z grupą kontrolną otrzymującą placebo, z zastosowaniem zmiennej dawki, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol był znacząco bardziej skuteczny niż placebo w zmniejszaniu objawów maniakalnych w ciągu 3 tygodni. Badania te obejmowały pacjentów z objawami lub bez objawów psychotycznych oraz pacjentów z szybką zmianą fazy lub bez szybkiej zmiany fazy (przebieg typu rapid-cycling).
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
W jednym 3-tygodniowym badaniu, prowadzonym z grupą kontrolną otrzymującą placebo, z zastosowaniem stałej dawki w monoterapii, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol nie wykazał większej skuteczności niż placebo. W dwóch 12-tygodniowych badaniach, prowadzonych z grupą kontrolną otrzymującą placebo oraz inne substancje czynne, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, arypiprazol był skuteczniejszy niż placebo w 3. tygodniu badania, a wynik leczenia podtrzymującego był w 12. tygodniu badania porównywalny z wynikiem dla litu lub haloperydolu. W 12. tygodniu arypiprazol powodował także remisję objawów maniakalnych u porównywalnej liczby pacjentów co lit lub haloperydol.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
W 6-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, którzy częściowo nie reagowali na monoterapię litem lub walproinianem przez 2 tygodnie przy terapeutycznych stężeniach w surowicy, zastosowanie arypiprazolu jako dodatkowego leku w większym stopniu zwiększyło skuteczność zapobiegania objawom maniakalnym niż stosowanie litu lub walproinianu w monoterapii. W 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, które przedłużono o 74 tygodnie, u pacjentów z objawami maniakalnymi, którzy osiągnęli remisję w trakcie stosowania arypiprazolu w czasie fazy stabilizacji przed randomizacją, arypiprazol był bardziej skuteczny niż placebo w zapobieganiu nawrotowi chorobie dwubiegunowej, głównie w zapobieganiu nawrotowi objawów maniakalnych, ale nie wykazał przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
W 52-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, u pacjentów z obecnym epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, którzy osiągnęli trwałą remisję (w skali oceny manii Younga [ang. Young Mania Rating Scale, YMRS] oraz w skali oceny depresji MADRS z całkowitą ilością punktów ≤ 12) w trakcie stosowania arypiprazolu (w dawce od 10 mg na dobę do 30 mg na dobę) w skojarzeniu z litem lub walproinianem przez 12 kolejnych tygodni, połączenie z arypiprazolem wykazało przewagę nad placebo w zapobieganiu nawrotowi choroby afektywnej dwubiegunowej zmniejszając ryzyko o 46% (współczynnik ryzyka 0,54) i w zapobieganiu nawrotom manii zmniejszając ryzyko o 65% (współczynnik ryzyka 0,35), ale nie wykazało przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
Zastosowanie arypiprazolu jako dodatkowego leku wykazało przewagę wobec placebo w przypadku drugorzędowego pomiaru wyniku leczenia w ocenach ogólnego wrażenia klinicznego w wersji dla ChAD (ang. Clinical Global Impression - Bipolar version, CGI-BP) nasilenia choroby (mania) (ang. Severity of illness , SOI [mania]). W tym badaniu, pacjenci zostali przydzieleni przez badaczy do badania prowadzonego metodą próby otwartej, z zastosowaniem litu lub walproinianu w monoterapii, w celu oceny częściowego braku odpowiedzi. Pacjenci byli stabilizowani przez co najmniej 12 kolejnych tygodni za pomocą skojarzenia arypiprazolu i stosowanego wcześniej stabilizatora nastroju. Pacjenci stabilni byli następnie losowo przydzielani do grupy kontynuującej stosowanie tego samego stabilizatora nastroju z arypiprazolem lub placebo w badaniu metodą podwójnie ślepej próby.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
W fazie randomizowanej oceniano cztery podgrupy stabilizatora nastroju: arypiprazol + lit; arypiprazol + walproinian; placebo + lit; placebo + walproinian. Odsetki Kaplana- Meiera dla nawrotu jakiegokolwiek zaburzenia nastroju w przypadku zastosowania dodatkowego leku były następujące: 16% w grupie stosującej arypiprazol + lit i 18% w grupie stosującej arypiprazol + walproinian, w porównaniu do 45% w grupie stosującej placebo + lit i 19% w grupie stosującej placebo + walproinian. Populacja dzieci i młodzieży Schizofrenia u młodzieży Wyniki 6-tygodniowego badania z grupą kontrolną otrzymującą placebo, w którym udział wzięło 302 nastoletnich pacjentów chorych na schizofrenię (od 13 do 17 lat), u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje statystycznie istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
W czasie trwania 26-tygodniowego badania prowadzonego metodą otwartej próby w analizie podgrupy nastoletnich pacjentów w wieku od 15 do 17 lat obserwowano utrzymywanie się działania u 74% całkowitej populacji włączonej do badania. W badaniu z randomizacją, prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo, trwającym od 60 do 89 tygodni, które prowadzono z udziałem młodzieży ze schizofrenią (n = 146; w wieku od 13 do 17 lat) występowała statystycznie znamienna różnica w zakresie odsetka nawrotów objawów psychotycznych pomiędzy grupą otrzymującą arypiprazol (19,39%) a grupą otrzymującą placebo (37,5%). Punkt szacunkowy współczynnika ryzyka (HR) w całej populacji wynosił 0,461 (95% przedział ufności, od 0,242 do 0,879). W analizach w podgrupach punkt szacunkowy współczynnika ryzyka wynosił 0,495 wśród uczestników w wieku od 13 do 14 lat w porównaniu do 0,454 wśród uczestników w wieku od 15 do 17 lat.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
Jednak ocena szacunkowa współczynnika ryzyka w grupie młodszych uczestników (od 13 do 14 lat) nie była precyzyjna, odzwierciedlając mniejszą liczebność uczestników w tej grupie (arypiprazol, n = 29; placebo, n = 12) i przedział ufności dla tej oceny szacunkowej (wynoszący od 0,151 do 1,628) uniemożliwiał wyciągnięcie wniosków odnośnie występowania wyniku leczenia. Natomiast 95% przedział ufności dla współczynnika ryzyka w podgrupie starszych uczestników (arypiprazol, n = 69; placebo, n = 36) wynosił od 0,242 do 0,879 i dlatego można wyciągnąć wnioski odnośnie wyników leczenia u starszych pacjentów. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u dzieci i młodzieży Arypiprazol badano w 30-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, w którym udział wzięło 296 dzieci i młodzieży (od 10 do 17 lat), którzy spełnili kryteria diagnostyczne według DSM-IV (ang.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
Diagnostic and Statistical Manual of Mental Disorders ) dla zaburzenia afektywnego dwubiegunowego typu I z epizodami maniakalnymi lub mieszanymi z objawami psychotycznymi lub bez tych objawów oraz wyjściowo mieli wynik ≥20 w skali manii według Younga (Y-MRS). Wśród pacjentów włączonych do podstawowej analizy skuteczności, 139 pacjentów miało postawioną diagnozę aktualnie współistniejącego ADHD. Arypiprazol wykazał przewagę w stosunku do placebo w odniesieniu do zmiany wartości wyjściowej w 4. oraz 12. tygodniu jako wynik całościowy wg Y-MRS. W analizie post-hoc przewaga nad placebo była bardziej wyraźna u pacjentów ze współistniejącym zespołem ADHD w porównaniu do pacjentów bez ADHD, gdzie nie zaobserwowano różnicy w stosunku do placebo. Zapobieganie nawrotom nie zostało określone. Do najczęstszych zdarzeń niepożądanych występujących w trakcie leczenia, wśród pacjentów otrzymujących dawkę 30 mg, były zaburzenia pozapiramidowe (28,3%), senność (27,3%), ból głowy (23,2%) oraz nudności (14,1%).
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
Średni przyrost masy ciała w 30-tygodniowm okresie leczenia wynosił 2,9 kg, w porównaniu do 0,98 kg u pacjentów, u których stosowano placebo. Drażliwość związana z zaburzeniami autystycznymi u dzieci i młodzieży (patrz punkt 4.2) U pacjentów w wieku od 6 do 17 lat arypiprazol badano w dwóch 8-tygodniowych badaniach prowadzonych z grupą kontrolną otrzymującą placebo [w jednym badaniu stosowano zmienną dawkę (od 2 mg na dobę do 15 mg na dobę), a w drugim stałą dawkę (5 mg na dobę, 10 mg na dobę lub 15 mg na dobę)] oraz jednym 52-tygodniowym badaniu otwartym. Dawkowanie w tych badaniach rozpoczynano od dawki 2 mg na dobę, po tygodniu zwiększanej do 5 mg na dobę, a następnie zwiększanej w odstępach tygodniowych o 5 mg na dobę do czasu osiągnięcia dawki docelowej. Ponad 75% pacjentów miało mniej niż 13 lat. Arypiprazol wykazał statystycznie większą skuteczność w porównaniu do placebo w podskali dotyczącej drażliwości Listy Zachowań Aberracyjnych (ang.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
Aberrant Behaviour Checklist Irritability subscale ). Jednakże, nie ustalono znaczenia klinicznego tej obserwacji. Profil bezpieczeństwa obejmował przyrost masy ciała i zmianę stężenia prolaktyny. Czas trwania długoterminowego badania dotyczącego bezpieczeństwa był ograniczony do 52-tygodni. W zebranych badaniach, częstość występowania małego stężenia prolaktyny u dziewcząt (<3 ng/ml) i u chłopców (<2 ng/ml) leczonych arypiprazolem wynosiła odpowiednio, 27/46 (58,7%) i 258/298 (86,6%). W badaniach prowadzonych z grupą kontrolną otrzymującą placebo średni przyrost masy ciała wynosił 0,4 kg w grupie placebo i 1,6 kg w grupie arypiprazolu. Arypiprazol badano także w długoterminowym badaniu leczenia podtrzymującego, prowadzonym z grupą kontrolną otrzymującą placebo. Po od 13- do 26-tygodniowej stabilizacji z zastosowaniem arypiprazolu (w dawkach od 2 mg na dobę do 15 mg na dobę), pacjenci z trwałą odpowiedzią albo kontynuowali leczenie arypiprazolem, albo otrzymywali placebo przez kolejne 16 tygodni.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
Odsetki Kaplana-Meiera dla nawrotu w tygodniu 16. były następujące: 35% dla grupy stosującej arypiprazol oraz 52% dla grupy placebo; współczynnik ryzyka nawrotu w 16 tygodniu (arypiprazol/placebo) wynosił 0,57 (różnica nieistotna statystycznie). Średni przyrost masy ciała w fazie stabilizacji (do 26 tygodni) w grupie otrzymującej arypiprazol wynosił 3,2 kg, natomiast w drugiej fazie badania (16 tygodni) obserwowano dalszy średni wzrost o 2,2 kg w grupie otrzymującej arypiprazol w porównaniu do 0,6 kg w grupie placebo. Objawy pozapiramidowe były zgłaszane głównie w fazie stabilizacji, u 17% pacjentów, z drgawkami stanowiącymi 6,5%. Tiki związane z zespołem Tourette’a u dzieci i młodzieży (patrz punkt 4.2) Skuteczność arypiprazolu badano u dzieci i młodzieży z zespołem Tourette’a (arypiprazol: n = 99, placebo: n = 44) w trwającym 8 tygodni, randomizowanym badaniu prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo w schemacie leczenia w grupach z użyciem stałej dawki zależnej od masy ciała od 5 mg na dobę do 20 mg na dobę i dawki początkowej wynoszącej 2 mg.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
Pacjenci byli w wieku od 7 do 17 lat i przed rozpoczęciem leczenia uzyskali średni wynik 30 na łącznej skali tików w Globalnej Skali Nasilenia Tików z Yale ( Total Tic Score on the Yale Global Tic Severity Scale , TTS-YGTSS). Grupa pacjentów otrzymująca arypiprazol wykazywała poprawę mierzoną zmianą wyniku na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 8 tygodniu leczenia, która wynosiła 13,35 w grupie otrzymującej małą dawkę (5 mg lub 10 mg) i 16,94 w grupie otrzymującej dużą dawkę (10 mg lub 20 mg) w porównaniu do poprawy odnotowanej u pacjentów otrzymujących placebo i zmiany wynoszącej 7,09. Skuteczność arypiprazolu u dzieci i młodzieży z zespołem Touretta (arypiprazol: n = 32, placebo: n = 29) oceniano również w przypadku podawania zmiennych dawek od 2 mg na dobę do 20 mg na dobę z dawką początkową wynoszącą 2 mg w trwającym 10 tygodni, randomizowanym badaniu prowadzonym w Korei Południowej prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakodynamiczne
Pacjenci w wieku od 6 do 18 lat uzyskali średni wynik 29 na skali TTS-YGTSS w pomiarze początkowym. Pacjenci otrzymujący arypiprazol wykazywali poprawę mierzoną zmianą wyniku o 14,97 na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 10 tygodniu w porównaniu do poprawy wynoszącej 9,62 w grupie placebo. W obu wspomnianych badaniach krótkoterminowych nie określono klinicznego znaczenia wyników dotyczących skuteczności, biorąc pod uwagę wielkość działania terapeutycznego w porównaniu do dużego wpływu efektu placebo i niejasne skutki w zakresie funkcjonowania psychospołecznego. Brak danych długoterminowych dotyczących skuteczności i bezpieczeństwa stosowania arypiprazolu w tej niestabilnej chorobie. Europejska Agencja Leków wstrzymała obowiązek dołączania wyników badań produktu leczniczego ABILIFY w jednej lub kilku podgrupach populacji dzieci i młodzieży w leczeniu schizofrenii oraz w leczeniu choroby afektywnej dwubiegunowej (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Arypiprazol jest dobrze wchłaniany, maksymalne stężenie w osoczu osiąga w ciągu od 3 do 5 godzin po podaniu. Arypiprazol w minimalnym stopniu ulega metabolizmowi przedukładowemu. Bezwzględna dostępność po doustnym podaniu jednej tabletki wynosi 87%. Spożywanie posiłków o dużej zawartości tłuszczu nie wpływa na farmakokinetykę arypiprazolu. Dystrybucja Arypiprazol jest rozmieszczany w całym organizmie, pozorna objętość dystrybucji wynosi 4,9 l/kg, co wskazuje na znaczną dystrybucję pozanaczyniową. W stężeniach terapeutycznych arypiprazol i dehydroarypiprazol wiążą się w ponad 99% z białkami surowicy, głównie z albuminami. Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie. Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakokinetyczne
Jak wynika z badań in vitro , enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N- dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. W stanie stacjonarnym aktywny metabolit, dehydroarypiprazol, stanowi około 40% AUC arypiprazolu w osoczu. Eliminacja Średni okres półtrwania arypiprazolu w fazie eliminacji wynosi około 75 godzin u osób o podwyższonej aktywności CYP2D6 i około 146 godzin u osób o obniżonej aktywności CYP2D6. Całkowity klirens arypiprazolu wynosi 0,7 ml/min/kg i jest to głównie klirens wątrobowy. Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [ 14 C], stwierdza się odpowiednio 27% i 60% podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1% niezmienionego arypiprazolu zostaje wydalone z moczem i około 18% z kałem.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakokinetyczne
Dzieci i młodzież Farmakokinetyka arypiprazolu i dehydroarypiprazolu u dzieci w wieku od 10 do 17 lat była podobna do farmakokinetyki u dorosłych, po uwzględnieniu różnic w masie ciała. Farmakokinetyka w szczególnych grupach pacjentów Pacjenci w podeszłym wieku Nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi, nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Nie stwierdzono, aby farmakokinetyka arypiprazolu różniła się u zdrowych kobiet i zdrowych mężczyzn. Nie stwierdzono także żadnego mierzalnego wpływu płci na farmakokinetykę leku u pacjentów ze schizofrenią. Palenie tytoniu Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie wpływów na farmakokinetykę arypiprazolu, zależnych od palenia tytoniu.
- CHPL leku Abilify, tabletki, 10 mgWłaściwości farmakokinetyczne
Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy. Zaburzenia czynności nerek Stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u osób z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badania obejmujące podanie pojedynczej dawki leku, przeprowadzone u osób z różnego stopnia marskością wątroby (klasy Childa-Pugha A, B i C) nie wykazały, by zaburzenia czynności wątroby wpływały istotnie na farmakokinetykę arypiprazolu i dehydroarypiprazolu, jednak w badaniu wzięło udział tylko 3 chorych z marskością wątroby klasy C, co jest liczbą niewystarczającą do wyciągnięcia wniosków dotyczących zdolności metabolicznych tych pacjentów.
- CHPL leku Abilify, tabletki, 10 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Istotne działanie toksyczne stwierdzano jedynie po podaniu dawek lub przy stopniu narażenia wyraźnie przekraczającym maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza (gromadzenie barwnika lipofuscyny i (lub) obumieranie komórek miąższowych) stwierdzany u szczurów po 104 tygodniach podawania arypiprazolu w dawce od 20 mg/kg mc. na dobę do 60 mg/kg mc.
- CHPL leku Abilify, tabletki, 10 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała od 3 do 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki) i zwiększenie częstości występowania raków nadnerczy, a także skojarzonej częstości występowania gruczolaków lub raków nadnerczy u samic szczurów otrzymujących lek w dawce 60 mg/kg mc. na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki). Największa ekspozycja nie powodująca powstawania nowotworów u samic szczurów odpowiadała 7- krotnie większej ekspozycji niż ekspozycja występująca u ludzi po zastosowaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych sprzężonych związków hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 mg/kg mc. na dobę do 125 mg/kg mc.
- CHPL leku Abilify, tabletki, 10 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym była od 1 do 3 razy wyższa niż wartość występująca u ludzi po podaniu maksymalnej zalecanej dawki klinicznej lub od 16 do 81 razy wyższa niż po podaniu maksymalnej dawki zalecanej na podstawie przeliczenia mg/m 2 pc.). Jednak stężenie sprzężonych związków siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania najwyższej proponowanej dawki 30 mg na dobę, nie przekraczało 6% stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie mniejsze (6%) niż granica rozpuszczalności określona in vitro . W badaniach toksykologicznych po podaniu wielokrotnym u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt oraz brak jest dowodów neurotoksyczności i niepożądanego wpływu na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych.
- CHPL leku Abilify, tabletki, 10 mgPrzedkliniczne dane o bezpieczeństwie
Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowano toksyczny wpływ na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po zastosowaniu dawek maksymalnych zalecanych u ludzi). Toksyczny wpływ na ciężarne samice obserwowano podczas podawania dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Abilify, tabletki, 10 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki Laktoza jednowodna Skrobia kukurydziana Celuloza mikrokrystaliczna Hydroksypropyloceluloza Magnezu stearynian Otoczka tabletki ABILIFY 5 mg tabletki Lak aluminiowy z indygotyną (E 132) ABILIFY 10 mg tabletki Żelaza tlenek czerwony (E 172) ABILIFY 15 mg tabletki Żelaza tlenek żółty (E 172) ABILIFY 30 mg tabletki Żelaza tlenek czerwony (E 172) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Aluminiowe blistry perforowane, podzielne na dawki pojedyncze, w pudełkach tekturowych zawierających 14 × 1, 28 × 1, 49 × 1, 56 × 1, 98 × 1 tabletek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
- CHPL leku Abilify, tabletki, 10 mgDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Abilify, tabletki, 15 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ABILIFY 5 mg tabletki ABILIFY 10 mg tabletki ABILIFY 15 mg tabletki ABILIFY 30 mg tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ABILIFY 5 mg tabletki Każda tabletka zawiera 5 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 63,65 mg laktozy (w postaci jednowodnej) w tabletce ABILIFY 10 mg tabletki Każda tabletka zawiera 10 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 59,07 mg laktozy (w postaci jednowodnej) w tabletce ABILIFY 15 mg tabletki Każda tabletka zawiera 15 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 54,15 mg laktozy (w postaci jednowodnej) w tabletce ABILIFY 30 mg tabletki Każda tabletka zawiera 30 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 177,22 mg laktozy (w postaci jednowodnej) w tabletce Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka ABILIFY 5 mg tabletki Prostokątna i niebieska, oznaczona na jednej stronie symbolem „A-007” i cyfrą „5”.
- CHPL leku Abilify, tabletki, 15 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
ABILIFY 10 mg tabletki Prostokątna i różowa, oznaczona na jednej stronie symbolem „A-008” i liczbą „10”. ABILIFY 15 mg tabletki Okrągła i żółta, oznaczona na jednej stronie symbolem „A-009” i liczbą „15”. ABILIFY 30 mg tabletki Okrągła i różowa, oznaczona na jednej stronie symbolem „A-011” i liczbą „30”.
- CHPL leku Abilify, tabletki, 15 mgWskazania do stosowania
4.1 Wskazania do stosowania ABILIFY jest wskazany do leczenia schizofrenii u dorosłych i u młodzieży w wieku 15 lat i starszej. ABILIFY jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym lub ciężkim w przebiegu zaburzenia afektywnego dwubiegunowego typu I oraz w zapobieganiu nowym epizodom maniakalnym u dorosłych, u których występują głównie epizody maniakalne i którzy odpowiadają na leczenie arypiprazolem (patrz punkt 5.1). ABILIFY jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym lub ciężkim w przebiegu zaburzenia afektywnego dwubiegunowego typu I u młodzieży w wieku 13 lat i starszej, w leczeniu trwającym do 12 tygodni (patrz punkt 5.1).
- CHPL leku Abilify, tabletki, 15 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Schizofrenia: zalecana dawka początkowa produktu ABILIFY to 10 mg na dobę lub 15 mg na dobę z dawką podtrzymującą 15 mg na dobę. Lek należy podawać raz na dobę o stałej porze, niezależnie od posiłków. ABILIFY jest skuteczny w dawkach od 10 mg na dobę do 30 mg na dobę. Chociaż nie potwierdzono większej skuteczności dawek większych niż dawka dobowa 15 mg, to jednak u poszczególnych pacjentów większa dawka może być korzystna. Maksymalna dawka dobowa nie może być większa niż 30 mg. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I: zalecana dawka początkowa to 15 mg produktu ABILIFY podawana w schemacie raz na dobę, niezależnie od posiłków jako monoterapia lub w leczeniu skojarzonym (patrz punkt 5.1). U niektórych pacjentów może być korzystne zastosowanie większej dawki. Maksymalna dawka dobowa nie może być większa niż 30 mg.
- CHPL leku Abilify, tabletki, 15 mgDawkowanie
Zapobieganie nawrotom epizodów maniakalnych w zaburzeniu afektywnym dwubiegunowym typu I: w celu zapobiegania nawrotom epizodów maniakalnych u pacjentów, którzy stosują arypiprazol w monoterapii lub w terapii skojarzonej, należy kontynuować leczenie stosując ustaloną dawkę. Dostosowanie dawki dobowej, w tym jej zmniejszenie, należy rozważyć na podstawie stanu klinicznego. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej : zalecana dawka produktu ABILIFY, to 10 mg na dobę podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie powinno być rozpoczęte od dawki 2 mg (stosując ABILIFY 1 mg/ml roztwór doustny) przez 2 dni, stopniowo zwiększanej do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. W przypadkach, w których zwiększenie dawki jest właściwe, należy podawać kolejne dawki zwiększone jednorazowo o 5 mg, nie przekraczając maksymalnej dawki dobowej 30 mg (patrz punkt 5.1).
- CHPL leku Abilify, tabletki, 15 mgDawkowanie
ABILIFY jest skuteczny w przedziale dawek od 10 mg na dobę do 30 mg na dobę. Nie wykazano większej skuteczności przy zastosowaniu dawek dobowych większych niż 10 mg, chociaż indywidualni pacjenci mogą odnieść korzyść z zastosowania większych dawek. ABILIFY nie jest zalecany do stosowania u pacjentów ze schizofrenią w wieku poniżej 15 lat, z powodu braku wystarczających danych dotyczących bezpieczeństwa stosowania i skuteczności (patrz punkty 4.8 i 5.1). Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej: zalecana dawka produktu ABILIFY to 10 mg na dobę, podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie należy rozpocząć od dawki 2 mg (stosując ABILIFY roztwór doustny 1 mg/ml) przez 2 dni, stopniowo zwiększać do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg.
- CHPL leku Abilify, tabletki, 15 mgDawkowanie
Czas trwania leczenia powinien być możliwie najkrótszy konieczny do uzyskania kontroli objawów i nie może być dłuższy niż 12 tygodni. Nie wykazano większej skuteczności po zastosowaniu dawek dobowych większych niż 10 mg, a dawka dobowa wynosząca 30 mg jest związana ze znacząco większą częstością występowania istotnych reakcji niepożądanych, w tym zdarzeń związanych z objawami pozapiramidowymi (ang. EPS), senności, zmęczenia oraz zwiększenia masy ciała (patrz punkt 4.8). Z tego powodu dawki większe niż 10 mg na dobę należy stosować tylko w wyjątkowych przypadkach oraz z zachowaniem ścisłej kontroli klinicznej (patrz punkty 4.4, 4.8 i 5.1). Młodsi pacjenci są narażeni na zwiększone ryzyko działań niepożądanych związanych z arypiprazolem. Z tego powodu produkt ABILIFY nie jest zalecany do stosowania u pacjentów w wieku poniżej 13 lat (patrz punkty 4.8 i 5.1).
- CHPL leku Abilify, tabletki, 15 mgDawkowanie
Drażliwość związana z zaburzeniami autystycznymi: nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego ABILIFY u dzieci i młodzieży w wieku poniżej 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących dawkowania. Tiki związane z zespołem Tourette’a: nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego ABILIFY u dzieci i młodzieży w wieku od 6 do 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących dawkowania. Szczególne grupy pacjentów Zaburzenia czynności wątroby Nie ma konieczności modyfikacji dawki u osób z zaburzeniami czynności wątroby o nasileniu lekkim lub umiarkowanym. Nie ma wystarczających danych do ustalenia dawkowania u pacjentów z ciężką niewydolnością wątroby. W tej grupie pacjentów należy ostrożnie ustalać dawkowanie.
- CHPL leku Abilify, tabletki, 15 mgDawkowanie
Niemniej jednak, w grupie pacjentów z ciężkimi zaburzeniami czynności wątroby największą dawkę dobową 30 mg należy stosować ze szczególną ostrożnością (patrz punkt 5.2). Zaburzenia czynności nerek Nie ma konieczności modyfikacji dawki u pacjentów z zaburzeniami czynności nerek. Pacjenci w podeszłym wieku Bezpieczeństwo i skuteczność stosowania produktu ABILIFY w leczeniu schizofrenii i w epizodach manii w przebiegu zaburzenia afektywnywnego dwubiegunowego typu I nie zostały zbadane u pacjentów w wieku 65 lat i starszych. Jednak z powodu większej wrażliwości tych pacjentów, należy rozważyć zastosowanie mniejszej dawki początkowej, jeśli pozwalają na to okoliczności kliniczne (patrz punkt 4.4). Płeć Nie ma konieczności modyfikacji dawek leku w zależności od płci (patrz punkt 5.2). Palacze tytoniu Biorąc pod uwagę metabolizm arypiprazolu nie ma konieczności modyfikacji dawek u palaczy (patrz punkt 4.5).
- CHPL leku Abilify, tabletki, 15 mgDawkowanie
Dostosowanie dawki z powodu interakcji Dawkę arypiprazolu należy zmniejszyć w przypadku równoczesnego podawania leku o silnym działaniu hamującym w stosunku do cytochromu CYP3A4 lub CYP2D6. Po zakończeniu jednoczesnego stosowania inhibitora CYP3A4 lub CYP2D6 należy ponownie zwiększyć dawkę arypiprazolu (patrz punkt 4.5). Dawkę arypiprazolu należy zwiększyć w przypadku równoczesnego podawania leków silnie indukujących CYP3A4. Po odstawieniu leku indukującego CYP3A4, dawkę arypiprazolu należy ponownie zmniejszyć do zalecanej (patrz punkt 4.5). Sposób podawania Produkt leczniczy ABILIFY jest przeznaczony do podawania doustnego. Tabletki ulegające rozpadowi w jamie ustnej lub roztwór doustny mogą być stosowane alternatywnie do tabletek ABILIFY u pacjentów, którzy mają trudności w połykaniu tabletek ABILIFY (patrz także punkt 5.2).
- CHPL leku Abilify, tabletki, 15 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Abilify, tabletki, 15 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić w ciągu od kilku dni do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Prawdopodobieństwo podjęcia próby samobójczej Występowanie zachowań samobójczych jest związane z chorobami psychicznymi oraz zaburzeniami nastroju i w niektórych przypadkach było zgłaszane wkrótce po rozpoczęciu lub zmianie leczenia przeciwpsychotycznego, w tym leczenia arypiprazolem (patrz punkt 4.8). Leczenie przeciwpsychotyczne pacjentów wysokiego ryzyka powinno odbywać się pod ścisłym nadzorem. Zaburzenia sercowo-naczyniowe Arypiprazol należy stosować ostrożnie u pacjentów z chorobą sercowo-naczyniową (zawał mięśnia sercowego lub choroba niedokrwienna, niewydolność serca lub zaburzenia przewodzenia w wywiadzie), chorobą naczyń mózgu, w stanach predysponujących do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie przeciwnadciśnieniowymi produktami leczniczymi) lub z nadciśnieniem tętniczym, w tym postępującym lub złośliwym.
- CHPL leku Abilify, tabletki, 15 mgSpecjalne środki ostrozności
Po zastosowaniu leków przeciwpsychotycznych obserwowano przypadki żylnej choroby zakrzepowo-zatorowej (VTE - ang. venous thromboembolism ). Ponieważ u pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE przed rozpoczęciem oraz w czasie leczenia arypiprazolem i wdrożyć odpowiednie środki zapobiegawcze. Wydłużenie odstępu QT W badaniach klinicznych arypiprazolu częstość występowania wydłużenia odstępu QT była porównywalna z placebo. Arypiprazol należy stosować ostrożnie u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy W badaniach klinicznych trwających nie dłużej niż rok, w trakcie leczenia arypiprazolem zgłaszano niezbyt częste przypadki dyskinez związane z leczeniem.
- CHPL leku Abilify, tabletki, 15 mgSpecjalne środki ostrozności
Jeśli objawy przedmiotowe lub podmiotowe późnych dyskinez wystąpią u pacjentów leczonych arypiprazolem, należy rozważyć zmniejszenie dawki lub odstawienie leku (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Inne objawy pozapiramidowe W pediatrycznych badaniach klinicznych z zastosowaniem arypiprazolu obserwowano akatyzję oraz parkinsonizm. Jeśli u pacjenta przyjmującego arypiprazol wystąpią objawy przedmiotowe i podmiotowe innych zaburzeń pozapiramidowych, należy rozważyć zmniejszenie dawki oraz wprowadzenie ścisłej kontroli klinicznej. Złośliwy Zespół Neuroleptyczny (NMS ) NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z podawaniem leków przeciwpsychotycznych. W badaniach klinicznych, odnotowano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku Abilify, tabletki, 15 mgSpecjalne środki ostrozności
Klinicznymi objawami NMS są bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz objawy niestabilności autonomicznego układu nerwowego (nieregularne tętno lub wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Jednakże, obserwowano także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę, niekoniecznie związane z NMS. Jeśli wystąpiły wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS, bądź niewyjaśnionego pochodzenia wysoka gorączka, bez innych objawów NMS, należy przerwać leczenie wszystkimi lekami przeciwpsychotycznymi, w tym także arypiprazolem. Drgawki W badaniach klinicznych odnotowano niezbyt częste przypadki napadów drgawek w czasie leczenia arypiprazolem.
- CHPL leku Abilify, tabletki, 15 mgSpecjalne środki ostrozności
Z tego powodu arypiprazol należy stosować z zachowaniem ostrożności u pacjentów, u których w przeszłości występowały napady drgawek lub u których występują choroby wiążące się ze skłonnością do takich napadów (patrz punkt 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencją Zwiększona śmiertelność W trzech badaniach kontrolowanych placebo (n = 938, średnia wieku: 82,4; zakres: od 56 do 99 lat), u pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera, leczonych arypiprazolem, występowało zwiększone ryzyko zgonu w porównaniu z grupą otrzymującą placebo. Częstość zgonów u pacjentów leczonych arypiprazolem wynosiła 3,5% w porównaniu do 1,7% w grupie placebo. Chociaż przyczyny zgonów były zróżnicowane to większość zgonów wydawała się być związana albo z chorobami układu krążenia (np. niewydolność serca, nagłe zgony) albo z chorobami zakaźnymi (np. zapalenie płuc) (patrz punkt 4.8).
- CHPL leku Abilify, tabletki, 15 mgSpecjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego U pacjentów w tych samych badaniach odnotowano działania niepożądane dotyczące krążenia mózgowego (np. udar, przejściowe napady niedokrwienia) w tym o przebiegu zakończonym zgonem (średnia wieku: 84 lata; zakres od 78 do 88 lat). Ogólnie w tych badaniach 1,3% wszystkich pacjentów leczonych arypiprazolem zgłaszało działania niepożądane dotyczące krążenia mózgowego w porównaniu do 0,6% pacjentów otrzymujących placebo. Różnica ta nie była istotna statystycznie. Jednakże w jednym z tych badań z zastosowaniem ustalonego dawkowania u pacjentów leczonych arypiprazolem występowała istotna zależność odpowiedzi od dawki dla działań niepożądanych dotyczących krążenia mózgowego (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów z psychozą związaną z demencją.
- CHPL leku Abilify, tabletki, 15 mgSpecjalne środki ostrozności
Hiperglikemia i cukrzyca U pacjentów leczonych nietypowymi lekami przeciwpsychotycznymi, w tym arypiprazolem, opisywano hiperglikemię, w niektórych przypadkach bardzo wysoką z kwasicą ketonową i śpiączką hiperosmotyczną lub zgonem. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. W badaniach klinicznych z arypiprazolem nie było istotnych różnic w częstości występowania działań niepożądanych związanych z hiperglikemią (w tym cukrzycy) lub nieprawidłowych wartości laboratoryjnych stężenia glukozy w porównaniu do placebo. Nie jest dostępna dokładna ocena ryzyka wystąpienia działań niepożądanych związanych z hiperglikemią, która pozwalałaby na dokonanie bezpośredniego porównania leczenia arypiprazolem i innymi atypowymi lekami przeciwpsychotycznymi.
- CHPL leku Abilify, tabletki, 15 mgSpecjalne środki ostrozności
Pacjenci leczeni jakimikolwiek lekami przeciwpsychotycznymi, włącznie z arypiprazolem, powinni być obserwowani, czy nie występują u nich objawy podmiotowe i przedmiotowe związane z hiperglikemią (takie jak nadmierne pragnienie, wielomocz, nadmierny apetyt i osłabienie), a pacjenci z cukrzycą lub czynnikami ryzyka wystąpienia cukrzycy powinni być regularnie monitorowani pod względem pogorszenia kontroli glikemii (patrz punkt 4.8). Nadwrażliwość Podczas przyjmowania arypiprazolu mogą wystąpić reakcje nadwrażliwości charakteryzujące się objawami reakcji uczuleniowych (patrz punkt 4.8). Zwiększenie masy ciała Obserwowane u pacjentów ze schizofrenią i zaburzeniem afektywnym dwubiegunowym zwiększenie masy ciała jest zwykle spowodowane współistniejącymi chorobami, stosowaniem leków przeciwpsychotycznych, o których wiadomo, że powodują zwiększenie masy ciała, niewłaściwym stylem życia i może prowadzić do ciężkich powikłań.
- CHPL leku Abilify, tabletki, 15 mgSpecjalne środki ostrozności
Po wprowadzeniu leku do obrotu obserwowano zwiększenie masy ciała u pacjentów otrzymujących arypiprazol. Jeśli występowało, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych arypiprazol nie powodował klinicznie istotnego zwiększenia masy ciała u dorosłych (patrz punkt 5.1). W badaniach klinicznych z udziałem młodzieży z zaburzeniem afektywnym dwubiegunowym wykazano, że stosowanie arypiprazolu ma związek ze zwiększeniem masy ciała po 4 tygodniach leczenia. U młodzieży z zaburzeniem afektywnym dwubiegunowym należy kontrolować przyrost masy ciała. Jeśli przyrost masy ciała jest znaczący klinicznie, należy rozważyć zmniejszenie dawki (patrz punkt 4.8). Dysfagia Ze stosowaniem leków przeciwpsychotycznych, w tym arypiprazolu, wiąże się spowolnienie motoryki przełyku i ryzyko aspiracji. Arypiprazol należy stosować ostrożnie u pacjentów z ryzykiem wystąpienia zachłystowego zapalenia płuc.
- CHPL leku Abilify, tabletki, 15 mgSpecjalne środki ostrozności
Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Podczas przyjmowania arypiprazolu u pacjentów mogą występować zwiększone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy obejmują: zwiększenie popędów seksualnych, kompulsywną potrzebę wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania. Ważne jest, aby lekarze przepisujący lek pytali pacjentów lub opiekunów w szczególności o pojawienie się nowego lub zwiększonego popędu do hazardu, popędów seksualnych, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa lub kompulsywnego objadania się, lub innych popędów podczas leczenia arypiprazolem. Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu leku.
- CHPL leku Abilify, tabletki, 15 mgSpecjalne środki ostrozności
Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Lekarz rozważy zmianę dawki lub odstawienie leku, jeśli u pacjenta wystąpią takie popędy podczas przyjmowania arypiprazolu (patrz punkt 4.8). Laktoza ABILIFY tabletki zawierają laktozę. Lek nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy. Pacjenci ze współistniejącym zespołem nadpobudliwości psychoruchowej (ang. attention deficit hyperactivity disorder , ADHD) Pomimo wysokiej częstości współistnienia zaburzenia afektywnego dwubiegunowego typu I oraz zespołu ADHD, dane dotyczące bezpieczeństwa jednoczesnego stosowania arypiprazolu oraz stymulantów są bardzo ograniczone; dlatego też należy zachować wyjątkową ostrożność w razie podawania tych produktów jednocześnie.
- CHPL leku Abilify, tabletki, 15 mgSpecjalne środki ostrozności
Upadki Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków. Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2).
- CHPL leku Abilify, tabletki, 15 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na antagonistyczne działanie na receptor adrenergiczny α 1 , arypiprazol może nasilać działanie niektórych przeciwnadciśnieniowych produktów leczniczych. Ze względu na pierwotne działanie arypiprazolu na OUN, należy zachować ostrożność, jeśli arypiprazol jest podawany razem z alkoholem lub z innymi produktami leczniczymi działającymi na OUN, wywołującymi zbliżone działania niepożądane, takie jak sedacja (patrz punkt 4.8). Należy zachować ostrożność podając arypiprazol równocześnie z produktami leczniczymi, o których wiadomo, że powodują wydłużenie odstępu QT lub zaburzenia elektrolitowe. Możliwy wpływ innych produktów leczniczych na arypiprazol Antagonista receptora H 2 - famotydyna, lek hamujący uwalnianie kwasu żołądkowego, zmniejsza szybkość wchłaniania arypiprazolu, jednak działanie to nie ma znaczenia klinicznego.
- CHPL leku Abilify, tabletki, 15 mgInterakcje
Arypiprazol jest metabolizowany na wiele sposobów, w tym także przez enzymy, takie jak CYP2D6 i CYP3A4. Nie jest jednak metabolizowany przez enzymy z grupy CYP1A, a więc nie jest konieczne stosowanie specjalnych dawek u palaczy tytoniu. Chinidyna i inne silne inhibitory CYP2D6 Wyniki badań klinicznych z udziałem zdrowych osób wykazały, że silny inhibitor enzymu CYP2D6 (chinidyna) zwiększa wartość AUC arypiprazolu o 107%, podczas gdy wartość C max nie zmienia się. Wartości AUC i C max dehydroarypiprazolu, aktywnego metabolitu, były zmniejszone odpowiednio o 32% i 47%. W przypadku jednoczesnego podawania chinidyny i arypiprazolu, należy zmniejszyć dawkę arypiprazolu o około połowę w stosunku do przepisanej dawki. Inne silne inhibitory grupy enzymów CYP2D6, takie jak fluoksetyna i paroksetyna, mogą powodować podobne skutki i w takich sytuacjach należy podobnie zmniejszyć dawkę leku.
- CHPL leku Abilify, tabletki, 15 mgInterakcje
Ketokonazol i inne silne inhibitory CYP3A4 Wyniki badań klinicznych z udziałem zdrowych osób wskazują, że silny inhibitor CYP3A4 (ketokonazol) zwiększa wartości AUC i C max arypiprazolu odpowiednio o 63% i 37%, zaś wartości AUC i C max dehydroarypiprazolu odpowiednio o 77% i 43%. W grupie osób o obniżonej aktywności CYP2D6, równoczesne stosowanie silnych inhibitorów CYP3A4 może powodować zwiększenie stężenia arypiprazolu w osoczu, w porównaniu do osób o podwyższonej aktywności CYP2D6. W przypadku jednoczesnego stosowania ketokonazolu albo innych silnych inhibitorów CYP3A4 z arypiprazolem, zakładane korzyści powinny przeważyć potencjalne ryzyko dla pacjenta. W przypadku jednoczesnego stosowania ketokonazolu z arypiprazolem, przepisaną dawkę arypiprazolu należy zmniejszyć o około połowę. Inne leki silnie hamujące aktywność CYP3A4, takie jak itrakonazol oraz inhibitory proteazy HIV, mogą powodować podobne skutki jak ketokonazol i w takich przypadkach należy podobnie zmniejszyć dawkę (patrz punkt 4.2).
- CHPL leku Abilify, tabletki, 15 mgInterakcje
Po odstawieniu inhibitora CYP2D6 lub CYP3A4, dawkę arypiprazolu należy zwiększyć do tej, jaką stosowano przed rozpoczęciem terapii skojarzonej. W czasie równoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazemu) lub CYP2D6 (np. escytalopramu) z arypiprazolem, można spodziewać się niewielkiego zwiększenia stężenia arypiprazolu w osoczu. Karbamazepina i inne leki indukujące CYP3A4 Po jednoczesnym podaniu karbamazepiny, leku silnie indukującego CYP3A4 w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnie geometryczne wartości C max i AUC arypiprazolu zmniejszyły się odpowiednio o 68% i 73%, w stosunku do wartości tych parametrów podczas stosowania arypiprazolu (30 mg) w monoterapii. Podobnie, w przypadku dehydroarypiprazolu średnie geometryczne wartości C max i AUC po jednoczesnym podaniu karbamazepiny zmniejszają się odpowiednio o 69% i 71%, w stosunku do ich wartości podczas stosowania arypiprazolem w monoterapii.
- CHPL leku Abilify, tabletki, 15 mgInterakcje
Zatem dawkę arypiprazolu należy podwoić, gdy jednocześnie podaje się go z karbamazepiną. Można się spodziewać, że jednoczesne podawanie arypiprazolu i innych leków silnie indukujących CYP3A4 (takich jak ryfampicyna , ryfabutyna, fenytoina, fenobarbital, prymidon, efawirenz, newirapina i ziele dziurawca) może działać podobnie i dlatego należy podobnie zwiększyć dawkę. Po zakończeniu podawania leku silnie indukującego CYP3A4, należy zmniejszyć dawkę arypiprazolu do zalecanej. Walproinian i lit Skojarzone stosowanie walproinianów lub litu z arypiprazolem nie powodowało żadnych istotnych klinicznie zmian stężenia arypiprazolu i w związku z tym nie jest konieczne dostosowanie dawki podczas podawania walproinianu lub litu w skojarzeniu z arypiprazolem. Możliwy wpływ arypiprazolu na inne produkty lecznicze W czasie badań klinicznych, dawki arypiprazolu od 10 mg na dobę do 30 mg na dobę nie wywierały istotnego wpływu na metabolizm substratów CYP2D6 (stosunek dekstrometorfan/3- metoksymorfinan), CYP2C9 (warfaryna), CYP2C19 (omeprazol) i CYP3A4 (dekstrometorfan).
- CHPL leku Abilify, tabletki, 15 mgInterakcje
Ponadto w warunkach in vitro , arypiprazol i dehydroarypiprazol nie zmieniały metabolizmu zachodzącego z udziałem CYP1A2. Istnieje zatem małe prawdopodobieństwo wystąpienia istotnych klinicznie interakcji między produktami leczniczymi metabolizowanymi przez te enzymy. Kiedy arypiprazol był podawany z walproinianem, litem lub lamotryginą nie stwierdzono klinicznie istotnej zmiany w stężeniach walproinianu, litu lub lamotryginy. Zespół serotoninowy Obserwowano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol, a możliwe objawy przedmiotowe oraz podmiotowe dla tego stanu mogą wystąpić szczególnie w przypadku jednoczesnego stosowania innych leków serotoninergicznych, takich jak SSRI/SNRI (selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny) lub leków, o których wiadomo, że zwiększają stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Abilify, tabletki, 15 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie przeprowadzono dotychczas odpowiednich badań z grupą kontrolną otrzymującą placebo dotyczących działania arypiprazolu u kobiet w ciąży. Notowano występowanie wad wrodzonych, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. Na podstawie wyników badań przeprowadzonych na zwierzętach nie można wykluczyć potencjalnego toksycznego wpływu leku na płód (patrz punkt 5.3). Pacjentki należy poinformować o konieczności powiadomienia swojego lekarza, jeśli w trakcie leczenia arypiprazolem zajdą w ciąże lub planują zajście w ciążę. Ze względu na niewystarczające dane dotyczące bezpieczeństwa u ludzi oraz budzące wątpliwości wyniki badań wpływu na rozród na zwierzętach, ten lek nie może być stosowany w okresie ciąży, chyba że spodziewane korzyści wyraźnie przewyższają potencjalne ryzyko dla płodu.
- CHPL leku Abilify, tabletki, 15 mgWpływ na płodność, ciążę i laktację
Noworodki narażone na działanie leków przeciwpsychotycznych (w tym arypiprazolu) w czasie trzeciego trymestru ciąży są w grupie ryzyka, w której mogą wystąpić działania niepożądane, w tym zaburzenia pozapiramidowe i (lub) objawy odstawienne, które po porodzie mogą różnić się ciężkością przebiegu oraz czasem trwania. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być uważnie monitorowane (patrz punkt 4.8). Karmienie piersią Arypiprazol/metabolity przenikają do mleka ludzkiego. Należy podjąć decyzję czy przerwać karmienie piersią, czy przerwać podawanie arypiprazolu biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem na reprodukcję.
- CHPL leku Abilify, tabletki, 15 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe (sedacja), senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku Abilify, tabletki, 15 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Najczęściej notowanymi działaniami niepożądanymi w badaniach prowadzonych z grupą kontrolną otrzymującą placebo były akatyzja i nudności, każde występujące częściej niż u 3% pacjentów leczonych arypiprazolem podawanym doustnie. Tabelaryczne zestawienie działań niepożądanych Częstość występowania działań niepożądanych związanych z leczeniem arypiprazolem podano w poniższej tabeli. Dane w tabeli oparto na działaniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układ/narząd i częstości: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000); nie znana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Abilify, tabletki, 15 mgDziałania niepożądane
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Nie można określić częstości działań niepożądanych zgłaszanych po wprowadzeniu do obrotu, ponieważ pochodzą one ze spontanicznych zgłoszeń. Z tego względu częstość takich działań niepożądanych określono jako „nieznana”.
- CHPL leku Abilify, tabletki, 15 mgDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia krwii układu chłonnego LeukopeniaNeutropenia Trombocytopenia Zaburzenia układu immunologicznego Reakcje uczuleniowe (np. reakcja anafilaktyczna, obrzęk naczynioruchowy obejmujący obrzęk języka, obrzęk twarzy,świąd alergiczny lub pokrzywkę) Zaburzenia endokrynologiczne Hiperprolaktynemia Zmniejszenie stężenia prolaktynywe krwi Cukrzycowa śpiączka hiperosmolarnaCukrzycowa kwasica ketonowa Zaburzenia metabolizmu iodżywiania Cukrzyca Hiperglikemia Hiponatremia Anoreksja - CHPL leku Abilify, tabletki, 15 mgDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia psychiczne Bezsenność LękNiepokój, zwł. ruchowy Depresja Hiperseksualność Próby samobójcze, myśli samobójcze i dokonane samobójstwa (patrz punkt 4.4) Patologiczne uzależnienie od hazarduZaburzenie kontroli impulsów ObżarstwoKompulsywna potrzeba wydawania pieniędzy Poriomania Zachowania agresywne Nadmierne pobudzenieNerwowość Zaburzenia układu nerwowego Akatyzja Zaburzenia pozapiramidowe DrżenieBóle głowy Sedacja SennośćZawroty głowy Późne dyskinezy DystoniaZespół„niespokojnych nóg” Złośliwy zespół neuroleptyczny Drgawki typu grand mal Zespół serotoninowy Zaburzenia mowy Zaburzenia oka Niewyraźne widzenie Podwójne widzenie Światłowstręt (fotofobia) Napad przymusowego patrzenia z rotacją gałek ocznych Zaburzenia serca Tachykardia Nagły zgon niewyjaśniony Torsades de pointes Arytmia komorowa Zatrzymanie akcji sercaBradykardia Zaburzenia naczyniowe Hipotensja ortostatyczna Choroba zakrzepowo-zatorowa żył (w tym zator płucny i zakrzepica żył głębokich) Nadciśnienie tętniczeOmdlenia Zaburzenia układu oddechowego, klatki piersiowej iśródpiersia Czkawka Zachłystowe zapalenie płuc Skurcz krtaniSkurcz części ustnej gardła Zaburzenia żołądka i jelit Zaparcia Niestrawność Nudności Nadmierne wydzielanie ślinyWymioty Zapalenie trzustki Dysfagia BiegunkaDyskomfort w jamie brzusznej Dyskomfort w obrębie żołądka Zaburzeniawątroby i dróg żółciowych Niewydolność wątrobyZapalenie wątroby Żółtaczka Zaburzenia skóry i tkanki podskórnej WysypkaReakcja fotoalergiczna ŁysienieNadmierne pocenie sięWysypka polekowa z eozynofiliąi objawami ogólnoustrojowymi (zespół DRESS) - CHPL leku Abilify, tabletki, 15 mgDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia mięśniowo- szkieletowe itkanki łącznej Rozpad mięśni poprzecznie prążkowanych (rabdomioliza) Bóle mięśnioweSztywność Zaburzenia nereki dróg moczowych Nietrzymanie moczu Zatrzymanie moczu Ciąża, połóg iokresokołoporodowy Zespół abstynencyjny u noworodków (patrz punkt 4.6) Zaburzenia układu rozrodczego ipiersi Priapizm Zaburzenia ogólne i stany w miejscu podania Zmęczenie Zaburzenia regulacji temperatury (np. hipotermia, gorączka)Ból w klatce piersiowej Obrzęk obwodowy Badaniadiagnostyczne Zmniejszenie masy ciała Zwiększenie masy ciała Zwiększenie aktywności aminotransferazy alaninowej Zwiększenie aktywności aminotransferazy asparaginianowej Zwiększenie aktywności gammaglutamylotransferazy Zwiększenie aktywności fosfatazy alkalicznej Wydłużenie odstępu QTZwiększenie stężenia glukozy we krwiZwiększenie stężenia glikozylowanej hemoglobiny Wahania stężenia glukozy we krwiZwiększona aktywność fosfokinazy kreatynowej - CHPL leku Abilify, tabletki, 15 mgDziałania niepożądane
Opis wybranych działań niepożądanych Dorośli Objawy pozapiramidowe (ang. EPS) Schizofrenia: w długookresowym 52-tygodniowym badaniu prowadzonym z grupą kontrolną, u pacjentów leczonych arypiprazolem ogólnie rzadziej występowały EPS (25,8%), w tym parkinsonizm, akatyzja, dystonia i dyskineza, w porównaniu do pacjentów leczonych haloperydolem (57,3%). W długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, częstość występowania EPS wynosiła 19% w przypadku pacjentów leczonych arypiprazolem i 13,1% w przypadku pacjentów otrzymujących placebo. W innym długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną częstość występowania EPS wynosiła 14,8% w przypadku pacjentów leczonych arypiprazolem i 15,1% w przypadku pacjentów otrzymujących olanzapinę. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I: w 12- tygodniowym badaniu prowadzonym z grupą kontrolną przypadki EPS stwierdzano u 23,5% pacjentów leczonych arypiprazolem i u 53,3% pacjentów leczonych haloperydolem.
- CHPL leku Abilify, tabletki, 15 mgDziałania niepożądane
W innym 12- tygodnowym badaniu przypadki EPS stwierdzano u 26,6% pacjentów leczonych arypiprazolem i u 17,6% pacjentów leczonych litem. W długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo podczas fazy leczenia podtrzymującego przypadki EPS wystąpiły u 18,2% pacjentów leczonych arypiprazolem i u 15,7% pacjentów otrzymujących placebo. Akatyzja W badaniach prowadzonych z grupą kontrolną otrzymującą placebo przypadki akatyzji u pacjentów z zaburzeniami afektywnymi dwubiegunowymi występowały u 12,1% pacjentów leczonych arypiprazolem i u 3,2% pacjentów otrzymujących placebo. U pacjentów ze schizofrenią liczba przypadków akatyzji wynosiła 6,2% w grupie arypiprazolu i 3,0% w grupie placebo. Dystonia Efekt klasy terapeutycznej: objawy dystonii, długotrwałe nieprawidłowe skurcze grup mięśni, mogą występować u wrażliwych pacjentów w ciągu pierwszych kilku dni leczenia.
- CHPL leku Abilify, tabletki, 15 mgDziałania niepożądane
Do objawów dystonii należą: skurcze mięśni szyi, czasami postępujące do ucisku w gardle, trudności z przełykaniem, trudności z oddychaniem i (lub) zaburzenia ruchów języka. Chociaż objawy te mogą występować po zastosowaniu małych dawek, występują częściej i o większym nasileniu podczas stosowania leków przeciwpsychotycznych pierwszej generacji o dużych mocach i w większych dawkach. Obserwowano zwiększone ryzyko ostrej dystonii u mężczyzn i w młodszych grupach wiekowych. Prolaktyna Podczas badań klinicznych w zakresie zarejestrowanych wskazań i po wprowadzeniu produktu leczniczego do obrotu u pacjentów otrzymujących arypiprazol obserwowano zarówno zwiększenie, jak i zmniejszenie stężenia prolaktyny w surowicy w porównaniu do pomiarów początkowych (punkt 5.1). Parametry laboratoryjne Porównania pomiędzy arypiprazolem i placebo dotyczące odsetka pacjentów, u których wystąpiły potencjalnie istotne zmiany rutynowych parametrów laboratoryjnych i lipidowych (patrz punkt 5.1), nie wykazały medycznie istotnych różnic (patrz punkt 5.1).
- CHPL leku Abilify, tabletki, 15 mgDziałania niepożądane
Ogólnie przejściowe i bezobjawowe zwiększenie aktywności CPK (fosfokinazy kreatynowej) obserwowano u 3,5% pacjentów leczonych arypiprazolem w porównaniu do 2,0% pacjentów otrzymujących placebo. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej W krótkoterminowym badaniu z kontrolą placebo, w którym udział wzięło 302 nastolatków (od 13 do 17 lat) chorych na schizofrenię, częstość występowania i rodzaj reakcji niepożądanych były podobne do występujących u dorosłych, z wyjątkiem następujących działań niepożądanych zgłaszanych częściej u nastolatków otrzymujących arypiprazol niż u dorosłych otrzymujących arypiprazol (i częściej niż placebo): Senność/sedacja i zaburzenia pozapiramidowe były zgłaszane bardzo często (≥1/10), oraz suchość w jamie ustnej, zwiększony apetyt, niedociśnienie ortostatyczne były zgłaszane często (≥1/100, <1/10).
- CHPL leku Abilify, tabletki, 15 mgDziałania niepożądane
Profil bezpieczeństwa w 26-tygodniowym badaniu prowadzonym na zasadzie próby otwartej, był podobny do obserwowanego w badaniu krótkoterminowym z kontrolą placebo. Profil bezpieczeństwa w długoterminowym badaniu prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo był podobny z wyjątkiem następujących reakcji, które były zgłaszane częściej, niż w grupie dzieci i młodzieży przyjmujących placebo: często zgłaszano zmniejszenie masy ciała, zwiększenie stężenia insuliny we krwi, arytmię i leukopenię (≥1/100, <1/10). W zebranej populacji nastolatków (od 13 do 17 lat) chorych na schizofrenię, leczonych do 2 lat, przypadki małego stężenia prolaktyny w surowicy stwierdzono u 29,5% dziewcząt (<3 ng/ml) i 48,3% chłopców (<2 ng/ml). W grupie młodzieży (w wieku od 13 do 17 lat) ze schizofrenią, otrzymującej dawki arypiprazolu od 5 mg do 30 mg przez okres maksymalnie do 72 miesięcy, częstość występowania niskich stężeń prolaktyny w surowicy u kobiet (<3 ng/ml) i u mężczyzn (<2 ng/ml) wynosiła odpowiednio 25,6% i 45,0%.
- CHPL leku Abilify, tabletki, 15 mgDziałania niepożądane
Podczas dwóch długoterminowych badań z udziałem młodzieży (od 13 do 17 lat) ze schizofrenią i pacjentów z chorobą afektywną dwubiegunową leczonych arypiprazolem, częstość występowania małych stężeń prolaktyny w surowicy u kobiet (<3 ng/ml) i mężczyzn (<2 ng/ml) wynosiła odpowiednio 37,0% i 59,4%. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej Częstość występowania i rodzaj reakcji niepożądanych u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I były podobne do występujących u dorosłych, z wyjątkiem następujących działań niepożądanych: senność (23,0%), zaburzenia pozapiramidowe (18.4%), akatyzja (16.0%) i zmęczenie (11.8%) były zgłaszane bardzo często (≥1/10); natomiast ból w górnej części brzucha, zwiększenie częstości akcji serca, zwiększenie masy ciała, zwiększenie apetytu, drżenie mięśni oraz dyskineza były zgłaszane często (≥1/100, <1/10).
- CHPL leku Abilify, tabletki, 15 mgDziałania niepożądane
Następujące reakcje niepożądane miały prawdopodobnie związek z zastosowaną dawką: zaburzenia pozapiramidowe (częstość występowania w przypadku dawki 10 mg wynosiła 9,1%; w przypadku dawki 30 mg 28,8%; w przypadku placebo 1,7%); i akatyzja (częstość występowania w przypadku dawki 10 mg wynosiła 12,1%; w przypadku dawki 30 mg 20,3%; w przypadku placebo 1,7%). Średnie zmiany masy ciała u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I po 12. oraz 30. tygodniu wynosiły odpowiednio w przypadku arypiprazolu 2,4 kg oraz 5,8 kg, a w przypadku placebo 0,2 kg oraz 2,3 kg. W populacji dzieci i młodzieży senność oraz zmęczenie obserwowano częściej u pacjentów z zaburzeniem afektywnym dwubiegunowym, w porównaniu do pacjentów ze schizofrenią. W populacji dzieci i młodzieży z zaburzeniem afektywnym dwubiegunowym (od 10 do 17 lat), leczonych do 30 tygodni, przypadki małego stężenia prolaktyny w surowicy stwierdzono u 28,0% dziewcząt (<3 ng/ml) i 53,3% chłopców (<2 ng/ml).
- CHPL leku Abilify, tabletki, 15 mgDziałania niepożądane
Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Patologiczne uzależnienie od hazardu, hiperseksualność, kompulsywna potrzeba wydawania pieniędzy i obżarstwo lub kompulsywne objadanie się mogą wystąpić u pacjentów leczonych arypiprazolem (patrz punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania wymienionego w załączniku V .
- CHPL leku Abilify, tabletki, 15 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedmiotowe i podmiotowe W badaniach klinicznych i po wprowadzeniu produktu do obrotu przypadkowe bądź zamierzone przedawkowanie samego arypiprazolu stwierdzono u dorosłych pacjentów po oszacowanej dawce do 1260 mg niezakończone zgonem. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: letarg, wzrost ciśnienia tętniczego krwi, senność, przyspieszona czynność serca (tachykardia), nudności, wymioty i biegunka. Ponadto zgłaszano przypadkowe przedawkowanie samego arypiprazolu (do 195 mg) u dzieci, bez zgonów. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: senność, przejściowa utrata świadomości i objawy pozapiramidowe. Postępowanie po przedawkowaniu W przypadku przedawkowania leku stosuje się leczenie podtrzymujące, polegające na utrzymaniu drożności dróg oddechowych, dotlenianiu i wentylacji oraz leczeniu objawowym. Należy wziąć pod uwagę możliwość wpływu wielu produktów leczniczych.
- CHPL leku Abilify, tabletki, 15 mgPrzedawkowanie
Z tego względu należy niezwłocznie rozpocząć monitorowanie czynności układu krążenia, obejmujące stałe monitorowanie zapisu elektrokardiograficznego, w celu wykrycia możliwych zaburzeń rytmu serca. W przypadku potwierdzonego lub podejrzewanego przedawkowania arypiprazolu należy objąć pacjenta ścisłą kontrolą i obserwować go do czasu poprawy jego stanu. Aktywowany węgiel (50 g), podany w godzinę po zażyciu arypiprazolu, obniża wartość C max leku o około 41%, a wartość AUC o około 51%, co wskazuje na jego skuteczność w leczeniu przedawkowania. Hemodializa Pomimo że brak informacji dotyczących wpływu hemodializ w leczeniu przedawkowania arypiprazolu, to jednak istnieje małe prawdopodobieństwo, by hemodializy były użyteczne w takich przypadkach, ze względu na znaczny stopień wiązania arypiprazolu z białkami osocza.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12 Mechanizm działania Uważa się, że skuteczność arypiprazolu w leczeniu schizofrenii i zaburzenia afektywnego dwubiegunowego typu I jest związana ze skojarzonym działaniem częściowo agonistycznym w stosunku do receptora dopaminowego D 2 i serotoninowego 5-HT 1A oraz antagonistycznym w stosunku do receptora serotoninowego 5-HT 2A . Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D 2 i D 3 , serotoninowych 5-HT 1A i 5-HT 2A oraz umiarkowane powinowactwo do receptorów dopaminowych D 4 , serotoninowych 5-HT 2C i 5-HT 7 , a także adrenergicznych alfa-1 i histaminowych H 1 .
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Arypiprazol w dawkach od 0,5 mg do 30 mg, podawany raz na dobę przez 2 tygodnie osobom zdrowym powoduje zależne od dawki zmniejszenie wiązania rakloprydu znakowanego 11 C, ligandu receptora D 2 /D 3 , w jądrze ogoniastym i skorupie, co można wykryć za pomocą pozytonowej tomografii emisyjnej. Skuteczność kliniczna i bezpieczeństwo stosowania Dorośli Schizofrenia Wyniki trzech krótkoterminowych badań (od 4 do 6 tygodni) z grupą kontrolną otrzymującą placebo, w których udział wzięło 1 228 dorosłych chorych na schizofrenię, u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
Arypiprazol jest skuteczny w podtrzymywaniu poprawy klinicznej podczas kontynuacji leczenia u tych dorosłych pacjentów, u których obserwowano wstępną dobrą reakcję na lek. W badaniu z grupą kontrolną przyjmującą haloperydol, odsetek pacjentów, u których udało się utrzymać dobrą reakcję na produkt leczniczy, w ciągu 52 tygodni był podobny w obu grupach (arypiprazol 77% i haloperydol 73%). Badanie ukończyła istotnie większa grupa pacjentów leczonych arypiprazolem (43%) niż haloperydolem (30%). Wyniki uzyskane w skalach ocen stosowanych jako drugorzędowe punkty końcowe skuteczności, w tym w skali PANSS i w skali oceny depresji Montgomery-Asberg [ang. Montgomery–Åsberg-Depression-Rating-Scale, MADRS], wskazują na istotną poprawę w stosunku do haloperydolu. W trwającym 26 tygodni badaniu prowadzonym z grupą kontrolną otrzymującą placebo, z udziałem pacjentów dorosłych z ustabilizowaną przewlekłą schizofrenią stwierdzono w wyniku leczenia arypiprazolem większe zmniejszenie częstości nawrotów, 34% w grupie leczonych arypiprazolem i 57% w grupie otrzymującej placebo.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
Przyrost masy ciała Wyniki badań klinicznych wskazują, że arypiprazol nie powoduje klinicznie istotnego przyrostu masy ciała. W trwającym 26 tygodni badaniu z grupą kontrolną leczonych olanzapiną i wykorzystaniem podwójnie ślepej próby, przeprowadzonym w wielu krajach, udział wzięło 314 dorosłych pacjentów ze schizofrenią. Pierwszorzędowym punktem końcowym była ocena przyrostu masy ciała. U istotnie mniejszej liczby pacjentów leczonych arypiprazolem w porównaniu z otrzymującymi olanzapinę, stwierdzono przyrost masy ciała o co najmniej 7% w porównaniu z pomiarem początkowym (tzn. przyrost masy ciała o co najmniej 5,6 kg przy średniej początkowej masie wynoszącej ok. 80,5 kg) w grupie leczonych arypiprazolem (n = 18 lub 13% pacjentów nadających się do oceny), w porównaniu z grupą otrzymującą olanzapinę (n = 45 lub 33% pacjentów nadających się do oceny).
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
Stężenia lipidów W zbiorczej analizie wyników stężeń lipidów pochodzących z badań klinicznych prowadzonych z grupą kontrolną otrzymującą placebo u dorosłych, arypiprazol nie powodował klinicznie istotnych zmian stężeń cholesterolu całkowitego, triglicerydów, cholesterolu frakcji lipoprotein o dużej gęstości (HDL) i cholesterolu frakcji lipoprotein o małej gęstości (LDL). Prolaktyna Stężenia prolaktyny oceniono podczas wszystkich badań z zastosowaniem wszystkich dawek arypiprazolu (n = 28 242). Częstość występowania hiperprolaktynemii lub zwiększenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem (0,3%) była podobna do częstości występowania hiperprolaktynemii w grupie otrzymującej placebo (0,2%). U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia hiperprolaktynemii wynosiła 42 dni, a mediana czasu trwania wynosiła 34 dni.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
Częstość występowania hiperprolaktynemii lub zmniejszenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem wynosiła 0,4% w porównaniu do 0,02% w grupie otrzymującej placebo. U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 30 dni, a mediana czasu trwania wynosiła 194 dni. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I W dwóch 3-tygodniowych badaniach, prowadzonych z grupą kontrolną otrzymującą placebo, z zastosowaniem zmiennej dawki, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol był znacząco bardziej skuteczny niż placebo w zmniejszaniu objawów maniakalnych w ciągu 3 tygodni. Badania te obejmowały pacjentów z objawami lub bez objawów psychotycznych oraz pacjentów z szybką zmianą fazy lub bez szybkiej zmiany fazy (przebieg typu rapid-cycling).
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
W jednym 3-tygodniowym badaniu, prowadzonym z grupą kontrolną otrzymującą placebo, z zastosowaniem stałej dawki w monoterapii, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol nie wykazał większej skuteczności niż placebo. W dwóch 12-tygodniowych badaniach, prowadzonych z grupą kontrolną otrzymującą placebo oraz inne substancje czynne, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, arypiprazol był skuteczniejszy niż placebo w 3. tygodniu badania, a wynik leczenia podtrzymującego był w 12. tygodniu badania porównywalny z wynikiem dla litu lub haloperydolu. W 12. tygodniu arypiprazol powodował także remisję objawów maniakalnych u porównywalnej liczby pacjentów co lit lub haloperydol.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
W 6-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, którzy częściowo nie reagowali na monoterapię litem lub walproinianem przez 2 tygodnie przy terapeutycznych stężeniach w surowicy, zastosowanie arypiprazolu jako dodatkowego leku w większym stopniu zwiększyło skuteczność zapobiegania objawom maniakalnym niż stosowanie litu lub walproinianu w monoterapii. W 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, które przedłużono o 74 tygodnie, u pacjentów z objawami maniakalnymi, którzy osiągnęli remisję w trakcie stosowania arypiprazolu w czasie fazy stabilizacji przed randomizacją, arypiprazol był bardziej skuteczny niż placebo w zapobieganiu nawrotowi chorobie dwubiegunowej, głównie w zapobieganiu nawrotowi objawów maniakalnych, ale nie wykazał przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
W 52-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, u pacjentów z obecnym epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, którzy osiągnęli trwałą remisję (w skali oceny manii Younga [ang. Young Mania Rating Scale, YMRS] oraz w skali oceny depresji MADRS z całkowitą ilością punktów ≤ 12) w trakcie stosowania arypiprazolu (w dawce od 10 mg na dobę do 30 mg na dobę) w skojarzeniu z litem lub walproinianem przez 12 kolejnych tygodni, połączenie z arypiprazolem wykazało przewagę nad placebo w zapobieganiu nawrotowi choroby afektywnej dwubiegunowej zmniejszając ryzyko o 46% (współczynnik ryzyka 0,54) i w zapobieganiu nawrotom manii zmniejszając ryzyko o 65% (współczynnik ryzyka 0,35), ale nie wykazało przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
Zastosowanie arypiprazolu jako dodatkowego leku wykazało przewagę wobec placebo w przypadku drugorzędowego pomiaru wyniku leczenia w ocenach ogólnego wrażenia klinicznego w wersji dla ChAD (ang. Clinical Global Impression - Bipolar version, CGI-BP) nasilenia choroby (mania) (ang. Severity of illness , SOI [mania]). W tym badaniu, pacjenci zostali przydzieleni przez badaczy do badania prowadzonego metodą próby otwartej, z zastosowaniem litu lub walproinianu w monoterapii, w celu oceny częściowego braku odpowiedzi. Pacjenci byli stabilizowani przez co najmniej 12 kolejnych tygodni za pomocą skojarzenia arypiprazolu i stosowanego wcześniej stabilizatora nastroju. Pacjenci stabilni byli następnie losowo przydzielani do grupy kontynuującej stosowanie tego samego stabilizatora nastroju z arypiprazolem lub placebo w badaniu metodą podwójnie ślepej próby.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
W fazie randomizowanej oceniano cztery podgrupy stabilizatora nastroju: arypiprazol + lit; arypiprazol + walproinian; placebo + lit; placebo + walproinian. Odsetki Kaplana- Meiera dla nawrotu jakiegokolwiek zaburzenia nastroju w przypadku zastosowania dodatkowego leku były następujące: 16% w grupie stosującej arypiprazol + lit i 18% w grupie stosującej arypiprazol + walproinian, w porównaniu do 45% w grupie stosującej placebo + lit i 19% w grupie stosującej placebo + walproinian. Populacja dzieci i młodzieży Schizofrenia u młodzieży Wyniki 6-tygodniowego badania z grupą kontrolną otrzymującą placebo, w którym udział wzięło 302 nastoletnich pacjentów chorych na schizofrenię (od 13 do 17 lat), u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje statystycznie istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
W czasie trwania 26-tygodniowego badania prowadzonego metodą otwartej próby w analizie podgrupy nastoletnich pacjentów w wieku od 15 do 17 lat obserwowano utrzymywanie się działania u 74% całkowitej populacji włączonej do badania. W badaniu z randomizacją, prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo, trwającym od 60 do 89 tygodni, które prowadzono z udziałem młodzieży ze schizofrenią (n = 146; w wieku od 13 do 17 lat) występowała statystycznie znamienna różnica w zakresie odsetka nawrotów objawów psychotycznych pomiędzy grupą otrzymującą arypiprazol (19,39%) a grupą otrzymującą placebo (37,5%). Punkt szacunkowy współczynnika ryzyka (HR) w całej populacji wynosił 0,461 (95% przedział ufności, od 0,242 do 0,879). W analizach w podgrupach punkt szacunkowy współczynnika ryzyka wynosił 0,495 wśród uczestników w wieku od 13 do 14 lat w porównaniu do 0,454 wśród uczestników w wieku od 15 do 17 lat.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
Jednak ocena szacunkowa współczynnika ryzyka w grupie młodszych uczestników (od 13 do 14 lat) nie była precyzyjna, odzwierciedlając mniejszą liczebność uczestników w tej grupie (arypiprazol, n = 29; placebo, n = 12) i przedział ufności dla tej oceny szacunkowej (wynoszący od 0,151 do 1,628) uniemożliwiał wyciągnięcie wniosków odnośnie występowania wyniku leczenia. Natomiast 95% przedział ufności dla współczynnika ryzyka w podgrupie starszych uczestników (arypiprazol, n = 69; placebo, n = 36) wynosił od 0,242 do 0,879 i dlatego można wyciągnąć wnioski odnośnie wyników leczenia u starszych pacjentów. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u dzieci i młodzieży Arypiprazol badano w 30-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, w którym udział wzięło 296 dzieci i młodzieży (od 10 do 17 lat), którzy spełnili kryteria diagnostyczne według DSM-IV (ang.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
Diagnostic and Statistical Manual of Mental Disorders ) dla zaburzenia afektywnego dwubiegunowego typu I z epizodami maniakalnymi lub mieszanymi z objawami psychotycznymi lub bez tych objawów oraz wyjściowo mieli wynik ≥20 w skali manii według Younga (Y-MRS). Wśród pacjentów włączonych do podstawowej analizy skuteczności, 139 pacjentów miało postawioną diagnozę aktualnie współistniejącego ADHD. Arypiprazol wykazał przewagę w stosunku do placebo w odniesieniu do zmiany wartości wyjściowej w 4. oraz 12. tygodniu jako wynik całościowy wg Y-MRS. W analizie post-hoc przewaga nad placebo była bardziej wyraźna u pacjentów ze współistniejącym zespołem ADHD w porównaniu do pacjentów bez ADHD, gdzie nie zaobserwowano różnicy w stosunku do placebo. Zapobieganie nawrotom nie zostało określone. Do najczęstszych zdarzeń niepożądanych występujących w trakcie leczenia, wśród pacjentów otrzymujących dawkę 30 mg, były zaburzenia pozapiramidowe (28,3%), senność (27,3%), ból głowy (23,2%) oraz nudności (14,1%).
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
Średni przyrost masy ciała w 30-tygodniowm okresie leczenia wynosił 2,9 kg, w porównaniu do 0,98 kg u pacjentów, u których stosowano placebo. Drażliwość związana z zaburzeniami autystycznymi u dzieci i młodzieży (patrz punkt 4.2) U pacjentów w wieku od 6 do 17 lat arypiprazol badano w dwóch 8-tygodniowych badaniach prowadzonych z grupą kontrolną otrzymującą placebo [w jednym badaniu stosowano zmienną dawkę (od 2 mg na dobę do 15 mg na dobę), a w drugim stałą dawkę (5 mg na dobę, 10 mg na dobę lub 15 mg na dobę)] oraz jednym 52-tygodniowym badaniu otwartym. Dawkowanie w tych badaniach rozpoczynano od dawki 2 mg na dobę, po tygodniu zwiększanej do 5 mg na dobę, a następnie zwiększanej w odstępach tygodniowych o 5 mg na dobę do czasu osiągnięcia dawki docelowej. Ponad 75% pacjentów miało mniej niż 13 lat. Arypiprazol wykazał statystycznie większą skuteczność w porównaniu do placebo w podskali dotyczącej drażliwości Listy Zachowań Aberracyjnych (ang.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
Aberrant Behaviour Checklist Irritability subscale ). Jednakże, nie ustalono znaczenia klinicznego tej obserwacji. Profil bezpieczeństwa obejmował przyrost masy ciała i zmianę stężenia prolaktyny. Czas trwania długoterminowego badania dotyczącego bezpieczeństwa był ograniczony do 52-tygodni. W zebranych badaniach, częstość występowania małego stężenia prolaktyny u dziewcząt (<3 ng/ml) i u chłopców (<2 ng/ml) leczonych arypiprazolem wynosiła odpowiednio, 27/46 (58,7%) i 258/298 (86,6%). W badaniach prowadzonych z grupą kontrolną otrzymującą placebo średni przyrost masy ciała wynosił 0,4 kg w grupie placebo i 1,6 kg w grupie arypiprazolu. Arypiprazol badano także w długoterminowym badaniu leczenia podtrzymującego, prowadzonym z grupą kontrolną otrzymującą placebo. Po od 13- do 26-tygodniowej stabilizacji z zastosowaniem arypiprazolu (w dawkach od 2 mg na dobę do 15 mg na dobę), pacjenci z trwałą odpowiedzią albo kontynuowali leczenie arypiprazolem, albo otrzymywali placebo przez kolejne 16 tygodni.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
Odsetki Kaplana-Meiera dla nawrotu w tygodniu 16. były następujące: 35% dla grupy stosującej arypiprazol oraz 52% dla grupy placebo; współczynnik ryzyka nawrotu w 16 tygodniu (arypiprazol/placebo) wynosił 0,57 (różnica nieistotna statystycznie). Średni przyrost masy ciała w fazie stabilizacji (do 26 tygodni) w grupie otrzymującej arypiprazol wynosił 3,2 kg, natomiast w drugiej fazie badania (16 tygodni) obserwowano dalszy średni wzrost o 2,2 kg w grupie otrzymującej arypiprazol w porównaniu do 0,6 kg w grupie placebo. Objawy pozapiramidowe były zgłaszane głównie w fazie stabilizacji, u 17% pacjentów, z drgawkami stanowiącymi 6,5%. Tiki związane z zespołem Tourette’a u dzieci i młodzieży (patrz punkt 4.2) Skuteczność arypiprazolu badano u dzieci i młodzieży z zespołem Tourette’a (arypiprazol: n = 99, placebo: n = 44) w trwającym 8 tygodni, randomizowanym badaniu prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo w schemacie leczenia w grupach z użyciem stałej dawki zależnej od masy ciała od 5 mg na dobę do 20 mg na dobę i dawki początkowej wynoszącej 2 mg.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
Pacjenci byli w wieku od 7 do 17 lat i przed rozpoczęciem leczenia uzyskali średni wynik 30 na łącznej skali tików w Globalnej Skali Nasilenia Tików z Yale ( Total Tic Score on the Yale Global Tic Severity Scale , TTS-YGTSS). Grupa pacjentów otrzymująca arypiprazol wykazywała poprawę mierzoną zmianą wyniku na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 8 tygodniu leczenia, która wynosiła 13,35 w grupie otrzymującej małą dawkę (5 mg lub 10 mg) i 16,94 w grupie otrzymującej dużą dawkę (10 mg lub 20 mg) w porównaniu do poprawy odnotowanej u pacjentów otrzymujących placebo i zmiany wynoszącej 7,09. Skuteczność arypiprazolu u dzieci i młodzieży z zespołem Touretta (arypiprazol: n = 32, placebo: n = 29) oceniano również w przypadku podawania zmiennych dawek od 2 mg na dobę do 20 mg na dobę z dawką początkową wynoszącą 2 mg w trwającym 10 tygodni, randomizowanym badaniu prowadzonym w Korei Południowej prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakodynamiczne
Pacjenci w wieku od 6 do 18 lat uzyskali średni wynik 29 na skali TTS-YGTSS w pomiarze początkowym. Pacjenci otrzymujący arypiprazol wykazywali poprawę mierzoną zmianą wyniku o 14,97 na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 10 tygodniu w porównaniu do poprawy wynoszącej 9,62 w grupie placebo. W obu wspomnianych badaniach krótkoterminowych nie określono klinicznego znaczenia wyników dotyczących skuteczności, biorąc pod uwagę wielkość działania terapeutycznego w porównaniu do dużego wpływu efektu placebo i niejasne skutki w zakresie funkcjonowania psychospołecznego. Brak danych długoterminowych dotyczących skuteczności i bezpieczeństwa stosowania arypiprazolu w tej niestabilnej chorobie. Europejska Agencja Leków wstrzymała obowiązek dołączania wyników badań produktu leczniczego ABILIFY w jednej lub kilku podgrupach populacji dzieci i młodzieży w leczeniu schizofrenii oraz w leczeniu choroby afektywnej dwubiegunowej (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Arypiprazol jest dobrze wchłaniany, maksymalne stężenie w osoczu osiąga w ciągu od 3 do 5 godzin po podaniu. Arypiprazol w minimalnym stopniu ulega metabolizmowi przedukładowemu. Bezwzględna dostępność po doustnym podaniu jednej tabletki wynosi 87%. Spożywanie posiłków o dużej zawartości tłuszczu nie wpływa na farmakokinetykę arypiprazolu. Dystrybucja Arypiprazol jest rozmieszczany w całym organizmie, pozorna objętość dystrybucji wynosi 4,9 l/kg, co wskazuje na znaczną dystrybucję pozanaczyniową. W stężeniach terapeutycznych arypiprazol i dehydroarypiprazol wiążą się w ponad 99% z białkami surowicy, głównie z albuminami. Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie. Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakokinetyczne
Jak wynika z badań in vitro , enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N- dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. W stanie stacjonarnym aktywny metabolit, dehydroarypiprazol, stanowi około 40% AUC arypiprazolu w osoczu. Eliminacja Średni okres półtrwania arypiprazolu w fazie eliminacji wynosi około 75 godzin u osób o podwyższonej aktywności CYP2D6 i około 146 godzin u osób o obniżonej aktywności CYP2D6. Całkowity klirens arypiprazolu wynosi 0,7 ml/min/kg i jest to głównie klirens wątrobowy. Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [ 14 C], stwierdza się odpowiednio 27% i 60% podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1% niezmienionego arypiprazolu zostaje wydalone z moczem i około 18% z kałem.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakokinetyczne
Dzieci i młodzież Farmakokinetyka arypiprazolu i dehydroarypiprazolu u dzieci w wieku od 10 do 17 lat była podobna do farmakokinetyki u dorosłych, po uwzględnieniu różnic w masie ciała. Farmakokinetyka w szczególnych grupach pacjentów Pacjenci w podeszłym wieku Nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi, nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Nie stwierdzono, aby farmakokinetyka arypiprazolu różniła się u zdrowych kobiet i zdrowych mężczyzn. Nie stwierdzono także żadnego mierzalnego wpływu płci na farmakokinetykę leku u pacjentów ze schizofrenią. Palenie tytoniu Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie wpływów na farmakokinetykę arypiprazolu, zależnych od palenia tytoniu.
- CHPL leku Abilify, tabletki, 15 mgWłaściwości farmakokinetyczne
Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy. Zaburzenia czynności nerek Stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u osób z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badania obejmujące podanie pojedynczej dawki leku, przeprowadzone u osób z różnego stopnia marskością wątroby (klasy Childa-Pugha A, B i C) nie wykazały, by zaburzenia czynności wątroby wpływały istotnie na farmakokinetykę arypiprazolu i dehydroarypiprazolu, jednak w badaniu wzięło udział tylko 3 chorych z marskością wątroby klasy C, co jest liczbą niewystarczającą do wyciągnięcia wniosków dotyczących zdolności metabolicznych tych pacjentów.
- CHPL leku Abilify, tabletki, 15 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Istotne działanie toksyczne stwierdzano jedynie po podaniu dawek lub przy stopniu narażenia wyraźnie przekraczającym maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza (gromadzenie barwnika lipofuscyny i (lub) obumieranie komórek miąższowych) stwierdzany u szczurów po 104 tygodniach podawania arypiprazolu w dawce od 20 mg/kg mc. na dobę do 60 mg/kg mc.
- CHPL leku Abilify, tabletki, 15 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała od 3 do 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki) i zwiększenie częstości występowania raków nadnerczy, a także skojarzonej częstości występowania gruczolaków lub raków nadnerczy u samic szczurów otrzymujących lek w dawce 60 mg/kg mc. na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki). Największa ekspozycja nie powodująca powstawania nowotworów u samic szczurów odpowiadała 7- krotnie większej ekspozycji niż ekspozycja występująca u ludzi po zastosowaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych sprzężonych związków hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 mg/kg mc. na dobę do 125 mg/kg mc.
- CHPL leku Abilify, tabletki, 15 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym była od 1 do 3 razy wyższa niż wartość występująca u ludzi po podaniu maksymalnej zalecanej dawki klinicznej lub od 16 do 81 razy wyższa niż po podaniu maksymalnej dawki zalecanej na podstawie przeliczenia mg/m 2 pc.). Jednak stężenie sprzężonych związków siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania najwyższej proponowanej dawki 30 mg na dobę, nie przekraczało 6% stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie mniejsze (6%) niż granica rozpuszczalności określona in vitro . W badaniach toksykologicznych po podaniu wielokrotnym u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt oraz brak jest dowodów neurotoksyczności i niepożądanego wpływu na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych.
- CHPL leku Abilify, tabletki, 15 mgPrzedkliniczne dane o bezpieczeństwie
Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowano toksyczny wpływ na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po zastosowaniu dawek maksymalnych zalecanych u ludzi). Toksyczny wpływ na ciężarne samice obserwowano podczas podawania dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Abilify, tabletki, 15 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki Laktoza jednowodna Skrobia kukurydziana Celuloza mikrokrystaliczna Hydroksypropyloceluloza Magnezu stearynian Otoczka tabletki ABILIFY 5 mg tabletki Lak aluminiowy z indygotyną (E 132) ABILIFY 10 mg tabletki Żelaza tlenek czerwony (E 172) ABILIFY 15 mg tabletki Żelaza tlenek żółty (E 172) ABILIFY 30 mg tabletki Żelaza tlenek czerwony (E 172) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Aluminiowe blistry perforowane, podzielne na dawki pojedyncze, w pudełkach tekturowych zawierających 14 × 1, 28 × 1, 49 × 1, 56 × 1, 98 × 1 tabletek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
- CHPL leku Abilify, tabletki, 15 mgDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Abilify, tabletki, 30 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ABILIFY 5 mg tabletki ABILIFY 10 mg tabletki ABILIFY 15 mg tabletki ABILIFY 30 mg tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ABILIFY 5 mg tabletki Każda tabletka zawiera 5 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 63,65 mg laktozy (w postaci jednowodnej) w tabletce ABILIFY 10 mg tabletki Każda tabletka zawiera 10 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 59,07 mg laktozy (w postaci jednowodnej) w tabletce ABILIFY 15 mg tabletki Każda tabletka zawiera 15 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 54,15 mg laktozy (w postaci jednowodnej) w tabletce ABILIFY 30 mg tabletki Każda tabletka zawiera 30 mg arypiprazolu. Substancja pomocnicza o znanym działaniu 177,22 mg laktozy (w postaci jednowodnej) w tabletce Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka ABILIFY 5 mg tabletki Prostokątna i niebieska, oznaczona na jednej stronie symbolem „A-007” i cyfrą „5”.
- CHPL leku Abilify, tabletki, 30 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
ABILIFY 10 mg tabletki Prostokątna i różowa, oznaczona na jednej stronie symbolem „A-008” i liczbą „10”. ABILIFY 15 mg tabletki Okrągła i żółta, oznaczona na jednej stronie symbolem „A-009” i liczbą „15”. ABILIFY 30 mg tabletki Okrągła i różowa, oznaczona na jednej stronie symbolem „A-011” i liczbą „30”.
- CHPL leku Abilify, tabletki, 30 mgWskazania do stosowania
4.1 Wskazania do stosowania ABILIFY jest wskazany do leczenia schizofrenii u dorosłych i u młodzieży w wieku 15 lat i starszej. ABILIFY jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym lub ciężkim w przebiegu zaburzenia afektywnego dwubiegunowego typu I oraz w zapobieganiu nowym epizodom maniakalnym u dorosłych, u których występują głównie epizody maniakalne i którzy odpowiadają na leczenie arypiprazolem (patrz punkt 5.1). ABILIFY jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym lub ciężkim w przebiegu zaburzenia afektywnego dwubiegunowego typu I u młodzieży w wieku 13 lat i starszej, w leczeniu trwającym do 12 tygodni (patrz punkt 5.1).
- CHPL leku Abilify, tabletki, 30 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Schizofrenia: zalecana dawka początkowa produktu ABILIFY to 10 mg na dobę lub 15 mg na dobę z dawką podtrzymującą 15 mg na dobę. Lek należy podawać raz na dobę o stałej porze, niezależnie od posiłków. ABILIFY jest skuteczny w dawkach od 10 mg na dobę do 30 mg na dobę. Chociaż nie potwierdzono większej skuteczności dawek większych niż dawka dobowa 15 mg, to jednak u poszczególnych pacjentów większa dawka może być korzystna. Maksymalna dawka dobowa nie może być większa niż 30 mg. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I: zalecana dawka początkowa to 15 mg produktu ABILIFY podawana w schemacie raz na dobę, niezależnie od posiłków jako monoterapia lub w leczeniu skojarzonym (patrz punkt 5.1). U niektórych pacjentów może być korzystne zastosowanie większej dawki. Maksymalna dawka dobowa nie może być większa niż 30 mg.
- CHPL leku Abilify, tabletki, 30 mgDawkowanie
Zapobieganie nawrotom epizodów maniakalnych w zaburzeniu afektywnym dwubiegunowym typu I: w celu zapobiegania nawrotom epizodów maniakalnych u pacjentów, którzy stosują arypiprazol w monoterapii lub w terapii skojarzonej, należy kontynuować leczenie stosując ustaloną dawkę. Dostosowanie dawki dobowej, w tym jej zmniejszenie, należy rozważyć na podstawie stanu klinicznego. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej : zalecana dawka produktu ABILIFY, to 10 mg na dobę podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie powinno być rozpoczęte od dawki 2 mg (stosując ABILIFY 1 mg/ml roztwór doustny) przez 2 dni, stopniowo zwiększanej do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. W przypadkach, w których zwiększenie dawki jest właściwe, należy podawać kolejne dawki zwiększone jednorazowo o 5 mg, nie przekraczając maksymalnej dawki dobowej 30 mg (patrz punkt 5.1).
- CHPL leku Abilify, tabletki, 30 mgDawkowanie
ABILIFY jest skuteczny w przedziale dawek od 10 mg na dobę do 30 mg na dobę. Nie wykazano większej skuteczności przy zastosowaniu dawek dobowych większych niż 10 mg, chociaż indywidualni pacjenci mogą odnieść korzyść z zastosowania większych dawek. ABILIFY nie jest zalecany do stosowania u pacjentów ze schizofrenią w wieku poniżej 15 lat, z powodu braku wystarczających danych dotyczących bezpieczeństwa stosowania i skuteczności (patrz punkty 4.8 i 5.1). Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej: zalecana dawka produktu ABILIFY to 10 mg na dobę, podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie należy rozpocząć od dawki 2 mg (stosując ABILIFY roztwór doustny 1 mg/ml) przez 2 dni, stopniowo zwiększać do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg.
- CHPL leku Abilify, tabletki, 30 mgDawkowanie
Czas trwania leczenia powinien być możliwie najkrótszy konieczny do uzyskania kontroli objawów i nie może być dłuższy niż 12 tygodni. Nie wykazano większej skuteczności po zastosowaniu dawek dobowych większych niż 10 mg, a dawka dobowa wynosząca 30 mg jest związana ze znacząco większą częstością występowania istotnych reakcji niepożądanych, w tym zdarzeń związanych z objawami pozapiramidowymi (ang. EPS), senności, zmęczenia oraz zwiększenia masy ciała (patrz punkt 4.8). Z tego powodu dawki większe niż 10 mg na dobę należy stosować tylko w wyjątkowych przypadkach oraz z zachowaniem ścisłej kontroli klinicznej (patrz punkty 4.4, 4.8 i 5.1). Młodsi pacjenci są narażeni na zwiększone ryzyko działań niepożądanych związanych z arypiprazolem. Z tego powodu produkt ABILIFY nie jest zalecany do stosowania u pacjentów w wieku poniżej 13 lat (patrz punkty 4.8 i 5.1).
- CHPL leku Abilify, tabletki, 30 mgDawkowanie
Drażliwość związana z zaburzeniami autystycznymi: nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego ABILIFY u dzieci i młodzieży w wieku poniżej 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących dawkowania. Tiki związane z zespołem Tourette’a: nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego ABILIFY u dzieci i młodzieży w wieku od 6 do 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących dawkowania. Szczególne grupy pacjentów Zaburzenia czynności wątroby Nie ma konieczności modyfikacji dawki u osób z zaburzeniami czynności wątroby o nasileniu lekkim lub umiarkowanym. Nie ma wystarczających danych do ustalenia dawkowania u pacjentów z ciężką niewydolnością wątroby. W tej grupie pacjentów należy ostrożnie ustalać dawkowanie.
- CHPL leku Abilify, tabletki, 30 mgDawkowanie
Niemniej jednak, w grupie pacjentów z ciężkimi zaburzeniami czynności wątroby największą dawkę dobową 30 mg należy stosować ze szczególną ostrożnością (patrz punkt 5.2). Zaburzenia czynności nerek Nie ma konieczności modyfikacji dawki u pacjentów z zaburzeniami czynności nerek. Pacjenci w podeszłym wieku Bezpieczeństwo i skuteczność stosowania produktu ABILIFY w leczeniu schizofrenii i w epizodach manii w przebiegu zaburzenia afektywnywnego dwubiegunowego typu I nie zostały zbadane u pacjentów w wieku 65 lat i starszych. Jednak z powodu większej wrażliwości tych pacjentów, należy rozważyć zastosowanie mniejszej dawki początkowej, jeśli pozwalają na to okoliczności kliniczne (patrz punkt 4.4). Płeć Nie ma konieczności modyfikacji dawek leku w zależności od płci (patrz punkt 5.2). Palacze tytoniu Biorąc pod uwagę metabolizm arypiprazolu nie ma konieczności modyfikacji dawek u palaczy (patrz punkt 4.5).
- CHPL leku Abilify, tabletki, 30 mgDawkowanie
Dostosowanie dawki z powodu interakcji Dawkę arypiprazolu należy zmniejszyć w przypadku równoczesnego podawania leku o silnym działaniu hamującym w stosunku do cytochromu CYP3A4 lub CYP2D6. Po zakończeniu jednoczesnego stosowania inhibitora CYP3A4 lub CYP2D6 należy ponownie zwiększyć dawkę arypiprazolu (patrz punkt 4.5). Dawkę arypiprazolu należy zwiększyć w przypadku równoczesnego podawania leków silnie indukujących CYP3A4. Po odstawieniu leku indukującego CYP3A4, dawkę arypiprazolu należy ponownie zmniejszyć do zalecanej (patrz punkt 4.5). Sposób podawania Produkt leczniczy ABILIFY jest przeznaczony do podawania doustnego. Tabletki ulegające rozpadowi w jamie ustnej lub roztwór doustny mogą być stosowane alternatywnie do tabletek ABILIFY u pacjentów, którzy mają trudności w połykaniu tabletek ABILIFY (patrz także punkt 5.2).
- CHPL leku Abilify, tabletki, 30 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Abilify, tabletki, 30 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić w ciągu od kilku dni do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Prawdopodobieństwo podjęcia próby samobójczej Występowanie zachowań samobójczych jest związane z chorobami psychicznymi oraz zaburzeniami nastroju i w niektórych przypadkach było zgłaszane wkrótce po rozpoczęciu lub zmianie leczenia przeciwpsychotycznego, w tym leczenia arypiprazolem (patrz punkt 4.8). Leczenie przeciwpsychotyczne pacjentów wysokiego ryzyka powinno odbywać się pod ścisłym nadzorem. Zaburzenia sercowo-naczyniowe Arypiprazol należy stosować ostrożnie u pacjentów z chorobą sercowo-naczyniową (zawał mięśnia sercowego lub choroba niedokrwienna, niewydolność serca lub zaburzenia przewodzenia w wywiadzie), chorobą naczyń mózgu, w stanach predysponujących do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie przeciwnadciśnieniowymi produktami leczniczymi) lub z nadciśnieniem tętniczym, w tym postępującym lub złośliwym.
- CHPL leku Abilify, tabletki, 30 mgSpecjalne środki ostrozności
Po zastosowaniu leków przeciwpsychotycznych obserwowano przypadki żylnej choroby zakrzepowo-zatorowej (VTE - ang. venous thromboembolism ). Ponieważ u pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE przed rozpoczęciem oraz w czasie leczenia arypiprazolem i wdrożyć odpowiednie środki zapobiegawcze. Wydłużenie odstępu QT W badaniach klinicznych arypiprazolu częstość występowania wydłużenia odstępu QT była porównywalna z placebo. Arypiprazol należy stosować ostrożnie u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy W badaniach klinicznych trwających nie dłużej niż rok, w trakcie leczenia arypiprazolem zgłaszano niezbyt częste przypadki dyskinez związane z leczeniem.
- CHPL leku Abilify, tabletki, 30 mgSpecjalne środki ostrozności
Jeśli objawy przedmiotowe lub podmiotowe późnych dyskinez wystąpią u pacjentów leczonych arypiprazolem, należy rozważyć zmniejszenie dawki lub odstawienie leku (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Inne objawy pozapiramidowe W pediatrycznych badaniach klinicznych z zastosowaniem arypiprazolu obserwowano akatyzję oraz parkinsonizm. Jeśli u pacjenta przyjmującego arypiprazol wystąpią objawy przedmiotowe i podmiotowe innych zaburzeń pozapiramidowych, należy rozważyć zmniejszenie dawki oraz wprowadzenie ścisłej kontroli klinicznej. Złośliwy Zespół Neuroleptyczny (NMS ) NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z podawaniem leków przeciwpsychotycznych. W badaniach klinicznych, odnotowano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku Abilify, tabletki, 30 mgSpecjalne środki ostrozności
Klinicznymi objawami NMS są bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz objawy niestabilności autonomicznego układu nerwowego (nieregularne tętno lub wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Jednakże, obserwowano także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę, niekoniecznie związane z NMS. Jeśli wystąpiły wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS, bądź niewyjaśnionego pochodzenia wysoka gorączka, bez innych objawów NMS, należy przerwać leczenie wszystkimi lekami przeciwpsychotycznymi, w tym także arypiprazolem. Drgawki W badaniach klinicznych odnotowano niezbyt częste przypadki napadów drgawek w czasie leczenia arypiprazolem.
- CHPL leku Abilify, tabletki, 30 mgSpecjalne środki ostrozności
Z tego powodu arypiprazol należy stosować z zachowaniem ostrożności u pacjentów, u których w przeszłości występowały napady drgawek lub u których występują choroby wiążące się ze skłonnością do takich napadów (patrz punkt 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencją Zwiększona śmiertelność W trzech badaniach kontrolowanych placebo (n = 938, średnia wieku: 82,4; zakres: od 56 do 99 lat), u pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera, leczonych arypiprazolem, występowało zwiększone ryzyko zgonu w porównaniu z grupą otrzymującą placebo. Częstość zgonów u pacjentów leczonych arypiprazolem wynosiła 3,5% w porównaniu do 1,7% w grupie placebo. Chociaż przyczyny zgonów były zróżnicowane to większość zgonów wydawała się być związana albo z chorobami układu krążenia (np. niewydolność serca, nagłe zgony) albo z chorobami zakaźnymi (np. zapalenie płuc) (patrz punkt 4.8).
- CHPL leku Abilify, tabletki, 30 mgSpecjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego U pacjentów w tych samych badaniach odnotowano działania niepożądane dotyczące krążenia mózgowego (np. udar, przejściowe napady niedokrwienia) w tym o przebiegu zakończonym zgonem (średnia wieku: 84 lata; zakres od 78 do 88 lat). Ogólnie w tych badaniach 1,3% wszystkich pacjentów leczonych arypiprazolem zgłaszało działania niepożądane dotyczące krążenia mózgowego w porównaniu do 0,6% pacjentów otrzymujących placebo. Różnica ta nie była istotna statystycznie. Jednakże w jednym z tych badań z zastosowaniem ustalonego dawkowania u pacjentów leczonych arypiprazolem występowała istotna zależność odpowiedzi od dawki dla działań niepożądanych dotyczących krążenia mózgowego (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów z psychozą związaną z demencją.
- CHPL leku Abilify, tabletki, 30 mgSpecjalne środki ostrozności
Hiperglikemia i cukrzyca U pacjentów leczonych nietypowymi lekami przeciwpsychotycznymi, w tym arypiprazolem, opisywano hiperglikemię, w niektórych przypadkach bardzo wysoką z kwasicą ketonową i śpiączką hiperosmotyczną lub zgonem. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. W badaniach klinicznych z arypiprazolem nie było istotnych różnic w częstości występowania działań niepożądanych związanych z hiperglikemią (w tym cukrzycy) lub nieprawidłowych wartości laboratoryjnych stężenia glukozy w porównaniu do placebo. Nie jest dostępna dokładna ocena ryzyka wystąpienia działań niepożądanych związanych z hiperglikemią, która pozwalałaby na dokonanie bezpośredniego porównania leczenia arypiprazolem i innymi atypowymi lekami przeciwpsychotycznymi.
- CHPL leku Abilify, tabletki, 30 mgSpecjalne środki ostrozności
Pacjenci leczeni jakimikolwiek lekami przeciwpsychotycznymi, włącznie z arypiprazolem, powinni być obserwowani, czy nie występują u nich objawy podmiotowe i przedmiotowe związane z hiperglikemią (takie jak nadmierne pragnienie, wielomocz, nadmierny apetyt i osłabienie), a pacjenci z cukrzycą lub czynnikami ryzyka wystąpienia cukrzycy powinni być regularnie monitorowani pod względem pogorszenia kontroli glikemii (patrz punkt 4.8). Nadwrażliwość Podczas przyjmowania arypiprazolu mogą wystąpić reakcje nadwrażliwości charakteryzujące się objawami reakcji uczuleniowych (patrz punkt 4.8). Zwiększenie masy ciała Obserwowane u pacjentów ze schizofrenią i zaburzeniem afektywnym dwubiegunowym zwiększenie masy ciała jest zwykle spowodowane współistniejącymi chorobami, stosowaniem leków przeciwpsychotycznych, o których wiadomo, że powodują zwiększenie masy ciała, niewłaściwym stylem życia i może prowadzić do ciężkich powikłań.
- CHPL leku Abilify, tabletki, 30 mgSpecjalne środki ostrozności
Po wprowadzeniu leku do obrotu obserwowano zwiększenie masy ciała u pacjentów otrzymujących arypiprazol. Jeśli występowało, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych arypiprazol nie powodował klinicznie istotnego zwiększenia masy ciała u dorosłych (patrz punkt 5.1). W badaniach klinicznych z udziałem młodzieży z zaburzeniem afektywnym dwubiegunowym wykazano, że stosowanie arypiprazolu ma związek ze zwiększeniem masy ciała po 4 tygodniach leczenia. U młodzieży z zaburzeniem afektywnym dwubiegunowym należy kontrolować przyrost masy ciała. Jeśli przyrost masy ciała jest znaczący klinicznie, należy rozważyć zmniejszenie dawki (patrz punkt 4.8). Dysfagia Ze stosowaniem leków przeciwpsychotycznych, w tym arypiprazolu, wiąże się spowolnienie motoryki przełyku i ryzyko aspiracji. Arypiprazol należy stosować ostrożnie u pacjentów z ryzykiem wystąpienia zachłystowego zapalenia płuc.
- CHPL leku Abilify, tabletki, 30 mgSpecjalne środki ostrozności
Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Podczas przyjmowania arypiprazolu u pacjentów mogą występować zwiększone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy obejmują: zwiększenie popędów seksualnych, kompulsywną potrzebę wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania. Ważne jest, aby lekarze przepisujący lek pytali pacjentów lub opiekunów w szczególności o pojawienie się nowego lub zwiększonego popędu do hazardu, popędów seksualnych, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa lub kompulsywnego objadania się, lub innych popędów podczas leczenia arypiprazolem. Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu leku.
- CHPL leku Abilify, tabletki, 30 mgSpecjalne środki ostrozności
Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Lekarz rozważy zmianę dawki lub odstawienie leku, jeśli u pacjenta wystąpią takie popędy podczas przyjmowania arypiprazolu (patrz punkt 4.8). Laktoza ABILIFY tabletki zawierają laktozę. Lek nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy. Pacjenci ze współistniejącym zespołem nadpobudliwości psychoruchowej (ang. attention deficit hyperactivity disorder , ADHD) Pomimo wysokiej częstości współistnienia zaburzenia afektywnego dwubiegunowego typu I oraz zespołu ADHD, dane dotyczące bezpieczeństwa jednoczesnego stosowania arypiprazolu oraz stymulantów są bardzo ograniczone; dlatego też należy zachować wyjątkową ostrożność w razie podawania tych produktów jednocześnie.
- CHPL leku Abilify, tabletki, 30 mgSpecjalne środki ostrozności
Upadki Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków. Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2).
- CHPL leku Abilify, tabletki, 30 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na antagonistyczne działanie na receptor adrenergiczny α 1 , arypiprazol może nasilać działanie niektórych przeciwnadciśnieniowych produktów leczniczych. Ze względu na pierwotne działanie arypiprazolu na OUN, należy zachować ostrożność, jeśli arypiprazol jest podawany razem z alkoholem lub z innymi produktami leczniczymi działającymi na OUN, wywołującymi zbliżone działania niepożądane, takie jak sedacja (patrz punkt 4.8). Należy zachować ostrożność podając arypiprazol równocześnie z produktami leczniczymi, o których wiadomo, że powodują wydłużenie odstępu QT lub zaburzenia elektrolitowe. Możliwy wpływ innych produktów leczniczych na arypiprazol Antagonista receptora H 2 - famotydyna, lek hamujący uwalnianie kwasu żołądkowego, zmniejsza szybkość wchłaniania arypiprazolu, jednak działanie to nie ma znaczenia klinicznego.
- CHPL leku Abilify, tabletki, 30 mgInterakcje
Arypiprazol jest metabolizowany na wiele sposobów, w tym także przez enzymy, takie jak CYP2D6 i CYP3A4. Nie jest jednak metabolizowany przez enzymy z grupy CYP1A, a więc nie jest konieczne stosowanie specjalnych dawek u palaczy tytoniu. Chinidyna i inne silne inhibitory CYP2D6 Wyniki badań klinicznych z udziałem zdrowych osób wykazały, że silny inhibitor enzymu CYP2D6 (chinidyna) zwiększa wartość AUC arypiprazolu o 107%, podczas gdy wartość C max nie zmienia się. Wartości AUC i C max dehydroarypiprazolu, aktywnego metabolitu, były zmniejszone odpowiednio o 32% i 47%. W przypadku jednoczesnego podawania chinidyny i arypiprazolu, należy zmniejszyć dawkę arypiprazolu o około połowę w stosunku do przepisanej dawki. Inne silne inhibitory grupy enzymów CYP2D6, takie jak fluoksetyna i paroksetyna, mogą powodować podobne skutki i w takich sytuacjach należy podobnie zmniejszyć dawkę leku.
- CHPL leku Abilify, tabletki, 30 mgInterakcje
Ketokonazol i inne silne inhibitory CYP3A4 Wyniki badań klinicznych z udziałem zdrowych osób wskazują, że silny inhibitor CYP3A4 (ketokonazol) zwiększa wartości AUC i C max arypiprazolu odpowiednio o 63% i 37%, zaś wartości AUC i C max dehydroarypiprazolu odpowiednio o 77% i 43%. W grupie osób o obniżonej aktywności CYP2D6, równoczesne stosowanie silnych inhibitorów CYP3A4 może powodować zwiększenie stężenia arypiprazolu w osoczu, w porównaniu do osób o podwyższonej aktywności CYP2D6. W przypadku jednoczesnego stosowania ketokonazolu albo innych silnych inhibitorów CYP3A4 z arypiprazolem, zakładane korzyści powinny przeważyć potencjalne ryzyko dla pacjenta. W przypadku jednoczesnego stosowania ketokonazolu z arypiprazolem, przepisaną dawkę arypiprazolu należy zmniejszyć o około połowę. Inne leki silnie hamujące aktywność CYP3A4, takie jak itrakonazol oraz inhibitory proteazy HIV, mogą powodować podobne skutki jak ketokonazol i w takich przypadkach należy podobnie zmniejszyć dawkę (patrz punkt 4.2).
- CHPL leku Abilify, tabletki, 30 mgInterakcje
Po odstawieniu inhibitora CYP2D6 lub CYP3A4, dawkę arypiprazolu należy zwiększyć do tej, jaką stosowano przed rozpoczęciem terapii skojarzonej. W czasie równoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazemu) lub CYP2D6 (np. escytalopramu) z arypiprazolem, można spodziewać się niewielkiego zwiększenia stężenia arypiprazolu w osoczu. Karbamazepina i inne leki indukujące CYP3A4 Po jednoczesnym podaniu karbamazepiny, leku silnie indukującego CYP3A4 w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnie geometryczne wartości C max i AUC arypiprazolu zmniejszyły się odpowiednio o 68% i 73%, w stosunku do wartości tych parametrów podczas stosowania arypiprazolu (30 mg) w monoterapii. Podobnie, w przypadku dehydroarypiprazolu średnie geometryczne wartości C max i AUC po jednoczesnym podaniu karbamazepiny zmniejszają się odpowiednio o 69% i 71%, w stosunku do ich wartości podczas stosowania arypiprazolem w monoterapii.
- CHPL leku Abilify, tabletki, 30 mgInterakcje
Zatem dawkę arypiprazolu należy podwoić, gdy jednocześnie podaje się go z karbamazepiną. Można się spodziewać, że jednoczesne podawanie arypiprazolu i innych leków silnie indukujących CYP3A4 (takich jak ryfampicyna , ryfabutyna, fenytoina, fenobarbital, prymidon, efawirenz, newirapina i ziele dziurawca) może działać podobnie i dlatego należy podobnie zwiększyć dawkę. Po zakończeniu podawania leku silnie indukującego CYP3A4, należy zmniejszyć dawkę arypiprazolu do zalecanej. Walproinian i lit Skojarzone stosowanie walproinianów lub litu z arypiprazolem nie powodowało żadnych istotnych klinicznie zmian stężenia arypiprazolu i w związku z tym nie jest konieczne dostosowanie dawki podczas podawania walproinianu lub litu w skojarzeniu z arypiprazolem. Możliwy wpływ arypiprazolu na inne produkty lecznicze W czasie badań klinicznych, dawki arypiprazolu od 10 mg na dobę do 30 mg na dobę nie wywierały istotnego wpływu na metabolizm substratów CYP2D6 (stosunek dekstrometorfan/3- metoksymorfinan), CYP2C9 (warfaryna), CYP2C19 (omeprazol) i CYP3A4 (dekstrometorfan).
- CHPL leku Abilify, tabletki, 30 mgInterakcje
Ponadto w warunkach in vitro , arypiprazol i dehydroarypiprazol nie zmieniały metabolizmu zachodzącego z udziałem CYP1A2. Istnieje zatem małe prawdopodobieństwo wystąpienia istotnych klinicznie interakcji między produktami leczniczymi metabolizowanymi przez te enzymy. Kiedy arypiprazol był podawany z walproinianem, litem lub lamotryginą nie stwierdzono klinicznie istotnej zmiany w stężeniach walproinianu, litu lub lamotryginy. Zespół serotoninowy Obserwowano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol, a możliwe objawy przedmiotowe oraz podmiotowe dla tego stanu mogą wystąpić szczególnie w przypadku jednoczesnego stosowania innych leków serotoninergicznych, takich jak SSRI/SNRI (selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny) lub leków, o których wiadomo, że zwiększają stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Abilify, tabletki, 30 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie przeprowadzono dotychczas odpowiednich badań z grupą kontrolną otrzymującą placebo dotyczących działania arypiprazolu u kobiet w ciąży. Notowano występowanie wad wrodzonych, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. Na podstawie wyników badań przeprowadzonych na zwierzętach nie można wykluczyć potencjalnego toksycznego wpływu leku na płód (patrz punkt 5.3). Pacjentki należy poinformować o konieczności powiadomienia swojego lekarza, jeśli w trakcie leczenia arypiprazolem zajdą w ciąże lub planują zajście w ciążę. Ze względu na niewystarczające dane dotyczące bezpieczeństwa u ludzi oraz budzące wątpliwości wyniki badań wpływu na rozród na zwierzętach, ten lek nie może być stosowany w okresie ciąży, chyba że spodziewane korzyści wyraźnie przewyższają potencjalne ryzyko dla płodu.
- CHPL leku Abilify, tabletki, 30 mgWpływ na płodność, ciążę i laktację
Noworodki narażone na działanie leków przeciwpsychotycznych (w tym arypiprazolu) w czasie trzeciego trymestru ciąży są w grupie ryzyka, w której mogą wystąpić działania niepożądane, w tym zaburzenia pozapiramidowe i (lub) objawy odstawienne, które po porodzie mogą różnić się ciężkością przebiegu oraz czasem trwania. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być uważnie monitorowane (patrz punkt 4.8). Karmienie piersią Arypiprazol/metabolity przenikają do mleka ludzkiego. Należy podjąć decyzję czy przerwać karmienie piersią, czy przerwać podawanie arypiprazolu biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem na reprodukcję.
- CHPL leku Abilify, tabletki, 30 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe (sedacja), senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku Abilify, tabletki, 30 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Najczęściej notowanymi działaniami niepożądanymi w badaniach prowadzonych z grupą kontrolną otrzymującą placebo były akatyzja i nudności, każde występujące częściej niż u 3% pacjentów leczonych arypiprazolem podawanym doustnie. Tabelaryczne zestawienie działań niepożądanych Częstość występowania działań niepożądanych związanych z leczeniem arypiprazolem podano w poniższej tabeli. Dane w tabeli oparto na działaniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układ/narząd i częstości: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000); nie znana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Abilify, tabletki, 30 mgDziałania niepożądane
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Nie można określić częstości działań niepożądanych zgłaszanych po wprowadzeniu do obrotu, ponieważ pochodzą one ze spontanicznych zgłoszeń. Z tego względu częstość takich działań niepożądanych określono jako „nieznana”.
- CHPL leku Abilify, tabletki, 30 mgDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia krwii układu chłonnego LeukopeniaNeutropenia Trombocytopenia Zaburzenia układu immunologicznego Reakcje uczuleniowe (np. reakcja anafilaktyczna, obrzęk naczynioruchowy obejmujący obrzęk języka, obrzęk twarzy,świąd alergiczny lub pokrzywkę) Zaburzenia endokrynologiczne Hiperprolaktynemia Zmniejszenie stężenia prolaktynywe krwi Cukrzycowa śpiączka hiperosmolarnaCukrzycowa kwasica ketonowa Zaburzenia metabolizmu iodżywiania Cukrzyca Hiperglikemia Hiponatremia Anoreksja - CHPL leku Abilify, tabletki, 30 mgDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia psychiczne Bezsenność LękNiepokój, zwł. ruchowy Depresja Hiperseksualność Próby samobójcze, myśli samobójcze i dokonane samobójstwa (patrz punkt 4.4) Patologiczne uzależnienie od hazarduZaburzenie kontroli impulsów ObżarstwoKompulsywna potrzeba wydawania pieniędzy Poriomania Zachowania agresywne Nadmierne pobudzenieNerwowość Zaburzenia układu nerwowego Akatyzja Zaburzenia pozapiramidowe DrżenieBóle głowy Sedacja SennośćZawroty głowy Późne dyskinezy DystoniaZespół„niespokojnych nóg” Złośliwy zespół neuroleptyczny Drgawki typu grand mal Zespół serotoninowy Zaburzenia mowy Zaburzenia oka Niewyraźne widzenie Podwójne widzenie Światłowstręt (fotofobia) Napad przymusowego patrzenia z rotacją gałek ocznych Zaburzenia serca Tachykardia Nagły zgon niewyjaśniony Torsades de pointes Arytmia komorowa Zatrzymanie akcji sercaBradykardia Zaburzenia naczyniowe Hipotensja ortostatyczna Choroba zakrzepowo-zatorowa żył (w tym zator płucny i zakrzepica żył głębokich) Nadciśnienie tętniczeOmdlenia Zaburzenia układu oddechowego, klatki piersiowej iśródpiersia Czkawka Zachłystowe zapalenie płuc Skurcz krtaniSkurcz części ustnej gardła Zaburzenia żołądka i jelit Zaparcia Niestrawność Nudności Nadmierne wydzielanie ślinyWymioty Zapalenie trzustki Dysfagia BiegunkaDyskomfort w jamie brzusznej Dyskomfort w obrębie żołądka Zaburzeniawątroby i dróg żółciowych Niewydolność wątrobyZapalenie wątroby Żółtaczka Zaburzenia skóry i tkanki podskórnej WysypkaReakcja fotoalergiczna ŁysienieNadmierne pocenie sięWysypka polekowa z eozynofiliąi objawami ogólnoustrojowymi (zespół DRESS) - CHPL leku Abilify, tabletki, 30 mgDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia mięśniowo- szkieletowe itkanki łącznej Rozpad mięśni poprzecznie prążkowanych (rabdomioliza) Bóle mięśnioweSztywność Zaburzenia nereki dróg moczowych Nietrzymanie moczu Zatrzymanie moczu Ciąża, połóg iokresokołoporodowy Zespół abstynencyjny u noworodków (patrz punkt 4.6) Zaburzenia układu rozrodczego ipiersi Priapizm Zaburzenia ogólne i stany w miejscu podania Zmęczenie Zaburzenia regulacji temperatury (np. hipotermia, gorączka)Ból w klatce piersiowej Obrzęk obwodowy Badaniadiagnostyczne Zmniejszenie masy ciała Zwiększenie masy ciała Zwiększenie aktywności aminotransferazy alaninowej Zwiększenie aktywności aminotransferazy asparaginianowej Zwiększenie aktywności gammaglutamylotransferazy Zwiększenie aktywności fosfatazy alkalicznej Wydłużenie odstępu QTZwiększenie stężenia glukozy we krwiZwiększenie stężenia glikozylowanej hemoglobiny Wahania stężenia glukozy we krwiZwiększona aktywność fosfokinazy kreatynowej - CHPL leku Abilify, tabletki, 30 mgDziałania niepożądane
Opis wybranych działań niepożądanych Dorośli Objawy pozapiramidowe (ang. EPS) Schizofrenia: w długookresowym 52-tygodniowym badaniu prowadzonym z grupą kontrolną, u pacjentów leczonych arypiprazolem ogólnie rzadziej występowały EPS (25,8%), w tym parkinsonizm, akatyzja, dystonia i dyskineza, w porównaniu do pacjentów leczonych haloperydolem (57,3%). W długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, częstość występowania EPS wynosiła 19% w przypadku pacjentów leczonych arypiprazolem i 13,1% w przypadku pacjentów otrzymujących placebo. W innym długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną częstość występowania EPS wynosiła 14,8% w przypadku pacjentów leczonych arypiprazolem i 15,1% w przypadku pacjentów otrzymujących olanzapinę. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I: w 12- tygodniowym badaniu prowadzonym z grupą kontrolną przypadki EPS stwierdzano u 23,5% pacjentów leczonych arypiprazolem i u 53,3% pacjentów leczonych haloperydolem.
- CHPL leku Abilify, tabletki, 30 mgDziałania niepożądane
W innym 12- tygodnowym badaniu przypadki EPS stwierdzano u 26,6% pacjentów leczonych arypiprazolem i u 17,6% pacjentów leczonych litem. W długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo podczas fazy leczenia podtrzymującego przypadki EPS wystąpiły u 18,2% pacjentów leczonych arypiprazolem i u 15,7% pacjentów otrzymujących placebo. Akatyzja W badaniach prowadzonych z grupą kontrolną otrzymującą placebo przypadki akatyzji u pacjentów z zaburzeniami afektywnymi dwubiegunowymi występowały u 12,1% pacjentów leczonych arypiprazolem i u 3,2% pacjentów otrzymujących placebo. U pacjentów ze schizofrenią liczba przypadków akatyzji wynosiła 6,2% w grupie arypiprazolu i 3,0% w grupie placebo. Dystonia Efekt klasy terapeutycznej: objawy dystonii, długotrwałe nieprawidłowe skurcze grup mięśni, mogą występować u wrażliwych pacjentów w ciągu pierwszych kilku dni leczenia.
- CHPL leku Abilify, tabletki, 30 mgDziałania niepożądane
Do objawów dystonii należą: skurcze mięśni szyi, czasami postępujące do ucisku w gardle, trudności z przełykaniem, trudności z oddychaniem i (lub) zaburzenia ruchów języka. Chociaż objawy te mogą występować po zastosowaniu małych dawek, występują częściej i o większym nasileniu podczas stosowania leków przeciwpsychotycznych pierwszej generacji o dużych mocach i w większych dawkach. Obserwowano zwiększone ryzyko ostrej dystonii u mężczyzn i w młodszych grupach wiekowych. Prolaktyna Podczas badań klinicznych w zakresie zarejestrowanych wskazań i po wprowadzeniu produktu leczniczego do obrotu u pacjentów otrzymujących arypiprazol obserwowano zarówno zwiększenie, jak i zmniejszenie stężenia prolaktyny w surowicy w porównaniu do pomiarów początkowych (punkt 5.1). Parametry laboratoryjne Porównania pomiędzy arypiprazolem i placebo dotyczące odsetka pacjentów, u których wystąpiły potencjalnie istotne zmiany rutynowych parametrów laboratoryjnych i lipidowych (patrz punkt 5.1), nie wykazały medycznie istotnych różnic (patrz punkt 5.1).
- CHPL leku Abilify, tabletki, 30 mgDziałania niepożądane
Ogólnie przejściowe i bezobjawowe zwiększenie aktywności CPK (fosfokinazy kreatynowej) obserwowano u 3,5% pacjentów leczonych arypiprazolem w porównaniu do 2,0% pacjentów otrzymujących placebo. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej W krótkoterminowym badaniu z kontrolą placebo, w którym udział wzięło 302 nastolatków (od 13 do 17 lat) chorych na schizofrenię, częstość występowania i rodzaj reakcji niepożądanych były podobne do występujących u dorosłych, z wyjątkiem następujących działań niepożądanych zgłaszanych częściej u nastolatków otrzymujących arypiprazol niż u dorosłych otrzymujących arypiprazol (i częściej niż placebo): Senność/sedacja i zaburzenia pozapiramidowe były zgłaszane bardzo często (≥1/10), oraz suchość w jamie ustnej, zwiększony apetyt, niedociśnienie ortostatyczne były zgłaszane często (≥1/100, <1/10).
- CHPL leku Abilify, tabletki, 30 mgDziałania niepożądane
Profil bezpieczeństwa w 26-tygodniowym badaniu prowadzonym na zasadzie próby otwartej, był podobny do obserwowanego w badaniu krótkoterminowym z kontrolą placebo. Profil bezpieczeństwa w długoterminowym badaniu prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo był podobny z wyjątkiem następujących reakcji, które były zgłaszane częściej, niż w grupie dzieci i młodzieży przyjmujących placebo: często zgłaszano zmniejszenie masy ciała, zwiększenie stężenia insuliny we krwi, arytmię i leukopenię (≥1/100, <1/10). W zebranej populacji nastolatków (od 13 do 17 lat) chorych na schizofrenię, leczonych do 2 lat, przypadki małego stężenia prolaktyny w surowicy stwierdzono u 29,5% dziewcząt (<3 ng/ml) i 48,3% chłopców (<2 ng/ml). W grupie młodzieży (w wieku od 13 do 17 lat) ze schizofrenią, otrzymującej dawki arypiprazolu od 5 mg do 30 mg przez okres maksymalnie do 72 miesięcy, częstość występowania niskich stężeń prolaktyny w surowicy u kobiet (<3 ng/ml) i u mężczyzn (<2 ng/ml) wynosiła odpowiednio 25,6% i 45,0%.
- CHPL leku Abilify, tabletki, 30 mgDziałania niepożądane
Podczas dwóch długoterminowych badań z udziałem młodzieży (od 13 do 17 lat) ze schizofrenią i pacjentów z chorobą afektywną dwubiegunową leczonych arypiprazolem, częstość występowania małych stężeń prolaktyny w surowicy u kobiet (<3 ng/ml) i mężczyzn (<2 ng/ml) wynosiła odpowiednio 37,0% i 59,4%. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej Częstość występowania i rodzaj reakcji niepożądanych u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I były podobne do występujących u dorosłych, z wyjątkiem następujących działań niepożądanych: senność (23,0%), zaburzenia pozapiramidowe (18.4%), akatyzja (16.0%) i zmęczenie (11.8%) były zgłaszane bardzo często (≥1/10); natomiast ból w górnej części brzucha, zwiększenie częstości akcji serca, zwiększenie masy ciała, zwiększenie apetytu, drżenie mięśni oraz dyskineza były zgłaszane często (≥1/100, <1/10).
- CHPL leku Abilify, tabletki, 30 mgDziałania niepożądane
Następujące reakcje niepożądane miały prawdopodobnie związek z zastosowaną dawką: zaburzenia pozapiramidowe (częstość występowania w przypadku dawki 10 mg wynosiła 9,1%; w przypadku dawki 30 mg 28,8%; w przypadku placebo 1,7%); i akatyzja (częstość występowania w przypadku dawki 10 mg wynosiła 12,1%; w przypadku dawki 30 mg 20,3%; w przypadku placebo 1,7%). Średnie zmiany masy ciała u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I po 12. oraz 30. tygodniu wynosiły odpowiednio w przypadku arypiprazolu 2,4 kg oraz 5,8 kg, a w przypadku placebo 0,2 kg oraz 2,3 kg. W populacji dzieci i młodzieży senność oraz zmęczenie obserwowano częściej u pacjentów z zaburzeniem afektywnym dwubiegunowym, w porównaniu do pacjentów ze schizofrenią. W populacji dzieci i młodzieży z zaburzeniem afektywnym dwubiegunowym (od 10 do 17 lat), leczonych do 30 tygodni, przypadki małego stężenia prolaktyny w surowicy stwierdzono u 28,0% dziewcząt (<3 ng/ml) i 53,3% chłopców (<2 ng/ml).
- CHPL leku Abilify, tabletki, 30 mgDziałania niepożądane
Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Patologiczne uzależnienie od hazardu, hiperseksualność, kompulsywna potrzeba wydawania pieniędzy i obżarstwo lub kompulsywne objadanie się mogą wystąpić u pacjentów leczonych arypiprazolem (patrz punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania wymienionego w załączniku V .
- CHPL leku Abilify, tabletki, 30 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedmiotowe i podmiotowe W badaniach klinicznych i po wprowadzeniu produktu do obrotu przypadkowe bądź zamierzone przedawkowanie samego arypiprazolu stwierdzono u dorosłych pacjentów po oszacowanej dawce do 1260 mg niezakończone zgonem. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: letarg, wzrost ciśnienia tętniczego krwi, senność, przyspieszona czynność serca (tachykardia), nudności, wymioty i biegunka. Ponadto zgłaszano przypadkowe przedawkowanie samego arypiprazolu (do 195 mg) u dzieci, bez zgonów. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: senność, przejściowa utrata świadomości i objawy pozapiramidowe. Postępowanie po przedawkowaniu W przypadku przedawkowania leku stosuje się leczenie podtrzymujące, polegające na utrzymaniu drożności dróg oddechowych, dotlenianiu i wentylacji oraz leczeniu objawowym. Należy wziąć pod uwagę możliwość wpływu wielu produktów leczniczych.
- CHPL leku Abilify, tabletki, 30 mgPrzedawkowanie
Z tego względu należy niezwłocznie rozpocząć monitorowanie czynności układu krążenia, obejmujące stałe monitorowanie zapisu elektrokardiograficznego, w celu wykrycia możliwych zaburzeń rytmu serca. W przypadku potwierdzonego lub podejrzewanego przedawkowania arypiprazolu należy objąć pacjenta ścisłą kontrolą i obserwować go do czasu poprawy jego stanu. Aktywowany węgiel (50 g), podany w godzinę po zażyciu arypiprazolu, obniża wartość C max leku o około 41%, a wartość AUC o około 51%, co wskazuje na jego skuteczność w leczeniu przedawkowania. Hemodializa Pomimo że brak informacji dotyczących wpływu hemodializ w leczeniu przedawkowania arypiprazolu, to jednak istnieje małe prawdopodobieństwo, by hemodializy były użyteczne w takich przypadkach, ze względu na znaczny stopień wiązania arypiprazolu z białkami osocza.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12 Mechanizm działania Uważa się, że skuteczność arypiprazolu w leczeniu schizofrenii i zaburzenia afektywnego dwubiegunowego typu I jest związana ze skojarzonym działaniem częściowo agonistycznym w stosunku do receptora dopaminowego D 2 i serotoninowego 5-HT 1A oraz antagonistycznym w stosunku do receptora serotoninowego 5-HT 2A . Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D 2 i D 3 , serotoninowych 5-HT 1A i 5-HT 2A oraz umiarkowane powinowactwo do receptorów dopaminowych D 4 , serotoninowych 5-HT 2C i 5-HT 7 , a także adrenergicznych alfa-1 i histaminowych H 1 .
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Arypiprazol w dawkach od 0,5 mg do 30 mg, podawany raz na dobę przez 2 tygodnie osobom zdrowym powoduje zależne od dawki zmniejszenie wiązania rakloprydu znakowanego 11 C, ligandu receptora D 2 /D 3 , w jądrze ogoniastym i skorupie, co można wykryć za pomocą pozytonowej tomografii emisyjnej. Skuteczność kliniczna i bezpieczeństwo stosowania Dorośli Schizofrenia Wyniki trzech krótkoterminowych badań (od 4 do 6 tygodni) z grupą kontrolną otrzymującą placebo, w których udział wzięło 1 228 dorosłych chorych na schizofrenię, u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
Arypiprazol jest skuteczny w podtrzymywaniu poprawy klinicznej podczas kontynuacji leczenia u tych dorosłych pacjentów, u których obserwowano wstępną dobrą reakcję na lek. W badaniu z grupą kontrolną przyjmującą haloperydol, odsetek pacjentów, u których udało się utrzymać dobrą reakcję na produkt leczniczy, w ciągu 52 tygodni był podobny w obu grupach (arypiprazol 77% i haloperydol 73%). Badanie ukończyła istotnie większa grupa pacjentów leczonych arypiprazolem (43%) niż haloperydolem (30%). Wyniki uzyskane w skalach ocen stosowanych jako drugorzędowe punkty końcowe skuteczności, w tym w skali PANSS i w skali oceny depresji Montgomery-Asberg [ang. Montgomery–Åsberg-Depression-Rating-Scale, MADRS], wskazują na istotną poprawę w stosunku do haloperydolu. W trwającym 26 tygodni badaniu prowadzonym z grupą kontrolną otrzymującą placebo, z udziałem pacjentów dorosłych z ustabilizowaną przewlekłą schizofrenią stwierdzono w wyniku leczenia arypiprazolem większe zmniejszenie częstości nawrotów, 34% w grupie leczonych arypiprazolem i 57% w grupie otrzymującej placebo.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
Przyrost masy ciała Wyniki badań klinicznych wskazują, że arypiprazol nie powoduje klinicznie istotnego przyrostu masy ciała. W trwającym 26 tygodni badaniu z grupą kontrolną leczonych olanzapiną i wykorzystaniem podwójnie ślepej próby, przeprowadzonym w wielu krajach, udział wzięło 314 dorosłych pacjentów ze schizofrenią. Pierwszorzędowym punktem końcowym była ocena przyrostu masy ciała. U istotnie mniejszej liczby pacjentów leczonych arypiprazolem w porównaniu z otrzymującymi olanzapinę, stwierdzono przyrost masy ciała o co najmniej 7% w porównaniu z pomiarem początkowym (tzn. przyrost masy ciała o co najmniej 5,6 kg przy średniej początkowej masie wynoszącej ok. 80,5 kg) w grupie leczonych arypiprazolem (n = 18 lub 13% pacjentów nadających się do oceny), w porównaniu z grupą otrzymującą olanzapinę (n = 45 lub 33% pacjentów nadających się do oceny).
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
Stężenia lipidów W zbiorczej analizie wyników stężeń lipidów pochodzących z badań klinicznych prowadzonych z grupą kontrolną otrzymującą placebo u dorosłych, arypiprazol nie powodował klinicznie istotnych zmian stężeń cholesterolu całkowitego, triglicerydów, cholesterolu frakcji lipoprotein o dużej gęstości (HDL) i cholesterolu frakcji lipoprotein o małej gęstości (LDL). Prolaktyna Stężenia prolaktyny oceniono podczas wszystkich badań z zastosowaniem wszystkich dawek arypiprazolu (n = 28 242). Częstość występowania hiperprolaktynemii lub zwiększenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem (0,3%) była podobna do częstości występowania hiperprolaktynemii w grupie otrzymującej placebo (0,2%). U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia hiperprolaktynemii wynosiła 42 dni, a mediana czasu trwania wynosiła 34 dni.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
Częstość występowania hiperprolaktynemii lub zmniejszenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem wynosiła 0,4% w porównaniu do 0,02% w grupie otrzymującej placebo. U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 30 dni, a mediana czasu trwania wynosiła 194 dni. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I W dwóch 3-tygodniowych badaniach, prowadzonych z grupą kontrolną otrzymującą placebo, z zastosowaniem zmiennej dawki, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol był znacząco bardziej skuteczny niż placebo w zmniejszaniu objawów maniakalnych w ciągu 3 tygodni. Badania te obejmowały pacjentów z objawami lub bez objawów psychotycznych oraz pacjentów z szybką zmianą fazy lub bez szybkiej zmiany fazy (przebieg typu rapid-cycling).
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
W jednym 3-tygodniowym badaniu, prowadzonym z grupą kontrolną otrzymującą placebo, z zastosowaniem stałej dawki w monoterapii, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol nie wykazał większej skuteczności niż placebo. W dwóch 12-tygodniowych badaniach, prowadzonych z grupą kontrolną otrzymującą placebo oraz inne substancje czynne, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, arypiprazol był skuteczniejszy niż placebo w 3. tygodniu badania, a wynik leczenia podtrzymującego był w 12. tygodniu badania porównywalny z wynikiem dla litu lub haloperydolu. W 12. tygodniu arypiprazol powodował także remisję objawów maniakalnych u porównywalnej liczby pacjentów co lit lub haloperydol.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
W 6-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, którzy częściowo nie reagowali na monoterapię litem lub walproinianem przez 2 tygodnie przy terapeutycznych stężeniach w surowicy, zastosowanie arypiprazolu jako dodatkowego leku w większym stopniu zwiększyło skuteczność zapobiegania objawom maniakalnym niż stosowanie litu lub walproinianu w monoterapii. W 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, które przedłużono o 74 tygodnie, u pacjentów z objawami maniakalnymi, którzy osiągnęli remisję w trakcie stosowania arypiprazolu w czasie fazy stabilizacji przed randomizacją, arypiprazol był bardziej skuteczny niż placebo w zapobieganiu nawrotowi chorobie dwubiegunowej, głównie w zapobieganiu nawrotowi objawów maniakalnych, ale nie wykazał przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
W 52-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, u pacjentów z obecnym epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, którzy osiągnęli trwałą remisję (w skali oceny manii Younga [ang. Young Mania Rating Scale, YMRS] oraz w skali oceny depresji MADRS z całkowitą ilością punktów ≤ 12) w trakcie stosowania arypiprazolu (w dawce od 10 mg na dobę do 30 mg na dobę) w skojarzeniu z litem lub walproinianem przez 12 kolejnych tygodni, połączenie z arypiprazolem wykazało przewagę nad placebo w zapobieganiu nawrotowi choroby afektywnej dwubiegunowej zmniejszając ryzyko o 46% (współczynnik ryzyka 0,54) i w zapobieganiu nawrotom manii zmniejszając ryzyko o 65% (współczynnik ryzyka 0,35), ale nie wykazało przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
Zastosowanie arypiprazolu jako dodatkowego leku wykazało przewagę wobec placebo w przypadku drugorzędowego pomiaru wyniku leczenia w ocenach ogólnego wrażenia klinicznego w wersji dla ChAD (ang. Clinical Global Impression - Bipolar version, CGI-BP) nasilenia choroby (mania) (ang. Severity of illness , SOI [mania]). W tym badaniu, pacjenci zostali przydzieleni przez badaczy do badania prowadzonego metodą próby otwartej, z zastosowaniem litu lub walproinianu w monoterapii, w celu oceny częściowego braku odpowiedzi. Pacjenci byli stabilizowani przez co najmniej 12 kolejnych tygodni za pomocą skojarzenia arypiprazolu i stosowanego wcześniej stabilizatora nastroju. Pacjenci stabilni byli następnie losowo przydzielani do grupy kontynuującej stosowanie tego samego stabilizatora nastroju z arypiprazolem lub placebo w badaniu metodą podwójnie ślepej próby.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
W fazie randomizowanej oceniano cztery podgrupy stabilizatora nastroju: arypiprazol + lit; arypiprazol + walproinian; placebo + lit; placebo + walproinian. Odsetki Kaplana- Meiera dla nawrotu jakiegokolwiek zaburzenia nastroju w przypadku zastosowania dodatkowego leku były następujące: 16% w grupie stosującej arypiprazol + lit i 18% w grupie stosującej arypiprazol + walproinian, w porównaniu do 45% w grupie stosującej placebo + lit i 19% w grupie stosującej placebo + walproinian. Populacja dzieci i młodzieży Schizofrenia u młodzieży Wyniki 6-tygodniowego badania z grupą kontrolną otrzymującą placebo, w którym udział wzięło 302 nastoletnich pacjentów chorych na schizofrenię (od 13 do 17 lat), u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje statystycznie istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
W czasie trwania 26-tygodniowego badania prowadzonego metodą otwartej próby w analizie podgrupy nastoletnich pacjentów w wieku od 15 do 17 lat obserwowano utrzymywanie się działania u 74% całkowitej populacji włączonej do badania. W badaniu z randomizacją, prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo, trwającym od 60 do 89 tygodni, które prowadzono z udziałem młodzieży ze schizofrenią (n = 146; w wieku od 13 do 17 lat) występowała statystycznie znamienna różnica w zakresie odsetka nawrotów objawów psychotycznych pomiędzy grupą otrzymującą arypiprazol (19,39%) a grupą otrzymującą placebo (37,5%). Punkt szacunkowy współczynnika ryzyka (HR) w całej populacji wynosił 0,461 (95% przedział ufności, od 0,242 do 0,879). W analizach w podgrupach punkt szacunkowy współczynnika ryzyka wynosił 0,495 wśród uczestników w wieku od 13 do 14 lat w porównaniu do 0,454 wśród uczestników w wieku od 15 do 17 lat.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
Jednak ocena szacunkowa współczynnika ryzyka w grupie młodszych uczestników (od 13 do 14 lat) nie była precyzyjna, odzwierciedlając mniejszą liczebność uczestników w tej grupie (arypiprazol, n = 29; placebo, n = 12) i przedział ufności dla tej oceny szacunkowej (wynoszący od 0,151 do 1,628) uniemożliwiał wyciągnięcie wniosków odnośnie występowania wyniku leczenia. Natomiast 95% przedział ufności dla współczynnika ryzyka w podgrupie starszych uczestników (arypiprazol, n = 69; placebo, n = 36) wynosił od 0,242 do 0,879 i dlatego można wyciągnąć wnioski odnośnie wyników leczenia u starszych pacjentów. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u dzieci i młodzieży Arypiprazol badano w 30-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, w którym udział wzięło 296 dzieci i młodzieży (od 10 do 17 lat), którzy spełnili kryteria diagnostyczne według DSM-IV (ang.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
Diagnostic and Statistical Manual of Mental Disorders ) dla zaburzenia afektywnego dwubiegunowego typu I z epizodami maniakalnymi lub mieszanymi z objawami psychotycznymi lub bez tych objawów oraz wyjściowo mieli wynik ≥20 w skali manii według Younga (Y-MRS). Wśród pacjentów włączonych do podstawowej analizy skuteczności, 139 pacjentów miało postawioną diagnozę aktualnie współistniejącego ADHD. Arypiprazol wykazał przewagę w stosunku do placebo w odniesieniu do zmiany wartości wyjściowej w 4. oraz 12. tygodniu jako wynik całościowy wg Y-MRS. W analizie post-hoc przewaga nad placebo była bardziej wyraźna u pacjentów ze współistniejącym zespołem ADHD w porównaniu do pacjentów bez ADHD, gdzie nie zaobserwowano różnicy w stosunku do placebo. Zapobieganie nawrotom nie zostało określone. Do najczęstszych zdarzeń niepożądanych występujących w trakcie leczenia, wśród pacjentów otrzymujących dawkę 30 mg, były zaburzenia pozapiramidowe (28,3%), senność (27,3%), ból głowy (23,2%) oraz nudności (14,1%).
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
Średni przyrost masy ciała w 30-tygodniowm okresie leczenia wynosił 2,9 kg, w porównaniu do 0,98 kg u pacjentów, u których stosowano placebo. Drażliwość związana z zaburzeniami autystycznymi u dzieci i młodzieży (patrz punkt 4.2) U pacjentów w wieku od 6 do 17 lat arypiprazol badano w dwóch 8-tygodniowych badaniach prowadzonych z grupą kontrolną otrzymującą placebo [w jednym badaniu stosowano zmienną dawkę (od 2 mg na dobę do 15 mg na dobę), a w drugim stałą dawkę (5 mg na dobę, 10 mg na dobę lub 15 mg na dobę)] oraz jednym 52-tygodniowym badaniu otwartym. Dawkowanie w tych badaniach rozpoczynano od dawki 2 mg na dobę, po tygodniu zwiększanej do 5 mg na dobę, a następnie zwiększanej w odstępach tygodniowych o 5 mg na dobę do czasu osiągnięcia dawki docelowej. Ponad 75% pacjentów miało mniej niż 13 lat. Arypiprazol wykazał statystycznie większą skuteczność w porównaniu do placebo w podskali dotyczącej drażliwości Listy Zachowań Aberracyjnych (ang.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
Aberrant Behaviour Checklist Irritability subscale ). Jednakże, nie ustalono znaczenia klinicznego tej obserwacji. Profil bezpieczeństwa obejmował przyrost masy ciała i zmianę stężenia prolaktyny. Czas trwania długoterminowego badania dotyczącego bezpieczeństwa był ograniczony do 52-tygodni. W zebranych badaniach, częstość występowania małego stężenia prolaktyny u dziewcząt (<3 ng/ml) i u chłopców (<2 ng/ml) leczonych arypiprazolem wynosiła odpowiednio, 27/46 (58,7%) i 258/298 (86,6%). W badaniach prowadzonych z grupą kontrolną otrzymującą placebo średni przyrost masy ciała wynosił 0,4 kg w grupie placebo i 1,6 kg w grupie arypiprazolu. Arypiprazol badano także w długoterminowym badaniu leczenia podtrzymującego, prowadzonym z grupą kontrolną otrzymującą placebo. Po od 13- do 26-tygodniowej stabilizacji z zastosowaniem arypiprazolu (w dawkach od 2 mg na dobę do 15 mg na dobę), pacjenci z trwałą odpowiedzią albo kontynuowali leczenie arypiprazolem, albo otrzymywali placebo przez kolejne 16 tygodni.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
Odsetki Kaplana-Meiera dla nawrotu w tygodniu 16. były następujące: 35% dla grupy stosującej arypiprazol oraz 52% dla grupy placebo; współczynnik ryzyka nawrotu w 16 tygodniu (arypiprazol/placebo) wynosił 0,57 (różnica nieistotna statystycznie). Średni przyrost masy ciała w fazie stabilizacji (do 26 tygodni) w grupie otrzymującej arypiprazol wynosił 3,2 kg, natomiast w drugiej fazie badania (16 tygodni) obserwowano dalszy średni wzrost o 2,2 kg w grupie otrzymującej arypiprazol w porównaniu do 0,6 kg w grupie placebo. Objawy pozapiramidowe były zgłaszane głównie w fazie stabilizacji, u 17% pacjentów, z drgawkami stanowiącymi 6,5%. Tiki związane z zespołem Tourette’a u dzieci i młodzieży (patrz punkt 4.2) Skuteczność arypiprazolu badano u dzieci i młodzieży z zespołem Tourette’a (arypiprazol: n = 99, placebo: n = 44) w trwającym 8 tygodni, randomizowanym badaniu prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo w schemacie leczenia w grupach z użyciem stałej dawki zależnej od masy ciała od 5 mg na dobę do 20 mg na dobę i dawki początkowej wynoszącej 2 mg.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
Pacjenci byli w wieku od 7 do 17 lat i przed rozpoczęciem leczenia uzyskali średni wynik 30 na łącznej skali tików w Globalnej Skali Nasilenia Tików z Yale ( Total Tic Score on the Yale Global Tic Severity Scale , TTS-YGTSS). Grupa pacjentów otrzymująca arypiprazol wykazywała poprawę mierzoną zmianą wyniku na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 8 tygodniu leczenia, która wynosiła 13,35 w grupie otrzymującej małą dawkę (5 mg lub 10 mg) i 16,94 w grupie otrzymującej dużą dawkę (10 mg lub 20 mg) w porównaniu do poprawy odnotowanej u pacjentów otrzymujących placebo i zmiany wynoszącej 7,09. Skuteczność arypiprazolu u dzieci i młodzieży z zespołem Touretta (arypiprazol: n = 32, placebo: n = 29) oceniano również w przypadku podawania zmiennych dawek od 2 mg na dobę do 20 mg na dobę z dawką początkową wynoszącą 2 mg w trwającym 10 tygodni, randomizowanym badaniu prowadzonym w Korei Południowej prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakodynamiczne
Pacjenci w wieku od 6 do 18 lat uzyskali średni wynik 29 na skali TTS-YGTSS w pomiarze początkowym. Pacjenci otrzymujący arypiprazol wykazywali poprawę mierzoną zmianą wyniku o 14,97 na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 10 tygodniu w porównaniu do poprawy wynoszącej 9,62 w grupie placebo. W obu wspomnianych badaniach krótkoterminowych nie określono klinicznego znaczenia wyników dotyczących skuteczności, biorąc pod uwagę wielkość działania terapeutycznego w porównaniu do dużego wpływu efektu placebo i niejasne skutki w zakresie funkcjonowania psychospołecznego. Brak danych długoterminowych dotyczących skuteczności i bezpieczeństwa stosowania arypiprazolu w tej niestabilnej chorobie. Europejska Agencja Leków wstrzymała obowiązek dołączania wyników badań produktu leczniczego ABILIFY w jednej lub kilku podgrupach populacji dzieci i młodzieży w leczeniu schizofrenii oraz w leczeniu choroby afektywnej dwubiegunowej (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Arypiprazol jest dobrze wchłaniany, maksymalne stężenie w osoczu osiąga w ciągu od 3 do 5 godzin po podaniu. Arypiprazol w minimalnym stopniu ulega metabolizmowi przedukładowemu. Bezwzględna dostępność po doustnym podaniu jednej tabletki wynosi 87%. Spożywanie posiłków o dużej zawartości tłuszczu nie wpływa na farmakokinetykę arypiprazolu. Dystrybucja Arypiprazol jest rozmieszczany w całym organizmie, pozorna objętość dystrybucji wynosi 4,9 l/kg, co wskazuje na znaczną dystrybucję pozanaczyniową. W stężeniach terapeutycznych arypiprazol i dehydroarypiprazol wiążą się w ponad 99% z białkami surowicy, głównie z albuminami. Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie. Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakokinetyczne
Jak wynika z badań in vitro , enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N- dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. W stanie stacjonarnym aktywny metabolit, dehydroarypiprazol, stanowi około 40% AUC arypiprazolu w osoczu. Eliminacja Średni okres półtrwania arypiprazolu w fazie eliminacji wynosi około 75 godzin u osób o podwyższonej aktywności CYP2D6 i około 146 godzin u osób o obniżonej aktywności CYP2D6. Całkowity klirens arypiprazolu wynosi 0,7 ml/min/kg i jest to głównie klirens wątrobowy. Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [ 14 C], stwierdza się odpowiednio 27% i 60% podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1% niezmienionego arypiprazolu zostaje wydalone z moczem i około 18% z kałem.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakokinetyczne
Dzieci i młodzież Farmakokinetyka arypiprazolu i dehydroarypiprazolu u dzieci w wieku od 10 do 17 lat była podobna do farmakokinetyki u dorosłych, po uwzględnieniu różnic w masie ciała. Farmakokinetyka w szczególnych grupach pacjentów Pacjenci w podeszłym wieku Nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi, nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Nie stwierdzono, aby farmakokinetyka arypiprazolu różniła się u zdrowych kobiet i zdrowych mężczyzn. Nie stwierdzono także żadnego mierzalnego wpływu płci na farmakokinetykę leku u pacjentów ze schizofrenią. Palenie tytoniu Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie wpływów na farmakokinetykę arypiprazolu, zależnych od palenia tytoniu.
- CHPL leku Abilify, tabletki, 30 mgWłaściwości farmakokinetyczne
Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy. Zaburzenia czynności nerek Stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u osób z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badania obejmujące podanie pojedynczej dawki leku, przeprowadzone u osób z różnego stopnia marskością wątroby (klasy Childa-Pugha A, B i C) nie wykazały, by zaburzenia czynności wątroby wpływały istotnie na farmakokinetykę arypiprazolu i dehydroarypiprazolu, jednak w badaniu wzięło udział tylko 3 chorych z marskością wątroby klasy C, co jest liczbą niewystarczającą do wyciągnięcia wniosków dotyczących zdolności metabolicznych tych pacjentów.
- CHPL leku Abilify, tabletki, 30 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Istotne działanie toksyczne stwierdzano jedynie po podaniu dawek lub przy stopniu narażenia wyraźnie przekraczającym maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza (gromadzenie barwnika lipofuscyny i (lub) obumieranie komórek miąższowych) stwierdzany u szczurów po 104 tygodniach podawania arypiprazolu w dawce od 20 mg/kg mc. na dobę do 60 mg/kg mc.
- CHPL leku Abilify, tabletki, 30 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała od 3 do 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki) i zwiększenie częstości występowania raków nadnerczy, a także skojarzonej częstości występowania gruczolaków lub raków nadnerczy u samic szczurów otrzymujących lek w dawce 60 mg/kg mc. na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki). Największa ekspozycja nie powodująca powstawania nowotworów u samic szczurów odpowiadała 7- krotnie większej ekspozycji niż ekspozycja występująca u ludzi po zastosowaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych sprzężonych związków hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 mg/kg mc. na dobę do 125 mg/kg mc.
- CHPL leku Abilify, tabletki, 30 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym była od 1 do 3 razy wyższa niż wartość występująca u ludzi po podaniu maksymalnej zalecanej dawki klinicznej lub od 16 do 81 razy wyższa niż po podaniu maksymalnej dawki zalecanej na podstawie przeliczenia mg/m 2 pc.). Jednak stężenie sprzężonych związków siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania najwyższej proponowanej dawki 30 mg na dobę, nie przekraczało 6% stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie mniejsze (6%) niż granica rozpuszczalności określona in vitro . W badaniach toksykologicznych po podaniu wielokrotnym u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt oraz brak jest dowodów neurotoksyczności i niepożądanego wpływu na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych.
- CHPL leku Abilify, tabletki, 30 mgPrzedkliniczne dane o bezpieczeństwie
Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowano toksyczny wpływ na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po zastosowaniu dawek maksymalnych zalecanych u ludzi). Toksyczny wpływ na ciężarne samice obserwowano podczas podawania dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Abilify, tabletki, 30 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki Laktoza jednowodna Skrobia kukurydziana Celuloza mikrokrystaliczna Hydroksypropyloceluloza Magnezu stearynian Otoczka tabletki ABILIFY 5 mg tabletki Lak aluminiowy z indygotyną (E 132) ABILIFY 10 mg tabletki Żelaza tlenek czerwony (E 172) ABILIFY 15 mg tabletki Żelaza tlenek żółty (E 172) ABILIFY 30 mg tabletki Żelaza tlenek czerwony (E 172) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Aluminiowe blistry perforowane, podzielne na dawki pojedyncze, w pudełkach tekturowych zawierających 14 × 1, 28 × 1, 49 × 1, 56 × 1, 98 × 1 tabletek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
- CHPL leku Abilify, tabletki, 30 mgDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ABILIFY 7,5 mg/ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml zawiera 7,5 mg arypiprazolu. Każda fiolka zawiera 9,75 mg arypiprazolu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań Przezroczysty, bezbarwny, roztwór wodny.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania ABILIFY roztwór do wstrzykiwań jest wskazany do szybkiego opanowania niepokoju i zaburzeń zachowania u dorosłych pacjentów ze schizofrenią lub u pacjentów z epizodami maniakalnymi w przebiegu zaburzenia afektywnego dwubiegunowego typu I, kiedy leczenie doustne nie jest właściwe. Leczenie produktm leczniczym ABILIFY roztwór do wstrzykiwań należy odstawić tak szybko, jak jest to klinicznie uzasadnione i należy rozpocząć stosowanie doustnego arypiprazolu.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zalecana początkowa dawka produktu leczniczego ABILIFY roztwór do wstrzykiwań wynosi 9,75 mg (1,3 ml), podana jako pojedyncze wstrzyknięcie domięśniowe. Skuteczna dawka produktu leczniczego ABILIFY roztwór do wstrzykiwań mieści się w zakresie 5,25 mg do 15 mg podana jako pojedyncze wstrzyknięcie. Mniejsza dawka 5,25 mg (0,7 ml) może być podana na podstawie oceny indywidualnego stanu klinicznego, która powinna obejmować także wzięcie pod uwagę produktów leczniczych już podanych albo w leczeniu podtrzymującym, albo ostrym (patrz punkt 4.5). Drugie wstrzyknięcie może być podane 2 godziny po pierwszym na podstawie oceny indywidualnego stanu klinicznego, a podawać należy nie więcej niż trzy wstrzyknięcia w ciągu każdych 24 godzin. Maksymalna dawka dobowa arypiprazolu wynosi 30 mg (włączając w to wszystkie postacie produktu leczniczego ABILIFY).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDawkowanie
Jeśli wskazana jest kontynuacja leczenia doustnego postacią arypiprazolu, patrz Charakterystyka Produktu Leczniczego dla produktu leczniczego ABILIFY tabletki, ABILIFY tabletki ulegające rozpadowi w jamie ustnej lub ABILIFY roztwór doustny. Szczególne grupy pacjentów Dzieci i młodzież Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego ABILIFY u dzieci i młodzieży w wieku od 0 do 17 lat. Nie ma dostępnych danych. Zaburzenia czynności wątroby Nie ma konieczności modyfikacji dawki u osób z zaburzeniami czynności wątroby o nasileniu lekkim lub umiarkowanym. Nie ma wystarczających danych do ustalenia dawkowania u pacjentów z ciężką niewydolnością wątroby. W tej grupie pacjentów należy ostrożnie ustalać dawkowanie. Niemniej jednak, w grupie pacjentów z ciężkimi zaburzeniami czynności wątroby największą dawkę dobową 30 mg należy stosować ze szczególną ostrożnością (patrz punkt 5.2).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDawkowanie
Zaburzenia czynności nerek Nie ma konieczności modyfikacji dawki u pacjentów z zaburzeniami czynności nerek. Pacjenci w podeszłym wieku Bezpieczeństwo i skuteczność stosowania produktu ABILIFY w leczeniu schizofrenii i w epizodach manii w przebiegu zaburzenia afektywnywnego dwubiegunowego typu I nie zostały zbadane u pacjentów w wieku 65 lat i starszych. Jednak z powodu większej wrażliwości tych pacjentów, należy rozważyć zastosowanie mniejszej dawki początkowej, jeśli pozwalają na to okoliczności kliniczne (patrz punkt 4.4). Płeć Nie ma konieczności modyfikacji dawek leku w zależności od płci (patrz punkt 5.2). Palacze tytoniu Biorąc pod uwagę metabolizm arypiprazolu nie ma konieczności modyfikacji dawek u palaczy (patrz punkt 4.5). Dostosowanie dawki z powodu interakcji Dawkę arypiprazolu należy zmniejszyć w przypadku równoczesnego podawania leku o silnym działaniu hamującym w stosunku do cytochromu CYP3A4 lub CYP2D6.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDawkowanie
Po zakończeniu jednoczesnego stosowania inhibitora CYP3A4 lub CYP2D6 należy ponownie zwiększyć dawkę arypiprazolu (patrz punkt 4.5). Dawkę arypiprazolu należy zwiększyć w przypadku równoczesnego podawania leków silnie indukujących CYP3A4. Po odstawieniu leku indukującego CYP3A4, dawkę arypiprazolu należy ponownie zmniejszyć do zalecanej (patrz punkt 4.5). Sposób podawania ABILIFY roztwór do wstrzykiwań jest przeznaczony do podania domięśniowego. W celu zwiększenia wchłaniania i zminimalizowania jego zmienności zalecane jest wykonywanie wstrzyknięć w mięsień naramienny lub głęboko w mięsień pośladkowy wielki z ominięciem obszarów otłuszczonych. Produktu leczniczego ABILIFY roztwór do wstrzykiwań nie należy podawać dożylnie lub podskórnie. Produkt leczniczy jest gotowy do użycia i przeznaczony tylko do krótkotrwałego stosowania (patrz punkt 5.1).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Skuteczność produktu leczniczego ABILIFY roztwór do wstrzykiwań u pacjentów z niepokojem i zaburzeniami zachowania nie została ustalona w odniesieniu do stanów innych niż schizofrenia i epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I. Jednoczesne podawanie leków przeciwpsychotycznych w postaci wstrzyknięć i benzodiazepin drogą pozajelitową może być związane z nadmierną sedacją i depresją krążenia i oddechową. Jeśli leczenie benzodiazepiną w postaci pozajelitowej jest uznane za konieczne dodatkowo do leczenia arypiprazolem w postaci roztworu do wstrzykiwań, pacjenci powinni być monitorowani czy nie występuje u nich nadmierna sedacja i ortostatyczny spadek ciśnienia krwi (patrz punkt 4.5). Pacjenci otrzymujący ABILIFY roztwór do wstrzykiwań powinni być obserwowani, czy nie występuje u nich ortostatyczny spadek ciśnienia krwi.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlSpecjalne środki ostrozności
Należy regularnie monitorować ciśnienie krwi, tętno, częstość oddechu i poziom świadomości. Bezpieczeństwo i skuteczność produktu leczniczego ABILIFY roztwór do wstrzykiwań nie były oceniane u pacjentów z zatruciem alkoholem lub produktami leczniczymi (ani przepisywanymi, ani niedozwolonymi produktami leczniczymi). Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić w ciągu od kilku dni do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Prawdopodobieństwo podjęcia próby samobójczej Występowanie zachowań samobójczych jest związane z chorobami psychicznymi oraz zaburzeniami nastroju i w niektórych przypadkach było zgłaszane wkrótce po rozpoczęciu lub zmianie leczenia przeciwpsychotycznego, w tym leczenia arypiprazolem (patrz punkt 4.8). Leczenie przeciwpsychotyczne pacjentów wysokiego ryzyka powinno odbywać się pod ścisłym nadzorem.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlSpecjalne środki ostrozności
Zaburzenia sercowo-naczyniowe Arypiprazol należy stosować ostrożnie u pacjentów z chorobą sercowo-naczyniową (zawał mięśnia sercowego lub choroba niedokrwienna, niewydolność serca lub zaburzenia przewodzenia w wywiadzie), chorobą naczyń mózgu, w stanach predysponujących do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie przeciwnadciśnieniowymi produktami leczniczymi) lub z nadciśnieniem tętniczym, w tym postępującym lub złośliwym. Po zastosowaniu leków przeciwpsychotycznych obserwowano przypadki żylnej choroby zakrzepowo-zatorowej (VTE - ang. venous thromboembolism ). Ponieważ u pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE przed rozpoczęciem oraz w czasie leczenia arypiprazolem i wdrożyć odpowiednie środki zapobiegawcze (patrz punkt 4.8).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlSpecjalne środki ostrozności
Wydłużenie odstępu QT W badaniach klinicznych leczenia doustną postacią arypiprazolu częstość występowania wydłużenia odstępu QT była porównywalna z placebo. Arypiprazol należy stosować ostrożnie u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy W badaniach klinicznych trwających nie dłużej niż rok, w trakcie leczenia arypiprazolem zgłaszano niezbyt częste przypadki dyskinez związane z leczeniem. Jeśli objawy przedmiotowe lub podmiotowe późnych dyskinez wystąpią u pacjentów leczonych arypiprazolem, należy rozważyć zmniejszenie dawki lub odstawienie leku (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Inne objawy pozapiramidowe W pediatrycznych badaniach klinicznych z zastosowaniem arypiprazolu obserwowano akatyzję oraz parkinsonizm.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlSpecjalne środki ostrozności
Jeśli u pacjenta przyjmującego arypiprazol wystąpią objawy przedmiotowe i podmiotowe innych zaburzeń pozapiramidowych, należy rozważyć zmniejszenie dawki oraz wprowadzenie ścisłej kontroli klinicznej. Złośliwy Zespół Neuroleptyczny (NMS ) NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z podawaniem leków przeciwpsychotycznych. W badaniach klinicznych, odnotowano rzadkie przypadki NMS w czasie leczenia arypiprazolem. Klinicznymi objawami NMS są bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz objawy niestabilności autonomicznego układu nerwowego (nieregularne tętno lub wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Jednakże, obserwowano także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę, niekoniecznie związane z NMS.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlSpecjalne środki ostrozności
Jeśli wystąpiły wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS, bądź niewyjaśnionego pochodzenia wysoka gorączka, bez innych objawów NMS, należy przerwać leczenie wszystkimi lekami przeciwpsychotycznymi, w tym także arypiprazolem. Drgawki W badaniach klinicznych odnotowano niezbyt częste przypadki napadów drgawek w czasie leczenia arypiprazolem. Z tego powodu arypiprazol należy stosować z zachowaniem ostrożności u pacjentów, u których w przeszłości występowały napady drgawek lub u których występują choroby wiążące się ze skłonnością do takich napadów (patrz punkt 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencją Zwiększona śmiertelność W trzech badaniach kontrolowanych placebo (n = 938, średnia wieku: 82,4; zakres: od 56 do 99 lat), u pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera, leczonych arypiprazolem, występowało zwiększone ryzyko zgonu w porównaniu z grupą otrzymującą placebo.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlSpecjalne środki ostrozności
Częstość zgonów u pacjentów leczonych arypiprazolem wynosiła 3,5% w porównaniu do 1,7% w grupie placebo. Chociaż przyczyny zgonów były zróżnicowane to większość zgonów wydawała się być związana albo z chorobami układu krążenia (np. niewydolność serca, nagłe zgony) albo z chorobami zakaźnymi (np. zapalenie płuc) (patrz punkt 4.8). Działania niepożądane dotyczące krążenia mózgowego U pacjentów w tych samych badaniach odnotowano działania niepożądane dotyczące krążenia mózgowego (np. udar, przejściowe napady niedokrwienia) w tym o przebiegu zakończonym zgonem (średnia wieku: 84 lata; zakres od 78 do 88 lat). Ogólnie w tych badaniach 1,3% wszystkich pacjentów leczonych arypiprazolem zgłaszało działania niepożądane dotyczące krążenia mózgowego w porównaniu do 0,6% pacjentów otrzymujących placebo. Różnica ta nie była istotna statystycznie.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlSpecjalne środki ostrozności
Jednakże w jednym z tych badań z zastosowaniem ustalonego dawkowania u pacjentów leczonych arypiprazolem występowała istotna zależność odpowiedzi od dawki dla działań niepożądanych dotyczących krążenia mózgowego (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów z psychozą związaną z demencją. Hiperglikemia i cukrzyca U pacjentów leczonych nietypowymi lekami przeciwpsychotycznymi, w tym arypiprazolem, opisywano hiperglikemię, w niektórych przypadkach bardzo wysoką z kwasicą ketonową i śpiączką hiperosmotyczną lub zgonem. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. W badaniach klinicznych z arypiprazolem nie było istotnych różnic w częstości występowania działań niepożądanych związanych z hiperglikemią (w tym cukrzycy) lub nieprawidłowych wartości laboratoryjnych stężenia glukozy w porównaniu do placebo.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlSpecjalne środki ostrozności
Nie jest dostępna dokładna ocena ryzyka wystąpienia działań niepożądanych związanych z hiperglikemią, która pozwalałaby na dokonanie bezpośredniego porównania leczenia arypiprazolem i innymi atypowymi lekami przeciwpsychotycznymi. Pacjenci leczeni jakimikolwiek lekami przeciwpsychotycznymi, włącznie z arypiprazolem, powinni być obserwowani, czy nie występują u nich objawy podmiotowe i przedmiotowe związane z hiperglikemią (takie jak nadmierne pragnienie, wielomocz, nadmierny apetyt i osłabienie), a pacjenci z cukrzycą lub czynnikami ryzyka wystąpienia cukrzycy powinni być regularnie monitorowani pod względem pogorszenia kontroli glikemii (patrz punkt 4.8). Nadwrażliwość Podczas przyjmowania arypiprazolu mogą wystąpić reakcje nadwrażliwości charakteryzujące się objawami reakcji uczuleniowych (patrz punkt 4.8).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlSpecjalne środki ostrozności
Zwiększenie masy ciała Obserwowane u pacjentów ze schizofrenią i zaburzeniem afektywnym dwubiegunowym zwiększenie masy ciała jest zwykle spowodowane współistniejącymi chorobami, stosowaniem leków przeciwpsychotycznych, o których wiadomo, że powodują zwiększenie masy ciała, niewłaściwym stylem życia i może prowadzić do ciężkich powikłań. Po wprowadzeniu leku do obrotu obserwowano zwiększenie masy ciała u pacjentów otrzymujących arypiprazol w postaci doustnej. Jeśli występowało, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych arypiprazol nie powodował klinicznie istotnego zwiększenia masy ciała u dorosłych (patrz punkt 5.1). W badaniach klinicznych z udziałem młodzieży z zaburzeniem afektywnym dwubiegunowym wykazano, że stosowanie arypiprazolu ma związek ze zwiększeniem masy ciała po 4 tygodniach leczenia.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlSpecjalne środki ostrozności
U młodzieży z zaburzeniem afektywnym dwubiegunowym należy kontrolować przyrost masy ciała. Jeśli przyrost masy ciała jest znaczący klinicznie, należy rozważyć zmniejszenie dawki (patrz punkt 4.8). Dysfagia Ze stosowaniem leków przeciwpsychotycznych, w tym arypiprazolu, wiąże się spowolnienie motoryki przełyku i ryzyko aspiracji. Arypiprazol należy stosować ostrożnie u pacjentów z ryzykiem wystąpienia zachłystowego zapalenia płuc. Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Podczas przyjmowania arypiprazolu u pacjentów mogą występować zwiększone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy obejmują: zwiększenie popędów seksualnych, kompulsywną potrzebę wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlSpecjalne środki ostrozności
Ważne jest, aby lekarze przepisujący lek pytali pacjentów lub opiekunów w szczególności o pojawienie się nowego lub zwiększonego popędu do hazardu, popędów seksualnych, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa lub kompulsywnego objadania się, lub innych popędów podczas leczenia arypiprazolem. Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu leku. Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Lekarz rozważy zmianę dawki lub odstawienie leku, jeśli u pacjenta wystąpią takie popędy podczas przyjmowania arypiprazolu (patrz punkt 4.8). Sód ABILIFY roztwór do wstrzykiwań zawiera sód. Lek zawiera mniej niż 1 mmol (23 mg) sodu na jednostkę dawkowania, co oznacza, że uznaje się go za „wolny od sodu”. Pacjenci ze współistniejącym zespołem nadpobudliwości psychoruchowej (ang.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlSpecjalne środki ostrozności
attention deficit hyperactivity disorder , ADHD) Pomimo wysokiej częstości współistnienia zaburzenia afektywnego dwubiegunowego typu I oraz zespołu ADHD, dane dotyczące bezpieczeństwa jednoczesnego stosowania arypiprazolu oraz stymulantów są bardzo ograniczone; dlatego też należy zachować wyjątkową ostrożność w razie podawania tych produktów jednocześnie. Upadki Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków. Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji produktu leczniczego ABILIFY roztwór do wstrzykiwań. Informacje podane poniżej uzyskano z badań arypiprazolu w postaci doustnej. Ze względu na antagonistyczne działanie na receptor adrenergiczny α 1 , arypiprazol może nasilać działanie niektórych przeciwnadciśnieniowych produktów leczniczych. Ze względu na pierwotne działanie arypiprazolu na OUN, należy zachować ostrożność, jeśli arypiprazol jest podawany razem z alkoholem lub z innymi produktami leczniczymi działającymi na OUN, wywołującymi zbliżone działania niepożądane, takie jak sedacja (patrz punkt 4.8). Należy zachować ostrożność podając arypiprazol równocześnie z produktami leczniczymi, o których wiadomo, że powodują wydłużenie odstępu QT lub zaburzenia elektrolitowe.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlInterakcje
Możliwy wpływ innych produktów leczniczych na ABILIFY roztwór do wstrzykiwań Jednoczesne podanie lorazepamu roztwór do wstrzykiwań nie wpłynęło na farmakokinetykę produktu leczniczego ABILIFY roztwór do wstrzykiwań. Jednakże w badaniu pojedynczej dawki po domięśniowym podaniu arypiprazolu (dawka 15 mg) osobom zdrowym jednocześnie z podaniem domięśniowym lorazepamu (dawka 2 mg) nasilenie sedacji było większe po podaniu leków w skojarzeniu, w porównaniu do obserwowanego tylko po podaniu arypiprazolu. Antagonista receptora H 2 - famotydyna, lek hamujący uwalnianie kwasu żołądkowego, zmniejsza szybkość wchłaniania arypiprazolu, jednak działanie to nie ma znaczenia klinicznego. Arypiprazol jest metabolizowany na wiele sposobów, w tym także przez enzymy, takie jak CYP2D6 i CYP3A4. Nie jest jednak metabolizowany przez enzymy z grupy CYP1A, a więc nie jest konieczne stosowanie specjalnych dawek u palaczy tytoniu.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlInterakcje
Chinidyna i inne silne inhibitory CYP2D6 Wyniki badań klinicznych doustnej postaci arypiprazolu z udziałem zdrowych ochotników wykazały, że silny inhibitor enzymu CYP2D6 (chinidyna) zwiększa wartość AUC arypiprazolu o 107%, podczas gdy wartość C max nie zmienia się. Wartości AUC i C max dehydroarypiprazolu, aktywnego metabolitu, były zmniejszone odpowiednio o 32% i 47%. W przypadku jednoczesnego podawania chinidyny i arypiprazolu, należy zmniejszyć dawkę arypiprazolu o około połowę w stosunku do przepisanej dawki. Inne silne inhibitory grupy enzymów CYP2D6, takie jak fluoksetyna i paroksetyna, mogą powodować podobne skutki i w takich sytuacjach należy podobnie zmniejszyć dawkę leku. Ketokonazol i inne silne inhibitory CYP3A4 Wyniki badań klinicznych doustnej postaci arypiprazolu z udziałem zdrowych osób wskazują, że silny inhibitor CYP3A4 (ketokonazol) zwiększa wartości AUC i C max arypiprazolu odpowiednio o 63% i 37%, zaś wartości AUC i C max dehydroarypiprazolu odpowiednio o 77% i 43%.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlInterakcje
W grupie osób o obniżonej aktywności CYP2D6, równoczesne stosowanie silnych inhibitorów CYP3A4 może powodować zwiększenie stężenia arypiprazolu w osoczu, w porównaniu do osób o podwyższonej aktywności CYP2D6. W przypadku jednoczesnego stosowania ketokonazolu albo innych silnych inhibitorów CYP3A4 z arypiprazolem, zakładane korzyści powinny przeważyć potencjalne ryzyko dla pacjenta. W przypadku jednoczesnego stosowania ketokonazolu z arypiprazolem, przepisaną dawkę arypiprazolu należy zmniejszyć o około połowę. Inne leki silnie hamujące aktywność CYP3A4, takie jak itrakonazol oraz inhibitory proteazy HIV, mogą powodować podobne skutki jak ketokonazol i w takich przypadkach należy podobnie zmniejszyć dawkę (patrz punkt 4.2). Po odstawieniu inhibitora CYP2D6 lub CYP3A4, dawkę arypiprazolu należy zwiększyć do tej, jaką stosowano przed rozpoczęciem terapii skojarzonej. W czasie równoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazemu) lub CYP2D6 (np.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlInterakcje
escytalopramu) z arypiprazolem, można spodziewać się niewielkiego zwiększenia stężenia arypiprazolu w osoczu. Karbamazepina i inne leki indukujące CYP3A4 Po jednoczesnym podaniu karbamazepiny, leku silnie indukującego CYP3A4 w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnie geometryczne wartości C max i AUC arypiprazolu zmniejszyły się odpowiednio o 68% i 73%, w stosunku do wartości tych parametrów podczas stosowania arypiprazolu (30 mg) w monoterapii. Podobnie, w przypadku dehydroarypiprazolu średnie geometryczne wartości C max i AUC po jednoczesnym podaniu karbamazepiny zmniejszają się odpowiednio o 69% i 71%, w stosunku do ich wartości podczas stosowania arypiprazolem w monoterapii. Zatem dawkę arypiprazolu należy podwoić, gdy jednocześnie podaje się go z karbamazepiną.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlInterakcje
Można się spodziewać, że jednoczesne podawanie arypiprazolu i innych leków silnie indukujących CYP3A4 (takich jak ryfampicyna , ryfabutyna, fenytoina, fenobarbital, prymidon, efawirenz, newirapina i ziele dziurawca) może działać podobnie i dlatego należy podobnie zwiększyć dawkę. Po zakończeniu podawania leku silnie indukującego CYP3A4, należy zmniejszyć dawkę arypiprazolu do zalecanej. Walproinian i lit Skojarzone stosowanie walproinianów lub litu z arypiprazolem nie powodowało żadnych istotnych klinicznie zmian stężenia arypiprazolu i w związku z tym nie jest konieczne dostosowanie dawki podczas podawania walproinianu lub litu w skojarzeniu z arypiprazolem. Możliwy wpływ arypiprazolu na inne produkty lecznicze Równoczesne podanie produktu leczniczego ABILIFY roztwór do wstrzykiwań nie wpłynęło na farmakokinetykę lorazepamu w postaci roztworu do wstrzykiwań.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlInterakcje
Jednakże w badaniu pojedynczej dawki po domięśniowym podaniu arypiprazolu (dawka 15 mg) osobom zdrowym jednocześnie z podaniem domięśniowym lorazepamu (dawka 2 mg), obserwowany ortostatyczny spadek ciśnienia krwi był większy po podaniu leków w skojarzeniu, w porównaniu do obserwowanego tylko po lorazepamie. W czasie badań klinicznych doustne dawki arypiprazolu od 10 mg na dobę do 30 mg na dobę nie wywierały istotnego wpływu na metabolizm substratów CYP2D6 (stosunek dekstrometorfan/3- metoksymorfinan), CYP2C9 (warfaryna), CYP2C19 (omeprazol) i CYP3A4 (dekstrometorfan). Ponadto w warunkach in vitro , arypiprazol i dehydroarypiprazol nie zmieniały metabolizmu zachodzącego z udziałem CYP1A2. Istnieje zatem małe prawdopodobieństwo wystąpienia istotnych klinicznie interakcji między produktami leczniczymi metabolizowanymi przez te enzymy.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlInterakcje
Kiedy arypiprazol był podawany z walproinianem, litem lub lamotryginą nie stwierdzono klinicznie istotnej zmiany w stężeniach walproinianu, litu lub lamotryginy. Zespół serotoninowy Obserwowano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol, a możliwe objawy przedmiotowe oraz podmiotowe dla tego stanu mogą wystąpić szczególnie w przypadku jednoczesnego stosowania innych leków serotoninergicznych, takich jak SSRI/SNRI (selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny) lub leków, o których wiadomo, że zwiększają stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie przeprowadzono dotychczas odpowiednich badań z grupą kontrolną otrzymującą placebo dotyczących działania arypiprazolu u kobiet w ciąży. Notowano występowanie wad wrodzonych, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. Na podstawie wyników badań przeprowadzonych na zwierzętach nie można wykluczyć potencjalnego toksycznego wpływu leku na płód (patrz punkt 5.3). Pacjentki należy poinformować o konieczności powiadomienia swojego lekarza, jeśli w trakcie leczenia arypiprazolem zajdą w ciąże lub planują zajście w ciążę. Ze względu na niewystarczające dane dotyczące bezpieczeństwa u ludzi oraz budzące wątpliwości wyniki badań wpływu na rozród na zwierzętach, ten lek nie może być stosowany w okresie ciąży, chyba że spodziewane korzyści wyraźnie przewyższają potencjalne ryzyko dla płodu.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWpływ na płodność, ciążę i laktację
Noworodki narażone na działanie leków przeciwpsychotycznych (w tym arypiprazolu) w czasie trzeciego trymestru ciąży są w grupie ryzyka, w której mogą wystąpić działania niepożądane, w tym zaburzenia pozapiramidowe i (lub) objawy odstawienne, które po porodzie mogą różnić się ciężkością przebiegu oraz czasem trwania. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być uważnie monitorowane (patrz punkt 4.8). Karmienie piersią Arypiprazol/metabolity przenikają do mleka ludzkiego. Należy podjąć decyzję czy przerwać karmienie piersią, czy przerwać podawanie arypiprazolu biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem na reprodukcję.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe (sedacja), senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Najczęściej notowanymi działaniami niepożądanymi w badaniach prowadzonych z grupą kontrolną otrzymującą placebo były nudności, zawroty głowy i senność, każda występująca częściej niż u 3% pacjentów leczonych arypiprazolem podawanym doustnie. Tabelaryczne zestawienie działań niepożądanych Częstość występowania działań niepożądanych związanych z leczeniem arypiprazolem podano w poniższej tabeli. Dane w tabeli oparto na działaniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układ/narząd i częstości: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000); nie znana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDziałania niepożądane
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Nie można określić częstości działań niepożądanych zgłaszanych po wprowadzeniu do obrotu, ponieważ pochodzą one ze spontanicznych zgłoszeń. Z tego względu częstość takich działań niepożądanych określono jako „nieznana”.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia krwii układu chłonnego LeukopeniaNeutropenia Trombocytopenia Zaburzenia układu immunologicznego Reakcje uczuleniowe (np. reakcja anafilaktyczna, obrzęk naczynioruchowy obejmującyobrzęk języka, obrzęk twarzy, świąd alergiczny lub pokrzywkę) Zaburzenia endokrynologiczne Hiperprolaktynemia Zmniejszenie stężenia prolaktynywe krwi Cukrzycowa śpiączka hiperosmolarnaCukrzycowa kwasica ketonowa Zaburzeniametabolizmu i odżywiania Cukrzyca Hiperglikemia Hiponatremia Anoreksja Zaburzenia psychiczne Bezsenność LękNiepokój, zwł. ruchowy Depresja Hiperseksualność Próby samobójcze, myśli samobójcze i dokonane samobójstwa (patrz punkt 4.4) Patologiczne uzależnienie od hazarduZaburzenie kontroli impulsów ObżarstwoKompulsywna potrzeba wydawania pieniędzy Poriomania Zachowania agresywne Nadmierne pobudzenieNerwowość Zaburzenia układu nerwowego Akatyzja Zaburzenia pozapiramidowe DrżenieBóle głowy Sedacja SennośćZawroty głowy Późne dyskinezy DystoniaZespół„niespokojnych nóg” Złośliwy zespół neuroleptyczny Drgawki typu grand mal Zespół serotoninowy Zaburzenia mowy Zaburzenia oka Niewyraźne widzenie Podwójne widzenie Światłowstręt(fotofobia) Napad przymusowego patrzenia z rotacją gałek ocznych Zaburzenia serca Tachykardia Nagły zgon niewyjaśniony Torsades de pointes Arytmia komorowa Zatrzymanie akcji sercaBradykardia Zaburzenia naczyniowe Hipotensja ortostatyczna Choroba zakrzepowo-zatorowa żył (w tym zator płucny i zakrzepica żył głębokich)Nadciśnienie tętnicze Omdlenia - CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia układu oddechowego, klatki piersiowej iśródpiersia Czkawka Zachłystowe zapalenie płuc Skurcz krtaniSkurcz części ustnej gardła Zaburzenia żołądka i jelit Zaparcia Niestrawność Nudności Nadmierne wydzielanie ślinyWymioty Suchość w jamie ustnej Zapalenie trzustki Dysfagia BiegunkaDyskomfort w jamie brzusznej Dyskomfort w obrębie żołądka Zaburzeniawątroby i dróg żółciowych Niewydolność wątrobyZapalenie wątroby Żółtaczka Zaburzenia skóry i tkanki podskórnej WysypkaReakcja fotoalergiczna ŁysienieNadmierne pocenie sięWysypka polekowa z eozynofiliąi objawami ogólnoustrojowymi (zespół DRESS) Zaburzenia mięśniowo- szkieletowe itkanki łącznej Rozpad mięśni poprzecznie prążkowanych (rabdomioliza) Bóle mięśnioweSztywność Zaburzenia nereki dróg moczowych Nietrzymanie moczu Zatrzymanie moczu Ciąża, połóg i okres okołoporodowy Zespół abstynencyjny u noworodków (patrz punkt 4.6) Zaburzenia układu rozrodczego ipiersi Priapizm Zaburzenia ogólne i stany w miejscu podania Zmęczenie Zaburzenia regulacji temperatury (np. hipotermia, gorączka)Ból w klatce piersiowej Obrzęk obwodowy - CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDziałania niepożądane
Często Niezbyt często Nieznana Badaniadiagnostyczne Zwiększone ciśnienie rozkurczowe krwi Zmniejszenie masy ciała Zwiększenie masy ciała Zwiększenie aktywności aminotransferazy alaninowej Zwiększenie aktywności aminotransferazy asparaginianowej Zwiększenie aktywności gammaglutamylotransferazy Zwiększenie aktywności fosfatazy alkalicznej Wydłużenie odstępu QTZwiększenie stężenia glukozy we krwiZwiększenie stężenia glikozylowanej hemoglobiny Wahania stężenia glukozy we krwiZwiększona aktywność fosfokinazy kreatynowej - CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDziałania niepożądane
Opis wybranych działań niepożądanych Objawy pozapiramidowe (ang. EPS) Schizofrenia: w długookresowym 52-tygodniowym badaniu prowadzonym z grupą kontrolną, u pacjentów leczonych arypiprazolem ogólnie rzadziej występowały EPS (25,8%), w tym parkinsonizm, akatyzja, dystonia i dyskineza, w porównaniu do pacjentów leczonych haloperydolem (57,3%). W długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, częstość występowania EPS wynosiła 19% w przypadku pacjentów leczonych arypiprazolem i 13,1% w przypadku pacjentów otrzymujących placebo. W innym długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną częstość występowania EPS wynosiła 14,8% w przypadku pacjentów leczonych arypiprazolem i 15,1% w przypadku pacjentów otrzymujących olanzapinę. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I: w 12- tygodniowym badaniu prowadzonym z grupą kontrolną przypadki EPS stwierdzano u 23,5% pacjentów leczonych arypiprazolem i u 53,3% pacjentów leczonych haloperydolem.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDziałania niepożądane
W innym 12- tygodnowym badaniu przypadki EPS stwierdzano u 26,6% pacjentów leczonych arypiprazolem i u 17,6% pacjentów leczonych litem. W długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo podczas fazy leczenia podtrzymującego przypadki EPS wystąpiły u 18,2% pacjentów leczonych arypiprazolem i u 15,7% pacjentów otrzymujących placebo. Akatyzja W badaniach prowadzonych z grupą kontrolną otrzymującą placebo przypadki akatyzji u pacjentów z zaburzeniami afektywnymi dwubiegunowymi występowały u 12,1% pacjentów leczonych arypiprazolem i u 3,2% pacjentów otrzymujących placebo. U pacjentów ze schizofrenią liczba przypadków akatyzji wynosiła 6,2% w grupie arypiprazolu i 3,0% w grupie placebo. Dystonia Efekt klasy terapeutycznej: objawy dystonii, długotrwałe nieprawidłowe skurcze grup mięśni, mogą występować u wrażliwych pacjentów w ciągu pierwszych kilku dni leczenia.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDziałania niepożądane
Do objawów dystonii należą: skurcze mięśni szyi, czasami postępujące do ucisku w gardle, trudności z przełykaniem, trudności z oddychaniem i (lub) zaburzenia ruchów języka. Chociaż objawy te mogą występować po zastosowaniu małych dawek, występują częściej i o większym nasileniu podczas stosowania leków przeciwpsychotycznych pierwszej generacji o dużych mocach i w większych dawkach. Obserwowano zwiększone ryzyko ostrej dystonii u mężczyzn i w młodszych grupach wiekowych. Prolaktyna Podczas badań klinicznych w zakresie zarejestrowanych wskazań i po wprowadzeniu produktu leczniczego do obrotu u pacjentów otrzymujących arypiprazol obserwowano zarówno zwiększenie, jak i zmniejszenie stężenia prolaktyny w surowicy w porównaniu do pomiarów początkowych (punkt 5.1). Parametry laboratoryjne Porównania pomiędzy arypiprazolem i placebo dotyczące odsetka pacjentów, u których wystąpiły potencjalnie istotne zmiany rutynowych parametrów laboratoryjnych i lipidowych (patrz punkt 5.1), nie wykazały medycznie istotnych różnic (patrz punkt 5.1).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDziałania niepożądane
Ogólnie przejściowe i bezobjawowe zwiększenie aktywności CPK (fosfokinazy kreatynowej) obserwowano u 3,5% pacjentów leczonych arypiprazolem w porównaniu do 2,0% pacjentów otrzymujących placebo. Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Patologiczne uzależnienie od hazardu, hiperseksualność, kompulsywna potrzeba wydawania pieniędzy i obżarstwo lub kompulsywne objadanie się mogą wystąpić u pacjentów leczonych arypiprazolem (patrz punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania wymienionego w załączniku V .
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlPrzedawkowanie
4.9 Przedawkowanie Nie zgłaszano żadnych przypadków przedawkowania związanych z reakcjami niepożądanymi podczas badań klinicznych produktu leczniczego ABILIFY roztwór do wstrzykiwań. Należy zachować ostrożność, aby uniknąć nieumyślnego wstrzyknięcia produktu leczniczego do naczynia krwionośnego. Po potwierdzonym lub podejrzewanym przypadkowym przedawkowaniu/nieumyślnym podaniu dożylnym konieczna jest ścisła obserwacja pacjenta i jeśli pojawią się wszelkie potencjalne ciężkie medycznie objawy lub oznaki, wymagane jest monitorowanie pacjenta, które powinno obejmować ciągłe monitorowanie elektrokardiograficzne. Medyczny nadzór i monitorowanie powinno być prowadzone do czasu powrotu pacjenta do zdrowia. Objawy przedmiotowe i podmiotowe W badaniach klinicznych i po wprowadzeniu produktu do obrotu przypadkowe bądź zamierzone przedawkowanie samego arypiprazolu stwierdzono u dorosłych pacjentów po oszacowanej dawce do 1260 mg niezakończone zgonem.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlPrzedawkowanie
Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: letarg, wzrost ciśnienia tętniczego krwi, senność, przyspieszona czynność serca (tachykardia), nudności, wymioty i biegunka. Ponadto zgłaszano przypadkowe przedawkowanie samego arypiprazolu (do 195 mg) u dzieci, bez zgonów. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: senność, przejściowa utrata świadomości i objawy pozapiramidowe. Postępowanie po przedawkowaniu W przypadku przedawkowania leku stosuje się leczenie podtrzymujące, polegające na utrzymaniu drożności dróg oddechowych, dotlenianiu i wentylacji oraz leczeniu objawowym. Należy wziąć pod uwagę możliwość wpływu wielu produktów leczniczych. Z tego względu należy niezwłocznie rozpocząć monitorowanie czynności układu krążenia, obejmujące stałe monitorowanie zapisu elektrokardiograficznego, w celu wykrycia możliwych zaburzeń rytmu serca.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlPrzedawkowanie
W przypadku potwierdzonego lub podejrzewanego przedawkowania arypiprazolu należy objąć pacjenta ścisłą kontrolą i obserwować go do czasu poprawy jego stanu. Aktywowany węgiel (50 g), podany w godzinę po zażyciu arypiprazolu, obniża wartość C max leku o około 41%, a wartość AUC o około 51%, co wskazuje na jego skuteczność w leczeniu przedawkowania. Hemodializa Pomimo że brak informacji dotyczących wpływu hemodializ w leczeniu przedawkowania arypiprazolu, to jednak istnieje małe prawdopodobieństwo, by hemodializy były użyteczne w takich przypadkach, ze względu na znaczny stopień wiązania arypiprazolu z białkami osocza.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12 Mechanizm działania Uważa się, że skuteczność arypiprazolu w leczeniu schizofrenii i zaburzenia afektywnego dwubiegunowego typu I jest związana ze skojarzonym działaniem częściowo agonistycznym w stosunku do receptora dopaminowego D 2 i serotoninowego 5-HT 1A oraz antagonistycznym w stosunku do receptora serotoninowego 5-HT 2A . Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D 2 i D 3 , serotoninowych 5-HT 1A i 5-HT 2A oraz umiarkowane powinowactwo do receptorów dopaminowych D 4 , serotoninowych 5-HT 2C i 5-HT 7 , a także adrenergicznych alfa-1 i histaminowych H 1 .
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Arypiprazol w dawkach od 0,5 mg do 30 mg, podawany raz na dobę przez 2 tygodnie osobom zdrowym powoduje zależne od dawki zmniejszenie wiązania rakloprydu znakowanego 11 C, ligandu receptora D 2 /D 3 , w jądrze ogoniastym i skorupie, co można wykryć za pomocą pozytonowej tomografii emisyjnej. Skuteczność kliniczna i bezpieczeństwo stosowania Nadmierne pobudzenie u chorych na schizofrenię i z zaburzeniem afektywnym dwubiegunowym typu I leczonych produktem leczniczym ABILIFY roztwór do wstrzykiwań W dwóch krótkoterminowych (24 godzinnych) kontrolowanych placebo badaniach obejmujących 554 dorosłych pacjentów ze schizofrenią z objawami pobudzenia i zaburzeniami zachowania, stosowanie produktu leczniczego ABILIFY roztwór do wstrzykiwań związane było ze statystycznie istotnie większą poprawą w zakresie objawów pobudzenia/zachowania niż z placebo i była podobna do występującej po haloperydolu.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakodynamiczne
W jednym krótkoterminowym (24 godzinnym) badaniu klinicznym, z grupą kontrolną otrzymującą placebo, przeprowadzonym w grupie 291 pacjentów z zaburzeniem afektywnym dwubiegunowym z objawami pobudzenia i zaburzeniami zachowania, ABILIFY roztwór do wstrzykiwań powodował statystycznie istotne zmniejszenie objawów pobudzenia/zaburzeń zachowania w porównaniu do placebo, a jego działanie było podobne do lorazepamu stosowanego jako lek referencyjny. Obserwowana średnia poprawa wyjściowego wyniku skali PANSS Excitement Component dla głównego punktu końcowego – 2 godzin wynosiła 5,8 w grupie placebo, 9,6 w grupie lorazepamu i 8,7 w grupie produktu leczniczego ABILIFY roztwór do wstrzykiwań. Analizy w podgrupie pacjentów z epizodami mieszanymi lub u pacjentów ze znaczącym pobudzeniem wykazała podobny wzór skuteczności jak w całej grupie, ale ze względu na zmniejszone wielkości grup nie można było ocenić istotności statystycznej.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakodynamiczne
Schizofrenia leczona arypiprazolem w postaci doustnej Wyniki trzech krótkoterminowych badań (4 do 6 tygodni) z grupą kontrolną otrzymującą placebo, w których udział wzięło 1228 dorosłych chorych na schizofrenię, u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol w postaci dousnej powoduje istotnie większą poprawę w zakresie objawów psychotycznych niż placebo. Arypiprazol jest skuteczny w podtrzymywaniu poprawy klinicznej podczas kontynuacji leczenia u tych dorosłych pacjentów, u których obserwowano wstępną dobrą reakcję na lek. W badaniu z grupą kontrolną przyjmującą haloperydol, odsetek pacjentów, u których udało się utrzymać dobrą reakcję na produkt leczniczy w ciągu 52 tygodni, był podobny w obu grupach (arypiprazol w postaci doustnej 77% i haloperydol 73%). Badanie ukończyła istotnie większa grupa pacjentów leczonych doustnym arypiprazolem (43%) niż doustnym haloperydolem (30%).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakodynamiczne
Wyniki uzyskane w skalach ocen stosowanych jako drugorzędowe punkty końcowe skuteczności, w tym w skali PANSS i w skali oceny depresji Montgomery-Asberg [ang. Montgomery–Åsberg-Depression-Rating-Scale, MADRS], wskazują na istotną poprawę w stosunku do haloperydolu. W trwającym 26 tygodni badaniu prowadzonym z grupą kontrolną otrzymującą placebo, z udziałem pacjentów dorosłych z ustabilizowaną przewlekłą schizofrenią stwierdzono, że leczenie arypiprazolem w postaci doustnej powoduje większe zmniejszenie częstości nawrotów, 34% w grupie leczonych doustnym arypiprazolem i 57% w grupie otrzymującej placebo. Przyrost masy ciała Wyniki badań klinicznych arypiprazolu w postaci doustnej wskazują, że doustny arypiprazol nie powoduje klinicznie istotnego przyrostu masy ciała. W trwającym 26 tygodni badaniu z grupą kontrolną leczonych olanzapiną i wykorzystaniem podwójnie ślepej próby, przeprowadzonym w wielu krajach, udział wzięło 314 dorosłych pacjentów ze schizofrenią.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakodynamiczne
Pierwszorzędowym punktem końcowym była ocena przyrostu masy ciała. U istotnie mniejszej liczby pacjentów leczonych arypiprazolem w porównaniu z otrzymującymi olanzapinę, stwierdzono przyrost masy ciała o co najmniej 7% w porównaniu z pomiarem początkowym (tzn. przyrost masy ciała o co najmniej 5,6 kg przy średniej początkowej masie wynoszącej ok. 80,5 kg) w grupie leczonych arypiprazolem w postaci doustnej (n = 18 lub 13% pacjentów nadających się do oceny), w porównaniu z grupą otrzymującą olanzapinę w postaci doustnej (n = 45 lub 33% pacjentów nadających się do oceny). Stężenia lipidów W zbiorczej analizie wyników stężeń lipidów pochodzących z badań klinicznych prowadzonych z grupą kontrolną otrzymującą placebo u dorosłych, arypiprazol nie powodował klinicznie istotnych zmian stężeń cholesterolu całkowitego, triglicerydów, cholesterolu frakcji lipoprotein o dużej gęstości (HDL) i cholesterolu frakcji lipoprotein o małej gęstości (LDL).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakodynamiczne
Prolaktyna Stężenia prolaktyny oceniono podczas wszystkich badań z zastosowaniem wszystkich dawek arypiprazolu (n = 28 242). Częstość występowania hiperprolaktynemii lub zwiększenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem (0,3%) była podobna do częstości występowania hiperprolaktynemii w grupie otrzymującej placebo (0,2%). U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia hiperprolaktynemii wynosiła 42 dni, a mediana czasu trwania wynosiła 34 dni. Częstość występowania hiperprolaktynemii lub zmniejszenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem wynosiła 0,4% w porównaniu do 0,02% w grupie otrzymującej placebo. U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 30 dni, a mediana czasu trwania wynosiła 194 dni.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakodynamiczne
Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I leczone arypiprazolem podawanym doustnie W dwóch 3-tygodniowych badaniach, prowadzonych z grupą kontrolną otrzymującą placebo, z zastosowaniem zmiennej dawki, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol był znacząco bardziej skuteczny niż placebo w zmniejszaniu objawów maniakalnych w ciągu 3 tygodni. Badania te obejmowały pacjentów z objawami lub bez objawów psychotycznych oraz pacjentów z szybką zmianą fazy lub bez szybkiej zmiany fazy (przebieg typu rapid-cycling). W jednym 3-tygodniowym badaniu, prowadzonym z grupą kontrolną otrzymującą placebo, z zastosowaniem stałej dawki w monoterapii, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol nie wykazał większej skuteczności niż placebo.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakodynamiczne
W dwóch 12-tygodniowych badaniach, prowadzonych z grupą kontrolną otrzymującą placebo oraz inne substancje czynne, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, arypiprazol był skuteczniejszy niż placebo w 3. tygodniu badania, a wynik leczenia podtrzymującego był w 12. tygodniu badania porównywalny z wynikiem dla litu lub haloperydolu. W 12. tygodniu arypiprazol powodował także remisję objawów maniakalnych u porównywalnej liczby pacjentów co lit lub haloperydol. W 6-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, którzy częściowo nie reagowali na monoterapię litem lub walproinianem przez 2 tygodnie przy terapeutycznych stężeniach w surowicy, zastosowanie arypiprazolu jako dodatkowego leku w większym stopniu zwiększyło skuteczność zapobiegania objawom maniakalnym niż stosowanie litu lub walproinianu w monoterapii.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakodynamiczne
W 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, które przedłużono o 74 tygodnie, u pacjentów z objawami maniakalnymi, którzy osiągnęli remisję w trakcie stosowania arypiprazolu w czasie fazy stabilizacji przed randomizacją, arypiprazol był bardziej skuteczny niż placebo w zapobieganiu nawrotowi chorobie dwubiegunowej, głównie w zapobieganiu nawrotowi objawów maniakalnych, ale nie wykazał przewagi nad placebo w zapobieganiu nawrotowi depresji. W 52-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, u pacjentów z obecnym epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, którzy osiągnęli trwałą remisję (w skali oceny manii Younga [ang. Young Mania Rating Scale, YMRS] oraz w skali oceny depresji MADRS z całkowitą ilością punktów ≤ 12) w trakcie stosowania arypiprazolu (w dawce od 10 mg na dobę do 30 mg na dobę) w skojarzeniu z litem lub walproinianem przez 12 kolejnych tygodni, połączenie z arypiprazolem wykazało przewagę nad placebo w zapobieganiu nawrotowi choroby afektywnej dwubiegunowej zmniejszając ryzyko o 46% (współczynnik ryzyka 0,54) i w zapobieganiu nawrotom manii zmniejszając ryzyko o 65% (współczynnik ryzyka 0,35), ale nie wykazało przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakodynamiczne
Zastosowanie arypiprazolu jako dodatkowego leku wykazało przewagę wobec placebo w przypadku drugorzędowego pomiaru wyniku leczenia w ocenach ogólnego wrażenia klinicznego w wersji dla ChAD (ang. Clinical Global Impression - Bipolar version, CGI-BP) nasilenia choroby (mania) (ang. Severity of illness , SOI [mania]). W tym badaniu, pacjenci zostali przydzieleni przez badaczy do badania prowadzonego metodą próby otwartej, z zastosowaniem litu lub walproinianu w monoterapii, w celu oceny częściowego braku odpowiedzi. Pacjenci byli stabilizowani przez co najmniej 12 kolejnych tygodni za pomocą skojarzenia arypiprazolu i stosowanego wcześniej stabilizatora nastroju. Pacjenci stabilni byli następnie losowo przydzielani do grupy kontynuującej stosowanie tego samego stabilizatora nastroju z arypiprazolem lub placebo w badaniu metodą podwójnie ślepej próby.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakodynamiczne
W fazie randomizowanej oceniano cztery podgrupy stabilizatora nastroju: arypiprazol + lit; arypiprazol + walproinian; placebo + lit; placebo + walproinian. Odsetki Kaplana- Meiera dla nawrotu jakiegokolwiek zaburzenia nastroju w przypadku zastosowania dodatkowego leku były następujące: 16% w grupie stosującej arypiprazol + lit i 18% w grupie stosującej arypiprazol + walproinian, w porównaniu do 45% w grupie stosującej placebo + lit i 19% w grupie stosującej placebo + walproinian. Europejska Agencja Leków wstrzymała obowiązek dołączania wyników badań produktu leczniczego ABILIFY w jednej lub kilku podgrupach populacji dzieci i młodzieży w leczeniu schizofrenii oraz w leczeniu choroby afektywnej dwubiegunowej (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Arypiprazol podany domięśniowo jako pojedyncza dawka osobom zdrowym jest dobrze wchłaniany i wykazuje bezwzględną biodostępność 100%. Wartość AUC arypiprazolu w pierwszych 2 godzinach po wstrzyknięciu domięśniowym była o 90% większa niż wartość AUC po podaniu tej samej dawki w postaci tabletki; ogólnoustrojowe oddziaływanie było zazwyczaj podobne w przypadku obu postaci farmaceutycznych. W 2 badaniach u osób zdrowych średni czas do wystąpienia maksymalnego stężenia w osoczu wynosił 1 i 3 godziny po podaniu. Dystrybucja Na podstawie wyników z badań arypiprazolu w postaci doustnej stwierdzono, że arypiprazol jest rozmieszczany w całym organizmie, pozorna objętość dystrybucji wynosi 4,9 l/kg, co wskazuje na znaczną dystrybucję pozanaczyniową. W stężeniach terapeutycznych arypiprazol i dehydroarypiprazol wiążą się w ponad 99% z białkami surowicy, głównie z albuminami. Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakokinetyczne
Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji. Jak wynika z badań in vitro , enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N- dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. W stanie stacjonarnym aktywny metabolit, dehydroarypiprazol, stanowi około 40% AUC arypiprazolu w osoczu. Eliminacja Średni okres półtrwania arypiprazolu w fazie eliminacji wynosi około 75 godzin u osób o podwyższonej aktywności CYP2D6 i około 146 godzin u osób o obniżonej aktywności CYP2D6. Całkowity klirens arypiprazolu wynosi 0,7 ml/min/kg i jest to głównie klirens wątrobowy. Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [ 14 C], stwierdza się odpowiednio 27% i 60% podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1% niezmienionego arypiprazolu zostaje wydalone z moczem i około 18% z kałem.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakokinetyczne
Farmakokinetyka w szczególnych grupach pacjentów Pacjenci w podeszłym wieku Nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi, nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Nie stwierdzono, aby farmakokinetyka arypiprazolu różniła się u zdrowych kobiet i zdrowych mężczyzn. Nie stwierdzono także żadnego mierzalnego wpływu płci na farmakokinetykę leku u pacjentów ze schizofrenią. Palenie tytoniu Populacyjne badanie farmakokinetyczne arypiprazolu w postaci doustnej nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od palenia tytoniu. Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlWłaściwości farmakokinetyczne
Zaburzenia czynności nerek Stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u osób z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badania obejmujące podanie pojedynczej dawki leku, przeprowadzone u osób z różnego stopnia marskością wątroby (klasy Childa-Pugha A, B i C) nie wykazały, by zaburzenia czynności wątroby wpływały istotnie na farmakokinetykę arypiprazolu i dehydroarypiprazolu, jednak w badaniu wzięło udział tylko 3 chorych z marskością wątroby klasy C, co jest liczbą niewystarczającą do wyciągnięcia wniosków dotyczących zdolności metabolicznych tych pacjentów.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Podanie produktu leczniczego ABILIFY roztwór do wstrzykiwań było dobrze tolerowane i nie powodowało bezpośredniego wpływu toksycznego na docelowy narząd u szczurów lub małp po dawkach wielokrotnych w ogólnoustrojowych ekspozycjach (AUC), które były odpowiednio 15 i 5 razy większe niż ekspozycja u ludzi po podaniu maksymalnej dawki dla człowieka wynoszącej 30 mg w podaniu domięśniowym. W badaniach toksycznego wpływu na reprodukcję po podaniu dożylnym nie obserwowano nowych danych dotyczących bezpieczeństwa przy ekspozycji matek do 15 (szczury) i 29 (króliki) razy większej niż ekspozycja u człowieka po podaniu dawki 30 mg. Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa doustnego arypiperazolu, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlPrzedkliniczne dane o bezpieczeństwie
Istotne działanie toksyczne stwierdzano jedynie po podaniu dawek lub przy stopniu narażenia wyraźnie przekraczającym maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza (gromadzenie barwnika lipofuscyny i (lub) obumieranie komórek miąższowych) stwierdzany u szczurów po 104 tygodniach podawania arypiprazolu w dawce od 20 mg/kg mc. na dobę do 60 mg/kg mc. na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała od 3 do 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki) i zwiększenie częstości występowania raków nadnerczy, a także skojarzonej częstości występowania gruczolaków lub raków nadnerczy u samic szczurów otrzymujących lek w dawce 60 mg/kg mc. na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlPrzedkliniczne dane o bezpieczeństwie
Największa ekspozycja nie powodująca powstawania nowotworów u samic szczurów odpowiadała 7 krotnie większej ekspozycji niż ekspozycja występująca u ludzi po zastosowaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych sprzężonych związków hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 mg/kg mc. na dobę do 125 mg/kg mc. na dobę (średnia wartość AUC w stanie stacjonarnym była od 1 do 3 razy wyższa niż wartość występująca u ludzi po podaniu maksymalnej zalecanej dawki klinicznej lub od 16 do 81 razy wyższa niż po podaniu maksymalnej dawki zalecanej na podstawie przeliczenia mg/m 2 pc.). Jednak stężenie sprzężonych związków siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania najwyższej proponowanej dawki 30 mg na dobę, nie przekraczało 6% stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie mniejsze (6%) niż granica rozpuszczalności określona in vitro .
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlPrzedkliniczne dane o bezpieczeństwie
W badaniach toksykologicznych po podaniu wielokrotnym u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt oraz brak jest dowodów neurotoksyczności i niepożądanego wpływu na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych. Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowano toksyczny wpływ na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po zastosowaniu dawek maksymalnych zalecanych u ludzi).
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlPrzedkliniczne dane o bezpieczeństwie
Toksyczny wpływ na ciężarne samice obserwowano podczas podawania dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Abilify, roztwór do wstrzykiwań, 7,5 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sulfobutyloeter -cyklodekstryny Kwas winowy Sodu wodorotlenek Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 18 miesięcy Po otwarciu: produkt należy natychmiast użyć. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać fiolkę w zewnętrznym pudełku tekturowym w celu ochrony przed światłem. Warunki przechowywania produktu leczniczego po pierwszym otwarciu, patrz punkt 6.3. 6.5 Rodzaj i zawartość opakowania Każde pudełko tekturowe zawiera jedną fiolkę przeznaczoną do jednorazowego użycia ze szkła typu I z korkiem z gumy butylowej i zrywalną plombą aluminiową. 6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ABILIFY 1 mg/ml roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 1 mg arypiprazolu. Substancje pomocnicze o znanym działaniu (w ml) 200 mg fruktozy, 400 mg sacharozy, 1,8 mg parahydroksybenzoesanu metylu (E 218), 0,2 mg parahydroksybenzoesanu propylu (E 216) Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór doustny Klarowny płyn, w odcieniach od bezbarwnego do jasnożółtego.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania ABILIFY jest wskazany do leczenia schizofrenii u dorosłych i u młodzieży w wieku 15 lat i starszej. ABILIFY jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym lub ciężkim w przebiegu zaburzenia afektywnego dwubiegunowego typu I oraz w zapobieganiu nowym epizodom maniakalnym u dorosłych, u których występują głównie epizody maniakalne i którzy odpowiadają na leczenie arypiprazolem (patrz punkt 5.1). ABILIFY jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym lub ciężkim w przebiegu zaburzenia afektywnego dwubiegunowego typu I u młodzieży w wieku 13 lat i starszej, w leczeniu trwającym do 12 tygodni (patrz punkt 5.1).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Schizofrenia: zalecana dawka początkowa produktu ABILIFY to 10 mg na dobę lub 15 mg na dobę (tj. 10 ml lub 15 ml roztworu na dobę) z dawką podtrzymującą 15 mg na dobę. Lek należy podawać raz na dobę o stałej porze, niezależnie od posiłków. ABILIFY jest skuteczny w dawkach od 10 mg na dobę do 30 mg na dobę (tj. od 10 ml do 30 ml roztworu na dobę). Chociaż nie potwierdzono większej skuteczności dawek większych niż dawka dobowa 15 mg, to jednak u poszczególnych pacjentów większa dawka może być korzystna. Maksymalna dawka dobowa nie może być większa niż 30 mg. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I: zalecana dawka początkowa to 15 mg produktu ABILIFY (15 ml roztworu na dobę) podawana w schemacie raz na dobę, niezależnie od posiłków jako monoterapia lub w leczeniu skojarzonym (patrz punkt 5.1). U niektórych pacjentów może być korzystne zastosowanie większej dawki.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDawkowanie
Maksymalna dawka dobowa nie może być większa niż 30 mg. Zapobieganie nawrotom epizodów maniakalnych w zaburzeniu afektywnym dwubiegunowym typu I: w celu zapobiegania nawrotom epizodów maniakalnych u pacjentów, którzy stosują arypiprazol w monoterapii lub w terapii skojarzonej, należy kontynuować leczenie stosując ustaloną dawkę. Dostosowanie dawki dobowej, w tym jej zmniejszenie, należy rozważyć na podstawie stanu klinicznego. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej : zalecana dawka produktu ABILIFY, to 10 mg na dobę podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie powinno być rozpoczęte od dawki 2 mg (stosując ABILIFY 1 mg/ml roztwór doustny) przez 2 dni, stopniowo zwiększanej do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDawkowanie
W przypadkach, w których zwiększenie dawki jest właściwe, należy podawać kolejne dawki zwiększone jednorazowo o 5 mg, nie przekraczając maksymalnej dawki dobowej 30 mg (patrz punkt 5.1). ABILIFY jest skuteczny w przedziale dawek od 10 mg na dobę do 30 mg na dobę. Nie wykazano większej skuteczności przy zastosowaniu dawek dobowych większych niż 10 mg, chociaż indywidualni pacjenci mogą odnieść korzyść z zastosowania większych dawek. ABILIFY nie jest zalecany do stosowania u pacjentów ze schizofrenią w wieku poniżej 15 lat, z powodu braku wystarczających danych dotyczących bezpieczeństwa stosowania i skuteczności (patrz punkty 4.8 i 5.1). Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej: zalecana dawka produktu ABILIFY to 10 mg na dobę, podawana w schemacie raz na dobę, niezależnie od posiłków.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDawkowanie
Leczenie należy rozpocząć od dawki 2 mg (stosując ABILIFY roztwór doustny 1 mg/ml) przez 2 dni, stopniowo zwiększać do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. Czas trwania leczenia powinien być możliwie najkrótszy konieczny do uzyskania kontroli objawów i nie może być dłuższy niż 12 tygodni. Nie wykazano większej skuteczności po zastosowaniu dawek dobowych większych niż 10 mg, a dawka dobowa wynosząca 30 mg jest związana ze znacząco większą częstością występowania istotnych reakcji niepożądanych, w tym zdarzeń związanych z objawami pozapiramidowymi (ang. EPS), senności, zmęczenia oraz zwiększenia masy ciała (patrz punkt 4.8). Z tego powodu dawki większe niż 10 mg na dobę należy stosować tylko w wyjątkowych przypadkach oraz z zachowaniem ścisłej kontroli klinicznej (patrz punkty 4.4, 4.8 i 5.1). Młodsi pacjenci są narażeni na zwiększone ryzyko działań niepożądanych związanych z arypiprazolem.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDawkowanie
Z tego powodu produkt ABILIFY nie jest zalecany do stosowania u pacjentów w wieku poniżej 13 lat (patrz punkty 4.8 i 5.1). Drażliwość związana z zaburzeniami autystycznymi: nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego ABILIFY u dzieci i młodzieży w wieku poniżej 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących dawkowania. Tiki związane z zespołem Tourette’a: nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego ABILIFY u dzieci i młodzieży w wieku od 6 do 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących dawkowania. Szczególne grupy pacjentów Zaburzenia czynności wątroby Nie ma konieczności modyfikacji dawki u osób z zaburzeniami czynności wątroby o nasileniu lekkim lub umiarkowanym. Nie ma wystarczających danych do ustalenia dawkowania u pacjentów z ciężką niewydolnością wątroby. W tej grupie pacjentów należy ostrożnie ustalać dawkowanie.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDawkowanie
Niemniej jednak, w grupie pacjentów z ciężkimi zaburzeniami czynności wątroby największą dawkę dobową 30 mg należy stosować ze szczególną ostrożnością (patrz punkt 5.2). Zaburzenia czynności nerek Nie ma konieczności modyfikacji dawki u pacjentów z zaburzeniami czynności nerek. Pacjenci w podeszłym wieku Bezpieczeństwo i skuteczność stosowania produktu ABILIFY w leczeniu schizofrenii i w epizodach manii w przebiegu zaburzenia afektywnywnego dwubiegunowego typu I nie zostały zbadane u pacjentów w wieku 65 lat i starszych. Jednak z powodu większej wrażliwości tych pacjentów, należy rozważyć zastosowanie mniejszej dawki początkowej, jeśli pozwalają na to okoliczności kliniczne (patrz punkt 4.4). Płeć Nie ma konieczności modyfikacji dawek leku w zależności od płci (patrz punkt 5.2). Palacze tytoniu Biorąc pod uwagę metabolizm arypiprazolu nie ma konieczności modyfikacji dawek u palaczy (patrz punkt 4.5).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDawkowanie
Dostosowanie dawki z powodu interakcji Dawkę arypiprazolu należy zmniejszyć w przypadku równoczesnego podawania leku o silnym działaniu hamującym w stosunku do cytochromu CYP3A4 lub CYP2D6. Po zakończeniu jednoczesnego stosowania inhibitora CYP3A4 lub CYP2D6 należy ponownie zwiększyć dawkę arypiprazolu (patrz punkt 4.5). Dawkę arypiprazolu należy zwiększyć w przypadku równoczesnego podawania leków silnie indukujących CYP3A4. Po odstawieniu leku indukującego CYP3A4, dawkę arypiprazolu należy ponownie zmniejszyć do zalecanej (patrz punkt 4.5). Sposób podawania Produkt leczniczy ABILIFY jest przeznaczony do podawania doustnego. Tabletki ulegające rozpadowi w jamie ustnej lub roztwór doustny mogą być stosowane alternatywnie do tabletek ABILIFY u pacjentów, którzy mają trudności w połykaniu tabletek ABILIFY (patrz także punkt 5.2).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić w ciągu od kilku dni do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Prawdopodobieństwo podjęcia próby samobójczej Występowanie zachowań samobójczych jest związane z chorobami psychicznymi oraz zaburzeniami nastroju i w niektórych przypadkach było zgłaszane wkrótce po rozpoczęciu lub zmianie leczenia przeciwpsychotycznego, w tym leczenia arypiprazolem (patrz punkt 4.8). Leczenie przeciwpsychotyczne pacjentów wysokiego ryzyka powinno odbywać się pod ścisłym nadzorem. Zaburzenia sercowo-naczyniowe Arypiprazol należy stosować ostrożnie u pacjentów z chorobą sercowo-naczyniową (zawał mięśnia sercowego lub choroba niedokrwienna, niewydolność serca lub zaburzenia przewodzenia w wywiadzie), chorobą naczyń mózgu, w stanach predysponujących do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie przeciwnadciśnieniowymi produktami leczniczymi) lub z nadciśnieniem tętniczym, w tym postępującym lub złośliwym.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
Po zastosowaniu leków przeciwpsychotycznych obserwowano przypadki żylnej choroby zakrzepowo-zatorowej (VTE - ang. venous thromboembolism ). Ponieważ u pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE przed rozpoczęciem oraz w czasie leczenia arypiprazolem i wdrożyć odpowiednie środki zapobiegawcze. Wydłużenie odstępu QT W badaniach klinicznych arypiprazolu częstość występowania wydłużenia odstępu QT była porównywalna z placebo. Arypiprazol należy stosować ostrożnie u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy W badaniach klinicznych trwających nie dłużej niż rok, w trakcie leczenia arypiprazolem zgłaszano niezbyt częste przypadki dyskinez związane z leczeniem.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
Jeśli objawy przedmiotowe lub podmiotowe późnych dyskinez wystąpią u pacjentów leczonych arypiprazolem, należy rozważyć zmniejszenie dawki lub odstawienie leku (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Inne objawy pozapiramidowe W pediatrycznych badaniach klinicznych z zastosowaniem arypiprazolu obserwowano akatyzję oraz parkinsonizm. Jeśli u pacjenta przyjmującego arypiprazol wystąpią objawy przedmiotowe i podmiotowe innych zaburzeń pozapiramidowych, należy rozważyć zmniejszenie dawki oraz wprowadzenie ścisłej kontroli klinicznej. Złośliwy Zespół Neuroleptyczny (NMS ) NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z podawaniem leków przeciwpsychotycznych. W badaniach klinicznych, odnotowano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
Klinicznymi objawami NMS są bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz objawy niestabilności autonomicznego układu nerwowego (nieregularne tętno lub wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Jednakże, obserwowano także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę, niekoniecznie związane z NMS. Jeśli wystąpiły wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS, bądź niewyjaśnionego pochodzenia wysoka gorączka, bez innych objawów NMS, należy przerwać leczenie wszystkimi lekami przeciwpsychotycznymi, w tym także arypiprazolem. Drgawki W badaniach klinicznych odnotowano niezbyt częste przypadki napadów drgawek w czasie leczenia arypiprazolem.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
Z tego powodu arypiprazol należy stosować z zachowaniem ostrożności u pacjentów, u których w przeszłości występowały napady drgawek lub u których występują choroby wiążące się ze skłonnością do takich napadów (patrz punkt 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencją Zwiększona śmiertelność W trzech badaniach kontrolowanych placebo (n = 938, średnia wieku: 82,4; zakres: od 56 do 99 lat), u pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera, leczonych arypiprazolem, występowało zwiększone ryzyko zgonu w porównaniu z grupą otrzymującą placebo. Częstość zgonów u pacjentów leczonych arypiprazolem wynosiła 3,5% w porównaniu do 1,7% w grupie placebo. Chociaż przyczyny zgonów były zróżnicowane to większość zgonów wydawała się być związana albo z chorobami układu krążenia (np. niewydolność serca, nagłe zgony) albo z chorobami zakaźnymi (np. zapalenie płuc) (patrz punkt 4.8).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego U pacjentów w tych samych badaniach odnotowano działania niepożądane dotyczące krążenia mózgowego (np. udar, przejściowe napady niedokrwienia) w tym o przebiegu zakończonym zgonem (średnia wieku: 84 lata; zakres od 78 do 88 lat). Ogólnie w tych badaniach 1,3% wszystkich pacjentów leczonych arypiprazolem zgłaszało działania niepożądane dotyczące krążenia mózgowego w porównaniu do 0,6% pacjentów otrzymujących placebo. Różnica ta nie była istotna statystycznie. Jednakże w jednym z tych badań z zastosowaniem ustalonego dawkowania u pacjentów leczonych arypiprazolem występowała istotna zależność odpowiedzi od dawki dla działań niepożądanych dotyczących krążenia mózgowego (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów z psychozą związaną z demencją.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
Hiperglikemia i cukrzyca U pacjentów leczonych nietypowymi lekami przeciwpsychotycznymi, w tym arypiprazolem, opisywano hiperglikemię, w niektórych przypadkach bardzo wysoką z kwasicą ketonową i śpiączką hiperosmotyczną lub zgonem. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. W badaniach klinicznych z arypiprazolem nie było istotnych różnic w częstości występowania działań niepożądanych związanych z hiperglikemią (w tym cukrzycy) lub nieprawidłowych wartości laboratoryjnych stężenia glukozy w porównaniu do placebo. Nie jest dostępna dokładna ocena ryzyka wystąpienia działań niepożądanych związanych z hiperglikemią, która pozwalałaby na dokonanie bezpośredniego porównania leczenia arypiprazolem i innymi atypowymi lekami przeciwpsychotycznymi.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
Pacjenci leczeni jakimikolwiek lekami przeciwpsychotycznymi, włącznie z arypiprazolem, powinni być obserwowani, czy nie występują u nich objawy podmiotowe i przedmiotowe związane z hiperglikemią (takie jak nadmierne pragnienie, wielomocz, nadmierny apetyt i osłabienie), a pacjenci z cukrzycą lub czynnikami ryzyka wystąpienia cukrzycy powinni być regularnie monitorowani pod względem pogorszenia kontroli glikemii (patrz punkt 4.8). Nadwrażliwość Podczas przyjmowania arypiprazolu mogą wystąpić reakcje nadwrażliwości charakteryzujące się objawami reakcji uczuleniowych (patrz punkt 4.8). Zwiększenie masy ciała Obserwowane u pacjentów ze schizofrenią i zaburzeniem afektywnym dwubiegunowym zwiększenie masy ciała jest zwykle spowodowane współistniejącymi chorobami, stosowaniem leków przeciwpsychotycznych, o których wiadomo, że powodują zwiększenie masy ciała, niewłaściwym stylem życia i może prowadzić do ciężkich powikłań.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
Po wprowadzeniu leku do obrotu obserwowano zwiększenie masy ciała u pacjentów otrzymujących arypiprazol. Jeśli występowało, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych arypiprazol nie powodował klinicznie istotnego zwiększenia masy ciała u dorosłych (patrz punkt 5.1). W badaniach klinicznych z udziałem młodzieży z zaburzeniem afektywnym dwubiegunowym wykazano, że stosowanie arypiprazolu ma związek ze zwiększeniem masy ciała po 4 tygodniach leczenia. U młodzieży z zaburzeniem afektywnym dwubiegunowym należy kontrolować przyrost masy ciała. Jeśli przyrost masy ciała jest znaczący klinicznie, należy rozważyć zmniejszenie dawki (patrz punkt 4.8). Dysfagia Ze stosowaniem leków przeciwpsychotycznych, w tym arypiprazolu, wiąże się spowolnienie motoryki przełyku i ryzyko aspiracji. Arypiprazol należy stosować ostrożnie u pacjentów z ryzykiem wystąpienia zachłystowego zapalenia płuc.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Podczas przyjmowania arypiprazolu u pacjentów mogą występować zwiększone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy obejmują: zwiększenie popędów seksualnych, kompulsywną potrzebę wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania. Ważne jest, aby lekarze przepisujący lek pytali pacjentów lub opiekunów w szczególności o pojawienie się nowego lub zwiększonego popędu do hazardu, popędów seksualnych, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa lub kompulsywnego objadania się, lub innych popędów podczas leczenia arypiprazolem. Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu leku.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Lekarz rozważy zmianę dawki lub odstawienie leku, jeśli u pacjenta wystąpią takie popędy podczas przyjmowania arypiprazolu (patrz punkt 4.8) Fruktoza Roztwór doustny zawiera fruktozę. Fruktoza może uszkadzać zęby. Pacjenci z dziedziczną nietolerancją fruktozy nie powinni przyjmować tego produktu leczniczego. Sacharoza Roztwór doustny zawiera sacharozę. Sacharoza może mieć szkodliwy wpływ na zęby. Pacjenci z rzadkimi dziedzicznymi zaburzeniami związanymi z nietolerancją fruktozy, zespołem złego wchłaniania glukozy-galaktozy lub niedoborem sacharazy-izomaltazy, nie powinni przyjmować produktu leczniczego. Parahydroksybenzoesany Roztwór doustny zawiera parahydroksybenzoesan metylu oraz parahydroksybenzoesan propylu. Lek może powodować reakcje alergiczne (możliwe reakcje typu późnego). Sód Roztwór doustny zawiera sód.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
Lek zawiera mniej niż 1 mmol (23 mg) sodu na jednostkę dawkowania, co oznacza, że uznaje się go za „wolny od sodu”. Pacjenci ze współistniejącym zespołem nadpobudliwości psychoruchowej (ang. attention deficit hyperactivity disorder , ADHD) Pomimo wysokiej częstości współistnienia zaburzenia afektywnego dwubiegunowego typu I oraz zespołu ADHD, dane dotyczące bezpieczeństwa jednoczesnego stosowania arypiprazolu oraz stymulantów są bardzo ograniczone; dlatego też należy zachować wyjątkową ostrożność w razie podawania tych produktów jednocześnie. Upadki Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków. Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na antagonistyczne działanie na receptor adrenergiczny α 1 , arypiprazol może nasilać działanie niektórych przeciwnadciśnieniowych produktów leczniczych. Ze względu na pierwotne działanie arypiprazolu na OUN, należy zachować ostrożność, jeśli arypiprazol jest podawany razem z alkoholem lub z innymi produktami leczniczymi działającymi na OUN, wywołującymi zbliżone działania niepożądane, takie jak sedacja (patrz punkt 4.8). Należy zachować ostrożność podając arypiprazol równocześnie z produktami leczniczymi, o których wiadomo, że powodują wydłużenie odstępu QT lub zaburzenia elektrolitowe. Możliwy wpływ innych produktów leczniczych na arypiprazol Antagonista receptora H 2 - famotydyna, lek hamujący uwalnianie kwasu żołądkowego, zmniejsza szybkość wchłaniania arypiprazolu, jednak działanie to nie ma znaczenia klinicznego.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlInterakcje
Arypiprazol jest metabolizowany na wiele sposobów, w tym także przez enzymy, takie jak CYP2D6 i CYP3A4. Nie jest jednak metabolizowany przez enzymy z grupy CYP1A, a więc nie jest konieczne stosowanie specjalnych dawek u palaczy tytoniu. Chinidyna i inne silne inhibitory CYP2D6 Wyniki badań klinicznych z udziałem zdrowych osób wykazały, że silny inhibitor enzymu CYP2D6 (chinidyna) zwiększa wartość AUC arypiprazolu o 107%, podczas gdy wartość C max nie zmienia się. Wartości AUC i C max dehydroarypiprazolu, aktywnego metabolitu, były zmniejszone odpowiednio o 32% i 47%. W przypadku jednoczesnego podawania chinidyny i arypiprazolu, należy zmniejszyć dawkę arypiprazolu o około połowę w stosunku do przepisanej dawki. Inne silne inhibitory grupy enzymów CYP2D6, takie jak fluoksetyna i paroksetyna, mogą powodować podobne skutki i w takich sytuacjach należy podobnie zmniejszyć dawkę leku.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlInterakcje
Ketokonazol i inne silne inhibitory CYP3A4 Wyniki badań klinicznych z udziałem zdrowych osób wskazują, że silny inhibitor CYP3A4 (ketokonazol) zwiększa wartości AUC i C max arypiprazolu odpowiednio o 63% i 37%, zaś wartości AUC i C max dehydroarypiprazolu odpowiednio o 77% i 43%. W grupie osób o obniżonej aktywności CYP2D6, równoczesne stosowanie silnych inhibitorów CYP3A4 może powodować zwiększenie stężenia arypiprazolu w osoczu, w porównaniu do osób o podwyższonej aktywności CYP2D6. W przypadku jednoczesnego stosowania ketokonazolu albo innych silnych inhibitorów CYP3A4 z arypiprazolem, zakładane korzyści powinny przeważyć potencjalne ryzyko dla pacjenta. W przypadku jednoczesnego stosowania ketokonazolu z arypiprazolem, przepisaną dawkę arypiprazolu należy zmniejszyć o około połowę. Inne leki silnie hamujące aktywność CYP3A4, takie jak itrakonazol oraz inhibitory proteazy HIV, mogą powodować podobne skutki jak ketokonazol i w takich przypadkach należy podobnie zmniejszyć dawkę (patrz punkt 4.2).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlInterakcje
Po odstawieniu inhibitora CYP2D6 lub CYP3A4, dawkę arypiprazolu należy zwiększyć do tej, jaką stosowano przed rozpoczęciem terapii skojarzonej. W czasie równoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazemu) lub CYP2D6 (np. escytalopramu) z arypiprazolem, można spodziewać się niewielkiego zwiększenia stężenia arypiprazolu w osoczu. Karbamazepina i inne leki indukujące CYP3A4 Po jednoczesnym podaniu karbamazepiny, leku silnie indukującego CYP3A4 w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnie geometryczne wartości C max i AUC arypiprazolu zmniejszyły się odpowiednio o 68% i 73%, w stosunku do wartości tych parametrów podczas stosowania arypiprazolu (30 mg) w monoterapii. Podobnie, w przypadku dehydroarypiprazolu średnie geometryczne wartości C max i AUC po jednoczesnym podaniu karbamazepiny zmniejszają się odpowiednio o 69% i 71%, w stosunku do ich wartości podczas stosowania arypiprazolem w monoterapii.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlInterakcje
Zatem dawkę arypiprazolu należy podwoić, gdy jednocześnie podaje się go z karbamazepiną. Można się spodziewać, że jednoczesne podawanie arypiprazolu i innych leków silnie indukujących CYP3A4 (takich jak ryfampicyna , ryfabutyna, fenytoina, fenobarbital, prymidon, efawirenz, newirapina i ziele dziurawca) może działać podobnie i dlatego należy podobnie zwiększyć dawkę. Po zakończeniu podawania leku silnie indukującego CYP3A4, należy zmniejszyć dawkę arypiprazolu do zalecanej. Walproinian i lit Skojarzone stosowanie walproinianów lub litu z arypiprazolem nie powodowało żadnych istotnych klinicznie zmian stężenia arypiprazolu i w związku z tym nie jest konieczne dostosowanie dawki podczas podawania walproinianu lub litu w skojarzeniu z arypiprazolem. Możliwy wpływ arypiprazolu na inne produkty lecznicze W czasie badań klinicznych, dawki arypiprazolu od 10 mg na dobę do 30 mg na dobę nie wywierały istotnego wpływu na metabolizm substratów CYP2D6 (stosunek dekstrometorfan/3- metoksymorfinan), CYP2C9 (warfaryna), CYP2C19 (omeprazol) i CYP3A4 (dekstrometorfan).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlInterakcje
Ponadto w warunkach in vitro , arypiprazol i dehydroarypiprazol nie zmieniały metabolizmu zachodzącego z udziałem CYP1A2. Istnieje zatem małe prawdopodobieństwo wystąpienia istotnych klinicznie interakcji między produktami leczniczymi metabolizowanymi przez te enzymy. Kiedy arypiprazol był podawany z walproinianem, litem lub lamotryginą nie stwierdzono klinicznie istotnej zmiany w stężeniach walproinianu, litu lub lamotryginy. Zespół serotoninowy Obserwowano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol, a możliwe objawy przedmiotowe oraz podmiotowe dla tego stanu mogą wystąpić szczególnie w przypadku jednoczesnego stosowania innych leków serotoninergicznych, takich jak SSRI/SNRI (selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny) lub leków, o których wiadomo, że zwiększają stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie przeprowadzono dotychczas odpowiednich badań z grupą kontrolną otrzymującą placebo dotyczących działania arypiprazolu u kobiet w ciąży. Notowano występowanie wad wrodzonych, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. Na podstawie wyników badań przeprowadzonych na zwierzętach nie można wykluczyć potencjalnego toksycznego wpływu leku na płód (patrz punkt 5.3). Pacjentki należy poinformować o konieczności powiadomienia swojego lekarza, jeśli w trakcie leczenia arypiprazolem zajdą w ciąże lub planują zajście w ciążę. Ze względu na niewystarczające dane dotyczące bezpieczeństwa u ludzi oraz budzące wątpliwości wyniki badań wpływu na rozród na zwierzętach, ten lek nie może być stosowany w okresie ciąży, chyba że spodziewane korzyści wyraźnie przewyższają potencjalne ryzyko dla płodu.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWpływ na płodność, ciążę i laktację
Noworodki narażone na działanie leków przeciwpsychotycznych (w tym arypiprazolu) w czasie trzeciego trymestru ciąży są w grupie ryzyka, w której mogą wystąpić działania niepożądane, w tym zaburzenia pozapiramidowe i (lub) objawy odstawienne, które po porodzie mogą różnić się ciężkością przebiegu oraz czasem trwania. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być uważnie monitorowane (patrz punkt 4.8). Karmienie piersią Arypiprazol/metabolity przenikają do mleka ludzkiego. Należy podjąć decyzję czy przerwać karmienie piersią, czy przerwać podawanie arypiprazolu biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem na reprodukcję.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe (sedacja), senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Najczęściej notowanymi działaniami niepożądanymi w badaniach prowadzonych z grupą kontrolną otrzymującą placebo były akatyzja i nudności, każde występujące częściej niż u 3% pacjentów leczonych arypiprazolem podawanym doustnie. Tabelaryczne zestawienie działań niepożądanych Częstość występowania działań niepożądanych związanych z leczeniem arypiprazolem podano w poniższej tabeli. Dane w tabeli oparto na działaniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układ/narząd i częstości: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000); nie znana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDziałania niepożądane
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Nie można określić częstości działań niepożądanych zgłaszanych po wprowadzeniu do obrotu, ponieważ pochodzą one ze spontanicznych zgłoszeń. Z tego względu częstość takich działań niepożądanych określono jako „nieznana”.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia krwii układu chłonnego LeukopeniaNeutropenia Trombocytopenia Zaburzenia układu immunologicznego Reakcje uczuleniowe (np. reakcja anafilaktyczna, obrzęk naczynioruchowy obejmujący obrzęk języka, obrzęk twarzy,świąd alergiczny lub pokrzywkę) Zaburzenia endokrynologiczne Hiperprolaktynemia Zmniejszenie stężenia prolaktynywe krwi Cukrzycowa śpiączka hiperosmolarnaCukrzycowa kwasica ketonowa Zaburzenia metabolizmu iodżywiania Cukrzyca Hiperglikemia Hiponatremia Anoreksja Zaburzenia psychiczne Bezsenność LękNiepokój, zwł. ruchowy Depresja Hiperseksualność Próby samobójcze, myśli samobójcze i dokonane samobójstwa (patrz punkt 4.4) Patologiczne uzależnienie od hazarduZaburzenie kontroli impulsów ObżarstwoKompulsywna potrzeba wydawania pieniędzy Poriomania Zachowania agresywne Nadmierne pobudzenieNerwowość - CHPL leku Abilify, roztwór doustny, 1 mg/mlDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia układu nerwowego Akatyzja Zaburzenia pozapiramidowe DrżenieBóle głowy Sedacja SennośćZawroty głowy Późne dyskinezy DystoniaZespół„niespokojnych nóg” Złośliwy zespół neuroleptyczny Drgawki typu grand mal Zespół serotoninowy Zaburzenia mowy Zaburzenia oka Niewyraźne widzenie Podwójne widzenie Światłowstręt(fotofobia) Napad przymusowego patrzenia z rotacją gałek ocznych Zaburzenia serca Tachykardia Nagły zgon niewyjaśniony Torsades de pointes Arytmia komorowaZatrzymanie akcji serca Bradykardia Zaburzenia naczyniowe Hipotensja ortostatyczna Choroba zakrzepowo-zatorowa żył (w tym zator płucny i zakrzepica żył głębokich) Nadciśnienie tętniczeOmdlenia Zaburzenia układu oddechowego, klatki piersiowej iśródpiersia Czkawka Zachłystowe zapalenie płuc Skurcz krtaniSkurcz części ustnej gardła Zaburzenia żołądka i jelit Zaparcia Niestrawność Nudności Nadmierne wydzielanie ślinyWymioty Zapalenie trzustki Dysfagia BiegunkaDyskomfort w jamie brzusznej Dyskomfort w obrębie żołądka Zaburzenia wątroby i drógżółciowych Niewydolność wątroby Zapalenie wątrobyŻółtaczka Zaburzenia skóry i tkanki podskórnej WysypkaReakcja fotoalergiczna ŁysienieNadmierne pocenie sięWysypka polekowa z eozynofilią i objawami ogólnoustrojowymi(zespół DRESS) Zaburzenia mięśniowo- szkieletowe itkanki łącznej Rozpad mięśni poprzecznie prążkowanych (rabdomioliza) Bóle mięśnioweSztywność Zaburzenia nereki dróg moczowych Nietrzymanie moczu Zatrzymanie moczu Ciąża, połóg iokresokołoporodowy Zespół abstynencyjny u noworodków (patrz punkt 4.6) Zaburzenia układu rozrodczego ipiersi Priapizm - CHPL leku Abilify, roztwór doustny, 1 mg/mlDziałania niepożądane
Często Niezbyt często Nieznana Zaburzenia ogólne i stany w miejscu podania Zmęczenie Zaburzenia regulacji temperatury (np. hipotermia, gorączka)Ból w klatce piersiowej Obrzęk obwodowy Badania Zmniejszenie masy ciała diagnostyczne Zwiększenie masy ciała Zwiększenie aktywności aminotransferazy alaninowej Zwiększenie aktywności aminotransferazy asparaginianowej Zwiększenie aktywności gammaglutamylotransferazy Zwiększenie aktywności fosfatazy alkalicznej Wydłużenie odstępu QT Zwiększenie stężenia glukozy we krwi Zwiększenie stężenia glikozylowanej hemoglobiny Wahania stężenia glukozy we krwi Zwiększona aktywność fosfokinazy kreatynowej - CHPL leku Abilify, roztwór doustny, 1 mg/mlDziałania niepożądane
Opis wybranych działań niepożądanych Dorośli Objawy pozapiramidowe (ang. EPS) Schizofrenia: w długookresowym 52-tygodniowym badaniu prowadzonym z grupą kontrolną, u pacjentów leczonych arypiprazolem ogólnie rzadziej występowały EPS (25,8%), w tym parkinsonizm, akatyzja, dystonia i dyskineza, w porównaniu do pacjentów leczonych haloperydolem (57,3%). W długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, częstość występowania EPS wynosiła 19% w przypadku pacjentów leczonych arypiprazolem i 13,1% w przypadku pacjentów otrzymujących placebo. W innym długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną częstość występowania EPS wynosiła 14,8% w przypadku pacjentów leczonych arypiprazolem i 15,1% w przypadku pacjentów otrzymujących olanzapinę. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I: w 12- tygodniowym badaniu prowadzonym z grupą kontrolną przypadki EPS stwierdzano u 23,5% pacjentów leczonych arypiprazolem i u 53,3% pacjentów leczonych haloperydolem.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDziałania niepożądane
W innym 12- tygodnowym badaniu przypadki EPS stwierdzano u 26,6% pacjentów leczonych arypiprazolem i u 17,6% pacjentów leczonych litem. W długookresowym 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo podczas fazy leczenia podtrzymującego przypadki EPS wystąpiły u 18,2% pacjentów leczonych arypiprazolem i u 15,7% pacjentów otrzymujących placebo. Akatyzja W badaniach prowadzonych z grupą kontrolną otrzymującą placebo przypadki akatyzji u pacjentów z zaburzeniami afektywnymi dwubiegunowymi występowały u 12,1% pacjentów leczonych arypiprazolem i u 3,2% pacjentów otrzymujących placebo. U pacjentów ze schizofrenią liczba przypadków akatyzji wynosiła 6,2% w grupie arypiprazolu i 3,0% w grupie placebo. Dystonia Efekt klasy terapeutycznej: objawy dystonii, długotrwałe nieprawidłowe skurcze grup mięśni, mogą występować u wrażliwych pacjentów w ciągu pierwszych kilku dni leczenia.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDziałania niepożądane
Do objawów dystonii należą: skurcze mięśni szyi, czasami postępujące do ucisku w gardle, trudności z przełykaniem, trudności z oddychaniem i (lub) zaburzenia ruchów języka. Chociaż objawy te mogą występować po zastosowaniu małych dawek, występują częściej i o większym nasileniu podczas stosowania leków przeciwpsychotycznych pierwszej generacji o dużych mocach i w większych dawkach. Obserwowano zwiększone ryzyko ostrej dystonii u mężczyzn i w młodszych grupach wiekowych. Prolaktyna Podczas badań klinicznych w zakresie zarejestrowanych wskazań i po wprowadzeniu produktu leczniczego do obrotu u pacjentów otrzymujących arypiprazol obserwowano zarówno zwiększenie, jak i zmniejszenie stężenia prolaktyny w surowicy w porównaniu do pomiarów początkowych (punkt 5.1). Parametry laboratoryjne Porównania pomiędzy arypiprazolem i placebo dotyczące odsetka pacjentów, u których wystąpiły potencjalnie istotne zmiany rutynowych parametrów laboratoryjnych i lipidowych (patrz punkt 5.1), nie wykazały medycznie istotnych różnic (patrz punkt 5.1).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDziałania niepożądane
Ogólnie przejściowe i bezobjawowe zwiększenie aktywności CPK (fosfokinazy kreatynowej) obserwowano u 3,5% pacjentów leczonych arypiprazolem w porównaniu do 2,0% pacjentów otrzymujących placebo. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej W krótkoterminowym badaniu z kontrolą placebo, w którym udział wzięło 302 nastolatków (od 13 do 17 lat) chorych na schizofrenię, częstość występowania i rodzaj reakcji niepożądanych były podobne do występujących u dorosłych, z wyjątkiem następujących działań niepożądanych zgłaszanych częściej u nastolatków otrzymujących arypiprazol niż u dorosłych otrzymujących arypiprazol (i częściej niż placebo): Senność/sedacja i zaburzenia pozapiramidowe były zgłaszane bardzo często (≥1/10), oraz suchość w jamie ustnej, zwiększony apetyt, niedociśnienie ortostatyczne były zgłaszane często (≥1/100, <1/10).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDziałania niepożądane
Profil bezpieczeństwa w 26-tygodniowym badaniu prowadzonym na zasadzie próby otwartej, był podobny do obserwowanego w badaniu krótkoterminowym z kontrolą placebo. Profil bezpieczeństwa w długoterminowym badaniu prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo był podobny z wyjątkiem następujących reakcji, które były zgłaszane częściej, niż w grupie dzieci i młodzieży przyjmujących placebo: często zgłaszano zmniejszenie masy ciała, zwiększenie stężenia insuliny we krwi, arytmię i leukopenię (≥1/100, <1/10). W zebranej populacji nastolatków (od 13 do 17 lat) chorych na schizofrenię, leczonych do 2 lat, przypadki małego stężenia prolaktyny w surowicy stwierdzono u 29,5% dziewcząt (<3 ng/ml) i 48,3% chłopców (<2 ng/ml). W grupie młodzieży (w wieku od 13 do 17 lat) ze schizofrenią, otrzymującej dawki arypiprazolu od 5 mg do 30 mg przez okres maksymalnie do 72 miesięcy, częstość występowania niskich stężeń prolaktyny w surowicy u kobiet (<3 ng/ml) i u mężczyzn (<2 ng/ml) wynosiła odpowiednio 25,6% i 45,0%.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDziałania niepożądane
Podczas dwóch długoterminowych badań z udziałem młodzieży (od 13 do 17 lat) ze schizofrenią i pacjentów z chorobą afektywną dwubiegunową leczonych arypiprazolem, częstość występowania małych stężeń prolaktyny w surowicy u kobiet (<3 ng/ml) i mężczyzn (<2 ng/ml) wynosiła odpowiednio 37,0% i 59,4%. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej Częstość występowania i rodzaj reakcji niepożądanych u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I były podobne do występujących u dorosłych, z wyjątkiem następujących działań niepożądanych: senność (23,0%), zaburzenia pozapiramidowe (18.4%), akatyzja (16.0%) i zmęczenie (11.8%) były zgłaszane bardzo często (≥1/10); natomiast ból w górnej części brzucha, zwiększenie częstości akcji serca, zwiększenie masy ciała, zwiększenie apetytu, drżenie mięśni oraz dyskineza były zgłaszane często (≥1/100, <1/10).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDziałania niepożądane
Następujące reakcje niepożądane miały prawdopodobnie związek z zastosowaną dawką: zaburzenia pozapiramidowe (częstość występowania w przypadku dawki 10 mg wynosiła 9,1%; w przypadku dawki 30 mg 28,8%; w przypadku placebo 1,7%); i akatyzja (częstość występowania w przypadku dawki 10 mg wynosiła 12,1%; w przypadku dawki 30 mg 20,3%; w przypadku placebo 1,7%). Średnie zmiany masy ciała u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I po 12. oraz 30. tygodniu wynosiły odpowiednio w przypadku arypiprazolu 2,4 kg oraz 5,8 kg, a w przypadku placebo 0,2 kg oraz 2,3 kg. W populacji dzieci i młodzieży senność oraz zmęczenie obserwowano częściej u pacjentów z zaburzeniem afektywnym dwubiegunowym, w porównaniu do pacjentów ze schizofrenią. W populacji dzieci i młodzieży z zaburzeniem afektywnym dwubiegunowym (od 10 do 17 lat), leczonych do 30 tygodni, przypadki małego stężenia prolaktyny w surowicy stwierdzono u 28,0% dziewcząt (<3 ng/ml) i 53,3% chłopców (<2 ng/ml).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDziałania niepożądane
Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Patologiczne uzależnienie od hazardu, hiperseksualność, kompulsywna potrzeba wydawania pieniędzy i obżarstwo lub kompulsywne objadanie się mogą wystąpić u pacjentów leczonych arypiprazolem (patrz punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania wymienionego w załączniku V .
- CHPL leku Abilify, roztwór doustny, 1 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy przedmiotowe i podmiotowe W badaniach klinicznych i po wprowadzeniu produktu do obrotu przypadkowe bądź zamierzone przedawkowanie samego arypiprazolu stwierdzono u dorosłych pacjentów po oszacowanej dawce do 1260 mg niezakończone zgonem. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: letarg, wzrost ciśnienia tętniczego krwi, senność, przyspieszona czynność serca (tachykardia), nudności, wymioty i biegunka. Ponadto zgłaszano przypadkowe przedawkowanie samego arypiprazolu (do 195 mg) u dzieci, bez zgonów. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: senność, przejściowa utrata świadomości i objawy pozapiramidowe. Postępowanie po przedawkowaniu W przypadku przedawkowania leku stosuje się leczenie podtrzymujące, polegające na utrzymaniu drożności dróg oddechowych, dotlenianiu i wentylacji oraz leczeniu objawowym. Należy wziąć pod uwagę możliwość wpływu wielu produktów leczniczych.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlPrzedawkowanie
Z tego względu należy niezwłocznie rozpocząć monitorowanie czynności układu krążenia, obejmujące stałe monitorowanie zapisu elektrokardiograficznego, w celu wykrycia możliwych zaburzeń rytmu serca. W przypadku potwierdzonego lub podejrzewanego przedawkowania arypiprazolu należy objąć pacjenta ścisłą kontrolą i obserwować go do czasu poprawy jego stanu. Aktywowany węgiel (50 g), podany w godzinę po zażyciu arypiprazolu, obniża wartość C max leku o około 41%, a wartość AUC o około 51%, co wskazuje na jego skuteczność w leczeniu przedawkowania. Hemodializa Pomimo że brak informacji dotyczących wpływu hemodializ w leczeniu przedawkowania arypiprazolu, to jednak istnieje małe prawdopodobieństwo, by hemodializy były użyteczne w takich przypadkach, ze względu na znaczny stopień wiązania arypiprazolu z białkami osocza.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12 Mechanizm działania Uważa się, że skuteczność arypiprazolu w leczeniu schizofrenii i zaburzenia afektywnego dwubiegunowego typu I jest związana ze skojarzonym działaniem częściowo agonistycznym w stosunku do receptora dopaminowego D 2 i serotoninowego 5-HT 1A oraz antagonistycznym w stosunku do receptora serotoninowego 5-HT 2A . Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D 2 i D 3 , serotoninowych 5-HT 1A i 5-HT 2A oraz umiarkowane powinowactwo do receptorów dopaminowych D 4 , serotoninowych 5-HT 2C i 5-HT 7 , a także adrenergicznych alfa-1 i histaminowych H 1 .
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Arypiprazol w dawkach od 0,5 mg do 30 mg, podawany raz na dobę przez 2 tygodnie osobom zdrowym powoduje zależne od dawki zmniejszenie wiązania rakloprydu znakowanego 11 C, ligandu receptora D 2 /D 3 , w jądrze ogoniastym i skorupie, co można wykryć za pomocą pozytonowej tomografii emisyjnej. Skuteczność kliniczna i bezpieczeństwo stosowania Dorośli Schizofrenia Wyniki trzech krótkoterminowych badań (od 4 do 6 tygodni) z grupą kontrolną otrzymującą placebo, w których udział wzięło 1 228 dorosłych chorych na schizofrenię, u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Arypiprazol jest skuteczny w podtrzymywaniu poprawy klinicznej podczas kontynuacji leczenia u tych dorosłych pacjentów, u których obserwowano wstępną dobrą reakcję na lek. W badaniu z grupą kontrolną przyjmującą haloperydol, odsetek pacjentów, u których udało się utrzymać dobrą reakcję na produkt leczniczy, w ciągu 52 tygodni był podobny w obu grupach (arypiprazol 77% i haloperydol 73%). Badanie ukończyła istotnie większa grupa pacjentów leczonych arypiprazolem (43%) niż haloperydolem (30%). Wyniki uzyskane w skalach ocen stosowanych jako drugorzędowe punkty końcowe skuteczności, w tym w skali PANSS i w skali oceny depresji Montgomery-Asberg [ang. Montgomery–Åsberg-Depression-Rating-Scale, MADRS], wskazują na istotną poprawę w stosunku do haloperydolu. W trwającym 26 tygodni badaniu prowadzonym z grupą kontrolną otrzymującą placebo, z udziałem pacjentów dorosłych z ustabilizowaną przewlekłą schizofrenią stwierdzono w wyniku leczenia arypiprazolem większe zmniejszenie częstości nawrotów, 34% w grupie leczonych arypiprazolem i 57% w grupie otrzymującej placebo.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Przyrost masy ciała Wyniki badań klinicznych wskazują, że arypiprazol nie powoduje klinicznie istotnego przyrostu masy ciała. W trwającym 26 tygodni badaniu z grupą kontrolną leczonych olanzapiną i wykorzystaniem podwójnie ślepej próby, przeprowadzonym w wielu krajach, udział wzięło 314 dorosłych pacjentów ze schizofrenią. Pierwszorzędowym punktem końcowym była ocena przyrostu masy ciała. U istotnie mniejszej liczby pacjentów leczonych arypiprazolem w porównaniu z otrzymującymi olanzapinę, stwierdzono przyrost masy ciała o co najmniej 7% w porównaniu z pomiarem początkowym (tzn. przyrost masy ciała o co najmniej 5,6 kg przy średniej początkowej masie wynoszącej ok. 80,5 kg) w grupie leczonych arypiprazolem (n = 18 lub 13% pacjentów nadających się do oceny), w porównaniu z grupą otrzymującą olanzapinę (n = 45 lub 33% pacjentów nadających się do oceny).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Stężenia lipidów W zbiorczej analizie wyników stężeń lipidów pochodzących z badań klinicznych prowadzonych z grupą kontrolną otrzymującą placebo u dorosłych, arypiprazol nie powodował klinicznie istotnych zmian stężeń cholesterolu całkowitego, triglicerydów, cholesterolu frakcji lipoprotein o dużej gęstości (HDL) i cholesterolu frakcji lipoprotein o małej gęstości (LDL). Prolaktyna Stężenia prolaktyny oceniono podczas wszystkich badań z zastosowaniem wszystkich dawek arypiprazolu (n = 28 242). Częstość występowania hiperprolaktynemii lub zwiększenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem (0,3%) była podobna do częstości występowania hiperprolaktynemii w grupie otrzymującej placebo (0,2%). U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia hiperprolaktynemii wynosiła 42 dni, a mediana czasu trwania wynosiła 34 dni.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Częstość występowania hiperprolaktynemii lub zmniejszenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem wynosiła 0,4% w porównaniu do 0,02% w grupie otrzymującej placebo. U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 30 dni, a mediana czasu trwania wynosiła 194 dni. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I W dwóch 3-tygodniowych badaniach, prowadzonych z grupą kontrolną otrzymującą placebo, z zastosowaniem zmiennej dawki, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol był znacząco bardziej skuteczny niż placebo w zmniejszaniu objawów maniakalnych w ciągu 3 tygodni. Badania te obejmowały pacjentów z objawami lub bez objawów psychotycznych oraz pacjentów z szybką zmianą fazy lub bez szybkiej zmiany fazy (przebieg typu rapid-cycling).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
W jednym 3-tygodniowym badaniu, prowadzonym z grupą kontrolną otrzymującą placebo, z zastosowaniem stałej dawki w monoterapii, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol nie wykazał większej skuteczności niż placebo. W dwóch 12-tygodniowych badaniach, prowadzonych z grupą kontrolną otrzymującą placebo oraz inne substancje czynne, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, arypiprazol był skuteczniejszy niż placebo w 3. tygodniu badania, a wynik leczenia podtrzymującego był w 12. tygodniu badania porównywalny z wynikiem dla litu lub haloperydolu. W 12. tygodniu arypiprazol powodował także remisję objawów maniakalnych u porównywalnej liczby pacjentów co lit lub haloperydol.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
W 6-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, którzy częściowo nie reagowali na monoterapię litem lub walproinianem przez 2 tygodnie przy terapeutycznych stężeniach w surowicy, zastosowanie arypiprazolu jako dodatkowego leku w większym stopniu zwiększyło skuteczność zapobiegania objawom maniakalnym niż stosowanie litu lub walproinianu w monoterapii. W 26-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, które przedłużono o 74 tygodnie, u pacjentów z objawami maniakalnymi, którzy osiągnęli remisję w trakcie stosowania arypiprazolu w czasie fazy stabilizacji przed randomizacją, arypiprazol był bardziej skuteczny niż placebo w zapobieganiu nawrotowi chorobie dwubiegunowej, głównie w zapobieganiu nawrotowi objawów maniakalnych, ale nie wykazał przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
W 52-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, u pacjentów z obecnym epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, którzy osiągnęli trwałą remisję (w skali oceny manii Younga [ang. Young Mania Rating Scale, YMRS] oraz w skali oceny depresji MADRS z całkowitą ilością punktów ≤ 12) w trakcie stosowania arypiprazolu (w dawce od 10 mg na dobę do 30 mg na dobę) w skojarzeniu z litem lub walproinianem przez 12 kolejnych tygodni, połączenie z arypiprazolem wykazało przewagę nad placebo w zapobieganiu nawrotowi choroby afektywnej dwubiegunowej zmniejszając ryzyko o 46% (współczynnik ryzyka 0,54) i w zapobieganiu nawrotom manii zmniejszając ryzyko o 65% (współczynnik ryzyka 0,35), ale nie wykazało przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Zastosowanie arypiprazolu jako dodatkowego leku wykazało przewagę wobec placebo w przypadku drugorzędowego pomiaru wyniku leczenia w ocenach ogólnego wrażenia klinicznego w wersji dla ChAD (ang. Clinical Global Impression - Bipolar version, CGI-BP) nasilenia choroby (mania) (ang. Severity of illness , SOI [mania]). W tym badaniu, pacjenci zostali przydzieleni przez badaczy do badania prowadzonego metodą próby otwartej, z zastosowaniem litu lub walproinianu w monoterapii, w celu oceny częściowego braku odpowiedzi. Pacjenci byli stabilizowani przez co najmniej 12 kolejnych tygodni za pomocą skojarzenia arypiprazolu i stosowanego wcześniej stabilizatora nastroju. Pacjenci stabilni byli następnie losowo przydzielani do grupy kontynuującej stosowanie tego samego stabilizatora nastroju z arypiprazolem lub placebo w badaniu metodą podwójnie ślepej próby.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
W fazie randomizowanej oceniano cztery podgrupy stabilizatora nastroju: arypiprazol + lit; arypiprazol + walproinian; placebo + lit; placebo + walproinian. Odsetki Kaplana- Meiera dla nawrotu jakiegokolwiek zaburzenia nastroju w przypadku zastosowania dodatkowego leku były następujące: 16% w grupie stosującej arypiprazol + lit i 18% w grupie stosującej arypiprazol + walproinian, w porównaniu do 45% w grupie stosującej placebo + lit i 19% w grupie stosującej placebo + walproinian. Populacja dzieci i młodzieży Schizofrenia u młodzieży Wyniki 6-tygodniowego badania z grupą kontrolną otrzymującą placebo, w którym udział wzięło 302 nastoletnich pacjentów chorych na schizofrenię (od 13 do 17 lat), u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje statystycznie istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
W czasie trwania 26-tygodniowego badania prowadzonego metodą otwartej próby w analizie podgrupy nastoletnich pacjentów w wieku od 15 do 17 lat obserwowano utrzymywanie się działania u 74% całkowitej populacji włączonej do badania. W badaniu z randomizacją, prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo, trwającym od 60 do 89 tygodni, które prowadzono z udziałem młodzieży ze schizofrenią (n = 146; w wieku od 13 do 17 lat) występowała statystycznie znamienna różnica w zakresie odsetka nawrotów objawów psychotycznych pomiędzy grupą otrzymującą arypiprazol (19,39%) a grupą otrzymującą placebo (37,5%). Punkt szacunkowy współczynnika ryzyka (HR) w całej populacji wynosił 0,461 (95% przedział ufności, od 0,242 do 0,879). W analizach w podgrupach punkt szacunkowy współczynnika ryzyka wynosił 0,495 wśród uczestników w wieku od 13 do 14 lat w porównaniu do 0,454 wśród uczestników w wieku od 15 do 17 lat.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Jednak ocena szacunkowa współczynnika ryzyka w grupie młodszych uczestników (od 13 do 14 lat) nie była precyzyjna, odzwierciedlając mniejszą liczebność uczestników w tej grupie (arypiprazol, n = 29; placebo, n = 12) i przedział ufności dla tej oceny szacunkowej (wynoszący od 0,151 do 1,628) uniemożliwiał wyciągnięcie wniosków odnośnie występowania wyniku leczenia. Natomiast 95% przedział ufności dla współczynnika ryzyka w podgrupie starszych uczestników (arypiprazol, n = 69; placebo, n = 36) wynosił od 0,242 do 0,879 i dlatego można wyciągnąć wnioski odnośnie wyników leczenia u starszych pacjentów. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u dzieci i młodzieży Arypiprazol badano w 30-tygodniowym badaniu prowadzonym z grupą kontrolną otrzymującą placebo, w którym udział wzięło 296 dzieci i młodzieży (od 10 do 17 lat), którzy spełnili kryteria diagnostyczne według DSM-IV (ang.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Diagnostic and Statistical Manual of Mental Disorders ) dla zaburzenia afektywnego dwubiegunowego typu I z epizodami maniakalnymi lub mieszanymi z objawami psychotycznymi lub bez tych objawów oraz wyjściowo mieli wynik ≥20 w skali manii według Younga (Y-MRS). Wśród pacjentów włączonych do podstawowej analizy skuteczności, 139 pacjentów miało postawioną diagnozę aktualnie współistniejącego ADHD. Arypiprazol wykazał przewagę w stosunku do placebo w odniesieniu do zmiany wartości wyjściowej w 4. oraz 12. tygodniu jako wynik całościowy wg Y-MRS. W analizie post-hoc przewaga nad placebo była bardziej wyraźna u pacjentów ze współistniejącym zespołem ADHD w porównaniu do pacjentów bez ADHD, gdzie nie zaobserwowano różnicy w stosunku do placebo. Zapobieganie nawrotom nie zostało określone. Do najczęstszych zdarzeń niepożądanych występujących w trakcie leczenia, wśród pacjentów otrzymujących dawkę 30 mg, były zaburzenia pozapiramidowe (28,3%), senność (27,3%), ból głowy (23,2%) oraz nudności (14,1%).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Średni przyrost masy ciała w 30-tygodniowm okresie leczenia wynosił 2,9 kg, w porównaniu do 0,98 kg u pacjentów, u których stosowano placebo. Drażliwość związana z zaburzeniami autystycznymi u dzieci i młodzieży (patrz punkt 4.2) U pacjentów w wieku od 6 do 17 lat arypiprazol badano w dwóch 8-tygodniowych badaniach prowadzonych z grupą kontrolną otrzymującą placebo [w jednym badaniu stosowano zmienną dawkę (od 2 mg na dobę do 15 mg na dobę), a w drugim stałą dawkę (5 mg na dobę, 10 mg na dobę lub 15 mg na dobę)] oraz jednym 52-tygodniowym badaniu otwartym. Dawkowanie w tych badaniach rozpoczynano od dawki 2 mg na dobę, po tygodniu zwiększanej do 5 mg na dobę, a następnie zwiększanej w odstępach tygodniowych o 5 mg na dobę do czasu osiągnięcia dawki docelowej. Ponad 75% pacjentów miało mniej niż 13 lat. Arypiprazol wykazał statystycznie większą skuteczność w porównaniu do placebo w podskali dotyczącej drażliwości Listy Zachowań Aberracyjnych (ang.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Aberrant Behaviour Checklist Irritability subscale ). Jednakże, nie ustalono znaczenia klinicznego tej obserwacji. Profil bezpieczeństwa obejmował przyrost masy ciała i zmianę stężenia prolaktyny. Czas trwania długoterminowego badania dotyczącego bezpieczeństwa był ograniczony do 52-tygodni. W zebranych badaniach, częstość występowania małego stężenia prolaktyny u dziewcząt (<3 ng/ml) i u chłopców (<2 ng/ml) leczonych arypiprazolem wynosiła odpowiednio, 27/46 (58,7%) i 258/298 (86,6%). W badaniach prowadzonych z grupą kontrolną otrzymującą placebo średni przyrost masy ciała wynosił 0,4 kg w grupie placebo i 1,6 kg w grupie arypiprazolu. Arypiprazol badano także w długoterminowym badaniu leczenia podtrzymującego, prowadzonym z grupą kontrolną otrzymującą placebo. Po od 13- do 26-tygodniowej stabilizacji z zastosowaniem arypiprazolu (w dawkach od 2 mg na dobę do 15 mg na dobę), pacjenci z trwałą odpowiedzią albo kontynuowali leczenie arypiprazolem, albo otrzymywali placebo przez kolejne 16 tygodni.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Odsetki Kaplana-Meiera dla nawrotu w tygodniu 16. były następujące: 35% dla grupy stosującej arypiprazol oraz 52% dla grupy placebo; współczynnik ryzyka nawrotu w 16 tygodniu (arypiprazol/placebo) wynosił 0,57 (różnica nieistotna statystycznie). Średni przyrost masy ciała w fazie stabilizacji (do 26 tygodni) w grupie otrzymującej arypiprazol wynosił 3,2 kg, natomiast w drugiej fazie badania (16 tygodni) obserwowano dalszy średni wzrost o 2,2 kg w grupie otrzymującej arypiprazol w porównaniu do 0,6 kg w grupie placebo. Objawy pozapiramidowe były zgłaszane głównie w fazie stabilizacji, u 17% pacjentów, z drgawkami stanowiącymi 6,5%. Tiki związane z zespołem Tourette’a u dzieci i młodzieży (patrz punkt 4.2) Skuteczność arypiprazolu badano u dzieci i młodzieży z zespołem Tourette’a (arypiprazol: n = 99, placebo: n = 44) w trwającym 8 tygodni, randomizowanym badaniu prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo w schemacie leczenia w grupach z użyciem stałej dawki zależnej od masy ciała od 5 mg na dobę do 20 mg na dobę i dawki początkowej wynoszącej 2 mg.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Pacjenci byli w wieku od 7 do 17 lat i przed rozpoczęciem leczenia uzyskali średni wynik 30 na łącznej skali tików w Globalnej Skali Nasilenia Tików z Yale ( Total Tic Score on the Yale Global Tic Severity Scale , TTS-YGTSS). Grupa pacjentów otrzymująca arypiprazol wykazywała poprawę mierzoną zmianą wyniku na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 8 tygodniu leczenia, która wynosiła 13,35 w grupie otrzymującej małą dawkę (5 mg lub 10 mg) i 16,94 w grupie otrzymującej dużą dawkę (10 mg lub 20 mg) w porównaniu do poprawy odnotowanej u pacjentów otrzymujących placebo i zmiany wynoszącej 7,09. Skuteczność arypiprazolu u dzieci i młodzieży z zespołem Touretta (arypiprazol: n = 32, placebo: n = 29) oceniano również w przypadku podawania zmiennych dawek od 2 mg na dobę do 20 mg na dobę z dawką początkową wynoszącą 2 mg w trwającym 10 tygodni, randomizowanym badaniu prowadzonym w Korei Południowej prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Pacjenci w wieku od 6 do 18 lat uzyskali średni wynik 29 na skali TTS-YGTSS w pomiarze początkowym. Pacjenci otrzymujący arypiprazol wykazywali poprawę mierzoną zmianą wyniku o 14,97 na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 10 tygodniu w porównaniu do poprawy wynoszącej 9,62 w grupie placebo. W obu wspomnianych badaniach krótkoterminowych nie określono klinicznego znaczenia wyników dotyczących skuteczności, biorąc pod uwagę wielkość działania terapeutycznego w porównaniu do dużego wpływu efektu placebo i niejasne skutki w zakresie funkcjonowania psychospołecznego. Brak danych długoterminowych dotyczących skuteczności i bezpieczeństwa stosowania arypiprazolu w tej niestabilnej chorobie. Europejska Agencja Leków wstrzymała obowiązek dołączania wyników badań produktu leczniczego ABILIFY w jednej lub kilku podgrupach populacji dzieci i młodzieży w leczeniu schizofrenii oraz w leczeniu choroby afektywnej dwubiegunowej (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Arypiprazol jest dobrze wchłaniany, maksymalne stężenie w osoczu osiąga w ciągu od 3 do 5 godzin po podaniu. Arypiprazol w minimalnym stopniu ulega metabolizmowi przedukładowemu. Bezwzględna dostępność po doustnym podaniu jednej tabletki wynosi 87%. Spożywanie posiłków o dużej zawartości tłuszczu nie wpływa na farmakokinetykę arypiprazolu. Dystrybucja Arypiprazol jest rozmieszczany w całym organizmie, pozorna objętość dystrybucji wynosi 4,9 l/kg, co wskazuje na znaczną dystrybucję pozanaczyniową. W stężeniach terapeutycznych arypiprazol i dehydroarypiprazol wiążą się w ponad 99% z białkami surowicy, głównie z albuminami. Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie. Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakokinetyczne
Jak wynika z badań in vitro , enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N- dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. W stanie stacjonarnym aktywny metabolit, dehydroarypiprazol, stanowi około 40% AUC arypiprazolu w osoczu. Eliminacja Średni okres półtrwania arypiprazolu w fazie eliminacji wynosi około 75 godzin u osób o podwyższonej aktywności CYP2D6 i około 146 godzin u osób o obniżonej aktywności CYP2D6. Całkowity klirens arypiprazolu wynosi 0,7 ml/min/kg i jest to głównie klirens wątrobowy. Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [ 14 C], stwierdza się odpowiednio 27% i 60% podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1% niezmienionego arypiprazolu zostaje wydalone z moczem i około 18% z kałem. Roztwór doustny Arypiprazol po podaniu doustnym w postaci roztworu jest dobrze wchłaniany.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakokinetyczne
W przypadku stosowania dawek równoważnych, wartości maksymalnego stężenia arypiprazolu (C max ) w osoczu po zastosowaniu roztworu doustnego były nieco wyższe niż w przypadku tabletek, niemniej ogólna ekspozycja (AUC) była porównywalna. W badaniu dotyczącym biorównoważności względnej porównywano farmakokinetykę 30 mg arypiprazolu w formie roztworu doustnego oraz tabletek 30 mg arypiprazolu u osób zdrowych. Stosunek wartości średnich geometrycznych C max oznaczanych dla roztworu i tabletek wynosił 122% (n = 30). Farmakokinetyki pojedynczych dawek arypiprazolu były liniowe oraz proporcjonalnie zależne od dawki. Dzieci i młodzież Farmakokinetyka arypiprazolu i dehydroarypiprazolu u dzieci w wieku od 10 do 17 lat była podobna do farmakokinetyki u dorosłych, po uwzględnieniu różnic w masie ciała.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakokinetyczne
Farmakokinetyka w szczególnych grupach pacjentów Pacjenci w podeszłym wieku Nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi, nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Nie stwierdzono, aby farmakokinetyka arypiprazolu różniła się u zdrowych kobiet i zdrowych mężczyzn. Nie stwierdzono także żadnego mierzalnego wpływu płci na farmakokinetykę leku u pacjentów ze schizofrenią. Palenie tytoniu Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie wpływów na farmakokinetykę arypiprazolu, zależnych od palenia tytoniu. Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlWłaściwości farmakokinetyczne
Zaburzenia czynności nerek Stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u osób z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badania obejmujące podanie pojedynczej dawki leku, przeprowadzone u osób z różnego stopnia marskością wątroby (klasy Childa-Pugha A, B i C) nie wykazały, by zaburzenia czynności wątroby wpływały istotnie na farmakokinetykę arypiprazolu i dehydroarypiprazolu, jednak w badaniu wzięło udział tylko 3 chorych z marskością wątroby klasy C, co jest liczbą niewystarczającą do wyciągnięcia wniosków dotyczących zdolności metabolicznych tych pacjentów.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Istotne działanie toksyczne stwierdzano jedynie po podaniu dawek lub przy stopniu narażenia wyraźnie przekraczającym maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza (gromadzenie barwnika lipofuscyny i (lub) obumieranie komórek miąższowych) stwierdzany u szczurów po 104 tygodniach podawania arypiprazolu w dawce od 20 mg/kg mc. na dobę do 60 mg/kg mc.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała od 3 do 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki) i zwiększenie częstości występowania raków nadnerczy, a także skojarzonej częstości występowania gruczolaków lub raków nadnerczy u samic szczurów otrzymujących lek w dawce 60 mg/kg mc. na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki). Największa ekspozycja nie powodująca powstawania nowotworów u samic szczurów odpowiadała 7- krotnie większej ekspozycji niż ekspozycja występująca u ludzi po zastosowaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych sprzężonych związków hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 mg/kg mc. na dobę do 125 mg/kg mc.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym była od 1 do 3 razy wyższa niż wartość występująca u ludzi po podaniu maksymalnej zalecanej dawki klinicznej lub od 16 do 81 razy wyższa niż po podaniu maksymalnej dawki zalecanej na podstawie przeliczenia mg/m 2 pc.). Jednak stężenie sprzężonych związków siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania najwyższej proponowanej dawki 30 mg na dobę, nie przekraczało 6% stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie mniejsze (6%) niż granica rozpuszczalności określona in vitro . W badaniach toksykologicznych po podaniu wielokrotnym u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt oraz brak jest dowodów neurotoksyczności i niepożądanego wpływu na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlPrzedkliniczne dane o bezpieczeństwie
Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowano toksyczny wpływ na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po zastosowaniu dawek maksymalnych zalecanych u ludzi). Toksyczny wpływ na ciężarne samice obserwowano podczas podawania dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Disodu edetynian Fruktoza Gliceryna Kwas mlekowy Metylu parahydroksybenzoesan (E 218) Glikol propylenowy Propylu parahydroksybenzoesan (E 216) Sodu wodorotlenek Sacharoza Woda oczyszczona Aromat pomarańczowy 6.2 Niezgodności farmaceutyczne Roztworu doustnego nie należy rozcieńczać innymi płynami bądź mieszać z jakimkolwiek pokarmem przed jego podaniem. 6.3 Okres ważności 3 lata Po pierwszym otwarciu: 6 miesięcy. 6.4 Specjalne środki ostrożności podczas przechowywania Brak szczególnych środków ostrożności dotyczących przechowywania. Warunki przechowywania produktu leczniczego po pierwszym otwarciu, patrz punkt 6.3. 6.5 Rodzaj i zawartość opakowania Butelki typu PET, zawierające 50 ml, 150 ml lub 480 ml, z polipropylenowym zamknięciem zabezpieczającym przed otwarciem przez dzieci.
- CHPL leku Abilify, roztwór doustny, 1 mg/mlDane farmaceutyczne
Do pudełka tekturowego zawierającego 1 butelkę dołączone są polipropylenowa miarka dozująca z podziałką co 2,5 ml i polipropylenowa pipeta z podziałką co 0,5 ml. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Abilify Maintena 300 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu Abilify Maintena 400 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu Abilify Maintena 300 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Abilify Maintena 400 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Abilify Maintena 300 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu Każda fiolka zawiera 300 mg arypiprazolu. Abilify Maintena 400 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu Każda fiolka zawiera 400 mg arypiprazolu.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
Abilify Maintena 300 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Każda ampułko-strzykawka zawiera 300 mg arypiprazolu. Abilify Maintena 400 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Każda ampułko-strzykawka zawiera 400 mg arypiprazolu. Po rekonstytucji każdy ml zawiesiny zawiera 200 mg arypiprazolu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Abilify Maintena 300 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu Abilify Maintena 400 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu Proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu Abilify Maintena 300 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Abilify Maintena 400 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Proszek: biały lub białawy Rozpuszczalnik: przezroczysty
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWskazania do stosowania
4.1 Wskazania do stosowania Abilify Maintena jest wskazany w leczeniu podtrzymującym schizofrenii u dorosłych pacjentów ze stabilizacją choroby za pomocą doustnej postaci arypiprazolu.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie W przypadku pacjentów nieleczonych wcześniej arypiprazolem przed rozpoczęciem leczenia produktem leczniczym Abilify Maintena należy najpierw ustalić tolerancję po podaniu postaci doustnej arypiprazolu. Zalecana dawka początkowa i dawka podtrzymująca produktu leczniczego Abilify Maintena wynosi 400 mg. Nie jest wymagane dobieranie indywidualnej dawki tego produktu leczniczego. Produkt leczniczy należy podawać raz w miesiącu jako pojedyncze wstrzyknięcie (nie wcześniej niż po 26 dniach od podania poprzedniego wstrzyknięcia). Po podaniu pierwszego wstrzyknięcia przez 14 kolejnych dni należy kontynuować podawanie doustnej postaci arypiprazolu w dawce od 10 mg do 20 mg, aby utrzymać terapeutyczne stężenie arypiprazolu podczas rozpoczynania leczenia. Jeśli występują działania niepożądane po podaniu dawki 400 mg, należy rozważyć zmniejszenie dawki do 300 mg raz na miesiąc. Pominięcie dawek
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDawkowanie
Pominięcie dawek Jeśli pacjent pominął drugą lub trzecią dawkę i od ostatniego wstrzyknięcia upłynęło: Działanie od > 4 tygodni do < 5 tygodni Wstrzyknięcie należy wykonać jak najszybciej,a następnie wznowić schemat comiesięcznych wstrzyknięć. > 5 tygodni Należy ponownie rozpocząć jednoczesne podawanie doustnej postaci arypiprazolu przez 14 dni wraz z kolejnym podanym wstrzyknięciem, a następnie wznowić schemat comiesięcznychwstrzyknięć. Jeśli pominięto czwartą lub kolejną dawkę (tj. po osiągnięciu stanu stacjonarnego), a czas, który upłynął od ostatniegowstrzyknięcia wynosi: Działanie od > 4 tygodni do < 6 tygodni Wstrzyknięcie należy podać jak najszybciej,a następnie wznowić schemat comiesięcznych wstrzyknięć. > 6 tygodni Należy ponownie rozpocząć jednoczesne podawanie doustnejpostaci arypiprazolu przez 14 dni wrazz kolejnym podanym wstrzyknięciem, a następnie wznowić schemat comiesięcznych wstrzyknięć. - CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDawkowanie
Szczególne grupy pacjentów Osoby w podeszłym wieku Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Abilify Maintena u pacjentów w wieku 65 lat lub starszych (patrz punkt 4.4). Zaburzenia czynności nerek U pacjentów z zaburzeniami czynności nerek nie jest konieczne dostosowanie dawki (patrz punkt 5.2). Zaburzenia czynności wątroby U pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności wątroby nie jest wymagane dostosowanie dawki. Nie ma wystarczających danych do ustalenia zaleceń dawkowania u pacjentów z ciężkimi zaburzeniami czynności wątroby. Dawkowanie u tych pacjentów wymaga ostrożności, zaleca się postać doustną (patrz punkt 5.2). Osoby wolno metabolizujące z udziałem CYP2D6 W przypadku pacjentów, u których rozpoznano wolny metabolizm z udziałem CYP2D6, dawka początkowa i dawka podtrzymująca powinna wynosić 300 mg. W przypadku jednoczesnego stosowania z silnymi inhibitorami CYP3A4 dawkę należy zmniejszyć do 200 mg (patrz punkt 4.5).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDawkowanie
Dostosowanie dawki z powodu interakcji Dostosowanie dawki należy przeprowadzić u pacjentów przyjmujących równocześnie silne inhibitory CYP3A4 lub silne inhibitory CYP2D6 dłużej niż przez 14 dni. W razie odstawienia inhibitora CYP3A4 lub CYP2D6, może być wymagane zwiększenie dawki do wcześniejszej wielkości dawki (patrz punkt 4.5). W przypadku pojawienia się działań niepożądanych pomimo dostosowania dawki produktu leczniczego Abilify Maintena, należy ponownie rozważyć, czy konieczne jest jednoczesne stosowanie inhibitora CYP2D6 lub CYP3A4. Należy unikać równoczesnego stosowania leków indukujących CYP3A4 z produktem leczniczym Abilify Maintena przez okres dłuższy niż 14 dni, ponieważ powoduje to zmniejszenie stężenia arypiprazolu we krwi i takie stężenie może nie być skuteczne (patrz punkt 4.5).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDawkowanie
Dostosowanie dawki produktu leczniczego Abilify Maintena u pacjentów jednocześnie przyjmujących silne inhibitory CYP2D6, silne inhibitory CYP3A4 i (lub) leki indukujące CYP3A4 dłużej niż przez 14 dni
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDawkowanie
Dawka dostosowana Pacjenci przyjmujący dawkę 400 mg produktu leczniczego Abilify Maintena Silne inhibitory CYP2D6 lub silne inhibitory CYP3A4 300 mg Silne inhibitory CYP2D6 i silne inhibitory CYP3A4 200 mg* Leki indukujące CYP3A4 Unikać stosowania Pacjenci przyjmujący dawkę 300 mg produktu leczniczego Abilify Maintena Silne inhibitory CYP2D6 lub silne inhibitory CYP3A4 200 mg* Silne inhibitory CYP2D6 i silne inhibitory CYP3A4 160 mg* Leki indukujące CYP3A4 Unikać stosowania - CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDawkowanie
* Dostosowane dawki 200 mg i 160 mg uzyskuje się wyłącznie przez zastosowanie produktu Abilify Maintena proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu. Dzieci i młodzież Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Abilify Maintena u dzieci i młodzieży w wieku od 0 do 17 lat. Nie ma dostępnych danych. Sposób podawania Produkt leczniczy Abilify Maintena jest przeznaczony wyłącznie do podawania domięśniowego. Produktu nie wolno podawać dożylnie ani podskórnie. Powinien on być podawany wyłącznie przez fachowy personel medyczny. Abilify Maintena proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu Zawiesinę należy wstrzykiwać niezwłocznie po rekonstytucji, ale można ją przechowywać w fiolce w temperaturze poniżej 25 °C przez maksymalnie 4 godziny.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDawkowanie
Abilify Maintena proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Zawiesinę należy wstrzykiwać niezwłocznie po rekonstytucji, ale można ją przechowywać w strzykawce w temperaturze poniżej 25°C przez maksymalnie 2 godziny. Zawiesinę należy wstrzykiwać powoli, jednorazowo (nie wolno dzielić dawek) do mięśnia pośladkowego lub naramiennego. Należy zachować ostrożność podczas wykonywania wstrzyknięcia, aby nie wstrzyknąć produktu leczniczego do naczynia krwionośnego. Podanie do mięśnia pośladkowego Zaleca się używanie bezpiecznych igieł 22 G × 38 mm do wstrzyknięć podskórnych do mięśnia pośladkowego. W przypadku otyłych pacjentów (wskaźnik masy ciała > 28 kg/m 2 pc.), należy używać bezpiecznych igieł do wstrzyknięć podskórnych 21 G × 50 mm. Należy zmieniać miejsce wstrzyknięcia podając produkt leczniczy raz do jednego, raz do drugiego mięśnia pośladkowego.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDawkowanie
Podanie do mięśnia naramiennego Do wstrzyknięć podskórnych do mięśnia naramiennego zaleca się używanie bezpiecznych igieł 23 G × 25 mm. W przypadku otyłych pacjentów należy używać bezpiecznych igieł do wstrzyknięć podskórnych 22 G × 38 mm. Należy zmieniać miejsce wstrzyknięcia podając produkt leczniczy raz do jednego, raz do drugiego mięśnia naramiennego. Fiolki z proszkiem i rozpuszczalnikiem oraz ampułko-strzykawka są przeznaczone wyłącznie do jednorazowego użycia. Pełne instrukcje stosowania podano w ulotce załączonej do produktu leczniczego (informacje przeznaczone wyłącznie dla fachowego personelu medycznego).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić w ciągu kilku dni do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Zastosowanie u pacjentów w stanie silnego pobudzenia lub w ostrym stanie psychotycznym Produktu leczniczego Abilify Maintena nie należy stosować do leczenia silnego pobudzenia ani ostrych stanów psychotycznych, gdy wymagane jest natychmiastowe złagodzenie objawów. Prawdopodobieństwo podjęcia próby samobójczej Występowanie zachowań samobójczych jest właściwe w chorobach psychotycznych i w niektórych przypadkach było zgłaszane niedługo po rozpoczęciu przyjmowania leku przeciwpsychotycznego lub po zmianie na inny lek przeciwpsychotyczny, w tym arypiprazol (patrz punkt 4.8). Leczeniu przeciwpsychotycznemu u pacjentów z grupy wysokiego ryzyka powinna towarzyszyć ścisła obserwacja pacjenta.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgSpecjalne środki ostrozności
Zaburzenia sercowo-naczyniowe Arypiprazol należy stosować ostrożnie u pacjentów z rozpoznaną chorobą sercowo-naczyniową (zawał mięśnia sercowego lub choroba niedokrwienna w wywiadzie, niewydolność serca lub zaburzenia przewodzenia), chorobą naczyń mózgowych, w stanach predysponujących do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie przeciwnadciśnieniowymi produktami leczniczymi) lub nadciśnienia tętniczego, w tym postępującego lub złośliwego. Zgłaszano przypadki choroby zakrzepowo-zatorowej żył (ang. venous thromboembolism , VTE) w związku ze stosowaniem produktów przeciwpsychotycznych. U pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, dlatego należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE przed rozpoczęciem oraz w czasie leczenia arypiprazolem i wdrożyć odpowiednie środki zapobiegawcze (patrz punkt 4.8).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgSpecjalne środki ostrozności
Wydłużenie odstępu QT Podczas badań klinicznych nad leczeniem arypiprazolem w postaci doustnej częstość przypadków wydłużenia odstępu QT była porównywalna z placebo. Arypiprazol należy stosować ostrożnie u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy W badaniach klinicznych trwających nie dłużej niż rok zgłaszano niezbyt częste przypadki dyskinez występujące w trakcie leczenia arypiprazolem. Jeśli objawy przedmiotowe lub podmiotowe późnych dyskinez wystąpią u pacjentów leczonych arypiprazolem, należy rozważyć zmniejszenie dawki lub odstawienie leku (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Złośliwy zespół neuroleptyczny (ang. Neuroleptic Malignant Syndrome , NMS) NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z podawaniem leków przeciwpsychotycznych. W badaniach klinicznych odnotowano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgSpecjalne środki ostrozności
Klinicznymi objawami NMS są bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz przejawy zaburzeń stabilności układu wegetatywnego (nieregularne tętno i wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Jednakże zgłaszano także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę niekoniecznie związane z NMS. Jeśli u pacjenta wystąpią wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS, bądź wystąpi niewyjaśnionego pochodzenia wysoka gorączka bez innych objawów NMS, należy przerwać leczenie wszystkimi przeciwpsychotycznymi produktami leczniczymi, w tym także arypiprazolem (patrz punkt 4.8). Drgawki W badaniach klinicznych zgłaszano niezbyt częste przypadki napadów drgawkowych w czasie leczenia arypiprazolem.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgSpecjalne środki ostrozności
Z tego powodu arypiprazol należy stosować zachowując ostrożność u pacjentów, u których w przeszłości występowały napady drgawkowe lub u których występują choroby wiążące się ze skłonnością do takich napadów (patrz punkt 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencją Zwiększona śmiertelność W trzech badaniach nad arypiprazolem w postaci doustnej z grupą kontrolną otrzymującą placebo prowadzonych z udziałem pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera (n = 938; średnia wieku: 82,4 lat; zakres: 56-99 lat), pacjentom leczonym arypiprazolem zagrażało większe ryzyko zgonu w porównaniu do pacjentów otrzymujących placebo. Odsetek zgonów wśród pacjentów otrzymującej doustnie arypiprazol wynosił 3,5 % w porównaniu do 1,7 % dla placebo. Chociaż przyczyny zgonów były różne, to w większości zgonów miały one charakter sercowo- naczyniowy (np. niewydolność krążenia, nagły zgon) lub zakaźny (np. zapalenie płuc) (patrz punkt 4.8).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgSpecjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego W tych samych badaniach nad arypiprazolem w postaci doustnej zgłaszano występowanie u pacjentów działań niepożądanych dotyczących krążenia mózgowego (np. udar, przemijający napad niedokrwienny), w tym zgonów (średnia wieku: 84 lata; zakres: 78-88 lat). Łącznie podczas tych badań działania niepożądane dotyczące krążenia mózgowego zgłoszono u 1,3 % pacjentów otrzymujących arypiprazol w postaci doustnej w porównaniu do 0,6 % pacjentów otrzymujących placebo. Różnica ta nie była statystycznie istotna. Jednakże w jednym z tych badań z zastosowaniem stałych dawek u pacjentów leczonych arypiprazolem występowała istotna zależność odpowiedzi od dawki w przypadku działań niepożądanych dotyczących krążenia mózgowego (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów z psychozą związaną z demencją.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgSpecjalne środki ostrozności
Hiperglikemia i cukrzyca U pacjentów leczonych nietypowymi lekami przeciwpsychotycznymi, w tym arypiprazolem, zgłaszano hiperglikemię, w niektórych przypadkach bardzo wysoką z kwasicą ketonową i śpiączką hiperosmotyczną lub zgonem. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. W badaniach klinicznych arypiprazolu nie było istotnych różnic w częstości występowania działań niepożądanych związanych z hiperglikemią (w tym cukrzycy) ani w nieprawidłowych wartościach laboratoryjnych stężenia glukozy w porównaniu do grupy otrzymującej placebo. Dla pacjentów leczonych arypiprazolem i innymi nietypowymi lekami przeciwpsychotycznymi nie ma dostępnych dokładnych szacunków ryzyka wystąpienia działań niepożądanych związanych z hiperglikemią, aby móc dokonać bezpośredniego porównania.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgSpecjalne środki ostrozności
Pacjentów leczonych jakimikolwiek lekami przeciwpsychotycznymi, w tym arypiprazolem, należy objąć obserwacją w kierunku objawów przedmiotowych i podmiotowych hiperglikemii (takich jak zwiększone pragnienie, wielomocz, nadmierne łaknienie i osłabienie), a pacjentów z cukrzycą lub z czynnikami ryzyka cukrzycy należy regularnie monitorować pod kątem pogorszenia obniżania stężenia glukozy we krwi (patrz punkt 4.8). Nadwrażliwość Podczas przyjmowania arypiprazolu mogą pojawić się reakcje nadwrażliwości charakteryzujące się objawami reakcji uczuleniowych. Zwiększenie się masy ciała Zwiększenie się masy ciała często obserwuje się u pacjentów ze schizofrenią w związku z przyjmowaniem leków przeciwpsychotycznych o znanym wpływie na zwiększanie się masy ciała, współistniejącymi chorobami i niehigienicznym trybem życia. Może to prowadzić do ciężkich powikłań.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgSpecjalne środki ostrozności
Po wprowadzeniu leku do obrotu zgłaszano przypadki zwiększania się masy ciała u pacjentów, którym przepisano arypiprazol w postaci doustnej. Jeśli takie przypadki występowały, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych nie wykazano, aby arypiprazol powodował klinicznie istotne zwiększenie się masy ciała (patrz punkt 4.8). Dysfagia Z przyjmowaniem leków przeciwpsychotycznych, w tym arypiprazolu, wiąże się spowolnienie motoryki przełyku i ryzyko aspiracji. Arypiprazol należy stosować ostrożnie u pacjentów z grupy ryzyka zachłystowego zapalenia płuc. Patologiczne uzależnienie od hazardu Po wprowadzeniu leku do obrotu zgłaszano przypadki patologicznego uzależnienia od hazardu wśród pacjentów, którym przepisano arypiprazol w postaci doustnej, niezależnie od tego, czy wcześniej takie uzależnienie od hazardu występowało w wywiadzie medycznym.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgSpecjalne środki ostrozności
Pacjenci, którzy w przeszłości byli uzależnieni od hazardu, mogą być narażeni na większe ryzyko wystąpienia tego działania niepożądanego i należy ich szczególnie monitorować (patrz punkt 4.8).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji produktu leczniczego Abilify Maintena. Informacje podane poniżej uzyskano z badań arypiprazolu w postaci doustnej. W związku z antagonistycznym działaniem wobec receptorów α1-adrenergicznych arypiprazol może nasilać działanie określonych leków przeciwnadciśnieniowych. Biorąc pod uwagę podstawowe działanie arypiprazolu na ośrodkowy układ nerwowy (OUN), należy zachować ostrożność podczas podawania arypiprazolu jednocześnie z alkoholem lub w skojarzeniu z innymi lekami wywierającymi wpływ na OUN z nakładającymi się działaniami niepożądanymi, takimi jak uspokojenie polekowe (patrz punkt 4.8). Należy zachować ostrożność, podając arypiprazol w skojarzeniu z lekami o znanym działaniu powodującym wydłużenie odstępu QT lub zaburzenia elektrolitowe.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgInterakcje
Możliwy wpływ innych leków na arypiprazol Arypiprazol jest metabolizowany na wiele sposobów, w tym także przez enzymy, takie jak CYP2D6 i CYP3A4. Nie jest jednak metabolizowany przez enzymy z grupy CYP1A, więc nie jest konieczne dostosowywanie dawek u palaczy tytoniu. Chinidyna i inne silne inhibitory CYP2D6 W badaniu klinicznym arypiprazolu podawanego doustnie zdrowym ochotnikom silny inhibitor CYP2D6 (chinidyna) zwiększał wartość AUC arypiprazolu o 107 %, natomiast wartość C max pozostawała niezmieniona. Wartości AUC i C max dehydroarypiprazolu, czynnego metabolitu, były odpowiednio zmniejszone o 32 % i o 47 %. Można przewidywać, że inne silne inhibitory CYP2D6, takie jak fluoksetyna i paroksetyna, mogą wywierać podobne działanie i dlatego należy w podobny sposób zmniejszyć dawkę (patrz punkt 4.2).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgInterakcje
Ketokonazol i inne silne inhibitory CYP3A4 W badaniu klinicznym arypiprazolu podawanego doustnie zdrowym ochotnikom silny inhibitor CYP3A4 (ketokonazol) zwiększał wartości AUC i C max arypiprazolu odpowiednio o 63 % i 37 %. Wartości AUC i C max dehydroarypiprazolu wzrosły odpowiednio o 77 % i 43 %. U pacjentów z wolnym metabolizmem przy udziale CYP2D6 jednoczesne podawanie silnych inhibitorów CYP3A4 może powodować większe stężenia arypiprazolu w osoczu w porównaniu do pacjentów z intensywnym metabolizmem przy udziale CYP2D6 (patrz punkt 4.2). W przypadku rozważania podawania ketokonazolu lub innych silnych inhibitorów CYP3A4 w skojarzeniu z arypiprazolem potencjalne korzyści powinny przeważać nad potencjalnym ryzykiem dla pacjenta. Można przewidywać, że inne silne inhibitory CYP3A4, takie jak itrakonazol i inhibitory proteazy HIV, mogą wywierać podobne działanie i dlatego należy w podobny sposób zmniejszyć dawkę (patrz punkt 4.2).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgInterakcje
Po przerwaniu przyjmowania inhibitora CYP2D6 lub CYP3A4 dawkę arypiprazolu należy zwiększyć do początkowej dawki z okresu przed rozpoczęciem terapii skojarzonej. Można spodziewać się łagodnego zwiększenia stężenia arypiprazolu w osoczu w przypadku jednoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazem) lub CYP2D6 (np. escytalopram) z tym produktem leczniczym. Karbamazepina i inne leki indukujące CYP3A4 Po podaniu karbamazepiny, silnego leku indukującego CYP3A4, w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnie geometryczne wartości C max i AUC arypiprazolu były odpowiednio o 68 % i 73 % mniejsze w porównaniu do doustnego arypiprazolu (30 mg) podawanego w monoterapii. Podobnie średnie geometryczne wartości C max i AUC dehydroarypiprazolu po jednoczesnym podaniu karbamazepiny były mniejsze odpowiednio o 69 % i 71 %, niż te wartości po podaniu doustnego arypiprazolu w monoterapii.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgInterakcje
Można oczekiwać, że podobne działanie może wywierać podawanie produktu leczniczego Abilify Maintena w skojarzeniu z innymi lekami indukującymi CYP3A4 (takimi jak ryfampicyna, ryfabutyna, fenytoina, fenobarbital, primidon, efawirenz, newirapina i ziele dziurawca). Należy unikać podawania leków indukujących CYP3A4 w skojarzeniu z produktem leczniczym Abilify Maintena, ponieważ powoduje to zmniejszenie stężenia arypiprazolu we krwi i takie stężenie może nie być skuteczne. Walproinian i lit Gdy walproinian lub lit były podawane w skojarzeniu z arypiprazolem, nie było klinicznie istotnych zmian w zakresie stężeń arypiprazolu i w związku z tym nie jest konieczne dostosowanie dawki podczas podawania walproinianu lub litu z produktem leczniczym Abilify Maintena. Możliwy wpływ arypiprazolu na inne produkty lecznicze W badaniach klinicznych doustne dawki 10-30 mg/dobę arypiprazolu nie wywierały istotnego wpływu na metabolizm substratów CYP2D6 (współczynnik dekstrometorfan/3-metoksymorfinan), CYP2C9 (warfaryna), CYP2C19 (omeprazol) i CYP3A4 (dekstrometorfan).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgInterakcje
Ponadto w warunkach in vitro arypiprazol i dehydroarypiprazol nie zmieniały metabolizmu zachodzącego z udziałem CYP1A2. Istnieje zatem małe prawdopodobieństwo, aby produkt leczniczy Abilify Maintena powodował klinicznie istotne interakcje z innymi lekami za pośrednictwem tych enzymów. Kiedy arypiprazol był podawany w skojarzeniu z lamotryginą, dekstrometorfanem, warfaryną, omeprazolem, escytalopramem lub wenlafaksyną, nie stwierdzono klinicznie istotnej zmiany w stężeniach tych leków. W związku z tym żadne modyfikacje dawki nie są konieczne podczas jednoczesnego stosowania z produktem leczniczym Abilify Maintena. Zespół serotoninowy Zgłaszano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol i możliwe objawy przedmiotowe i podmiotowe tego zespołu mogą wystąpić szczególnie w przypadku jednoczesnego stosowania z innymi lekami o działaniu serotoninergicznym, takimi jak SSRI/SNRI (selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny) lub z lekami, o których wiadomo, że wpływają na zwiększenie stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie prowadzono odpowiednich i dobrze kontrolowanych badań klinicznych arypiprazolu u kobiet w ciąży. Zgłaszano występowanie wad wrodzonych, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. W badaniach na zwierzętach nie można było wykluczyć potencjalnego wystąpienia objawów toksyczności rozwojowej (patrz punkt 5.3). Pacjentki należy poinformowanć o konieczności powiadomienia swojego lekarza o zajściu w ciążę lub planowaniu zajścia w ciążę podczas leczenia produktem leczniczym Abilify Maintena. Ze względu na niewystarczające dane dotyczące bezpieczeństwa u ludzi oraz budzące wątpliwości wyniki badań na zwierzętach, ten lek nie może być stosowany w okresie ciąży, jeśli spodziewane korzyści wyraźnie nie przewyższają potencjalnego ryzyka dla płodu. Lekarze przepisujący recepty muszą pamiętać o długotrwałych właściwościach produktu leczniczego Abilify Maintena.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWpływ na płodność, ciążę i laktację
Noworodki narażone na działanie leków przeciwpsychotycznych (w tym arypiprazolu) w czasie trzeciego trymestru ciąży należą do grupy ryzyka narażonej na wystąpienie działań niepożądanych, w tym zaburzeń pozapiramidowych i (lub) objawów z odstawienia, które po porodzie mogą różnić się nasileniem i czasem trwania. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być objęte ścisłą obserwacją (patrz punkt 4.8). Karmienie piersią Arypiprazol przenika do mleka ludzkiego. Należy podjąć decyzję, czy przerwać karmienie piersią czy przerwać podawanie produktu Abilify Maintena biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem na reprodukcję.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol może wywierać niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe, senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8). Z tego względu pacjentom należy doradzić, aby nie prowadzili pojazdów ani nie obsługiwali maszyn dopóki nie będzie znana ich indywidualna podatność na ten produkt leczniczy.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Najczęściej występujące działania niepożądane zgłaszane u ≥ 5 % pacjentów w dwóch długoterminowych badaniach produktu Abilify Maintena prowadzonych metodą podwójnie ślepej próby obejmowały zwiększenie masy ciała (9,0 %), akatyzję (7,9 %), bezsenność (5,8 %) i ból w miejscu podania (5,1 %). Tabelaryczne zestawienie działań niepożądanych Częstość występowania działań niepożądanych związanych z leczenie arypiprazolem podano w poniższej tabeli. Dane w tabeli oparto na działaniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układ/narząd i częstości: bardzo często (≥ 1/10), często (≥ 1/100 do < 1/10); niezbyt często (≥ 1/1 000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1 000), bardzo rzadko (< 1/10 000); nie znana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDziałania niepożądane
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Nie można określić częstości działań niepożądanych zgłaszanych po wprowadzeniu do obrotu, ponieważ pochodzą one ze spontanicznych zgłoszeń. Z uwagi na to częstość takich działań niepożądanych określono jako „nieznana”.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDziałania niepożądane
Często Niezbyt często Nie znana Zaburzenia krwi i układu chłonnego Neutropenia Niedokrwistość Trombocytopenia Zmniejszenie liczby neutrofiliZmniejszenie liczby białychkrwinek Leukopenia Zaburzenia układu immunologi cznego Nadwrażliwość Reakcje uczuleniowe (np. reakcja anafilaktyczna, obrzęk naczynioruchowy obejmującyobrzęk języka, obrzęk twarzy, świąd lub pokrzywkę) - CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDziałania niepożądane
Często Niezbyt często Nie znana Zaburzeniaendokrynolog iczne Zmniejszenie stężeniaprolaktyny we krwi Hiperprolaktynemia Cukrzycowa śpiączkahiperosmolarna Kwasica ketonowa Zaburzenia metabolizmu i odżywiania Zwiększenie masy ciała Cukrzyca Zmniejszenie masy ciała Hiperglikemia Hipercholesterolemia Hiperinsulinemia Hiperlipidemia HipertrójglicerydemiaZaburzenia łaknienia Anoreksja Hiponatremia Zaburzenia psychiczne Nadmierne pobudzenie Lęk Niepokój Bezsenność Myśli samobójcze Zaburzenia psychotyczne OmamyUrojenia Hiperseksualność Reakcje paniki DepresjaChwiejność emocjonalnaApatia Dysforia Zaburzenia snu BruksizmObniżenie libidoZmiany nastroju Dokonane samobójstwo Próba samobójcza Patologiczne uzależnienie od hazarduNerwowośćZachowania agresywne Zaburzenia układu nerwowego Zaburzenia pozapiramidowe Akatyzja Drżenie Dyskineza Sedacja Senność Zawroty głowy Bóle głowy DystoniaPóźne dyskinezy Parkinsonizm Zaburzenia ruchu Nadpobudliwość psychomotorycznaZespół „niespokojnych nóg” Sztywność mięśni szkieletowychHipertonia Spowolnienie ruchowe ŚlinotokZaburzenia smakuOmamy węchowe Złośliwy zespół neuroleptyczny Drgawki typu grand mal Zespół serotoninowy Zaburzenia mowy Zaburzenia oka Napad przymusowego patrzenia z rotacją gałek Niewyraźne widzenie Ból okaPodwójne widzenie Zaburzenia serca Dodatkowe skurcze komorowe Bradykardia TachykardiaZmniejszenie amplitudy załamka T w EKG Nieprawidłowości w badaniu EKGInwersja załamka Tw EKG Nagły niewyjaśniony zgon Zatrzymanie akcji serca Torsades de pointes Arytmie komoroweWydłużenie odstępu QT Zaburzenia naczyniowe Nadciśnienie tętniczeHipotensja ortostatyczna OmdleniaChoroba zakrzepowo-zatorowa - CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDziałania niepożądane
Często Niezbyt często Nie znana Podwyższone ciśnienie krwi żył (w tym zator płucnyi zakrzepica żył głębokich) Zaburzenia układu oddechowego, klatki piersiowej iśródpiersia Kaszel Czkawka Skurcz części ustnej gardłaSkurcz krtaniZachłystowe zapalenie płuc Zaburzeniażołądka i jelit Suchość wjamie ustnej Choroba refluksowa przełyku NiestrawnośćWymioty Biegunka NudnościBól w nadbrzuszu Dyskomfort w jamie brzusznejZaparciaCzęste wypróżnienia Nadmierne wydzielanie śliny Zapalenie trzustki Dysfagia Zaburzenia wątroby i dróg żółciowych Nieprawidłowy wynik testów wątrobowychZwiększenie aktywności enzymów wątrobowych Podwyższenie aktywności aminotransferazy alaninowej Zwiększenie aktywności gamma-glutamylotransferazy Podwyższone stężenie bilirubiny we krwi Podwyższenie aktywności aminotransferazyasparaginianowej Niewydolność wątroby ŻółtaczkaZapalenie wątroby Zwiększenie aktywności fosfatazy zasadowej Zaburzenia skóry i tkanki podskórnej Łysienie TrądzikTrądzik różowatyEgzema Stwardnienia skóry WysypkaReakcja fotoalergicznaNadmierne pocenie się Zaburzenia mięśniowo- szkieletowe i tkanki łącznej Sztywność mięśniowo- szkieletowa Sztywność mięśni Skurcze mięśni Drżenie mięśni Napięcie mięśni Bóle mięśniowe Ból w kończynach Ból stawówBól plecówZmniejszenie zakresu ruchu stawuSztywność karku Szczękościsk Rozpad mięśni poprzecznie prążkowanych (rabdomioliza) Zaburzenia nerek i dróg moczowych Kamica nerkowa Cukromocz Zatrzymanie moczu Nietrzymanie moczu Ciąża, połógi okres Zespół abstynencyjny unoworodków (patrz punkt 4.6) - CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDziałania niepożądane
Często Niezbyt często Nie znana okołoporodowy Zaburzeniaukładu rozrodczego i piersi Zaburzenia erekcji Mlekotok Ginekomastia Wrażliwość piersiSuchość pochwy Długotrwały wzwód Zaburzenia ogólne i stany w miejscu podania Reakcje w miejscu podania Stwardnienie w miejscu podania Zmęczenie GorączkaAstenia Zaburzenia choduDyskomfort w klatce piersiowejReakcja w miejscu podania Rumień w miejscu podania Obrzęk w miejscu podania Dyskomfort w miejscu podaniaŚwiąd w miejscu podania Wzmożone pragnienieSpowolnienie Zaburzenia regulacji temperatury (np. hipotermia, gorączka)Ból w klatce piersiowejObrzęk obwodowy Badania diagnostyczne Zwiększenie aktywności fosfokinazy kreatynowej we krwi Zwiększenie stężenia glukozy we krwi Zmniejszenie stężenia glukozy we krwi Zwiększenie stężenia glikozylowanej hemoglobiny Zwiększenie obwodu w pasie Zmniejszenie stężenia cholesterolu we krwi Zmniejszenie stężenia trójglicerydów we krwi Wahania stężenia glukozy wekrwi - CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDziałania niepożądane
Opis wybranych działań niepożądanych Reakcje w miejscu podania Podczas faz dwóch długoterminowych badań prowadzonych metodą podwójnie ślepej próby z grupą kontrolną obserwowano reakcje w miejscu podania, których nasilenie generalnie było łagodne lub umiarkowane i które ustępowały w miarę upływu czasu. Ból w miejscu podania (częstość 5,1 %) pojawiał się średnio w drugim dniu po wstrzyknięciu i utrzymywał się średnio przez 4 dni. W otwartym badaniu, porównującym biodostępność produktu leczniczego Abilify Maintena podawanego do mięśnia naramiennego lub pośladkowego, reakcje związane z miejscem podania występowały nieznacznie częściej po podaniu do mięśnia naramiennego. Większość reakcji miała charakter łagodny i ustępowała po kolejnych podaniach produktu. W porównaniu do badań, podczas których produkt leczniczy Abilify Maintena był podawany do mięśnia pośladkowego, ponowne występowanie bólu w miejscu podania występowało częściej po podaniu do mięśnia naramiennego.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDziałania niepożądane
Leukopenia Neutropenię zgłaszano w programie klinicznym dotyczącym produktu leczniczego Abilify Maintena i zazwyczaj pojawiała się ona około 16 dnia po pierwszym podaniu, a utrzymywała się średnio 18 dni. Objawy pozapiramidowe (ang. EPS) W badaniach z udziałem pacjentów ze stabilną schizofrenią podawanie produktu leczniczego Abilify Maintena wiązało się z większą częstością objawów EPS (18,4 %) niż w przypadku leczenia arypiprazolem w postaci doustnej (11,7 %). Akatyzja była najczęściej zgłaszanym objawem (8,2 %) i zazwyczaj pojawiała się ona około 10. dnia po pierwszym podaniu, a utrzymywała się średnio 56 dni. Pacjenci z akatyzją zwykle przyjmowali w ramach leczenia leki przeciwcholinergiczne, głównie mesylat benzatropiny i triheksyfenidyl. Rzadziej w leczeniu akatyzji podawano substancje, takie jak propranolol i benzodiazepiny (klonazepam i diazepam).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDziałania niepożądane
Na kolejnym miejscu były przypadki parkinsonizmu z częstością występowania wynoszącą 6,9 % dla produktu leczniczego Abilify Maintena, 4,15 % dla arypiprazolu 10-30 mg w postaci tabletek doustnych i 3,0 % dla placebo. Dystonia Efekt klasy terapeutycznej: objawy dystonii, długotrwałe nieprawidłowe skurcze grup mięśni, mogą występować u wrażliwych pacjentów w ciągu pierwszych kilku dni leczenia. Do objawów dystonii należą: skurcze mięśni szyi, czasami postępujące do ucisku w gardle, trudności z przełykaniem, trudności z oddychaniem i (lub) protruzja języka. Chociaż objawy te mogą występować po zastosowaniu małych dawek, występują częściej i z większym nasileniem podczas stosowania leków przeciwpsychotycznych pierwszej generacji o silnym działaniu i w większych dawkach. Obserwowano zwiększone ryzyko ostrej dystonii u mężczyzn i w młodszych grupach wiekowych.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDziałania niepożądane
Masa ciała Podczas długoterminowego badania prowadzonego przez 38 tygodni metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną częstość przypadków zwiększenia się masy ciała o 7 % od pomiaru początkowego do ostatniej wizyty wynosiła 9,5 % dla produktu leczniczego Abilify Maintena i 11,7 % dla arypiprazolu 10-30 mg w postaci tabletek doustnych. Częstość przypadków zmniejszenia się masy ciała o ≥ 7 % od pomiaru początkowego do ostatniej wizyty wynosiła 10,2 % w grupie otrzymującej produktu leczniczy Abilify Maintena i 4,5 % w grupie otrzymującej arypiprazol doustnie w tabletkach 10-30 mg. Podczas długoterminowego badania prowadzonego przez 52 tygodnie metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo częstość przypadków zwiększania się masy ciała o 7 % od pomiaru początkowego do ostatniej wizyty wynosiła 6,4 % dla produktu leczniczego Abilify Maintena i 5,2 % dla placebo.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDziałania niepożądane
Częstość przypadków zmniejszenia się masy ciała o ≥ 7 % od pomiaru początkowego do ostatniej wizyty wynosiła 6,4 % dla produktu leczniczego Abilify Maintena i 6,7 % dla placebo. Podczas leczenia prowadzonego metodą podwójnie ślepej próby średnia zmiana masy ciała od pomiaru początkowego do ostatniej wizyty wynosiła −0,2 kg w grupie otrzymującej produktu leczniczy Abilify Maintena i −0,4 kg w grupie otrzymującej placebo (p = 0,812). Prolaktyna Podczas badań klinicznych w zakresie zarejestrowanych wskazań i po wprowadzeniu produktu leczniczego do obrotu u pacjentów otrzymujących arypiprazol obserwowano zarówno zwiększenie, jak i zmniejszenie stężenia prolaktyny w surowicy w porównaniu do pomiarów początkowych (punkt 5.1). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania wymienionego w załączniku V .
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgPrzedawkowanie
4.9 Przedawkowanie Nie zgłaszano żadnych przypadków przedawkowania związanych z działaniami niepożądanymi podczas badań klinicznych produktu leczniczego Abilify Maintena. Należy zachować ostrożność, aby uniknąć nieumyślnego wstrzyknięcia produktu leczniczego do naczynia krwionośnego. Po potwierdzonym lub podejrzewanym przypadkowym przedawkowaniu/nieumyślnym podaniu dożylnym konieczna jest ścisła obserwacja pacjenta i jeśli pojawią się wszelkie potencjalne ciężkie medycznie objawy lub oznaki, wymagane jest monitorowanie pacjenta, które powinno obejmować ciągłe monitorowanie elektrokardiograficzne. Medyczny nadzór i monitorowanie powinno być prowadzone do czasu powrotu pacjenta do zdrowia. Symulacja natychmiastowego uwolnienia całej dawki leku wykazała, że prognozowana mediana stężenia arypiprazolu osiąga szczytową wartość 4 500 ng/ml lub około 9-krotną wartość górnego zakresu terapeutycznego.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgPrzedawkowanie
W przypadku natychmiastowego uwolnienia całej dawki przewiduje się, że stężenia arypiprazolu szybko ulegają zmniejszeniu do górnego limitu przedziału terapeutycznego po około 3 dniach. Do siódmego dnia średnie stężenia arypiprazolu nadal maleją do stężeń zgodnych z dawką domięśniowej postaci depot bez natychmiastowego uwolnienia całej dawki. Biorąc pod uwagę, że przedawkowanie jest mniej prawdopodobne w przypadku produktów leczniczych podawanych pozajelitowo niż w przypadku produktów doustnych, poniżej podano informacje odnośne dotyczące przedawkowania postaci doustnej. Objawy przedmiotowe i podmiotowe W badaniach klinicznych i doświadczeniu po wprowadzeniu produktu do obrotu przypadkowe lub zamierzone ostre przedawkowanie arypiprazolu w monoterapii stwierdzono u dorosłych pacjentów ze zgłoszonymi dawkami ocenianymi jako maksymalnie 1 260 mg (41-krotność maksymalnej zalecanej dawki dobowej) bez zgonów.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgPrzedawkowanie
Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: letarg, wzrost ciśnienia tętniczego krwi, senność, przyspieszona czynność serca (tachykardia), nudności, wymioty i i biegunka. Ponadto zgłaszano przypadkowe przedawkowanie samego arypiprazolu (do 195 mg) u dzieci, bez zgonów. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: senność, przejściowa utrata świadomości i objawy pozapiramidowe. Postępowanie po przedawkowaniu W przypadku przedawkowania leku stosuje się leczenie podtrzymujące polegające na utrzymaniu drożności dróg oddechowych, dotlenianiu i wentylacji oraz leczeniu objawowym. Należy wziąć pod uwagę możliwość wpływu wielu produktów leczniczych. Z tego względu należy niezwłocznie rozpocząć monitorowanie czynności układu krążenia, obejmujące stałe monitorowanie zapisu elektrokardiograficznego, w celu wykrycia możliwych zaburzeń rytmu serca.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgPrzedawkowanie
Po potwierdzonym lub podejrzewanym przedawkowaniu arypiprazolu należy prowadzić ścisły nadzór i monitorowanie medyczne do czasu poprawy zdrowia pacjenta. Hemodializa Pomimo braku informacji dotyczących wpływu hemodializy na leczenie przedawkowania arypiprazolu, istnieje jednak małe prawdopodobieństwo, że hemodializy byłyby użyteczne w takich przypadkach ze względu na znaczny stopień wiązania się arypiprazolu z białkami osocza.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12 Mechanizm działania Przyjmuje się, że skuteczność arypiprazolu w leczeniu schizofrenii związana jest ze skojarzonym działaniem częściowo agonistycznym wobec receptora dopaminowego D 2 i receptora serotoninowego 5-HT 1A oraz z działaniem antagonistycznym wobec receptora serotoninowego 5-HT 2A . Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hiperaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D 2 i D 3 , serotoninowych 5HT1a i 5HT2a oraz umiarkowane powinowactwo do receptorów dopaminowych D 4 , serotoninowych 5HT 2C i 5HT 7 , a także adrenergicznych alfa-1 i histaminowych H 1 .
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do cholinergicznych receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Arypiprazol podawany doustnie w dawkach od 0,5 do 30 mg raz na dobę przez 2 tygodnie zdrowym ochotnikom powoduje zależne od dawki zmniejszenie wiązania rakloprydu znakowanego 11 C, ligandu receptora D 2 /D 3 , w jądrze ogoniastym i skorupie, co można wykryć za pomocą pozytronowej tomografii emisyjnej. Skuteczność kliniczna i bezpieczeństwo stosowania Leczenie podtrzymujące schizofrenii u dorosłych Skuteczność produktu leczniczego Abilify Maintena w leczeniu podtrzymującym pacjentów ze schizofrenią ustalono w dwóch długoterminowych randomizowanych badaniach klinicznych prowadzonych metodą podwójnie ślepej próby.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
Zasadnicze 38-tygodniowe badanie randomizowane prowadzone metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną miało na celu ustalenie skuteczności, bezpieczeństwa stosowania i tolerancji tego produktu leczniczego podawanego raz w miesiącu w postaci wstrzyknięcia w porównaniu do arypiprazolu w tabletkach 10-30 mg podawanego raz na dobę doustnie jako leczenie podtrzymujące u dorosłych pacjentów ze schizofrenią. Badanie składało się z fazy przesiewowej i 3 faz leczenia: fazy konwersji, fazy stabilizującej z zastosowaniem leku doustnego i fazy prowadzonej metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną. Sześciuset sześćdziesięciu dwóch pacjentów kwalifikujących się do trwającej 38 tygodni fazy prowadzonej metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną przydzielono losowo w stosunku 2:2:1 do leczenia metodą podwójnie ślepej próby do jednej z 3 grup leczenia: 1) Abilify Maintena 2) dawka stabilizująca arypiprazolu 10-30 mg w postaci doustnej lub 3) długodziałający arypiprazol 50 mg/25 mg w postaci wstrzyknięcia.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
Dawka długodziałającego arypiprazolu 50 mg/25 mg została uwzględniona w badaniu jako arypiprazol w małej dawce w celu przetestowania czułości badania w schemacie badania z lekiem równoważnym. Wyniki analizy pierwszorzędowego punktu końcowego oceny skuteczności, szacowany odsetek pacjentów, u których występowało zagrożenie nawrotu choroby do końca 26. tygodnia fazy podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną wykazały, że produkt leczniczy Abilify Maintena 400 mg/300 mg jest równoważny z doustnym arypiprazolem w tabletkach 10-30 mg. Szacowany odsetek nawrotów do końca 26. tygodnia wynosił 7,12 % dla produktu leczniczego Abilify Maintena i 7,76 % dla arypiprazolu 10-30 mg w postaci tabletek doustnych, różnica o −0,64 %. Dziewięćdziesięciopięcioprocentowy przedział ufności (−5,26; 3,99) dla różnicy w zakresie szacowanego odsetka pacjentów, którym zagraża nawrót choroby do 26. tygodnia, wyłączał wstępnie określony margines równoważności 11,5 %.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
Z uwagi na to produkt leczniczy Abilify Maintena jest równoważny z doustną postacią arypiprazolu w tabletkach 10-30 mg. Szacowany odsetek pacjentów, którym zagraża nawrót choroby do końca 26. tygodnia dla produktu leczniczego Abilify Maintena wynosił 7,12 %, co było statystycznie znamiennie niższe niż dla długo działającego arypiprazolu we wstrzyknięciu 50 mg/25 mg (21,80 %; p = 0,0006). Zatem ustalono wyższość produktu leczniczego Abilify Maintena nad długodziałającym arypiprazolem do wstrzyknięć 50 mg/25 mg i potwierdzono wiarygodność schematu badania. Na Rysunku 1 przedstawiono krzywe Kaplana-Meiera czasu od randomizacji do zagrażającego nawrotu choroby w ciągu trwającej 38 tygodni podwójnie ślepej fazy z grupą kontrolną otrzymującą substancję czynną dla produktu leczniczego Abilify Maintena, doustnego arypiprazolu 10-30 mg i długo działającego arypiprazolu do wstrzyknięć 50 mg/25 mg. Rys.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
1 Wykres Kaplana-Meiera limitu produktu dla czasu do nasilenia objawów psychotycznych/zagrażającego nawrotu ARIP IMD 400/ 300 mg ARIP 10-30 mg ARIP IMD 50/25 mg Liczba uczestników z grupy ryzyka Test log-rank ARIP IMD 400/300 mg w porównaniu do ARIP 10-30 mg: wartość p = 0,9920 ARIP IMD 400/300 mg w porównaniu do ARIP IMD 50/25 mg: wartość p < 0,0001
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
Liczba pacjentów, którym nie zagraża nawrót choroby 1,0 0,8 0,6 0,4 0,2 0,0 IMD 400/300 mg ARIP 10-30 mg IMD 50/25 mg
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
Dni od randomizacji UWAGA: ARIP IMD 400/300 mg = Abilify Maintena; ARIP 10-30 mg = doustny arypiprazol; ARIP IMD 50/25 mg = długodziałający arypiprazol do wstrzyknięć Ponadto równorzędność produktu leczniczego Abilify Maintena w porównaniu do doustnego arypiprazolu 10-30 mg potwierdzają wyniki analizy wg skali objawów pozytywnych i negatywnych w schizofrenii (ang. Positive and Negative Syndrome Scale Score, PANSS). Tabela 1 Łączny wynik w skali PANSS – zmiana od pomiaru początkowego do 38. tygodnia – ostatnia obserwacja przeniesiona dalej (LOCF): Randomizowana próba skuteczności a, b
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
Łączny wynik w skali PANSS – zmiana od pomiaru początkowego do 38. tygodnia-wynik ostatniej obserwacji przeniesiony dalej (LOCF):Randomizowana próba skuteczności a, b Abilify Maintena400 mg/300 mg(n = 263) Arypiprazol w postaci doustnej 10-30 mg/dobę(n = 266) Długodziałający arypiprazol do wstrzyknięć50 mg/25 mg(n = 131) Średnia wartość początkowa (SD) 57,9 (12,94) 56,6 (12,65) 56,1 (12,59) Średnia zmiana(SD) -1,8 (10,49) 0,7 (11,60) 3,2 (14,45) Wartość-P nie dotyczy 0,0272 0,0002 - CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
a: Zmiana ujemna oceny oznacza poprawę. b: Do oceny włączono wyłącznie pacjentów z oceną początkową i co najmniej jedną oceną po ocenie początkowej. Wartości P wyprowadzono z porównania zmiany od pomiaru początkowego podczas analizy modelu kowariancji z lekiem jako wyrazem i oceną początkową jako zmienną. Drugie badanie prowadzone przez 52 tygodnie było badaniem randomizowanym z wycofaniem, prowadzonym metodą podwójnie ślepej próby prowadzonym w Stanach Zjednoczonych u dorosłych pacjentów z aktualnym rozpoznaniem schizofrenii. Badanie składało się z fazy przesiewowej i 4 faz leczenia: fazy konwersji, fazy stabilizującej z zastosowaniem leku doustnego, fazy stabilizującej z zastosowaniem produktu leczniczego Abilify Maintena i fazy prowadzonej metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
Pacjenci, którzy spełnili wymóg stabilizacji choroby lekiem doustnym w fazie stabilizującej leczenia doustnego, zostali przydzieleni do otrzymywania metodą pojedynczej ślepej próby produktu leczniczego Abilify Maintena i rozpoczęli fazę stabilizującą z zastosowaniem produktu Abilify Maintena trwającą minimalnie 12 tygodni i maksymalnie 36 tygodni. Pacjenci kwalifikujący się do fazy prowadzonej metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo byli losowo przydzielani w proporcji 2:1 do leczenia metodą podwójnie ślepej próby produktem leczniczym Abilify Maintena lub placebo. Końcowa analiza skuteczności obejmowała 403 randomizowanych pacjentów i 80 przypadków zaostrzenia objawów psychotycznych/zdarzeń zagrożenia nawrotu choroby. W grupie otrzymującej placebo u 39,6 % pacjentów nastąpiła progresja do ryzyka zagrażającego nawrotu choroby, natomiast w grupie otrzymującej produkt leczniczy Abilify Maintena ryzyko zagrażającego nawrotu choroby wystąpiło u 10 % pacjentów; zatem pacjentom z grupy otrzymującej placebo zagrażało 5,03-krotnie większe ryzyko zagrażającego nawrotu choroby Prolaktyna Podczas badania prowadzonego przez 38 tygodni metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną występowało średnie zmniejszenie stężeń prolaktyny w grupie otrzymującej produkt leczniczy Abilify Maintena (−0,33 ng/ml) w porównaniu do średniego zwiększenia w grupie otrzymującej arypiprazol doustnie w tabletkach 10-30 mg (0,79 ng/ml; p < 0,01).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
Częstość występowania wśród pacjentów przyjmujących produkt leczniczy Abilify Maintena stężenia prolaktyny > 1-krotności górnej granicy normy (GGN) podczas wszystkich ocen wynosiła 5,4 % w porównaniu do 3,5 % pacjentów przyjmujących doustnie arypiprazol w tabletkach 10-30 mg. W każdej grupie leczenia u pacjentów płci męskiej częstość była generalnie większa niż u kobiet. Podczas badania prowadzonego przez 52 tygodnie metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo występowało średnie zmniejszenie stężeń prolaktyny w grupie otrzymującej produkt leczniczy Abilify Maintena (−0,38 ng/ml) w porównaniu do średniego zwiększenia w grupie otrzymującej placebo (1,67 ng/ml). Częstość stężenia prolaktyny > 1-krotności górnej granicy normy (GGN) wśród pacjentów przyjmujących produkt leczniczy Abilify Maintena wynosiła 1,9 % w porównaniu do 7,1 % u pacjentów otrzymujących placebo.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
Leczenie ostrych przypadków schizofrenii u dorosłych Skuteczność produktu leczniczego Abilify Maintena u dorosłych pacjentów z ostrym nawrotem schizofrenii określono w krótkotrwałym (12-tygodniowym), randomizowanym badaniu, prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo (n = 339). Główny punkt końcowy (zmiana łącznej oceny w skali PANSS w zakresie od pomiaru początkowego do 10 tygodnia) wykazał wyższość produktu leczniczego Abilify Maintena (n = 167) wobec placebo (n = 172). Podobnie do łącznej oceny w skali PANSS, zarówno podskala objawów pozytywnych jak i negatywnych PANSS również wykazały poprawę (zmniejszenie) w miarę upływu czasu w porównaniu do pomiaru początkowego. Tabela 2 Łączny wynik w skali PANSS – zmiana od pomiaru początkowego do 10. tygodnia: Randomizowana próba skuteczności
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
Łączny wynik w skali PANSS –zmiana od pomiaru początkowego do 10. tygodnia: Randomizowana próba skuteczności a Abilify Maintena400 mg/300 mg Placebo Średnia wartość początkowa (SD) 102,4 (11,4)n = 162 103,4 (11,1)n = 167 Średnia zmiana (SD) wyznaczona metodą najmniejszych kwadratów -26,8 (1,6)n = 99 -11,7 (1,6)n = 81 Wartość-P < 0,0001 Różnica leczeniab (95 % CI) -15,1 (-19,4, -10,8) - CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
a Dane były analizowane za pomocą analizy mieszanego modelu ponownych pomiarów ( ang. mixed model repeated measures MMRM). Analiza obejmowała wyłącznie uczestników losowo przydzielonych do grupy otrzymującej dany lek, którzy otrzymali co najmniej jedno wstrzyknięcie leku oraz przeprowadzono u nich ocenę skuteczności podczas pomiaru początkowego i co najmniej jedną taką ocenę w późniejszym czasie. b Różnica (Abilify Maintena minus placebo) wyznaczona metodą najmniejszych kwadratów w stosunku do pomiaru początkowego. Ponadto produkt leczniczy Abilify Maintena wykazywał również statystycznie istotną poprawę w zakresie objawów reprezentowanych przez zmianę oceny na skali CGIS w zakresie od pomiaru początkowego do 10. tygodnia. Funkcjonowanie indywidualne i społeczne oceniano przy użyciu skali funkcjonowania indywidualnego i społecznego (PSP - Personal and Social Performance).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
Skala PSP jest zwalidowaną, ocenianą przez lekarza skalą, mierzącą funkcjonowanie indywidualne i społeczne w czterech domenach: zajęć użytecznych społecznie (np. praca i nauka), związków osobistych i społecznych, dbałości o higienę osobistą oraz zachowań zakłócających porządek i agresywnych. Zaobserwowano statystycznie istotną różnicę na korzyść produktu leczniczego Abilify Maintena 400 mg/300 mg w porównaniu do placebo w 10. tygodniu (+7,1, p < 0,0001, 95 % CI: 4,1; 10,1 za pomocą modelu ANCOVA (LOCF)). Profil bezpieczeństwa był zgodny ze znanym profilem bezpieczeństwa produktu leczniczego Abilify Maintena. Niemniej występowały różnice w porównaniu do stosowania w leczeniu podtrzymującym schizofrenii. Podczas krótkotrwałego (12-tygodniowego), randomizowanego badania, prowadzonego metodą podwójnie ślepej próby z udziałem pacjentów otrzymujących Abilify Maintena 400 mg/300 mg, objawy, które występowały co najmniej dwukrotnie częściej niż u pacjentów otrzymujących placebo, obejmowały zwiększenie masy ciała i akatyzję.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakodynamiczne
Częstość występowania zwiększenia masy ciała wynoszącego ≤ 7 % od pomiaru początkowego do ostatniej wizyty (12. tydzień ) wynosiła 21,5 % w grupie pacjentów otrzymujących produkt Abilify Maintena w porównaniu do 8,5% w grupie placebo. Akatyzja była najczęściej obserwowanym objawem EPS (częstość występowania tego objawu w grupie otrzymującej produkt Abilify Maintena wynosiła 11,4 %, a w grupie placebo – 3,5 %). Dzieci i młodzież Europejska Agencja Leków uchyliła obowiązek dołączenia wyników badań produktu leczniczego Abilify Maintena we wszystkich podgrupach populacji dzieci i młodzieży w leczeniu schizofrenii (patrz punkt 4.2).
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Wchłanianie arypiprazolu do krążenia układowego po podaniu produktu leczniczego Abilify Maintena następuje powoli i jest wydłużone w związku z małą rozpuszczalnością cząsteczek arypiprazolu. Średni okres półtrwania wchłaniania produktu leczniczego Abilify Maintena wynosi około 28 dni. Wchłanianie arypiprazolu z postaci depot podawanej domięśniowo było pełne w porównaniu do standardowej postaci podawanej domięśniowo (o natychmiastowym uwalnianiu). Wartości C max dostosowanej dawki dla postaci depot wynosiły około 5 % wartości C max standardowej postaci domięśniowej. Po podaniu pojedynczej dawki produktu leczniczego Abilify Maintena do mięśnia pośladkowego lub naramiennego, zakres wchłaniania (AUC) był podobny w przypadku obu miejsc podania, ale szybkość wchłaniania (C max ) była większa po podaniu do mięśnia naramiennego.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakokinetyczne
Po podaniu wielokrotnym dawek domięśniowych, stężenia arypiprazolu w osoczu stopniowo rosną do maksymalnego stężenia w osoczu po medianie czasu t max wynoszącej odpowiednio 7 dni w przypadku mięśnia pośladkowego i 4 dni w przypadku mięśnia naramiennego. Stężenia w stanie stacjonarnym u typowego uczestnika było osiągane po podaniu czwartej dawki w przypadku obu miejsc podania. Zwiększone stężenia arypiprazolu i dehydroarypiprazolu oraz parametry AUC mniejsze niż proporcjonalne do podanej dawki są obserwowane po comiesięcznym podaniu produktu leczniczego Abilify Maintena od 300 mg do 400 mg. Dystrybucja Na podstawie badań nad arypiprazolem podawanym doustnie arypiprazol jest rozmieszczany w całym organizmie, a pozorna objętość dystrybucji wynosi 4,9 l/kg, co wskazuje na znaczną dystrybucję pozanaczyniową. W stężeniach terapeutycznych arypiprazol i dehydroarypiprazol wiążą się w ponad 99 % z białkami surowicy, głównie z albuminami.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakokinetyczne
Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie. Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji. Jak wynika z badań in vitro enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N- dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. Po wielokrotnym podaniu produktu leczniczego Abilify Maintena czynny metabolit, dehydroarypiprazol, stanowi około 29,1 do 32,5 % wartości AUC arypiprazolu w osoczu. Eliminacja Po podaniu wielokrotnych dawek 400 mg lub 300 mg produktu leczniczego Abilify Maintena średni okres półtrwania arypiprazolu w końcowej fazie eliminacji wynosił odpowiednio 46,5 i 29,9 dnia, przypuszczalnie w związku z parametrami kinetycznymi ograniczonymi szybkością wchłaniania.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakokinetyczne
Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [ 14 C], stwierdza się odpowiednio 27 % i 60 % podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1 % niezmienionego arypiprazolu zostaje wydalone z moczem i około 18 % z kałem. Farmakokinetyka w specjalnych grupach pacjentów Osoby o wolnym metabolizmie z udziałem CYP2D6 Na podstawie oceny farmakokinetyki produktu leczniczego Abilify Maintena w populacji całkowity klirens arypiprazolu wynosił 3,71 l/h u pacjentów z szybkim metabolizmem z udziałem CYP2D6 i około 1,88 l/h (mniej o około 50 %) u pacjentów z wolnym metabolizmem z udziałem CYP2D6 (odnośnie zaleceń dawkowania patrz punkt 4.2). Pacjenci w podeszłym wieku Po podaniu doustnym arypiprazolu nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi. Nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę produktu leczniczego Abilify Maintena u pacjentów ze schizofrenią.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakokinetyczne
Płeć Po podaniu doustnym arypiprazolu nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi mężczyznami a kobietami. Nie stwierdzono także mierzalnego wpływu płci na farmakokinetykę produktu leczniczego Abilify Maintena podczas badań klinicznych u pacjentów ze schizofrenią. Palenie tytoniu Populacyjne badanie farmakokinetyczne arypiprazolu w postaci doustnej nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od palenia tytoniu. Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy. Zaburzenia czynności nerek W badaniu z pojedynczą dawką arypiprazolu w postaci doustnej stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u pacjentów z ciężkimi chorobami nerek i u młodych osób zdrowych.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgWłaściwości farmakokinetyczne
Zaburzenia czynności wątroby Badanie z pojedynczą dawką arypiprazolu podawanego doustnie pacjentom z marskością wątroby różnego stopnia (klasa A, B lub C w skali Child-Pugh) nie wykazało znacznego wpływu zaburzeń czynności wątroby na farmakokinetykę arypiprazolu i dehydroarypiprazolu, ale w badaniu uczestniczyło tylko 3 pacjentów z marskością wątroby klasy C, co jest niewystarczające do wyciągnięcia wniosków w zakresie możliwości metabolizmu u takich pacjentów.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Profil toksykologiczny arypiprazolu podawanego zwierzętom doświadczalnym we wstrzyknięciu domięśniowym jest generalnie podobny do profilu obserwowanego po podaniu doustnym przy porównywalnych stężeniach w osoczu. Jednak po podaniu domięśniowym reakcję zapalną obserwowano w miejscu podania i obejmowała ona ziarniniakowe zmiany zapalne, ogniska (złogi leku), nacieki komórkowe, obrzęki i zwłóknienie u małp. Objawy te zwykle ustępowały po przerwaniu podawania. Dane niekliniczne dla arypiprazolu podawanego doustnie wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgPrzedkliniczne dane o bezpieczeństwie
Arypiprazol w postaci doustnej Istotne działanie toksyczne stwierdzano jedynie po podaniu dawek lub przy stopniu narażenia wyraźnie przekraczającym maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza stwierdzany u szczurów po 104 tygodniach doustnego podawania arypiprazolu w dawce przekraczającej od 3 do 10 razy średnią wartość AUC w stanie stacjonarnym występującą u ludzi po podaniu maksymalnej zalecanej dawki i zwiększenie częstości występowania raków nadnerczy, a także łącznej częstości występowania gruczolaków/raków korowonadnerczowych u samic szczurów otrzymujących produkt w dawce przekraczającej 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgPrzedkliniczne dane o bezpieczeństwie
Największe narażenie niepowodujące powstawania nowotworów u samic szczurów odpowiadało siedmiokrotnemu narażeniu u ludzi występującemu po podaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych koniugatów hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 do 125 mg/kg mc./dobę (około 16 do 81 razy wyższa niż po podaniu maksymalnej dawki zalecanej u ludzi na podstawie przeliczenia mg/m 2 pc.). Jednak stężenie koniugatów siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania największej proponowanej dawki 30 mg na dobę, nie przekraczało 6 % stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie poniżej (6 %) granicy rozpuszczalności określonej in vitro .
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgPrzedkliniczne dane o bezpieczeństwie
W badaniach toksykologicznych z użyciem dawki wielokrotnej u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt oraz nie było dowodów potwierdzających neurotoksyczność i niepożądany wpływ na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych. Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowano toksyczny wpływ na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po podaniu maksymalnej zalecanej dawki u ludzi.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgPrzedkliniczne dane o bezpieczeństwie
Toksyczny wpływ na ciężarne samice obserwowano podczas podawania dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Proszek Karmeloza sodowa Mannitol Sodu diwodorofosforan jednowodny Wodorotlenek sodu Rozpuszczalnik Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata Po rekonstytucji Abilify Maintena 300 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu Abilify Maintena 400 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu Wykazano, że produkt zachowuje stabilność chemiczną i fizyczną przez okres 4 godzin w temperaturze 25 °C. Z mikrobiologicznego punktu widzenia, o ile metoda otwarcia/rekonstytucji nie eliminuje ryzyka skażenia mikrobiologicznego, produkt należy zużyć natychmiast. Jeśli produkt nie zostanie zastosowany natychmiast, użytkownik ponosi odpowiedzialność za dalszy okres oraz warunki przechowywania.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDane farmaceutyczne
Przed wstrzyknięciem energicznie wstrząsać fiolkę przez co najmniej 60 sekund, aby ponownie uzyskać zawiesinę. Nie pozostawiać odtworzonej zawiesiny w strzykawce. Abilify Maintena 300 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Abilify Maintena 400 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Jeśli wstrzyknięcie nie zostanie wykonane niezwłocznie po rekonstytucji, strzykawkę można przechowywać maksymalnie przez 2 godziny w temperaturze poniżej 25°C. Jeśli strzykawkę pozostawiono na ponad 15 minut, przed wstrzyknięciem należy energicznie nią wstrząsać przez co najmniej 20 sekund, aby ponownie uzyskać zawiesinę. 6.4 Specjalne środki ostrożności podczas przechowywania Nie zamrażać.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDane farmaceutyczne
Abilify Maintena 300 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Abilify Maintena 400 mg proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Ampułko-strzykawkę przechowywać w opakowaniu zewnętrznym w celu ochrony przed światłem. Warunki przechowywania produktu leczniczego po rekonstytucji, patrz punkt 6.3. 6.5 Rodzaj i zawartość opakowania Fiolka szklana Fiolka szklana (szkło typu I) z gumowym korkiem laminowanym, zamknięta aluminiowym kapslem. Rozpuszczalnik Fiolka szklana (szkło typu I) o pojemności 2 ml z gumowym korkiem laminowanym, zamknięta aluminiowym kapslem. Pojedyncze opakowanie Każde pojedyncze opakowanie zawiera jedną fiolkę z proszkiem, fiolkę z rozpuszczalnikiem o pojemności 2 ml, jedną strzykawkę ze złączem typu luer lock o pojemności 3 ml z założoną bezpieczną igłą do wstrzyknięć podskórnych 21 G × 38 mm z osłoną igły, jedną jednorazową strzykawkę o pojemności 3 ml z końcówką typu luer lock , jeden łącznik fiolki i trzy bezpieczne igły do wstrzyknięć podskórnych: jedna 23 G × 25 mm, jedna 22 G × 38 mm i jedna 21 G × 50 mm.
- CHPL leku Abilify Maintena, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu, 300 mgDane farmaceutyczne
Opakowanie zbiorcze Pakiet zawierający 3 pojedyncze opakowania. Ampułko-strzykawka Ampułko-strzykawka ze szkła typu I zawierająca proszek w przedniej komorze i rozpuszczalnik w tylnej komorze. Pojedyncze opakowanie Każde pojedyncze opakowanie zawiera jedną ampułko-strzykawkę i trzy bezpieczne igły do wstrzyknięć podskórnych: jedna 23 G x 25 mm, jedna 22 G x 38 mm i jedna 21 G x 50 mm. Opakowanie zbiorcze Pakiet zawierający 3 pojedyncze opakowania. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami. Pełne instrukcje przygotowania produktu leczniczego Abilify Maintena do stosowania podano w ulotce załączonej do produktu leczniczego (informacje przeznaczone wyłącznie dla fachowego personelu medycznego).
- CHPL leku Abilium, kapsułki twarde, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Abilium, 10 mg, kapsułki, twarde Abilium, 15 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Abilium, 10 mg Każda kapsułka zawiera 10 mg arypiprazolu. Abilium, 15 mg Każda kapsułka zawiera 15 mg arypiprazolu. Pełny wykaz substancji pomocniczych, patrz punkt 6.l. 3. POSTAĆ FARMACEUTYCZNA Kapsułka, twarda Abilium, 10 mg Twarde, żelatynowe, nieprzezroczyste kapsułki nr 3 o barwie różowej. Zawartość kapsułek: proszek barwy białej do kremowej. Abilium, 15 mg Twarde, żelatynowe, nieprzezroczyste kapsułki nr 2 o barwie kremowej. Zawartość kapsułek: proszek barwy białej do kremowej.
- CHPL leku Abilium, kapsułki twarde, 10 mgWskazania do stosowania
4.1 Wskazania do stosowania Abilium jest wskazany do leczenia schizofrenii u dorosłych i u młodzieży w wieku 15 lat i starszej. Abilium jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym do ciężkiego w przebiegu zaburzenia afektywnego dwubiegunowego typu I oraz w zapobieganiu nowym epizodom maniakalnym u dorosłych, u których występują głównie epizody maniakalne i którzy odpowiadają na leczenie arypiprazolem (patrz punkt 5.1). Abilium jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym do ciężkiego w przebiegu zaburzenia afektywnego dwubiegunowego typu I u młodzieży w wieku 13 lat i starszej, w leczeniu trwającym do 12 tygodni (patrz punkt 5.1).
- CHPL leku Abilium, kapsułki twarde, 10 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Schizofrenia: zalecana dawka początkowa produktu leczniczego Abilium to 10 mg lub 15 mg na dobę z dawką podtrzymującą 15 mg na dobę. Produkt należy podawać raz na dobę o stałej porze, niezależnie od posiłków. Abilium jest skuteczny w dawkach od 10 mg do 30 mg na dobę. Chociaż nie potwierdzono większej skuteczności dawek większych niż dawka dobowa 15 mg, jednak u poszczególnych pacjentów większa dawka może być korzystna. Maksymalna dawka dobowa nie może być większa niż 30 mg. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I: zalecana dawka to 15 mg produktu Abilium podawane w schemacie raz na dobę, niezależnie od posiłków, jako monoterapia lub w leczeniu skojarzonym (patrz punkt 5.1). U niektórych pacjentów może być korzystne zastosowanie większej dawki. Maksymalna dawka dobowa nie może być większa niż 30 mg.
- CHPL leku Abilium, kapsułki twarde, 10 mgDawkowanie
Zapobieganie nawrotom epizodów maniakalnych w zaburzeniu afektywnym dwubiegunowym typu I: w celu zapobiegania nawrotom epizodów maniakalnych u pacjentów, którzy stosują arypiprazol w monoterapii lub w terapii skojarzonej, należy kontynuować leczenie stosując ustaloną dawkę. Dostosowanie dawki dobowej, w tym jej zmniejszenie, należy rozważyć na podstawie stanu klinicznego. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej: zalecana dawka produktu Abilium to 10 mg na dobę, podawane w schemacie raz na dobę, niezależnie od posiłków. Leczenie powinno być rozpoczęte od dawki 2 mg (stosując arypiprazol 1mg/ml roztwór doustny) przez 2 dni, stopniowo zwiększanej do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. Jeśli jest to konieczne, należy podawać kolejne dawki zwiększone jednorazowo o 5 mg, nie przekraczając maksymalnej dawki dobowej 30 mg (patrz punkt 5.1). Abilium jest skuteczny w przedziale dawek od 10 mg do 30 mg na dobę.
- CHPL leku Abilium, kapsułki twarde, 10 mgDawkowanie
Nie wykazano większej skuteczności dla dawek dobowych większych niż 10 mg, choć u niektórych pacjentów zastosowanie większych dawek może być korzystne. Abilium nie jest zalecany do stosowania u pacjentów ze schizofrenią w wieku poniżej 15 lat z powodu braku wystarczających danych dotyczących skuteczności i bezpieczeństwa stosowania (patrz punkty 4.8 i 5.1). Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej: zalecana dawka produktu Abilium to 10 mg na dobę, podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie należy rozpocząć od dawki 2 mg (stosując arypiprazol roztwór doustny, 1 mg/ml) przez 2 dni, stopniowo zwiększanej do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. Czas trwania leczenia powinien być możliwie najkrótszy, konieczny do uzyskania kontroli objawów i nie może być dłuższy niż 12 tygodni.
- CHPL leku Abilium, kapsułki twarde, 10 mgDawkowanie
Nie wykazano większej skuteczności leczenia po zastosowaniu dawek dobowych większych niż 10 mg, a po podaniu dawki dobowej 30 mg znacząco zwiększa się częstość występowania istotnych działań niepożądanych, włączając zdarzenia związane z objawami pozapiramidowymi (ang. EPS), takimi jak senność, zmęczenie oraz zwiększenie masy ciała (patrz punkt 4.8). Z tego powodu dawki większe niż 10 mg na dobę można stosować tylko w wyjątkowych przypadkach oraz z zachowaniem ścisłej kontroli klinicznej (patrz punkty 4.4, 4.8 i 5.1). Młodsi pacjenci są narażeni na zwiększone ryzyko wystąpienia działań niepożądanych związanych z arypiprazolem. Z tego powodu nie zaleca się stosowania produktu Abilium u pacjentów w wieku poniżej 13 lat (patrz punkty 4.8 i 5.1). Drażliwość związana z zaburzeniami autystycznymi Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego Abilium u dzieci i młodzieży w wieku poniżej 18 lat.
- CHPL leku Abilium, kapsułki twarde, 10 mgDawkowanie
Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących stosowania. Tiki związane z zespołem Tourette’a Dotychczas nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Abilium u dzieci i młodzieży w wieku od 6 do 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących stosowania. Szczególne grupy pacjentów Zaburzenia czynności wątroby Nie ma konieczności modyfikacji dawki u osób z zaburzeniami czynności wątroby o nasileniu lekkim do umiarkowanego. Nie ma wystarczających danych do ustalenia dawkowania u pacjentów z ciężką niewydolnością wątroby. W tej grupie pacjentów dawkowanie należy ustalać ostrożnie. Niemniej, w grupie pacjentów z ciężkimi zaburzeniami czynności wątroby największą dawkę dobową 30 mg należy stosować ze szczególną ostrożnością (patrz punkt 5.2). Zaburzenia czynności nerek Nie jest konieczne modyfikowanie dawki u pacjentów z zaburzeniami czynności nerek.
- CHPL leku Abilium, kapsułki twarde, 10 mgDawkowanie
Pacjenci w podeszłym wieku Bezpieczeństwo stosowania i skuteczność produktu Abilium w leczeniu schizofrenii i w epizodach manii w przebiegu zaburzenia afektywnego dwubiegunowego typu I u pacjentów w wieku 65 lat i starszych nie została ustalona. Jednakże z powodu większej wrażliwości tej populacji, należy rozważyć zastosowanie mniejszej dawki początkowej, jeśli pozwalają na to okoliczności kliniczne (patrz punkt 4.4). Płeć Nie ma konieczności modyfikacji dawki leku w zależności od płci (patrz punkt 5.2). Palacze tytoniu Biorąc pod uwagę metabolizm arypiprazolu, nie jest konieczne modyfikowanie dawki u palaczy (patrz punkt 4.5). Dostosowanie dawki z powodu interakcji Dawkę arypiprazolu należy zmniejszyć w okresie równoczesnego stosowania silnego inhibitora cytochromu CYP3A4 lub CYP2D6. Po zakończeniu jednoczesnego stosowania inhibitora CYP3A4 lub CYP2D6, dawkę arypiprazolu należy z kolei zwiększyć (patrz punkt 4.5).
- CHPL leku Abilium, kapsułki twarde, 10 mgDawkowanie
Dawkę arypiprazolu należy zwiększyć w okresie równoczesnego stosowania leków silnie indukujących CYP3A4. Po odstawieniu produktu leczniczego indukującego CYP3A4, dawkę arypiprazolu należy ponownie zmniejszyć do dawki zalecanej (patrz punkt 4.5). Sposób podawania Produkt Abilium jest przeznaczony do stosowania doustnego.
- CHPL leku Abilium, kapsułki twarde, 10 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Abilium, kapsułki twarde, 10 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić w ciągu kilku dni do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją lekarza. Próby samobójcze 3. Występowanie zachowań samobójczych wynika z chorób psychicznych oraz zaburzeń nastroju i w niektórych przypadkach było zgłaszane wkrótce po rozpoczęciu lub zmianie leczenia przeciwpsychotycznego, w tym leczenia arypiprazolem (patrz punkt 4.8). Leczenie przeciwpsychotyczne pacjentów wysokiego ryzyka powinno odbywać się pod ścisłym nadzorem. Zaburzenia sercowo-naczyniowe Arypiprazol należy stosować ostrożnie u pacjentów z chorobą sercowo-naczyniową (zawał mięśnia sercowego lub chorobą niedokrwienną w wywiadzie, niewydolnością serca lub zaburzeniami przewodzenia), chorobą naczyń mózgu, w stanach predysponujących do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie produktami przeciwnadciśnieniowymi) lub nadciśnienia tętniczego, w tym nadciśnienia postępującego lub złośliwego.
- CHPL leku Abilium, kapsułki twarde, 10 mgSpecjalne środki ostrozności
Po zastosowaniu leków przeciwpsychotycznych obserwowano przypadki żylnej choroby zakrzepowo – zatorowej (VTE – ang. venous thromboembolism). Ponieważ u pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, przed rozpoczęciem oraz w trakcie leczenia arypiprazolem należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE i wdrożyć odpowiednie środki zapobiegawcze. Wydłużenie odstępu QT W badaniach klinicznych arypiprazolu częstość występowania wydłużenia odstępu QT była porównywalna ze stwierdzaną w grupie placebo. Arypiprazol należy stosować ostrożnie u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy W badaniach klinicznych trwających nie dłużej niż rok, w okresie leczenia arypiprazolem niezbyt często zgłaszano dyskinezy wymagające leczenia.
- CHPL leku Abilium, kapsułki twarde, 10 mgSpecjalne środki ostrozności
Jeśli u pacjentów leczonych produktem Abilium wystąpią przedmiotowe lub podmiotowe objawy późnych dyskinez, należy rozważyć zmniejszenie dawki lub odstawienie arypiprazolu (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po zakończeniu leczenia arypiprazolem. Inne objawy pozapiramidowe W pediatrycznych badaniach klinicznych z zastosowaniem arypiprazolu obserwowano akatyzję oraz parkinsonizm. Jeśli u pacjenta przyjmującego arypiprazol wystąpią przedmiotowe i podmiotowe objawy innych zaburzeń pozapiramidowych, należy rozważyć zmniejszenie dawki oraz wprowadzenie ścisłej kontroli klinicznej. Złośliwy Zespół Neuroleptyczny (NMS) NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z przyjmowaniem leków przeciwpsychotycznych. W badaniach klinicznych zgłaszano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku Abilium, kapsułki twarde, 10 mgSpecjalne środki ostrozności
Klinicznymi objawami NMS są: bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz objawy niestabilności autonomicznego układu nerwowego (nieregularne tętno i wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Zgłaszano jednak także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę, niekoniecznie związane z NMS. Jeśli wystąpiły wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS, lub wysoka gorączka niewyjaśnionego pochodzenia, bez innych objawów NMS, należy przerwać leczenie wszystkimi lekami przeciwpsychotycznymi, w tym także arypiprazolem. Drgawki 4. W badaniach klinicznych w czasie leczenia arypiprazolem odnotowano niezbyt częste napady drgawek.
- CHPL leku Abilium, kapsułki twarde, 10 mgSpecjalne środki ostrozności
Z tego powodu arypiprazol należy stosować z zachowaniem ostrożności u pacjentów, u których w przeszłości występowały napady drgawek lub u których występują choroby wiążące się ze skłonnością do takich napadów (patrz punkt 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencj? Zwiększona śmiertelność. W trzech badaniach kontrolowanych placebo (n = 938, średnia wieku: 82,4; zakres: 56-99 lat) u pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera, leczonych arypiprazolem, występowało zwiększone ryzyko zgonu w porównaniu z grupą otrzymującą placebo. Częstość zgonów u pacjentów leczonych arypiprazolem wynosiła 3,5% w porównaniu do 1,7 % w grupie placebo. Chociaż przyczyny zgonów były zróżnicowane, to większość zgonów wydawała się związana albo z chorobami układu krążenia (np. niewydolność serca, nagła śmierć), albo z chorobami zakaźnymi (np. zapalenie płuc) (patrz punkt 4.8).
- CHPL leku Abilium, kapsułki twarde, 10 mgSpecjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego W tych samych badaniach, u pacjentów odnotowano działania niepożądane dotyczące krążenia mózgowego (np. udar, przejściowe napady niedokrwienia), w tym o przebiegu zakończonym zgonem (średnia wieku: 84 lata; zakres 78-88 lat). Ogólnie, w tych badaniach 1,3% wszystkich pacjentów leczonych arypiprazolem zgłaszało działania niepożądane dotyczące krążenia mózgowego w porównaniu do 0,6 % pacjentów otrzymujących placebo. Różnica ta nie była jednak statystycznie istotna. W jednym z badań z zastosowaniem ustalonego dawkowania, u pacjentów leczonych arypiprazolem obserwowano jednak istotną zależność między występowaniem działań niepożądanych dotyczących krążenia mózgowego a dawką (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów, u których występują psychozy związane z demencją.
- CHPL leku Abilium, kapsułki twarde, 10 mgSpecjalne środki ostrozności
Hiperglikemia i cukrzyca U pacjentów leczonych atypowymi lekami przeciwpsychotycznymi, w tym arypiprazolem, opisywano hiperglikemię, niekiedy bardzo wysoką, z kwasicą ketonową i śpiączką hiperosmotyczną lub zgonem. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań są otyłość i cukrzyca w wywiadzie rodzinnym. W badaniach klinicznych z arypiprazolem nie było istotnych różnic w częstości występowania działań niepożądanych związanych z hiperglikemią (w tym cukrzycy) ani nieprawidłowych wartości laboratoryjnych stężenia glukozy w porównaniu z placebo. Nie jest dostępna dokładna ocena ryzyka wystąpienia działań niepożądanych związanych z hiperglikemią, która pozwalałaby na bezpośrednie porównanie leczenia arypiprazolem i innymi atypowymi lekami przeciwpsychotycznymi.
- CHPL leku Abilium, kapsułki twarde, 10 mgSpecjalne środki ostrozności
Pacjenci leczeni jakimikolwiek lekami przeciwpsychotycznymi, włącznie z arypiprazolem, powinni być monitorowani, czy nie występują u nich objawy podmiotowe i przedmiotowe związane z hiperglikemią (takie, jak: nadmierne pragnienie, wielomocz, nadmierny apetyt i osłabienie), a pacjenci z cukrzycą lub czynnikami ryzyka wystąpienia cukrzycy powinni być regularnie monitorowani w kierunku pogorszenia kontroli glikemii (patrz punkt 4.8). Nadwrażliwość Po zastosowaniu arypiprazolu, mogą wystąpić reakcje nadwrażliwości charakteryzujące się objawami uczulenia (patrz punkt 4.8). Zwiększenie masy ciała Zwiększenie masy ciała, obserwowane u pacjentów ze schizofrenią i zaburzeniem afektywnym dwubiegunowym, jest zwykle spowodowane współistniejącymi chorobami, stosowaniem leków przeciwpsychotycznych, o których wiadomo, że powodują zwiększenie masy ciała, niewłaściwym stylem życia i może prowadzić do ciężkich powikłań.
- CHPL leku Abilium, kapsułki twarde, 10 mgSpecjalne środki ostrozności
Po wprowadzeniu arypiprazolu do obrotu obserwowano zwiększenie masy ciała u pacjentów stosujących ten lek. Jeśli stwierdzano zwiększenie masy, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych arypiprazol nie powodował klinicznie istotnego zwiększenia masy ciała u dorosłych (patrz punkt 5.1). W badaniach klinicznych z udziałem młodzieży z epizodem manii w przebiegu zaburzenia afektywnego dwubiegunowego wykazano, że stosowanie arypiprazolu ma związek ze zwiększeniem masy ciała po 4 tygodniach leczenia. U młodzieży z zaburzeniem afektywnym dwubiegunowym należy kontrolować zwiększenie masy ciała. Jeśli przyrost masy ciała jest znaczący klinicznie, należy rozważyć zmniejszenie dawki (patrz punkt 4.8). Dysfagia Zaburzenia kurczliwości mięśniówki przełyku i aspiracja wynikają ze stosowania leków przeciwpsychotycznych, w tym arypiprazolu.
- CHPL leku Abilium, kapsułki twarde, 10 mgSpecjalne środki ostrozności
Arypiprazol należy stosować ostrożnie u pacjentów z ryzykiem wystąpienia zachłystowego zapalenia płuc. Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Podczas przyjmowania arypiprazolu u pacjentów mogą występować nasilone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy to: zwiększenie popędu seksualnego, kompulsywna potrzeba wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania. Ważne, aby lekarze przepisujący lek pytali pacjentów lub opiekunów zwłaszcza o wystąpienie nowego lub nasilonego popędu do hazardu, popędów seksualnych, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa, czy kompulsywnego objadania się, lub innych popędów podczas leczenia arypiprazolem.
- CHPL leku Abilium, kapsułki twarde, 10 mgSpecjalne środki ostrozności
Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu leku. Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Lekarz rozważy zmianę dawki lub odstawienie produktu, jeśli u pacjenta wystąpią takie popędy podczas przyjmowania arypiprazolu (patrz punkt 4.8). Pacjenci ze współistniejącym ADHD Pomimo wysokiej częstości współistnienia zaburzenia afektywnego dwubiegunowego typu I oraz ADHD, dane dotyczące bezpieczeństwa jednoczesnego stosowania arypiprazolu oraz substancji psychoaktywnych działających pobudzająco są bardzo ograniczone; dlatego należy zachować wyjątkową ostrożność w okresie jednoczesnego stosowania tych produktów leczniczych. Upadki Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków.
- CHPL leku Abilium, kapsułki twarde, 10 mgSpecjalne środki ostrozności
Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2). Produkt leczniczy Abilium zawiera sód Produkt leczniczy Abilium zawiera mniej niż 1 mmol (23 mg) sodu na kapsułkę, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Abilium, kapsułki twarde, 10 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na antagonistyczne działanie na receptor adrenergiczny α1, arypiprazol może nasilać działanie niektórych leków przeciwnadciśnieniowych. Ze względu na pierwotne działanie arypiprazolu na OUN, należy zachować ostrożność, jeśli arypiprazol jest przyjmowany razem z alkoholem lub z innymi produktami leczniczymi działającymi na OUN, powodującymi zbliżone działania niepożądane, takie jak zmniejszenie aktywności ośrodkowego układu nerwowego (patrz punkt 4.8). Należy zachować ostrożność podając arypiprazol równocześnie z produktami leczniczymi, o których wiadomo, że powodują wydłużenie odstępu QT lub zaburzenia elektrolitowe. Możliwy wpływ innych produktów leczniczych na arypiprazol Antagonista receptora H2- famotydyna, lek hamujący uwalnianie kwasu żołądkowego, zmniejsza szybkość wchłaniania arypiprazolu, jednak działanie to nie ma znaczenia klinicznego.
- CHPL leku Abilium, kapsułki twarde, 10 mgInterakcje
Arypiprazol jest metabolizowany na wiele sposobów, w tym także przez enzymy, takie jak CYP2D6 i CYP3A4. Nie jest jednak metabolizowany przez enzymy z grupy CYP1A, a więc nie jest konieczne stosowanie zmodyfikowanych dawek u palaczy tytoniu. Chinidyna i inne inhibitory CYP2D6 Wyniki badań klinicznych z udziałem zdrowych osób wykazały, że silny inhibitor enzymu CYP2D6 (chinidyna) zwiększa pole pod krzywą AUC arypiprazolu o 107%, podczas gdy Cmax się nie zmienia. AUC i Cmax dehydroarypiprazolu, czynnego metabolitu, były zmniejszone odpowiednio o 32% i 47%. Podczas jednoczesnego podawania chinidyny i arypiprazolu, należy zmniejszyć dawkę produktu Abilium o około połowę w stosunku do przepisanej dawki. Inne silne inhibitory grupy enzymów CYP2D6, takie jak fluoksetyna i paroksetyna, mogą powodować podobne skutki, dlatego w takich sytuacjach należy podobnie zmniejszyć ich dawkę.
- CHPL leku Abilium, kapsułki twarde, 10 mgInterakcje
Ketokonazol i inne inhibitory CYP3A4 Wyniki badań klinicznych z udziałem zdrowych osób wskazują, że silny inhibitor CYP3A4 (ketokonazol) zwiększa pole pod krzywą AUC i Cmax arypiprazolu odpowiednio o 63% i 37%, a AUC i Cmax dehydroarypiprazolu odpowiednio o 77 % i 43%. W grupie osób o zmniejszonej aktywności CYP2D6, równoczesne stosowanie silnych inhibitorów CYP3A4 może powodować zwiększenie stężenia arypiprazolu w osoczu, w porównaniu do osób o zwiększonej aktywności CYP2D6. Po jednoczesnym zastosowaniu ketokonazolu lub innych silnych inhibitorów CYP3A4 z arypiprazolem, zakładane korzyści powinny przeważyć ryzyko dla pacjenta. W przypadku jednoczesnego stosowania ketokonazolu z arypiprazolem, przepisaną dawkę produktu Abilium należy zmniejszyć o około połowę. Inne leki silnie hamujące aktywność CYP3A4, takie jak itrakonazol oraz inhibitory proteazy HIV, mogą powodować podobne skutki jak ketokonazol i w takich przypadkach należy podobnie zmniejszyć dawki (patrz punkt 4.2).
- CHPL leku Abilium, kapsułki twarde, 10 mgInterakcje
Po odstawieniu inhibitora CYP2D6 lub CYP3A4, dawkę produktu Abilium należy zwiększyć do tej, jaką stosowano przed rozpoczęciem leczenia skojarzonego. W czasie równoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazemu) lub CYP2D6 (np. escytalopramu) z arypiprazolem, można spodziewać się niewielkiego zwiększenia stężenia arypiprazolu w osoczu. Karbamazepina i inne leki indukujące CYP3A4 Po jednoczesnym podaniu karbamazepiny, silnego induktora CYP3A4 w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnia geometryczna Cmax i pole pod krzywą AUC arypiprazolu zmniejszyły się odpowiednio o 68% i 73%, w stosunku do wartości tych parametrów podczas stosowania arypiprazolu (30 mg) w monoterapii. Podobnie, w przypadku dehydroarypiprazolu średnia geometryczna Cmax i pole pod krzywą AUC po jednoczesnym podaniu karbamazepiny zmniejszały się odpowiednio o 69% i 71% w stosunku do ich wartości podczas leczenia samym arypiprazolem.
- CHPL leku Abilium, kapsułki twarde, 10 mgInterakcje
Dawkę arypiprazolu należy podwoić, gdy jednocześnie stosuje się ten produkt z karbamazepiną. Można się spodziewać, że jednoczesne podawanie arypiprazolu i innych silnych induktorów CYP3A4 (takich, jak ryfampicyna, ryfabutyna, fenytoina, fenobarbital, prymidon, efawirenz, newirapina i ziele dziurawca) mogą działać podobnie, dlatego dawkę należy podobnie zwiększyć. Po zakończeniu stosowania silnego induktora CYP3A4, dawkę arypiprazolu należy zmniejszyć do zalecanej. Walproinian i lit Skojarzone stosowanie walproinianów lub litu z arypiprazolem nie powodowało żadnych klinicznie istotnych zmian stężenia arypiprazolu i w związku z tym nie jest konieczne dostosowanie dawki podczas podawania walproinianu lub litu w skojarzeniu z arypiprazolem. Możliwy wpływ arypiprazolu na inne produkty lecznicze W czasie badań klinicznych, dawki arypiprazolu od 10 mg do 30 mg na dobę nie wywierały istotnego wpływu na metabolizm substratów CYP2D6 (współczynnik dekstrometorfan/3-metoksymorfinan), CYP2C9 (warfaryna), CYP2C19 (omeprazol) i CYP3A4 (dekstrometorfan).
- CHPL leku Abilium, kapsułki twarde, 10 mgInterakcje
Ponadto, w warunkach in vitro arypiprazol i dehydroarypiprazol nie zmieniały metabolizmu zachodzącego z udziałem CYP1A2. Istnieje zatem małe prawdopodobieństwo wystąpienia istotnych klinicznie interakcji między produktami leczniczymi metabolizowanymi przez te enzymy. Kiedy arypiprazol był podawany z walproinianem, litem lub lamotryginą, nie stwierdzono klinicznie istotnej zmiany w stężeniach walproinianu, litu ani lamotryginy. Zespół serotoninowy Obserwowano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol, a objawy przedmiotowe oraz podmiotowe dla tego stanu mogą wystąpić szczególnie w przypadku jednoczesnego stosowania innych leków serotoninergicznych, takich jak SSRI/SNRI (selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny) lub produktów leczniczych, o których wiadomo, że zwiększają stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Abilium, kapsułki twarde, 10 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Dotychczas nie przeprowadzono odpowiednio kontrolowanych badań dotyczących działania arypiprazolu u kobiet w ciąży. Zgłaszano wady wrodzone, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. Na podstawie wyników badań przeprowadzonych na zwierzętach nie można wykluczyć potencjalnego toksycznego wpływu arypiprazolu na płód (patrz punkt 5.3). Konieczne jest zalecenie pacjentkom, aby poinformowały lekarza, jeśli w trakcie leczenia arypiprazolem zajdą w ciąże lub planują zajście w ciążę. Ze względu na niewystarczające dane dotyczące bezpieczeństwa u ludzi oraz budzące wątpliwości wyniki badań na zwierzętach, ten lek nie może być stosowany w okresie ciąży, chyba że spodziewane korzyści wyraźnie przewyższają ryzyko dla płodu.
- CHPL leku Abilium, kapsułki twarde, 10 mgWpływ na płodność, ciążę i laktację
Noworodki narażone na działanie leków przeciwpsychotycznych (w tym arypiprazolu) w czasie trzeciego trymestru ciąży znajdują się w grupie ryzyka, w której mogą wystąpić działania niepożądane, w tym zaburzenia pozapiramidowe i (lub) zespół odstawienia, które po porodzie mogą różnić się ciężkością przebiegu oraz czasem trwania. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane ze ssaniem. W związku z powyższym noworodki z tej grupy powinny być uważnie monitorowane (patrz punkt 4.8). Karmienie piersi? Arypiprazol/metabolity przenikają do mleka ludzkiego. Należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać przyjmowanie arypiprazolu, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem na reprodukcję.
- CHPL leku Abilium, kapsułki twarde, 10 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe, senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku Abilium, kapsułki twarde, 10 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa W badaniach klinicznych kontrolowanych placebo najczęściej zgłaszanymi działaniami niepożądanymi były akatyzja i nudności, każde występujące częściej niż u 3% pacjentów leczonych arypiprazolem podawanym doustnie. Tabelaryczne zestawienie działań niepożądanych Częstość występowania działań niepożądanych związanych z leczeniem arypiprazolem podano w poniższej tabeli. Dane w tabeli oparto na działaniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układów i narządów i częstości: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000); częstość nieznana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Abilium, kapsułki twarde, 10 mgDziałania niepożądane
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Nie można określić częstości działań niepożądanych zgłaszanych po wprowadzeniu arypiprazolu do obrotu, ponieważ pochodzą one ze spontanicznych zgłoszeń. Z tego względu częstość takich działań niepożądanych określono jako „nieznana”. Zaburzenia krwi i układu chłonnego Zaburzenia układu immunologicznego Często: Leukopenia Niezbyt często: Neutropenia, Trombocytopenia Nieznana: Reakcje uczuleniowe (np. reakcja anafilaktyczna, obrzęk naczynioruchowy z obrzękiem języka, obrzękiem twarzy, świądem lub pokrzywką) Zaburzenia endokrynologiczne ... Zaburzenia metabolizmu i odżywiania Cukrzyca Hyperprolaktynemia Zmniejszenie stężenia prolaktyny we krwi Hiperglikemia Cukrzycowa śpiączka hiperosmotyczna Kwasica ketonowa Hiponatremia Anoreksja Zaburzenia psychiczne ...
- CHPL leku Abilium, kapsułki twarde, 10 mgDziałania niepożądane
Zaburzenia układu nerwowego Bezsenność Lęk Niepokój zwłaszcza ruchowy Akatyzja Zaburzenia pozapiramidowe Drżenie Bóle głowy Sedacja Senność Zawroty głowy Depresja Hiperseksualność Późne dyskinezy Dystonia Zespół „niespokojnych nóg” Próby samobójcze, myśli samobójcze i samobójstwa (patrz punkt 4.4) Patologiczne uzależnienie od hazardu Zaburzenia kontroli impulsów Obżarstwo Kompulsywna potrzeba wydawania pieniędzy Poriomania Zachowania agresywne Nadmierne pobudzenie Nerwowość Złośliwy zespół neuroleptyczny (ang. NMS) Drgawki typu grand mal Zespół serotoninowy Zaburzenia mowy Zaburzenia oka ... Zaburzenia serca ... Zaburzenia naczyniowe ... Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Niewyraźne widzenie Podwójne widzenie Światłowstręt (fotofobia) Tachykardia Hipotensja ortostatyczna Czkawka Napad przymusowego patrzenia z rotacją gałek ocznych Nagły niewyjaśniony zgon Torsade de pointes Arytmie komorowe Zatrzymanie akcji serca Bradykardia Choroba zakrzepowo-zatorowa żył (w tym zator płucny i zakrzepica żył głębokich) Nadciśnienie tętnicze Omdlenia Zachłystowe zapalenie płuc Skurcz krtani Skurcz części ustnej gardła Zaburzenia żołądka i jelit ...
- CHPL leku Abilium, kapsułki twarde, 10 mgDziałania niepożądane
Zaburzenia wątroby i dróg żółciowych Zaparcia Niestrawność Nudności Nadmierne wydzielanie śliny Wymioty Zapalenie trzustki Dysfagia Biegunka Dyskomfort w jamie brzusznej Dyskomfort w obrębie żołądka Niewydolność wątroby Zapalenie wątroby Żółtaczka Zaburzenia skóry i tkanki podskórnej ... Zaburzenia mięśniowo-szkieletowe i tkanki łącznej ... Zaburzenia nerek i dróg moczowych ... Ciąża, połóg i okres okołoporodowy ... Zaburzenia układu rozrodczego i piersi ... Zaburzenia ogólne i stany w miejscu podania Zmęczenie Wysypka Reakcja fotoalergiczna Łysienie Nadmierne pocenie się Wysypka polekowa z eozynofilią i objawami ogólnoustrojowymi (zespół DRESS) Rabdomioliza Bóle mięśniowe Sztywność Nietrzymanie moczu Zatrzymanie wydalania moczu Zespół odstawienia u niemowląt (patrz punkt 4.6) Priapizm Zaburzenia regulacji temperatury ciała (np.
- CHPL leku Abilium, kapsułki twarde, 10 mgDziałania niepożądane
hipotermia, gorączka) Ból w klatce piersiowej Obrzęk obwodowy Zmniejszenie masy ciała Zwiększenie masy ciała Zwiększenie aktywności aminotransferazy alaninowej Zwiększenie aktywności aminotransferazy asparaginianowej Zwiększenie aktywności gammaglutamylotransferazy Zwiększenie aktywności fosfatazy alkalicznej Wydłużenie odstępu QT Zwiększenie stężenia glukozy we krwi Zwiększenie stężenia glikozylowanej hemoglobiny Wahania stężenia glukozy we krwi Zwiększenie aktywności fosfokinazy kreatynowej Opis wybranych działań niepożądanych Dorośli Objawy pozapiramidowe (ang. EPS) w długotrwałym 52-tygodniowym kontrolowanym badaniu u pacjentów leczonych arypiprazolem, ogólnie rzadziej występowały EPS (25,8%), w tym parkinsonizm, akatyzja, dystonia i dyskineza, niż u pacjentów leczonych haloperydolem (57,3%).
- CHPL leku Abilium, kapsułki twarde, 10 mgDziałania niepożądane
W długotrwałym 26-tygodniowym badaniu kontrolowanym placebo, częstość występowania EPS wynosiła 19% u pacjentów leczonych arypiprazolem i 13,1% u pacjentów otrzymujących placebo. W innym długotrwałym 26-tygodniowym kontrolowanym badaniu częstość występowania EPS wynosiła 14,8% u pacjentów leczonych arypiprazolem i 15,1% u pacjentów otrzymujących olanzapinę. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I: w 12-tygodniowym kontrolowanym badaniu objawy EPS stwierdzano u 23,5% pacjentów leczonych arypiprazolem i u 53,3% u pacjentów leczonych haloperydolem. W innym 12-tygodniowym badaniu EPS stwierdzano u 26,6% pacjentów leczonych arypiprazolem i 17,6% pacjentów leczonych litem. W długotrwałym 26-tygodniowym kontrolowanym badaniu placebo w leczeniu podtrzymującym objawy EPS stwierdzano u 18,2% u pacjentów leczonych arypiprazolem i 15,7% u pacjentów otrzymujących placebo.
- CHPL leku Abilium, kapsułki twarde, 10 mgDziałania niepożądane
Akatyzja w kontrolowanych placebo badaniach u pacjentów z zaburzeniami afektywnymi dwubiegunowymi akatyzja występowała u 12,1% pacjentów leczonych arypiprazolem i u 3,2% pacjentów otrzymujących placebo. U pacjentów ze schizofrenią akatyzję stwierdzano u 6,2% pacjentów w grupie arypiprazolu i 3,0% w grupie placebo. Dystonia: Efekt klasy terapeutycznej: objawy dystonii, długotrwałe, nieprawidłowe kurcze grup mięśni, mogą występować u wrażliwych pacjentów przez kilka pierwszych dni leczenia. Do objawów dystonii należą: kurcze mięśni szyi, czasami postępujące do ucisku w gardle, trudności z przełykaniem, trudności z oddychaniem i (lub) zaburzenia ruchów języka. Chociaż objawy te mogą występować po zastosowaniu małych dawek, występują częściej i z większym nasileniem podczas stosowania leków przeciwpsychotycznych pierwszej generacji w większych dawkach. Obserwowano zwiększone ryzyko ostrej dystonii u mężczyzn i w młodszych grupach wiekowych.
- CHPL leku Abilium, kapsułki twarde, 10 mgDziałania niepożądane
Prolaktyna: Podczas badań klinicznych w zakresie zarejestrowanych wskazań i po wprowadzeniu produktu leczniczego do obrotu, u pacjentów otrzymujących arypiprazol obserwowano zarówno zwiększenie, jak i zmniejszenie stężenia prolaktyny w surowicy w porównaniu do pomiarów początkowych (punkt 5.1). Parametry laboratoryjne: Porównania między arypiprazolem i placebo dotyczące odsetka pacjentów, u których wystąpiły potencjalnie istotne zmiany rutynowych parametrów laboratoryjnych i lipidowych (patrz punkt 5.1), nie wykazały klinicznie istotnych różnic. Ogólnie przejściowe i bezobjawowe zwiększenie aktywności CPK (fosfokinazy kreatynowej) obserwowano u 3,5% pacjentów leczonych arypiprazolem w porównaniu do 2,0% pacjentów otrzymujących placebo. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej: W krótkotrwałym badaniu kontrolowanym placebo, w którym wzięło udział 302 nastolatków (13-17 lat) chorych na schizofrenię, częstość występowania i rodzaj działań niepożądanych były podobne do występujących u dorosłych, z wyjątkiem następujących działań niepożądanych zgłaszanych częściej u nastolatków otrzymujących arypiprazol niż u dorosłych otrzymujących arypiprazol (i częściej niż w grupie placebo): senność/sedacja i zaburzenia pozapiramidowe zgłaszane bardzo często (≥ 1/10) oraz suchość w jamie ustnej, zwiększony apetyt, niedociśnienie ortostatyczne zgłaszane często (≥1/100 do <1/10).
- CHPL leku Abilium, kapsułki twarde, 10 mgDziałania niepożądane
Profil bezpieczeństwa w 26-tygodniowym badaniu prowadzonym na zasadzie próby otwartej, był podobny do obserwowanego w badaniu krótkotrwałym z kontrolą placebo. Profil bezpieczeństwa w długoterminowym badaniu prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo był podobny z wyjątkiem następujących reakcji, które były zgłaszane częściej, niż w grupie dzieci i młodzieży przyjmujących placebo: często zgłaszano zmniejszenie masy ciała, zwiększenie stężenia insuliny we krwi, arytmię i leukopenię (≥1/100 do <1/10). W zebranej populacji nastolatków (13-17 lat) chorych na schizofrenię, leczonych do 2 lat, przypadki małego stężenia prolaktyny w surowicy stwierdzono u 29,5% dziewcząt (<3 ng/ml) i 48,3% chłopców (<2 ng/ml). W grupie młodzieży (w wieku 13-17 lat) ze schizofrenią, otrzymującej dawki arypiprazolu od 5 mg do 30 mg przez okres maksymalnie do 72 miesięcy, częstość występowania małych stężeń prolaktyny w surowicy u pacjentek (<3 ng/ml) i u pacjentów (<2 ng/ml) wynosiła odpowiednio 25,6% i 45,0%.
- CHPL leku Abilium, kapsułki twarde, 10 mgDziałania niepożądane
Podczas dwóch długoterminowych badań z udziałem młodzieży (13-17 lat) ze schizofrenią i pacjentów z chorobą afektywną dwubiegunową leczonych arypiprazolem, częstość występowania małych stężeń prolaktyny w surowicy u kobiet (<3 ng/ml) i mężczyzn (<2 ng/ml) wynosiła odpowiednio 37,0% i 59,4%. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej Częstość występowania i rodzaj działań niepożądanych u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I były podobne do występujących u dorosłych, z wyjątkiem następujących działań niepożądanych: bardzo często (≥1/10) senność (23,0%), zaburzenia pozapiramidowe (18,4%), akatyzja (16,0%) i zmęczenie (11,8%); często (≥1/100 do <1/10) ból w górnej części brzucha, zwiększenie częstości akcji serca, zwiększenie masy ciała, zwiększenie apetytu, drżenie mięśni oraz dyskineza.
- CHPL leku Abilium, kapsułki twarde, 10 mgDziałania niepożądane
Następujące działania niepożądane miały prawdopodobnie związek z zastosowaną dawką: zaburzenia pozapiramidowe (częstość występowania dla dawki 10 mg wynosiła 9,1%, dla dawki 30 mg 28,8%, dla placebo 1,7%); i akatyzja (częstość występowania dla dawki 10 mg wynosiła 12,1%, dla dawki 30 mg 20,3%, dla placebo 1,7%). Średnie zmiany masy ciała u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I po 12. oraz 30. tygodniu leczenia wynosiły, odpowiednio, dla arypiprazolu 2,4 kg oraz 5,8 kg, a dla placebo 0,2 kg oraz 2,3 kg. W populacji dzieci i młodzieży senność oraz zmęczenie obserwowano częściej u pacjentów z zaburzeniem afektywnym dwubiegunowym, w porównaniu do pacjentów ze schizofrenią. W populacji dzieci i młodzieży z zaburzeniem afektywnym dwubiegunowym (10-17 lat), leczonych do 30 tygodni, małe stężenia prolaktyny w surowicy stwierdzono u 28,0% dziewcząt (<3 ng/ml) i u 53,3% chłopców (<2 ng/ml).
- CHPL leku Abilium, kapsułki twarde, 10 mgDziałania niepożądane
Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów U pacjentów leczonych arypiprazolem może wystąpić patologiczne uzależnienie od hazardu, hiperseksualność, kompulsywna potrzeba wydawania pieniędzy i obżarstwo lub kompulsywne objadanie się (patrz punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al.
- CHPL leku Abilium, kapsułki twarde, 10 mgDziałania niepożądane
Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49-21301, faks: + 48 22 49-21-309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Abilium, kapsułki twarde, 10 mgPrzedawkowanie
4.9 Przedawkowanie 13. Objawy przedmiotowe i podmiotowe W badaniach klinicznych i po wprowadzeniu arypiprazolu do obrotu zgłaszano przypadkowe bądź zamierzone przedawkowanie samego arypiprazolu przez dorosłych pacjentów w szacowanej dawce do 1260 mg niezakończone zgonem. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: letarg, zwiększenie ciśnienia tętniczego krwi, senność, przyspieszenie czynności serca (tachykardia), nudności, wymioty i biegunka. Ponadto zgłaszano przypadkowe przedawkowanie samego arypiprazolu (do 195 mg) u dzieci, bez zgonów. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: senność, przejściowa utrata świadomości i objawy pozapiramidowe. Postępowanie po przedawkowaniu Po przedawkowaniu arypiprazolu stosuje się leczenie podtrzymujące, polegające na utrzymaniu drożności dróg oddechowych, dotlenianiu i wentylacji oraz leczenie objawowe.
- CHPL leku Abilium, kapsułki twarde, 10 mgPrzedawkowanie
Należy wziąć pod uwagę możliwość wpływu wielu produktów leczniczych. Z tego względu należy niezwłocznie rozpocząć monitorowanie czynności układu krążenia, włączając stałe monitorowanie zapisu elektrokardiograficznego, w celu wykrycia możliwych zaburzeń rytmu serca. Wiedząc lub podejrzewając przedawkowanie arypiprazolu należy wnikliwie monitorować pacjenta i obserwować go do czasu poprawy jego stanu. Węgiel aktywny (50 g), podany w godzinę po zażyciu arypiprazolu, zmniejsza Cmax arypiprazolu o około 41%, a pole pod krzywą AUC o około 51%, co wskazuje na jego skuteczność w leczeniu przedawkowania. Hemodializa Pomimo braku informacji dotyczących wpływu hemodializ w leczeniu przedawkowania arypiprazolu, jest mało prawdopodobne, aby hemodializy były użyteczne w takich sytuacjach, ze względu na znaczny stopień wiązania się arypiprazolu z białkami osocza.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12. Mechanizm działania Uważa się, że skuteczność arypiprazolu w leczeniu schizofrenii i zaburzenia afektywnego dwubiegunowego typu I jest związana ze skojarzonym działaniem częściowo agonistycznym w stosunku do receptora dopaminowego D2 i serotoninowego 5HT1a oraz antagonistycznym w stosunku do receptora serotoninowego 5HT2a. Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D2 i D3, serotoninowych 5HT1a i 5HT2a oraz umiarkowane powinowactwo do receptorów dopaminowych D4, serotoninowych 5HT2c i 5HT7, a także adrenergicznych alfa-1 i histaminowych H1.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Skuteczność kliniczna i bezpieczeństwo stosowania Dorośli Schizofrenia Wyniki trzech krótkotrwałych badań (4 do 6 tygodni) z kontrolą placebo, z udziałem 1228 dorosłych chorych na schizofrenię, u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje istotnie większą poprawę w zakresie objawów psychotycznych niż placebo. Arypiprazol jest skuteczny w podtrzymywaniu poprawy klinicznej podczas kontynuacji leczenia u tych dorosłych pacjentów, u których obserwowano wstępną dobrą reakcję na lek.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
W badaniu z grupą kontrolną przyjmującą haloperydol, odsetek pacjentów, u których udało się utrzymać dobrą reakcję na lek, przez 52 tygodnie był podobny w obu grupach (arypiprazol 77% i haloperydol 73%). Badanie ukończyła istotnie większa grupa pacjentów leczonych arypiprazolem (43%) niż haloperydolem (30%). Wyniki uzyskane w skalach ocen stosowanych jako wtórne mierniki skuteczności, w tym w skali PANSS i w skali oceny depresji Montgomery-Asberg (MADRS), wskazują na istotną przewagę arypiprazolu nad haloperydolem. W trwającym 26 tygodni badaniu kontrolowanym placebo, z udziałem pacjentów dorosłych z ustabilizowaną przewlekłą schizofrenią stwierdzono, że leczenie arypiprazolem powoduje rzadsze występowanie nawrotów (34% w grupie leczonych arypiprazolem i 57% w grupie otrzymującej placebo). Zwiększenie masy ciała Wyniki badań klinicznych wskazują, że arypiprazol nie powoduje klinicznie istotnego przyrostu masy ciała.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
W trwającym 26 tygodni badaniu z grupą kontrolną, przeprowadzonym w wielu krajach, udział wzięło 314 dorosłych pacjentów ze schizofrenią. Pacjentów leczono olanzapiną i z wykorzystaniem podwójnie ślepej próby. Pierwotnym celem była ocena przyrostu masy ciała. W istotnie mniejszej grupie pacjentów leczonych arypiprazolem, w porównaniu z otrzymującymi olanzapinę stwierdzono przyrost masy ciała o ≥7%, względem pomiaru początkowego (tzn. zwiększenie masy ciała o co najmniej 5,6 kg przy średniej początkowej masie wynoszącej ok. 80,5 kg) w grupie leczonych arypiprazolem (n = 18 lub 13% pacjentów, których wyniki poddawano analizie), w porównaniu z olanzapiną (n = 45 lub 33% pacjentów, których wyniki poddawano analizie). Stężenia lipidów W zbiorczej analizie wyników stężeń lipidów pochodzących z kontrolowanych placebo badań klinicznych u dorosłych, arypiprazol nie powodował klinicznie istotnych zmian stężeń cholesterolu całkowitego, triglicerydów, cholesterolu HDL i cholesterolu LDL.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
Prolaktyna Stężenia prolaktyny oceniono podczas wszystkich badań z zastosowaniem wszystkich dawek arypiprazolu (n = 28 242). Częstość występowania hiperprolaktynemii lub zwiększenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem (0,3%) była podobna do częstości występowania hiperprolaktynemii w grupie otrzymującej placebo (0,2%). U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 42 dni, a mediana czasu trwania wynosiła 34 dni. Częstość występowania hiperprolaktynemii lub zmniejszenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem wynosiła 0,4% w porównaniu do 0,02% w grupie otrzymującej placebo. U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 30 dni, a mediana czasu trwania wynosiła 194 dni. 15.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I W dwóch 3-tygodniowych badaniach, kontrolowanych placebo, z zastosowaniem zmiennej dawki, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol w monoterapii był znacząco bardziej skuteczny niż placebo w zmniejszaniu objawów maniakalnych w ciągu 3 tygodni. Badania te dotyczyły pacjentów z objawami lub bez objawów psychotycznych oraz pacjentów z szybką zmianą fazy lub bez szybkiej zmiany fazy (przebieg typu rapid-cycling). W jednym 3-tygodniowym badaniu, kontrolowanym placebo, z zastosowaniem stałej dawki w monoterapii, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol nie wykazał większej skuteczności niż placebo.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
W dwóch 12-tygodniowych badaniach, kontrolowanych placebo oraz innymi substancjami czynnymi, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, arypiprazol był skuteczniejszy niż placebo w 3. tygodniu badania, a wynik leczenia podtrzymującego był w 12. tygodniu badania porównywalny z wynikiem dla litu lub haloperydolu. W 12. tygodniu arypiprazol powodował także remisję objawów maniakalnych u porównywalnej liczby pacjentów co lit lub haloperydol. W 6-tygodniowym, kontrolowanym placebo, badaniu u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, którzy częściowo nie reagowali na monoterapię litem lub walproinianem przez 2 tygodnie przy terapeutycznych stężeniach w surowicy, zastosowanie arypiprazolu jako dodatkowego leku w większym stopniu zwiększyło skuteczność zapobiegania objawom maniakalnym niż stosowanie litu lub walproinianu w monoterapii.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
W 26-tygodniowym, kontrolowanym placebo, badaniu które przedłużono o 74 tygodnie, u pacjentów z objawami maniakalnymi, którzy osiągnęli remisję w trakcie stosowania arypiprazolu w czasie fazy stabilizacji przed randomizacją, arypiprazol był bardziej skuteczny niż placebo w zapobieganiu nawrotowi choroby dwubiegunowej, głównie w zapobieganiu nawrotowi objawów maniakalnych, ale nie wykazał przewagi nad placebo w zapobieganiu nawrotowi depresji. W 52-tygodniowym, kontrolowanym placebo badaniu, u pacjentów z obecnym epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, którzy osiągnęli trwałą remisję (w skali oceny manii Younga Y-MRS oraz w skali oceny depresji Montgomery-Asberg MADRS z całkowitą liczbą punktów ≤12) podczas stosowania arypiprazolu (w dawce 10 mg na dobę do 30 mg na dobę) jednocześnie z litem lub walproinianem przez 12 kolejnych tygodni, wykazano przewagę stosowania z arypiprazolem nad placebo w zapobieganiu nawrotowi choroby afektywnej dwubiegunowej (współczynnik ryzyka 0,54), zmniejszając ryzyko o 46% i w zapobieganiu nawrotom manii, zmniejszając ryzyko o 65% (współczynnik ryzyka 0,35), ale nie wykazano przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
Skojarzenie z arypiprazolem wykazało przewagę nad placebo w przypadku drugorzędowego punktu oceny, skala ogólnego wrażenia klinicznego (ang. CGI-BP) nasilenia choroby (mania). W tym badaniu, pacjenci zostali przydzieleni przez badaczy do badania prowadzonego metodą próby otwartej, z zastosowaniem litu lub walproinianu w monoterapii, w celu oceny częściowego braku odpowiedzi. Pacjenci byli stabilizowani przez co najmniej 12 kolejnych tygodni za pomocą skojarzenia arypiprazolu i stosowanego wcześniej stabilizatora nastroju. Pacjenci stabilni byli następnie losowo przydzielani do grupy kontynuującej stosowanie tego samego stabilizatora nastroju z arypiprazolem lub placebo w badaniu metodą podwójnie ślepej próby. W fazie randomizowanej oceniano cztery podgrupy stabilizatora nastroju: arypiprazol + lit; arypiprazol + walproinian; placebo + lit; placebo + walproinian.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
Współczynniki Kaplana-Meiera dla nawrotu jakiegokolwiek zaburzenia nastroju w przypadku terapii skojarzonej były następujące: 16% dla grupy stosującej arypiprazol + lit i 18% dla grupy arypiprazol + walproinian, w porównaniu do 45% dla grupy placebo + lit i 19% dla grupy placebo + walproinian. 16. Populacja dzieci i młodzieży Schizofrenia u młodzieży Wyniki 6-tygodniowego badania z kontrolą placebo z udziałem 302 nastoletnich pacjentów z schizofrenią (13-17 lat), u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje statystycznie istotnie większą poprawę w zakresie objawów psychotycznych niż placebo. W analizie podgrupy nastoletnich pacjentów w wieku pomiędzy 15 a 17 lat, stanowiącej 74% całkowitej włączonej populacji, w czasie trwania 26-tygodniowego badania prowadzonego na zasadzie próby otwartej obserwowano utrzymywanie się działania.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
W badaniu z randomizacją, prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo, trwającym 60-89 tygodni, które prowadzono z udziałem młodzieży ze schizofrenią (n = 146; w wieku 13-17 lat) występowała statystycznie znamienna różnica w zakresie odsetka nawrotów objawów psychotycznych pomiędzy grupą otrzymującą arypiprazol (19,39 %) a grupą otrzymującą placebo (37,5 %). Punkt szacunkowy współczynnika ryzyka (HR) w całej populacji wynosił 0,461 (95% przedział ufności, 0,242-0,879). W analizach w podgrupach punkt szacunkowy współczynnika ryzyka wynosił 0,495 wśród uczestników w wieku od 13 do 14 lat w porównaniu do 0,454 wśród uczestników w wieku od 15 do 17 lat. Jednak ocena szacunkowa współczynnika ryzyka w grupie młodszych uczestników (13-14 lat) nie była precyzyjna, odzwierciedlając mniejszą liczebność uczestników w tej grupie (arypiprazol, n = 29; placebo, n = 12) i przedział ufności dla tej oceny szacunkowej (wynoszący od 0,151 do 1,628) uniemożliwiał wyciągnięcie wniosków odnośnie występowania wyniku leczenia.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
Natomiast 95% przedział ufności dla współczynnika ryzyka w podgrupie starszych uczestników (arypiprazol, n = 69; placebo, n = 36) wynosił od 0,242 do 0,879 i dlatego można wyciągnąć wnioski odnośnie wyników leczenia u starszych pacjentów. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u dzieci i młodzieży Arypiprazol badano w 30-tygodniowym badaniu kontrolowanym placebo z udziałem 296 dzieci i młodzieży (10-17 lat), którzy spełnili kryteria diagnostyczne według DSM-IV dla zaburzenia afektywnego dwubiegunowego typu I z epizodami maniakalnymi lub mieszanymi z objawami psychotycznymi lub bez tych objawów oraz wyjściowo mieli wynik ≥20 w skali manii według Younga (Y-MRS). Wśród pacjentów włączonych do podstawowej analizy skuteczności, 139 pacjentów miało postawioną diagnozę aktualnie współistniejącego ADHD. Arypiprazol wykazał przewagę w stosunku do placebo w odniesieniu do zmiany wartości wyjściowej w 4. oraz 12. tygodniu jako wynik całościowy wg Y-MRS.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
W dalszych analizach przewaga nad placebo była bardziej wyraźna u pacjentów ze współistniejącym zespołem ADHD niż u pacjentów bez ADHD, gdzie nie zaobserwowano różnicy w stosunku do placebo. Zapobieganie nawrotom nie zostało określone. Drażliwość związana z zaburzeniami autystycznymi u dzieci i młodzieży (patrz punkt 4.2) U pacjentów w wieku od 6 do 17 lat arypiprazol badano w dwóch 8-tygodniowych badaniach z zastosowaniem placebo [w jednym badaniu stosowano zmienną dawkę (2 mg -15 mg/dobę), a w drugim stałą dawkę (5 mg, 10 mg lub 15 mg/dobę)] oraz jednym 52-tygodniowym badaniu otwartym. Dawkowanie w tych badaniach rozpoczynano od dawki 2 mg/dobę, po tygodniu zwiększanej do 5 mg/dobę, a następnie zwiększanej w odstępach tygodniowych o 5 mg/dobę do czasu osiągnięcia dawki docelowej. Ponad 75% pacjentów miało mniej niż 13 lat. Arypiprazol wykazał statystycznie większą skuteczność w porównaniu do placebo w podskali dotyczącej drażliwości Listy Zachowań Aberracyjnych (ang.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
Aberrant Behaviour Checklist Irritability subscale). Jednak, nie ustalono znaczenia klinicznego tej obserwacji. Profil bezpieczeństwa dotyczył zwiększenia masy ciała i zmian stężenia prolaktyny. Czas trwania długotrwałego badania dotyczącego bezpieczeństwa był ograniczony do 52 tygodni. W zebranych badaniach, częstość występowania małego stężenia prolaktyny u dziewcząt (<3 ng/ml) i u chłopców (<2 ng/ml) leczonych arypiprazolem wynosiła odpowiednio, 27/46 (58,7%) i 258/298 (86,6%). W badaniach kontrolowanych placebo średni przyrost masy ciała wynosił 0,4 kg w grupie placebo i 1,6 kg w grupie arypiprazolu. Arypiprazol badano także w długoterminowym badaniu podtrzymującym, kontrolowanym placebo. Po 13-26-tygodniowej stabilizacji z zastosowaniem arypiprazolu (w dawkach 2 mg - 15 mg/dobę), pacjenci z trwałą odpowiedzią albo kontynuowali leczenie arypiprazolem, albo też otrzymywali placebo przez kolejne 16 tygodni. Współczynniki Kaplana-Meiera dla nawrotu w tygodniu 16.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
były następujące: 35% dla grupy stosującej arypiprazol oraz 52% dla grupy placebo; współczynnik ryzyka nawrotu w ciągu 16 tygodni (arypiprazol/placebo) wynosił 0,57 (różnica nieistotna statystycznie). Średnie zwiększenie masy ciała w fazie stabilizacji (do 26 tygodni) z zastosowaniem arypiprazolu wynosiło 3,2 kg, natomiast w drugiej fazie badania (16 tygodni) obserwowano dalszy średnie zwiększenie o 2,2 kg dla arypiprazolu w porównaniu do 0,6 kg dla placebo. Objawy pozapiramidowe były zgłaszane głównie w fazie stabilizacji u 17% pacjentów, z drgawkami stanowiącymi 6,5%. Tiki związane z zespołem Tourette’a u dzieci i młodzieży (patrz punkt 4.2) Skuteczność arypiprazolu badano u dzieci i młodzieży z zespołem Tourette’a (arypiprazol: n = 99, placebo: n = 44) w trwającym 8 tygodni, randomizowanym badaniu prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo w schemacie leczenia w grupach z zastosowaniem stałej dawki zależnej od masy ciała od 5 mg/dobę do 20 mg/dobę i dawki początkowej wynoszącej 2 mg.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
Pacjenci byli w wieku 7 - 17 lat i przed rozpoczęciem leczenia uzyskali średni wynik 30 na łącznej skali tików w Globalnej Skali Nasilenia Tików z Yale (Total Tic Score on the Yale Global Tic Severity Scale, TTS-YGTSS). Grupa pacjentów otrzymująca arypiprazol wykazywała poprawę mierzoną zmianą wyniku na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 8 tygodniu leczenia, która wynosiła 13,35 w grupie otrzymującej małą dawkę (5 mg lub 10 mg) i 16,94 w grupie otrzymującej dużą dawkę (10 mg lub 20 mg) w porównaniu do poprawy odnotowanej u pacjentów otrzymujących placebo i zmiany wynoszącej 7,09. Skuteczność arypiprazolu u dzieci i młodzieży z zespołem Touretta (arypiprazol: n = 32, placebo: n = 29) oceniano również w przypadku podawania zmiennych dawek od 2 mg/dobę do 20 mg/dobę z dawką początkową wynoszącą 2 mg, w trwającym 10 tygodni, randomizowanym badaniu w Korei Południowej prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakodynamiczne
Pacjenci w wieku od 6 do 18 lat uzyskali średni wynik 29 na skali TTS-YGTSS w pomiarze początkowym. Pacjenci otrzymujący arypiprazol wykazywali poprawę mierzoną zmianą wyniku o 14,97 na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 10 tygodniu w porównaniu do poprawy wynoszącej 9,62 w grupie placebo. W obu wspomnianych badaniach krótkotrwałych nie określono klinicznego znaczenia wyników dotyczących skuteczności, biorąc pod uwagę działanie terapeutyczne w porównaniu do istotnego wpływu efektu placebo i niejasne skutki w zakresie funkcjonowania psychospołecznego. Brak danych z badań długotrwałych dotyczących skuteczności i bezpieczeństwa arypiprazolu w tej niestabilnej chorobie. Europejska Agencja Leków wstrzymała obowiązek dołączania wyników badań referencyjnego produktu leczniczego zawierającego arypiprazol w jednej lub kilku podgrupach populacji dzieci i młodzieży w leczeniu schizofrenii oraz w leczeniu choroby afektywnej dwubiegunowej (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Arypiprazol jest dobrze wchłaniany, maksymalne stężenie w osoczu osiąga w ciągu 3-5 godzin po podaniu. Arypiprazol w minimalnym stopniu ulega metabolizmowi przedukładowemu. Bezwzględna dostępność po doustnym podaniu jednej tabletki wynosi 87%. Spożywanie posiłków o dużej zawartości tłuszczu nie wpływa na farmakokinetykę arypiprazolu. Dystrybucja Arypiprazol jest rozmieszczany w całym organizmie, pozorna objętość dystrybucji wynosi 4,9 l/kg, co wskazuje na znaczną dystrybucję pozanaczyniową. W stężeniach terapeutycznych arypiprazol i dehydroarypiprazol wiążą się w ponad 99% z białkami surowicy, głównie z albuminami. Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie. Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakokinetyczne
Jak wynika z badań in vitro, enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N-dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. W stanie stacjonarnym czynny metabolit, dehydroarypiprazol, stanowi około 40% pola pod krzywą AUC arypiprazolu w osoczu. Eliminacja Średni okres półtrwania arypiprazolu w fazie eliminacji wynosi około 75 godzin u osób o zwiększonej aktywności CYP2D6 i około 146 godzin u osób o zmniejszonej aktywności CYP2D6. Całkowity klirens arypiprazolu wynosi 0,7 ml/min/kg i jest to głównie klirens wątrobowy. Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [¹⁴C], stwierdza się odpowiednio 27% i 60% podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1% niezmienionego arypiprazolu zostaje wydalone z moczem i około 18% z kałem.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakokinetyczne
Dzieci i młodzież Farmakokinetyka arypiprazolu i dehydroarypiprazolu u dzieci w wieku od 10 do 17 lat była podobna do farmakokinetyki u dorosłych, po uwzględnieniu różnic w masie ciała. Farmakokinetyka w szczególnych grupach pacjentów Pacjenci w podeszłym wieku Nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi, nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Nie stwierdzono, aby farmakokinetyka arypiprazolu różniła się u zdrowych kobiet i zdrowych mężczyzn. Nie stwierdzono także żadnego mierzalnego wpływu płci na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Palenie tytoniu Populacyjne badania farmakokinetyczne nie wykazały żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu, zależnych od palenia tytoniu.
- CHPL leku Abilium, kapsułki twarde, 10 mgWłaściwości farmakokinetyczne
Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy. Zaburzenia czynności nerek Stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u osób z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badania obejmujące podanie pojedynczej dawki leku, przeprowadzone u osób z różnego stopnia marskością wątroby (klasy Child-Pugh A, B i C) nie wykazały, by niewydolność wątroby wpływała istotnie na farmakokinetykę arypiprazolu i dehydroarypiprazolu, jednak w badaniu wzięło udział tylko 3 chorych z marskością wątroby typu C, co jest liczbą niewystarczającą do wyciągnięcia wniosków dotyczących zdolności metabolicznych tych pacjentów.
- CHPL leku Abilium, kapsułki twarde, 10 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Istotne działanie toksyczne stwierdzano jedynie po podaniu dawek lub przy stopniu narażenia wyraźnie przekraczającym maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza (gromadzenie barwnika lipofuscyny i (lub) obumieranie komórek miąższowych) stwierdzany u szczurów po 104 tygodniach podawania arypiprazolu w dawce od 20 mg do 60 mg/kg mc./dobę (średnia wartość pola pod krzywą AUC w stanie stacjonarnym przekraczała od 3 do 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki) i zwiększenie częstości występowania raków nadnerczy, a także skojarzonej częstości występowania gruczolaków lub raków nadnerczy u samic szczurów otrzymujących lek w dawce 60 mg/kg mc./dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki).
- CHPL leku Abilium, kapsułki twarde, 10 mgPrzedkliniczne dane o bezpieczeństwie
Największa ekspozycja nie powodująca powstawania nowotworów u samic szczurów odpowiadała 7-krotnej ekspozycji u ludzi występującej po stosowaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych sprzężonych związków hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 mg do 125 mg/kg mc./dobę (średnia wartość AUC w stanie stacjonarnym była od 1 do 3 razy większa niż wartość występująca u ludzi po podaniu maksymalnej zalecanej dawki klinicznej lub 16 do 81 razy większa niż po podaniu maksymalnej dawki zalecanej na podstawie przeliczenia mg/m² pc). Jednak stężenie sprzężonych związków siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania największej proponowanej dawki 30 mg na dobę, nie przekraczało 6% stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie mniejsze (6%) niż granica rozpuszczalności określona in vitro.
- CHPL leku Abilium, kapsułki twarde, 10 mgPrzedkliniczne dane o bezpieczeństwie
W badaniach toksykologicznych z zastosowaniem dawki wielokrotnej u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt. Brak dowodów neurotoksyczności i niepożądanego wpływu na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych. Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowano toksyczny wpływ na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości pola pod krzywą AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po zastosowaniu dawek maksymalnych zalecanych u ludzi).
- CHPL leku Abilium, kapsułki twarde, 10 mgPrzedkliniczne dane o bezpieczeństwie
Toksyczny wpływ na samice ciężarne obserwowano podczas podawania dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Abilium, kapsułki twarde, 10 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Abilium, 10 mg Celuloza mikrokrystaliczna Karboksymetyloskrobia sodowa typ A Powidon Krzemionka koloidalna bezwodna Magnezu stearynian Karmin (E 120) Tytanu dwutlenek (E 171) Żelatyna Abilium, 15 mg Celuloza mikrokrystaliczna Karboksymetyloskrobia sodowa typ A Powidon Krzemionka koloidalna bezwodna Magnezu stearynian Żelaza tlenek żółty (E 172) Tytanu dwutlenek (E 171) Żelatyna 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Blister z folii trójwarstwowej OPA/Aluminium/PVC i folia Aluminiowa, umieszczony w tekturowym pudełku. Jeden blister zawiera 7 kapsułek. Opakowanie jednostkowe zawiera 2 lub 4 lub 8 blistrów.
- CHPL leku Abilium, kapsułki twarde, 10 mgDane farmaceutyczne
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Abilium, kapsułki twarde, 15 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Abilium, 10 mg, kapsułki, twarde Abilium, 15 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Abilium, 10 mg Każda kapsułka zawiera 10 mg arypiprazolu. Abilium, 15 mg Każda kapsułka zawiera 15 mg arypiprazolu. Pełny wykaz substancji pomocniczych, patrz punkt 6.l. 3. POSTAĆ FARMACEUTYCZNA Kapsułka, twarda Abilium, 10 mg Twarde, żelatynowe, nieprzezroczyste kapsułki nr 3 o barwie różowej. Zawartość kapsułek: proszek barwy białej do kremowej. Abilium, 15 mg Twarde, żelatynowe, nieprzezroczyste kapsułki nr 2 o barwie kremowej. Zawartość kapsułek: proszek barwy białej do kremowej.
- CHPL leku Abilium, kapsułki twarde, 15 mgWskazania do stosowania
4.1 Wskazania do stosowania Abilium jest wskazany do leczenia schizofrenii u dorosłych i u młodzieży w wieku 15 lat i starszej. Abilium jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym do ciężkiego w przebiegu zaburzenia afektywnego dwubiegunowego typu I oraz w zapobieganiu nowym epizodom maniakalnym u dorosłych, u których występują głównie epizody maniakalne i którzy odpowiadają na leczenie arypiprazolem (patrz punkt 5.1). Abilium jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym do ciężkiego w przebiegu zaburzenia afektywnego dwubiegunowego typu I u młodzieży w wieku 13 lat i starszej, w leczeniu trwającym do 12 tygodni (patrz punkt 5.1).
- CHPL leku Abilium, kapsułki twarde, 15 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Schizofrenia: zalecana dawka początkowa produktu leczniczego Abilium to 10 mg lub 15 mg na dobę z dawką podtrzymującą 15 mg na dobę. Produkt należy podawać raz na dobę o stałej porze, niezależnie od posiłków. Abilium jest skuteczny w dawkach od 10 mg do 30 mg na dobę. Chociaż nie potwierdzono większej skuteczności dawek większych niż dawka dobowa 15 mg, jednak u poszczególnych pacjentów większa dawka może być korzystna. Maksymalna dawka dobowa nie może być większa niż 30 mg. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I: zalecana dawka to 15 mg produktu Abilium podawane w schemacie raz na dobę, niezależnie od posiłków, jako monoterapia lub w leczeniu skojarzonym (patrz punkt 5.1). U niektórych pacjentów może być korzystne zastosowanie większej dawki. Maksymalna dawka dobowa nie może być większa niż 30 mg.
- CHPL leku Abilium, kapsułki twarde, 15 mgDawkowanie
Zapobieganie nawrotom epizodów maniakalnych w zaburzeniu afektywnym dwubiegunowym typu I: w celu zapobiegania nawrotom epizodów maniakalnych u pacjentów, którzy stosują arypiprazol w monoterapii lub w terapii skojarzonej, należy kontynuować leczenie stosując ustaloną dawkę. Dostosowanie dawki dobowej, w tym jej zmniejszenie, należy rozważyć na podstawie stanu klinicznego. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej: zalecana dawka produktu Abilium to 10 mg na dobę, podawane w schemacie raz na dobę, niezależnie od posiłków. Leczenie powinno być rozpoczęte od dawki 2 mg (stosując arypiprazol 1mg/ml roztwór doustny) przez 2 dni, stopniowo zwiększanej do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. Jeśli jest to konieczne, należy podawać kolejne dawki zwiększone jednorazowo o 5 mg, nie przekraczając maksymalnej dawki dobowej 30 mg (patrz punkt 5.1). Abilium jest skuteczny w przedziale dawek od 10 mg do 30 mg na dobę.
- CHPL leku Abilium, kapsułki twarde, 15 mgDawkowanie
Nie wykazano większej skuteczności dla dawek dobowych większych niż 10 mg, choć u niektórych pacjentów zastosowanie większych dawek może być korzystne. Abilium nie jest zalecany do stosowania u pacjentów ze schizofrenią w wieku poniżej 15 lat z powodu braku wystarczających danych dotyczących skuteczności i bezpieczeństwa stosowania (patrz punkty 4.8 i 5.1). Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej: zalecana dawka produktu Abilium to 10 mg na dobę, podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie należy rozpocząć od dawki 2 mg (stosując arypiprazol roztwór doustny, 1 mg/ml) przez 2 dni, stopniowo zwiększanej do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. Czas trwania leczenia powinien być możliwie najkrótszy, konieczny do uzyskania kontroli objawów i nie może być dłuższy niż 12 tygodni.
- CHPL leku Abilium, kapsułki twarde, 15 mgDawkowanie
Nie wykazano większej skuteczności leczenia po zastosowaniu dawek dobowych większych niż 10 mg, a po podaniu dawki dobowej 30 mg znacząco zwiększa się częstość występowania istotnych działań niepożądanych, włączając zdarzenia związane z objawami pozapiramidowymi (ang. EPS), takimi jak senność, zmęczenie oraz zwiększenie masy ciała (patrz punkt 4.8). Z tego powodu dawki większe niż 10 mg na dobę można stosować tylko w wyjątkowych przypadkach oraz z zachowaniem ścisłej kontroli klinicznej (patrz punkty 4.4, 4.8 i 5.1). Młodsi pacjenci są narażeni na zwiększone ryzyko wystąpienia działań niepożądanych związanych z arypiprazolem. Z tego powodu nie zaleca się stosowania produktu Abilium u pacjentów w wieku poniżej 13 lat (patrz punkty 4.8 i 5.1). Drażliwość związana z zaburzeniami autystycznymi: Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego Abilium u dzieci i młodzieży w wieku poniżej 18 lat.
- CHPL leku Abilium, kapsułki twarde, 15 mgDawkowanie
Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących stosowania. Tiki związane z zespołem Tourette’a: Dotychczas nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Abilium u dzieci i młodzieży w wieku od 6 do 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących stosowania. Szczególne grupy pacjentów Zaburzenia czynności wątroby Nie ma konieczności modyfikacji dawki u osób z zaburzeniami czynności wątroby o nasileniu lekkim do umiarkowanego. Nie ma wystarczających danych do ustalenia dawkowania u pacjentów z ciężką niewydolnością wątroby. W tej grupie pacjentów dawkowanie należy ustalać ostrożnie. Niemniej, w grupie pacjentów z ciężkimi zaburzeniami czynności wątroby największą dawkę dobową 30 mg należy stosować ze szczególną ostrożnością (patrz punkt 5.2). Zaburzenia czynności nerek Nie jest konieczne modyfikowanie dawki u pacjentów z zaburzeniami czynności nerek.
- CHPL leku Abilium, kapsułki twarde, 15 mgDawkowanie
Pacjenci w podeszłym wieku Bezpieczeństwo stosowania i skuteczność produktu Abilium w leczeniu schizofrenii i w epizodach manii w przebiegu zaburzenia afektywnego dwubiegunowego typu I u pacjentów w wieku 65 lat i starszych nie została ustalona. Jednakże z powodu większej wrażliwości tej populacji, należy rozważyć zastosowanie mniejszej dawki początkowej, jeśli pozwalają na to okoliczności kliniczne (patrz punkt 4.4). Płeć Nie ma konieczności modyfikacji dawki leku w zależności od płci (patrz punkt 5.2). Palacze tytoniu Biorąc pod uwagę metabolizm arypiprazolu, nie jest konieczne modyfikowanie dawki u palaczy (patrz punkt 4.5). Dostosowanie dawki z powodu interakcji Dawkę arypiprazolu należy zmniejszyć w okresie równoczesnego stosowania silnego inhibitora cytochromu CYP3A4 lub CYP2D6. Po zakończeniu jednoczesnego stosowania inhibitora CYP3A4 lub CYP2D6, dawkę arypiprazolu należy z kolei zwiększyć (patrz punkt 4.5).
- CHPL leku Abilium, kapsułki twarde, 15 mgDawkowanie
Dawkę arypiprazolu należy zwiększyć w okresie równoczesnego stosowania leków silnie indukujących CYP3A4. Po odstawieniu produktu leczniczego indukującego CYP3A4, dawkę arypiprazolu należy ponownie zmniejszyć do dawki zalecanej (patrz punkt 4.5). Sposób podawania Produkt Abilium jest przeznaczony do stosowania doustnego.
- CHPL leku Abilium, kapsułki twarde, 15 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Abilium, kapsułki twarde, 15 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić w ciągu kilku dni do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją lekarza. Próby samobójcze 3. Występowanie zachowań samobójczych wynika z chorób psychicznych oraz zaburzeń nastroju i w niektórych przypadkach było zgłaszane wkrótce po rozpoczęciu lub zmianie leczenia przeciwpsychotycznego, w tym leczenia arypiprazolem (patrz punkt 4.8). Leczenie przeciwpsychotyczne pacjentów wysokiego ryzyka powinno odbywać się pod ścisłym nadzorem. Zaburzenia sercowo-naczyniowe Arypiprazol należy stosować ostrożnie u pacjentów z chorobą sercowo-naczyniową (zawał mięśnia sercowego lub chorobą niedokrwienną w wywiadzie, niewydolnością serca lub zaburzeniami przewodzenia), chorobą naczyń mózgu, w stanach predysponujących do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie produktami przeciwnadciśnieniowymi) lub nadciśnienia tętniczego, w tym nadciśnienia postępującego lub złośliwego.
- CHPL leku Abilium, kapsułki twarde, 15 mgSpecjalne środki ostrozności
Po zastosowaniu leków przeciwpsychotycznych obserwowano przypadki żylnej choroby zakrzepowo – zatorowej (VTE – ang. venous thromboembolism). Ponieważ u pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, przed rozpoczęciem oraz w trakcie leczenia arypiprazolem należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE i wdrożyć odpowiednie środki zapobiegawcze. Wydłużenie odstępu QT W badaniach klinicznych arypiprazolu częstość występowania wydłużenia odstępu QT była porównywalna ze stwierdzaną w grupie placebo. Arypiprazol należy stosować ostrożnie u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy W badaniach klinicznych trwających nie dłużej niż rok, w okresie leczenia arypiprazolem niezbyt często zgłaszano dyskinezy wymagające leczenia.
- CHPL leku Abilium, kapsułki twarde, 15 mgSpecjalne środki ostrozności
Jeśli u pacjentów leczonych produktem Abilium wystąpią przedmiotowe lub podmiotowe objawy późnych dyskinez, należy rozważyć zmniejszenie dawki lub odstawienie arypiprazolu (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po zakończeniu leczenia arypiprazolem. Inne objawy pozapiramidowe W pediatrycznych badaniach klinicznych z zastosowaniem arypiprazolu obserwowano akatyzję oraz parkinsonizm. Jeśli u pacjenta przyjmującego arypiprazol wystąpią przedmiotowe i podmiotowe objawy innych zaburzeń pozapiramidowych, należy rozważyć zmniejszenie dawki oraz wprowadzenie ścisłej kontroli klinicznej. Złośliwy Zespół Neuroleptyczny (NMS) NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z przyjmowaniem leków przeciwpsychotycznych. W badaniach klinicznych zgłaszano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku Abilium, kapsułki twarde, 15 mgSpecjalne środki ostrozności
Klinicznymi objawami NMS są: bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz objawy niestabilności autonomicznego układu nerwowego (nieregularne tętno i wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Zgłaszano jednak także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę, niekoniecznie związane z NMS. Jeśli wystąpiły wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS, lub wysoka gorączka niewyjaśnionego pochodzenia, bez innych objawów NMS, należy przerwać leczenie wszystkimi lekami przeciwpsychotycznymi, w tym także arypiprazolem. Drgawki 4. W badaniach klinicznych w czasie leczenia arypiprazolem odnotowano niezbyt częste napady drgawek.
- CHPL leku Abilium, kapsułki twarde, 15 mgSpecjalne środki ostrozności
Z tego powodu arypiprazol należy stosować z zachowaniem ostrożności u pacjentów, u których w przeszłości występowały napady drgawek lub u których występują choroby wiążące się ze skłonnością do takich napadów (patrz punkt 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencj? Zwiększona śmiertelność. W trzech badaniach kontrolowanych placebo (n = 938, średnia wieku: 82,4; zakres: 56-99 lat) u pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera, leczonych arypiprazolem, występowało zwiększone ryzyko zgonu w porównaniu z grupą otrzymującą placebo. Częstość zgonów u pacjentów leczonych arypiprazolem wynosiła 3,5% w porównaniu do 1,7 % w grupie placebo. Chociaż przyczyny zgonów były zróżnicowane, to większość zgonów wydawała się związana albo z chorobami układu krążenia (np. niewydolność serca, nagła śmierć), albo z chorobami zakaźnymi (np. zapalenie płuc) (patrz punkt 4.8).
- CHPL leku Abilium, kapsułki twarde, 15 mgSpecjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego W tych samych badaniach, u pacjentów odnotowano działania niepożądane dotyczące krążenia mózgowego (np. udar, przejściowe napady niedokrwienia), w tym o przebiegu zakończonym zgonem (średnia wieku: 84 lata; zakres 78-88 lat). Ogólnie, w tych badaniach 1,3% wszystkich pacjentów leczonych arypiprazolem zgłaszało działania niepożądane dotyczące krążenia mózgowego w porównaniu do 0,6 % pacjentów otrzymujących placebo. Różnica ta nie była jednak statystycznie istotna. W jednym z badań z zastosowaniem ustalonego dawkowania, u pacjentów leczonych arypiprazolem obserwowano jednak istotną zależność między występowaniem działań niepożądanych dotyczących krążenia mózgowego a dawką (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów, u których występują psychozy związane z demencją.
- CHPL leku Abilium, kapsułki twarde, 15 mgSpecjalne środki ostrozności
Hiperglikemia i cukrzyca U pacjentów leczonych atypowymi lekami przeciwpsychotycznymi, w tym arypiprazolem, opisywano hiperglikemię, niekiedy bardzo wysoką, z kwasicą ketonową i śpiączką hiperosmotyczną lub zgonem. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań są otyłość i cukrzyca w wywiadzie rodzinnym. W badaniach klinicznych z arypiprazolem nie było istotnych różnic w częstości występowania działań niepożądanych związanych z hiperglikemią (w tym cukrzycy) ani nieprawidłowych wartości laboratoryjnych stężenia glukozy w porównaniu z placebo. Nie jest dostępna dokładna ocena ryzyka wystąpienia działań niepożądanych związanych z hiperglikemią, która pozwalałaby na bezpośrednie porównanie leczenia arypiprazolem i innymi atypowymi lekami przeciwpsychotycznymi.
- CHPL leku Abilium, kapsułki twarde, 15 mgSpecjalne środki ostrozności
Pacjenci leczeni jakimikolwiek lekami przeciwpsychotycznymi, włącznie z arypiprazolem, powinni być monitorowani, czy nie występują u nich objawy podmiotowe i przedmiotowe związane z hiperglikemią (takie, jak: nadmierne pragnienie, wielomocz, nadmierny apetyt i osłabienie), a pacjenci z cukrzycą lub czynnikami ryzyka wystąpienia cukrzycy powinni być regularnie monitorowani w kierunku pogorszenia kontroli glikemii (patrz punkt 4.8). Nadwrażliwość Po zastosowaniu arypiprazolu, mogą wystąpić reakcje nadwrażliwości charakteryzujące się objawami uczulenia (patrz punkt 4.8). Zwiększenie masy ciała Zwiększenie masy ciała, obserwowane u pacjentów ze schizofrenią i zaburzeniem afektywnym dwubiegunowym, jest zwykle spowodowane współistniejącymi chorobami, stosowaniem leków przeciwpsychotycznych, o których wiadomo, że powodują zwiększenie masy ciała, niewłaściwym stylem życia i może prowadzić do ciężkich powikłań.
- CHPL leku Abilium, kapsułki twarde, 15 mgSpecjalne środki ostrozności
Po wprowadzeniu arypiprazolu do obrotu obserwowano zwiększenie masy ciała u pacjentów stosujących ten lek. Jeśli stwierdzano zwiększenie masy, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych arypiprazol nie powodował klinicznie istotnego zwiększenia masy ciała u dorosłych (patrz punkt 5.1). W badaniach klinicznych z udziałem młodzieży z epizodem manii w przebiegu zaburzenia afektywnego dwubiegunowego wykazano, że stosowanie arypiprazolu ma związek ze zwiększeniem masy ciała po 4 tygodniach leczenia. U młodzieży z zaburzeniem afektywnym dwubiegunowym należy kontrolować zwiększenie masy ciała. Jeśli przyrost masy ciała jest znaczący klinicznie, należy rozważyć zmniejszenie dawki (patrz punkt 4.8). Dysfagia Zaburzenia kurczliwości mięśniówki przełyku i aspiracja wynikają ze stosowania leków przeciwpsychotycznych, w tym arypiprazolu.
- CHPL leku Abilium, kapsułki twarde, 15 mgSpecjalne środki ostrozności
Arypiprazol należy stosować ostrożnie u pacjentów z ryzykiem wystąpienia zachłystowego zapalenia płuc. Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Podczas przyjmowania arypiprazolu u pacjentów mogą występować nasilone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy to: zwiększenie popędu seksualnego, kompulsywna potrzeba wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania. Ważne, aby lekarze przepisujący lek pytali pacjentów lub opiekunów zwłaszcza o wystąpienie nowego lub nasilonego popędu do hazardu, popędów seksualnych, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa, czy kompulsywnego objadania się, lub innych popędów podczas leczenia arypiprazolem.
- CHPL leku Abilium, kapsułki twarde, 15 mgSpecjalne środki ostrozności
Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu leku. Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Lekarz rozważy zmianę dawki lub odstawienie produktu, jeśli u pacjenta wystąpią takie popędy podczas przyjmowania arypiprazolu (patrz punkt 4.8). Pacjenci ze współistniejącym ADHD Pomimo wysokiej częstości współistnienia zaburzenia afektywnego dwubiegunowego typu I oraz ADHD, dane dotyczące bezpieczeństwa jednoczesnego stosowania arypiprazolu oraz substancji psychoaktywnych działających pobudzająco są bardzo ograniczone; dlatego należy zachować wyjątkową ostrożność w okresie jednoczesnego stosowania tych produktów leczniczych. Upadki Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków.
- CHPL leku Abilium, kapsułki twarde, 15 mgSpecjalne środki ostrozności
Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2). Produkt leczniczy Abilium zawiera sód Produkt leczniczy Abilium zawiera mniej niż 1 mmol (23 mg) sodu na kapsułkę, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Abilium, kapsułki twarde, 15 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na antagonistyczne działanie na receptor adrenergiczny α1, arypiprazol może nasilać działanie niektórych leków przeciwnadciśnieniowych. Ze względu na pierwotne działanie arypiprazolu na OUN, należy zachować ostrożność, jeśli arypiprazol jest przyjmowany razem z alkoholem lub z innymi produktami leczniczymi działającymi na OUN, powodującymi zbliżone działania niepożądane, takie jak zmniejszenie aktywności ośrodkowego układu nerwowego (patrz punkt 4.8). Należy zachować ostrożność podając arypiprazol równocześnie z produktami leczniczymi, o których wiadomo, że powodują wydłużenie odstępu QT lub zaburzenia elektrolitowe. Możliwy wpływ innych produktów leczniczych na arypiprazol Antagonista receptora H2- famotydyna, lek hamujący uwalnianie kwasu żołądkowego, zmniejsza szybkość wchłaniania arypiprazolu, jednak działanie to nie ma znaczenia klinicznego.
- CHPL leku Abilium, kapsułki twarde, 15 mgInterakcje
Arypiprazol jest metabolizowany na wiele sposobów, w tym także przez enzymy, takie jak CYP2D6 i CYP3A4. Nie jest jednak metabolizowany przez enzymy z grupy CYP1A, a więc nie jest konieczne stosowanie zmodyfikowanych dawek u palaczy tytoniu. Chinidyna i inne inhibitory CYP2D6 Wyniki badań klinicznych z udziałem zdrowych osób wykazały, że silny inhibitor enzymu CYP2D6 (chinidyna) zwiększa pole pod krzywą AUC arypiprazolu o 107%, podczas gdy Cmax się nie zmienia. AUC i Cmax dehydroarypiprazolu, czynnego metabolitu, były zmniejszone odpowiednio o 32% i 47%. Podczas jednoczesnego podawania chinidyny i arypiprazolu, należy zmniejszyć dawkę produktu Abilium o około połowę w stosunku do przepisanej dawki. Inne silne inhibitory grupy enzymów CYP2D6, takie jak fluoksetyna i paroksetyna, mogą powodować podobne skutki, dlatego w takich sytuacjach należy podobnie zmniejszyć ich dawkę.
- CHPL leku Abilium, kapsułki twarde, 15 mgInterakcje
Ketokonazol i inne inhibitory CYP3A4 Wyniki badań klinicznych z udziałem zdrowych osób wskazują, że silny inhibitor CYP3A4 (ketokonazol) zwiększa pole pod krzywą AUC i Cmax arypiprazolu odpowiednio o 63% i 37%, a AUC i Cmax dehydroarypiprazolu odpowiednio o 77 % i 43%. W grupie osób o zmniejszonej aktywności CYP2D6, równoczesne stosowanie silnych inhibitorów CYP3A4 może powodować zwiększenie stężenia arypiprazolu w osoczu, w porównaniu do osób o zwiększonej aktywności CYP2D6. Po jednoczesnym zastosowaniu ketokonazolu lub innych silnych inhibitorów CYP3A4 z arypiprazolem, zakładane korzyści powinny przeważyć ryzyko dla pacjenta. W przypadku jednoczesnego stosowania ketokonazolu z arypiprazolem, przepisaną dawkę produktu Abilium należy zmniejszyć o około połowę. Inne leki silnie hamujące aktywność CYP3A4, takie jak itrakonazol oraz inhibitory proteazy HIV, mogą powodować podobne skutki jak ketokonazol i w takich przypadkach należy podobnie zmniejszyć dawki (patrz punkt 4.2).
- CHPL leku Abilium, kapsułki twarde, 15 mgInterakcje
Po odstawieniu inhibitora CYP2D6 lub CYP3A4, dawkę produktu Abilium należy zwiększyć do tej, jaką stosowano przed rozpoczęciem leczenia skojarzonego. W czasie równoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazemu) lub CYP2D6 (np. escytalopramu) z arypiprazolem, można spodziewać się niewielkiego zwiększenia stężenia arypiprazolu w osoczu. Karbamazepina i inne leki indukujące CYP3A4 Po jednoczesnym podaniu karbamazepiny, silnego induktora CYP3A4 w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnia geometryczna Cmax i pole pod krzywą AUC arypiprazolu zmniejszyły się odpowiednio o 68% i 73%, w stosunku do wartości tych parametrów podczas stosowania arypiprazolu (30 mg) w monoterapii. Podobnie, w przypadku dehydroarypiprazolu średnia geometryczna Cmax i pole pod krzywą AUC po jednoczesnym podaniu karbamazepiny zmniejszały się odpowiednio o 69% i 71% w stosunku do ich wartości podczas leczenia samym arypiprazolem.
- CHPL leku Abilium, kapsułki twarde, 15 mgInterakcje
Dawkę arypiprazolu należy podwoić, gdy jednocześnie stosuje się ten produkt z karbamazepiną. Można się spodziewać, że jednoczesne podawanie arypiprazolu i innych silnych induktorów CYP3A4 (takich, jak ryfampicyna, ryfabutyna, fenytoina, fenobarbital, prymidon, efawirenz, newirapina i ziele dziurawca) mogą działać podobnie, dlatego dawkę należy podobnie zwiększyć. Po zakończeniu stosowania silnego induktora CYP3A4, dawkę arypiprazolu należy zmniejszyć do zalecanej. Walproinian i lit Skojarzone stosowanie walproinianów lub litu z arypiprazolem nie powodowało żadnych klinicznie istotnych zmian stężenia arypiprazolu i w związku z tym nie jest konieczne dostosowanie dawki podczas podawania walproinianu lub litu w skojarzeniu z arypiprazolem. Możliwy wpływ arypiprazolu na inne produkty lecznicze W czasie badań klinicznych, dawki arypiprazolu od 10 mg do 30 mg na dobę nie wywierały istotnego wpływu na metabolizm substratów CYP2D6 (współczynnik dekstrometorfan/3-metoksymorfinan), CYP2C9 (warfaryna), CYP2C19 (omeprazol) i CYP3A4 (dekstrometorfan).
- CHPL leku Abilium, kapsułki twarde, 15 mgInterakcje
Ponadto, w warunkach in-vitro arypiprazol i dehydroarypiprazol nie zmieniały metabolizmu zachodzącego z udziałem CYP1A2. Istnieje zatem małe prawdopodobieństwo wystąpienia istotnych klinicznie interakcji między produktami leczniczymi metabolizowanymi przez te enzymy. Kiedy arypiprazol był podawany z walproinianem, litem lub lamotryginą, nie stwierdzono klinicznie istotnej zmiany w stężeniach walproinianu, litu ani lamotryginy. Zespół serotoninowy Obserwowano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol, a objawy przedmiotowe oraz podmiotowe dla tego stanu mogą wystąpić szczególnie w przypadku jednoczesnego stosowania innych leków serotoninergicznych, takich jak SSRI/SNRI (selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny) lub produktów leczniczych, o których wiadomo, że zwiększają stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Abilium, kapsułki twarde, 15 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Dotychczas nie przeprowadzono odpowiednio kontrolowanych badań dotyczących działania arypiprazolu u kobiet w ciąży. Zgłaszano wady wrodzone, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. Na podstawie wyników badań przeprowadzonych na zwierzętach nie można wykluczyć potencjalnego toksycznego wpływu arypiprazolu na płód (patrz punkt 5.3). Konieczne jest zalecenie pacjentkom, aby poinformowały lekarza, jeśli w trakcie leczenia arypiprazolem zajdą w ciążę lub planują zajście w ciążę. Ze względu na niewystarczające dane dotyczące bezpieczeństwa u ludzi oraz budzące wątpliwości wyniki badań na zwierzętach, ten lek nie może być stosowany w okresie ciąży, chyba że spodziewane korzyści wyraźnie przewyższają ryzyko dla płodu.
- CHPL leku Abilium, kapsułki twarde, 15 mgWpływ na płodność, ciążę i laktację
Noworodki narażone na działanie leków przeciwpsychotycznych (w tym arypiprazolu) w czasie trzeciego trymestru ciąży znajdują się w grupie ryzyka, w której mogą wystąpić działania niepożądane, w tym zaburzenia pozapiramidowe i (lub) zespół odstawienia, które po porodzie mogą różnić się ciężkością przebiegu oraz czasem trwania. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane ze ssaniem. W związku z powyższym noworodki z tej grupy powinny być uważnie monitorowane (patrz punkt 4.8). Karmienie piersi? Arypiprazol/metabolity przenikają do mleka ludzkiego. Należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać przyjmowanie arypiprazolu, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem na reprodukcję.
- CHPL leku Abilium, kapsułki twarde, 15 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe, senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku Abilium, kapsułki twarde, 15 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa W badaniach klinicznych kontrolowanych placebo najczęściej zgłaszanymi działaniami niepożądanymi były akatyzja i nudności, każde występujące częściej niż u 3% pacjentów leczonych arypiprazolem podawanym doustnie. Tabelaryczne zestawienie działań niepożądanych Częstość występowania działań niepożądanych związanych z leczeniem arypiprazolem podano w poniższej tabeli. Dane w tabeli oparto na działaniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układów i narządów i częstości: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000); częstość nieznana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Abilium, kapsułki twarde, 15 mgDziałania niepożądane
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Nie można określić częstości działań niepożądanych zgłaszanych po wprowadzeniu arypiprazolu do obrotu, ponieważ pochodzą one ze spontanicznych zgłoszeń. Z tego względu częstość takich działań niepożądanych określono jako „nieznana”. Zaburzenia krwi i układu chłonnego Zaburzenia układu immunologicznego Często: Leukopenia Niezbyt często: Neutropenia, Trombocytopenia Nieznana: Reakcje uczuleniowe (np. reakcja anafilaktyczna, obrzęk naczynioruchowy z obrzękiem języka, obrzękiem twarzy, świądem lub pokrzywką) Zaburzenia endokrynologiczne Zaburzenia metabolizmu i odżywiania Cukrzyca Hyperprolaktynemia Zmniejszenie stężenia prolaktyny we krwi Hiperglikemia Cukrzycowa śpiączka hiperosmotyczna Kwasica ketonowa Hiponatremia Anoreksja Zaburzenia psychiczne Zaburzenia układu nerwowego Bezsenność Lęk Niepokój zwłaszcza ruchowy Akatyzja Zaburzenia pozapiramidowe Drżenie Bóle głowy Sedacja Senność Zawroty głowy Depresja Hiperseksualność Późne dyskinezy Dystonia Zespół „niespokojnych nóg” Próby samobójcze, myśli samobójcze i samobójstwa (patrz punkt 4.4) Patologiczne uzależnienie od hazardu Zaburzenia kontroli impulsów Obżarstwo Kompulsywna potrzeba wydawania pieniędzy Poriomania Zachowania agresywne Nadmierne pobudzenie Nerwowość Złośliwy zespół neuroleptyczny (ang.
- CHPL leku Abilium, kapsułki twarde, 15 mgDziałania niepożądane
NMS) Drgawki typu grand mal Zespół serotoninowy Zaburzenia mowy Zaburzenia oka Zaburzenia serca Zaburzenia naczyniowe Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Niewyraźne widzenie Podwójne widzenie Światłowstręt (fotofobia) Tachykardia Hipotensja ortostatyczna Czkawka Napad przymusowego patrzenia z rotacją gałek ocznych Nagły niewyjaśniony zgon Torsade de pointes Arytmie komorowe Zatrzymanie akcji serca Bradykardia Choroba zakrzepowo-zatorowa żył (w tym zator płucny i zakrzepica żył głębokich) Nadciśnienie tętnicze Omdlenia Zachłystowe zapalenie płuc Skurcz krtani Skurcz części ustnej gardła Zaburzenia żołądka i jelit Zaburzenia wątroby i dróg żółciowych Zaparcia Niestrawność Nudności Nadmierne wydzielanie śliny Wymioty Zapalenie trzustki Dysfagia Biegunka Dyskomfort w jamie brzusznej Dyskomfort w obrębie żołądka Niewydolność wątroby Zapalenie wątroby Żółtaczka Zaburzenia skóry i tkanki podskórnej Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Zaburzenia nerek i dróg moczowych Ciąża, połóg i okres okołoporodowy Zaburzenia układu rozrodczego i piersi Zaburzenia ogólne i stany w miejscu podania Badania diagnostyczne Zmęczenie Wysypka Reakcja fotoalergiczna Łysienie Nadmierne pocenie się Wysypka polekowa z eozynofilią i objawami ogólnoustrojowymi (zespół DRESS) Rabdomioliza Bóle mięśniowe Sztywność Nietrzymanie moczu Zatrzymanie wydalania moczu Zespół odstawienia u niemowląt (patrz punkt 4.6) Priapizm Zaburzenia regulacji temperatury ciała (np.
- CHPL leku Abilium, kapsułki twarde, 15 mgDziałania niepożądane
hipotermia, gorączka) Ból w klatce piersiowej Obrzęk obwodowy Zmniejszenie masy ciała Zwiększenie masy ciała Zwiększenie aktywności aminotransferazy alaninowej Zwiększenie aktywności aminotransferazy asparaginianowej Zwiększenie aktywności gammaglutamylotransferazy Zwiększenie aktywności fosfatazy alkalicznej Wydłużenie odstępu QT Zwiększenie stężenia glukozy we krwi Zwiększenie stężenia glikozylowanej hemoglobiny Wahania stężenia glukozy we krwi Zwiększenie aktywności fosfokinazy kreatynowej Opis wybranych działań niepożądanych Dorośli Objawy pozapiramidowe (ang. EPS) Schizofrenia: w długotrwałym 52-tygodniowym kontrolowanym badaniu u pacjentów leczonych arypiprazolem, ogólnie rzadziej występowały EPS (25,8%), w tym parkinsonizm, akatyzja, dystonia i dyskineza, niż u pacjentów leczonych haloperydolem (57,3%).
- CHPL leku Abilium, kapsułki twarde, 15 mgDziałania niepożądane
W długotrwałym 26-tygodniowym badaniu kontrolowanym placebo, częstość występowania EPS wynosiła 19% u pacjentów leczonych arypiprazolem i 13,1% u pacjentów otrzymujących placebo. W innym długotrwałym 26-tygodniowym kontrolowanym badaniu częstość występowania EPS wynosiła 14,8% u pacjentów leczonych arypiprazolem i 15,1% u pacjentów otrzymujących olanzapinę. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I: w 12-tygodniowym kontrolowanym badaniu objawy EPS stwierdzano u 23,5% pacjentów leczonych arypiprazolem i u 53,3% u pacjentów leczonych haloperydolem. W innym 12-tygodniowym badaniu EPS stwierdzano u 26,6% pacjentów leczonych arypiprazolem i 17,6% pacjentów leczonych litem. W długotrwałym 26-tygodniowym kontrolowanym badaniu placebo w leczeniu podtrzymującym objawy EPS stwierdzano u 18,2% u pacjentów leczonych arypiprazolem i 15,7% u pacjentów otrzymujących placebo.
- CHPL leku Abilium, kapsułki twarde, 15 mgDziałania niepożądane
Akatyzja: W kontrolowanych placebo badaniach u pacjentów z zaburzeniami afektywnymi dwubiegunowymi akatyzja występowała u 12,1% pacjentów leczonych arypiprazolem i u 3,2% pacjentów otrzymujących placebo. U pacjentów ze schizofrenią akatyzję stwierdzano u 6,2% pacjentów w grupie arypiprazolu i 3,0% w grupie placebo. Dystonia: Efekt klasy terapeutycznej: objawy dystonii, długotrwałe, nieprawidłowe kurcze grup mięśni, mogą występować u wrażliwych pacjentów przez kilka pierwszych dni leczenia. Do objawów dystonii należą: kurcze mięśni szyi, czasami postępujące do ucisku w gardle, trudności z przełykaniem, trudności z oddychaniem i (lub) zaburzenia ruchów języka. Chociaż objawy te mogą występować po zastosowaniu małych dawek, występują częściej i z większym nasileniem podczas stosowania leków przeciwpsychotycznych pierwszej generacji w większych dawkach. Obserwowano zwiększone ryzyko ostrej dystonii u mężczyzn i w młodszych grupach wiekowych.
- CHPL leku Abilium, kapsułki twarde, 15 mgDziałania niepożądane
Prolaktyna: Podczas badań klinicznych w zakresie zarejestrowanych wskazań i po wprowadzeniu produktu leczniczego do obrotu, u pacjentów otrzymujących arypiprazol obserwowano zarówno zwiększenie, jak i zmniejszenie stężenia prolaktyny w surowicy w porównaniu do pomiarów początkowych (punkt 5.1). Parametry laboratoryjne: Porównania między arypiprazolem i placebo dotyczące odsetka pacjentów, u których wystąpiły potencjalnie istotne zmiany rutynowych parametrów laboratoryjnych i lipidowych (patrz punkt 5.1), nie wykazały klinicznie istotnych różnic. Ogólnie przejściowe i bezobjawowe zwiększenie aktywności CPK (fosfokinazy kreatynowej) obserwowano u 3,5% pacjentów leczonych arypiprazolem w porównaniu do 2,0% pacjentów otrzymujących placebo.
- CHPL leku Abilium, kapsułki twarde, 15 mgPrzedawkowanie
4.9 Przedawkowanie 13. Objawy przedmiotowe i podmiotowe W badaniach klinicznych i po wprowadzeniu arypiprazolu do obrotu zgłaszano przypadkowe bądź zamierzone przedawkowanie samego arypiprazolu przez dorosłych pacjentów w szacowanej dawce do 1260 mg niezakończone zgonem. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: letarg, zwiększenie ciśnienia tętniczego krwi, senność, przyspieszenie czynności serca (tachykardia), nudności, wymioty i biegunka. Ponadto zgłaszano przypadkowe przedawkowanie samego arypiprazolu (do 195 mg) u dzieci, bez zgonów. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: senność, przejściowa utrata świadomości i objawy pozapiramidowe. Postępowanie po przedawkowaniu Po przedawkowaniu arypiprazolu stosuje się leczenie podtrzymujące, polegające na utrzymaniu drożności dróg oddechowych, dotlenianiu i wentylacji oraz leczenie objawowe.
- CHPL leku Abilium, kapsułki twarde, 15 mgPrzedawkowanie
Należy wziąć pod uwagę możliwość wpływu wielu produktów leczniczych. Z tego względu należy niezwłocznie rozpocząć monitorowanie czynności układu krążenia, włączając stałe monitorowanie zapisu elektrokardiograficznego, w celu wykrycia możliwych zaburzeń rytmu serca. Wiedząc lub podejrzewając przedawkowanie arypiprazolu należy wnikliwie monitorować pacjenta i obserwować go do czasu poprawy jego stanu. Węgiel aktywny (50 g), podany w godzinę po zażyciu arypiprazolu, zmniejsza Cmax arypiprazolu o około 41%, a pole pod krzywą AUC o około 51%, co wskazuje na jego skuteczność w leczeniu przedawkowania. Hemodializa Pomimo braku informacji dotyczących wpływu hemodializ w leczeniu przedawkowania arypiprazolu, jest mało prawdopodobne, aby hemodializy były użyteczne w takich sytuacjach, ze względu na znaczny stopień wiązania się arypiprazolu z białkami osocza.
- CHPL leku Abilium, kapsułki twarde, 15 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12. Mechanizm działania Uważa się, że skuteczność arypiprazolu w leczeniu schizofrenii i zaburzenia afektywnego dwubiegunowego typu I jest związana ze skojarzonym działaniem częściowo agonistycznym w stosunku do receptora dopaminowego D2 i serotoninowego 5HT1a oraz antagonistycznym w stosunku do receptora serotoninowego 5HT2a. Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D2 i D3, serotoninowych 5HT1a i 5HT2a oraz umiarkowane powinowactwo do receptorów dopaminowych D4, serotoninowych 5HT2c i 5HT7, a także adrenergicznych alfa-1 i histaminowych H1.
- CHPL leku Abilium, kapsułki twarde, 15 mgWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Skuteczność kliniczna i bezpieczeństwo stosowania Dorośli Schizofrenia Wyniki trzech krótkotrwałych badań (4 do 6 tygodni) z kontrolą placebo, z udziałem 1228 dorosłych chorych na schizofrenię, u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje istotnie większą poprawę w zakresie objawów psychotycznych niż placebo. Arypiprazol jest skuteczny w podtrzymywaniu poprawy klinicznej podczas kontynuacji leczenia u tych dorosłych pacjentów, u których obserwowano wstępną dobrą reakcję na lek.
- CHPL leku Abilium, kapsułki twarde, 15 mgWłaściwości farmakodynamiczne
W badaniu z grupą kontrolną przyjmującą haloperydol, odsetek pacjentów, u których udało się utrzymać dobrą reakcję na lek, przez 52 tygodnie był podobny w obu grupach (arypiprazol 77% i haloperydol 73%). Badanie ukończyła istotnie większa grupa pacjentów leczonych arypiprazolem (43%) niż haloperydolem (30%). Wyniki uzyskane w skalach ocen stosowanych jako wtórne mierniki skuteczności, w tym w skali PANSS i w skali oceny depresji Montgomery-Asberg (MADRS), wskazują na istotną przewagę arypiprazolu nad haloperydolem. W trwającym 26 tygodni badaniu kontrolowanym placebo, z udziałem pacjentów dorosłych z ustabilizowaną przewlekłą schizofrenią stwierdzono, że leczenie arypiprazolem powoduje rzadsze występowanie nawrotów (34% w grupie leczonych arypiprazolem i 57% w grupie otrzymującej placebo). Zwiększenie masy ciała Wyniki badań klinicznych wskazują, że arypiprazol nie powoduje klinicznie istotnego przyrostu masy ciała.
- CHPL leku Abilium, kapsułki twarde, 15 mgWłaściwości farmakodynamiczne
W trwającym 26 tygodni badaniu z grupą kontrolną, przeprowadzonym w wielu krajach, udział wzięło 314 dorosłych pacjentów ze schizofrenią. Pacjentów leczono olanzapiną i z wykorzystaniem podwójnie ślepej próby. Pierwotnym celem była ocena przyrostu masy ciała. W istotnie mniejszej grupie pacjentów leczonych arypiprazolem, w porównaniu z otrzymującymi olanzapinę stwierdzono przyrost masy ciała o ≥7%, względem pomiaru początkowego (tzn. zwiększenie masy ciała o co najmniej 5,6 kg przy średniej początkowej masie wynoszącej ok. 80,5 kg) w grupie leczonych arypiprazolem (n = 18 lub 13% pacjentów, których wyniki poddawano analizie), w porównaniu z olanzapiną (n = 45 lub 33% pacjentów, których wyniki poddawano analizie). Stężenia lipidów W zbiorczej analizie wyników stężeń lipidów pochodzących z kontrolowanych placebo badań klinicznych u dorosłych, arypiprazol nie powodował klinicznie istotnych zmian stężeń cholesterolu całkowitego, triglicerydów, cholesterolu HDL i cholesterolu LDL.
- CHPL leku Abilium, kapsułki twarde, 15 mgWłaściwości farmakodynamiczne
Prolaktyna Stężenia prolaktyny oceniono podczas wszystkich badań z zastosowaniem wszystkich dawek arypiprazolu (n = 28 242). Częstość występowania hiperprolaktynemii lub zwiększenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem (0,3%) była podobna do częstości występowania hiperprolaktynemii w grupie otrzymującej placebo (0,2%). U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 42 dni, a mediana czasu trwania wynosiła 34 dni. Częstość występowania hiperprolaktynemii lub zmniejszenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem wynosiła 0,4% w porównaniu do 0,02% w grupie otrzymującej placebo. U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 30 dni, a mediana czasu trwania wynosiła 194 dni.
- CHPL leku Abilium, kapsułki twarde, 15 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Arypiprazol jest dobrze wchłaniany, maksymalne stężenie w osoczu osiąga w ciągu 3-5 godzin po podaniu. Arypiprazol w minimalnym stopniu ulega metabolizmowi przedukładowemu. Bezwzględna dostępność po doustnym podaniu jednej tabletki wynosi 87%. Spożywanie posiłków o dużej zawartości tłuszczu nie wpływa na farmakokinetykę arypiprazolu. Dystrybucja Arypiprazol jest rozmieszczany w całym organizmie, pozorna objętość dystrybucji wynosi 4,9 l/kg, co wskazuje na znaczną dystrybucję pozanaczyniową. W stężeniach terapeutycznych arypiprazol i dehydroarypiprazol wiążą się w ponad 99% z białkami surowicy, głównie z albuminami. Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie. Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji.
- CHPL leku Abilium, kapsułki twarde, 15 mgWłaściwości farmakokinetyczne
Jak wynika z badań in vitro, enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N-dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. W stanie stacjonarnym czynny metabolit, dehydroarypiprazol, stanowi około 40% pola pod krzywą AUC arypiprazolu w osoczu. Eliminacja Średni okres półtrwania arypiprazolu w fazie eliminacji wynosi około 75 godzin u osób o zwiększonej aktywności CYP2D6 i około 146 godzin u osób o zmniejszonej aktywności CYP2D6. Całkowity klirens arypiprazolu wynosi 0,7 ml/min/kg i jest to głównie klirens wątrobowy. Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [¹⁴C], stwierdza się odpowiednio 27% i 60% podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1% niezmienionego arypiprazolu zostaje wydalone z moczem i około 18% z kałem.
- CHPL leku Abilium, kapsułki twarde, 15 mgWłaściwości farmakokinetyczne
Dzieci i młodzież Farmakokinetyka arypiprazolu i dehydroarypiprazolu u dzieci w wieku od 10 do 17 lat była podobna do farmakokinetyki u dorosłych, po uwzględnieniu różnic w masie ciała. Farmakokinetyka w szczególnych grupach pacjentów Pacjenci w podeszłym wieku Nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi, nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Nie stwierdzono, aby farmakokinetyka arypiprazolu różniła się u zdrowych kobiet i zdrowych mężczyzn. Nie stwierdzono także żadnego mierzalnego wpływu płci na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Palenie tytoniu Populacyjne badania farmakokinetyczne nie wykazały żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu, zależnych od palenia tytoniu.
- CHPL leku Abilium, kapsułki twarde, 15 mgWłaściwości farmakokinetyczne
Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy. Zaburzenia czynności nerek Stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u osób z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badania obejmujące podanie pojedynczej dawki leku, przeprowadzone u osób z różnego stopnia marskością wątroby (klasy Child-Pugh A, B i C) nie wykazały, by niewydolność wątroby wpływała istotnie na farmakokinetykę arypiprazolu i dehydroarypiprazolu, jednak w badaniu wzięło udział tylko 3 chorych z marskością wątroby typu C, co jest liczbą niewystarczającą do wyciągnięcia wniosków dotyczących zdolności metabolicznych tych pacjentów.
- CHPL leku Abilium, kapsułki twarde, 15 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Istotne działanie toksyczne stwierdzano jedynie po podaniu dawek lub przy stopniu narażenia wyraźnie przekraczającym maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza (gromadzenie barwnika lipofuscyny i (lub) obumieranie komórek miąższowych) stwierdzany u szczurów po 104 tygodniach podawania arypiprazolu w dawce od 20 mg do 60 mg/kg mc./dobę (średnia wartość pola pod krzywą AUC w stanie stacjonarnym przekraczała od 3 do 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki) i zwiększenie częstości występowania raków nadnerczy, a także skojarzonej częstości występowania gruczolaków lub raków nadnerczy u samic szczurów otrzymujących lek w dawce 60 mg/kg mc./dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki).
- CHPL leku Abilium, kapsułki twarde, 15 mgPrzedkliniczne dane o bezpieczeństwie
Największa ekspozycja nie powodująca powstawania nowotworów u samic szczurów odpowiadała 7-krotnej ekspozycji u ludzi występującej po stosowaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych sprzężonych związków hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 mg do 125 mg/kg mc./dobę (średnia wartość AUC w stanie stacjonarnym była od 1 do 3 razy większa niż wartość występująca u ludzi po podaniu maksymalnej zalecanej dawki klinicznej lub 16 do 81 razy większa niż po podaniu maksymalnej dawki zalecanej na podstawie przeliczenia mg/m² pc). Jednak stężenie sprzężonych związków siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania największej proponowanej dawki 30 mg na dobę, nie przekraczało 6% stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie mniejsze (6%) niż granica rozpuszczalności określona in vitro.
- CHPL leku Abilium, kapsułki twarde, 15 mgPrzedkliniczne dane o bezpieczeństwie
W badaniach toksykologicznych z zastosowaniem dawki wielokrotnej u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt. Brak dowodów neurotoksyczności i niepożądanego wpływu na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych. Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowane toksyczne wpływy na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości pola pod krzywą AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po zastosowaniu dawek maksymalnych zalecanych u ludzi).
- CHPL leku Abilium, kapsułki twarde, 15 mgPrzedkliniczne dane o bezpieczeństwie
Toksyczny wpływ na samice ciężarne obserwowano podczas podawania dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Abilium, kapsułki twarde, 15 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Abilium, 10 mg Celuloza mikrokrystaliczna Karboksymetyloskrobia sodowa typ A Powidon Krzemionka koloidalna bezwodna Magnezu stearynian Karmin (E 120) Tytanu dwutlenek (E 171) Żelatyna Abilium, 15 mg Celuloza mikrokrystaliczna Karboksymetyloskrobia sodowa typ A Powidon Krzemionka koloidalna bezwodna Magnezu stearynian Żelaza tlenek żółty (E 172) Tytanu dwutlenek (E 171) Żelatyna 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Blister z folii trójwarstwowej OPA/Aluminium/PVC i folia Aluminiowa, umieszczony w tekturowym pudełku. Jeden blister zawiera 7 kapsułek. Opakowanie jednostkowe zawiera 2 lub 4 lub 8 blistrów.
- CHPL leku Abilium, kapsułki twarde, 15 mgDane farmaceutyczne
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Apra, tabletki, 5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Apra, 5 mg, tabletki Apra, 10 mg, tabletki Apra, 15 mg, tabletki Apra, 30 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Apra, 5 mg, tabletki Każda tabletka zawiera 5 mg arypiprazolu. Substancje pomocnicze o znanym działaniu: 0,5 mg aspartamu w tabletce, 47,53 mg laktozy jednowodnej w tabletce, 0,0018 mg alkoholu benzylowego w tabletce. Apra, 10 mg, tabletki Każda tabletka zawiera 10 mg arypiprazolu. Substancje pomocnicze o znanym działaniu: 1 mg aspartamu w tabletce, 95,05 mg laktozy jednowodnej w tabletce, 0,0036 mg alkoholu benzylowego w tabletce. Apra, 15 mg, tabletki Każda tabletka 15 mg arypiprazolu. Substancje pomocnicze o znanym działaniu: 1,5 mg aspartamu w tabletce, 142,58 mg laktozy jednowodnej w tabletce, 0,0054 mg alkoholu benzylowego w tabletce. Apra, 30 mg, tabletki Każda tabletka zawiera 30 mg arypiprazolu.
- CHPL leku Apra, tabletki, 5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
Substancje pomocnicze o znanym działaniu: 3 mg aspartamu w tabletce, 285,15 mg laktozy jednowodnej w tabletce, 0,0108 mg alkoholu benzylowego w tabletce. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Apra, 5 mg, tabletki Prostokątna, obustronnie wypukła i niebieska, o wymiarach 7,6 mm x 4,3 mm, gładka po obu stronach. Apra, 10 mg, tabletki Prostokątna, obustronnie wypukła i różowa, o wymiarach 9,3 mm x 5,2 mm, gładka po obu stronach. Apra, 15 mg, tabletki Okrągła, płaska i żółta, o średnicy 9,0 mm, gładka po obu stronach. Apra, 30 mg, tabletki Okrągła, płaska i różowa, o średnicy 10,0 mm, gładka po obu stronach.
- CHPL leku Apra, tabletki, 5 mgWskazania do stosowania
4.1 Wskazania do stosowania Apra jest wskazana w leczeniu schizofrenii u dorosłych i u młodzieży w wieku 15 lat i starszej. Apra jest wskazana w leczeniu epizodów maniakalnych o nasileniu umiarkowanym do ciężkiego w przebiegu zaburzenia afektywnego dwubiegunowego typu I oraz w zapobieganiu nowym epizodom maniakalnym u dorosłych, u których występują głównie epizody maniakalne i którzy odpowiadają na leczenie arypiprazolem (patrz punkt 5.1). Apra jest wskazana w leczeniu epizodów maniakalnych o nasileniu umiarkowanym do ciężkiego w przebiegu zaburzenia afektywnego dwubiegunowego typu I u młodzieży w wieku 13 lat i starszej, w leczeniu trwającym do 12 tygodni (patrz punkt 5.1).
- CHPL leku Apra, tabletki, 5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Schizofrenia: zalecana dawka początkowa produktu Apra to 10 lub 15 mg na dobę z dawką podtrzymującą 15 mg na dobę. Lek należy podawać raz na dobę o stałej porze, niezależnie od posiłków. Produkt leczniczy Apra jest skuteczny w dawkach od 10 do 30 mg na dobę. Chociaż nie potwierdzono większej skuteczności dawek większych niż dawka dobowa 15 mg, jednak u poszczególnych pacjentów większa dawka może być korzystna. Maksymalna dawka dobowa nie może być większa niż 30 mg. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I: zalecana dawka początkowa to 15 mg arypiprazolu podawanego w schemacie raz na dobę, niezależnie od posiłków jako monoterapia lub w leczeniu skojarzonym (patrz punkt 5.1). U niektórych pacjentów może być korzystne zastosowanie większej dawki. Maksymalna dawka dobowa nie może być większa niż 30 mg.
- CHPL leku Apra, tabletki, 5 mgDawkowanie
Zapobieganie nawrotom epizodów maniakalnych w zaburzeniu afektywnym dwubiegunowym typu I: w celu zapobiegania nawrotom epizodów maniakalnych u pacjentów, którzy stosują arypiprazol w monoterapii lub w terapii skojarzonej, należy kontynuować leczenie stosując ustaloną dawkę. Dostosowanie dawki dobowej, w tym jej zmniejszenie, należy rozważyć na podstawie stanu klinicznego. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej: zalecana dawka produktu Apra to 10 mg na dobę podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie powinno być rozpoczęte od dawki 2 mg (stosując roztwór doustny 1mg/ml) przez 2 dni, stopniowo zwiększanej do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. W przypadkach gdzie zwiększenie dawki jest właściwe, należy podawać kolejne dawki zwiększone jednorazowo o 5 mg, nie przekraczając maksymalnej dawki dobowej 30 mg (patrz punkt 5.1). Apra jest skuteczna w przedziale dawek 10 mg do 30 mg na dobę.
- CHPL leku Apra, tabletki, 5 mgDawkowanie
Nie wykazano większej skuteczności dla dawek dobowych większych niż 10 mg, chociaż poszczególni pacjenci mogą odnieść korzyść z zastosowania większych dawek. Apra nie jest zalecana do stosowania u pacjentów ze schizofrenią w wieku poniżej 15 lat, z powodu braku wystarczających danych dotyczących bezpieczeństwa stosowania i skuteczności (patrz punkty 4.8 i 5.1). Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej: zalecana dawka produktu Apra to 10 mg na dobę, podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie należy rozpocząć od dawki 2 mg (stosując roztwór doustny 1 mg/ml) przez 2 dni, stopniowo zwiększyć do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. Czas trwania leczenia powinien być możliwie najkrótszy konieczny do uzyskania kontroli objawów i nie może przekraczać 12 tygodni.
- CHPL leku Apra, tabletki, 5 mgDawkowanie
Nie wykazano większej skuteczności leczenia po zastosowaniu dawek dobowych większych niż 10 mg, a dawka dobowa wynosząca 30 mg jest związana ze znacząco większą częstością występowania istotnych działań niepożądanych, włączając zdarzenia związane z objawami pozapiramidowymi (ang. EPS), senność, zmęczenie oraz zwiększenie masy ciała (patrz punkt 4.8). Z tego powodu dawki większe niż 10 mg na dobę należy stosować tylko w wyjątkowych przypadkach oraz z zachowaniem ścisłej kontroli klinicznej (patrz punkty 4.4, 4.8 i 5.1). Młodsi pacjenci są narażeni na zwiększone ryzyko działań niepożądanych związanych z arypiprazolem. Z tego powodu produkt Apra nie jest zalecany do stosowania u pacjentów w wieku poniżej 13 lat (patrz punkty 4.8 i 5.1). Szczególne grupy pacjentów Zaburzenia czynności wątroby: Nie ma konieczności modyfikacji dawki u osób z zaburzeniami czynności wątroby o nasileniu lekkim do umiarkowanego.
- CHPL leku Apra, tabletki, 5 mgDawkowanie
Nie ma wystarczających danych do ustalenia dawkowania u pacjentów z ciężką niewydolnością wątroby. W tej grupie pacjentów należy ostrożnie ustalać dawkowanie. Niemniej jednak w grupie pacjentów z ciężkimi zaburzeniami czynności wątroby najwyższą dawkę dobową 30 mg należy stosować ze szczególną ostrożnością (patrz punkt 5.2). Zaburzenia czynności nerek: Nie ma konieczności modyfikacji dawki u pacjentów z zaburzeniami czynności nerek. Pacjenci w podeszłym wieku: Bezpieczeństwo i skuteczność stosowania produktu Apra w leczeniu schizofrenii i w epizodach manii w przebiegu zaburzenia afektywnego dwubiegunowego typu I nie zostały zbadane u pacjentów w wieku 65 lat i starszych. Jednak z powodu większej wrażliwości tych pacjentów, należy rozważyć zastosowanie mniejszej dawki początkowej, jeśli pozwalają na to okoliczności kliniczne (patrz punkt 4.4). Płeć: Nie ma konieczności modyfikacji dawek leku w zależności od płci (patrz punkt 5.2).
- CHPL leku Apra, tabletki, 5 mgDawkowanie
Palacze tytoniu: Biorąc pod uwagę metabolizm arypiprazolu nie ma konieczności modyfikacji dawek u palaczy (patrz punkt 4.5). Dostosowanie dawki z powodu interakcji: Dawkę arypiprazolu należy zmniejszyć w wypadku równoczesnego podawania środka o silnym działaniu hamującym w stosunku do cytochromu CYP3A4 lub CYP2D6. Po zakończeniu jednoczesnego stosowania inhibitora CYP3A4 lub CYP2D6 należy z kolei zwiększyć dawkę arypiprazolu (patrz punkt 4.5). Dawkę arypiprazolu należy zwiększyć w wypadku równoczesnego podawania leków silnie indukujących CYP3A4. Po odstawieniu leku indukującego CYP3A4, dawkę arypiprazolu należy ponownie zmniejszyć do zalecanej (patrz punkt 4.5). Sposób podawania Tabletki Apra są przeznaczone do stosowania doustnego. Tabletki ulegające rozpadowi w jamie ustnej Apra-swift mogą być stosowane alternatywnie do tabletek Apra u pacjentów, którzy mają trudności w połykaniu tabletek Apra (patrz także punkt 5.2).
- CHPL leku Apra, tabletki, 5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Apra, tabletki, 5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić dopiero po kilku dniach do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Prawdopodobieństwo podjęcia próby samobójczej Występowanie zachowań samobójczych jest związane z chorobami psychicznymi oraz zaburzeniami nastroju i w niektórych przypadkach było zgłaszane wkrótce po rozpoczęciu lub zmianie leczenia przeciwpsychotycznego, w tym leczenia arypiprazolem ( patrz punkt 4.8). Leczenie przeciwpsychotyczne pacjentów wysokiego ryzyka powinno odbywać się pod ścisłym nadzorem. Zaburzenia sercowo-naczyniowe Arypiprazol należy stosować ostrożnie u pacjentów z chorobą sercowo-naczyniową (zawał mięśnia sercowego lub choroba niedokrwienna w wywiadzie, niewydolność serca lub zaburzenia przewodzenia), chorobą naczyń mózgu, w stanach predysponujących do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie przeciwnadciśnieniowymi produktami leczniczymi) lub nadciśnienia tętniczego, w tym postępującego lub złośliwego.
- CHPL leku Apra, tabletki, 5 mgSpecjalne środki ostrozności
Po zastosowaniu leków przeciwpsychotycznych obserwowano przypadki żylnej choroby zakrzepowo-zatorowej (VTE - ang. venous thromboembolism). Ponieważ u pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE przed rozpoczęciem oraz w czasie leczenia arypiprazolem i wdrożyć odpowiednie środki zapobiegawcze. Wydłużenie odstępu QT W badaniach klinicznych arypiprazolu częstość występowania wydłużenia odstępu QT była porównywalna z placebo. Arypiprazol należy ostrożnie stosować u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy W badaniach klinicznych trwających nie dłużej niż rok zgłaszano w trakcie leczenia arypiprazolem niezbyt częste przypadki dyskinez wymagające interwencji.
- CHPL leku Apra, tabletki, 5 mgSpecjalne środki ostrozności
Jeśli objawy przedmiotowe lub podmiotowe późnych dyskinez wystąpią u pacjentów leczonych arypiprazolem, należy rozważyć zmniejszenie dawki lub odstawienie leku (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Inne objawy pozapiramidowe W pediatrycznych badaniach klinicznych z zastosowaniem arypiprazolu obserwowano akatyzję oraz parkinsonizm. Jeśli u pacjenta przyjmującego arypiprazol wystąpią objawy przedmiotowe i podmiotowe innych zaburzeń pozapiramidowych, należy rozważyć zmniejszenie dawki oraz wprowadzenie ścisłej kontroli klinicznej. Złośliwy Zespół Neuroleptyczny (NMS) NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z podawaniem leków przeciwpsychotycznych. W badaniach klinicznych, odnotowano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku Apra, tabletki, 5 mgSpecjalne środki ostrozności
Klinicznymi objawami NMS są bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz objawy niestabilności autonomicznego układu nerwowego (nieregularne tętno i wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Jednakże, obserwowano także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę, niekoniecznie związane z NMS. Jeśli wystąpiły wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS, bądź niewyjaśnionego pochodzenia wysoka gorączka, bez innych objawów NMS, należy przerwać leczenie wszystkimi lekami przeciwpsychotycznymi, w tym także arypiprazolem. Drgawki W badaniach klinicznych odnotowano niezbyt częste przypadki napadów drgawek w czasie leczenia arypiprazolem.
- CHPL leku Apra, tabletki, 5 mgSpecjalne środki ostrozności
Z tego powodu arypiprazol należy stosować z zachowaniem ostrożności u pacjentów, u których w przeszłości występowały napady drgawek lub, u których występują choroby wiążące się ze skłonnością do takich napadów (patrz pkt. 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencją: Zwiększona śmiertelność: W trzech badaniach kontrolowanych placebo (n= 938, średnia wieku: 82,4; zakres: 56-99 lat), u pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera, leczonych arypiprazolem, występowało zwiększone ryzyko zgonu w porównaniu z grupą otrzymującą placebo. Częstość zgonów u pacjentów leczonych arypiprazolem wynosiła 3,5% w porównaniu do 1,7% w grupie placebo. Chociaż przyczyny zgonów były zróżnicowane to większość zgonów wydawała się związana albo z chorobami układu krążenia (np. niewydolność serca, nagłe zgony), albo z chorobami infekcyjnymi (np. zapalenie płuc) (patrz punkt 4.8).
- CHPL leku Apra, tabletki, 5 mgSpecjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego: U pacjentów w tych samych badaniach odnotowano działania niepożądane dotyczące krążenia mózgowego (np. udar, przejściowe napady niedokrwienia) w tym o przebiegu zakończonym zgonem (średnia wieku: 84 lata; zakres 78-88 lat). Ogólnie w tych badaniach 1,3% wszystkich pacjentów leczonych arypiprazolem zgłaszało działania niepożądane dotyczące krążenia mózgowego, w porównaniu do 0,6% pacjentów otrzymujących placebo. Różnica ta nie była istotna statystycznie. W jednym z tych badań z zastosowaniem ustalonego dawkowania u pacjentów leczonych arypiprazolem występowała jednak istotna zależność odpowiedzi od dawki dla działań niepożądanych dotyczących krążenia mózgowego (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów z psychozą związaną z demencją. Upadki: Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków.
- CHPL leku Apra, tabletki, 5 mgSpecjalne środki ostrozności
Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2). Hiperglikemia i cukrzyca: U pacjentów leczonych nietypowymi środkami przeciwpsychotycznymi, w tym arypiprazolem, opisywano hiperglikemię, w niektórych przypadkach bardzo wysoką z kwasicą ketonową i śpiączką hiperosmotyczną lub zgonem. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. W badaniach klinicznych z arypiprazolem nie było istotnych różnic w częstości występowania działań niepożądanych związanych z hiperglikemią (w tym cukrzycy) lub nieprawidłowych wartości laboratoryjnych stężenia glukozy w porównaniu do placebo.
- CHPL leku Apra, tabletki, 5 mgSpecjalne środki ostrozności
Nie jest dostępna dokładna ocena ryzyka wystąpienia działań niepożądanych związanych z hiperglikemią, która pozwalałaby na dokonanie bezpośredniego porównania leczenia arypiprazolem i innymi atypowymi lekami przeciwpsychotycznymi. Pacjenci leczeni jakimkolwiek lekiem przeciwpsychotycznym, włącznie z arypiprazolem, powinni być obserwowani czy nie występują u nich objawy podmiotowe i przedmiotowe związane z hiperglikemią (takie jak nadmierne pragnienie, wielomocz, nadmierny apetyt i osłabienie), a pacjenci z cukrzycą lub czynnikami ryzyka wystąpienia cukrzycy powinni być regularnie monitorowani pod kątem pogorszenia kontroli glikemii (patrz punkt 4.8). Nadwrażliwość: Podczas przyjmowania arypiprazolu, mogą wystąpić reakcje nadwrażliwości charakteryzujące się objawami reakcji uczuleniowych (patrz punkt 4.8).
- CHPL leku Apra, tabletki, 5 mgSpecjalne środki ostrozności
Zwiększenie masy ciała: Obserwowane u pacjentów ze schizofrenią i zaburzeniem afektywnym dwubiegunowym zwiększenie masy ciała jest zwykle spowodowane współistniejącymi chorobami, stosowaniem leków przeciwpsychotycznych, o których wiadomo, że powodują zwiększenie masy ciała, niewłaściwym stylem życia i może prowadzić do ciężkich powikłań. Po wprowadzeniu produktu do obrotu obserwowano zwiększenie masy ciała u pacjentów otrzymujących arypiprazol. Jeśli występowało, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych arypiprazol nie powodował klinicznie istotnego zwiększenia masy ciała u dorosłych (patrz punkt 5.1). W badaniach klinicznych z udziałem młodzieży z epizodem manii w przebiegu zaburzenia afektywnego dwubiegunowego wykazano, że stosowanie arypiprazolu ma związek ze zwiększeniem masy ciała po 4 tygodniach leczenia.
- CHPL leku Apra, tabletki, 5 mgSpecjalne środki ostrozności
U młodzieży z zaburzeniem afektywnym dwubiegunowym należy kontrolować przyrost masy ciała. Jeśli przyrost masy ciała jest znaczący klinicznie, należy rozważyć zmniejszenie dawki (patrz punkt 4.8). Dysfagia: Ze stosowaniem leków przeciwpsychotycznych, w tym arypiprazolu, wiąże się spowolnienie motoryki przełyku i ryzyko aspiracji. Arypiprazol należy stosować ostrożnie u pacjentów z ryzykiem wystąpienia zachłystowego zapalenia płuc. Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Podczas przyjmowania arypiprazolu u pacjentów mogą występować zwiększone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy obejmują: zwiększenie popędów seksualnych, kompulsywną potrzebę wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania.
- CHPL leku Apra, tabletki, 5 mgSpecjalne środki ostrozności
Ważne jest, aby lekarze przepisujący lek pytali pacjentów lub opiekunów w szczególności o pojawienie się nowego lub zwiększonego popędu do hazardu, popędów seksualnych, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa lub kompulsywnego objadania się, lub innych popędów podczas leczenia arypiprazolem. Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu leku. Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Lekarz rozważy zmianę dawki lub odstawienie leku, jeśli u pacjenta wystąpią takie popędy podczas przyjmowania arypiprazolu (patrz punkt 4.8). Pacjenci ze współistniejącym ADHD Pomimo wysokiej częstości współistnienia zaburzenia afektywnego dwubiegunowego typu I oraz zespołu ADHD, dane dotyczące bezpieczeństwa jednoczesnego stosowania arypiprazolu oraz stymulantów są bardzo ograniczone; dlatego też należy zachować wyjątkową ostrożność w razie podawania tych produktów jednocześnie.
- CHPL leku Apra, tabletki, 5 mgSpecjalne środki ostrozności
Specjalne ostrzeżenia dotyczące substancji pomocniczych Aspartam: Aspartam jest źródłem fenyloalaniny. Może być szkodliwy dla pacjentów z fenyloketonurią. Jest to rzadka choroba genetyczna, w której fenyloalanina gromadzi się w organizmie, z powodu jej nieprawidłowego wydalania. Laktoza: Tabletki Apra zawierają laktozę. Lek nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy- galaktozy. Sód: Lek zawiera mniej niż 1 mmol (23 mg) sodu w każdej tabletce, to znaczy lek uznaje się za „wolny od sodu”. Alkohol benzylowy: Alkohol benzylowy może powodować reakcje alergiczne. Kobiety w ciąży lub karmiące piersią powinny skontaktować się z lekarzem przed zastosowaniem leku, gdyż duża ilość alkoholu benzylowego może gromadzić się w ich organizmie i powodować działania niepożądane (tzw. kwasicę metaboliczną).
- CHPL leku Apra, tabletki, 5 mgSpecjalne środki ostrozności
Pacjenci z chorobami wątroby lub nerek powinni skontaktować się z lekarzem przed zastosowaniem leku, gdyż duża ilość alkoholu benzylowego może gromadzić się w ich organizmie i powodować działania niepożądane (tzw. kwasicę metaboliczną).
- CHPL leku Apra, tabletki, 5 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na antagonistyczne działanie na receptor adrenergiczny α1, arypiprazol może nasilać działanie niektórych leków przeciwnadciśnieniowych. Ze względu na pierwotne działanie arypiprazolu na OUN, należy zachować ostrożność, jeśli arypiprazol jest przyjmowany razem z alkoholem lub z innymi produktami leczniczymi działającymi na OUN, wywołującymi zbliżone działania niepożądane, takie jak sedacja (patrz punkt 4.8). Należy zachować ostrożność podając arypiprazol równocześnie z produktami leczniczymi, o których wiadomo, że powodują wydłużenie odstępu QT lub zaburzenia elektrolitowe. Możliwy wpływ innych produktów leczniczych na arypiprazol Antagonista receptora H2 - famotydyna, lek hamujący uwalnianie kwasu żołądkowego, zmniejsza szybkość wchłaniania arypiprazolu, jednak działanie to nie ma znaczenia klinicznego.
- CHPL leku Apra, tabletki, 5 mgInterakcje
Arypiprazol jest metabolizowany na wiele sposobów, w tym także przez enzymy, takie jak CYP2D6 i CYP3A4. Nie jest jednak metabolizowany przez enzymy z grupy CYP1A, a więc nie jest konieczne stosowanie specjalnych dawek u palaczy tytoniu. Chinidyna i inne silne inhibitory CYP2D6: Wyniki badań klinicznych z udziałem zdrowych osób wykazały, że silny inhibitor enzymu CYP2D6 (chinidyna) zwiększa AUC arypiprazolu o 107%, podczas gdy Cmax nie zmienia się. AUC i Cmax dehydroarypiprazolu, aktywnego metabolitu, były zmniejszone odpowiednio o 32% i 47%. W przypadku jednoczesnego podawania chinidyny i arypiprazolu, należy zmniejszyć dawkę arypiprazolu o około połowę w stosunku do przepisanej dawki. Inne silne inhibitory grupy enzymów CYP2D6, takie jak fluoksetyna i paroksetyna, mogą powodować podobne skutki i w takich sytuacjach należy podobnie zredukować dawkę leku.
- CHPL leku Apra, tabletki, 5 mgInterakcje
Ketokonazol i inne silne inhibitory CYP3A4: Wyniki badań klinicznych z udziałem zdrowych osób wskazują, że silny inhibitor CYP3A4 (ketokonazol) zwiększa AUC i Cmax arypiprazolu odpowiednio o 63% i 37%, a AUC i Cmax dehydroarypiprazolu odpowiednio o 77% i 43%. W grupie osób o obniżonej aktywności CYP2D6, równoczesne stosowanie silnych inhibitorów CYP3A4 może powodować zwiększenie stężenia arypiprazolu w osoczu, w porównaniu do osób o podwyższonej aktywności CYP2D6. W przypadku jednoczesnego stosowania ketokonazolu albo innych silnych inhibitorów CYP3A4 z arypiprazolem, zakładane korzyści powinny przeważyć ryzyko dla pacjenta. W przypadku jednoczesnego stosowania ketokonazolu z arypiprazolem, przepisaną dawkę arypiprazolu należy zmniejszyć o około połowę. Inne leki silnie hamujące aktywność CYP3A4, takie jak itrakonazol oraz inhibitory proteazy HIV, mogą powodować podobne skutki jak ketokonazol i w takich przypadkach należy podobnie zredukować dawkowanie (patrz punkt 4.2).
- CHPL leku Apra, tabletki, 5 mgInterakcje
Po odstawieniu inhibitora CYP2D6 lub CYP3A4, dawkę arypiprazolu należy zwiększyć do tej, jaką stosowano przed rozpoczęciem terapii skojarzonej. W czasie równoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazemu) lub CYP2D6 (np. escytalopramu) z arypiprazolem, można spodziewać się niewielkiego zwiększenia stężenia arypiprazolu w osoczu. Karbamazepina i inne leki indukujące CYP3A4: Po jednoczesnym podaniu karbamazepiny, silnego induktora CYP3A4 w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnia geometryczna Cmax i AUC arypiprazolu zmniejszyły się odpowiednio o 68% i 73%, w stosunku do wartości tych parametrów podczas stosowania arypiprazolu (30 mg) w monoterapii. Podobnie, w przypadku dehydroarypiprazolu średnia geometryczna Cmax i AUC po jednoczesnym podaniu karbamazepiny zmniejszają się odpowiednio o 69% i 71%, w stosunku do ich wartości podczas leczenia samym arypiprazolem.
- CHPL leku Apra, tabletki, 5 mgInterakcje
Dlatego dawkę arypiprazolu należy podwoić, gdy jednocześnie podaje się go z karbamazepiną. Można się spodziewać, że jednoczesne podawanie arypiprazolu i innych silnych induktorów CYP3A4 (takie jak ryfampicyna, ryfabutyna, fenytoina, fenobarbital, prymidon, efawirenz, newirapina i ziele dziurawca zwyczajnego) może działać podobnie i dlatego należy podobnie zwiększyć dawkę. Po zakończeniu podawania silnego induktora CYP3A4, należy zmniejszyć dawkę arypiprazolu do zalecanej. Walproinian i lit: Skojarzone stosowanie walproinianów lub soli litu z arypiprazolem nie powodowało żadnych istotnych klinicznie zmian stężenia arypiprazolu i w związku z tym nie jest konieczne dostosowanie dawki podczas podawania walproinianu lub litu w skojarzeniu z arypiprazolem. Zespół serotoninowy: obserwowano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol, a możliwe objawy przedmiotowe oraz podmiotowe dla tego stanu mogą wystąpić szczególnie w razie jednoczesnego stosowania innych leków serotoninergicznych, takich jak SSRI/SNRI (selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny) lub leków, o których wiadomo, że zwiększają stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Apra, tabletki, 5 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie przeprowadzono dotychczas odpowiednio kontrolowanych badań dotyczących działania arypiprazolu u kobiet w ciąży. Notowano występowanie wad wrodzonych, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. Na podstawie wyników badań przeprowadzonych na zwierzętach nie można wykluczyć potencjalnego toksycznego wpływu leku na płód (patrz punkt 5.3). Pacjentki należy poinformować o konieczności powiadomienia swojego lekarza, jeśli w trakcie leczenia arypiprazolem zajdą w ciąże lub planują zajście w ciążę. Ze względu na niewystarczające dane dotyczące bezpieczeństwa u ludzi oraz budzące wątpliwości wyniki badań na zwierzętach, ten lek nie może być stosowany w okresie ciąży, chyba że spodziewane korzyści wyraźnie przewyższają potencjalne ryzyko dla płodu.
- CHPL leku Apra, tabletki, 5 mgWpływ na płodność, ciążę i laktację
Noworodki narażone na działanie leków przeciwpsychotycznych (w tym na arypiprazol) w czasie trzeciego trymestru ciąży są w grupie ryzyka, w której mogą wystąpić działania niepożądane, w tym zaburzenia pozapiramidowe i (lub) objawy odstawienia, które po porodzie mogą różnić się ciężkością oraz czasem trwania. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być uważnie monitorowane (patrz punkt 4.8). Karmienie piersi? Arypiprazol/metabolity przenikają do mleka ludzkiego. Należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać przyjmowanie arypiprazolu, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem na reprodukcję.
- CHPL leku Apra, tabletki, 5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe, senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku Apra, tabletki, 5 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Najczęściej notowanymi działaniami niepożądanymi w kontrolowanych placebo badaniach były akatyzja i nudności, każde występujące częściej niż u 3% pacjentów leczonych arypiprazolem podawanym doustnie. Tabelaryczne zestawienie działań niepożądanych: Częstość występowania działań niepożądanych związanych z leczeniem arypiprazolem podano w poniższej tabeli. Dane w tabeli oparto na działaniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układ/narząd i częstości: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych). W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
- CHPL leku Apra, tabletki, 5 mgDziałania niepożądane
Nie można określić częstości działań niepożądanych zgłaszanych po wprowadzeniu do obrotu, ponieważ pochodzą one ze spontanicznych zgłoszeń. Z tego względu częstość takich działań niepożądanych określono jako „nieznana”.
- CHPL leku Apra, tabletki, 5 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedmiotowe i podmiotowe W badaniach klinicznych i po wprowadzeniu produktu do obrotu zgłaszano przypadkowe bądź zamierzone przedawkowanie samego arypiprazolu przez dorosłych pacjentów o szacowanej dawce do 1260 mg niezakończone zgonem. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: letarg, wzrost ciśnienia tętniczego krwi, senność, przyspieszona czynność serca (tachykardia), nudności, wymioty i biegunka. Ponadto zgłaszano przypadkowe przedawkowanie samego arypiprazolu (do 195 mg) u dzieci, bez zgonów. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: senność, przejściowa utrata świadomości i objawy pozapiramidowe. Postępowanie po przedawkowaniu W wypadku przedawkowania leku stosuje się leczenie podtrzymujące, polegające na utrzymaniu drożności dróg oddechowych, dotlenianiu i wentylacji oraz leczeniu objawowym.
- CHPL leku Apra, tabletki, 5 mgPrzedawkowanie
Należy wziąć pod uwagę możliwość działania wielu produktów leczniczych. Z tego względu należy niezwłocznie rozpocząć monitorowanie czynności układu krążenia, obejmujące stałe monitorowanie zapisu elektrokardiograficznego, w celu wykrycia możliwych zaburzeń rytmu serca. Wiedząc lub podejrzewając przedawkowanie arypiprazolu należy objąć ścisłą kontrolą pacjenta i obserwować go do czasu poprawy jego stanu. Aktywny węgiel (50 g), podany w godzinę po zażyciu arypiprazolu, obniża Cmax arypiprazolu o około 41%, a AUC o około 51%, co wskazuje na jego skuteczność w leczeniu przedawkowania. Hemodializa: Chociaż brak informacji dotyczących wpływu hemodializ w leczeniu przedawkowania arypiprazolu, to jest jednak małe prawdopodobieństwo, że hemodializy będą użyteczne w takich przypadkach, ze względu na znaczny stopień wiązania arypiprazolu z białkami osocza.
- CHPL leku Apra, tabletki, 5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12 Mechanizm działania Uważa się, że skuteczność arypiprazolu w leczeniu schizofrenii i zaburzenia afektywnego dwubiegunowego typu I jest związana ze skojarzonym działaniem częściowo agonistycznym w stosunku do receptora dopaminowego D2 i serotoninowego 5-HT1a oraz antagonistycznym w stosunku do receptora serotoninowego 5-HT2a. Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D2 i D3, serotoninowych 5-HT1a i 5-HT2a oraz umiarkowane powinowactwo do receptorów dopaminowych D4, serotoninowych 5-HT2c i 5-HT7, a także adrenergicznych alfa-1 i histaminowych H1.
- CHPL leku Apra, tabletki, 5 mgWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Arypiprazol w dawkach od 0,5 do 30 mg, podawany raz na dobę przez 2 tygodnie osobom zdrowym powoduje zależne od dawki zmniejszenie wiązania rakloprydu znakowanego ¹¹C, ligandu receptora D2/D3, w jądrze ogoniastym i skorupie, co można wykryć za pomocą pozytonowej tomografii emisyjnej. Skuteczność kliniczna i bezpieczeństwo stosowania Dorośli Schizofrenia Wyniki trzech krótkoterminowych badań (4 do 6 tygodni) z kontrolą placebo z udziałem 1228 dorosłych chorych na schizofrenię, u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku Apra, tabletki, 5 mgWłaściwości farmakodynamiczne
Arypiprazol jest skuteczna w podtrzymywaniu poprawy klinicznej podczas kontynuacji leczenia u tych dorosłych pacjentów, u których obserwowano wstępną dobrą reakcję na lek. W badaniu z grupą kontrolną przyjmującą haloperydol, odsetek pacjentów, u których udało się utrzymać dobrą reakcję na produkt leczniczy, w ciągu 52 tygodni był podobny w obu grupach (arypiprazol 77% i haloperydol 73%). Badanie ukończyła istotnie większa grupa pacjentów leczonych arypiprazolem (43%) niż haloperydolem (30%). Wyniki uzyskane w skalach ocen stosowanych jako wtórne mierniki skuteczności, w tym w skali PANSS i w skali oceny depresji Montgomery-Asberg, wskazują na istotną przewagę nad haloperydolem. W trwającym 26 tygodni kontrolowanym badaniu z użyciem placebo, z udziałem pacjentów dorosłych z ustabilizowaną przewlekłą schizofrenią, stwierdzono w wyniku leczenia arypiprazolem większe zmniejszenie częstości nawrotów (34% w grupie leczonych arypiprazolem i 57% w grupie otrzymującej placebo). 15.
- CHPL leku Apra, tabletki, 5 mgWłaściwości farmakodynamiczne
Przyrost masy ciała Wyniki badań klinicznych wskazują, że arypiprazol nie powoduje klinicznie istotnego przyrostu masy ciała. W trwającym 26 tygodni badaniu z grupą kontrolną leczonych olanzapiną i wykorzystaniem podwójnie ślepej próby, przeprowadzonym w wielu krajach, udział wzięło 314 chorych dorosłych na schizofrenię. Pierwotnym celem była ocena przyrostu masy ciała. W istotnie mniejszej grupie pacjentów leczonych arypiprazolem w porównaniu z otrzymującymi olanzapinę, stwierdzono przyrost masy ciała o ≥7% wobec pomiaru wyjściowego (tzn. przyrost masy ciała o co najmniej 5,6 kg przy średniej początkowej masie wynoszącej ok. 80,5 kg); w grupie leczonych arypiprazolem (n = 18 lub 13% pacjentów, których wyniki poddawano analizie), w porównaniu grupą otrzymujących olanzapinę (n = 45 lub 33% pacjentów, których wyniki poddawano analizie).
- CHPL leku Apra, tabletki, 5 mgWłaściwości farmakodynamiczne
Stężenia lipidów W zbiorczej analizie wyników stężeń lipidów pochodzących z kontrolowanych placebo badań klinicznych u dorosłych, arypiprazol nie powodował klinicznie istotnych zmian stężeń cholesterolu całkowitego, triglicerydów, cholesterolu HDL i cholesterolu LDL. Prolaktyna Stężenia prolaktyny oceniono podczas wszystkich badań z zastosowaniem wszystkich dawek arypiprazolu (n = 28 242). Częstość występowania hiperprolaktynemii lub zwiększenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem (0,3%) była podobna do częstości występowania hiperprolaktynemii w grupie otrzymującej placebo (0,2%). U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 42 dni, a mediana czasu trwania wynosiła 34 dni. Częstość występowania hiperprolaktynemii lub zmniejszenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem wynosiła 0,4% w porównaniu do 0,02% w grupie otrzymującej placebo.
- CHPL leku Apra, tabletki, 5 mgWłaściwości farmakodynamiczne
U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 30 dni, a mediana czasu trwania wynosiła 194 dni. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I W dwóch 3-tygodniowych badaniach, kontrolowanych placebo, z zastosowaniem zmiennej dawki, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol w monoterapii był znacząco bardziej skuteczny niż placebo w zmniejszaniu objawów maniakalnych w ciągu 3 tygodni. Badania te obejmowały pacjentów z objawami lub bez objawów psychotycznych oraz pacjentów z szybką zmianą fazy lub bez szybkiej zmiany fazy (przebieg typu rapid-cycling). W jednym 3-tygodniowym badaniu, kontrolowanym placebo, z zastosowaniem stałej dawki w monoterapii, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol nie wykazał większej skuteczności niż placebo.
- CHPL leku Apra, tabletki, 5 mgWłaściwości farmakodynamiczne
W dwóch 12-tygodniowych badaniach, kontrolowanych placebo oraz innymi substancjami czynnymi u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, arypiprazol był skuteczniejszy niż placebo w 3. tygodniu badania, a wynik leczenia podtrzymującego był w 12. tygodniu badania porównywalny z wynikiem dla litu lub haloperydolu. W 12. tygodniu arypiprazol powodował także remisję objawów maniakalnych u porównywalnej liczby pacjentów co lit lub haloperydol. W 6-tygodniowym, kontrolowanym placebo, badaniu u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, którzy częściowo nie odpowiadali na monoterapię litem lub walproinianem przez 2 tygodnie przy terapeutycznych stężeniach w surowicy, zastosowanie arypiprazolu jako dodatkowego leku w większym stopniu zwiększyło skuteczność zapobiegania objawom maniakalnym niż stosowanie litu lub walproinianu w monoterapii.
- CHPL leku Apra, tabletki, 5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Arypiprazol jest dobrze wchłaniany, maksymalne stężenie w osoczu osiąga w ciągu 3-5 godzin po podaniu. Arypiprazol w minimalnym stopniu ulega metabolizmowi przedukładowemu. Bezwzględna dostępność po doustnym podaniu jednej tabletki wynosi 87%. Spożywanie posiłków o dużej zawartości tłuszczu nie wpływa na farmakokinetykę arypiprazolu. Dystrybucja Arypiprazol jest rozmieszczany w całym organizmie, pozorna objętość dystrybucji wynosi 4,9 l/kg, co wskazuje na znaczną dystrybucję pozanaczyniową. W stężeniach terapeutycznych arypiprazol i dehydroarypiprazol wiążą się w ponad 99% z białkami surowicy, głównie z albuminami. Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie. Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji.
- CHPL leku Apra, tabletki, 5 mgWłaściwości farmakokinetyczne
Jak wynika z badań in vitro, enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N-dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. W stanie stacjonarnym aktywny metabolit, dehydroarypiprazol, stanowi około 40% AUC arypiprazolu w osoczu. Eliminacja Średni okres półtrwania arypiprazolu w fazie eliminacji wynosi około 75 godzin u osób o podwyższonej aktywności CYP2D6 i około 146 godzin u osób o obniżonej aktywności CYP2D6. Całkowity klirens arypiprazolu wynosi 0,7 ml/min/kg mc. i jest to głównie klirens wątrobowy. Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [¹⁴C], stwierdza się odpowiednio 27% i 60% podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1% niezmienionego arypiprazolu zostaje wydalone z moczem, a około 18% z kałem.
- CHPL leku Apra, tabletki, 5 mgWłaściwości farmakokinetyczne
Dzieci i młodzież Farmakokinetyka arypiprazolu i dehydroarypiprazolu u dzieci w wieku 10 do 17 lat była podobna do farmakokinetyki u dorosłych, po uwzględnieniu różnic w masie ciała. Farmakokinetyka w szczególnych grupach pacjentów Pacjenci w podeszłym wieku Nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi, nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Nie stwierdzono, aby farmakokinetyka arypiprazolu różniła się u zdrowych kobiet i zdrowych mężczyzn. Nie stwierdzono także żadnego mierzalnego wpływu płci na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Palenie tytoniu Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie wpływów na farmakokinetykę arypiprazolu, zależnych od palenia tytoniu.
- CHPL leku Apra, tabletki, 5 mgWłaściwości farmakokinetyczne
Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy. Zaburzenia czynności nerek Stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u osób z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badania obejmujące podanie pojedynczej dawki leku, przeprowadzone u osób z różnego stopnia marskością wątroby (klasy Child-Pugh A, B i C) nie wykazały, by zaburzenia czynności wątroby wpływały istotnie na farmakokinetykę arypiprazolu i dehydroarypiprazolu, jednak w badaniu wzięło udział tylko 3 chorych z marskością wątroby typu C, co jest liczbą niewystarczającą do wyciągnięcia wniosków dotyczących zdolności metabolicznych tych pacjentów.
- CHPL leku Apra, tabletki, 5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego i toksycznego wpływu na reprodukcję i rozwój, nie ujawniają występowania szczególnego zagrożenia dla człowieka. Istotne działanie toksyczne stwierdzano jedynie, gdy dawki lub stopień narażenia wyraźnie przekraczały maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza (gromadzenie barwnika lipofuscyny i (lub) obumieranie komórek miąższowych) stwierdzany u szczurów po 104 tygodniach podawania arypiprazolu w dawce od 20 do 60 mg/kg mc.
- CHPL leku Apra, tabletki, 5 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 3 do 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki) i zwiększenie częstości występowania raków nadnerczy, a także skojarzonej częstości występowania gruczolaków lub raków nadnerczy u samic szczurów otrzymujących lek w dawce 60 mg/kg mc. na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki). Największa ekspozycja nie powodująca powstawania nowotworów u samic szczurów odpowiadała 7 krotnej ekspozycji u ludzi występującej po stosowaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych sprzężonych związków hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 do 125 mg/kg mc.
- CHPL leku Apra, tabletki, 5 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym była od 1 do 3 razy większa niż wartość występująca u ludzi po podaniu maksymalnej zalecanej dawki klinicznej lub 16 do 81 razy większa niż po podaniu maksymalnej dawki zalecanej w przeliczeniu na mg/m2 pc). Jednak stężenie sprzężonych związków siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania najwyższej proponowanej dawki 30 mg na dobę, nie przekraczało 6% stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie mniejsze (6%) niż granica rozpuszczalności określona in vitro. W badaniach toksykologicznych z użyciem dawki wielokrotnej u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt, nie ma też dowodów neurotoksyczności i niepożądanego wpływu na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych.
- CHPL leku Apra, tabletki, 5 mgPrzedkliniczne dane o bezpieczeństwie
Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowane toksyczne wpływy na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po zastosowaniu dawek maksymalnych zalecanych u ludzi). Toksyczny wpływ na ciężarne samice obserwowano po podawaniu dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Apra, tabletki, 5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Apra, tabletki 5 mg: Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Aspartam (E 951) Magnezu stearynian Indygotyna, lak (E 132) Aromat waniliowy (maltodekstryna, guma arabska E 414, glikol propylenowy E 1520, alkohol benzylowy E 1519) Apra, tabletki 10 i 30 mg: Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Aspartam (E951) Magnezu stearynian Żelaza tlenek czerwony (E 172) Aromat waniliowy (maltodekstryna, guma arabska E 414, glikol propylenowy E 1520, alkohol benzylowy E 1519) Apra, tabletki 15 mg: Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Aspartam (E 951) Magnezu stearynian Żelaza tlenek żółty (E 172) Aromat waniliowy (maltodekstryna, guma arabska E 414, glikol propylenowy E 1520, alkohol benzylowy E 1519) 6.2 Niezgodności farmaceutyczne Nie dotyczy.
- CHPL leku Apra, tabletki, 5 mgDane farmaceutyczne
6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Brak szczególnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Apra, 5mg i Apra, 30mg: Pudełka tekturowe zawierające 7, 14 i 28 tabletek w blistrach OPA/Aluminium/PVC/Aluminium. Apra, 10 mg i Apra, 15mg: Pudełka tekturowe zawierające 7, 14, 28, 56 i 84 tabletki w blistrach OPA/Aluminium/PVC/Aluminium. 6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć w sposób zgodny z lokalnymi przepisami.
- CHPL leku Apra, tabletki, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Apra, 5 mg, tabletki Apra, 10 mg, tabletki Apra, 15 mg, tabletki Apra, 30 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Apra, 5 mg, tabletki Każda tabletka zawiera 5 mg arypiprazolu. Substancje pomocnicze o znanym działaniu: 0,5 mg aspartamu w tabletce, 47,53 mg laktozy jednowodnej w tabletce, 0,0018 mg alkoholu benzylowego w tabletce. Apra, 10 mg, tabletki Każda tabletka zawiera 10 mg arypiprazolu. Substancje pomocnicze o znanym działaniu: 1 mg aspartamu w tabletce, 95,05 mg laktozy jednowodnej w tabletce, 0,0036 mg alkoholu benzylowego w tabletce. Apra, 15 mg, tabletki Każda tabletka 15 mg arypiprazolu. Substancje pomocnicze o znanym działaniu: 1,5 mg aspartamu w tabletce, 142,58 mg laktozy jednowodnej w tabletce, 0,0054 mg alkoholu benzylowego w tabletce. Apra, 30 mg, tabletki Każda tabletka zawiera 30 mg arypiprazolu.
- CHPL leku Apra, tabletki, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
Substancje pomocnicze o znanym działaniu: 3 mg aspartamu w tabletce, 285,15 mg laktozy jednowodnej w tabletce, 0,0108 mg alkoholu benzylowego w tabletce. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Apra, 5 mg, tabletki Prostokątna, obustronnie wypukła i niebieska, o wymiarach 7,6 mm x 4,3 mm, gładka po obu stronach. Apra, 10 mg, tabletki Prostokątna, obustronnie wypukła i różowa, o wymiarach 9,3 mm x 5,2 mm, gładka po obu stronach. Apra, 15 mg, tabletki Okrągła, płaska i żółta, o średnicy 9,0 mm, gładka po obu stronach. Apra, 30 mg, tabletki Okrągła, płaska i różowa, o średnicy 10,0 mm, gładka po obu stronach.
- CHPL leku Apra, tabletki, 10 mgWskazania do stosowania
4.1 Wskazania do stosowania Apra jest wskazana w leczeniu schizofrenii u dorosłych i u młodzieży w wieku 15 lat i starszej. Apra jest wskazana w leczeniu epizodów maniakalnych o nasileniu umiarkowanym do ciężkiego w przebiegu zaburzenia afektywnego dwubiegunowego typu I oraz w zapobieganiu nowym epizodom maniakalnym u dorosłych, u których występują głównie epizody maniakalne i którzy odpowiadają na leczenie arypiprazolem (patrz punkt 5.1). Apra jest wskazana w leczeniu epizodów maniakalnych o nasileniu umiarkowanym do ciężkiego w przebiegu zaburzenia afektywnego dwubiegunowego typu I u młodzieży w wieku 13 lat i starszej, w leczeniu trwającym do 12 tygodni (patrz punkt 5.1).
- CHPL leku Apra, tabletki, 10 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Schizofrenia: zalecana dawka początkowa produktu Apra to 10 lub 15 mg na dobę z dawką podtrzymującą 15 mg na dobę. Lek należy podawać raz na dobę o stałej porze, niezależnie od posiłków. Produkt leczniczy Apra jest skuteczny w dawkach od 10 do 30 mg na dobę. Chociaż nie potwierdzono większej skuteczności dawek większych niż dawka dobowa 15 mg, jednak u poszczególnych pacjentów większa dawka może być korzystna. Maksymalna dawka dobowa nie może być większa niż 30 mg. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I: zalecana dawka początkowa to 15 mg arypiprazolu podawanego w schemacie raz na dobę, niezależnie od posiłków jako monoterapia lub w leczeniu skojarzonym (patrz punkt 5.1). U niektórych pacjentów może być korzystne zastosowanie większej dawki. Maksymalna dawka dobowa nie może być większa niż 30 mg.
- CHPL leku Apra, tabletki, 10 mgDawkowanie
Zapobieganie nawrotom epizodów maniakalnych w zaburzeniu afektywnym dwubiegunowym typu I: w celu zapobiegania nawrotom epizodów maniakalnych u pacjentów, którzy stosują arypiprazol w monoterapii lub w terapii skojarzonej, należy kontynuować leczenie stosując ustaloną dawkę. Dostosowanie dawki dobowej, w tym jej zmniejszenie, należy rozważyć na podstawie stanu klinicznego. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej: zalecana dawka produktu Apra to 10 mg na dobę podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie powinno być rozpoczęte od dawki 2 mg (stosując roztwór doustny 1mg/ml) przez 2 dni, stopniowo zwiększanej do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. W przypadkach gdzie zwiększenie dawki jest właściwe, należy podawać kolejne dawki zwiększone jednorazowo o 5 mg, nie przekraczając maksymalnej dawki dobowej 30 mg (patrz punkt 5.1). Apra jest skuteczna w przedziale dawek 10 mg do 30 mg na dobę.
- CHPL leku Apra, tabletki, 10 mgDawkowanie
Nie wykazano większej skuteczności dla dawek dobowych większych niż 10 mg, chociaż poszczególni pacjenci mogą odnieść korzyść z zastosowania większych dawek. Apra nie jest zalecana do stosowania u pacjentów ze schizofrenią w wieku poniżej 15 lat, z powodu braku wystarczających danych dotyczących bezpieczeństwa stosowania i skuteczności (patrz punkty 4.8 i 5.1). Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej: zalecana dawka produktu Apra to 10 mg na dobę, podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie należy rozpocząć od dawki 2 mg (stosując roztwór doustny 1 mg/ml) przez 2 dni, stopniowo zwiększyć do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. Czas trwania leczenia powinien być możliwie najkrótszy konieczny do uzyskania kontroli objawów i nie może przekraczać 12 tygodni.
- CHPL leku Apra, tabletki, 10 mgDawkowanie
Nie wykazano większej skuteczności leczenia po zastosowaniu dawek dobowych większych niż 10 mg, a dawka dobowa wynosząca 30 mg jest związana ze znacząco większą częstością występowania istotnych działań niepożądanych, włączając zdarzenia związane z objawami pozapiramidowymi (ang. EPS), senność, zmęczenie oraz zwiększenie masy ciała (patrz punkt 4.8). Z tego powodu dawki większe niż 10 mg na dobę należy stosować tylko w wyjątkowych przypadkach oraz z zachowaniem ścisłej kontroli klinicznej (patrz punkty 4.4, 4.8 i 5.1). Młodsi pacjenci są narażeni na zwiększone ryzyko działań niepożądanych związanych z arypiprazolem. Z tego powodu produkt Apra nie jest zalecany do stosowania u pacjentów w wieku poniżej 13 lat (patrz punkty 4.8 i 5.1). Szczególne grupy pacjentów Zaburzenia czynności wątroby: Nie ma konieczności modyfikacji dawki u osób z zaburzeniami czynności wątroby o nasileniu lekkim do umiarkowanego.
- CHPL leku Apra, tabletki, 10 mgDawkowanie
Nie ma wystarczających danych do ustalenia dawkowania u pacjentów z ciężką niewydolnością wątroby. W tej grupie pacjentów należy ostrożnie ustalać dawkowanie. Niemniej jednak w grupie pacjentów z ciężkimi zaburzeniami czynności wątroby najwyższą dawkę dobową 30 mg należy stosować ze szczególną ostrożnością (patrz punkt 5.2). Zaburzenia czynności nerek: Nie ma konieczności modyfikacji dawki u pacjentów z zaburzeniami czynności nerek. Pacjenci w podeszłym wieku: Bezpieczeństwo i skuteczność stosowania produktu Apra w leczeniu schizofrenii i w epizodach manii w przebiegu zaburzenia afektywnego dwubiegunowego typu I nie zostały zbadane u pacjentów w wieku 65 lat i starszych. Jednak z powodu większej wrażliwości tych pacjentów, należy rozważyć zastosowanie mniejszej dawki początkowej, jeśli pozwalają na to okoliczności kliniczne (patrz punkt 4.4). Płeć: Nie ma konieczności modyfikacji dawek leku w zależności od płci (patrz punkt 5.2).
- CHPL leku Apra, tabletki, 10 mgDawkowanie
Palacze tytoniu: Biorąc pod uwagę metabolizm arypiprazolu nie ma konieczności modyfikacji dawek u palaczy (patrz punkt 4.5). Dostosowanie dawki z powodu interakcji: Dawkę arypiprazolu należy zmniejszyć w wypadku równoczesnego podawania środka o silnym działaniu hamującym w stosunku do cytochromu CYP3A4 lub CYP2D6. Po zakończeniu jednoczesnego stosowania inhibitora CYP3A4 lub CYP2D6 należy z kolei zwiększyć dawkę arypiprazolu (patrz punkt 4.5). Dawkę arypiprazolu należy zwiększyć w wypadku równoczesnego podawania leków silnie indukujących CYP3A4. Po odstawieniu leku indukującego CYP3A4, dawkę arypiprazolu należy ponownie zmniejszyć do zalecanej (patrz punkt 4.5). Sposób podawania Tabletki Apra są przeznaczone do stosowania doustnego. Tabletki ulegające rozpadowi w jamie ustnej Apra-swift mogą być stosowane alternatywnie do tabletek Apra u pacjentów, którzy mają trudności w połykaniu tabletek Apra (patrz także punkt 5.2).
- CHPL leku Apra, tabletki, 10 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Apra, tabletki, 10 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić dopiero po kilku dniach do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Prawdopodobieństwo podjęcia próby samobójczej: Występowanie zachowań samobójczych jest związane z chorobami psychicznymi oraz zaburzeniami nastroju i w niektórych przypadkach było zgłaszane wkrótce po rozpoczęciu lub zmianie leczenia przeciwpsychotycznego, w tym leczenia arypiprazolem ( patrz punkt 4.8). Leczenie przeciwpsychotyczne pacjentów wysokiego ryzyka powinno odbywać się pod ścisłym nadzorem. Zaburzenia sercowo-naczyniowe: Arypiprazol należy stosować ostrożnie u pacjentów z chorobą sercowo-naczyniową (zawał mięśnia sercowego lub choroba niedokrwienna w wywiadzie, niewydolność serca lub zaburzenia przewodzenia), chorobą naczyń mózgu, w stanach predysponujących do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie przeciwnadciśnieniowymi produktami leczniczymi) lub nadciśnienia tętniczego, w tym postępującego lub złośliwego.
- CHPL leku Apra, tabletki, 10 mgSpecjalne środki ostrozności
Po zastosowaniu leków przeciwpsychotycznych obserwowano przypadki żylnej choroby zakrzepowo-zatorowej (VTE - ang. venous thromboembolism). Ponieważ u pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE przed rozpoczęciem oraz w czasie leczenia arypiprazolem i wdrożyć odpowiednie środki zapobiegawcze. Wydłużenie odstępu QT: W badaniach klinicznych arypiprazolu częstość występowania wydłużenia odstępu QT była porównywalna z placebo. Arypiprazol należy ostrożnie stosować u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy: W badaniach klinicznych trwających nie dłużej niż rok zgłaszano w trakcie leczenia arypiprazolem niezbyt częste przypadki dyskinez wymagające interwencji.
- CHPL leku Apra, tabletki, 10 mgSpecjalne środki ostrozności
Jeśli objawy przedmiotowe lub podmiotowe późnych dyskinez wystąpią u pacjentów leczonych arypiprazolem, należy rozważyć zmniejszenie dawki lub odstawienie leku (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Inne objawy pozapiramidowe: W pediatrycznych badaniach klinicznych z zastosowaniem arypiprazolu obserwowano akatyzję oraz parkinsonizm. Jeśli u pacjenta przyjmującego arypiprazol wystąpią objawy przedmiotowe i podmiotowe innych zaburzeń pozapiramidowych, należy rozważyć zmniejszenie dawki oraz wprowadzenie ścisłej kontroli klinicznej. Złośliwy Zespół Neuroleptyczny (NMS): NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z podawaniem leków przeciwpsychotycznych. W badaniach klinicznych, odnotowano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku Apra, tabletki, 10 mgSpecjalne środki ostrozności
Klinicznymi objawami NMS są bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz objawy niestabilności autonomicznego układu nerwowego (nieregularne tętno i wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Jednakże, obserwowano także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę, niekoniecznie związane z NMS. Jeśli wystąpiły wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS, bądź niewyjaśnionego pochodzenia wysoka gorączka, bez innych objawów NMS, należy przerwać leczenie wszystkimi lekami przeciwpsychotycznymi, w tym także arypiprazolem. Drgawki: W badaniach klinicznych odnotowano niezbyt częste przypadki napadów drgawek w czasie leczenia arypiprazolem.
- CHPL leku Apra, tabletki, 10 mgSpecjalne środki ostrozności
Z tego powodu arypiprazol należy stosować z zachowaniem ostrożności u pacjentów, u których w przeszłości występowały napady drgawek lub, u których występują choroby wiążące się ze skłonnością do takich napadów (patrz pkt. 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencją: Zwiększona śmiertelność. W trzech badaniach kontrolowanych placebo (n= 938, średnia wieku: 82,4; zakres: 56-99 lat), u pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera, leczonych arypiprazolem, występowało zwiększone ryzyko zgonu w porównaniu z grupą otrzymującą placebo. Częstość zgonów u pacjentów leczonych arypiprazolem wynosiła 3,5% w porównaniu do 1,7% w grupie placebo. Chociaż przyczyny zgonów były zróżnicowane to większość zgonów wydawała się związana albo z chorobami układu krążenia (np. niewydolność serca, nagłe zgony), albo z chorobami infekcyjnymi (np. zapalenie płuc) (patrz punkt 4.8).
- CHPL leku Apra, tabletki, 10 mgSpecjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego: U pacjentów w tych samych badaniach odnotowano działania niepożądane dotyczące krążenia mózgowego (np. udar, przejściowe napady niedokrwienia) w tym o przebiegu zakończonym zgonem (średnia wieku: 84 lata; zakres 78-88 lat). Ogólnie w tych badaniach 1,3% wszystkich pacjentów leczonych arypiprazolem zgłaszało działania niepożądane dotyczące krążenia mózgowego, w porównaniu do 0,6% pacjentów otrzymujących placebo. Różnica ta nie była istotna statystycznie. W jednym z tych badań z zastosowaniem ustalonego dawkowania u pacjentów leczonych arypiprazolem występowała jednak istotna zależność odpowiedzi od dawki dla działań niepożądanych dotyczących krążenia mózgowego (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów z psychozą związaną z demencją. Upadki: Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków.
- CHPL leku Apra, tabletki, 10 mgSpecjalne środki ostrozności
Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2). Hiperglikemia i cukrzyca: U pacjentów leczonych nietypowymi środkami przeciwpsychotycznymi, w tym arypiprazolem, opisywano hiperglikemię, w niektórych przypadkach bardzo wysoką z kwasicą ketonową i śpiączką hiperosmotyczną lub zgonem. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. W badaniach klinicznych z arypiprazolem nie było istotnych różnic w częstości występowania działań niepożądanych związanych z hiperglikemią (w tym cukrzycy) lub nieprawidłowych wartości laboratoryjnych stężenia glukozy w porównaniu do placebo.
- CHPL leku Apra, tabletki, 10 mgSpecjalne środki ostrozności
Nie jest dostępna dokładna ocena ryzyka wystąpienia działań niepożądanych związanych z hiperglikemią, która pozwalałaby na dokonanie bezpośredniego porównania leczenia arypiprazolem i innymi atypowymi lekami przeciwpsychotycznymi. Pacjenci leczeni jakimkolwiek lekiem przeciwpsychotycznym, włącznie z arypiprazolem, powinni być obserwowani czy nie występują u nich objawy podmiotowe i przedmiotowe związane z hiperglikemią (takie jak nadmierne pragnienie, wielomocz, nadmierny apetyt i osłabienie), a pacjenci z cukrzycą lub czynnikami ryzyka wystąpienia cukrzycy powinni być regularnie monitorowani pod kątem pogorszenia kontroli glikemii (patrz punkt 4.8). Nadwrażliwość: Podczas przyjmowania arypiprazolu, mogą wystąpić reakcje nadwrażliwości charakteryzujące się objawami reakcji uczuleniowych (patrz punkt 4.8).
- CHPL leku Apra, tabletki, 10 mgSpecjalne środki ostrozności
Zwiększenie masy ciała: Obserwowane u pacjentów ze schizofrenią i zaburzeniem afektywnym dwubiegunowym zwiększenie masy ciała jest zwykle spowodowane współistniejącymi chorobami, stosowaniem leków przeciwpsychotycznych, o których wiadomo, że powodują zwiększenie masy ciała, niewłaściwym stylem życia i może prowadzić do ciężkich powikłań. Po wprowadzeniu produktu do obrotu obserwowano zwiększenie masy ciała u pacjentów otrzymujących arypiprazol. Jeśli występowało, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych arypiprazol nie powodował klinicznie istotnego zwiększenia masy ciała u dorosłych (patrz punkt 5.1). W badaniach klinicznych z udziałem młodzieży z epizodem manii w przebiegu zaburzenia afektywnego dwubiegunowego wykazano, że stosowanie arypiprazolu ma związek ze zwiększeniem masy ciała po 4 tygodniach leczenia.
- CHPL leku Apra, tabletki, 10 mgSpecjalne środki ostrozności
U młodzieży z zaburzeniem afektywnym dwubiegunowym należy kontrolować przyrost masy ciała. Jeśli przyrost masy ciała jest znaczący klinicznie, należy rozważyć zmniejszenie dawki (patrz punkt 4.8). Dysfagia: Ze stosowaniem leków przeciwpsychotycznych, w tym arypiprazolu, wiąże się spowolnienie motoryki przełyku i ryzyko aspiracji. Arypiprazol należy stosować ostrożnie u pacjentów z ryzykiem wystąpienia zachłystowego zapalenia płuc. Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów: Podczas przyjmowania arypiprazolu u pacjentów mogą występować zwiększone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy obejmują: zwiększenie popędów seksualnych, kompulsywną potrzebę wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania.
- CHPL leku Apra, tabletki, 10 mgSpecjalne środki ostrozności
Ważne jest, aby lekarze przepisujący lek pytali pacjentów lub opiekunów w szczególności o pojawienie się nowego lub zwiększonego popędu do hazardu, popędów seksualnych, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa lub kompulsywnego objadania się, lub innych popędów podczas leczenia arypiprazolem. Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu leku. Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Lekarz rozważy zmianę dawki lub odstawienie leku, jeśli u pacjenta wystąpią takie popędy podczas przyjmowania arypiprazolu (patrz punkt 4.8). Pacjenci ze współistniejącym ADHD: Pomimo wysokiej częstości współistnienia zaburzenia afektywnego dwubiegunowego typu I oraz zespołu ADHD, dane dotyczące bezpieczeństwa jednoczesnego stosowania arypiprazolu oraz stymulantów są bardzo ograniczone; dlatego też należy zachować wyjątkową ostrożność w razie podawania tych produktów jednocześnie.
- CHPL leku Apra, tabletki, 10 mgSpecjalne środki ostrozności
Specjalne ostrzeżenia dotyczące substancji pomocniczych Aspartam: Aspartam jest źródłem fenyloalaniny. Może być szkodliwy dla pacjentów z fenyloketonurią. Jest to rzadka choroba genetyczna, w której fenyloalanina gromadzi się w organizmie, z powodu jej nieprawidłowego wydalania. Laktoza: Tabletki Apra zawierają laktozę. Lek nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy- galaktozy. Sód: Lek zawiera mniej niż 1 mmol (23 mg) sodu w każdej tabletce, to znaczy lek uznaje się za „wolny od sodu”. Alkohol benzylowy: Alkohol benzylowy może powodować reakcje alergiczne. Kobiety w ciąży lub karmiące piersią powinny skontaktować się z lekarzem przed zastosowaniem leku, gdyż duża ilość alkoholu benzylowego może gromadzić się w ich organizmie i powodować działania niepożądane (tzw. kwasicę metaboliczną).
- CHPL leku Apra, tabletki, 10 mgSpecjalne środki ostrozności
Pacjenci z chorobami wątroby lub nerek powinni skontaktować się z lekarzem przed zastosowaniem leku, gdyż duża ilość alkoholu benzylowego może gromadzić się w ich organizmie i powodować działania niepożądane (tzw. kwasicę metaboliczną).
- CHPL leku Apra, tabletki, 10 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na antagonistyczne działanie na receptor adrenergiczny α1, arypiprazol może nasilać działanie niektórych leków przeciwnadciśnieniowych. Ze względu na pierwotne działanie arypiprazolu na OUN, należy zachować ostrożność, jeśli arypiprazol jest przyjmowany razem z alkoholem lub z innymi produktami leczniczymi działającymi na OUN, wywołującymi zbliżone działania niepożądane, takie jak sedacja (patrz punkt 4.8). Należy zachować ostrożność podając arypiprazol równocześnie z produktami leczniczymi, o których wiadomo, że powodują wydłużenie odstępu QT lub zaburzenia elektrolitowe. Możliwy wpływ innych produktów leczniczych na arypiprazol Antagonista receptora H2 - famotydyna, lek hamujący uwalnianie kwasu żołądkowego, zmniejsza szybkość wchłaniania arypiprazolu, jednak działanie to nie ma znaczenia klinicznego.
- CHPL leku Apra, tabletki, 10 mgInterakcje
Arypiprazol jest metabolizowany na wiele sposobów, w tym także przez enzymy, takie jak CYP2D6 i CYP3A4. Nie jest jednak metabolizowany przez enzymy z grupy CYP1A, a więc nie jest konieczne stosowanie specjalnych dawek u palaczy tytoniu. Chinidyna i inne silne inhibitory CYP2D6: Wyniki badań klinicznych z udziałem zdrowych osób wykazały, że silny inhibitor enzymu CYP2D6 (chinidyna) zwiększa AUC arypiprazolu o 107%, podczas gdy Cmax nie zmienia się. AUC i Cmax dehydroarypiprazolu, aktywnego metabolitu, były zmniejszone odpowiednio o 32% i 47%. W przypadku jednoczesnego podawania chinidyny i arypiprazolu, należy zmniejszyć dawkę arypiprazolu o około połowę w stosunku do przepisanej dawki. Inne silne inhibitory grupy enzymów CYP2D6, takie jak fluoksetyna i paroksetyna, mogą powodować podobne skutki i w takich sytuacjach należy podobnie zredukować dawkę leku.
- CHPL leku Apra, tabletki, 10 mgInterakcje
Ketokonazol i inne silne inhibitory CYP3A4: Wyniki badań klinicznych z udziałem zdrowych osób wskazują, że silny inhibitor CYP3A4 (ketokonazol) zwiększa AUC i Cmax arypiprazolu odpowiednio o 63% i 37%, a AUC i Cmax dehydroarypiprazolu odpowiednio o 77% i 43%. W grupie osób o obniżonej aktywności CYP2D6, równoczesne stosowanie silnych inhibitorów CYP3A4 może powodować zwiększenie stężenia arypiprazolu w osoczu, w porównaniu do osób o podwyższonej aktywności CYP2D6. W przypadku jednoczesnego stosowania ketokonazolu albo innych silnych inhibitorów CYP3A4 z arypiprazolem, zakładane korzyści powinny przeważyć ryzyko dla pacjenta. W przypadku jednoczesnego stosowania ketokonazolu z arypiprazolem, przepisaną dawkę arypiprazolu należy zmniejszyć o około połowę. Inne leki silnie hamujące aktywność CYP3A4, takie jak itrakonazol oraz inhibitory proteazy HIV, mogą powodować podobne skutki jak ketokonazol i w takich przypadkach należy podobnie zredukować dawkowanie (patrz punkt 4.2).
- CHPL leku Apra, tabletki, 10 mgInterakcje
Po odstawieniu inhibitora CYP2D6 lub CYP3A4, dawkę arypiprazolu należy zwiększyć do tej, jaką stosowano przed rozpoczęciem terapii skojarzonej. W czasie równoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazemu) lub CYP2D6 (np. escytalopramu) z arypiprazolem, można spodziewać się niewielkiego zwiększenia stężenia arypiprazolu w osoczu. Karbamazepina i inne leki indukujące CYP3A4: Po jednoczesnym podaniu karbamazepiny, silnego induktora CYP3A4 w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnia geometryczna Cmax i AUC arypiprazolu zmniejszyły się odpowiednio o 68% i 73%, w stosunku do wartości tych parametrów podczas stosowania arypiprazolu (30 mg) w monoterapii. Podobnie, w przypadku dehydroarypiprazolu średnia geometryczna Cmax i AUC po jednoczesnym podaniu karbamazepiny zmniejszają się odpowiednio o 69% i 71%, w stosunku do ich wartości podczas leczenia samym arypiprazolem.
- CHPL leku Apra, tabletki, 10 mgInterakcje
Dlatego dawkę arypiprazolu należy podwoić, gdy jednocześnie podaje się go z karbamazepiną. Można się spodziewać, że jednoczesne podawanie arypiprazolu i innych silnych induktorów CYP3A4 (takie jak ryfampicyna, ryfabutyna, fenytoina, fenobarbital, prymidon, efawirenz, newirapina i ziele dziurawca zwyczajnego) może działać podobnie i dlatego należy podobnie zwiększyć dawkę. Po zakończeniu podawania silnego induktora CYP3A4, należy zmniejszyć dawkę arypiprazolu do zalecanej. Walproinian i lit: Skojarzone stosowanie walproinianów lub soli litu z arypiprazolem nie powodowało żadnych istotnych klinicznie zmian stężenia arypiprazolu i w związku z tym nie jest konieczne dostosowanie dawki podczas podawania walproinianu lub litu w skojarzeniu z arypiprazolem. Zespół serotoninowy: obserwowano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol, a możliwe objawy przedmiotowe oraz podmiotowe dla tego stanu mogą wystąpić szczególnie w razie jednoczesnego stosowania innych leków serotoninergicznych, takich jak SSRI/SNRI (selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny) lub leków, o których wiadomo, że zwiększają stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Apra, tabletki, 10 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie przeprowadzono dotychczas odpowiednio kontrolowanych badań dotyczących działania arypiprazolu u kobiet w ciąży. Notowano występowanie wad wrodzonych, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. Na podstawie wyników badań przeprowadzonych na zwierzętach nie można wykluczyć potencjalnego toksycznego wpływu leku na płód (patrz punkt 5.3). Pacjentki należy poinformować o konieczności powiadomienia swojego lekarza, jeśli w trakcie leczenia arypiprazolem zajdą w ciąże lub planują zajście w ciążę. Ze względu na niewystarczające dane dotyczące bezpieczeństwa u ludzi oraz budzące wątpliwości wyniki badań na zwierzętach, ten lek nie może być stosowany w okresie ciąży, chyba że spodziewane korzyści wyraźnie przewyższają potencjalne ryzyko dla płodu. Karmienie piersi? Arypiprazol/metabolity przenikają do mleka ludzkiego.
- CHPL leku Apra, tabletki, 10 mgWpływ na płodność, ciążę i laktację
Należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać przyjmowanie arypiprazolu, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem na reprodukcję.
- CHPL leku Apra, tabletki, 10 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe, senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku Apra, tabletki, 10 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa: Najczęściej notowanymi działaniami niepożądanymi w kontrolowanych placebo badaniach były akatyzja i nudności, każde występujące częściej niż u 3% pacjentów leczonych arypiprazolem podawanym doustnie. Tabelaryczne zestawienie działań niepożądanych: Częstość występowania działań niepożądanych związanych z leczeniem arypiprazolem podano w poniższej tabeli. Dane w tabeli oparto na działaniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układ/narząd i częstości: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych). W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
- CHPL leku Apra, tabletki, 10 mgDziałania niepożądane
Nie można określić częstości działań niepożądanych zgłaszanych po wprowadzeniu do obrotu, ponieważ pochodzą one ze spontanicznych zgłoszeń. Z tego względu częstość takich działań niepożądanych określono jako „nieznana”.
- CHPL leku Apra, tabletki, 10 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedmiotowe i podmiotowe W badaniach klinicznych i po wprowadzeniu produktu do obrotu zgłaszano przypadkowe bądź zamierzone przedawkowanie samego arypiprazolu przez dorosłych pacjentów o szacowanej dawce do 1260 mg niezakończone zgonem. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: letarg, wzrost ciśnienia tętniczego krwi, senność, przyspieszona czynność serca (tachykardia), nudności, wymioty i biegunka. Ponadto zgłaszano przypadkowe przedawkowanie samego arypiprazolu (do 195 mg) u dzieci, bez zgonów. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: senność, przejściowa utrata świadomości i objawy pozapiramidowe. Postępowanie po przedawkowaniu W wypadku przedawkowania leku stosuje się leczenie podtrzymujące, polegające na utrzymaniu drożności dróg oddechowych, dotlenianiu i wentylacji oraz leczeniu objawowym.
- CHPL leku Apra, tabletki, 10 mgPrzedawkowanie
Należy wziąć pod uwagę możliwość działania wielu produktów leczniczych. Z tego względu należy niezwłocznie rozpocząć monitorowanie czynności układu krążenia, obejmujące stałe monitorowanie zapisu elektrokardiograficznego, w celu wykrycia możliwych zaburzeń rytmu serca. Wiedząc lub podejrzewając przedawkowanie arypiprazolu należy objąć ścisłą kontrolą pacjenta i obserwować go do czasu poprawy jego stanu. Aktywny węgiel (50 g), podany w godzinę po zażyciu arypiprazolu, obniża Cmax arypiprazolu o około 41%, a AUC o około 51%, co wskazuje na jego skuteczność w leczeniu przedawkowania. Hemodializa: Chociaż brak informacji dotyczących wpływu hemodializ w leczeniu przedawkowania arypiprazolu, to jest jednak małe prawdopodobieństwo, że hemodializy będą użyteczne w takich przypadkach, ze względu na znaczny stopień wiązania arypiprazolu z białkami osocza.
- CHPL leku Apra, tabletki, 10 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12 Mechanizm działania Uważa się, że skuteczność arypiprazolu w leczeniu schizofrenii i zaburzenia afektywnego dwubiegunowego typu I jest związana ze skojarzonym działaniem częściowo agonistycznym w stosunku do receptora dopaminowego D2 i serotoninowego 5-HT1a oraz antagonistycznym w stosunku do receptora serotoninowego 5-HT2a. Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D2 i D3, serotoninowych 5-HT1a i 5-HT2a oraz umiarkowane powinowactwo do receptorów dopaminowych D4, serotoninowych 5-HT2c i 5-HT7, a także adrenergicznych alfa-1 i histaminowych H1.
- CHPL leku Apra, tabletki, 10 mgWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Arypiprazol w dawkach od 0,5 do 30 mg, podawany raz na dobę przez 2 tygodnie osobom zdrowym powoduje zależne od dawki zmniejszenie wiązania rakloprydu znakowanego ¹¹C, ligandu receptora D2/D3, w jądrze ogoniastym i skorupie, co można wykryć za pomocą pozytonowej tomografii emisyjnej. Skuteczność kliniczna i bezpieczeństwo stosowania Dorośli Schizofrenia Wyniki trzech krótkoterminowych badań (4 do 6 tygodni) z kontrolą placebo z udziałem 1228 dorosłych chorych na schizofrenię, u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku Apra, tabletki, 10 mgWłaściwości farmakodynamiczne
Arypiprazol jest skuteczna w podtrzymywaniu poprawy klinicznej podczas kontynuacji leczenia u tych dorosłych pacjentów, u których obserwowano wstępną dobrą reakcję na lek. W badaniu z grupą kontrolną przyjmującą haloperydol, odsetek pacjentów, u których udało się utrzymać dobrą reakcję na produkt leczniczy, w ciągu 52 tygodni był podobny w obu grupach (arypiprazol 77% i haloperydol 73%). Badanie ukończyła istotnie większa grupa pacjentów leczonych arypiprazolem (43%) niż haloperydolem (30%). Wyniki uzyskane w skalach ocen stosowanych jako wtórne mierniki skuteczności, w tym w skali PANSS i w skali oceny depresji Montgomery-Asberg, wskazują na istotną przewagę nad haloperydolem. W trwającym 26 tygodni kontrolowanym badaniu z użyciem placebo, z udziałem pacjentów dorosłych z ustabilizowaną przewlekłą schizofrenią, stwierdzono w wyniku leczenia arypiprazolem większe zmniejszenie częstości nawrotów (34% w grupie leczonych arypiprazolem i 57% w grupie otrzymującej placebo). 15.
- CHPL leku Apra, tabletki, 10 mgWłaściwości farmakodynamiczne
Przyrost masy ciała Wyniki badań klinicznych wskazują, że arypiprazol nie powoduje klinicznie istotnego przyrostu masy ciała. W trwającym 26 tygodni badaniu z grupą kontrolną leczonych olanzapiną i wykorzystaniem podwójnie ślepej próby, przeprowadzonym w wielu krajach, udział wzięło 314 chorych dorosłych na schizofrenię. Pierwotnym celem była ocena przyrostu masy ciała. W istotnie mniejszej grupie pacjentów leczonych arypiprazolem w porównaniu z otrzymującymi olanzapinę, stwierdzono przyrost masy ciała o ≥7% wobec pomiaru wyjściowego (tzn. przyrost masy ciała o co najmniej 5,6 kg przy średniej początkowej masie wynoszącej ok. 80,5 kg); w grupie leczonych arypiprazolem (n = 18 lub 13% pacjentów, których wyniki poddawano analizie), w porównaniu grupą otrzymujących olanzapinę (n = 45 lub 33% pacjentów, których wyniki poddawano analizie).
- CHPL leku Apra, tabletki, 10 mgWłaściwości farmakodynamiczne
Stężenia lipidów W zbiorczej analizie wyników stężeń lipidów pochodzących z kontrolowanych placebo badań klinicznych u dorosłych, arypiprazol nie powodował klinicznie istotnych zmian stężeń cholesterolu całkowitego, triglicerydów, cholesterolu HDL i cholesterolu LDL. Prolaktyna Stężenia prolaktyny oceniono podczas wszystkich badań z zastosowaniem wszystkich dawek arypiprazolu (n = 28 242). Częstość występowania hiperprolaktynemii lub zwiększenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem (0,3%) była podobna do częstości występowania hiperprolaktynemii w grupie otrzymującej placebo (0,2%). U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 42 dni, a mediana czasu trwania wynosiła 34 dni. Częstość występowania hiperprolaktynemii lub zmniejszenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem wynosiła 0,4% w porównaniu do 0,02% w grupie otrzymującej placebo.
- CHPL leku Apra, tabletki, 10 mgWłaściwości farmakodynamiczne
U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 30 dni, a mediana czasu trwania wynosiła 194 dni. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I W dwóch 3-tygodniowych badaniach, kontrolowanych placebo, z zastosowaniem zmiennej dawki, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol w monoterapii był znacząco bardziej skuteczny niż placebo w zmniejszaniu objawów maniakalnych w ciągu 3 tygodni. Badania te obejmowały pacjentów z objawami lub bez objawów psychotycznych oraz pacjentów z szybką zmianą fazy lub bez szybkiej zmiany fazy (przebieg typu rapid-cycling). W jednym 3-tygodniowym badaniu, kontrolowanym placebo, z zastosowaniem stałej dawki w monoterapii, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol nie wykazał większej skuteczności niż placebo.
- CHPL leku Apra, tabletki, 10 mgWłaściwości farmakodynamiczne
W dwóch 12-tygodniowych badaniach, kontrolowanych placebo oraz innymi substancjami czynnymi u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, arypiprazol był skuteczniejszy niż placebo w 3. tygodniu badania, a wynik leczenia podtrzymującego był w 12. tygodniu badania porównywalny z wynikiem dla litu lub haloperydolu. W 12. tygodniu arypiprazol powodował także remisję objawów maniakalnych u porównywalnej liczby pacjentów co lit lub haloperydol. W 6-tygodniowym, kontrolowanym placebo, badaniu u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, którzy częściowo nie odpowiadali na monoterapię litem lub walproinianem przez 2 tygodnie przy terapeutycznych stężeniach w surowicy, zastosowanie arypiprazolu jako dodatkowego leku w większym stopniu zwiększyło skuteczność zapobiegania objawom maniakalnym niż stosowanie litu lub walproinianu w monoterapii.
- CHPL leku Apra, tabletki, 10 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Arypiprazol jest dobrze wchłaniany, maksymalne stężenie w osoczu osiąga w ciągu 3-5 godzin po podaniu. Arypiprazol w minimalnym stopniu ulega metabolizmowi przedukładowemu. Bezwzględna dostępność po doustnym podaniu jednej tabletki wynosi 87%. Spożywanie posiłków o dużej zawartości tłuszczu nie wpływa na farmakokinetykę arypiprazolu. Dystrybucja Arypiprazol jest rozmieszczany w całym organizmie, pozorna objętość dystrybucji wynosi 4,9 l/kg, co wskazuje na znaczną dystrybucję pozanaczyniową. W stężeniach terapeutycznych arypiprazol i dehydroarypiprazol wiążą się w ponad 99% z białkami surowicy, głównie z albuminami. Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie. Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji.
- CHPL leku Apra, tabletki, 10 mgWłaściwości farmakokinetyczne
Jak wynika z badań in vitro, enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N-dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. W stanie stacjonarnym aktywny metabolit, dehydroarypiprazol, stanowi około 40% AUC arypiprazolu w osoczu. Eliminacja Średni okres półtrwania arypiprazolu w fazie eliminacji wynosi około 75 godzin u osób o podwyższonej aktywności CYP2D6 i około 146 godzin u osób o obniżonej aktywności CYP2D6. Całkowity klirens arypiprazolu wynosi 0,7 ml/min/kg mc. i jest to głównie klirens wątrobowy. Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [¹⁴C], stwierdza się odpowiednio 27% i 60% podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1% niezmienionego arypiprazolu zostaje wydalone z moczem, a około 18% z kałem.
- CHPL leku Apra, tabletki, 10 mgWłaściwości farmakokinetyczne
Dzieci i młodzież Farmakokinetyka arypiprazolu i dehydroarypiprazolu u dzieci w wieku 10 do 17 lat była podobna do farmakokinetyki u dorosłych, po uwzględnieniu różnic w masie ciała. Farmakokinetyka w szczególnych grupach pacjentów Pacjenci w podeszłym wieku Nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi, nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Nie stwierdzono, aby farmakokinetyka arypiprazolu różniła się u zdrowych kobiet i zdrowych mężczyzn. Nie stwierdzono także żadnego mierzalnego wpływu płci na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Palenie tytoniu Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie wpływów na farmakokinetykę arypiprazolu, zależnych od palenia tytoniu.
- CHPL leku Apra, tabletki, 10 mgWłaściwości farmakokinetyczne
Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy. Zaburzenia czynności nerek Stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u osób z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badania obejmujące podanie pojedynczej dawki leku, przeprowadzone u osób z różnego stopnia marskością wątroby (klasy Child-Pugh A, B i C) nie wykazały, by zaburzenia czynności wątroby wpływały istotnie na farmakokinetykę arypiprazolu i dehydroarypiprazolu, jednak w badaniu wzięło udział tylko 3 chorych z marskością wątroby typu C, co jest liczbą niewystarczającą do wyciągnięcia wniosków dotyczących zdolności metabolicznych tych pacjentów.
- CHPL leku Apra, tabletki, 10 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego i toksycznego wpływu na reprodukcję i rozwój, nie ujawniają występowania szczególnego zagrożenia dla człowieka. Istotne działanie toksyczne stwierdzano jedynie, gdy dawki lub stopień narażenia wyraźnie przekraczały maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza (gromadzenie barwnika lipofuscyny i (lub) obumieranie komórek miąższowych) stwierdzany u szczurów po 104 tygodniach podawania arypiprazolu w dawce od 20 do 60 mg/kg mc.
- CHPL leku Apra, tabletki, 10 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 3 do 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki) i zwiększenie częstości występowania raków nadnerczy, a także skojarzonej częstości występowania gruczolaków lub raków nadnerczy u samic szczurów otrzymujących lek w dawce 60 mg/kg mc. na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki). Największa ekspozycja nie powodująca powstawania nowotworów u samic szczurów odpowiadała 7 krotnej ekspozycji u ludzi występującej po stosowaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych sprzężonych związków hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 do 125 mg/kg mc.
- CHPL leku Apra, tabletki, 10 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym była od 1 do 3 razy większa niż wartość występująca u ludzi po podaniu maksymalnej zalecanej dawki klinicznej lub 16 do 81 razy większa niż po podaniu maksymalnej dawki zalecanej w przeliczeniu na mg/m2 pc). Jednak stężenie sprzężonych związków siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania najwyższej proponowanej dawki 30 mg na dobę, nie przekraczało 6% stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie mniejsze (6%) niż granica rozpuszczalności określona in vitro. W badaniach toksykologicznych z użyciem dawki wielokrotnej u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt, nie ma też dowodów neurotoksyczności i niepożądanego wpływu na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych.
- CHPL leku Apra, tabletki, 10 mgPrzedkliniczne dane o bezpieczeństwie
Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowane toksyczne wpływy na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po zastosowaniu dawek maksymalnych zalecanych u ludzi). Toksyczny wpływ na ciężarne samice obserwowano po podawaniu dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Apra, tabletki, 10 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Apra, tabletki 5 mg: Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Aspartam (E 951) Magnezu stearynian Indygotyna, lak (E 132) Aromat waniliowy (maltodekstryna, guma arabska E 414, glikol propylenowy E 1520, alkohol benzylowy E 1519) Apra, tabletki 10 i 30 mg: Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Aspartam (E951) Magnezu stearynian Żelaza tlenek czerwony (E 172) Aromat waniliowy (maltodekstryna, guma arabska E 414, glikol propylenowy E 1520, alkohol benzylowy E 1519) Apra, tabletki 15 mg: Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Aspartam (E 951) Magnezu stearynian Żelaza tlenek żółty (E 172) Aromat waniliowy (maltodekstryna, guma arabska E 414, glikol propylenowy E 1520, alkohol benzylowy E 1519) 6.2 Niezgodności farmaceutyczne Nie dotyczy.
- CHPL leku Apra, tabletki, 10 mgDane farmaceutyczne
6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Brak szczególnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Apra, 5mg i Apra, 30mg: Pudełka tekturowe zawierające 7, 14 i 28 tabletek w blistrach OPA/Aluminium/PVC/Aluminium. Apra, 10 mg i Apra, 15mg: Pudełka tekturowe zawierające 7, 14, 28, 56 i 84 tabletki w blistrach OPA/Aluminium/PVC/Aluminium. 6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć w sposób zgodny z lokalnymi przepisami.
- CHPL leku Apra, tabletki, 15 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Apra, 5 mg, tabletki Apra, 10 mg, tabletki Apra, 15 mg, tabletki Apra, 30 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Apra, 5 mg, tabletki Każda tabletka zawiera 5 mg arypiprazolu. Substancje pomocnicze o znanym działaniu: 0,5 mg aspartamu w tabletce, 47,53 mg laktozy jednowodnej w tabletce, 0,0018 mg alkoholu benzylowego w tabletce. Apra, 10 mg, tabletki Każda tabletka zawiera 10 mg arypiprazolu. Substancje pomocnicze o znanym działaniu: 1 mg aspartamu w tabletce, 95,05 mg laktozy jednowodnej w tabletce, 0,0036 mg alkoholu benzylowego w tabletce. Apra, 15 mg, tabletki Każda tabletka 15 mg arypiprazolu. Substancje pomocnicze o znanym działaniu: 1,5 mg aspartamu w tabletce, 142,58 mg laktozy jednowodnej w tabletce, 0,0054 mg alkoholu benzylowego w tabletce. Apra, 30 mg, tabletki Każda tabletka zawiera 30 mg arypiprazolu.
- CHPL leku Apra, tabletki, 15 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
Substancje pomocnicze o znanym działaniu: 3 mg aspartamu w tabletce, 285,15 mg laktozy jednowodnej w tabletce, 0,0108 mg alkoholu benzylowego w tabletce. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Apra, 5 mg, tabletki Prostokątna, obustronnie wypukła i niebieska, o wymiarach 7,6 mm x 4,3 mm, gładka po obu stronach. Apra, 10 mg, tabletki Prostokątna, obustronnie wypukła i różowa, o wymiarach 9,3 mm x 5,2 mm, gładka po obu stronach. Apra, 15 mg, tabletki Okrągła, płaska i żółta, o średnicy 9,0 mm, gładka po obu stronach. Apra, 30 mg, tabletki Okrągła, płaska i różowa, o średnicy 10,0 mm, gładka po obu stronach.
- CHPL leku Apra, tabletki, 15 mgWskazania do stosowania
4.1 Wskazania do stosowania Apra jest wskazana w leczeniu schizofrenii u dorosłych i u młodzieży w wieku 15 lat i starszej. Apra jest wskazana w leczeniu epizodów maniakalnych o nasileniu umiarkowanym do ciężkiego w przebiegu zaburzenia afektywnego dwubiegunowego typu I oraz w zapobieganiu nowym epizodom maniakalnym u dorosłych, u których występują głównie epizody maniakalne i którzy odpowiadają na leczenie arypiprazolem (patrz punkt 5.1). Apra jest wskazana w leczeniu epizodów maniakalnych o nasileniu umiarkowanym do ciężkiego w przebiegu zaburzenia afektywnego dwubiegunowego typu I u młodzieży w wieku 13 lat i starszej, w leczeniu trwającym do 12 tygodni (patrz punkt 5.1).
- CHPL leku Apra, tabletki, 15 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Schizofrenia: zalecana dawka początkowa produktu Apra to 10 lub 15 mg na dobę z dawką podtrzymującą 15 mg na dobę. Lek należy podawać raz na dobę o stałej porze, niezależnie od posiłków. Produkt leczniczy Apra jest skuteczny w dawkach od 10 do 30 mg na dobę. Chociaż nie potwierdzono większej skuteczności dawek większych niż dawka dobowa 15 mg, jednak u poszczególnych pacjentów większa dawka może być korzystna. Maksymalna dawka dobowa nie może być większa niż 30 mg. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I: zalecana dawka początkowa to 15 mg arypiprazolu podawanego w schemacie raz na dobę, niezależnie od posiłków jako monoterapia lub w leczeniu skojarzonym (patrz punkt 5.1). U niektórych pacjentów może być korzystne zastosowanie większej dawki. Maksymalna dawka dobowa nie może być większa niż 30 mg.
- CHPL leku Apra, tabletki, 15 mgDawkowanie
Zapobieganie nawrotom epizodów maniakalnych w zaburzeniu afektywnym dwubiegunowym typu I: w celu zapobiegania nawrotom epizodów maniakalnych u pacjentów, którzy stosują arypiprazol w monoterapii lub w terapii skojarzonej, należy kontynuować leczenie stosując ustaloną dawkę. Dostosowanie dawki dobowej, w tym jej zmniejszenie, należy rozważyć na podstawie stanu klinicznego. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej: zalecana dawka produktu Apra to 10 mg na dobę podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie powinno być rozpoczęte od dawki 2 mg (stosując roztwór doustny 1mg/ml) przez 2 dni, stopniowo zwiększanej do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. W przypadkach gdzie zwiększenie dawki jest właściwe, należy podawać kolejne dawki zwiększone jednorazowo o 5 mg, nie przekraczając maksymalnej dawki dobowej 30 mg (patrz punkt 5.1). Apra jest skuteczna w przedziale dawek 10 mg do 30 mg na dobę.
- CHPL leku Apra, tabletki, 15 mgDawkowanie
Nie wykazano większej skuteczności dla dawek dobowych większych niż 10 mg, chociaż poszczególni pacjenci mogą odnieść korzyść z zastosowania większych dawek. Apra nie jest zalecana do stosowania u pacjentów ze schizofrenią w wieku poniżej 15 lat, z powodu braku wystarczających danych dotyczących bezpieczeństwa stosowania i skuteczności (patrz punkty 4.8 i 5.1). Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej: zalecana dawka produktu Apra to 10 mg na dobę, podawana w schemacie raz na dobę, niezależnie od posiłków. Leczenie należy rozpocząć od dawki 2 mg (stosując roztwór doustny 1 mg/ml) przez 2 dni, stopniowo zwiększyć do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. Czas trwania leczenia powinien być możliwie najkrótszy konieczny do uzyskania kontroli objawów i nie może przekraczać 12 tygodni.
- CHPL leku Apra, tabletki, 15 mgDawkowanie
Nie wykazano większej skuteczności leczenia po zastosowaniu dawek dobowych większych niż 10 mg, a dawka dobowa wynosząca 30 mg jest związana ze znacząco większą częstością występowania istotnych działań niepożądanych, włączając zdarzenia związane z objawami pozapiramidowymi (ang. EPS), senność, zmęczenie oraz zwiększenie masy ciała (patrz punkt 4.8). Z tego powodu dawki większe niż 10 mg na dobę należy stosować tylko w wyjątkowych przypadkach oraz z zachowaniem ścisłej kontroli klinicznej (patrz punkty 4.4, 4.8 i 5.1). Młodsi pacjenci są narażeni na zwiększone ryzyko działań niepożądanych związanych z arypiprazolem. Z tego powodu produkt Apra nie jest zalecany do stosowania u pacjentów w wieku poniżej 13 lat (patrz punkty 4.8 i 5.1). Szczególne grupy pacjentów Zaburzenia czynności wątroby: Nie ma konieczności modyfikacji dawki u osób z zaburzeniami czynności wątroby o nasileniu lekkim do umiarkowanego.
- CHPL leku Apra, tabletki, 15 mgDawkowanie
Nie ma wystarczających danych do ustalenia dawkowania u pacjentów z ciężką niewydolnością wątroby. W tej grupie pacjentów należy ostrożnie ustalać dawkowanie. Niemniej jednak w grupie pacjentów z ciężkimi zaburzeniami czynności wątroby najwyższą dawkę dobową 30 mg należy stosować ze szczególną ostrożnością (patrz punkt 5.2). Zaburzenia czynności nerek: Nie ma konieczności modyfikacji dawki u pacjentów z zaburzeniami czynności nerek. Pacjenci w podeszłym wieku: Bezpieczeństwo i skuteczność stosowania produktu Apra w leczeniu schizofrenii i w epizodach manii w przebiegu zaburzenia afektywnego dwubiegunowego typu I nie zostały zbadane u pacjentów w wieku 65 lat i starszych. Jednak z powodu większej wrażliwości tych pacjentów, należy rozważyć zastosowanie mniejszej dawki początkowej, jeśli pozwalają na to okoliczności kliniczne (patrz punkt 4.4). Płeć: Nie ma konieczności modyfikacji dawek leku w zależności od płci (patrz punkt 5.2).
- CHPL leku Apra, tabletki, 15 mgDawkowanie
Palacze tytoniu: Biorąc pod uwagę metabolizm arypiprazolu nie ma konieczności modyfikacji dawek u palaczy (patrz punkt 4.5). Dostosowanie dawki z powodu interakcji: Dawkę arypiprazolu należy zmniejszyć w wypadku równoczesnego podawania środka o silnym działaniu hamującym w stosunku do cytochromu CYP3A4 lub CYP2D6. Po zakończeniu jednoczesnego stosowania inhibitora CYP3A4 lub CYP2D6 należy z kolei zwiększyć dawkę arypiprazolu (patrz punkt 4.5). Dawkę arypiprazolu należy zwiększyć w wypadku równoczesnego podawania leków silnie indukujących CYP3A4. Po odstawieniu leku indukującego CYP3A4, dawkę arypiprazolu należy ponownie zmniejszyć do zalecanej (patrz punkt 4.5). Sposób podawania Tabletki Apra są przeznaczone do stosowania doustnego. Tabletki ulegające rozpadowi w jamie ustnej Apra-swift mogą być stosowane alternatywnie do tabletek Apra u pacjentów, którzy mają trudności w połykaniu tabletek Apra (patrz także punkt 5.2).
- CHPL leku Apra, tabletki, 15 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Apra, tabletki, 15 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić dopiero po kilku dniach do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Prawdopodobieństwo podjęcia próby samobójczej: Występowanie zachowań samobójczych jest związane z chorobami psychicznymi oraz zaburzeniami nastroju i w niektórych przypadkach było zgłaszane wkrótce po rozpoczęciu lub zmianie leczenia przeciwpsychotycznego, w tym leczenia arypiprazolem ( patrz punkt 4.8). Leczenie przeciwpsychotyczne pacjentów wysokiego ryzyka powinno odbywać się pod ścisłym nadzorem. Zaburzenia sercowo-naczyniowe: Arypiprazol należy stosować ostrożnie u pacjentów z chorobą sercowo-naczyniową (zawał mięśnia sercowego lub choroba niedokrwienna w wywiadzie, niewydolność serca lub zaburzenia przewodzenia), chorobą naczyń mózgu, w stanach predysponujących do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie przeciwnadciśnieniowymi produktami leczniczymi) lub nadciśnienia tętniczego, w tym postępującego lub złośliwego.
- CHPL leku Apra, tabletki, 15 mgSpecjalne środki ostrozności
Po zastosowaniu leków przeciwpsychotycznych obserwowano przypadki żylnej choroby zakrzepowo-zatorowej (VTE - ang. venous thromboembolism). Ponieważ u pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE przed rozpoczęciem oraz w czasie leczenia arypiprazolem i wdrożyć odpowiednie środki zapobiegawcze. Wydłużenie odstępu QT: W badaniach klinicznych arypiprazolu częstość występowania wydłużenia odstępu QT była porównywalna z placebo. Arypiprazol należy ostrożnie stosować u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy: W badaniach klinicznych trwających nie dłużej niż rok zgłaszano w trakcie leczenia arypiprazolem niezbyt częste przypadki dyskinez wymagające interwencji.
- CHPL leku Apra, tabletki, 15 mgSpecjalne środki ostrozności
Jeśli objawy przedmiotowe lub podmiotowe późnych dyskinez wystąpią u pacjentów leczonych arypiprazolem, należy rozważyć zmniejszenie dawki lub odstawienie leku (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Inne objawy pozapiramidowe: W pediatrycznych badaniach klinicznych z zastosowaniem arypiprazolu obserwowano akatyzję oraz parkinsonizm. Jeśli u pacjenta przyjmującego arypiprazol wystąpią objawy przedmiotowe i podmiotowe innych zaburzeń pozapiramidowych, należy rozważyć zmniejszenie dawki oraz wprowadzenie ścisłej kontroli klinicznej. Złośliwy Zespół Neuroleptyczny (NMS): NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z podawaniem leków przeciwpsychotycznych. W badaniach klinicznych, odnotowano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku Apra, tabletki, 15 mgSpecjalne środki ostrozności
Klinicznymi objawami NMS są bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz objawy niestabilności autonomicznego układu nerwowego (nieregularne tętno i wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Jednakże, obserwowano także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę, niekoniecznie związane z NMS. Jeśli wystąpiły wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS, bądź niewyjaśnionego pochodzenia wysoka gorączka, bez innych objawów NMS, należy przerwać leczenie wszystkimi lekami przeciwpsychotycznymi, w tym także arypiprazolem. Drgawki: W badaniach klinicznych odnotowano niezbyt częste przypadki napadów drgawek w czasie leczenia arypiprazolem.
- CHPL leku Apra, tabletki, 15 mgSpecjalne środki ostrozności
Z tego powodu arypiprazol należy stosować z zachowaniem ostrożności u pacjentów, u których w przeszłości występowały napady drgawek lub, u których występują choroby wiążące się ze skłonnością do takich napadów (patrz pkt. 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencją: Zwiększona śmiertelność. W trzech badaniach kontrolowanych placebo (n= 938, średnia wieku: 82,4; zakres: 56-99 lat), u pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera, leczonych arypiprazolem, występowało zwiększone ryzyko zgonu w porównaniu z grupą otrzymującą placebo. Częstość zgonów u pacjentów leczonych arypiprazolem wynosiła 3,5% w porównaniu do 1,7% w grupie placebo. Chociaż przyczyny zgonów były zróżnicowane to większość zgonów wydawała się związana albo z chorobami układu krążenia (np. niewydolność serca, nagłe zgony), albo z chorobami infekcyjnymi (np. zapalenie płuc) (patrz punkt 4.8).
- CHPL leku Apra, tabletki, 15 mgSpecjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego: U pacjentów w tych samych badaniach odnotowano działania niepożądane dotyczące krążenia mózgowego (np. udar, przejściowe napady niedokrwienia) w tym o przebiegu zakończonym zgonem (średnia wieku: 84 lata; zakres 78-88 lat). Ogólnie w tych badaniach 1,3% wszystkich pacjentów leczonych arypiprazolem zgłaszało działania niepożądane dotyczące krążenia mózgowego, w porównaniu do 0,6% pacjentów otrzymujących placebo. Różnica ta nie była istotna statystycznie. W jednym z tych badań z zastosowaniem ustalonego dawkowania u pacjentów leczonych arypiprazolem występowała jednak istotna zależność odpowiedzi od dawki dla działań niepożądanych dotyczących krążenia mózgowego (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów z psychozą związaną z demencją. Upadki: Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków.
- CHPL leku Apra, tabletki, 15 mgSpecjalne środki ostrozności
Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2). Hiperglikemia i cukrzyca: U pacjentów leczonych nietypowymi środkami przeciwpsychotycznymi, w tym arypiprazolem, opisywano hiperglikemię, w niektórych przypadkach bardzo wysoką z kwasicą ketonową i śpiączką hiperosmotyczną lub zgonem. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. W badaniach klinicznych z arypiprazolem nie było istotnych różnic w częstości występowania działań niepożądanych związanych z hiperglikemią (w tym cukrzycy) lub nieprawidłowych wartości laboratoryjnych stężenia glukozy w porównaniu do placebo.
- CHPL leku Apra, tabletki, 15 mgSpecjalne środki ostrozności
Nie jest dostępna dokładna ocena ryzyka wystąpienia działań niepożądanych związanych z hiperglikemią, która pozwalałaby na dokonanie bezpośredniego porównania leczenia arypiprazolem i innymi atypowymi lekami przeciwpsychotycznymi. Pacjenci leczeni jakimkolwiek lekiem przeciwpsychotycznym, włącznie z arypiprazolem, powinni być obserwowani czy nie występują u nich objawy podmiotowe i przedmiotowe związane z hiperglikemią (takie jak nadmierne pragnienie, wielomocz, nadmierny apetyt i osłabienie), a pacjenci z cukrzycą lub czynnikami ryzyka wystąpienia cukrzycy powinni być regularnie monitorowani pod kątem pogorszenia kontroli glikemii (patrz punkt 4.8). Nadwrażliwość: Podczas przyjmowania arypiprazolu, mogą wystąpić reakcje nadwrażliwości charakteryzujące się objawami reakcji uczuleniowych (patrz punkt 4.8).
- CHPL leku Apra, tabletki, 15 mgSpecjalne środki ostrozności
Zwiększenie masy ciała: Obserwowane u pacjentów ze schizofrenią i zaburzeniem afektywnym dwubiegunowym zwiększenie masy ciała jest zwykle spowodowane współistniejącymi chorobami, stosowaniem leków przeciwpsychotycznych, o których wiadomo, że powodują zwiększenie masy ciała, niewłaściwym stylem życia i może prowadzić do ciężkich powikłań. Po wprowadzeniu produktu do obrotu obserwowano zwiększenie masy ciała u pacjentów otrzymujących arypiprazol. Jeśli występowało, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych arypiprazol nie powodował klinicznie istotnego zwiększenia masy ciała u dorosłych (patrz punkt 5.1). W badaniach klinicznych z udziałem młodzieży z epizodem manii w przebiegu zaburzenia afektywnego dwubiegunowego wykazano, że stosowanie arypiprazolu ma związek ze zwiększeniem masy ciała po 4 tygodniach leczenia.
- CHPL leku Apra, tabletki, 15 mgSpecjalne środki ostrozności
U młodzieży z zaburzeniem afektywnym dwubiegunowym należy kontrolować przyrost masy ciała. Jeśli przyrost masy ciała jest znaczący klinicznie, należy rozważyć zmniejszenie dawki (patrz punkt 4.8). Dysfagia: Ze stosowaniem leków przeciwpsychotycznych, w tym arypiprazolu, wiąże się spowolnienie motoryki przełyku i ryzyko aspiracji. Arypiprazol należy stosować ostrożnie u pacjentów z ryzykiem wystąpienia zachłystowego zapalenia płuc. Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Podczas przyjmowania arypiprazolu u pacjentów mogą występować zwiększone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy obejmują: zwiększenie popędów seksualnych, kompulsywną potrzebę wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania.
- CHPL leku Apra, tabletki, 15 mgSpecjalne środki ostrozności
Ważne jest, aby lekarze przepisujący lek pytali pacjentów lub opiekunów w szczególności o pojawienie się nowego lub zwiększonego popędu do hazardu, popędów seksualnych, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa lub kompulsywnego objadania się, lub innych popędów podczas leczenia arypiprazolem. Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu leku. Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Lekarz rozważy zmianę dawki lub odstawienie leku, jeśli u pacjenta wystąpią takie popędy podczas przyjmowania arypiprazolu (patrz punkt 4.8). Pacjenci ze współistniejącym ADHD Pomimo wysokiej częstości współistnienia zaburzenia afektywnego dwubiegunowego typu I oraz zespołu ADHD, dane dotyczące bezpieczeństwa jednoczesnego stosowania arypiprazolu oraz stymulantów są bardzo ograniczone; dlatego też należy zachować wyjątkową ostrożność w razie podawania tych produktów jednocześnie.
- CHPL leku Apra, tabletki, 15 mgSpecjalne środki ostrozności
Specjalne ostrzeżenia dotyczące substancji pomocniczych Aspartam: Aspartam jest źródłem fenyloalaniny. Może być szkodliwy dla pacjentów z fenyloketonurią. Jest to rzadka choroba genetyczna, w której fenyloalanina gromadzi się w organizmie, z powodu jej nieprawidłowego wydalania. Laktoza: Tabletki Apra zawierają laktozę. Lek nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy- galaktozy. Sód: Lek zawiera mniej niż 1 mmol (23 mg) sodu w każdej tabletce, to znaczy lek uznaje się za „wolny od sodu”. Alkohol benzylowy: Alkohol benzylowy może powodować reakcje alergiczne. Kobiety w ciąży lub karmiące piersią powinny skontaktować się z lekarzem przed zastosowaniem leku, gdyż duża ilość alkoholu benzylowego może gromadzić się w ich organizmie i powodować działania niepożądane (tzw. kwasicę metaboliczną).
- CHPL leku Apra, tabletki, 15 mgSpecjalne środki ostrozności
Pacjenci z chorobami wątroby lub nerek powinni skontaktować się z lekarzem przed zastosowaniem leku, gdyż duża ilość alkoholu benzylowego może gromadzić się w ich organizmie i powodować działania niepożądane (tzw. kwasicę metaboliczną).
- CHPL leku Apra, tabletki, 15 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na antagonistyczne działanie na receptor adrenergiczny α1, arypiprazol może nasilać działanie niektórych leków przeciwnadciśnieniowych. Ze względu na pierwotne działanie arypiprazolu na OUN, należy zachować ostrożność, jeśli arypiprazol jest przyjmowany razem z alkoholem lub z innymi produktami leczniczymi działającymi na OUN, wywołującymi zbliżone działania niepożądane, takie jak sedacja (patrz punkt 4.8). Należy zachować ostrożność podając arypiprazol równocześnie z produktami leczniczymi, o których wiadomo, że powodują wydłużenie odstępu QT lub zaburzenia elektrolitowe. Możliwy wpływ innych produktów leczniczych na arypiprazol Antagonista receptora H2 - famotydyna, lek hamujący uwalnianie kwasu żołądkowego, zmniejsza szybkość wchłaniania arypiprazolu, jednak działanie to nie ma znaczenia klinicznego.
- CHPL leku Apra, tabletki, 15 mgInterakcje
Arypiprazol jest metabolizowany na wiele sposobów, w tym także przez enzymy, takie jak CYP2D6 i CYP3A4. Nie jest jednak metabolizowany przez enzymy z grupy CYP1A, a więc nie jest konieczne stosowanie specjalnych dawek u palaczy tytoniu. Chinidyna i inne silne inhibitory CYP2D6: Wyniki badań klinicznych z udziałem zdrowych osób wykazały, że silny inhibitor enzymu CYP2D6 (chinidyna) zwiększa AUC arypiprazolu o 107%, podczas gdy Cmax nie zmienia się. AUC i Cmax dehydroarypiprazolu, aktywnego metabolitu, były zmniejszone odpowiednio o 32% i 47%. W przypadku jednoczesnego podawania chinidyny i arypiprazolu, należy zmniejszyć dawkę arypiprazolu o około połowę w stosunku do przepisanej dawki. Inne silne inhibitory grupy enzymów CYP2D6, takie jak fluoksetyna i paroksetyna, mogą powodować podobne skutki i w takich sytuacjach należy podobnie zredukować dawkę leku.
- CHPL leku Apra, tabletki, 15 mgInterakcje
Ketokonazol i inne silne inhibitory CYP3A4: Wyniki badań klinicznych z udziałem zdrowych osób wskazują, że silny inhibitor CYP3A4 (ketokonazol) zwiększa AUC i Cmax arypiprazolu odpowiednio o 63% i 37%, a AUC i Cmax dehydroarypiprazolu odpowiednio o 77% i 43%. W grupie osób o obniżonej aktywności CYP2D6, równoczesne stosowanie silnych inhibitorów CYP3A4 może powodować zwiększenie stężenia arypiprazolu w osoczu, w porównaniu do osób o podwyższonej aktywności CYP2D6. W przypadku jednoczesnego stosowania ketokonazolu albo innych silnych inhibitorów CYP3A4 z arypiprazolem, zakładane korzyści powinny przeważyć ryzyko dla pacjenta. W przypadku jednoczesnego stosowania ketokonazolu z arypiprazolem, przepisaną dawkę arypiprazolu należy zmniejszyć o około połowę. Inne leki silnie hamujące aktywność CYP3A4, takie jak itrakonazol oraz inhibitory proteazy HIV, mogą powodować podobne skutki jak ketokonazol i w takich przypadkach należy podobnie zredukować dawkowanie (patrz punkt 4.2).
- CHPL leku Apra, tabletki, 15 mgInterakcje
Po odstawieniu inhibitora CYP2D6 lub CYP3A4, dawkę arypiprazolu należy zwiększyć do tej, jaką stosowano przed rozpoczęciem terapii skojarzonej. W czasie równoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazemu) lub CYP2D6 (np. escytalopramu) z arypiprazolem, można spodziewać się niewielkiego zwiększenia stężenia arypiprazolu w osoczu. Karbamazepina i inne leki indukujące CYP3A4: Po jednoczesnym podaniu karbamazepiny, silnego induktora CYP3A4 w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnia geometryczna Cmax i AUC arypiprazolu zmniejszyły się odpowiednio o 68% i 73%, w stosunku do wartości tych parametrów podczas stosowania arypiprazolu (30 mg) w monoterapii. Podobnie, w przypadku dehydroarypiprazolu średnia geometryczna Cmax i AUC po jednoczesnym podaniu karbamazepiny zmniejszają się odpowiednio o 69% i 71%, w stosunku do ich wartości podczas leczenia samym arypiprazolem.
- CHPL leku Apra, tabletki, 15 mgInterakcje
Dlatego dawkę arypiprazolu należy podwoić, gdy jednocześnie podaje się go z karbamazepiną. Można się spodziewać, że jednoczesne podawanie arypiprazolu i innych silnych induktorów CYP3A4 (takie jak ryfampicyna, ryfabutyna, fenytoina, fenobarbital, prymidon, efawirenz, newirapina i ziele dziurawca zwyczajnego) może działać podobnie i dlatego należy podobnie zwiększyć dawkę. Po zakończeniu podawania silnego induktora CYP3A4, należy zmniejszyć dawkę arypiprazolu do zalecanej. Walproinian i lit: Skojarzone stosowanie walproinianów lub soli litu z arypiprazolem nie powodowało żadnych istotnych klinicznie zmian stężenia arypiprazolu i w związku z tym nie jest konieczne dostosowanie dawki podczas podawania walproinianu lub litu w skojarzeniu z arypiprazolem. Zespół serotoninowy: obserwowano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol, a możliwe objawy przedmiotowe oraz podmiotowe dla tego stanu mogą wystąpić szczególnie w razie jednoczesnego stosowania innych leków serotoninergicznych, takich jak SSRI/SNRI (selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny) lub leków, o których wiadomo, że zwiększają stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Apra, tabletki, 15 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie przeprowadzono dotychczas odpowiednio kontrolowanych badań dotyczących działania arypiprazolu u kobiet w ciąży. Notowano występowanie wad wrodzonych, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. Na podstawie wyników badań przeprowadzonych na zwierzętach nie można wykluczyć potencjalnego toksycznego wpływu leku na płód (patrz punkt 5.3). Pacjentki należy poinformować o konieczności powiadomienia swojego lekarza, jeśli w trakcie leczenia arypiprazolem zajdą w ciąże lub planują zajście w ciążę. Ze względu na niewystarczające dane dotyczące bezpieczeństwa u ludzi oraz budzące wątpliwości wyniki badań na zwierzętach, ten lek nie może być stosowany w okresie ciąży, chyba że spodziewane korzyści wyraźnie przewyższają potencjalne ryzyko dla płodu.
- CHPL leku Apra, tabletki, 15 mgWpływ na płodność, ciążę i laktację
Noworodki Noworodki narażone na działanie leków przeciwpsychotycznych (w tym na arypiprazol) w czasie trzeciego trymestru ciąży są w grupie ryzyka, w której mogą wystąpić działania niepożądane, w tym zaburzenia pozapiramidowe i (lub) objawy odstawienia, które po porodzie mogą różnić się ciężkością oraz czasem trwania. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być uważnie monitorowane (patrz punkt 4.8). Karmienie piersi? Arypiprazol/metabolity przenikają do mleka ludzkiego. Należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać przyjmowanie arypiprazolu, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem na reprodukcję.
- CHPL leku Apra, tabletki, 15 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe, senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku Apra, tabletki, 15 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa: Najczęściej notowanymi działaniami niepożądanymi w kontrolowanych placebo badaniach były akatyzja i nudności, każde występujące częściej niż u 3% pacjentów leczonych arypiprazolem podawanym doustnie. Tabelaryczne zestawienie działań niepożądanych: Częstość występowania działań niepożądanych związanych z leczeniem arypiprazolem podano w poniższej tabeli. Dane w tabeli oparto na działaniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układ/narząd i częstości: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych). W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
- CHPL leku Apra, tabletki, 15 mgDziałania niepożądane
Nie można określić częstości działań niepożądanych zgłaszanych po wprowadzeniu do obrotu, ponieważ pochodzą one ze spontanicznych zgłoszeń. Z tego względu częstość takich działań niepożądanych określono jako „nieznana”.
- CHPL leku Apra, tabletki, 15 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedmiotowe i podmiotowe W badaniach klinicznych i po wprowadzeniu produktu do obrotu zgłaszano przypadkowe bądź zamierzone przedawkowanie samego arypiprazolu przez dorosłych pacjentów o szacowanej dawce do 1260 mg niezakończone zgonem. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: letarg, wzrost ciśnienia tętniczego krwi, senność, przyspieszona czynność serca (tachykardia), nudności, wymioty i biegunka. Ponadto zgłaszano przypadkowe przedawkowanie samego arypiprazolu (do 195 mg) u dzieci, bez zgonów. Do potencjalnie istotnych klinicznie objawów podmiotowych i przedmiotowych należały: senność, przejściowa utrata świadomości i objawy pozapiramidowe. Postępowanie po przedawkowaniu W wypadku przedawkowania leku stosuje się leczenie podtrzymujące, polegające na utrzymaniu drożności dróg oddechowych, dotlenianiu i wentylacji oraz leczeniu objawowym.
- CHPL leku Apra, tabletki, 15 mgPrzedawkowanie
Należy wziąć pod uwagę możliwość działania wielu produktów leczniczych. Z tego względu należy niezwłocznie rozpocząć monitorowanie czynności układu krążenia, obejmujące stałe monitorowanie zapisu elektrokardiograficznego, w celu wykrycia możliwych zaburzeń rytmu serca. Wiedząc lub podejrzewając przedawkowanie arypiprazolu należy objąć ścisłą kontrolą pacjenta i obserwować go do czasu poprawy jego stanu. Aktywny węgiel (50 g), podany w godzinę po zażyciu arypiprazolu, obniża Cmax arypiprazolu o około 41%, a AUC o około 51%, co wskazuje na jego skuteczność w leczeniu przedawkowania. Hemodializa: Chociaż brak informacji dotyczących wpływu hemodializ w leczeniu przedawkowania arypiprazolu, to jest jednak małe prawdopodobieństwo, że hemodializy będą użyteczne w takich przypadkach, ze względu na znaczny stopień wiązania arypiprazolu z białkami osocza.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12 Mechanizm działania Uważa się, że skuteczność arypiprazolu w leczeniu schizofrenii i zaburzenia afektywnego dwubiegunowego typu I jest związana ze skojarzonym działaniem częściowo agonistycznym w stosunku do receptora dopaminowego D2 i serotoninowego 5-HT1a oraz antagonistycznym w stosunku do receptora serotoninowego 5-HT2a. Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D2 i D3, serotoninowych 5-HT1a i 5-HT2a oraz umiarkowane powinowactwo do receptorów dopaminowych D4, serotoninowych 5-HT2c i 5-HT7, a także adrenergicznych alfa-1 i histaminowych H1.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Arypiprazol w dawkach od 0,5 do 30 mg, podawany raz na dobę przez 2 tygodnie osobom zdrowym powoduje zależne od dawki zmniejszenie wiązania rakloprydu znakowanego ¹¹C, ligandu receptora D2/D3, w jądrze ogoniastym i skorupie, co można wykryć za pomocą pozytonowej tomografii emisyjnej. Skuteczność kliniczna i bezpieczeństwo stosowania Dorośli Schizofrenia Wyniki trzech krótkoterminowych badań (4 do 6 tygodni) z kontrolą placebo z udziałem 1228 dorosłych chorych na schizofrenię, u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
Arypiprazol jest skuteczna w podtrzymywaniu poprawy klinicznej podczas kontynuacji leczenia u tych dorosłych pacjentów, u których obserwowano wstępną dobrą reakcję na lek. W badaniu z grupą kontrolną przyjmującą haloperydol, odsetek pacjentów, u których udało się utrzymać dobrą reakcję na produkt leczniczy, w ciągu 52 tygodni był podobny w obu grupach (arypiprazol 77% i haloperydol 73%). Badanie ukończyła istotnie większa grupa pacjentów leczonych arypiprazolem (43%) niż haloperydolem (30%). Wyniki uzyskane w skalach ocen stosowanych jako wtórne mierniki skuteczności, w tym w skali PANSS i w skali oceny depresji Montgomery-Asberg, wskazują na istotną przewagę nad haloperydolem. W trwającym 26 tygodni kontrolowanym badaniu z użyciem placebo, z udziałem pacjentów dorosłych z ustabilizowaną przewlekłą schizofrenią, stwierdzono w wyniku leczenia arypiprazolem większe zmniejszenie częstości nawrotów (34% w grupie leczonych arypiprazolem i 57% w grupie otrzymującej placebo). 15.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
Przyrost masy ciała Wyniki badań klinicznych wskazują, że arypiprazol nie powoduje klinicznie istotnego przyrostu masy ciała. W trwającym 26 tygodni badaniu z grupą kontrolną leczonych olanzapiną i wykorzystaniem podwójnie ślepej próby, przeprowadzonym w wielu krajach, udział wzięło 314 chorych dorosłych na schizofrenię. Pierwotnym celem była ocena przyrostu masy ciała. W istotnie mniejszej grupie pacjentów leczonych arypiprazolem w porównaniu z otrzymującymi olanzapinę, stwierdzono przyrost masy ciała o ≥7% wobec pomiaru wyjściowego (tzn. przyrost masy ciała o co najmniej 5,6 kg przy średniej początkowej masie wynoszącej ok. 80,5 kg); w grupie leczonych arypiprazolem (n = 18 lub 13% pacjentów, których wyniki poddawano analizie), w porównaniu grupą otrzymujących olanzapinę (n = 45 lub 33% pacjentów, których wyniki poddawano analizie).
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
Stężenia lipidów W zbiorczej analizie wyników stężeń lipidów pochodzących z kontrolowanych placebo badań klinicznych u dorosłych, arypiprazol nie powodował klinicznie istotnych zmian stężeń cholesterolu całkowitego, triglicerydów, cholesterolu HDL i cholesterolu LDL. Prolaktyna Stężenia prolaktyny oceniono podczas wszystkich badań z zastosowaniem wszystkich dawek arypiprazolu (n = 28 242). Częstość występowania hiperprolaktynemii lub zwiększenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem (0,3%) była podobna do częstości występowania hiperprolaktynemii w grupie otrzymującej placebo (0,2%). U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 42 dni, a mediana czasu trwania wynosiła 34 dni. Częstość występowania hiperprolaktynemii lub zmniejszenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem wynosiła 0,4% w porównaniu do 0,02% w grupie otrzymującej placebo.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 30 dni, a mediana czasu trwania wynosiła 194 dni. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I W dwóch 3-tygodniowych badaniach, kontrolowanych placebo, z zastosowaniem zmiennej dawki, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol w monoterapii był znacząco bardziej skuteczny niż placebo w zmniejszaniu objawów maniakalnych w ciągu 3 tygodni. Badania te obejmowały pacjentów z objawami lub bez objawów psychotycznych oraz pacjentów z szybką zmianą fazy lub bez szybkiej zmiany fazy (przebieg typu rapid-cycling). W jednym 3-tygodniowym badaniu, kontrolowanym placebo, z zastosowaniem stałej dawki w monoterapii, u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol nie wykazał większej skuteczności niż placebo.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
W dwóch 12-tygodniowych badaniach, kontrolowanych placebo oraz innymi substancjami czynnymi u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, arypiprazol był skuteczniejszy niż placebo w 3. tygodniu badania, a wynik leczenia podtrzymującego był w 12. tygodniu badania porównywalny z wynikiem dla litu lub haloperydolu. W 12. tygodniu arypiprazol powodował także remisję objawów maniakalnych u porównywalnej liczby pacjentów co lit lub haloperydol. W 6-tygodniowym, kontrolowanym placebo, badaniu u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, którzy częściowo nie odpowiadali na monoterapię litem lub walproinianem przez 2 tygodnie przy terapeutycznych stężeniach w surowicy, zastosowanie arypiprazolu jako dodatkowego leku w większym stopniu zwiększyło skuteczność zapobiegania objawom maniakalnym niż stosowanie litu lub walproinianu w monoterapii.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
W 26-tygodniowym, kontrolowanym placebo, badaniu które przedłużono o 74 tygodnie, u pacjentów z objawami maniakalnymi, którzy osiągnęli remisję w trakcie stosowania arypiprazolu w czasie fazy stabilizacji przed randomizacją, arypiprazol był bardziej skuteczny niż placebo w zapobieganiu nawrotowi choroby dwubiegunowej, głównie w zapobieganiu nawrotowi objawów maniakalnych, ale nie wykazał przewagi nad placebo w zapobieganiu nawrotowi depresji. W 52-tygodniowym, kontrolowanym placebo badaniu, u pacjentów z obecnym epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, którzy osiągnęli trwałą remisję (w skali oceny manii Younga Y-MRS oraz w skali oceny depresji Montgomery-Asberg MADRS całkowita liczba punktów ≤12) w trakcie stosowania arypiprazolu (w dawce 10 mg na dobę do 30 mg na dobę) w skojarzeniu z litem lub walproinianem przez 12 kolejnych tygodni, połączenie z arypiprazolem wykazało przewagę nad placebo w zapobieganiu nawrotowi choroby afektywnej dwubiegunowej (współczynnik ryzyka 0,54), zmniejszając ryzyko o 46% i w zapobieganiu nawrotom manii, zmniejszając ryzyko o 65% (współczynnik ryzyka 0,35), ale nie wykazało przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
Skojarzenie z arypiprazolem wykazało przewagę wobec placebo w przypadku drugorzędowego punktu oceny, skala ogólnego wrażenia klinicznego w wersji dla ChAD (ang. CGI-BP) nasilenia choroby (mania). W tym badaniu, pacjenci zostali przydzieleni przez badaczy do badania prowadzonego metodą próby otwartej, z zastosowaniem litu lub walproinianu w monoterapii, w celu oceny częściowego braku odpowiedzi. Pacjenci byli stabilizowani przez co najmniej 12 kolejnych tygodni za pomocą skojarzenia arypiprazolu i stosowanego wcześniej stabilizatora nastroju. Pacjenci stabilni byli następnie losowo przydzielani do grupy kontynuującej stosowanie tego samego stabilizatora nastroju z arypiprazolem lub placebo w badaniu metodą podwójnie ślepej próby. W fazie randomizowanej oceniano cztery podgrupy stabilizatora nastroju: arypiprazol + lit; arypiprazol + walproinian; placebo + lit; placebo + walproinian.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
Współczynniki Kaplana-Meiera dla nawrotu jakiegokolwiek zaburzenia nastroju w przypadku terapii skojarzonej były następujące: 16% dla grupy stosującej arypiprazol + lit i 18% dla grupy arypiprazol + walproinian, w porównaniu do 45% dla grupy placebo + lit i 19% dla grupy placebo + walproinian. Populacja dzieci i młodzieży Schizofrenia u młodzieży Wyniki 6-tygodniowego badania z kontrolą placebo, w którym udział wzięło 302 nastoletnich pacjentów chorych na schizofrenię (13-17 lat), u których stwierdzano objawy pozytywne lub negatywne, wykazały, że arypiprazol powoduje statystycznie istotnie większą poprawę w zakresie objawów psychotycznych niż placebo. W analizie podgrupy nastoletnich pacjentów w wieku pomiędzy 15 a 17 lat, stanowiącej 74% całej włączonej populacji, w czasie trwania 26-tygodniowego badania prowadzonego na zasadzie próby otwartej obserwowano utrzymywanie się działania.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
W badaniu z randomizacją, prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo, trwającym 60 do 89 tygodni, które prowadzono z udziałem młodzieży ze schizofrenią (n = 146; w wieku 13 do 17 lat) występowała statystycznie znamienna różnica w zakresie odsetka nawrotów objawów psychotycznych pomiędzy grupą otrzymującą arypiprazol (19,39%) a grupą otrzymującą placebo (37,5%). Punkt szacunkowy współczynnika ryzyka (HR) w całej populacji wynosił 0,461 (95% przedział ufności, 0,242 do 0,879). W analizach w podgrupach punkt szacunkowy współczynnika ryzyka wynosił 0,495 wśród uczestników w wieku od 13 do 14 lat w porównaniu do 0,454 wśród uczestników w wieku od 15 do 17 lat. Jednak ocena szacunkowa współczynnika ryzyka w grupie młodszych uczestników (13 do 14 lat) nie była precyzyjna, odzwierciedlając mniejszą liczebność uczestników w tej grupie (arypiprazol, n = 29; placebo, n = 12) i przedział ufności dla tej oceny szacunkowej (wynoszący od 0,151 do 1,628) uniemożliwiał wyciągnięcie wniosków odnośnie występowania wyniku leczenia.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
Natomiast 95% przedział ufności dla współczynnika ryzyka w podgrupie starszych uczestników (arypiprazol, n = 69; placebo, n = 36) wynosił od 0,242 do 0,879 i dlatego można wyciągnąć wnioski odnośnie wyników leczenia u starszych pacjentów. 17. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u dzieci i młodzieży Arypiprazol badano w 30-tygodniowym badaniu kontrolowanym placebo z udziałem 296 dzieci i młodzieży (10-17 lat), którzy spełnili kryteria diagnostyczne według DSM-IV dla zaburzenia afektywnego dwubiegunowego typu I z epizodami maniakalnymi lub mieszanymi z objawami psychotycznymi lub bez tych objawów oraz wyjściowo mieli wynik ≥ 20 w skali manii według Younga (Y-MRS) jako wartość wyjściową. Wśród pacjentów włączonych do podstawowej analizy skuteczności, 139 pacjentów miało postawioną diagnozę aktualnie współistniejącego ADHD. Arypiprazol wykazał przewagę w stosunku do placebo w odniesieniu do zmiany wartości wyjściowej w 4. oraz 12.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
tygodniu jako wynik całościowy wg Y-MRS. W dalszych analizach przewaga nad placebo była bardziej wyraźna u pacjentów ze współistniejącym zespołem ADHD w porównaniu do pacjentów bez ADHD, gdzie nie zaobserwowano różnicy w stosunku do placebo. Zapobieganie nawrotom nie zostało określone. Do najczęstszych zdarzeń niepożądanych występujących w trakcie leczenia, wśród pacjentów otrzymujących dawkę 30 mg, były zaburzenia pozapiramidowe (28,3%), senność (27,3%), ból głowy (23,2%) oraz nudności (14,1%). Średni przyrost masy ciała w 30-tygodniowym okresie leczenia wynosił 2,9 kg, w porównaniu do 0,98 kg u pacjentów, u których stosowano placebo. Drażliwość związana z zaburzeniami autystycznymi u dzieci i młodzieży (patrz punkt 4.2) U pacjentów w wieku od 6 do 17 lat arypiprazol badano w dwóch 8-tygodniowych badaniach z użyciem placebo [w jednym badaniu stosowano zmienną dawkę (2-15 mg na dobę), a w drugim stałą dawkę (5, 10 lub 15 mg na dobę)] oraz jednym 52-tygodniowym badaniu otwartym.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
Dawkowanie w tych badaniach rozpoczynano od dawki 2 mg na dobę, po tygodniu zwiększanej do 5 mg na dobę, a następnie zwiększanej w odstępach tygodniowych o 5 mg na dobę do czasu osiągnięcia dawki docelowej. Ponad 75% pacjentów miało mniej niż 13 lat. Arypiprazol wykazał statystycznie większą skuteczność w porównaniu do placebo w podskali dotyczącej drażliwości z Listy Zachowań Aberracyjnych (ang. Aberrant Behaviour Checklist Irritability subscale). Jednakże nie ustalono znaczenia klinicznego tej obserwacji. Profil bezpieczeństwa obejmował przyrost masy ciała i zmianę stężenia prolaktyny. Czas trwania długoterminowego badania dotyczącego bezpieczeństwa był ograniczony do 52-tygodni. W zebranych badaniach, częstość występowania małego stężenia prolaktyny u dziewcząt (<3 ng/ml) i u chłopców (<2 ng/ml) leczonych arypiprazolem wynosiła odpowiednio, 27/46 (58,7%) i 258/298 (86,6%).
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
W badaniach kontrolowanych placebo średni przyrost masy ciała wynosił 0,4 kg w grupie placebo i 1,6 kg w grupie arypiprazolu. Arypiprazol badano także w długoterminowym badaniu podtrzymującym, kontrolowanym placebo. Po 13-26-tygodniowej stabilizacji z zastosowaniem arypiprazolu (w dawkach 2-15 mg na dobę), pacjenci z trwałą odpowiedzią albo kontynuowali leczenie arypiprazolem bądź też otrzymywali placebo przez kolejne 16 tygodni. Współczynniki Kaplana-Meiera dla nawrotu w tygodniu 16. były następujące: 35% dla grupy stosującej arypiprazol oraz 52% dla grupy placebo; współczynnik ryzyka nawrotu w ciągu 16 tygodni (arypiprazol/placebo) wynosił 0,57 (różnica nieistotna statystycznie). Średni przyrost masy ciała w fazie stabilizacji (do 26 tygodni) z zastosowaniem arypiprazolu wynosił 3,2 kg, natomiast w drugiej fazie badania (16 tygodni) obserwowano dalszy średni wzrost o 2,2 kg dla arypiprazolu w porównaniu do 0,6 kg dla placebo.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
Objawy pozapiramidowe zgłaszano głównie w fazie stabilizacji, u 17% pacjentów z drgawkami stanowiącymi 6%. Tiki związane z zespołem Tourette’a u dzieci i młodzieży (patrz punkt 4.2) Skuteczność arypiprazolu badano u dzieci i młodzieży z zespołem Tourette’a (arypiprazol: n = 99, placebo: n = 44) w trwającym 8 tygodni, randomizowanym badaniu prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo w schemacie leczenia w grupach z użyciem stałej dawki zależnej od masy ciała od 5 mg na dobę do 20 mg na dobę i dawki początkowej wynoszącej 2 mg. Pacjenci byli w wieku 7 - 17 lat i przed rozpoczęciem leczenia uzyskali średni wynik 30 na łącznej skali tików w Globalnej Skali Nasilenia Tików z Yale (Total Tic Score on the Yale Global Tic Severity Scale, TTS-YGTSS). Grupa pacjentów otrzymująca arypiprazol wykazywała poprawę mierzoną zmianą wyniku na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 8 tygodniu leczenia, która wynosiła 13,35 w grupie otrzymującej małą dawkę (5 mg lub 10 mg) i 16,94 w grupie otrzymującej dużą dawkę (10 mg lub 20 mg) w porównaniu do poprawy odnotowanej u pacjentów otrzymujących placebo i zmiany wynoszącej 7,09.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
Skuteczność arypiprazolu u dzieci i młodzieży z zespołem Tourette’a (arypiprazol: n = 32, placebo: n = 29) oceniano również w przypadku podawania zmiennych dawek od 2 mg na dobę do 20 mg na dobę z dawką początkową wynoszącą 2 mg w trwającym 10 tygodni, randomizowanym badaniu w Korei Południowej prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo. Pacjenci w wieku 6 - 18 lat uzyskali średni wynik 29 na skali TTS-YGTSS w pomiarze początkowym. Pacjenci otrzymujący arypiprazol wykazywali poprawę mierzoną zmianą wyniku o 14,97 na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 10 tygodniu w porównaniu do poprawy wynoszącej 9,62 w grupie placebo. W obu wspomnianych badaniach krótkoterminowych nie określono klinicznego znaczenia wyników dotyczących skuteczności, biorąc pod uwagę działanie terapeutyczne w porównaniu do istotnego wpływu efektu placebo i niejasne skutki w zakresie funkcjonowania psychospołecznego.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakodynamiczne
Brak danych długoterminowych dotyczących skuteczności i bezpieczeństwa arypiprazolu w tej niestabilnej chorobie. Europejska Agencja Leków wstrzymała obowiązek dołączania wyników badań produktu leczniczego zawierającego arypiprazol w jednej lub kilku podgrupach populacji dzieci i młodzieży w leczeniu schizofrenii oraz w leczeniu choroby afektywnej dwubiegunowej (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Arypiprazol jest dobrze wchłaniany, maksymalne stężenie w osoczu osiąga w ciągu 3-5 godzin po podaniu. Arypiprazol w minimalnym stopniu ulega metabolizmowi przedukładowemu. Bezwzględna dostępność po doustnym podaniu jednej tabletki wynosi 87%. Spożywanie posiłków o dużej zawartości tłuszczu nie wpływa na farmakokinetykę arypiprazolu. Dystrybucja Arypiprazol jest rozmieszczany w całym organizmie, pozorna objętość dystrybucji wynosi 4,9 l/kg, co wskazuje na znaczną dystrybucję pozanaczyniową. W stężeniach terapeutycznych arypiprazol i dehydroarypiprazol wiążą się w ponad 99% z białkami surowicy, głównie z albuminami. Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie. Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakokinetyczne
Jak wynika z badań in vitro, enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N-dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. W stanie stacjonarnym aktywny metabolit, dehydroarypiprazol, stanowi około 40% AUC arypiprazolu w osoczu. Eliminacja Średni okres półtrwania arypiprazolu w fazie eliminacji wynosi około 75 godzin u osób o podwyższonej aktywności CYP2D6 i około 146 godzin u osób o obniżonej aktywności CYP2D6. Całkowity klirens arypiprazolu wynosi 0,7 ml/min/kg mc. i jest to głównie klirens wątrobowy. Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [¹⁴C], stwierdza się odpowiednio 27% i 60% podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1% niezmienionego arypiprazolu zostaje wydalone z moczem, a około 18% z kałem.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakokinetyczne
Dzieci i młodzież Farmakokinetyka arypiprazolu i dehydroarypiprazolu u dzieci w wieku 10 do 17 lat była podobna do farmakokinetyki u dorosłych, po uwzględnieniu różnic w masie ciała. Farmakokinetyka w szczególnych grupach pacjentów Pacjenci w podeszłym wieku Nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi, nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Nie stwierdzono, aby farmakokinetyka arypiprazolu różniła się u zdrowych kobiet i zdrowych mężczyzn. Nie stwierdzono także żadnego mierzalnego wpływu płci na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Palenie tytoniu Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie wpływów na farmakokinetykę arypiprazolu, zależnych od palenia tytoniu.
- CHPL leku Apra, tabletki, 15 mgWłaściwości farmakokinetyczne
Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy. Zaburzenia czynności nerek Stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u osób z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badania obejmujące podanie pojedynczej dawki leku, przeprowadzone u osób z różnego stopnia marskością wątroby (klasy Child-Pugh A, B i C) nie wykazały, by zaburzenia czynności wątroby wpływały istotnie na farmakokinetykę arypiprazolu i dehydroarypiprazolu, jednak w badaniu wzięło udział tylko 3 chorych z marskością wątroby typu C, co jest liczbą niewystarczającą do wyciągnięcia wniosków dotyczących zdolności metabolicznych tych pacjentów.
- CHPL leku Apra, tabletki, 15 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego i toksycznego wpływu na reprodukcję i rozwój, nie ujawniają występowania szczególnego zagrożenia dla człowieka. Istotne działanie toksyczne stwierdzano jedynie, gdy dawki lub stopień narażenia wyraźnie przekraczały maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza (gromadzenie barwnika lipofuscyny i (lub) obumieranie komórek miąższowych) stwierdzany u szczurów po 104 tygodniach podawania arypiprazolu w dawce od 20 do 60 mg/kg mc.
- CHPL leku Apra, tabletki, 15 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 3 do 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki) i zwiększenie częstości występowania raków nadnerczy, a także skojarzonej częstości występowania gruczolaków lub raków nadnerczy u samic szczurów otrzymujących lek w dawce 60 mg/kg mc. na dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki). Największa ekspozycja nie powodująca powstawania nowotworów u samic szczurów odpowiadała 7 krotnej ekspozycji u ludzi występującej po stosowaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych sprzężonych związków hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 do 125 mg/kg mc.
- CHPL leku Apra, tabletki, 15 mgPrzedkliniczne dane o bezpieczeństwie
na dobę (średnia wartość AUC w stanie stacjonarnym była od 1 do 3 razy większa niż wartość występująca u ludzi po podaniu maksymalnej zalecanej dawki klinicznej lub 16 do 81 razy większa niż po podaniu maksymalnej dawki zalecanej w przeliczeniu na mg/m2 pc). Jednak stężenie sprzężonych związków siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania najwyższej proponowanej dawki 30 mg na dobę, nie przekraczało 6% stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie mniejsze (6%) niż granica rozpuszczalności określona in vitro. W badaniach toksykologicznych z użyciem dawki wielokrotnej u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt, nie ma też dowodów neurotoksyczności i niepożądanego wpływu na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych.
- CHPL leku Apra, tabletki, 15 mgPrzedkliniczne dane o bezpieczeństwie
Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowane toksyczne wpływy na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po zastosowaniu dawek maksymalnych zalecanych u ludzi). Toksyczny wpływ na ciężarne samice obserwowano po podawaniu dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Apra, tabletki, 15 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Apra, tabletki 5 mg: Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Aspartam (E 951) Magnezu stearynian Indygotyna, lak (E 132) Aromat waniliowy (maltodekstryna, guma arabska E 414, glikol propylenowy E 1520, alkohol benzylowy E 1519) Apra, tabletki 10 i 30 mg: Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Aspartam (E951) Magnezu stearynian Żelaza tlenek czerwony (E 172) Aromat waniliowy (maltodekstryna, guma arabska E 414, glikol propylenowy E 1520, alkohol benzylowy E 1519) Apra, tabletki 15 mg: Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Aspartam (E 951) Magnezu stearynian Żelaza tlenek żółty (E 172) Aromat waniliowy (maltodekstryna, guma arabska E 414, glikol propylenowy E 1520, alkohol benzylowy E 1519) 6.2 Niezgodności farmaceutyczne Nie dotyczy.
- CHPL leku Apra, tabletki, 15 mgDane farmaceutyczne
6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Brak szczególnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Apra, 5mg i Apra, 30mg: Pudełka tekturowe zawierające 7, 14 i 28 tabletek w blistrach OPA/Aluminium/PVC/Aluminium. Apra, 10 mg i Apra, 15mg: Pudełka tekturowe zawierające 7, 14, 28, 56 i 84 tabletki w blistrach OPA/Aluminium/PVC/Aluminium. 6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć w sposób zgodny z lokalnymi przepisami.
- CHPL leku o rpl_id: 100352300Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Aripiprazole Sandoz, 10 mg, tabletki ulegające rozpadowi w jamie ustnej Aripiprazole Sandoz, 15 mg, tabletki ulegające rozpadowi w jamie ustnej Aripiprazole Sandoz, 30 mg, tabletki ulegające rozpadowi w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Tabletki 10 mg Każda tabletka ulegająca rozpadowi w jamie ustnej zawiera 10 mg arypiprazolu (Aripiprazolum). Substancje pomocnicze o znanym działaniu Każda tabletka ulegająca rozpadowi w jamie ustnej zawiera 90,30 mg laktozy (w postaci laktozy jednowodnej), 1,0 mg aspartamu i do 0,0036 mg alkoholu benzylowego. Tabletki 15 mg Każda tabletka ulegająca rozpadowi w jamie ustnej zawiera 15 mg arypiprazolu (Aripiprazolum). Substancje pomocnicze o znanym działaniu Każda tabletka ulegająca rozpadowi w jamie ustnej zawiera 135,46 mg laktozy (w postaci laktozy jednowodnej), 1,5 mg aspartamu i do 0,0054 mg alkoholu benzylowego.
- CHPL leku o rpl_id: 100352300Nazwa produktu leczniczego, skład i postać farmaceutyczna
Tabletki 30 mg Każda tabletka ulegająca rozpadowi w jamie ustnej zawiera 30 mg arypiprazolu (Aripiprazolum). Substancje pomocnicze o znanym działaniu Każda tabletka ulegająca rozpadowi w jamie ustnej zawiera 270,90 mg laktozy (w postaci laktozy jednowodnej), 3,0 mg aspartamu i do 0,0108 mg alkoholu benzylowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka ulegająca rozpadowi w jamie ustnej. Tabletki 10 mg Okrągłe, płaskie, różowe tabletki o średnicy 8,0 mm ± 0,1 mm, z napisem „10” na jednej stronie i gładkie na drugiej stronie. Tabletki 15 mg Okrągłe, płaskie, żółte tabletki o średnicy 9,0 mm ± 0,1 mm, z napisem „15” na jednej stronie i gładkie na drugiej stronie. Tabletki 30 mg Okrągłe, płaskie, różowe tabletki o średnicy 10,0 mm ± 0,1 mm, z napisem „30” na jednej stronie i gładkie na drugiej stronie.
- CHPL leku o rpl_id: 100352300Wskazania do stosowania
4.1 Wskazania do stosowania 1. NL/H/3231/001-002-003/IB/014 Aripiprazole Sandoz jest wskazany w leczeniu schizofrenii u dorosłych i u młodzieży w wieku 15 lat i starszej. Aripiprazole Sandoz jest wskazany w leczeniu epizodów maniakalnych o nasileniu umiarkowanym do ciężkiego w przebiegu zaburzenia afektywnego dwubiegunowego typu I oraz w zapobieganiu nowym epizodom maniakalnym u dorosłych, u których występują głównie epizody maniakalne i którzy odpowiadają na leczenie arypiprazolem (patrz punkt 5.1). Aripiprazole Sandoz jest wskazany w trwającym do 12 tygodni leczeniu epizodów maniakalnych o nasileniu umiarkowanym do ciężkiego w przebiegu zaburzenia afektywnego dwubiegunowego typu I u młodzieży w wieku 13 lat i starszej (patrz punkt 5.1).
- CHPL leku o rpl_id: 100352300Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Schizofrenia: zalecaną dawką początkową produktu Aripiprazole Sandoz jest 10 lub 15 mg na dobę z dawką podtrzymującą 15 mg na dobę raz na dobę, niezależnie od posiłków. Aripiprazole Sandoz jest skuteczny w dawkach od 10 do 30 mg na dobę. Chociaż nie potwierdzono większej skuteczności dawek większych niż dawka dobowa 15 mg, jednak u poszczególnych pacjentów większa dawka może być korzystna. Maksymalna dawka dobowa nie może być większa niż 30 mg. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I: zalecana dawka początkowa to 15 mg arypiprazolu podawanych w schemacie raz na dobę, niezależnie od posiłków, w monoterapii lub w leczeniu skojarzonym (patrz punkt 5.1). U niektórych pacjentów może być korzystne zastosowanie większej dawki. Maksymalna dawka dobowa nie może być większa niż 30 mg.
- CHPL leku o rpl_id: 100352300Dawkowanie
Zapobieganie nawrotom epizodów maniakalnych w zaburzeniu afektywnym dwubiegunowym typu I: w celu zapobiegania nawrotom epizodów maniakalnych u pacjentów, którzy otrzymywali arypiprazol w monoterapii lub w terapii skojarzonej, leczenie należy kontynuować stosując tę samą dawkę. Dostosowanie dawki dobowej, w tym jej zmniejszenie, należy rozważyć na podstawie stanu klinicznego. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej: zalecana dawka produktu Aripiprazole Sandoz to 10 mg na dobę podawanych w schemacie raz na dobę, niezależnie od posiłków. Leczenie należy rozpocząć od dawki 2 mg (stosując roztwór doustny zawierający arypiprazol o mocy 1 mg/ml) podawanej przez 2 dni, zwiększanej stopniowo do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg. W przypadkach, gdzie to właściwe, dalsze zwiększenie dawki należy przeprowadzać dodając jednorazowo po 5 mg, bez przekroczenia maksymalnej dawki dobowej 30 mg (patrz punkt 5.1).
- CHPL leku o rpl_id: 100352300Dawkowanie
Produkt leczniczy Aripiprazole Sandoz jest skuteczny w przedziale dawek od 10 do 30 mg na dobę. Nie wykazano większej skuteczności dawek dobowych większych niż 10 mg, chociaż u poszczególnych pacjentów zastosowanie większych dawek może być korzystne. Nie zaleca się stosowania produktu Aripiprazole Sandoz u pacjentów ze schizofrenią w wieku poniżej 15 lat ze względu na brak wystarczających danych dotyczących bezpieczeństwa stosowania i skuteczności (patrz punkty 4.8 i 5.1). Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej: zalecana dawka produktu Aripiprazole Sandoz to 10 mg na dobę podawanych w schemacie raz na dobę, niezależnie od posiłków. Leczenie należy rozpocząć od dawki 2 mg (stosując roztwór doustny zawierający arypiprazol o mocy 1 mg/ml) podawanej przez 2 dni, zwiększanej stopniowo do 5 mg przez kolejne 2 dni, aż do osiągnięcia zalecanej dawki dobowej wynoszącej 10 mg.
- CHPL leku o rpl_id: 100352300Dawkowanie
Czas trwania leczenia powinien być możliwie najkrótszy konieczny do uzyskania kontroli objawów i nie może być dłuższy niż 12 tygodni. Nie wykazano większej skuteczności dawek dobowych większych niż 10 mg, a stosowanie dawki dobowej 30 mg jest związane ze znacząco większą częstością istotnych działań niepożądanych, włączając zdarzenia związane z objawami pozapiramidowymi (ang. EPS), senność, zmęczenie oraz zwiększenie masy ciała (patrz punkt 4.8). Z tego względu dawki większe niż 10 mg na dobę należy stosować tylko w wyjątkowych przypadkach oraz z zachowaniem ścisłej kontroli klinicznej (patrz punkty 4.4, 4.8 i 5.1). U młodszych pacjentów zwiększone jest ryzyko zdarzeń niepożądanych związanych ze stosowaniem arypiprazolu, dlatego nie zaleca się stosowania produktu Aripiprazole Sandoz u pacjentów w wieku poniżej 13 lat (patrz punkty 4.8 i 5.1).
- CHPL leku o rpl_id: 100352300Dawkowanie
Drażliwość związana z zaburzeniami autystycznymi: nie ustalono dotychczas bezpieczeństwa stosowania ani skuteczności arypiprazolu u dzieci i młodzieży w wieku poniżej 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale nie można określić zaleceń dotyczących dawkowania. Tiki związane z zespołem Tourette’a: nie ustalono dotychczas bezpieczeństwa stosowania i skuteczności arypiprazolu u dzieci i młodzieży w wieku od 6 do 18 lat. Aktualne dane przedstawiono w punkcie 5.1, ale nie można określić zaleceń dotyczących dawkowania. Szczególne grupy pacjentów Zaburzenia czynności wątroby U pacjentów z lekkimi do umiarkowanych zaburzeniami czynności wątroby modyfikacja dawki nie jest konieczna. Dostępne dane są niewystarczające, aby ustalić dawkowanie u pacjentów z ciężkimi zaburzeniami czynności wątroby. W tej grupie pacjentów dawkowanie należy ustalać ostrożnie, a największą dawkę dobową 30 mg należy stosować ze szczególną ostrożnością (patrz punkt 5.2).
- CHPL leku o rpl_id: 100352300Dawkowanie
Zaburzenia czynności nerek U pacjentów z zaburzeniami czynności nerek modyfikacja dawki nie jest konieczna. Osoby w podeszłym wieku Nie ustalono bezpieczeństwa stosowania i skuteczności arypiprazolu w leczeniu schizofrenii lub epizodów manii w przebiegu zaburzenia afektywnego dwubiegunowego typu I u pacjentów w wieku 65 lat i starszych. Jednak ze względu na większą wrażliwość tych pacjentów, należy rozważyć zastosowanie mniejszej dawki początkowej, jeśli pozwalają na to okoliczności kliniczne (patrz punkt 4.4). Płeć Nie jest konieczna modyfikacja dawkowania w zależności od płci (patrz punkt 5.2). Palenie tytoniu Biorąc pod uwagę metabolizm arypiprazolu, modyfikacja dawkowania u osób palących tytoń nie jest konieczna (patrz punkt 4.5). Dostosowanie dawki ze względu na interakcje Dawkę arypiprazolu należy zmniejszyć w razie jednoczesnego podawania silnych inhibitorów izoenzymów CYP3A4 lub CYP2D6.
- CHPL leku o rpl_id: 100352300Dawkowanie
Po zakończeniu jednoczesnego stosowania inhibitora CYP3A4 lub CYP2D6, dawkę arypiprazolu należy ponownie zwiększyć (patrz punkt 4.5). Dawkę arypiprazolu należy zwiększyć w razie jednoczesnego podawania leków silnie indukujących CYP3A4. Po odstawieniu leku indukującego CYP3A4, dawkę arypiprazolu należy ponownie zmniejszyć do dawki zalecanej (patrz punkt 4.5). Sposób podawania Produkt leczniczy Aripiprazole Sandoz jest przeznaczony do podawania doustnego. Tabletkę ulegającą rozpadowi w jamie ustnej należy położyć na języku, gdzie szybko rozpuści się w ślinie. Można ją popić płynem. Wyjęcie nienaruszonej tabletki z jamy ustnej jest trudne. Ponieważ tabletka ulegająca rozpadowi w jamie ustnej jest krucha, należy ją zażyć bezpośrednio po wyjęciu z blistra. Możliwe jest również wymieszanie tabletki z wodą i wypicie otrzymanej zawiesiny.
- CHPL leku o rpl_id: 100352300Dawkowanie
Tabletki ulegające rozpadowi w jamie ustnej mogą stanowić alternatywę dla produktu leczniczego w tabletkach dla pacjentów z trudnościami w połknięciu tabletki z arypiprazolem (patrz również punkt 5.2).
- CHPL leku o rpl_id: 100352300Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku o rpl_id: 100352300Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego poprawa stanu klinicznego pacjenta może nastąpić w ciągu kilku dni do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Prawdopodobieństwo podjęcia próby samobójczej Występowanie zachowań samobójczych jest związane z chorobami psychicznymi oraz zaburzeniami nastroju i w niektórych przypadkach było zgłaszane wkrótce po rozpoczęciu lub zmianie leczenia przeciwpsychotycznego, w tym leczenia arypiprazolem (patrz punkt 4.8). Leczenie przeciwpsychotyczne pacjentów wysokiego ryzyka powinno odbywać się pod ścisłym nadzorem. Zaburzenia sercowo-naczyniowe Arypiprazol należy stosować ostrożnie u pacjentów z chorobą sercowo-naczyniową (zawał mięśnia sercowego lub choroba niedokrwienna serca w wywiadzie, niewydolność serca lub zaburzenia przewodzenia), chorobą naczyń mózgowych, w stanach predysponujących do niedociśnienia tętniczego (odwodnienie, zmniejszenie objętości krwi krążącej i stosowanie leków przeciwnadciśnieniowych) lub nadciśnienia tętniczego, w tym postępującego lub złośliwego.
- CHPL leku o rpl_id: 100352300Specjalne środki ostrozności
Po zastosowaniu przeciwpsychotycznych produktów leczniczych obserwowano przypadki żylnej choroby zakrzepowo-zatorowej (ang. venous thromboembolism, VTE). Ponieważ u pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, przed rozpoczęciem oraz w trakcie leczenia arypiprazolem należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE i wdrożyć odpowiednie środki zapobiegawcze. Wydłużenie odstępu QT W badaniach klinicznych częstość występowania wydłużenia odstępu QT po zastosowaniu arypiprazolu i placebo była porównywalna. Arypiprazol należy stosować ostrożnie u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy W badaniach klinicznych trwających rok lub krócej, w trakcie leczenia arypiprazolem zgłaszano niezbyt częste przypadki dyskinez wymagające interwencji.
- CHPL leku o rpl_id: 100352300Specjalne środki ostrozności
Jeśli u pacjenta leczonego arypiprazolem wystąpią przedmiotowe lub podmiotowe objawy późnych dyskinez, należy rozważyć zmniejszenie dawki lub odstawienie leku (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Inne objawy pozapiramidowe W badaniach klinicznych z zastosowaniem arypiprazolu u dzieci i młodzieży obserwowano akatyzję oraz parkinsonizm. Jeśli u pacjenta przyjmującego arypiprazol wystąpią przedmiotowe i podmiotowe objawy innych zaburzeń pozapiramidowych, należy rozważyć zmniejszenie dawki oraz wprowadzenie ścisłej kontroli klinicznej. Złośliwy zespół neuroleptyczny (ang. neuroleptic malignant syndrome, NMS) NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić podczas stosowania leków przeciwpsychotycznych. W badaniach klinicznych odnotowano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku o rpl_id: 100352300Specjalne środki ostrozności
Klinicznymi objawami NMS są wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz przejawy niestabilności autonomicznego układu nerwowego (nieregularne tętno lub wahania ciśnienia tętniczego, częstoskurcz, obfite pocenie się i zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak zwiększenie aktywności kinazy kreatynowej, mioglobinuria (rabdomioliza) i ostra niewydolność nerek. Jednak notowano także zwiększenie aktywności kinazy kreatynowej i rabdomiolizę, niekoniecznie związane z NMS. Jeśli u pacjenta wystąpią objawy przedmiotowe i podmiotowe wskazujące na NMS, bądź wystąpi niewyjaśnionego pochodzenia wysoka gorączka bez innych klinicznych objawów NMS, należy odstawić wszystkie leki przeciwpsychotyczne, w tym arypiprazol. Napady drgawkowe W badaniach klinicznych odnotowano niezbyt częste przypadki napadów drgawek w czasie leczenia arypiprazolem.
- CHPL leku o rpl_id: 100352300Specjalne środki ostrozności
Z tego względu arypiprazol należy stosować ostrożnie u pacjentów z napadami drgawek w wywiadzie lub z chorobami wiążącymi się ze skłonnością do takich napadów (patrz punkt 4.8). Pacjenci w podeszłym wieku z psychozą związaną z otępieniem Zwiększona śmiertelność W trzech kontrolowanych placebo badaniach (n=938, średni wiek: 82,4 roku; zakres: 56-99 lat) z udziałem osób w podeszłym wieku z psychozą związaną z chorobą Alzheimera, ryzyko zgonu u pacjentów otrzymujących arypiprazol było większe niż u pacjentów otrzymujących placebo. Częstość zgonów u pacjentów leczonych arypiprazolem wynosiła 3,5% w porównaniu z 1,7% w grupie placebo. Wprawdzie przyczyny zgonów były zróżnicowane, ale wydaje się, że większość zgonów związana była albo z chorobami układu krążenia (np. niewydolność serca, nagły zgon), albo z chorobami infekcyjnymi (np. zapalenie płuc), patrz punkt 4.8.
- CHPL leku o rpl_id: 100352300Specjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego W tych samych badaniach odnotowano działania niepożądane dotyczące krążenia mózgowego (np. udar, przemijający napad niedokrwienny), również zakończone zgonem (średni wiek pacjentów: 84 lata; zakres 78-88 lat). Ogólnie, w badaniach tych działania niepożądane dotyczące krążenia mózgowego wystąpiły u 1,3% pacjentów leczonych arypiprazolem w porównaniu z 0,6% pacjentów otrzymujących placebo. Różnica ta nie była istotna statystycznie. W jednym z tych badań z zastosowaniem ustalonej dawki stwierdzono jednak istotną zależność działań niepożądanych dotyczących krążenia mózgowego od dawki u pacjentów leczonych arypiprazolem (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów z psychozą związaną z otępieniem. Hiperglikemia i cukrzyca U pacjentów leczonych atypowymi przeciwpsychotycznymi produktami leczniczymi, w tym arypiprazolem, opisywano hiperglikemię, w niektórych przypadkach bardzo wysoką, z kwasicą ketonową lub śpiączką hiperosmotyczną albo zgonem.
- CHPL leku o rpl_id: 100352300Specjalne środki ostrozności
Czynnikami ryzyka, które mogą sprzyjać wystąpieniu ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. W badaniach klinicznych nie wykazano znaczących różnic w częstości działań niepożądanych związanych z hiperglikemią (w tym cukrzycy) ani nieprawidłowego stężenia glukozy we krwi w badaniach laboratoryjnych po zastosowaniu arypiprazolu i po podaniu placebo. U pacjentów leczonych arypiprazolem i innymi atypowymi przeciwpsychotycznymi produktami leczniczymi nie jest dostępne dokładne oszacowanie ryzyka działań niepożądanych związanych z hiperglikemią, które pozwoliłoby na bezpośrednie porównanie. U pacjentów leczonych jakimikolwiek przeciwpsychotycznymi produktami leczniczymi, w tym arypiprazolem, należy obserwować, czy nie występują objawy przedmiotowe i podmiotowe hiperglikemii (takie jak nadmierne pragnienie, wielomocz, nadmierne łaknienie i osłabienie), a u pacjentów z cukrzycą lub czynnikami ryzyka jej rozwoju należy regularnie monitorować pogorszenie kontroli glikemii (patrz punkt 4.8).
- CHPL leku o rpl_id: 100352300Specjalne środki ostrozności
Nadwrażliwość Po zastosowaniu arypiprazolu mogą wystąpić reakcje nadwrażliwości charakteryzujące się objawami uczulenia (patrz punkt 4.8). Zwiększenie masy ciała Obserwowane często u pacjentów ze schizofrenią i zaburzeniem afektywnym dwubiegunowym zwiększenie masy ciała zwykle spowodowane jest współistniejącymi chorobami, stosowaniem leków przeciwpsychotycznych, które powodują zwiększenie masy ciała, niewłaściwym stylem życia, i może prowadzić do ciężkich powikłań. Zwiększenie masy ciała obserwowano u pacjentów w okresie po wprowadzeniu arypiprazolu do obrotu. Jeśli występowało, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych nie wykazano, aby arypiprazol powodował klinicznie istotne zwiększenie masy ciała u dorosłych (patrz punkt 5.1), zaś w badaniach klinicznych z udziałem młodzieży z epizodem manii w przebiegu zaburzenia afektywnego dwubiegunowego stosowanie arypiprazolu wiązało się ze zwiększeniem masy ciała po 4 tygodniach leczenia.
- CHPL leku o rpl_id: 100352300Specjalne środki ostrozności
Zwiększenie masy ciała należy kontrolować u młodzieży z manią w przebiegu zaburzenia afektywnego dwubiegunowego. Jeśli jest ono znaczące klinicznie, należy rozważyć zmniejszenie dawki (patrz punkt 4.8). Dysfagia Zaburzenia kurczliwości mięśniówki przełyku i zachłyśnięcie wiązały się ze stosowaniem leków przeciwpsychotycznych, w tym arypiprazolu. Arypiprazol należy stosować ostrożnie u pacjentów z ryzykiem zachłystowego zapalenia płuc. Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Podczas przyjmowania arypiprazolu u pacjentów mogą występować zwiększone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy obejmują: zwiększenie popędu seksualnego, kompulsywną potrzebę wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania.
- CHPL leku o rpl_id: 100352300Specjalne środki ostrozności
Ważne, aby lekarze przepisujący lek pytali pacjentów lub opiekunów w szczególności o pojawienie się podczas leczenia arypiprazolem nowego lub zwiększonego popędu do hazardu, popędu seksualnego, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa lub kompulsywnego objadania się, lub innych popędów. Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu leku. Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Należy rozważyć zmianę dawki lub odstawienie leku, jeśli u pacjenta wystąpią takie popędy podczas przyjmowania arypiprazolu (patrz punkt 4.8). Pacjenci ze współistniejącym zespołem nadpobudliwości psychoruchowej z deficytem uwagi (ADHD) Mimo częstego współistnienia zaburzenia afektywnego dwubiegunowego typu I oraz zespołu ADHD, dane dotyczące bezpieczeństwa jednoczesnego stosowania arypiprazolu i stymulantów są bardzo ograniczone; dlatego należy zachować wyjątkową ostrożność podczas podawania tych produktów leczniczych jednocześnie.
- CHPL leku o rpl_id: 100352300Specjalne środki ostrozności
Upadki Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków. Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2). Aripiprazole Sandoz zawiera laktozę, sód, aspartam i alkohol benzylowy. Ten produkt leczniczy zawiera laktozę. Pacjenci z rzadką, wrodzoną nietolerancją galaktozy, brakiem laktazy lub zaburzeniami wchłaniania glukozy-galaktozy nie powinni stosować tego produktu leczniczego. Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg sodu) w tabletce ulegającej rozpadowi w jamie ustnej, to znaczy produkt leczniczy uznaje się za „wolny od sodu”. Tabletki 10 mg Ten produkt leczniczy zawiera 1,0 mg aspartamu w każdej tabletce ulegającej rozpadowi w jamie ustnej. Aspartam jest źródłem fenyloalaniny, która może być szkodliwa dla osób z fenyloketonurią.
- CHPL leku o rpl_id: 100352300Specjalne środki ostrozności
Ten produkt leczniczy zawiera do 0,0036 mg alkoholu benzylowego w każdej tabletce ulegającej rozpadowi w jamie ustnej. Alkohol benzylowy może powodować reakcje alergiczne. Duże objętości alkoholu benzylowego należy podawać z ostrożnością i tylko w razie konieczności, zwłaszcza u pacjentów z zaburzeniami czynności nerek lub wątroby z powodu ryzyka kumulacji toksyczności (kwasica metaboliczna). Tabletki 15 mg Ten produkt leczniczy zawiera 1,5 mg aspartamu w każdej tabletce ulegającej rozpadowi w jamie ustnej. Aspartam jest źródłem fenyloalaniny, która może być szkodliwa dla osób z fenyloketonurią. Ten produkt leczniczy zawiera do 0,0054 mg alkoholu benzylowego w każdej tabletce ulegającej rozpadowi w jamie ustnej. Alkohol benzylowy może powodować reakcje alergiczne. Duże objętości alkoholu benzylowego należy podawać z ostrożnością i tylko w razie konieczności, zwłaszcza u pacjentów z zaburzeniami czynności nerek lub wątroby z powodu ryzyka kumulacji toksyczności (kwasica metaboliczna).
- CHPL leku o rpl_id: 100352300Specjalne środki ostrozności
Tabletki 30 mg Ten produkt leczniczy zawiera 3,0 mg aspartamu w każdej tabletce ulegającej rozpadowi w jamie ustnej. Aspartam jest źródłem fenyloalaniny, która może być szkodliwa dla osób z fenyloketonurią. Ten produkt leczniczy zawiera do 0,0108 mg alkoholu benzylowego w każdej tabletce ulegającej rozpadowi w jamie ustnej. Alkohol benzylowy może powodować reakcje alergiczne. Duże objętości alkoholu benzylowego należy podawać z ostrożnością i tylko w razie konieczności, zwłaszcza u pacjentów z zaburzeniami czynności nerek lub wątroby z powodu ryzyka kumulacji toksyczności (kwasica metaboliczna).
- CHPL leku o rpl_id: 100352300Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na antagonistyczne działanie na receptor α₁- adrenergiczny, arypiprazol może nasilać działanie niektórych przeciwnadciśnieniowych produktów leczniczych. Ze względu na główne działanie arypiprazolu na OUN należy zachować ostrożność, jeśli arypiprazol jest podawany razem z alkoholem lub z innymi produktami leczniczymi działającymi na OUN, wywołującymi zbliżone działania niepożądane, takie jak sedacja (patrz punkt 4.8). Należy zachować ostrożność podczas jednoczesnego stosowania arypiprazolu i produktów leczniczych wydłużających odstęp QT lub powodujących zaburzenia elektrolitowe. Możliwy wpływ innych produktów leczniczych na arypiprazol Famotydyna, hamujący wydzielanie kwasu solnego w żołądku antagonista receptora H₂, zmniejsza szybkość wchłaniania arypiprazolu, jednak działanie to nie ma znaczenia klinicznego.
- CHPL leku o rpl_id: 100352300Interakcje
Arypiprazol jest metabolizowany w wielu procesach z udziałem izoenzymów CYP2D6 i CYP3A4, ale nie przez enzymy z grupy CYP1A, więc nie jest konieczna modyfikacja dawkowania u osób palących tytoń. Chinidyna i inne inhibitory CYP2D6 W badaniu klinicznym z udziałem zdrowych osób silny inhibitor izoenzymu CYP2D6 (chinidyna) zwiększał AUC arypiprazolu o 107% bez zmiany Cmₐₓ. Wartości AUC i Cmₐₓ dehydroarypiprazolu, czynnego metabolitu, zmniejszały się odpowiednio o 32% i 47%. Podczas jednoczesnego podawania z chinidyną dawkę arypiprazolu należy zmniejszyć do około połowy przepisanej dawki. Inne silne inhibitory izoenzymu CYP2D6, takie jak fluoksetyna i paroksetyna, mogą mieć podobne działanie i w takich sytuacjach należy podobnie zmniejszyć dawkę leku. Ketokonazol i inne inhibitory CYP3A4 W badaniu klinicznym z udziałem zdrowych osób silny inhibitor CYP3A4 (ketokonazol) zwiększał wartości AUC i Cmₐₓ arypiprazolu odpowiednio o 63% i 37%, zaś AUC i Cmₐₓ dehydroarypiprazolu odpowiednio o 77% i 43%.
- CHPL leku o rpl_id: 100352300Interakcje
U osób wolno metabolizujących z udziałem CYP2D6 stosowanie silnych inhibitorów CYP3A4 może powodować zwiększenie stężenia w osoczu jednocześnie podawanego arypiprazolu w porównaniu z osobami o szybkim metabolizmie z udziałem CYP2D6. Jeśli rozważane jest jednoczesne stosowanie ketokonazolu albo innych silnych inhibitorów CYP3A4 z arypiprazolem, zakładane korzyści z leczenia powinny przeważyć potencjalne ryzyko dla pacjenta. W przypadku jednoczesnego stosowania ketokonazolu z arypiprazolem, przepisaną dawkę arypiprazolu należy zmniejszyć do około połowy. Inne silne inhibitory CYP3A4, takie jak itrakonazol i inhibitory proteazy HIV, mogą mieć podobne działanie i w takich przypadkach należy podobnie zmniejszyć dawkowanie (patrz punkt 4.2). Po odstawieniu inhibitora CYP2D6 lub CYP3A4 dawkę arypiprazolu należy zwiększyć do tej, jaką stosowano przed rozpoczęciem terapii skojarzonej. Jeśli słabe inhibitory CYP3A4 (np. diltiazem) lub CYP2D6 (np.
- CHPL leku o rpl_id: 100352300Interakcje
escytalopram) stosowane są jednocześnie z arypiprazolem, można spodziewać się niewielkiego zwiększenia jego stężenia w osoczu. Karbamazepina i inne leki indukujące CYP3A4 Po jednoczesnym podaniu karbamazepiny, silnego induktora CYP3A4, z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnie geometryczne Cmₐₓ i AUC arypiprazolu zmniejszyły się odpowiednio o 68% i 73%, w porównaniu z wartościami, gdy arypiprazol (30 mg) stosowany był w monoterapii. Podobnie, średnie geometryczne Cmₐₓ i AUC dla dehydroarypiprazolu po jednoczesnym podaniu karbamazepiny były mniejsze o odpowiednio 69% i 71% niż po zastosowaniu arypiprazolu w monoterapii. Dawkę arypiprazolu należy podwoić, gdy jednocześnie podaje się karbamazepinę. Można oczekiwać, że jednoczesne podawanie arypiprazolu i innych silnych induktorów CYP3A4 (takich jak ryfampicyna, ryfabutyna, fenytoina, fenobarbital, prymidon, efawirenz, newirapina i ziele dziurawca) będzie działać podobnie, dlatego należy podobnie zwiększyć dawkę.
- CHPL leku o rpl_id: 100352300Interakcje
Po odstawieniu silnego induktora CYP3A4 dawkę arypiprazolu należy zmniejszyć do zalecanej. Walproinian i lit Skojarzone stosowanie arypiprazolu z walproinianem lub litem nie powodowało żadnych istotnych klinicznie zmian stężenia arypiprazolu, dlatego nie jest konieczne dostosowanie dawki podczas podawania walproinianu lub litu z arypiprazolem. Możliwy wpływ arypiprazolu na inne produkty lecznicze W czasie badań klinicznych arypiprazol w dawce od 10 do 30 mg na dobę nie wpływał istotnie na metabolizm substratów CYP2D6 (współczynnik dekstrometorfan/3-metoksymorfinan), CYP2C9 (warfaryna), CYP2C19 (omeprazol) i CYP3A4 (dekstrometorfan). Ponadto w warunkach in vitro arypiprazol i dehydroarypiprazol nie zmieniały metabolizmu zachodzącego z udziałem CYP1A2. Dlatego istotne klinicznie interakcje między produktami leczniczymi metabolizowanymi przez te enzymy są mało prawdopodobne.
- CHPL leku o rpl_id: 100352300Interakcje
Arypiprazol nie zmieniał istotnie klinicznie stężenia jednocześnie podawanego walproinianu, litu lub lamotryginy. Zespół serotoninowy U pacjentów przyjmujących arypiprazol obserwowano przypadki zespołu serotoninowego, a możliwe objawy przedmiotowe oraz podmiotowe mogą wystąpić szczególnie podczas jednoczesnego stosowania innych serotoninergicznych produktów leczniczych, takich jak selektywne inhibitory wychwytu zwrotnego serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny (SSRI/SNRI) lub produktów leczniczych, które zwiększają stężenie arypiprazolu (patrz punkt 4.8).
- CHPL leku o rpl_id: 100352300Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie przeprowadzono odpowiednich i dobrze kontrolowanych badań z zastosowaniem arypiprazolu u kobiet w ciąży. Notowano wprawdzie występowanie wad wrodzonych, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. Na podstawie wyników badań na zwierzętach nie można wykluczyć możliwości szkodliwego wpływu leku na rozwój płodu (patrz punkt 5.3). Należy zalecić pacjentkom, aby poinformowały lekarza, jeśli zajdą w ciążę lub planują ciążę w trakcie leczenia arypiprazolem. Ze względu na niewystarczające dane dotyczące bezpieczeństwa stosowania u ludzi i budzące wątpliwości wyniki badań toksycznego wpływu na reprodukcję u zwierząt, produktu leczniczego nie należy stosować w okresie ciąży, chyba że spodziewane korzyści wyraźnie przewyższają możliwe ryzyko dla płodu.
- CHPL leku o rpl_id: 100352300Wpływ na płodność, ciążę i laktację
Noworodki narażone na działanie leków przeciwpsychotycznych (w tym arypiprazol) w czasie trzeciego trymestru ciąży obarczone są ryzykiem wystąpienia działań niepożądanych, w tym zaburzeń pozapiramidowych i (lub) objawów odstawienia o różnym nasileniu i czasie trwania po porodzie. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane ze ssaniem. Dlatego stan noworodków należy uważnie kontrolować (patrz punkt 4.8). Karmienie piersi? Arypiprazol i (lub) jego metabolity przenikają do mleka kobiecego. Należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać/nie podejmować podawania arypiprazolu, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem na reprodukcję.
- CHPL leku o rpl_id: 100352300Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe, senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku o rpl_id: 100352300Działania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Najczęściej notowanymi działaniami niepożądanymi w kontrolowanych placebo badaniach są akatyzja i nudności; każde występuje u więcej niż 3% pacjentów otrzymujących doustnie arypiprazol. Tabelaryczne zestawienie działań niepożądanych: Częstość działań niepożądanych związanych z leczeniem arypiprazolem podano w poniższej tabeli. Dane w tabeli oparto na działaniach niepożądanych zgłaszanych podczas badań klinicznych i (lub) po wprowadzeniu arypiprazolu do obrotu. Wszystkie działania niepożądane wymieniono zgodnie z klasyfikacją układów i narządów oraz częstością: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000) i częstość nieznana (nie może być określona na podstawie dostępnych danych). W obrębie każdej grupy częstości działania niepożądane wymieniono zgodnie z malejącą ciężkością.
- CHPL leku o rpl_id: 100352300Działania niepożądane
Zaburzenia krwi i układu chłonnego Zaburzenia układu immunologicznego Zaburzenia endokrynologiczne Zaburzenia metabolizmu i odżywiania Zaburzenia psychiczne Zaburzenia układu nerwowego Zaburzenia oka Zaburzenia serca Często Cukrzyca Bezsenność, lęk, niepokój (zwłaszcza ruchowy) Akatyzja, zaburzenia pozapiramidowe, drżenie, bóle głowy, uspokojenie, senność, zawroty głowy Nieostre widzenie Niezbyt często Hiperprolaktynemia Hiperglikemia Depresja, hiperseksualność Późne dyskinezy, Dystonia, Zespół niespokojnych nóg Podwójne widzenie, światłowstręt Tachykardia Częstość nieznana Leukopenia, neutropenia, małopłytkowość Reakcja alergiczna (np. reakcja anafilaktyczna, obrzęk naczynioruchowy, w tym opuchnięcie i obrzęk języka, obrzęk twarzy, alergiczny świąd lub pokrzywka) Śpiączka hiperosmotyczna, kwasica ketonowa Hiponatremia, jadłowstręt Próby samobójcze, myśli samobójcze i dokonane samobójstwo (patrz punkt 4.4), patologiczne uprawianie hazardu, zaburzenia kontroli impulsów, obżarstwo, kompulsywna potrzeba wydawania pieniędzy, poriomania, agresja, pobudzenie, nerwowość Złośliwy zespół neuroleptyczny, drgawki typu grand mal, zespół serotoninowy, zaburzenia mowy Napad przymusowego patrzenia z rotacją gałek ocznych Nagły niewyjaśniony zgon, zaburzenia rytmu serca typu torsade Zaburzenia naczyniowe Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zaburzenia żołądka i jelit Zaburzenia wątroby i dróg żółciowych Zaburzenia skóry i tkanki podskórnej Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Zaburzenia nerek i dróg moczowych Ciąża, połóg i okres okołoporodowy Zaburzenia ogólne i stany w miejscu podania Badania diagnostyczne Zmęczenie Zaburzenia termoregulacji (np.
- CHPL leku o rpl_id: 100352300Działania niepożądane
hipotermia, gorączka), ból w klatce piersiowej, obrzęki obwodowe Zmniejszenie masy ciała Zwiększenie masy ciała Zwiększona aktywność aminotransferazy alaninowej (AlAT), Zwiększona aktywność aminotransferazy asparaginianowej (AspAT), Zwiększona aktywność gamma-glutamylotransferazy (GGT), Zwiększona aktywność fosfatazy zasadowej Wydłużenie odstępu QT Zwiększone stężenie glukozy we krwi, zwiększone stężenie glikowanej hemoglobiny, wahania stężenia glukozy we krwi, zwiększona aktywność kinazy kreatynowej Opis wybranych działań niepożądanych Dorośli Objawy pozapiramidowe (ang. EPS) Schizofrenia: w długotrwałym, 52-tygodniowym, kontrolowanym badaniu, częstość EPS (w tym parkinsonizm, akatyzja, dystonia i dyskineza) u pacjentów leczonych arypiprazolem była ogólnie mniejsza (25,8%) niż u pacjentów leczonych haloperydolem (57,3%).
- CHPL leku o rpl_id: 100352300Działania niepożądane
W długotrwałym, 26-tygodniowym, kontrolowanym placebo badaniu, częstość EPS u pacjentów leczonych arypiprazolem wynosiła 19%, a w grupie placebo 13,1%. W innym długotrwałym, 26-tygodniowym, kontrolowanym badaniu częstość EPS u pacjentów leczonych arypiprazolem wynosiła 14,8%, a u pacjentów otrzymujących olanzapinę 15,1%. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I: w trwającym 12 tygodni kontrolowanym badaniu przypadki EPS stwierdzano u 23,5% pacjentów leczonych arypiprazolem i u 53,3% pacjentów leczonych haloperydolem. W innym 12-tygodniowym badaniu przypadki EPS stwierdzano u 26,6% pacjentów leczonych arypiprazolem i u 17,6% pacjentów leczonych litem. W długotrwałym, 26-tygodniowym, kontrolowanym placebo badaniu w leczeniu podtrzymującym, przypadki EPS stwierdzano u 18,2 % pacjentów leczonych arypiprazolem i u 15,7% pacjentów otrzymujących placebo.
- CHPL leku o rpl_id: 100352300Działania niepożądane
Akatyzja W kontrolowanych placebo badaniach akatyzja w przebiegu zaburzenia afektywnego dwubiegunowego występowała u 12,1% pacjentów leczonych arypiprazolem i u 3,2% pacjentów otrzymujących placebo, zaś w przebiegu schizofrenii u 6,2% pacjentów otrzymujących arypiprazol i 3,0% w grupie placebo. Dystonia Efekt klasy terapeutycznej - objawy dystonii, długotrwałe nieprawidłowe skurcze grup mięśni, mogą występować u wrażliwych pacjentów w ciągu pierwszych kilku dni leczenia. Do objawów dystonii należą: skurcze mięśni szyi, czasami postępujące do ucisku w gardle, trudności w połykaniu, trudności w oddychaniu i (lub) zaburzenia ruchów języka. Chociaż objawy te mogą występować po zastosowaniu małych dawek, występują częściej i z większym nasileniem podczas stosowania przeciwpsychotycznych produktów leczniczych pierwszej generacji w dużych mocach i większych dawkach. Zwiększone ryzyko ostrej dystonii obserwowano u mężczyzn i młodszych grup wiekowych.
- CHPL leku o rpl_id: 100352300Działania niepożądane
Prolaktyna W trakcie badań klinicznych dotyczących stosowania arypiprazolu w zatwierdzonych wskazaniach oraz w okresie po wprowadzeniu do obrotu obserwowano zarówno zwiększenie, jak i zmniejszenie stężenia prolaktyny w surowicy w porównaniu z wartościami sprzed leczenia (patrz punkt 5.1). Parametry laboratoryjne Porównanie odsetka pacjentów otrzymujących arypiprazol lub placebo, u których wystąpiły potencjalnie istotne klinicznie zmiany wartości rutynowych parametrów laboratoryjnych i wskaźników lipidowych (patrz punkt 5.1), nie wykazało ważnych z medycznego punktu widzenia różnic. Zwiększenie aktywności CK (kinazy kreatynowej), na ogół przemijające i bezobjawowe, obserwowano u 3,5% pacjentów leczonych arypiprazolem w porównaniu z 2,0% pacjentów otrzymujących placebo. Dzieci i młodzież Schizofrenia u młodzieży w wieku 15 lat i starszej W krótkotrwałym, kontrolowanym placebo badaniu z udziałem 302 nastolatków (w wieku 13-17 lat) ze schizofrenią, częstość i rodzaj działań niepożądanych były podobne do występujących u dorosłych, z wyjątkiem następujących działań niepożądanych zgłaszanych częściej u nastolatków otrzymujących arypiprazol niż u dorosłych otrzymujących arypiprazol (i częściej niż placebo): senność/sedacja i zaburzenia pozapiramidowe zgłaszane bardzo często (≥1/10) oraz suchość w jamie ustnej, zwiększony apetyt, niedociśnienie ortostatyczne zgłaszane często (≥1/100, <1/10).
- CHPL leku o rpl_id: 100352300Działania niepożądane
Profil bezpieczeństwa w otwartym, 26-tygodniowym badaniu był podobny do obserwowanego w krótkotrwałym badaniu z kontrolą placebo. Profil bezpieczeństwa w długotrwałym, kontrolowanym badaniu z podwójnie ślepą próbą był również podobny, a wyjątek stanowiły następujące reakcje, które zgłaszano częściej niż u dzieci i młodzieży otrzymujących placebo i które występowały często (≥1/100 do <1/10): zmniejszenie masy ciała, zwiększenie stężenia insuliny we krwi, zaburzenia rytmu serca i leukopenia. W łącznej populacji nastolatków (w wieku 13-17 lat) ze schizofrenią leczonych do 2 lat, przypadki małego stężenia prolaktyny w surowicy stwierdzono u 29,5% dziewcząt (<3 ng/ml) i 48,3% chłopców (<2 ng/ml). W grupie młodzieży (w wieku 13-17 lat) ze schizofrenią, otrzymującej arypiprazol w dawce od 5 do 30 mg przez okres do 72 miesięcy, małe stężenie prolaktyny w surowicy odnotowano u 25,6% pacjentek (<3 ng/ml) i u 45,0% pacjentów (<2 ng/ml).
- CHPL leku o rpl_id: 100352300Działania niepożądane
Podczas dwóch długotrwałych badań z udziałem młodzieży (13-17 lat) ze schizofrenią i pacjentów z chorobą afektywną dwubiegunową leczonych arypiprazolem częstość, z jaką notowano małe stężenia prolaktyny w surowicy u kobiet (<3 ng/ml) i mężczyzn (<2 ng/ml), wynosiła odpowiednio 37,0% i 59,4%. Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u młodzieży w wieku 13 lat i starszej Częstość i rodzaj działań niepożądanych u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I były podobne do występujących u dorosłych, z wyjątkiem następujących reakcji: bardzo często (≥1/10) senność (23,0%), zaburzenia pozapiramidowe (18,4%), akatyzja (16,0%) i zmęczenie (11,8%); często (≥1/100 do <1/10) ból w nadbrzuszu, zwiększenie częstości akcji serca, zwiększenie masy ciała, zwiększenie apetytu, drżenie mięśni oraz dyskineza.
- CHPL leku o rpl_id: 100352300Działania niepożądane
Następujące działania niepożądane miały prawdopodobnie związek z zastosowaną dawką: zaburzenia pozapiramidowe (częstość dla dawki 10 mg wynosiła 9,1%, dla dawki 30 mg 28,8%, dla placebo 1,7%) i akatyzja (częstość dla dawki 10 mg wynosiła 12,1%, dla dawki 30 mg 20,3%, dla placebo 1,7%). Średnie zmiany masy ciała u młodzieży z zaburzeniem afektywnym dwubiegunowym typu I po 12 i 30 tygodniach leczenia wynosiły u pacjentów otrzymujących arypiprazol 2,4 kg i 5,8 kg, a w grupie placebo 0,2 kg i 2,3 kg. U dzieci i młodzieży senność oraz zmęczenie obserwowano częściej u pacjentów z zaburzeniem afektywnym dwubiegunowym niż u pacjentów ze schizofrenią. W populacji dzieci i młodzieży z zaburzeniem afektywnym dwubiegunowym (w wieku 10-17 lat), leczonych do 30 tygodni, małe stężenie prolaktyny w surowicy stwierdzono u 28,0% dziewcząt (<3 ng/ml) i 53,3% chłopców (<2 ng/ml).
- CHPL leku o rpl_id: 100352300Działania niepożądane
Patologiczne uzależnienie od hazardu i inne zaburzenia kontroli impulsów Patologiczne uzależnienie od hazardu, hiperseksualność, kompulsywna potrzeba wydawania pieniędzy i obżarstwo lub kompulsywne objadanie się mogą wystąpić u pacjentów leczonych arypiprazolem (patrz punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al.
- CHPL leku o rpl_id: 100352300Działania niepożądane
Jerozolimskie 181C, 02-222 Warszawa tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku o rpl_id: 100352300Przedawkowanie
4.9 Przedawkowanie Objawy przedmiotowe i podmiotowe W badaniach klinicznych i po wprowadzeniu produktu do obrotu odnotowano przypadkowe bądź zamierzone przedawkowanie samego arypiprazolu przez dorosłych pacjentów po oszacowanej dawce do 1260 mg, bez przypadków zgonu. Potencjalnie ważne medycznie objawy przedmiotowe i podmiotowe obejmowały: letarg, zwiększone ciśnienie tętnicze, senność, tachykardię, nudności, wymioty i biegunkę. Ponadto otrzymano zgłoszenia przypadkowego przedawkowania samego arypiprazolu (do 195 mg) u dzieci, bez przypadku zgonu. Potencjalnie istotne klinicznie objawy przedmiotowe i podmiotowe obejmowały senność, przemijającą utratę przytomności i objawy pozapiramidowe. Postępowanie po przedawkowaniu W przypadku przedawkowania należy zastosować leczenie podtrzymujące, utrzymanie drożności dróg oddechowych, dotlenianie i wentylację oraz leczenie objawowe. Należy wziąć pod uwagę możliwość wpływu wielu produktów leczniczych.
- CHPL leku o rpl_id: 100352300Przedawkowanie
Z tego względu należy niezwłocznie rozpocząć monitorowanie czynności układu krążenia, obejmujące stałe monitorowanie zapisu elektrokardiograficznego w celu wykrycia możliwych zaburzeń rytmu serca. Każdy potwierdzony lub podejrzewany przypadek przedawkowania arypiprazolu należy objąć ścisłą kontrolą i prowadzić ją do czasu uzyskania poprawy stanu pacjenta. Węgiel aktywny (50 g) podany w godzinę po zażyciu arypiprazolu zmniejszał Cmₐₓ arypiprazolu o około 41% i AUC o około 51%, co wskazuje, że może być skuteczny w leczeniu przedawkowania. Hemodializa Mimo braku informacji dotyczących wpływu hemodializy w leczeniu przedawkowania arypiprazolu, jej skuteczność jest mało prawdopodobna ze względu na znaczny stopień wiązania arypiprazolu z białkami osocza.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12 Mechanizm działania Uważa się, że skuteczność arypiprazolu w leczeniu schizofrenii i zaburzenia afektywnego dwubiegunowego typu I wynika ze skojarzenia częściowego działania agonistycznego wobec receptora dopaminowego D₂ i serotoninowego 5HT₁ₐ oraz antagonistycznego wobec receptora serotoninowego 5HT₂ₐ. Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D₂ i D₃, serotoninowych 5HT₁ₐ i 5HT₂ₐ oraz umiarkowane powinowactwo do receptorów dopaminowych D₄, serotoninowych 5HT₂c i 5HT₇, a także adrenergicznych alfa-1 i histaminowych H₁.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
Wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Jak wykazała pozytonowa tomografia emisyjna, arypiprazol w dawkach od 0,5 do 30 mg podawanych zdrowym osobom raz na dobę przez 2 tygodnie powodował zależne od dawki zmniejszenie wiązania rakloprydu znakowanego ¹¹C, ligandu receptora D₂/D₃, w jądrze ogoniastym i skorupie. Skuteczność kliniczna i bezpieczeństwo stosowania Dorośli Schizofrenia W trzech krótkotrwałych (4 do 6 tygodni), kontrolowanych placebo badaniach z udziałem 1228 dorosłych pacjentów ze schizofrenią, u których stwierdzono objawy pozytywne lub negatywne, podawanie arypiprazolu powodowało istotnie większą poprawę w zakresie objawów psychotycznych niż placebo.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
U dorosłych pacjentów, u których obserwowano wstępną dobrą reakcję na lek, arypiprazol skutecznie podtrzymywał poprawę kliniczną podczas kontynuacji leczenia. W badaniu z grupą kontrolną przyjmującą haloperydol odsetek pacjentów, u których udało się utrzymać dobrą reakcję na produkt leczniczy w ciągu 52 tygodni, był podobny w obu grupach (arypiprazol 77% i haloperydol 73%). Badanie ukończyła istotnie większa liczba pacjentów leczonych arypiprazolem (43%) niż haloperydolem (30%). Wyniki uzyskane w skalach ocen stosowanych jako wtórne punkty końcowe badania, w tym w skali PANSS i w skali oceny depresji MADRS (Montgomery-Asberg Depression Rating Scale), wskazują na istotną przewagę nad haloperydolem. W trwającym 26 tygodni kontrolowanym placebo badaniu z udziałem dorosłych pacjentów z ustabilizowaną przewlekłą schizofrenią stwierdzono, że arypiprazol w większym niż placebo stopniu redukował częstość nawrotów (34% w grupie leczonych arypiprazolem i 57% w grupie otrzymującej placebo).
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
Zwiększenie masy ciała Wyniki badań klinicznych nie wskazują, aby arypiprazol powodował klinicznie istotne zwiększenie masy ciała. W trwającym 26 tygodni, wieloośrodkowym badaniu z podwójnie ślepą próbą i grupą kontrolną otrzymującą olanzapinę udział wzięło 314 dorosłych pacjentów ze schizofrenią, a pierwszorzędowym punktem końcowym badania był przyrost masy ciała. U znacząco mniejszej grupy pacjentów stwierdzono zwiększenie masy ciała o ≥7% wobec wartości początkowej (tzn. przyrost masy ciała o co najmniej 5,6 kg przy średniej początkowej masie wynoszącej około 80,5 kg) w grupie otrzymującej arypiprazol (n=18 lub 13% pacjentów, których wyniki poddawano analizie) w porównaniu z grupą otrzymującą olanzapinę (n=45 lub 33% pacjentów, których wyniki poddawano analizie). Parametry lipidowe W zbiorczej analizie parametrów lipidowych pochodzących z kontrolowanych placebo badań klinicznych u dorosłych nie wykazano, aby arypiprazol powodował klinicznie istotne zmiany stężenia cholesterolu całkowitego, triglicerydów, cholesterolu HDL i cholesterolu LDL.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
Prolaktyna Stężenia prolaktyny oceniono podczas wszystkich badań z zastosowaniem wszystkich dawek arypiprazolu (n=28 242). Częstość hiperprolaktynemii lub zwiększenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem (0,3%) była podobna do częstości hiperprolaktynemii w grupie otrzymującej placebo (0,2%). U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 42 dni, a mediana czasu trwania wynosiła 34 dni. Częstość hiperprolaktynemii lub zmniejszenia stężenia prolaktyny w surowicy u pacjentów leczonych arypiprazolem wynosiła 0,4% w porównaniu z 0,02% w grupie otrzymującej placebo. U pacjentów otrzymujących arypiprazol mediana czasu do wystąpienia objawu wynosiła 30 dni, a mediana czasu trwania wynosiła 194 dni. Epizody maniakalne w przebiegu zaburzenia afektywnego dwubiegunowego typu I W dwóch 3-tygodniowych, kontrolowanych placebo badaniach z zastosowaniem zmiennej dawki, z udziałem pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol w monoterapii znacząco bardziej skutecznie niż placebo zmniejszał objawy maniakalne w ciągu 3 tygodni.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
Badania te obejmowały pacjentów z objawami lub bez objawów psychotycznych oraz pacjentów z szybką zmianą fazy lub bez szybkiej zmiany fazy (przebieg typu rapid-cycling). W jednym 3-tygodniowym badaniu kontrolowanym placebo z zastosowaniem stałej dawki w monoterapii u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, arypiprazol nie był bardziej skuteczny niż placebo. W dwóch trwających 12 tygodni badaniach kontrolowanych placebo oraz innymi substancjami czynnymi u pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, arypiprazol był bardziej skuteczny niż placebo w 3. tygodniu badania, a wynik leczenia podtrzymującego był w 12. tygodniu badania porównywalny z wynikiem leczenia litem lub haloperydolem. Odsetek pacjentów, u których uzyskano remisję objawów maniakalnych po zastosowaniu arypiprazolu, litu lub haloperydolu, był w 12.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
tygodniu badania porównywalny. W 6-tygodniowym, kontrolowanym placebo badaniu z udziałem pacjentów z epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I z objawami lub bez objawów psychotycznych, którzy częściowo nie reagowali na monoterapię litem lub walproinianem przez 2 tygodnie przy terapeutycznych stężeniach w surowicy, zastosowanie arypiprazolu jako dodatkowego leku spowodowało większą skuteczność leczenia w celu redukcji objawów maniakalnych niż stosowanie litu lub walproinianu w monoterapii. W 26-tygodniowym, kontrolowanym placebo, rozszerzonym o 74 tygodnie badaniu z udziałem pacjentów z objawami maniakalnymi, którzy osiągnęli remisję w trakcie stosowania arypiprazolu w czasie fazy stabilizacji przed randomizacją, arypiprazol skuteczniej niż placebo zapobiegał nawrotowi choroby dwubiegunowej, głównie w zapobieganiu nawrotowi objawów maniakalnych, ale nie wykazał przewagi nad placebo w zapobieganiu nawrotowi depresji.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
W 52-tygodniowym, kontrolowanym placebo badaniu u pacjentów z trwającym epizodem maniakalnym lub mieszanym w przebiegu zaburzenia afektywnego dwubiegunowego typu I, którzy osiągnęli trwałą remisję (w skali oceny manii Younga Y-MRS oraz w skali oceny depresji MADRS całkowita liczba punktów ≤12) w trakcie stosowania arypiprazolu (w dawce od 10 mg na dobę do 30 mg na dobę) w skojarzeniu z litem lub walproinianem przez 12 kolejnych tygodni, połączenie z arypiprazolem miało przewagę nad placebo w zapobieganiu nawrotowi choroby afektywnej dwubiegunowej (współczynnik ryzyka 0,54), zmniejszając ryzyko o 46% i w zapobieganiu nawrotom manii, zmniejszając ryzyko o 65% (współczynnik ryzyka 0,35), ale nie wykazało przewagi nad placebo w zapobieganiu nawrotowi depresji. Leczenie skojarzone z arypiprazolem wykazało przewagę wobec placebo w przypadku drugorzędowego punktu oceny, skali ogólnego wrażenia klinicznego (ang. CGI-BP) nasilenia choroby (mania).
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
W tym badaniu pacjenci zostali przydzieleni przez badaczy do badania prowadzonego metodą próby otwartej z zastosowaniem litu lub walproinianu w monoterapii, w celu oceny częściowego braku odpowiedzi. Stan pacjentów był stabilizowany przez co najmniej 12 kolejnych tygodni za pomocą skojarzenia arypiprazolu i stosowanego wcześniej stabilizatora nastroju. Pacjenci stabilni byli następnie przydzielani losowo do grupy otrzymującej w dalszym ciągu ten sam stabilizator nastroju z arypiprazolem lub z placebo w badaniu metodą podwójnie ślepej próby. W fazie randomizowanej oceniano cztery podgrupy stabilizatora nastroju: arypiprazol + lit; arypiprazol + walproinian; placebo + lit; placebo + walproinian. Współczynniki Kaplana-Meiera dla nawrotu jakiegokolwiek zaburzenia nastroju w przypadku terapii skojarzonej były następujące: 16% dla grupy stosującej arypiprazol + lit i 18% dla grupy arypiprazol + walproinian, w porównaniu do 45% dla grupy placebo + lit i 19% dla grupy placebo + walproinian.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
Dzieci i młodzież Schizofrenia u młodzieży W 6-tygodniowym kontrolowanym placebo badaniu, w którym udział wzięło 302 nastoletnich pacjentów ze schizofrenią (w wieku 13-17 lat), u których stwierdzano objawy pozytywne lub negatywne, stosowanie arypiprazolu wiązało się ze statystycznie istotnie większą poprawą w zakresie objawów psychotycznych niż placebo. W analizie podgrupy pacjentów w wieku między 15 a 17 lat (stanowiącej 74% całkowitej populacji włączonej do badania), obserwowano utrzymywanie się działania w czasie trwania 26-tygodniowej otwartej fazy badania. W trwającym 60-89 tygodni randomizowanym, kontrolowanym placebo badaniu z podwójnie ślepą próbą, które prowadzono z udziałem młodzieży ze schizofrenią (n=146; w wieku 13-17 lat), stwierdzono statystycznie znamienną różnicę w zakresie odsetka nawrotów objawów psychotycznych między grupą otrzymującą arypiprazol (19,39%) a grupą otrzymującą placebo (37,5%).
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
Punkt szacunkowy współczynnika ryzyka (HR) w całej populacji wynosił 0,461 (95% przedział ufności, 0,242-0,879). W analizach w podgrupach punkt szacunkowy współczynnika ryzyka wynosił 0,495 u uczestników w wieku od 13 do 14 lat w porównaniu z 0,454 u uczestników w wieku od 15 do 17 lat. Jednak ocena szacunkowa współczynnika ryzyka w grupie młodszych uczestników (13-14 lat) nie była precyzyjna, odzwierciedlając mniejszą liczebność grupy (arypiprazol, n=29; placebo, n=12) i przedział ufności dla tej oceny szacunkowej (wynoszący od 0,151 do 1,628) uniemożliwiał wyciągnięcie wniosków odnośnie występowania wyniku leczenia. Natomiast 95% przedział ufności dla współczynnika ryzyka w podgrupie starszych uczestników (arypiprazol, n=69; placebo, n=36) wynosił od 0,242 do 0,879 i dlatego można wyciągnąć u nich wnioski odnośnie wyników leczenia.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
Epizody maniakalne w zaburzeniu afektywnym dwubiegunowym typu I u dzieci i młodzieży Arypiprazol badano w 30-tygodniowym badaniu kontrolowanym placebo, w którym udział wzięło 296 dzieci i młodzieży (w wieku 10-17 lat) spełniającej kryteria diagnostyczne według DSM-IV dla zaburzenia afektywnego dwubiegunowego typu I z epizodami maniakalnymi lub mieszanymi z objawami psychotycznymi lub bez tych objawów i z wynikiem ≥20 w skali manii według Younga (Y-MRS), jako wartością wyjściową. Spośród pacjentów włączonych do podstawowej analizy skuteczności, u 139 pacjentów rozpoznano aktualnie współistniejący ADHD. Wykazano przewagę arypiprazolu nad placebo w odniesieniu do zmiany wartości w skali wg Y-MRS wobec wartości wyjściowej w 4. oraz 12. tygodniu. W dalszych analizach przewaga nad placebo była bardziej wyraźna u pacjentów ze współistniejącym zespołem ADHD w porównaniu z pacjentami bez ADHD, gdzie nie zaobserwowano różnicy w stosunku do placebo. Zapobieganie nawrotom nie zostało określone.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
Do najczęstszych zdarzeń niepożądanych występujących w trakcie leczenia u pacjentów otrzymujących dawkę 30 mg należały zaburzenia pozapiramidowe (28,3%), senność (27,3%), ból głowy (23,2%) oraz nudności (14,1%). Średni przyrost masy ciała w 30-tygodniowych okresie leczenia wynosił 2,9 kg w porównaniu z 0,98 kg u pacjentów, u których stosowano placebo. Drażliwość związana z zaburzeniami autystycznymi u dzieci i młodzieży (patrz punkt 4.2) U pacjentów w wieku od 6 do 17 lat arypiprazol badano w dwóch 8-tygodniowych badaniach kontrolowanych placebo [w jednym badaniu stosowano zmienną dawkę (2-15 mg/dobę), a w drugim stałą dawkę (5, 10 lub 15 mg/dobę)] oraz w jednym 52-tygodniowym badaniu otwartym. Dawkowanie w tych badaniach rozpoczynano od 2 mg/dobę, po tygodniu zwiększanych do 5 mg/dobę, a następnie zwiększanych w odstępach tygodniowych o 5 mg/dobę do czasu osiągnięcia dawki docelowej. Ponad 75% pacjentów miało mniej niż 13 lat.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
Wykazano statystycznie większą niż placebo skuteczność arypiprazolu w podskali dotyczącej drażliwości Listy Zachowań Aberracyjnych (ang. Aberrant Behaviour Checklist Irritability subscale). Jednak nie ustalono znaczenia klinicznego tej obserwacji. Profil bezpieczeństwa obejmował zwiększenie masy ciała i zmianę stężenia prolaktyny. Czas trwania długoterminowego badania dotyczącego bezpieczeństwa był ograniczony do 52 tygodni. W zebranych badaniach małe stężenie prolaktyny u leczonych arypiprazolem dziewcząt (<3 ng/ml) i chłopców (<2 ng/ml) stwierdzono u, odpowiednio, 27/46 (58,7%) i 258/298 (86,6%) pacjentów. W badaniach kontrolowanych placebo średnie zwiększenie masy ciała wynosiło 0,4 kg w grupie placebo i 1,6 kg w grupie arypiprazolu. Arypiprazol badano także w kontrolowanym placebo, długoterminowym badaniu podtrzymującym.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
Po 13-26-tygodniowej stabilizacji z zastosowaniem arypiprazolu (w dawkach 2-15 mg/dobę) pacjenci z trwałą odpowiedzią albo kontynuowali leczenie arypiprazolem, albo otrzymywali placebo przez kolejne 16 tygodni. Współczynniki Kaplana-Meiera dla nawrotu w tygodniu 16. były następujące: 35% dla grupy stosującej arypiprazol oraz 52% dla grupy placebo; współczynnik ryzyka nawrotu w ciągu 16 tygodni (arypiprazol/placebo) wynosił 0,57 (różnica nieistotna statystycznie). Średnie zwiększenie masy ciała w fazie stabilizacji (do 26 tygodni) z zastosowaniem arypiprazolu wynosiło 3,2 kg, natomiast w drugiej fazie badania (16 tygodni) obserwowano dalszy średni wzrost o 2,2 kg dla arypiprazolu w porównaniu z 0,6 kg dla placebo. Objawy pozapiramidowe były zgłaszane głównie w fazie stabilizacji, u 17% pacjentów, z drgawkami stanowiącymi 6,5%.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
Tiki związane z zespołem Tourette’a u dzieci i młodzieży (patrz punkt 4.2) Skuteczność arypiprazolu badano u dzieci i młodzieży z zespołem Tourette’a (arypiprazol: n=99, placebo: n=44) w trwającym 8 tygodni, randomizowanym, kontrolowanym placebo badaniu z podwójnie ślepą próbą w schemacie leczenia z użyciem stałej dawki zależnej od masy ciała od 5 mg/dobę do 20 mg/dobę i dawki początkowej wynoszącej 2 mg. Pacjenci byli w wieku 7-17 lat i przed rozpoczęciem leczenia uzyskali średni wynik 30 na łącznej skali tików w Globalnej Skali Nasilenia Tików z Yale (Total Tic Score on the Yale Global Tic Severity Scale, TTS-YGTSS). Grupa pacjentów otrzymująca arypiprazol wykazywała poprawę mierzoną zmianą wyniku na skali TTS-YGTSS od pomiaru początkowego do pomiaru w 8. tygodniu leczenia, która wynosiła 13,35 w grupie otrzymującej małą dawkę (5 mg lub 10 mg) i 16,94 w grupie otrzymującej dużą dawkę (10 mg lub 20 mg) w porównaniu z poprawą wynoszącą 7,09 u pacjentów otrzymujących placebo.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
W trwającym 10 tygodni randomizowanym, kontrolowanym placebo badaniu z podwójnie ślepą próbą, przeprowadzonym w Korei Południowej, oceniano skuteczność zmiennej dawki arypiprazolu (od 2 mg/dobę do 20 mg/dobę) u dzieci i młodzieży z zespołem Tourette’a (arypiprazol: n=32, placebo: n=29), z dawką początkową wynoszącą 2 mg. Pacjenci w wieku 6-18 lat uzyskali średni wynik 29 na skali TTS-YGTSS w pomiarze początkowym. Pacjenci otrzymujący arypiprazol wykazywali poprawę mierzoną w 10. tygodniu zmianą wyniku o 14,97 na skali TTS-YGTSS od pomiaru początkowego w porównaniu z poprawą wynoszącą 9,62 w grupie placebo. W obu tych krótkich badaniach nie określono klinicznej istotności uzyskanych wyników, biorąc pod uwagę działanie terapeutyczne w porównaniu z istotnym wpływem efektu placebo i niejasne skutki w zakresie funkcjonowania psychospołecznego. Brak danych długoterminowych dotyczących skuteczności i bezpieczeństwa arypiprazolu w tej niestabilnej chorobie.
- CHPL leku o rpl_id: 100352300Właściwości farmakodynamiczne
Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań referencyjnego produktu leczniczego zawierającego arypiprazol w jednej lub kilku podgrupach populacji dzieci i młodzieży w leczeniu schizofrenii oraz w leczeniu choroby afektywnej dwubiegunowej (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
- CHPL leku o rpl_id: 100352300Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Arypiprazol w tabletkach ulegających rozpadowi w jamie ustnej i w tabletkach jest biorównoważny, z podobną szybkością i zakresem wchłaniania. Arypiprazol w tabletkach ulegających rozpadowi w jamie ustnej może stanowić alternatywę dla arypiprazolu w tabletkach. Wchłanianie Arypiprazol jest dobrze wchłaniany, a maksymalne stężenie w osoczu osiąga w ciągu 3-5 godzin po podaniu. Arypiprazol w minimalnym stopniu podlega metabolizmowi przedukładowemu. Bezwzględna dostępność po doustnym podaniu jednej tabletki wynosi 87%. Spożywanie posiłków o dużej zawartości tłuszczu nie wpływa na farmakokinetykę arypiprazolu. Dystrybucja Arypiprazol jest rozmieszczany w całym organizmie, a pozorna objętość dystrybucji wynosząca 4,9 l/kg wskazuje na znaczną dystrybucję pozanaczyniową. W stężeniach terapeutycznych arypiprazol i dehydroarypiprazol wiążą się w ponad 99% z białkami surowicy, głównie z albuminami.
- CHPL leku o rpl_id: 100352300Właściwości farmakokinetyczne
Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie, głównie w trzech procesach: dehydrogenacji, hydroksylacji i N-dealkilacji. Jak wynika z badań in vitro, za dehydrogenację i hydroksylację arypiprazolu odpowiadają enzymy CYP3A4 i CYP2D6, a N-dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną w krążeniu ogólnym jest sam arypiprazol. W stanie stacjonarnym czynny metabolit, dehydroarypiprazol, stanowi około 40% AUC arypiprazolu w osoczu. Eliminacja Średni okres półtrwania arypiprazolu w fazie eliminacji wynosi u osób szybko i wolno metabolizujących z udziałem enzymu CYP2D6, odpowiednio, około 75 godzin i około 146 godzin. Całkowity klirens arypiprazolu wynosi 0,7 ml/min/kg i jest to głównie klirens wątrobowy. Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [¹⁴C], stwierdza się odpowiednio 27% i 60% podanego pierwiastka radioaktywnego w moczu i kale.
- CHPL leku o rpl_id: 100352300Właściwości farmakokinetyczne
Mniej niż 1% niezmienionego arypiprazolu zostaje wydalone w moczu i około 18% z kałem. Dzieci i młodzież Farmakokinetyka arypiprazolu i dehydroarypiprazolu u dzieci w wieku 10 do 17 lat była podobna do farmakokinetyki u dorosłych, po korekcie różnic w masie ciała. Farmakokinetyka w szczególnych grupach pacjentów Osoby w podeszłym wieku Nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami starszymi a młodszymi osobami dorosłymi; nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Nie stwierdzono różnic w farmakokinetyce arypiprazolu u zdrowych kobiet i zdrowych mężczyzn. Nie stwierdzono także żadnego mierzalnego wpływu płci na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Palenie tytoniu Populacyjne badania farmakokinetyczne nie wykazały żadnych istotnych klinicznie, zależnych od palenia tytoniu różnic w farmakokinetyce arypiprazolu.
- CHPL leku o rpl_id: 100352300Właściwości farmakokinetyczne
Rasa Populacyjne badania farmakokinetyczne nie wykazały żadnych istotnych klinicznie, zależnych od rasy różnic w farmakokinetyce arypiprazolu. Zaburzenia czynności nerek Stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u osób z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badania z zastosowaniem pojedynczej dawki leku u osób z różnego stopnia marskością wątroby (klasy A, B i C wg Childa-Pugha) nie wykazały, aby zaburzenia czynności wątroby wpływały istotnie na farmakokinetykę arypiprazolu i dehydroarypiprazolu. W badaniu tym jednak wzięło udział tylko 3 pacjentów z marskością wątroby klasy C, co jest liczbą niewystarczającą do wyciągnięcia wniosków dotyczących zdolności metabolicznych tych pacjentów.
- CHPL leku o rpl_id: 100352300Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Istotne działanie toksyczne stwierdzano jedynie po podaniu dawek lub przy stopniu narażenia wyraźnie przekraczającym maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza (gromadzenie barwnika lipofuscyny i (lub) obumieranie komórek miąższowych) stwierdzany u szczurów po 104 tygodniach podawania arypiprazolu w dawce od 20 do 60 mg/kg mc./dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 3 do 10 razy wartość u ludzi po podaniu maksymalnej zalecanej dawki) i zwiększenie częstości raków nadnerczy, a także skojarzonej częstości gruczolaków lub raków nadnerczy u samic szczura otrzymujących lek w dawce 60 mg/kg mc./dobę (średnia wartość AUC w stanie stacjonarnym przekraczała 10 razy wartość u ludzi po podaniu maksymalnej zalecanej dawki).
- CHPL leku o rpl_id: 100352300Przedkliniczne dane o bezpieczeństwie
Największa ekspozycja niepowodująca powstawania nowotworów u samic szczura odpowiadała 7-krotnej ekspozycji u ludzi po stosowaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się sprzężonych związków siarczanowych hydroksyarypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 do 125 mg/kg mc./dobę (średnia wartość AUC w stanie stacjonarnym była od 1 do 3 razy większa niż AUC u ludzi po podaniu maksymalnej zalecanej dawki klinicznej lub 16 do 81 razy wyższa niż po podaniu maksymalnej dawki zalecanej na podstawie przeliczenia mg/m² pc). Jednak stężenie sprzężonych związków siarczanowych hydroksyarypiprazolu w żółci człowieka podczas stosowania największej proponowanej dawki 30 mg na dobę, nie przekraczało 6% stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie mniejsze (6%) niż granica rozpuszczalności określona in vitro.
- CHPL leku o rpl_id: 100352300Przedkliniczne dane o bezpieczeństwie
W badaniach toksykologicznych z użyciem dawki wielokrotnej u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt. Ponadto brak dowodów na istnienie neurotoksyczności i niepożądanego wpływu na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych. Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowane toksyczne wpływy na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po zastosowaniu dawek maksymalnych zalecanych u ludzi).
- CHPL leku o rpl_id: 100352300Przedkliniczne dane o bezpieczeństwie
Toksyczny wpływ na samice ciężarne obserwowano podczas podawania dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku o rpl_id: 100352300Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Tabletki 10 mg i 30 mg: Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Aspartam (E 951) Magnezu stearynian Żelaza tlenek czerwony (E 172) Aromat waniliowy (zawiera maltodekstrynę, gumę arabską, glikol propylenowy, alkohol benzylowy, aromaty wanilii) Tabletki 15 mg: Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Aspartam (E 951) Magnezu stearynian Żelaza tlenek żółty (E 172) Aromat waniliowy (zawiera maltodekstrynę, gumę arabską, glikol propylenowy, alkohol benzylowy, aromaty wanilii) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania 21. NL/H/3231/001-002-003/IB/014 Brak specjalnych zaleceń dotyczących przechowywania.
- CHPL leku o rpl_id: 100352300Dane farmaceutyczne
6.5 Rodzaj i zawartość opakowania Tabletki ulegające rozpadowi w jamie ustnej są pakowane w blistry zdzieralne papier/PET/Aluminium/PVC/Aluminium/OPA i umieszczane w tekturowym pudełku. Wielkości opakowań: Blistry: 10, 14, 28, 30, 49, 56, 98 tabletek ulegających rozpadowi w jamie ustnej. Blistry perforowane: 10 x 1, 14 x 1, 28 x 1, 30 x 1, 49 x 1, 56 x 1, 98 x 1 tabletek ulegających rozpadowi w jamie ustnej. Nie wszystkie rodzaje i wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Abilify Maintena 720 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko- strzykawce Abilify Maintena 960 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko- strzykawce 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Abilify Maintena 720 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko- strzykawce Każda ampułko-strzykawka zawiera 720 mg arypiprazolu (aripiprazolum) na 2,4 ml (300 mg/ml). Abilify Maintena 960 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko- strzykawce Każda ampułko-strzykawka zawiera 960 mg arypiprazolu (aripiprazolum) na 3,2 ml (300 mg/ml). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce. Zawiesina jest biała lub biaława. Zawiesina ma obojętny odczyn pH (około 7,0).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWskazania do stosowania
4.1 Wskazania do stosowania Abilify Maintena jest wskazany w leczeniu podtrzymującym schizofrenii u dorosłych pacjentów ze stabilizacją choroby za pomocą arypiprazolu.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie W przypadku pacjentów nieleczonych wcześniej arypiprazolem przed rozpoczęciem leczenia produktem leczniczym Abilify Maintena należy najpierw ustalić tolerancję po podaniu arypiprazolu. Nie jest wymagane dobieranie indywidualnej dawki produktu leczniczego Abilify Maintena. Początkowy schemat dawkowania Zalecanym początkowym schematem dawkowania podczas przejścia z leczenia produktem Abilify Maintena 400 mg podawanym raz w miesiącu jest Abilify Maintena 960 mg podawany nie wcześniej niż 26 dni po poprzednim wstrzyknięciu produktu leczniczego Abilify Maintena 400. Następnie produkt leczniczy Abilify Maintena 960 mg należy podawać co dwa miesiące (co 56 dni). Można również rozpocząć podawanie postępując zgodnie z jednym z dwóch poniższych dodatkowych schematów dawkowania: • Rozpoczęcie leczenia obejmujące jedno wstrzyknięcie: w dniu rozpoczęcia leczenia po podaniu produktu doustnego należy podać jedno wstrzyknięcie produktu leczniczego Abilify Maintena 960 mg i kontynuować leczenie dobową dawką arypiprazolu w postaci doustnej od 10 mg do 20 mg, podawaną przez 14 kolejnych dni w celu utrzymania terapeutycznego stężenia arypiprazolu podczas rozpoczynania leczenia.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDawkowanie
• Rozpoczęcie leczenia obejmujące podanie dwóch wstrzyknięć: w dniu rozpoczęcia leczenia po podaniu produktu doustnego należy podać jedno wstrzyknięcie produktu leczniczego Abilify Maintena 960 mg i jedno wstrzyknięcie produktu leczniczego Abilify Maintena 400 mg w dwóch różnych miejscach podania (patrz sposób podawania), w skojarzeniu z podaniem arypiprazolu w postaci doustnej w jednej dawce wynoszącej 20 mg. Odstęp pomiędzy podawaniem dawek i modyfikacje dawki Po rozpoczęciu podawania wstrzyknięć zalecana dawka podtrzymująca to jedno wstrzyknięcie produktu leczniczego Abilify Maintena 960 mg co dwa miesiące. Wstrzyknięcie produktu leczniczego Abilify Maintena 960 mg należy podawać co dwa miesiące w postaci pojedynczego wstrzyknięcia (po 56 dniach od poprzedniego wstrzyknięcia). Pacjentom można podawać wstrzyknięcie do 2 tygodni przed zaplanowanym terminem lub do 2 tygodni po zaplanowanym terminie podania dawki co dwa miesiące.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDawkowanie
Jeśli występują działania niepożądane po podaniu produktu leczniczego Abilify Maintena 960 mg, należy rozważyć zmniejszenie dawki do produktu leczniczego Abilify Maintena 720 mg podawanego co dwa miesiące. Pominięcie dawek Jeśli od podania ostatniego wstrzyknięcia upłynęło więcej niż 8 tygodni i mniej niż 14 tygodni, należy jak najszybciej podać następną dawkę produktu Abilify Maintena 960 mg/720 mg. Następnie należy wznowić schemat dawkowania co dwa miesiące. Jeśli od podania ostatniego wstrzyknięcia upłynęło więcej niż 14 tygodni, następną dawkę produktu Abilify Maintena 960 mg/720 mg należy podać jednocześnie z doustną dawką arypiprazolu przez 14 dni lub jako 2 oddzielne wstrzyknięcia (jedno wstrzyknięcie produktu Abilify Maintena 960 mg i jedno wstrzyknięcie produktu Abilify Maintena 400 mg lub po jednym wstrzyknięciu Abilify Maintena 720 mg i Abilify Maintena 300 mg) podane razem z jedną dawką 20 mg arypiprazolu w postaci doustnej.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDawkowanie
Następnie należy wznowić schemat dawkowania co dwa miesiące. Szczególne grupy pacjentów Osoby w podeszłym wieku Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Abilify Maintena 960 mg/720 mg u pacjentów w wieku 65 lat lub starszych (patrz punkt 4.4). Nie można podać zaleceń dotyczących dawkowania. Zaburzenia czynności nerek U pacjentów z zaburzeniami czynności nerek nie jest konieczne dostosowanie dawki (patrz punkt 5.2). Zaburzenia czynności wątroby U pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności wątroby nie jest wymagane dostosowanie dawki. Nie ma wystarczających danych do ustalenia zaleceń dawkowania u pacjentów z ciężkimi zaburzeniami czynności wątroby. Dawkowanie u tych pacjentów wymaga ostrożności. Zaleca się postać doustną (patrz punkt 5.2).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDawkowanie
Osoby wolno metabolizujące z udziałem CYP2D6 W przypadku pacjentów, u których rozpoznano wolny metabolizm z udziałem CYP2D6: • Pacjenci przechodzący z leczenia produktem leczniczym Abilify Maintena 300 mg raz w miesiącu: Rozpoczęcie leczenia obejmujące podanie jednego wstrzyknięcia produktu leczniczego Abilify Maintena 720 mg nie wcześniej niż po upływie 26 dni po podaniu wcześniejszego wstrzyknięcia produktu leczniczego Abilify Maintena 300 mg. • Rozpoczęcie leczenia obejmujące podanie jednego wstrzyknięcia (po przejściu z leczenia doustnego): Dawka początkowa powinna obejmować jedno wstrzyknięcie produktu leczniczego Abilify Maintena 720 mg, a następnie należy kontynuować leczenie przepisaną przez lekarza dawką arypiprazolu w postaci doustnej przez kolejnych 14 dni. • Rozpoczęcie leczenia obejmujące podanie dwóch wstrzyknięć (po przejściu z leczenia doustnego): Dawka początkowa powinna obejmować dwa oddzielne wstrzyknięcia; jedno wstrzyknięcie produktu leczniczego Abilify Maintena 720 mg i jedno wstrzyknięcie produktu leczniczego Abilify Maintena 300 mg wraz z podaniem pojedynczej dawki 20 mg arypiprazolu w postaci doustnej (patrz metoda podania).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDawkowanie
Następnie dawkę podtrzymującą produktu leczniczego Abilify Maintena 720 mg należy podawać co dwa miesiące jako pojedyncze wstrzyknięcie. Dostosowanie dawki podtrzymującej z powodu interakcji z inhibitorami CYP2D6 i (lub) CYP3A4 i (lub) lekami indukującymi CYP3A4 Dostosowanie dawki podtrzymującej należy przeprowadzić u pacjentów przyjmujących równocześnie silne inhibitory CYP3A4 lub silne inhibitory CYP2D6 dłużej niż przez 14 dni. W razie odstawienia inhibitora CYP3A4 lub CYP2D6, może być wymagane zwiększenie dawki do wcześniejszej wielkości dawki (patrz punkt 4.5). W przypadku pojawienia się działań niepożądanych pomimo dostosowania dawki produktu leczniczego Abilify Maintena 960 mg, należy ponownie rozważyć, czy konieczne jest jednoczesne stosowanie inhibitora CYP2D6 lub CYP3A4. Należy unikać równoczesnego stosowania leków indukujących CYP3A4 z produktem leczniczym Abilify Maintena 960 mg/720 mg przez okres dłuższy niż 14 dni, ponieważ powoduje to zmniejszenie stężenia arypiprazolu we krwi i takie stężenie może nie być skuteczne (patrz punkt 4.5).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDawkowanie
Produktu leczniczego Abilify Maintena 960 mg/720 mg nie należy stosować u pacjentów o znanym wolnym metabolizmie z udziałem cytochromu CYP2D6, którzy jednocześnie przyjmują silny inhibitor CYP2D6 i (lub) CYP3A4. Tabela 1: Dostosowanie dawki podtrzymującej produktu leczniczego Abilify Maintena u pacjentów jednocześnie przyjmujących silne inhibitory CYP2D6, silne inhibitory CYP3A4 i (lub) leki indukujące CYP3A4 dłużej niż przez 14 dni
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDawkowanie
Dawka dostosowana co 2 miesiące Pacjenci przyjmujący dawkę produktu leczniczego Abilify Maintena 960 mg Silne inhibitory CYP2D6 lub silne inhibitory CYP3A4 720 mg Silne inhibitory CYP2D6 i silne inhibitory CYP3A4 Unikać stosowania Leki indukujące CYP3A4 Unikać stosowania - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDawkowanie
*Należy unikać podawania u pacjentów, którzy już przyjmują dawkę 720 mg, np. z powodu działań niepożądanych powodowanych przez większą dawkę. Dzieci i młodzież Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Abilify Maintena 960 mg/720 mg u dzieci i młodzieży w wieku od 0 do 17 lat. Dane nie są dostępne. Sposób podawania Produkt leczniczy Abilify Maintena 960 mg i 720 mg jest przeznaczony wyłącznie do podawania do mięśnia pośladkowego i nie wolno podawać go dożylnie ani podskórnie. Produkt leczniczy musi być podawany wyłącznie przez fachowy personel medyczny. Zawiesina musi być wstrzykiwana powoli w postaci pojedynczego wstrzyknięcia (dawki nie mogą być podzielone) do mięśnia pośladkowego, na przemian po prawej i po lewej stronie. Należy zachować ostrożność podczas wykonywania wstrzyknięcia, aby nie wstrzyknąć produktu leczniczego do naczynia krwionośnego.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDawkowanie
W przypadku rozpoczynania leczenia z zastosowaniem opcji wymagającej podania dwóch wstrzyknięć (jedna dawka produktu leczniczego Abilify Maintena 960 mg lub 720 mg i jedna dawka produktu leczniczego Abilify Maintena 400 mg lub 300 mg), wstrzyknięcia należy podawać w dwóch różnych miejscach. NIE podawać obu wstrzyknięć jednocześnie do tego samego mięśnia pośladkowego. Pełne instrukcje przygotowania produktu leczniczego Abilify Maintena 960 mg/720 mg do stosowania podano w ulotce załączonej do produktu leczniczego (informacje przeznaczone wyłącznie dla fachowego personelu medycznego).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić w ciągu kilku dni do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Zastosowanie u pacjentów w stanie silnego pobudzenia lub w ostrym stanie psychotycznym Produktu leczniczego Abilify Maintena nie należy stosować do leczenia silnego pobudzenia ani ostrych stanów psychotycznych, gdy wymagane jest natychmiastowe złagodzenie objawów. Prawdopodobieństwo podjęcia próby samobójczej Występowanie zachowań samobójczych jest właściwe w chorobach psychotycznych i w niektórych przypadkach było zgłaszane niedługo po rozpoczęciu przyjmowania leku przeciwpsychotycznego lub po zmianie na inny lek przeciwpsychotyczny, w tym arypiprazol (patrz punkt 4.8). Leczeniu przeciwpsychotycznemu u pacjentów z grupy wysokiego ryzyka powinna towarzyszyć ścisła obserwacja pacjenta.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgSpecjalne środki ostrozności
Zaburzenia sercowo-naczyniowe Arypiprazol należy stosować ostrożnie u pacjentów z rozpoznaną chorobą sercowo-naczyniową (zawał mięśnia sercowego lub choroba niedokrwienna w wywiadzie, niewydolność serca lub zaburzenia przewodzenia), chorobą naczyń mózgowych, w stanach, które predysponują do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie przeciwnadciśnieniowymi produktami leczniczymi) lub nadciśnienia tętniczego, w tym postępującego lub złośliwego. Zgłaszano przypadki choroby zakrzepowo-zatorowej żył (ang. venous thromboembolism , VTE) w związku ze stosowaniem produktów przeciwpsychotycznych. U pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, dlatego należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE przed rozpoczęciem oraz w czasie leczenia arypiprazolem i wdrożyć odpowiednie środki zapobiegawcze (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgSpecjalne środki ostrozności
Wydłużenie odstępu QT Podczas badań klinicznych nad leczeniem arypiprazolem w postaci doustnej częstość przypadków wydłużenia odstępu QT była porównywalna z placebo. Arypiprazol należy stosować ostrożnie u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy W badaniach klinicznych trwających nie dłużej niż rok zgłaszano niezbyt częste przypadki dyskinez występujące w trakcie leczenia arypiprazolem. Jeśli objawy przedmiotowe lub podmiotowe późnych dyskinez wystąpią u pacjentów leczonych arypiprazolem, należy rozważyć zmniejszenie dawki lub odstawienie leku (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Złośliwy zespół neuroleptyczny (ang. Neuroleptic Malignant Syndrome , NMS) NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z podawaniem leków przeciwpsychotycznych. W badaniach klinicznych odnotowano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgSpecjalne środki ostrozności
Klinicznymi objawami NMS są bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz przejawy zaburzeń stabilności układu wegetatywnego (nieregularne tętno lub wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Jednakże zgłaszano także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę niekoniecznie związane z NMS. Jeśli u pacjenta wystąpią wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS bądź wystąpi niewyjaśnionego pochodzenia wysoka gorączka bez innych objawów NMS, należy przerwać leczenie wszystkimi lekami przeciwpsychotycznymi, w tym także arypiprazolem (patrz punkt 4.8). Drgawki W badaniach klinicznych zgłaszano niezbyt częste przypadki napadów drgawkowych w czasie leczenia arypiprazolem.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgSpecjalne środki ostrozności
Z tego powodu arypiprazol należy stosować zachowując ostrożność u pacjentów, u których w przeszłości występowały napady drgawkowe lub u których występują choroby wiążące się ze skłonnością do takich napadów (patrz punkt 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencją Zwiększona śmiertelność W trzech badaniach nad arypiprazolem w postaci doustnej z grupą kontrolną otrzymującą placebo prowadzonych z udziałem pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera (n = 938; średnia wieku: 82,4 lat; zakres: 56 do 99 lat), pacjentom leczonym arypiprazolem zagrażało większe ryzyko zgonu w porównaniu do pacjentów otrzymujących placebo. Odsetek zgonów wśród pacjentów otrzymującej doustnie arypiprazol wynosił 3,5 % w porównaniu do 1,7 % dla placebo. Chociaż przyczyny zgonów były różne, to w większości zgonów miały one charakter sercowo- naczyniowy (np. niewydolność krążenia, nagły zgon) lub zakaźny (np. zapalenie płuc) (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgSpecjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego W tych samych badaniach nad arypiprazolem w postaci doustnej zgłaszano występowanie u pacjentów działań niepożądanych dotyczących krążenia mózgowego (np. udar, przemijający napad niedokrwienny), w tym zgonów (średnia wieku: 84 lata; zakres: 78 do 88 lat). Łącznie podczas tych badań działania niepożądane dotyczące krążenia mózgowego zgłoszono u 1,3 % pacjentów otrzymujących arypiprazol w postaci doustnej w porównaniu do 0,6 % pacjentów otrzymujących placebo. Różnica ta nie była statystycznie istotna. Jednakże w jednym z tych badań z zastosowaniem stałych dawek u pacjentów leczonych arypiprazolem występowała istotna zależność odpowiedzi od dawki w przypadku działań niepożądanych dotyczących krążenia mózgowego (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów z psychozą związaną z demencją.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgSpecjalne środki ostrozności
Hiperglikemia i cukrzyca U pacjentów leczonych arypiprazolem zgłaszano hiperglikemię, w niektórych przypadkach bardzo wysoką z towarzyszącą kwasicą ketonową, śpiączką hiperosmotyczną lub zgonem. Nie przeprowadzono żadnych specjalnych badań stosowania produktu leczniczego Abilify Maintena u pacjentów z hiperglikemią ani z cukrzycą. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. Pacjentów leczonych arypiprazolem należy objąć obserwacją w kierunku objawów przedmiotowych i podmiotowych hiperglikemii (takich jak zwiększone pragnienie, wielomocz, nadmierne łaknienie i osłabienie), a pacjentów z cukrzycą lub z czynnikami ryzyka cukrzycy należy regularnie monitorować pod kątem pogorszenia kontroli glikemii (patrz punkt 4.8). Nadwrażliwość Podczas przyjmowania arypiprazolu mogą pojawić się reakcje nadwrażliwości charakteryzujące się objawami reakcji uczuleniowych (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgSpecjalne środki ostrozności
Zwiększenie masy ciała Zwiększenie masy ciała często obserwuje się u pacjentów ze schizofrenią w związku z przyjmowaniem leków przeciwpsychotycznych o znanym wpływie na zwiększanie się masy ciała, współistniejącymi chorobami i niehigienicznym trybem życia. Może to prowadzić do ciężkich powikłań. Po wprowadzeniu leku do obrotu zgłaszano przypadki zwiększania się masy ciała u pacjentów, którym przepisano arypiprazol w postaci doustnej. Jeśli takie przypadki występowały, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych nie wykazano, aby arypiprazol powodował klinicznie istotne zwiększenie się masy ciała (patrz punkt 4.8). Dysfagia Ze stosowaniem arypiprazolu wiąże się spowolnienie motoryki przełyku i ryzyko aspiracji. Arypiprazol należy stosować ostrożnie u pacjentów z grupy ryzyka zachłystowego zapalenia płuc.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgSpecjalne środki ostrozności
Zaburzenie związane z hazardem i inne zaburzenia kontroli impulsów Podczas przyjmowania arypiprazolu u pacjentów mogą występować zwiększone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy obejmują: zwiększenie popędów seksualnych, kompulsywną potrzebę wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania. Ważne jest, aby lekarze przepisujący lek pytali pacjentów lub opiekunów w szczególności o pojawienie się nowego lub zwiększonego popędu do hazardu, popędów seksualnych, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa lub kompulsywnego objadania się, lub innych popędów podczas leczenia arypiprazolem. Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu produktu leczniczego.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgSpecjalne środki ostrozności
Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Należy rozważyć zmianę dawki lub odstawienie produktu leczniczego, jeśli u pacjenta wystąpią takie popędy (patrz punkt 4.8) Upadki Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków. Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2). Sód Produkt zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji produktu leczniczego Abilify Maintena. Informacje podane poniżej uzyskano z badań arypiprazolu w postaci doustnej. Podczas oceny potencjalnych interakcji z innymi produktami leczniczymi należy również uwzględnić dwumiesięczny odstęp między podaniem dawek i długi okres półtrwania arypiprazolu po podaniu produktu leczniczego Abilify Maintena 960 mg lub 720 mg. W związku z antagonistycznym działaniem wobec receptorów α1-adrenergicznych arypiprazol może nasilać działanie określonych leków przeciwnadciśnieniowych. Biorąc pod uwagę podstawowe działanie arypiprazolu na ośrodkowy układ nerwowy (OUN), należy zachować ostrożność podczas podawania arypiprazolu jednocześnie z alkoholem lub w skojarzeniu z innymi lekami wywierającymi wpływ na OUN z nakładającymi się działaniami niepożądanymi, takimi jak uspokojenie polekowe (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgInterakcje
Należy zachować ostrożność, podając arypiprazol w skojarzeniu z lekami o znanym działaniu powodującym wydłużenie odstępu QT lub zaburzenia elektrolitowe. Możliwy wpływ innych leków na arypiprazol Chinidyna i inne silne inhibitory CYP2D6 W badaniu klinicznym arypiprazolu podawanego doustnie zdrowym ochotnikom silny inhibitor CYP2D6 (chinidyna) zwiększał wartość AUC arypiprazolu o 107 %, natomiast wartość C max pozostawała niezmieniona. Wartości AUC i C max dehydroarypiprazolu, czynnego metabolitu, były odpowiednio zmniejszone o 32 % i o 47 %. Można przewidywać, że inne silne inhibitory CYP2D6, takie jak fluoksetyna i paroksetyna, mogą wywierać podobne działanie i dlatego należy w podobny sposób zmniejszyć dawkę (patrz punkt 4.2). Ketokonazol i inne silne inhibitory CYP3A4 W badaniu klinicznym arypiprazolu podawanego doustnie zdrowym ochotnikom silny inhibitor CYP3A4 (ketokonazol) zwiększał wartości AUC i C max arypiprazolu odpowiednio o 63 % i 37 %.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgInterakcje
Wartości AUC i C max dehydroarypiprazolu wzrosły odpowiednio o 77 % i 43 %. U pacjentów z wolnym metabolizmem przy udziale CYP2D6 jednoczesne podawanie silnych inhibitorów CYP3A4 może powodować większe stężenia arypiprazolu w osoczu w porównaniu do pacjentów z intensywnym metabolizmem przy udziale CYP2D6 (patrz punkt 4.2). W przypadku rozważania podawania ketokonazolu lub innych silnych inhibitorów CYP3A4 w skojarzeniu z arypiprazolem potencjalne korzyści powinny przeważać nad potencjalnym ryzykiem dla pacjenta. Można przewidywać, że inne silne inhibitory CYP3A4, takie jak itrakonazol i inhibitory proteazy HIV, mogą wywierać podobne działanie i dlatego należy w podobny sposób zmniejszyć dawkę (patrz punkt 4.2). Po przerwaniu przyjmowania inhibitora CYP2D6 lub CYP3A4 dawkę arypiprazolu należy zwiększyć do początkowej dawki z okresu przed rozpoczęciem terapii skojarzonej.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgInterakcje
Można spodziewać się łagodnego zwiększenia stężenia arypiprazolu w osoczu w przypadku jednoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazem) lub CYP2D6 (np. escytalopram) z arypiprazolem. Karbamazepina i inne leki indukujące CYP3A4 Po podaniu karbamazepiny, silnego leku indukującego CYP3A4, w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnie geometryczne wartości C max i AUC arypiprazolu były odpowiednio o 68 % i 73 % mniejsze w porównaniu do doustnego arypiprazolu (30 mg) podawanego w monoterapii. Podobnie średnie geometryczne wartości C max i AUC dehydroarypiprazolu po jednoczesnym podaniu karbamazepiny były mniejsze odpowiednio o 69 % i 71 %, niż te wartości po podaniu doustnego arypiprazolu w monoterapii. Można oczekiwać, że podobne działanie może wywierać podawanie produktu leczniczego Abilify Maintena 960 mg/720 mg w skojarzeniu z innymi lekami indukującymi CYP3A4 (takimi jak ryfampicyna, ryfabutyna, fenytoina, fenobarbital, primidon, efawirenz, newirapina i ziele dziurawca).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgInterakcje
Należy unikać podawania leków indukujących CYP3A4 w skojarzeniu z produktem leczniczym Abilify Maintena 960 mg/720 mg, ponieważ powoduje to zmniejszenie stężenia arypiprazolu we krwi i takie stężenie może nie być skuteczne. Zespół serotoninowy Zgłaszano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol i możliwe objawy przedmiotowe i podmiotowe tego zespołu mogą wystąpić szczególnie w przypadku jednoczesnego stosowania z innymi lekami o działaniu serotoninergicznym, takimi jak selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny (SSRI/SNRI, ang. Selective Serotonin Reuptake Inhibitor/Serotonin and Noradrenaline Reuptake Inhibitor ) lub z lekami, o których wiadomo, że wpływają na zwiększenie stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Kobiety w wieku rozrodczym Oczekuje się, że narażenie na arypiprazol w osoczu po podaniu pojedynczej dawki produktu leczniczego Abilify Maintena utrzymuje się przez okres do 34 tygodni (patrz punkt 5.2). Należy to wziąć pod uwagę przy rozpoczynaniu leczenia u kobiet w wieku rozrodczym, biorąc pod uwagę ewentualną przyszłą ciążę lub karmienie piersią. Produkt leczniczy Abilify Maintena należy stosować u kobiet planujących zajście w ciążę tylko, jeśli jest to bezwzględnie konieczne. Ciąża Nie prowadzono odpowiednich i dobrze kontrolowanych badań klinicznych arypiprazolu u kobiet w okresie ciąży. Zgłaszano występowanie wad wrodzonych, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. W badaniach na zwierzętach nie można było wykluczyć potencjalnego wystąpienia objawów toksyczności rozwojowej (patrz punkt 5.3).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWpływ na płodność, ciążę i laktację
Pacjentki należy poinformować o konieczności powiadomienia swojego lekarza o zajściu w ciążę lub planowaniu zajścia w ciążę podczas leczenia arypiprazolem. Lekarze przepisujący recepty muszą pamiętać o długotrwałych właściwościach produktu leczniczego Abilify Maintena. Arypiprazol był wykrywany w osoczu u dorosłych pacjentów w okresie do 34 tygodni po podaniu pojedynczej dawki zawiesiny o przedłużonym uwalnianiu. Noworodki narażone na działanie leków przeciwpsychotycznych (w tym arypiprazolu) w czasie trzeciego trymestru ciąży należą do grupy ryzyka narażonej na wystąpienie działań niepożądanych, w tym zaburzeń pozapiramidowych i (lub) objawów z odstawienia, które po porodzie mogą różnić się nasileniem i czasem trwania. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być objęte ścisłą obserwacją (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWpływ na płodność, ciążę i laktację
Narażenie matki na produkt leczniczy Abilify Maintena przed i w okresie ciąży może prowadzić do wystąpienia działań niepożądanych u noworodka. Produktu leczniczego Abilify Maintena nie należy stosować w okresie ciąży, jeśli nie jest to bezwzględnie konieczne. Karmienie piersią Jeśli produkt Abilify Maintena jest podawany kobietom karmiącym piersią, arypiprazol/metabolity przenikają do mleka ludzkiego w takim stopniu, że prawdopodobny jest wpływ na niemowlęta karmione piersią . Ponieważ oczekuje się, że pojedyncza dawka produktu leczniczego Abilify Maintena utrzymuje się w osoczu przez okres do 34 tygodni (patrz punkt 5.2), niemowlętom karmionym piersią może zagrażać ryzyko nawet jeśli produkt leczniczy Abilify Maintena był podany na długo przed karmieniem piersią. Pacjentki obecnie leczone, lub które były wcześniej leczone, produktem leczniczym Abilify Maintena w ciągu ostatnich 34 tygodni, nie powinny karmić piersią.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWpływ na płodność, ciążę i laktację
Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem arypiprazolu na reprodukcję.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe, senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Profil bezpieczeństwa produktu leczniczego Abilify Maintena 960 mg i Abilify Maintena 720 mg w leczeniu schizofrenii u dorosłych opiera się na odpowiednich i dobrze kontrolowanych badaniach leków Abilify Maintena 400 mg i Abilify Maintena 300 mg. Zasadniczo, działania niepożądane obserwowane w badaniach klinicznych produktu leczniczego Abilify Maintena 960 mg/720 mg były podobne do działań niepożądanych obserwowanych w badaniach klinicznych produktu leczniczego Abilify Maintena 400 mg/300 mg. Najczęściej obserwowanymi podczas badań klinicznych działaniami niepożądanymi powodowane przez produkt leczniczy zgłaszane u ≥ 5% pacjentów w dwóch długoterminowych badań klinicznych prowadzonych metodą podwójnie ślepej próby leczonych produktem Abilify Maintena 400 mg/300 mg były: zwiększenie masy ciała (9,0%), akatyzja (7,9%) i bezsenność (5,8%).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
Najczęściej obserwowanymi podczas badań klinicznych działaniami niepożądanymi powodowanymi przez produkt leczniczy Abilify Maintena 960 mg/720 mg były: zwiększenie masy ciała (22,7%), ból w miejscu wstrzyknięcia (18,2%), akatyzja (9,8%), lęk (8,3%), ból głowy (7,6%), bezsenność (7,6%) i zaparcia (6,1%). Tabelaryczne zestawienie działań niepożądanych Częstość występowania działań niepożądanych związanych z produktem leczniczym Abilify Maintena 400 mg/300 mg i 960 mg/720 mg podano w poniższej tabeli. Dane w tabeli oparto na reakcjach niepożądanych zgłaszanych podczas badań klinicznych i (lub) stosowania po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układ/narząd i częstości: bardzo często (≥ 1/10), często (≥ 1/100 do < 1/10); niezbyt często (≥ 1/1 000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1 000), bardzo rzadko (< 1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Działania niepożądane wymienione z częstością występowania „nieznana” zgłaszano po wprowadzeniu produktu do obrotu.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
Klasyfikacja układów i narządów Często Niezbyt często Nieznana Zaburzenia krwi i układu chłonnego Neutropenia Niedokrwistość Trombocytopenia Zmniejszenie liczby neutrofili Zmniejszenie liczbybiałych krwinek Leukopenia Zaburzenia układu immunologi cznego Nadwrażliwość Reakcje uczuleniowe (np. reakcja anafilaktyczna, obrzęk naczynioruchowy obejmujący obrzęk języka, obrzęk twarzy,świąd lub pokrzywkę) Zaburzeniaendokrynologi czne Zmniejszenie stężenia prolaktyny we krwiHiperprolaktynemia Cukrzycowa śpiączkahiperosmolarna Kwasica ketonowa Zaburzenia metabolizmu i odżywiania Zwiększenie masy ciałaa CukrzycaZmniejszenie masy ciała Hiperglikemia Hipercholesterolemia Hiperinsulinemia Hiperlipidemia HipertrójglicerydemiaZaburzenia łaknienia Anoreksja Zmniejszony apetytb Hiponatremia Zaburzenia psychiczne Nadmierne pobudzenieLęk Niepokój Bezsenność Myśli samobójcze Zaburzenia psychotyczne OmamyUrojenia Hiperseksualność Reakcje paniki DepresjaChwiejność emocjonalnaApatia Dysforia Zaburzenia snu BruksizmObniżenie libidoZmiany nastroju Dokonane samobójstwo Próba samobójcza Zaburzenia związane z hazardemZaburzenia kontroli impulsów ObżarstwoKompulsywna potrzeba wydawania pieniędzy Poriomania Nerwowość Zachowania agresywne Zaburzenia układu nerwowego Zaburzenia pozapiramidowe Akatyzja Drżenie Dyskineza Sedacja Senność Zawroty głowy Bóle głowy DystoniaPóźne dyskinezy Parkinsonizm Zaburzenia ruchu Nadpobudliwość psychomotoryczna Zespół „niespokojnych nóg”Sztywność mięśni szkieletowych Hipertonia Spowolnienie ruchowe ŚlinotokZaburzenia smakuOmamy węchowe Złośliwy zespół neuroleptyczny Uogólniony napad toniczno-kloniczny Zespół serotoninowy Zaburzenia mowy - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
Klasyfikacja układów i narządów Często Niezbyt często Nieznana Zaburzeniaoka Napad przymusowego patrzenia z rotacją gałek Niewyraźne widzenie Ból okaPodwójne widzenie Światłowstręt (fotofobia) Zaburzenia serca Dodatkowe skurcze komorowe Bradykardia TachykardiaZmniejszenie amplitudy załamka T w EKG Nieprawidłowości w badaniu EKGInwersja załamka T w EKG Nagły zgon Zatrzymanie akcji serca Torsades de pointes Arytmie komorowe Wydłużony odstęp QT Zaburzenia naczyniowe Nadciśnienie tętnicze Hipotensja ortostatyczna Podwyższone ciśnienie krwi OmdleniaChoroba zatorowa żył (w tym zator płucnyi zakrzepica żył głębokich) Zaburzenia układu oddechowego, klatkipiersiowej i śródpiersia KaszelCzkawka Skurcz części ustnej gardłaSkurcz krtani Zachłystowe zapalenie płuc Zaburzenia żołądka i jelit Suchość w jamie ustnej Choroba refluksowa przełyku Niestrawność WymiotyBiegunkaNudnościBól w nadbrzuszu Dyskomfort w jamie brzusznejZaparciaCzęste wypróżnieniaNadmierne wydzielanie śliny Zapalenie trzustki Dysfagia - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
Klasyfikacja układów i narządów Często Niezbyt często Nieznana Zaburzenia wątroby i dróg żółciowych Nieprawidłowy wynik testów wątrobowych Zwiększenie aktywności enzymów wątrobowych Podwyższenie aktywności aminotransferazy alaninowejZwiększenie aktywności gamma- glutamylotransferazy Podwyższone stężenie bilirubiny we krwi Podwyższenie aktywności aminotransferazyasparaginianowej Niewydolność wątroby ŻółtaczkaZapalenie wątroby Zwiększenie aktywności fosfatazy zasadowej Zaburzenia skóry i tkanki podskórnej Łysienie TrądzikTrądzik różowaty Egzema Stwardnienia skóry WysypkaReakcja fotoalergiczna Nadmierne pocenie się Wysypka polekowa z eozynofilią i objawami ogólnoustrojowymi(zespół DRESS) Zaburzenia mięśniowo- szkieletowe i tkanki łącznej Sztywność mięśniowo- szkieletowa Sztywność mięśni Skurcze mięśni Drżenie mięśni Napięcie mięśni Bóle mięśniowe Ból w kończynach Ból stawówBól pleców Zmniejszenie zakresu ruchu stawu Sztywność karkuSzczękościsk Rozpad mięśni poprzecznie prążkowanych (rabdomioliza) Zaburzenianerek i drógmoczowych Kamica nerkowa Cukromocz Zatrzymanie moczu Nietrzymanie moczu Ciąża, połógi okresokołoporodowy Zespół abstynencyjny u noworodków Zaburzenia układu rozrodczego ipiersi Zaburzenia erekcji Mlekotok Ginekomastia Wrażliwość piersiSuchość pochwy Długotrwały wzwód - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
Klasyfikacja układów i narządów Często Niezbyt często Nieznana Zaburzenia ogólne i stany w miejscu podania Reakcje w miejscupodaniaaStwardnienie w miejscu podania Zmęczenie GorączkaAsteniaZaburzenia chodu Dyskomfort w klatce piersiowejReakcja w miejscupodaniaRumień w miejscupodaniaObrzęk w miejscupodaniaDyskomfort w miejscupodaniaŚwiąd w miejscupodaniaWzmożone pragnienie Spowolnienie Zaburzenia regulacji temperatury (np. hipotermia, gorączka) Ból w klatce piersiowej Obrzęk obwodowy Badaniadiagnostyczne Zwiększenie aktywności fosfokinazy kreatynowej we krwi Zwiększenie stężenia glukozy we krwi Zmniejszenie stężenia glukozy we krwi Zwiększenie stężenia glikozylowanej hemoglobiny Zwiększenie obwodu w pasieZmniejszenie stężenia cholesterolu we krwi Zmniejszenie stężeniatriglicerydów we krwi Wahania stężenia glukozy we krwi - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
a: Zgłaszane jako bardzo często występujące podczas badań klinicznych produktu leczniczego Abilify Maintena 960 mg/720 mg. b: zgłaszane tylko podczas badań klinicznych produktu leczniczego Abilify Maintena 960 mg/720 mg. Opis wybranych działań niepożądanych Reakcje w miejscu podania Odsetek pacjentów w otwartym badaniu, u których zgłaszano jakiekolwiek działania niepożądane związane z miejscem wstrzyknięcia (wszystkie zgłaszane jako ból w miejscu wstrzyknięcia), wynosił 18,2% u pacjentów leczonych produktem leczniczym Abilify Maintena 960 mg i 9,0% u pacjentów leczonych produktem leczniczym Abilify Maintena 400 mg. W obu grupach leczenia u większości pacjentów zgłaszany ból w miejscu wstrzyknięcia wystąpił po pierwszym wstrzyknięciu produktu leczniczego Abilify Maintena 960 mg (u 21 na 24 pacjentów) lub produktu leczniczego Abilify Maintena 400 mg (u 7 na 12 pacjentów) i ustąpił w ciągu 5 dni oraz był zgłaszany ze zmniejszającą się częstością i nasileniem po kolejnych wstrzyknięciach.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
Ogólny średni wynik w skali analogowej dla bólu w miejscu podania (0 = brak bólu do 100 = nieznośnie silny ból) w przypadku ocen bólu przez pacjentów był podobny w obu grupach leczenia po podaniu ostatniego wstrzyknięcia: 0,8 przed podaniem i 1,4 po podaniu w grupie otrzymującej produkt leczniczy Abilify Maintena 960 mg w porównaniu do 1,3 po podaniu w grupie otrzymującej produkt leczniczy Abilify Maintena 400 mg. Neutropenia Neutropenię zgłaszano w programie klinicznym dotyczącym produktu leczniczego Abilify Maintena 400 mg/300 mg i zazwyczaj pojawiała się ona około 16 dnia po pierwszym podaniu i utrzymywała się średnio 18 dni. Objawy pozapiramidowe (ang. EPS) W badaniach z udziałem pacjentów ze stabilną schizofrenią podawanie produktu leczniczego Abilify Maintena 400 mg/300 mg wiązało się z większą częstością objawów EPS (18,4 %) niż w przypadku leczenia arypiprazolem w postaci doustnej (11,7 %).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
Akatyzja była najczęściej zgłaszanym objawem (8,2 %) i zazwyczaj pojawiała się ona około 10. dnia po pierwszym podaniu, a utrzymywała się średnio 56 dni. Pacjenci z akatyzją zwykle przyjmowali w ramach leczenia leki przeciwcholinergiczne, głównie mesylat benzatropiny i triheksyfenidyl. Rzadziej w leczeniu akatyzji podawano substancje, takie jak propranolol i benzodiazepiny (klonazepam i diazepam). Na kolejnym miejscu były przypadki parkinsonizmu z częstością występowania wynoszącą 6,9 % dla produktu leczniczego Abilify Maintena 400 mg/300 mg, 4,2 % dla arypiprazolu 10 mg do 30 mg w postaci tabletek doustnych i 3,0 % dla placebo. Dane z otwartego badania pacjentów leczonych produktem leczniczym Abilify Maintena 960 mg wykazały minimalną zmianę w stosunku do wartości początkowej w wynikach EPS, ocenianych za pomocą skali oceny Simpsona-Angusa (ang. Simpson-Angus Rating , SAS), skali oceny nieprawidłowych ruchów mimowolnych (ang.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
Abnormal Involuntary Movement Scale , AIMS) oraz skali oceny akatyzji Barnesa (ang. Barnes Akathisia Rating Scale , BARS). Częstość występowania zgłaszanych zdarzeń związanych z EPS u pacjentów leczonych produktem leczniczym Abilify Maintena 960 mg wynosiła 18,2% w porównaniu do częstości występowania u pacjentów leczonych produktem leczniczym Abilify Maintena 400 mg, która wynosiła 13,4%. Dystonia Efekt klasy terapeutycznej: objawy dystonii, długotrwałe nieprawidłowe skurcze grup mięśni, mogą występować u wrażliwych pacjentów w ciągu pierwszych kilku dni leczenia. Do objawów dystonii należą: skurcze mięśni szyi, czasami postępujące do ucisku w gardle, trudności z przełykaniem, trudności z oddychaniem i (lub) protruzja języka. Chociaż objawy te mogą występować po zastosowaniu małych dawek, występują częściej i z większym nasileniem podczas stosowania leków przeciwpsychotycznych pierwszej generacji o silnym działaniu i w większych dawkach.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
Obserwowano zwiększone ryzyko ostrej dystonii u mężczyzn i w młodszych grupach wiekowych. Masa ciała Podczas długoterminowego badania prowadzonego przez 38 tygodni metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną (patrz punkt 5.1), częstość przypadków zwiększenia się masy ciała o 7 % od pomiaru początkowego do ostatniej wizyty wynosiła 9,5 % dla produktu leczniczego Abilify Maintena 400 mg/300 mg i 11,7 % dla arypiprazolu 10 mg do 30 mg w postaci tabletek doustnych. Częstość przypadków zmniejszenia się masy ciała o ≥ 7 % od pomiaru początkowego do ostatniej wizyty wynosiła 10,2 % w grupie otrzymującej produktu leczniczy Abilify Maintena 400 mg/300 mg i 4,5 % w grupie otrzymującej arypiprazol doustnie w tabletkach 10 mg do 30 mg. Podczas długoterminowego badania prowadzonego przez 52 tygodnie metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo (patrz punkt 5.1) częstość przypadków zwiększania się masy ciała o 7 % od pomiaru początkowego do ostatniej wizyty wynosiła 6,4 % dla produktu leczniczego Abilify Maintena 400 mg/300 mg i 5,2 % dla placebo.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
Częstość przypadków zmniejszenia się masy ciała o ≥ 7 % od pomiaru początkowego do ostatniej wizyty wynosiła 6,4 % dla produktu leczniczego Abilify Maintena 400 mg/300 mg i 6,7 % dla placebo. Podczas leczenia prowadzonego metodą podwójnie ślepej próby średnia zmiana masy ciała od pomiaru początkowego do ostatniej wizyty wynosiła −0,2 kg w grupie otrzymującej produktu leczniczy Abilify Maintena 400 mg/300 mg i −0,4 kg w grupie otrzymującej placebo (p = 0,812). W otwartym, randomizowanym badaniu z zastosowaniem kilku dawek z udziałem dorosłych pacjentów ze schizofrenią (i zaburzeniem dwubiegunowym typu I), w którym postać produktu leczniczego Abilify Maintena 960 mg podawanego co dwa miesiące oceniano w porównaniu do produktu leczniczego Abilify Maintena 400 mg podawanego co miesiąc, całkowita częstość przyrostu masy ciała ≥ 7% w stosunku do wartości początkowej była porównywalna między produktem leczniczym Abilify Maintena 960 mg (40,6 %) a produktem leczniczym Abilify Maintena 400 mg (42,9 %).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
Średnia zmiana masy ciała od pomiaru początkowego do ostatniej wizyty wynosiła 3,6 kg w grupie otrzymującej Abilify Maintena 960 mg i 3,0 kg w grupie otrzymującej Abilify Maintena 400 mg. Prolaktyna Podczas badań klinicznych w zakresie zarejestrowanych wskazań i po wprowadzeniu produktu leczniczego do obrotu u pacjentów otrzymujących arypiprazol obserwowano zarówno zwiększenie, jak i zmniejszenie stężenia prolaktyny w surowicy w porównaniu do pomiarów początkowych (punkt 5.1). Zaburzenie związane z hazardem i inne zaburzenia kontroli impulsów Zaburzenie związane z hazardem, hiperseksualność, kompulsywna potrzeba wydawania pieniędzy i obżarstwo lub kompulsywne objadanie się mogą wystąpić u pacjentów leczonych arypiprazolem (patrz punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania wymienionego w załączniku V .
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgPrzedawkowanie
4.9 Przedawkowanie Podczas badań klinicznych arypiprazolu nie zgłaszano żadnych przypadków przedawkowania związanych z działaniami niepożądanymi. Chociaż doświadczenia związane z przedawkowaniem arypiprazolu są ograniczone, wśród nielicznych przypadków przedawkowania (przypadkowego lub zamierzonego) zgłaszanych w badaniach klinicznych i po wprowadzeniu do obrotu arypiprazolu w postaci doustnej, największe szacowane spożycie wynosiło łącznie 1 260 mg bez zgonów. Potencjalną możliwość uwolnienia całej dawki oceniano poprzez symulację stężeń arypiprazolu w osoczu po całkowitym wchłonięciu dawki produktu leczniczego Abilify Maintena 960 mg w krążeniu ogólnoustrojowym . W oparciu o wyniki symulacji, w przypadku wystąpienia uwolnienia całej dawki, stężenie arypiprazolu może być do 13,5 raza większe niż stężenia osiągane przy zastosowaniu dawki terapeutycznej produktu leczniczego Abilify Maintena 960 mg bez uwolnienia całej dawki.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgPrzedawkowanie
Ponadto stężenie arypiprazolu po uwolnieniu całej dawki uległoby zmniejszeniu w ciągu 5 dni do stężeń zwykle obserwowanych po podaniu produktu leczniczego Abilify Maintena 960 mg. Objawy przedmiotowe i podmiotowe Należy zachować ostrożność podczas wykonywania wstrzyknięcia, aby nie wstrzyknąć tego produktu leczniczego do naczynia krwionośnego. Po stwierdzonym lub podejrzewanym przypadkowym przedawkowaniu/nieumyślnym podaniu dożylnym arypiprazolu, konieczna jest ścisła obserwacja pacjenta. Potencjalnie ważne klinicznie objawy podmiotowe i przedmiotowe to: letarg, zwiększenie ciśnienia tętniczego krwi, senność, tachykardia, nudności, wymioty i biegunka. Postępowanie po przedawkowaniu Brak znanego swoistego antidotum dla arypiprazolu. Postępowanie w przypadku przedawkowania powinno obejmować leczenie wspomagające, w tym ścisłą obserwację i kontrolę pacjenta przez lekarza. Należy zapewnić odpowiednią drożność dróg oddechowych, natlenienie i wspomaganie oddychania.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgPrzedawkowanie
Monitorować rytm serca i parametry życiowe. Stosować leczenie wspomagające i objawowe. Leczenie powinno obejmować ogólne środki stosowane w leczeniu przedawkowania jakiegokolwiek produktu leczniczego. Należy rozważyć możliwość przedawkowania kilku produktów leczniczych. Przy ocenie potrzeb leczenia i poprawy stanu zdrowia należy wziąć pod uwagę długotrwałe działanie produktu leczniczego oraz długi okres półtrwania arypiprazolu w fazie eliminacji.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12 Mechanizm działania Przyjmuje się, że skuteczność arypiprazolu w leczeniu schizofrenii związana jest ze skojarzonym działaniem częściowo agonistycznym wobec receptora dopaminowego D 2 i receptora serotoninowego 5-HT 1A oraz z działaniem antagonistycznym wobec receptora serotoninowego 5-HT 2A . Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D 2 i D 3 , serotoninowych 5HT 1A i 5HT 2A oraz umiarkowane powinowactwo do receptorów dopaminowych D 4 , serotoninowych 5HT 2C i 5HT 7 , a także adrenergicznych alfa-1 i histaminowych H 1 .
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do cholinergicznych receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Arypiprazol podawany doustnie w dawkach od 0,5 mg do 30 mg raz na dobę przez 2 tygodnie zdrowym ochotnikom powoduje zależne od dawki zmniejszenie wiązania rakloprydu znakowanego 11 C, ligandu receptora D 2 /D 3 , w jądrze ogoniastym i skorupie, co można wykryć za pomocą pozytonowej tomografii emisyjnej. Skuteczność kliniczna i bezpieczeństwo stosowania Leczenie podtrzymujące schizofrenii u dorosłych Skuteczność produktu leczniczego Abilify Maintena 960 mg, podawanego co dwa miesiące, została częściowo określona na podstawie porównania parametrów farmakokinetycznych w ramach otwartego, wieloośrodkowego, randomizowanego badania z zastosowaniem kilku dawek, prowadzonego w grupach równoległych.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Badanie wykazało, że produkt leczniczy Abilify Maintena 960 mg zapewnia podobne stężenie arypiprazolu, a tym samym podobną skuteczność, jak produkt leczniczy Abilify Maintena 400 mg w czasie pomiędzy podaniem kolejnych dawek (patrz punkt 5.2). Podobieństwo stężeń arypiprazolu w osoczu w przypadku produktu leczniczego Abilify Maintena 960 mg i produktu leczniczego Abilify Maintena 400 mg przedstawiono w tabeli 2. Tabela 2: Współczynnik średniej geometrycznej i przedział ufności (CI) po czwartym podaniu produktu leczniczego Abilify Maintena 960 mg lub siódmym i ósmym podaniu produktu leczniczego Abilify Maintena 400 mg w badaniu otwartym
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Parametr Współczynnik(Abilify Maintena 960 mg/Abilify Maintena 400 mg) 90% CI aAUC0-56 1,006c 0,851 - 1,190 bC56/C28 1,011d 0,893 - 1,145 bCmax 1,071c 0,903 - 1,270 - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
a Wartość AUC 0-56 po czwartym podaniu produktu leczniczego Abilify Maintena 960 mg lub suma wartości AUC 0-28 po siódmym i ósmym podaniu produktu leczniczego Abilify Maintena 400 mg b Stężenia arypiprazolu w osoczu po czwartym podaniu produktu leczniczego Abilify Maintena 960 mg (C 56 ) lub ósmym podaniu produktu leczniczego Abilify Maintena 400 mg (C 28 ). c Abilify Maintena 960 mg (n = 34), Abilify Maintena 400 mg (n = 32) d Abilify Maintena 960 mg (n = 96), Abilify Maintena 400 mg (n = 82). Skuteczność produktu leczniczego Abilify Maintena 960 mg/720 mg w leczeniu schizofrenii jest dodatkowo wspierana przez określoną skuteczność produktu leczniczego Abilify Maintena 400 mg/300 mg, jak podsumowano poniżej: Skuteczność produktu Abilify Maintena 400 mg/300 mg Skuteczność produktu leczniczego Abilify Maintena 400 mg/300 mg w leczeniu podtrzymującym pacjentów ze schizofrenią ustalono w dwóch długoterminowych randomizowanych badaniach klinicznych prowadzonych metodą podwójnie ślepej próby.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Zasadnicze 38-tygodniowe badanie randomizowane prowadzone metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną miało na celu ustalenie skuteczności, bezpieczeństwa stosowania i tolerancji tego produktu leczniczego podawanego raz w miesiącu w postaci wstrzyknięcia w porównaniu do arypiprazolu w tabletkach 10 mg do 30 mg podawanego raz na dobę doustnie jako leczenie podtrzymujące u dorosłych pacjentów ze schizofrenią. Badanie składało się z fazy przesiewowej i 3 faz leczenia: fazy konwersji, fazy stabilizującej z zastosowaniem leku doustnego i fazy prowadzonej metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną. Sześciuset sześćdziesięciu dwóch pacjentów kwalifikujących się do trwającej 38 tygodni fazy prowadzonej metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną przydzielono losowo w stosunku 2:2:1 do leczenia metodą podwójnie ślepej próby do jednej z 3 grup leczenia: 1) Abilify Maintena 2) dawka stabilizująca arypiprazolu 10 mg do 30 mg w postaci doustnej lub 3) długodziałający arypiprazol 50 mg/25 mg w postaci wstrzyknięcia.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Dawka długodziałającego arypiprazolu 50 mg/25 mg została uwzględniona w badaniu jako arypiprazol w małej dawce w celu przetestowania czułości badania w schemacie badania z lekiem równoważnym. Wyniki analizy pierwszorzędowego punktu końcowego oceny skuteczności, szacowany odsetek pacjentów, u których występowało zagrożenie nawrotu choroby do końca 26. tygodnia fazy podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną wykazały, że produkt leczniczy Abilify Maintena 400 mg/300 mg jest równoważny z doustnym arypiprazolem w tabletkach 10 mg do 30 mg. Szacowany odsetek nawrotów do końca 26. tygodnia wynosił 7,12 % dla produktu leczniczego Abilify Maintena 400 mg/300 mg i 7,76 % dla arypiprazolu 10 mg do 30 mg w postaci tabletek doustnych, różnica o −0,64 %. Dziewięćdziesięciopięcioprocentowy przedział ufności (−5,26; 3,99) dla różnicy w zakresie szacowanego odsetka pacjentów, którym zagraża nawrót choroby do 26.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
tygodnia, wyłączał wstępnie określony margines równoważności 11,5 %. Z uwagi na to produkt leczniczy Abilify Maintena 400 mg/300 mg jest równoważny z doustną postacią arypiprazolu w tabletkach 10 mg do 30 mg. Szacowany odsetek pacjentów, którym zagraża nawrót choroby do końca 26. tygodnia dla produktu leczniczego Abilify Maintena 400 mg/300 mg wynosił 7,12 %, co było statystycznie znamiennie niższe niż dla długo działającego arypiprazolu 50 mg/25 mg w postaci wstrzyknięcia (21,80 %; p = 0,0006). Zatem ustalono wyższość produktu leczniczego Abilify Maintena 400 mg/300 mg nad długodziałającym arypiprazolem 50 mg/25 mg w postaci wstrzyknięcia i potwierdzono wiarygodność schematu badania. Na Rysunku 1 przedstawiono krzywe Kaplana-Meiera czasu od randomizacji do zagrażającego nawrotu choroby w ciągu trwającej 38 tygodni podwójnie ślepej fazy z grupą kontrolną otrzymującą substancję czynną dla produktu leczniczego Abilify Maintena 400 mg/300 mg, doustnego arypiprazolu 10 mg do 30 mg i długo działającego arypiprazolu 50 mg/25 mg w postaci wstrzyknięcia.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Rys. 1: Wykres Kaplana-Meiera limitu produktu dla czasu do nasilenia objawów psychotycznych/zagrażającego nawrotu ARIP IMD 400/ 300 mg ARIP 10-30 mg ARIP IMD 50/25 mg Liczba uczestników z grupy ryzyka Test log-rank ARIP IMD 400/300 mg w porównaniu do ARIP 10-30 mg: wartość p = 0,9920 ARIP IMD 400/300 mg w porównaniu do ARIP IMD 50/25 mg: wartość p < 0,0001
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Liczba pacjentów, którym nie zagraża nawrót choroby 1,0 0,8 0,6 0,4 0,2 0,0 IMD 400/300 mg ARIP 10-30 mg IMD 50/25 mg
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Dni od randomizacji UWAGA: ARIP IMD 400/300 mg = Abilify Maintena; ARIP 10 mg do 30 mg = doustny arypiprazol; ARIP IMD 50/25 mg = długodziałający arypiprazol w postaci wstrzyknięcia Ponadto równorzędność produktu leczniczego Abilify Maintena w porównaniu do doustnego arypiprazolu 10 mg do 30 mg potwierdzają wyniki analizy wg skali objawów pozytywnych i negatywnych w schizofrenii (ang. Positive and Negative Syndrome Scale Score , PANSS). Tabela 3: Łączny wynik w skali PANSS – zmiana od pomiaru początkowego do 38. tygodnia – ostatnia obserwacja przeniesiona dalej (ang. Last Observation Carried Forward , LOCF): Randomizowana próba skuteczności a, b
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Abilify Maintena400 mg/300 mg(n = 263) Arypiprazol w postaci doustnej 10 mg-30 mg/dobę(n = 266) Długodziałający arypiprazol w postaci wstrzyknięcia50 mg/25 mg(n = 131) Średnia wartość początkowa (SD) 57,9 (12,94) 56,6 (12,65) 56,1 (12,59) Średnia zmiana (SD) −1,8 (10,49) 0,7 (11,60) 3,2 (14,45) Wartość-P nie dotyczy 0,0272 0,0002 - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
a Zmiana ujemna oceny oznacza poprawę. b Do oceny włączono wyłącznie pacjentów z oceną początkową i co najmniej jedną oceną po ocenie początkowej. Wartości P wyprowadzono z porównania zmiany od pomiaru początkowego podczas analizy modelu kowariancji z lekiem jako wyrazem i oceną początkową jako zmienną. Drugie badanie prowadzone przez 52 tygodnie było badaniem randomizowanym z wycofaniem, prowadzonym metodą podwójnie ślepej próby prowadzonym w Stanach Zjednoczonych u dorosłych pacjentów z aktualnym rozpoznaniem schizofrenii. Badanie składało się z fazy przesiewowej i 4 faz leczenia: fazy konwersji, fazy stabilizującej z zastosowaniem leku doustnego, fazy stabilizującej z zastosowaniem leku podawanego domięśniowo i fazy prowadzonej metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Pacjenci, którzy spełnili wymóg stabilizacji choroby lekiem doustnym w fazie stabilizującej leczenia doustnego, zostali przydzieleni do otrzymywania metodą pojedynczej ślepej próby produktu leczniczego Abilify Maintena 400 mg/300 mg i rozpoczęli fazę stabilizującą z zastosowaniem leku podawanego domięśniowo trwającą minimalnie 12 tygodni i maksymalnie 36 tygodni. Pacjenci kwalifikujący się do fazy prowadzonej metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo byli losowo przydzielani w proporcji 2:1 do leczenia metodą podwójnie ślepej próby produktem leczniczym Abilify Maintena 400 mg/300 mg lub placebo. Końcowa analiza skuteczności obejmowała 403 randomizowanych pacjentów i 80 przypadków zaostrzenia objawów psychotycznych/zdarzeń zagrożenia nawrotu choroby. W grupie otrzymującej placebo u 39,6 % pacjentów nastąpiła progresja do ryzyka zagrażającego nawrotu choroby, natomiast w grupie otrzymującej produkt leczniczy Abilify Maintena 400 mg/300 mg ryzyko zagrażającego nawrotu choroby wystąpiło u 10 % pacjentów; zatem pacjentom z grupy otrzymującej placebo zagrażało 5,03-krotnie większe ryzyko zagrażającego nawrotu choroby Prolaktyna Podczas badania prowadzonego przez 38 tygodni metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną występowało średnie zmniejszenie stężeń prolaktyny w grupie otrzymującej produkt leczniczy Abilify Maintena 400 mg/300 mg (−0,33 ng/ml) w porównaniu do średniego zwiększenia w grupie otrzymującej arypiprazol doustnie w tabletkach 10 mg do 30 mg (0,79 ng/ml; p < 0,01).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Częstość występowania wśród pacjentów przyjmujących produkt leczniczy Abilify Maintena 400 mg/300 mg stężenia prolaktyny > 1-krotności górnej granicy normy (GGN) podczas wszystkich ocen wynosiła 5,4 % w porównaniu do 3,5 % pacjentów przyjmujących doustnie arypiprazol w tabletkach 10 mg do 30 mg. W każdej grupie leczenia u pacjentów płci męskiej częstość była generalnie większa niż u kobiet. Podczas badania prowadzonego przez 52 tygodnie metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo występowało średnie zmniejszenie stężeń prolaktyny w grupie otrzymującej produkt leczniczy Abilify Maintena 400 mg/300 mg (−0,38 ng/ml) w porównaniu do średniego zwiększenia w grupie otrzymującej placebo (1,67 ng/ml). Częstość stężenia prolaktyny > 1-krotności górnej granicy normy (GGN) wśród pacjentów przyjmujących produkt leczniczy Abilify Maintena 400 mg/300 mg wynosiła 1,9 % w porównaniu do 7,1 % u pacjentów otrzymujących placebo.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Leczenie ostrych przypadków schizofrenii u dorosłych Skuteczność produktu leczniczego Abilify Maintena 400 mg/300 mg u dorosłych pacjentów z ostrym nawrotem schizofrenii określono w krótkotrwałym (12-tygodniowym), randomizowanym badaniu, prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo (n = 339). Główny punkt końcowy (zmiana łącznej oceny w skali PANSS w zakresie od pomiaru początkowego do 10 tygodnia) wykazał wyższość produktu leczniczego Abilify Maintena 400 mg/300 mg (n = 167) wobec placebo (n = 172). Podobnie do łącznej oceny w skali PANSS, zarówno podskala objawów pozytywnych, jak i negatywnych PANSS również wykazały poprawę (zmniejszenie) w miarę upływu czasu w porównaniu do pomiaru początkowego. Tabela 4: Łączny wynik w skali PANSS – zmiana od pomiaru początkowego do 10. tygodnia: Randomizowana próba skuteczności a
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Abilify Maintena400 mg/300 mg Placebo Średnia wartość początkowa (SD) 102,4 (11,4)n = 162 103,4 (11,1)n = 167 Średnia zmiana (SD) wyznaczona metodą najmniejszych kwadratów −26,8 (1,6)n = 99 −11,7 (1,6)n = 81 Wartość-P < 0,0001 Różnica leczeniab (95 % CI) −15,1 (−19,4, −10,8) - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
a Dane były analizowane za pomocą analizy mieszanego modelu ponownych pomiarów ( ang. mixed model repeated measures MMRM). Analiza obejmowała wyłącznie uczestników losowo przydzielonych do grupy otrzymującej dany lek, którzy otrzymali co najmniej jedno wstrzyknięcie leku oraz przeprowadzono u nich ocenę skuteczności podczas pomiaru początkowego i co najmniej jedną taką ocenę w późniejszym czasie. b Różnica (Abilify Maintena minus placebo) wyznaczona metodą najmniejszych kwadratów w stosunku do pomiaru początkowego. Ponadto produkt leczniczy Abilify Maintena 400 mg/300 mg wykazywał również statystycznie istotną poprawę w zakresie objawów reprezentowanych przez zmianę oceny na skali ogólnego wrażenia klinicznego dotyczącego nasilenia objawów ( Clinical Global Impressions Severity , CGI-S) w zakresie od pomiaru początkowego do 10. tygodnia.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Funkcjonowanie indywidualne i społeczne oceniano przy użyciu skali funkcjonowania indywidualnego i społecznego (PSP - Personal and Social Performance). Skala PSP jest zwalidowaną, ocenianą przez lekarza skalą, mierzącą funkcjonowanie indywidualne i społeczne w czterech domenach: zajęć użytecznych społecznie (np. praca i nauka), związków osobistych i społecznych, dbałości o higienę osobistą oraz zachowań zakłócających porządek i agresywnych. Zaobserwowano statystycznie istotną różnicę na korzyść produktu leczniczego Abilify Maintena 400 mg/300 mg w porównaniu do placebo w 10. tygodniu (+7,1, p < 0,0001, 95 % CI: 4,1; 10,1 za pomocą modelu ANCOVA (LOCF)). Profil bezpieczeństwa był zgodny ze znanym profilem bezpieczeństwa produktu leczniczego Abilify Maintena 400 mg/300 mg. Niemniej występowały różnice w porównaniu do stosowania w leczeniu podtrzymującym schizofrenii.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakodynamiczne
Podczas krótkotrwałego (12-tygodniowego), randomizowanego badania, prowadzonego metodą podwójnie ślepej próby z udziałem pacjentów otrzymujących Abilify Maintena 400 mg/300 mg, objawy, które występowały co najmniej dwukrotnie częściej niż u pacjentów otrzymujących placebo, obejmowały zwiększenie masy ciała i akatyzję. Częstość występowania zwiększenia masy ciała wynoszącego ≤ 7 % od pomiaru początkowego do ostatniej wizyty (12. tydzień ) wynosiła 21,5 % w grupie pacjentów otrzymujących produkt Abilify Maintena 400 mg/300 mg w porównaniu do 8,5% w grupie placebo. Akatyzja była najczęściej obserwowanym objawem EPS (częstość występowania tego objawu w grupie otrzymującej produkt Abilify Maintena 400 mg/300 mg wynosiła 11,4 %, a w grupie placebo –3,5 %). Dzieci i młodzież Europejska Agencja Leków uchyliła obowiązek dołączenia wyników badań produktu leczniczego Abilify Maintena we wszystkich podgrupach populacji dzieci i młodzieży w leczeniu schizofrenii (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Farmakokinetyka arypiprazolu po podaniu produktu leczniczego Abilify Maintena, przedstawiona poniżej, opiera się na podaniu do mięśnia pośladkowego. Produkt Abilify Maintena 960 mg/720 mg dostarcza arypiprazol w okresie 2 miesięcy w porównaniu do produktu Abilify Maintena 400 mg/300 mg. Dawki produktu leczniczego Abilify Maintena 960 mg i 720 mg podawane do mięśnia pośladkowego zapewniają całkowite zakresy ekspozycji na arypiprazol mieszczące się w zakresie ekspozycji odpowiadającym odpowiednio dawkom 300 mg i 400 mg produktu leczniczego Abilify Maintena (podawanego raz w miesiącu). Ponadto średnie obserwowane maksymalne stężenia w osoczu (C max ) i stężenia arypiprazolu w osoczu na koniec okresu dawkowania były podobne w przypadku produktu leczniczego Abilify Maintena 960 mg/720 mg w porównaniu do odpowiadających im dawek produktu leczniczego Abilify Maintena 400 mg/300 mg (patrz punkt 5.1).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakokinetyczne
Profile średniego stężenia arypiprazolu w osoczu zależnego od czasu po czwartym podaniu produktu leczniczego Abilify Maintena 960 mg (n = 102) lub po siódmym i ósmym podaniu produktu leczniczego Abilify Maintena 400 mg (n = 93) do mięśnia pośladkowego u pacjentów ze schizofrenią (i zaburzeniem dwubiegunowym typu I) przedstawiono na rysunku 2. Rysunek 2: Profil średniego stężenia arypiprazolu w osoczu zależnego od czasu po czwartym podaniu produktu leczniczego Abilify Maintena 960 mg lub po siódmym i ósmym podaniu produktu leczniczego Abilify Maintena 400 mg
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakokinetyczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakokinetyczne
Wchłanianie/Dystrybucja Wchłanianie arypiprazolu do krążenia ogólnoustrojowego następuje powoli i jest wydłużone po podaniu do mięśnia pośladkowego w związku ze słabą rozpuszczalnością cząsteczek arypiprazolu. Profil uwalniania arypiprazolu z produktu leczniczego Abilify Maintena 960 mg/720 mg powoduje utrzymujące się stężenia w osoczu przez okres dwóch miesięcy po wstrzyknięciu do mięśnia pośladkowego. Uwalnianie substancji czynnej po podaniu pojedynczej dawki arypiprazolu w postaci do wstrzykiwań co dwa miesiące rozpoczyna się w pierwszym dniu i utrzymuje się aż do 34 tygodni. Uwalnianie substancji czynnej po podaniu pojedynczej dawki 780 mg gotowego do użycia arypiprazolu o przedłużonym działaniu podawanego co 2 miesiące rozpoczyna się w pierwszym dniu i utrzymuje się aż do 34 tygodni.. Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie. Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakokinetyczne
Jak wynika z badań in vitro enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N- dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. Po wielokrotnym podaniu produktu leczniczego Abilify Maintena 960 mg/720 mg czynny metabolit, dehydroarypiprazol, stanowi około 30 % wartości AUC arypiprazolu w osoczu. Eliminacja Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [ 14 C], stwierdza się odpowiednio 25 % i 55 % podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1 % niezmienionego arypiprazolu zostaje wydalone z moczem i około 18 % z kałem. Farmakokinetyka w szczególnych grupach pacjentów Nie przeprowadzono żadnych specjalnych badań stosowania produktu leczniczego Abilify Maintena w szczególnych grupach pacjentów.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakokinetyczne
Osoby o wolnym metabolizmie z udziałem CYP2D6 Na podstawie analizy farmakokinetyki populacyjnej stwierdzono, że stężenie arypiprazolu w osoczu jest około 2 razy większe u osób wolnym metabolizmie z udziałem CYP2D6 w porównaniu z osobami metabolizującymi prawidłowo z udziałem CYP2D6. (patrz punkt 4.2). Pacjenci w podeszłym wieku Po podaniu doustnym arypiprazolu nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi. Nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Po podaniu doustnym arypiprazolu nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi mężczyznami a kobietami. Nie stwierdzono także mierzalnego wpływu płci na farmakokinetykę arypiprazolu podczas badań klinicznych u pacjentów ze schizofrenią.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgWłaściwości farmakokinetyczne
Palenie tytoniu Populacyjne badanie farmakokinetyczne arypiprazolu w postaci doustnej nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od palenia tytoniu. Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy. Zaburzenia czynności nerek W badaniu z pojedynczą dawką arypiprazolu w postaci doustnej stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u pacjentów z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badanie z pojedynczą dawką arypiprazolu podawanego doustnie pacjentom z marskością wątroby różnego stopnia (klasa A, B lub C w skali Child-Pugh) nie wykazało znacznego wpływu zaburzeń czynności wątroby na farmakokinetykę arypiprazolu i dehydroarypiprazolu, ale w badaniu uczestniczyło tylko 3 pacjentów z marskością wątroby klasy C, co jest niewystarczające do wyciągnięcia wniosków w zakresie możliwości metabolizmu u takich pacjentów.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Profil toksykologiczny arypiprazolu podawanego zwierzętom doświadczalnym we wstrzyknięciu domięśniowym jest generalnie podobny do profilu obserwowanego po podaniu doustnym przy porównywalnych stężeniach w osoczu. Jednak po podaniu domięśniowym reakcję zapalną obserwowano w miejscu podania i obejmowała ona ziarniniakowe zmiany zapalne, ogniska (złogi substancji czynnej), nacieki komórkowe, obrzęki i zwłóknienie u małp. Objawy te zwykle stopniowo ustępowały po przerwaniu podawania. Dane niekliniczne dla arypiprazolu podawanego doustnie wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgPrzedkliniczne dane o bezpieczeństwie
Arypiprazol w postaci doustnej Istotne działanie toksyczne stwierdzano jedynie po podaniu dawek lub przy stopniu narażenia wyraźnie przekraczającym maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza stwierdzany u szczurów po 104 tygodniach doustnego podawania arypiprazolu w dawce przekraczającej od 3 do 10 razy średnią wartość AUC w stanie stacjonarnym występującą u ludzi po podaniu maksymalnej zalecanej dawki i zwiększenie częstości występowania raków nadnerczy, a także łącznej częstości występowania gruczolaków/raków korowonadnerczowych u samic szczurów otrzymujących produkt w dawce przekraczającej 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgPrzedkliniczne dane o bezpieczeństwie
Największe narażenie niepowodujące powstawania nowotworów u samic szczurów odpowiadało siedmiokrotnemu narażeniu u ludzi występującemu po podaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych koniugatów hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 mg/kg mc./dobę do 125 mg/kg mc./dobę (około 16 do 81 razy wyższa niż po podaniu maksymalnej dawki zalecanej u ludzi na podstawie przeliczenia mg/m 2 pc.). Jednak stężenie koniugatów siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania największej proponowanej dawki 30 mg na dobę, nie przekraczało 6 % stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie poniżej (6 %) granicy rozpuszczalności określonej in vitro .
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgPrzedkliniczne dane o bezpieczeństwie
W badaniach toksykologicznych z użyciem dawki wielokrotnej u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt oraz nie było dowodów potwierdzających neurotoksyczność i niepożądany wpływ na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych u ludzi. Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowano toksyczny wpływ na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po podaniu maksymalnej zalecanej dawki u ludzi.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgPrzedkliniczne dane o bezpieczeństwie
Toksyczny wpływ na ciężarne samice obserwowano podczas podawania dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Karmeloza sodowa Makrogol Powidon (E1201) Sodu chlorek Sodu diwodorofosforan jednowodny (E339) Sodu wodorotlenek ( do regulacji pH) (E524) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Ampułko-strzykawka (kopolimer zawierający cykliczne olefiny) z korkiem tłoka z gumy bromobutylowej i nasadką końcówki z gumy bromobutylowej oraz tłokiem z polipropylenu i uchwytem na palec. Abilify Maintena 960 mg, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko- strzykawce Każde opakowanie 960 mg zawiera jedną ampułko-strzykawkę i dwie sterylne igły bezpieczne: jedną o długości 38 mm (1,5 cala) 22 G i jedną o długości 51 mm (2 cale) 21 G.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDane farmaceutyczne
Abilify Maintena 720 mg, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko- strzykawce Każde opakowanie 720 mg zawiera jedną ampułko-strzykawkę i dwie sterylne igły bezpieczne: jedną o długości 38 mm (1,5 cala) 22 G i jedną o długości 51 mm (2 cale) 21 G. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Postukać strzykawką o dłoń co najmniej 10 razy. Po postukaniu energicznie wstrząsać strzykawką przez co najmniej 10 sekund. Podanie do mięśnia pośladkowego Zalecaną igłą do podania do mięśnia pośladkowego jest sterylna igła bezpieczna o długości 38 mm (1,5 cala) 22 G; u pacjentów otyłych (wskaźnik masy ciała > 28 kg/m 2 ) należy stosować sterylną igłę bezpieczną o długości 51 mm (2 cale) 21 G. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 720 mgDane farmaceutyczne
Pełne instrukcje przygotowania produktu leczniczego Abilify Maintena 960 mg/720 mg do stosowania podano w ulotce załączonej do produktu leczniczego (informacje przeznaczone wyłącznie dla fachowego personelu medycznego).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Abilify Maintena 720 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko- strzykawce Abilify Maintena 960 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko- strzykawce 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Abilify Maintena 720 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko- strzykawce Każda ampułko-strzykawka zawiera 720 mg arypiprazolu (aripiprazolum) na 2,4 ml (300 mg/ml). Abilify Maintena 960 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko- strzykawce Każda ampułko-strzykawka zawiera 960 mg arypiprazolu (aripiprazolum) na 3,2 ml (300 mg/ml). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce. Zawiesina jest biała lub biaława. Zawiesina ma obojętny odczyn pH (około 7,0).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWskazania do stosowania
4.1 Wskazania do stosowania Abilify Maintena jest wskazany w leczeniu podtrzymującym schizofrenii u dorosłych pacjentów ze stabilizacją choroby za pomocą arypiprazolu.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie W przypadku pacjentów nieleczonych wcześniej arypiprazolem przed rozpoczęciem leczenia produktem leczniczym Abilify Maintena należy najpierw ustalić tolerancję po podaniu arypiprazolu. Nie jest wymagane dobieranie indywidualnej dawki produktu leczniczego Abilify Maintena. Początkowy schemat dawkowania Zalecanym początkowym schematem dawkowania podczas przejścia z leczenia produktem Abilify Maintena 400 mg podawanym raz w miesiącu jest Abilify Maintena 960 mg podawany nie wcześniej niż 26 dni po poprzednim wstrzyknięciu produktu leczniczego Abilify Maintena 400. Następnie produkt leczniczy Abilify Maintena 960 mg należy podawać co dwa miesiące (co 56 dni). Można również rozpocząć podawanie postępując zgodnie z jednym z dwóch poniższych dodatkowych schematów dawkowania: • Rozpoczęcie leczenia obejmujące jedno wstrzyknięcie: w dniu rozpoczęcia leczenia po podaniu produktu doustnego należy podać jedno wstrzyknięcie produktu leczniczego Abilify Maintena 960 mg i kontynuować leczenie dobową dawką arypiprazolu w postaci doustnej od 10 mg do 20 mg, podawaną przez 14 kolejnych dni w celu utrzymania terapeutycznego stężenia arypiprazolu podczas rozpoczynania leczenia.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDawkowanie
• Rozpoczęcie leczenia obejmujące podanie dwóch wstrzyknięć: w dniu rozpoczęcia leczenia po podaniu produktu doustnego należy podać jedno wstrzyknięcie produktu leczniczego Abilify Maintena 960 mg i jedno wstrzyknięcie produktu leczniczego Abilify Maintena 400 mg w dwóch różnych miejscach podania (patrz sposób podawania), w skojarzeniu z podaniem arypiprazolu w postaci doustnej w jednej dawce wynoszącej 20 mg. Odstęp pomiędzy podawaniem dawek i modyfikacje dawki Po rozpoczęciu podawania wstrzyknięć zalecana dawka podtrzymująca to jedno wstrzyknięcie produktu leczniczego Abilify Maintena 960 mg co dwa miesiące. Wstrzyknięcie produktu leczniczego Abilify Maintena 960 mg należy podawać co dwa miesiące w postaci pojedynczego wstrzyknięcia (po 56 dniach od poprzedniego wstrzyknięcia). Pacjentom można podawać wstrzyknięcie do 2 tygodni przed zaplanowanym terminem lub do 2 tygodni po zaplanowanym terminie podania dawki co dwa miesiące.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDawkowanie
Jeśli występują działania niepożądane po podaniu produktu leczniczego Abilify Maintena 960 mg, należy rozważyć zmniejszenie dawki do produktu leczniczego Abilify Maintena 720 mg podawanego co dwa miesiące. Pominięcie dawek Jeśli od podania ostatniego wstrzyknięcia upłynęło więcej niż 8 tygodni i mniej niż 14 tygodni, należy jak najszybciej podać następną dawkę produktu Abilify Maintena 960 mg/720 mg. Następnie należy wznowić schemat dawkowania co dwa miesiące. Jeśli od podania ostatniego wstrzyknięcia upłynęło więcej niż 14 tygodni, następną dawkę produktu Abilify Maintena 960 mg/720 mg należy podać jednocześnie z doustną dawką arypiprazolu przez 14 dni lub jako 2 oddzielne wstrzyknięcia (jedno wstrzyknięcie produktu Abilify Maintena 960 mg i jedno wstrzyknięcie produktu Abilify Maintena 400 mg lub po jednym wstrzyknięciu Abilify Maintena 720 mg i Abilify Maintena 300 mg) podane razem z jedną dawką 20 mg arypiprazolu w postaci doustnej.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDawkowanie
Następnie należy wznowić schemat dawkowania co dwa miesiące. Szczególne grupy pacjentów Osoby w podeszłym wieku Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Abilify Maintena 960 mg/720 mg u pacjentów w wieku 65 lat lub starszych (patrz punkt 4.4). Nie można podać zaleceń dotyczących dawkowania. Zaburzenia czynności nerek U pacjentów z zaburzeniami czynności nerek nie jest konieczne dostosowanie dawki (patrz punkt 5.2). Zaburzenia czynności wątroby U pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności wątroby nie jest wymagane dostosowanie dawki. Nie ma wystarczających danych do ustalenia zaleceń dawkowania u pacjentów z ciężkimi zaburzeniami czynności wątroby. Dawkowanie u tych pacjentów wymaga ostrożności. Zaleca się postać doustną (patrz punkt 5.2).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDawkowanie
Osoby wolno metabolizujące z udziałem CYP2D6 W przypadku pacjentów, u których rozpoznano wolny metabolizm z udziałem CYP2D6: • Pacjenci przechodzący z leczenia produktem leczniczym Abilify Maintena 300 mg raz w miesiącu: Rozpoczęcie leczenia obejmujące podanie jednego wstrzyknięcia produktu leczniczego Abilify Maintena 720 mg nie wcześniej niż po upływie 26 dni po podaniu wcześniejszego wstrzyknięcia produktu leczniczego Abilify Maintena 300 mg. • Rozpoczęcie leczenia obejmujące podanie jednego wstrzyknięcia (po przejściu z leczenia doustnego): Dawka początkowa powinna obejmować jedno wstrzyknięcie produktu leczniczego Abilify Maintena 720 mg, a następnie należy kontynuować leczenie przepisaną przez lekarza dawką arypiprazolu w postaci doustnej przez kolejnych 14 dni. • Rozpoczęcie leczenia obejmujące podanie dwóch wstrzyknięć (po przejściu z leczenia doustnego): Dawka początkowa powinna obejmować dwa oddzielne wstrzyknięcia; jedno wstrzyknięcie produktu leczniczego Abilify Maintena 720 mg i jedno wstrzyknięcie produktu leczniczego Abilify Maintena 300 mg wraz z podaniem pojedynczej dawki 20 mg arypiprazolu w postaci doustnej (patrz metoda podania).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDawkowanie
Następnie dawkę podtrzymującą produktu leczniczego Abilify Maintena 720 mg należy podawać co dwa miesiące jako pojedyncze wstrzyknięcie. Dostosowanie dawki podtrzymującej z powodu interakcji z inhibitorami CYP2D6 i (lub) CYP3A4 i (lub) lekami indukującymi CYP3A4 Dostosowanie dawki podtrzymującej należy przeprowadzić u pacjentów przyjmujących równocześnie silne inhibitory CYP3A4 lub silne inhibitory CYP2D6 dłużej niż przez 14 dni. W razie odstawienia inhibitora CYP3A4 lub CYP2D6, może być wymagane zwiększenie dawki do wcześniejszej wielkości dawki (patrz punkt 4.5). W przypadku pojawienia się działań niepożądanych pomimo dostosowania dawki produktu leczniczego Abilify Maintena 960 mg, należy ponownie rozważyć, czy konieczne jest jednoczesne stosowanie inhibitora CYP2D6 lub CYP3A4. Należy unikać równoczesnego stosowania leków indukujących CYP3A4 z produktem leczniczym Abilify Maintena 960 mg/720 mg przez okres dłuższy niż 14 dni, ponieważ powoduje to zmniejszenie stężenia arypiprazolu we krwi i takie stężenie może nie być skuteczne (patrz punkt 4.5).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDawkowanie
Produktu leczniczego Abilify Maintena 960 mg/720 mg nie należy stosować u pacjentów o znanym wolnym metabolizmie z udziałem cytochromu CYP2D6, którzy jednocześnie przyjmują silny inhibitor CYP2D6 i (lub) CYP3A4. Tabela 1: Dostosowanie dawki podtrzymującej produktu leczniczego Abilify Maintena u pacjentów jednocześnie przyjmujących silne inhibitory CYP2D6, silne inhibitory CYP3A4 i (lub) leki indukujące CYP3A4 dłużej niż przez 14 dni
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDawkowanie
Dawka dostosowana co 2 miesiące Pacjenci przyjmujący dawkę produktu leczniczego Abilify Maintena 960 mg Silne inhibitory CYP2D6 lub silne inhibitory CYP3A4 720 mg Silne inhibitory CYP2D6 i silne inhibitory CYP3A4 Unikać stosowania Leki indukujące CYP3A4 Unikać stosowania - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDawkowanie
*Należy unikać podawania u pacjentów, którzy już przyjmują dawkę 720 mg, np. z powodu działań niepożądanych powodowanych przez większą dawkę. Dzieci i młodzież Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Abilify Maintena 960 mg/720 mg u dzieci i młodzieży w wieku od 0 do 17 lat. Dane nie są dostępne. Sposób podawania Produkt leczniczy Abilify Maintena 960 mg i 720 mg jest przeznaczony wyłącznie do podawania do mięśnia pośladkowego i nie wolno podawać go dożylnie ani podskórnie. Produkt leczniczy musi być podawany wyłącznie przez fachowy personel medyczny. Zawiesina musi być wstrzykiwana powoli w postaci pojedynczego wstrzyknięcia (dawki nie mogą być podzielone) do mięśnia pośladkowego, na przemian po prawej i po lewej stronie. Należy zachować ostrożność podczas wykonywania wstrzyknięcia, aby nie wstrzyknąć produktu leczniczego do naczynia krwionośnego.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDawkowanie
W przypadku rozpoczynania leczenia z zastosowaniem opcji wymagającej podania dwóch wstrzyknięć (jedna dawka produktu leczniczego Abilify Maintena 960 mg lub 720 mg i jedna dawka produktu leczniczego Abilify Maintena 400 mg lub 300 mg), wstrzyknięcia należy podawać w dwóch różnych miejscach. NIE podawać obu wstrzyknięć jednocześnie do tego samego mięśnia pośladkowego. Pełne instrukcje przygotowania produktu leczniczego Abilify Maintena 960 mg/720 mg do stosowania podano w ulotce załączonej do produktu leczniczego (informacje przeznaczone wyłącznie dla fachowego personelu medycznego).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego kliniczna poprawa stanu pacjenta może nastąpić w ciągu kilku dni do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Zastosowanie u pacjentów w stanie silnego pobudzenia lub w ostrym stanie psychotycznym Produktu leczniczego Abilify Maintena nie należy stosować do leczenia silnego pobudzenia ani ostrych stanów psychotycznych, gdy wymagane jest natychmiastowe złagodzenie objawów. Prawdopodobieństwo podjęcia próby samobójczej Występowanie zachowań samobójczych jest właściwe w chorobach psychotycznych i w niektórych przypadkach było zgłaszane niedługo po rozpoczęciu przyjmowania leku przeciwpsychotycznego lub po zmianie na inny lek przeciwpsychotyczny, w tym arypiprazol (patrz punkt 4.8). Leczeniu przeciwpsychotycznemu u pacjentów z grupy wysokiego ryzyka powinna towarzyszyć ścisła obserwacja pacjenta.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgSpecjalne środki ostrozności
Zaburzenia sercowo-naczyniowe Arypiprazol należy stosować ostrożnie u pacjentów z rozpoznaną chorobą sercowo-naczyniową (zawał mięśnia sercowego lub choroba niedokrwienna w wywiadzie, niewydolność serca lub zaburzenia przewodzenia), chorobą naczyń mózgowych, w stanach, które predysponują do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie przeciwnadciśnieniowymi produktami leczniczymi) lub nadciśnienia tętniczego, w tym postępującego lub złośliwego. Zgłaszano przypadki choroby zakrzepowo-zatorowej żył (ang. venous thromboembolism , VTE) w związku ze stosowaniem produktów przeciwpsychotycznych. U pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka VTE, dlatego należy zidentyfikować wszystkie możliwe czynniki ryzyka VTE przed rozpoczęciem oraz w czasie leczenia arypiprazolem i wdrożyć odpowiednie środki zapobiegawcze (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgSpecjalne środki ostrozności
Wydłużenie odstępu QT Podczas badań klinicznych nad leczeniem arypiprazolem w postaci doustnej częstość przypadków wydłużenia odstępu QT była porównywalna z placebo. Arypiprazol należy stosować ostrożnie u pacjentów z wydłużeniem odstępu QT w wywiadzie rodzinnym (patrz punkt 4.8). Późne dyskinezy W badaniach klinicznych trwających nie dłużej niż rok zgłaszano niezbyt częste przypadki dyskinez występujące w trakcie leczenia arypiprazolem. Jeśli objawy przedmiotowe lub podmiotowe późnych dyskinez wystąpią u pacjentów leczonych arypiprazolem, należy rozważyć zmniejszenie dawki lub odstawienie leku (patrz punkt 4.8). Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Złośliwy zespół neuroleptyczny (ang. Neuroleptic Malignant Syndrome , NMS) NMS jest potencjalnie śmiertelnym zespołem objawów, które mogą wystąpić w związku z podawaniem leków przeciwpsychotycznych. W badaniach klinicznych odnotowano rzadkie przypadki NMS w czasie leczenia arypiprazolem.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgSpecjalne środki ostrozności
Klinicznymi objawami NMS są bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz przejawy zaburzeń stabilności układu wegetatywnego (nieregularne tętno lub wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak: zwiększenie aktywności fosfokinazy kreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Jednakże zgłaszano także zwiększenie aktywności fosfokinazy kreatynowej i rabdomiolizę niekoniecznie związane z NMS. Jeśli u pacjenta wystąpią wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS bądź wystąpi niewyjaśnionego pochodzenia wysoka gorączka bez innych objawów NMS, należy przerwać leczenie wszystkimi lekami przeciwpsychotycznymi, w tym także arypiprazolem (patrz punkt 4.8). Drgawki W badaniach klinicznych zgłaszano niezbyt częste przypadki napadów drgawkowych w czasie leczenia arypiprazolem.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgSpecjalne środki ostrozności
Z tego powodu arypiprazol należy stosować zachowując ostrożność u pacjentów, u których w przeszłości występowały napady drgawkowe lub u których występują choroby wiążące się ze skłonnością do takich napadów (patrz punkt 4.8). Pacjenci w podeszłym wieku z psychozą związaną z demencją Zwiększona śmiertelność W trzech badaniach nad arypiprazolem w postaci doustnej z grupą kontrolną otrzymującą placebo prowadzonych z udziałem pacjentów w podeszłym wieku z psychozą związaną z chorobą Alzheimera (n = 938; średnia wieku: 82,4 lat; zakres: 56 do 99 lat), pacjentom leczonym arypiprazolem zagrażało większe ryzyko zgonu w porównaniu do pacjentów otrzymujących placebo. Odsetek zgonów wśród pacjentów otrzymującej doustnie arypiprazol wynosił 3,5 % w porównaniu do 1,7 % dla placebo. Chociaż przyczyny zgonów były różne, to w większości zgonów miały one charakter sercowo- naczyniowy (np. niewydolność krążenia, nagły zgon) lub zakaźny (np. zapalenie płuc) (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgSpecjalne środki ostrozności
Działania niepożądane dotyczące krążenia mózgowego W tych samych badaniach nad arypiprazolem w postaci doustnej zgłaszano występowanie u pacjentów działań niepożądanych dotyczących krążenia mózgowego (np. udar, przemijający napad niedokrwienny), w tym zgonów (średnia wieku: 84 lata; zakres: 78 do 88 lat). Łącznie podczas tych badań działania niepożądane dotyczące krążenia mózgowego zgłoszono u 1,3 % pacjentów otrzymujących arypiprazol w postaci doustnej w porównaniu do 0,6 % pacjentów otrzymujących placebo. Różnica ta nie była statystycznie istotna. Jednakże w jednym z tych badań z zastosowaniem stałych dawek u pacjentów leczonych arypiprazolem występowała istotna zależność odpowiedzi od dawki w przypadku działań niepożądanych dotyczących krążenia mózgowego (patrz punkt 4.8). Arypiprazol nie jest wskazany w leczeniu pacjentów z psychozą związaną z demencją.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgSpecjalne środki ostrozności
Hiperglikemia i cukrzyca U pacjentów leczonych arypiprazolem zgłaszano hiperglikemię, w niektórych przypadkach bardzo wysoką z towarzyszącą kwasicą ketonową, śpiączką hiperosmotyczną lub zgonem. Nie przeprowadzono żadnych specjalnych badań stosowania produktu leczniczego Abilify Maintena u pacjentów z hiperglikemią ani z cukrzycą. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. Pacjentów leczonych arypiprazolem należy objąć obserwacją w kierunku objawów przedmiotowych i podmiotowych hiperglikemii (takich jak zwiększone pragnienie, wielomocz, nadmierne łaknienie i osłabienie), a pacjentów z cukrzycą lub z czynnikami ryzyka cukrzycy należy regularnie monitorować pod kątem pogorszenia kontroli glikemii (patrz punkt 4.8). Nadwrażliwość Podczas przyjmowania arypiprazolu mogą pojawić się reakcje nadwrażliwości charakteryzujące się objawami reakcji uczuleniowych (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgSpecjalne środki ostrozności
Zwiększenie masy ciała Zwiększenie masy ciała często obserwuje się u pacjentów ze schizofrenią w związku z przyjmowaniem leków przeciwpsychotycznych o znanym wpływie na zwiększanie się masy ciała, współistniejącymi chorobami i niehigienicznym trybem życia. Może to prowadzić do ciężkich powikłań. Po wprowadzeniu leku do obrotu zgłaszano przypadki zwiększania się masy ciała u pacjentów, którym przepisano arypiprazol w postaci doustnej. Jeśli takie przypadki występowały, to zwykle u pacjentów z istotnymi czynnikami ryzyka, takimi jak: cukrzyca, zaburzenia tarczycy lub gruczolak przysadki w wywiadzie. W badaniach klinicznych nie wykazano, aby arypiprazol powodował klinicznie istotne zwiększenie się masy ciała (patrz punkt 4.8). Dysfagia Ze stosowaniem arypiprazolu wiąże się spowolnienie motoryki przełyku i ryzyko aspiracji. Arypiprazol należy stosować ostrożnie u pacjentów z grupy ryzyka zachłystowego zapalenia płuc.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgSpecjalne środki ostrozności
Zaburzenie związane z hazardem i inne zaburzenia kontroli impulsów Podczas przyjmowania arypiprazolu u pacjentów mogą występować zwiększone popędy, w szczególności popęd do hazardu i niezdolność do kontrolowania tych popędów. Inne zgłaszane popędy obejmują: zwiększenie popędów seksualnych, kompulsywną potrzebę wydawania pieniędzy, obżarstwo lub kompulsywne objadanie się oraz inne impulsywne i kompulsywne zachowania. Ważne jest, aby lekarze przepisujący lek pytali pacjentów lub opiekunów w szczególności o pojawienie się nowego lub zwiększonego popędu do hazardu, popędów seksualnych, kompulsywnej potrzeby wydawania pieniędzy, obżarstwa lub kompulsywnego objadania się, lub innych popędów podczas leczenia arypiprazolem. Należy pamiętać, że objawy zaburzenia kontroli impulsów mogą być związane z chorobą podstawową; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu produktu leczniczego.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgSpecjalne środki ostrozności
Zaburzenia kontroli impulsów mogą zaszkodzić pacjentowi lub innym, jeśli nie zostaną rozpoznane. Należy rozważyć zmianę dawki lub odstawienie produktu leczniczego, jeśli u pacjenta wystąpią takie popędy (patrz punkt 4.8) Upadki Arypiprazol może powodować senność, niedociśnienie ortostatyczne, niestabilność ruchową i czuciową, co może prowadzić do upadków. Należy zachować ostrożność podczas leczenia pacjentów z grupy podwyższonego ryzyka i rozważyć zmniejszenie dawki początkowej (np. u pacjentów w podeszłym wieku lub pacjentów osłabionych, patrz punkt 4.2). Sód Produkt zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji produktu leczniczego Abilify Maintena. Informacje podane poniżej uzyskano z badań arypiprazolu w postaci doustnej. Podczas oceny potencjalnych interakcji z innymi produktami leczniczymi należy również uwzględnić dwumiesięczny odstęp między podaniem dawek i długi okres półtrwania arypiprazolu po podaniu produktu leczniczego Abilify Maintena 960 mg lub 720 mg. W związku z antagonistycznym działaniem wobec receptorów α1-adrenergicznych arypiprazol może nasilać działanie określonych leków przeciwnadciśnieniowych. Biorąc pod uwagę podstawowe działanie arypiprazolu na ośrodkowy układ nerwowy (OUN), należy zachować ostrożność podczas podawania arypiprazolu jednocześnie z alkoholem lub w skojarzeniu z innymi lekami wywierającymi wpływ na OUN z nakładającymi się działaniami niepożądanymi, takimi jak uspokojenie polekowe (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgInterakcje
Należy zachować ostrożność, podając arypiprazol w skojarzeniu z lekami o znanym działaniu powodującym wydłużenie odstępu QT lub zaburzenia elektrolitowe. Możliwy wpływ innych leków na arypiprazol Chinidyna i inne silne inhibitory CYP2D6 W badaniu klinicznym arypiprazolu podawanego doustnie zdrowym ochotnikom silny inhibitor CYP2D6 (chinidyna) zwiększał wartość AUC arypiprazolu o 107 %, natomiast wartość C max pozostawała niezmieniona. Wartości AUC i C max dehydroarypiprazolu, czynnego metabolitu, były odpowiednio zmniejszone o 32 % i o 47 %. Można przewidywać, że inne silne inhibitory CYP2D6, takie jak fluoksetyna i paroksetyna, mogą wywierać podobne działanie i dlatego należy w podobny sposób zmniejszyć dawkę (patrz punkt 4.2). Ketokonazol i inne silne inhibitory CYP3A4 W badaniu klinicznym arypiprazolu podawanego doustnie zdrowym ochotnikom silny inhibitor CYP3A4 (ketokonazol) zwiększał wartości AUC i C max arypiprazolu odpowiednio o 63 % i 37 %.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgInterakcje
Wartości AUC i C max dehydroarypiprazolu wzrosły odpowiednio o 77 % i 43 %. U pacjentów z wolnym metabolizmem przy udziale CYP2D6 jednoczesne podawanie silnych inhibitorów CYP3A4 może powodować większe stężenia arypiprazolu w osoczu w porównaniu do pacjentów z intensywnym metabolizmem przy udziale CYP2D6 (patrz punkt 4.2). W przypadku rozważania podawania ketokonazolu lub innych silnych inhibitorów CYP3A4 w skojarzeniu z arypiprazolem potencjalne korzyści powinny przeważać nad potencjalnym ryzykiem dla pacjenta. Można przewidywać, że inne silne inhibitory CYP3A4, takie jak itrakonazol i inhibitory proteazy HIV, mogą wywierać podobne działanie i dlatego należy w podobny sposób zmniejszyć dawkę (patrz punkt 4.2). Po przerwaniu przyjmowania inhibitora CYP2D6 lub CYP3A4 dawkę arypiprazolu należy zwiększyć do początkowej dawki z okresu przed rozpoczęciem terapii skojarzonej.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgInterakcje
Można spodziewać się łagodnego zwiększenia stężenia arypiprazolu w osoczu w przypadku jednoczesnego stosowania słabych inhibitorów CYP3A4 (np. diltiazem) lub CYP2D6 (np. escytalopram) z arypiprazolem. Karbamazepina i inne leki indukujące CYP3A4 Po podaniu karbamazepiny, silnego leku indukującego CYP3A4, w skojarzeniu z doustnym arypiprazolem pacjentom ze schizofrenią lub zaburzeniami schizoafektywnymi, średnie geometryczne wartości C max i AUC arypiprazolu były odpowiednio o 68 % i 73 % mniejsze w porównaniu do doustnego arypiprazolu (30 mg) podawanego w monoterapii. Podobnie średnie geometryczne wartości C max i AUC dehydroarypiprazolu po jednoczesnym podaniu karbamazepiny były mniejsze odpowiednio o 69 % i 71 %, niż te wartości po podaniu doustnego arypiprazolu w monoterapii. Można oczekiwać, że podobne działanie może wywierać podawanie produktu leczniczego Abilify Maintena 960 mg/720 mg w skojarzeniu z innymi lekami indukującymi CYP3A4 (takimi jak ryfampicyna, ryfabutyna, fenytoina, fenobarbital, primidon, efawirenz, newirapina i ziele dziurawca).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgInterakcje
Należy unikać podawania leków indukujących CYP3A4 w skojarzeniu z produktem leczniczym Abilify Maintena 960 mg/720 mg, ponieważ powoduje to zmniejszenie stężenia arypiprazolu we krwi i takie stężenie może nie być skuteczne. Zespół serotoninowy Zgłaszano przypadki zespołu serotoninowego u pacjentów przyjmujących arypiprazol i możliwe objawy przedmiotowe i podmiotowe tego zespołu mogą wystąpić szczególnie w przypadku jednoczesnego stosowania z innymi lekami o działaniu serotoninergicznym, takimi jak selektywne inhibitory zwrotnego wychwytu serotoniny/inhibitory wychwytu zwrotnego serotoniny i noradrenaliny (SSRI/SNRI, ang. Selective Serotonin Reuptake Inhibitor/Serotonin and Noradrenaline Reuptake Inhibitor ) lub z lekami, o których wiadomo, że wpływają na zwiększenie stężenia arypiprazolu (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Kobiety w wieku rozrodczym Oczekuje się, że narażenie na arypiprazol w osoczu po podaniu pojedynczej dawki produktu leczniczego Abilify Maintena utrzymuje się przez okres do 34 tygodni (patrz punkt 5.2). Należy to wziąć pod uwagę przy rozpoczynaniu leczenia u kobiet w wieku rozrodczym, biorąc pod uwagę ewentualną przyszłą ciążę lub karmienie piersią. Produkt leczniczy Abilify Maintena należy stosować u kobiet planujących zajście w ciążę tylko, jeśli jest to bezwzględnie konieczne. Ciąża Nie prowadzono odpowiednich i dobrze kontrolowanych badań klinicznych arypiprazolu u kobiet w okresie ciąży. Zgłaszano występowanie wad wrodzonych, jednak nie można było ustalić ich związku przyczynowego z arypiprazolem. W badaniach na zwierzętach nie można było wykluczyć potencjalnego wystąpienia objawów toksyczności rozwojowej (patrz punkt 5.3).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWpływ na płodność, ciążę i laktację
Pacjentki należy poinformować o konieczności powiadomienia swojego lekarza o zajściu w ciążę lub planowaniu zajścia w ciążę podczas leczenia arypiprazolem. Lekarze przepisujący recepty muszą pamiętać o długotrwałych właściwościach produktu leczniczego Abilify Maintena. Arypiprazol był wykrywany w osoczu u dorosłych pacjentów w okresie do 34 tygodni po podaniu pojedynczej dawki zawiesiny o przedłużonym uwalnianiu. Noworodki narażone na działanie leków przeciwpsychotycznych (w tym arypiprazolu) w czasie trzeciego trymestru ciąży należą do grupy ryzyka narażonej na wystąpienie działań niepożądanych, w tym zaburzeń pozapiramidowych i (lub) objawów z odstawienia, które po porodzie mogą różnić się nasileniem i czasem trwania. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być objęte ścisłą obserwacją (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWpływ na płodność, ciążę i laktację
Narażenie matki na produkt leczniczy Abilify Maintena przed i w okresie ciąży może prowadzić do wystąpienia działań niepożądanych u noworodka. Produktu leczniczego Abilify Maintena nie należy stosować w okresie ciąży, jeśli nie jest to bezwzględnie konieczne. Karmienie piersią Jeśli produkt Abilify Maintena jest podawany kobietom karmiącym piersią, arypiprazol/metabolity przenikają do mleka ludzkiego w takim stopniu, że prawdopodobny jest wpływ na niemowlęta karmione piersią . Ponieważ oczekuje się, że pojedyncza dawka produktu leczniczego Abilify Maintena utrzymuje się w osoczu przez okres do 34 tygodni (patrz punkt 5.2), niemowlętom karmionym piersią może zagrażać ryzyko nawet jeśli produkt leczniczy Abilify Maintena był podany na długo przed karmieniem piersią. Pacjentki obecnie leczone, lub które były wcześniej leczone, produktem leczniczym Abilify Maintena w ciągu ostatnich 34 tygodni, nie powinny karmić piersią.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWpływ na płodność, ciążę i laktację
Płodność Arypiprazol nie zaburzał płodności na podstawie danych z badań nad toksycznym wpływem arypiprazolu na reprodukcję.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Arypiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z możliwym wpływem na układ nerwowy i wzrok, takim jak uspokojenie polekowe, senność, omdlenie, niewyraźne widzenie, podwójne widzenie (patrz punkt 4.8).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Profil bezpieczeństwa produktu leczniczego Abilify Maintena 960 mg i Abilify Maintena 720 mg w leczeniu schizofrenii u dorosłych opiera się na odpowiednich i dobrze kontrolowanych badaniach leków Abilify Maintena 400 mg i Abilify Maintena 300 mg. Zasadniczo, działania niepożądane obserwowane w badaniach klinicznych produktu leczniczego Abilify Maintena 960 mg/720 mg były podobne do działań niepożądanych obserwowanych w badaniach klinicznych produktu leczniczego Abilify Maintena 400 mg/300 mg. Najczęściej obserwowanymi podczas badań klinicznych działaniami niepożądanymi powodowane przez produkt leczniczy zgłaszane u ≥ 5% pacjentów w dwóch długoterminowych badań klinicznych prowadzonych metodą podwójnie ślepej próby leczonych produktem Abilify Maintena 400 mg/300 mg były: zwiększenie masy ciała (9,0%), akatyzja (7,9%) i bezsenność (5,8%).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
Najczęściej obserwowanymi podczas badań klinicznych działaniami niepożądanymi powodowanymi przez produkt leczniczy Abilify Maintena 960 mg/720 mg były: zwiększenie masy ciała (22,7%), ból w miejscu wstrzyknięcia (18,2%), akatyzja (9,8%), lęk (8,3%), ból głowy (7,6%), bezsenność (7,6%) i zaparcia (6,1%). Tabelaryczne zestawienie działań niepożądanych Częstość występowania działań niepożądanych związanych z produktem leczniczym Abilify Maintena 400 mg/300 mg i 960 mg/720 mg podano w poniższej tabeli. Dane w tabeli oparto na reakcjach niepożądanych zgłaszanych podczas badań klinicznych i (lub) stosowania po wprowadzeniu do obrotu. Wszystkie działania niepożądane podano według klasyfikacji układ/narząd i częstości: bardzo często (≥ 1/10), często (≥ 1/100 do < 1/10); niezbyt często (≥ 1/1 000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1 000), bardzo rzadko (< 1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Działania niepożądane wymienione z częstością występowania „nieznana” zgłaszano po wprowadzeniu produktu do obrotu.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
Klasyfikacja układów i narządów Często Niezbyt często Nieznana Zaburzenia krwi i układu chłonnego Neutropenia Niedokrwistość Trombocytopenia Zmniejszenie liczby neutrofili Zmniejszenie liczbybiałych krwinek Leukopenia Zaburzenia układu immunologi cznego Nadwrażliwość Reakcje uczuleniowe (np. reakcja anafilaktyczna, obrzęk naczynioruchowy obejmujący obrzęk języka, obrzęk twarzy,świąd lub pokrzywkę) Zaburzeniaendokrynologi czne Zmniejszenie stężenia prolaktyny we krwiHiperprolaktynemia Cukrzycowa śpiączkahiperosmolarna Kwasica ketonowa Zaburzenia metabolizmu i odżywiania Zwiększenie masy ciałaa CukrzycaZmniejszenie masy ciała Hiperglikemia Hipercholesterolemia Hiperinsulinemia Hiperlipidemia HipertrójglicerydemiaZaburzenia łaknienia Anoreksja Zmniejszony apetytb Hiponatremia Zaburzenia psychiczne Nadmierne pobudzenieLęk Niepokój Bezsenność Myśli samobójcze Zaburzenia psychotyczne OmamyUrojenia Hiperseksualność Reakcje paniki DepresjaChwiejność emocjonalnaApatia Dysforia Zaburzenia snu BruksizmObniżenie libidoZmiany nastroju Dokonane samobójstwo Próba samobójcza Zaburzenia związane z hazardemZaburzenia kontroli impulsów ObżarstwoKompulsywna potrzeba wydawania pieniędzy Poriomania Nerwowość Zachowania agresywne Zaburzenia układu nerwowego Zaburzenia pozapiramidowe Akatyzja Drżenie Dyskineza Sedacja Senność Zawroty głowy Bóle głowy DystoniaPóźne dyskinezy Parkinsonizm Zaburzenia ruchu Nadpobudliwość psychomotoryczna Zespół „niespokojnych nóg”Sztywność mięśni szkieletowych Hipertonia Spowolnienie ruchowe ŚlinotokZaburzenia smakuOmamy węchowe Złośliwy zespół neuroleptyczny Uogólniony napad toniczno-kloniczny Zespół serotoninowy Zaburzenia mowy - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
Klasyfikacja układów i narządów Często Niezbyt często Nieznana Zaburzeniaoka Napad przymusowego patrzenia z rotacją gałek Niewyraźne widzenie Ból okaPodwójne widzenie Światłowstręt (fotofobia) Zaburzenia serca Dodatkowe skurcze komorowe Bradykardia TachykardiaZmniejszenie amplitudy załamka T w EKG Nieprawidłowości w badaniu EKGInwersja załamka T w EKG Nagły zgon Zatrzymanie akcji serca Torsades de pointes Arytmie komorowe Wydłużony odstęp QT Zaburzenia naczyniowe Nadciśnienie tętnicze Hipotensja ortostatyczna Podwyższone ciśnienie krwi OmdleniaChoroba zatorowa żył (w tym zator płucnyi zakrzepica żył głębokich) Zaburzenia układu oddechowego, klatkipiersiowej i śródpiersia KaszelCzkawka Skurcz części ustnej gardłaSkurcz krtani Zachłystowe zapalenie płuc Zaburzenia żołądka i jelit Suchość w jamie ustnej Choroba refluksowa przełyku Niestrawność WymiotyBiegunkaNudnościBól w nadbrzuszu Dyskomfort w jamie brzusznejZaparciaCzęste wypróżnieniaNadmierne wydzielanie śliny Zapalenie trzustki Dysfagia - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
Klasyfikacja układów i narządów Często Niezbyt często Nieznana Zaburzenia wątroby i dróg żółciowych Nieprawidłowy wynik testów wątrobowych Zwiększenie aktywności enzymów wątrobowych Podwyższenie aktywności aminotransferazy alaninowejZwiększenie aktywności gamma- glutamylotransferazy Podwyższone stężenie bilirubiny we krwi Podwyższenie aktywności aminotransferazyasparaginianowej Niewydolność wątroby ŻółtaczkaZapalenie wątroby Zwiększenie aktywności fosfatazy zasadowej Zaburzenia skóry i tkanki podskórnej Łysienie TrądzikTrądzik różowaty Egzema Stwardnienia skóry WysypkaReakcja fotoalergiczna Nadmierne pocenie się Wysypka polekowa z eozynofilią i objawami ogólnoustrojowymi(zespół DRESS) Zaburzenia mięśniowo- szkieletowe i tkanki łącznej Sztywność mięśniowo- szkieletowa Sztywność mięśni Skurcze mięśni Drżenie mięśni Napięcie mięśni Bóle mięśniowe Ból w kończynach Ból stawówBól pleców Zmniejszenie zakresu ruchu stawu Sztywność karkuSzczękościsk Rozpad mięśni poprzecznie prążkowanych (rabdomioliza) Zaburzenianerek i drógmoczowych Kamica nerkowa Cukromocz Zatrzymanie moczu Nietrzymanie moczu Ciąża, połógi okresokołoporodowy Zespół abstynencyjny u noworodków Zaburzenia układu rozrodczego ipiersi Zaburzenia erekcji Mlekotok Ginekomastia Wrażliwość piersiSuchość pochwy Długotrwały wzwód - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
Klasyfikacja układów i narządów Często Niezbyt często Nieznana Zaburzenia ogólne i stany w miejscu podania Reakcje w miejscupodaniaaStwardnienie w miejscu podania Zmęczenie GorączkaAsteniaZaburzenia chodu Dyskomfort w klatce piersiowejReakcja w miejscupodaniaRumień w miejscupodaniaObrzęk w miejscupodaniaDyskomfort w miejscupodaniaŚwiąd w miejscupodaniaWzmożone pragnienie Spowolnienie Zaburzenia regulacji temperatury (np. hipotermia, gorączka) Ból w klatce piersiowej Obrzęk obwodowy Badaniadiagnostyczne Zwiększenie aktywności fosfokinazy kreatynowej we krwi Zwiększenie stężenia glukozy we krwi Zmniejszenie stężenia glukozy we krwi Zwiększenie stężenia glikozylowanej hemoglobiny Zwiększenie obwodu w pasieZmniejszenie stężenia cholesterolu we krwi Zmniejszenie stężeniatriglicerydów we krwi Wahania stężenia glukozy we krwi - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
a: Zgłaszane jako bardzo często występujące podczas badań klinicznych produktu leczniczego Abilify Maintena 960 mg/720 mg. b: zgłaszane tylko podczas badań klinicznych produktu leczniczego Abilify Maintena 960 mg/720 mg. Opis wybranych działań niepożądanych Reakcje w miejscu podania Odsetek pacjentów w otwartym badaniu, u których zgłaszano jakiekolwiek działania niepożądane związane z miejscem wstrzyknięcia (wszystkie zgłaszane jako ból w miejscu wstrzyknięcia), wynosił 18,2% u pacjentów leczonych produktem leczniczym Abilify Maintena 960 mg i 9,0% u pacjentów leczonych produktem leczniczym Abilify Maintena 400 mg. W obu grupach leczenia u większości pacjentów zgłaszany ból w miejscu wstrzyknięcia wystąpił po pierwszym wstrzyknięciu produktu leczniczego Abilify Maintena 960 mg (u 21 na 24 pacjentów) lub produktu leczniczego Abilify Maintena 400 mg (u 7 na 12 pacjentów) i ustąpił w ciągu 5 dni oraz był zgłaszany ze zmniejszającą się częstością i nasileniem po kolejnych wstrzyknięciach.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
Ogólny średni wynik w skali analogowej dla bólu w miejscu podania (0 = brak bólu do 100 = nieznośnie silny ból) w przypadku ocen bólu przez pacjentów był podobny w obu grupach leczenia po podaniu ostatniego wstrzyknięcia: 0,8 przed podaniem i 1,4 po podaniu w grupie otrzymującej produkt leczniczy Abilify Maintena 960 mg w porównaniu do 1,3 po podaniu w grupie otrzymującej produkt leczniczy Abilify Maintena 400 mg. Neutropenia Neutropenię zgłaszano w programie klinicznym dotyczącym produktu leczniczego Abilify Maintena 400 mg/300 mg i zazwyczaj pojawiała się ona około 16 dnia po pierwszym podaniu i utrzymywała się średnio 18 dni. Objawy pozapiramidowe (ang. EPS) W badaniach z udziałem pacjentów ze stabilną schizofrenią podawanie produktu leczniczego Abilify Maintena 400 mg/300 mg wiązało się z większą częstością objawów EPS (18,4 %) niż w przypadku leczenia arypiprazolem w postaci doustnej (11,7 %).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
Akatyzja była najczęściej zgłaszanym objawem (8,2 %) i zazwyczaj pojawiała się ona około 10. dnia po pierwszym podaniu, a utrzymywała się średnio 56 dni. Pacjenci z akatyzją zwykle przyjmowali w ramach leczenia leki przeciwcholinergiczne, głównie mesylat benzatropiny i triheksyfenidyl. Rzadziej w leczeniu akatyzji podawano substancje, takie jak propranolol i benzodiazepiny (klonazepam i diazepam). Na kolejnym miejscu były przypadki parkinsonizmu z częstością występowania wynoszącą 6,9 % dla produktu leczniczego Abilify Maintena 400 mg/300 mg, 4,2 % dla arypiprazolu 10 mg do 30 mg w postaci tabletek doustnych i 3,0 % dla placebo. Dane z otwartego badania pacjentów leczonych produktem leczniczym Abilify Maintena 960 mg wykazały minimalną zmianę w stosunku do wartości początkowej w wynikach EPS, ocenianych za pomocą skali oceny Simpsona-Angusa (ang. Simpson-Angus Rating , SAS), skali oceny nieprawidłowych ruchów mimowolnych (ang.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
Abnormal Involuntary Movement Scale , AIMS) oraz skali oceny akatyzji Barnesa (ang. Barnes Akathisia Rating Scale , BARS). Częstość występowania zgłaszanych zdarzeń związanych z EPS u pacjentów leczonych produktem leczniczym Abilify Maintena 960 mg wynosiła 18,2% w porównaniu do częstości występowania u pacjentów leczonych produktem leczniczym Abilify Maintena 400 mg, która wynosiła 13,4%. Dystonia Efekt klasy terapeutycznej: objawy dystonii, długotrwałe nieprawidłowe skurcze grup mięśni, mogą występować u wrażliwych pacjentów w ciągu pierwszych kilku dni leczenia. Do objawów dystonii należą: skurcze mięśni szyi, czasami postępujące do ucisku w gardle, trudności z przełykaniem, trudności z oddychaniem i (lub) protruzja języka. Chociaż objawy te mogą występować po zastosowaniu małych dawek, występują częściej i z większym nasileniem podczas stosowania leków przeciwpsychotycznych pierwszej generacji o silnym działaniu i w większych dawkach.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
Obserwowano zwiększone ryzyko ostrej dystonii u mężczyzn i w młodszych grupach wiekowych. Masa ciała Podczas długoterminowego badania prowadzonego przez 38 tygodni metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną (patrz punkt 5.1), częstość przypadków zwiększenia się masy ciała o 7 % od pomiaru początkowego do ostatniej wizyty wynosiła 9,5 % dla produktu leczniczego Abilify Maintena 400 mg/300 mg i 11,7 % dla arypiprazolu 10 mg do 30 mg w postaci tabletek doustnych. Częstość przypadków zmniejszenia się masy ciała o ≥ 7 % od pomiaru początkowego do ostatniej wizyty wynosiła 10,2 % w grupie otrzymującej produktu leczniczy Abilify Maintena 400 mg/300 mg i 4,5 % w grupie otrzymującej arypiprazol doustnie w tabletkach 10 mg do 30 mg. Podczas długoterminowego badania prowadzonego przez 52 tygodnie metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo (patrz punkt 5.1) częstość przypadków zwiększania się masy ciała o 7 % od pomiaru początkowego do ostatniej wizyty wynosiła 6,4 % dla produktu leczniczego Abilify Maintena 400 mg/300 mg i 5,2 % dla placebo.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
Częstość przypadków zmniejszenia się masy ciała o ≥ 7 % od pomiaru początkowego do ostatniej wizyty wynosiła 6,4 % dla produktu leczniczego Abilify Maintena 400 mg/300 mg i 6,7 % dla placebo. Podczas leczenia prowadzonego metodą podwójnie ślepej próby średnia zmiana masy ciała od pomiaru początkowego do ostatniej wizyty wynosiła −0,2 kg w grupie otrzymującej produktu leczniczy Abilify Maintena 400 mg/300 mg i −0,4 kg w grupie otrzymującej placebo (p = 0,812). W otwartym, randomizowanym badaniu z zastosowaniem kilku dawek z udziałem dorosłych pacjentów ze schizofrenią (i zaburzeniem dwubiegunowym typu I), w którym postać produktu leczniczego Abilify Maintena 960 mg podawanego co dwa miesiące oceniano w porównaniu do produktu leczniczego Abilify Maintena 400 mg podawanego co miesiąc, całkowita częstość przyrostu masy ciała ≥ 7% w stosunku do wartości początkowej była porównywalna między produktem leczniczym Abilify Maintena 960 mg (40,6 %) a produktem leczniczym Abilify Maintena 400 mg (42,9 %).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
Średnia zmiana masy ciała od pomiaru początkowego do ostatniej wizyty wynosiła 3,6 kg w grupie otrzymującej Abilify Maintena 960 mg i 3,0 kg w grupie otrzymującej Abilify Maintena 400 mg. Prolaktyna Podczas badań klinicznych w zakresie zarejestrowanych wskazań i po wprowadzeniu produktu leczniczego do obrotu u pacjentów otrzymujących arypiprazol obserwowano zarówno zwiększenie, jak i zmniejszenie stężenia prolaktyny w surowicy w porównaniu do pomiarów początkowych (punkt 5.1). Zaburzenie związane z hazardem i inne zaburzenia kontroli impulsów Zaburzenie związane z hazardem, hiperseksualność, kompulsywna potrzeba wydawania pieniędzy i obżarstwo lub kompulsywne objadanie się mogą wystąpić u pacjentów leczonych arypiprazolem (patrz punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania wymienionego w załączniku V .
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgPrzedawkowanie
4.9 Przedawkowanie Podczas badań klinicznych arypiprazolu nie zgłaszano żadnych przypadków przedawkowania związanych z działaniami niepożądanymi. Chociaż doświadczenia związane z przedawkowaniem arypiprazolu są ograniczone, wśród nielicznych przypadków przedawkowania (przypadkowego lub zamierzonego) zgłaszanych w badaniach klinicznych i po wprowadzeniu do obrotu arypiprazolu w postaci doustnej, największe szacowane spożycie wynosiło łącznie 1 260 mg bez zgonów. Potencjalną możliwość uwolnienia całej dawki oceniano poprzez symulację stężeń arypiprazolu w osoczu po całkowitym wchłonięciu dawki produktu leczniczego Abilify Maintena 960 mg w krążeniu ogólnoustrojowym . W oparciu o wyniki symulacji, w przypadku wystąpienia uwolnienia całej dawki, stężenie arypiprazolu może być do 13,5 raza większe niż stężenia osiągane przy zastosowaniu dawki terapeutycznej produktu leczniczego Abilify Maintena 960 mg bez uwolnienia całej dawki.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgPrzedawkowanie
Ponadto stężenie arypiprazolu po uwolnieniu całej dawki uległoby zmniejszeniu w ciągu 5 dni do stężeń zwykle obserwowanych po podaniu produktu leczniczego Abilify Maintena 960 mg. Objawy przedmiotowe i podmiotowe Należy zachować ostrożność podczas wykonywania wstrzyknięcia, aby nie wstrzyknąć tego produktu leczniczego do naczynia krwionośnego. Po stwierdzonym lub podejrzewanym przypadkowym przedawkowaniu/nieumyślnym podaniu dożylnym arypiprazolu, konieczna jest ścisła obserwacja pacjenta. Potencjalnie ważne klinicznie objawy podmiotowe i przedmiotowe to: letarg, zwiększenie ciśnienia tętniczego krwi, senność, tachykardia, nudności, wymioty i biegunka. Postępowanie po przedawkowaniu Brak znanego swoistego antidotum dla arypiprazolu. Postępowanie w przypadku przedawkowania powinno obejmować leczenie wspomagające, w tym ścisłą obserwację i kontrolę pacjenta przez lekarza. Należy zapewnić odpowiednią drożność dróg oddechowych, natlenienie i wspomaganie oddychania.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgPrzedawkowanie
Monitorować rytm serca i parametry życiowe. Stosować leczenie wspomagające i objawowe. Leczenie powinno obejmować ogólne środki stosowane w leczeniu przedawkowania jakiegokolwiek produktu leczniczego. Należy rozważyć możliwość przedawkowania kilku produktów leczniczych. Przy ocenie potrzeb leczenia i poprawy stanu zdrowia należy wziąć pod uwagę długotrwałe działanie produktu leczniczego oraz długi okres półtrwania arypiprazolu w fazie eliminacji.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX12 Mechanizm działania Przyjmuje się, że skuteczność arypiprazolu w leczeniu schizofrenii związana jest ze skojarzonym działaniem częściowo agonistycznym wobec receptora dopaminowego D 2 i receptora serotoninowego 5-HT 1A oraz z działaniem antagonistycznym wobec receptora serotoninowego 5-HT 2A . Antagonistyczne właściwości arypiprazolu wykazano na zwierzęcym modelu hiperaktywności dopaminergicznej, a właściwości agonistyczne na zwierzęcym modelu hipoaktywności dopaminergicznej. W warunkach in vitro arypiprazol wykazuje silne powinowactwo do receptorów dopaminowych D 2 i D 3 , serotoninowych 5HT 1A i 5HT 2A oraz umiarkowane powinowactwo do receptorów dopaminowych D 4 , serotoninowych 5HT 2C i 5HT 7 , a także adrenergicznych alfa-1 i histaminowych H 1 .
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Arypiprazol wykazuje także umiarkowane powinowactwo do miejsc wychwytu zwrotnego serotoniny, nie wykazuje natomiast istotnego powinowactwa do cholinergicznych receptorów muskarynowych. Interakcje z receptorami innymi niż podtypy receptorów dopaminowych i serotoninowych pozwalają na wyjaśnienie niektórych innych właściwości klinicznych arypiprazolu. Arypiprazol podawany doustnie w dawkach od 0,5 mg do 30 mg raz na dobę przez 2 tygodnie zdrowym ochotnikom powoduje zależne od dawki zmniejszenie wiązania rakloprydu znakowanego 11 C, ligandu receptora D 2 /D 3 , w jądrze ogoniastym i skorupie, co można wykryć za pomocą pozytonowej tomografii emisyjnej. Skuteczność kliniczna i bezpieczeństwo stosowania Leczenie podtrzymujące schizofrenii u dorosłych Skuteczność produktu leczniczego Abilify Maintena 960 mg, podawanego co dwa miesiące, została częściowo określona na podstawie porównania parametrów farmakokinetycznych w ramach otwartego, wieloośrodkowego, randomizowanego badania z zastosowaniem kilku dawek, prowadzonego w grupach równoległych.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Badanie wykazało, że produkt leczniczy Abilify Maintena 960 mg zapewnia podobne stężenie arypiprazolu, a tym samym podobną skuteczność, jak produkt leczniczy Abilify Maintena 400 mg w czasie pomiędzy podaniem kolejnych dawek (patrz punkt 5.2). Podobieństwo stężeń arypiprazolu w osoczu w przypadku produktu leczniczego Abilify Maintena 960 mg i produktu leczniczego Abilify Maintena 400 mg przedstawiono w tabeli 2. Tabela 2: Współczynnik średniej geometrycznej i przedział ufności (CI) po czwartym podaniu produktu leczniczego Abilify Maintena 960 mg lub siódmym i ósmym podaniu produktu leczniczego Abilify Maintena 400 mg w badaniu otwartym
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Parametr Współczynnik(Abilify Maintena 960 mg/Abilify Maintena 400 mg) 90% CI aAUC0-56 1,006c 0,851 - 1,190 bC56/C28 1,011d 0,893 - 1,145 bCmax 1,071c 0,903 - 1,270 - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
a Wartość AUC 0-56 po czwartym podaniu produktu leczniczego Abilify Maintena 960 mg lub suma wartości AUC 0-28 po siódmym i ósmym podaniu produktu leczniczego Abilify Maintena 400 mg b Stężenia arypiprazolu w osoczu po czwartym podaniu produktu leczniczego Abilify Maintena 960 mg (C 56 ) lub ósmym podaniu produktu leczniczego Abilify Maintena 400 mg (C 28 ). c Abilify Maintena 960 mg (n = 34), Abilify Maintena 400 mg (n = 32) d Abilify Maintena 960 mg (n = 96), Abilify Maintena 400 mg (n = 82). Skuteczność produktu leczniczego Abilify Maintena 960 mg/720 mg w leczeniu schizofrenii jest dodatkowo wspierana przez określoną skuteczność produktu leczniczego Abilify Maintena 400 mg/300 mg, jak podsumowano poniżej: Skuteczność produktu Abilify Maintena 400 mg/300 mg Skuteczność produktu leczniczego Abilify Maintena 400 mg/300 mg w leczeniu podtrzymującym pacjentów ze schizofrenią ustalono w dwóch długoterminowych randomizowanych badaniach klinicznych prowadzonych metodą podwójnie ślepej próby.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Zasadnicze 38-tygodniowe badanie randomizowane prowadzone metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną miało na celu ustalenie skuteczności, bezpieczeństwa stosowania i tolerancji tego produktu leczniczego podawanego raz w miesiącu w postaci wstrzyknięcia w porównaniu do arypiprazolu w tabletkach 10 mg do 30 mg podawanego raz na dobę doustnie jako leczenie podtrzymujące u dorosłych pacjentów ze schizofrenią. Badanie składało się z fazy przesiewowej i 3 faz leczenia: fazy konwersji, fazy stabilizującej z zastosowaniem leku doustnego i fazy prowadzonej metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną. Sześciuset sześćdziesięciu dwóch pacjentów kwalifikujących się do trwającej 38 tygodni fazy prowadzonej metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną przydzielono losowo w stosunku 2:2:1 do leczenia metodą podwójnie ślepej próby do jednej z 3 grup leczenia: 1) Abilify Maintena 2) dawka stabilizująca arypiprazolu 10 mg do 30 mg w postaci doustnej lub 3) długodziałający arypiprazol 50 mg/25 mg w postaci wstrzyknięcia.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Dawka długodziałającego arypiprazolu 50 mg/25 mg została uwzględniona w badaniu jako arypiprazol w małej dawce w celu przetestowania czułości badania w schemacie badania z lekiem równoważnym. Wyniki analizy pierwszorzędowego punktu końcowego oceny skuteczności, szacowany odsetek pacjentów, u których występowało zagrożenie nawrotu choroby do końca 26. tygodnia fazy podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną wykazały, że produkt leczniczy Abilify Maintena 400 mg/300 mg jest równoważny z doustnym arypiprazolem w tabletkach 10 mg do 30 mg. Szacowany odsetek nawrotów do końca 26. tygodnia wynosił 7,12 % dla produktu leczniczego Abilify Maintena 400 mg/300 mg i 7,76 % dla arypiprazolu 10 mg do 30 mg w postaci tabletek doustnych, różnica o −0,64 %. Dziewięćdziesięciopięcioprocentowy przedział ufności (−5,26; 3,99) dla różnicy w zakresie szacowanego odsetka pacjentów, którym zagraża nawrót choroby do 26.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
tygodnia, wyłączał wstępnie określony margines równoważności 11,5 %. Z uwagi na to produkt leczniczy Abilify Maintena 400 mg/300 mg jest równoważny z doustną postacią arypiprazolu w tabletkach 10 mg do 30 mg. Szacowany odsetek pacjentów, którym zagraża nawrót choroby do końca 26. tygodnia dla produktu leczniczego Abilify Maintena 400 mg/300 mg wynosił 7,12 %, co było statystycznie znamiennie niższe niż dla długo działającego arypiprazolu 50 mg/25 mg w postaci wstrzyknięcia (21,80 %; p = 0,0006). Zatem ustalono wyższość produktu leczniczego Abilify Maintena 400 mg/300 mg nad długodziałającym arypiprazolem 50 mg/25 mg w postaci wstrzyknięcia i potwierdzono wiarygodność schematu badania. Na Rysunku 1 przedstawiono krzywe Kaplana-Meiera czasu od randomizacji do zagrażającego nawrotu choroby w ciągu trwającej 38 tygodni podwójnie ślepej fazy z grupą kontrolną otrzymującą substancję czynną dla produktu leczniczego Abilify Maintena 400 mg/300 mg, doustnego arypiprazolu 10 mg do 30 mg i długo działającego arypiprazolu 50 mg/25 mg w postaci wstrzyknięcia.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Rys. 1: Wykres Kaplana-Meiera limitu produktu dla czasu do nasilenia objawów psychotycznych/zagrażającego nawrotu ARIP IMD 400/ 300 mg ARIP 10-30 mg ARIP IMD 50/25 mg Liczba uczestników z grupy ryzyka Test log-rank ARIP IMD 400/300 mg w porównaniu do ARIP 10-30 mg: wartość p = 0,9920 ARIP IMD 400/300 mg w porównaniu do ARIP IMD 50/25 mg: wartość p < 0,0001
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Liczba pacjentów, którym nie zagraża nawrót choroby 1,0 0,8 0,6 0,4 0,2 0,0 IMD 400/300 mg ARIP 10-30 mg IMD 50/25 mg
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Dni od randomizacji UWAGA: ARIP IMD 400/300 mg = Abilify Maintena; ARIP 10 mg do 30 mg = doustny arypiprazol; ARIP IMD 50/25 mg = długodziałający arypiprazol w postaci wstrzyknięcia Ponadto równorzędność produktu leczniczego Abilify Maintena w porównaniu do doustnego arypiprazolu 10 mg do 30 mg potwierdzają wyniki analizy wg skali objawów pozytywnych i negatywnych w schizofrenii (ang. Positive and Negative Syndrome Scale Score , PANSS). Tabela 3: Łączny wynik w skali PANSS – zmiana od pomiaru początkowego do 38. tygodnia – ostatnia obserwacja przeniesiona dalej (ang. Last Observation Carried Forward , LOCF): Randomizowana próba skuteczności a, b
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Abilify Maintena400 mg/300 mg(n = 263) Arypiprazol w postaci doustnej 10 mg-30 mg/dobę(n = 266) Długodziałający arypiprazol w postaci wstrzyknięcia50 mg/25 mg(n = 131) Średnia wartość początkowa (SD) 57,9 (12,94) 56,6 (12,65) 56,1 (12,59) Średnia zmiana (SD) −1,8 (10,49) 0,7 (11,60) 3,2 (14,45) Wartość-P nie dotyczy 0,0272 0,0002 - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
a Zmiana ujemna oceny oznacza poprawę. b Do oceny włączono wyłącznie pacjentów z oceną początkową i co najmniej jedną oceną po ocenie początkowej. Wartości P wyprowadzono z porównania zmiany od pomiaru początkowego podczas analizy modelu kowariancji z lekiem jako wyrazem i oceną początkową jako zmienną. Drugie badanie prowadzone przez 52 tygodnie było badaniem randomizowanym z wycofaniem, prowadzonym metodą podwójnie ślepej próby prowadzonym w Stanach Zjednoczonych u dorosłych pacjentów z aktualnym rozpoznaniem schizofrenii. Badanie składało się z fazy przesiewowej i 4 faz leczenia: fazy konwersji, fazy stabilizującej z zastosowaniem leku doustnego, fazy stabilizującej z zastosowaniem leku podawanego domięśniowo i fazy prowadzonej metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Pacjenci, którzy spełnili wymóg stabilizacji choroby lekiem doustnym w fazie stabilizującej leczenia doustnego, zostali przydzieleni do otrzymywania metodą pojedynczej ślepej próby produktu leczniczego Abilify Maintena 400 mg/300 mg i rozpoczęli fazę stabilizującą z zastosowaniem leku podawanego domięśniowo trwającą minimalnie 12 tygodni i maksymalnie 36 tygodni. Pacjenci kwalifikujący się do fazy prowadzonej metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo byli losowo przydzielani w proporcji 2:1 do leczenia metodą podwójnie ślepej próby produktem leczniczym Abilify Maintena 400 mg/300 mg lub placebo. Końcowa analiza skuteczności obejmowała 403 randomizowanych pacjentów i 80 przypadków zaostrzenia objawów psychotycznych/zdarzeń zagrożenia nawrotu choroby. W grupie otrzymującej placebo u 39,6 % pacjentów nastąpiła progresja do ryzyka zagrażającego nawrotu choroby, natomiast w grupie otrzymującej produkt leczniczy Abilify Maintena 400 mg/300 mg ryzyko zagrażającego nawrotu choroby wystąpiło u 10 % pacjentów; zatem pacjentom z grupy otrzymującej placebo zagrażało 5,03-krotnie większe ryzyko zagrażającego nawrotu choroby Prolaktyna Podczas badania prowadzonego przez 38 tygodni metodą podwójnie ślepej próby z grupą kontrolną otrzymującą substancję czynną występowało średnie zmniejszenie stężeń prolaktyny w grupie otrzymującej produkt leczniczy Abilify Maintena 400 mg/300 mg (−0,33 ng/ml) w porównaniu do średniego zwiększenia w grupie otrzymującej arypiprazol doustnie w tabletkach 10 mg do 30 mg (0,79 ng/ml; p < 0,01).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Częstość występowania wśród pacjentów przyjmujących produkt leczniczy Abilify Maintena 400 mg/300 mg stężenia prolaktyny > 1-krotności górnej granicy normy (GGN) podczas wszystkich ocen wynosiła 5,4 % w porównaniu do 3,5 % pacjentów przyjmujących doustnie arypiprazol w tabletkach 10 mg do 30 mg. W każdej grupie leczenia u pacjentów płci męskiej częstość była generalnie większa niż u kobiet. Podczas badania prowadzonego przez 52 tygodnie metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo występowało średnie zmniejszenie stężeń prolaktyny w grupie otrzymującej produkt leczniczy Abilify Maintena 400 mg/300 mg (−0,38 ng/ml) w porównaniu do średniego zwiększenia w grupie otrzymującej placebo (1,67 ng/ml). Częstość stężenia prolaktyny > 1-krotności górnej granicy normy (GGN) wśród pacjentów przyjmujących produkt leczniczy Abilify Maintena 400 mg/300 mg wynosiła 1,9 % w porównaniu do 7,1 % u pacjentów otrzymujących placebo.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Leczenie ostrych przypadków schizofrenii u dorosłych Skuteczność produktu leczniczego Abilify Maintena 400 mg/300 mg u dorosłych pacjentów z ostrym nawrotem schizofrenii określono w krótkotrwałym (12-tygodniowym), randomizowanym badaniu, prowadzonym metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo (n = 339). Główny punkt końcowy (zmiana łącznej oceny w skali PANSS w zakresie od pomiaru początkowego do 10 tygodnia) wykazał wyższość produktu leczniczego Abilify Maintena 400 mg/300 mg (n = 167) wobec placebo (n = 172). Podobnie do łącznej oceny w skali PANSS, zarówno podskala objawów pozytywnych, jak i negatywnych PANSS również wykazały poprawę (zmniejszenie) w miarę upływu czasu w porównaniu do pomiaru początkowego. Tabela 4: Łączny wynik w skali PANSS – zmiana od pomiaru początkowego do 10. tygodnia: Randomizowana próba skuteczności a
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Abilify Maintena400 mg/300 mg Placebo Średnia wartość początkowa (SD) 102,4 (11,4)n = 162 103,4 (11,1)n = 167 Średnia zmiana (SD) wyznaczona metodą najmniejszych kwadratów −26,8 (1,6)n = 99 −11,7 (1,6)n = 81 Wartość-P < 0,0001 Różnica leczeniab (95 % CI) −15,1 (−19,4, −10,8) - CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
a Dane były analizowane za pomocą analizy mieszanego modelu ponownych pomiarów ( ang. mixed model repeated measures MMRM). Analiza obejmowała wyłącznie uczestników losowo przydzielonych do grupy otrzymującej dany lek, którzy otrzymali co najmniej jedno wstrzyknięcie leku oraz przeprowadzono u nich ocenę skuteczności podczas pomiaru początkowego i co najmniej jedną taką ocenę w późniejszym czasie. b Różnica (Abilify Maintena minus placebo) wyznaczona metodą najmniejszych kwadratów w stosunku do pomiaru początkowego. Ponadto produkt leczniczy Abilify Maintena 400 mg/300 mg wykazywał również statystycznie istotną poprawę w zakresie objawów reprezentowanych przez zmianę oceny na skali ogólnego wrażenia klinicznego dotyczącego nasilenia objawów ( Clinical Global Impressions Severity , CGI-S) w zakresie od pomiaru początkowego do 10. tygodnia.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Funkcjonowanie indywidualne i społeczne oceniano przy użyciu skali funkcjonowania indywidualnego i społecznego (PSP - Personal and Social Performance). Skala PSP jest zwalidowaną, ocenianą przez lekarza skalą, mierzącą funkcjonowanie indywidualne i społeczne w czterech domenach: zajęć użytecznych społecznie (np. praca i nauka), związków osobistych i społecznych, dbałości o higienę osobistą oraz zachowań zakłócających porządek i agresywnych. Zaobserwowano statystycznie istotną różnicę na korzyść produktu leczniczego Abilify Maintena 400 mg/300 mg w porównaniu do placebo w 10. tygodniu (+7,1, p < 0,0001, 95 % CI: 4,1; 10,1 za pomocą modelu ANCOVA (LOCF)). Profil bezpieczeństwa był zgodny ze znanym profilem bezpieczeństwa produktu leczniczego Abilify Maintena 400 mg/300 mg. Niemniej występowały różnice w porównaniu do stosowania w leczeniu podtrzymującym schizofrenii.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakodynamiczne
Podczas krótkotrwałego (12-tygodniowego), randomizowanego badania, prowadzonego metodą podwójnie ślepej próby z udziałem pacjentów otrzymujących Abilify Maintena 400 mg/300 mg, objawy, które występowały co najmniej dwukrotnie częściej niż u pacjentów otrzymujących placebo, obejmowały zwiększenie masy ciała i akatyzję. Częstość występowania zwiększenia masy ciała wynoszącego ≤ 7 % od pomiaru początkowego do ostatniej wizyty (12. tydzień ) wynosiła 21,5 % w grupie pacjentów otrzymujących produkt Abilify Maintena 400 mg/300 mg w porównaniu do 8,5% w grupie placebo. Akatyzja była najczęściej obserwowanym objawem EPS (częstość występowania tego objawu w grupie otrzymującej produkt Abilify Maintena 400 mg/300 mg wynosiła 11,4 %, a w grupie placebo –3,5 %). Dzieci i młodzież Europejska Agencja Leków uchyliła obowiązek dołączenia wyników badań produktu leczniczego Abilify Maintena we wszystkich podgrupach populacji dzieci i młodzieży w leczeniu schizofrenii (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Farmakokinetyka arypiprazolu po podaniu produktu leczniczego Abilify Maintena, przedstawiona poniżej, opiera się na podaniu do mięśnia pośladkowego. Produkt Abilify Maintena 960 mg/720 mg dostarcza arypiprazol w okresie 2 miesięcy w porównaniu do produktu Abilify Maintena 400 mg/300 mg. Dawki produktu leczniczego Abilify Maintena 960 mg i 720 mg podawane do mięśnia pośladkowego zapewniają całkowite zakresy ekspozycji na arypiprazol mieszczące się w zakresie ekspozycji odpowiadającym odpowiednio dawkom 300 mg i 400 mg produktu leczniczego Abilify Maintena (podawanego raz w miesiącu). Ponadto średnie obserwowane maksymalne stężenia w osoczu (C max ) i stężenia arypiprazolu w osoczu na koniec okresu dawkowania były podobne w przypadku produktu leczniczego Abilify Maintena 960 mg/720 mg w porównaniu do odpowiadających im dawek produktu leczniczego Abilify Maintena 400 mg/300 mg (patrz punkt 5.1).
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakokinetyczne
Profile średniego stężenia arypiprazolu w osoczu zależnego od czasu po czwartym podaniu produktu leczniczego Abilify Maintena 960 mg (n = 102) lub po siódmym i ósmym podaniu produktu leczniczego Abilify Maintena 400 mg (n = 93) do mięśnia pośladkowego u pacjentów ze schizofrenią (i zaburzeniem dwubiegunowym typu I) przedstawiono na rysunku 2. Rysunek 2: Profil średniego stężenia arypiprazolu w osoczu zależnego od czasu po czwartym podaniu produktu leczniczego Abilify Maintena 960 mg lub po siódmym i ósmym podaniu produktu leczniczego Abilify Maintena 400 mg
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakokinetyczne
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakokinetyczne
Wchłanianie/Dystrybucja Wchłanianie arypiprazolu do krążenia ogólnoustrojowego następuje powoli i jest wydłużone po podaniu do mięśnia pośladkowego w związku ze słabą rozpuszczalnością cząsteczek arypiprazolu. Profil uwalniania arypiprazolu z produktu leczniczego Abilify Maintena 960 mg/720 mg powoduje utrzymujące się stężenia w osoczu przez okres dwóch miesięcy po wstrzyknięciu do mięśnia pośladkowego. Uwalnianie substancji czynnej po podaniu pojedynczej dawki arypiprazolu w postaci do wstrzykiwań co dwa miesiące rozpoczyna się w pierwszym dniu i utrzymuje się aż do 34 tygodni. Uwalnianie substancji czynnej po podaniu pojedynczej dawki 780 mg gotowego do użycia arypiprazolu o przedłużonym działaniu podawanego co 2 miesiące rozpoczyna się w pierwszym dniu i utrzymuje się aż do 34 tygodni.. Metabolizm Arypiprazol jest w znacznym stopniu metabolizowany w wątrobie. Proces ten przebiega trzema głównymi drogami: dehydrogenacji, hydroksylacji oraz N-dealkilacji.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakokinetyczne
Jak wynika z badań in vitro enzymy CYP3A4 i CYP2D6 warunkują dehydrogenację oraz hydroksylację arypiprazolu, a N- dealkilacja jest katalizowana przez CYP3A4. Główną cząsteczką czynną znajdującą się w krążeniu ogólnym jest sam arypiprazol. Po wielokrotnym podaniu produktu leczniczego Abilify Maintena 960 mg/720 mg czynny metabolit, dehydroarypiprazol, stanowi około 30 % wartości AUC arypiprazolu w osoczu. Eliminacja Po doustnym podaniu pojedynczej dawki arypiprazolu znakowanego [ 14 C], stwierdza się odpowiednio 25 % i 55 % podanego pierwiastka radioaktywnego w moczu i kale. Mniej niż 1 % niezmienionego arypiprazolu zostaje wydalone z moczem i około 18 % z kałem. Farmakokinetyka w szczególnych grupach pacjentów Nie przeprowadzono żadnych specjalnych badań stosowania produktu leczniczego Abilify Maintena w szczególnych grupach pacjentów.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakokinetyczne
Osoby o wolnym metabolizmie z udziałem CYP2D6 Na podstawie analizy farmakokinetyki populacyjnej stwierdzono, że stężenie arypiprazolu w osoczu jest około 2 razy większe u osób wolnym metabolizmie z udziałem CYP2D6 w porównaniu z osobami metabolizującymi prawidłowo z udziałem CYP2D6. (patrz punkt 4.2). Pacjenci w podeszłym wieku Po podaniu doustnym arypiprazolu nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi osobami w podeszłym wieku a młodszymi osobami dorosłymi. Nie stwierdzono także mierzalnego wpływu wieku na farmakokinetykę arypiprazolu u pacjentów ze schizofrenią. Płeć Po podaniu doustnym arypiprazolu nie stwierdzono różnic w farmakokinetyce arypiprazolu między zdrowymi mężczyznami a kobietami. Nie stwierdzono także mierzalnego wpływu płci na farmakokinetykę arypiprazolu podczas badań klinicznych u pacjentów ze schizofrenią.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgWłaściwości farmakokinetyczne
Palenie tytoniu Populacyjne badanie farmakokinetyczne arypiprazolu w postaci doustnej nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od palenia tytoniu. Rasa Populacyjne badanie farmakokinetyczne nie wykazało żadnych istotnych klinicznie różnic w farmakokinetyce arypiprazolu zależnych od rasy. Zaburzenia czynności nerek W badaniu z pojedynczą dawką arypiprazolu w postaci doustnej stwierdzono, że charakterystyka farmakokinetyczna arypiprazolu i dehydroarypiprazolu jest podobna u pacjentów z ciężkimi chorobami nerek i u młodych osób zdrowych. Zaburzenia czynności wątroby Badanie z pojedynczą dawką arypiprazolu podawanego doustnie pacjentom z marskością wątroby różnego stopnia (klasa A, B lub C w skali Child-Pugh) nie wykazało znacznego wpływu zaburzeń czynności wątroby na farmakokinetykę arypiprazolu i dehydroarypiprazolu, ale w badaniu uczestniczyło tylko 3 pacjentów z marskością wątroby klasy C, co jest niewystarczające do wyciągnięcia wniosków w zakresie możliwości metabolizmu u takich pacjentów.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Profil toksykologiczny arypiprazolu podawanego zwierzętom doświadczalnym we wstrzyknięciu domięśniowym jest generalnie podobny do profilu obserwowanego po podaniu doustnym przy porównywalnych stężeniach w osoczu. Jednak po podaniu domięśniowym reakcję zapalną obserwowano w miejscu podania i obejmowała ona ziarniniakowe zmiany zapalne, ogniska (złogi substancji czynnej), nacieki komórkowe, obrzęki i zwłóknienie u małp. Objawy te zwykle stopniowo ustępowały po przerwaniu podawania. Dane niekliniczne dla arypiprazolu podawanego doustnie wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgPrzedkliniczne dane o bezpieczeństwie
Arypiprazol w postaci doustnej Istotne działanie toksyczne stwierdzano jedynie po podaniu dawek lub przy stopniu narażenia wyraźnie przekraczającym maksymalne dawki lub narażenie występujące u ludzi, co wskazuje, że działanie takie jest ograniczone lub nie występuje w praktyce klinicznej. Obserwacje te obejmują: zależny od dawki toksyczny wpływ na nadnercza stwierdzany u szczurów po 104 tygodniach doustnego podawania arypiprazolu w dawce przekraczającej od 3 do 10 razy średnią wartość AUC w stanie stacjonarnym występującą u ludzi po podaniu maksymalnej zalecanej dawki i zwiększenie częstości występowania raków nadnerczy, a także łącznej częstości występowania gruczolaków/raków korowonadnerczowych u samic szczurów otrzymujących produkt w dawce przekraczającej 10 razy wartość występującą u ludzi po podaniu maksymalnej zalecanej dawki.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgPrzedkliniczne dane o bezpieczeństwie
Największe narażenie niepowodujące powstawania nowotworów u samic szczurów odpowiadało siedmiokrotnemu narażeniu u ludzi występującemu po podaniu zalecanej dawki. Dodatkowo stwierdzono występowanie kamicy żółciowej, jako następstwo odkładania się siarczanowych koniugatów hydroksylowanych metabolitów arypiprazolu w żółci małp, którym wielokrotnie podawano doustnie dawki leku od 25 mg/kg mc./dobę do 125 mg/kg mc./dobę (około 16 do 81 razy wyższa niż po podaniu maksymalnej dawki zalecanej u ludzi na podstawie przeliczenia mg/m 2 pc.). Jednak stężenie koniugatów siarczanowych hydroksyarypiprazolu w żółci człowieka, podczas stosowania największej proponowanej dawki 30 mg na dobę, nie przekraczało 6 % stężenia stwierdzanego w żółci małp podczas trwającego 39 tygodni badania i jest znacznie poniżej (6 %) granicy rozpuszczalności określonej in vitro .
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgPrzedkliniczne dane o bezpieczeństwie
W badaniach toksykologicznych z użyciem dawki wielokrotnej u młodych szczurów i psów profil toksyczności arypiprazolu był porównywalny z profilem obserwowanym u dorosłych zwierząt oraz nie było dowodów potwierdzających neurotoksyczność i niepożądany wpływ na rozwój. Wyniki przeprowadzonych w pełnym zakresie standardowych badań genotoksyczności wskazują, że arypiprazol nie ma właściwości genotoksycznych u ludzi. Arypiprazol nie zaburzał płodności w badaniach toksycznego wpływu na reprodukcję. Obserwowano toksyczny wpływ na rozwój, w tym także zależne od dawki opóźnienie płodowej mineralizacji kości oraz możliwy wpływ teratogenny u szczurów, którym podawano dawki subterapeutyczne (oceniane na podstawie wartości AUC) oraz u królików, którym podawano dawki powodujące ekspozycję 3 i 11 razy przewyższającą wartość AUC występującą w stanie stacjonarnym po podaniu maksymalnej zalecanej dawki u ludzi.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgPrzedkliniczne dane o bezpieczeństwie
Toksyczny wpływ na ciężarne samice obserwowano podczas podawania dawek podobnych do tych, które powodują toksyczny wpływ na rozwój.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Karmeloza sodowa Makrogol Powidon (E1201) Sodu chlorek Sodu diwodorofosforan jednowodny (E339) Sodu wodorotlenek ( do regulacji pH) (E524) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Ampułko-strzykawka (kopolimer zawierający cykliczne olefiny) z korkiem tłoka z gumy bromobutylowej i nasadką końcówki z gumy bromobutylowej oraz tłokiem z polipropylenu i uchwytem na palec. Abilify Maintena 960 mg, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko- strzykawce Każde opakowanie 960 mg zawiera jedną ampułko-strzykawkę i dwie sterylne igły bezpieczne: jedną o długości 38 mm (1,5 cala) 22 G i jedną o długości 51 mm (2 cale) 21 G.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDane farmaceutyczne
Abilify Maintena 720 mg, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko- strzykawce Każde opakowanie 720 mg zawiera jedną ampułko-strzykawkę i dwie sterylne igły bezpieczne: jedną o długości 38 mm (1,5 cala) 22 G i jedną o długości 51 mm (2 cale) 21 G. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Postukać strzykawką o dłoń co najmniej 10 razy. Po postukaniu energicznie wstrząsać strzykawką przez co najmniej 10 sekund. Podanie do mięśnia pośladkowego Zalecaną igłą do podania do mięśnia pośladkowego jest sterylna igła bezpieczna o długości 38 mm (1,5 cala) 22 G; u pacjentów otyłych (wskaźnik masy ciała > 28 kg/m 2 ) należy stosować sterylną igłę bezpieczną o długości 51 mm (2 cale) 21 G. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Abilify Maintena, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce, 960 mgDane farmaceutyczne
Pełne instrukcje przygotowania produktu leczniczego Abilify Maintena 960 mg/720 mg do stosowania podano w ulotce załączonej do produktu leczniczego (informacje przeznaczone wyłącznie dla fachowego personelu medycznego).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO RXULTI 0,25 mg tabletki powlekane RXULTI 0,5 mg tabletki powlekane RXULTI 1 mg tabletki powlekane RXULTI 2 mg tabletki powlekane RXULTI 3 mg tabletki powlekane RXULTI 4 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY RXULTI 0,25 mg tabletki powlekane Każda tabletka powlekana zawiera 0,25 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45,8 mg laktozy (w postaci jednowodnej). RXULTI 0,5 mg tabletki powlekane Każda tabletka powlekana zawiera 0,5 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45,5 mg laktozy (w postaci jednowodnej). RXULTI 1 mg tabletki powlekane Każda tabletka powlekana zawiera 1 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45 mg laktozy (w postaci jednowodnej). RXULTI 2 mg tabletki powlekane Każda tabletka powlekana zawiera 2 mg brekspiprazolu.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 44,1 mg laktozy (w postaci jednowodnej). RXULTI 3 mg tabletki powlekane Każda tabletka powlekana zawiera 3 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 43,1 mg laktozy (w postaci jednowodnej). RXULTI 4 mg tabletki powlekane Każda tabletka powlekana zawiera 4 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 42,2 mg laktozy (w postaci jednowodnej). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana RXULTI 0,25 mg tabletki powlekane Jasnobrązowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 0.25 po jednej stronie. RXULTI 0,5 mg tabletki powlekane Jasnopomarańczowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 0.5 po jednej stronie.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
RXULTI 1 mg tabletki powlekane Jasnożółte, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 1 po jednej stronie. RXULTI 2 mg tabletki powlekane Jasnozielone, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 2 po jednej stronie. RXULTI 3 mg tabletki powlekane Jasnofioletowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 3 po jednej stronie. RXULTI 4 mg tabletki powlekane Białe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 4 po jednej stronie.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy RXULTI jest wskazany do leczenia schizofrenii u dorosłych.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zalecana dawka początkowa brekspiprazolu to 1 mg raz na dobę w dniach od 1. do 4. Zakres zalecanej dawki docelowej wynosi od 2 mg do 4 mg raz na dobę. Zależnie od reakcji klinicznej i tolerancji pacjenta dawka brekspiprazolu może być zwiększona do 2 mg raz na dobę w dniach od 5. do 7., a następnie do 4 mg w dniu 8. Maksymalna zalecana dawka dobowa wynosi 4 mg. Zmiana z leczenia innymi lekami przeciwpsychotycznymi na brekspiprazol Podczas zmiany z leczenia innymi lekami przeciwpsychotycznymi na brekspiprazol należy rozważyć stopniowe krzyżowe dobieranie dawki leku ze stopniowym odstawianiem wcześniej stosowanego leku podczas rozpoczynania leczenia brekspiprazolem. Zmiana z leczenia brekspiprazolem na inne leki przeciwpsychotyczne Podczas zmiany z leczenia brekspiprazolem na inne leki przeciwpsychotyczne nie ma potrzeby stopniowego dobierania krzyżowego dawki leku.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDawkowanie
Przyjmowanie nowego leku przeciwpsychotycznego należy rozpocząć od najmniejszej jego dawki, jednocześnie odstawiając brekspiprazol. Należy brać pod uwagę, że stężenie brekspiprazolu w osoczu będzie się zmniejszało stopniowo, aż do całkowitej eliminacji leku z organizmu po 1 lub 2 tygodniach. Szczególne grupy pacjentów Pacjenci w podeszłym wieku Nie określono bezpieczeństwa stosowania ani skuteczności brekspiprazolu w leczeniu schizofrenii u pacjentów w wieku 65 lat lub starszych (patrz punkt 4.4 i 5.2). Nie jest możliwe podanie wskazówek odnośnie do minimalnej skutecznej/bezpiecznej dawki w tej grupie pacjentów. Zaburzenia czynności nerek Maksymalna zalecana dawka u pacjentów z umiarkowanym i ciężkim zaburzeniem czynności nerek jest zmniejszona do 3 mg raz na dobę (patrz punkt 5.2). Zaburzenia czynności wątroby Maksymalna zalecana dawka u pacjentów z umiarkowanym i ciężkim zaburzeniem czynności wątroby (≥7 w klasyfikacji Childa-Pugha) jest zmniejszona do 3 mg raz na dobę (patrz punkt 5.2).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDawkowanie
Osoby o wolnym metabolizmie przy udziale cytochromu CYP2D6 U pacjentów o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 wymagana jest zmiana dawki do połowy zalecanej dawki. Dalsze zmniejszenie dawki do jednej czwartej zalecanej dawki jest wymagane w przypadku pacjentów o znanym słabym metabolizmie przy udziale cytochromu CYP2D6, którzy przyjmującą jednocześnie silne lub umiarkowane inhibitory cytochromu CYP3A4 (patrz punkty 4.5 i 5.2). Dostosowanie dawki z powodu interakcji Dostosowanie dawki należy przeprowadzić u pacjentów przyjmujących jednocześnie silne inhibitory/leki indukujące CYP3A4 lub silne inhibitory CYP2D6. W razie odstawienia inhibitora/leku indukującego CYP3A4 lub inhibitora CYP2D6 może być wymagany powrót do tej dawki brekspiprazolu, jaką stosowano przed rozpoczęciem skojarzonego leczenia (patrz punkt 4.5).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDawkowanie
W razie pojawienia się działań niepożądanych pomimo dostosowania dawki produktu leczniczego RXULTI, należy ponownie rozważyć, czy konieczne jest jednoczesne stosowanie produktu leczniczego RXULTI i inhibitora CYP2D6 lub CYP3A4. Tabela 1: Dostosowanie dawki produktu leczniczego RXULTI u pacjentów o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 oraz w przypadku jednoczesnego stosowania z inhibitorami cytochrom CYP
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDawkowanie
Czynniki Dawka dostosowana Osoby z wolno metabolizującym cytochromem CYP2D6 Osoby o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 Podawać połowę zalecanej dawki Osoby o wolnym metabolizmie przy udziale cytochromu CYP2D6 przyjmujące silne/umiarkowane inhibitory cytochromuCYP3A4 Podawać jedną czwartą zalecanej dawki Pacjenci przyjmujący inhibitory cytochromu CYP2D6 i (lub) inhibitory cytochromu CYP3A4 Silne inhibitory cytochromu CYP2D6 Podawać połowę zalecanej dawki Silne inhibitory cytochromu CYP3A4 Podawać połowę zalecanej dawki Silne/umiarkowane inhibitory cytochromuCYP2D6 z silnymi/umiarkowanymi inhibitorami cytochromu CYP3A4 Podawać jedną czwartą zalecanej dawki - CHPL leku RXULTI, tabletki powlekane, 0,25 mgDawkowanie
Pacjenci przyjmujący leki silnie indukujące cytochrom CYP3A4 Jeśli brekspiprazol jest stosowany jednocześnie z lekami silnie indukującymi cytochrom CYP3A4 (np. ryfampicyna), u pacjenta, u którego uzyskano stabilizację dzięki podawaniu brekspiprazolu, niezbędne jest stopniowe zwiększanie dawki dobowej brekspiprazolu do dwukrotnej zalecanej dawki brekspiprazolu w ciągu od 1 do 2 tygodni. Następnie, jeśli na podstawie odpowiedzi klinicznej potrzebne jest dalsze dostosowanie dawki, dawkę można zwiększyć maksymalnie do trzykrotnej zalecanej dawki dobowej. W przypadku stosowania brekspiprazolu jednocześnie z lekami silnie indukującymi cytochrom CYP3A4 dawka dobowa nie może przekraczać 12 mg. Zaleca się podawanie brekspiprazolu dwa razy na dobę w dawce podzielonej, ponieważ dawkowanie raz na dobę powoduje duże wahania stężenia od wartości szczytowej do najniższej (patrz punkt 4.5).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDawkowanie
Produkty lecznicze indukujące cytochrom CYP3A4 działają w sposób zależny od czasu i uzyskanie maksymalnego efektu ich działania może zająć co najmniej 2 tygodnie od rozpoczęcia ich stosowania. I odwrotnie, po odstawieniu leku indukcja cytochromu CYP3A4 może utrzymywać się co najmniej 2 tygodnie zanim nie ustąpi. Dzieci i młodzież Nie określono bezpieczeństwa stosowania ani skuteczności brekspiprazolu u dzieci i młodzieży w wieku poniżej 18 lat. Dane nie są dostępne. Sposób podawania Podanie doustne. Tabletki powlekane można przyjmować wraz z posiłkiem lub oddzielnie.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podczas leczenia przeciwpsychotycznego uzyskanie klinicznej poprawy stanu pacjenta może zająć od kilku dni do kilku tygodni. Przez cały ten czas pacjent powinien pozostawać pod ścisłą obserwacją. Myśli i zachowania samobójcze Występowanie zachowań samobójczych jest nieodłącznie związane z zaburzeniami psychotycznymi i zaburzeniami nastroju. W niektórych przypadkach zdarzenia takie zgłaszane są krótko po rozpoczęciu leczenia lub po zmianie leczenia przeciwpsychotycznego, w tym zastosowaniu leczenia brekspiprazolem (patrz punkt 4.8). Leczenie przeciwpsychotyczne pacjentów z grupy wysokiego ryzyka powinno odbywać się pod ścisłym nadzorem. Zaburzenia sercowo-naczyniowe Brekspiprazolu nie oceniano u pacjentów z zawałem mięśnia sercowego, chorobą niedokrwienną serca ani klinicznie istotną chorobą sercowo-naczyniową w wywiadzie, ponieważ tacy pacjenci zostali wyłączeni z udziału w badaniach klinicznych.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgSpecjalne środki ostrozności
Brekspiprazol należy stosować ostrożnie u pacjentów z chorobą sercowo-naczyniową (w wywiadzie zawał mięśnia sercowego lub choroba niedokrwienna serca, niewydolność serca lub zaburzenia przewodzenia), chorobą naczyń mózgu, w stanach predysponujących do niedociśnienia (odwodnienie, zmniejszenie objętości krwi krążącej i leczenie przeciwnadciśnieniowymi produktami leczniczymi) lub nadciśnienia tętniczego (w tym postępującego lub złośliwego). Wydłużenie odstępu QT U pacjentów leczonych lekami przeciwpsychotycznymi może wystąpić wydłużenie odstępu QT. Podczas badań klinicznych zgłoszono jedynie kilka przypadków nieznacznego wydłużenia odstępu QT w przypadku stosowania brekspiprazolu. Należy zachować ostrożność, gdy brekspiprazol jest przepisywany pacjentom ze stwierdzoną chorobą sercowo-naczyniową, z wydłużeniem odstępu QT w wywiadzie rodzinnym, z zaburzeniem równowagi elektrolitowej lub w przypadku pacjentów jednocześnie przyjmujących inne produkty lecznicze, które uważa się za wydłużające odstęp QT (patrz punkty 4.8 i 5.1).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgSpecjalne środki ostrozności
Żylna choroba zakrzepowo-zatorowa Zgłaszano przypadki żylnej choroby zakrzepowo-zatorowej (ŻChZZ) po stosowaniu leków przeciwpsychotycznych. Ze względu na częste występowanie nabytych czynników ryzyka ŻChZZ u pacjentów leczonych lekami przeciwpsychotycznymi należy rozpoznać wszystkie możliwe czynniki ryzyka zakrzepu z zatorami przed rozpoczęciem leczenia brekspiprazolem i w czasie jego trwania, a także należy przedsięwziąć środki zapobiegawcze. Niedociśnienie ortostatyczne i omdlenia Do działań niepożądanych związanych z niedociśnieniem ortostatycznym mogą należeć zawroty głowy, uczucie pustki w głowie i tachykardia. Na ogół ryzyko to jest największe na początku leczenia lekami przeciwpsychotycznymi i podczas zwiększania dawki. Do pacjentów z grupy zwiększonego ryzyka wystąpienia tych działań niepożądanych (np.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgSpecjalne środki ostrozności
pacjenci w podeszłym wieku) lub do pacjentów z grupy zwiększonego ryzyka wystąpienia powikłań związanych z niedociśnieniem należą osoby z odwodnieniem, hipowolemią, przyjmujące leki przeciwnadciśnieniowe, z chorobą układu krążenia (np. niewydolność serca, zawał mięśnia sercowego, niedokrwienie lub zaburzenia przewodzenia), z chorobą naczyń mózgowych w wywiadzie, a także osoby nieleczone wcześniej lekami przeciwpsychotycznymi. U takich pacjentów należy rozważyć niższą dawkę początkową i wolniejsze dobieranie dawki, a także monitorować parametry ortostatyczne czynności życiowych (patrz punkt 4.2). Złośliwy zespół neuroleptyczny (ang. NMS) NMS jest potencjalnie śmiertelnym zespołem objawów, który zgłaszano w związku z podawaniem leków przeciwpsychotycznych, w tym brekspiprazolu (patrz punkt 4.8).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgSpecjalne środki ostrozności
Klinicznymi objawami NMS są bardzo wysoka gorączka, sztywność mięśni, zaburzenia świadomości oraz przejawy zaburzeń stabilności układu wegetatywnego (nieregularne tętno i wahania ciśnienia krwi, częstoskurcz, obfite pocenie się oraz zaburzenia rytmu serca). Mogą wystąpić także objawy dodatkowe, takie jak zwiększenie aktywności kinazy fosfokreatynowej, mioglobinuria (rabdomioliza) oraz ostra niewydolność nerek. Jeśli wystąpiły wyżej wymienione objawy podmiotowe lub przedmiotowe świadczące o NMS, bądź niewyjaśnionego pochodzenia wysoka gorączka bez innych objawów NMS, należy niezwłocznie przerwać leczenie brekspiprazolem. Objawy pozapiramidowe (ang. EPS) Objawy pozapiramidowe (w tym ostra dystonia) są znanymi działaniami grupy leków przeciwpsychotycznych. Brekspiprazol należy stosować ostrożnie u pacjentów z objawami pozapiramidowymi w wywiadzie.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgSpecjalne środki ostrozności
Późne dyskinezy Zespół potencjalnie nieodwracalnych, mimowolnych ruchów dyskinetycznych może wystąpić u pacjentów leczonych lekami przeciwpsychotycznymi. Chociaż częstość występowania tego zespołu wydaje się największa u pacjentów w podeszłym wieku, zwłaszcza kobiet w podeszłym wieku, nie można opierać się na szacunkowych danych częstości występowania, aby przewidzieć, u których pacjentów w momencie rozpoczęcia leczenia przeciwpsychotycznego prawdopodobnie rozwinie się ten zespół. Jeśli objawy przedmiotowe lub podmiotowe późnych dyskinez wystąpią u pacjentów leczonych brekspiprazolem, należy rozważyć zmniejszenie dawki lub odstawienie leku. Objawy takie mogą czasowo nasilić się lub nawet wystąpić dopiero po odstawieniu leku. Działania niepożądane dotyczące krążenia mózgowego W badaniach klinicznych niektórych leków przeciwpsychotycznych stosowanych u pacjentów w podeszłym wieku z otępieniem, prowadzonych z grupą kontrolną otrzymującą placebo, występowała większa częstość działań niepożądanych dotyczących krążenia mózgowego (udar, przejściowe napady niedokrwienia), w tym zakończonych zgonem, w porównaniu do pacjentów otrzymujących placebo.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgSpecjalne środki ostrozności
Pacjenci w podeszłym wieku z psychozą związaną z otępieniem Nie badano brekspiprazolu u pacjentów w podeszłym wieku z otępieniem i brekspiprazol nie jest zalecany do leczenia tych pacjentów w związku ze zwiększonym ryzykiem ogólnej śmiertelności. Hiperglikemia i cukrzyca U pacjentów leczonych nietypowymi lekami przeciwpsychotycznymi zgłaszano hiperglikemię, w niektórych przypadkach bardzo wysoką z towarzyszącą kwasicą ketonową i śpiączką hiperosmotyczną lub zgonem. Czynnikami ryzyka, które mogą predysponować pacjenta do wystąpienia ciężkich powikłań, są otyłość i cukrzyca w wywiadzie rodzinnym. Pacjenci leczeni jakimikolwiek lekami przeciwpsychotycznymi, w tym brekspiprazolem, powinni być obserwowani, aby można było stwierdzić, czy występują u nich objawy podmiotowe i przedmiotowe związane z hiperglikemią (takie jak nadmierne pragnienie, wielomocz, nadmierny apetyt i osłabienie).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgSpecjalne środki ostrozności
Przed rozpoczęciem lub wkrótce po rozpoczęciu leczenia przeciwpsychotycznego należy ocenić stężenie glukozy w osoczu na czczo. Podczas długotrwałego leczenia pacjenci powinni być regularnie monitorowani pod względem objawów pogorszenia kontroli glikemii. Zwiększenie masy ciała i dyslipidemia Stosowanie leków przeciwpsychotycznych, w tym brekspiprazolu, wiąże się ze zmianami metabolicznymi, w tym ze zwiększeniem masy ciała i dyslipidemią. Wraz z wydłużeniem czasu trwania leczenia brekspiprazolem obserwowano zwiększenie częstości występowania przypadków zwiększania masy ciała (patrz punkt 4.8). Na początku leczenia należy ocenić profil lipidowy. Na początku leczenia i w jego trakcie zaleca się kliniczne monitorowanie masy ciała i profilu lipidowego. Napady (padaczkowe) Jak w przypadku innych leków przeciwpsychotycznych, brekspiprazol należy stosować z zachowaniem ostrożności u pacjentów, u których w przeszłości występowały napady drgawkowe lub inne choroby, które potencjalnie obniżają próg napadów padaczkowych.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgSpecjalne środki ostrozności
Podczas stosowania brekspiprazolu zgłaszano napady drgawkowe (patrz punkt 4.8). Regulacja temperatury ciała Lekom przeciwpsychotycznym przypisuje się zakłócanie zdolności organizmu do obniżania temperatury ciała. Zaleca się zachowanie odpowiedniej ostrożności podczas przepisywania brekspiprazolu pacjentom, którzy mogą znaleźć się w sytuacjach prowadzących do podwyższenia temperatury ciała, takich jak intensywne ćwiczenia, narażenie na ekstremalnie wysokie temperatury, jednoczesne przyjmowanie produktów leczniczych o działaniu przeciwcholinergicznym lub odwodnienie. Dysfagia Z przyjmowaniem leków przeciwpsychotycznych wiąże się spowolnienie motoryki przełyku i ryzyko aspiracji. Brekspiprazol należy stosować ostrożnie u pacjentów z grupy ryzyka zachłystowego zapalenia płuc. Zaburzenia kontroli impulsów U pacjentów leczonych brekspiprazolem zgłaszano zaburzenia kontroli impulsów, w tym uzależnienie od hazardu.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgSpecjalne środki ostrozności
Podczas przyjmowania brekspiprazolu pacjenci mogą wykazywać nasilone skłonności, szczególnie do hazardu, i niemożność ich kontrolowania. Inne zgłoszone popędy obejmują: kompulsywne zachowania seksualne, kompulsywne zakupy, nadmierne objadanie się i inne impulsywne i kompulsywne zachowania. Pacjenci z zaburzeniami kontroli impulsów w wywiadzie mogą być narażeni na większe ryzyko wystąpienia tego działania i należy ich uważnie monitorować. Pacjenci mogą nie postrzegać tych zachowań jako nieprawidłowe, dlatego ważne jest, aby lekarze przepisujący lek pytali pacjentów lub ich opiekunów zwłaszcza o pojawienie się nowych lub nasilonych zaburzeń kontroli impulsów lub innych kompulsywnych zachowań podczas leczenia brekspiprazolem. Należy zauważyć, że objawy zaburzenia kontroli impulsów mogą być związane z podstawową chorobą; jednak w niektórych przypadkach zgłaszano ustąpienie popędów po zmniejszeniu dawki lub odstawieniu produktu leczniczego.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgSpecjalne środki ostrozności
Kompulsywne zachowania, jeśli nie zostaną rozpoznane, mogą zaszkodzić pacjentowi lub innym osobom. Należy rozważyć zmniejszenie dawki lub odstawienie produktu leczniczego, jeśli u pacjenta wystąpią takie popędy podczas stosowania brekspiprazolu (patrz punkt 4.8). Leukopenia, neutropenia i agranulocytoza Podczas leczenia lekami przeciwpsychotycznymi zgłaszano leukopenię, neutropenię i agranulocytozę (w tym przypadki śmiertelne). Możliwe czynniki ryzyka leukopenii/neutropenii obejmują stwierdzoną przed leczeniem małą liczbę białych krwinek i występującą w wywiadzie leukopenię/neutropenię wywołaną lekiem. U pacjentów, u których wcześniej występowała mała liczba białych krwinek lub leukopenia/neutropenia wywołana lekiem (w wywiadzie), należy w ciągu pierwszych kilku miesięcy leczenia monitorować morfologię krwi i przerwać leczenie brekspiprazolem przy pierwszych oznakach zmniejszenia liczby białych krwinek, gdy brak innych czynników przyczynowych.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgSpecjalne środki ostrozności
Pacjenci z neutropenią powinni być objęci ścisłą obserwacją w zakresie gorączki lub innych objawów zakażenia i leczeni niezwłocznie po wystąpieniu takich objawów lub oznak. U pacjentów z ciężką neutropenią (bezwzględna liczba granulocytów obojętnochłonnych <1 000/mm 3 ) należy przerwać stosowanie brekspiprazolu i prowadzić obserwację liczby białych krwinek do czasu uzyskania poprawy. Prolaktyna Brekspiprazol może zwiększać stężenie prolaktyny. Zwiększenia stężenia związane z leczeniem brekspiprazolem są na ogół łagodne i mogą ustępować podczas kontynuowania leczenia, jednak w niektórych rzadkich przypadkach działanie może utrzymywać się podczas stosowania leku (patrz punkt 4.8). Laktoza Produkt leczniczy RXULTI tabletki powlekane zawiera laktozę. Lek nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Brekspiprazol jest głównie metabolizowany przez cytochrom CYP3A4 i cytochrom CYP2D6. Możliwy wpływ innych leków na brekspiprazol Inhibitory CYP3A4 Podawanie brekspiprazolu w dawce doustnej 2 mg raz na dobę w skojarzeniu z ketokonazolem (200 mg dwa razy na dobę przez 7 dni), silnym inhibitorem cytochromu CYP3A4, zwiększało wartość AUC brekspiprazolu o 97% i nie zmieniało wartości C max . Na podstawie wyników badań interakcji zaleca się zmniejszenie dawki brekspiprazolu o połowę w przypadku podawania go jednocześnie z silnymi inhibitorami cytochromu CYP3A4 (itrakonazol, ketokonazol, rytonawir i klarytromycyna). Leki indukujące cytochrom CYP3A4 Podanie pojedynczej dawki doustnej brekspiprazolu 4 mg w skojarzeniu z ryfampicyną (600 mg dwa razy na dobę przez 12 dni), silnym lekiem indukującym cytochrom CYP3A4, powodowało zmniejszenie wartości C max i AUC brekspiprazolu w przybliżeniu odpowiednio o 31% i 73%.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgInterakcje
Jeśli brekspiprazol jest stosowany jednocześnie z silnymi lekami indukującymi cytochrom CYP3A4 (np. karbamazepina, fenobarbital, ryfampicyna, dziurawiec), całkowita dawka dobowa brekspiprazolu jest zwiększona około trzykrotnie w stosunku do zalecanej dawki. Dawkowanie raz na dobę brekspiprazolu w przypadku równoczesnego podawania leków indukujących cytochrom CYP3A4 powoduje duże wahania stężenia od wartości szczytowej do najniższej (patrz punkt 4.2). Inhibitory cytochromu CYP2D6 Podanie pojedynczej doustnej dawki brekspiprazolu wynoszącej 2 mg w skojarzeniu z chinidyną (324 mg/dobę przez 7 dni), silnym inhibitorem cytochromu CYP2D6, powodowało zwiększenie wartości AUC brekspiprazolu o 94% i nie zmieniało wartości C max . Na podstawie wyników badań interakcji zaleca się modyfikację dawki brekspiprazolu do połowy dawki, gdy brekspiprazol stosowany jest jednocześnie z silnymi inhibitorami cytochromu CYP2D6 (chinidyna, paroksetyna i fluoksetyna).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgInterakcje
Na podstawie szacunkowych ocen z analizy parametrów farmakokinetyki populacji, w przypadku pacjentów z szybkim metabolizmem z udziałem cytochromu CYP2D6 otrzymujących inhibitory zarówno cytochromu CYP3A4, jak i cytochromu CYP2D6 lub w przypadku pacjentów z wolno metabolizującym cytochromem CYP2D6 otrzymujących silne inhibitory cytochromu CYP3A4 przewiduje się około 4-krotne do 5-krotnego zwiększenie stężenia brekspiprazolu i zaleca się u tych pacjentów zmniejszenie dawki do jednej czwartej (patrz punkt 4.2). Możliwy wpływ brekspiprazolu na inne produkty lecznicze Na podstawie wyników badań in vitro nie jest prawdopodobne, aby brekspiprazol powodował klinicznie istotne interakcje farmakokinetyczne z produktami leczniczymi metabolizowanymi przy udziale izoenzymów cytochromu P450. Brekspiprazol nie wpływa na wchłanianie produktów leczniczych będących substratami transportera białka oporności raka piersi (ang. BCRP) i transportera glikoproteiny P (Pgp).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgInterakcje
Należy zachować ostrożność, podając brekspiprazol w skojarzeniu z lekami o znanym działaniu powodującym wydłużenie odstępu QT (np. moksyfloksacyna) lub zaburzenia elektrolitowe (np. leki moczopędne, takie jak furosemid, bendroflumetiazyd). W przypadku jednoczesnego podawania brekspiprazolu z produktami leczniczymi o znanym działaniu powodującym zwiększenie stężenia fosfokinazy kreatyny (CPK) np. statynami, takimi jak symwastatyna, należy rozważyć możliwe działanie addycyjne ze wzrostem CPK wywołanym przez brekspiprazol. Interakcje farmakodynamiczne Obecnie nie ma dostępnych żadnych informacji na temat interakcji farmakodynamicznych brekspiprazolu. Należy zachować ostrożność podczas przepisywania innych produktów leczniczych do jednoczesnego stosowania. Biorąc pod uwagę działania brekspiprazolu głównie na ośrodkowy układ nerwowy (OUN), należy zachować ostrożność podczas przyjmowania brekspiprazolu jednocześnie z alkoholem lub w skojarzeniu z innymi produktami leczniczymi wpływającymi na OUN z nakładającymi się działaniami niepożądanymi, takimi jak opiaty (np.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgInterakcje
kodeina lub morfina) (patrz punkt 4.8).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Dane na temat stosowania brekspiprazolu u kobiet w ciąży są ograniczone lub ich brak. Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3). Nie zaleca się stosowania brekspiprazolu w okresie ciąży i u kobiet w wieku rozrodczym niestosujących antykoncepcji. Noworodki, które były narażone na działanie leków przeciwpsychotycznych, w tym brekspiprazolu, w czasie trzeciego trymestru ciąży, należą do grupy ryzyka wystąpienia działań niepożądanych, w tym zaburzeń pozapiramidowych i (lub) objawów z odstawienia. Objawy te mogą różnić się nasileniem i czasem trwania po porodzie. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych i zaburzenia związane z karmieniem. W związku z tym noworodki powinny być objęte ścisłą obserwacją. Karmienie piersią Nie wiadomo, czy brekspiprazol/jego metabolity przenikają do mleka ludzkiego.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWpływ na płodność, ciążę i laktację
Dostępne dane farmakodynamiczne/toksykologiczne z badań na zwierzętach wykazały przenikanie brekspiprazolu/metabolitów do mleka samic szczura (patrz punkt 5.3). Nie można wykluczyć ryzyka dla noworodków/niemowląt. Należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać przyjmowanie brekspiprazolu, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Płodność Nie badano wpływu brekspiprazolu na płodność u ludzi. Badania na zwierzętach wykazały zmniejszenie płodności samic (patrz punkt 5.3).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brekspiprazol wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn w związku z potencjalnym działaniem na układ nerwowy, takim jak uspokojenie polekowe i zawroty głowy. Są to częste działania niepożądane leku (patrz punkt 4.8).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Najczęściej obserwowanymi działaniami niepożądanymi leku były akatyzja (5,6%) i zwiększenie masy ciała (3,9%). Tabelaryczne zestawienie działań niepożądanych Częstość występowania działań niepożądanych związanych z leczeniem brekspiprazolem przedstawiono w tabeli poniżej. Tabela opiera się na działaniach niepożądanych zgłaszanych podczas krótkoterminowych badań klinicznych II i III fazy odpowiednich dawek terapeutycznych (od 2 mg do 4 mg) i prowadzonych z grupą kontrolną otrzymującą placebo. Wszystkie działania niepożądane podano według klasyfikacji układ/narząd i częstości: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDziałania niepożądane
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDziałania niepożądane
Klasyfikacjaukład/narząd Bardzo często Często Niezbyt często Nieznana Zaburzenia układuimmunologicznego Wysypka Obrzęk naczynioruchow yPokrzywka Opuchnięta twarz Zaburzenia metabolizmu iodżywiania Zwiększenie masy ciała Zaburzenia psychiczne Próba samobójcza Myśli samobójcze Zaburzenie związane z hazardem Zachowanie impulsywne Napadowe objadanie się Kompulsywne kupowanie, Kompulsywne zachowania seksualne - CHPL leku RXULTI, tabletki powlekane, 0,25 mgDziałania niepożądane
Klasyfikacjaukład/narząd Bardzo często Często Niezbyt często Nieznana Zaburzenia układunerwowego Akatyzja Zawroty głowy Drżenie Sedacja Parkinsonizm Napady (padaczkowe) Złośliwy zespół neuroleptyczny (ang. NMS) Zaburzenia serca Wydłużenie odstępu QT w elektrokardiogram ie Zaburzenia naczyniowe Choroba zakrzepowo- zatorowa żył (w tym zator płucny i zakrzepica żył głębokich) Niedociśnienie ortostatyczne Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Kaszel Zaburzenia żołądkai jelit Biegunka Nudności Ból w górnej części jamy brzusznej Próchnica zębów Wzdęcia Zaburzenia mięśniowo- szkieletowe i tkanki łącznej Bóle plecówBól w kończynie Mialgia Rabdomioliza Ciąża, połóg i okres okołoporodowy Zespół objawów odstawienia u noworodków (patrz punkt 4.6) Badania diagnostyczne Zwiększone stężenie prolaktyny we krwi1 Zwiększone stężenie fosfokinazy kreatynowej we krwi Podwyższone ciśnienie krwi Zwiększone stężenie triglicerydów we krwi Zwiększenie aktywności enzymów wątrobowych - CHPL leku RXULTI, tabletki powlekane, 0,25 mgDziałania niepożądane
1 Klasyfikacja zwiększenia stężenia prolaktyny we krwi opiera się na potencjalnie istotnych kryteriach (ang. Potentially clinically relevant, PCR) >1 × górna granica normy (GGN). Opis wybranych działań niepożądanych Objawy pozapiramidowe (ang. EPS) Akatyzja była najczęściej zgłaszanym objawem pozapiramidowym związanym z działaniem niepożądanym leku w grupie pacjentów otrzymujących brekspiprazol w dawce od 2 mg/dobę do 4 mg/dobę (5,6%) w porównaniu do grupy pacjentów otrzymujących placebo (4,5%), kolejnym objawem było drżenie (2,7%) w porównaniu do grupy pacjentów otrzymujących placebo (1,2%). Innymi objawami pozapiramidowymi związanymi z działaniami niepożądanymi leku zgłaszanymi podczas krótkoterminowych badań klinicznych prowadzonych z grupą kontrolną były: dyskinezy (0,4%), zaburzenia pozapiramidowe (1,8%) i parkinsonizm (0,4%).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDziałania niepożądane
Akatyzja Na podstawie badań z zastosowaniem stałej dawki u pacjentów leczonych brekspiprazolem wydaje się, że występowanie akatyzji zależne jest od dawki, a częstość wzrasta wraz ze zwiększeniem dawki. Częstość występowania akatyzji w grupie otrzymującej brekspiprazol w dawce 1 mg/dobę, 2 mg/dobę i 4 mg/dobę wynosiła odpowiednio 3,0%, 4,6% i 6,5% w porównaniu do 5,2% w grupie otrzymującej placebo. Częstość akatyzji w krótkoterminowych badaniach prowadzonych z grupą kontrolną (5,4%) była podobna do częstości występowania akatyzji w długoterminowych badaniach otwartych (5,7%). Zachowania samobójcze W krótkoterminowych badaniach z grupą kontrolną działania niepożądane związane z leczeniem (ang. Treatment Emergent Adverse Events , TEAE) dotyczące zachowań samobójczych zgłoszono u 8 uczestników (0,5%, 2 ciężkie działania, 1 prowadzące do odstawienia leczenia) we wszystkich grupach otrzymujących brekspiprazol i 3 uczestników (0,4%, inne niż ciężkie działania) w grupie otrzymującej placebo.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDziałania niepożądane
W długoterminowych, otwartych badaniach klinicznych, TEAE związane z zachowaniami samobójczymi zgłoszono u 23 uczestników (1,6%). Ogólnie w programie badań klinicznych brekspiprazolu w leczeniu schizofrenii wystąpił jeden zgon z powodu samobójstwa, uznany przez badacza za niezwiązany z badanym lekiem. Odnotowano spontaniczne zgłoszenia przypadków dokonanych samobójstw i prób samobójczych po wprowadzeniu leku do obrotu. Wydłużenie odstępu QT W krótkoterminowych badaniach brekspiprazolu prowadzonych z grupą kontrolną zgłoszono 3 przypadki działań niepożądanych związanych z leczeniem (ang. TEAE) dotyczące wydłużenia odstępu QT w grupie pacjentów otrzymujących dawkę od 2 mg do 4 mg (0,3%) wobec 3 przypadków TEAE (0,5%) zgłoszonych w grupie pacjentów otrzymujących placebo. Częstość TEAE w badaniach długoterminowych była podobna do częstości w badaniach krótkoterminowych.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDziałania niepożądane
Wpływ stosowania brekspiprazolu w dawkach terapeutycznych (4 mg) i w dawkach większych niż terapeutyczna (12 mg) na odstęp QT oceniano u uczestników ze schizofrenią lub zaburzeniami schizoafektywnymi w randomizowanym badaniu, prowadzonym metodą podwójnie ślepej próby, z grupą kontrolną otrzymującą placebo i grupą kontrolną otrzymującą substancję czynną (moksyfloksacyna), prowadzonym w grupach równoległych. Analizy podgrup z tego badania sugerowały, że wydłużenie skorygowanego odstępu QT było większe u kobiet niż u mężczyzn (patrz punkt 5.1). Zwiększenie masy ciała W krótkoterminowych badaniach z grupą kontrolną odsetek uczestników z klinicznie istotnym zwiększeniem masy ciała (wzrost o ≥7% od początkowej masy ciała) wynosił 9,1% w grupie otrzymującej brekspiprazol w dawce od 2 mg/dobę do 4 mg/dobę, w porównaniu do 3,8% w grupie placebo.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDziałania niepożądane
W długoterminowym badaniu otwartym odsetek uczestników z klinicznie istotnym zwiększeniem masy ciała (wzrost o ≥7% masy ciała) podczas dowolnej wizyty wynosił 20,7%, a 0,4% uczestników przerywało udział z powodu zwiększenia masy ciała. U uczestników ze zwiększeniem masy ciała ≥7% w stosunku do wartości początkowej masa ciała zwiększała się wraz z upływem czasu, ze średnim zwiększeniem masy ciała do 10,2 kg w 52. tygodniu. Średnia zmiana całkowitej masy ciała w przypadku grupy otrzymującej brekspiprazol podczas długoterminowego otwartego badania klinicznego wynosiła 2,1 kg w 52. tygodniu. Prolaktyna Częstość występowania zwiększenia stężenia prolaktyny we krwi wynosiła 0,9% w grupie otrzymującej dawkę od 2 mg do 4 mg brekspiprazolu w porównaniu z 0,5% w grupie placebo w krótkoterminowych badaniach klinicznych prowadzonych z grupą kontrolną.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDziałania niepożądane
W krótkoterminowych badaniach większe częstości zwiększenia stężenia prolaktyny (1,5% w porównaniu do 0,60%) obserwowano u kobiet w porównaniu do mężczyzn. Ponadto częstość zwiększenia stężenia prolaktyny >1 × GGN w grupie otrzymującej dawkę od 2 mg do 4 mg brekspiprazolu wynosiła 13,7% u kobiet w porównaniu do 6,4% w grupie placebo i 11,1% u mężczyzn w porównaniu do 10,3% w grupie placebo. Złośliwy zespół neuroleptyczny Potencjalnie śmiertelny zespół objawów zwany złośliwym zespołem neuroleptycznym (ang. Neuroleptic Malignant Syndrome , NMS) zgłaszano w związku z podawaniem brekspiprazolu (patrz punkt 4.4). Nudności W przypadku nudności częstość występowania w grupie otrzymującej dawkę od 2 mg do 4 mg brekspiprazolu w badaniach krótkoterminowych prowadzonych z grupą kontrolną wynosiła 2,3 % w porównaniu do 2,0 % w grupie otrzymującej placebo.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDziałania niepożądane
W przypadku wymiotów częstość występowania wynosiła 1,0% w grupie otrzymującej brekspiprazol w porównaniu do 1,2 % w grupie otrzymującej placebo. Pod względem różnic między płciami wśród uczestników otrzymujących brekspiprazol w badaniach krótkoterminowych obserwowano częstsze występowanie nudności (4,8% w porównaniu do 2,8%) i wymiotów (4,6% w porównaniu do 1,4%) u kobiet w porównaniu do mężczyzn. W przypadku uczestników otrzymujących placebo częstość występowania nudności wynosiła 2,8% w przypadku mężczyzn w porównaniu do 3,2% w przypadku kobiet, natomiast częstość występowania wymiotów wynosiła 3,0% w przypadku mężczyzn w porównaniu do 2,6% w przypadku kobiet (patrz punkt 5.2). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania wymienionego w załączniku V .
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgPrzedawkowanie
4.9 Przedawkowanie Bezpośrednio po przedawkowaniu może być korzystne płukanie żołądka i podanie środka wymiotnego. Należy wykonać badanie EKG w przypadku przedawkowania, a jeśli występuje wydłużenie odstępu QT, należy włączyć monitorowanie akcji serca. Poza tym w razie przedawkowania stosuje się leczenie podtrzymujące, polegające na utrzymaniu drożności dróg oddechowych, natlenieniu i wentylacji oraz leczeniu objawowym. Do czasu poprawy stanu zdrowia pacjenta należy prowadzić ścisły nadzór medyczny i obserwację. Podanie doustne aktywnego węgla drzewnego i sorbitolu (50 g/240 ml) godzinę po przyjęciu doustnej dawki 2 mg brekspiprazolu zmniejszyło wartości C max i AUC brekspiprazolu, odpowiednio, o około od 5% do 23% i od 31% do 39%. Nie ma jednak wystarczających informacji na temat możliwego działania terapeutycznego węgla aktywnego w leczeniu przedawkowania brekspiprazolu.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgPrzedawkowanie
Pomimo braku informacji dotyczących wpływu hemodializ na leczenie przedawkowania brekspiprazolu prawdopodobieństwo użyteczności hemodializ w takich przypadkach jest małe, ze względu na znaczny stopień wiązania się brekspiprazolu z białkami osocza.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC N05AX16 Mechanizm działania Brekspiprazol jest nietypowym lekiem przeciwpsychotycznym. Uważa się, że w farmakologii brekspiprazolu pośredniczy działanie modulujące w układach serotoniny i dopaminy, które łączy częściowo agonistyczne działanie w stosunku do receptorów serotoninowego 5-HT 1A i dopaminowego D 2 i oraz działanie antagonistyczne w stosunku do receptora serotoninowego 5-HT 2A z podobnym dużym powinowactwem do wszystkich tych receptorów (Ki: od 0,1 nM do 0,5 nM). Brekspiprazol wykazuje również działanie antagonistyczne w stosunku do receptorów noradrenergicznych α 1B/2C z powinowactwem w tym samym pod-nanomolarnym zakresem Ki (Ki: od 0,2 nM do 0,6 nM). Działanie farmakodynamiczne Nie badano wpływu zmienności genetycznej na odpowiedzi farmakodynamiczne na brekspiprazol.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
Wpływ na odstęp QT Wpływ brekspiprazolu na odstęp QT oceniano u pacjentów ze schizofrenią lub zaburzeniami schizoafektywnymi. W ogólnej analizie brekspiprazol nie wydłużał skorygowanego odstępu QT do klinicznie istotnego zakresu po podaniu dawek terapeutycznych i większych niż terapeutyczne (4 mg/dobę, n = 62 lub 12 mg/dobę, n = 53) i nie obserwowano żadnej korelacji pomiędzy stężeniami brekspiprazolu i wydłużeniem skorygowanego odstępu QT. Analizy w podgrupach badania dokładnego skorygowanego odstępu QT c sugerują, że wydłużenie skorygowanego QT c było większe u kobiet niż u mężczyzn. W grupie uczestników otrzymujących brekspiprazol w dawce 4 mg/dobę maksymalna skorygowana o placebo średnia zmiana od początkowej wartości skorygowanego QT cI wynosiła 5,2 ms (90% CI: 1,5, 8,9) u mężczyzn (n = 48) i 15,0 ms (90% CI: 7,7., 22,3) u kobiet (n = 14) po 6 godzinach od przyjęcia dawki.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
W grupie uczestników otrzymujących brekspiprazol w dawce 12 mg/dobę maksymalna skorygowana o placebo średnia zmiana od początkowej wartości skorygowanego QT cI wynosiła 2,9 ms (90% CI: −1,2, 6,9) u mężczyzn (n = 40) po 12 godzinach od przyjęcia dawki i 10,4 ms (90% CI: 2,7, 18,2) u kobiet (n = 13) po 24 godzinach od przyjęcia dawki. Z powodu mniejszej liczby kobiet w stosunku do liczby mężczyzn włączonych do badania nie można wyciągać ostatecznych wniosków. Skuteczności kliniczna i bezpieczeństwo stosowania Skuteczność i bezpieczeństwo stosowania brekspiprazolu u pacjentów dorosłych ze schizofrenią badano podczas dwóch międzynarodowych i jednego regionalnego (Japonia), randomizowanych, 6-tygodniowych badań klinicznych, prowadzonych metodą podwójnie ślepej próby, z grupą kontrolną otrzymującą placebo, ze stałą dawką (badania od 1 do 3), podczas międzynarodowego, randomizowanego 6-tygodniowego badania klinicznego, prowadzonego metodą podwójnie ślepej próby, z grupą kontrolną otrzymującą lek porównawczy z substancją czynną (kwetapina), ze zmiennymi dawkami (badanie 4) oraz podczas jednego międzynarodowego, 52-tygodniowego badania dawki podtrzymującej prowadzonego z grupą kontrolną otrzymującą placebo (badanie 5).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
Badania objęły 2 690 pacjentów w wieku od 18 lat do 65 lat. W badaniach 1, 2 i 3 dawkę brekspiprazolu dobierano zgodnie z opisem w punkcie 4.2, podając 1 mg przez 4 dni, następnie 2 mg w dniach od 5. do 7. W dniu 8. dawkę zwiększono do 4 mg w przypadku niektórych grup badania. Krótkoterminowe badania Podczas trzech krótkoterminowych badań ze stałą dawką (badania 1, 2 i 3) uczestnicy byli randomizowani do grupy otrzymującej brekspiprazol w dawce 2 mg raz na dobę, 4 mg raz na dobę lub placebo. Badanie 4 oceniało skuteczność, bezpieczeństwo stosowania i tolerancję brekspiprazolu w zmiennych dawkach, w zakresie od 2 mg/dobę do 4 mg/dobę i od 400 mg do 800 mg kwetapiny o przedłużonym uwalnianiu (XR), w celu oceny czułości badania. W badaniach krótkoterminowych główny punkt końcowy oceny skuteczności określono jako średnią zmianę od pomiaru początkowego do pomiaru z 6 tygodnia łącznych wyników w skali objawów dodatnich i ujemnych (ang.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
Positive and Negative Syndrome Scale , PANSS), kwestionariusza obejmującego kilka pozycji i składającego się z pięciu ocenianych czynników objawów dodatnich, objawów ujemnych, bezładnych myśli, niekontrolowanej wrogości/ekscytacji i lęku/depresji. Kluczowym drugorzędowym punktem końcowym w badaniach 1, 2 i 4 było ogólne kliniczne wrażenie nasilenia choroby (ang. Clinical Global Impression of Severity , CGI-S) schizofrenii, 7-punktowa ocena kliniczna nasilenia choroby przez lekarza. CGI-S oceniano również w badaniach 3 i 5 jako drugorzędowy punkt końcowy. Wpływ brekspiprazolu oceniano również dla wielu wcześniej określonych drugorzędowych punktów końcowych: specyficznych aspektów objawów schizofrenii (Dodatni wynik podskali PANSS, Ujemny wynik podskali PANSS, wynik Składnika Ekscytacji PANSS [PEC], Czynniki dodatnie, ujemne Mardera, bezładne myśli, niekontrolowana wrogość/ekscytacja i lęk/depresja w skali PANSS).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
Analizy odpowiedzi (zdefiniowana jako 30% poprawa całkowitego wyniku PANSS w porównaniu do wartości początkowej i wyniku CGI-I wynoszącego 1 [bardzo znaczna poprawa] lub 2 [znaczna poprawa]). Wykazano skuteczność w badaniu 1 brekspiprazolu zarówno w dawce 2 mg/dobę, jak i w dawce 4 mg/dobę i powtórzono to w badaniu 2 wyłącznie dla dawki brekspiprazolu 4 mg/dobę oraz w badaniu 3 wyłącznie dla dawki brekspiprazolu 2 mg/dobę. W badaniu 4 prowadzonym ze zmiennymi dawkami w 6. tygodniu u uczestników w grupie otrzymującej brekspiprazol obserwowano liczbowo większą poprawę w skali PANSS niż u uczestników w grupie placebo, jednak różnica w 6. tygodniu nie osiągnęła istotności statystycznej głównej analizy skuteczności (p = 0,0560; patrz tabela 2). W tym samym badaniu lek porównawczy z substancją czynną (kwetiapina XR) dodano jedynie w celu analizy czułości, oddzielnie od placebo. Tabela 2: Główne wyniki oceny skuteczności w przypadku 6 - tygodniowych badań w leczeniu schizofrenii
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
Badanie kliniczne Grupa leczenia n Główny pomiar skuteczności: PANSS Średnia wartość początkowa (SD) Średnia zmiana LS od punktu początkowego (SE) Średnia różnica LSa, b (95% CI) Wartość p 1 Brekspiprazol 180 95,85 −20,73 −8,72 <0,0001 (2 mg/dobę)* (13,75) (1,55) (−13,1, −4,37) Brekspiprazol 178 94,70 −19,65 −7,64 0,0006 (4 mg/dobę)* (12,06) (1,54) (−12,0, −3,30) Placebo 178 95,69 −12,01 -- -- (11,46) (1,60) 2 Brekspiprazol 179 96,30 −16,61 −3,08 0,1448 (2 mg/dobę) (12,91) (1,49) (−7,23, 1,07) - CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
Badanie kliniczne Grupa leczenia n Główny pomiar skuteczności: PANSS Średnia wartość początkowa (SD) Średnia zmiana LS od punktu początkowego (SE) Średnia różnica LSa, b (95% CI) Wartość p Brekspiprazol 181 94,99 −20,00 −6,47 0,0022 (4 mg/dobę)* (12,38) (1,48) (−10,6, −2,35) Placebo 180 94,63 −13,53 -- -- (12,84) (1,52) 3 Brekspiprazol 113 96,55 −14,95 −7,32 0,0124 (2 mg/dobę)* (19,20) (2,00) (−13,04, −1,59) Brekspiprazol 109 96,39 −11,49 −3,86 0,1959 (4 mg/dobę) (15,73) (2,10) (−9,71, 2,00) Placebo 113 97,19 −7,63 -- -- (19,27) (2,11) Brekspiprazol 97,82 −19,99 4 (od2 mg/dobę do 4 mg/do 150 (10,25) (1,51) −4,1(−8,2, 0,1) 0,0560 bę) Placebo 159 98,38 −15,93 -- -- (10,30) (1,49) - CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
SD Odchylenie standardowe SE Błąd standardowy Średnia LS Średnia metody najmniejszych kwadratów CI Przedział ufności * Lek statystycznie znamiennie lepszy niż placebo a Różnica (brekspiprazol minus placebo) oznacza najmniejszą średnią zmianę metodą najmniejszych kwadratów od wartości początkowej, w 6. tygodniu b Średnia różnica LS, 95% przedział ufności i wartości p dla poszczególnych badań pochodziły z analizy MMRM ( ang. Mixed effect Model Repeat Measurement , model mieszany dla powtarzanych pomiarów) w następujący sposób: stałe wpływy ośrodka, leczenia i interakcji leczenia według wizyty przy wykorzystaniu jako współzmiennych wartości początkowej i interakcji wartości początkowej według wizyty. Zastosowano niestrukturalną strukturę macierzy zmiennej i współzmiennej Podstawowa analiza statystyczna została przeprowadzona przy użyciu modelu MMRM z imputacją MAR ( ang. Missing At Random , brakujące w sposób losowy).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
Wyniki analizy wrażliwości z zastosowaniem wielokrotnych imputacji opartych na placebo (PMI) były zgodne z analizą główną. Wyniki dla (kluczowego) drugorzędowego parametru wyniku leczenia i dodatkowych punktów końcowych potwierdzały pierwszorzędowy punkt końcowy. W badaniu 1. statystycznie znamienną większą poprawę w skali CGI-S, kluczowy drugorzędowy pomiar skuteczności w 6. tygodniu, wykazano również dla dawki 2 mg/dobę i 4 mg/dobę w porównaniu do grup otrzymujących placebo. Ze względu na hierarchiczną procedurę badań większa poprawa zarówno w przypadku dawki 2 mg/dobę, jak i 4 mg/dobę wykazana w skali CGIS może być jedynie uznana za potwierdzającą wyniki badań 2., 3. i 4. (patrz tabela 3). Tabela 3: Główne drugorzędowe wyniki oceny skuteczności w przypadku 6 - tygodniowych badań w leczeniu schizofrenii
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
Badan ie kliniczne Grupa leczenia n Główny drugorzędowy pomiar skuteczności: CGI-S Średnia wartość początkowa (SD) Średnia zmiana LS od punktu początkowego(SE) Średnia różnica LSa (95% CI) Wartość p 1. Brekspiprazol (2 mg/dobę)* 181 4,90(0,64) −1,15(0,08) −0,33(−0,56, −0,10) 0,0056 Brekspiprazol(4 mg/dobę)* 178 4,81(0,64) −1,20(0,08) −0,38(−0,61, −0,15) 0,0012 Placebo 181 4,84(0,66) −0,82(0,09) -- -- 2. Brekspiprazol (2 mg/dobę) 180 4,96(0,65) −0,99(0,09) −0,19(−0,42, 0,05) 0,1269 Brekspiprazol(4 mg/dobę)* 183 4,85(0,64) −1,19(0,08) −0,38(−0,62, −0,15) 0,0015 Placebo 181 4,87(0,61) −0,81(0,09) -- -- 3. Brekspiprazol (2 mg/dobę)* 113 4,80(0,78) −0,84(0,11) −0,35(−0,67, −0,03) 0,0308 Brekspiprazol(4 mg/dobę) 109 4,71(0,75) −0,64(0,12) −0,16(−0,48, 0,17) 0,3461 Placebo 113 4,73(0,71) −0,48(0,12) -- -- 4. Brekspiprazol* (od2 mg/dobę do 4 mg/do bę)b 150 4,96(0,59) −1,21(0,08) −0,27(−0,49, −0,06) 0,0142 Placebo 159 4,94(0,57) −0,93(0,08) -- -- - CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
SD Odchylenie standardowe SE Błąd standardowy Średnia LS Średnia metody najmniejszych kwadratów CI Przedział ufności * Lek statystycznie znamiennie lepszy niż placebo a Różnica (brekspiprazol minus placebo) oznacza najmniejszą średnią zmianę metodą najmniejszych kwadratów od wartości początkowej w 6. tygodniu b Średnia dawka 3,5 mg/dobę Badanie dotyczące utrzymania skuteczności W badaniu 5., które było długoterminowym badaniem zaprojektowanym dla oceny utrzymywania się działania brekspiprazolu poprzez ocenę opóźnienia w czasie do zbliżającego się nawrotu schizofrenii, u pacjentów ze schizofrenią, u których wystąpiła odpowiedź na leczenie brekspiprazolem w dawce od 1 mg/dobę do 4 mg/dobę, nastąpiła stabilizacja choroby w czasie od 12 tygodni do 36 tygodni. Zostali oni następnie zrandomizowani metodą podwójnie ślepej próby do grupy kontynuującej leczenie dawką stabilizującą brekspiprazolu (n = 96) lub do grupy otrzymującej placebo (n = 104) przez 52 tygodnie lub do wystąpienia nawrotu.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
W głównej analizie czasu do zbliżającego się nawrotu choroby u pacjentów otrzymujących brekspiprazol wykazano znacznie dłuższy czas do wystąpienia nawrotu w porównaniu do pacjentów otrzymujących placebo (p <0,0001). W 52. tygodniu stosowania brekspiprazolu (13,5%) obserwowano zmniejszone ryzyko nawrotu choroby o 71% w porównaniu do grupy placebo (38,5%). Podczas okresu stabilizacji brekspiprazol poprawił objawy kliniczne (oceniane za pomocą skali PANSS, CGI-S i CGI-I [ANCOVA LOCF]) i funkcjonowanie (oceniane za pomocą globalnej oceny funkcjonowania (ang. Global Assessment of Functioning , GAF) [Analiza kowariancji – ANCOVA LOCF ( ang. Last Observation Carried Forward , metoda ekstrapolacji ostatniej obserwacji)]. Taka poprawa utrzymywała się w trakcie 52-tygodniowej fazy leczenia dawką podtrzymującą prowadzonej metodą podwójnie ślepej próby u pacjentów leczonych brekspiprazolem, podczas gdy u pacjentów zrandomizowanych do grupy placebo wykazano pogorszenie wyników w skali PANSS, CGI-S, CGI-I oraz GAF [ANCOVA LOCF]).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakodynamiczne
Brekspiprazol umożliwiał utrzymywanie kontroli objawów i funkcjonowanie w porównaniu do placebo. Dzieci i młodzież Europejska Agencja Leków wstrzymała obowiązek dołączenia wyników badań oceny skuteczności i bezpieczeństwa stosowania brekspiprazolu w populacji dzieci i młodzieży w wieku od 13 lat do poniżej 18 lat (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Brekspiprazol jest wchłaniany po podaniu tabletki, a maksymalne stężenia w osoczu występują w ciągu 4,0 godzin po podaniu pojedynczej dawki. Bezwzględna biodostępność tabletki po podaniu doustnym wynosi 95,1%. Stężenie brekspiprazolu w stanie równowagi jest osiągane w ciągu od 10 dni do 12 dni od podania. Podanie tabletki brekspiprazolu 4 mg ze standardowym posiłkiem wysokotłuszczowym nie miało istotnego wpływu na wartości C max i AUC brekspiprazolu. Po podaniu jednorazowym i wielokrotnym raz na dobę narażenie na brekspiprazol (C max i AUC) wzrasta proporcjonalnie do podanej dawki. Jak wynika z badań in vivo , brekspiprazol nie jest ani substratem ani inhibitorem transporterów wychwytu leku, takich jak gen kodujący glikoproteinę P 1 (Pgp) oporności wielolekowej (ang. Multi Drug Resistance , MDR) i BCRP.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakokinetyczne
Dystrybucja Objętość dystrybucji brekspiprazolu po podaniu dożylnym jest wysoka (1,56 l/kg ± 0,418 l/kg), co wskazuje na dystrybucję pozanaczyniową. Brekspiprazol w dużym stopniu wiąże się z białkami osocza (ponad 99%) z albuminą surowicy i kwaśną glikoproteiną α1, a na jego wiązanie z białkami nie ma wpływu zaburzenie czynności nerek lub wątroby. Na podstawie wyników badań in vitro warfaryna, diazepam i digitoksyna nie mają wpływu na wiązanie brekspiprazolu z białkami. Metabolizm Na podstawie badań metabolizmu in vitro z użyciem rekombinowanego ludzkiego cytochromu P450 wykazano, że w metabolizmie brekspiprazolu pośredniczy głównie cytochrom CYP3A4 i CYP2D6, prowadząc do powstawania utleniających metabolitów. Na podstawie danych z badań in vitro brekspiprazol wykazywał niewielkie hamowanie lub brak hamowania innych izoenzymów cytochromu CYP450.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakokinetyczne
W badaniach in vivo w metabolizmie brekspiprazolu pośredniczy głównie cytochrom CYP3A4 i CYP2D6, prowadząc do powstawania utleniających metabolitów tylko z jednym metabolitem, DM-3411, obecnym w osoczu z ponad 10% narażeniem w osoczu. W stanie równowagi metabolit DM-3411 odpowiada za narażenia na brekspiprazol (AUC) w osoczu od 23,1% do 47,7%. Należy zauważyć, że badania przedkliniczne in vivo wykazały, że przy klinicznie istotnych narażeniach na brekspiprazol w osoczu narażenie w mózgu na metabolit DM-3411 było poniżej granicy wykrywalności. W związku z tym uważa się, że metabolit DM-3411 nie przyczynia się do terapeutycznego działania brekspiprazolu. Eliminacja Po doustnym podaniu pojedynczej dawki brekspiprazolu znakowanego [ 14 C] około 24,6% i 46% podanej radioaktywności odzyskano, odpowiednio, w moczu i kale. Mniej niż 1% niezmienionego brekspiprazolu był wydalany z moczem, a około 14% dawki doustnej zostało odzyskane w postaci niezmienionej w kale.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakokinetyczne
Pozorny doustny klirens tabletki brekspiprazolu po podaniu raz na dobę wynosi 19,8 (± 11,4) ml/h/kg. Po wielokrotnym podaniu raz na dobę brekspiprazolu okres półtrwania w końcowej fazie eliminacji brekspiprazolu i jego głównego metabolitu, DM-3411, wynosił odpowiednio 91,4 godziny i 85,7 godziny. Liniowość/nieliniowość Farmakokinetyka brekspiprazolu jest proporcjonalna do dawki i nie ulega zmianie w czasie po podaniu pojedynczej dawki (od 0,2 mg do 8 mg) i po podaniu kilku dawek (od 0,5 mg do 4 mg) w schemacie podawania raz na dobę. Farmakokinetyka u specjalnych populacji pacjentów Wiek Po podaniu pojedynczej dawki brekspiprazolu (2 mg) u pacjentów w podeszłym wieku (w wieku powyżej 65 lat) wykazywano podobne narażenie ogólnoustrojowe na brekspiprazol (C max i AUC), jak u pacjentów dorosłych (od 18 lat do 45 lat, patrz punkty 4.2 i 4.4). Płeć W ocenie PK populacyjnej zidentyfikowano płeć jako statystycznie znamienną współzmienną.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakokinetyczne
Narażenie (AUC) na brekspiprazol u kobiet oceniono na wyższe o 25% niż u mężczyzn (patrz punkt 4.8). Rasa Chociaż nie przeprowadzono żadnego swoistego badania farmakokinetycznego, to jednak ocena farmakokinetyczna w populacji nie wykazała istotnych klinicznie różnic związanych z rasą w farmakokinetyce brekspiprazolu. Genotyp CYP2D6 Ocena farmakokinetyczna w populacji wykazała, że u pacjentów z wolno metabolizującym CYP2D6 występuje większe o 47% narażenie na brekspiprazol w porównaniu do pacjentów z intensywnym metabolizmem (patrz punkt 4.2). Palenie tytoniu Na podstawie badań in vitro wykorzystujących ludzkie enzymy wątrobowe stwierdzono, że brekspiprazol nie jest substratem dla cytochromu CYP1A2. Palenie nie powinno zatem wpływać na farmakokinetykę brekspiprazolu. Zaburzenia czynności nerek U uczestników (n = 10) z ciężką niewydolnością nerek (CL cr <30 ml/min) wartość AUC podanego doustnie brekspiprazolu (3 mg w pojedynczej dawce) w porównaniu do dobranych zdrowych ochotników wzrosła o 68%, podczas gdy wartość C max nie uległa zmianie.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakokinetyczne
U pacjentów z umiarkowanym lub ciężkim zaburzeniem czynności nerek (klirens kreatyniny CL cr <60 ml/minutę) maksymalna zalecana dawka jest zmniejszana do 3 mg raz na dobę (patrz punkt 4.2). Zaburzenia czynności wątroby U uczestników (n = 22) z różnym stopniem zaburzeń czynności wątroby (klasa A, B i C w skali Childa-Pugha) wartość AUC po podaniu doustnym brekspiprazolu (pojedynczej dawki 2 mg), w porównaniu do dobranych zdrowych ochotników, zwiększyła się o 24% w przypadku łagodnych zaburzeń czynności wątroby, zwiększyła się o 60% w przypadku umiarkowanych zaburzeń czynności wątroby i nie uległa zmianie w przypadku ciężkich zaburzeń czynności wątroby. U pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności wątroby (klasa B i C w skali Childa-Pugha) maksymalna zalecana dawka jest zmniejszona do 3 mg podawanych raz na dobę (patrz punkt 4.2).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgWłaściwości farmakokinetyczne
Dzieci i młodzież Nie określono bezpieczeństwa stosowania ani skuteczności brekspiprazolu u dzieci i młodzieży w wieku poniżej 18 lat (patrz punkt 4.2).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Działania obserwowane w badaniach toksyczności po podaniu wielokrotnym u szczurów i małp były głównie związane z nadmiernym działaniem farmakologicznym brekspiprazolu. Nie można ustalić marginesów bezpieczeństwa na podstawie AUC 0-24 h przy maksymalnej zalecanej dawce ludzkiej (ang. Maximum Recommended Human Dose , MRHD) wynoszącej 4 mg/dobę u samic i samców szczurów i małp. Toksyczność sercowo-naczyniowa Po podaniu doustnym brekspiprazol powodował zmniejszenie ciśnienia krwi i wydłużał odstęp QT w badaniu bezpieczeństwa farmakologicznego u przytomnego psa, w badaniach toksyczności po podaniu wielokrotnym u małp płci męskiej i żeńskiej oraz w badaniu toksyczności na młodych osobnikach psów obu płci. Wpływ brekspiprazolu na zmniejszenie ciśnienia krwi jest przypisywany spodziewanej blokadzie receptorów adrenergicznych α1 w obwodowych naczyniach krwionośnych.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgPrzedkliniczne dane o bezpieczeństwie
Genotoksyczność, rakotwórczość Brekspiprazol nie wykazywał żadnego możliwego działania genotoksycznego zarówno w badaniach in vitro, jak i in vivo z użyciem klinicznie istotnych narażeń. Brekspiprazol podawany doustnie nie zwiększał częstości występowania nowotworów w 2-letnim badaniu rakotwórczości u samców i samic szczurów oraz u samców myszy po narażeniu stanowiącym do 4,4-krotności i 3,1-krotności MRHD. W przypadku podobnych lub nawet mniejszych klinicznie istotnych narażeń u samic myszy obserwowano zwiększoną częstość występowania gruczolakoraka gruczołu sutkowego i gruczolakoraka płaskokomórkowego oraz gruczolaka części dystalnej przysadki: te nowotwory endokrynologiczne z udziałem prolaktyny obserwowano również u gryzoni w badaniach innych leków przeciwpsychotycznych, a ich znaczenie kliniczne jest nieznane.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgPrzedkliniczne dane o bezpieczeństwie
Wpływ toksyczności na reprodukcję Po podaniu doustnym brekspiprazol nie wpływał na płodność samców szczurów, ale przedłużał fazę diestrus i zmniejszał płodność u samic szczurów w przypadku podobnych lub nawet mniejszych klinicznie istotnych narażeń niż uzyskane po podaniu MRHD. Obserwowano znaczne zwiększenie utraty przed implantacją w przypadku klinicznych narażeń na MRHD na poziomie do 4,1-krotności. W badaniach dotyczących szkodliwego wpływu na rozwój zarodkowo-płodowy brekspiprazol nie wykazywał działania teratogennego u szczurów po podaniu doustnym do poziomu narażenia (na podstawie danych dotyczących szczurów, które nie były w ciąży) osiąganego klinicznie po podaniu MRHD. U królików obserwowano zniekształcenia kręgów u 3 płodów z 2 miotów po podaniu dawek doustnych brekspiprazolu matkom odpowiadających około 16,5-krotności narażenia klinicznego MRHD.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgPrzedkliniczne dane o bezpieczeństwie
Opóźniony wzrost, rozwój fizyczny i pogorszenie zdolności do przeżycia potomstwa obserwowano po podaniu dawek brekspiprazolu toksycznych dla matek w badaniu toksyczności rozwojowej przed/po porodzie u szczurów otrzymujących dawki doustnie. Po podaniu doustnym u ciężarnych samic szczura wykazano przenikanie brekspiprazolu do płodu i mleka w stężeniach, które były na ogół porównywalne do poziomów obserwowanych we krwi matki. Ocena ryzyka dla środowiska Brekspiprazol jest bardzo trwały i wykazuje bardzo dużą zdolność do biokumulacji, jednak nie jest toksyczny dla środowiska: możliwy dodatek brekspiprazolu do lądowego łańcucha pokarmowego może stanowić problem (patrz punkt 6.6).
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki Laktoza jednowodna Skrobia kukurydziana Celuloza mikrokrystaliczna Niskopodstawiona hydroksypropyloceluloza Hydroksypropyloceluloza Magnezu stearynian Woda oczyszczona Powłoczka tabletki Hypromeloza (E 464) Talk (E 553b) Tytanu dwutlenek (E 171) RXULTI 0,25 mg, tabletki powlekane Żelaza tlenek (E 172) (żółty, czerwony, czarny) RXULTI 0,5 mg, tabletki powlekane Żelaza tlenek (E 172) (żółty, czerwony) RXULTI 1 mg, tabletki powlekane Żelaza tlenek (E 172) (żółty) RXULTI 2 mg, tabletki powlekane Żelaza tlenek (E 172) (żółty, czarny) RXULTI 3 mg, tabletki powlekane Żelaza tlenek (E 172) (czerwony, czarny) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
- CHPL leku RXULTI, tabletki powlekane, 0,25 mgDane farmaceutyczne
6.5 Rodzaj i zawartość opakowania RXULTI 0,25 mg i 0,5 mg tabletki powlekane 28 tabletek powlekanych w blistrach Aluminium/PVC. RXULTI 1 mg tabletki powlekane 10, 28 lub 56 tabletek powlekanych w blistrach Aluminium/PVC. RXULTI 2 mg, 3 mg i 4 mg tabletki powlekane 28 lub 56 tabletek powlekanych w blistrach Aluminium/PVC. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Ten produkt leczniczy może stanowić ryzyko dla środowiska (patrz punkt 5.3). Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku RXULTI, tabletki powlekane, 0,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO RXULTI 0,25 mg tabletki powlekane RXULTI 0,5 mg tabletki powlekane RXULTI 1 mg tabletki powlekane RXULTI 2 mg tabletki powlekane RXULTI 3 mg tabletki powlekane RXULTI 4 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY RXULTI 0,25 mg tabletki powlekane Każda tabletka powlekana zawiera 0,25 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45,8 mg laktozy (w postaci jednowodnej). RXULTI 0,5 mg tabletki powlekane Każda tabletka powlekana zawiera 0,5 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45,5 mg laktozy (w postaci jednowodnej). RXULTI 1 mg tabletki powlekane Każda tabletka powlekana zawiera 1 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45 mg laktozy (w postaci jednowodnej). RXULTI 2 mg tabletki powlekane Każda tabletka powlekana zawiera 2 mg brekspiprazolu.
- CHPL leku RXULTI, tabletki powlekane, 0,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 44,1 mg laktozy (w postaci jednowodnej). RXULTI 3 mg tabletki powlekane Każda tabletka powlekana zawiera 3 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 43,1 mg laktozy (w postaci jednowodnej). RXULTI 4 mg tabletki powlekane Każda tabletka powlekana zawiera 4 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 42,2 mg laktozy (w postaci jednowodnej). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana RXULTI 0,25 mg tabletki powlekane Jasnobrązowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 0.25 po jednej stronie. RXULTI 0,5 mg tabletki powlekane Jasnopomarańczowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 0.5 po jednej stronie.
- CHPL leku RXULTI, tabletki powlekane, 0,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
RXULTI 1 mg tabletki powlekane Jasnożółte, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 1 po jednej stronie. RXULTI 2 mg tabletki powlekane Jasnozielone, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 2 po jednej stronie. RXULTI 3 mg tabletki powlekane Jasnofioletowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 3 po jednej stronie. RXULTI 4 mg tabletki powlekane Białe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 4 po jednej stronie.
- CHPL leku RXULTI, tabletki powlekane, 0,5 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy RXULTI jest wskazany do leczenia schizofrenii u dorosłych.
- CHPL leku RXULTI, tabletki powlekane, 0,5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zalecana dawka początkowa brekspiprazolu to 1 mg raz na dobę w dniach od 1. do 4. Zakres zalecanej dawki docelowej wynosi od 2 mg do 4 mg raz na dobę. Zależnie od reakcji klinicznej i tolerancji pacjenta dawka brekspiprazolu może być zwiększona do 2 mg raz na dobę w dniach od 5. do 7., a następnie do 4 mg w dniu 8. Maksymalna zalecana dawka dobowa wynosi 4 mg. Zmiana z leczenia innymi lekami przeciwpsychotycznymi na brekspiprazol Podczas zmiany z leczenia innymi lekami przeciwpsychotycznymi na brekspiprazol należy rozważyć stopniowe krzyżowe dobieranie dawki leku ze stopniowym odstawianiem wcześniej stosowanego leku podczas rozpoczynania leczenia brekspiprazolem. Zmiana z leczenia brekspiprazolem na inne leki przeciwpsychotyczne Podczas zmiany z leczenia brekspiprazolem na inne leki przeciwpsychotyczne nie ma potrzeby stopniowego dobierania krzyżowego dawki leku.
- CHPL leku RXULTI, tabletki powlekane, 0,5 mgDawkowanie
Przyjmowanie nowego leku przeciwpsychotycznego należy rozpocząć od najmniejszej jego dawki, jednocześnie odstawiając brekspiprazol. Należy brać pod uwagę, że stężenie brekspiprazolu w osoczu będzie się zmniejszało stopniowo, aż do całkowitej eliminacji leku z organizmu po 1 lub 2 tygodniach. Szczególne grupy pacjentów Pacjenci w podeszłym wieku Nie określono bezpieczeństwa stosowania ani skuteczności brekspiprazolu w leczeniu schizofrenii u pacjentów w wieku 65 lat lub starszych (patrz punkt 4.4 i 5.2). Nie jest możliwe podanie wskazówek odnośnie do minimalnej skutecznej/bezpiecznej dawki w tej grupie pacjentów. Zaburzenia czynności nerek Maksymalna zalecana dawka u pacjentów z umiarkowanym i ciężkim zaburzeniem czynności nerek jest zmniejszona do 3 mg raz na dobę (patrz punkt 5.2). Zaburzenia czynności wątroby Maksymalna zalecana dawka u pacjentów z umiarkowanym i ciężkim zaburzeniem czynności wątroby (≥7 w klasyfikacji Childa-Pugha) jest zmniejszona do 3 mg raz na dobę (patrz punkt 5.2).
- CHPL leku RXULTI, tabletki powlekane, 0,5 mgDawkowanie
Osoby o wolnym metabolizmie przy udziale cytochromu CYP2D6 U pacjentów o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 wymagana jest zmiana dawki do połowy zalecanej dawki. Dalsze zmniejszenie dawki do jednej czwartej zalecanej dawki jest wymagane w przypadku pacjentów o znanym słabym metabolizmie przy udziale cytochromu CYP2D6, którzy przyjmującą jednocześnie silne lub umiarkowane inhibitory cytochromu CYP3A4 (patrz punkty 4.5 i 5.2). Dostosowanie dawki z powodu interakcji Dostosowanie dawki należy przeprowadzić u pacjentów przyjmujących jednocześnie silne inhibitory/leki indukujące CYP3A4 lub silne inhibitory CYP2D6. W razie odstawienia inhibitora/leku indukującego CYP3A4 lub inhibitora CYP2D6 może być wymagany powrót do tej dawki brekspiprazolu, jaką stosowano przed rozpoczęciem skojarzonego leczenia (patrz punkt 4.5).
- CHPL leku RXULTI, tabletki powlekane, 0,5 mgDawkowanie
W razie pojawienia się działań niepożądanych pomimo dostosowania dawki produktu leczniczego RXULTI, należy ponownie rozważyć, czy konieczne jest jednoczesne stosowanie produktu leczniczego RXULTI i inhibitora CYP2D6 lub CYP3A4. Tabela 1: Dostosowanie dawki produktu leczniczego RXULTI u pacjentów o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 oraz w przypadku jednoczesnego stosowania z inhibitorami cytochrom CYP
- CHPL leku RXULTI, tabletki powlekane, 0,5 mgDawkowanie
Czynniki Dawka dostosowana Osoby z wolno metabolizującym cytochromem CYP2D6 Osoby o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 Podawać połowę zalecanej dawki Osoby o wolnym metabolizmie przy udziale cytochromu CYP2D6 przyjmujące silne/umiarkowane inhibitory cytochromuCYP3A4 Podawać jedną czwartą zalecanej dawki Pacjenci przyjmujący inhibitory cytochromu CYP2D6 i (lub) inhibitory cytochromu CYP3A4 Silne inhibitory cytochromu CYP2D6 Podawać połowę zalecanej dawki Silne inhibitory cytochromu CYP3A4 Podawać połowę zalecanej dawki Silne/umiarkowane inhibitory cytochromuCYP2D6 z silnymi/umiarkowanymi inhibitorami cytochromu CYP3A4 Podawać jedną czwartą zalecanej dawki - CHPL leku RXULTI, tabletki powlekane, 0,5 mgDawkowanie
Pacjenci przyjmujący leki silnie indukujące cytochrom CYP3A4 Jeśli brekspiprazol jest stosowany jednocześnie z lekami silnie indukującymi cytochrom CYP3A4 (np. ryfampicyna), u pacjenta, u którego uzyskano stabilizację dzięki podawaniu brekspiprazolu, niezbędne jest stopniowe zwiększanie dawki dobowej brekspiprazolu do dwukrotnej zalecanej dawki brekspiprazolu w ciągu od 1 do 2 tygodni. Następnie, jeśli na podstawie odpowiedzi klinicznej potrzebne jest dalsze dostosowanie dawki, dawkę można zwiększyć maksymalnie do trzykrotnej zalecanej dawki dobowej. W przypadku stosowania brekspiprazolu jednocześnie z lekami silnie indukującymi cytochrom CYP3A4 dawka dobowa nie może przekraczać 12 mg. Zaleca się podawanie brekspiprazolu dwa razy na dobę w dawce podzielonej, ponieważ dawkowanie raz na dobę powoduje duże wahania stężenia od wartości szczytowej do najniższej (patrz punkt 4.5).
- CHPL leku RXULTI, tabletki powlekane, 0,5 mgDawkowanie
Produkty lecznicze indukujące cytochrom CYP3A4 działają w sposób zależny od czasu i uzyskanie maksymalnego efektu ich działania może zająć co najmniej 2 tygodnie od rozpoczęcia ich stosowania. I odwrotnie, po odstawieniu leku indukcja cytochromu CYP3A4 może utrzymywać się co najmniej 2 tygodnie zanim nie ustąpi. Dzieci i młodzież Nie określono bezpieczeństwa stosowania ani skuteczności brekspiprazolu u dzieci i młodzieży w wieku poniżej 18 lat. Dane nie są dostępne. Sposób podawania Podanie doustne. Tabletki powlekane można przyjmować wraz z posiłkiem lub oddzielnie.
- CHPL leku RXULTI, tabletki powlekane, 0,5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku RXULTI, tabletki powlekane, 1 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO RXULTI 0,25 mg tabletki powlekane RXULTI 0,5 mg tabletki powlekane RXULTI 1 mg tabletki powlekane RXULTI 2 mg tabletki powlekane RXULTI 3 mg tabletki powlekane RXULTI 4 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY RXULTI 0,25 mg tabletki powlekane Każda tabletka powlekana zawiera 0,25 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45,8 mg laktozy (w postaci jednowodnej). RXULTI 0,5 mg tabletki powlekane Każda tabletka powlekana zawiera 0,5 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45,5 mg laktozy (w postaci jednowodnej). RXULTI 1 mg tabletki powlekane Każda tabletka powlekana zawiera 1 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45 mg laktozy (w postaci jednowodnej). RXULTI 2 mg tabletki powlekane Każda tabletka powlekana zawiera 2 mg brekspiprazolu.
- CHPL leku RXULTI, tabletki powlekane, 1 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 44,1 mg laktozy (w postaci jednowodnej). RXULTI 3 mg tabletki powlekane Każda tabletka powlekana zawiera 3 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 43,1 mg laktozy (w postaci jednowodnej). RXULTI 4 mg tabletki powlekane Każda tabletka powlekana zawiera 4 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 42,2 mg laktozy (w postaci jednowodnej). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana RXULTI 0,25 mg tabletki powlekane Jasnobrązowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 0.25 po jednej stronie. RXULTI 0,5 mg tabletki powlekane Jasnopomarańczowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 0.5 po jednej stronie.
- CHPL leku RXULTI, tabletki powlekane, 1 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
RXULTI 1 mg tabletki powlekane Jasnożółte, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 1 po jednej stronie. RXULTI 2 mg tabletki powlekane Jasnozielone, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 2 po jednej stronie. RXULTI 3 mg tabletki powlekane Jasnofioletowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 3 po jednej stronie. RXULTI 4 mg tabletki powlekane Białe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 4 po jednej stronie.
- CHPL leku RXULTI, tabletki powlekane, 1 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy RXULTI jest wskazany do leczenia schizofrenii u dorosłych.
- CHPL leku RXULTI, tabletki powlekane, 1 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zalecana dawka początkowa brekspiprazolu to 1 mg raz na dobę w dniach od 1. do 4. Zakres zalecanej dawki docelowej wynosi od 2 mg do 4 mg raz na dobę. Zależnie od reakcji klinicznej i tolerancji pacjenta dawka brekspiprazolu może być zwiększona do 2 mg raz na dobę w dniach od 5. do 7., a następnie do 4 mg w dniu 8. Maksymalna zalecana dawka dobowa wynosi 4 mg. Zmiana z leczenia innymi lekami przeciwpsychotycznymi na brekspiprazol Podczas zmiany z leczenia innymi lekami przeciwpsychotycznymi na brekspiprazol należy rozważyć stopniowe krzyżowe dobieranie dawki leku ze stopniowym odstawianiem wcześniej stosowanego leku podczas rozpoczynania leczenia brekspiprazolem. Zmiana z leczenia brekspiprazolem na inne leki przeciwpsychotyczne Podczas zmiany z leczenia brekspiprazolem na inne leki przeciwpsychotyczne nie ma potrzeby stopniowego dobierania krzyżowego dawki leku.
- CHPL leku RXULTI, tabletki powlekane, 1 mgDawkowanie
Przyjmowanie nowego leku przeciwpsychotycznego należy rozpocząć od najmniejszej jego dawki, jednocześnie odstawiając brekspiprazol. Należy brać pod uwagę, że stężenie brekspiprazolu w osoczu będzie się zmniejszało stopniowo, aż do całkowitej eliminacji leku z organizmu po 1 lub 2 tygodniach. Szczególne grupy pacjentów Pacjenci w podeszłym wieku Nie określono bezpieczeństwa stosowania ani skuteczności brekspiprazolu w leczeniu schizofrenii u pacjentów w wieku 65 lat lub starszych (patrz punkt 4.4 i 5.2). Nie jest możliwe podanie wskazówek odnośnie do minimalnej skutecznej/bezpiecznej dawki w tej grupie pacjentów. Zaburzenia czynności nerek Maksymalna zalecana dawka u pacjentów z umiarkowanym i ciężkim zaburzeniem czynności nerek jest zmniejszona do 3 mg raz na dobę (patrz punkt 5.2). Zaburzenia czynności wątroby Maksymalna zalecana dawka u pacjentów z umiarkowanym i ciężkim zaburzeniem czynności wątroby (≥7 w klasyfikacji Childa-Pugha) jest zmniejszona do 3 mg raz na dobę (patrz punkt 5.2).
- CHPL leku RXULTI, tabletki powlekane, 1 mgDawkowanie
Osoby o wolnym metabolizmie przy udziale cytochromu CYP2D6 U pacjentów o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 wymagana jest zmiana dawki do połowy zalecanej dawki. Dalsze zmniejszenie dawki do jednej czwartej zalecanej dawki jest wymagane w przypadku pacjentów o znanym słabym metabolizmie przy udziale cytochromu CYP2D6, którzy przyjmującą jednocześnie silne lub umiarkowane inhibitory cytochromu CYP3A4 (patrz punkty 4.5 i 5.2). Dostosowanie dawki z powodu interakcji Dostosowanie dawki należy przeprowadzić u pacjentów przyjmujących jednocześnie silne inhibitory/leki indukujące CYP3A4 lub silne inhibitory CYP2D6. W razie odstawienia inhibitora/leku indukującego CYP3A4 lub inhibitora CYP2D6 może być wymagany powrót do tej dawki brekspiprazolu, jaką stosowano przed rozpoczęciem skojarzonego leczenia (patrz punkt 4.5).
- CHPL leku RXULTI, tabletki powlekane, 1 mgDawkowanie
W razie pojawienia się działań niepożądanych pomimo dostosowania dawki produktu leczniczego RXULTI, należy ponownie rozważyć, czy konieczne jest jednoczesne stosowanie produktu leczniczego RXULTI i inhibitora CYP2D6 lub CYP3A4. Tabela 1: Dostosowanie dawki produktu leczniczego RXULTI u pacjentów o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 oraz w przypadku jednoczesnego stosowania z inhibitorami cytochrom CYP
- CHPL leku RXULTI, tabletki powlekane, 1 mgDawkowanie
Czynniki Dawka dostosowana Osoby z wolno metabolizującym cytochromem CYP2D6 Osoby o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 Podawać połowę zalecanej dawki Osoby o wolnym metabolizmie przy udziale cytochromu CYP2D6 przyjmujące silne/umiarkowane inhibitory cytochromuCYP3A4 Podawać jedną czwartą zalecanej dawki Pacjenci przyjmujący inhibitory cytochromu CYP2D6 i (lub) inhibitory cytochromu CYP3A4 Silne inhibitory cytochromu CYP2D6 Podawać połowę zalecanej dawki Silne inhibitory cytochromu CYP3A4 Podawać połowę zalecanej dawki Silne/umiarkowane inhibitory cytochromuCYP2D6 z silnymi/umiarkowanymi inhibitorami cytochromu CYP3A4 Podawać jedną czwartą zalecanej dawki - CHPL leku RXULTI, tabletki powlekane, 1 mgDawkowanie
Pacjenci przyjmujący leki silnie indukujące cytochrom CYP3A4 Jeśli brekspiprazol jest stosowany jednocześnie z lekami silnie indukującymi cytochrom CYP3A4 (np. ryfampicyna), u pacjenta, u którego uzyskano stabilizację dzięki podawaniu brekspiprazolu, niezbędne jest stopniowe zwiększanie dawki dobowej brekspiprazolu do dwukrotnej zalecanej dawki brekspiprazolu w ciągu od 1 do 2 tygodni. Następnie, jeśli na podstawie odpowiedzi klinicznej potrzebne jest dalsze dostosowanie dawki, dawkę można zwiększyć maksymalnie do trzykrotnej zalecanej dawki dobowej. W przypadku stosowania brekspiprazolu jednocześnie z lekami silnie indukującymi cytochrom CYP3A4 dawka dobowa nie może przekraczać 12 mg. Zaleca się podawanie brekspiprazolu dwa razy na dobę w dawce podzielonej, ponieważ dawkowanie raz na dobę powoduje duże wahania stężenia od wartości szczytowej do najniższej (patrz punkt 4.5).
- CHPL leku RXULTI, tabletki powlekane, 1 mgDawkowanie
Produkty lecznicze indukujące cytochrom CYP3A4 działają w sposób zależny od czasu i uzyskanie maksymalnego efektu ich działania może zająć co najmniej 2 tygodnie od rozpoczęcia ich stosowania. I odwrotnie, po odstawieniu leku indukcja cytochromu CYP3A4 może utrzymywać się co najmniej 2 tygodnie zanim nie ustąpi. Dzieci i młodzież Nie określono bezpieczeństwa stosowania ani skuteczności brekspiprazolu u dzieci i młodzieży w wieku poniżej 18 lat. Dane nie są dostępne. Sposób podawania Podanie doustne. Tabletki powlekane można przyjmować wraz z posiłkiem lub oddzielnie.
- CHPL leku RXULTI, tabletki powlekane, 1 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku RXULTI, tabletki powlekane, 2 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO RXULTI 0,25 mg tabletki powlekane RXULTI 0,5 mg tabletki powlekane RXULTI 1 mg tabletki powlekane RXULTI 2 mg tabletki powlekane RXULTI 3 mg tabletki powlekane RXULTI 4 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY RXULTI 0,25 mg tabletki powlekane Każda tabletka powlekana zawiera 0,25 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45,8 mg laktozy (w postaci jednowodnej). RXULTI 0,5 mg tabletki powlekane Każda tabletka powlekana zawiera 0,5 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45,5 mg laktozy (w postaci jednowodnej). RXULTI 1 mg tabletki powlekane Każda tabletka powlekana zawiera 1 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45 mg laktozy (w postaci jednowodnej). RXULTI 2 mg tabletki powlekane Każda tabletka powlekana zawiera 2 mg brekspiprazolu.
- CHPL leku RXULTI, tabletki powlekane, 2 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 44,1 mg laktozy (w postaci jednowodnej). RXULTI 3 mg tabletki powlekane Każda tabletka powlekana zawiera 3 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 43,1 mg laktozy (w postaci jednowodnej). RXULTI 4 mg tabletki powlekane Każda tabletka powlekana zawiera 4 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 42,2 mg laktozy (w postaci jednowodnej). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana RXULTI 0,25 mg tabletki powlekane Jasnobrązowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 0.25 po jednej stronie. RXULTI 0,5 mg tabletki powlekane Jasnopomarańczowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 0.5 po jednej stronie.
- CHPL leku RXULTI, tabletki powlekane, 2 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
RXULTI 1 mg tabletki powlekane Jasnożółte, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 1 po jednej stronie. RXULTI 2 mg tabletki powlekane Jasnozielone, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 2 po jednej stronie. RXULTI 3 mg tabletki powlekane Jasnofioletowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 3 po jednej stronie. RXULTI 4 mg tabletki powlekane Białe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 4 po jednej stronie.
- CHPL leku RXULTI, tabletki powlekane, 2 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy RXULTI jest wskazany do leczenia schizofrenii u dorosłych.
- CHPL leku RXULTI, tabletki powlekane, 2 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zalecana dawka początkowa brekspiprazolu to 1 mg raz na dobę w dniach od 1. do 4. Zakres zalecanej dawki docelowej wynosi od 2 mg do 4 mg raz na dobę. Zależnie od reakcji klinicznej i tolerancji pacjenta dawka brekspiprazolu może być zwiększona do 2 mg raz na dobę w dniach od 5. do 7., a następnie do 4 mg w dniu 8. Maksymalna zalecana dawka dobowa wynosi 4 mg. Zmiana z leczenia innymi lekami przeciwpsychotycznymi na brekspiprazol Podczas zmiany z leczenia innymi lekami przeciwpsychotycznymi na brekspiprazol należy rozważyć stopniowe krzyżowe dobieranie dawki leku ze stopniowym odstawianiem wcześniej stosowanego leku podczas rozpoczynania leczenia brekspiprazolem. Zmiana z leczenia brekspiprazolem na inne leki przeciwpsychotyczne Podczas zmiany z leczenia brekspiprazolem na inne leki przeciwpsychotyczne nie ma potrzeby stopniowego dobierania krzyżowego dawki leku.
- CHPL leku RXULTI, tabletki powlekane, 2 mgDawkowanie
Przyjmowanie nowego leku przeciwpsychotycznego należy rozpocząć od najmniejszej jego dawki, jednocześnie odstawiając brekspiprazol. Należy brać pod uwagę, że stężenie brekspiprazolu w osoczu będzie się zmniejszało stopniowo, aż do całkowitej eliminacji leku z organizmu po 1 lub 2 tygodniach. Szczególne grupy pacjentów Pacjenci w podeszłym wieku Nie określono bezpieczeństwa stosowania ani skuteczności brekspiprazolu w leczeniu schizofrenii u pacjentów w wieku 65 lat lub starszych (patrz punkt 4.4 i 5.2). Nie jest możliwe podanie wskazówek odnośnie do minimalnej skutecznej/bezpiecznej dawki w tej grupie pacjentów. Zaburzenia czynności nerek Maksymalna zalecana dawka u pacjentów z umiarkowanym i ciężkim zaburzeniem czynności nerek jest zmniejszona do 3 mg raz na dobę (patrz punkt 5.2). Zaburzenia czynności wątroby Maksymalna zalecana dawka u pacjentów z umiarkowanym i ciężkim zaburzeniem czynności wątroby (≥7 w klasyfikacji Childa-Pugha) jest zmniejszona do 3 mg raz na dobę (patrz punkt 5.2).
- CHPL leku RXULTI, tabletki powlekane, 2 mgDawkowanie
Osoby o wolnym metabolizmie przy udziale cytochromu CYP2D6 U pacjentów o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 wymagana jest zmiana dawki do połowy zalecanej dawki. Dalsze zmniejszenie dawki do jednej czwartej zalecanej dawki jest wymagane w przypadku pacjentów o znanym słabym metabolizmie przy udziale cytochromu CYP2D6, którzy przyjmującą jednocześnie silne lub umiarkowane inhibitory cytochromu CYP3A4 (patrz punkty 4.5 i 5.2). Dostosowanie dawki z powodu interakcji Dostosowanie dawki należy przeprowadzić u pacjentów przyjmujących jednocześnie silne inhibitory/leki indukujące CYP3A4 lub silne inhibitory CYP2D6. W razie odstawienia inhibitora/leku indukującego CYP3A4 lub inhibitora CYP2D6 może być wymagany powrót do tej dawki brekspiprazolu, jaką stosowano przed rozpoczęciem skojarzonego leczenia (patrz punkt 4.5).
- CHPL leku RXULTI, tabletki powlekane, 2 mgDawkowanie
W razie pojawienia się działań niepożądanych pomimo dostosowania dawki produktu leczniczego RXULTI, należy ponownie rozważyć, czy konieczne jest jednoczesne stosowanie produktu leczniczego RXULTI i inhibitora CYP2D6 lub CYP3A4. Tabela 1: Dostosowanie dawki produktu leczniczego RXULTI u pacjentów o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 oraz w przypadku jednoczesnego stosowania z inhibitorami cytochrom CYP
- CHPL leku RXULTI, tabletki powlekane, 2 mgDawkowanie
Czynniki Dawka dostosowana Osoby z wolno metabolizującym cytochromem CYP2D6 Osoby o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 Podawać połowę zalecanej dawki Osoby o wolnym metabolizmie przy udziale cytochromu CYP2D6 przyjmujące silne/umiarkowane inhibitory cytochromuCYP3A4 Podawać jedną czwartą zalecanej dawki Pacjenci przyjmujący inhibitory cytochromu CYP2D6 i (lub) inhibitory cytochromu CYP3A4 Silne inhibitory cytochromu CYP2D6 Podawać połowę zalecanej dawki Silne inhibitory cytochromu CYP3A4 Podawać połowę zalecanej dawki Silne/umiarkowane inhibitory cytochromuCYP2D6 z silnymi/umiarkowanymi inhibitorami cytochromu CYP3A4 Podawać jedną czwartą zalecanej dawki - CHPL leku RXULTI, tabletki powlekane, 2 mgDawkowanie
Pacjenci przyjmujący leki silnie indukujące cytochrom CYP3A4 Jeśli brekspiprazol jest stosowany jednocześnie z lekami silnie indukującymi cytochrom CYP3A4 (np. ryfampicyna), u pacjenta, u którego uzyskano stabilizację dzięki podawaniu brekspiprazolu, niezbędne jest stopniowe zwiększanie dawki dobowej brekspiprazolu do dwukrotnej zalecanej dawki brekspiprazolu w ciągu od 1 do 2 tygodni. Następnie, jeśli na podstawie odpowiedzi klinicznej potrzebne jest dalsze dostosowanie dawki, dawkę można zwiększyć maksymalnie do trzykrotnej zalecanej dawki dobowej. W przypadku stosowania brekspiprazolu jednocześnie z lekami silnie indukującymi cytochrom CYP3A4 dawka dobowa nie może przekraczać 12 mg. Zaleca się podawanie brekspiprazolu dwa razy na dobę w dawce podzielonej, ponieważ dawkowanie raz na dobę powoduje duże wahania stężenia od wartości szczytowej do najniższej (patrz punkt 4.5).
- CHPL leku RXULTI, tabletki powlekane, 2 mgDawkowanie
Produkty lecznicze indukujące cytochrom CYP3A4 działają w sposób zależny od czasu i uzyskanie maksymalnego efektu ich działania może zająć co najmniej 2 tygodnie od rozpoczęcia ich stosowania. I odwrotnie, po odstawieniu leku indukcja cytochromu CYP3A4 może utrzymywać się co najmniej 2 tygodnie zanim nie ustąpi. Dzieci i młodzież Nie określono bezpieczeństwa stosowania ani skuteczności brekspiprazolu u dzieci i młodzieży w wieku poniżej 18 lat. Dane nie są dostępne. Sposób podawania Podanie doustne. Tabletki powlekane można przyjmować wraz z posiłkiem lub oddzielnie.
- CHPL leku RXULTI, tabletki powlekane, 2 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku RXULTI, tabletki powlekane, 3 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO RXULTI 0,25 mg tabletki powlekane RXULTI 0,5 mg tabletki powlekane RXULTI 1 mg tabletki powlekane RXULTI 2 mg tabletki powlekane RXULTI 3 mg tabletki powlekane RXULTI 4 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY RXULTI 0,25 mg tabletki powlekane Każda tabletka powlekana zawiera 0,25 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45,8 mg laktozy (w postaci jednowodnej). RXULTI 0,5 mg tabletki powlekane Każda tabletka powlekana zawiera 0,5 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45,5 mg laktozy (w postaci jednowodnej). RXULTI 1 mg tabletki powlekane Każda tabletka powlekana zawiera 1 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45 mg laktozy (w postaci jednowodnej). RXULTI 2 mg tabletki powlekane Każda tabletka powlekana zawiera 2 mg brekspiprazolu.
- CHPL leku RXULTI, tabletki powlekane, 3 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 44,1 mg laktozy (w postaci jednowodnej). RXULTI 3 mg tabletki powlekane Każda tabletka powlekana zawiera 3 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 43,1 mg laktozy (w postaci jednowodnej). RXULTI 4 mg tabletki powlekane Każda tabletka powlekana zawiera 4 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 42,2 mg laktozy (w postaci jednowodnej). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana RXULTI 0,25 mg tabletki powlekane Jasnobrązowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 0.25 po jednej stronie. RXULTI 0,5 mg tabletki powlekane Jasnopomarańczowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 0.5 po jednej stronie.
- CHPL leku RXULTI, tabletki powlekane, 3 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
RXULTI 1 mg tabletki powlekane Jasnożółte, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 1 po jednej stronie. RXULTI 2 mg tabletki powlekane Jasnozielone, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 2 po jednej stronie. RXULTI 3 mg tabletki powlekane Jasnofioletowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 3 po jednej stronie. RXULTI 4 mg tabletki powlekane Białe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 4 po jednej stronie.
- CHPL leku RXULTI, tabletki powlekane, 3 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy RXULTI jest wskazany do leczenia schizofrenii u dorosłych.
- CHPL leku RXULTI, tabletki powlekane, 3 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zalecana dawka początkowa brekspiprazolu to 1 mg raz na dobę w dniach od 1. do 4. Zakres zalecanej dawki docelowej wynosi od 2 mg do 4 mg raz na dobę. Zależnie od reakcji klinicznej i tolerancji pacjenta dawka brekspiprazolu może być zwiększona do 2 mg raz na dobę w dniach od 5. do 7., a następnie do 4 mg w dniu 8. Maksymalna zalecana dawka dobowa wynosi 4 mg. Zmiana z leczenia innymi lekami przeciwpsychotycznymi na brekspiprazol Podczas zmiany z leczenia innymi lekami przeciwpsychotycznymi na brekspiprazol należy rozważyć stopniowe krzyżowe dobieranie dawki leku ze stopniowym odstawianiem wcześniej stosowanego leku podczas rozpoczynania leczenia brekspiprazolem. Zmiana z leczenia brekspiprazolem na inne leki przeciwpsychotyczne Podczas zmiany z leczenia brekspiprazolem na inne leki przeciwpsychotyczne nie ma potrzeby stopniowego dobierania krzyżowego dawki leku.
- CHPL leku RXULTI, tabletki powlekane, 3 mgDawkowanie
Przyjmowanie nowego leku przeciwpsychotycznego należy rozpocząć od najmniejszej jego dawki, jednocześnie odstawiając brekspiprazol. Należy brać pod uwagę, że stężenie brekspiprazolu w osoczu będzie się zmniejszało stopniowo, aż do całkowitej eliminacji leku z organizmu po 1 lub 2 tygodniach. Szczególne grupy pacjentów Pacjenci w podeszłym wieku Nie określono bezpieczeństwa stosowania ani skuteczności brekspiprazolu w leczeniu schizofrenii u pacjentów w wieku 65 lat lub starszych (patrz punkt 4.4 i 5.2). Nie jest możliwe podanie wskazówek odnośnie do minimalnej skutecznej/bezpiecznej dawki w tej grupie pacjentów. Zaburzenia czynności nerek Maksymalna zalecana dawka u pacjentów z umiarkowanym i ciężkim zaburzeniem czynności nerek jest zmniejszona do 3 mg raz na dobę (patrz punkt 5.2). Zaburzenia czynności wątroby Maksymalna zalecana dawka u pacjentów z umiarkowanym i ciężkim zaburzeniem czynności wątroby (≥7 w klasyfikacji Childa-Pugha) jest zmniejszona do 3 mg raz na dobę (patrz punkt 5.2).
- CHPL leku RXULTI, tabletki powlekane, 3 mgDawkowanie
Osoby o wolnym metabolizmie przy udziale cytochromu CYP2D6 U pacjentów o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 wymagana jest zmiana dawki do połowy zalecanej dawki. Dalsze zmniejszenie dawki do jednej czwartej zalecanej dawki jest wymagane w przypadku pacjentów o znanym słabym metabolizmie przy udziale cytochromu CYP2D6, którzy przyjmującą jednocześnie silne lub umiarkowane inhibitory cytochromu CYP3A4 (patrz punkty 4.5 i 5.2). Dostosowanie dawki z powodu interakcji Dostosowanie dawki należy przeprowadzić u pacjentów przyjmujących jednocześnie silne inhibitory/leki indukujące CYP3A4 lub silne inhibitory CYP2D6. W razie odstawienia inhibitora/leku indukującego CYP3A4 lub inhibitora CYP2D6 może być wymagany powrót do tej dawki brekspiprazolu, jaką stosowano przed rozpoczęciem skojarzonego leczenia (patrz punkt 4.5).
- CHPL leku RXULTI, tabletki powlekane, 3 mgDawkowanie
W razie pojawienia się działań niepożądanych pomimo dostosowania dawki produktu leczniczego RXULTI, należy ponownie rozważyć, czy konieczne jest jednoczesne stosowanie produktu leczniczego RXULTI i inhibitora CYP2D6 lub CYP3A4. Tabela 1: Dostosowanie dawki produktu leczniczego RXULTI u pacjentów o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 oraz w przypadku jednoczesnego stosowania z inhibitorami cytochrom CYP
- CHPL leku RXULTI, tabletki powlekane, 3 mgDawkowanie
Czynniki Dawka dostosowana Osoby z wolno metabolizującym cytochromem CYP2D6 Osoby o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 Podawać połowę zalecanej dawki Osoby o wolnym metabolizmie przy udziale cytochromu CYP2D6 przyjmujące silne/umiarkowane inhibitory cytochromuCYP3A4 Podawać jedną czwartą zalecanej dawki Pacjenci przyjmujący inhibitory cytochromu CYP2D6 i (lub) inhibitory cytochromu CYP3A4 Silne inhibitory cytochromu CYP2D6 Podawać połowę zalecanej dawki Silne inhibitory cytochromu CYP3A4 Podawać połowę zalecanej dawki Silne/umiarkowane inhibitory cytochromuCYP2D6 z silnymi/umiarkowanymi inhibitorami cytochromu CYP3A4 Podawać jedną czwartą zalecanej dawki - CHPL leku RXULTI, tabletki powlekane, 3 mgDawkowanie
Pacjenci przyjmujący leki silnie indukujące cytochrom CYP3A4 Jeśli brekspiprazol jest stosowany jednocześnie z lekami silnie indukującymi cytochrom CYP3A4 (np. ryfampicyna), u pacjenta, u którego uzyskano stabilizację dzięki podawaniu brekspiprazolu, niezbędne jest stopniowe zwiększanie dawki dobowej brekspiprazolu do dwukrotnej zalecanej dawki brekspiprazolu w ciągu od 1 do 2 tygodni. Następnie, jeśli na podstawie odpowiedzi klinicznej potrzebne jest dalsze dostosowanie dawki, dawkę można zwiększyć maksymalnie do trzykrotnej zalecanej dawki dobowej. W przypadku stosowania brekspiprazolu jednocześnie z lekami silnie indukującymi cytochrom CYP3A4 dawka dobowa nie może przekraczać 12 mg. Zaleca się podawanie brekspiprazolu dwa razy na dobę w dawce podzielonej, ponieważ dawkowanie raz na dobę powoduje duże wahania stężenia od wartości szczytowej do najniższej (patrz punkt 4.5).
- CHPL leku RXULTI, tabletki powlekane, 3 mgDawkowanie
Produkty lecznicze indukujące cytochrom CYP3A4 działają w sposób zależny od czasu i uzyskanie maksymalnego efektu ich działania może zająć co najmniej 2 tygodnie od rozpoczęcia ich stosowania. I odwrotnie, po odstawieniu leku indukcja cytochromu CYP3A4 może utrzymywać się co najmniej 2 tygodnie zanim nie ustąpi. Dzieci i młodzież Nie określono bezpieczeństwa stosowania ani skuteczności brekspiprazolu u dzieci i młodzieży w wieku poniżej 18 lat. Dane nie są dostępne. Sposób podawania Podanie doustne. Tabletki powlekane można przyjmować wraz z posiłkiem lub oddzielnie.
- CHPL leku RXULTI, tabletki powlekane, 3 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku RXULTI, tabletki powlekane, 4 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO RXULTI 0,25 mg tabletki powlekane RXULTI 0,5 mg tabletki powlekane RXULTI 1 mg tabletki powlekane RXULTI 2 mg tabletki powlekane RXULTI 3 mg tabletki powlekane RXULTI 4 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY RXULTI 0,25 mg tabletki powlekane Każda tabletka powlekana zawiera 0,25 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45,8 mg laktozy (w postaci jednowodnej). RXULTI 0,5 mg tabletki powlekane Każda tabletka powlekana zawiera 0,5 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45,5 mg laktozy (w postaci jednowodnej). RXULTI 1 mg tabletki powlekane Każda tabletka powlekana zawiera 1 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 45 mg laktozy (w postaci jednowodnej). RXULTI 2 mg tabletki powlekane Każda tabletka powlekana zawiera 2 mg brekspiprazolu.
- CHPL leku RXULTI, tabletki powlekane, 4 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 44,1 mg laktozy (w postaci jednowodnej). RXULTI 3 mg tabletki powlekane Każda tabletka powlekana zawiera 3 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 43,1 mg laktozy (w postaci jednowodnej). RXULTI 4 mg tabletki powlekane Każda tabletka powlekana zawiera 4 mg brekspiprazolu. Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera około 42,2 mg laktozy (w postaci jednowodnej). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana RXULTI 0,25 mg tabletki powlekane Jasnobrązowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 0.25 po jednej stronie. RXULTI 0,5 mg tabletki powlekane Jasnopomarańczowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 0.5 po jednej stronie.
- CHPL leku RXULTI, tabletki powlekane, 4 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
RXULTI 1 mg tabletki powlekane Jasnożółte, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 1 po jednej stronie. RXULTI 2 mg tabletki powlekane Jasnozielone, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 2 po jednej stronie. RXULTI 3 mg tabletki powlekane Jasnofioletowe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 3 po jednej stronie. RXULTI 4 mg tabletki powlekane Białe, okrągłe, lekko wypukłe tabletki o średnicy 6 mm ze ściętymi krawędziami, z wytłoczonym napisem BRX i 4 po jednej stronie.
- CHPL leku RXULTI, tabletki powlekane, 4 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy RXULTI jest wskazany do leczenia schizofrenii u dorosłych.
- CHPL leku RXULTI, tabletki powlekane, 4 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zalecana dawka początkowa brekspiprazolu to 1 mg raz na dobę w dniach od 1. do 4. Zakres zalecanej dawki docelowej wynosi od 2 mg do 4 mg raz na dobę. Zależnie od reakcji klinicznej i tolerancji pacjenta dawka brekspiprazolu może być zwiększona do 2 mg raz na dobę w dniach od 5. do 7., a następnie do 4 mg w dniu 8. Maksymalna zalecana dawka dobowa wynosi 4 mg. Zmiana z leczenia innymi lekami przeciwpsychotycznymi na brekspiprazol Podczas zmiany z leczenia innymi lekami przeciwpsychotycznymi na brekspiprazol należy rozważyć stopniowe krzyżowe dobieranie dawki leku ze stopniowym odstawianiem wcześniej stosowanego leku podczas rozpoczynania leczenia brekspiprazolem. Zmiana z leczenia brekspiprazolem na inne leki przeciwpsychotyczne Podczas zmiany z leczenia brekspiprazolem na inne leki przeciwpsychotyczne nie ma potrzeby stopniowego dobierania krzyżowego dawki leku.
- CHPL leku RXULTI, tabletki powlekane, 4 mgDawkowanie
Przyjmowanie nowego leku przeciwpsychotycznego należy rozpocząć od najmniejszej jego dawki, jednocześnie odstawiając brekspiprazol. Należy brać pod uwagę, że stężenie brekspiprazolu w osoczu będzie się zmniejszało stopniowo, aż do całkowitej eliminacji leku z organizmu po 1 lub 2 tygodniach. Szczególne grupy pacjentów Pacjenci w podeszłym wieku Nie określono bezpieczeństwa stosowania ani skuteczności brekspiprazolu w leczeniu schizofrenii u pacjentów w wieku 65 lat lub starszych (patrz punkt 4.4 i 5.2). Nie jest możliwe podanie wskazówek odnośnie do minimalnej skutecznej/bezpiecznej dawki w tej grupie pacjentów. Zaburzenia czynności nerek Maksymalna zalecana dawka u pacjentów z umiarkowanym i ciężkim zaburzeniem czynności nerek jest zmniejszona do 3 mg raz na dobę (patrz punkt 5.2). Zaburzenia czynności wątroby Maksymalna zalecana dawka u pacjentów z umiarkowanym i ciężkim zaburzeniem czynności wątroby (≥7 w klasyfikacji Childa-Pugha) jest zmniejszona do 3 mg raz na dobę (patrz punkt 5.2).
- CHPL leku RXULTI, tabletki powlekane, 4 mgDawkowanie
Osoby o wolnym metabolizmie przy udziale cytochromu CYP2D6 U pacjentów o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 wymagana jest zmiana dawki do połowy zalecanej dawki. Dalsze zmniejszenie dawki do jednej czwartej zalecanej dawki jest wymagane w przypadku pacjentów o znanym słabym metabolizmie przy udziale cytochromu CYP2D6, którzy przyjmującą jednocześnie silne lub umiarkowane inhibitory cytochromu CYP3A4 (patrz punkty 4.5 i 5.2). Dostosowanie dawki z powodu interakcji Dostosowanie dawki należy przeprowadzić u pacjentów przyjmujących jednocześnie silne inhibitory/leki indukujące CYP3A4 lub silne inhibitory CYP2D6. W razie odstawienia inhibitora/leku indukującego CYP3A4 lub inhibitora CYP2D6 może być wymagany powrót do tej dawki brekspiprazolu, jaką stosowano przed rozpoczęciem skojarzonego leczenia (patrz punkt 4.5).
- CHPL leku RXULTI, tabletki powlekane, 4 mgDawkowanie
W razie pojawienia się działań niepożądanych pomimo dostosowania dawki produktu leczniczego RXULTI, należy ponownie rozważyć, czy konieczne jest jednoczesne stosowanie produktu leczniczego RXULTI i inhibitora CYP2D6 lub CYP3A4. Tabela 1: Dostosowanie dawki produktu leczniczego RXULTI u pacjentów o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 oraz w przypadku jednoczesnego stosowania z inhibitorami cytochrom CYP
- CHPL leku RXULTI, tabletki powlekane, 4 mgDawkowanie
Czynniki Dawka dostosowana Osoby z wolno metabolizującym cytochromem CYP2D6 Osoby o znanym wolnym metabolizmie przy udziale cytochromu CYP2D6 Podawać połowę zalecanej dawki Osoby o wolnym metabolizmie przy udziale cytochromu CYP2D6 przyjmujące silne/umiarkowane inhibitory cytochromuCYP3A4 Podawać jedną czwartą zalecanej dawki Pacjenci przyjmujący inhibitory cytochromu CYP2D6 i (lub) inhibitory cytochromu CYP3A4 Silne inhibitory cytochromu CYP2D6 Podawać połowę zalecanej dawki Silne inhibitory cytochromu CYP3A4 Podawać połowę zalecanej dawki Silne/umiarkowane inhibitory cytochromuCYP2D6 z silnymi/umiarkowanymi inhibitorami cytochromu CYP3A4 Podawać jedną czwartą zalecanej dawki - CHPL leku RXULTI, tabletki powlekane, 4 mgDawkowanie
Pacjenci przyjmujący leki silnie indukujące cytochrom CYP3A4 Jeśli brekspiprazol jest stosowany jednocześnie z lekami silnie indukującymi cytochrom CYP3A4 (np. ryfampicyna), u pacjenta, u którego uzyskano stabilizację dzięki podawaniu brekspiprazolu, niezbędne jest stopniowe zwiększanie dawki dobowej brekspiprazolu do dwukrotnej zalecanej dawki brekspiprazolu w ciągu od 1 do 2 tygodni. Następnie, jeśli na podstawie odpowiedzi klinicznej potrzebne jest dalsze dostosowanie dawki, dawkę można zwiększyć maksymalnie do trzykrotnej zalecanej dawki dobowej. W przypadku stosowania brekspiprazolu jednocześnie z lekami silnie indukującymi cytochrom CYP3A4 dawka dobowa nie może przekraczać 12 mg. Zaleca się podawanie brekspiprazolu dwa razy na dobę w dawce podzielonej, ponieważ dawkowanie raz na dobę powoduje duże wahania stężenia od wartości szczytowej do najniższej (patrz punkt 4.5).
- CHPL leku RXULTI, tabletki powlekane, 4 mgDawkowanie
Produkty lecznicze indukujące cytochrom CYP3A4 działają w sposób zależny od czasu i uzyskanie maksymalnego efektu ich działania może zająć co najmniej 2 tygodnie od rozpoczęcia ich stosowania. I odwrotnie, po odstawieniu leku indukcja cytochromu CYP3A4 może utrzymywać się co najmniej 2 tygodnie zanim nie ustąpi. Dzieci i młodzież Nie określono bezpieczeństwa stosowania ani skuteczności brekspiprazolu u dzieci i młodzieży w wieku poniżej 18 lat. Dane nie są dostępne. Sposób podawania Podanie doustne. Tabletki powlekane można przyjmować wraz z posiłkiem lub oddzielnie.
- CHPL leku RXULTI, tabletki powlekane, 4 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Zypsila, kapsułki twarde, 20 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Zypsila, 20 mg, kapsułki, twarde Zypsila, 40 mg, kapsułki, twarde Zypsila, 60 mg, kapsułki, twarde Zypsila, 80 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Zypsila, 20 mg, kapsułki, twarde Każda kapsułka, twarda zawiera 20 mg zyprazydonu w postaci zyprazydonu wodorosiarczanu. Zypsila, 40 mg, kapsułki, twarde Każda kapsułka, twarda zawiera 40 mg zyprazydonu w postaci zyprazydonu wodorosiarczanu. Zypsila, 60 mg, kapsułki, twarde Każda kapsułka, twarda zawiera 60 mg zyprazydonu w postaci zyprazydonu wodorosiarczanu. Zypsila, 80 mg, kapsułki, twarde Każda kapsułka, twarda zawiera 80 mg zyprazydonu w postaci zyprazydonu wodorosiarczanu. Substancja pomocnicza o znanym działaniu 20 mg 40 mg 60 mg 80 mg Laktoza (mg/kapsułkę) 57,43 114,86 172,30 229,73 Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3.
- CHPL leku Zypsila, kapsułki twarde, 20 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
POSTAĆ FARMACEUTYCZNA Kapsułka, twarda Zypsila, 20 mg, kapsułki, twarde Wieczko kapsułki jest pastelowozielone, korpus kapsułki biały. Kapsułka zawiera proszek w kolorze od jasnoróżowego do brązowawego. Zypsila, 40 mg, kapsułki, twarde Wieczko kapsułki jest ciemnozielone, korpus kapsułki pastelowozielony. Kapsułka zawiera proszek w kolorze od jasnoróżowego do brązowawego. Zypsila, 60 mg, kapsułki, twarde Wieczko kapsułki jest ciemnozielone, korpus kapsułki biały. Kapsułka zawiera proszek w kolorze od jasnoróżowego do brązowawego. Zypsila, 80 mg, kapsułki, twarde Wieczko kapsułki jest pastelowozielone, korpus kapsułki biały. Kapsułka zawiera proszek w kolorze od jasnoróżowego do brązowawego.
- CHPL leku Zypsila, kapsułki twarde, 20 mgWskazania do stosowania
4.1 Wskazania do stosowania Zyprazydon stosowany jest w leczeniu schizofrenii u dorosłych. Zyprazydon stosowany jest w leczeniu maniakalnych i mieszanych epizodów o umiarkowanej ciężkości w zaburzeniu afektywnym dwubiegunowym u dorosłych oraz dzieci i młodzieży w wieku 10-17 lat (skuteczność produktu leczniczego w zapobieganiu nawrotom epizodów choroby dwubiegunowej nie została ustalona, patrz punkt 5.1).
- CHPL leku Zypsila, kapsułki twarde, 20 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli W leczeniu fazy zaostrzenia schizofrenii i epizodu manii w zaburzeniu dwubiegunowym zalecana dawka wynosi 40 mg dwa razy na dobę w trakcie posiłku. Dawka ta może być zwiększona zależnie od stanu klinicznego pacjenta, maksymalnie do 80 mg dwa razy na dobę. Jeżeli jest to wskazane, maksymalną zalecaną dawkę można stosować już od 3. dnia leczenia. Bardzo ważne, by nie przekraczać maksymalnej dawki, gdyż profil bezpieczeństwa powyżej 160 mg/dobę nie został potwierdzony, a przyjmowanie zyprazydonu wiąże się z proporcjonalnym do dawki wydłużeniem odstępu QT (patrz punkty 4.3 i 4.4). W leczeniu podtrzymującym pacjentów ze schizofrenią należy stosować najmniejsze skuteczne dawki zyprazydonu; w wielu przypadkach dawka 20 mg dwa razy na dobę może okazać się wystarczająca.
- CHPL leku Zypsila, kapsułki twarde, 20 mgDawkowanie
Pacjenci w podeszłym wieku Mniejsza dawka początkowa nie jest zwykle wskazana, ale należy ją jednak rozważyć u pacjentów w wieku powyżej 65 lat, jeśli istnieje uzasadnienie kliniczne. Zaburzenia czynności nerek U pacjentów z zaburzeniami czynności nerek nie jest konieczne dostosowanie dawki (patrz punkt 5.2). Zaburzenia czynności wątroby U pacjentów z niewydolnością wątroby należy rozważyć zmniejszenie dawki (patrz punkty 4.3 i 5.2). Dzieci i młodzież Choroba afektywna dwubiegunowa Zalecana dawka w leczeniu stanów ostrych w przebiegu choroby afektywnej dwubiegunowej u dzieci i młodzieży (w wieku od 10 do 17 lat) to 20 mg przyjęte w pojedynczej dawce dobowej podczas posiłku w pierwszym dniu leczenia. W kolejnych dniach zyprazydon powinien być podawany podczas posiłków w dwóch dawkach podzielonych, przy czym dawkę dobową należy stopniowo zwiększać przez okres 1-2 tygodni, aż do osiągnięcia docelowych wartości w granicach 120-160 mg/dobę u pacjentów o masie ciała ≥45 kg lub 60-80 mg/dobę u pacjentów o masie ciała <45 kg.
- CHPL leku Zypsila, kapsułki twarde, 20 mgDawkowanie
W późniejszym okresie dawki powinny być dobierane na podstawie indywidualnego stanu klinicznego w zakresie 80-160 mg/dobę u pacjentów o masie ciała ≥45 kg lub 40-80 mg/dobę u pacjentów o masie ciała <45 kg. W badaniu klinicznym dopuszczono nierówne rozłożenie wielkości dawek podzielnych, przy czym poranna dawka leku była o 20 mg lub 40 mg mniejsza od dawki wieczornej (patrz punkty 4.4, 4.5 i 5.2). Szczególnie istotne jest, aby nie przekraczać maksymalnej dawki ustalonej na podstawie masy ciała, ponieważ nie potwierdzono profilu bezpieczeństwa zyprazydonu w dawkach większych od dawki maksymalnej (160 mg/dobę dla dzieci o masie ciała ≥45 kg i 80 mg/dobę dla dzieci o masie ciała <45 kg), a zyprazydon wykazuje związek z zależnym od dawki wydłużeniem QT (patrz punkty 4.3 i 4.4). Schizofrenia Nie przeprowadzono badań oceniających bezpieczeństwo i skuteczność stosowania zyprazydonu u dzieci i młodzieży ze schizofrenią (patrz punkty 4.4 i 5.1). Sposób podawania Podanie doustne.
- CHPL leku Zypsila, kapsułki twarde, 20 mgDawkowanie
Kapsułki należy przyjmować z posiłkiem i połykać w całości, bez uprzedniego żucia, kruszenia lub otwierania, ponieważ może to wpływać na wchłanianie leku.
- CHPL leku Zypsila, kapsułki twarde, 20 mgPrzeciwwskazania
4.3 Przeciwwskazania Stwierdzona nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, Stwierdzone wydłużenie odstępu QT, Wrodzony zespół wydłużonego odstępu QT, Świeży zawał mięśnia sercowego, Niewyrównana niewydolność serca, Zaburzenia rytmu serca leczone lekami przeciwarytmicznymi z grupy IA i III, Jednoczesne leczenie lekami wydłużającymi odstęp QT, takimi jak: leki przeciwarytmiczne z grupy IA i III, trójtlenek arsenu, halofantryna, octan lewometadylu, mesorydazyna, tiorydazyna, pimozyd, sparfloksacyna, gatifloksacyna, moksyfloksacyna, metylosulfonian dolasetronu, meflokina, sertindol, cyzapryd (patrz punkty 4.4 i 4.5).
- CHPL leku Zypsila, kapsułki twarde, 60 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Zypsila, 20 mg, kapsułki, twarde Zypsila, 40 mg, kapsułki, twarde Zypsila, 60 mg, kapsułki, twarde Zypsila, 80 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Zypsila, 20 mg, kapsułki, twarde Każda kapsułka, twarda zawiera 20 mg zyprazydonu w postaci zyprazydonu wodorosiarczanu. Zypsila, 40 mg, kapsułki, twarde Każda kapsułka, twarda zawiera 40 mg zyprazydonu w postaci zyprazydonu wodorosiarczanu. Zypsila, 60 mg, kapsułki, twarde Każda kapsułka, twarda zawiera 60 mg zyprazydonu w postaci zyprazydonu wodorosiarczanu. Zypsila, 80 mg, kapsułki, twarde Każda kapsułka, twarda zawiera 80 mg zyprazydonu w postaci zyprazydonu wodorosiarczanu. Substancja pomocnicza o znanym działaniu 20 mg 40 mg 60 mg 80 mg Laktoza (mg/kapsułkę) 57,43 114,86 172,30 229,73 Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3.
- CHPL leku Zypsila, kapsułki twarde, 60 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
POSTAĆ FARMACEUTYCZNA Kapsułka, twarda Zypsila, 20 mg, kapsułki, twarde Wieczko kapsułki jest pastelowozielone, korpus kapsułki biały. Kapsułka zawiera proszek w kolorze od jasnoróżowego do brązowawego. Zypsila, 40 mg, kapsułki, twarde Wieczko kapsułki jest ciemnozielone, korpus kapsułki pastelowozielony. Kapsułka zawiera proszek w kolorze od jasnoróżowego do brązowawego. Zypsila, 60 mg, kapsułki, twarde Wieczko kapsułki jest ciemnozielone, korpus kapsułki biały. Kapsułka zawiera proszek w kolorze od jasnoróżowego do brązowawego. Zypsila, 80 mg, kapsułki, twarde Wieczko kapsułki jest pastelowozielone, korpus kapsułki biały. Kapsułka zawiera proszek w kolorze od jasnoróżowego do brązowawego.
- CHPL leku Zypsila, kapsułki twarde, 60 mgWskazania do stosowania
4.1 Wskazania do stosowania Zyprazydon stosowany jest w leczeniu schizofrenii u dorosłych. Zyprazydon stosowany jest w leczeniu maniakalnych i mieszanych epizodów o umiarkowanej ciężkości w zaburzeniu afektywnym dwubiegunowym u dorosłych oraz dzieci i młodzieży w wieku 10-17 lat (skuteczność produktu leczniczego w zapobieganiu nawrotom epizodów choroby dwubiegunowej nie została ustalona, patrz punkt 5.1).
- CHPL leku Zypsila, kapsułki twarde, 60 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli W leczeniu fazy zaostrzenia schizofrenii i epizodu manii w zaburzeniu dwubiegunowym zalecana dawka wynosi 40 mg dwa razy na dobę w trakcie posiłku. Dawka ta może być zwiększona zależnie od stanu klinicznego pacjenta, maksymalnie do 80 mg dwa razy na dobę. Jeżeli jest to wskazane, maksymalną zalecaną dawkę można stosować już od 3. dnia leczenia. Bardzo ważne, by nie przekraczać maksymalnej dawki, gdyż profil bezpieczeństwa powyżej 160 mg/dobę nie został potwierdzony, a przyjmowanie zyprazydonu wiąże się z proporcjonalnym do dawki wydłużeniem odstępu QT (patrz punkty 4.3 i 4.4). W leczeniu podtrzymującym pacjentów ze schizofrenią należy stosować najmniejsze skuteczne dawki zyprazydonu; w wielu przypadkach dawka 20 mg dwa razy na dobę może okazać się wystarczająca.
- CHPL leku Zypsila, kapsułki twarde, 60 mgDawkowanie
Pacjenci w podeszłym wieku Mniejsza dawka początkowa nie jest zwykle wskazana, ale należy ją jednak rozważyć u pacjentów w wieku powyżej 65 lat, jeśli istnieje uzasadnienie kliniczne. Zaburzenia czynności nerek U pacjentów z zaburzeniami czynności nerek nie jest konieczne dostosowanie dawki (patrz punkt 5.2). Zaburzenia czynności wątroby U pacjentów z niewydolnością wątroby należy rozważyć zmniejszenie dawki (patrz punkty 4.3 i 5.2). Dzieci i młodzież Choroba afektywna dwubiegunowa Zalecana dawka w leczeniu stanów ostrych w przebiegu choroby afektywnej dwubiegunowej u dzieci i młodzieży (w wieku od 10 do 17 lat) to 20 mg przyjęte w pojedynczej dawce dobowej podczas posiłku w pierwszym dniu leczenia. W kolejnych dniach zyprazydon powinien być podawany podczas posiłków w dwóch dawkach podzielonych, przy czym dawkę dobową należy stopniowo zwiększać przez okres 1-2 tygodni, aż do osiągnięcia docelowych wartości w granicach 120-160 mg/dobę u pacjentów o masie ciała ≥45 kg lub 60-80 mg/dobę u pacjentów o masie ciała <45 kg.
- CHPL leku Zypsila, kapsułki twarde, 60 mgDawkowanie
W późniejszym okresie dawki powinny być dobierane na podstawie indywidualnego stanu klinicznego w zakresie 80-160 mg/dobę u pacjentów o masie ciała ≥45 kg lub 40-80 mg/dobę u pacjentów o masie ciała <45 kg. W badaniu klinicznym dopuszczono nierówne rozłożenie wielkości dawek podzielnych, przy czym poranna dawka leku była o 20 mg lub 40 mg mniejsza od dawki wieczornej (patrz punkty 4.4, 4.5 i 5.2). Szczególnie istotne jest, aby nie przekraczać maksymalnej dawki ustalonej na podstawie masy ciała, ponieważ nie potwierdzono profilu bezpieczeństwa zyprazydonu w dawkach większych od dawki maksymalnej (160 mg/dobę dla dzieci o masie ciała ≥45 kg i 80 mg/dobę dla dzieci o masie ciała <45 kg), a zyprazydon wykazuje związek z zależnym od dawki wydłużeniem QT (patrz punkty 4.3 i 4.4). Schizofrenia Nie przeprowadzono badań oceniających bezpieczeństwo i skuteczność stosowania zyprazydonu u dzieci i młodzieży ze schizofrenią (patrz punkty 4.4 i 5.1). Sposób podawania Podanie doustne.
- CHPL leku Zypsila, kapsułki twarde, 60 mgDawkowanie
Kapsułki należy przyjmować z posiłkiem i połykać w całości, bez uprzedniego żucia, kruszenia lub otwierania, ponieważ może to wpływać na wchłanianie leku.
- CHPL leku Zypsila, kapsułki twarde, 60 mgPrzeciwwskazania
4.3 Przeciwwskazania Stwierdzona nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, Stwierdzone wydłużenie odstępu QT, Wrodzony zespół wydłużonego odstępu QT, Świeży zawał mięśnia sercowego, Niewyrównana niewydolność serca, Zaburzenia rytmu serca leczone lekami przeciwarytmicznymi z grupy IA i III, Jednoczesne leczenie lekami wydłużającymi odstęp QT, takimi jak: leki przeciwarytmiczne z grupy IA i III, trójtlenek arsenu, halofantryna, octan lewometadylu, mesorydazyna, tiorydazyna, pimozyd, sparfloksacyna, gatifloksacyna, moksyfloksacyna, metylosulfonian dolasetronu, meflokina, sertindol, cyzapryd (patrz punkty 4.4 i 4.5).
- CHPL leku Zypsila, kapsułki twarde, 40 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Zypsila, 20 mg, kapsułki, twarde Zypsila, 40 mg, kapsułki, twarde Zypsila, 60 mg, kapsułki, twarde Zypsila, 80 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Zypsila, 20 mg, kapsułki, twarde Każda kapsułka, twarda zawiera 20 mg zyprazydonu w postaci zyprazydonu wodorosiarczanu. Zypsila, 40 mg, kapsułki, twarde Każda kapsułka, twarda zawiera 40 mg zyprazydonu w postaci zyprazydonu wodorosiarczanu. Zypsila, 60 mg, kapsułki, twarde Każda kapsułka, twarda zawiera 60 mg zyprazydonu w postaci zyprazydonu wodorosiarczanu. Zypsila, 80 mg, kapsułki, twarde Każda kapsułka, twarda zawiera 80 mg zyprazydonu w postaci zyprazydonu wodorosiarczanu. Substancja pomocnicza o znanym działaniu 20 mg 40 mg 60 mg 80 mg Laktoza (mg/kapsułkę) 57,43 114,86 172,30 229,73 Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3.
- CHPL leku Zypsila, kapsułki twarde, 40 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
POSTAĆ FARMACEUTYCZNA Kapsułka, twarda Zypsila, 20 mg, kapsułki, twarde Wieczko kapsułki jest pastelowozielone, korpus kapsułki biały. Kapsułka zawiera proszek w kolorze od jasnoróżowego do brązowawego. Zypsila, 40 mg, kapsułki, twarde Wieczko kapsułki jest ciemnozielone, korpus kapsułki pastelowozielony. Kapsułka zawiera proszek w kolorze od jasnoróżowego do brązowawego. Zypsila, 60 mg, kapsułki, twarde Wieczko kapsułki jest ciemnozielone, korpus kapsułki biały. Kapsułka zawiera proszek w kolorze od jasnoróżowego do brązowawego. Zypsila, 80 mg, kapsułki, twarde Wieczko kapsułki jest pastelowozielone, korpus kapsułki biały. Kapsułka zawiera proszek w kolorze od jasnoróżowego do brązowawego.
- CHPL leku Zypsila, kapsułki twarde, 40 mgWskazania do stosowania
4.1 Wskazania do stosowania Zyprazydon stosowany jest w leczeniu schizofrenii u dorosłych. Zyprazydon stosowany jest w leczeniu maniakalnych i mieszanych epizodów o umiarkowanej ciężkości w zaburzeniu afektywnym dwubiegunowym u dorosłych oraz dzieci i młodzieży w wieku 10-17 lat (skuteczność produktu leczniczego w zapobieganiu nawrotom epizodów choroby dwubiegunowej nie została ustalona, patrz punkt 5.1).
- CHPL leku Zypsila, kapsułki twarde, 40 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli W leczeniu fazy zaostrzenia schizofrenii i epizodu manii w zaburzeniu dwubiegunowym zalecana dawka wynosi 40 mg dwa razy na dobę w trakcie posiłku. Dawka ta może być zwiększona zależnie od stanu klinicznego pacjenta, maksymalnie do 80 mg dwa razy na dobę. Jeżeli jest to wskazane, maksymalną zalecaną dawkę można stosować już od 3. dnia leczenia. Bardzo ważne, by nie przekraczać maksymalnej dawki, gdyż profil bezpieczeństwa powyżej 160 mg/dobę nie został potwierdzony, a przyjmowanie zyprazydonu wiąże się z proporcjonalnym do dawki wydłużeniem odstępu QT (patrz punkty 4.3 i 4.4). W leczeniu podtrzymującym pacjentów ze schizofrenią należy stosować najmniejsze skuteczne dawki zyprazydonu; w wielu przypadkach dawka 20 mg dwa razy na dobę może okazać się wystarczająca.
- CHPL leku Zypsila, kapsułki twarde, 40 mgDawkowanie
Pacjenci w podeszłym wieku Mniejsza dawka początkowa nie jest zwykle wskazana, ale należy ją jednak rozważyć u pacjentów w wieku powyżej 65 lat, jeśli istnieje uzasadnienie kliniczne. Zaburzenia czynności nerek U pacjentów z zaburzeniami czynności nerek nie jest konieczne dostosowanie dawki (patrz punkt 5.2). Zaburzenia czynności wątroby U pacjentów z niewydolnością wątroby należy rozważyć zmniejszenie dawki (patrz punkty 4.3 i 5.2). Dzieci i młodzież Choroba afektywna dwubiegunowa Zalecana dawka w leczeniu stanów ostrych w przebiegu choroby afektywnej dwubiegunowej u dzieci i młodzieży (w wieku od 10 do 17 lat) to 20 mg przyjęte w pojedynczej dawce dobowej podczas posiłku w pierwszym dniu leczenia. W kolejnych dniach zyprazydon powinien być podawany podczas posiłków w dwóch dawkach podzielonych, przy czym dawkę dobową należy stopniowo zwiększać przez okres 1-2 tygodni, aż do osiągnięcia docelowych wartości w granicach 120-160 mg/dobę u pacjentów o masie ciała ≥45 kg lub 60-80 mg/dobę u pacjentów o masie ciała <45 kg.
- CHPL leku Zypsila, kapsułki twarde, 40 mgDawkowanie
W późniejszym okresie dawki powinny być dobierane na podstawie indywidualnego stanu klinicznego w zakresie 80-160 mg/dobę u pacjentów o masie ciała ≥45 kg lub 40-80 mg/dobę u pacjentów o masie ciała <45 kg. W badaniu klinicznym dopuszczono nierówne rozłożenie wielkości dawek podzielnych, przy czym poranna dawka leku była o 20 mg lub 40 mg mniejsza od dawki wieczornej (patrz punkty 4.4, 4.5 i 5.2). Szczególnie istotne jest, aby nie przekraczać maksymalnej dawki ustalonej na podstawie masy ciała, ponieważ nie potwierdzono profilu bezpieczeństwa zyprazydonu w dawkach większych od dawki maksymalnej (160 mg/dobę dla dzieci o masie ciała ≥45 kg i 80 mg/dobę dla dzieci o masie ciała <45 kg), a zyprazydon wykazuje związek z zależnym od dawki wydłużeniem QT (patrz punkty 4.3 i 4.4). Schizofrenia Nie przeprowadzono badań oceniających bezpieczeństwo i skuteczność stosowania zyprazydonu u dzieci i młodzieży ze schizofrenią (patrz punkty 4.4 i 5.1). Sposób podawania Podanie doustne.
- CHPL leku Zypsila, kapsułki twarde, 40 mgDawkowanie
Kapsułki należy przyjmować z posiłkiem i połykać w całości, bez uprzedniego żucia, kruszenia lub otwierania, ponieważ może to wpływać na wchłanianie leku.
- CHPL leku Zypsila, kapsułki twarde, 40 mgPrzeciwwskazania
4.3 Przeciwwskazania Stwierdzona nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, Stwierdzone wydłużenie odstępu QT, Wrodzony zespół wydłużonego odstępu QT, Świeży zawał mięśnia sercowego, Niewyrównana niewydolność serca, Zaburzenia rytmu serca leczone lekami przeciwarytmicznymi z grupy IA i III, Jednoczesne leczenie lekami wydłużającymi odstęp QT, takimi jak: leki przeciwarytmiczne z grupy IA i III, trójtlenek arsenu, halofantryna, octan lewometadylu, mesorydazyna, tiorydazyna, pimozyd, sparfloksacyna, gatifloksacyna, moksyfloksacyna, metylosulfonian dolasetronu, meflokina, sertindol, cyzapryd (patrz punkty 4.4 i 4.5).
Zobacz również:
- Dawkowanie leku
Arypiprazol to nowoczesna substancja czynna stosowana w leczeniu schizofrenii i zaburzeń afektywnych dwubiegunowych. Jego dawkowanie jest precyzyjnie określone i różni się w zależności od postaci leku, wieku pacjenta, drogi podania i innych czynników. Dowiedz się, jak prawidłowo przyjmować arypiprazol, jakie są zalecane dawki w poszczególnych grupach pacjentów oraz jak dostosować leczenie do indywidualnych potrzeb.
- Działania niepożądane i skutki uboczne
Arypiprazol to substancja czynna stosowana w leczeniu różnych zaburzeń psychicznych, takich jak schizofrenia czy zaburzenia afektywne dwubiegunowe. Chociaż jest uznawana za lek nowoczesny i bezpieczniejszy w porównaniu do starszych neuroleptyków, może powodować działania niepożądane – zarówno łagodne, jak i poważniejsze. Profil tych działań może się różnić w zależności od formy leku (tabletki, roztwór doustny, wstrzykiwania) oraz indywidualnych cech pacjenta. Poniżej znajdziesz szczegółowe informacje o możliwych działaniach niepożądanych arypiprazolu oraz o tym, jak często mogą występować.
- Mechanizm działania
Arypiprazol to nowoczesna substancja czynna wykorzystywana głównie w leczeniu schizofrenii i zaburzeń afektywnych dwubiegunowych. Działa w wyjątkowy sposób na układ nerwowy, wpływając na kluczowe przekaźniki mózgowe. Różne postaci leku – od tabletek, przez roztwory doustne, po zastrzyki o przedłużonym działaniu – pozwalają na indywidualne dopasowanie terapii. Poznaj, jak arypiprazol oddziałuje na organizm i co sprawia, że jest tak istotny w leczeniu wielu zaburzeń psychicznych.
- Porównanie substancji czynnych
Porównanie arypiprazolu, brekspiprazolu i zyprazydonu pozwala lepiej zrozumieć, jak te nowoczesne leki przeciwpsychotyczne mogą być wykorzystywane w leczeniu schizofrenii i zaburzeń afektywnych dwubiegunowych. Każda z tych substancji ma swoje specyficzne zastosowania, a także różni się profilem bezpieczeństwa i zaleceniami dotyczącymi stosowania u dzieci, osób starszych, kobiet w ciąży czy pacjentów z chorobami nerek lub wątroby. Poznaj kluczowe podobieństwa i różnice, które mogą mieć znaczenie dla wyboru odpowiedniej terapii w zależności od indywidualnych potrzeb pacjenta.
- Profil bezpieczeństwa
Arypiprazol to lek stosowany w leczeniu schizofrenii i zaburzeń afektywnych dwubiegunowych, dostępny w różnych postaciach – od tabletek, przez roztwory doustne, aż po długodziałające wstrzyknięcia. Profil bezpieczeństwa tej substancji czynnej jest dobrze poznany i szeroko udokumentowany. Choć arypiprazol jest uważany za nowoczesny i relatywnie bezpieczny lek przeciwpsychotyczny, wymaga zachowania ostrożności u określonych grup pacjentów oraz uwzględnienia możliwych działań niepożądanych i interakcji.
- Przeciwwskazania
Arypiprazol to nowoczesny lek przeciwpsychotyczny, który znajduje zastosowanie w leczeniu schizofrenii oraz epizodów maniakalnych. Chociaż skutecznie pomaga wielu pacjentom, istnieją sytuacje, w których jego stosowanie jest niewskazane lub wymaga dużej ostrożności. Poznaj, w jakich przypadkach arypiprazol jest przeciwwskazany, kiedy należy zachować szczególną czujność oraz na co zwrócić uwagę przy różnych postaciach i drogach podania tego leku.
- Stosowanie u dzieci
Bezpieczeństwo stosowania arypiprazolu u dzieci i młodzieży jest szczególnie ważne ze względu na ich odmienny metabolizm oraz rozwijający się organizm. Stosowanie tej substancji wymaga ścisłego przestrzegania wskazań, odpowiedniego dawkowania i regularnej kontroli stanu zdrowia młodych pacjentów. W niniejszym opisie przedstawiamy kluczowe informacje na temat stosowania arypiprazolu w różnych postaciach i drogach podania u dzieci i młodzieży, ze szczególnym uwzględnieniem wskazań, bezpieczeństwa oraz ograniczeń wiekowych.
- Stosowanie u kierowców
Arypiprazol to nowoczesna substancja czynna stosowana w leczeniu zaburzeń psychicznych, takich jak schizofrenia czy choroba afektywna dwubiegunowa. Chociaż jej stosowanie może znacząco poprawić jakość życia pacjentów, warto wiedzieć, jak wpływa na zdolność do prowadzenia pojazdów i obsługi maszyn. Zrozumienie potencjalnych działań niepożądanych arypiprazolu oraz różnic między jego postaciami pozwala podejmować świadome decyzje dotyczące codziennych aktywności wymagających pełnej koncentracji.
- Stosowanie w ciąży
Stosowanie leków w ciąży i podczas karmienia piersią wymaga szczególnej ostrożności, ponieważ wiele substancji czynnych może wpływać na rozwijające się dziecko. Arypiprazol, lek przeciwpsychotyczny, wykorzystywany jest w leczeniu schizofrenii i zaburzeń afektywnych dwubiegunowych. Jednak decyzja o jego stosowaniu w tych wyjątkowych okresach życia kobiety powinna być podejmowana bardzo rozważnie i zawsze w porozumieniu z lekarzem. Warto poznać, jakie są oficjalne zalecenia dotyczące bezpieczeństwa arypiprazolu u kobiet w ciąży i matek karmiących, jakie mogą być potencjalne zagrożenia dla noworodka oraz czy lek ten wpływa na płodność.
- Wskazania - na co działa?
Arypiprazol to nowoczesna substancja czynna stosowana w leczeniu zaburzeń psychicznych, takich jak schizofrenia czy choroba afektywna dwubiegunowa. Dzięki różnym postaciom i dawkom leku możliwe jest dostosowanie terapii zarówno dla dorosłych, jak i dla młodzieży. Poznaj najważniejsze wskazania do stosowania arypiprazolu oraz różnice w zależności od wieku i drogi podania.
- Rzedawkowanie substancji
Arypiprazol to substancja czynna stosowana w leczeniu różnych zaburzeń psychicznych. Przedawkowanie tej substancji może prowadzić do wystąpienia niepokojących objawów, takich jak senność, przyspieszone bicie serca czy zaburzenia układu nerwowego. Objawy te mogą się różnić w zależności od postaci leku oraz drogi podania. W przypadku przedawkowania arypiprazolu konieczna jest szybka reakcja i odpowiednie postępowanie, by zminimalizować ryzyko poważnych powikłań.
REKLAMA