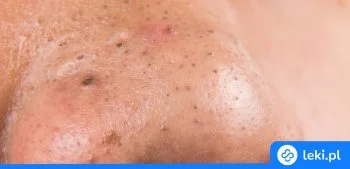
Kwas salicylowy to popularna substancja stosowana miejscowo na skórę, wykorzystywana w leczeniu różnych problemów dermatologicznych, takich jak odciski, brodawki, łuszczyca czy nadmierna potliwość. Dzięki swoim właściwościom złuszczającym i antyseptycznym pomaga w usuwaniu zrogowaciałego naskórka oraz wspiera regenerację skóry.
Jak działa kwas salicylowy?
Kwas salicylowy należy do grupy leków dermatologicznych i jest szeroko stosowany w leczeniu problemów skórnych, takich jak odciski, brodawki, łuszczyca czy nadmierne rogowacenie naskórka. Jego główne działanie polega na zmiękczaniu i złuszczaniu zrogowaciałego naskórka, co ułatwia jego usuwanie i wspomaga proces gojenia skóry12.
Dostępne postacie leku i połączenia
- Płyn na skórę: dostępny samodzielnie lub w połączeniu z innymi substancjami, takimi jak kwas mlekowy, prednizolon, estradiol benzoesan, chlormidazol, mentol, tymol, metenamina345678
- Maść: często łączona z innymi składnikami, np. betametazon, kwas mlekowy, kamfora, alantoina, nikotynamid, mocznik910111213
- Krem: z dodatkiem innych substancji pielęgnujących skórę14
- Puder na skórę: zwykle w połączeniu z kwasem borowym15
- Emulsja na skórę: często z dodatkiem kamfory i innych substancji rozgrzewających16
- Roztwór na skórę: w połączeniu z chlormidazolem6
Kwas salicylowy występuje w różnych stężeniach – od 1% do nawet 40% – oraz w połączeniach z innymi substancjami czynnymi, takimi jak kwas mlekowy, prednizolon, betametazon, flumetazon, fluorouracyl, alantoina, mocznik czy kamfora31112.
Wskazania do stosowania
- Usuwanie odcisków, nagniotków i zrogowaciałej skóry1718
- Leczenie brodawek zwykłych, stóp i mozaikowych1920
- Leczenie łuszczycy, atopowego zapalenia skóry, wyprysku, liszaja płaskiego2122
- Nadmierna potliwość stóp2324
- Pęknięcia zgrubiałego naskórka, pielęgnacja skóry stóp i rąk25
- Leczenie infekcji grzybiczych i bakteryjnych skóry26
Dawkowanie
Najczęściej kwas salicylowy stosuje się miejscowo na skórę 1-2 razy dziennie, nakładając cienką warstwę na zmienione miejsca. W przypadku preparatów na odciski i brodawki leczenie trwa zwykle od kilku dni do kilku tygodni272829.
Przeciwwskazania
- Nadwrażliwość na kwas salicylowy lub inne składniki preparatu30
- Uszkodzona, podrażniona lub zakażona skóra30
- Cukrzyca lub zaburzenia krążenia (przy niektórych postaciach)30
- Okres ciąży i karmienia piersią (dla części preparatów)30
- Stosowanie u dzieci poniżej określonego wieku (najczęściej poniżej 2 lub 12 lat, w zależności od preparatu)3031
Profil bezpieczeństwa
Kwas salicylowy nie powinien być stosowany w okresie ciąży i karmienia piersią w większości dostępnych preparatów30. Może być przeciwwskazany u osób starszych, z niewydolnością nerek lub wątroby przy długotrwałym stosowaniu na dużą powierzchnię skóry32. Substancja nie wpływa na zdolność prowadzenia pojazdów ani obsługi maszyn33. Może wchodzić w interakcje z alkoholem, jeśli preparat zawiera etanol34.
Przedawkowanie
Przedawkowanie kwasu salicylowego po zastosowaniu miejscowym jest rzadkie, ale może wystąpić po nałożeniu na dużą powierzchnię skóry lub na uszkodzoną skórę. Objawy to m.in. zawroty głowy, szumy uszne, nudności, wymioty, zaburzenia oddychania35. W razie przedawkowania należy zaprzestać stosowania i skontaktować się z lekarzem35.
Interakcje
Kwas salicylowy może nasilać działanie niektórych leków stosowanych miejscowo, np. kortykosteroidów, oraz zwiększać wchłanianie innych substancji przez skórę3637. Należy unikać jednoczesnego stosowania z innymi preparatami o działaniu złuszczającym38.
Najczęstsze działania niepożądane
Mechanizm działania
Kwas salicylowy działa keratolitycznie – zmiękcza i rozluźnia zrogowaciały naskórek, ułatwiając jego złuszczanie. W połączeniach z innymi substancjami może także zwiększać ich przenikanie przez skórę i wzmacniać działanie przeciwzapalne lub antyseptyczne243.
Stosowanie w ciąży
Większość preparatów z kwasem salicylowym nie powinna być stosowana w okresie ciąży i karmienia piersią3044.
Stosowanie u dzieci
Stosowanie kwasu salicylowego u dzieci zależy od preparatu – zazwyczaj nie jest zalecane u dzieci poniżej 2 lub 12 lat3031. Niektóre preparaty można stosować u starszych dzieci wyłącznie pod kontrolą lekarza45.
Stosowanie u kierowców
Kwas salicylowy stosowany miejscowo nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn33.
Kwas salicylowy – porównanie substancji czynnych
Kwas salicylowy, kwas acetylosalicylowy i kwas mefenamowy to leki o działaniu przeciwzapalnym, przeciwbólowym lub keratolitycznym. Różnią się wskazaniami, bezpieczeństwem u dzieci, kobiet w ciąży i wp...
czytaj więcej ❯❯- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ABE (89 mg + 89 mg)/g, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu na skórę zawiera 89 mg kwasu mlekowego (Acidum lacticum), w postaci 90% roztworu kwasu mlekowego, i 89 mg kwasu salicylowego (Acidum salicylicum). Pełny wykaz substancji pomocniczych - patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Płyn na skórę
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Usuwanie odcisków, nagniotków, zgrubiałej skóry.
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gDawkowanie
4.2 Dawkowanie i sposób podania Produkt leczniczy ABE należy stosować zgodnie z zaleceniem lekarza lub zgodnie z opisem podanym w ulotce. Po odkręceniu zakrętki i wyjęciu aplikatora chwilę odczekać, aż nadmiar płynu spłynie do butelki. Następnie posmarować produktem wyłącznie powierzchnię odciska lub zrogowaciałej skóry, zwracając uwagę, aby płyn nie dostał się na zdrową skórę. Po posmarowaniu odczekać chwilę, aż produkt zaschnie w postaci białej błonki. Stosować dwa razy na dobę rano i wieczorem. Leczenie trwa około 1 tygodnia. Przed nałożeniem produktu nie stosować na miejsca poddawane działaniu produktu żadnych kosmetyków. Po zakończonej kuracji wymoczyć nogi, złuszczony odcisk powinien dać się łatwo usunąć. Po każdorazowym użyciu butelkę należy dobrze zamknąć. Przechowywać pojemnik szczelnie zamknięty, dokładnie dokręcać zakrętkę po każdorazowym użyciu. Chronić przed wyparowaniem. Dzieci: Nie stosować u dzieci w wieku poniżej 2 lat.
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gDawkowanie
U dzieci od 2 do 12 lat można stosować tylko pod kontrolą lekarza.
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nie stosować: w przypadku nadwrażliwości na substancję czynną lub którąkolwiek substancję pomocniczą, na podrażnioną, zakażoną lub zmienioną zapalnie skórę, u pacjentów z cukrzycą – osoby chore na cukrzycę nie mogą stosować tego produktu bez skontaktowania się z lekarzem, w okresie ciąży i karmienia piersią, u dzieci w wieku poniżej 2 lat.
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt leczniczy jest przeznaczony tylko do użytku zewnętrznego. Kuracja nie jest przeciwwskazaniem do codziennej, zwykłej higieny stóp. Należy przerwać leczenie, jeśli wystąpi podrażnienie skóry. Należy chronić przed produktem leczniczym oraz jego oparami oczy, drogi oddechowe i błony śluzowe. W razie przypadkowego kontaktu produktu leczniczego z oczami lub błonami śluzowymi należy natychmiast przemyć je dużą ilością wody. Produkt leczniczy należy nakładać wyłącznie na odcisk lub zrogowaciałą skórę. Nie należy stosować produktu leczniczego na niezmienioną zdrową skórę, ani na uszkodzoną skórę, gdyż kwas salicylowy wchłania się przez skórę i mogą wystąpić ogólnoustrojowe działania niepożądane kwasu salicylowego. Jeżeli dojdzie do pokrycia produktem leczniczym otaczającej odcisk zdrowej skóry, należy natychmiast przemyć ją wodą. Nie stosować u dzieci w wieku poniżej 2 lat.
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gSpecjalne środki ostrozności
U dzieci od 2 do 12 lat można stosować tylko pod kontrolą lekarza.
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Brak danych.
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ze względu na brak badań dotyczących stosowania u kobiet w ciąży i karmiących piersią, produkt nie może być stosowany w okresie ciąży i karmienia.
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn Lek ABE nie ma wpływu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu.
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gDziałania niepożądane
4.8 Działanie niepożądane W obrębie skóry otaczającej może wystąpić pieczenie i nadżerki pozostawiające przemijające przebarwienia. W przypadku wystąpienia rozległego zaczerwienienia w obrębie otaczającej skóry, lub innych działań niepożądanych należy przerwać stosowanie produktu i skonsultować się z lekarzem. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49-21-301, fax: +48 22 49-21-309, Strona internetowa: https://smz.ezdrowie.gov.pl.
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gDziałania niepożądane
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gPrzedawkowanie
4.9 Przedawkowanie Brak doniesień na temat przedawkowania leku.
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki dermatologiczne przeciw nadmiernemu rogowaceniu naskórka. Kod ATC: kod nie nadany przez WHO. Kwas salicylowy działa keratolitycznie, zmiękcza i rozpulchnia zrogowaciały naskórek, ułatwiając jego złuszczanie. Kwas mlekowy jest środkiem żrącym, niszczącym zrogowaciałą warstwę skóry. Płyn ABE do usuwania odcisków zmiękcza i złuszcza zrogowaciałą skórę (odciski, nagniotki). Zawarte w nim substancje pomocnicze działają antyseptycznie i natłuszczająco.
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Brak danych
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak danych
- CHPL leku ABE, płyn na skórę, (89 mg + 89 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych: Nitroceluloza (2:1) + octan Etylu Olej rycynowy Terpentyna balsamiczna Jod sublimowany 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 2 lata 6.4 Szczególne środki ostrożności podczas przechowywania leku Przechowywać w temperaturze poniżej 25ºC. Produkt łatwopalny. Przechowywać z dala od ognia i źródeł ciepła. 6.5 Rodzaj i zawartość opakowania Butelka ze szkła oranżowego o pojemności 10 ml, zawierająca 8 g płynu na skórę z aplikatorem z polietylenu typu LDPE i zakrętką z polipropylenu, umieszczona w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ACERIN, (195 mg + 98 mg)/g, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu na skórę zawiera 195 mg kwasu salicylowego (Acidum salicylicum) i 98 mg kwasu mlekowego (Acidum lacticum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Płyn na skórę.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Usuwanie odcisków i zgrubiałej skóry.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Acerin jest przeznaczony wyłącznie do stosowania na skórę. Produkt leczniczy Acerin nałożyć pędzelkiem na odcisk lub zgrubiałe miejsce na skórze. Należy uważać, aby nie dotknąć zdrowej skóry. Poczekać aż produkt leczniczy dobrze wyschnie. Nakładanie produktu leczniczego, w razie konieczności, powtarzać przez kilka dni. Następnie należy wymoczyć nogi i usunąć odcisk. Stosować ostrożnie, aby nie dopuścić do kapania płynu z pędzelka i do rozlania produktu leczniczego. Dzieci Nie stosować. Brak badań.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne (kwas salicylowy lub kwas mlekowy) lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować produktu: doustnie, u dzieci, u pacjentów z cukrzycą lub z zaburzeniami układu krążenia, jeśli skóra w otoczeniu odciska jest uszkodzona lub zmieniona chorobowo, na twarzy i w okolicy narządów płciowych.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy przerwać leczenie, jeśli wystąpi nadmierne podrażnienie skóry. Należy chronić przed produktem leczniczym oraz jego oparami oczy, drogi oddechowe i błony śluzowe. W razie przypadkowego kontaktu produktu leczniczego z oczami lub błonami śluzowymi, należy natychmiast je przemyć dużą ilością wody. Należy zabezpieczyć skórę otaczającą odcisk przed kontaktem z produktem leczniczym, gdyż może spowodować oparzenia. Produkt leczniczy należy nakładać wyłącznie na odcisk. Nie należy stosować produktu leczniczego na niezmienioną zdrową skórę, ani na uszkodzoną skórę, gdyż kwas salicylowy wchłania się przez skórę i mogą wystąpić ogólnoustrojowe działania niepożądane kwasu salicylowego. Jeśli dojdzie do pokrycia produktem leczniczym otaczającej odcisk zdrowej skóry, należy natychmiast przemyć ją wodą. Produkt leczniczy zawiera lotne i łatwopalne substancje, dlatego na opakowaniu jest ostrzeżenie „Ostrożnie z ogniem”.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Nie przeprowadzono badań dotyczących stosowania w okresie ciąży i karmienia piersią.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie prowadzono badań dotyczących wpływu produktu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gDziałania niepożądane
4.8 Działania niepożądane Mogą wystąpić objawy podrażnienia i stan zapalny. Zastosowanie produktu leczniczego na zdrową skórę może spowodować oparzenie i ból. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 – 21 – 301, fax: + 48 22 49 – 21 – 309, Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gPrzedawkowanie
4.9 Przedawkowanie Nie zgłoszono przypadku przedawkowania.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki dermatologiczne przeciw nadmiernemu rogowaceniu naskórka. Kwas salicylowy działa keratolitycznie, zmiękcza i rozpulchnia zrogowaciały naskórek, ułatwiając jego złuszczanie. Kwas mlekowy jest środkiem żrącym niszczącym zrogowaciałą warstwę skóry.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Brak danych.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak danych.
- CHPL leku Acerin, płyn do stosowania na skórę, (195 mg + 98 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Celulozy octanoftalan Kalafonia Aceton Octan n-butylu 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 1 rok 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC, w suchym pomieszczeniu. Przechowywać opakowanie szczelnie zamknięte. Przechowywać w oryginalnym opakowaniu. Produkt leczniczy łatwopalny. Ostrożnie z ogniem. 6.5 Rodzaj i zawartość opakowania Butelka z bezbarwnego szkła z polipropylenową zakrętką, zaopatrzoną w aplikatur z pędzelkiem, zawierająca 8 g płynu na skórę, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania produktu leczniczego Wszelkie niewykorzystane resztki produktu leczniczego należy usunąć zgodnie z lokalnymi przepisami. Opróżnione opakowania nie nadają się do powtórnego wykorzystania.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Alpicort® E (2 mg + 0,05 mg + 4 mg)/ml płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml płynu na skórę zawiera 2 mg prednizolonu (Prednisolonum), 0,05 mg estradiolu benzoesanu (Estradiolum) i 4 mg kwasu salicylowego (Acidum salicylicum). Substancja pomocnicza o znanym działaniu: glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Płyn na skórę. Przezroczysty, bezbarwny roztwór.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlWskazania do stosowania
4.1 Wskazania do stosowania Alpicort E jest wskazany do stosowania u dorosłych w wieku od 18 lat. W przebiegu różnych postaci łysienia, zwłaszcza w łysieniu androgenozależnym.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Stosować jeden raz na dobę, najlepiej wieczorem. Gdy tylko objawy zapalne nieco ustąpią, wystarczy stosowanie 2 do 3 razy w tygodniu. W tym celu nanosić produkt otworem aplikatora skierowanym do dołu, na leczone miejsca. Następnie masować palcami skórę głowy przez 2–3 minuty. Czas trwania leczenia małych powierzchni nie powinien, ze względu na obecność prednizolonu w roztworze, być dłuższy niż 2–3 tygodnie. Doświadczenie kliniczne obejmuje okres leczenia do 6 miesięcy. Nie prowadzono badań dotyczących czasu utrzymywania się działania po odstawieniu leku. Dzieci i młodzież Alpicort E jest przeciwwskazany do stosowania u dzieci w wieku do 18 lat (patrz punkt 4.3). Sposób podawania Do stosowania na skórę głowy.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlPrzeciwwskazania
4.3 Przeciwwskazania Alpicort E jest przeciwwskazany w: nadwrażliwości na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, u niemowląt, dzieci i młodzieży w wieku poniżej 18 lat, w przypadkach nowotworów estrogenozależnych lub w przypadku ich podejrzenia, w przypadku niewyjaśnionych krwawień z narządów rozrodczych, w okolicach błon śluzowych, w jamie ustnej, do lub w okolicach oczu oraz w okolicach genitaliów lub wewnętrznie, w przypadku ospy wietrznej, szczególnych schorzeń skóry (gruźlica, kiła) i zapalnych reakcji na szczepienia, przy grzybicach i bakteryjnych infekcjach skórnych, w przypadku okołoustnych chorób zapalnych skóry (objawy podrażnienia skóry wokół ust z zaczerwienieniem i guzkami) i trądziku różowatego (zaczerwienienie twarzy z ewentualnymi zapalnymi lub ropnymi pryszczami), w wilgotnych lub ostrych schorzeniach skóry głowy.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Glikol propylenowy może powodować podrażnienie skóry. Lek Alpicort E ze względu na zawartość alkoholu izopropylowego może być stosowany wyłącznie zewnętrznie na skórze głowy. Przy leczeniu przez okres dłuższy niż 2–3 tygodnie należy, ze względu na zawartość estrogenu w roztworze, stosować szczególne środki ostrożności: w przypadku endometriozy lub mastopatii, u kobiet, które już przyjmują produkty zawierające estrogen, leczenie należy prowadzić wyłącznie pod ścisłą kontrolą lekarza. Chronić oczy i błony śluzowe przed kontaktem z produktem. Zaburzenie widzenia: Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Lek Alpicort E z powodu swojego składu może nasilać działanie innych zewnętrznie stosowanych substancji czynnych.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Ze względu na zawartość estrogenu lek Alpicort E nie jest wskazany do stosowania w ciąży. Jeżeli w trakcie leczenia dojdzie do zapłodnienia i ciąży, leczenie za pomocą leku Alpicort E należy natychmiast przerwać. Większość dostępnych obecnie wyników badań epidemiologicznych odnośnie niezamierzonej ekspozycji płodu na estrogen, nie wykazują działania teratogennego lub toksycznego dla płodu. Również ze względu na obecność glikokortykosteroidu powinno się unikać stosowania leku Alpicort E w ciąży. Podczas długotrwałego leczenia glikokortykosteroidami w ciąży może dojść do wewnątrzmacicznego opóźnienia rozwojowego dziecka. Glikokortykosteroidy w doświadczeniu na zwierzętach prowadziły do rozszczepienia podniebienia. Dyskutowane jest podwyższone ryzyko rozszczepienia podniebienia u ludzkich płodów po podaniu glikokortykosteroidów w pierwszym trymestrze ciąży.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlWpływ na płodność, ciążę i laktację
Ponadto na podstawie wyników badań epidemiologicznych w połączeniu z doświadczeniami na zwierzętach dyskutuje się nad tym, czy wewnątrzmaciczna ekspozycja na działanie glikokortykosteroidów może doprowadzić do schorzeń metabolicznych i sercowo-naczyniowych. W przypadku podania glikokortykosteroidów pod koniec ciąży istnieje ryzyko zaniku kory nadnerczy u płodu, które może wymagać zastosowania leczenia substytucyjnego u noworodka. Karmienie piersi? Estrogeny mogą mieć wpływ na laktację, ponieważ mogą zmieniać objętość i skład mleka ludzkiego. Niewielkie ilości estrogenów lub ich metabolity mogą przenikać do mleka kobiet karmiących i mieć wpływ na dziecko. Do mleka ludzkiego przenikają także glikokortykoidy. Dlatego podczas leczenia za pomocą leku Alpicort E nie należy karmić piersią lub leczenie lekiem Alpicort E należy rozpocząć dopiero po zakończeniu karmienia piersią.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Alpicort E nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlDziałania niepożądane
4.8 Działania niepożądane Częstości występowania działań niepożądanych są określone zgodnie z następującą konwencją: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia skóry i tkanki podskórnej Rzadko: nadwrażliwość skórna Bardzo rzadko: jak w przypadku wszystkich produktów zawierających glikokortykosteroidy, może dojść do zmian skórnych (zmniejszenie grubości skóry, poszerzenie małych naczyń krwionośnych, tworzenie się pasemek, trądzik sterydowy, okołoustne zapalenie skóry, nadmierne owłosienie ciała). Zaburzenia oka Nie znana: nieostre widzenie (patrz także punkt 4.4.) Ponadto możliwe są krótkotrwałe podrażnienia skóry (np. pieczenie, zaczerwienienie).
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlDziałania niepożądane
Podczas długotrwałego stosowania w dużych dawkach lub na dużych powierzchniach oraz w przypadku stosowania niezgodnego z przeznaczeniem możliwe jest działanie ogólnoustrojowe glikokortykosteroidów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C PL-02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlPrzedawkowanie
4.9 Przedawkowanie W razie przypadkowego przyjęcia doustnego, szczególnie przez dzieci, należy pamiętać, że lek Alpicort E zawiera alkohol izopropylowy. Jak dotąd nie stwierdzono zatruć przy stosowaniu miejscowym leku Alpicort E.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Kortykosteroidy o słabym działaniu, inne mieszanki. Kod ATC: D07XA02 Alpicort E zawiera jako składnik estrogenowy ester kwasu benzoesowego naturalnego 17ß-estradiolu. Właściwości farmakologiczne benzoesanu estradiolu są porównywalne z właściwościami estradiolu. Niedobór estrogenu powoduje atrofię naskórka oraz osłabienie ukrwienia i przemiany materii skóry. Działanie estrogenów na naczynia włosowate wynika z różnych mechanizmów działania. Z jednej strony działanie estrogenów na wzrost włosów może wynikać z pobudzenia ukrwienia, tzn. stymulacji przemiany materii. Ponadto istnieją objawy zmniejszenia biologicznie czynnych androgenów (5 - dihydrotestosteron) po zastosowaniu estrogenów. Jako zasadę działania estrogenów rozważa się następujące mechanizmy: Blokada enzymu 5a-reduktazy i tym samym redukcja tworzenia się biologicznie czynnego dihydrotestosteronu. Konkurencyjna blokada receptorów androgenów przez estradiol.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlWłaściwości farmakodynamiczne
Prednizolon należy zgodnie z obecnie powszechną klasyfikacją kortykosteroidów miejscowych – na słabe (I), umiarkowane (II), silne (III), bardzo silne (IV) – do pierwszej grupy. Tym samym prednizolon nadaje się szczególnie dobrze do leczenia zapalnych dermatoz, ponieważ nie posiada istotnego działania antyproliferacyjnego. Kwas salicylowy w stężeniach niższych niż 0,5 % może nasilać przenikanie innych substancji czynnych. Brak jest odpowiednich badań dotyczących leku Alpicort E. Dodatkowo można spodziewać się słabego działania keratoplastycznego i antymikrobiotycznego na skórze głowy powodowanego przez kwas salicylowy.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie i przenikanie miejscowo aplikowanych estrogenów w istotny sposób zależy od rodzaju podłoża. W przypadku leku Alpicort E wykazano, że podczas stosowania na owłosionej głowie (100 cm2 powierzchni) całkowite stężenie estrogenu w moczu nie ulega zmianie. Stąd wniosek, że benzoesan estradiolu zawarty w leku Alpicort E, albo uwalniany jest bardzo powoli, albo metabolizowany jest już w skórze, przez co nie dochodzi do podwyższenia stężenia estrogenu we krwi. Należy więc spodziewać się, że przenikanie i wchłanianie prednizolonu będzie podobne jak innych stosowanych naskórnie kortykosteroidów. Okres półtrwania w osoczu wynosi od 2 - 4 godzin, podczas gdy biologiczny okres półtrwania wynosi 12–36 godzin, ponieważ steroid związany w kompleksie receptorów cytozolowych dłużej pozostaje w komórce. Prednizolon, jak kortykosteroidy fizjologiczne poddawany jest w wątrobie przemianie materii w biologicznie nieaktywny związek, głównie wydalany przez nerki.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlWłaściwości farmakokinetyczne
Jak wynika z badań na zwierzętach i farmakokinetycznych badaniach u ludzi, kwas salicylowy przenika szybko zależnie od podłoża i innych czynników wpływających na penetrację (np. stan skóry). Wchłanianie przezskórne zwiększa się w przypadku dermatoz, występujących wraz z zapalnymi lub ogniskowymi zmianami skórnymi. Ogólnoustrojowo kwas salicylowy metabolizowany jest do kwasu salicylurowego, glukoronidów, kwasu gentyzynowego względnie kwasu dihydroksybenzoesowego i jest głównie wydalany przez nerki. Okres półtrwania kwasu salicylowego wynosi od 2–3 godzin.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Wyniki badań nad estrogenem posiadają, z powodu istotnych różnic pomiędzy poszczególnymi gatunkami zwierząt doświadczalnych oraz w porównaniu do ludzi, tylko ograniczoną wartość w odniesieniu do ludzi. U zwierząt estrogeny już w stosunkowo małych dawkach wykazywały działanie embrioletalne; zaobserwowano niedorozwój układu moczowego i płciowego i feminizację męskich płodów. Dane przedkliniczne z badań konwencjonalnych przewlekłej toksyczności, genotoksyczności i rakotwórczości nie wykazały szczególnego ryzyka dla ludzi z wyjątkiem tego opisanego już we wcześniejszych rozdziałach informacji specjalistycznej. Glikokortykosteroidy w doświadczeniach na zwierzętach różnych gatunków indukowały efekt teratogenny (rozszczepienie podniebienia, niedorozwój szkieletu). U szczurów zaobserwowano wydłużenie ciąży oraz utrudniony poród. Ponadto przeżycie, masa urodzeniowa oraz przyrost masy ciała potomstwa uległy redukcji.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlPrzedkliniczne dane o bezpieczeństwie
Nie zaobserwowano wpływu na płodność. Badania na zwierzętach wykazały również, że podawanie kortykosteroidów w dawkach terapeutycznych podczas ciąży zwiększa ryzyko schorzeń sercowo-naczyniowych i (lub) zaburzeń przemiany materii w dorosłym wieku oraz wpływa na zagęszczenie receptorów kortykosteroidów, neuroprzekaźników oraz na zachowanie.
- CHPL leku Alpicort E, płyn na skórę, (2 mg + 0,05 mg + 4 mg)/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Alkohol izopropylowy, glikol propylenowy, arginina, woda oczyszczona. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 30 °C. Przechowywać w oryginalnym opakowaniu, w celu ochrony przed światłem. 6.5 Rodzaj i zawartość opakowania Butelka ze szkła oranżowego z aplikatorem i plastikowym zamknięciem (PP) w tekturowym pudełku. 100 ml 6.6 Specjalne środki ostrożności dotyczące usuwania Brak specjalnych wymagań dotyczących usuwania. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Alpicort (2 mg + 4 mg)/ml płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml płynu na skórę zawiera 2 mg prednizolonu (Prednisolonum) i 4 mg kwasu salicylowego (Acidum salicylicum). Substancja pomocnicza o znanym działaniu: glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Płyn na skórę. Przezroczysty, bezbarwny roztwór.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlWskazania do stosowania
4.1 Wskazania do stosowania Wypadanie włosów w przebiegu chorób takich jak: łuszczyca owłosionej skóry głowy, wyprysk łojotokowy, łojotok, łysienie plackowate, rozlane wypadanie włosów, jak również po zakażeniach ogólnoustrojowych.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Stosować jeden raz na dobę, najlepiej wieczorem. Gdy tylko objawy zapalne nieco ustąpią, wystarczy stosowanie 2 do 3 razy w tygodniu. W tym celu nanosić produkt otworem aplikatora skierowanym do dołu, na leczone miejsca. Następnie masować palcami skórę głowy przez 2–3 minuty. Czas trwania leczenia małych powierzchni nie powinien, ze względu na obecność w roztworze prednizolonu, być dłuższy niż 2–3 tygodnie. Doświadczenie kliniczne obejmuje okres leczenia do 6 miesięcy. Nie prowadzono badań dotyczących czasu utrzymywania się działania po odstawieniu produktu. Dzieci i młodzież Alpicort jest przeciwwskazany do stosowania u dzieci w wieku 0–12 lat (patrz punkt 4.3). U dzieci powyżej 12 lat produkt nie powinien być stosowany na zbyt dużą powierzchnię ciała i (lub) przez zbyt długi czas. Sposób stosowania Do stosowania na skórę głowy.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlPrzeciwwskazania
4.3 Przeciwwskazania Alpicort jest przeciwwskazany: w przypadku nadwrażliwości na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, u niemowląt i dzieci w wieku poniżej 12 lat, w okolicach błon śluzowych, w jamie ustnej, do lub w okolicach oczu oraz w okolicach genitaliów, względnie wewnętrznie, w przypadku ospy wietrznej, szczególnych schorzeń skóry (gruźlica, kiła) i zapalnych reakcjach na szczepienia, przy grzybicach i bakteryjnych zakażeniach skórnych, w przypadku okołoustnych chorób zapalnych skóry (objawy podrażnienia skóry wokół ust z zaczerwienieniem i guzkami) i trądziku różowatego.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Glikol propylenowy może powodować podrażnienie skóry. Produkt Alpicort ze względu na zawartość alkoholu izopropylowego może być stosowany wyłącznie zewnętrznie. Zaburzenie widzenia: Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów. Dzieci i młodzież: U dzieci nie wolno przekraczać dobowej dawki 0,2 g kwasu salicylowego (= 50 ml produktu Alpicort). Chronić oczy i błony śluzowe przed kontaktem z produktem.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Alpicort ze względu na skład może nasilać działanie innych zewnętrznie stosowanych substancji czynnych.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża W ciąży produkt Alpicort nie powinien być stosowany ze względu na zawartość kwasu salicylowego, z wyjątkiem stosowania na małych powierzchniach (powierzchnia mniejsza niż 5 cm²). Podczas długotrwałego leczenia glikokortykosteroidami w okresie ciąży, nie można wykluczyć uszkodzenia płodu. Prednizolon stosowany w próbach na zwierzętach prowadził do rozszczepienia podniebienia (patrz 5.3). Dyskutowane jest podwyższone ryzyko rozszczepienia podniebienia u ludzkich płodów po podaniu glikokortykoidów w pierwszym trymestrze ciąży. W przypadku podania glikokortykosteroidów pod koniec ciąży istnieje ryzyko zaniku kory nadnerczy u płodu, które może wymagać zastosowania leczenia substytucyjnego u noworodka. Karmienie piersi? Glikokortykosteroidy przenikają w niewielkich ilościach do mleka matki (do 0,23% pojedynczej dawki). W przypadku dawek do 10 mg/dobę, ilość prednizolonu przenikająca do mleka matki jest śladowa.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlWpływ na płodność, ciążę i laktację
Nie stwierdzono jak dotąd uszkodzenia u niemowląt. Mimo to wskazanie do zastosowania produktu w okresie karmienia piersią powinno być dokładnie rozważone. Stosunek stężenia prednizolonu znajdującego się w mleku do stężenia w osoczu zwiększa się w przypadku stosowania większych dawek (stężenie w osoczu stanowi 25% zawartości prednizolonu w mleku, przy podawaniu 80 mg prednizolonu na dobę) i w takich przypadkach zaleca się zaprzestanie karmienia piersią.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Alpicort nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlDziałania niepożądane
4.8 Działania niepożądane Częstości występowania działań niepożądanych są określone zgodnie z następującą konwencją: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia skóry i tkanki podskórnej Rzadko: nadwrażliwość skórna (alergiczny wykwit kontaktowy) Bardzo rzadko: zmiany skórne (zmniejszenie grubości skóry, poszerzenie małych naczyń krwionośnych, tworzenie się pasemek, trądzik sterydowy, okołoustne zapalenie skóry, nadmierne owłosienie ciała) Zaburzenia oka Nie znana: nieostre widzenie (patrz także punkt 4.4.) Ponadto możliwe są krótkotrwałe podrażnienia skóry (np. pieczenie, zaczerwienienie). Podczas długotrwałego stosowania (ponad 2–3 tygodnie) lub na dużych powierzchniach (np.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlDziałania niepożądane
cała skóra głowy) oraz w przypadku stosowania niezgodnego z przeznaczeniem możliwe jest działanie ogólnoustrojowe kortykosteroidów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C PL-02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlPrzedawkowanie
4.9 Przedawkowanie W razie przypadkowego przyjęcia doustnego, szczególnie przez dzieci, należy pamiętać, że produkt Alpicort zawiera alkohol izopropylowy. Jak dotąd nie stwierdzono zatruć przy stosowaniu miejscowym.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Kortykosteroidy, słabe; kortykosteroidy w produktach złożonych. Kod ATC: D07XA02 Prednizolon należy do słabo działających miejscowo kortykosteroidów i nadaje się szczególnie dobrze do leczenia czysto zapalnych dermatoz bez efektu hiperproliferacyjnego. Kwas salicylowy w stężeniach mniejszych niż 0,5 % może nasilać przenikanie innych substancji czynnych. Brak jest odpowiednich badań dotyczących produktu Alpicort. Dodatkowo można spodziewać się słabego działania keratoplastycznego i przeciwbakteryjnego na skórze głowy, powodowanego przez kwas salicylowy.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Nie przeprowadzono badań dotyczących farmakokinetyki substancji czynnych zawartych w produkcie Alpicort. Jednakże na podstawie ogólnie znanego zachowania roztworów alkoholowych można przypuszczać że substancje czynne produktu Alpicort są całkowicie uwalniane w skórze. Należy więc spodziewać się, że przenikanie i wchłanianie prednizolonu będzie podobne, jak innych stosowanych naskórnie kortykosteroidów. Okres półtrwania w osoczu wynosi od 2–4 godzin, podczas gdy biologiczny okres półtrwania wynosi 12–36 godzin, ponieważ steroid związany w kompleksie receptorów cytozolowych dłużej pozostaje w komórce. Prednizolon, jak inne kortykosteroidy, fizjologiczne poddawany jest w wątrobie przemianie w biologicznie nieaktywny związek, głównie wydalany przez nerki. Jak wynika z badań na zwierzętach i farmakokinetycznych badaniach u ludzi, kwas salicylowy przenika szybko zależnie od podłoża i innych czynników wpływających na penetrację (np. stan skóry).
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlWłaściwości farmakokinetyczne
Wchłanianie przezskórne zwiększa się w erytrodermii łuszczycowej i dermatozach, które, występujące wraz z zmianami zapalnymi lub nadżerkami. Ogólnoustrojowo kwas salicylowy metabolizowany jest do kwasu salicylurowego, glukoronidów, kwasu gentyzynowego względnie kwasu dihydroksybenzoesowego i jest głównie wydalany przez nerki. Okres półtrwania kwasu salicylowego wynosi od 2–3 godzin. Na skutek zwiększającego przenikanie działania kwasu salicylowego wchłanianie prednizolonu przez skórę jest większe.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Toksyczność ostra: W oparciu o badania konwencjonalne dotyczące ostrej toksyczności prednizolonu dane niekliniczne nie wskazują na istotne zagrożenie produktu Alpicort dla człowieka. W stosowaniu miejscowym kwasu salicylowego sporadyczne występowanie intoksykacji zależy od farmaceutycznej postaci, nałożonej ilości kwasu salicylowego, powierzchni, na jaką zostaje nałożony, czasu trwania leczenia, częstości leczenia i objawów skórnych. Wczesnych objawów toksyczności salicylanów należy spodziewać się, gdy stężenie w osoczu będzie większe niż 30 mg/dl. Podczas stosowania zgodnie z przeznaczeniem, stężenie w osoczu zwykle nie jest większe niż 5 mg/dl. Miejscowo roztwory 5 % kwasu salicylowego mogą powodować podrażnienia. Toksyczność przewlekła: Po codziennych dootrzewnowych dawkach 33 mg/kg masy ciała stosowanych przez 7 do 14 dni u szczurów, stwierdzono zmiany pod mikroskopem świetlnym i elektronowym w wysepkach Langerhansa.
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlPrzedkliniczne dane o bezpieczeństwie
U królików wywołano doświadczalne uszkodzenie wątroby, stosując codziennie dawki w wysokości 2 do 3 mg/kg masy ciała przez 2 do 4 tygodni. Działanie histotoksyczne w postaci martwicy mięśni zaobserwowano po wielotygodniowym stosowaniu 0,5 do 5 mg/kg u świnek morskich i 4 mg/kg u psów. Brak wyników badań długotrwałego stosowania miejscowego kwasu salicylowego na zwierzętach (patrz Toksyczność ostra). Mutagenność: Dostępne wyniki badań kwasu salicylowego i prednizolonu nie wskazują na istotne klinicznie genotoksyczne właściwości. Toksyczność reprodukcyjna: Prednizolon wywołuje w doświadczeniach na zwierzętach rozszczepienie podniebienia u myszy, chomików i królików. W aplikacji pozajelitowej zaobserwowano u szczurów nieznaczne anomalie budowy czaszki, żuchwy i języka. Zaobserwowano wewnątrzmaciczne zaburzenia wzrostu (patrz również 4.6).
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlPrzedkliniczne dane o bezpieczeństwie
Podczas stosowania wysokich dawek prednizolonu przez dłuższy okres czasu (30 mg/dobę przez co najmniej 4 tygodnie) zaobserwowano odwracalne zaburzenia spermatogenezy, które po odstawieniu produktu utrzymywały się jeszcze przez kilka tygodni. Kwas salicylowy po podaniu doustnym podczas prób na zwierzętach u wielu gatunków zwierząt powodował działanie teratogenne. Opisywano zaburzenia implantacji, działanie toksyczne na embriony i płody (zmniejszenie wagi urodzeniowej) oraz zaburzenia uczenia się w kolejnych pokoleniach po ekspozycji prenatalnej. Nie należy spodziewać się działania toksycznego przy stosowaniu zgodnym z przeznaczeniem, ponieważ stężenia w osoczu powodujące działanie toksyczne nie są osiągane (patrz Toksyczność ostra).
- CHPL leku Alpicort, płyn na skórę, (2 mg + 4 mg)/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Alkohol izopropylowy glikol propylenowy arginina woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 30 °C. Przechowywać w oryginalnym opakowaniu, w celu ochrony przed światłem. 6.5 Rodzaj i zawartość opakowania Butelka ze szkła oranżowego z aplikatorem i plastikowym zamknięciem (PP) w tekturowym pudełku. 100 ml 6.6 Specjalne środki ostrożności dotyczące usuwania Brak specjalnych wymagań dotyczących usuwania. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Antypot (10 mg + 100 mg)/g, puder na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 g pudru na skórę zawiera 10 mg kwasu salicylowego (Acidum salicylicum) i 100 mg kwasu borowego (Acidum boricum). Substancje pomocnicze, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Puder na skórę
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gWskazania do stosowania
4.1. Wskazania do stosowania Preparat stosowany w nadmiernej potliwości stóp, szczególnie z występującą jednocześnie przykrą wonią rozkładającego się potu.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gDawkowanie
4.2. Dawkowanie i sposób stosowania Po starannym umyciu i osuszeniu stóp lekko zapudrować przestrzenie międzypalcowe i skórę stóp. Zabieg wykonywać raz lub 2 razy na dobę, zależnie od nasilenia dolegliwości przez 7 dni.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na kwas salicylowy lub borowy, lub na którykolwiek ze składników preparatu. Nie stosować w przypadku podrażnienia, stanu zapalnego oraz innych zmian chorobowych skóry stóp (np. ubytków naskórka, owrzodzeń, ran). Nie stosować u dzieci.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Preparat jest przeznaczony wyłącznie do stosowania na nieuszkodzoną skórę stóp. Przerwać leczenie, jeśli wystąpi nadmierne podrażnienie, stan zapalny skóry lub objawy uczulenia. Unikać kontaktu preparatu z oczami i błonami śluzowymi. W razie przypadkowego kontaktu preparatu z oczami, należy przepłukać oczy dużą ilością wody przy szeroko odchylonej powiece i skontaktować się z okulistą. Nie należy stosować preparatu na większą powierzchnię skóry niż jest to wskazane lub na uszkodzoną skórę oraz długotrwale, gdyż mogą wystąpić ogólnoustrojowe objawy niepożądane kwasu salicylowego i kwasu borowego. Kwas salicylowy dobrze wchłania się przez skórę, dlatego podczas stosowania preparatu na dużą powierzchnię skóry mogą wystąpić ogólnoustrojowe objawy niepożądane kwasu salicylowego, jak np.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gSpecjalne środki ostrozności
zaburzenia równowagi kwasowo-zasadowej, zaburzenia oddychania, słuchu, zawroty głowy, a podczas długotrwałego stosowania – krwawienia, zmiany skórne i wyprysk. Kwas borowy stosowany długotrwale na skórę może spowodować wystąpienie objawów przewlekłego zatrucia kwasem borowym, jak utrata apetytu, zaburzenia żołądkowo – jelitowe, zapalenie skóry, zaburzenia miesiączkowania, niedokrwistość, osłabienie, drgawki i wyłysienie.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gInterakcje
4.5. Interakcje z innymi lekami i inne rodzaje interakcji Jednoczesne stosowanie innych leków, powodujących miejscowe przekrwienie skóry może nasilać niebezpieczeństwo wchłaniania się preparatu.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gWpływ na płodność, ciążę i laktację
4.6. Ciąża i laktacja Nie należy stosować w okresie ciąży i karmienia piersią. Nie badano niebezpieczeństwa stosowania w okresie ciąży i karmienia piersią.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Preparat nie ma wpływu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gDziałania niepożądane
4.8. Działania niepożądane Mogą wystąpić miejscowe objawy niepożądane, takie jak podrażnienie, wysypka, wysuszenie oraz stan zapalny skóry. Ponadto mogą wystąpić reakcje nadwrażliwości. Mimo, że nie ma danych dotyczących innych działań niepożądanych podczas stosowania preparatu zgodnie ze wskazaniami – patrz również punkt 4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gPrzedawkowanie
4.9. Przedawkowanie Brak danych dotyczących przedawkowania podczas stosowania preparatu zgodnie ze wskazaniami i sposobem stosowania. W razie przypadkowego spożycia preparatu, może dojść do ciężkiego zatrucia substancjami czynnymi – kwasem salicylowym i kwasem borowym. W takich przypadkach należy natychmiast skontaktować się z lekarzem. Odnotowano zgłoszenie ostrego zatrucia kwasem borowym po przypadkowym spożyciu roztworu kwasu borowego lub pudru z kwasem borowym na uszkodzoną skórę. Kwas borowy po przypadkowym spożyciu lub stosowany na uszkodzoną, zranioną lub zmienioną zapalnie skórę wchłania się do krwi i kumuluje w organizmie. W wyniku ostrego zatrucia kwasem borowym mogą wystąpić ogólnoustrojowe objawy niepożądane kwasu borowego, m.in. biegunka, wymioty, bóle brzucha, krwawe stolce, uszkodzenie wątroby i nerek, niewydolność krążenia obwodowego, wysypka, gorączka, zapaść, drgawki i zgon.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki do stosowania miejscowego przeciw poceniu. Brak kodu ATC. Preparat zapobiega nadmiernemu poceniu się stóp w wyniku działania odkażającego, ściągającego i osuszającego skórę, likwiduje także przykrą woń potu. Po zastosowaniu miejscowym, substancje czynne preparatu – kwas salicylowy (1%) i kwas borowy (10%), działają odkażająco. Działanie ściągające wykazuje substancja pomocnicza preparatu – ałun glinowo-potasowy (alumen – 10%).
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Kwas salicylowy dobrze przenika do krwi przez nieuszkodzoną skórę. Przenikanie kwasu borowego przez nieuszkodzoną skórę jest nieznaczne. Kwas borowy przenika do krwi przez uszkodzoną, zranioną lub zmienioną zapalnie skórę. W razie wielokrotnego stosowania miejscowego kwasu borowego może następować kumulacja leku w organizmie i doprowadzić do ciężkiego zatrucia kwasem borowym. Kwas borowy jest wydalany głównie przez nerki.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Brak danych. Dane dostępne w piśmiennictwie wskazują na ryzyko ogólnoustrojowego działania niepożądanego stosowanego miejscowo kwasu borowego i salicylowego. Kwas borowy podczas stosowania na uszkodzoną, zranioną lub zmienioną zapalnie skórę wchłania się do krwi i kumuluje w organizmie. W takim przypadku mogą wystąpić ogólnoustrojowe objawy niepożądane kwasu borowego, m.in. biegunka, wymioty, bóle brzucha, uszkodzenie wątroby i nerek, niewydolność krążenia obwodowego, wysypka, gorączka, zapaść, drgawki i zgon. Podczas długotrwałego stosowania mogą wystąpić objawy przewlekłego zatrucia kwasem borowym, jak utrata apetytu, zaburzenia żołądkowo-jelitowe, zapalenie skóry, zaburzenia miesiączkowania, niedokrwistość, osłabienie, drgawki i wyłysienie. Kwas salicylowy dobrze wchłania się przez skórę, dlatego podczas stosowania na dużą powierzchnię skóry mogą wystąpić ogólnoustrojowe objawy niepożądane kwasu salicylowego, jak np.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gPrzedkliniczne dane o bezpieczeństwie
zaburzenia równowagi kwasowo-zasadowej, zaburzenia oddychania, słuchu, zawroty głowy, a podczas długotrwałego stosowania – krwawienia, zmiany skórne i wyprysk.
- CHPL leku Antypot, puder, (100 mg + 10 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Siarczan glinowo-potasowy, talk 6.2. Niezgodności farmaceutyczne Brak 6.3. Okres ważności 2 lata 6.4. Specjalne środki ostrożności przy przechowywaniu Przechowywać w temperaturze poniżej 25°C. 6.5. Rodzaj i zawartość opakowania Pudełko do zasypek z polipropylenu, zawierające 30 g proszku. 6.6. Instrukcja dotycząca przygotowania produktu leczniczego do stosowania i usuwania jego pozostałości Brak specjalnych zaleceń
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO BRODACID (50,4 mg + 100 mg )/g, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu na skórę zawiera 50,4 mg kwasu mlekowego (Acidum lacticum), w postaci 90% roztworu kwasu mlekowego i 100 mg kwasu salicylowego (Acidum salicylicum). Pełny wykaz substancji pomocniczych, patrz; punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Płyn na skórę
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie brodawek zwykłych, około paznokciowych, brodawek stóp i mozaikowych.
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Czystą i suchą powierzchnię brodawki smarować produktem leczniczym za pomocą aplikatora. Po odkręceniu zakrętki i wyjęciu aplikatora chwilę odczekać, aż nadmiar płynu spłynie do butelki, a następnie posmarować wyłącznie powierzchnię brodawki, zwracając uwagę, aby płyn nie dostał się na zdrową skórę, błony śluzowe lub do oczu. Po posmarowaniu brodawki odczekać chwilę, aż płyn zaschnie w postaci białej błonki. Stosować dwa razy na dobę na czystą i suchą skórę. Smarować wyłącznie powierzchnię brodawki, w zależności od wyniku leczenia przez kilkanaście dni, maksymalnie do 6-8 tygodni. Przechowywać butelkę szczelnie zamkniętą, dokładnie dokręcać zakrętkę po każdorazowym użyciu. Chronić przed wyparowaniem. Dzieci: Nie stosować u dzieci w wieku poniżej 2 lat. U dzieci od 2 do 12 lat można stosować tylko pod kontrolą lekarza.
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nie stosować produktu leczniczego: w nadwrażliwości na substancję czynną lub na którąkolwiek substancję pomocniczą. w leczeniu brodawek płaskich i zmian zlokalizowanych w okolicy oczu, na błonach śluzowych oraz na twarzy, na znamiona owłosione i nieowłosione, na zakażoną lub zmienioną zapalnie skórę, w okresie ciąży i karmienia piersią, u dzieci w wieku poniżej 2 lat.
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt leczniczy jest przeznaczony tylko do użytku zewnętrznego. Należy przerwać leczenie, jeśli wystąpi podrażnienie skóry. Należy chronić przed produktem leczniczym oraz jego oparami oczy, drogi oddechowe i błony śluzowe. W razie przypadkowego kontaktu produktu leczniczego z oczami lub błonami śluzowymi, należy natychmiast je przemyć dużą ilością wody. Produkt leczniczy należy nakładać wyłącznie na brodawki. Nie należy stosować produktu leczniczego na niezmienioną zdrową skórę, ani na uszkodzoną skórę, gdyż kwas salicylowy wchłania się przez skórę i mogą wystąpić ogólnoustrojowe działania niepożądane kwasu salicylowego. Jeśli dojdzie do pokrycia produktem leczniczym otaczającej brodawkę zdrowej skóry, należy natychmiast przemyć ją wodą. Nie stosować u dzieci w wieku poniżej 2 lat. U dzieci od 2 do 12 lat można stosować tylko pod kontrolą lekarza.
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Brak danych.
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ze względu na brak badań pacjentek kobiet w ciąży i karmiących piersią, produkt nie może być stosowany w okresie ciąży i karmienia piersią.
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn Brodacid nie ma wpływu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn.
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gDziałania niepożądane
4.8 Działania niepożądane W przypadku nieprawidłowego stosowania leku, w obrębie skóry otaczającej może wystąpić pieczenie i nadżerki, pozostawiające przemijające przebarwienia. Zgłaszanie podejrzewanych działań niepożądanych: Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49-21-301, fax: +48 22 49-21-309, e-mail: ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gPrzedawkowanie
4.9 Przedawkowanie Nie zgłoszono przypadku przedawkowania.
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki dermatologiczne przeciw brodawkom. Kod ATC: kod nie nadany przez WHO. Kwas salicylowy działa keratolitycznie, zmiękcza i rozpulchnia zrogowaciały naskórek, ułatwiając jego złuszczanie. Kwas mlekowy jest środkiem żrącym, niszczącym zrogowaciałą warstwę skóry. Substancja pomocnicza produktu leczniczego - dimetylosulfotlenek zwiększa przenikanie składników czynnych w głąb tkanki.
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Brak danych.
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak danych.
- CHPL leku Brodacid, płyn na skórę, (50,4 mg + 100 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU 6.1 Wykaz substancji pomocniczych: Dimetylosulfotlenek Nitroceluloza (2:1 w etanolu) + octan etylu 6.2 Niezgodności farmaceutyczne. Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Szczególne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. Produkt łatwopalny. Z uwagi na łatwopalność produktu, przechowywać z dala od ognia i źródeł ciepła. 6.5 Rodzaj i zawartość opakowania Butelka z bezbarwnego szkła o pojemności 10 ml z aplikatorem polietylenowym i zakrętką, zwierająca 8 g płynu na skórę, umieszczona w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Capsigel N, emulsja na skórę, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Capsigel N emulsja na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g emulsji na skórę zawiera: Nonivamidum - 0,05 g, Acidum salicylicum - 1,9 g, Camphora - 5,0 g, Terebinthinae aetheroleum a Pino pinastro - 5,0 g, Eucalypti aetheroleum - 2,0 g. Pełny wykaz substancji pomocniczych, patrz pkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Emulsja na skórę
- CHPL leku Capsigel N, emulsja na skórę, -Wskazania do stosowania
4.1 Wskazania do stosowania Capsigel N stosowany jest jako środek rozgrzewający w bólach mięśniowych (naciągnięcia, bolesne skurcze mięśni), pomocniczo w bólach przy stanach zapalnych stawów oraz w nerwobólach (zapalenie korzonków nerwowych, rwa kulszowa).
- CHPL leku Capsigel N, emulsja na skórę, -Dawkowanie
4.2 Dawkowanie i sposób podawania Stosować zewnętrznie na skórę. Dorośli: niewielką ilość emulsji na skórę delikatnie wmasować w bolące miejsca 1 – 2 razy dziennie. Odstępy między kolejnymi aplikacjami emulsji powinny być nie mniejsze niż 4 godziny. Stosować nie dłużej niż przez okres 2 dni. Po nałożeniu leku należy dokładnie umyć dłonie wodą z mydłem, zmywając pozostałości emulsji. W trakcie nanoszenia produktu bezwzględnie unikać kontaktu z oczami oraz błonami śluzowymi. Nie stosować na uszkodzoną skórę. Przerwa przed ponownym zastosowaniem na to samo miejsce musi wynosić przynajmniej 14 dni. Uwaga: przy dłuższym stosowaniu w tym samym miejscu może nastąpić uszkodzenie nerwów czuciowych.
- CHPL leku Capsigel N, emulsja na skórę, -Przeciwwskazania
4.3 Przeciwwskazania Uszkodzona skóra, nadwrażliwość na noniwamid lub przetwory z pieprzowca, salicylany lub na pozostałe składniki produktu. Nie należy stosować u dzieci.
- CHPL leku Capsigel N, emulsja na skórę, -Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania nie stosować na uszkodzoną skórę; w przypadku wystąpienia objawów uczulenia charakteryzujących się powstaniem wysięków lub wysypki należy niezwłocznie zaprzestać stosowania; na początku terapii można odczuwać mrowienie, pieczenie; po nałożeniu produktu należy dokładnie umyć dłonie wodą z mydłem, zmywając pozostały na dłoniach produkt; w żadnym wypadku nie należy brać gorącej kąpieli przed lub po nałożeniu produktu, gdyż może to pogłębić odczucie mrowienia, pieczenia; lanolina może wywołać miejscowe podrażnienie skóry (zapalenie skóry kontaktowe); w przypadku dłużej utrzymującego się rumienia lub wystąpienia obrzęku należy przerwać stosowanie produktu, zaleca się przemyć skórę wodą utlenioną.
- CHPL leku Capsigel N, emulsja na skórę, -Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Brak danych.
- CHPL leku Capsigel N, emulsja na skórę, -Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ze względu na brak danych potwierdzających bezpieczeństwo stosowania nie stosować produktu w czasie ciąży oraz w czasie karmienia piersią. Brak badań oraz doniesień literaturowych wykazujących wpływ poszczególnych składników emulsji Capsigel N na płodność.
- CHPL leku Capsigel N, emulsja na skórę, -Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn Brak danych na temat wpływu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn.
- CHPL leku Capsigel N, emulsja na skórę, -Działania niepożądane
4.8 Działania niepożądane W niektórych przypadkach mogą wystąpić odczyny uczuleniowe (wykwit pokrzywkowy). W przypadku utrzymywania się odczynu uczuleniowego, po zaprzestaniu stosowania produktu, należy zasięgnąć porady lekarskiej.
- CHPL leku Capsigel N, emulsja na skórę, -Przedawkowanie
4.9 Przedawkowanie Przedawkowanie produktu Capsigel N może wywołać podrażnienie skóry. Niewłaściwe użycie Przypadkowe połknięcie emulsji Capsigel N może wywołać dolegliwości żołądkowo-jelitowe takie jak wymioty i biegunka. Należy zastosować leczenie objawowe. Ostre zatrucia z nudnościami, wymiotami, bólem brzucha i głowy, zawrotami głowy, uczuciem i uderzeniami gorąca, konwulsjami, trudnościami w oddychaniu i śpiączką obserwowano po znaczącym przypadkowym spożyciu. Pacjenci z ciężkimi żołądkowo-jelitowymi lub neurologicznymi objawami zatrucia powinni być obserwowani i leczeni objawowo. Nie należy wywoływać wymiotów.
- CHPL leku Capsigel N, emulsja na skórę, -Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Produkt leczniczy po aplikacji na skórę wywiera działanie drażniące, powodując jej przekrwienie, zaczerwienienie a jednocześnie rozgrzanie. Rozszerzenie naczyń krwionośnych powoduje lepsze ukrwienie obolałego miejsca, szybsze ustępowanie obrzęków, stanów zapalnych a w konsekwencji bólu.
- CHPL leku Capsigel N, emulsja na skórę, -Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Nie przeprowadzono badań farmakokinetycznych produktu Capsigel N.
- CHPL leku Capsigel N, emulsja na skórę, -Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Nie przeprowadzono przedklinicznych badań bezpieczeństwa stosowania dla produktu Capsigel N.
- CHPL leku Capsigel N, emulsja na skórę, -Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Lanolina Parafina stała Parafina ciekła Metylohydroksyetyloceluloza Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie stwierdzono. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25ºC. Produkt leczniczy przechowywać w miejscu niedostępnym i niewidocznym dla dzieci. 6.5 Rodzaj i zawartość opakowania Dostępne opakowanie zawiera 40 g emulsji w tubie aluminiowej z zakrętką z polietylenu w kartoniku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Produkt do stosowania na skórę.
- CHPL leku Dernilan, maść, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Dernilan, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g maści zawiera: 1 g kamfory racemicznej (Camphora racemica) 300 mg alantoiny (Allantoinum) 250 mg nikotynamidu (Nicotinamidum) 100 mg kwasu salicylowego (Acidum salicylicum) Substancje pomocnicze o znanym działaniu: metylu parahydroksybenzoesan, propylu parahydroksybenzoesan, alkohol cetylowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść
- CHPL leku Dernilan, maść, -Wskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy stosuje się w przypadkach bolesnych i głębokich pęknięć zgrubiałego i zrogowaciałego naskórka, w pielęgnacji skóry stóp i rąk.
- CHPL leku Dernilan, maść, -Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Skórę stóp i rąk smarować maścią od 3 do 4 razy na dobę. Maść lekko wmasować, co kilka dni stopy lub ręce wymoczyć i usunąć zrogowaciały naskórek. Po wygojeniu zmian produkt stosować 1 do 2 razy na dobę po umyciu stóp i rąk. Dzieci i młodzież Produktu leczniczego Dernilan nie należy stosować u dzieci w wieku poniżej 12 lat.
- CHPL leku Dernilan, maść, -Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną (kamforę racemiczną, alantoinę, nikotynamid lub kwas salicylowy) lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować produktu leczniczego na rozległe obszary uszkodzonej skóry oraz na błony śluzowe.
- CHPL leku Dernilan, maść, -Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt zawiera metylu parahydroksybenzoesan i propylu parahydroksybenzoesan i dlatego może powodować reakcje alergiczne (możliwe reakcje typu późnego). Produkt zawiera alkohol cetylowy i dlatego może powodować miejscową reakcję skórną (np. kontaktowe zapalenie skóry).
- CHPL leku Dernilan, maść, -Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Brak danych na temat ewentualnych interakcji alantoiny, nikotynamidu i kamfory stosowanych miejscowo na skórę. Kwas salicylowy występujący w maści może nasilać działanie terapeutyczne innych niesteroidowych leków przeciwzapalnych.
- CHPL leku Dernilan, maść, -Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie zaleca się stosowania u kobiet w okresie ciąży. Karmienie piersi? Nie zaleca się stosowania u kobiet w okresie karmienia piersią. Płodność Brak danych na temat wpływu produktu na płodność.
- CHPL leku Dernilan, maść, -Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Dernilan, maść nie ma wpływu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn.
- CHPL leku Dernilan, maść, -Działania niepożądane
4.8 Działania niepożądane Działania niepożądane przedstawiono zgodnie z klasyfikacją narządów i układów wg MedDRA oraz częstością występowania: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000), nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia skóry i tkanki podskórnej częstość nieznana: alergiczne reakcje skórne, miejscowe podrażnienia.
- CHPL leku Dernilan, maść, -Przedawkowanie
4.9 Przedawkowanie Nie zgłoszono dotychczas żadnego przypadku przedawkowania.
- CHPL leku Dernilan, maść, -Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki dermatologiczne. Brak kodu ATC. Alantoina pobudza wzrost komórek, stymuluje proces różnicowania i regeneracji. Działa przeciwzapalnie i ściągająco, ułatwia oczyszczanie ran. Przyspiesza ziarninowanie i odbudowę naskórka. Wywołuje długotrwały efekt keratoplastyczny w warstwie rogowej naskórka w postaci zmiękczenia i wygładzenia powierzchni skóry. Nikotynamid odgrywa ważną rolę w utrzymaniu prawidłowego stanu skóry, poprawia ukrwienie skóry i jest niezbędny do prawidłowego rogowacenia się naskórka. Kwas salicylowy stosowany w obrębie zrogowaciałego naskórka powoduje rozpulchnienie keratyny, zmiękczenie, macerację a następnie złuszczanie. Efekt keratoplastyczny, poprzedzony rozluźnieniem połączeń międzykomórkowych, normalizuje rogowacenie naskórka w miejscu stosowania tej substancji. W ten sposób usuwane są zbędne warstwy zrogowaciałych komórek naskórka.
- CHPL leku Dernilan, maść, -Właściwości farmakodynamiczne
Kamfora zastosowana zewnętrznie zwęża rozszerzone naczynia włosowate, natomiast rozkurcza zwężone naczynia skórne. Wywiera wpływ rozgrzewający, drażniący. Działa bakteriobójczo, wywołuje subiektywne odczucie zmniejszenia bólu, powoduje przekrwienie skóry. W wyniku skojarzonego działania wymienionych substancji czynnych produkt Dernilan działa gojąco i przeciwzapalnie, przyspiesza ziarninowanie oraz ułatwia usuwanie zgrubiałego, zrogowaciałego naskórka ze stóp i rąk.
- CHPL leku Dernilan, maść, -Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Produkt leczniczy Dernilan, maść zastosowany na skórę wykazuje działanie miejscowe. Efekt terapeutyczny spodziewany jest w miejscu nałożenia maści. Nie prowadzono badań nad właściwościami farmakokinetycznymi substancji czynnych produktu Dernilan, maść. Teoretycznie wszystkie substancje czynne wchłaniają się przez skórę w ograniczonej ilości, zapewniającej efekt kliniczny.
- CHPL leku Dernilan, maść, -Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Toksyczność po podaniu wielokrotnym Na podstawie dostępnego piśmiennictwa fachowego została wykluczona toksyczność po podaniu wielokrotnym alantoiny, nikotynamidu, kamfory oraz kwasu salicylowego. Alantoina i nikotynamid charakteryzują się dobrą tolerancją miejscową, nie wykazują działania pierwotnie drażniącego, alergizującego i fototoksycznego. Kamfora natomiast stosowana miejscowo na skórę może powodować działanie drażniące o umiarkowanym nasileniu. Objawy w postaci uczucia pieczenia i mrowienia są krótkotrwałe. Roztwory etanolowe kwasu salicylowego o stężeniu 1–20%, stosowane miejscowo na skórę wykazywały działanie pierwotnie drażniące. Brak danych świadczących o rakotwórczych i mutagennych właściwościach alantoiny, nikotynamidu, kwasu salicylowego i kamfory.
- CHPL leku Dernilan, maść, -Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Wazelina biała Glicerol Woda oczyszczona Alkohol cetylowy Cholesterol Metylu parahydroksybenzoesan Propylu parahydroksybenzoesan 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25C. 6.5 Rodzaj i zawartość opakowania Tuba aluminiowa wewnątrz lakierowana, zamknięta membraną z zakrętką z polietylenu, zawierająca 35 g maści w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań dotyczących usuwania. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Diprosalic, (0,64 mg + 30 mg)/g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy gram maści zawiera 0,64 mg betametazonu dipropionianu (Betamethasoni dipropionas) (co odpowiada 0,5 mg betametazonu) i 30 mg kwasu salicylowego (Acidum salicylicum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy Diprosalic maść jest wskazany w miejscowym leczeniu podostrych i przewlekłych chorób skóry, takich jak: łuszczyca, cięższe postaci atopowego zapalenia skóry, świerzbiączka ograniczona (neurodermit), liszaj płaski, cięższe postaci wyprysku (w tym wyprysk pieniążkowaty, wyprysk kontaktowy).
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i dzieci w wieku powyżej 12 lat: niewielką ilość maści (0,2 – 0,5 cm maści na 10 cm2 powierzchni skóry) należy nanieść na zmienione chorobowo miejsca na skórze i lekko wmasować dwa razy na dobę (rano i wieczorem). W niektórych przypadkach dobre wyniki leczenia można uzyskać przy rzadszym stosowaniu. Okres leczenia nie powinien trwać dłużej niż 14 dni. W razie nawrotu choroby leczenie można powtórzyć. Produktu nie stosować u dzieci w wieku do 12 lat. Sposób podawania Podanie na skórę.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nie stosować: w nadwrażliwości na substancje czynne - betametazonu dipropionian i kwas salicylowy lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; w przypadku zakażeń bakteryjnych (np. w gruźlicy, kile), wirusowych (opryszczka, półpasiec, ospa wietrzna) lub grzybiczych skóry; w trądziku pospolitym; w trądziku różowatym; w zapaleniu skóry wokół ust; na skórę twarzy; w pieluszkowym zapaleniu skóry; w świądzie okolicy odbytu i narządów płciowych; u dzieci w wieku do 12 lat.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Jeśli podczas stosowania produktu leczniczego Diprosalic maść wystąpią objawy podrażnienia, uczulenia lub nadmiernego wysuszenia skóry, należy natychmiast zaprzestać stosowania produktu. W przypadku wystąpienia zakażeń bakteryjnych należy zastosować odpowiednie leczenie przeciwbakteryjne. Kortykosteroidy i kwas salicylowy wchłaniają się przez skórę, dlatego podczas stosowania produktu leczniczego Diprosalic maść istnieje ryzyko wystąpienia ogólnoustrojowych objawów niepożądanych kortykosteroidów (w tym zahamowanie czynności kory nadnerczy) oraz kwasu salicylowego. Z tego względu należy unikać podawania produktu leczniczego na dużą powierzchnię skóry, rany, uszkodzoną skórę, stosowania w dużych dawkach, a także długotrwałego leczenia produktem. W razie konieczności zastosowania produktu leczniczego w takich przypadkach, należy zachować specjalne środki ostrożności.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gSpecjalne środki ostrozności
Szczególnie ostrożnie stosować u pacjentów z łuszczycą, gdyż miejscowe stosowanie kortykosteroidów w łuszczycy może być niebezpieczne z wielu powodów, w tym ze względu na nawrót choroby spowodowany rozwojem tolerancji, ryzyko wystąpienia uogólnionej łuszczycy krostkowej i ogólne działania toksyczne spowodowane zaburzeniem ciągłości skóry. Nie należy stosować produktu leczniczego pod opatrunkiem okluzyjnym, gdyż może on zwiększać przezskórne wchłanianie kortykosteroidów. Unikać kontaktu produktu leczniczego z oczami i błonami śluzowymi. Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego (w tym podanie donosowe, wziewne i do oka) stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn zaburzeń widzenia, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (ang.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gSpecjalne środki ostrozności
Central Serous Chorioretinopathy - CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów. Dzieci Ostrożnie stosować u dzieci. U dzieci, ze względu na większy niż u dorosłych stosunek powierzchni ciała do masy ciała, łatwiej niż u dorosłych może dojść do zahamowania czynności osi podwzgórze-przysadka-nadnercza i wystąpienia objawów niepożądanych charakterystycznych dla kortykosteroidów, w tym zaburzeń wzrostu i rozwoju. U dzieci leczonych miejscowo kortykosteroidami opisywano: zahamowanie czynności osi podwzgórze-przysadka-nadnercza, zespół Cushinga, zahamowanie wzrostu, zmniejszenie przyrostu masy ciała oraz nadciśnienie wewnątrzczaszkowe. Zahamowanie czynności nadnerczy u dzieci powodowało zmniejszenie stężenia kortyzolu w osoczu i brak odpowiedzi na stymulację ACTH. Nadciśnienie wewnątrzczaszkowe powodowało uwypuklenie ciemiączka, wystąpienie bólów głowy i obustronne obrzęki tarcz nerwów wzrokowych.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych dotyczących stosowania kortykosteroidów u kobiet w okresie ciąży. Produkt leczniczy Diprosalic maść można stosować tylko wtedy, gdy potencjalna korzyść dla matki przeważa możliwe ryzyko dla płodu. W badaniach na zwierzętach wykazano, że kortykosteroidy stosowane miejscowo mogą działać teratogennie. Karmienie piersi? Nie wiadomo, czy miejscowo stosowane kortykosteroidy wchłaniają się przez skórę w takim stopniu, że mogą przenikać do mleka kobiecego. Należy podjąć decyzję czy przerwać karmienie piersią czy przerwać podawanie produktu Diprosalic maść, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy Diprosalic maść nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gDziałania niepożądane
4.8 Działania niepożądane Podczas miejscowego stosowania kortykosteroidów obserwowano następujące działania niepożądane: pieczenie swędzenie podrażnienie wysuszenie skóry zapalenie mieszków włosowych nadmierne owłosienie zmiany trądzikopodobne zanik barwnika skóry zapalenie skóry wokół ust alergiczne kontaktowe zapalenie skóry macerację skóry wtórne zakażenia atrofię skóry rozstępy skóry potówki Długotrwałe miejscowe stosowanie produktów zawierających kwas salicylowy może powodować wystąpienie zapalenia skóry. W wyniku wchłaniania substancji czynnych do krwi mogą również wystąpić ogólne działania niepożądane betametazonu (charakterystyczne dla kortykosteroidów) i kwasu salicylowego. Ogólne objawy niepożądane występują przede wszystkim w przypadku długotrwałego stosowania produktu leczniczego, stosowania na dużą powierzchnię skóry oraz stosowania u dzieci.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gDziałania niepożądane
Podczas stosowania kortykosteroidów obserwowano nieostre widzenie (częstość nieznana - nie może być określona na podstawie dostępnych danych) (patrz także punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, Tel.: + 48 22 49 21 301, Faks: + 48 22 49 21 309, Strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gPrzedawkowanie
4.9 Przedawkowanie Długotrwałe miejscowe stosowanie kortykosteroidów może doprowadzić do zahamowania czynności osi podwzgórze-przysadka-nadnercza i w konsekwencji do wtórnej niewydolności nadnerczy, a także nadczynności kory nadnerczy, łącznie z zespołem Cushinga. Miejscowe stosowanie kwasu salicylowego długotrwale lub w dużych dawkach może spowodować zatrucie kwasem salicylowym. W przypadku przedawkowania należy zastosować odpowiednie leczenie objawowe. Ostre objawy przedawkowania hormonów kory nadnerczy zwykle są odwracalne. Jeśli jest to konieczne, należy wyrównać stężenie elektrolitów. W przypadku przewlekłego zatrucia wskazane jest powolne, stopniowe odstawianie kortykosteroidów. Zatrucia kwasem salicylowym leczy się objawowo. Należy podjąć działania zmierzające do szybkiego usunięcia salicylanów z organizmu pacjenta. Wskazane jest doustne podawanie dwuwęglanu sodu w celu alkalizacji moczu i wymuszenia diurezy.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: kortykosteroidy o silnym działaniu w skojarzeniu z innymi lekami, kod ATC: D07 XC 01 Dipropionian betametazonu jest syntetycznym fluorowanym kortykosteroidem, należącym do klasy kortykosteroidów o silnym działaniu (III grupa). Stosowany miejscowo wykazuje działanie przeciwzapalne i przeciwświądowe, a także obkurczające naczynia krwionośne. Kwas salicylowy zastosowany miejscowo zmiękcza keratynę i zrogowaciały naskórek oraz złuszcza naskórek, ułatwiając przenikanie dipropionianu betametazonu do skóry.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Kwas salicylowy zastosowany na skórę, wywiera tylko działanie miejscowe. Dipropionian betametazonu po podaniu na skórę wchłania się przez skórę w zależności od wielu czynników, w tym od podłoża produktu leczniczego, struktury naskórka, użycia opatrunków okluzyjnych. Kortykosteroidy podane miejscowo mogą wchłaniać się przez nieuszkodzoną skórę. Stan zapalny i (lub) inne choroby skóry mogą zwiększać przezskórną absorpcję kortykosteroidów. Opatrunki okluzyjne znacząco zwiększają przezskórne wchłanianie kortykosteroidów. Szlak metaboliczny wchłoniętych kortykosteroidów po podaniu miejscowym jest podobny do szlaku metabolicznego kortykosteroidów podanych ogólnie. Kortykosteroidy wiążą się w różnym stopniu z białkami osocza, są metabolizowane głównie w wątrobie i wydalane z moczem. Niektóre kortykosteroidy stosowane miejscowo i ich metabolity są także wydalane z żółcią.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dipropionian betametazonu z kwasem salicylowym w maści stosowano miejscowo na nieuszkodzoną skórę i na otarcia skóry u szczurów i królików. Produkt leczniczy był dobrze tolerowany i nie stwierdzano działań niepożądanych. Wielokrotne podanie produktu na nieuszkodzoną skórę i otarcia skóry u szczurów i królików odpowiednio przez okres 15 lub 63 dni było przez nie dobrze tolerowane. Nie wystąpiły niespodziewane działania niepożądane, a jedynie ogólnoustrojowe objawy niepożądane kortykosteroidów.
- CHPL leku Diprosalic, maść, (0,64 mg + 30 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Wazelina biała Parafina ciekła 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Tuba aluminiowa z zakrętką w tekturowym pudełku. 15 g 30 g Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Diprosalic, (0,64 mg + 20 mg)/g, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy gram płynu zawiera 0,64 mg betametazonu dipropionianu (Betamethasoni dipropionas) (co odpowiada 0,5 mg betametazonu) oraz 20 mg kwasu salicylowego (Acidum salicylicum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Płyn na skórę
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Diprosalic w postaci płynu wskazany jest w miejscowym leczeniu łuszczycy owłosionej skóry głowy, cięższych postaci łojotokowego zapalenia skóry, liszaja płaskiego, ciężkich postaci alergicznego zapalenia skóry, wyprysku kontaktowego w obrębie owłosionej skóry głowy, liszaja rumieniowatego.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i dzieci w wieku powyżej 12 lat: niewielką ilość płynu (około 0,5 ml na 10 cm2 powierzchni skóry) należy nanieść na zmienione miejsca na skórze dwa razy na dobę (rano i wieczorem). W niektórych przypadkach dobre wyniki leczenia można uzyskać przy rzadszym stosowaniu. Okres leczenia nie powinien trwać dłużej niż 14 dni. W razie nawrotu choroby leczenie można powtórzyć. Produktu nie stosować u dzieci w wieku do 12 lat. Sposób podawania Podanie na skórę.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nie stosować: w nadwrażliwości na substancje czynne - betametazonu dipropionian i kwas salicylowy lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; w przypadku zakażeń bakteryjnych (np. w gruźlicy, kile), wirusowych (opryszczka, półpasiec, ospa wietrzna) lub grzybiczych skóry; w trądziku pospolitym; w trądziku różowatym; w zapaleniu skóry wokół ust; na skórę twarzy; w pieluszkowym zapaleniu skóry; w świądzie okolicy odbytu i narządów płciowych; u dzieci w wieku do 12 lat.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Jeśli podczas stosowania produktu leczniczego Diprosalic płyn wystąpią objawy podrażnienia, uczulenia lub nadmiernego wysuszenia skóry, należy natychmiast zaprzestać stosowania produktu. W przypadku wystąpienia zakażeń bakteryjnych należy zastosować odpowiednie leczenie przeciwbakteryjne. Kortykosteroidy i kwas salicylowy wchłaniają się przez skórę, dlatego podczas stosowania produktu leczniczego Diprosalic płyn istnieje ryzyko wystąpienia ogólnoustrojowych objawów niepożądanych kortykosteroidów (w tym zahamowanie czynności kory nadnerczy) oraz kwasu salicylowego. Z tego względu należy unikać podawania produktu leczniczego na dużą powierzchnię skóry, rany, uszkodzoną skórę, stosowania w dużych dawkach, a także długotrwałego leczenia produktem. W razie konieczności zastosowania produktu leczniczego w takich przypadkach, należy zachować specjalne środki ostrożności.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gSpecjalne środki ostrozności
Szczególnie ostrożnie stosować u pacjentów z łuszczycą, gdyż miejscowe stosowanie kortykosteroidów w łuszczycy może być niebezpieczne z wielu powodów, w tym ze względu na nawrót choroby spowodowany rozwojem tolerancji, ryzyko wystąpienia uogólnionej łuszczycy krostkowej i ogólne działania toksyczne spowodowane zaburzeniem ciągłości skóry. Nie należy stosować produktu leczniczego pod opatrunkiem okluzyjnym, gdyż może on zwiększać przezskórne wchłanianie kortykosteroidów. Unikać kontaktu produktu leczniczego z oczami i błonami śluzowymi. Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego (w tym podanie donosowe, wziewne i do oka) stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn zaburzeń widzenia, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (ang.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gSpecjalne środki ostrozności
Central Serous Chorioretinopathy - CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów. Dzieci Ostrożnie stosować u dzieci. U dzieci, ze względu na większy niż u dorosłych stosunek powierzchni ciała do masy ciała, łatwiej niż u dorosłych może dojść do zahamowania czynności osi podwzgórze-przysadka-nadnercza i wystąpienia objawów niepożądanych charakterystycznych dla kortykosteroidów, w tym zaburzeń wzrostu i rozwoju. U dzieci leczonych miejscowo kortykosteroidami opisywano: zahamowanie czynności osi podwzgórze-przysadka-nadnercza, zespół Cushinga, zahamowanie wzrostu, zmniejszenie przyrostu masy ciała oraz nadciśnienie wewnątrzczaszkowe. Zahamowanie czynności nadnerczy u dzieci powodowało zmniejszenie stężenia kortyzolu w osoczu i brak odpowiedzi na stymulację ACTH. Nadciśnienie wewnątrzczaszkowe powodowało uwypuklenie ciemiączka, wystąpienie bólów głowy i obustronne obrzęki tarcz nerwów wzrokowych.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych dotyczących stosowania kortykosteroidów u kobiet w okresie ciąży. Produkt leczniczy Diprosalic płyn można stosować tylko wtedy, gdy potencjalna korzyść dla matki przeważa możliwe ryzyko dla płodu. W badaniach na zwierzętach wykazano, że kortykosteroidy stosowane miejscowo mogą działać teratogennie. Karmienie piersi? Nie wiadomo, czy miejscowo stosowane kortykosteroidy wchłaniają się przez skórę w takim stopniu, że mogą przenikać do mleka kobiecego. Należy podjąć decyzję czy przerwać karmienie piersią czy przerwać podawanie produktu Diprosalic płyn, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy Diprosalic nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gDziałania niepożądane
4.8 Działania niepożądane Podczas miejscowego stosowania kortykosteroidów obserwowano następujące działania niepożądane: pieczenie swędzenie podrażnienie wysuszenie skóry zapalenie mieszków włosowych nadmierne owłosienie zmiany trądzikopodobne zanik barwnika skóry zapalenie skóry wokół ust alergiczne kontaktowe zapalenie skóry macerację skóry wtórne zakażenia atrofię skóry rozstępy skóry potówki Długotrwałe miejscowe stosowanie produktów zawierających kwas salicylowy może powodować wystąpienie zapalenia skóry. W wyniku wchłaniania substancji czynnych do krwi mogą również wystąpić ogólne działania niepożądane betametazonu (charakterystyczne dla kortykosteroidów) i kwasu salicylowego. Ogólne objawy niepożądane występują przede wszystkim w przypadku długotrwałego stosowania produktu leczniczego, stosowania na dużą powierzchnię skóry oraz stosowania u dzieci.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gDziałania niepożądane
Podczas stosowania kortykosteroidów obserwowano nieostre widzenie (częstość nieznana - nie może być określona na podstawie dostępnych danych) (patrz także punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, Tel.: + 48 22 49 21 301, Faks: + 48 22 49 21 309, Strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gPrzedawkowanie
4.9 Przedawkowanie Długotrwałe miejscowe stosowanie kortykosteroidów może doprowadzić do zahamowania czynności osi podwzgórze-przysadka-nadnercza i w konsekwencji do wtórnej niewydolności nadnerczy, a także nadczynności kory nadnerczy, łącznie z zespołem Cushinga. Miejscowe stosowanie kwasu salicylowego długotrwale lub w dużych dawkach może spowodować zatrucie kwasem salicylowym. W przypadku przedawkowania należy zastosować odpowiednie leczenie objawowe. Ostre objawy przedawkowania hormonów kory nadnerczy zwykle są odwracalne. Jeśli jest to konieczne, należy wyrównać stężenie elektrolitów. W przypadku przewlekłego zatrucia wskazane jest powolne, stopniowe odstawianie kortykosteroidów. Zatrucia kwasem salicylowym leczy się objawowo. Należy podjąć działania zmierzające do szybkiego usunięcia salicylanów z organizmu pacjenta. Wskazane jest doustne podawanie dwuwęglanu sodu w celu alkalizacji moczu i wymuszenia diurezy.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: kortykosteroidy o silnym działaniu w skojarzeniu z innymi lekami, kod ATC: D07 XC 01 Dipropionian betametazonu jest syntetycznym fluorowanym kortykosteroidem, należącym do klasy kortykosteroidów o silnym działaniu (III grupa). Stosowany miejscowo wykazuje działanie przeciwzapalne i przeciwświądowe, a także obkurczające naczynia krwionośne. Kwas salicylowy zastosowany miejscowo zmiękcza keratynę i zrogowaciały naskórek oraz złuszcza naskórek, ułatwiając przenikanie dipropionianu betametazonu do skóry.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Kwas salicylowy zastosowany na skórę, wywiera tylko działanie miejscowe. Dipropionian betametazonu po podaniu na skórę wchłania się przez skórę w zależności od wielu czynników, w tym od podłoża produktu leczniczego, struktury naskórka, użycia opatrunków okluzyjnych. Kortykosteroidy podane miejscowo mogą wchłaniać się przez nieuszkodzoną skórę. Stan zapalny i (lub) inne choroby skóry mogą zwiększać przezskórną absorpcję kortykosteroidów. Opatrunki okluzyjne znacząco zwiększają przezskórne wchłanianie kortykosteroidów. Szlak metaboliczny wchłoniętych kortykosteroidów po podaniu miejscowym jest podobny do szlaku metabolicznego kortykosteroidów podanych ogólnie. Kortykosteroidy wiążą się w różnym stopniu z białkami osocza, są metabolizowane głównie w wątrobie i wydalane z moczem. Niektóre kortykosteroidy stosowane miejscowo i ich metabolity są także wydalane z żółcią.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dipropionian betametazonu z kwasem salicylowym w maści stosowano miejscowo na nieuszkodzoną skórę i na otarcia skóry u szczurów i królików. Produkt leczniczy był dobrze tolerowany i nie stwierdzano działań niepożądanych. Wielokrotne podanie produktu na nieuszkodzoną skórę i otarcia skóry u szczurów i królików odpowiednio przez okres 15 lub 63 dni było przez nie dobrze tolerowane. Nie wystąpiły niespodziewane działania niepożądane, a jedynie ogólnoustrojowe objawy niepożądane kortykosteroidów.
- CHPL leku Diprosalic, płyn na skórę, (0,64 mg + 20 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Disodu edetynian Hypromeloza Sodu wodorotlenek Alkohol izopropylowy Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 18 miesięcy 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Butelka z polietylenu w tekturowym pudełku. 1 butelka po 30 ml Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LE CZNICZEGO Lorinden A, (0,2 mg + 30 mg)/g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g maści zawiera 0,2 mg flumetazonu piwalanu (Flumetasoni pivalas) i 30 mg kwasu salicylowego (Acidum salicylicum). Substancje pomocnicze o znanym działaniu: glikol propylenowy, lanolina bezwodna. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTY CZNA Maść. Biała maść o bladożółtym odcieniu.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Miejscowe leczenie stanów zapalnych skóry, zwłaszcza o podłożu alergicznym, odpowiadających na leczenie kortykosteroidami (nie powikłanych wtórnym zakażeniem bakteryjnym), przebiegających z nadmiernym rogowaceniem i uporczywym swędzeniem. Lorinden A stosuje się szczególnie w: łojotokowym zapaleniu skóry, atopowym zapaleniu skóry, liszaju pokrzywkowym, wyprysku kontaktowym alergicznym, rumieniu wielopostaciowym, toczniu rumieniowatym, łuszczycy zadawnionej, liszaju płaskim.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Stosować nie częściej niż raz lub dwa razy na dobę. Nie stosować produktu leczniczego dłużej niż przez 2 tygodnie. Na skórę twarzy nie stosować dłużej niż przez 7 dni. W ciągu tygodnia można zużyć nie więcej niż 15 g (1 tubę) maści. Dzieci i młodzież Nie stosować u dzieci w wieku poniżej 2 lat. U dzieci powyżej 2 lat stosować bardzo ostrożnie, tylko raz na dobę, na niewielką powierzchnię skóry, nie stosować na skórę twarzy. Sposób podawania Podanie na skórę. Należy nakładać cienką warstwę maści na chorobowo zmienione miejsca na skórze. W razie nadmiernego liszajowacenia lub nadmiernego rogowacenia zmienionej chorobowo skóry, dopuszcza się stosowanie opatrunku okluzyjnego, który należy zmieniać raz na 24 godziny.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwości na flumetazonu piwalan, inne kokortykosteroidy, kwas salicylowy lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować produktu leczniczego: w wirusowych (np. ospa wietrzna, opryszczka zwykła), grzybiczych lub bakteryjnych zakażeniach skóry, nowotworach skóry, trądziku pospolitym, trądziku różowatym, zapaleniu skóry wokół ust, świądzie okolicy odbytu, w pieluszkowym zapaleniu skóry, zapaleniu lub owrzodzeniu żylakowatym, na rozległe zmiany skórne, zwłaszcza przebiegające z ubytkiem skóry, np. w oparzeniach, u dzieci w wieku poniżej 2 lat.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Jeśli podczas stosowania produktu leczniczego wystąpią objawy podrażnienia, uczulenia lub nadmiernego wysuszenia skóry, należy natychmiast zaprzestać stosowania produktu. Nie stosować bez przerwy dłużej niż przez 2 tygodnie. Kortykosteroidy i kwas salicylowy wchłaniają się przez skórę. Dlatego podczas stosowania produktu leczniczego istnieje ryzyko wystąpienia ogólnoustrojowych objawów niepożądanych kortykosteroidów (w tym zahamowanie czynności kory nadnerczy, zmniejszenie stężenia kortyzolu we krwi, zespół Cushinga) oraz kwasu salicylowego. Z tego względu należy unikać podawania produktu leczniczego na dużą powierzchnię skóry, rany, uszkodzoną skórę, stosowania w dużych dawkach, a także długotrwałego leczenia produktem. Podczas leczenia wskazana jest okresowa kontrola czynności kory nadnerczy przez oznaczanie kortyzolu we krwi i w moczu po stymulacji nadnerczy przez ACTH.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gSpecjalne środki ostrozności
W przypadku zakażenia skóry w leczonym miejscu, należy zastosować dodatkowe leczenie przeciwbakteryjne lub przeciwgrzybicze. Jeżeli objawy zakażenia nie ustąpią, należy przerwać stosowanie produktu leczniczego do czasu wyleczenia zakażenia. Nie należy stosować produktu leczniczego na powieki lub na skórę w okolicy powiek, ze względu na ryzyko jaskry lub zaćmy oraz u osób z jaskrą lub zaćmą, gdyż może wystąpić nasilenie objawów choroby. Unikać kontaktu produktu z oczami i błonami śluzowymi. Na skórę twarzy oraz na skórę pach i pachwin stosować tylko w przypadkach bezwzględnie koniecznych, ze względu na zwiększone wchłanianie kortykosteroidu przez delikatną skórę i związane z tym zwiększone ryzyko teleangiektazji, dermatitis periorali, zaników skóry, nawet po krótkim stosowaniu. Stosowanie produktu leczniczego pod opatrunkiem okluzyjnym należy ograniczyć do wyjątkowych sytuacji, ponieważ opatrunek nasila wchłanianie kortykosteroidu do organizmu, ponadto może wystąpić zanik naskórka, rozstępy i nadkażenia.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gSpecjalne środki ostrozności
Ostrożnie stosować w stanach zanikowych tkanki podskórnej, zwłaszcza u osób w podeszłym wieku. Zaburzenia widzenia Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (ang. Central Serous Chorioretinopathy, CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów. Dzieci i młodzież Ostrożnie stosować u dzieci w wieku powyżej 2 lat. U dzieci, ze względu na większy niż u dorosłych stosunek powierzchni ciała do masy ciała, łatwiej niż u dorosłych może dojść do zahamowania czynności osi podwzgórze-przysadka-nadnercza i wystąpienia objawów niepożądanych charakterystycznych dla kortykosteroidów, w tym zaburzeń wzrostu i rozwoju.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gSpecjalne środki ostrozności
Lorinden A zawiera glikol propylenowy Lorinden A zawiera 50 mg glikolu propylenowego w 1 g maści. Glikol propylenowy może powodować podrażnienie skóry. Lorinden A zawiera lanolinę Produkt leczniczy może powodować miejscowe reakcje skórne (np. kontaktowe zapalenie skóry).
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji. Należy jednak mieć na uwadze, aby nie szczepić pacjentów przeciwko ospie i nie podejmować innych immunizacji, szczególnie przy przewlekłym stosowaniu produktu leczniczego na dużą powierzchnię skóry, ze względu na ryzyko braku prawidłowej odpowiedzi immunologicznej. W przypadku długotrwałego stosowania produktu leczniczego na duże powierzchnie skóry, w wyniku wchłaniania kwasu salicylowego do organizmu, może wystąpić nasilenie działania metotreksatu, doustnych leków przeciwcukrzycowych pochodnych sulfonylomocznika. Lorinden A maść może nasilać działanie leków immunosupresyjnych i osłabiać działanie leków immunostymulujących.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Lorinden A maść może być zastosowany u kobiet w ciąży tylko krótkotrwale, na małą powierzchnię skóry, jeżeli korzyści dla matki przewyższają ryzyko dla płodu. Bezwzględnie nie stosować w pierwszym trymestrze ciąży. W badaniach na zwierzętach wykazano, że kortykosteroidy działają teratogennie, nawet po stosowaniu małych dawek doustnie. Działanie teratogenne występowało u zwierząt, także po stosowaniu silnych glikokortykosteroidów na skórę. Nie przeprowadzono kontrolowanych badań dotyczących działania teratogennego po miejscowym stosowaniu na skórę flumetazonu piwalanu u kobiet w okresie ciąży. Karmienie piersi? Należy rozważyć czy zaprzestać karmienia piersią czy zaprzestać stosowania produktu Lorinden A maść, biorąc pod uwagę możliwość wystąpienia działań niepożądanych u dzieci i korzyści leczenia dla matki.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gWpływ na płodność, ciążę i laktację
Nie ustalono, czy miejscowo stosowane kortykosteroidy wchłaniają się przez skórę w takim stopniu, że mogą przenikać do mleka kobiet karmiących. Nie wiadomo w jakim stopniu flumetazonu piwalanu może przenikać do mleka kobiet karmiących piersią po zastosowaniu na skórę.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Lorinden A nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane wymieniono poniżej zgodnie z klasyfikacją układów i narządów MedDRA oraz częstością występowania, według następującej konwencji: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100); rzadko (≥1/10 000 do <1/1 000); bardzo rzadko (< 1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych). Klasyfikacja układów i narządów Zaburzenia skóry i tkanki podskórnej: Nieznana. Mogą wystąpić objawy trądzikopodobne, plamica posteroidowa, zanik naskórka i tkanki podskórnej, suchość skóry, nadmierne owłosienie lub łysienie, odbarwienie lub przebarwienie skóry, zanik i rozstępy skóry, teleangiektazje, stan zapalny skóry dookoła ust, zapalenie mieszków włosowych, rozstępy, wtórne zakażenia, podrażnienie skóry. Niekiedy może wystąpić pokrzywka lub wysypka plamisto-grudkowa albo zaostrzenie istniejących zmian chorobowych.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gDziałania niepożądane
Ze względu na zawartość kwasu salicylowego, podczas długotrwałego stosowania produktu leczniczego może wystąpić zapalenie skóry. Zaburzenia oka: Nieznana. Nieostre widzenie (patrz także punkt 4.4.). W przypadku stosowania produktu leczniczego na skórę powiek, niekiedy może wystąpić jaskra lub zaćma. Zaburzenia ogólne i stany w miejscu podania: Nieznana. W wyniku wchłaniania substancji czynnych do krwi mogą również wystąpić ogólnoustrojowe działania niepożądane flumetazonu piwalanu i kwasu salicylowego. Występują one przede wszystkim w przypadku długotrwałego stosowania produktu leczniczego, stosowania go na dużą powierzchnię skóry, pod opatrunkiem okluzyjnym lub w przypadku stosowania u dzieci. Ogólnoustrojowe objawy niepożądane flumetazonu piwalanu charakterystyczne dla kortykosteroidów, to m.in. zahamowanie czynności osi podwzgórze–przysadka–nadnercza, zespół Cushinga, hamowanie wzrostu i rozwoju u dzieci, hiperglikemia, cukromocz, obrzęki, nadciśnienie, zmniejszenie odporności.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, Tel.: + 48 22 49 21 301, Faks: +48 22 49 21 309, Strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gPrzedawkowanie
4.9 Przedawkowanie Długotrwałe lub nieprawidłowe miejscowe stosowanie produktu leczniczego lub stosowanie na duże powierzchnie skóry, może doprowadzić do zahamowania czynności osi podwzgórze-przysadka-nadnercza, hamowanie wzrostu i rozwoju u dzieci. Mogą wystąpić objawy przedawkowania w postaci, m.in. obrzęków, nadciśnienia, hiperglikemii, cukromoczu, zmniejszenia odporności a w ciężkich przypadkach występowaniem choroby Cushinga. Należy wówczas stopniowo odstawiać produkt leczniczy lub zastosować słabiej działające kortykosteroidy. Rzadko mogą wystąpić objawy zatrucia salicylanami.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: kortykosteroidy o umiarkowanie silnym działaniu w połączeniu z innymi lekami. Kod ATC: D 07 XB 30 Właściwości produktu leczniczego Lorinden A maść wynikają ze skojarzonego działania flumetazonu piwalanu i kwasu salicylowego. Flumetazonu piwalan jest syntetycznym kortykosteroidem o umiarkowanie silnym działaniu przeciwzapalnym. Stosowany miejscowo wykazuje działanie przeciwzapalne, przeciwświądowe i obkurczające naczynia krwionośne. Kwas salicylowy w stężeniu występującym w preparacie wykazuje słabe działanie keratolityczne. Ułatwia przenikanie glikokortykosteroidu przez nadmiernie zrogowaciały naskórek.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Flumetazonu piwalan po podaniu na skórę łatwo przenika do warstwy rogowej skóry. W niewielkim stopniu może przenikać do organizmu i wykazuje wówczas działanie ogólne. Wchłanianie flumetazonu piwalanu przez skórę zwiększa się po zastosowaniu na delikatną skórę w okolicy fałdów lub na skórę twarzy oraz na skórę z uszkodzonym naskórkiem lub uszkodzoną procesem zapalnym. Wchłanianie flumetazonu piwalanu ulega zwiększeniu podczas stosowania opatrunku okluzyjnego, częstego stosowaniu produktu leczniczego lub po zastosowaniu go na dużą powierzchnię skóry. Wchłanianie flumetazonu piwalanu przez skórę u dzieci jest większe niż u dorosłych. Metabolizm Po wchłonięciu ze skóry do organizmu flumetazonu piwalan jest metabolizowany głównie w wątrobie. Eliminacja Następnie jest wydalany z moczem i w mniejszej ilości z żółcią, głównie w postaci połączeń z kwasem glukuronowym oraz w niewielkiej ilości w postaci niezmienionej.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Działanie mutagenne Nie przeprowadzono badań dotyczących mutagennego działania flumetazonu piwalanu, przeprowadzono natomiast badania dotyczące działania mutagennego innych kortykosteroidów o zbliżonej budowie chemicznej. Flutykazonu propionian nie wykazywał działania mutagennego w teście Ames’a wykonanym na bakteriach Escherichia coli, w teście konwersji genów wykonanych na drożdżach Saccharomyces cerevisiae oraz w teście działania mutagennego na komórkach jajnika chomika chińskiego. Nie wykazano również działania mutagennego flutykazonu w badaniach na limfocytach ludzkich in vitro oraz działania klastogenowego w teście mikrojąderkowym na myszach. Badania hydrokortyzonu i prednizolonu na bakteriach Salmonella typhimurium również nie wykazały ich działania mutagennego. Działanie rakotwórcze Nie uzyskano jednak danych mogących wskazywać, że miejscowe stosowanie kortykosteroidów sprzyja występowaniu raka skóry u ludzi.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gPrzedkliniczne dane o bezpieczeństwie
Wpływ na płodność Nie badano wpływu flumetazonu piwalanu na płodność, natomiast wykazano wpływ na płodność dla innych kortykosteroidów.
- CHPL leku Lorinden A, maść, (30 mg + 0,2 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZ NE 6.1 Wykaz substancji pomocniczych Glikol propylenowy wazelina biała lanolina bezwodna 6.2 Niezgodności farmaceutyczne Nie stosować jednocześnie z innymi lekami stosowanymi na skórę. 6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności przy przechowywaniu Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość pojemnika Tuba aluminiowa z membraną zabezpieczającą, zamykana polietylenową lub polipropylenową nakrętką z przebijakiem, zawierająca 15 g maści, umieszczona w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Maść na odciski Aflofarm, (400 mg + 100 mg) /g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g inaści zawiera 400 mg kwasu salicylowego (Acidum salicylicum) i 100 mg kwasu mlekowego (Aciduni laeticum). Substancja pomocnicza o manym działaniu: laiaolina. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Usuwanie odcisków, nagniotków oraz zgrubień skóry stóp.
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Podanie miejscowe na skórę. Nakładać maść 1 lub 2 razy na dobę na zrogowaciate miejsca na skórze stóp, uważając, aby nie dotknąć zdrowej skóry. Po wystąpieniu bolesności należy wymoczyć stopy w gorącej wodzie i usunąć rozmiękczony zrogowaciały naskórek. Zabieg powtarzać kilkakrotnie. Dzieci: Nie stosować u dzieci w wieku do 2 lat. Ostrożnie stosować u dzieci w wieku powyżej 2 lat.
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nie stosować produktu leczniczego: w nadwrażliwości na kwas salicylowy lub mlekowy lub na którykolwiek ze składników produktu leczniczego; u dzieci w wieku do 2 lat; u pacjentów chorych na cukrzycę lub osób z zaburzeniami krążenia; jeśli skóra w otoczeniu odcisku jest uszkodzona lub zmieniona zapalnie.
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy przerwać leczenie, jeśli wystąpią objawy podrażnienia skóry lub uczulenie. Maść należy nanosić wyłącznie na zrogowaciały naskórek. Nie należy stosować produktu na niezmienioną zdrową skórę, ani na skórę uszkodzoną, gdyż kwas salicylowy wchłania się przez skórę i mogą wystąpić ogólnoustrojowe działania niepożądane kwasu salicylowego. Chronić oczy i błony śluzowe przed kontaktem z produktem. W razie kontaktu produktu z oczami lub błonami śluzowymi, miejsca te należy przemyć wodą. Ze względu na zawartość lanoliny lek może powodować miejscowe reakcje skórne (np. kontaktowe zapalenie skóry).
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Brak danych.
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Brak danych na temat bezpieczeństwa stosowania u kobiet w ciąży i kobiet karmiących. Jednak biorąc pod uwagę możliwość wchłonięcia i przenikania kwasu salicylowego przez łożysko do krwi płodu, nie należy stosować produktu u kobiet w ciąży.
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gDziałania niepożądane
4.8 Działania niepożądane Poniżej wymieniono możliwe działania niepożądane zgodnie z klasyfikacją układów i narządów. Zaburzenia skóry i tkanki podskórnej: odczyny alergiczne, stan zapalny skóry. Po zastosowaniu produktu na zdrową skórę lub błony śluzowe mogą wystąpić objawy podrażnienia skóry w postaci rumienia, złuszczenia i nadżerek, oraz stan zapalny.
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gPrzedawkowanie
4.9 Przedawkowanie Brak danych na temat przedawkowania.
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwko nadmiarowi rogowacenia naskórka, do stosowania miejscowego. Kod ATC: brak kod. Kwas salicylowy stosowany miejscowo działa keratolitycznie, zmiękcza i rozpulchnia zrogowaciały naskórek ułatwiając jego złuszczanie. Kwas mlekowy w stężeniu 10% działa keratolitycznie.
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie: Kwas salicylowy wchłania się przez nieuszkodzony naskórek do skóry właściwej i tkanki podskórnej osiągając maksymalne stężenie po 4-8 godzinach. Brak danych na temat możliwości wchłaniania kwasu mlekowego przez skórę. Dystrybucja: Brak danych na temat dystrybucji kwasu mlekowego stosowanego miejscowo u ludzi. Kwas salicylowy po wchłonięciu do organizmu dostaje się do ośrodkowego układu nerwowego, przenika przez łożysko i znajduje się we krwi płodu.
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak danych.
- CHPL leku Maść na odciski Aflofarm, maść, (400 mg + 100 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Wazelina żółta Lanolina 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Nie zamrażać. Przechowywać w oryginalnym opakowaniu. 6.5 Rodzaj i zawartość opakowania 4 tuba aluminiowa z membraną zabezpieczającą i zakrętką, w tekturowym pudelku. 1 tuba po 10 g. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak szczególnych wymagań.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO MAŚĆ NA ODCISKI, (400 mg + 100 mg)/g, maść 2. SK AD JAKOŚCIOWY I ILOŚCIOWY 1 g maści zawiera: kwas salicylowy (Acidum salicylicum) 400 mg, kwas (S)-mlekowy (Acidum lacticum) 100 mg. Peny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść Maść barwy żółtej lub zielonkawej o charakterystycznym zapachu.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Usuwanie odcisków.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Do stosowania miejscowego na odciski. Odcisk wymoczyć i osuszyć. Naożyć na odcisk cienką warstwę maści i zabezpieczyć plastrem lub bandażem. Stosować produkt przez 4 do 6 dni rano i na noc, nie zmywając posmarowanych miejsc wodą. Następnie odcisk należy dobrze wymoczyć w gorącej wodzie i usunąć. Nie należy wycinać ani wyrywać odcisków. W razie braku efektów powtórzyć leczenie po upływie 3 dni.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nie stosować: w przypadku nadwrażliwości na substancje czynne (kwas salicylowy lub kwas mlekowy) lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, u pacjentów chorych na cukrzycę lub osób z zaburzeniami krążenia, jeśli skóra w otoczeniu odcisku jest uszkodzona lub zmieniona zapalnie, u dzieci.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy przerwać leczenie, jeśli wystąpią objawy podrażnienia skóry lub uczulenie. Unikać kontaktu maści z oczami i błonami śluzowymi. Produkt należy nakładać wyłącznie na odcisk. Nie należy stosować produktu na niezmienioną zdrową skórę, ani na skórę uszkodzoną, gdyż mogą wystąpić ogólnoustrojowe działania niepożądane kwasu salicylowego.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie są znane interakcje wynikające z miejscowego i krótkotrwałego zastosowania produktu zgodnie ze wskazaniami i zalecanym sposobem stosowania.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Nie badano bezpieczeństwa stosowania produktu u kobiet w okresie ciąży ani u kobiet karmiących piersią.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gDziałania niepożądane
4.8 Działania niepożądane Stosowanie produktu zgodne ze wskazaniami i zalecanym dawkowaniem nie wiąże się z istotnym ryzykiem wystąpienia działań niepożądanych. Niekiedy może wystąpić miejscowe podrażnienie i objawy nadwrażliwości skóry. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Aleje Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, fax: + 48 22 49 21 309, e-mail: ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gPrzedawkowanie
4.9 Przedawkowanie Kwas salicylowy i kwas mlekowy zastosowane na skórę jedynie w niewielkim stopniu przenikają do okolicznych tkanek. Ryzyko wystąpienia ich działania ogólnoustrojowego jest nieznaczne. Przedawkowanie, zastosowanie na skórę wrażliwą lub uszkodzoną, nałożenie na błony śluzowe albo przypadkowe spożycie mogą doprowadzić do miejscowego uszkodzenia tkanek.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki dermatologiczne o działaniu keratolitycznym. Maść na odciski zawiera substancje czynne kwas salicylowy i kwas S-mlekowy oraz substancje pomocnicze - plaster nostrzykowy i bezwodną lanolinę. Kwas salicylowy (kwas 2-hydroksybenzoesowy) stosowany miejscowo na odcisk w stężeniu 40% działa keratolitycznie, zmiękcza i rozpulchnia zrogowaciały naskórek, ułatwiając jego złuszczanie. Kwas mlekowy stosowany w stężeniu 10% ma działanie keratolityczne. Plaster nostrzykowy ma działanie rozmiękczające i przeciwzapalne.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Substancje czynne produktu po zastosowaniu na skórę jedynie w niewielkim stopniu przenikają do okolicznych tkanek. W praktyce nie dochodzi do wchłonięcia do organizmu substancji czynnych w dawkach, które by mogły spowodować działanie ogólnoustrojowe.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Nie wykonano badań przedklinicznych produktu leczniczego. Brak danych dotyczących pełnej przedklinicznej oceny kwasu salicylowego i kwasu mlekowego po miejscowym i krótkotrwałym zastosowaniu na odciski w postaciach przeznaczonych do stosowania miejscowego.
- CHPL leku Maść na odciski, maść, (400 mg + 100 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Plaster nostrzykowy Lanolina 6. Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 1 rok 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze nie wyższej niż 25°C. 6.5 Rodzaj i zawartość opakowania Tuba aluminiowa membranowa z zakrętką PE, zawierająca 10 g maści, umieszczona w pudeku tekturowym z ulotką dla pacjenta. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Mobilat, (0,2 g + 1,0 g + 2,0 g)/100 g , maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g maści zawiera: mukopolisacharydowy polisiarczan (Mucopolisaccharidum polisulphatum) 0,2 g ekstrakt z kory nadnerczy (Suprarenal extract) 1,0 g kwas salicylowy (Acidum salicylicum) 2,0 g Substancja pomocnicza o znanym działaniu: cetylostearylowy alkohol emulgujący (typ A) Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść. Biała, świecąca, jednorodna maść.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie pourazowych i miejscowych stanów zapalnych, choroby zwyrodnieniowej stawów i tkanek okołostawowych. Miejscowe, wspomagające leczenie zmienionych zapalnie stawów w chorobach reumatycznych.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Raz lub trzy razy na dobę na zmienione chorobowo miejsca nakłada się pasek maści o długości od 5 do 15 cm. Jeżeli jest zastosowany opatrunek okluzyjny dawkę można odpowiednio zwiększyć. Należy unikać kontaktu maści z otwartymi ranami, oczami i błonami śluzowymi. Po nałożeniu maści na zmieniony chorobowo obszar, należy delikatnie wmasować ją w skórę. Dzieci i młodzież Nie stosować u dzieci poniżej 12 roku życia bez przepisu lekarza. Sposób podawania Do stosowania zewnętrznego na skórę.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą, wymienioną w punkcie 6.1. W przypadku ospy wietrznej, reakcji poszczepiennych, grzybiczych lub bakteryjnych zakażeniach skóry lub innych swoistych zmianach skórnych w obszarze podawania leku (np. zmiany gruźlicze, kiła) oraz u dzieci produkt leczniczy Mobilat maść może być stosowany jedynie po przeprowadzeniu przez lekarza wnikliwej analizy korzyści do ryzyka. Analizę taką należy przeprowadzać również w przypadku przedłużonego stosowania produktu Mobilat na dużych obszarach skóry u chorych z zaburzoną czynnością nerek.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Mobilat maść powinien być stosowany jedynie na nieuszkodzoną skórę. Należy unikać kontaktu produktu Mobilat z otwartymi ranami, oczami i błonami śluzowymi. Po nałożeniu maści na zmienioną chorobowo skórę należy umyć ręce, chyba że to ręce są miejscem leczonym. Produkt Mobilat maść zawiera cetylostearylowy alkohol emulgujący (typ A). Produkt leczniczy może powodować miejscową reakcję skórną (np. kontaktowe zapalenie skóry). Dzieci i młodzież Nie stosować u dzieci poniżej 12 roku życia bez przepisu lekarza.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Kwas salicylowy może zwiększyć wchłanianie innych produktów leczniczych stosowanych miejscowo. Długotrwałe stosowanie produktu Mobilat na dużych obszarach skóry może prowadzić do zwiększenia działania toksycznego metotreksatu oraz działania hipoglikemizującego sulfonylomocznika.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Produkt leczniczy Mobilat należy stosować ostrożnie u kobiet w ciąży po wnikliwym rozważeniu stosunku korzyści do ryzyka, a le nawet wtedy nie stosować na dużych powierzchniach skóry. Karmienie piersi? Nie stosować produktu Mobilat w okolicy piersi u kobiet karmiących piersią.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Mobilat nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gDziałania niepożądane
4.8 Działania niepożądane W obrębie każdej grupy o określonej częstości objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Częstość występowania przedstawiono w sposób następujący: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia skóry i tkanki podskórnej Rzadko: miejscowe podrażnienia skóry. Bardzo rzadko: uczulenia kontaktowe.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gPrzedawkowanie
4.9 Przedawkowanie W związku ze sposobem podawania produktu Mobilat przedawkowanie jest mało prawdopodobne. Możliwe jest zatrucie salicylanami w następstwie przypadkowego połknięcia produktu. Objawami zatrucia są wymioty, nasilone pocenie się, tachykardia, hiperwentylacja, gorączka, szumy uszne, zaburzenia świadomości, zasadowica oddechowa i zasadowy odczyn moczu. Leczenie: płukanie żołądka, monitorowanie stężenia salicylanów w surowicy, pomiar pH osocza i elektrolitów. Może być niezbędne zastosowanie diurezy forsowanej. W przypadku wystąpienia objawów przedawkowania należy zastosować właściwe leczenie objawowe.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki do stosowania miejscowego w bólach stawów i mięśni, pochodne kwasu salicylowego. Kod ATC nie został nadany przez WHO. Substancje czynne zawarte w produkcie Mobilat oddziałują w złożony sposób na procesy zapalne zachodzące w tkankach podskórnych. Połączenie wyżej wymienionych substancji pozwala uzyskać działanie addycji i komplementarności, dzięki czemu zwiększa się skuteczność terapeutyczna produktu, która jest większa niż w przypadku pojedynczego zastosowania substancji czynnych. Działanie przeciwzapalne ekstraktu z kory nadnerczy i kwasu salicylowego polega głównie na hamowaniu biosyntezy prostaglandyn, hamowaniu uwalniania enzymów lizosomalnych oraz innych mediatorów stanów zapalnych. Dodatkowo ekstrakt z kory nadnerczy hamuje przepuszczalność naczyń włosowatych, wywiera działanie przeciwwysiękowe.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gWłaściwości farmakodynamiczne
Mukopolisacharydowy polisiarczan działając jako inhibitor enzymów katabolicznych, wpływa hamująco na proces rozkładu tkanek. Poprzez aktywację plazminogenu i działanie przeciwzakrzepowe substancja ta przyspiesza eliminację złogów włóknika z obszaru zapalenia. Poza tym mukopolisacharydowy polisiarczan stymuluje procesy metaboliczne komórek mezenchymalnych, przez co przyczynia się do szybkiej regeneracji uszkodzonych tkanek. Dzięki właściwościom keratolitycznym kwasu salicylowego następuje rozluźnienie komórek naskórka, co ułatwia wchłanianie pozostałych substancji czynnych produktu leczniczego przez skórę.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Substancje czynne ulegają wchłanianiu z podłoża maści wnikając poprzez skórę do tkanek położonych pod powierzchnią skóry. Maksymalne stężenia kwasu salicylowego osiągane są 4 do 8 godzin od zastosowania. Około 7% dawki podawanej na skórę jest wydalane z moczem, głównie w postaci kwasu salicylomoczowego, a jedynie jej niewielka część usuwana jest z organizmu w niezmienionej formie lub w postaci glukuronianów. Po wchłonięciu mukopolisacharydowego polisiarczanu przez skórę w organizmie dochodzi do częściowej czasozależnej depolimeryzacji i niewielkiej desulfatyzacji substancji czynnej. Badania na zwierzętach wykazują, że około 1% dawki podawanej na skórę wydalane jest z moczem. Budowa kortykosteroidów wchodzących w skład wyciągu z kory nadnerczy jest zbliżona do struktury kortykosteroidów występujących w organizmie człowieka. Wchłonięta dawka hormonów nadnerczy nie wywiera wpływu na wielkość fizjologicznego stężenia kortykosteroidów zawartych we krwi.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Kwas salicylowy Badania farmakokinetyczne na modelach zwierzęcych oraz ludziach wskazują na szybkie przenikanie kwasu salicylowego zależne od podłoża, ale także innych czynników wpływających na penetrację, np. kondycję skóry pacjenta. Dlatego, podczas stosowania zewnętrznego, przypadki zatrucia (występujące rzadko) są zależne od formy farmaceutycznej, ilości zaaplikowanego salicylanu, wielkości leczonego obszaru, czasu i częstotliwości leczenia oraz obrazu dermatologicznego. Objawów zatrucia można się spodziewać jedynie w przypadku przekroczenia stężenia 30 mg/dl w surowicy krwi w wyniku wchłonięcia przez skórę. Nie badano przewlekłego stosowania na skórę u zwierząt. Brak jednoznacznie wskazujących danych na działanie mutagenne kwasu salicylowego w rozległej literaturze naukowej. Brak danych z długoterminowych badań u zwierząt dotyczących potencjału kancerogennego kwasu salicylowego.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gPrzedkliniczne dane o bezpieczeństwie
Salicylany wykazały działanie teratogenne u kilku gatunków zwierząt podczas regularnego stosowania. Opisywano zaburzenia zagnieżdżania zarodków, działanie toksyczne wobec zarodków i płodów oraz zaburzenia zdolności uczenia się potomstwa po ekspozycji pozajelitowej. Podczas miejscowego stosowania nie osiąga się stężeń w osoczu mających znaczenie toksykologiczne, dlatego nie oczekuje się występowania toksyczności w przypadku prawidłowego zastosowania. Mukopolisacharydowy polisiarczan Badania toksyczności przewlekłej u psów i szczurów trwające dłużej niż 13 tygodni (podanie domięśniowe) wykazały występowanie podrażnienia w miejscu podania, zwiększenie masy wątroby i nerek oraz powiększenie węzłów chłonnych karkowych i krezki jelita. W badaniach teratogenności oraz toksyczności przeprowadzonych u zarodków szczurów i królików, mukopolisacharydowy polisiarczan w dawce 32 mg/kg był toksyczny dla zarodków (zmniejszona masa ciała, zwiększona częstość resorpcji oraz zmniejszona przeżywalność płodów), ale nie stwierdzono działania teratogennego.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gPrzedkliniczne dane o bezpieczeństwie
Nie wykazano działania mutagennego mukopolisacharydowego polisiarczanu w badaniach mutagenności (test Amesa, test aberracji chromosomalnej). Nie przeprowadzono badań rakotwórczości. Ekstrakt z kory nadnerczy Hormony kory nadnerczy zawarte w ekstrakcie wykazują strukturalne podobieństwo do fizjologicznie występujących korykosteroidów. Ilość hormonów kory nadnerczy wchłonięta po podaniu produktu nie powoduje zmian fizjologicznych stężeń kortykosteroidów.
- CHPL leku Mobilat, maść, (0,2 g + 1 g + 2 g)/100 gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Disodu edetynian, tymol, izopropylowy alkohol, etanoloamina, mirystylowy alkohol, cetylostearylowy alkohol emulgujący (typ A), woskowa podstawa maściowa, kwas stearynowy, glicerol 85%, woda oczyszczona. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 18 miesięcy; po pierwszym otwarciu: 12 miesięcy. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Tuba aluminiowa wewnątrz lakierowana żywicą epoksyfenolową z zakrętką PP w tekturowym pudełku. Zawartość maści: 50 g, 100 g. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Polfungicid, (50 mg + 10 mg)/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 50 mg chlormidazolu chlorowodorku (Chlormidazoli hydrochloridum) i 10 mg kwasu salicylowego (Acidum salicylicum). Substancja pomocnicza o znanym działaniu: glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1 3. POSTAĆ FARMACEUTYCZNA Roztwór na skórę Przezroczysty roztwór, bezbarwny lub lekko brunatny
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlWskazania do stosowania
4.1 Wskazania do stosowania Grzybicze i bakteryjne zakażenia paznokci i skóry - grzybice międzypalcowe, a szczególnie przypaznokciowe.
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Miejscowo: zmienioną chorobowo okolicę należy pędzlować roztworem 2 lub 3 razy na dobę. Pacjenci w podeszłym wieku: Nie ma potrzeby zmiany dawkowania. Pacjenci z zaburzeniami czynności wątroby i nerek: Nie ma potrzeby zmiany dawkowania.
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy unikać kontaktu produktu z oczami oraz błonami śluzowymi. W przypadku, gdy do takiego kontaktu dojdzie, należy przepłukać dużą ilością wody gałkę oczną lub błonę śluzową na którą został podany produkt. Kwas salicylowy może zmieniać przepuszczalność skóry dla innych stosowanych jednocześnie substancji, dlatego należy unikać podawania innych leków, kosmetyków itp. na skórę leczoną tym produktem. W przypadku wystąpienia zaczerwienienia, pieczenia lub świądu skóry na którą podano produkt, należy przerwać jego stosowanie. Produkt leczniczy zawiera glikol propylenowy, który może powodować podrażnienie skóry.
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Kwas salicylowy może zmieniać przepuszczalność skóry dla innych stosowanych jednocześnie substancji, kosmetyków itp.
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Z powodu braku dobrze udokumentowanych badań dotyczących bezpieczeństwa stosowania, produkt może być stosowany w ciąży jedynie w przypadkach, gdy w opinii lekarza korzyść dla matki przeważa nad potencjalnym zagrożeniem dla płodu. Z powodu braku odpowiednich badań, nie zaleca się stosowania produktu Polfungicid w okresie karmienia piersią.
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Polfungicid nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlDziałania niepożądane
4.8 Działania niepożądane Zaburzenia skóry i tkanki podskórnej: miejscowe objawy podrażnienia skóry - zaczerwienienie, pieczenie lub swędzenie skóry (częstość nieznana - nie może być określona na podstawie dostępnych danych); w razie ich wystąpienia należy przerwać stosowanie produktu. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C, 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlPrzedawkowanie
4.9 Przedawkowanie Dotychczas nie zgłoszono żadnego przypadku przedawkowania produktu. W razie przypadkowego lub omyłkowego doustnego zażycia produktu Polfungicid należy natychmiast podjąć działania mające na celu usunięcie go z organizmu (wywoływanie wymiotów, płukanie żołądka). Należy kontrolować stan równowagi wodnoelektrolitowej, a w razie konieczności wdrożyć leczenie objawowe.
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwgrzybicze do stosowania zewnętrznego, pochodne imidazolu i triazolu, kod ATC: D01AC20. Chlormidazol jest substancją o działaniu przeciwgrzybiczym, szczególnie skuteczną w przypadku grzybów z rodzaju Epidermophyton, Trichophyton i Microsporum, ale skuteczną również w przypadku zakażeń wywołanych przez rodzaj Aspergillus i Candida oraz Sporothrix schenkii, Cryptococcus neoformans i Torulopsis glabrata. Chlormidazol wykazuje również działanie przeciwbakteryjne - działa bakteriostatycznie na bakterie Gram-dodatnie, m. in Streptococcus pyogenes oraz Bacillus subtilis. Kwas salicylowy wywiera działanie bakteriostatyczne, grzybobójcze oraz keratolitycznie, nasilając działanie chlormidazolu. Substancje pomocnicze zawarte w produkcie (izopropanol i glikol propylenowy) ułatwiają penetrację substancji czynnych w głąb skóry.
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Brak jest danych dotyczących farmakokinetyki chlormidazolu po podaniu miejscowym na skórę u ludzi. Kwas salicylowy praktycznie nie wchłania się do krwi po podaniu miejscowym na skórę.
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak istotnych danych.
- CHPL leku Polfungicid, roztwór na skórę, (50 mg + 10 mg)/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Alkohol izopropylowy Disodu edetynian Glikol propylenowy Woda oczyszczona. 6.2 Niezgodności farmaceutyczne Nie należy stosować produktu leczniczego jednocześnie z innymi lekami lub kosmetykami na ten sam obszar skóry. 6.3 Okres ważności 4 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać w oryginalnym opakowaniu. 6.5 Rodzaj i zawartość opakowania Butelka ze szkła oranżowego z zakrętką i kroplomierzem, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak szczególnych wymagań
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Maść przeciw odciskom i zgrubieniom skóry „Rekord Łuszczy”, 200 mg/g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g maści zawiera 200 mg kwasu salicylowego (Acidum salicylicum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gWskazania do stosowania
4.1. Wskazania do stosowania Usuwanie odcisków oraz zgrubień skóry.
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gDawkowanie
4.2. Dawkowanie i sposób podawania Stosować miejscowo. Przed rozpoczęciem leczenia nogi należy dobrze wymoczyć w ciepłej wodzie. Następnie należy nałożyć maść na odcisk i zabezpieczyć plastrem. Codziennie uzupełniać ubytek maści zachowując ostrożność tak, aby nie dostała się na zdrową skórę. Leczenie trwa tydzień. Po upływie tego czasu nogi należy ponownie dobrze wymoczyć. Odcisk powinien dać się łatwo usunąć. W ten sam sposób leczy się zgrubiałą skórę. W przypadku bardzo zastarzałych zmianach, leczenie należy powtórzyć. Nie stosować dłużej niż przez 2 tygodnie.
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gPrzeciwwskazania
4.3. Przeciwwskazania Nie stosować produktu leczniczego: w nadwrażliwości na kwas salicylowy, salicylany lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; u pacjentów z cukrzycą lub z zaburzeniami układu krążenia; jeśli skóra w okolicy odciska (lub zgrubienia skóry) jest zraniona lub zmieniona zapalnie; na zmiany o dużej powierzchni; do oczu; na skórę twarzy, pachwin; w okolicy odbytu i narządów płciowych; na błony śluzowe; u dzieci.
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Przerwać leczenie, jeśli wystąpi nadmierne podrażnienie skóry. Chronić oczy i błony śluzowe przed kontaktem z produktem. Produkt należy nakładać wyłącznie na odcisk lub zgrubienie skóry – nie należy stosować produktu na niezmienioną zdrową skórę, ani na uszkodzoną skórę, gdyż kwas salicylowy wchłania się przez skórę i mogą wystąpić jego ogólnoustrojowe działania. Jeśli dojdzie do pokrycia produktem otaczającej odcisk zdrowej skóry, należy ją natychmiast dokładnie zmyć wodą.
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Dotychczas nie odnotowano interakcji produktu z innymi produktami leczniczymi. Ponieważ kwas salicylowy wchłania się przez nieuszkodzony naskórek, produkt może oddziaływać z lekami działającymi ogólnie i miejscowo. Kwas salicylowy, jako lek silnie wiążący się z białkami krwi, wypiera z połączeń z białkami krwi leki o mniejszym powinowactwie, co prowadzi do nasilenia ich działania. Kwas salicylowy nasila działanie m.in. doustnych leków hipoglikemizujących z grupy pochodnych sulfonylomocznika, preparatów litu, leków przeciwzakrzepowych, może nasilać działanie fenytoiny i kwasu walproinowego. Leki metabolizowane przez cytochrom P-450, jak cymetydyna, hamują metabolizm kwasu salicylowego. Kwas salicylowy może osłabiać działanie leków hipotensyjnych, np. z grupy inhibitorów konwertazy angiotensyny oraz leków moczopędnych.
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Ciąża Kwas salicylowy przenika przez łożysko, dlatego produktu nie należy stosować u kobiet w ciąży. Karmienie piersi? Brak danych na temat bezpieczeństwa stosowania produktu u kobiet karmiących piersią.
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Maść przeciw odciskom i zgrubieniom skóry „Rekord Łuszczy” nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gDziałania niepożądane
4.8. Działania niepożądane Produkt może powodować miejscowe podrażnienie skóry, stan zapalny skóry, odczyny alergiczne i nadmierne wysuszenie skóry. Zastosowanie produktu na skórę zdrową, duże powierzchnie skóry lub błony śluzowe może powodować objawy podrażnienia w postaci rumienia. W przypadku przewlekłego stosowania leku mogą wystąpić ogólne działania niepożądane kwasu salicylowego. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al.
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gDziałania niepożądane
Jerozolimskie 181C, 02-222 Warszawa, Tel: + 48 22 49 21 301, Faks: + 48 22 49 21 309; strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gPrzedawkowanie
4.9. Przedawkowanie Brak danych dotyczących przedawkowania podczas stosowania zgodnie ze wskazaniami i sposobem stosowania.
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki dermatologiczne rozmiękczające i osłaniające. kod ATC: D 02 AF Kwas salicylowy stosowany miejscowo na zrogowaciały naskórek działa keratolitycznie oraz zmiękcza i rozpulchnia naskórek, ułatwiając jego złuszczanie.
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Wchłanianie Kwas salicylowy łatwo wchłania się do tkanek położonych pod powierzchnią skóry, maksymalne stężenie we krwi osiąga po 4-8 godzinach. Wchłanianie kwasu salicylowego przez prawidłowy naskórek istotnie zwiększa się po usunięciu lub uszkodzeniu warstwy rogowej. Około 10% zastosowanego miejscowo kwasu salicylowego ulega wchłonięciu do organizmu. Dystrybucja Salicylany po wchłonięciu do organizmu wiążą się z białkami krwi w 80%. Po zastosowaniu małych dawek terapeutycznych, salicylany w znacznym stopniu wiążą się z białkami osocza, natomiast w czasie stosowania dużych dawek frakcja niezwiązana istotnie się zwiększa. Kwas salicylowy po wchłonięciu do organizmu przenika do ośrodkowego układu nerwowego i przez łożysko, występuje też w ilościach śladowych we krwi płodu. Metabolizm Kwas salicylowy ulega przemianie do kwasu gentyzynowego (kwas 2,5-dihydroksybenzoesowy).
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gWłaściwości farmakokinetyczne
Ponadto kwas salicylowy jest metabolizowany przez połączenie z glicyną do kwasu salicylurowego i sprzęgany z kwasem glukuronowym. Wydalanie Metabolity kwasu salicylowego wydalane są głównie przez nerki, a 10%-50% kwasu salicylowego wydalane jest w postaci niezmienionej. Eliminacja zachodzi zgodnie z zasadami kinetyki pierwszorzędowej po podaniu małych dawek (T0,5=4 h) i kinetyki nieliniowej po zastosowaniu dawek dużych (T0,5>15 h). Z moczem wydalane jest około 7% dawki zastosowanego miejscowo kwasu salicylowego.
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Brak danych.
- CHPL leku Maść przeciw odciskom i zgrubieniom skóry Rekord Łuszczy, maść, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Wazelina żółta 6.2. Niezgodności farmaceutyczne Brak danych. 6.3. Okres ważności 3 lata Po pierwszym otwarciu opakowania – 2 lata. 6.4. Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać w miejscu niedostępnym i niewidocznym dla dzieci. 6.5. Rodzaj i zawartość opakowania. Tuba aluminiowa z zakrętką z polietylenu w tekturowym pudełku. 15 g maści. 6.6. Specjalne środki ostrożności dotyczące usuwania produktu leczniczego Bez specjalnych wymagań.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Sonol (21 mg + 21 mg + 2 mg)/1ml, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml leku zawiera: Substancje czynne Lewomentol (Levomentholum) 21 mg Kwas salicylowy (Acidum salicylicum) 21 mg Tymol (Thymolum) 2 mg Pełny wykaz substancji pomocniczych, patrz punkt 6.1. Substancje pomocnicze o znanym działaniu: glikol propylenowy. 3. POSTAĆ FARMACEUTYCZNA Płyn na skórę.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlWskazania do stosowania
4.1 Wskazania do stosowania Produkt Sonol jest wskazany jako środek pomocniczy do stosowania w leczeniu chorób infekcyjnych skóry.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Młodzież powyżej 12 lat i dorośli: Stosować początkowo 4-5 razy na dobę, gdy nastąpi poprawa 2-3 razy na dobę. Dzieci: Nie stosować u dzieci w wieku poniżej 12 lat. Sposób podawania Płyn na skórę. Produkt przeznaczony wyłącznie do stosowania zewnętrznego. Miejsca swędzące i wykwity na wargach smarować cienko i równomiernie.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na składniki produktu lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować na otwarte rany, błony śluzowe i skórę uszkodzoną. Nie stosować u dzieci poniżej 12 lat. Nie stosować w przypadku rozległych zmian złuszczających (np. w łuszczycy).
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenie i środki ostrożności dotyczące stosowania W przypadku wystąpienia nadwrażliwości na którykolwiek ze składników produktu (utrzymujące się zaczerwienienie skóry) należy przerwać stosowanie produktu i skontaktować się z lekarzem. Ponieważ kwas salicylowy bardzo łatwo wchłania się w przez skórę nie powinien być stosowany na dużych obszarach skóry przez długi czas, szczególnie u dzieci. Tymol podany doustnie wchłania się z jelit i pobudza ruchy robaczkowe. Wydala się przez nerki. Może działać drażniąco na nerki i powodować białkomocz. W ostrych zatruciach występują objawy ze strony przewodu pokarmowego. Glikol propylenowy może powodować podrażnienie skóry.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Nie stosować z innymi preparatami zawierającymi składniki złuszczające, np. rezorcynol, siarkę, ponieważ może wystąpić podrażnienie skóry. Preparatów zawierających kwas salicylowy nie powinno się stosować razem z preparatami przeciwtrądzikowymi lub zawierającymi czynniki pilingujące (np. rezorcynol, siarkę) ze względu na możliwość podrażnienia skóry.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie stosować u kobiet w ciąży, jeśli nie jest to bezwzględnie konieczne. Karmienie piersi? Nie stosować u kobiet karmiących piersią, jeśli nie jest to bezwzględnie konieczne.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Sonol nie ma wpływu na zdolności prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane leku przedstawiono zgodnie z klasyfikacją narządów i układów wg MedDRA oraz częstością występowania: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000); nieznana ( nie może być określona na podstawie dostępnych danych). Zaburzenia skóry i tkanki podskórnej: Częstość nieznana: Podrażnienie skóry.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlPrzedawkowanie
4.9 Przedawkowanie Opisano 1 przypadek intoksykacji kwasem salicylowym u pacjenta z dużymi zmianami łuszczycowymi. Kwas salicylowy łatwo wchłania się przez skórę i przedawkowany wywołuje objawy zatrucia salicylanami objawiające się zawrotami głowy, szumem w uszach, wymiotami, bólami głowy, zaburzeniami świadomości. Po dużych dawkach mogą wystąpić ciężkie zatrucia z objawami porażenia ośrodka oddechowego, gorączką, osłabieniem, kwasicą ketonową. Może również dojść do uszkodzenia centralnego układu nerwowego, układu oddechowego i krążenia. Szczególnie narażone na jego działanie są dzieci.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna, kod ATC: nie przydzielony. Zawarty w produkcie lewomentol posiada właściwości bakteriobójcze, znieczulające i przeciwświądowe. Tymol i kwas salicylowy wzmagają je i zapobiegają namnażaniu się bakterii i potęgują antyseptyczne działanie leku. Tymol posiada właściwości przeciwwirusowe, w tym wykazano jego działanie hamujące na rozwój infekcji wywołanej wirusem opryszczki pospolitej HHV-1 (HSV-1, herpes labialis - opryszczka wargowa).
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Lek bardzo słabo wchłania się przez nieuszkodzoną skórę. Za wyjątkiem kwasu salicylowego pozostałe składniki leku nie są wchłaniane.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach wykazano, że lewomentol działa hepatoksycznie. Podawany szczurom dożołądkowo przez 28 dni powodował uszkodzenie wątroby. W badaniach na zwierzętach wykazano, iż salicylany łatwo przenikają przez łożysko i działają teratogennie. Brak danych dotyczących stosowania preparatów kwasu salicylowego w okresie ciąży i karmienia piersią u ludzi. Potencjalne zagrożenie dla człowieka nie jest znane.
- CHPL leku Sonol, płyn na skórę, (21 mg + 21 mg + 2 mg)/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych glikol propylenowy 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w pomieszczeniach suchych, w temperaturze poniżej 25 °C, chronić od światła. 6.5 Rodzaje i zawartość opakowania Butelka (HDPE) zakończona zamknięciem typu roll-on i zakrętką (PP) oraz obejmą z kulką (LDPE, PP) w tekturowym pudełku. Dostępne opakowanie po 8 g. 6.6 Specjalne środki ostrożności dotyczące usuwania produktu leczniczego Brak szczególnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZGO Medispirant stepspray, (10 mg + 10 mg + 20 mg)/g, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu na skórę zawiera 10 mg mentolu (Mentholum), 10 mg kwasu salicylowego (Acidum salicylicum) i 20 mg metenaminy (Methenaminum). Substancja pomocnicza o znanym działaniu: 1 g płynu zawiera 376,04 mg etanolu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Płyn na skórę Roztwór etanolowy, przezroczysty, optycznie jednorodny o zapachu charakterystycznym dla składników.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy przeznaczony jest do stosowania zewnętrznego na skórę, w przypadku nadmiernego pocenia się stóp.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i młodzież w wieku powyżej 12 lat: przez kilka dni spryskiwać stopy płynem, najlepiej wieczorem po umyciu nóg. Sposób podawania Podanie na skórę.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować produktu leczniczego na uszkodzoną skórę. Nie stosować u dzieci w wieku poniżej 12 lat. Nie stosować produktu leczniczego długotrwale i na duże powierzchnie skóry. Nie stosować na błony śluzowe.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy przerwać stosowanie produktu leczniczego przy skłonnościach do uczuleń. Należy unikać kontaktu z błonami śluzowymi oczu, ust i nosa. W razie potrzeby zmyć produkt leczniczy ze skóry lub błon śluzowych wodą. Specjalne ostrzeżenia dotyczące substancji pomocniczych Etanol Ten produkt leczniczy zawiera 376,04 mg alkoholu (etanolu) w każdym 1 g płynu. Produkt leczniczy może powodować pieczenie uszkodzonej skóry. Produkt leczniczy łatwopalny. Nie stosować w pobliżu otwartego ognia, zapalonego papierosa lub niektórych urządzeń (np. suszarki do włosów).
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Dotychczas nie stwierdzono.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ze względu na brak danych dotyczących bezpieczeństwa, nie zaleca się stosowania produktu leczniczego w okresie ciąży i karmienia piersią.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Medispirant stepspray nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gDziałania niepożądane
4.8 Działania niepożądane W trakcie stosowania produktu leczniczego mogą wystąpić reakcje uczuleniowe skóry. W przypadku wystąpienia takich objawów należy zaprzestać stosowania produktu leczniczego. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: +48 22 49 21 301 Fax: +48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gPrzedawkowanie
4.9 Przedawkowanie Brak danych na temat przedawkowania produktu leczniczego stosowanego miejscowo. W przypadku zaobserwowania jakichkolwiek niepokojących objawów należy zaprzestać stosowania produktu leczniczego i skontaktować się z lekarzem.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: środki przeciw nadmiernemu poceniu się Kod ATC: D 11 AX Produkt leczniczy stosowany zewnętrznie na skórę stóp. Zmniejsza nadmierne wydzielanie potu poprzez hamowanie aktywności gruczołów potowych. Likwiduje przykry zapach potu poprzez hamowanie rozwoju bakterii. Działa dezynfekująco, przeciwgrzybiczo, przeciwzapalnie i wysuszająco. Pobudza zakończenia nerwów czuciowych, wywołując uczucie chłodu. Wykazuje łagodne miejscowe działanie znieczulające, zmniejsza dolegliwości objawiające się świądem skóry.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Brak danych.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Przeprowadzone badania aplikacyjne wykazały, że produkt leczniczy nie wywiera efektu drażniącego, ani alergizującego w obrębie skóry poddanej aplikacji, jak i w miejscach odległych.
- CHPL leku Medispirant stepspray, płyn na skórę, (10 mg + 10 mg + 20 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Etanol 96% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Butelka polietylenowa (HDPE) z pompką rozpylającą, składająca się z materiałów: polipropylen (PP), polietylen (LDPE, LDPE/HDPE, LDPE(EPE)), polioksymetylen (POM), szkło bezbarwne oraz stal w tekturowym pudełku z ulotką dla pacjenta. 1 op. – 100 g 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO HASCERAL, (100 mg + 50 mg)/g, maść 2. SKŁAD JAKOŚCIOWY i ILOŚCIOWY 1 g maści zawiera: Mocznik (Urea) 100 mg Kwas salicylowy (Acidum salicylicum) 50 mg Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść Maść barwy białej lub lekko kremowej.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Wskazaniami do stosowania produktu Hasceral są choroby przebiegające z zaburzeniem rogowacenia – rybia łuska, łuszczyca, łupież czerwony mieszkowy, nadmierne rogowacenie dłoni i stóp oraz rogowacenie mieszkowe, ponadto: alergiczny i niealergiczny wyprysk dłoni, neurodermit, atopowe zapalenie skóry oraz stany nadmiernego wysuszenia skóry o różnej etiologii.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Maść wcierać w zmienione chorobowo miejsca na skórze 1 do 2 razy na dobę. Stosować przez kilka lub kilkanaście dni, przy dłuższym stosowaniu wprowadzić przerwy. Produkt zmywa się pod wpływem ciepłej wody, dlatego po umyciu należy ponownie nałożyć maść. Sposób podawania Podanie na skórę.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stosować na uszkodzoną skórę oraz w okolicy oczu i błon śluzowych. Nie stosować maści na większe powierzchnie skóry, a jedynie miejscowo.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Brak danych.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ze względu na wchłanianie przez skórę, preparaty zawierające kwas salicylowy nie powinny być stosowane na duże powierzchnie skóry u kobiet w ciąży oraz karmiących piersią.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brak danych dotyczących wpływu produktu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gDziałania niepożądane
4.8 Działania niepożądane Zastosowanie produktu zgodnie z opisanym dawkowaniem i wskazaniami nie wiąże się z istotnym ryzykiem wystąpienia działań niepożądanych. Niekiedy może wystąpić miejscowe podrażnienie skóry. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Aleje Jerozolimskie 181C, 02 - 222 Warszawa tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309 e-mail: ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gPrzedawkowanie
4.9 Przedawkowanie Nie zgłoszono żadnego przypadku przedawkowania.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: preparaty keratolityczne i działające ochronnie, preparaty kwasu salicylowego, kod ATC: D02AF. Kwas salicylowy w stężeniu 5 % wywołuje złuszczanie komórek naskórka (korneocytów warstwy rogowej). Efekt jego działania jest dwukierunkowy. Polega na redukowaniu przylegania komórek rogowych przez rozpuszczenie substancji międzykomórkowej oraz zmniejszeniu pH w warstwie rogowej, co sprzyja nawodnieniu i zmiękczeniu naskórka. W efekcie dochodzi do utraty spójności między komórkami, ich oddzielania i złuszczania. 10% mocznik w podłożu maściowym wywołuje efekt keratolityczny, co prowadzi do ścieńczenia warstwy rogowej naskórka i jego złuszczania. Zmniejszenie spójności keratynocytów i rozmiękczanie nadmiernie zrogowaciałych warstw naskórka polega dodatkowo na zwiększaniu jego uwodnienia przez mocznik, co związane jest głównie z zależnymi od niskiej masy cząsteczkowej właściwościami osmotycznymi tego związku.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gWłaściwości farmakodynamiczne
Ponadto mocznik odnawia płaszcz ochronny skóry, co w znaczącym stopniu ogranicza zwrotną utratę wody przez powłoki skórne. Kwas salicylowy i mocznik poprzez zmianę pH na powierzchni skóry działają również przeciwbakteryjnie i przeciwgrzybiczo.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Brak jest danych na temat badań klinicznych preparatów zawierających kwas salicylowy i mocznik. Zarówno jednak kwas salicylowy, jak i mocznik aplikowane na powłoki skórne, ulegają absorpcji do naskórka, skąd są eliminowane wraz ze złuszczającymi się warstwami. Resorpcja kwasu salicylowego i mocznika przez skórę, nie ma znaczenia klinicznego przy ograniczonym stosowaniu na nieuszkodzoną skórę. Śladowe ilości zresorbowanego kwasu salicylowego są wydalane przez nerki z moczem.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Nie przeprowadzono nieklinicznych badań dotyczących bezpieczeństwa stosowania produktu Hasceral. Brak jest danych nieklinicznych dotyczących pełnej oceny bezpieczeństwa kwasu salicylowego i mocznika po miejscowym i krótkotrwałym zastosowaniu w postaciach przeznaczonych do użytku zewnętrznego.
- CHPL leku Hasceral, maść, (100 mg + 50 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Polisorbat 40 Sorbitanu trójoleinian Samoemulgujący monostearynian glicerolu Glicerol Wazelina biała 6.2 Niezgodności farmaceutyczne Nie stwierdzono. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu, w temperaturze poniżej 25ᵒC. 6.5 Rodzaj i zawartość opakowania Tuba aluminiowa zamykana zakrętką z polietylenu, zawierająca 50 g produktu leczniczego, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Viprosal B, maść, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO VIPROSAL B 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g maści zawiera: substancja czynna: 0,05 j.m. jadu żmii zygzakowatej, 30 mg kamfory racemicznej (Camphora racemica), 30 mg olejku terpentynowego z sosny nadmorskiej (Terebinthini aetheroleum), 10 mg kwasu salicylowego (Acidum salicylicum). substancje pomocnicze: alkohol cetostearylowy Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść Biała lub nieznacznie żółtawa maść o zapachu kamfory i terpentyny.
- CHPL leku Viprosal B, maść, -Wskazania do stosowania
4.1 Wskazania do stosowania Maść jest tradycyjnie stosowana zewnętrznie jako środek przeciwbólowy do uśmierzania bólów neuralgicznych i stawowych.
- CHPL leku Viprosal B, maść, -Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie: Niewielką ilość maści (5 do 10 g czyli około 1 do 2 łyżeczek od herbaty, w zależności od leczonej powierzchni) stosuje się na bolesne miejsca i wmasowuje w skórę raz lub dwa razy dziennie, zależnie od intensywności bólu, aż do jego ustąpienia. Czas trwania leczenia zależy od natury i ciężkości choroby. Nie ma doświadczenia dotyczącego stosowania u dzieci (patrz punkt 4.4). Sposób podawania: Do stosowania miejscowego na skórę
- CHPL leku Viprosal B, maść, -Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą maści; skóra owrzodzona lub dotknięta innymi schorzeniami; zaburzenia krążenia mózgowego i wieńcowego; skłonności do skurczów naczyń; ciężkie uszkodzenia czynnościowe wątroby lub nerek.
- CHPL leku Viprosal B, maść, -Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Maści Viprosal B nie należy stosować na uszkodzoną powierzchnię skóry. W celu zapobieżenia silnym podrażnieniom należy chronić oczy i unikać kontaktu z błoną śluzową. W celu uniknięcia objawów niepożądanych należy przed zastosowaniem leku określić wrażliwość skóry poprzez naniesienie małej ilości maści na małą powierzchnię skóry. Z uwagi na brak danych dotyczących stosowania u dzieci lub nastolatków, nie zaleca się stosowania leku w tych grupach. Maść VIPROSAL B zawiera jako substancję pomocniczą alkohol cetostearylowy, który wykazuje działanie biologiczne. Ze względu na ich zawartość lek może powodować miejscową reakcję skórną (np. kontaktowe zapalenie skóry).
- CHPL leku Viprosal B, maść, -Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Viprosal B, maść, -Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Brak jest wystarczających danych dotyczących stosowania substancji czynnej leku u kobiet w ciąży i karmiących piersią. Z powodu braku danych na temat bezpieczeństwa stosowania leku nie należy stosować w ciąży ani w czasie karmienia piersią.
- CHPL leku Viprosal B, maść, -Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn VIPROSAL B nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Viprosal B, maść, -Działania niepożądane
4.8 Działania niepożądane Poniższe działania niepożądane zostały przedstawione wg. częstości i uporządkowania grup układowo-narządowych zgodnie z terminologią MedDRA: bardzo częste (≥1/10), nieznana (nie może być ustalona na podstawie dostępnych danych). Zaburzenia skóry i tkanki podskórnej Bardzo częste: Zapalenie skóry, Wysuszenie skóry, miejscowe złuszczenie skóry, rumień, świąd, wysypka rumieniowata, kruchość skóry (ryzyko uszkodzeń mechanicznych), nadżerki, owrzodzenia Zaburzenia układu odpornościowego: Nieznana. W przypadku nadwrażliwości skóry na składniki maści, zastosowanie jej może spowodować swędzenie, obrzęk lub pokrzywkę. W takim przypadku zaleca się zaprzestanie leczenia i zmycie maści ze skóry. Opisane powyżej objawy znikają po zaprzestaniu leczenia.
- CHPL leku Viprosal B, maść, -Przedawkowanie
4.9 Przedawkowanie Nie zgłoszono żadnego przypadku przedawkowania. Przedawkowanie może powodować podrażnienia skóry. Maść powoduje mocne podrażnienia, jeżeli stosowana jest na błony śluzowe. Niewłaściwe zastosowanie: W sytuacji przypadkowego połknięcia natychmiast należy skontaktować się z lekarzem. Połknięcie maści mogę spowodować objawy ze strony przewodu pokarmowego takie, jak wymioty i biegunka. Leczenie jest objawowe. Ostre zatrucie obserwowano po znaczącym, przypadkowym spożyciu, co objawiało się nudnościami, wymiotami, bólami brzucha i głowy, zawrotami głowy, uderzeniami zimna i gorąca, drgawkami, zapaścią oddechową i śpiączką. Pacjenci z poważnymi objawami neurologicznymi lub objawami zatrucia powinny być obserwowani i leczeni objawowo. Nie należy wywoływać wymiotów.
- CHPL leku Viprosal B, maść, -Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki do stosowania miejscowego w bólach stawów i mięśni, kod ATC: M02AX10. Główną substancją czynną maści jest jad żmii (Vipera berus berus L.) zawierający fosfolipazę, fosfodiesterazę, hialuronidazę i inne składniki czynne. Jad żmii zawiera ponadto peptydy o specyficznych właściwościach powodujących hemolizę, zwiększoną przepuszczalność naczyń włosowatych i działających na krzepnięcie krwi. Stosowany miejscowo jad żmii działa drażniąco i przeciwbólowo, po wchłonięciu aktywuje mechanizmy obronne organizmu. Maść VIPROSAL B zawiera również składniki powodujące łagodny terapeutyczny odczyn zapalny, działające miejscowo drażniąco i przeciwbólowo. Miejscowe podrażnienie skóry powoduje zmiany i selektywne zmniejszenie zaopatrzenia w krew i substancje odżywcze organów wewnętrznych unerwianych przez ten sam odcinek kręgowy.
- CHPL leku Viprosal B, maść, -Właściwości farmakodynamiczne
Podrażnienie wywołuje w odpowiednim odcinku kręgowym uzupełniającą aktywację systemu antynocyceptywnego, co zapobiega docieraniu wstępnych bodźców bólowych do kory mózgowej i zapobiega odczuwaniu bólu.
- CHPL leku Viprosal B, maść, -Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Substancje czynne maści szybko ulęgają absorpcji powodując w ciągu kilku minut wrażenie kłucia, niewielkie przekrwienie skóry i uczucie ciepła. Działanie przeciwbólowe występuje w ciągu 20-30 minut od zastosowania i utrzymuje się do 1,5 do 2 godzin.
- CHPL leku Viprosal B, maść, -Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne nie ujawniają występowania szczególnego zagrożenia dla człowieka.
- CHPL leku Viprosal B, maść, -Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Wazelina biała alkohol cetostearylowy parafina stała sodu cetostearylosiarczan glicerol sodu chlorek woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywaniu Przechowywać w temperaturze poniżej 25˚C. Nie przechowywać w lodówce ani nie zamrażać. 6.5 Rodzaj i zawartość opakowania 50 g maści w aluminiowej tubie umieszczonej w tekturowym pudełku. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Dernilan, krem, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Dernilan, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g kremu zawiera: 1 g kamfory racemicznej (Camphora racemica) 300 mg alantoiny (Allantoinum) 250 mg nikotynamidu (Nicotinamidum) 100 mg kwasu salicylowego (Acidum salicylicum) Substancje pomocnicze o znanym działaniu: metylu parahydroksybenzoesan, propylu parahydroksybenzoesan, alkohol stearylowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem
- CHPL leku Dernilan, krem, -Wskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy stosuje się w przypadkach bolesnych i głębokich pęknięć zgrubiałego i zrogowaciałego naskórka, w pielęgnacji skóry stóp i rąk.
- CHPL leku Dernilan, krem, -Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Skórę stóp i rąk smarować kremem od 3 do 4 razy na dobę. Krem lekko wmasować, co kilka dni stopy lub ręce wymoczyć i usunąć zrogowaciały naskórek. Po wygojeniu zmian produkt stosować 1 do 2 razy na dobę po umyciu stóp i rąk. Dzieci i młodzież Produktu leczniczego Dernilan nie należy stosować u dzieci w wieku poniżej 12 lat.
- CHPL leku Dernilan, krem, -Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną (kamforę racemiczną, alantoinę, nikotynamid lub kwas salicylowy) lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować produktu leczniczego na rozległe obszary uszkodzonej skóry oraz na błony śluzowe.
- CHPL leku Dernilan, krem, -Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt zawiera metylu parahydroksybenzoesan i propylu parahydroksybenzoesan i dlatego może powodować reakcje alergiczne (możliwe reakcje typu późnego). Produkt zawiera alkohol stearylowy i dlatego może powodować miejscową reakcję skórną (np. kontaktowe zapalenie skóry).
- CHPL leku Dernilan, krem, -Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Brak danych na temat interakcji alantoiny, nikotynamidu i kamfory stosowanych miejscowo na skórę. Kwas salicylowy występujący w kremie może nasilać działanie terapeutyczne innych niesteroidowych leków przeciwzapalnych.
- CHPL leku Dernilan, krem, -Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie zaleca się stosowania u kobiet w okresie ciąży. Karmienie piersi? Nie zaleca się stosowania u kobiet w okresie karmienia piersią. Płodność Brak danych na temat wpływu produktu na płodność.
- CHPL leku Dernilan, krem, -Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Dernilan krem nie ma wpływu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn.
- CHPL leku Dernilan, krem, -Działania niepożądane
4.8 Działania niepożądane Działania niepożądane przedstawiono zgodnie z klasyfikacją narządów i układów wg MedDRA oraz częstością występowania: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000); nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia skóry i tkanki podskórnej częstość nieznana: alergiczne reakcje skórne, miejscowe podrażnienia. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al.
- CHPL leku Dernilan, krem, -Działania niepożądane
Jerozolimskie 181C, 02-222 Warszawa, nr tel.: (22) 49-21-301, nr faksu: (22) 49-21-309, e-mail: ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Dernilan, krem, -Przedawkowanie
4.9 Przedawkowanie Nie zgłoszono dotychczas żadnego przypadku przedawkowania.
- CHPL leku Dernilan, krem, -Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki dermatologiczne. Brak kodu ATC. Alantoina pobudza wzrost komórek, stymuluje proces różnicowania i regeneracji. Działa przeciwzapalnie i ściągająco, ułatwia oczyszczanie ran. Przyspiesza ziarninowanie i odbudowę naskórka. Wywołuje długotrwały efekt keratoplastyczny w warstwie rogowej naskórka w postaci zmiękczenia i wygładzenia powierzchni skóry. Nikotynamid odgrywa ważną rolę w utrzymaniu prawidłowego stanu skóry, poprawia ukrwienie skóry i jest niezbędny do prawidłowego rogowacenia naskórka. Kwas salicylowy stosowany w obrębie zrogowaciałego naskórka powoduje rozpulchnienie keratyny, zmiękczenie, macerację a następnie złuszczanie. Efekt keratoplastyczny, poprzedzony rozluźnieniem połączeń międzykomórkowych, normalizuje rogowacenie naskórka w miejscu stosowania tej substancji. W ten sposób usuwane są zbędne warstwy zrogowaciałych komórek naskórka.
- CHPL leku Dernilan, krem, -Właściwości farmakodynamiczne
Kamfora zastosowana zewnętrznie zwęża rozszerzone naczynia włosowate, natomiast rozkurcza zwężone naczynia skórne. Wywiera wpływ rozgrzewający, drażniący. Działa bakteriobójczo, wywołuje subiektywne odczucie zmniejszenia bólu, powoduje przekrwienie skóry. W wyniku skojarzonego działania wymienionych substancji czynnych produkt Dernilan działa gojąco i przeciwzapalnie, przyspiesza ziarninowanie oraz ułatwia usuwanie zgrubiałego, zrogowaciałego naskórka ze stóp i rąk.
- CHPL leku Dernilan, krem, -Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Produkt leczniczy Dernilan, krem stosowany na skórę wykazuje działanie miejscowe. Efekt terapeutyczny spodziewany jest w miejscu nałożenia kremu. Nie prowadzono badań nad właściwościami farmakokinetycznymi substancji czynnych produktu Dernilan krem. Teoretycznie wszystkie substancje czynne wchłaniają się przez skórę w ograniczonej ilości, zapewniającej efekt kliniczny.
- CHPL leku Dernilan, krem, -Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Toksyczność po podaniu wielokrotnym Na podstawie dostępnego piśmiennictwa fachowego została wykluczona toksyczność po podaniu wielokrotnym alantoiny, nikotynamidu, kamfory oraz kwasu salicylowego. Alantoina i nikotynamid charakteryzują się dobrą tolerancją miejscową, nie wykazują działania pierwotnie drażniącego, alergizującego i fototoksycznego. Kamfora natomiast stosowana miejscowo na skórę może powodować działanie drażniące o umiarkowanym nasileniu. Objawy w postaci uczucia pieczenia i mrowienia są krótkotrwałe. Roztwory etanolowe kwasu salicylowego o stężeniu 1–20%, stosowane miejscowo na skórę wykazywały działanie pierwotnie drażniące. Brak danych świadczących o rakotwórczych i mutagennych właściwościach alantoiny, nikotynamidu, kwasu salicylowego i kamfory.
- CHPL leku Dernilan, krem, -Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Makrogolu eter cetostearylowy Glicerolu monostearynian Oktylu stearynian Alkohol stearylowy Triglicerydy nasyconych kwasów tłuszczowych o średniej długości łańcucha Decylu oleinian Parafina ciekła Glicerol (E 422) Karbomer Metylu parahydroksybenzoesan Propylu parahydroksybenzoesan Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25C. 6.5 Rodzaj i zawartość opakowania Tuba aluminiowa wewnątrz lakierowana, zamknięta membraną, z zakrętką z polietylenu, zawierająca 35 g kremu, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań dotyczących usuwania.
- CHPL leku Dernilan, krem, -Dane farmaceutyczne
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO BELOSALIC, (0,5 mg + 30 mg)/g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden gram maści zawiera substancje czynne: 0,5 mg betametazonu (Betamethasonum) w postaci betametazonu dipropionianu i 30 mg kwasu salicylowego (Acidum salicylicum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Belosalic w postaci maści jest wskazany w miejscowym leczeniu chorób skóry przebiegających z nadmiernym rogowaceniem, suchością i stanem zapalnym, reagujących na miejscowe leczenie kortykosteroidami.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Belosalic w maści jest przeznaczony tylko do stosowania na skórę. Dawkowanie Dorośli i dzieci w wieku powyżej 12 lat: Cienką warstwę produktu należy lekko wcierać w chorobowo zmienione miejsca na skórze dwa razy na dobę. W lżejszych przypadkach wystarcza rzadsze stosowanie. Nie stosować dłużej niż przez 14 dni. Dzieci: Nie zaleca się stosowania produktu u dzieci w wieku poniżej 12 lat.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować produktu leczniczego Belosalic w maści: w gruźlicy skóry, w zakażeniach wirusowych skóry (np. opryszczka zwykła, ospa bydlęca, ospa wietrzna), w trądziku, zapaleniu skóry wokół ust, trądziku różowatym, w okolicy odbytu i narządów płciowych, w pieluszkowym zapaleniu skóry, w grzybiczych lub bakteryjnych zakażeniach skóry, o ile jednocześnie nie wdrożono odpowiedniego leczenia przyczynowego.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie należy stosować produktu Belosalic w maści na owłosioną skórę głowy. Jeśli po zastosowaniu produktu Belosalic w maści wystąpi skórna reakcja alergiczna (świąd, pieczenie lub zaczerwienienie skóry), należy go natychmiast odstawić. Nie należy stosować okładów i opatrunków zamkniętych, gdyż mogą nasilać wchłanianie kortykosteroidu przez skórę (patrz punkty 4.8. i 4.9.). Unikać kontaktu produktu z oczami i błonami śluzowymi. Nie stosować do oczu ani wokół oczu. Nie zaleca się stosowania na skórę twarzy, ze względu na ryzyko zapalenia skóry (podobnego do zmian trądzikopodobnych), zapalenia skóry wokół ust, zaniku skóry i trądziku. W przypadku zakażenia skóry należy zastosować leczenie produktami leczniczymi przeciwbakteryjnymi lub przeciwgrzybiczymi.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gSpecjalne środki ostrozności
Ze względu na to, że kortykosteroidy i kwas salicylowy wchłaniają się przez skórę, podczas stosowania produktu Belosalic w maści istnieje ryzyko wystąpienia ogólnoustrojowych objawów niepożądanych kortykosteroidów (w tym zahamowanie czynności kory nadnerczy) oraz kwasu salicylowego. Z tego względu należy unikać stosowania produktu na dużą powierzchnię ciała, uszkodzoną skórę, stosowania w dużych dawkach, długotrwałego leczenia produktem, stosowania u pacjentów z zaburzeniami czynności wątroby i u dzieci (patrz punkty 4.8. i 4.9.). Na skórę pach i pachwin stosować Belosalic w maści tylko w przypadkach bezwzględnie koniecznych, z uwagi na zwiększone wchłanianie. Szczególnie ostrożnie należy stosować Belosalic w maści u pacjentów z łuszczycą, gdyż miejscowe stosowanie kortykosteroidów w łuszczycy może być niebezpieczne, m.in.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gSpecjalne środki ostrozności
ze względu na nawrót choroby spowodowany rozwojem tolerancji, ryzyko wystąpienia uogólnionej łuszczycy krostkowej i ogólne działania toksyczne spowodowane zaburzeniem czynności skóry. Dzieci i młodzież Nie zaleca się stosowania produktu Belosalic w maści u dzieci w wieku poniżej 12 lat, ze względu na ryzyko zahamowania czynności osi podwzgórze–przysadka–nadnercza, zespołu Cushinga oraz wzrostu ciśnienia wewnątrzczaszkowego po miejscowym stosowaniu silnie działających kortykosteroidów. Zaburzenie widzenia Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie są znane interakcje z innymi produktami leczniczymi stosowanymi miejscowo. Jednoczesne stosowanie miejscowe produktów kosmetycznych lub dermatologicznych używanych w leczeniu trądziku, produktów zawierających środki złuszczające lub etanol oraz mydeł o działaniu wysuszającym może nasilać podrażnienie skóry.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych lub istnieją tylko ograniczone dane dotyczące stosowania betametazonu dipropionianu i kwasu salicylowego u kobiet w okresie ciąży. Wiadomo jednak, że substancje te mogą się wchłaniać przez skórę. W badaniach na zwierzętach laboratoryjnych wykazano teratogenne działanie doustnie stosowanego kwasu salicylowego i silnych kortykosteroidów stosowanych na skórę (patrz punkt 5.3). Stosowanie produktu Belosalic w maści u ciężarnych kobiet dozwolone jest jedynie w przypadkach, w których korzyść dla ciężarnej kobiety wynikająca ze stosowania produktu przewyższa ryzyko dla płodu. Stosowanie produktu powinno jednak być krótkotrwałe i ograniczać się do małej powierzchni ciała. Karmienie piersi? Nie wiadomo, czy miejscowo stosowane kortykosteroidy, w tym betametazonu dipropionian wchłaniają się przez skórę w takim stopniu, że mogą przenikać do mleka kobiet karmiących piersią.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gWpływ na płodność, ciążę i laktację
Istnieją dane o tym, że ogólnie działające kortykosteroidy przenikają do mleka. Kwas salicylowy po zastosowaniu na skórę może wchłaniać się do organizmu. Należy podjąć decyzję czy przerwać karmienie piersią czy przerwać podawanie produktu Belosalic w maści biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Produktu nie należy stosować na skórę piersi przed karmieniem piersią.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Belosalic w maści nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gDziałania niepożądane
4.8 Działania niepożądane Miejscowe stosowanie betametazonu dipropionianu może spowodować zanikowe zmiany skóry, nieodwracalne rozstępy, suchość skóry, rozszerzenie drobnych tętniczek, zapalenie mieszków włosowych, nadmierne owłosienie, zmiany trądzikopodobne, alergiczne kontaktowe zapalenie skóry (pieczenie, obrzęk i zapalne pęcherzyki na skórze), zapalenie skóry wokół ust, swędzenie, odbarwienie skóry, hamowanie czynności gruczołów potowych (potówka) oraz wystąpienie wtórnych zakażeń. Miejscowe stosowanie kwasu salicylowego może spowodować zapalenie skóry. W wyniku wchłaniania substancji czynnych do krwi mogą również wystąpić ogólne działania niepożądane betametazonu i kwasu salicylowego (patrz punkt 4.9). Ogólne objawy niepożądane występują rzadko (≥1/10 000 do <1/1 000), przede wszystkim w przypadku długotrwałego stosowania produktu, stosowania na dużą powierzchnię skóry, pod okładem zamkniętym oraz stosowania u dzieci i zwykle ustępują po zaprzestaniu stosowania produktu.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gDziałania niepożądane
Zaburzenia oka Częstość nieznana (nie może być określona na podstawie dostępnych danych): podczas stosowania kortykosteroidów obserwowano nieostre widzenie (patrz także punkt 4.4.). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa Tel.: (22) 49 21 301 Faks: (22) 49 21 309 strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gPrzedawkowanie
4.9 Przedawkowanie Podczas stosowania produktu przez dłuższy czas (powyżej 2 tygodni), stosowania na dużych powierzchniach skóry lub na uszkodzoną skórę, w razie stosowania okładów zamkniętych oraz w przypadku stosowania u dzieci, w wyniku nasilonego wchłaniania substancji czynnych do układu krążenia, może dojść do ich przedawkowania i wystąpienia ogólnych objawów niepożądanych kortykosteroidów i kwasu salicylowego. Objawy przedawkowania charakterystyczne dla kortykosteroidów, to m.in. zahamowanie czynności osi podwzgórze–przysadka–nadnercza, zespół Cushinga, łagodne nadciśnienie wewnątrzczaszkowe, hamowanie wzrostu i rozwoju u dzieci, hiperglikemia i cukromocz. Objawy przedawkowania kwasu salicylowego, to m.in. bladość, zmęczenie, senność, hiperwentylacja z przyspieszonym oddechem, mdłości, wymioty, zaburzenia słuchu, dezorientacja. W przypadku przedawkowania należy zaprzestać stosowania produktu Belosalic w maści. Leczenie jest objawowe.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gPrzedawkowanie
Jeśli wystąpią objawy takie, jak: gorączka, bóle mięśniowe, bóle stawowe oraz ogólne osłabienie, należy rozważyć zastosowanie kortykosteroidu w postaci o działaniu ogólnym.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: kortykosteroidy do stosowania miejscowego o silnym działaniu, w skojarzeniu z innymi lekami, kod ATC: D07X C01. Belosalic w maści do stosowania na skórę zawiera kortykosteroid o silnym działaniu – betametazonu dipropionian oraz kwas salicylowy. Mechanizm działania Betametazonu dipropionian, syntetyczny fluorowany kortykosteroid do stosowania miejscowego w dermatologii, działa silnie przeciwzapalnie, przeciwświądowo i obkurczająco na naczynia krwionośne. Dokładny mechanizm działania miejscowo stosowanych kortykosteroidów jest nieznany. Działanie obkurczające naczynia krwionośne zmniejsza przenikanie kortykosteroidu do surowicy. Kwas salicylowy w wyniku działania keratolitycznego działa złuszczająco i ułatwia przenikanie kortykosteroidu do skóry.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Na stopień przenikania przez skórę miejscowo zastosowanego betametazonu dipropionianu i kwasu salicylowego mają wpływ liczne czynniki takie, jak podłoże maści, stan naskórka oraz stosowanie okładu zamkniętego. Wchłanianie kortykosteroidów mogą nasilać procesy zapalne skóry lub stosowanie okładów zamkniętych. Kortykosteroidy w większym stopniu wchłaniają się przez uszkodzoną skórę. Miejscowo stosowane kortykosteroidy po wchłonięciu przez skórę wykazują podobne właściwości farmakokinetyczne jak kortykosteroidy stosowane w postaci o działaniu ogólnoustrojowym. Kortykosteroidy po podaniu na skórę wchłaniają się w 12-14%. Dystrybucja Mniej więcej 64% betametazonu wiąże się z białkami osocza, a objętość dystrybucji wynosi 1,4 l/kg mc. Metabolizm i eliminacja Betametazon jest metabolizowany w wątrobie, a jego metabolity są wydalane przede wszystkim z moczem.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gWłaściwości farmakokinetyczne
Kwas salicylowy po zastosowaniu na skórę pod okładem okluzyjnym osiąga maksymalne stężenia w osoczu w ciągu 5 godzin. Z moczem w niezmienionej postaci wydala się około 6% wchłoniętej ilości kwasu salicylowego. Największa ilość kwasu salicylowego wydala się w postaci metabolitów.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Toksyczność po jednokrotnym zastosowaniu. W badaniach na myszach i szczurach zanotowano następujące LD50 po zastosowaniu doustnym: betametazonu dipropionianu: LD50 u szczurów: 4 g/kg mc. LD50 u myszy: 5 g/kg mc. kwasu salicylowego: LD50 u szczurów: 400-800 mg/kg mc. LD50 u myszy: 1312 mg/kg mc. Toksyczność po wielokrotnym zastosowaniu. Wielokrotne zastosowanie betametazonu dipropionianu na skórę w dawkach dużo większych od dawek leczniczych, nie spowodowało objawów przewlekłej toksyczności. Działanie rakotwórcze. Nie ma dowodów na działanie rakotwórcze betametazonu i kwasu salicylowego. Działanie mutagenne i teratogenne. Nie ma dowodów na mutagenne działanie betametazonu dipropionianu. Kortykosteroidy o działaniu ogólnym działały teratogennie na zwierzęta laboratoryjne już w stosunkowo małych dawkach. Silnie działające kortykosteroidy działały teratogennie również po podaniu na skórę zwierząt laboratoryjnych.
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gPrzedkliniczne dane o bezpieczeństwie
Nie badano jednak teratogenności betametazonu dipropionianu, który także zalicza się do silnie działających kortykosteroidów. Betametazonu dipropionian stosowany u zajęcy w dawce od 0,05 mg/kg masy ciała wykazywał działanie teratogenne. Wspomniana dawka jest 26 razy większa od dawki betametazonu dipropionianu stosowanej miejscowo u ludzi. Nieprawidłowości, które odnotowano w rozwoju zarodka to przepukliny pępkowe, mózgowe i rozszczepienie podniebienia. W badaniach na szczurach i małpach wykazano działanie teratogenne kwasu salicylowego stosowanego doustnie w dawkach (po przeliczeniu) około 6 razy większych od maksymalnej dawki dobowej u ludzi (stosowanej na skórę na dużej powierzchni ciała).
- CHPL leku Belosalic, maść, (0,5 mg + 30 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Parafina ciekła Wazelina biała 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 4 lata Okres ważności po pierwszym otwarciu tuby: 12 miesięcy przy przechowywaniu w temperaturze poniżej 25⁰C. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25˚C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuba aluminiowa z membraną zabezpieczającą i polietylenową zakrętką z przebijakiem, w tekturowym pudełku 1 tuba po 30 g 1 tuba po 40 g Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań dotyczących usuwania. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO BELOSALIC, (0,5 mg + 20 mg)/g, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden gram płynu na skórę zawiera substancje czynne: 0,5 mg betametazonu (Betamethasonum) w postaci betametazonu dipropionianu i 20 mg kwasu salicylowego (Acidum salicylicum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Płyn na skórę
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Belosalic w postaci płynu na skórę jest wskazany w miejscowym leczeniu chorób skóry przebiegających z nadmiernym rogowaceniem, suchością i stanem zapalnym, reagujących na miejscowe leczenie kortykosteroidami.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Belosalic w postaci płynu jest przeznaczony tylko do stosowania na skórę. Dawkowanie Dorośli i dzieci w wieku powyżej 12 lat: Cienką warstwę produktu należy lekko wcierać w chorobowo zmienione miejsca na skórze dwa razy na dobę. W lżejszych przypadkach wystarcza rzadsze stosowanie. Nie stosować dłużej niż przez 14 dni. Dzieci: Nie zaleca się stosowania produktu u dzieci w wieku poniżej 12 lat.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować produktu leczniczego Belosalic w płynie: w gruźlicy skóry, w zakażeniach wirusowych skóry (np. opryszczka zwykła, ospa bydlęca, ospa wietrzna), w trądziku, zapaleniu skóry wokół ust, trądziku różowatym, w okolicy odbytu i narządów płciowych, w pieluszkowym zapaleniu skóry, w grzybiczych lub bakteryjnych zakażeniach skóry, o ile jednocześnie nie wdrożono odpowiedniego leczenia przyczynowego.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Jeśli po zastosowaniu produktu Belosalic w płynie wystąpi skórna reakcja alergiczna (świąd, pieczenie lub zaczerwienienie skóry), należy go natychmiast odstawić. Nie należy stosować okładów i opatrunków zamkniętych, gdyż mogą nasilać wchłanianie kortykosteroidu przez skórę (patrz punkty 4.8. i 4.9.). Unikać kontaktu produktu z oczami i błonami śluzowymi. Nie stosować do oczu ani wokół oczu. Nie zaleca się stosowania na skórę twarzy, ze względu na ryzyko zapalenia skóry (podobnego do zmian trądzikopodobnych), zapalenia skóry wokół ust, zaniku skóry i trądziku. W przypadku zakażenia skóry należy zastosować leczenie produktami leczniczymi przeciwbakteryjnymi lub przeciwgrzybiczymi. Ze względu na to, że kortykosteroidy i kwas salicylowy wchłaniają się przez skórę, podczas stosowania produktu Belosalic w płynie istnieje ryzyko wystąpienia ogólnoustrojowych objawów niepożądanych kortykosteroidów (w tym zahamowanie czynności kory nadnerczy) oraz kwasu salicylowego.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gSpecjalne środki ostrozności
Z tego względu należy unikać stosowania produktu na dużą powierzchnię ciała, uszkodzoną skórę, stosowania w dużych dawkach, długotrwałego leczenia produktem, stosowania u pacjentów z zaburzeniami czynności wątroby i u dzieci (patrz punkty 4.8. i 4.9.). Na skórę pach i pachwin stosować Belosalic w płynie tylko w przypadkach bezwzględnie koniecznych, z uwagi na zwiększone wchłanianie. Szczególnie ostrożnie należy stosować Belosalic w płynie u pacjentów z łuszczycą, gdyż miejscowe stosowanie kortykosteroidów w łuszczycy może być niebezpieczne, m.in. ze względu na nawrót choroby spowodowany rozwojem tolerancji, ryzyko wystąpienia uogólnionej łuszczycy krostkowej i ogólne działania toksyczne spowodowane zaburzeniem czynności skóry. Dzieci i młodzież: Nie zaleca się stosowania produktu Belosalic w płynie u dzieci w wieku poniżej 12 lat, ze względu na ryzyko zahamowania czynności osi podwzgórze–przysadka–nadnercza, zespołu Cushinga oraz wzrostu ciśnienia wewnątrzczaszkowego po miejscowym stosowaniu silnie działających kortykosteroidów.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gSpecjalne środki ostrozności
Zaburzenie widzenia: Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie są znane interakcje z innymi produktami leczniczymi stosowanymi miejscowo. Jednoczesne stosowanie miejscowe produktów kosmetycznych lub dermatologicznych używanych w leczeniu trądziku, produktów zawierających środki złuszczające lub etanol oraz mydeł o działaniu wysuszającym może nasilać podrażnienie skóry.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych lub istnieją tylko ograniczone dane dotyczące stosowania betametazonu dipropionianu i kwasu salicylowego u kobiet w okresie ciąży. Wiadomo jednak, że substancje te mogą się wchłaniać przez skórę. W badaniach na zwierzętach laboratoryjnych wykazano teratogenne działanie doustnie stosowanego kwasu salicylowego i silnych kortykosteroidów stosowanych na skórę (patrz punkt 5.3). Stosowanie produktu Belosalic w płynie u ciężarnych kobiet dozwolone jest jedynie w przypadkach, w których korzyść dla ciężarnej kobiety wynikająca ze stosowania produktu przewyższa ryzyko dla płodu. Stosowanie produktu powinno jednak być krótkotrwałe i ograniczać się do małej powierzchni ciała. Karmienie piersi? Nie wiadomo, czy miejscowo stosowane kortykosteroidy, w tym betametazonu dipropionian wchłaniają się przez skórę w takim stopniu, że mogą przenikać do mleka kobiet karmiących piersią.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gWpływ na płodność, ciążę i laktację
Istnieją dane o tym, że ogólnie działające kortykosteroidy przenikają do mleka. Kwas salicylowy po zastosowaniu na skórę może wchłaniać się do organizmu. Należy podjąć decyzję czy przerwać karmienie piersią czy przerwać podawanie produktu Belosalic w płynie biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki. Produktu nie należy stosować na skórę piersi przed karmieniem piersią.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Belosalic w płynie nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gDziałania niepożądane
4.8 Działania niepożądane Miejscowe stosowanie betametazonu dipropionianu może spowodować zanikowe zmiany skóry, nieodwracalne rozstępy, suchość skóry, rozszerzenie drobnych tętniczek, zapalenie mieszków włosowych, nadmierne owłosienie, zmiany trądzikopodobne, alergiczne kontaktowe zapalenie skóry (pieczenie, obrzęk i zapalne pęcherzyki na skórze), zapalenie skóry wokół ust, swędzenie, odbarwienie skóry, hamowanie czynności gruczołów potowych (potówka) oraz wystąpienie wtórnych zakażeń. Miejscowe stosowanie kwasu salicylowego może spowodować zapalenie skóry. W wyniku wchłaniania substancji czynnych do krwi mogą również wystąpić ogólne działania niepożądane betametazonu i kwasu salicylowego (patrz punkt 4.9). Ogólne objawy niepożądane występują rzadko (≥1/10 000 do <1/1 000), przede wszystkim w przypadku długotrwałego stosowania produktu, stosowania na dużą powierzchnię skóry, pod okładem zamkniętym oraz stosowania u dzieci i zwykle ustępują po zaprzestaniu stosowania produktu.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gDziałania niepożądane
Zaburzenia oka Częstość nieznana (nie może być określona na podstawie dostępnych danych): podczas stosowania kortykosteroidów obserwowano nieostre widzenie (patrz także punkt 4.4.). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa Tel: (22) 49 21 301 Faks: (22) 49 21 309 strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gPrzedawkowanie
4.9 Przedawkowanie Podczas stosowania produktu przez dłuższy czas (powyżej 2 tygodni), stosowania na dużych powierzchniach skóry lub na uszkodzoną skórę, w razie stosowania okładów zamkniętych oraz w przypadku stosowania u dzieci, w wyniku nasilonego wchłaniania substancji czynnych do układu krążenia, może dojść do ich przedawkowania i wystąpienia ogólnych objawów niepożądanych kortykosteroidów i kwasu salicylowego. Objawy przedawkowania charakterystyczne dla kortykosteroidów, to m.in. zahamowanie czynności osi podwzgórze–przysadka–nadnercza, zespół Cushinga, łagodne nadciśnienie wewnątrzczaszkowe, hamowanie wzrostu i rozwoju u dzieci, hiperglikemia i cukromocz. Objawy przedawkowania kwasu salicylowego, to m.in. bladość, zmęczenie, senność, hiperwentylacja z przyspieszonym oddechem, mdłości, wymioty, zaburzenia słuchu, dezorientacja. W przypadku przedawkowania należy zaprzestać stosowania produktu Belosalic w płynie. Leczenie jest objawowe.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gPrzedawkowanie
Jeśli wystąpią objawy takie, jak: gorączka, bóle mięśniowe, bóle stawowe oraz ogólne osłabienie, należy rozważyć zastosowanie kortykosteroidu w postaci o działaniu ogólnym.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: kortykosteroidy do stosowania miejscowego o silnym działaniu, w skojarzeniu z innymi lekami, kod ATC: D07X C01. Belosalic w postaci płynu na skórę zawiera kortykosteroid o silnym działaniu – betametazonu dipropionian oraz kwas salicylowy. Mechanizm działania Betametazonu dipropionian, syntetyczny fluorowany kortykosteroid do stosowania miejscowego w dermatologii, działa silnie przeciwzapalnie, przeciwświądowo i obkurczająco na naczynia krwionośne. Dokładny mechanizm działania miejscowo stosowanych kortykosteroidów jest nieznany. Działanie obkurczające naczynia krwionośne zmniejsza przenikanie kortykosteroidu do surowicy. Kwas salicylowy w wyniku działania keratolitycznego działa złuszczająco i ułatwia przenikanie kortykosteroidu do skóry.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Na stopień przenikania przez skórę miejscowo zastosowanego betametazonu dipropionianu i kwasu salicylowego mają wpływ liczne czynniki takie, jak podłoże płynu, stan naskórka oraz stosowanie okładu zamkniętego. Wchłanianie kortykosteroidów mogą nasilać procesy zapalne skóry lub stosowanie okładów zamkniętych. Kortykosteroidy w większym stopniu wchłaniają się przez uszkodzoną skórę. Miejscowo stosowane kortykosteroidy po wchłonięciu przez skórę wykazują podobne właściwości farmakokinetyczne jak kortykosteroidy stosowane w postaci o działaniu ogólnoustrojowym. Kortykosteroidy po podaniu na skórę wchłaniają się w 12-14%. Dystrybucja Mniej więcej 64% betametazonu wiąże się z białkami osocza, a objętość dystrybucji wynosi 1,4 l/kg mc. Metabolizm i eliminacja Betametazon jest metabolizowany w wątrobie, a jego metabolity są wydalane przede wszystkim z moczem.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gWłaściwości farmakokinetyczne
Kwas salicylowy po zastosowaniu na skórę pod okładem okluzyjnym osiąga maksymalne stężenia w osoczu w ciągu 5 godzin. Z moczem w niezmienionej postaci wydala się około 6% wchłoniętej ilości kwasu salicylowego. Największa ilość kwasu salicylowego wydala się w postaci metabolitów.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Toksyczność po jednokrotnym zastosowaniu. W badaniach na myszach i szczurach zanotowano następujące LD50 po zastosowaniu doustnym: betametazonu dipropionianu: LD50 u szczurów: 4 g/kg mc. LD50 u myszy: 5 g/kg mc. kwasu salicylowego: LD50 u szczurów: 400-800 mg/kg mc. LD50 u myszy: 1312 mg/kg mc. Toksyczność po wielokrotnym zastosowaniu. Wielokrotne zastosowanie betametazonu dipropionianu na skórę w dawkach dużo większych od dawek leczniczych, nie spowodowało objawów przewlekłej toksyczności. Działanie rakotwórcze. Nie ma dowodów na działanie rakotwórcze betametazonu i kwasu salicylowego. Działanie mutagenne i teratogenne. Nie ma dowodów na mutagenne działanie betametazonu dipropionianu. Kortykosteroidy o działaniu ogólnym działały teratogennie na zwierzęta laboratoryjne już w stosunkowo małych dawkach. Silnie działające kortykosteroidy działały teratogennie również po podaniu na skórę zwierząt laboratoryjnych.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gPrzedkliniczne dane o bezpieczeństwie
Nie badano jednak teratogenności betametazonu dipropionianu, który także zalicza się do silnie działających kortykosteroidów. Betametazonu dipropionian stosowany u zajęcy w dawce od 0,05 mg/kg masy ciała wykazywał działanie teratogenne. Wspomniana dawka jest 26 razy większa od dawki betametazonu dipropionianu stosowanej miejscowo u ludzi. Nieprawidłowości, które odnotowano w rozwoju zarodka to przepukliny pępkowe, mózgowe i rozszczepienie podniebienia. W badaniach na szczurach i małpach wykazano działanie teratogenne kwasu salicylowego stosowanego doustnie w dawkach (po przeliczeniu) około 6 razy większych od maksymalnej dawki dobowej u ludzi (stosowanej na skórę na dużej powierzchni ciała).
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Disodu edetynian Hypromeloza 4000 Sodu wodorotlenek Alkohol izopropylowy Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata. Okres ważności po pierwszym otwarciu butelki: 12 miesięcy przy przechowywaniu w temperaturze poniżej 25⁰C. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25˚C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Butelka polietylenowa z zakraplaczem i zakrętką polietylenową z pierścieniem gwarancyjnym, w tekturowym pudełku. 1 butelka po 50 ml 1 butelka po 100 ml Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań dotyczących usuwania.
- CHPL leku Belosalic, płyn na skórę, (0,5 mg + 20 mg)/gDane farmaceutyczne
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Verrumal, (100 mg + 5 mg)/g, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g (1,05 ml) płynu na skórę zawiera 100 mg kwasu salicylowego (Acidum salicylicum) i 5 mg fluorouracylu (Fluorouracilum). Substancje pomocnicze o znanym działaniu: 1 g płynu na skórę zawiera 80 mg dimetylosulfotlenku oraz 160 mg etanolu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Płyn na skórę. Przezroczysty, bezbarwny do barwy lekko żółto-pomarańczowej płyn.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Brodawki zwykłe, brodawki płaskie (młodocianych), brodawki stóp.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Do stosowania miejscowego na skórę. Produkt leczniczy stosuje się zazwyczaj od 2 do 3 razy na dobę, na każdą brodawkę, za pomocą dołączonego pędzelka. Produkt leczniczy Verrumal należy nanosić tylko na brodawkę, omijając zdrową skórę. Skórę otaczającą brodawkę można ochronić przed produktem poprzez nałożenie kremu lub maści. Zaleca się, aby przed zastosowaniem produktu leczniczego oczyścić pędzelek o szyjkę butelki. W przypadku bardzo małych brodawek, w celu dokładnego naniesienia produktu leczniczego można zamiast pędzelka używać wykałaczki lub zaostrzonej zapałki. Przed każdym zastosowaniem produktu leczniczego Verrumal należy najpierw usunąć powłokę pozostałą po poprzedniej aplikacji. Ciepła woda może ułatwić usunięcie tej powłoki. Produktu leczniczego Verrumal nie należy nanosić na owłosioną powierzchnię skóry. Może to prowadzić do zlepienia się włosów na leczonej powierzchni skóry.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gDawkowanie
W przypadku nanoszenia produktu leczniczego Verrumal na owłosioną powierzchnię skóry należy najpierw ją ogolić lub zastosować inne właściwe metody usuwania owłosienia. W przypadku brodawek okołopaznokciowych, a zwłaszcza podpaznokciowych, należy zwrócić uwagę, aby nie uległa zniszczeniu macierz paznokcia i produkt nie przedostał się do łożyska paznokcia. Maksymalna powierzchnia objęta leczeniem nie powinna być większa niż 25 cm2 powierzchni skóry. Czas stosowania produktu leczniczego wynosi 6 tygodni. Należy poinformować pacjenta, aby pamiętał o codziennym, regularnym stosowaniu produktu leczniczego. Po ustąpieniu zmian chorobowych stosowanie produktu leczniczego należy kontynuować jeszcze przez około 1 tydzień. Z doświadczeń wynika, że w niektórych przypadkach np. przy silnie wystających brodawkach zwykłych lub brodawkach na powierzchni stóp, po leczeniu produktem leczniczym Verrumal wskazane jest usunięcie przez lekarza pozostałej obumarłej tkanki.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gDawkowanie
Dzieci i młodzież: Verrumal jest przeciwwskazany u dzieci w wieku poniżej 6 lat. Sposób podawania: Podanie na skórę.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymieniona w punkcie 6.1. Produktu leczniczego Verrumal nie należy stosować: w okresie karmienia piersią, podczas ciąży, u kobiet, u których z całą pewnością nie można wykluczyć, że są w ciąży, u dzieci w wieku poniżej 6 lat, u pacjentów z niewydolnością nerek, jednocześnie z brywudyną, sorywudyną i analogami nukleozydów, gdyż są silnymi inhibitorami enzymu rozkładającego fluorouracyl – dehydrogenazy dihydropirymidyny (patrz także punkty 4.4 i 4.5), na duże powierzchnie skóry (większe niż 25 cm2). Nie można dopuścić do kontaktu produktu leczniczego Verrumal z oczami lub błonami śluzowymi.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produktu leczniczego nie należy stosować w miejscach szczególnie wrażliwych, takich jak okolice ust, nosa i warg. Należy unikać kontaktu produktu leczniczego Verrumal ze skórą otaczającą brodawki. W przypadku nieprawidłowego stosowania produktu leczniczego (np. nanoszenia płynu na skórę otaczającą brodawkę) może wystąpić miejscowo pieczenie i nadżerka pozostawiające przemijające zabarwienie. Leczenie należy przerwać, jeżeli na skórze otaczającej brodawkę pojawi się odczyn zapalny. W przypadku leczenia bardzo dużej ilości brodawek może wystąpić nadwrażliwość na światło słoneczne. Verrumal zawiera związek cytostatyczny - 5-fluorouracyl. Enzym dehydrogenaza dihydropirymidynowa (DPD) odgrywa ważną rolę w rozkładaniu fluorouracylu. Hamowanie, niedobór lub zmniejszenie aktywności tego enzymu może prowadzić do kumulacji fluorouracylu.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gSpecjalne środki ostrozności
Niemniej jednak z uwagi na to, że wchłanianie przezskórne fluorouracylu jest znikome w przypadku podawania produktu leczniczego Verrumal zgodnie z zatwierdzoną Charakterystyką Produktu Leczniczego, nie oczekuje się żadnych różnic w zakresie profilu bezpieczeństwa stosowania produktu leczniczego Verrumal w tej subpopulacji i nie uważa się, by modyfikacja dawki była konieczna. Analogi nukleozydów, jak brywudyna i sorywudyna w wyniku hamowania aktywności dehydrogenazy dihydropirymidyny, mogą powodować znaczne zwiększenie stężeń fluorouracylu lub innych fluoropirymidyn w osoczu i w związku z tym zwiększać toksyczność produktu leczniczego. Z tego powodu, pomiędzy podaniem produktu leczniczego Verrumal a zastosowaniem brywudyny, sorywudyny lub innych analogów nukleozydów, należy zachować przerwę wynoszącą co najmniej 4 tygodnie. Jeśli u pacjentów leczonych fluorouracylem przypadkowo podano analogi nukleozydów, jak np.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gSpecjalne środki ostrozności
brywudynę lub sorywudynę, należy podjąć skuteczne postępowanie, mające na celu zmniejszenie toksyczności fluorouracylu. Może być konieczne przyjęcie pacjenta do szpitala. Należy zastosować każdy rodzaj postępowania w celu ochrony pacjenta przed zakażeniami ogólnymi i odwodnieniem. U pacjentów leczonych jednocześnie fenytoiną i fluorouracylem, należy regularnie kontrolować stężenie fenytoiny w osoczu. Produktu leczniczego Verrumal nie należy stosować w przypadku krwawiących zmian skórnych. Jeśli brodawki znajdują się na obszarze skóry, który ma cienką warstwę naskórka, produkt leczniczy należy nakładać rzadziej i częściej kontrolować leczenie, ponieważ kwas salicylowy znajdujący się w produkcie może powodować tworzenie się blizn. W przypadku brodawek z silną skłonnością do rogowacenia, może być czasem korzystne ich wcześniejsze leczenie kwasem salicylowym w plastrach. U pacjentów z zaburzeniami czucia (np. pacjentów z cukrzycą) konieczne jest ścisłe monitorowanie pacjenta.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gSpecjalne środki ostrozności
Po każdym użyciu butelka z produktem leczniczym powinna być dokładnie zamknięta, gdyż w razie otwarcia butelki produkt szybko wysycha, co uniemożliwia jego dalsze prawidłowe stosowanie. Płyn na skórę nie powinien być stosowany jeśli pojawią się w nim kryształy. Podczas nanoszenia produktu leczniczego Verrumal należy uważać, aby nie poplamić produktem odzieży lub wyrobów z akrylu (np. wanny z akrylu), ponieważ produkt tworzy plamy, których nie można usunąć. Produkt jest łatwopalny: należy trzymać go z dala od ognia i nie używać w pobliżu otwartego płomienia, zapalonego papierosa lub niektórych urządzeń (np. suszarek do włosów). Specjalne ostrzeżenia dotyczące substancji pomocniczych: Substancja pomocnicza znajdująca się w produkcie leczniczym– dimetylosulfotlenek – może powodować podrażnienie skóry. Ten produkt leczniczy zawiera 160 mg alkoholu (etanolu) w każdym gramie płynu. Produkt leczniczy może powodować pieczenie uszkodzonej skóry.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Enzym dehydrogenaza dihydropirymidyny odgrywa ważną rolę w procesie rozkładania fluorouracylu. Analogi nukleozydów, jak brywudyna i sorywudyna mogą w wyniku hamowania aktywności dehydrogenazy dihydropirymidyny znacznie zwiększać stężenia fluorouracylu lub innych fluoropirymidyn w osoczu i w związku z tym zwiększać toksyczność fluorouracylu. Z tego powodu pomiędzy podaniem fluorouracylu i brywudyny, sorywudyny i innych analogów naukleozydów, należy zachować przerwę wynoszącą co najmniej 4 tygodnie. Jeśli to możliwe, przed rozpoczęciem leczenia fluoropirymidynami należy oznaczyć aktywność enzymu dehydrogenazy dihydropirymidyny. Podczas jednoczesnego stosowania fenytoiny i fluorouracylu zgłaszano zwiększenie stężenia fenytoiny w osoczu powodujące objawy zatrucia fenytoiną (patrz punkt 4.4).
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gInterakcje
Nie ma dowodów wskazujących na wchłanianie układowe kwasu salicylowego, niemniej jednak wchłonięty kwas salicylowy może powodować interakcje z metotreksatem i pochodnymi sulfonylomocznika.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na ciążę, płodność i laktację Ciąża Stosowanie produktu leczniczego Verrumal podczas ciąży jest przeciwwskazane (patrz punkt 4.3). Nie stosować u kobiet, u których z całą pewnością nie można wykluczyć, że są w ciąży. Karmienie piersi? Stosowanie produktu leczniczego Verrumal podczas karmienia piersią jest przeciwwskazane (patrz punkt 4.3).
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy Verrumal nie ma wpływu na zdolność prowadzenia pojazdów ani obsługiwania maszyn.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gDziałania niepożądane
4.8 Działania niepożądane Poniżej podano częstość i klasyfikację działań niepożądanych według układów i narządów zgodnie z terminologią MedDRA. Częstości są definiowane jako: bardzo często (≥ 1/10), często (≥ 1/100 do < 1/10), niezbyt często (≥ 1/1000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1000), bardzo rzadko (< 1/10 000), częstość nie znana (częstość nie może być określona na podstawie dostępnych danych). Klasyfikacja według układów i narządów, zgodnie z MedDRA Zaburzenia układu nerwowego - Często Ból głowy Zaburzenia oka - Niezbyt często Suchość oka, świąd oka, nasilone łzawienie. Zaburzenia skóry i tkanki podskórnej - Często Złuszczanie się skóry Zaburzenia ogólne i stany w miejscu podania - Bardzo często W miejscu podania: rumień, stan zapalny, podrażnienie (w tym pieczenie), ból, świąd W miejscu podania - Często krwawienie, nadżerka, strup W miejscu podania - Niezbyt często zapalenie skóry, obrzęk, owrzodzenie Wskutek silnego działania zmiękczającego warstwę zrogowaciałą naskórka, mogą wystąpić białawe przebarwienia i złuszczanie się skóry, szczególnie w okolicy brodawek.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gDziałania niepożądane
Ze względu na zawartość kwasu salicylowego w produkcie mogą wystąpić łagodne objawy podrażnienia, jak zapalenie skóry i kontaktowe reakcje alergiczne w postaci świądu, zaczerwienienia i niewielkich pęcherzy, nawet poza miejscem kontaktu produktu leczniczego ze skórą. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gDziałania niepożądane
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gPrzedawkowanie
4.9 Przedawkowanie Podczas stosowania produktu leczniczego zgodnie z zaleceniami, ilość produktu leczniczego Verrumal aplikowana na 25 cm2 powierzchni skóry wynosi 0,2 g, czyli 1 mg fluorouracylu, co odpowiada, u osób o masie ciała 60 kg dawce 0,017 mg/kg masy ciała. Toksyczność ogólnoustrojowa występuje po podaniu fluorouracylu dożylnie w dawkach wynoszących 15 mg/kg masy ciała, więc w tym przypadku można ją wykluczyć ze względu na 1000-krotny margines bezpieczeństwa. Ponadto nie występuje znaczące przezskórne wchłanianie fluorouracylu zawartego w produkcie leczniczym Verrumal (patrz także punkt 5.2). W przypadku prawidłowego stosowania produktu leczniczego, tj. zgodnego z zaleconym sposobem dawkowania, stężenie kwasu salicylowego wchłoniętego przez skórę w osoczu nie przekracza 5 mg/dl, tak więc zatrucie kwasem salicylowym jest mało prawdopodobne (patrz także punkt 5.2).
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gPrzedawkowanie
Aplikacja produktu leczniczego w ilości znacznie większej niż zalecana powoduje zwiększenie częstości występowania oraz nasilenia reakcji w miejscu podania. Wczesne objawy zatrucia salicylanami mogą wystąpić, jeśli stężenie salicylanów w surowicy będzie większe niż 30 mg/dl. Są to: uczucie dzwonienia w uszach, szum w uszach z pogorszeniem słuchu, krwawienia z nosa, nudności, wymioty, drażliwość oraz uczucie wysuszenia błon śluzowych. U małych dzieci stosunek powierzchni ciała do masy jest inny niż u dorosłych. Z tego powodu znaczące przekroczenie zalecanej maksymalnej dopuszczalnej powierzchni leczenia lub zwiększenie częstości aplikacji zwiększa ryzyko zatrucia kwasem salicylowym, zwłaszcza u małych dzieci.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki dermatologiczne przeciw brodawkom. Substancja czynna produktu leczniczego - fluorouracyl jest lekiem z grupy z cytostatyków o działaniu przeciwmetabolicznym. Fluorouracyl ze względu na podobieństwo strukturalne do tyminy (5-metylouracyl) występującej w kwasach nukleinowych, zapobiega powstawaniu i przyswajaniu tyminy, hamując w ten sposób syntezę DNA i RNA. W wyniku tego działania fluorouracyl hamuje namnażanie wirusów powodujących powstawanie brodawek, a także wzrost komórek, zwłaszcza komórek brodawek, które są w fazie intensywnego wzrostu. Substancja czynna produktu leczniczego - kwas salicylowy działa keratolitycznie, w wyniku czego poprawia penetrację fluorouracylu do brodawki.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne W badaniach przeprowadzonych na świniach, po zastosowaniu produktu leczniczego Verrumal na skórę nawet w dużych ilościach, w surowicy zwierząt nie stwierdzono obecności fluorouracylu. Oznacza to, że fluorouracyl nie był wchłaniany w ilościach wykrywalnych standardowymi metodami analitycznymi (HPLC). Z najnowszych badań wynika, że stopień wchłaniania fluorouracylu do organizmu człowieka po zastosowaniu produktu leczniczego Verrumal na skórę jest znacznie mniejszy niż 0,1%. Po nałożeniu na skórę, produkt leczniczy Verrumal tworzy zwartą błonę, która staje się biała po wyparowaniu rozpuszczalnika. Błona ta działa okluzyjnie, umożliwiając penetrację substancji czynnej do głębszych warstw brodawek. Kwas salicylowy działa keratolitycznie, poprawia penetrację fluorouracylu, szczególnie trudną w przypadku zastosowania na brodawki. Penetrację fluorouracylu ułatwia także substancja pomocnicza dimetylosulfotlenek, który działa jak rozpuszczalnik fluorouracylu.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gWłaściwości farmakokinetyczne
Badania na zwierzętach oraz badania kliniczne u ludzi wykazały, że kwas salicylowy przenika łatwo przez skórę, w zależności m.in. od stanu skóry. Metabolizm kwasu salicylowego: W organizmie kwas salicylowy łączy się z glicyną do kwasu salicylurowego, z kwasem glukuronowym w grupie fenolowej do glukuronidu eterowego i w grupie karboksylowej do glukuronidu estrowego, a także przez hydroksylację do kwasu gentyzynowego lub dwuhydroksybenzoesowego. W przypadku stosowania zalecanych dawek, okres półtrwania kwasu salicylowego wynosi od 2 do 3 godzin, ale w przypadku dużych dawek może być zwiększony do 15 - 30 godzin, ze względu na ograniczone sprzęganie kwasu salicylowego w wątrobie. Po miejscowym podaniu produktu leczniczego, stężenie kwasu salicylowego w surowicy zwykle nie przekracza 5 mg/dl, dlatego nie powinny wystąpić toksyczne działania kwasu salicylowego (patrz punkt 4.3).
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gWłaściwości farmakokinetyczne
Wczesne objawy zatrucia salicylanami mogą wystąpić dopiero wtedy, gdy ich stężenia w surowicy są większe niż 30 mg/dl.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak danych.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Etylu octan Etanol bezwodny Dimetylosulfotlenek Kopolimer metakrylanu butylu i metylu (80:20) Piroksylina 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata. Po pierwszym otwarciu opakowania (butelki) - zużyć w ciągu 6-ciu miesięcy. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25C. Przechowywać w temperaturze poniżej 10°C tylko przez krótki czas. Dłuższe przechowywanie w temperaturze poniżej 10°C może spowodować krystalizację fluorouracylu. Produkt jest łatwopalny. Dodatkowe informacje - patrz punkt 4.4. 6.5 Rodzaj i zawartość opakowania Butelka z bezbarwnego szkła z nakrętką i pędzelkiem, zawierająca 13 ml płynu, umieszczona w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań.
- CHPL leku Verrumal, płyn do stosowania na skórę, (100 mg + 5 mg)/gDane farmaceutyczne
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Bedicort salic, 0,5 mg/g + 30 mg/g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g maści zawiera 0,5 mg betametazonu (w postaci betametazonu dipropionianu) oraz 30 mg kwasu salicylowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Maść Biała lub prawie biała, półprzezroczysta, tłusta, miękka masa.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy Bedicort salic maść jest wskazany w miejscowym leczeniu podostrych i przewlekłych chorób skóry, takich jak: łuszczyca, cięższe postaci atopowego zapalenia skóry, świerzbiączka ograniczona (neurodermit), liszaj płaski, cięższe postaci wyprysku (w tym wyprysk pieniążkowaty, wyprysk kontaktowy).
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i dzieci w wieku powyżej 12 lat: Niewielką ilość produktu leczniczego Bedicort salic maść (0,2 – 0,5 cm maści na 10 cm2 powierzchni skóry) należy nanieść na zmienione chorobowo miejsca na skórze i lekko wmasować dwa razy na dobę (rano i wieczorem). W niektórych przypadkach, korzystny wynik leczenia można uzyskać przy rzadszym stosowaniu. Okres leczenia nie powinien trwać dłużej niż 14 dni. W razie nawrotu choroby leczenie można powtórzyć. Dzieci i młodzież: Nie należy stosować u dzieci w wieku poniżej 12 lat. Sposób podawania Podanie na skórę
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gPrzeciwwskazania
4.3 Przeciwwskazania Nie stosować: w nadwrażliwości na substancje czynne – betametazonu dipropionian i kwas salicylowy lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; w zakażeniach bakteryjnych (np. w gruźlicy, kile), wirusowych (opryszczce, półpaścu, ospie wietrznej), grzybiczych lub pasożytniczych (np. świerzbie) skóry; w trądziku pospolitym; w trądziku różowatym; w zapaleniu skóry wokół ust (dermatitis perioralis); na skórę twarzy; w pieluszkowym zapaleniu skóry; w świądzie okolic odbytu i narządów moczowo-płciowych; u dzieci w wieku poniżej 12 lat.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Jeśli podczas stosowania produktu leczniczego Bedicort salic maść wystąpią objawy podrażnienia, uczulenia lub nadmiernego wysuszenia skóry należy natychmiast zaprzestać jego stosowania. W przypadku wystąpienia zakażenia bakteryjnego, należy zastosować odpowiednie leczenie przeciwbakteryjne. Kortykosteroidy i kwas salicylowy są wchłaniane przez skórę, w związku z czym podczas stosowania produktu leczniczego Bedicort salic maść istnieje ryzyko wystąpienia ogólnoustrojowych objawów niepożądanych kortykosteroidów (w tym zahamowanie czynności kory nadnerczy) oraz kwasu salicylowego. Z tego względu należy unikać stosowania produktu leczniczego na dużą powierzchnię skóry, rany, uszkodzoną skórę, stosowania w dużych ilościach i długotrwale. W razie konieczności zastosowania produktu leczniczego w takich przypadkach, należy zachować specjalne środki ostrożności.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gSpecjalne środki ostrozności
Szczególna ostrożność powinna być zachowana podczas stosowania produktu u pacjentów z łuszczycą. Miejscowe stosowanie kortykosteroidów w łuszczycy może być niebezpieczne z wielu powodów, w tym ze względu na nawrót choroby spowodowany rozwojem tolerancji, ryzyko wystąpienia uogólnionej łuszczycy krostkowej oraz ogólne działania toksyczne spowodowane zaburzeniem ciągłości skóry. Nie należy stosować produktu leczniczego pod opatrunkiem okluzyjnym, ponieważ może on nasilać przezskórne wchłanianie kortykosteroidów. Należy unikać kontaktu produktu leczniczego z oczami i błonami śluzowymi. Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (ang.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gSpecjalne środki ostrozności
Central Serous Chorioretinopathy - CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów. Dzieci i młodzież: Ostrożnie stosować u dzieci. U dzieci, ze względu na większy niż u dorosłych stosunek powierzchni ciała do masy ciała, a co za tym idzie większą wchłanialność produktu leczniczego, łatwiej niż u dorosłych może dojść do zahamowania czynności osi podwzgórze-przysadka-nadnercza oraz wystąpienia objawów niepożądanych charakterystycznych dla kortykosteroidów, w tym zaburzeń wzrostu i rozwoju. U dzieci leczonych miejscowo kortykosteroidami opisywano: zahamowanie czynności osi podwzgórze-przysadka-nadnercza, zespół Cushinga, zahamowanie wzrostu, zmniejszenie przyrostu masy ciała oraz nadciśnienie wewnątrzczaszkowe. Zahamowanie czynności nadnerzy u dzieci powodowało zmniejszenie stężenia kortyzolu w osoczu i brak odpowiedzi na stymulację ACTH.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gSpecjalne środki ostrozności
Nadciśnienie wewnątrzczaszkowe powodowało uwypuklenia ciemiączka, wystąpienie bólów głowy i obustronne obrzęki tarcz nerwów wzrokowych.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych dotyczących miejscowego stosowania kortykosteroidów u kobiet w ciąży. Produkt leczniczy Bedicort salic maść powinien być stosowany w czasie ciąży tylko wtedy, gdy potencjalna korzyść dla matki przeważa możliwe ryzyko dla płodu. W badaniach na zwierzętach wykazano, że kortykosteroidy stosowane miejscowo mogą działać teratogennie. Karmienie piersi? Nie wiadomo, czy miejscowo stosowane kortykosteroidy wchłaniają się przez skórę w takim stopniu, aby były wykrywalne w mleku kobiecym. Należy podjąć decyzję, czy przerwać karmienie piersią czy przerwać stosowanie produktu leczniczego, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Bedicort salic maść nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane zostały zidentyfikowane w czasie stosowania miejscowo betametazonu oraz kwasu salicylowego. Częstość występowania tych działań niepożądanych została sklasyfikowana jako nieznana (nie może zostać ustalona na podstawie dostępnych danych). Zaburzenia oka: nieostre widzenie (patrz również punkt 4.4). Zaburzenia skóry i tkanki podskórnej: pieczenie świąd podrażnienie suchość skóry zapalenie mieszków włosowych nadmierne owłosienie zmiany trądzikopodobne zanik barwnika skóry zapalenie skóry wokół ust alergiczne, kontaktowe zapalenie skóry maceracja skóry zakażenia wtórne atrofia skóry rozstępy skóry potówki Długotrwałe miejscowe stosowanie preparatów zawierających kwas salicylowy może wywołać zapalenie skóry. W wyniku wchłaniania substancji czynnych do krwi mogą wystąpić ogólne działania niepożądane betametazonu (charakterystyczne dla kortykosteroidów) i kwasu salicylowego.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gDziałania niepożądane
Ogólne działania niepożądane mogą występować przede wszystkim w przypadku długotrwałego stosowania produktu leczniczego, stosowania na dużą powierzchnię skóry oraz stosowania u dzieci. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49-21-301, fax: +48 22 49-21-309, e-mail: ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gPrzedawkowanie
4.9 Przedawkowanie Objawy Długotrwałe, miejscowe stosowanie kortykosteroidów może doprowadzić do zahamowania czynności osi podwzgórze-przysadka-nadnercza i w konsekwencji do wtórnej niewydolności nadnerczy, a także nadczynności kory nadnerczy, łącznie z zespołem Cushinga. Miejscowe stosowanie preparatów zawierających kwas salicylowy długotrwale lub w dużych dawkach może wywołać objawy zatrucia kwasem salicylowym (zatrucie salicylanami). Leczenie W przypadku przedawkowania należy zastosować odpowiednie leczenie objawowe. Ostre objawy przedawkowania hormonów kory nadnerczy zwykle są odwracalne. Jeśli jest to konieczne, należy wyrównać stężenie elektrolitów. W przypadku przewlekłego zatrucia wskazane jest powolne, stopniowe odstawianie kortykosteroidów. Zatrucia kwasem salicylowym leczy się objawowo. Należy podjąć działania zmierzające do szybkiego usunięcia salicylanów z organizmu. Wskazane jest doustne podawanie dwuwęglanu sodu w celu alkalizacji moczu i wymuszenia diurezy.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: kortykosteroidy o silnym działaniu w skojarzeniu z innymi lekami. Kod ATC: D07X C01 Betametazonu dipropionian jest syntetyczną, fluorowaną pochodną hydrokortyzonu; wykazuje silne (grupa III) działanie przeciwzapalne, przeciwświądowe, przeciwalergiczne oraz obkurczające naczynia krwionośne. Posiada właściwości lipofilne i z łatwością wchłania się przez skórę do organizmu. Zmniejsza stan zapalny przez hamowanie syntezy prostaglandyn i leukotrienów jako wynik hamowania czynności fosfolipazy A2 i zmniejszonego uwalniania kwasu arachidonowego z fosfolipidów znajdujących się w błonach komórkowych. Wykazuje działanie przeciwalergiczne przez hamowanie rozwoju miejscowych reakcji alergicznych. Ze względu na miejscowy efekt obkurczania naczyń krwionośnych, zmniejsza reakcje wysiękowe. Zmniejsza syntezę białek i osadzanie się kolagenu. Przyspiesza rozpad białek w skórze i osłabia proces proliferacji.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gWłaściwości farmakodynamiczne
Kwas salicylowy jest stosowany miejscowo w leczeniu stanów hiperkeratotycznych i łuskowatych, gdzie jego keratolityczne działanie umożliwia wchłanianie kortykosteroidu. Wykazuje słabe działanie antyseptyczne i bakteriostatyczne.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Betametazonu dipropionian łatwo przenika przez rogową warstwę skóry, gdzie jest gromadzony. Nie jest metabolizowany w skórze. Kortykosteroidy zastosowane miejscowo mogą wchłaniać się przez nieuszkodzoną skórę. Wchłanianie dipropioninanu betametazonu jest zwiększone przy zastosowaniu na delikatną skórę (miejsca zgięć, twarz, skóra z uszkodzonym nabłonkiem lub zmieniona przez proces zapalny), na duże powierzchnie skóry oraz gdy jest zastosowany w opatrunku okluzyjnym, szczególnie u dzieci. Kwas salicylowy zastosowany na skórę wywołuje tylko działanie miejscowe. Dystrybucja Szlak metaboliczny wchłoniętych kortykosteroidów po podaniu miejscowym jest podobny do szlaku metabolicznego kortykosteroidów podanych ogólnie. Kortykosteroidy wiążą się z białkami osocza w różnym stopniu. Specyficzne wiązanie z globuliną ma wysokie powinowactwo ale małą pojemność, z albuminą, odwrotnie, niskie powinowactwo i dużą pojemność.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gWłaściwości farmakokinetyczne
Metabolizm i eliminacja Po wchłonięciu do organizmu, dipropionian betametazonu jest metabolizowany głównie w wątrobie i wydalany z moczem. Niektóre kortykosteroidy stosowane miejscowo i ich metabolity są także wydalane z żółcią.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dipropionian betametazonu z kwasem salicylowym w maści stosowano miejscowo na nieuszkodzoną skórę i na otarcia skóry u szczurów i królików. Produkt leczniczy był dobrze tolerowany i nie stwierdzono działań niepożądanych. Wielokrotne podanie produktu na nieuszkodzoną skórę i otarcia skóry u szczurów i królików odpowiednio przez okres 15 i 63 dni było przez nie dobrze tolerowane. Nie wystąpiły niespodziewane działania niepożądane, a jedynie ogólnoustrojowe działania niepożądane kortykosteroidów.
- CHPL leku Bedicort salic, maść, (0,5 mg + 30 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Parafina ciekła Wazelina biała 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 2 lata Okres ważności po pierwszym otwarciu: 2 tygodnie 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25ºC. 6.5 Rodzaj i zawartość opakowania Tuba aluminiowa (pokryta od wewnątrz epoksydowym lakierem) z membraną oraz zakrętką z HDPE w tekturowym pudełku. Wielkość opakowania: 15g, 30 g. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowywania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO COFFEPIRINE Tabletki od bólu głowy, (450 mg + 50 mg), tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 450 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum) i 50 mg kofeiny (Coffeinum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki białe, okrągłe obustronnie płaskie lub wypukłe, posiadające napis od bólu głowy a z drugiej strony krzyż równoramienny.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgWskazania do stosowania
4.1 Wskazania do stosowania Bóle różnego pochodzenia o małym i umiarkowanym nasileniu (np. bóle głowy, reumatyczne, mięśni, nerwobóle, ból zęba).
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i młodzież powyżej 12 lat Zazwyczaj stosuje się 1 tabletkę (450 mg kwasu acetylosalicylowego i 50 mg kofeiny), w razie konieczności od 2 do 6 razy na dobę, nie częściej niż co 4 godziny, w ciągu doby do 6 tabletek (co odpowiada 2700 mg kwasu acetylosalicylowego i 300 mg kofeiny). Produktu leczniczego nie należy stosować bez konsultacji z lekarzem dłużej niż przez 3 dni u dorosłych i przez 1 dzień u młodzieży powyżej 12 lat. U młodzieży w wieku powyżej 12 lat stosować ostrożnie ze względu na zawartość kofeiny. Dzieci i młodzież poniżej 12 lat Nie stosować. Sposób podawania Nie stosować na czczo. Tabletkę należy połknąć popijając dużą ilością płynu.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1 oraz na salicylany. Okres ciąży i karmienia piersią, choroba wrzodowa żołądka i (lub) dwunastnicy, krwawienia z przewodu pokarmowego, skaza krwotoczna, dna moczanowa, ciężkie zaburzenia czynności nerek lub wątroby. U dzieci w wieku poniżej 12 lat. U pacjentów z napadami astmy oskrzelowej w wywiadzie, wywołanymi podaniem salicylanów lub substancji o podobnym działaniu, szczególnie niesteroidowych leków przeciwzapalnych. Jednocześnie z metotreksatem w dawkach 15 mg na tydzień lub większych. Produktu leczniczego Coffepirine Tabletki od bólu głowy (podobnie jak innych zawierających kwas acetylosalicylowy) nie należy stosować w dniu, w którym pacjent otrzymuje dawkę metotreksatu. W ciężkiej niewydolności serca. Nie należy stosować produktu leczniczego w celu zwalczania bólu po operacji pomostowania naczyń wieńcowych.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt leczniczy należy stosować ostrożnie: w przypadku nadwrażliwości na niesteroidowe leki przeciwzapalne i przeciwreumatyczne lub inne substancje alergizujące; podczas jednoczesnego stosowania leków przeciwzakrzepowych; u pacjentów, u których w przeszłości występowała choroba wrzodowa lub krwawienia z przewodu pokarmowego; u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej; u pacjentów z nadczynnością tarczycy; u pacjentów z nadciśnieniem tętniczym; u pacjentów z padaczką. Należy ostrożnie stosować u pacjentów z chorobami alergicznymi (astma oskrzelowa, katar sienny, z polipami błony śluzowej nosa), przed zabiegami chirurgicznymi, w zaburzeniach czynności wątroby i nerek, w przypadku stosowania wewnątrzmacicznej wkładki antykoncepcyjnej lub w przypadku obfitych krwawień miesiączkowych.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgSpecjalne środki ostrozności
Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii. Przyjmowanie produktu leczniczego w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz poniżej wpływ na układ krążenia i naczynia mózgowe). Wpływ na układ krążenia i naczynia mózgowe. Z danych klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np. zawał serca lub udar). Dostępne dane są niewystarczające, aby wykluczyć takie ryzyko w przypadku przyjmowania Coffepirine Tabletki od bólu głowy w dawkach dobowych nie większych niż 6 tabletek (2,7 g kwasu acetylosalicylowego).
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgSpecjalne środki ostrozności
Dzieci i młodzież z objawami infekcji wirusowej, występującej z gorączką lub bez nie powinni przyjmować kwasu acetylosalicylowego bez uprzedniej konsultacji z lekarzem. W przypadku infekcji wirusowych, szczególnie takich jak: grypa typu A i B oraz ospa wietrzna, istnieje ryzyko wystąpienia zespołu Reye'a - rzadkiej, ale zagrażającej życiu choroby wymagającej natychmiastowej interwencji lekarskiej. Ryzyko może zwiększyć się, jeżeli w trakcie tych chorób, zostanie podany kwas acetylosalicylowy (związek przyczynowy nie został jednak udowodniony). Uporczywe wymioty występujące w czasie trwania chorób wirusowych mogą być objawem zespołu Reye'a.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Przeciwwskazane jest jednoczesne stosowanie z metotreksatem w dawkach 15 mg na tydzień lub większych. Metotreksat w dawkach mniejszych niż 15 mg na tydzień - nasilenie toksycznego działania metotreksatu na szpik kostny. Równoczesne stosowanie z tyklopidyną zwiększa ryzyko wystąpienia krwawienia. Jeśli istnieje konieczność jednoczesnego podawania produktów zawierających kwas acetylosalicylowy i tyklopidynę, należy kontrolować czas krwawienia. Skuteczność leków zwiększających wydalanie kwasu moczowego, leków moczopędnych np. spironolakton i furosemid, leków obniżających ciśnienie krwi może być zmniejszona, gdy stosowane są równocześnie z kwasem acetylosalicylowym. Kwas acetylosalicylowy nasila ototoksyczność furosemidu. W trakcie ogólnego stosowania glikokortysteroidów zmniejsza się stężenie salicylanów we krwi. Po odstawieniu steroidów istnieje ryzyko przedawkowania salicylanów.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgInterakcje
Dawkę salicylanów należy ustalić oddzielnie w okresie równoczesnego podawania z preparatami steroidowymi i ponownie po ich odstawieniu. Jednoczesne stosowanie produktu z pochodnymi fluorochinolonu (np. cyprofloksacyna), może spowodować kumulację kofeiny w organizmie. Cymetydyna i disulfiram oraz doustne środki antykoncepcyjne zwalniają metabolizm kofeiny. Barbiturany przyspieszają metabolizm kofeiny. Kofeina może nasilać działanie izoprenaliny. Kwas acetylosalicylowy nasila hipoglikemizujące działanie doustnych leków przeciwcukrzycowych z grupy sulfonylomocznika. Kwas acetylosalicylowy nasila działanie wszystkich leków zmniejszających krzepliwość krwi, w tym pochodnych kumaryny. Kwas acetylosalicylowy nasila działanie niektórych antybiotyków. Jednoczesne stosowanie kwasu acetylosalicylowego i innych niesteroidowych leków przeciwzapalnych zwiększa ryzyko uszkodzenia błony śluzowej przewodu pokarmowego, oraz uszkodzenie nerek.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgInterakcje
Picie alkoholu podczas leczenia zwiększa podrażnienie błon śluzowych i niebezpieczeństwo krwawień z przewodu pokarmowego. Kofeina osłabia działanie leków uspokajających i nasennych. Kofeina nasila działanie leków wywołujących tachykardię np. sympatykomimetyków, tyroksyny. Dane doświadczalne wskazują, że ibuprofen może hamować wpływ niskiej dawki kwasu acetylosalicylowego na agregację płytek w przypadku, gdy podaje się je jednocześnie. Jednakże ograniczenia badań i niepewność odnosząca się do ekstrapolacji badań ex vivo do przypadków klinicznych powodują, że nie ma jednoznacznych wniosków w przypadku regularnego lub sporadycznego stosowania ibuprofenu.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Produkt Coffepirine Tabletki od bólu głowy jest przeciwwskazany do stosowania w okresie ciąży. Karmienie piersi? Produkt Coffepirine Tabletki od bólu głowy jest przeciwwskazany podczas karmienia piersią. Płodność Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Coffepirine Tabletki od bólu głowy nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgDziałania niepożądane
4.8 Działania niepożądane Częstość występowania działań niepożądanych produktu leczniczego Coffepirine Tabletki od bólu głowy zależy od dawki produktu leczniczego, stanu i wrażliwości pacjenta oraz leczenia towarzyszącego. Częstość występowania działań niepożądanych oszacowano następująco: nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego: Nieznana: zwiększone ryzyko krwawień, wydłużenie czasu krwawienia, czasu protrombinowego, trombocytopenia. Zaburzenia układu immunologicznego: Nieznana: reakcje nadwrażliwości, w tym pokrzywka, odczyny skórne, reakcje anafilaktyczne, astma oskrzelowa, obrzęk naczynioruchowy. Zaburzenia układu nerwowego: Nieznana: zawroty głowy, szumy uszne. Nieznana: kofeina zawarta w produkcie leczniczym może powodować bezsenność, niepokój ruchowy.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgDziałania niepożądane
Długotrwałe przyjmowanie produktu leczniczego zawierającego kwas acetylosalicylowy może być przyczyną bólu głowy, który nasila się podczas przyjmowania kolejnych dawek. Zaburzenia serca: Kofeina może powodować zaburzenia rytmu serca. Nieznana: występowanie obrzęków, nadciśnienia i niewydolności serca. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale w dużych dawkach) może być związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np. zawał serca lub udar), patrz punkt 4.4. Zaburzenia żołądka i jelit: Nieznana: bóle brzucha, zgaga, nudności, wymioty; krwawienie z przewodu pokarmowego: jawne (fusowate wymioty, smoliste stolce) lub utajone, które mogą powodować niedokrwistość z niedoboru żelaza; choroba wrzodowa żołądka i dwunastnicy, perforacje. Zaburzenia wątroby i dróg żółciowych: Rzadko obserwowano zaburzenia czynności wątroby (zwiększenie aktywności aminotransferaz).
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgDziałania niepożądane
Zaburzenia nerek i dróg moczowych: W rzadkich przypadkach, po długotrwałym stosowaniu dużych dawek kwasu acetylosalicylowego zanotowano martwicę brodawek nerkowych i śródmiąższowe zapalenie nerek. Zaburzenia ogólne i stany w miejscu podania: Często: uczucie zmęczenia. Rzadko: obrzęk. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, Tel.: + 48 22 49 21 301, Faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgDziałania niepożądane
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedawkowania przeważnie występują po 2 godzinach. Po przedawkowaniu mogą wystąpić drżenie rąk, biegunka, senność, szumy uszne, bóle i zawroty głowy, dezorientacja, przyspieszony oddech, zaburzenia gospodarki kwasowo-zasadowej i kwasica metaboliczna, wymioty i bóle brzucha, podwyższenie temperatury ciała, zmniejszenie stężenia protrombiny, drgawki. W przypadku ciężkiego przedawkowania może wystąpić hiperwentylacja, zaburzenia oddychania, gorączka, kwasica metaboliczna, śpiączka. Objawami przedawkowania kofeiny są zaburzenia ze strony centralnego układu nerwowego tj. niepokój, pobudzenie, gonitwa myśli, bezsenność, drgawki, kołatanie serca, ból brzucha, biegunka, nudności i wymioty. Postępowanie po przedawkowaniu Pacjenta należy natychmiast przewieźć do szpitala. Postępowanie zależy od wielkości przyjętej dawki, stadium i objawów klinicznych.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgPrzedawkowanie
Należy zastosować środki mające na celu zmniejszenie wchłaniania substancji czynnej: płukanie żołądka, podanie węgla aktywowanego oraz kontrolować równowagę kwasowo-zasadową (niezbędna jest kontrola następujących parametrów krwi: pH, pC02, stężenia wodorowęglanów, stężenia potasu). Jeśli zachowana jest prawidłowa czynność nerek, można zastosować diurezę alkaliczną aż do uzyskania pH moczu w zakresie 7,5-8; w przypadku stężenia salicylanów w osoczu powyżej 500 mg/l (3,6 mmol/1) u dorosłych lub 300 mg/l (2,2 mmol/1) u dzieci należy rozważyć możliwość zastosowania forsowanej diurezy alkalicznej. Należy stosować wlewy dożylne zawierające NaHC03, KCl oraz leki moczopędne. W przypadku wystąpienia objawów pobudzenia centralnego układu nerwowego podaje się pochodne 1,4-benzodiazepiny. W przypadkach ciężkiego zatrucia można zastosować hemodializę lub dializę otrzewnową. Należy uzupełniać płyny oraz prowadzić ogólne postępowanie objawowe.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inne leki przeciwbólowe przeciwgorączkowe, kwas salicylowy i jego pochodne, preparaty złożone (bez psycholeptyków), kod ATC: N02BA51. Kwas acetylosalicylowy należy do grupy kwasowych niesteroidowych leków przeciwzapalnych o właściwościach przeciwbólowych, przeciwgorączkowych i przeciwzapalnych. Wykazano również jego właściwości antyagregacyjne. Mechanizm działania Mechanizm działania kwasu acetylosalicylowego polega na nieodwracalnym hamowaniu cyklooksygenazy kwasu arachidonowego, a tym samym hamowaniu syntezy prostanoidów: prostaglandyny E2 (PGE2), prostaglandyny I2 (PGI2) oraz tromboksanu A2. Kofeina należy do grupy ksantyn, które w dawkach terapeutycznych działają jako antagoniści receptorów adenozynowych. W wyniku tego zmniejsza się działanie hamujące adenozyny na ośrodkowy układ nerwowy.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgWłaściwości farmakodynamiczne
Mechanizm działania Kofeina działa na ośrodek naczynioruchowy w mózgu, wywołując skurcz mięśni gładkich naczyń krwionośnych, a tym samym zmniejszając przepływ krwi przez tkankę mózgową. Działa pobudzająco na ośrodek oddechowy. Dane doświadczalne wskazują, że ibuprofen może hamować wpływ niskiej dawki kwasu acetylosalicylowego na agregację płytek w przypadku, gdy podaje się je jednocześnie. W jednym badaniu, po przyjęciu pojedynczej dawki 400 mg ibuprofenu w ciągu 8 godzin przed lub w ciągu 30 minut po uwolnieniu dawki kwasu acetylosalicylowego (81 mg), stwierdzono zmniejszenie skuteczności ASA na powstawanie tromboksanu lub agregację płytek. Jednakże ograniczenia badań i niepewność odnosząca się do ekstrapolacji badań ex vivo do przypadków klinicznych powodują, że nie ma jednoznacznych wniosków w przypadku regularnego ani sporadycznego stosowania ibuprofenu.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Kwas acetylosalicylowy Wchłanianie Salicylany łatwo wchłaniają się z przewodu pokarmowego, częściowo w żołądku, głównie zaś w górnym odcinku jelita cienkiego. Szybkość wchłaniania zależy od stopnia jonizacji. Salicylany, jako słabe kwasy, są częściowo zjonizowane w środowisku zasadowym, w środowisku kwaśnym natomiast występują głównie w formie niezjonizowanej, która łatwo się wchłania. Stosowanie zatem leków zobojętniających jednocześnie z salicylanami, chociaż zmniejsza działanie drażniące na błonę śluzową żołądka, zmniejsza również w pewnym stopniu wchłanianie w żołądku salicylanów. Dystrybucja Salicylany łatwo przenikają do tkanek i płynów ustrojowych, między innymi przez łożysko do tkanek płodu. Metabolizm W organizmie są metabolizowane do kwasu salicylomoczowego, kwasu gentyzynowego oraz są sprzęgane z kwasem glukuronowym. Eliminacja Zazwyczaj tylko 10 % salicylanów wydala się z moczem w postaci nie zmienionej.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgWłaściwości farmakokinetyczne
Pochodne kwasu salicylowego powoli wydalają się z moczem, mogą się więc kumulować w organizmie. Alkalizacja moczu zwiększa czterokrotnie szybkość wydalania salicylanów. W chorobach nerek oraz podczas równoczesnego stosowania leków, które konkurują z salicylanami o mechanizmy transportujące w kanalikach nerkowych (probenecyd, acetazolamid), szybkość wydalania salicylanów zmniejsza się, co przyczynia się do ich kumulacji w organizmie. Salicylany wiążą się w 50-80 % z albuminami krwi. Kwas acetylosalicylowy może u niektórych ludzi spowodować acetylację lizyny, aminokwasu znajdującego się w albuminach. Ta przemiana aminokwasu może wywołać zmianę antygenowości albumin oraz wystąpienie nadwrażliwości na kwas acetylosalicylowy. Okres półtrwania wynosi od 2 do 3 godzin po zastosowaniu małych dawek, do ok. 15 godzin po dużych dawkach terapeutycznych lub w przypadku zatrucia. Kofeina Wchłanianie Po podaniu doustnym kofeina wchłania się prawie całkowicie w ciągu 2 do 13 minut.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgWłaściwości farmakokinetyczne
Po podaniu dawki 5 mg/kg mc. osiąga maksymalne stężenie w osoczu Cmax = 9-10 μg/ml po około 30-40 minutach. Biodostępność kofeiny po podaniu doustnym jest prawie całkowita. Wiąże się z białkami osocza w 30-40%, a objętość dystrybucji wynosi 0,52-1,05 l/kg mc. Dystrybucja Kofeina podlega dystrybucji do wszystkich kompartmentów, przenika przez barierę krew – mózg oraz przez łożysko, a także do mleka kobiet karmiących piersią. Biologiczny okres półtrwania kofeiny w osoczu wynosi od 4,1 do 5,7 godziny; zdarzają się jednakże różnice osobnicze dochodzące do 9-10 godzin. Metabolizm Kofeina jest metabolizowana głównie w wątrobie przy udziale układu enzymów związanych z cytochromem P-450 1A2 (CYP1A2) i z tego powodu może oddziaływać z lekami metabolizowanymi przez ten układ enzymów. Eliminacja Kofeina i jej metabolity wydalane są głównie przez nerki. W ciągu 48 godzin w moczu znajduje się do 86% podanej dawki.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgWłaściwości farmakokinetyczne
Nie więcej niż 1,8% podanej dawki kofeiny wydala się w postaci nie zmienionej. Głównymi metabolitami są: kwas 1-metylomoczowy (12-38%), 1-metyloksantyna (8-19%) i 5-acetyloamino-6-amino-3-metylouracyl (15%). Z kałem wydala się 2-5% podanej dawki. Główny metabolit to kwas 1,7-dimetylomoczowy, który stanowi 44% całkowitej ilości metabolitów wydalanych z kałem. Nie zaobserwowano dotychczas występowania interakcji farmakokinetycznych pomiędzy kwasem acetylosalicylowym i kofeiną.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach salicylany powodowały uszkodzenie nerek, lecz nie wywoływały innych zmian chorobowych. Kwas acetylosalicylowy został przebadany pod kątem działania mutagennego i rakotwórczego. Nie znaleziono dowodów świadczących o właściwościach mutagennych i rakotwórczych kwasu acetylosalicylowego. Badania na zwierzętach wykazały teratogenne działanie kofeiny, jednakże w badaniach u ludzi nie wykazano związku pomiędzy występowaniem wad wrodzonych, a spożyciem kofeiny przez kobiety w ciąży.
- CHPL leku Coffepirine Tabletki od bólu głowy, tabletki, 450 mg + 50 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Skrobia ziemniaczana Talk 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Blister z PVC/Aluminium lub z folii celofanowej i papieru laminowanego polietylenem w tekturowym pudełku w opakowaniach po 6, 8, 12 lub 18 tabletek. Blister z PVC/Aluminium w tekturowym pudełku w opakowaniach po 20, 50 tabletek. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Acard, tabletki dojelitowe, 75 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ACARD 75 mg, tabletki dojelitowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka dojelitowa zawiera 75 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka dojelitowa Tabletki dojelitowe są w kształcie serca, barwy białej lub prawie białej, obustronnie wypukłe, o gładkiej powierzchni.
- CHPL leku Acard, tabletki dojelitowe, 75 mgWskazania do stosowania
4.1 Wskazania do stosowania Choroba niedokrwienna serca oraz wszelkie sytuacje kliniczne, w których celowe jest hamowanie agregacji płytek krwi: zapobieganie zawałowi serca u osób dużego ryzyka; świeży zawał serca lub podejrzenie świeżego zawału serca; niestabilna choroba wieńcowa; prewencja wtórna u osób po przebytym zawale serca; stan po wszczepieniu pomostów aortalno-wieńcowych, angioplastyce wieńcowej; zapobieganie napadom przejściowego niedokrwienia mózgu (TIA) i niedokrwiennego udaru mózgu u pacjentów z TIA; po przebytym udarze niedokrwiennym mózgu u pacjentów z TIA; u osób z zarostową miażdżycą tętnic obwodowych; zapobieganie zakrzepicy naczyń wieńcowych u pacjentów z mnogimi czynnikami ryzyka; zapobieganie zakrzepicy żylnej i zatorowi płuc u pacjentów długotrwale unieruchomionych, np. po dużych zabiegach chirurgicznych jako uzupełnienie innych sposobów profilaktyki.
- CHPL leku Acard, tabletki dojelitowe, 75 mgDawkowanie
4.2 Dawkowanie i sposób podawania Podanie doustne. Tabletka dojelitowa produktu Acard ma otoczkę i nie rozpada się w żołądku, przez co zmniejsza się drażniące działanie kwasu acetylosalicylowego na błonę śluzową żołądka. Tabletki dojelitowe należy przyjmować po posiłku - połykać w całości. Uwaga: w świeżym zawale serca lub podejrzeniu świeżego zawału serca tabletki dojelitowe mogą być stosowane, gdy nie jest dostępny kwas acetylosalicylowy w tabletkach niepowlekanych. W takim przypadku tabletki dojelitowe należy bardzo dokładnie rozgryźć, aby uzyskać szybkie wchłanianie. Zapobieganie zawałowi serca u osób dużego ryzyka: Zwykle 1 tabletka dojelitowa (75 mg) na dobę. Świeży zawał serca lub podejrzenie świeżego zawału serca: Jednorazowo 4 tabletki dojelitowe (300 mg). Tabletki dojelitowe należy bardzo dokładnie rozgryźć, aby uzyskać szybkie wchłanianie! Niestabilna choroba wieńcowa, prewencja wtórna u osób po przebytym zawale serca: Zwykle 1 tabletka dojelitowa (75 mg) na dobę.
- CHPL leku Acard, tabletki dojelitowe, 75 mgDawkowanie
Stan po wszczepieniu pomostów aortalno-wieńcowych, angioplastyce wieńcowej: Zwykle 1 tabletka dojelitowa (75 mg) na dobę. Zapobieganie napadom przejściowego niedokrwienia mózgu (TIA) i niedokrwiennego udaru mózgu u pacjentów z TIA: Zwykle 1 tabletka dojelitowa (75 mg) na dobę. Po przebytym udarze niedokrwiennym mózgu u pacjentów z TIA: 1 tabletka dojelitowa (75 mg) na dobę. U osób z zarostową miażdżycą tętnic obwodowych: Zwykle 1 tabletka dojelitowa (75 mg) na dobę. Zapobieganie zakrzepicy naczyń wieńcowych u pacjentów z mnogimi czynnikami ryzyka: Zalecana dawka dobowa 1 do 2 tabletek dojelitowych (75 mg do 150 mg). Zapobieganie zakrzepicy żylnej i zatorowi płuc u pacjentów długotrwale unieruchomionych, np. po dużych zabiegach chirurgicznych jako uzupełnienie innych sposobów profilaktyki: 1 do 2 tabletek dojelitowych (75 mg do 150 mg) na dobę.
- CHPL leku Acard, tabletki dojelitowe, 75 mgPrzeciwwskazania
4.3 Przeciwwskazania Kwasu acetylosalicylowego nie należy stosować: w przypadku nadwrażliwości na kwas acetylosalicylowy, inne salicylany lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; u pacjentów ze skazą krwotoczną; u pacjentów z czynną chorobą wrzodową żołądka i (lub) dwunastnicy; u pacjentów z ciężką niewydolnością nerek; u pacjentów z ciężką niewydolnością wątroby; u pacjentów z napadami tzw. astmy aspirynowej w wywiadzie, wywołanymi podaniem salicylanów lub substancji o podobnym działaniu, szczególnie niesteroidowych leków przeciwzapalnych; jednocześnie z metotreksatem w dawkach 15 mg na tydzień lub większych (patrz punkt 4.5); w ostatnim trymestrze ciąży; u dzieci w wieku do 12 lat w przebiegu infekcji wirusowych ze względu na ryzyko wystąpienia zespołu Reye’a - rzadko występującej, ale ciężkiej choroby powodującej uszkodzenie wątroby i mózgu.
- CHPL leku Acard, tabletki dojelitowe, 75 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Znaczna część podanych poniżej ostrzeżeń i środków ostrożności dotyczy kwasu acetylosalicylowego stosowanego w dawkach konwencjonalnych, tj. od 1g do 3 g na dobę i wystąpienie tych reakcji jest mało prawdopodobne przy stosowaniu małych dawek produktu. Kwas acetylosalicylowy należy stosować ostrożnie: w pierwszym i drugim trymestrze ciąży; w okresie karmienia piersią; w przypadku nadwrażliwości na niesteroidowe leki przeciwzapalne i przeciwreumatyczne lub inne substancje alergizujące; podczas jednoczesnego stosowania leków przeciwzakrzepowych; podczas jednoczesnego stosowania ibuprofenu; u pacjentów z zaburzoną czynnością wątroby lub nerek; u pacjentów z chorobą wrzodową lub krwawieniami z przewodu pokarmowego w wywiadzie; u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej; u pacjentów z ciężką niewydolnością serca.
- CHPL leku Acard, tabletki dojelitowe, 75 mgSpecjalne środki ostrozności
Kwas acetylosalicylowy może być stosowany u pacjentów z nadwrażliwością na niesteroidowe leki przeciwzapalne lub inne substancje alergizujące wyłącznie po rozważeniu stosunku ryzyka do korzyści. Kwas acetylosalicylowy może powodować skurcz oskrzeli i wywoływać napady astmy lub inne reakcje nadwrażliwości. Czynniki ryzyka obejmują: astmę oskrzelową, przewlekłe choroby układu oddechowego, katar sienny z polipami błony śluzowej nosa. Ostrzeżenie to odnosi się także do pacjentów wykazujących reakcje alergiczne (np. odczyny skórne, świąd, pokrzywka) na inne substancje. U pacjentów ze zwiększoną skłonnością do krwawień (hemofilia, niedobór witaminy K), przyjmujących leki przeciwzakrzepowe (np. pochodne kumaryny lub heparynę - z wyjątkiem leczenia heparyną w małych dawkach) zastosowanie kwasu acetylosalicylowego należy rozważyć, uwzględniając stosunek ryzyka do korzyści. Kwas acetylosalicylowy należy stosować ostrożnie u pacjentów z zaburzoną czynnością wątroby lub nerek.
- CHPL leku Acard, tabletki dojelitowe, 75 mgSpecjalne środki ostrozności
Należy rozważyć stosowanie produktu leczniczego u pacjentów, u których w wywiadzie stwierdzono owrzodzenie żołądka i (lub) dwunastnicy, ponieważ może się uczynnić choroba wrzodowa oraz mogą wystąpić krwawienia z przewodu pokarmowego. Kwas acetylosalicylowy, ze względu na działanie antyagregacyjne, może powodować wydłużenie czasu krwawienia podczas lub po zabiegach chirurgicznych (włącznie z niewielkimi zabiegami, np. ekstrakcją zęba). Nie należy podawać kwasu acetylosalicylowego na 5 dni przed planowanym zabiegiem chirurgicznym, zwłaszcza okulistycznym i otologicznym. Kwas acetylosalicylowy, nawet w małych dawkach, hamuje wydalanie kwasu moczowego. U pacjentów ze zmniejszonym wydalaniem kwasu moczowego produkt leczniczy może wywołać napad dny moczanowej. Produkt zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Acard, tabletki dojelitowe, 75 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Częstość występowania interakcji kwasu acetylosalicylowego stosowanego w małych dawkach nie jest dokładnie poznana. Większość dotychczas opisanych interakcji dotyczy podawania kwasu acetylosalicylowego w dawkach konwencjonalnych, tj. od 1g do 3 g na dobę. Leki przeciwwskazane do jednoczesnego stosowania z kwasem acetylosalicylowym: metotreksat w dawkach 15 mg na tydzień lub większych Nasilenie toksycznego działania metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z lekami przeciwzapalnymi - w tym z kwasem acetylosalicylowym - oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza - patrz punkt 4.3). Interakcje wymagające zachowania szczególnej ostrożności: metotreksat w dawkach mniejszych niż 15 mg na tydzień ibuprofen leki przeciwzakrzepowe, np.
- CHPL leku Acard, tabletki dojelitowe, 75 mgInterakcje
pochodne kumaryny, heparyna inne niesteroidowe leki przeciwzapalne, w tym salicylany w dużych dawkach (≥ 3 g/dobę) leki zwiększające wydalanie kwasu moczowego z moczem, np. benzbromaron, probenecyd digoksyna leki przeciwcukrzycowe, np. insulina, pochodne sulfonylomocznika leki trombolityczne lub inne leki hamujące agregację płytek krwi, np. tyklopidyna leki moczopędne stosowane jednocześnie z kwasem acetylosalicylowym w dawkach 3 g na dobę i większych glikokortykosteroidy systemowe, z wyjątkiem hydrokortyzonu stosowanego jako terapia zastępcza w chorobie Addisona inhibitory konwertazy angiotensyny (ACE) stosowane jednocześnie z kwasem acetylosalicylowym w dawkach 3 g na dobę i większych kwas walproinowy metamizol alkohol Dane doświadczalne wskazują na możliwość hamowania przez ibuprofen wpływu małych dawek ASA na agregację płytek krwi w przypadku jednoczesnego podawania obu leków.
- CHPL leku Acard, tabletki dojelitowe, 75 mgInterakcje
Z uwagi jednak na ograniczenia wspomnianych danych oraz wątpliwości związane z ekstrapolacją danych uzyskanych ex vivo do warunków klinicznych, sformułowanie jednoznacznych wniosków dotyczących regularnego stosowania ibuprofenu nie jest możliwe, a kliniczne następstwa interakcji w przypadku doraźnego podawania ibuprofenu są mało prawdopodobne (patrz punkt 5.1). Jednoczesne stosowanie kwasu acetylosalicylowego z lekami przeciwzakrzepowymi może powodować nasilenie działania przeciwzakrzepowego: zwiększone ryzyko wydłużenia czasu krwawienia i krwotoków, wynikające z wypierania leków przeciwzakrzepowych z ich połączeń z białkami osocza oraz właściwości antyagregacyjnych kwasu acetylosalicylowego. Jednoczesne stosowanie niesteroidowych leków przeciwzapalnych z kwasem acetylosalicylowym zwiększa ryzyko wystąpienia uszkodzeń błony śluzowej żołądka i (lub) dwunastnicy i krwawień z przewodu pokarmowego oraz uszkodzenia nerek, na skutek synergicznego działania tych leków.
- CHPL leku Acard, tabletki dojelitowe, 75 mgInterakcje
Kwas acetylosalicylowy stosowany jednocześnie z lekami nasilającymi wydalanie kwasu moczowego, powoduje osłabienie działania leków przeciwdnawych (konkurencja w procesie wydalania kwasu moczowego przez kanaliki nerkowe). Jednoczesne stosowanie kwasu acetylosalicylowego z digoksyną powoduje zwiększenie stężenia digoksyny w osoczu, wynikające ze zmniejszonego wydalania digoksyny przez nerki. Ze względu na właściwości hipoglikemizujące oraz wypieranie pochodnych sulfonylomocznika z połączeń z białkami osocza kwas acetylosalicylowy nasila działanie leków przeciwcukrzycowych. Jednoczesne stosowanie kwasu acetylosalicylowego z lekami trombolitycznymi lub innymi lekami hamującymi agregację płytek krwi może powodować zwiększone ryzyko wydłużenia czasu krwawienia i krwotoków. Jednoczesne stosowanie leków moczopędnych z kwasem acetylosalicylowym w dawkach 3 g na dobę i większych – osłabienie działania moczopędnego poprzez zatrzymanie sodu i wody w organizmie na skutek zmniejszonej filtracji kłębuszkowej, spowodowanej zmniejszoną syntezą prostaglandyn w nerkach.
- CHPL leku Acard, tabletki dojelitowe, 75 mgInterakcje
Kwas acetylosalicylowy może nasilać działanie ototoksyczne furosemidu. Jednoczesne stosowanie glikokortykosteroidów systemowych, z wyjątkiem hydrokortyzonu stosowanego jako terapia zastępcza w chorobie Addisona, z kwasem acetylosalicylowym - zwiększone ryzyko wystąpienia choroby wrzodowej żołądka i (lub) dwunastnicy, krwawienia z przewodu pokarmowego oraz zmniejszenie stężenia salicylanów w osoczu w trakcie kortykoterapii i zwiększenie ryzyka przedawkowania salicylanów po zakończeniu przyjmowania glikokortykosteroidów. Jednoczesne stosowanie inhibitorów konwertazy angiotensyny (ACE) z kwasem acetylosalicylowym w dawkach 3 g na dobę i większych - zmniejszenie działania przeciwnadciśnieniowego poprzez zmniejszenie filtracji kłębuszkowej, wynikające z hamowania produkcji prostaglandyn, działających rozszerzająco na naczynia krwionośne. Kwas acetylosalicylowy zwiększa toksyczność kwasu walproinowego, poprzez wypieranie go z połączeń z białkami osocza.
- CHPL leku Acard, tabletki dojelitowe, 75 mgInterakcje
Kwas walproinowy nasila działanie antyagregacyjne kwasu acetylosalicylowego ze względu na synergiczne działanie antyagregacyjne obu leków. Jednoczesne stosowanie metamizolu z kwasem acetylosalicylowym może zmniejszać działanie hamujące kwasu acetylosalicylowego na agregację płytek krwi. Z tego względu metamizol należy stosować ostrożnie u pacjentów przyjmujących kwas acetylosalicylowy w małych dawkach w celu ochronnego działania na układ sercowo-naczyniowy. Alkohol może zwiększyć ryzyko wystąpienia działań niepożądanych dotyczących przewodu pokarmowego, tj. owrzodzenie błony śluzowej lub krwawienia.
- CHPL leku Acard, tabletki dojelitowe, 75 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Stosowanie kwasu acetylosalicylowego w I i II trymestrze ciąży jest dopuszczalne tylko pod warunkiem dokładnej oceny stosunku ryzyka do korzyści wynikających z leczenia. Stosowanie kwasu acetylosalicylowego w trzecim trymestrze ciąży jest przeciwwskazane. Zastosowanie bezpośrednio przed porodem może spowodować zahamowanie czynności porodowej lub nadmierne krwawienie. Karmienie piersi? Kwas acetylosalicylowy i jego metabolity przenikają w niewielkich ilościach do mleka kobiet karmiących piersią. Ponieważ jak dotąd, podczas krótkotrwałego stosowania salicylanów przez matki, nie stwierdzono występowania działań niepożądanych u niemowląt karmionych piersią, przerywanie karmienia piersią z reguły nie jest konieczne. Jednakże w przypadku regularnego przyjmowania dużych dawek kwasu acetylosalicylowego, karmienie piersią powinno być wcześniej przerwane.
- CHPL leku Acard, tabletki dojelitowe, 75 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt nie wywiera wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Acard, tabletki dojelitowe, 75 mgDziałania niepożądane
4.8 Działania niepożądane Poniżej przedstawiono działania niepożądane związane ze stosowaniem kwasu acetylosalicylowego: bardzo często (≥1/10); często (≥1/100, <1/10); niezbyt często (≥1/1000, <1/100); rzadko (≥1/10 000, <1/1000); bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia żołądka i jelit Często: objawy niestrawności (zgaga, nudności, wymioty) i bóle brzucha. Rzadko: stany zapalne żołądka i jelit, choroba wrzodowa żołądka i (lub) dwunastnicy bardzo rzadko prowadzące do krwotoków i perforacji charakteryzujące się odpowiednimi objawami klinicznymi i wynikami badań laboratoryjnych. Zaburzenia wątroby i dróg żółciowych Rzadko: przemijające zaburzenia czynności wątroby ze zwiększeniem aktywności aminotransferaz. Zaburzenia układu nerwowego Zawroty głowy i szumy uszne, będące zazwyczaj objawami przedawkowania.
- CHPL leku Acard, tabletki dojelitowe, 75 mgDziałania niepożądane
Zaburzenia krwi i układu chłonnego Zwiększone ryzyko krwawień, wydłużenie czasu krwawienia. Obserwowano krwawienia takie jak: krwotok okołooperacyjny, krwiaki, krwawienie z nosa, krwawienia z dróg moczowo-płciowych, krwawienia dziąseł. Rzadko lub bardzo rzadko raportowano poważne krwawienia takie jak: krwotok z przewodu pokarmowego, krwotok mózgowy (szczególnie u pacjentów z niekontrolowanym nadciśnieniem tętniczym i (lub) podczas równoczesnego podawania leków hemostatycznych), które w pojedynczych przypadkach mogą potencjalnie zagrażać życiu. Krwotok może prowadzić do ostrej lub przewlekłej niedokrwistości w wyniku krwotoku i (lub) niedokrwistości z niedoboru żelaza (na przykład w wyniku utajonych mikrokrwawień) z odpowiednimi objawami laboratoryjnymi i klinicznymi, takimi jak osłabienie, bladość, hypoperfuzja.
- CHPL leku Acard, tabletki dojelitowe, 75 mgDziałania niepożądane
Zaburzenia układu immunologicznego Reakcje nadwrażliwości z odpowiednimi objawami laboratoryjnymi i klinicznymi, w tym: astma, odczyny skórne, wysypka, pokrzywka, obrzęk, świąd, zaburzenia serca i układu oddechowego. Bardzo rzadko: ciężkie reakcje alergiczne włączając wstrząs anafilaktyczny. Zaburzenia nerek i dróg moczowych Bardzo rzadko: zaburzenia czynności nerek. Zaburzenia metabolizmu i odżywiania Bardzo rzadko: hipoglikemia. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al.
- CHPL leku Acard, tabletki dojelitowe, 75 mgDziałania niepożądane
Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Acard, tabletki dojelitowe, 75 mgPrzedawkowanie
4.9 Przedawkowanie Przedawkowanie u osób w podeszłym wieku i u małych dzieci wymaga szczególnej uwagi, gdyż może ono w tych grupach pacjentów prowadzić do zgonu. Z uwagi na niewielką dawkę kwasu acetylosalicylowego, przypadkowe przedawkowanie produktu Acard jest mało prawdopodobne. Celowe zażycie znacznej liczby tabletek może doprowadzić do wytworzenia się stężeń toksycznych we krwi, które mogą pojawiać się z opóźnieniem nawet do 12 godzin. Przyjęcie znacznej ilości tabletek dojelitowych zawierających otoczkę może doprowadzić do powstania w żołądku agregatu złożonego ze sklejonych tabletek, trudnego do usunięcia. Objawami przedawkowania są zwykle: szumy uszne, hiperwentylacja, gorączka, nudności, wymioty, zaburzenia widzenia, bóle i zawroty głowy, stan splątania, zaburzenia równowagi kwasowo-zasadowej i elektrolitowej, hipoglikemia, wykwity skórne. W przypadku ostrego przedawkowania mogą wystąpić: delirium, drżenie, duszność, nadmierna potliwość, pobudzenie, śpiączka.
- CHPL leku Acard, tabletki dojelitowe, 75 mgPrzedawkowanie
Postępowanie lecznicze polega na zmniejszeniu wchłaniania produktu leczniczego poprzez usunięcie zawartości żołądka (wywołanie wymiotów lub płukanie żołądka – jeśli od połknięcia tabletek nie upłynęła jedna godzina), przyspieszeniu wydalania produktu leczniczego, monitorowaniu równowagi wodno-elektrolitowej oraz unormowaniu temperatury ciała i czynności oddechowej.
- CHPL leku Acard, tabletki dojelitowe, 75 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwzakrzepowe; inhibitory krzepnięcia; kwas acetylosalicylowy. Kod ATC: B01AC06 Kwas acetylosalicylowy jest nieodwracalnym inhibitorem cyklooksygenazy, enzymu powodującego syntezę prostaglandyn z kwasu arachidonowego. Mechanizm ten jest odpowiedzialny za działanie przeciwzapalne, przeciwgorączkowe oraz przeciwbólowe. Najważniejszym działaniem kwasu acetylosalicylowego w dawce 75 mg jest hamowanie syntezy tromboksanu A2, związku zwiększającego agregację płytek i kurczącego naczynia. Zahamowanie cyklooksygenazy płytek prowadzi do zmniejszenia ich zdolności do agregacji. Agregacja płytek jest podstawowym procesem, od którego zależy stopniowe zwężenie się naczynia wieńcowego w przebiegu choroby niedokrwiennej serca. Osadzanie się agregatów płytkowych na zmienionym miażdżycowo odcinku naczynia prowadzi do powstania zakrzepów, stopniowo pogarszających perfuzję mięśnia sercowego aż do jego zawału.
- CHPL leku Acard, tabletki dojelitowe, 75 mgWłaściwości farmakodynamiczne
Wyniki licznych badań kontrolowanych świadczą, że optymalne hamowanie cyklooksygenazy płytkowej w stosunku do naczyniowej można uzyskać stosując małe dawki kwasu acetylosalicylowego, tj. od 40 mg do 150 mg na dobę. Przypuszcza się, że niewielkie dawki kwasu acetylosalicylowego w tabletkach posiadających otoczkę, która zapobiega uwolnieniu substancji czynnej w żołądku, wytwarzają w krążeniu wrotnym stężenia, wystarczające do zahamowania cyklooksygenazy płytkowej, podczas gdy małe stężenia w krążeniu obwodowym zabezpieczają przed zbyt silnym zahamowaniem syntezy prostacykliny w ścianie naczyń oraz przed działaniami niepożądanymi. Małe dawki kwasu acetylosalicylowego mogą więc działać skuteczniej od większych, powodując jednocześnie mniej działań niepożądanych. Dane doświadczalne wskazują na możliwość hamowania przez ibuprofen wpływu małych dawek ASA na agregację płytek krwi w przypadku jednoczesnego podawania obu leków.
- CHPL leku Acard, tabletki dojelitowe, 75 mgWłaściwości farmakodynamiczne
W jednym z badań po podaniu pojedynczej dawki ibuprofenu 400 mg w ciągu 8 godzin przed lub w ciągu 30 minut po podaniu ASA w postaci farmaceutycznej o natychmiastowym uwalnianiu (81 mg), odnotowano osłabienie wpływu ASA na powstawanie tromboksanu lub agregację płytek. Z uwagi jednak na ograniczenia wspomnianych danych oraz wątpliwości związane z ekstrapolacją danych uzyskanych ex vivo do warunków klinicznych, sformułowanie jednoznacznych wniosków dotyczących regularnego stosowania ibuprofenu nie jest możliwe, a kliniczne następstwa interakcji w przypadku doraźnego podawania ibuprofenu są mało prawdopodobne.
- CHPL leku Acard, tabletki dojelitowe, 75 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Kwas acetylosalicylowy znajdujący się w tabletkach posiadających otoczkę jest wchłaniany wolniej z przewodu pokarmowego niż z postaci rozpadających się w żołądku, między innymi dlatego, że w środowisku zasadowym znaczna część kwasu acetylosalicylowego występuje w postaci zdysocjowanej. Jednak obecność otoczki powoduje, że nie następuje uszkodzenie błony śluzowej żołądka. Pokarm opóźnia nieco wchłanianie substancji czynnej z tabletek z otoczką, nie na tyle jednak, by zmieniało to działanie produktu leczniczego. Po wchłonięciu kwas acetylosalicylowy jest szybko metabolizowany do kwasu salicylowego. Hamowanie agregacji płytek zależy prawdopodobnie od niezmienionej cząsteczki kwasu acetylosalicylowego. Powstający kwas salicylowy jest związany z białkami osocza w około 90% i jest eliminowany częściowo jako związek niezmieniony, częściowo pod postacią metabolitów.
- CHPL leku Acard, tabletki dojelitowe, 75 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Badania przeprowadzone na zwierzętach z użyciem kwasu acetylosalicylowego nie wykazały działania rakotwórczego. Przeprowadzone badania in vitro i in vivo nie wykazały działania mutagennego.
- CHPL leku Acard, tabletki dojelitowe, 75 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Celuloza sproszkowana Skrobia kukurydziana Karboksymetyloskrobia sodowa Otoczka: Hypromeloza Acryl Eze-White: Kopolimer kwasu metakrylowego typ C Talk Tytanu dwutlenek (E 171) Krzemionka koloidalna bezwodna Sodu wodorowęglan Sodu laurylosiarczan Trietylu cytrynian Emulsja antypienna 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Blister z folii Aluminium/PVC/PVDC w tekturowym pudełku. Opakowanie zawiera 30, 60, 90 lub 120 tabletek dojelitowych. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Acard, tabletki dojelitowe, 75 mgDane farmaceutyczne
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Acesan, tabletki, 30 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ACESAN, 30 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Jedna tabletka zawiera 30 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum). Substancja pomocnicza o znanym działaniu: żółcień chinolinowa, lak (E104) Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki Tabletki barwy żółtej, okrągłe, obustronnie wypukłe, o jednolitej powierzchni
- CHPL leku Acesan, tabletki, 30 mgWskazania do stosowania
4.1 Wskazania do stosowania Zapobieganie zawałowi mięśnia sercowego u pacjentów z wieloma czynnikami ryzyka Zapobieganie powikłaniom zatorowo-zakrzepowym po interwencjach na naczyniach (pomostowanie aortalno-wieńcowe – ang. CABG) Zapobieganie udarowi mózgu W dławicy piersiowej Zapobieganie powikłaniom zatorowo-zakrzepowym po świeżym zawale mięśnia sercowego
- CHPL leku Acesan, tabletki, 30 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie O doborze dawki leku ACESAN decyduje lekarz na podstawie wywiadu. Zwykle stosuje się 1 tabletkę raz na dobę. Sposób podawania Tabletki należy przyjmować doustnie, najlepiej w trakcie posiłku, z dużą ilością płynu.
- CHPL leku Acesan, tabletki, 30 mgPrzeciwwskazania
4.3 Przeciwwskazania Produktu nie należy stosować: w przypadku nadwrażliwości na substancję czynną – kwas acetylosalicylowy, inne salicylany lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, u pacjentów ze skazą krwotoczną, u pacjentów z czynną chorobą wrzodową żołądka i (lub) dwunastnicy, u pacjentów z ciężką niewydolnością wątroby, u pacjentów z ciężką niewydolnością nerek, u pacjentów z ciężką niewydolnością serca, u pacjentów z napadami astmy oskrzelowej w wywiadzie, wywołanymi podaniem salicylanów lub substancji o podobnym działaniu, szczególnie niesteroidowych leków przeciwzapalnych, jednocześnie z metotreksatem w dawkach 15 mg na tydzień lub większych (patrz punkt 4.5), w ostatnim trymestrze ciąży, u dzieci w wieku do 12 lat w przebiegu infekcji wirusowych ze względu na ryzyko wystąpienia zespołu Reye’a – rzadkiej, ale ciężkiej choroby powodującej uszkodzenie wątroby i mózgu.
- CHPL leku Acesan, tabletki, 30 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Kwas acetylosalicylowy należy stosować ostrożnie: w pierwszym i drugim trymestrze ciąży, w okresie karmienia piersią, w przypadku nadwrażliwości na niesteroidowe leki przeciwzapalne i przeciwreumatyczne lub inne substancje alergizujące, podczas jednoczesnego stosowania leków przeciwzakrzepowych, u pacjentów z zaburzoną czynnością nerek, u pacjentów z zaburzoną czynnością wątroby, u pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy lub krwawieniami z przewodu pokarmowego w wywiadzie, u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej. Ibuprofen przyjmowany jednocześnie z produktem ACESAN, może zmniejszać jego skuteczność terapeutyczną. Przed zastosowaniem ibuprofenu pacjent stosujący ACESAN powinien skontaktować się z lekarzem. Kwas acetylosalicylowy może powodować skurcz oskrzeli i wywoływać napady astmy lub inne reakcje nadwrażliwości.
- CHPL leku Acesan, tabletki, 30 mgSpecjalne środki ostrozności
Czynniki ryzyka obejmują: astmę oskrzelową, przewlekłe choroby układu oddechowego, katar sienny z polipami błony śluzowej nosa. Ostrzeżenie to odnosi się także do pacjentów, u których występują reakcje alergiczne (np. odczyny skórne, świąd, pokrzywka) na inne substancje. Kwas acetylosalicylowy, ze względu na działanie antyagregacyjne, może prowadzić do wydłużenia czasu krwawienia w czasie lub po zabiegach chirurgicznych (włącznie z niewielkimi zabiegami, np. ekstrakcją zęba). Może być konieczne czasowe przerwanie leczenia. Należy rozważyć odstawienie kwasu acetylosalicylowego na 5-7 dni przed planowanym zabiegiem chirurgicznym. Kwas acetylosalicylowy, nawet w małych dawkach, zmniejsza wydalanie kwasu moczowego. U pacjentów ze zmniejszonym wydalaniem kwasu moczowego produkt może wywołać napad dny moczanowej. Dzieci i młodzież z objawami infekcji wirusowej, występującej z gorączką lub bez, nie powinni przyjmować kwasu acetylosalicylowego bez uprzedniej konsultacji z lekarzem.
- CHPL leku Acesan, tabletki, 30 mgSpecjalne środki ostrozności
W przypadku infekcji wirusowych, szczególnie takich jak: grypa typu A i B oraz ospa wietrzna, istnieje ryzyko wystąpienia zespołu Reye’a – rzadkiej, ale zagrażającej życiu choroby wymagającej natychmiastowej interwencji lekarskiej. Ryzyko może zwiększyć się, jeżeli w trakcie tych chorób zostanie podany kwas acetylosalicylowy. Nie udowodniono jednak związku pomiędzy chorobami wirusowymi a przyjmowaniem kwasu acetylosalicylowego. Uporczywe wymioty występujące w czasie trwania chorób wirusowych mogą być objawem zespołu Reye’a. Ze względu na zawartość żółcieni chinolinowej, lek może powodować reakcje alergiczne.
- CHPL leku Acesan, tabletki, 30 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Leki przeciwwskazane do jednoczesnego stosowania z kwasem acetylosalicylowym: metotreksat w dawkach 15 mg na tydzień lub większych Zwiększenie toksycznego działania metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z lekami przeciwzapalnymi, w tym z kwasem acetylosalicylowym, oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza – patrz punkt 4.3) Interakcje wymagające zachowania szczególnej ostrożności: metotreksat w dawkach mniejszych niż 15 mg na tydzień ibuprofen leki przeciwzakrzepowe, np. pochodne kumaryny, heparyna selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI), np. sertralina lub paroksetyna inne niesteroidowe leki przeciwzapalne, w tym salicylany w dużych dawkach (≥ 3 g/dobę) leki zwiększające wydalanie kwasu moczowego z moczem, np.
- CHPL leku Acesan, tabletki, 30 mgInterakcje
benzbromaron, probenecyd digoksyna leki przeciwcukrzycowe, np. insulina, pochodne sulfonylomocznika leki trombolityczne lub inne leki hamujące agregację płytek krwi, np. tyklopidyna leki moczopędne stosowane jednocześnie z kwasem acetylosalicylowym w dawkach 3 g na dobę i większych glikokortykosteroidy systemowe, z wyjątkiem hydrokortyzonu stosowanego jako terapia zastępcza w chorobie Addisona inhibitory konwertazy angiotensyny (ACE) stosowane jednocześnie z kwasem acetylosalicylowym w dawkach 3 g na dobę i większych kwas walproinowy metamizol alkohol
- CHPL leku Acesan, tabletki, 30 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może mieć niekorzystny wpływ na ciążę i (lub) rozwój zarodka lub płodu. Wyniki badań epidemiologicznych wskazują na to, że stosowanie inhibitorów syntezy prostaglandyn we wczesnym okresie ciąży zwiększa ryzyko poronienia, występowania wad wrodzonych. Całkowite ryzyko wystąpienia wrodzonych wad sercowo-naczyniowych zwiększa się z mniej niż 1% do około 1,5%. Uważa się, że ryzyko zwiększa się wraz z dawką i długością terapii. U zwierząt po podaniu inhibitorów syntezy prostaglandyn zaobserwowano zwiększone ryzyko obumarcia zapłodnionego jaja w okresie przed i po zagnieżdżeniu się w macicy oraz zwiększone ryzyko obumarcia zarodka lub płodu. Dodatkowo, u zwierząt, po podaniu inhibitorów syntezy prostaglandyn w okresie organogenezy donoszono o zwiększonej liczbie przypadków różnych wad rozwojowych, w tym wad sercowo-naczyniowych.
- CHPL leku Acesan, tabletki, 30 mgWpływ na płodność, ciążę i laktację
Kwas acetylosalicylowy nie powinien być stosowany u kobiet w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. W razie stosowania kwasu acetylosalicylowego przez kobiety planujące ciążę lub w pierwszym i drugim trymestrze ciąży, należy stosować jak najmniejszą dawkę leku przez jak najkrótszy czas. W trzecim trymestrze ciąży wszystkie inhibitory syntezy prostaglandyn mogą powodować narażenie płodu na: działania toksyczne na układ krążenia i oddechowy (włącznie z przedwczesnym zamknięciem przewodu tętniczego i nadciśnieniem płucnym), zaburzenia czynności nerek mogące prowadzić do niewydolności nerek i małowodzia; W końcowym okresie ciąży wszystkie inhibitory prostaglandyn mogą spowodować narażenie matki i noworodka na: możliwość wydłużenia czasu krwawienia oraz działanie antyagregacyjne, które może ujawnić się nawet po zastosowaniu małych dawek, zahamowanie czynności skurczowej macicy prowadzącej do opóźnienia porodu lub przedłużenia akcji porodowej.
- CHPL leku Acesan, tabletki, 30 mgWpływ na płodność, ciążę i laktację
W konsekwencji kwas acetylosalicylowy w dawkach 100 mg/dobę lub wyższych jest przeciwwskazany w trzecim trymestrze ciąży. Karmienie piersi? Kwas acetylosalicylowy i jego metabolity przenikają w niewielkich ilościach do mleka kobiet karmiących piersią. Ponieważ jak dotąd, podczas krótkotrwałego stosowania salicylanów przez matki, nie stwierdzono występowania działań niepożądanych u niemowląt karmionych piersią, przerywanie karmienia piersią z reguły nie jest konieczne. Jednakże w przypadku regularnego przyjmowania dużych dawek kwasu acetylosalicylowego, karmienie piersią powinno być wcześniej przerwane.
- CHPL leku Acesan, tabletki, 30 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Acesan, tabletki, 30 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane zostały pogrupowane na podstawie klasyfikacji układów i narządów. Częstość działań niepożądanych została zdefiniowana następująco: bardzo często (≥1/10), często (1/100 do <1/10), niezbyt często (1/1000 do <1/100), rzadko (1/10 000 do <1/1000), bardzo rzadko (<1/10 000), nieznana (częstość nie może być określona na podstawie dostępnych danych) Zaburzenia krwi i układu chłonnego Zwiększone ryzyko krwawień, wydłużenie czasu krwawienia, czasu protrombinowego, trombocytopenia. Obserwowano krwawienia takie jak: krwotok okołooperacyjny, krwiaki, krwawienie z nosa, krwawienia z dróg moczowo-płciowych, krwawienia dziąseł. Rzadko lub bardzo rzadko raportowano poważne krwawienia takie jak: krwotok z przewodu pokarmowego, krwotok mózgowy (szczególnie u pacjentów z niekontrolowanym nadciśnieniem tętniczym i (lub) w przypadku równoczesnego podawania leków hemostatycznych), które w pojedynczych przypadkach mogą potencjalnie zagrażać życiu.
- CHPL leku Acesan, tabletki, 30 mgDziałania niepożądane
Krwotok może prowadzić do ostrej lub przewlekłej niedokrwistości w wyniku utraty krwi i (lub) niedokrwistości z niedoboru żelaza (na przykład w wyniku utajonych mikrokrwawień) z odpowiednimi objawami laboratoryjnymi i klinicznymi, takimi jak osłabienie, bladość, hipoperfuzja. Zaburzenie układu immunologicznego Reakcje nadwrażliwości z odpowiednimi objawami laboratoryjnymi i klinicznymi w tym: astma, odczyny skórne, wysypka, pokrzywka, obrzęk, świąd, zaburzenia serca i układu oddechowego. Bardzo rzadko: ciężkie reakcje alergiczne w tym wstrząs anafilaktyczny. Zaburzenia metabolizmu i odżywiania Bardzo rzadko: hipoglikemia. Zaburzenia układu nerwowego Zawroty głowy i szumy uszne, będące zazwyczaj objawami przedawkowania. Zaburzenia żołądka i jelit Często: objawy niestrawności (zgaga, nudności, wymioty) i bóle brzucha.
- CHPL leku Acesan, tabletki, 30 mgDziałania niepożądane
Rzadko: stany zapalne żołądka i jelit, choroba wrzodowa żołądka i (lub) dwunastnicy bardzo rzadko prowadzące do krwotoków i perforacji charakteryzujące się odpowiednimi objawami klinicznymi i wynikami badań laboratoryjnych. Zaburzenia wątroby i dróg żółciowych Rzadko: przemijające zaburzenia czynności wątroby ze zwiększeniem aktywności aminotransferaz. Zaburzenia nerek i dróg moczowych Bardzo rzadko: zaburzenia czynności nerek. W związku z leczeniem NLPZ zgłaszano występowanie obrzęków, nadciśnienia i niewydolności serca. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji i Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych.
- CHPL leku Acesan, tabletki, 30 mgDziałania niepożądane
Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: ndl@urpl.gov.pl Działania niepożądane można również zgłaszać podmiotowi odpowiedzialnemu.
- CHPL leku Acesan, tabletki, 30 mgPrzedawkowanie
4.9 Przedawkowanie Zatrucie salicylanami (może wystąpić w przypadku przyjmowania dawki >100 mg/kg mc./dobę przez więcej niż 2 dni) może być spowodowane długotrwałym przyjmowaniem dawek terapeutycznych lub zatruciem ostrym (w wyniku przedawkowania) potencjalnie zagrażającym życiu, np. po przypadkowym przyjęciu produktu leczniczego przez dzieci. Objawy zatrucia w wyniku długotrwałego przyjmowania produktu leczniczego są niespecyficzne, przez co łatwe do zbagatelizowania. Lekkie zatrucie, lub salicylizm, występuje zwykle po wielokrotnym przyjęciu zbyt dużych dawek. Objawy zatrucia obejmują: zawroty głowy (w tym pochodzenia błędnikowego), szumy uszne, głuchotę, nadmierne pocenie się, nudności i wymioty, ból głowy, dezorientację i mogą przeminąć po zmniejszeniu dawki przyjmowanego produktu leczniczego. Szumy uszne mogą pojawić się po wystąpieniu stężenia produktu leczniczego we krwi od 150 do 300 mikrogramów/ml.
- CHPL leku Acesan, tabletki, 30 mgPrzedawkowanie
Poważniejsze działania niepożądane występują, gdy stężenie kwasu acetylosalicylowego we krwi jest powyżej 300 mikrogramów/ml. Ciężkie zatrucie charakteryzuje się poważnymi zaburzeniami równowagi kwasowej, a objawy różnią się w zależności od wieku i ciężkości zatrucia. U dzieci objawia się najczęściej kwasicą metaboliczną. Stężenie kwasu acetylosalicylowego we krwi nie pozwala oszacować stopnia zatrucia. Wchłanianie kwasu acetylosalicylowego może być zmniejszone w wyniku opóźnionego opróżniania żołądka, tworzenia się złogów w żołądku lub w wyniku przyjęcia produktu leczniczego w postaci tabletek powlekanych. Leczenie ciężkiego zatrucia jest uzależnione od przyjętej dawki, stadium i objawów klinicznych. Należy zastosować standardowe techniki postępowania w przypadku zatrucia. Podstawowe działania, które należy podjąć, to zwiększenie wydalania substancji czynnej oraz przywrócenie równowagi elektrolitowej i równowagi kwasowo-zasadowej.
- CHPL leku Acesan, tabletki, 30 mgPrzedawkowanie
Objawy oraz wyniki badań: Objawy lekkiego do umiarkowanego zatrucia: Płukanie żołądka, wielokrotne podanie węgla aktywowanego, forsowana diureza alkaliczna Przyspieszony oddech, hiperwentylacja, alkaloza oddechowa Alkalemia, alkaluria Podawanie płynów i kontrola stężenia elektrolitów Obfite pocenie się Nudności, wymioty Objawy umiarkowanego do ciężkiego zatrucia: Płukanie żołądka, wielokrotne podanie węgla aktywowanego, forsowana diureza alkaliczna, hemodializa w ciężkich przypadkach Alkaloza oddechowa z kwasicą, aciduria Podawanie płynów i kontrola stężenia elektrolitów Bardzo wysoka gorączka Zaburzenia układu oddechowego: od hiperwentylacji, obrzęku płuc niesercowego pochodzenia do zatrzymania oddechu i asfiksji Zaburzenia serca i naczyń krwionośnych od arytmii, niskiego ciśnienia krwi do zatrzymania pracy serca Utrata płynów i elektrolitów: od odwodnienia, oligurii aż do niewydolności nerek Zaburzenia metabolizmu glukozy, ketoza Szumy uszne, głuchota Zaburzenia układu pokarmowego: krwawienia z układu pokarmowego Zaburzenia krwi: od zahamowania agregacji płytek krwi do koagulopatii np.
- CHPL leku Acesan, tabletki, 30 mgPrzedawkowanie
wydłużenie czasu protrombinowego, hipoprotrombinemia Zaburzenia neurologiczne: toksyczna encefalopatia i hamowanie czynności OUN objawiające się letargiem, dezorientacją aż do śpiączki i napadu drgawkowego Postępowanie po przedawkowaniu: Pacjenta należy natychmiast przewieźć do szpitala. Postępowanie zależy od wielkości przyjętej dawki, stadium i objawów klinicznych. Należy zastosować środki, mające na celu zmniejszenie wchłaniania substancji czynnej: płukanie żołądka, podanie węgla aktywowanego oraz kontrolować równowagę kwasowo-zasadową (niezbędna jest kontrola następujących parametrów krwi: pH, pCO2, stężenia wodorowęglanów, stężenia potasu). Jeśli zachowana jest prawidłowa czynność nerek, można zastosować diurezę alkaliczną aż do uzyskania pH moczu w zakresie 7,5–8; w przypadku stężenia salicylanów w osoczu powyżej 500 mg/l (3,6 mmol/l) u dorosłych lub 300 mg/l (2,2 mmol/l) u dzieci należy rozważyć możliwość zastosowania forsowanej diurezy alkalicznej.
- CHPL leku Acesan, tabletki, 30 mgPrzedawkowanie
Należy stosować wlewy dożylne zawierające NaHCO3, KCl oraz leki moczopędne. W przypadkach ciężkiego zatrucia można zastosować hemodializę lub dializę otrzewnową. Należy uzupełniać płyny oraz prowadzić ogólne postępowanie objawowe.
- CHPL leku Acesan, tabletki, 30 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inhibitory agregacji płytek Kod ATC: B01AC06 Kwas acetylosalicylowy (ASA) jest inhibitorem enzymu cyklooksygenazy (COX), aktywującego jeden ze szlaków przemiany kwasu arachidonowego, który może istnieć w dwóch odmianach: jako zawsze obecna w komórce COX-1 oraz pojawiająca się tylko po indukcji czynnikami zapalnymi COX-2. COX-1 i COX-2 występują w różnych typach komórek. Zadaniem COX-1 jest utrzymanie homeostazy w układzie krążenia oraz cytoprotekcja w żołądku i nerkach. Rola COX-2 polega na wywoływaniu lub podtrzymywaniu odczynu zapalnego. ASA jest selektywnym inhibitorem COX-1, zwłaszcza w płytkach krwi, dzięki czemu już bardzo małe dawki od 30 mg skutecznie hamują syntezę tromboksanu A2 (TXA2) – bardzo silnego biologicznie czynnika agregacyjnego i kurczącego naczynia krwionośne.
- CHPL leku Acesan, tabletki, 30 mgWłaściwości farmakodynamiczne
W znacznie mniejszym stopniu ASA hamuje COX-1 w śródbłonku naczyń, gdzie jego działanie byłoby niekorzystne ze względu na hamowanie syntezy prostacykliny (PGI2) – najsilniejszego biologicznie czynnika antyagregacyjnego. Działanie produktu leczniczego na płytki krwi jest nieodwracalne, co oznacza, że tracą one swoją aktywność przez cały okres przebywania w układzie krążenia (8-10 dni), natomiast na śródbłonek naczyń – jest krótkotrwałe i odwracalne.
- CHPL leku Acesan, tabletki, 30 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Kwas acetylosalicylowy w środowisku kwaśnym występuje w postaci niezjonizowanej, która łatwo wchłania się z żołądka i częściowo z górnego odcinka jelita cienkiego. Okres półtrwania produktu leczniczego t 0,5 = 1 – 2 h. Produkt leczniczy wiąże się w 50 – 80% z białkami osocza. Jest metabolizowany głównie w wątrobie do kwasu salicylurowego i sprzęgany z kwasem glukuronowym. Przenika przez barierę łożyskową i do mleka kobiet karmiących piersią. Produkt leczniczy wydalany jest głównie w moczu w postaci metabolitów, a około 10% w postaci niezmienionej.
- CHPL leku Acesan, tabletki, 30 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Profil bezpieczeństwa kwasu acetylosalicylowego jest dobrze udokumentowany w licznych badaniach przedklinicznych. Badania na zwierzętach wykazały, że salicylany powodowały uszkodzenie nerek, lecz nie wywoływały innych zmian chorobowych. Dane niekliniczne uzyskane na podstawie badań farmakologicznych dotyczących działania mutagennego i rakotwórczego nie ujawniają występowania działania mutagennego i rakotwórczego kwasu acetylosalicylowego. Badania przeprowadzone na zwierzętach i innych gatunkach wykazały objawy teratogenne salicylanów. Opisywane były objawy embriotoksyczne, fetotoksyczne i zaburzenia związane z możliwościami przyswajania wiedzy u potomstwa.
- CHPL leku Acesan, tabletki, 30 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Celuloza mikrokrystaliczna Karboksymetyloskrobia sodowa (typ A) Kwas stearynowy Żółcień chinolinowa, lak (E104) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Blistry PVC/PCTFE/Aluminium w tekturowym pudełku Wielkość opakowania: 63 tabletki 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Alka-Seltzer, 324 mg, tabletki musujące 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka musująca zawiera 324 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum). Substancje pomocnicze o znanym działaniu: sód, alkohol benzylowy oraz glukoza (składnik maltodekstryny). Jedna tabletka zawiera 477 mg sodu oraz 0,0018 mg alkoholu benzylowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka musująca.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgWskazania do stosowania
4.1 Wskazania do stosowania dolegliwości bólowe o lekkim i średnim nasileniu np.: bóle głowy, bóle mięśniowe (m.in. z uczuciem ogólnego rozbicia), bóle zębów ból i gorączka w przebiegu przeziębienia i grypy
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli: Jednorazowo od 324 do 972 mg kwasu acetylosalicylowego (tj. od 1 do 3 tabletek musujących). W razie konieczności dawka jednorazowa może być powtarzana po upływie minimum 4 do 6 godzin. Nie należy stosować w ciągu doby więcej niż 4000 mg kwasu acetylosalicylowego (tj. maksymalnie 12 tabletek musujących na dobę). Młodzież w wieku powyżej 12 lat: Produkt może być stosowany u młodzieży w wieku powyżej 12 lat wyłącznie na zlecenie lekarza. Jednorazowo 324 mg kwasu acetylosalicylowego (tj. 1 tabletka musująca). W razie konieczności dawka jednorazowa może być powtarzana do 3 razy na dobę, nie częściej niż co 4-6 godzin. Nie stosować więcej niż 972 mg kwasu acetylosalicylowego (tj. 3 tabletki musujące) na dobę. Produktu nie należy stosować dłużej niż 3 do 5 dni bez konsultacji z lekarzem.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgDawkowanie
Pacjenci z zaburzeniami czynności wątroby: Kwas acetylosalicylowy należy stosować ostrożnie u pacjentów z nieprawidłową czynnością wątroby (patrz punkt 4.4). Pacjenci z zaburzeniami czynności nerek: Kwas acetylosalicylowy należy stosować ostrożnie u pacjentów z nieprawidłową czynnością nerek (patrz punkt 4.4). W razie nieumyślnego zażycia lub przypadkowego przyjęcia leku przez dzieci (patrz punkt. 4.4). Sposób podawania Tabletki musujące należy przyjmować doustnie. Tabletki należy rozpuścić w szklance wody i wypić musujący płyn. Przyjmować po posiłkach.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgPrzeciwwskazania
4.3 Przeciwwskazania Produktu nie należy stosować: w przypadku nadwrażliwości na substancję czynną - kwas acetylosalicylowy, inne salicylany lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, u pacjentów ze skazą krwotoczną, u pacjentów z ostrą chorobą wrzodową żołądka lub dwunastnicy, u pacjentów z napadami astmy oskrzelowej w wywiadzie, wywołanymi podaniem salicylanów lub substancji o podobnym działaniu, szczególnie niesteroidowych leków przeciwzapalnych, jednocześnie z metotreksatem w dawkach 15 mg na tydzień lub większych (patrz: punkt 4.5), u pacjentów z ciężką niewydolnością serca, ciężką niewydolnością wątroby lub ciężką niewydolnością nerek, w ostatnim trymestrze ciąży, u dzieci w wieku poniżej 12 lat.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Kwas acetylosalicylowy należy stosować ostrożnie: w przypadku nadwrażliwości na niesteroidowe leki przeciwzapalne i przeciwreumatyczne lub inne substancje alergizujące, podczas jednoczesnego stosowania leków przeciwzakrzepowych (patrz: punkt. 4.5), u pacjentów z zaburzoną czynnością wątroby, u pacjentów z zaburzoną czynnością nerek lub zaburzeniami krążenia (np. choroba naczyń nerkowych, zastoinowa niewydolność serca, zmniejszenie objętości krwi krążącej, rozległa operacja, posocznica, ciężkie krwawienia), gdyż kwas acetylosalicylowy może dodatkowo zwiększyć ryzyko występowania zaburzeń czynności nerek i ciężkiej niewydolności nerek, u pacjentów z przebytą (przewlekłą lub nawracającą) chorobą wrzodową lub krwawieniami z przewodu pokarmowego w wywiadzie, u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej, gdyż podanie kwasu acetylosalicylowego może wywołać wystąpienie hemolizy lub niedokrwistości hemolitycznej.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgSpecjalne środki ostrozności
Czynniki, które mogą zwiększać ryzyko wystąpienia hemolizy to m.in. wysokie dawki kwasu acetylosalicylowego, gorączka, ciężkie infekcje, w okresie karmienia piersią (patrz punkt 4.6). Nie należy stosować produktów zawierających kwas acetylosalicylowy u kobiet w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne (patrz punkt 4.6). Kwas acetylosalicylowy może powodować skurcz oskrzeli i wywoływać napady astmy lub inne reakcje nadwrażliwości. Czynniki ryzyka obejmują: astmę oskrzelową, przewlekłe choroby układu oddechowego, katar sienny, polipy błony śluzowej nosa. Ostrzeżenie to odnosi się także do pacjentów, u których występują reakcje alergiczne (np. odczyny skórne, świąd, pokrzywka) na inne substancje. Kwas acetylosalicylowy, ze względu na działanie antyagregacyjne, które utrzymuje się przez kilka dni po zastosowaniu, może prowadzić do wydłużenia czasu krwawienia w czasie lub po zabiegach chirurgicznych (włącznie z niewielkimi zabiegami, np.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgSpecjalne środki ostrozności
ekstrakcją zęba). Kwas acetylosalicylowy, nawet w małych dawkach, zmniejsza wydalanie kwasu moczowego, co u predysponowanych pacjentów może wywołać napad dny moczanowej. Nie należy podawać produktów zawierających kwas acetylosalicylowy dzieciom i młodzieży w przebiegu infekcji wirusowych (z gorączką lub bez gorączki) bez konsultacji z lekarzem. W przebiegu niektórych chorób wirusowych, szczególnie w przypadku zakażenia wirusem grypy typu A, wirusem grypy typu B oraz ospy wietrznej istnieje ryzyko wystąpienia zespołu Reye’a – rzadkiej, ale zagrażającej życiu choroby, która wymaga natychmiastowej pomocy medycznej. Ryzyko wystąpienia zespołu Reye’a w przebiegu infekcji wirusowych może wzrosnąć jeśli jednocześnie podaje się kwas acetylosalicylowy, chociaż związek przyczynowy nie został udowodniony. Występowanie uporczywych wymiotów w przebiegu infekcji może wskazywać na wystąpienie zespołu Reye’a.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgSpecjalne środki ostrozności
Długotrwałe przyjmowanie produktów zawierających kwas acetylosalicylowy może być przyczyną bólu głowy, który nasila się podczas przyjmowania kolejnych dawek. Długotrwałe przyjmowanie leków przeciwbólowych, szczególnie zawierających kilka substancji czynnych może prowadzić do ciężkiego zaburzenia czynności nerek i niewydolności nerek. Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii (patrz punkt 4.6). Ostrzeżenia dotyczące substancji pomocniczych Produkt zawiera sód (477 mg w jednej tabletce), co jest równoważne 24% zalecanej przez Światową Organizację Zdrowia (WHO) maksymalnej 2 g dawki dobowej spożycia sodu u osób dorosłych. Maksymalna dawka dobowa tego produktu jest równoważna 288% zalecanej przez WHO maksymalnej dawki dobowej spożycia sodu. Alkohol benzylowy może powodować reakcje alergiczne.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgSpecjalne środki ostrozności
Pacjenci z zespołem złego wchłaniania glukozy-galaktozy nie powinni przyjmować produktu leczniczego.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Leki przeciwwskazane do jednoczesnego stosowania z kwasem acetylosalicylowym: Metotreksat w dawkach 15 mg na tydzień lub większych. Nasilenie toksycznego wpływu metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z produktami przeciwzapalnymi - w tym z kwasem acetylosalicylowym - oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza - patrz punkt 4.3). Interakcje wymagające zachowania szczególnej ostrożności: Metotreksat w dawkach mniejszych niż 15 mg na tydzień. Nasilenie toksycznego wpływu metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z produktami przeciwzapalnymi - w tym z kwasem acetylosalicylowym - oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza - patrz punkt 4.3). Leki przeciwzakrzepowe, leki trombolityczne lub inne leki hamujące agregację płytek krwi.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgInterakcje
Jednoczesne stosowanie kwasu acetylosalicylowego z lekami przeciwzakrzepowymi oraz trombolitycznymi może powodować nasilenie działania przeciwzakrzepowego: zwiększone ryzyko wydłużenia czasu krwawienia i krwotoków, wynikające z wypierania leków przeciwzakrzepowych z ich połączeń z białkami osocza oraz właściwości antyagregacyjnych kwasu acetylosalicylowego. Inne niesteroidowe leki przeciwzapalne, w tym salicylany. Jednoczesne stosowanie niesteroidowych leków przeciwzapalnych z kwasem acetylosalicylowym zwiększa ryzyko wystąpienia choroby wrzodowej i krwawień z przewodu pokarmowego oraz uszkodzenia nerek, na skutek synergistycznego działania tych leków. Selektywne inhibitory zwrotnego wychwytu serotoniny (SSRI). Zwiększone ryzyko krwawień z górnego odcinka przewodu pokarmowego na skutek synergistycznego działania tych leków. Leki zwiększające wydalanie kwasu moczowego z moczem, np. benzbromaron, probenecyd.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgInterakcje
Kwas acetylosalicylowy stosowany jednocześnie z lekami zwiększającymi wydalanie kwasu moczowego, powoduje osłabienie działania leków przeciwdnawych (konkurencja w procesie wydalania kwasu moczowego przez kanaliki nerkowe). Digoksyna. Jednoczesne stosowanie kwasu acetylosalicylowego z digoksyną powoduje zwiększenie stężenia digoksyny w osoczu, wynikające ze zmniejszonego wydalania digoksyny przez nerki. Leki przeciwcukrzycowe, np. insulina, pochodne sulfonylomocznika. Ze względu na właściwości hipoglikemizujące oraz wypieranie pochodnych sulfonylomocznika z połączeń z białkami osocza, kwas acetylosalicylowy nasila działanie leków przeciwcukrzycowych. Leki moczopędne stosowane jednocześnie z kwasem acetylosalicylowym – osłabienie działania moczopędnego poprzez zatrzymanie sodu i wody w organizmie na skutek zmniejszenia filtracji kłębuszkowej, spowodowanej zmniejszoną syntezą prostaglandyn w nerkach.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgInterakcje
Glikokortykosteroidy podawane ogólnie, z wyjątkiem hydrokortyzonu stosowanego jako terapia zastępcza w chorobie Addisona, stosowane jednocześnie z kwasem acetylosalicylowym – zmniejszenie stężenia salicylanów w osoczu w trakcie kortykoterapii i zwiększenie ryzyka przedawkowania salicylanów po zakończeniu przyjmowania kortykosteroidów (zwiększone ryzyko wystąpienia choroby wrzodowej i krwawień). Inhibitory konwertazy angiotensyny (ACE) stosowane jednocześnie z kwasem acetylosalicylowym - zmniejszenie działania przeciwnadciśnieniowego poprzez zmniejszenie filtracji kłębuszkowej, wynikające z hamowania produkcji prostaglandyn, działających rozszerzająco na naczynia krwionośne. Kwas walproinowy. Kwas acetylosalicylowy zwiększa toksyczność kwasu walproinowego, poprzez wypieranie go z połączeń z białkami osocza. Kwas walproinowy nasila działanie antyagregacyjne kwasu acetylosalicylowego ze względu na synergistyczne działanie antyagregacyjne obu leków. Alkohol.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgInterakcje
Alkohol może zwiększyć ryzyko wystąpienia działań niepożądanych ze strony przewodu pokarmowego, tj. owrzodzenie błony śluzowej lub krwawienia.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na ciążę i (lub) rozwój zarodka lub płodu. Wyniki badań epidemiologicznych wskazują na to, że stosowanie inhibitorów syntezy prostaglandyn we wczesnym okresie ciąży zwiększa ryzyko poronienia, występowania wad wrodzonych serca i wytrzewień wrodzonych. Całkowite ryzyko wystąpienia wrodzonych wad sercowo-naczyniowych zwiększa się z mniej niż 1% do około 1,5%. Uważa się, że ryzyko zwiększa się wraz z dawką i długością okresu terapii. U zwierząt po podaniu inhibitorów syntezy prostaglandyn zaobserwowano zwiększone ryzyko obumarcia zapłodnionego jaja w okresie przed i po zagnieżdżeniu się w macicy oraz zwiększone ryzyko obumarcia zarodka lub płodu. Dodatkowo, u zwierząt, po podaniu inhibitorów syntezy prostaglandyn w okresie organogenezy, donoszono o zwiększonej liczbie przypadków różnych wad rozwojowych, w tym wad sercowo-naczyniowych.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgWpływ na płodność, ciążę i laktację
Stosowanie produktu leczniczego Alka-Seltzer u kobiet od 20. tygodnia ciąży może powodować małowodzie wynikające z zaburzeń czynności nerek płodu. Może ono wystąpić wkrótce po rozpoczęciu leczenia i zwykle ustępuje po przerwaniu leczenia. Ponadto zgłaszano przypadki zwężenia przewodu tętniczego po stosowaniu produktu leczniczego w drugim trymestrze ciąży, z których większość ustępowała po przerwaniu leczenia. Z tego powodu, nie należy stosować produktów zawierających kwas acetylosalicylowy u kobiet w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. W razie stosowania kwasu acetylosalicylowego przez kobiety usiłujące zajść w ciążę lub w pierwszym i drugim trymestrze ciąży, należy stosować jak najmniejszą dawkę produktu leczniczego przez możliwie najkrótszy czas. Należy rozważyć obserwację przedporodową pod kątem małowodzia i zwężenia przewodu tętniczego po kilkudniowej ekspozycji na produkt Alka-Seltzer od 20. tygodnia ciąży.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgWpływ na płodność, ciążę i laktację
W przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego stosowanie Alka-Seltzer należy przerwać. W trzecim trymestrze ciąży Wszystkie inhibitory syntezy prostaglandyn mogą powodować narażenie płodu na: d działanie toksyczne na układ krążenia i układ oddechowy (przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne), zaburzenia czynności nerek (patrz powyżej). W końcowym okresie ciąży wszystkie inhibitory prostaglandyn mogą spowodować narażenie matki i noworodka na: możliwość wydłużenia czasu krwawienia, działanie antyagregacyjne, które może ujawnić się nawet po zastosowaniu bardzo małych dawek, zahamowanie czynności skurczowej macicy prowadzącej do opóźnienia porodu lub przedłużenia akcji porodowej. W konsekwencji kwas acetylosalicylowy jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3). Karmienie piersi? Kwas acetylosalicylowy i jego metabolity przenikają w niewielkich ilościach do mleka kobiecego.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgWpływ na płodność, ciążę i laktację
Ponieważ jak dotąd, podczas krótkotrwałego stosowania salicylanów przez matki, nie stwierdzono występowania działań niepożądanych u niemowląt karmionych piersią, przerywanie karmienia piersią z reguły nie jest konieczne. Jednakże w przypadku regularnego przyjmowania dużych dawek kwasu acetylosalicylowego, karmienie piersią powinno być wcześniej przerwane. Płodność Aktualnie dostępne dane dotyczące toksycznego wpływu kwasu acetylosalicylowego na rozrodczość są nadal dyskutowane. Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Alka-Seltzer nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgDziałania niepożądane
4.8 Działania niepożądane Częstość możliwych działań niepożądanych wymienionych poniżej określono następująco: często (1/100 do <1/10), rzadko (1/10 000 do <1/1 000), bardzo rzadko (<1/10 000), nieznana (częstość nie może być określona na podstawie dostępnych danych). Klasyfikacja układów i narządów Częstość występowania: Działania niepożądane Zaburzenia żołądka i jelit: często Bóle żołądka i brzucha, zgaga, niestrawność. rzadko: Zapalenie przewodu pokarmowego, potencjalnie zagrażające życiu krwawienia z przewodu pokarmowego: jawne (fusowate wymioty, smoliste stolce) lub utajone (do krwawień dochodzi tym częściej im większa jest dawka); choroba wrzodowa żołądka lub dwunastnicy, perforacja. nieznana: Enteropatia zwężeniowa jelit (szczególnie podczas długotrwałego stosowania), nudności, wymioty. Zaburzenia wątroby i dróg żółciowych: bardzo rzadko Przemijające zaburzenia czynności wątroby (zwiększenie aktywności aminotransferaz).
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgDziałania niepożądane
Zaburzenia układu nerwowego: rzadko Wylew krwi do mózgu (szczególnie u pacjentów z niekontrolowanym nadciśnieniem i (lub) jednocześnie stosujących inne leki przeciwzakrzepowe) potencjalnie zagrażający życiu. nieznana: Zawroty głowy będące zazwyczaj objawami przedawkowania. Zaburzenia ucha i błędnika: często Szumy uszne będące zazwyczaj objawami przedawkowania. Zaburzenia krwi i układu chłonnego: nieznana Zwiększone ryzyko krwawień, wydłużenie czasu krwawienia, czasu protrombinowego, trombocytopenia. Skutkiem krwawień może być niedokrwistość z niedoboru żelaza albo niedokrwistość krwotoczna objawiająca się astenią, bladością, hypoperfuzją, a także nieprawidłowymi wynikami badań laboratoryjnych. Hemoliza i niedokrwistość hemolityczna u pacjentów cierpiących na poważną postać niedoboru dehydrogenazy glukozo-6-fosforanowej (G6PD). Zaburzenia naczyniowe: nieznana Krwotoki (pozabiegowe, z nosa, z dziąseł, z układu moczowo-płciowego), krwiaki.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgDziałania niepożądane
Zaburzenia nerek i dróg moczowych: nieznana Zaburzenia czynności nerek i ciężkie uszkodzenie nerek. Zaburzenia układu immunologicznego: rzadko Reakcje nadwrażliwości z objawami klinicznymi i nieprawidłowymi wynikami odpowiednich badań laboratoryjnych takie jak: astma, łagodne do umiarkowanych reakcje obejmujące skórę, układ oddechowy, układ sercowo-naczyniowy z objawami takimi jak: wysypka, pokrzywka, obrzęk (w tym naczynioruchowy), zapalenie błony śluzowej nosa, przekrwienie błony śluzowej nosa. nieznana: Ciężkie reakcje, w tym wstrząs anafilaktyczny, zaburzenia oddychania i pracy serca. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: nieznana Choroba układu oddechowego, która nasila się po zastosowaniu kwasu acetylosalicylowego. Długotrwałe przyjmowanie produktów zawierających kwas acetylosalicylowy może być przyczyną bólu głowy, który nasila się podczas przyjmowania kolejnych dawek.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49-21-301 Fax: + 48 22 49-21-309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgPrzedawkowanie
4.9 Przedawkowanie Zatrucie salicylanami (może wystąpić w przypadku przyjmowania dawki > 100 mg/kg m.c./dobę przez więcej niż 2 dni) może być spowodowane długotrwałym przyjmowaniem dawek terapeutycznych lub zatruciem ostrym (w wyniku przedawkowania) potencjalnie zagrażającym życiu, np. po przypadkowym przyjęciu leku przez dzieci lub przypadkowym zatruciu. Przewlekłe zatrucie salicylanami Objawy zatrucia w wyniku długotrwałego przyjmowania leku są niespecyficzne, przez co łatwe do zbagatelizowania. Lekkie zatrucie, lub salicylizm, występuje zwykle po wielokrotnym przyjęciu zbyt dużych dawek. Objawy zatrucia obejmują: zawroty głowy (w tym pochodzenia błędnikowego), szumy uszne, głuchotę, nadmierne pocenie się, nudności i wymioty, ból głowy, splątanie i mogą ustąpić po zmniejszeniu dawki przyjmowanego leku. Szumy uszne mogą wystąpić przy stężeniu leku we krwi od 150 do 300 mikrogramów/ml.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgPrzedawkowanie
Poważniejsze działania niepożądane występują przy stężeniu kwasu acetylosalicylowego we krwi powyżej 300 mikrogramów/ml. Ostre zatrucie salicylanami Ciężkie zatrucie charakteryzuje się poważnymi zaburzeniami równowagi kwasowej a objawy różnią się w zależności od wieku i ciężkości zatrucia. U dzieci objawia się najczęściej kwasicą metaboliczną. Stężenie kwasu acetylosalicylowego we krwi nie pozwala oszacować stopnia zatrucia. Wchłanianie kwasu acetylosalicylowego może być zmniejszone w wyniku opóźnionego opróżniania żołądka, tworzenia się złogów w żołądku lub w wyniku przyjęcia leku w postaci tabletek powlekanych. Leczenie ciężkiego zatrucia jest uzależnione od przyjętej dawki, stadium i objawów klinicznych. Należy zastosować standardowe techniki postępowania w przypadku zatrucia. Podstawowe działania, które należy podjąć to zwiększenie wydalania substancji czynnej oraz przywrócenie równowagi elektrolitowej i równowagi kwasowo-zasadowej.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgPrzedawkowanie
Ze względu na złożoną patofizjologię skutków zatrucia salicylanami, objawy oraz wyniki badań mogą obejmować: Objawy Wyniki badań Postępowanie Zatrucie lekkie do umiarkowanego Płukanie żołądka, wielokrotne podanie węgla aktywowanego, forsowana diureza alkaliczna Przyspieszony oddech, hiperwentylacja, alkaloza oddechowa Obfite pocenie się Nudności, wymioty Alkalemia, alkaluria Zatrucie umiarkowane do ciężkiego Płukanie żołądka, wielokrotne podanie węgla aktywowanego, forsowana diureza alkaliczna, hemodializa w ciężkich przypadkach Alkaloza oddechowa z wyrównawczą kwasicą metaboliczn? Wysoka gorączka Podawanie płynów i kontrola stężenia elektrolitów Zaburzenia układu oddechowego: od hiperwentylacji, obrzęku płuc niesercowego pochodzenia do zatrzymania oddechu i asfiksji Zaburzenia serca i naczyń krwionośnych Ciśnienie krwi, zmiany w zapisie EKG Utrata płynów i elektrolitów: od odwodnienia, oligurii aż do niewydolności nerek Hipokaliemia, hipernatremia, hiponatremia, zaburzona praca nerek Podawanie płynów i kontrola stężenia elektrolitów Zaburzenia metabolizmu glukozy, ketoza Hiperglikemia, hipoglikemia (szczególnie u dzieci) Zwiększone stężenie ketonów Szumy uszne, głuchota Zaburzenia układu pokarmowego: krwawienia z układu pokarmowego Zaburzenia krwi: od zahamowania agregacji płytek krwi do koagulopatii np.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgPrzedawkowanie
wydłużenie czasu protrombinowego, hipoprotrombinemia Zaburzenia neurologiczne: toksyczna encefalopatia i hamowanie czynności OUN objawiające się letargiem, splątaniem aż do śpiączki i napadu drgawkowego
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inne leki przeciwbólowe i przeciwgorączkowe, kwas salicylowy i jego pochodne; kod ATC: N02B A01. Kwas acetylosalicylowy należy do grupy kwasowych niesteroidowych leków przeciwzapalnych o właściwościach przeciwbólowych, przeciwgorączkowych i przeciwzapalnych. Mechanizm jego działania polega na nieodwracalnym hamowaniu cyklooksygenazy kwasu arachidonowego, a tym samym hamowaniu syntezy prostanoidów: prostaglandyny E2 (PGE2), prostaglandyny I2 (PGI2) oraz tromboksanu A2. Hamując syntezę tromboksanu A2 w płytkach krwi, kwas acetylosalicylowy hamuje także agregację płytek krwi.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Po podaniu doustnym, kwas acetylosalicylowy wchłania się szybko i całkowicie z przewodu pokarmowego. W trakcie wchłaniania oraz po wchłonięciu jest przekształcany do głównego metabolitu – kwasu salicylowego. Zasadniczo, maksymalne stężenie kwasu acetylosalicylowego w osoczu osiągane jest po 18-30 minutach, a kwasu salicylowego po 0,72 - 2 godzinach. Dystrybucja Zarówno kwas acetylosalicylowy, jak i kwas salicylowy wiążą się silnie z białkami osocza i ulegają szybkiej dystrybucji w całym organizmie. Kwas salicylowy przenika przez łożysko i do mleka kobiet karmiących piersią. Metabolizm Kwas salicylowy metabolizowany jest głównie w wątrobie. Główne metabolity to kwas salicylowy sprzężony z glicyną (kwas salicylurowy), eter i ester glukuronidowy kwasu salicylowego (fenylosalicylan glukuronidu i acetylosalicylan glukuronidu) oraz kwas gentyzynowy w postaci wolnej i sprzężonej z glicyną.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgWłaściwości farmakokinetyczne
Eliminacja Kinetyka eliminacji kwasu salicylowego zależy w dużym stopniu od dawki, ponieważ metabolizm kwasu salicylowego jest ograniczony przez aktywność enzymów wątrobowych. Okres półtrwania wynosi od 2 do 3 godzin po zastosowaniu małych dawek (do 325 mg/dobę) do około 15 godzin po dużych dawkach terapeutycznych (powyżej 3 g/dobę) lub w przypadku zatrucia. Kwas salicylowy i jego metabolity są wydalane głównie przez nerki.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Profil bezpieczeństwa kwasu acetylosalicylowego jest dobrze udokumentowany w licznych badaniach nieklinicznych. W badaniach na zwierzętach salicylany powodowały uszkodzenie nerek, lecz nie wywoływały innych zmian chorobowych. Kwas acetylosalicylowy został przebadany pod kątem działania mutagennego i rakotwórczego. Nie znaleziono dowodów, świadczących o właściwościach mutagennych i rakotwórczych kwasu acetylosalicylowego. Na podstawie badań przeprowadzonych na zwierzętach, stwierdzono, że salicylany wykazują działanie teratogenne u kilku gatunków zwierząt. Istnieją doniesienia dotyczące zaburzeń implantacji jaja płodowego, działania toksycznego na zarodek i płód oraz zaburzeń sprawności uczenia się u potomstwa narażonego na salicylany przed urodzeniem.
- CHPL leku Alka-Seltzer, tabletki musujące, 324 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas cytrynowy sodu wodorowęglan Powidon 25 mieszanina dimetikonu i wapnia krzemianu (70% : 30%) mieszanina sodu dokusanu i sodu benzoesanu (85% : 15%) sodu sacharynian aromat limetowy (m.in. maltodekstryna, butylohydroksyanizol E320, butylohydroksytoluen E321, alkohol benzylowy) aromat cytrynowy (m.in. maltodekstryna, alkohol benzylowy, α-tokoferol E307) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Saszetki papier/PE/Al/Surlyn w tekturowym pudełku. Opakowanie zawiera 2, 6, 10 lub 40 tabletek musujących w postaci 1, 3, 5 lub 20 podwójnych saszetek, zawierających 2 tabletki musujące. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Aspimag, 150 mg + 21 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 150 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum) oraz 21 mg magnezu tlenku (Magnesii oxidum). Substancja pomocnicza o znanym działaniu: sacharoza Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgWskazania do stosowania
4.1 Wskazania do stosowania W chorobie niedokrwiennej serca oraz innych stanach chorobowych, w których wskazane jest hamowanie agregacji płytek krwi – między innymi: w zapobieganiu zawałowi serca u chorych dużego ryzyka, po wszczepieniu pomostów aortalno – wieńcowych, zastawek serca i zabiegach udrożnienia naczyń; w niestabilnej chorobie wieńcowej, po zawale serca lub udarze niedokrwiennym mózgu, w zapobieganiu zakrzepicy żylnej.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Jeżeli lekarz nie zaleci inaczej – zazwyczaj stosowana dawka dla dorosłych to 1/2 tabletki doustnie w czasie posiłku raz na dobę lub 1 tabletka co drugi dzień. Sposób podawania Podanie doustne.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne, salicylany lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Produktu leczniczego nie należy stosować: w przebiegu zakażeń wirusowych u dzieci i młodzieży (grypie, ospie wietrznej); u pacjentów ze skazą krwotoczną; u pacjentów z chorobą wrzodową żołądka i dwunastnicy; w ostatnim trymestrze ciąży.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Aspimag można stosować tylko po ścisłym rozważeniu stosunku ryzyka do korzyści w następujących przypadkach: pierwszym i drugim trymestrze ciąży, karmieniu piersią, uczuleniu na niesteroidowe leki przeciwzapalne lub inne substancje alergizujące, podczas jednoczesnego stosowania innych leków przeciwzakrzepowych (np. pochodnych kumaryny lub heparyny), u pacjentów ze znaczną niewydolnością wątroby, nerek lub z chorobą wrzodową w wywiadzie. W związku z możliwością wystąpienia zespołu Reye’a – rzadkiej, ale ciężkiej choroby – produkty lecznicze zawierające kwas acetylosalicylowy stosuje się w czasie chorób gorączkowych u dzieci i młodzieży poniżej 12 lat wyłącznie na zalecenie lekarza. Pacjenci z astmą oskrzelową, przewlekłymi schorzeniami układu oddechowego, gorączką sienną lub obrzękiem błony śluzowej nosa (polipy nosa) mogą reagować na niesteroidowe leki przeciwzapalne napadami astmy, ograniczonym obrzękiem skóry i błony śluzowej (obrzęk naczynioruchowy) lub pokrzywką częściej niż inni pacjenci.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgSpecjalne środki ostrozności
Pacjenci z rzadkimi dziedzicznymi zaburzeniami związanymi z nietolerancją fruktozy, zespołem złego wchłaniania glukozy - galaktozy lub niedoborem sacharazy - izomaltazy, nie powinni przyjmować produktu leczniczego.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Kwas acetylosalicylowy nasila działanie leków przeciwzakrzepowych, zwiększa ryzyko krwawień z przewodu pokarmowego podczas jednoczesnego stosowania kortykosteroidów lub picia alkoholu. Nasila działanie oraz objawy niepożądane niesteroidowych leków przeciwzapalnych, działanie pochodnych sulfonylomocznika, metotreksatu, sulfonamidów i ich połączeń oraz kwasu walproinowego. Zwiększa stężenie w osoczu digoksyny, barbituranów i związków litu. Kwas acetylosalicylowy osłabia działanie antagonistów aldosteronu i pętlowych leków moczopędnych, leków przeciw nadciśnieniu i przeciwdnawych zwiększających wydalanie kwasu moczowego. Jednoczesne stosowanie metamizolu z kwasem acetylosalicylowym może zmniejszać działanie hamujące kwasu acetylosalicylowego na agregację płytek krwi.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgInterakcje
Z tego względu metamizol należy stosować ostrożnie u pacjentów przyjmujących kwas acetylosalicylowy w małych dawkach w celu ochronnego działania na układ sercowo-naczyniowy.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Aspimag można stosować w ciąży jedynie w przypadkach, gdy w opinii lekarza korzyść dla matki przeważa nad potencjalnym zagrożeniem dla płodu. Nie należy go stosować w ostatnim trymestrze ciąży, gdyż może powodować wady płodu i komplikacje w czasie porodu. Karmienie piersi? Kwas acetylosalicylowy w niewielkich ilościach przenika do mleka kobiecego – dlatego, jeśli możliwe – należy unikać stosowania produktu Aspimag w czasie karmienia piersią.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brak danych dotyczących negatywnego wpływu produktu leczniczego Aspimag na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgDziałania niepożądane
4.8 Działania niepożądane Częstość występowania działań niepożądanych została określona w następujący sposób: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia żołądka i jelit Rzadko: nudności, biegunka, wymioty, krwawienia z przewodu pokarmowego (czarne, smoliste stolce; niedokrwistość z niedoboru żelaza), rozwój wrzodów trawiennych z krwawieniem i perforacją. Zaburzenia nerek i dróg moczowych Rzadko: nasilenie objawów dny moczanowej, zaburzenia czynności nerek. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Rzadko: napad duszności. Zaburzenia skóry i tkanki podskórnej Rzadko: reakcje skórne, w tym reakcje skórne o ciężkim przebiegu. Zaburzenia wątroby i dróg żółciowych Rzadko: zaburzenia czynności wątroby (zwiększenie aktywności aminotransferaz).
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgDziałania niepożądane
Inne zespół Reye’a, zawroty głowy oraz szumy uszne (zwłaszcza u dzieci i pacjentów w podeszłym wieku mogą być objawami przedawkowania). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: ndl@urpl.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgPrzedawkowanie
4.9 Przedawkowanie Objawy: hiperwentylacja (przyspieszenie oddechu), nudności, wymioty, zaburzenia widzenia i słuchu (szumy uszne), bóle i zawroty głowy, splątanie, zaburzenia równowagi kwasowo –zasadowej i elektrolitowej (np. utrata potasu), hipoglikemia, wykwity skórne. W przypadku zatrucia ostrego mogą wystąpić: delirium (majaczenie), drżenia, duszność, nadmierna potliwość, pobudzenie, wysoka gorączka, śpiączka. Postępowanie zależy od ciężkości zatrucia oraz od objawów klinicznych. Podobnie jak w przypadku zatrucia innymi lekami ma ono na celu zmniejszenie wchłaniania leku poprzez przyspieszenie wydalania, monitorowanie równowagi wodno – elektrolitowej oraz unormowanie temperatury i czynności oddechowej.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: środki przeciwzakrzepowe, inhibitory agregacji płytek (bez heparyny), kwas acetylosalicylowy. Kod ATC: B01AC06 Aspimag jest produktem leczniczym hamującym agregację płytek krwi, którego mechanizm działania polega na hamowaniu cyklooksygenazy prostaglandynowej, odpowiadającej między innymi za tworzenie w płytkach krwi tromboksanu A2 – ułatwiającego zlepianie się płytek i kurczącego naczynia. Kwas acetylosalicylowy podawany w dawkach mniejszych niż około 300 mg na dobę – ulega hydrolizie w krążeniu wrotnym, hamując poprzez nieodwracalną acetylację najpierw czynność cyklooksygenazy płytkowej, a następnie cyklooksygenazy w ścianach naczyń. W przypadku właściwego dawkowania (75 – 150 mg na dobę) uzyskuje się zmniejszenie zdolności zlepiania płytek bez istotnej ingerencji w czynność prostacykliny. Działanie jest nieodwracalne i trwa około 9 dni – czas życia płytki.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgWłaściwości farmakodynamiczne
Aspimag zawiera tlenek magnezu mający osłaniać miejscowo (po rozpadzie tabletki) ścianę żołądka przed możliwością jej uszkodzenia przez kwas acetylosalicylowy.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym małe dawki kwasu acetylosalicylowego wchłaniają się w ciągu około 30 minut z żołądka i górnej części jelita cienkiego jako niezjonizowane cząsteczki, w wyniku biernej dyfuzji. Kwas acetylosalicylowy wiąże się z białkami krwi. Po wchłonięciu hydrolizowany jest w ciągu około 15 minut przez esterazy surowicy, erytrocytów i wątroby do kwasu salicylurowego i salicylo-fenyloglukuronidu. Okres półtrwania eliminacji nie przekracza 2,5 godziny. Wydalany jest przez nerki, przenika do mleka kobiet karmiących piersią i przez barierę łożyska.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Profil bezpieczeństwa kwasu acetylosalicylowego jest dobrze udokumentowany w licznych badaniach przedklinicznych. Dane niekliniczne, uwzględniające wyniki konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, badań toksyczności po podaniu wielokrotnym, genotoksyczności, możliwego działania rakotwórczego i toksycznego wpływu na reprodukcję, nie ujawniają występowania szczególnego zagrożenia dla człowieka. Nie znaleziono dowodów świadczących o właściwościach mutagennych i rakotwórczych kwasu acetylosalicylowego.
- CHPL leku Aspimag, tabletki, 150 mg + 21 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sacharoza Skrobia ziemniaczana Krzemionka koloidalna bezwodna Kwas stearynowy Talk 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w miejscu niedostępnym i niewidocznym dla dzieci. Przechowywać w temperaturze poniżej 25ºC. Przechowywać pojemnik szczelnie zamknięty w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Pojemnik z polipropylenu z wieczkiem, w tekturowym pudełku. 50 szt. (1 pojemnik po 50 szt.) 100 szt. (1 pojemnik po 100 szt.) 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań dotyczących usuwania.
- CHPL leku Aspirin, tabletki, 500 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ASPIRIN, 500 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera substancję czynną: 500 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka
- CHPL leku Aspirin, tabletki, 500 mgWskazania do stosowania
4.1 Wskazania do stosowania bóle o małym lub umiarkowanym nasileniu gorączka
- CHPL leku Aspirin, tabletki, 500 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dorośli: Jednorazowo od 500 mg do 1000 mg kwasu acetylosalicylowego (tj. od 1 do 2 tabletek). W razie konieczności, dawka jednorazowa może być powtarzana co 4 do 8 godzin. Nie należy przekraczać maksymalnej dawki dobowej, która wynosi 4000 mg kwasu acetylosalicylowego (tj. 8 tabletek). Młodzież w wieku powyżej 12 lat: Produkt może być stosowany u młodzieży w wieku powyżej 12 lat wyłącznie na zlecenie lekarza. Jednorazowo 500 mg kwasu acetylosalicylowego (tj. 1 tabletka). W razie konieczności dawka jednorazowa może być powtarzana co 4 do 8 godzin. Nie stosować więcej niż 1500 mg kwasu acetylosalicylowego (tj. 3 tabletki) na dobę. W razie nieumyślnego zażycia lub przypadkowego przyjęcia leku przez dzieci, patrz punkt 4.4. Leku nie należy stosować dłużej niż 3-5 dni bez konsultacji z lekarzem.
- CHPL leku Aspirin, tabletki, 500 mgDawkowanie
Pacjenci z zaburzeniami czynności wątroby: Kwas acetylosalicylowy należy stosować ostrożnie u pacjentów z nieprawidłową czynnością wątroby (patrz punkt 4.4). Pacjenci z zaburzeniami czynności nerek: Kwas acetylosalicylowy należy stosować ostrożnie u pacjentów z nieprawidłową czynnością nerek (patrz punkt 4.4). Sposób podawania: Tabletki należy przyjmować doustnie, najlepiej po posiłkach, z dużą ilością wody.
- CHPL leku Aspirin, tabletki, 500 mgPrzeciwwskazania
4.3 Przeciwwskazania Produktu nie należy stosować: w przypadku nadwrażliwości na substancję czynną - kwas acetylosalicylowy, inne salicylany lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, u pacjentów ze skazą krwotoczną, u pacjentów z ostrą chorobą wrzodową żołądka lub dwunastnicy, u pacjentów z napadami astmy oskrzelowej w wywiadzie, wywołanymi podaniem salicylanów lub substancji o podobnym działaniu, szczególnie niesteroidowych leków przeciwzapalnych, jednocześnie z metotreksatem w dawkach 15 mg na tydzień lub większych (patrz punkt 4.5), u pacjentów z ciężką niewydolnością serca, ciężką niewydolnością wątroby lub ciężką niewydolnością nerek, w ostatnim trymestrze ciąży, u dzieci w wieku poniżej 12 lat.
- CHPL leku Aspirin, tabletki, 500 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Kwas acetylosalicylowy należy stosować ostrożnie: w przypadku nadwrażliwości na niesteroidowe leki przeciwzapalne i przeciwreumatyczne lub inne substancje alergizujące, podczas jednoczesnego stosowania leków przeciwzakrzepowych (patrz punkt 4.5), u pacjentów z zaburzoną czynnością wątroby, u pacjentów z zaburzoną czynnością nerek lub zaburzeniami krążenia (np. choroba naczyń nerkowych, zastoinowa niewydolność serca, zmniejszenie objętości krwi krążącej, rozległa operacja, posocznica, ciężkie krwawienia), gdyż kwas acetylosalicylowy może dodatkowo zwiększyć ryzyko występowania zaburzeń czynności nerek i ciężkiej niewydolności nerek, u pacjentów z przebytą (przewlekłą lub nawracającą) chorobą wrzodową lub krwawieniami z przewodu pokarmowego w wywiadzie, u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej, gdyż podanie kwasu acetylosalicylowego może wywołać wystąpienie hemolizy lub niedokrwistości hemolitycznej.
- CHPL leku Aspirin, tabletki, 500 mgSpecjalne środki ostrozności
Czynniki, które mogą zwiększać ryzyko wystąpienia hemolizy to m.in. wysokie dawki kwasu acetylosalicylowego, gorączka, ciężkie infekcje; w okresie karmienia piersią (patrz punkt 4.6). Nie należy stosować produktów zawierających kwas acetylosalicylowy u kobiet w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne (patrz punkt 4.6). Kwas acetylosalicylowy może powodować skurcz oskrzeli i wywoływać napady astmy lub inne reakcje nadwrażliwości. Czynniki ryzyka obejmują: astmę oskrzelową, przewlekłe choroby układu oddechowego, katar sienny, polipy błony śluzowej nosa. Ostrzeżenie to odnosi się także do pacjentów, u których występują reakcje alergiczne (np. odczyny skórne, świąd, pokrzywka) na inne substancje. Kwas acetylosalicylowy, ze względu na działanie antyagregacyjne, które utrzymuje się przez kilka dni po zastosowaniu, może prowadzić do wydłużenia czasu krwawienia w czasie lub po zabiegach chirurgicznych (włącznie z niewielkimi zabiegami, np.
- CHPL leku Aspirin, tabletki, 500 mgSpecjalne środki ostrozności
ekstrakcją zęba). Kwas acetylosalicylowy, nawet w małych dawkach, zmniejsza wydalanie kwasu moczowego, co u predysponowanych pacjentów może wywołać napad dny moczanowej. W przebiegu niektórych chorób wirusowych, szczególnie w przypadku zakażenia wirusem grypy typu A, wirusem grypy typu B lub ospy wietrznej, głównie u dzieci i młodzieży, istnieje ryzyko wystąpienia zespołu Reye’a – rzadkiej, ale zagrażającej życiu choroby. Występowanie uporczywych wymiotów w przebiegu infekcji może wskazywać na wystąpienie zespołu Reye’a, co wymaga natychmiastowej pomocy medycznej. Ryzyko wystąpienia zespołu Reye’a w przebiegu infekcji wirusowych może wzrosnąć, jeśli jednocześnie podaje się kwas acetylosalicylowy, chociaż związek przyczynowy nie został udowodniony. Z ww. względów u dzieci w wieku poniżej 12 lat produktów zawierających kwas acetylosalicylowy nie należy stosować, a u młodzieży w wieku powyżej 12 lat produkty zawierające kwas acetylosalicylowy można stosować wyłącznie na zlecenie lekarza.
- CHPL leku Aspirin, tabletki, 500 mgSpecjalne środki ostrozności
Długotrwałe przyjmowanie produktów zawierających kwas acetylosalicylowy może być przyczyną bólu głowy, który nasila się podczas przyjmowania kolejnych dawek. Długotrwałe przyjmowanie leków przeciwbólowych, szczególnie zawierających kilka substancji czynnych może prowadzić do ciężkiego zaburzenia czynności nerek i niewydolności nerek. Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
- CHPL leku Aspirin, tabletki, 500 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Leki przeciwwskazane do jednoczesnego stosowania z kwasem acetylosalicylowym: Metotreksat w dawkach 15 mg na tydzień lub większych. Nasilenie toksycznego wpływu metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z produktami przeciwzapalnymi - w tym z kwasem acetylosalicylowym - oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza - patrz punkt 4.3). Interakcje wymagające zachowania szczególnej ostrożności: Metotreksat w dawkach mniejszych niż 15 mg na tydzień. Nasilenie toksycznego wpływu metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z produktami przeciwzapalnymi - w tym z kwasem acetylosalicylowym - oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza - patrz wyżej). Leki przeciwzakrzepowe, leki trombolityczne lub inne leki hamujące agregację płytek krwi.
- CHPL leku Aspirin, tabletki, 500 mgInterakcje
Jednoczesne stosowanie kwasu acetylosalicylowego z lekami przeciwzakrzepowymi oraz trombolitycznymi może powodować nasilenie działania przeciwzakrzepowego: zwiększone ryzyko wydłużenia czasu krwawienia i krwotoków, wynikające z wypierania leków przeciwzakrzepowych z ich połączeń z białkami osocza oraz właściwości antyagregacyjnych kwasu acetylosalicylowego. Inne niesteroidowe leki przeciwzapalne, w tym salicylany. Jednoczesne stosowanie niesteroidowych leków przeciwzapalnych z kwasem acetylosalicylowym zwiększa ryzyko wystąpienia choroby wrzodowej i krwawień z przewodu pokarmowego oraz uszkodzenia nerek, na skutek synergistycznego działania tych leków. Selektywne inhibitory zwrotnego wychwytu serotoniny (SSRI). Zwiększone ryzyko krwawień z górnego odcinka przewodu pokarmowego na skutek synergistycznego działania tych leków. Leki zwiększające wydalanie kwasu moczowego z moczem, np. benzbromaron, probenecyd.
- CHPL leku Aspirin, tabletki, 500 mgInterakcje
Kwas acetylosalicylowy stosowany jednocześnie z lekami zwiększającymi wydalanie kwasu moczowego, powoduje osłabienie działania leków przeciwdnawych (konkurencja w procesie wydalania kwasu moczowego przez kanaliki nerkowe). Digoksyna. Jednoczesne stosowanie kwasu acetylosalicylowego z digoksyną powoduje zwiększenie stężenia digoksyny w osoczu, wynikające ze zmniejszonego wydalania digoksyny przez nerki. Leki przeciwcukrzycowe, np. insulina, pochodne sulfonylomocznika. Ze względu na właściwości hipoglikemizujące oraz wypieranie pochodnych sulfonylomocznika z połączeń z białkami osocza, kwas acetylosalicylowy nasila działanie leków przeciwcukrzycowych. Leki moczopędne stosowane jednocześnie z kwasem acetylosalicylowym – osłabienie działania moczopędnego poprzez zatrzymanie sodu i wody w organizmie na skutek zmniejszenia filtracji kłębuszkowej, spowodowanej zmniejszoną syntezą prostaglandyn w nerkach.
- CHPL leku Aspirin, tabletki, 500 mgInterakcje
Glikokortykosteroidy podawane ogólnie, z wyjątkiem hydrokortyzonu stosowanego jako terapia zastępcza w chorobie Addisona, stosowane jednocześnie z kwasem acetylosalicylowym - zmniejszenie stężenia salicylanów w osoczu w trakcie kortykoterapii i zwiększenie ryzyka przedawkowania salicylanów po zakończeniu przyjmowania kortykosteroidów (zwiększone ryzyko wystąpienia choroby wrzodowej i krwawień). Inhibitory konwertazy angiotensyny (ACE) stosowane jednocześnie z kwasem acetylosalicylowym - zmniejszenie działania przeciwnadciśnieniowego poprzez zmniejszenie filtracji kłębuszkowej, wynikające z hamowania produkcji prostaglandyn, działających rozszerzająco na naczynia krwionośne. Kwas walproinowy. Kwas acetylosalicylowy zwiększa toksyczność kwasu walproinowego, poprzez wypieranie go z połączeń z białkami osocza. Kwas walproinowy nasila działanie antyagregacyjne kwasu acetylosalicylowego ze względu na synergistyczne działanie antyagregacyjne obu leków. Alkohol.
- CHPL leku Aspirin, tabletki, 500 mgInterakcje
Alkohol może zwiększyć ryzyko wystąpienia działań niepożądanych ze strony przewodu pokarmowego, tj. owrzodzenie błony śluzowej lub krwawienia.
- CHPL leku Aspirin, tabletki, 500 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na ciążę i (lub) rozwój zarodka lub płodu. Wyniki badań epidemiologicznych wskazują na to, że stosowanie inhibitorów syntezy prostaglandyn we wczesnym okresie ciąży zwiększa ryzyko poronienia, występowania wad wrodzonych serca i wytrzewień wrodzonych. Całkowite ryzyko wystąpienia wrodzonych wad sercowo-naczyniowych zwiększa się z mniej niż 1% do około 1,5%. Uważa się, że ryzyko zwiększa się wraz z dawką i długością okresu terapii. U zwierząt po podaniu inhibitorów syntezy prostaglandyn zaobserwowano zwiększone ryzyko obumarcia zapłodnionego jaja w okresie przed i po zagnieżdżeniu się w macicy oraz zwiększone ryzyko obumarcia zarodka lub płodu. Dodatkowo, u zwierząt, po podaniu inhibitorów syntezy prostaglandyn w okresie organogenezy, donoszono o zwiększonej liczbie przypadków różnych wad rozwojowych, w tym wad sercowo-naczyniowych.
- CHPL leku Aspirin, tabletki, 500 mgWpływ na płodność, ciążę i laktację
Stosowanie produktu leczniczego Aspirin u kobiet od 20. tygodnia ciąży może powodować małowodzie wynikające z zaburzeń czynności nerek płodu. Może ono wystąpić wkrótce po rozpoczęciu leczenia i zwykle ustępuje po przerwaniu leczenia. Ponadto zgłaszano przypadki zwężenia przewodu tętniczego po stosowaniu produktu leczniczego w drugim trymestrze ciąży, z których większość ustępowała po przerwaniu leczenia. Z tego powodu, nie należy stosować produktów zawierających kwas acetylosalicylowy u kobiet w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. W razie stosowania kwasu acetylosalicylowego przez kobiety usiłujące zajść w ciążę lub w pierwszym i drugim trymestrze ciąży, należy stosować jak najmniejszą dawkę produktu leczniczego przez możliwie najkrótszy czas. Należy rozważyć obserwację przedporodową pod kątem małowodzia i zwężenia przewodu tętniczego po kilkudniowej ekspozycji na produkt Aspirin od 20. tygodnia ciąży.
- CHPL leku Aspirin, tabletki, 500 mgWpływ na płodność, ciążę i laktację
W przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego stosowanie Aspirin należy przerwać. W trzecim trymestrze ciąży Wszystkie inhibitory syntezy prostaglandyn mogą powodować narażenie płodu na: d działanie toksyczne na układ krążenia i układ oddechowy (przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne), zaburzenia czynności nerek (patrz powyżej). W końcowym okresie ciąży wszystkie inhibitory prostaglandyn mogą spowodować narażenie matki i noworodka na: możliwość wydłużenia czasu krwawienia, działanie antyagregacyjne, które może ujawnić się nawet po zastosowaniu bardzo małych dawek, zahamowanie czynności skurczowej macicy, prowadzącej do opóźnienia porodu lub przedłużenia akcji porodowej. W konsekwencji kwas acetylosalicylowy jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3). Karmienie piersi? Kwas acetylosalicylowy i jego metabolity przenikają w niewielkich ilościach do mleka kobiecego.
- CHPL leku Aspirin, tabletki, 500 mgWpływ na płodność, ciążę i laktację
Ponieważ jak dotąd, podczas krótkotrwałego stosowania salicylanów przez matki, nie stwierdzono występowania działań niepożądanych u niemowląt karmionych piersią, przerywanie karmienia piersią z reguły nie jest konieczne. Jednakże w przypadku regularnego przyjmowania dużych dawek kwasu acetylosalicylowego, karmienie piersią powinno być wcześniej przerwane. Płodność Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
- CHPL leku Aspirin, tabletki, 500 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Aspirin nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Aspirin, tabletki, 500 mgDziałania niepożądane
4.8 Działania niepożądane Zaburzeni Bóle żołądka i brzucha, zgaga, nudności, wymioty, niestrawność, zapalenie przewodu pokarmowego, potencjalnie zagrażające życiu krwawienia z przewodu pokarmowego: jawne (fusowate wymioty, smoliste stolce) lub utajone (do krwawień dochodzi tym częściej im większa jest dawka); choroba wrzodowa żołądka lub dwunastnicy, perforacja, enteropatia zwężeniowa jelit (szczególnie podczas długotrwałego stosowania). Zaburz W rzadkich przypadkach opisano przemijające zaburzenia czynności wątroby (zwiększenie aktywności aminotransferaz). Zaburzenia układu nerwowego: Zawroty głowy i szumy uszne, będące zazwyczaj objawami przedawkowania. Zaburze Zwiększone ryzyko krwawień, krwotoki (pooperacyjne, z nosa, z dziąseł, z układu moczowo-płciowego), krwiaki, wydłużenie czasu krwawienia, czasu protrombinowego, trombocytopenia.
- CHPL leku Aspirin, tabletki, 500 mgDziałania niepożądane
Skutkiem krwawień może być wystąpienie niedokrwistości z niedoboru żelaza albo niedokrwistości pokrwotocznej objawiające się astenią, bladością, hypoperfuzją a także nieprawidłowymi wynikami badań laboratoryjnych. Hemoliza i niedokrwistość hemolityczna u pacjentów cierpiących na poważną postać niedoboru dehydrogenazy glukozo-6-fosforanowej (G6PD). Zaburzenia naczyniowe: Wylew krwi do mózgu (szczególnie u pacjentów z niekontrolowanym nadciśnieniem i (lub) jednocześnie stosujących inne leki przeciwzakrzepowe) potencjalnie zagrażający życiu. Zaburzenia nerek i dróg moczowych: Zaburzenia czynności nerek i ciężkie uszkodzenie nerek. Zaburzenia układu immunologicznego: Reakcje nadwrażliwości z objawami klinicznymi i nieprawidłowymi wynikami odpowiednich badań laboratoryjnych takie jak: choroba układu oddechowego, która nasila się po zażyciu kwasu acetylosalicylowego, łagodne do umiarkowanych reakcje obejmujące skórę, układ oddechowy, układ sercowo-naczyniowy z objawami takimi jak: wysypka, pokrzywka, obrzęk (w tym naczynioruchowy), zaburzenia oddychania i pracy serca, zapalenie błony śluzowej nosa, przekrwienie błony śluzowej nosa i bardzo rzadko ciężkie reakcje, w tym wstrząs anafilaktyczny.
- CHPL leku Aspirin, tabletki, 500 mgDziałania niepożądane
Zaburzenia układu oddechowego: Astma oskrzelowa. Długotrwałe przyjmowanie produktów zawierających kwas acetylosalicylowy może być przyczyną bólu głowy, który nasila się podczas przyjmowania kolejnych dawek. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Aspirin, tabletki, 500 mgPrzedawkowanie
4.9 Przedawkowanie Zatrucie salicylanami (może wystąpić w przypadku przyjmowania dawki >100 mg/kg m.c./dobę przez więcej niż 2 dni) może być spowodowane długotrwałym przyjmowaniem dawek terapeutycznych lub zatruciem ostrym (w wyniku przedawkowania) potencjalnie zagrażającym życiu, np. po przypadkowym przyjęciu leku przez dzieci lub przypadkowym zatruciu. Przewlekłe zatrucie salicylanami Objawy zatrucia w wyniku długotrwałego przyjmowania leku są niespecyficzne, przez co łatwe do zbagatelizowania. Lekkie zatrucie lub salicylizm, występuje zwykle po wielokrotnym przyjęciu zbyt dużych dawek. Objawy zatrucia obejmują: zawroty głowy (w tym pochodzenia błędnikowego), szumy uszne, głuchotę, nadmierne pocenie się, nudności i wymioty, ból głowy, splątanie i mogą ustąpić po zmniejszeniu dawki przyjmowanego leku. Szumy uszne mogą wystąpić przy stężeniu leku we krwi od 150 do 300 mikrogramów/ml.
- CHPL leku Aspirin, tabletki, 500 mgPrzedawkowanie
Poważniejsze działania niepożądane występują przy stężeniu kwasu acetylosalicylowego we krwi powyżej 300 mikrogramów/ml. Ostre zatrucie salicylanami Ciężkie zatrucie charakteryzuje się poważnymi zaburzeniami równowagi kwasowej a objawy różnią się w zależności od wieku i ciężkości zatrucia. U dzieci objawia się najczęściej kwasicą metaboliczną. Stężenie kwasu acetylosalicylowego we krwi nie pozwala oszacować stopnia zatrucia. Wchłanianie kwasu acetylosalicylowego może być zmniejszone w wyniku opóźnionego opróżniania żołądka, tworzenia się złogów w żołądku lub w wyniku przyjęcia leku w postaci tabletek powlekanych. Leczenie ciężkiego zatrucia jest uzależnione od przyjętej dawki, stadium i objawów klinicznych. Należy zastosować standardowe techniki postępowania w przypadku zatrucia. Podstawowe działania, które należy podjąć to zwiększenie wydalania substancji czynnej oraz przywrócenie równowagi elektrolitowej i równowagi kwasowo-zasadowej.
- CHPL leku Aspirin, tabletki, 500 mgPrzedawkowanie
Ze względu na złożoną patofizjologię skutków zatrucia salicylanami, objawy oraz wyniki badań mogą obejmować: Objawy lekkie do umiarkowanego: Płukanie żołądka, wielokrotne podanie węgla aktywowanego, forsowana diureza alkaliczna Przyspieszony oddech, hiperwentylacja, alkaloza: Alkalemia, alkaluria Podawanie płynów i kontrola stężenia elektrolitów Obfite pocenie się: Nudności, wymioty Objawy umiarkowane do ciężkiego: Płukanie żołądka, wielokrotne podanie węgla aktywowanego, forsowana diureza alkaliczna, hemodializa w ciężkich przypadkach Kwasica, acyduria: Podawanie płynów i kontrola stężenia elektrolitów Wysoka gorączka: Podawanie płynów i kontrola stężenia elektrolitów Zaburzenia układu oddechowego: od hiperwentylacji, obrzęku płuc niesercowego pochodzenia do zatrzymania oddechu i asfiksji Zaburzenia serca i naczyń krwionośnych: od arytmii, niskiego ciśnienia do zatrzymania pracy serca Utrata płynów i elektrolitów: od odwodnienia, oligurii aż do niewydolności nerek Zaburzenia metabolizmu glukozy, ketoza: Hiperglikemia, hipoglikemia (szczególnie u dzieci) Szumy uszne, głuchota: Zaburzenia układu pokarmowego: krwawienia z układu pokarmowego Zaburzenia krwi: od zahamowania agregacji płytek krwi do koagulopatii np.
- CHPL leku Aspirin, tabletki, 500 mgPrzedawkowanie
wydłużenie czasu protrombinowego, hipoprotrombinemia Zaburzenia neurologiczne: toksyczna encefalopatia i hamowanie czynności OUN objawiające się letargiem, splątaniem aż do śpiączki i napadu drgawkowego
- CHPL leku Aspirin, tabletki, 500 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inne leki przeciwbólowe i przeciwgorączkowe, kwas salicylowy i jego pochodne; kod ATC: N02B A01. Kwas acetylosalicylowy należy do grupy kwasowych niesteroidowych leków przeciwzapalnych o właściwościach przeciwbólowych, przeciwgorączkowych i przeciwzapalnych. Mechanizm jego działania polega na nieodwracalnym hamowaniu cyklooksygenazy kwasu arachidonowego, a tym samym hamowaniu syntezy prostanoidów: prostaglandyny E2 (PGE2), prostaglandyny I2 (PGI2) oraz tromboksanu A2. Hamując syntezę tromboksanu A2 w płytkach krwi, kwas acetylosalicylowy hamuje także agregację płytek krwi.
- CHPL leku Aspirin, tabletki, 500 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, kwas acetylosalicylowy wchłania się szybko i całkowicie z przewodu pokarmowego. W trakcie wchłaniania oraz po wchłonięciu jest przekształcany do głównego metabolitu – kwasu salicylowego. Ogólnie, maksymalne stężenie kwasu acetylosalicylowego w osoczu osiągane jest po 18-30 minutach, a kwasu salicylowego po 0,72 - 2 godzinach. W przypadku tabletek 500 mg średnie maksymalne stężenie kwasu acetylosalicylowego w osoczu (Cmax) wynosi 5,4 μg/ml, a mediana czasu do uzyskania maksymalnego stężenia w osoczu (Tmax) wynosi 30 minut. Średnia całkowita ekspozycja na kwas acetylosalicylowy (pole pod krzywą [AUC]) wynosi 6,2 μg x h/ml. Wartość Cmax kwasu salicylowego wynosi 25,4 μg/ml, mediana Tmax wynosi 2 godziny, a średnia AUC wynosi 145 μg x h/ml. Zarówno kwas acetylosalicylowy jak i kwas salicylowy wiążą się silnie z białkami osocza i ulegają szybkiej dystrybucji w całym organizmie.
- CHPL leku Aspirin, tabletki, 500 mgWłaściwości farmakokinetyczne
Kwas salicylowy przenika przez łożysko i do mleka kobiet karmiących piersią. Kwas acetylosalicylowy jest przekształcany do swojego głównego metabolitu, kwasu salicylowego. Hydroliza grupy acetylowej kwasu acetylosalicylowego rozpoczyna się jeszcze podczas przejścia przez śluzówkę jelita, lecz proces ten zachodzi przede wszystkim w wątrobie. Główne metabolity to kwas salicylowy sprzężony z glicyną (kwas salicylurowy), eter i ester glukuronidowy kwasu salicylowego (fenylosalicylan glukuronidu i acetylosalicylan glukuronidu) oraz kwas gentyzynowy w postaci wolnej i sprzężonej z glicyną. Kinetyka eliminacji kwasu salicylowego zależy w dużym stopniu od dawki, ponieważ metabolizm kwasu salicylowego jest ograniczony przez aktywność enzymów wątrobowych. Okres półtrwania wynosi od 2 do 3 godzin po zastosowaniu małych dawek (do 325 mg/dobę) do około 15 godzin po dużych dawkach terapeutycznych (powyżej 3 g/dobę) lub w przypadku zatrucia.
- CHPL leku Aspirin, tabletki, 500 mgWłaściwości farmakokinetyczne
Kwas salicylowy i jego metabolity są wydalane głównie przez nerki.
- CHPL leku Aspirin, tabletki, 500 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Profil bezpieczeństwa kwasu acetylosalicylowego jest dobrze udokumentowany w licznych badaniach nieklinicznych. W badaniach na zwierzętach salicylany powodowały uszkodzenie nerek, lecz nie wywoływały innych zmian chorobowych. Kwas acetylosalicylowy został przebadany pod kątem działania mutagennego i rakotwórczego. Nie znaleziono dowodów, świadczących o właściwościach mutagennych i rakotwórczych kwasu acetylosalicylowego. Na podstawie badań przeprowadzonych na zwierzętach, stwierdzono, że salicylany wykazują działanie teratogenne u kilku gatunków zwierząt. Istnieją doniesienia dotyczące zaburzeń implantacji jaja płodowego, działania toksycznego na zarodek i płód oraz zaburzeń sprawności uczenia się u potomstwa narażonego na salicylany przed urodzeniem.
- CHPL leku Aspirin, tabletki, 500 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych celuloza skrobia kukurydziana 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 4 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30ºC. 6.5 Rodzaj i zawartość opakowania Blistry z folii PP/Al w tekturowym pudełku. Opakowanie zawiera 10, 20 lub 100 tabletek w blistrach po 10 tabletek. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ASPIRIN C, 400 mg + 240 mg, tabletki musujące 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka musująca zawiera substancje czynne: 400 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum) 240 mg kwasu askorbowego (Acidum ascorbicum) Substancje pomocnicze o znanym działaniu: Jedna tabletka musująca zawiera 467 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka musująca
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgWskazania do stosowania
4.1 Wskazania do stosowania Objawowe leczenie dolegliwości bólowych o małym i (lub) umiarkowanym nasileniu (np.: bóle głowy, bóle zębów, bóle mięśniowe). Objawowe leczenie dolegliwości bólowych i gorączki w przebiegu przeziębienia i grypy.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Jednorazowo od 1 do 2 tabletek musujących (tj. 400 – 800 mg kwasu acetylosalicylowego i 240 - 480 mg kwasu askorbowego). W razie konieczności, dawka jednorazowa może być powtarzana co 4 do 8 godzin. Nie należy przyjmować więcej niż 8 tabletek na dobę (tj. 3200 mg kwasu acetylosalicylowego i 1920 mg kwasu askorbowego). Młodzież w wieku powyżej 12 lat Produkt leczniczy Aspirin C może być stosowany u młodzieży w wieku powyżej 12 lat wyłącznie na zlecenie lekarza. Jednorazowo jedna tabletka musująca (tj. 400 mg kwasu acetylosalicylowego i 240 mg kwasu askorbowego). W razie konieczności dawka jednorazowa może być powtarzana co 4 do 8 godzin. Nie stosować więcej niż 3 tabletki na dobę (tj. 1200 mg kwasu acetylosalicylowego i 720 mg kwasu askorbowego). W razie nieumyślnego zażycia lub przypadkowego przyjęcia leku przez dzieci, patrz punkt 4.4.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgDawkowanie
Produktu leczniczego Aspirin C nie należy stosować dłużej niż 3-5 dni bez konsultacji z lekarzem. Pacjenci z zaburzeniami czynności wątroby Kwas acetylosalicylowy należy stosować ostrożnie u pacjentów z nieprawidłową czynnością wątroby (patrz punkt 4.4). Pacjenci z zaburzeniami czynności nerek Kwas acetylosalicylowy należy stosować ostrożnie u pacjentów z nieprawidłową czynnością nerek (patrz punkt 4.4). Sposób podawania Tabletki należy przyjmować doustnie. Przed zażyciem tabletki należy rozpuścić w szklance wody i wypić musujący płyn.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Skaza krwotoczna. Ostra choroba wrzodowa żołądka lub dwunastnicy. Napady astmy oskrzelowej w wywiadzie, wywołane podaniem salicylanów lub substancji o podobnym działaniu, szczególnie niesteroidowych leków przeciwzapalnych. Ciężka niewydolność serca, ciężka niewydolność wątroby lub ciężka niewydolność nerek. Jednocześnie z metotreksatem w dawkach 15 mg na tydzień lub większych (patrz punkt 4.5). Ostatni trymestr ciąży. U dzieci w wieku poniżej 12 lat. Kamica nerkowa aktualnie lub w przeszłości. Hiperoksaluria. Hemochromatoza.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Kwas acetylosalicylowy z kwasem askorbowym należy stosować ostrożnie: w przypadku nadwrażliwości na niesteroidowe leki przeciwzapalne i przeciwreumatyczne lub inne substancje alergizujące, podczas jednoczesnego stosowania leków przeciwzakrzepowych (patrz punkt 4.5), u pacjentów z zaburzoną czynnością wątroby, u pacjentów z zaburzoną czynnością nerek lub zaburzeniami krążenia (np. choroba naczyń nerkowych, zastoinowa niewydolność serca, zmniejszenie objętości krwi krążącej, rozległa operacja, posocznica, ciężkie krwawienia), gdyż kwas acetylosalicylowy może dodatkowo zwiększyć ryzyko występowania zaburzeń czynności nerek i ciężkiej niewydolności nerek, u pacjentów z przebytą (przewlekłą lub nawracającą) chorobą wrzodową lub krwawieniami z przewodu pokarmowego w wywiadzie, u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej, gdyż podanie kwasu acetylosalicylowego może wywołać wystąpienie hemolizy lub niedokrwistości hemolitycznej.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgSpecjalne środki ostrozności
Czynniki, które mogą zwiększać ryzyko wystąpienia hemolizy to m.in. wysokie dawki kwasu acetylosalicylowego, gorączka, ciężkie infekcje; w okresie karmienia piersią (patrz punkt 4.6). Nie należy stosować produktów zawierających kwas acetylosalicylowy u kobiet w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne (patrz punkt 4.6). Kwas acetylosalicylowy może powodować skurcz oskrzeli i wywoływać napady astmy lub inne reakcje nadwrażliwości. Czynniki ryzyka obejmują: astmę oskrzelową, przewlekłe choroby układu oddechowego, katar sienny, polipy błony śluzowej nosa. Ostrzeżenie to odnosi się także do pacjentów, u których występują reakcje alergiczne (np. odczyny skórne, świąd, pokrzywka) na inne substancje. Kwas acetylosalicylowy, ze względu na działanie antyagregacyjne, które utrzymuje się przez kilka dni po zastosowaniu, może prowadzić do wydłużenia czasu krwawienia w czasie lub po zabiegach chirurgicznych (włącznie z niewielkimi zabiegami, np.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgSpecjalne środki ostrozności
ekstrakcją zęba). Kwas acetylosalicylowy, nawet w małych dawkach, zmniejsza wydalanie kwasu moczowego, co u predysponowanych pacjentów może wywołać napad dny moczanowej. W przebiegu niektórych chorób wirusowych, szczególnie w przypadku zakażenia wirusem grypy typu A, wirusem grypy typu B lub ospy wietrznej, głównie u dzieci i młodzieży, istnieje ryzyko wystąpienia zespołu Reye’a – rzadkiej, ale zagrażającej życiu choroby. Występowanie uporczywych wymiotów w przebiegu infekcji może wskazywać na wystąpienie zespołu Reye’a, co wymaga natychmiastowej pomocy medycznej. Ryzyko wystąpienia zespołu Reye’a w przebiegu infekcji wirusowych może wzrosnąć, jeśli jednocześnie podaje się kwas acetylosalicylowy, chociaż związek przyczynowy nie został udowodniony. Z ww. względów u dzieci w wieku poniżej 12 lat produktów zawierających kwas acetylosalicylowy nie należy stosować, a u młodzieży w wieku powyżej 12 lat produkty zawierające kwas acetylosalicylowy można stosować wyłącznie na zlecenie lekarza.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgSpecjalne środki ostrozności
Długotrwałe przyjmowanie produktów zawierających kwas acetylosalicylowy może być przyczyną bólu głowy, który nasila się podczas przyjmowania kolejnych dawek. Długotrwałe przyjmowanie leków przeciwbólowych, szczególnie zawierających kilka substancji czynnych może prowadzić do ciężkiego zaburzenia czynności nerek i niewydolności nerek. Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii. W przypadku pacjentów chorych na szczawianowo-wapniową kamicę nerkową lub nawracającą kamicę nerkową zaleca się zachowanie szczególnej ostrożności w spożywaniu przez nich kwasu askorbowego. Produkt zawiera 467 mg sodu w jednej tabletce musującej, co jest równoważne 23% zalecanej przez Światową Organizację Zdrowia (WHO) maksymalnej 2 g dawki dobowej spożycia sodu u osób dorosłych.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgSpecjalne środki ostrozności
Należy wziąć to pod wagę u pacjentów ze zmniejszoną czynnością nerek i u pacjentów kontrolujących zawartość sodu w diecie.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Leki przeciwwskazane do jednoczesnego stosowania z kwasem acetylosalicylowym: Metotreksat w dawkach 15 mg na tydzień lub większych: nasilenie toksycznego wpływu metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z produktami przeciwzapalnymi - w tym z kwasem acetylosalicylowym - oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza - patrz punkt 4.3). Interakcje wymagające zachowania szczególnej ostrożności: Metotreksat w dawkach mniejszych niż 15 mg na tydzień: nasilenie toksycznego wpływu metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z produktami przeciwzapalnymi - w tym z kwasem acetylosalicylowym - oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza - patrz wyżej).
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgInterakcje
Leki przeciwzakrzepowe, leki trombolityczne lub inne leki hamujące agregację płytek krwi: jednoczesne stosowanie kwasu acetylosalicylowego z lekami przeciwzakrzepowymi oraz trombolitycznymi może powodować nasilenie działania przeciwzakrzepowego: zwiększone ryzyko wydłużenia czasu krwawienia i krwotoków, wynikające z wypierania leków przeciwzakrzepowych z ich połączeń z białkami osocza oraz właściwości antyagregacyjnych kwasu acetylosalicylowego. Inne niesteroidowe leki przeciwzapalne, w tym salicylany: jednoczesne stosowanie niesteroidowych leków przeciwzapalnych z kwasem acetylosalicylowym zwiększa ryzyko wystąpienia choroby wrzodowej i krwawień z przewodu pokarmowego oraz uszkodzenia nerek, na skutek synergistycznego działania tych leków. Selektywne inhibitory zwrotnego wychwytu serotoniny (SSRI): zwiększone ryzyko krwawień z górnego odcinka przewodu pokarmowego na skutek synergistycznego działania tych leków. Leki zwiększające wydalanie kwasu moczowego z moczem, np.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgInterakcje
benzbromaron, probenecyd: kwas acetylosalicylowy stosowany jednocześnie z lekami zwiększającymi wydalanie kwasu moczowego powoduje osłabienie działania leków przeciwdnawych (konkurencja w procesie wydalania kwasu moczowego przez kanaliki nerkowe). Digoksyna: jednoczesne stosowanie kwasu acetylosalicylowego z digoksyną powoduje zwiększenie stężenia digoksyny w osoczu, wynikające ze zmniejszonego wydalania digoksyny przez nerki. Leki przeciwcukrzycowe, np. insulina, pochodne sulfonylomocznika: ze względu na właściwości hipoglikemizujące oraz wypieranie pochodnych sulfonylomocznika z połączeń z białkami osocza, kwas acetylosalicylowy nasila działanie leków przeciwcukrzycowych. Leki moczopędne stosowane jednocześnie z kwasem acetylosalicylowym: osłabienie działania moczopędnego poprzez zatrzymywanie sodu i wody w organizmie na skutek zmniejszenia filtracji kłębuszkowej, spowodowanej zmniejszoną syntezą prostaglandyn w nerkach.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgInterakcje
Kwas acetylosalicylowy może nasilać działanie ototoksyczne furosemidu. Glikokortykosteroidy podawane ogólnie, z wyjątkiem hydrokortyzonu stosowanego jako terapia zastępcza w chorobie Addisona, stosowane jednocześnie z kwasem acetylosalicylowym: zmniejszenie stężenia salicylanów w osoczu w trakcie kortykoterapii i zwiększenie ryzyka przedawkowania salicylanów po zakończeniu przyjmowania kortykosteroidów (zwiększone ryzyko wystąpienia choroby wrzodowej i krwawień). Inhibitory konwertazy angiotensyny (ACE) stosowane jednocześnie z kwasem acetylosalicylowym: zmniejszenie działania przeciwnadciśnieniowego poprzez zmniejszenie filtracji kłębuszkowej, wynikające z hamowania produkcji prostaglandyn, działających rozszerzająco na naczynia krwionośne. Kwas walproinowy: kwas acetylosalicylowy zwiększa toksyczność kwasu walproinowego, poprzez wypieranie go z połączeń z białkami osocza.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgInterakcje
Kwas walproinowy nasila działanie antyagregacyjne kwasu acetylosalicylowego ze względu na synergistyczne działanie antyagregacyjne obu leków. Alkohol: może zwiększyć ryzyko wystąpienia działań niepożądanych ze strony przewodu pokarmowego, tj. owrzodzenie błony śluzowej lub krwawienia. Deferoksamina: jednoczesne stosowanie z kwasem askorbowym może zwiększyć toksyczność tkankową żelaza, zwłaszcza w obrębie serca, co powoduje jego niewydolność. Badania laboratoryjne Witamina C: Ponieważ witamina C jest związkiem o działaniu redukującym (tj. donorem elektronów), może wchodzić w interakcje chemiczne w trakcie badań laboratoryjnych, obejmujące reakcje utleniania - redukcji, takie jak analiza glukozy, kreatyniny, karbamazepiny, kwasu moczowego w moczu i surowicy oraz krwi utajonej w kale. Witamina C może wpływać na oznaczenia glukozy w moczu i we krwi, powodując ich zafałszowane wyniki, chociaż nie wpływa na stężenie glukozy we krwi.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża: Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na ciążę i (lub) rozwój zarodka lub płodu. Wyniki badań epidemiologicznych wskazują na to, że stosowanie inhibitorów syntezy prostaglandyn we wczesnym okresie ciąży zwiększa ryzyko poronienia, występowania wad wrodzonych serca i wytrzewień wrodzonych. Całkowite ryzyko wystąpienia wrodzonych wad sercowo-naczyniowych zwiększa się z mniej niż 1% do około 1,5%. Uważa się, że ryzyko zwiększa się wraz z dawką i długością okresu terapii. U zwierząt po podaniu inhibitorów syntezy prostaglandyn zaobserwowano zwiększone ryzyko obumarcia zapłodnionego jaja w okresie przed i po zagnieżdżeniu się w macicy oraz zwiększone ryzyko obumarcia zarodka lub płodu. Dodatkowo, u zwierząt, po podaniu inhibitorów syntezy prostaglandyn w okresie organogenezy, donoszono o zwiększonej liczbie przypadków różnych wad rozwojowych, w tym wad sercowo-naczyniowych.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgWpływ na płodność, ciążę i laktację
Stosowanie produktu leczniczego Aspirin C u kobiet od 20. tygodnia ciąży może powodować małowodzie wynikające z zaburzeń czynności nerek płodu. Może ono wystąpić wkrótce po rozpoczęciu leczenia i zwykle ustępuje po przerwaniu leczenia. Ponadto zgłaszano przypadki zwężenia przewodu tętniczego po stosowaniu produktu leczniczego w drugim trymestrze ciąży, z których większość ustępowała po przerwaniu leczenia. Z tego powodu, nie należy stosować produktów zawierających kwas acetylosalicylowy u kobiet w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. W razie stosowania kwasu acetylosalicylowego przez kobiety usiłujące zajść w ciążę lub w pierwszym i drugim trymestrze ciąży, należy stosować jak najmniejszą dawkę produktu leczniczego przez możliwie najkrótszy czas. Należy rozważyć obserwację przedporodową pod kątem małowodzia i zwężenia przewodu tętniczego po kilkudniowej ekspozycji na produkt Aspirin C od 20. tygodnia ciąży.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgWpływ na płodność, ciążę i laktację
W przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego stosowanie Aspirin C należy przerwać. W trzecim trymestrze ciąży: wszystkie inhibitory syntezy prostaglandyn mogą powodować narażenie płodu na: d działanie toksyczne na układ krążenia i układ oddechowy (przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne), zaburzenia czynności nerek (patrz powyżej). W końcowym okresie ciąży wszystkie inhibitory prostaglandyn mogą spowodować narażenie matki i noworodka na: możliwość wydłużenia czasu krwawienia, działanie antyagregacyjne, które może ujawnić się nawet po zastosowaniu bardzo małych dawek, zahamowanie czynności skurczowej macicy prowadzącej do opóźnienia porodu lub przedłużenia akcji porodowej. W konsekwencji kwas acetylosalicylowy jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3).
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgWpływ na płodność, ciążę i laktację
Karmienie piersią: Kwas acetylosalicylowy i jego metabolity, oraz witamina C przenikają w niewielkich ilościach do mleka kobiecego. Ponieważ jak dotąd, podczas krótkotrwałego stosowania salicylanów przez matki, nie stwierdzono występowania działań niepożądanych u niemowląt karmionych piersią, przerywanie karmienia piersią z reguły nie jest konieczne. Jednakże w przypadku regularnego przyjmowania dużych dawek kwasu acetylosalicylowego, karmienie piersią powinno być wcześniej przerwane. Płodność: Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Aspirin C nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgDziałania niepożądane
4.8 Działania niepożądane Zaburzenia żołądka i jelit: Bóle żołądka i brzucha zgaga biegunka nudności wymioty niestrawność zapalenie przewodu pokarmowego potencjalnie zagrażające życiu krwawienia z przewodu pokarmowego: jawne (fusowate wymioty, smoliste stolce) lub utajone (do krwawień dochodzi tym częściej im większa jest dawka) choroba wrzodowa żołądka lub dwunastnicy perforacja enteropatia zwężeniowa jelit (szczególnie podczas długotrwałego stosowania) Zaburzenia wątroby i dróg żółciowych: W rzadkich przypadkach opisano przemijające zaburzenia czynności wątroby (zwiększenie aktywności aminotransferaz). Zaburzenia układu nerwowego: Zawroty głowy i szumy uszne, będące zazwyczaj objawami przedawkowania. Zaburzenia krwi i układu chłonnego: Zwiększone ryzyko krwawień krwotoki (krwotok zabiegowy, z nosa, z dziąseł, z układu moczowo-płciowego) krwiaki wydłużenie czasu krwawienia, czasu protrombinowego trombocytopenia Skutkiem krwawień może być wystąpienie niedokrwistości z niedoboru żelaza albo ostrej niedokrwistości pokrwotocznej objawiające się astenią, bladością, hypoperfuzją a także nieprawidłowymi wynikami badań laboratoryjnych.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgDziałania niepożądane
Hemoliza i niedokrwistość hemolityczna u pacjentów cierpiących na poważną postać niedoboru dehydrogenazy glukozo-6-fosforanowej (G6PD). Zaburzenia naczyniowe: Wylew krwi do mózgu (szczególnie u pacjentów z niekontrolowanym nadciśnieniem i (lub) jednocześnie stosujących inne leki przeciwzakrzepowe) potencjalnie zagrażający życiu. Zaburzenia nerek i dróg moczowych: Zaburzenia czynności nerek i ciężkie uszkodzenie nerek. Zaburzenia układu immunologicznego: Reakcje nadwrażliwości z objawami klinicznymi i nieprawidłowymi wynikami odpowiednich badań laboratoryjnych takie jak: zaostrzenie choroby układu oddechowego, która nasila się po zażyciu kwasu acetylosalicylowego, łagodne do umiarkowanych reakcje obejmujące skórę, układ oddechowy, układ sercowo-naczyniowy z objawami takimi jak: wysypka, pokrzywka, obrzęk (w tym naczynioruchowy), zaburzenia oddychania i pracy serca, zapalenie błony śluzowej nosa, przekrwienie błony śluzowej nosa i bardzo rzadko ciężkie reakcje, w tym wstrząs anafilaktyczny.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgDziałania niepożądane
Zaburzenia układu oddechowego: Astma oskrzelowa. Długotrwałe przyjmowanie produktów zawierających kwas acetylosalicylowy może być przyczyną bólu głowy, który nasila się podczas przyjmowania kolejnych dawek. 4.9 Przedawkowanie Zatrucie salicylanami (może wystąpić w przypadku przyjmowania dawki >100 mg/kg m.c./dobę przez więcej niż 2 dni) może być spowodowane długotrwałym przyjmowaniem dawek terapeutycznych lub zatruciem ostrym (w wyniku przedawkowania) potencjalnie zagrażającym życiu, np. po przypadkowym przyjęciu leku przez dzieci lub przypadkowym zatruciu. Objawy zatrucia w wyniku długotrwałego przyjmowania leku są niespecyficzne, przez co łatwe do zbagatelizowania. Lekkie zatrucie lub salicylizm, występuje zwykle po wielokrotnym przyjęciu zbyt dużych dawek. Objawy zatrucia obejmują: zawroty głowy (w tym pochodzenia błędnikowego), szumy uszne, głuchotę, nadmierne pocenie się, nudności i wymioty, ból głowy, splątanie i mogą ustąpić po zmniejszeniu dawki przyjmowanego leku.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgDziałania niepożądane
Szumy uszne mogą wystąpić przy stężeniu leku we krwi od 150 do 300 mikrogramów/ml. Poważniejsze działania niepożądane występują przy stężeniu kwasu acetylosalicylowego we krwi powyżej 300 mikrogramów/ml. Ciężkie zatrucie charakteryzuje się poważnymi zaburzeniami równowagi kwasowej a objawy różnią się w zależności od wieku i ciężkości zatrucia. U dzieci objawia się najczęściej kwasicą metaboliczną. Stężenie kwasu acetylosalicylowego we krwi nie pozwala oszacować stopnia zatrucia. Wchłanianie kwasu acetylosalicylowego może być zmniejszone w wyniku opóźnionego opróżniania żołądka, tworzenia się złogów w żołądku lub w wyniku przyjęcia leku w postaci tabletek powlekanych. Leczenie ciężkiego zatrucia jest uzależnione od przyjętej dawki, stadium i objawów klinicznych. Należy zastosować standardowe techniki postępowania w przypadku zatrucia.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgDziałania niepożądane
Podstawowe działania, które należy podjąć to zwiększenie wydalania substancji czynnej oraz przywrócenie równowagi elektrolitowej i równowagi kwasowo-zasadowej. Objawy i postępowanie: Objawy Wyniki badań Postępowanie Zatrucie lekkie do umiarkowanego Płukanie żołądka, wielokrotne podanie węgla aktywowanego, forsowana diureza alkaliczna Przyspieszony oddech, hiperwentylacja, alkaloza oddechowa Alkalemia, alkaluria Podawanie płynów i kontrola stężenia elektrolitów Obfite pocenie się, nudności, wymioty Zatrucie umiarkowane do ciężkiego Płukanie żołądka, wielokrotne podanie węgla aktywowanego, forsowana diureza alkaliczna, hemodializa w ciężkich przypadkach Alkaloza oddechowa z wyrównawczą kwasicą metaboliczn? Kwasica, acyduria Podawanie płynów i kontrola stężenia elektrolitów Wysoka gorączka Zaburzenia układu oddechowego: od hiperwentylacji, obrzęku płuc niesercowego pochodzenia do zatrzymania oddechu i asfiksji Zaburzenia serca i naczyń krwionośnych od arytmii, niskiego ciśnienia do zatrzymania pracy serca Ciśnienie krwi, zmiany w zapisie EKG Utrata płynów i elektrolitów: od odwodnienia, oligurii aż do niewydolności nerek Hipokaliemia, hipernatremia, hiponatremia, zaburzona praca nerek Podawanie płynów i kontrola stężenia elektrolitów Zaburzenia metabolizmu glukozy, ketoza Hiperglikemia, hipoglikemia (szczególnie u dzieci) Zwiększone stężenie ketonów Szumy uszne, głuchota Zaburzenia układu pokarmowego: krwawienia z układu pokarmowego Zaburzenia krwi: od zahamowania agregacji płytek krwi do koagulopatii np.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgDziałania niepożądane
wydłużenie czasu protrombinowego, hipoprotrombinemia Zaburzenia neurologiczne: toksyczna encefalopatia i hamowanie czynności OUN objawiające się letargiem, splątaniem aż do śpiączki i napadu drgawkowego Kwas askorbowy Ostre lub przewlekłe przedawkowanie produktu może również powodować swoistą toksyczność związaną z witaminą C. Ogólnie objawy przedawkowania witaminy C mogą obejmować zaburzenia żołądkowo-jelitowe, takie jak biegunka, nudności i wymioty. Kliniczne objawy podmiotowe i przedmiotowe, wyniki badań laboratoryjnych oraz skutki przedawkowania zależą od indywidualnej wrażliwości, a także od dodatkowych uwarunkowań (tj. dawki, czasu trwania leczenia, czasu do postawienia rozpoznania). Jeżeli wystąpią objawy przedawkowania, produkt należy odstawić i skonsultować się z przedstawicielem służby zdrowia. Ostre lub przewlekłe przedawkowanie witaminy C (> 2 g/dobę u dorosłych) może powodować istotne zwiększenie stężenia szczawianów w moczu.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgDziałania niepożądane
W niektórych przypadkach prowadzi to do hiperoksalurii, krystalizacji szczawianu wapnia, powstania kamieni nerkowych, odkładania się szczawianu wapnia, nefropatii cewkowo-śródmiąższowej i ostrej niewydolności nerek. Przedawkowanie witaminy C u osób z niedoborem dehydrogenazy glukozo-6-fosforanowej (>3 g/dobę u dzieci i >15 g/dobę u dorosłych) może prowadzić do hemolizy erytrocytów.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgPrzedawkowanie
4.9 Przedawkowanie Zatrucie salicylanami (może wystąpić w przypadku przyjmowania dawki >100 mg/kg m.c./dobę przez więcej niż 2 dni) może być spowodowane długotrwałym przyjmowaniem dawek terapeutycznych lub zatruciem ostrym (w wyniku przedawkowania) potencjalnie zagrażającym życiu, np. po przypadkowym przyjęciu leku przez dzieci lub przypadkowym zatruciu. Objawy zatrucia w wyniku długotrwałego przyjmowania leku są niespecyficzne, przez co łatwe do zbagatelizowania. Lekkie zatrucie lub salicylizm, występuje zwykle po wielokrotnym przyjęciu zbyt dużych dawek. Objawy zatrucia obejmują: zawroty głowy (w tym pochodzenia błędnikowego), szumy uszne, głuchotę, nadmierne pocenie się, nudności i wymioty, ból głowy, splątanie i mogą ustąpić po zmniejszeniu dawki przyjmowanego leku. Szumy uszne mogą wystąpić przy stężeniu leku we krwi od 150 do 300 mikrogramów/ml. Poważniejsze działania niepożądane występują przy stężeniu kwasu acetylosalicylowego we krwi powyżej 300 mikrogramów/ml.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgPrzedawkowanie
Ciężkie zatrucie charakteryzuje się poważnymi zaburzeniami równowagi kwasowej a objawy różnią się w zależności od wieku i ciężkości zatrucia. U dzieci objawia się najczęściej kwasicą metaboliczną. Stężenie kwasu acetylosalicylowego we krwi nie pozwala oszacować stopnia zatrucia. Wchłanianie kwasu acetylosalicylowego może być zmniejszone w wyniku opóźnionego opróżniania żołądka, tworzenia się złogów w żołądku lub w wyniku przyjęcia leku w postaci tabletek powlekanych. Leczenie ciężkiego zatrucia jest uzależnione od przyjętej dawki, stadium i objawów klinicznych. Należy zastosować standardowe techniki postępowania w przypadku zatrucia. Podstawowe działania, które należy podjąć to zwiększenie wydalania substancji czynnej oraz przywrócenie równowagi elektrolitowej i równowagi kwasowo-zasadowej.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgPrzedawkowanie
Objawy i postępowanie: Objawy Wyniki badań Postępowanie Zatrucie lekkie do umiarkowanego Płukanie żołądka, wielokrotne podanie węgla aktywowanego, forsowana diureza alkaliczna Przyspieszony oddech, hiperwentylacja, alkaloza oddechowa Alkalemia, alkaluria Podawanie płynów i kontrola stężenia elektrolitów Obfite pocenie się, nudności, wymioty Zatrucie umiarkowane do ciężkiego Płukanie żołądka, wielokrotne podanie węgla aktywowanego, forsowana diureza alkaliczna, hemodializa w ciężkich przypadkach Alkaloza oddechowa z wyrównawczą kwasicą metaboliczn? Kwasica, acyduria Podawanie płynów i kontrola stężenia elektrolitów Wysoka gorączka Zaburzenia układu oddechowego: od hiperwentylacji, obrzęku płuc niesercowego pochodzenia do zatrzymania oddechu i asfiksji Zaburzenia serca i naczyń krwionośnych od arytmii, niskiego ciśnienia do zatrzymania pracy serca Ciśnienie krwi, zmiany w zapisie EKG Utrata płynów i elektrolitów: od odwodnienia, oligurii aż do niewydolności nerek Hipokaliemia, hipernatremia, hiponatremia, zaburzona praca nerek Podawanie płynów i kontrola stężenia elektrolitów Zaburzenia metabolizmu glukozy, ketoza Hiperglikemia, hipoglikemia (szczególnie u dzieci) Zwiększone stężenie ketonów Szumy uszne, głuchota Zaburzenia układu pokarmowego: krwawienia z układu pokarmowego Zaburzenia krwi: od zahamowania agregacji płytek krwi do koagulopatii np.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgPrzedawkowanie
wydłużenie czasu protrombinowego, hipoprotrombinemia Zaburzenia neurologiczne: toksyczna encefalopatia i hamowanie czynności OUN objawiające się letargiem, splątaniem aż do śpiączki i napadu drgawkowego Kwas askorbowy Ostre lub przewlekłe przedawkowanie produktu może również powodować swoistą toksyczność związaną z witaminą C. Ogólnie objawy przedawkowania witaminy C mogą obejmować zaburzenia żołądkowo-jelitowe, takie jak biegunka, nudności i wymioty. Kliniczne objawy podmiotowe i przedmiotowe, wyniki badań laboratoryjnych oraz skutki przedawkowania zależą od indywidualnej wrażliwości, a także od dodatkowych uwarunkowań (tj. dawki, czasu trwania leczenia, czasu do postawienia rozpoznania). Jeżeli wystąpią objawy przedawkowania, produkt należy odstawić i skonsultować się z przedstawicielem służby zdrowia. Ostre lub przewlekłe przedawkowanie witaminy C (> 2 g/dobę u dorosłych) może powodować istotne zwiększenie stężenia szczawianów w moczu.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgPrzedawkowanie
W niektórych przypadkach prowadzi to do hiperoksalurii, krystalizacji szczawianu wapnia, powstania kamieni nerkowych, odkładania się szczawianu wapnia, nefropatii cewkowo-śródmiąższowej i ostrej niewydolności nerek. Przedawkowanie witaminy C u osób z niedoborem dehydrogenazy glukozo-6-fosforanowej (>3 g/dobę u dzieci i >15 g/dobę u dorosłych) może prowadzić do hemolizy erytrocytów.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inne leki przeciwbólowe i przeciwgorączkowe, kwas salicylowy w połączeniach; kod ATC: N02B A51. Kwas acetylosalicylowy należy do grupy kwasowych niesteroidowych leków przeciwzapalnych o właściwościach przeciwbólowych, przeciwgorączkowych i przeciwzapalnych. Mechanizm jego działania polega na nieodwracalnym hamowaniu cyklooksygenazy kwasu arachidonowego, a tym samym hamowaniu syntezy prostanoidów: prostaglandyny E2 (PGE2), prostaglandyny I2 (PGI2) oraz tromboksanu A2. Hamując syntezę tromboksanu A2 w płytkach krwi, kwas acetylosalicylowy hamuje także agregację płytek krwi. Kwas askorbowy jest rozpuszczalny w wodzie i stanowi część układu chroniącego organizm ludzki przed endo- i egzogennymi rodnikami tlenowymi, które odgrywają również szczególną rolę w procesie zapalnym i wpływają na czynność leukocytów.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgWłaściwości farmakodynamiczne
Wyniki doświadczeń in vitro oraz ex vivo wskazują, że kwas askorbowy ma pozytywny wpływ na odpowiedź immunologiczną leukocytów ludzkich. Kwas askorbowy jest niezbędny do syntezy podstawowych związków istoty międzykomórkowej (mukopolisacharydów), które wraz z włóknami kolagenowymi odpowiadają za uszczelnianie ścian naczyń włośniczkowych. Dodatek kwasu askorbowego do kwasu acetylosalicylowego może powodować zmniejszenie częstości uszkodzeń w obrębie układu pokarmowego oraz nasilenia stresu tlenowego. To korzystne działanie może wpływać na lepszy profil tolerancji preparatu złożonego kwasu acetylosalicylowego z kwasem askorbowym w porównaniu z samym kwasem acetylosalicylowym.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Kwas acetylosalicylowy Wchłanianie: Po podaniu doustnym, kwas acetylosalicylowy wchłania się szybko i całkowicie z przewodu pokarmowego. Jest przekształcany do głównego metabolitu – kwasu salicylowego – w czasie i po wchłonięciu. Zazwyczaj, maksymalne stężenie kwasu acetylosalicylowego w osoczu osiągane jest po 15-30 minutach, a kwasu salicylowego po 0,72 do 2 godzinach, w zależności od postaci farmaceutycznej. Dodanie kwasu askorbowego prowadzi do niewielkich zmian lub braku zmian parametrów farmakokinetycznych kwasu acetylosalicylowego. Dystrybucja Zarówno kwas acetylosalicylowy jak i kwas salicylowy wiążą się silnie z białkami osocza i ulegają szybkiej dystrybucji w całym organizmie. Kwas salicylowy przenika przez łożysko i do mleka kobiet karmiących piersią. Metabolizm Kwas salicylowy metabolizowany jest głównie w wątrobie.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgWłaściwości farmakokinetyczne
Główne metabolity to kwas salicylowy sprzężony z glicyną (kwas salicylurowy), eter i ester glukuronidowy kwasu salicylowego (fenylosalicylan glukuronidu i acetylosalicylan glukuronidu) oraz kwas gentyzynowy w postaci wolnej i sprzężonej z glicyną. Eliminacja Kinetyka eliminacji kwasu salicylowego zależy w dużym stopniu od dawki, ponieważ metabolizm kwasu salicylowego jest ograniczony przez aktywność enzymów wątrobowych. Okres półtrwania wynosi od 2 do 3 godzin po zastosowaniu małych dawek (do 325 mg/dobę) do około 15 godzin po dużych dawkach terapeutycznych (powyżej 3 g/dobę) lub w przypadku zatrucia. Kwas salicylowy i jego metabolity są wydalane głównie przez nerki. Kwas askorbowy Po podaniu doustnym kwas askorbowy wchłania się w jelicie przy udziale Na+-zależnego systemu aktywnego transportu, który jest najbardziej aktywny w bliższej części jelita cienkiego.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgWłaściwości farmakokinetyczne
Wchłanianie nie jest proporcjonalne do przyjętej dawki; wprawdzie zwiększenie dawki dobowej nie powoduje proporcjonalnego zwiększenia stężenia kwasu askorbowego w osoczu i innych płynach ustrojowych, jednak dąży w kierunku górnych wartości. Kwas askorbowy jest częściowo metabolizowany do kwasu szczawiowego, z powstawaniem kwasu dehydroaskorbowego jako związku pośredniego. Kwas askorbowy podlega filtracji kłębuszkowej i reabsorbcji w proksymalnych kanalikach nerkowych przy udziale Na+-zależnego systemu aktywnego transportu. Główne metabolity kwasu askorbowego wydalane z moczem to kwas szczawiowy i kwas diketogulonowy.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Profil bezpieczeństwa kwasu acetylosalicylowego jest dobrze udokumentowany w licznych badaniach nieklinicznych. W badaniach na zwierzętach salicylany powodowały uszkodzenie nerek, lecz nie wywoływały innych zmian chorobowych. Kwas acetylosalicylowy został zbadany pod kątem działania mutagennego i rakotwórczego. Nie znaleziono dowodów, świadczących o właściwościach mutagennych i rakotwórczych kwasu acetylosalicylowego. Na podstawie badań przeprowadzonych na zwierzętach, stwierdzono, że salicylany wykazują działanie teratogenne u kilku gatunków zwierząt. Istnieją doniesienia dotyczące zaburzeń implantacji jaja płodowego, działania toksycznego na zarodek i płód oraz zaburzeń sprawności uczenia się u potomstwa narażonego na salicylany przed urodzeniem. Ograniczone dane dostępne z badań na zwierzętach i z udziałem ludzi wskazują na niską toksyczność witaminy C.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgPrzedkliniczne dane o bezpieczeństwie
Dane przedkliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących toksyczności ostrej oraz po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Aspirin C, tabletki musujące, 400 mg + 240 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych sodu cytrynian bezwodny sodu wodorowęglan kwas cytrynowy sodu węglan 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. 6.5 Rodzaj i zawartość opakowania 11 Saszetki papier/PE/Al/Surlyn w tekturowym pudełku. Opakowanie zawiera 10, 20 lub 40 tabletek musujących. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Przed zażyciem tabletkę należy rozpuścić w szklance wody. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ASPIRIN CARDIO, 100 mg, tabletki dojelitowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka dojelitowa zawiera jako substancję czynną 100 mg (Acidum acetylsalicylicum) kwasu acetylosalicylowego (ASA). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka dojelitowa
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgWskazania do stosowania
4.1. Wskazania do stosowania Kwas acetylosalicylowy jest wskazany do stosowania u dorosłych w następujących chorobach układu sercowo-naczyniowego: w niestabilnej chorobie wieńcowej, w świeżym zawale serca lub podejrzeniu świeżego zawału serca, w zapobieganiu powtórnemu zawałowi serca, w zapobieganiu powikłaniom zatorowo-zakrzepowym po zabiegach chirurgicznych lub interwencyjnych na naczyniach [np. przezskórna śródnaczyniowa angioplastyka wieńcowa (PTCA, ang. Percutaneous Transluminal Coronary Angioplasty), pomostowanie aortalno-wieńcowe (CABG, ang. Coronary Artery Bypass Grafting), endarterektomia tętnicy szyjnej, zespolenie („shunt”) tętniczo-żylne], w zapobieganiu napadom przejściowego niedokrwienia (TIA, ang. Transient Ischemic Attack) i niedokrwiennego udaru mózgu u pacjentów z TIA, w zapobieganiu pierwszemu zawałowi serca u pacjentów z wieloma czynnikami ryzyka, w zapobieganiu zakrzepicy żył głębokich i zatorowi płuc u pacjentów długotrwale unieruchomionych, np.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgWskazania do stosowania
po dużych zabiegach chirurgicznych, jako uzupełnienie innych metod profilaktyki.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgDawkowanie
4.2. Dawkowanie i sposób podawania Tabletki dojelitowe należy przyjmować do ustnie, najlepiej co najmniej 30 minut przed posiłkiem, popijając dużą ilością wody. Tabletek dojelitowych nie należy kruszyć, łamać ani żuć, aby zapewnić uwalnianie w środowisku zasadowym jelita. Ostry zawał serca: dawka początkowa powinna być rozkruszona lub rozgryziona i połknięta. w niestabilnej chorobie wieńcowej: 100 mg ASA raz na dobę; w świeżym zawale serca lub u pacjentów z podejrzeniem świeżego zawału serca: początkowa dawka nasycająca 200 - 300 mg ASA raz na dobę (2 do 3 tabletek dojelitowych) w celu uzyskania szybkiego zahamowania agregacji płytek. Tabletki dojelitowe należy rozgryźć, aby uzyskać szybkie wchłanianie; w zapobieganiu powtórnemu zawałowi serca: 100 mg ASA raz na dobę; w zapobieganiu powikłaniom zatorowo-zakrzepowym po zabiegach chirurgicznych lub interwencyjnych na naczyniach (np.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgDawkowanie
przezskórna śródnaczyniowa angioplastyka wieńcowa (PTCA), pomostowanie aortalno-wieńcowe (CABG), endarterektomia tętnicy szyjnej, zespolenie („shunt”) tętniczo-żylne) - 100 mg ASA raz na dobę; w zapobieganiu napadom przejściowego niedokrwienia (TIA) i niedokrwiennego udaru mózgu u pacjentów z TIA - 100 mg ASA raz na dobę; w zapobieganiu pierwszemu zawałowi serca u pacjentów z wieloma czynnikami ryzyka - 100 mg ASA raz na dobę; w zapobieganiu zakrzepicy żył głębokich i zatorowi płuc u pacjentów długotrwale unieruchomionych, np. po dużych zabiegach chirurgicznych jako uzupełnienie innych metod profilaktyki – od 100 mg do 200 mg ASA raz na dobę. Produkt leczniczy Aspirin Cardio jest przeciwwskazany do stosowania u dzieci w wieku do 12 lat (patrz punkt 4.3).
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgPrzeciwwskazania
4.3. Przeciwwskazania Produktu leczniczego nie należy stosować: w przypadku nadwrażliwości na substancję czynną - ASA, inne salicylany lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, u pacjentów ze skazą krwotoczną, u pacjentów z ostrą chorobą wrzodową żołądka i (lub) dwunastnicy, u pacjentów z ciężką niewydolnością nerek, u pacjentów z ciężką niewydolnością wątroby, u pacjentów z ciężką niewydolnością serca, u pacjentów z napadami astmy oskrzelowej w wywiadzie, wywołanymi podaniem salicylanów lub substancji o podobnym działaniu, szczególnie niesteroidowych leków przeciwzapalnych (NLPZ), jednocześnie z metotreksatem w dawkach 15 mg na tydzień lub większych (patrz punkt 4.5), w ostatnim trymestrze ciąży (patrz punkt 4.6), u dzieci w wieku do 12 lat w przebiegu zakażeń wirusowych ze względu na ryzyko wystąpienia zespołu Reye’a – rzadko występującej, ale ciężkiej choroby powodującej uszkodzenie wątroby i mózgu.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Kwas acetylosalicylowy należy stosować ostrożnie: w pierwszym i drugim trymestrze ciąży, w okresie karmienia piersią, w przypadku nadwrażliwości na niesteroidowe leki przeciwzapalne i przeciwreumatyczne lub inne substancje alergizujące, podczas jednoczesnego stosowania leków przeciwzakrzepowych (patrz punkt 4.5), u pacjentów z zaburzeniami czynności nerek lub z zaburzeniami układu krążenia (np. choroba naczyniowa nerek, zastoinowa niewydolność serca, zmniejszenie objętości, duże zabiegi chirurgiczne, sepsa lub duże zdarzenia krwotoczne), gdyż ASA może zwiększyć ryzyko uszkodzenia nerek i ostrej niewydolności nerek, u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej (G6PD) ASA może wywołać hemolizę lub niedokrwistość hemolityczną. Czynniki, które mogą zwiększać ryzyko hemolizy to np. duże dawki, gorączka lub ciężkie zakażenie, w przypadku planowanego zastosowania NLPZ.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgSpecjalne środki ostrozności
Niektóre niesteroidowe leki przeciwzapalne (NLPZ), takie jak ibuprofen i naproksen, mogą zmniejszać hamujący wpływ ASA na agregację płytek krwi. Należy zalecić pacjentom zgłaszanie lekarzowi stałego przyjmowania ASA w przypadku planowanego zastosowania NLPZ (patrz punkt 4.5), u pacjentów z zaburzoną czynnością wątroby, u pacjentów z chorobą wrzodową lub krwawieniami z przewodu pokarmowego w wywiadzie. ASA może powodować skurcz oskrzeli i wywoływać napady astmy lub inne reakcje nadwrażliwości. Czynniki ryzyka obejmują: astmę oskrzelową, przewlekłe choroby układu oddechowego, katar sienny, polipy błony śluzowej nosa. Ostrzeżenie to odnosi się także do pacjentów wykazujących reakcje alergiczne (np. odczyny skórne, świąd, pokrzywka) na inne substancje. ASA, ze względu na działanie antyagregacyjne, może prowadzić do wydłużenia czasu krwawienia w czasie lub po zabiegach chirurgicznych (włącznie z niewielkimi zabiegami, np. ekstrakcją zęba).
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgSpecjalne środki ostrozności
ASA, nawet w małych dawkach, zmniejsza wydalanie kwasu moczowego. U pacjentów ze zmniejszonym wydalaniem kwasu moczowego produkt leczniczy może wywołać napad dny moczanowej. Dzieci i młodzież z objawami zakażenia wirusowego, występującej z gorączką lub bez nie powinny przyjmować ASA bez uprzedniej konsultacji z lekarzem. W przypadku zakażeń wirusowych, szczególnie takich jak: grypa typu A i B oraz ospa wietrzna, istnieje ryzyko wystąpienia zespołu Reye’a – rzadkiej, ale zagrażającej życiu choroby wymagającej natychmiastowej interwencji lekarskiej. Ryzyko może zwiększyć się, jeżeli w trakcie tych chorób, zostanie podany ASA. Uporczywe wymioty występujące w czasie trwania chorób wirusowych mogą być objawem zespołu Reye’a. Produkt leczniczy Aspirin Cardio zawiera sód. Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Leki przeciwwskazane do jednoczesnego stosowania z kwasem acetylosalicylowym: metotreksat w dawkach 15 mg na tydzień lub większych. Zwiększenie toksycznego działania metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z lekami przeciwzapalnymi - w tym z ASA - oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza - patrz punkt 4.3). Interakcje wymagające zachowania szczególnej ostrożności: metotreksat w dawkach mniejszych niż 15 mg na tydzień. Zwiększenie toksycznego działania metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z lekami przeciwzapalnymi - w tym z ASA - oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza - patrz punkt 4.4). NLPZ.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgInterakcje
Jednoczesne (tego samego dnia) stosowanie niektórych NLPZ, takich jak ibuprofen i naproksen, może zmniejszyć nieodwracalny hamujący wpływ ASA na agregację płytek krwi. Kliniczne znaczenie tych interakcji jest nieznane. Leczenie niektórymi lekami z grupy NLPZ, takimi jak naproksen i ibuprofen, pacjentów ze zwiększonym ryzykiem sercowo-naczyniowym może ograniczyć kardioprotekcyjne działanie ASA (patrz punkt 4.4). metamizol. Metamizol stosowany jednocześnie z ASA może zmniejszać wpływ ASA na agregację płytek krwi. Dlatego należy zachować ostrożność podczas stosowania metamizolu u pacjentów otrzymujących małe dawki ASA w celu ochrony mięśnia sercowego. leki przeciwzakrzepowe, np. pochodne kumaryny, heparyna. Jednoczesne stosowanie ASA z lekami przeciwzakrzepowymi może powodować nasilenie działania przeciwzakrzepowego: zwiększone ryzyko wydłużenia czasu krwawienia i krwotoków, wynikające z wypierania leków przeciwzakrzepowych z ich połączeń z białkami osocza oraz właściwości antyagregacyjnych ASA.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgInterakcje
selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI). Zwiększone ryzyko krwawienia z górnego odcinka przewodu pokarmowego z powodu działania synergicznego. inne niesteroidowe leki przeciwzapalne, w tym salicylany. Jednoczesne stosowanie niesteroidowych leków przeciwzapalnych z ASA zwiększa ryzyko wystąpienia choroby wrzodowej żołądka i (lub) dwunastnicy i krwawień z przewodu pokarmowego oraz uszkodzenia nerek, na skutek synergicznego działania tych leków. leki zwiększające wydalanie kwasu moczowego z moczem, np. benzbromaron, probenecyd. ASA stosowany jednocześnie z lekami zwiększającymi wydalanie kwasu moczowego, powoduje zmniejszenie działania leków przeciwdnawych (konkurencja w procesie wydalania kwasu moczowego przez kanaliki nerkowe). digoksyna. Jednoczesne stosowanie ASA z digoksyną powoduje zwiększenie stężenia digoksyny w osoczu, wynikające ze zmniejszonego wydalania digoksyny przez nerki. leki przeciwcukrzycowe, np.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgInterakcje
insulina, pochodne sulfonylomocznika stosowane z ASA w dużych dawkach. Ze względu na właściwości hipoglikemizujące oraz wypieranie pochodnych sulfonylomocznika z połączeń z białkami osocza, ASA w dużych dawkach zwiększa działanie leków przeciwcukrzycowych. leki trombolityczne lub inne leki hamujące agregację płytek krwi, np. tyklopidyną. Stosowane jednocześnie z ASA mogą powodować zwiększone ryzyko wydłużenia czasu krwawienia i krwotoków. leki moczopędne stosowane jednocześnie z ASA w dawkach 3 g na dobę i większych. Zmniejszenie działania moczopędnego poprzez zatrzymanie sodu i wody w organizmie na skutek zmniejszenia filtracji kłębuszkowej, spowodowanej zmniejszoną syntezą prostaglandyn w nerkach. ASA może zwiększać działanie ototoksyczne furosemidu. glikokortykosteroidy stosowane ogólnoustrojowo, z wyjątkiem hydrokortyzonu stosowanego jako terapia zastępcza w chorobie Addisona.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgInterakcje
Stosowane jednocześnie z ASA - zwiększenie ryzyka wystąpienia choroby wrzodowej żołądka i (lub) dwunastnicy, krwawienia z przewodu pokarmowego oraz zmniejszenie stężenia salicylanów w osoczu w trakcie kortykoterapii i zwiększenie ryzyka przedawkowania salicylanów po zakończeniu przyjmowania glikokortykosteroidów. inhibitory konwertazy angiotensyny (ACE) stosowane jednocześnie z ASA w dawkach 3 g na dobę i większych. Zmniejszenie działania przeciwnadciśnieniowego poprzez zmniejszenie filtracji kłębuszkowej, wynikające z hamowania produkcji prostaglandyn, działających rozszerzająco na naczynia krwionośne. kwas walproinowy. ASA zwiększa toksyczność kwasu walproinowego, poprzez wypieranie go z połączeń z białkami osocza. Kwas walproinowy zwiększa działanie przeciwagregacyjne ASA ze względu na synergiczne działanie antyagregacyjne obu leków. alkohol. Alkohol może zwiększyć ryzyko wystąpienia działań niepożądanych dotyczących przewodu pokarmowego, tj.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgInterakcje
owrzodzenia błony śluzowej lub krwawienia.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na ciążę i (lub) rozwój zarodka/płodu. Badania epidemiologiczne wskazują, iż stosowanie inhibitorów syntezy prostaglandyn we wczesnym okresie ciąży zwiększa ryzyko wystąpienia poronienia, wad rozwojowych serca oraz wytrzewień wrodzonych. Ryzyko bezwzględne było większe od 1% do około 1,5%. Uważa się, że ryzyko zwiększa się wraz z dawką i długością okresu terapii. U zwierząt po podaniu inhibitorów syntezy prostaglandyn zaobserwowano zwiększone ryzyko obumarcia zapłodnionego jaja w okresie przed i po zagnieżdżeniu w macicy oraz zwiększone ryzyko obumarcia zarodka/płodu. Dodatkowo, u zwierząt, po podaniu inhibitorów syntezy prostaglandyn w okresie organogenezy, donoszono o zwiększonej liczbie przypadków różnych wad rozwojowych, w tym wad sercowo-naczyniowych. Badania na zwierzętach wykazały toksyczny wpływ na reprodukcję (patrz punkt 5.3).
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgWpływ na płodność, ciążę i laktację
Stosowanie produktu leczniczego Aspirin Cardio u kobiet od 20. tygodnia ciąży może powodować małowodzie wynikające z zaburzeń czynności nerek płodu. Może ono nastąpić wkrótce po rozpoczęciu leczenia i zwykle ustępuje po przerwaniu leczenia. Ponadto zgłaszano przypadki zwężenia przewodu tętniczego po stosowaniu produktu leczniczego w drugim trymestrze ciąży, z których większość ustępowała po przerwaniu leczenia. Z tego powodu, nie należy stosować produktu leczniczego Aspirin Cardio u kobiet w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. W razie stosowania ASA przez kobiety planujące ciążę lub w pierwszym i drugim trymestrze ciąży, należy stosować jak najmniejszą dawkę produktu leczniczego przez możliwie najkrótszy czas. Należy rozważyć obserwację przedporodową pod kątem małowodzia i zwężenia przewodu tętniczego po kilkudniowej ekspozycji na produkt Aspirin Cardio od 20. tygodnia ciąży.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgWpływ na płodność, ciążę i laktację
W przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego stosowanie Aspirin Cardio należy przerwać. W trzecim trymestrze ciąży wszystkie inhibitory syntezy prostaglandyn mogą powodować narażenie płodu na: działania toksyczne na układ krążenia i układ oddechowy (przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne), zaburzenia czynności nerek (patrz powyżej). W końcowym okresie ciąży wszystkie inhibitory prostaglandyn mogą spowodować narażenie kobiety w ciąży i noworodka na: możliwość wydłużenia czasu krwawienia, działanie antyagregacyjne, które może ujawnić się nawet po zastosowaniu bardzo małych dawek, zahamowanie czynności skurczowej macicy prowadzącej do opóźnienia porodu lub przedłużenia akcji porodowej. W konsekwencji kwas acetylosalicylowy jest przeciwwskazany u kobiet w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3). Karmienie piersi?
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgWpływ na płodność, ciążę i laktację
Kwas acetylosalicylowy i jego metabolity przenikają w niewielkich ilościach do mleka kobiet karmiących piersią. Ponieważ jak dotąd, podczas krótkotrwałego stosowania salicylanów u kobiety karmiącej piersią, nie stwierdzono występowania działań niepożądanych u niemowląt karmionych piersią, przerywanie karmienia piersią z reguły nie jest konieczne. Jednakże w przypadku regularnego przyjmowania dużych dawek ASA, karmienie piersią powinno być wcześniej przerwane. Płodność Ograniczone, dostępne, opublikowane dane z badań przeprowadzonych na ludziach, nie wykazały spójnego wpływu stosowania ASA na zaburzenia płodności. Badania prowadzone na zwierzętach również nie wykazują jednoznacznych dowodów na to, że stosowanie ASA wpływa na płodność.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy Aspirin Cardio nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgDziałania niepożądane
4.8. Działania niepożądane Wymienione poniżej działania niepożądane przedstawione zostały w oparciu o spontaniczne raporty po wprowadzeniu produktu do obrotu dla wszystkich produktów leczniczych zawierających ASA i badania kliniczne (CTs) z ASA jako badanym lekiem. Obliczenie częstości jest oparte na danych z ramienia, w którym stosowano ASA w badaniu ARRIVE. Częstość działań niepożądanych zgłoszonych dla ASA została podsumowana w poniższej tabeli, zgodnie z częstością występowania określoną następująco: często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000). Działania niepożądane zaobserwowane jedynie po wprowadzeniu produktu do obrotu, dla których częstość występowania nie mogła być określona, zostały przedstawione w kolumnie zatytułowanej „Częstość nieznana”. Tabela 1.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgDziałania niepożądane
Działania niepożądane zgłaszane w badaniach klinicznych ARRIVE* lub w okresie nadzoru po wprowadzeniu do obrotu u pacjentów, którzy byli leczeni produktem leczniczym Aspirin Cardio Częstość Klasyfikacja układów i narządów Często Niezbyt często Rzadko Częstość nieznana Zaburzenia krwi i układu chłonnego Niedokrwistość z niedoboru żelaza Niedokrwistość pokrwotoczna Hemoliza, niedokrwistość hemolityczna Zaburzenia układu immunologicznego Nadwrażliwość, nadwrażliwość na lek, obrzęk alergiczny i obrzęk naczynioruchowy Reakcja anafilaktyczna Wstrząs anafilaktyczny Zaburzenia układu nerwowego Zawroty głowy Krwotok mózgowy i śródczaszkowy Zaburzenia ucha i błędnika Szumy uszne Zaburzenia serca Zapaść sercowo-oddechowa Zaburzenia naczyniowe Krwiak Krwotok, krwotok mięśniowy Krwotok okołozabiegowy Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Krwawienie z nosa, nieżyt nosa Przekrwienie błony śluzowej nosa Zaostrzenie choroby układu oddechowego wynikające ze stosowania kwasu acetylosalicylowego Zaburzenia żołądka i jelit Niestrawność (zgaga, nudności, wymioty), bóle żołądkowo-jelitowe i bóle brzucha, zapalenie przewodu pokarmowego, krwotok z przewodu pokarmowego Krwawienie z dziąseł, nadżerki i choroba wrzodowa układu pokarmowego Perforacja owrzodzenia układu pokarmowego Enteropatia zwężeniowa jelit Zaburzenia wątroby i dróg żółciowych Zaburzenia czynności wątroby Zwiększenie aktywności aminotransferaz Zaburzenia skóry i tkanki podskórnej Wysypka, świąd Pokrzywka Zaburzenia nerek i dróg moczowych Krwawienie z dróg moczowo-płciowych Zaburzenia czynności nerek, ostra niewydolność nerek Urazy, zatrucia oraz powikłania po zabiegach Patrz punkt 4.9 Przedawkowanie *ARRIVE jest sponsorowanym przez firmę Bayer badaniem klinicznym, w którym wzięło udział 6270 uczestników w ramieniu z zastosowaniem ASA w dawce 100 mg i 6276 uczestników w ramieniu z zastosowaniem placebo.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgDziałania niepożądane
Mediana czasu trwania ekspozycji na ASA wynosiła 5,0 lat, z zakresem od 0 do 7 lat.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgPrzedawkowanie
4.9. Przedawkowanie Zatrucie salicylanami (może wystąpić w przypadku przyjmowania dawki > 100 mg/kg mc./dobę przez więcej niż 2 dni) może być spowodowane długotrwałym przyjmowaniem dawek terapeutycznych lub zatruciem ostrym (w wyniku przedawkowania) potencjalnie zagrażającym życiu, np. po przypadkowym przyjęciu produktu leczniczego przez dzieci. Objawy zatrucia w wyniku długotrwałego przyjmowania produktu leczniczego są niespecyficzne, przez co łatwe do zbagatelizowania. Lekkie zatrucie lub salicylizm, występuje zwykle po wielokrotnym przyjęciu zbyt dużych dawek. Objawy zatrucia obejmują: zawroty głowy (w tym pochodzenia błędnikowego), szumy uszne, głuchotę, nadmierne pocenie się, nudności i wymioty, ból głowy, dezorientację i mogą przeminąć po zmniejszeniu dawki przyjmowanego produktu leczniczego. Szumy uszne mogą pojawić się po wystąpieniu stężenia produktu leczniczego we krwi od 150 do 300 mikrogramów/ml.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgPrzedawkowanie
Ciężkie działania niepożądane występują, gdy stężenie ASA we krwi jest powyżej 300 mikrogramów/ml. Ciężkie zatrucie charakteryzuje się ciężkimi zaburzeniami równowagi kwasowej, a objawy różnią się w zależności od wieku i ciężkości zatrucia. U dzieci objawia się najczęściej kwasicą metaboliczną. Stężenie ASA we krwi nie pozwala oszacować stopnia zatrucia. Wchłanianie ASA może być zmniejszone w wyniku opóźnionego opróżniania żołądka, tworzenia się złogów w żołądku lub w wyniku przyjęcia produktu leczniczego w postaci tabletek dojelitowych. Leczenie ciężkiego zatrucia jest uzależnione od przyjętej dawki, stadium i objawów klinicznych. Należy zastosować standardowe techniki postępowania w przypadku zatrucia. Podstawowe działania, które należy podjąć to zwiększenie wydalania substancji czynnej oraz przywrócenie równowagi elektrolitowej i równowagi kwasowo-zasadowej.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgPrzedawkowanie
Ze względu na złożoną patofizjologię skutków zatrucia salicylanami, objawy oraz wyniki badań mogą obejmować: Objawy Wyniki badań Postępowanie Zatrucie lekkie do umiarkowanego Przyspieszony oddech, hiperwentylacja, alkaloza oddechowa Płukanie żołądka, wielokrotne podanie węgla aktywnego, forsowana diureza alkaliczna Zatrucie umiarkowane do ciężkiego Alkaloza oddechowa z wyrównawczą kwasicą metaboliczną Płukanie żołądka, wielokrotne podanie węgla aktywnego, forsowana diureza alkaliczna, hemodializa w ciężkich przypadkach Obfite pocenie się, nudności, wymioty Zaburzenia układu oddechowego: od hiperwentylacji, obrzęku płuc niesercowego pochodzenia do zatrzymania oddechu i asfiksji Zaburzenia serca i naczyń krwionośnych od arytmii, niskiego ciśnienia krwi do zatrzymania pracy serca Postępowanie po przedawkowaniu Pacjenta należy natychmiast przewieźć do szpitala. Postępowanie zależy od wielkości przyjętej dawki, stadium i objawów klinicznych.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgPrzedawkowanie
Należy zastosować środki, mające na celu zmniejszenie wchłaniania substancji czynnej: płukanie żołądka, podanie węgla aktywnego oraz kontrolować równowagę kwasowo-zasadową (niezbędna jest kontrola następujących parametrów krwi: pH, pCO2, stężenia wodorowęglanów, stężenia potasu). Jeśli zachowana jest prawidłowa czynność nerek, można zastosować diurezę alkaliczną aż do uzyskania pH moczu w zakresie 7,5–8; w przypadku stężenia salicylanów w osoczu powyżej 500 mg/l (3,6 mmol/l) u dorosłych lub 300 mg/l (2,2 mmol/l) u dzieci należy rozważyć możliwość zastosowania forsowanej diurezy alkalicznej. Należy stosować wlewy dożylne zawierające NaHCO3, KCl oraz leki moczopędne. W przypadkach ciężkiego zatrucia można zastosować hemodializę lub dializę otrzewnową.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inhibitory agregacji płytek krwi; kod ATC: B01AC06. Kwas acetylosalicylowy należy do grupy kwasowych niesteroidowych leków przeciwzapalnych o właściwościach przeciwbólowych, przeciwgorączkowych, przeciwzapalnych i przeciwpłytkowych. Jego mechanizm działania polega na nieodwracalnym hamowaniu cyklooksygenazy kwasu arachidonowego, a tym samym hamowaniu syntezy prostanoidów: prostaglandyny E2 (PGE2), prostaglandyny I2 (PGI2) oraz tromboksanu A2. Kwas acetylosalicylowy hamuje agregację płytek krwi przez blokowanie syntezy tromboksanu A2 w płytkach. Ten mechanizm jest wynikiem nieodwracalnego hamowania enzymu - cyklooksygenazy (COX-1), a co za tym idzie - syntezy prostanoidów oraz tromboksanu A2. Działanie to utrzymuje się do czasu pojawienia się nowej generacji płytek, ponieważ płytki krwi nie są w stanie zresyntezować tego enzymu. Przypuszcza się, że ASA wywiera także inne działania hamujące na płytki krwi.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Po podaniu doustnym, kwas acetylosalicylowy wchłania się szybko i całkowicie z przewodu pokarmowego. Jest przekształcany do jego głównego metabolitu – kwasu salicylowego – w czasie i po wchłonięciu. Ze względu na odporną na kwas solny w żołądku otoczkę tabletek dojelitowych produktu leczniczego Aspirin Cardio, kwas acetylosalicylowy nie uwalnia się w żołądku, lecz w zasadowym środowisku jelita. Dlatego Cmax ASA jest osiągane po 2-7 godzinach po podaniu tabletek dojelitowych. Jednoczesne przyjęcie pokarmu prowadzi do opóźnionego, jednak całkowitego wchłaniania ASA, co wskazuje na wpływ pokarmu jedynie na zmianę szybkości wchłaniania, ale nie na stopień wchłaniania. Ze względu na bezpośredni związek pomiędzy całkowitą ekspozycją ASA w osoczu a jego działaniem hamującym agregację płytek krwi, nie uważa się opóźnienia wchłaniania tabletek dojelitowych produktu leczniczego Aspirin Cardio za istotne dla osiągnięcia odpowiedniego efektu zahamowania agregacji płytek krwi w przypadku przewlekłego leczenia małymi dawkami produktu leczniczego Aspirin Cardio.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgWłaściwości farmakokinetyczne
Tym niemniej, w celu optymalnego wykorzystania właściwości składu tabletek dojelitowych produktu leczniczego Aspirin Cardio, odpornych na działanie kwasu żołądkowego, tabletki dojelitowe powinny być przyjmowane najlepiej przed posiłkami (30 minut lub więcej) i popijane dużą ilością wody (patrz punkt 4.2). Zarówno ASA jak i kwas salicylowy wiążą się silnie z białkami osocza i ulegają szybkiej dystrybucji w całym organizmie. Kwas salicylowy przenika przez łożysko i do mleka kobiet karmiących piersią (patrz punkt 4.6). Główna substancja czynna – ASA - jest przekształcany do jego głównego metabolitu – kwasu salicylowego. Grupa acetylowa ASA jest uwalniana na drodze hydrolizy, nawet podczas przechodzenia przez błonę śluzową jelita, ale powyższy proces zachodzi głównie w wątrobie. Główny metabolit - kwas salicylowy – jest metabolizowany głównie w wątrobie.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgWłaściwości farmakokinetyczne
Jego metabolity to: kwas salicylurowy, fenylosalicylan glukuronidu i acetylosalicylan glukuronidu oraz kwas gentyzynowy w postaci wolnej i sprzężonej z glicyną. Kinetyka eliminacji kwasu salicylowego zależy w dużym stopniu od dawki, ponieważ metabolizm kwasu salicylowego jest ograniczony przez aktywność enzymów wątrobowych. Okres półtrwania wynosi od 2 do 3 godzin po zastosowaniu małych dawek (do 325 mg/dobę) do około 15 godzin po dużych dawkach terapeutycznych (powyżej 3 g/dobę) lub w przypadku zatrucia. Kwas salicylowy i jego metabolity są wydalane głównie przez nerki. Dostępne dane farmakokinetyczne dla ASA nie wskazują na istnienie klinicznie istotnego odchylenia od dawko-zależności w zakresie dawek 100-500 mg.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Profil bezpieczeństwa kwasu acetylosalicylowego jest dobrze udokumentowany w licznych badaniach przedklinicznych. W badaniach na zwierzętach salicylany powodowały uszkodzenie nerek, lecz nie wywoływały innych zmian chorobowych. Dane niekliniczne uzyskane na podstawie badań in vitro i in vivo, dotyczące działania mutagennego i rakotwórczego nie ujawniają występowania działania mutagennego i rakotwórczego ASA. Badania na zwierzętach i innych gatunkach wykazały objawy teratogenne salicylanów. Opisywane były objawy embriotoksyczne, fetotoksyczne i zaburzenia związane z możliwościami przyswajania wiedzy u potomstwa.
- CHPL leku Aspirin Cardio, tabletki dojelitowe, 100 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Celuloza sproszkowana Skrobia kukurydziana Skład otoczki: Kopolimer kwasu metakrylowego i akrylan metylu Polisorbat 80 Sodu laurylosiarczan Talk Cytrynian trietylu 6.2. Niezgodności farmaceutyczne Nie dotyczy. 6.3. Okres ważności 5 lat 6.4. Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25 °C. 6.5. Rodzaj i zawartość opakowania Blistry z folii PP/Al/papier laminowany lub blistry z folii PVC/PVDC/Al lub blistry z folii PP/Al w tekturowym pudełku. Opakowanie zawiera 28, 56, 98 tabletek dojelitowych w blistrach po 14 tabletek lub 30, 50, 60, 90 tabletek dojelitowych w blistrach po 10 tabletek. 6.6. Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Ultrapiryna, 325 mg, tabletki dojelitowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 325 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka dojelitowa Tabletki okrągłe, gładkie, obustronnie wypukłe, powleczone białą powłoką bez plam i uszkodzeń.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgWskazania do stosowania
4.1 Wskazania do stosowania Wskazaniami do stosowania produktu leczniczego Ultrapiryna są: przeziębienie, grypa, stany gorączkowe; leczenie przewlekłe bólu i stanów zapalnych na przykład w reumatoidalnym zapaleniu stawów, młodzieńczym zapaleniu stawów, toczniu rumieniowatym układowym, chorobie zwyrodnieniowej stawów, zespole Reitera i w zmianach okołostawowych; łagodne i słabo nasilone bóle zębów, głowy, bóle menstruacyjne.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgDawkowanie
4.2 Dawkowanie i sposób podawania Przeciwbólowo i przeciwgorączkowo – 1 tabletka co 4 godziny lub 1 do 2 tabletek co 6 godzin. Tabletki należy przyjmować doustnie, najlepiej po posiłkach popijając dużą ilością płynu. U dorosłych nie należy przekraczać dawki maksymalnej 4 g kwasu acetylosalicylowego na dobę. U młodzieży w wieku powyżej 16 lat nie należy stosować więcej niż 1500 mg kwasu acetylosalicylowego na dobę. Nie stosować u dzieci i młodzieży poniżej 16 lat (patrz punkt 4.3). Produktu leczniczego nie należy stosować dłużej niż 3-5 dni bez konsultacji z lekarzem.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgPrzeciwwskazania
4.3 Przeciwwskazania nadwrażliwość na substancję czynną, inne salicylany lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; skazy krwotoczne; czynna choroba wrzodowa żołądka i (lub) dwunastnicy; ciężka niewydolność wątroby lub nerek; trzeci trymestr ciąży; nie stosować u pacjentów z napadami astmy oskrzelowej w wywiadzie, wywołanymi podaniem salicylanów lub substancji o podobnym działaniu, szczególnie niesteroidowych leków przeciwzapalnych; nie stosować u dzieci i młodzieży w wieku poniżej 16 lat, chyba że lekarz zaleci inaczej, ze względu na zagrożenie wystąpieniem zespołu Reye’a, rzadkiej, ale ciężkiej choroby powodującej uszkodzenie wątroby i mózgu; nie stosować jednocześnie z metotreksatem w dawkach 15 mg na tydzień lub większych.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt leczniczy może być stosowany tylko po starannym rozważeniu spodziewanych korzyści z leczenia w stosunku do ryzyka, w następujących przypadkach: pierwszy i drugi trymestr ciąży; karmienie piersią; nadwrażliwość na niesteroidowe leki przeciwzapalne (NLPZ) i przeciwreumatyczne lub inne substancje alergizujące; podczas jednoczesnego leczenia środkami przeciwzakrzepowymi, np. pochodne kumaryny lub heparyna; podczas jednoczesnego stosowania ibuprofenu; u pacjentów z zaburzoną czynnością nerek lub wątroby; u pacjentów z przebytą chorobą wrzodową żołądka i (lub) dwunastnicy lub krwawieniami z przewodu pokarmowego w wywiadzie; u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej; w przypadku, kiedy osoba stosująca produkt Ultrapiryna pozostaje na diecie bezsolnej.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgSpecjalne środki ostrozności
W przebiegu niektórych chorób wirusowych, szczególnie w przypadku zakażenia wirusem grypy typu A, wirusem grypy typu B lub ospy wietrznej, głównie u dzieci i młodzieży, istnieje ryzyko wystąpienia zespołu Reye’a – rzadkiej, ale zagrażającej życiu choroby. Występowanie uporczywych wymiotów w przebiegu infekcji może wskazywać na wystąpienie zespołu Reye’a, co wymaga natychmiastowej pomocy medycznej. Ryzyko wystąpienia zespołu Reye’a w przebiegu infekcji wirusowych może wzrosnąć, jeśli jednocześnie podaje się kwas acetylosalicylowy, chociaż związek przyczynowy nie został udowodniony. Z ww. względów u dzieci i młodzieży poniżej 16 lat produktów zawierających kwas acetylosalicylowy nie należy stosować (patrz punkt 4.3). Zachować ostrożność podczas stosowania u pacjentów z astmą oskrzelową, przewlekłymi schorzeniami układu oddechowego, katarem siennym lub obrzękiem błony śluzowej nosa lub polipami nosa, gdyż częściej niż inni pacjenci mogą reagować na NLPZ, w tym na kwas acetylosalicylowy napadami astmy, obrzękiem naczynioruchowym lub pokrzywką.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgSpecjalne środki ostrozności
Nie stosować co najmniej 5 dni przed planowanym zabiegiem chirurgicznym ze względu na możliwość nasilenia krwawień przez kwas acetylosalicylowy. Produkt powinien być stosowany ostrożnie u pacjentów ze zwiększoną tendencją do krwawień (hemofilia, niedobór witaminy K), u pacjentów z chorobą wrzodową żołądka i (lub) dwunastnicy w wywiadzie (zagrożenie krwawieniem z przewodu pokarmowego), w niedoborze dehydrogenazy glukozo-6-fosforanu (G-6-PD) z uwagi na ryzyko hemolizy. Nie należy stosować produktów zawierających kwas acetylosalicylowy u kobiet w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne (patrz punkt 4.6). Kwas acetylosalicylowy może powodować zwiększenie aktywności enzymów wątrobowych, mocznika i kreatyniny we krwi, hiperkaliemię, białkomocz oraz przedłużać czas krzepnięcia. Szczególną ostrożność należy zachować podczas jednoczesnego leczenia środkami przeciwzakrzepowymi (np. pochodne kumaryny, heparyna).
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgSpecjalne środki ostrozności
Kwas acetylosalicylowy nawet w małych dawkach zmniejsza wydalanie kwasu moczowego. U pacjentów ze zmniejszonym wydalaniem kwasu moczowego produkt leczniczy może wywołać napad dny moczanowej. Długotrwałe przyjmowanie produktów zawierających kwas acetylosalicylowy może być przyczyną bólu głowy i niewydolności nerek (szczegółowe informacje w punkcie 4.8). Kwas acetylosalicylowy może zaburzać płodność u kobiet (patrz punkt 4.6). Lek zawiera mniej niż 1 mmol (23 mg) sodu w 1 tabletce to znaczy lek uznaje się za „wolny od sodu”.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Leki przeciwwskazane do jednoczesnego stosowania z kwasem acetylosalicylowym: Metotreksat w dawkach 15 mg na tydzień lub większych. Nasilenie toksycznego wpływu metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z lekami przeciwzapalnymi – w tym z kwasem acetylosalicylowym – oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza – patrz punkt 4.3). Interakcje wymagające zachowania szczególnej ostrożności: Metotreksat w dawkach mniejszych niż 15 mg na tydzień. Nasilenie toksycznego wpływu metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z lekami przeciwzapalnymi – w tym z kwasem acetylosalicylowym – oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza). Ibuprofen.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgInterakcje
Jednoczesne stosowanie ibuprofenu antagonizuje nieodwracalne hamowanie agregacji płytek krwi przez kwas acetylosalicylowy. U pacjentów ze zwiększonym ryzykiem incydentów sercowo-naczyniowych leczenie ibuprofenem może zmniejszać działanie kardioprotekcyjne kwasu acetylosalicylowego (patrz punkt 4.4). Metamizol stosowany jednocześnie z kwasem acetylosalicylowym może zmniejszać wpływ kwasu acetylosalicylowego na agregację płytek krwi. Dlatego należy zachować ostrożność podczas stosowania metamizolu u pacjentów otrzymujących małe dawki kwasu acetylosalicylowego w celu ochrony mięśnia sercowego. Leki przeciwzakrzepowe np. pochodne kumaryny, heparyna. Jednoczesne stosowanie kwasu acetylosalicylowego z lekami przeciwzakrzepowymi może powodować nasilenie działania przeciwzakrzepowego, zwiększone ryzyko wydłużenia czasu krwawienia i krwotoków, wynikające z wypierania leków przeciwzakrzepowych z ich połączeń z białkami osocza oraz właściwości antyagregacyjne kwasu acetylosalicylowego.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgInterakcje
Inne niesteroidowe leki przeciwzapalne, w tym salicylany w dużych dawkach (3 g na dobę i większych). Jednoczesne stosowanie niesteroidowych leków przeciwzapalnych z kwasem acetylosalicylowym zwiększa ryzyko wystąpienia choroby wrzodowej i krwawień z przewodu pokarmowego oraz uszkodzenia nerek na skutek synergistycznego działania tych leków. Leki zwiększające wydalanie kwasu moczowego w moczu, np. benzbromaron, probenecyd. Kwas acetylosalicylowy z lekami zwiększającymi wydalanie kwasu moczowego powoduje osłabienie działania leków przeciwdnawych (konkurencja w procesie wydalania kwasu moczowego przez kanaliki nerkowe). Digoksyna. Jednoczesne stosowanie kwasu acetylosalicylowego z digoksyną powoduje zwiększenie stężenia digoksyny w osoczu, wynikające ze zmniejszonego wydalania digoksyny przez nerki. Leki przeciwcukrzycowe, np. pochodne sulfonylomocznika, insulina.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgInterakcje
Ze względu na właściwości hipoglikemizujące oraz wypieranie pochodnych sulfonylomocznika z połączeń z białkami osocza, w dużych dawkach salicylany nasilają działanie insuliny i doustnych leków przeciwcukrzycowych. Leki trombolityczne lub inne leki hamujące agregację płytek krwi np. tyklopidyna, stosowane jednocześnie z kwasem acetylosalicylowym mogą powodować zwiększone ryzyko wydłużenia czasu krwawień i krwotoków. Leki moczopędne stosowane jednocześnie z kwasem acetylosalicylowym w dawkach 3 g na dobę i większych – osłabienie działania moczopędnego poprzez zatrzymanie sodu i wody w organizmie na skutek zmniejszonej filtracji kłębuszkowej, spowodowanej zmniejszoną syntezą prostaglandyn w nerkach. Kwas acetylosalicylowy może nasilać działanie ototoksyczne furosemidu. Glikokortykosteroidy działające ogólnoustrojowo, z wyjątkiem hydrokortyzonu stosowane jako terapia zastępcza w chorobie Addisona, stosowane jednocześnie z kwasem acetylosalicylowym – powodują zwiększone ryzyko wystąpienia choroby wrzodowej i krwawienia z przewodu pokarmowego oraz zmniejszenie stężenia salicylanów w osoczu w trakcie kortykoterapii i zwiększone ryzyko przedawkowania salicylanów po zakończeniu stosowania glikokortykosteroidów.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgInterakcje
Inhibitory konwertazy angiotensyny (ACE) stosowane jednocześnie z kwasem acetylosalicylowym w dawkach 3 g na dobę i większych – zmniejszenie działania przeciwnadciśnieniowego poprzez zmniejszenie filtracji kłębuszkowej, wynikające z hamowania produkcji prostaglandyn działających rozszerzająco na naczynia krwionośne. Kwas walproinowy. Kwas acetylosalicylowy zwiększa stężenie w osoczu kwasu walproinowego i wywołuje jego działanie toksyczne poprzez wypieranie go z połączeń z białkami osocza. Kwas walproinowy nasila działanie antyagregacyjne kwasu acetylosalicylowego ze względu na synergistyczne działanie antyagregacyjne obu leków. Alkohol. Jednoczesne stosowanie z alkoholem, może nasilać działania niepożądane, w tym ryzyko owrzodzenia błony śluzowej oraz krwawień z przewodu pokarmowego i poza przewodem pokarmowym. Środki alkalizujące mocz i zobojętniające kwas żołądkowy zwiększają wydzielanie salicylanów z moczem. Kwas acetylosalicylowy osłabia działanie spironolaktonu.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na ciążę i (lub) rozwój zarodka lub płodu. Wyniki badań epidemiologicznych wskazują na to, że stosowanie inhibitorów syntezy prostaglandyn we wczesnym okresie ciąży zwiększa ryzyko poronienia, występowania wad wrodzonych serca i wytrzewień wrodzonych. Całkowite ryzyko wystąpienia wrodzonych wad sercowo-naczyniowych zwiększa się z mniej niż 1% do około 1,5%. Uważa się, że ryzyko zwiększa się wraz z dawką i długością okresu terapii. U zwierząt po podaniu inhibitorów syntezy prostaglandyn zaobserwowano zwiększone ryzyko obumarcia zapłodnionego jaja w okresie przed i po zagnieżdżeniu się w macicy oraz zwiększone ryzyko obumarcia zarodka lub płodu. Dodatkowo, u zwierząt, po podaniu inhibitorów syntezy prostaglandyn w okresie organogenezy, donoszono o zwiększonej liczbie przypadków różnych wad rozwojowych, w tym wad sercowo-naczyniowych.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgWpływ na płodność, ciążę i laktację
Nie należy stosować produktów zawierających kwas acetylosalicylowy u kobiet w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. W razie stosowania kwasu acetylosalicylowego przez kobiety usiłujące zajść w ciążę lub w pierwszym i drugim trymestrze ciąży, należy stosować jak najmniejszą dawkę leku przez jak najkrótszy czas. W trzecim trymestrze ciąży wszystkie inhibitory syntezy prostaglandyn mogą powodować narażenie płodu na: działania toksyczne na układ krążenia i oddechowy (włącznie z przedwczesnym zamknięciem przewodu tętniczego i nadciśnieniem płucnym), zaburzenia czynności nerek mogące prowadzić do niewydolności nerek i małowodzia. W końcowym okresie ciąży wszystkie inhibitory prostaglandyn mogą spowodować narażenie matki i noworodka na: możliwość wydłużenia czasu krwawienia oraz działanie antyagregacyjne, które może ujawnić się nawet po zastosowaniu małych dawek, zahamowanie czynności skurczowej macicy prowadzącej do opóźnienia porodu lub przedłużenia akcji porodowej.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgWpływ na płodność, ciążę i laktację
W konsekwencji kwas acetylosalicylowy jest przeciwwskazany w trzecim trymestrze ciąży. Karmienie piersi? Kwas acetylosalicylowy przenika do mleka kobiet karmiących piersią; stężenie w mleku sięga od 9% do 21% stężenia w surowicy matki. Kwas acetylosalicylowy zażywany przez kobietę karmiąca piersią był przyczyną reakcji alergicznych u niemowląt karmionych piersią. Kobiety karmiące piersią nie powinny przyjmować kwasu acetylosalicylowego regularnie, szczególnie w dużych dawkach (>300 mg na dobę). Płodność Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn), w tym kwas acetylosalicylowy w dawce ≥500 mg/ dobę, mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Lek nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgDziałania niepożądane
4.8 Działania niepożądane Częstość występowania działań niepożądanych uporządkowano w następujący sposób: często (≥1/100 do <1/10), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego Rzadko lub bardzo rzadko raportowano poważne krwawienia takie jak: krwotok z przewodu pokarmowego, krwotok mózgowy (szczególnie u pacjentów z niekontrolowanym nadciśnieniem tętniczym i (lub) współistnieniu przypadku równoczesnego podawania leków hemostatycznych), które w pojedynczych przypadkach mogą potencjalnie zagrażać życiu. Krwotok może prowadzić do ostrej lub przewlekłej niedokrwistości w wyniku krwotoku i (lub) niedokrwistości z niedoboru żelaza (na przykład w wyniku utajonych mikrokrwawień) z odpowiednimi objawami laboratoryjnymi i klinicznymi takimi jak osłabienie, bladość, hypoperfuzja. Częstość nieznana: zwiększone ryzyko krwawień, wydłużenie czasu krwawienia.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgDziałania niepożądane
Obserwowano krwawienia takie jak: krwotok okołooperacyjny, krwiaki, krwawienie z nosa, krwawienie z dróg moczowo-płciowych, krwawienie dziąseł. Zaburzenia układu immunologicznego Bardzo rzadko: ciężkie reakcje alergiczne włączając wstrząs anafilaktyczny. Częstość nieznana: reakcje nadwrażliwości z odpowiednimi objawami laboratoryjnymi i klinicznymi w tym: astma, odczyny skórne, wysypka, pokrzywka, obrzęk, świąd, zaburzenia serca i układu oddechowego. Zaburzenia metabolizmu i odżywiania Bardzo rzadko: hipoglikemia. Zaburzenia układu nerwowego Częstość nieznana: zawroty głowy i szumy uszne, będące zazwyczaj objawami przedawkowania. Zaburzenia żołądka i jelit Często: objawy niestrawności, (zgaga, nudności, wymioty) i bóle brzucha. Rzadko: stany zapalne żołądka i jelit, choroba wrzodowa żołądka i (lub) dwunastnicy bardzo rzadko prowadzące do krwotoków i perforacji charakteryzujące się odpowiednimi objawami klinicznymi i wynikami badań laboratoryjnych.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgDziałania niepożądane
Zaburzenia wątroby i dróg żółciowych Rzadko: przemijające zaburzenia czynności wątroby ze zwiększeniem aktywności aminotransferaz. Zaburzenia nerek i dróg moczowych Bardzo rzadko: zaburzenia czynności nerek. Długotrwałe przyjmowanie produktów zawierających kwas acetylosalicylowy może być przyczyną bólu głowy, który nasila się podczas przyjmowania kolejnych dawek. Długotrwałe przyjmowanie produktów przeciwbólowych, szczególnie zawierających kilka substancji czynnych może prowadzić do ciężkiego zaburzenia czynności nerek i niewydolności nerek. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgPrzedawkowanie
4.9 Przedawkowanie Zatrucie salicylanami może wystąpić w przypadku przyjmowania dawki powyżej 100 mg/kg mc./dobę przez więcej niż 2 dni. Może być również spowodowane długotrwałym przyjmowaniem dawek terapeutycznych lub zatruciem ostrym potencjalnie zagrażającym życiu, np. po przypadkowym przyjęciu leku przez dzieci. Objawy zatrucia w wyniku długotrwałego przyjmowania produktu są niespecyficzne, przez co łatwe do zbagatelizowania. Lekkie zatrucie lub salicylizm występuje zwykle po wielokrotnym przyjęciu zbyt dużych dawek. Objawy zatrucia obejmują: zawroty głowy, w tym pochodzenia błędnikowego, szumy uszne, głuchotę, nadmierne pocenie się, nudności i wymioty, ból głowy, splątanie i mogą ustąpić po zmniejszeniu dawki przyjmowanego leku. Szumy uszne mogą wystąpić przy stężeniu leku we krwi od 150 do 300 mikrogramów/ml. Poważniejsze działania niepożądane występują przy stężeniu kwasu acetylosalicylowego we krwi powyżej 300 mikrogramów/ml.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgPrzedawkowanie
Ciężkie zatrucie charakteryzuje się poważnymi zaburzeniami równowagi kwasowej, a objawy różnią się w zależności od wieku i ciężkości zatrucia. U dzieci objawia się najczęściej kwasicą metaboliczną. Stężenie kwasu acetylosalicylowego we krwi nie pozwala oszacować stopnia zatrucia. Wchłanianie kwasu acetylosalicylowego może być zmniejszone w wyniku opóźnionego opróżniania żołądka, tworzenia się złogów w żołądku lub w wyniku przyjęcia leku w postaci tabletek powlekanych. Leczenie ciężkiego zatrucia zależy od przyjętej dawki, stadium i objawów klinicznych. Należy zastosować standardowe techniki postępowania w przypadku zatrucia. Podstawowe działania, które należy podjąć to zwiększenie wydalania substancji czynnej oraz przywrócenie równowagi elektrolitycznej i równowagi kwasowo-zasadowej. Ze względu na złożoną patofizjologię skutków zatrucia salicylanami, objawy oraz wyniki badań mogą obejmować: OBJAWY WYNIKI BADAŃ POSTĘPOWANIE zatrucie lekkie do umiarkowanego płukanie żołądka, wielokrotne podanie węgla aktywowanego, forsowana diureza alkaliczna przyśpieszony oddech, hiperwentylacja, alkaloza oddechowa alkalemia, alkaluria podawanie płynów i kontrola stężenia elektrolitów obfite pocenie się zatrucie umiarkowane do ciężkiego płukanie żołądka, wielokrotne podanie węgla aktywowanego, forsowana diureza alkaliczna, w ciężkich przypadkach - hemodializa alkaloza oddechowa z wyrównawczą kwasicą metaboliczn?
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgPrzedawkowanie
kwasica, aciduria podawanie płynów i kontrola stężenia elektrolitów wysoka gorączka zaburzenia układu oddechowego: od hiperwentylacji, obrzęku płuc niesercowego pochodzenia do zatrzymania oddechu i asfiksji zaburzenia serca i naczyń krwionośnych od arytmii, niskiego ciśnienia do zatrzymania pracy serca ciśnienie krwi, zmiany w zapisie EKG utrata płynów i elektrolitów: od nawodnienia, oligurii aż do niewydolności nerek hipokaliemia, hipernatremia, hiponatremia, zaburzona czynność nerek podawanie płynów i kontrola stężenia elektrolitów zaburzenia metabolizmu glukozy, ketoza hiperglikemia, hipoglikemia (szczególnie u dzieci), zwiększone stężenie ketonów szumy uszne, głuchota zaburzenia układu pokarmowego: krwawienia z układu pokarmowego zaburzenia krwi: od zahamowania agregacji płytek krwi do koagulacji np.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgPrzedawkowanie
wydłużenie czasu protrombinowego, hipoprotrombinemia zaburzenia neurologiczne: toksyczna encefalopatia i hamowanie czynności OUN objawiające się letargiem, dezorientacją aż do śpiączki i napadu drgawkowego
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inne leki przeciwbólowe i przeciwgorączkowe, kwas salicylowy i jego pochodne, kwas acetylosalicylowy, kod ATC: N02BA01. Kwas acetylosalicylowy należy do grupy salicylanów. Działa przeciwbólowo, przeciwgorączkowo i przeciwzapalnie. Kwas acetylosalicylowy w małych dawkach hamuje agregację płytek krwi. Mechanizm działania polega na nieodwracalnym hamowaniu cyklooksygenazy płytek i przerwaniu produkcji tromboksanu A2. Większe dawki kwasu acetylosalicylowego, 2-3 g/dobę, działają przeciwbólowo, przeciwgorączkowo, a dawki rzędu 4-6 g/dobę - przeciwzapalnie poprzez mechanizm hamowania cyklooksygenaz tkankowych i zmniejszenie produkcji prostaglandyn.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Kwas acetylosalicylowy wchłania się z przewodu pokarmowego prawie całkowicie, lecz wchłanianie może różnić się w zależności od postaci farmaceutycznej oraz innych czynników takich, jak szybkość uwalniania substancji czynnej z tabletek i wartość pH w przewodzie pokarmowym. Ogólnie uważa się, że wchłanianie z postaci tabletek powlekanych dojelitowych jest opóźnione. Po wchłonięciu w dużym stopniu wiąże się z albuminami, białkami osocza. Przenika przez łożysko i do mleka matek karmiących. Ulega hydrolizie do salicylanu w przewodzie pokarmowym, wątrobie i krwi, a następnie metabolizowany jest w wątrobie do nieaktywnych pochodnych. Wydalany jest przez nerki w postaci kwasu salicylowego i sprzężonych metabolitów. Szybkość wydalania przez nerki zwiększa się wraz z alkalizacją moczu, osiągając najwyższe wartości przy pH ponad 7,5.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Profil bezpieczeństwa kwasu acetylosalicylowego jest dobrze udokumentowany w licznych badaniach nieklinicznych. Kwas acetylosalicylowy działa teratogennie u niektórych gatunków zwierząt. Opisano zaburzenia zagnieżdżania się jaja, działanie embriotoksyczne i fetotoksyczne oraz trudności uczenia się u potomstwa, jeśli lek był stosowany przed urodzeniem. Nie stwierdzono mutagennego i rakotwórczego działania kwasu acetylosalicylowego.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki: Skrobia preżelowana Celuloza mikrokrystaliczna Talk Karboksymetyloskrobia sodowa (typ A) Otoczka tabletki: Otoczka Opadry YS-1-7027: Hypromeloza Tytanu dwutlenek (E171) Triacetyna Otoczka ACRYL -EZE 93A18597: Kopolimer kwasu metakrylowego i akrylanu etylu Talk Tytanu dwutlenek (E171) Krzemionka koloidalna bezwodna Sodu wodorowęglan Sodu laurylosiarczan Trietylu cytrynian 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Pojemnik do tabletek polietylenowy z polietylenowym wieczkiem zawierającym środek pochłaniający wilgoć, w tekturowym pudełku. Pojemnik zawiera 30 lub 100 tabletek dojelitowych. Blister PVC/PVDC/Aluminium, w tekturowym pudełku. W jednym blistrze znajduje się 4 lub 6 tabletek.
- CHPL leku Ultrapiryna, tabletki dojelitowe, 325 mgDane farmaceutyczne
Opakowanie zawiera 4, 6, 12 lub 18 tabletek dojelitowych. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ETOPIRYNA, 300 mg + 100 mg + 50 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 300 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum), 100 mg etenzamidu (Ethenzamidum), 50 mg kofeiny (Coffeinum). Substancja pomocnicza o znanym działaniu: laktoza jednowodna. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki Białe, podłużne, obustronnie wypukłe tabletki
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgWskazania do stosowania
4.1 Wskazania do stosowania Bóle głowy oraz inne bóle o umiarkowanym nasileniu, zwłaszcza pochodzenia zapalnego.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgDawkowanie
4.2 Dawkowanie i sposób podawania Tabletki należy przyjmować po posiłku, popijając dużą ilością wody. Dorośli i młodzież powyżej 16 lat: 1 do 2 tabletek jednorazowo lub w razie potrzeby tę samą dawkę co 8 godzin. Nie stosować więcej niż 6 tabletek na dobę. Nie stosować dłużej niż kilka dni.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgPrzeciwwskazania
4.3 Przeciwwskazania Produktu leczniczego nie należy stosować w następujących przypadkach: nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nadwrażliwość na kwas acetylosalicylowy występuje u 0,3% populacji, w tym u 20% chorych na astmę oskrzelową lub przewlekłą pokrzywkę. Objawy nadwrażliwości: pokrzywka, a nawet wstrząs, mogą wystąpić w ciągu 3 godzin od przyjęcia kwasu acetylosalicylowego; nadwrażliwość na inne niesteroidowe leki przeciwzapalne, przebiegająca z objawami takimi jak: skurcz oskrzeli, katar sienny, wstrząs; astma oskrzelowa, przewlekłe schorzenia układu oddechowego, gorączka sienna lub obrzęk błony śluzowej nosa, gdyż pacjenci z tymi schorzeniami mogą reagować na niesteroidowe leki przeciwzapalne napadami astmy, ograniczonym obrzękiem skóry i błony śluzowej (obrzęk naczynioruchowy) lub pokrzywką częściej niż inni pacjenci; czynna choroba wrzodowa żołądka i (lub) dwunastnicy oraz stany zapalne lub krwawienia z przewodu pokarmowego (może dojść do wystąpienia krwawienia z przewodu pokarmowego lub uczynnienia choroby wrzodowej); ciężka niewydolność wątroby lub nerek; ciężka niewydolność serca; zaburzenia krzepnięcia krwi (np.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgPrzeciwwskazania
hemofilia, małopłytkowość) oraz jednoczesne leczenie środkami przeciwzakrzepowymi (np. pochodne kumaryny, heparyna); niedobór dehydrogenazy glukozo-6-fosforanowej; jednoczesne stosowanie z metotreksatem w dawkach 15 mg tygodniowo lub większych, ze względu na mielotoksyczność (patrz punkt 4.5); u dzieci i młodzieży w wieku poniżej 16 lat, zwłaszcza w przebiegu infekcji wirusowych, ze względu na ryzyko wystąpienia zespołu Reye’a; ostatni trymestr ciąży i okres karmienia piersią.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produktu leczniczego nie należy stosować u pacjentów przyjmujących doustne leki przeciwcukrzycowe z grupy sulfonylomocznika, ze względu na ryzyko nasilenia działania hipoglikemizującego, oraz u chorych przyjmujących leki przeciw dnie. Należy zachować ostrożność stosując produkt u pacjentów z zaburzeniami czynności nerek oraz z przewlekłą niewydolnością nerek. U pacjentów z młodzieńczym reumatoidalnym zapaleniem stawów i (lub) toczniem rumieniowatym układowym oraz niewydolnością wątroby produkt należy stosować ostrożnie, gdyż zwiększa się toksyczność salicylanów; u tych pacjentów należy kontrolować czynność wątroby. Przyjmowanie w najmniejszej skutecznej dawce przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych. Produkt należy odstawić na 5 do 7 dni przed planowanym zabiegiem chirurgicznym, ze względu na ryzyko wydłużonego czasu krwawienia zarówno w czasie jak i po zabiegu.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgSpecjalne środki ostrozności
Zachować ostrożność podczas stosowania z metotreksatem w dawkach mniejszych niż 15 mg na tydzień, ze względu na nasilenie toksycznego działania metotreksatu na szpik kostny. Jednoczesne stosowanie z metotreksatem w dawkach większych niż 15 mg na tydzień jest przeciwwskazane. Należy ostrożnie stosować w przypadku: krwotoków macicznych, nadmiernego krwawienia miesiączkowego, stosowania wewnątrzmacicznej wkładki antykoncepcyjnej, nadciśnienia tętniczego oraz niewydolności serca. Podczas leczenia nie należy pić alkoholu, ze względu na zwiększone ryzyko wystąpienia uszkodzenia błony śluzowej przewodu pokarmowego. U pacjentów w podeszłym wieku produkt należy stosować w mniejszych dawkach i w większych odstępach czasowych, ze względu na zwiększone ryzyko występowania objawów niepożądanych w tej grupie pacjentów. Należy zachować ostrożność w przypadku stosowania u pacjentów pobudzonych psychoruchowo i cierpiących na bezsenność.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgSpecjalne środki ostrozności
Istnieją dowody na to, że leki hamujące cyklooksygenazę (enzym uczestniczący w syntezie prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii. Produkt zawiera laktozę jednowodną. Pacjenci z rzadko występującą dziedziczną nietolerancją galaktozy, niedoborem laktazy (typu Lapp) lub zespołem złego wchłaniania glukozy-galaktozy nie powinni stosować tego produktu.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Inhibitory konwertazy angiotensyny (ACE): produkt może zmniejszać działanie przeciwnadciśnieniowe inhibitorów konwertazy angiotensyny. Acetazolamid: kwas acetylosalicylowy może w znacznym stopniu zwiększać stężenie, a tym samym toksyczność acetazolamidu. Leki przeciwzakrzepowe (np. heparyna, warfaryna): jednoczesne stosowanie z lekami przeciwzakrzepowymi może spowodować nasilenie działania przeciwzakrzepowego. Kwas acetylosalicylowy może wypierać warfarynę z połączeń białkowych, prowadząc do wydłużenia czasu protrombinowego i czasu krwawienia. Produkt może nasilać działanie przeciwzakrzepowe heparyny, zwiększając tym samym ryzyko krwawienia. Leki przeciwpadaczkowe: kwas acetylosalicylowy nasila działanie toksyczne kwasu walproinowego, zaś kwas walproinowy nasila działanie antyagregacyjne kwasu acetylosalicylowego.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgInterakcje
Leki moczopędne: produkt może zmniejszyć skuteczność leków moczopędnych oraz nasilać ototoksyczność furosemidu. Metotreksat: kwas acetylosalicylowy nasila toksyczne działanie metotreksatu na szpik kostny. Stosowanie produktu jednocześnie z metotreksatem w dawkach 15 mg na tydzień lub większych jest przeciwwskazane. Niesteroidowe leki przeciwzapalne: jednoczesne stosowanie salicylanów i innych niesteroidowych leków przeciwzapalnych nie jest zalecane, ze względu na zwiększone ryzyko występowania działań niepożądanych ze strony przewodu pokarmowego. Glikokortykosteroidy stosowane układowo: z wyjątkiem hydrokortyzonu jako terapii zastępczej w chorobie Addisona, podawane jednocześnie z salicylanami zwiększają ryzyko wystąpienia choroby wrzodowej i krwawienia z przewodu pokarmowego oraz zmniejszają stężenie salicylanów w osoczu w trakcie terapii; po jej zakończeniu zwiększa się ryzyko przedawkowania salicylanów.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgInterakcje
Leki przeciwcukrzycowe: produkt może nasilać działanie hipoglikemizujące leków przeciwcukrzycowych. Produktu nie należy stosować jednocześnie z pochodnymi sulfonylomocznika (patrz punkt 4.4). Leki zwiększające wydalanie kwasu moczowego (np. probenecyd, sulfinpirazon): salicylany osłabiają działanie leków zwiększających wydalanie kwasu moczowego. Produktu nie należy stosować jednocześnie z lekami przeciw dnie. Digoksyna: produkt może nasilać działanie digoksyny. Leki trombolityczne: produkt może nasilać działanie leków trombolitycznych, takich jak streptokinaza i alteplaza. Alkohol: zwiększa częstość i nasilenie krwawień z przewodu pokarmowego spowodowanych przez kwas acetylosalicylowy. W trakcie leczenia nie należy pić alkoholu. Omeprazol i kwas askorbowy nie wpływają na wchłanianie kwasu acetylosalicylowego. Doustne środki antykoncepcyjne, cymetydyna i disulfiram: spowalniają metabolizm kofeiny. Barbiturany: przyspieszają metabolizm kofeiny.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgInterakcje
Analeptyki i ergotamina: produkt może nasilać działanie innych analeptyków i ergotaminy.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na przebieg ciąży i (lub) rozwój zarodka oraz płodu. Dane pochodzące z badań epidemiologicznych wskazują na zwiększone ryzyko poronienia oraz występowania wad serca oraz wad przewodu pokarmowego, związane ze stosowaniem inhibitorów syntezy prostaglandyn we wczesnych tygodniach ciąży. Bezwzględne ryzyko występowania wad układu sercowo-naczyniowego zwiększało się w tych badaniach z wartości <1% do prawie 1,5%. Prawdopodobnie ryzyko występowania powyższych wad wrodzonych zwiększa się wraz ze stosowaniem większych dawek leku a także z wydłużaniem okresu terapii. U noworodków, których matki stosowały kwas acetylosalicylowy przed porodem, obserwowano krwawienia, takie jak wylewy podspojówkowe, krwiomocz, wybroczyny, krwiak podokostnowy czaszki.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgWpływ na płodność, ciążę i laktację
W innym badaniu obserwowano częstsze występowanie krwawień wewnątrzczaszkowych u wcześniaków urodzonych przez matki, które stosowały kwas acetylosalicylowy na tydzień przed porodem. U zwierząt dawka śmiertelna dla płodu była większa niż dawki stosowane klinicznie. U zwierząt, którym podawano inhibitory syntezy prostaglandyn w okresie organogenezy obserwowano zwiększoną częstość występowania różnych wad wrodzonych, w tym wad układu sercowo-naczyniowego. Kwas acetylosalicylowy bardzo łatwo przenika przez barierę łożyskową. W pierwszych 6 miesiącach ciąży produkt leczniczy może być stosowany jedynie w przypadku zdecydowanej konieczności. Jeśli zachodzi potrzeba zastosowania kwasu acetylosalicylowego u kobiet, które właśnie zaszły w ciążę, bądź podczas pierwszego lub drugiego trymestru ciąży, należy podawać najmniejszą skuteczną dawkę przez możliwie najkrótszy okres.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgWpływ na płodność, ciążę i laktację
W końcowych trzech miesiącach ciąży wszystkie inhibitory syntezy prostaglandyn mogą wpływać u płodu uszkadzająco: na układ krążenia (nadciśnienie płucne z przedwczesnym zamknięciem przewodu tętniczego Botalla); na nerki (może wystąpić niewydolność nerek z małowodziem). Wszystkie inhibitory syntezy prostaglandyn podawane kobietom w trzecim trymestrze ciąży mogą: powodować wydłużenie czasu krwawienia zarówno u matek jak i u noworodków oraz działanie antyagregacyjne, nawet podczas stosowania bardzo małych dawek; hamować kurczliwość macicy; taki wpływ na macicę związany był ze zwiększoną częstością występowania dystocji i opóźnionego porodu u zwierząt. W związku z tym produkt jest przeciwwskazany w ostatnim trymestrze ciąży. Karmienie piersi? Produkt jest przeciwwskazany w okresie karmienia piersią.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgWpływ na płodność, ciążę i laktację
Płodność Istnieją dowody na to, że leki hamujące cyklooksygenazę (enzym uczestniczący w syntezie prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brak wpływu.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgDziałania niepożądane
4.8 Działania niepożądane Po zastosowaniu produktu mogą wystąpić następujące działania niepożądane: Zaburzenia krwi i układu chłonnego Małopłytkowość Niedokrwistość wskutek mikrokrwawień z przewodu pokarmowego Niedokrwistość hemolityczna u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej Leukopenia Agranulocytoza Eozynopenia Zwiększone ryzyko krwawień Wydłużenie czasu krwawienia Wydłużenie czasu protrombinowego Zaburzenia układu immunologicznego Reakcje nadwrażliwości: wysypka, pokrzywka, obrzęk naczynioruchowy, skurcz oskrzeli, wstrząs Zaburzenia układu nerwowego Szumy uszne (zazwyczaj jako objaw przedawkowania) Zaburzenia słuchu Zawroty głowy Zaburzenia serca Niewydolność serca Zaburzenia naczyniowe Nadciśnienie Zaburzenia żołądka i jelit Niestrawność Zgaga Uczucie pełności w nadbrzuszu Nudności Wymioty Brak łaknienia Bóle brzucha Krwawienia z przewodu pokarmowego Uszkodzenie błony śluzowej żołądka Uczynnienie choroby wrzodowej Perforacje Owrzodzenie żołądka występuje u 15% pacjentów długotrwale przyjmujących kwas acetylosalicylowy Zaburzenia wątroby i dróg żółciowych Ogniskowa martwica komórek wątrobowych Tkliwość i powiększenie wątroby, szczególnie u pacjentów z młodzieńczym reumatoidalnym zapaleniem stawów, układowym toczniem rumieniowatym, gorączką reumatyczną lub chorobą wątroby w wywiadzie Przemijające zwiększenie aktywności aminotransferaz w surowicy, fosfatazy alkalicznej i stężenia bilirubiny Zaburzenia nerek i dróg moczowych Białkomocz Obecność leukocytów i erytrocytów w moczu Martwica brodawek nerkowych Śródmiąższowe zapalenie nerek Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgPrzedawkowanie
4.9 Przedawkowanie Po przedawkowaniu salicylanów mogą wystąpić: nudności, wymioty, szumy uszne i przyspieszenie oddechu. Obserwowano również inne objawy, takie jak: utrata słuchu, zaburzenia widzenia, bóle głowy, pobudzenie ruchowe, senność i śpiączka, drgawki, hipertermia. W ciężkich zatruciach występują zaburzenia gospodarki kwasowo-zasadowej i wodno-elektrolitowej (kwasica metaboliczna i odwodnienie). Objawami przedawkowania kofeiny są: bezsenność, zmęczenie, drżenie mięśni, majaczenie, tachykardia, skurcze dodatkowe, drgawki. Łagodne lub średnio ciężkie objawy toksyczności występują po zastosowaniu kwasu acetylosalicylowego w dawce 150-300 mg/kg mc. Ciężkie objawy zatrucia występują po zażyciu dawki 300-500 mg/kg mc. Potencjalnie śmiertelna dawka kwasu acetylosalicylowego jest większa niż 500 mg/kg mc. Zgon w przebiegu zatrucia kwasem acetylosalicylowym obserwowano po przyjęciu przez osoby dorosłe jednorazowej dawki 10-30 g.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgPrzedawkowanie
Postępowanie po przedawkowaniu: Pacjenta należy przewieźć do szpitala. Brak specyficznej odtrutki. Leczenie przedawkowania Sprowokowanie wymiotów lub wykonanie płukania żołądka (w celu zmniejszenia wchłaniania). Takie postępowanie jest skuteczne w czasie 3-4 godzin po zażyciu kwasu acetylosalicylowego, a w przypadku dużej dawki nawet do 10 godzin. Podanie węgla aktywnego w postaci zawiesiny wodnej (50 do 100 g u dorosłych lub 30 do 60 g u dzieci). Obniżanie temperatury ciała (w przypadku hipertermii) poprzez utrzymywanie niskiej temperatury otoczenia oraz zastosowanie chłodnych okładów. Stałe kontrolowanie gospodarki wodno-elektrolitowej i wyrównywanie zaburzeń. W celu przyspieszenia wydalania kwasu acetylosalicylowego przez nerki oraz w leczeniu kwasicy należy podać dożylnie wodorowęglan sodu. U pacjentów z prawidłową czynnością nerek można zastosować diurezę alkaliczną aż do pH moczu w granicach 7,5-8. W ciężkich zatruciach można zastosować hemodializę lub dializę otrzewnową.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgPrzedawkowanie
Dializa skutecznie usuwa kwas acetylosalicylowy z organizmu oraz ułatwia wyrównanie zaburzeń gospodarki kwasowo-zasadowej i wodno-elektrolitowej. W przypadkach wydłużenia czasu protrombinowego podaje się witaminę K. Nie należy stosować leków działających hamująco na ośrodkowy układ nerwowy, np. barbituranów, ze względu na ryzyko zahamowania ośrodka oddechowego. Pacjentom z zaburzeniami oddychania należy podać tlen. Jeśli to konieczne, wykonać intubację dotchawiczą i zastosować oddech zastępczy. W przypadku występowania wstrząsu zastosować typowe postępowanie przeciwwstrząsowe. Należy uzupełniać płyny oraz prowadzić ogólne leczenie objawowe.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inne leki przeciwbólowe i przeciwgorączkowe, kwas salicylowy i jego pochodne, kod ATC: N02BA71. Produkt łączy w sobie działanie salicylanów (kwasu acetylosalicylowego i etenzamidu) oraz kofeiny. Dwa pierwsze składniki wywierają działanie przeciwbólowe, głównie w bólach spowodowanych stanem zapalnym. Działają przede wszystkim obwodowo, hamując enzym cyklooksygenazę, a tym samym blokują syntezę prostaglandyn. W ten sposób zmniejsza się wrażliwość receptorów bólu (nocyceptorów) na bodźce wywołujące uczucie bólu (stany zapalne, urazy). Kofeina nasila działanie przeciwbólowe salicylanów. Mechanizm jej działania polega na przemieszczaniu Ca2+ w komórce, nagromadzeniu się cyklicznych nukleotydów i blokowaniu receptorów adenozynowych.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Salicylany, po podaniu doustnym ulegają częściowej hydrolizie w błonie śluzowej żołądka. Wchłaniają się szybko i prawie całkowicie. Po wchłonięciu ulegają dalszej hydrolizie w osoczu. Kofeina wchłania się szybko; stężenie maksymalne występuje po 1-2 godzinach. Dystrybucja Kwas acetylosalicylowy szybko i w znacznym stopniu rozmieszcza się w większości tkanek i płynów ustrojowych. Salicylany silnie wiążą się z białkami krwi i wypierają inne leki z tych połączeń. Kofeina łatwo przenika do wszystkich narządów i tkanek. Przenika do mleka kobiecego, płynu mózgowo rdzeniowego i przez barierę łożyska. W około 17% wiąże się z białkami surowicy krwi. Metabolizm Przemiana leku odbywa się głównie w wątrobie. Salicylany ulegają sprzęganiu głównie z glicyną do kwasu salicylurowego, glukuronidu fenolowego i acylowego oraz wielu innych metabolitów.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgWłaściwości farmakokinetyczne
Kofeina metabolizowana jest w wątrobie na drodze demetylacji i utleniania, do 1-metyloksantyny, 7-metyloksantyny, kwasu 1-metylomoczowego. Eliminacja Okres półtrwania salicylanów w osoczu wynosi około 2-3 godzin, a kwasu salicylowego około 6 godzin. Ponieważ metabolizm salicylanów ulega wysyceniu, okres ich półtrwania może ulec wydłużeniu do 15-30 godzin przy stosowaniu większych dawek. W przeciwieństwie do innych salicylanów, niezhydrolizowany kwas acetylosalicylowy nie kumuluje się w surowicy krwi po wielokrotnym podaniu. Kofeina i jej metabolity wydalane są przez nerki z moczem. Okres półtrwania dla kofeiny wynosi 3-7 godzin. Tylko 5-20% wydala się z moczem w postaci niezmienionej.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Właściwości mutagenne i zdolność do pobudzania wzrostu guzów Kwas acetylosalicylowy podawany szczurom przez 68 tygodni w ilości 0,5% karmy, nie działał rakotwórczo. W teście Amesa kwas acetylosalicylowy nie działał mutagennie, jednak w hodowli fibroblastów ludzkich powodował aberracje chromosomalne. Toksyczny wpływ na reprodukcję W badaniach na zwierzętach kwas acetylosalicylowy wykazywał działanie teratogenne. Opisywano zaburzenia zagnieżdżenia się jaja, działanie embrio- i fetotoksyczne oraz trudności w uczeniu się u potomstwa, jeżeli lek został zastosowany przed porodem. Kwas acetylosalicylowy hamował owulację u szczurów. Badania związane ze stosowaniem u ludzi, patrz punkt 4.6. Toksyczność ostra Ostre zatrucie kończące się zgonem może wystąpić po przyjęciu jednej dawki większej niż 10 g kwasu acetylosalicylowego u dorosłych i większej niż 4 g u dzieci.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgPrzedkliniczne dane o bezpieczeństwie
Stężenia kwasu salicylowego w osoczu od 300 do 350 μg/ml mogą wywołać objawy zatrucia, a stężenia od około 400 do 500 μg/ml mogą prowadzić do stanów śpiączki kończących się zgonem. Toksyczność przewlekła Kwas acetylosalicylowy oraz jego metabolity wywierają działanie miejscowo drażniące na błony śluzowe. Jeżeli w obrębie przewodu pokarmowego występują wrzody, zwiększona możliwość krwawienia stwarza ryzyko poważnego krwotoku. Poza tymi działaniami niepożądanymi opisano również uszkodzenie nerek u zwierząt, u których przewlekle i doraźnie stosowano duże dawki kwasu acetylosalicylowego.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Skrobia ziemniaczana Laktoza jednowodna 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem i wilgocią. 6.5 Rodzaj i zawartość opakowania Blistry z folii Aluminium/PVC w tekturowym pudełku. 2 tabletki (1 blister po 2 tabletki) 6 tabletek (1 blister po 6 tabletek) 10 tabletek (1 blister po 10 tabletek) 30 tabletek (5 blistrów po 6 tabletek) Blistry z folii Aluminium/PVC. 6 tabletek (1 blister po 6 tabletek) 10 tabletek (1 blister po 10 tabletek). Pojemnik z polietylenu niskociśnieniowego w tekturowym pudełku. 50 tabletek (1 pojemnik po 50 tabletek) 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań.
- CHPL leku Etopiryna, tabletki, 300 mg + 100 mg + 50 mgDane farmaceutyczne
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Nipas, 32 mg, tabletki dozębodołowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 32 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum). Substancje pomocnicze o znanym działaniu: laktoza jednowodna 17 mg, propylu parahydroksybenzoesan 3 mg. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka dozębodołowa Białe, płaskie, trójkątne tabletki z zaokrąglonymi wierzchołkami.
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgWskazania do stosowania
4.1 Wskazania do stosowania Do stosowania w stomatologii: suche zapalenie zębodołu (ASD) oraz przywierzchołkowe i rozlane zapalenie zębodołu, stany po wyłuszczeniu małych zropiałych torbieli, stany po dłutowaniu zębów i uszkodzeniu zębodołu po zabiegach.
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zazwyczaj stosowana dawka jednorazowa to od 1 do 3 tabletek. W cięższych przypadkach produkt leczniczy można stosować wielokrotnie. Sposób podawania Po wstępnym przepłukaniu zębodołu ciepłym 3% roztworem wodorowęglanu sodu lub 0,9% roztworem chlorku sodu, bez uprzedniego łyżeczkowania, umieszcza się produkt leczniczy w zębodole. Następnie zębodół przykrywa się tamponem na okres 20 minut. Po tym czasie tabletka ulega spęcznieniu i rozpuszczeniu, osłaniając zakończenia nerwowe i chroniąc ściany zębodołu przed dostępem śliny. Czas trwania leczenia Jednorazowa dawka (od 1 do 3 tabletek) powoduje ustąpienie dolegliwości na kilkanaście godzin. Stosowanie produktu leczniczego zaleca się do momentu ustąpienia dolegliwości bólowych i (lub) rozpoczęcia procesu gojenia przez ziarninowanie. Całkowite ustąpienie bólu obserwuje się na ogół po 3 do 4 dniach stosowania produktu leczniczego, przy codziennie zmienianych opatrunkach.
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na kwas acetylosalicylowy, inne salicylany lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Skaza krwotoczna. Ostatni trymestr ciąży.
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt leczniczy Nipas należy stosować ostrożnie u pacjentów przyjmujących środki przeciwzakrzepowe. Specjalne ostrzeżenia dotyczące substancji pomocniczych Laktoza jednowodna W skład produktu leczniczego wchodzi laktoza jednowodna. Produkt leczniczy nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozygalaktozy. Propylu parahydroksybenzoesan W skład produktu leczniczego wchodzi propylu parahydroksybenzoesan, który może powodować reakcje alergiczne (możliwe reakcje typu późnego).
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Salicylany są antagonistami witaminy K i mogą powodować hipoprotrombinemię. Silnie wypierają z połączeń z białkami, zwiększając wolną frakcję wielu podanych równocześnie produktów leczniczych i wzmagając ich działanie farmakologiczne. Ma to jednak znaczenie przy równoczesnym doustnym stosowaniu pochodnych kwasu salicylowego w dawkach powyżej 1 g/dobę.
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Produktu leczniczego Nipas nie należy stosować w trzecim trymestrze ciąży. Ostrożnie stosować w pierwszym i drugim trymestrze ciąży. Karmienie piersi? Nie zaleca się karmienia piersią podczas długotrwałej kuracji dużymi dawkami kwasu acetylosalicylowego. Krótkotrwałe stosowanie lub pojedyncze dawki produktu leczniczego nie stanowią zagrożenia dla niemowlęcia karmionego piersią.
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy Nipas nie ma wpływu na sprawność psychofizyczną, zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgDziałania niepożądane
4.8 Działania niepożądane Nie są znane działania niepożądane podczas miejscowego stosowania produktu leczniczego Nipas. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: +48 22 49 21 301 Faks: +48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgPrzedawkowanie
4.9 Przedawkowanie Nie zgłoszono żadnego przypadku przedawkowania. Do zębodołu możliwe jest wprowadzenie maksymalnie 3 tabletek zawierających w sumie 96 mg kwasu acetylosalicylowego. Doustne dawki jednorazowe kwasu acetylosalicylowego wynoszą od 300 do 1000 mg. Zgon w przebiegu zatrucia obserwowano po przyjęciu przez osoby dorosłe jednorazowej dawki od 10 do 30 g.
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inne leki do stosowania miejscowego w jamie ustnej, kod ATC: A01AD05 Kwas acetylosalicylowy należy do grupy niesteroidowych leków przeciwzapalnych. Działa przeciwbólowo poprzez hamowanie aktywności cyklooksygenazy kwasu arachidonowego, co powoduje zahamowanie syntezy prostaglandyny E i F. Prostaglandyny powstające w tkankach pod wpływem czynnika zapalnego stanowią (obok acetylocholiny, bradykininy i serotoniny) przekaźniki bólu w zakończeniach nerwowych. Dlatego pochodne kwasu salicylowego oprócz działania ośrodkowego wywierają także działanie przeciwbólowe w miejscu powstawania bólu. Salicylany zapobiegają również powstawaniu tromboksanów i prostacyklin. Hamowanie syntezy tromboksanów w płytkach wywołuje działanie antyagregacyjne objawiające się wydłużeniem czasu krwawienia.
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Przy podaniu miejscowym do suchego zębodołu, kwas acetylosalicylowy wchłania się szybko. Metabolizm W tkankach następuje hydroliza. Powstający kwas salicylowy i jego sole dyfundują szybko do tkanek i płynów ustrojowych. Ulegają częściowej biotransformacji w wątrobie, łatwo przenikają przez łożysko. Wiążą się w 50 do 80% z albuminami osocza, wypierając i wzmagając działanie innych leków. Eliminacja Okres półtrwania dla małych dawek wynosi od 2 do 4 godzin. Wydalanie zachodzi przez nerki w postaci kwasu salicylowego i jego metabolitów: kwasu salicylurowego i glukuronidów. W okresie do 24 godzin wydala się około 50% dawki (wolna eliminacja).
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak danych przedklinicznych dotyczących produktu leczniczego Nipas.
- CHPL leku Nipas, tabletki dozębodołowe, 32 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Laktoza jednowodna Propylu parahydroksybenzoesan Talk 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Pojemnik propylenowy z wieczkiem z polietylenu, zabezpieczeniem gwarancyjnym i środkiem osuszającym, zawierający 50 tabletek. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Produkt leczniczy Nipas powinien być stosowany tylko przez lekarzy stomatologów. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Polopiryna C, 500 mg + 200 mg, tabletki musujące 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 500 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum) oraz 200 mg kwasu askorbowego (Acidum ascorbicum). Substancja pomocnicza o znanym działaniu: sód. Każda tabletka zawiera 356 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka musująca. Białe, okrągłe, obustronnie płaskie tabletki, wrzucone do wody rozpuszczają się silnie musując.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgWskazania do stosowania
4.1 Wskazania do stosowania Bóle o słabym lub średnim nasileniu, np.: bóle głowy, bóle mięśniowe i stawowe oraz inne. Gorączka w przebiegu przeziębienia, zakażeń wirusowych i innych chorób.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Przeciwbólowo i przeciwgorączkowo zwykle stosuje się: Dorośli: jednorazowo od 1 do 2 tabletek. W razie potrzeby dawka może być powtarzana od 2 do 3 razy na dobę. Nie przyjmować więcej niż 3 g kwasu acetylosalicylowego na dobę. Młodzież w wieku powyżej 12 lat: od 1 do 2 tabletek na dobę. Należy stosować możliwie najmniejsze skuteczne dawki. Sposób podawania Podanie doustne. Produkt należy przyjmować w czasie posiłku. Przed zastosowaniem tabletkę należy rozpuścić w ¾ szklanki wody. Czas stosowania Leczenie objawowe bez porady lekarskiej można prowadzić nie dłużej niż 3 dni.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nadwrażliwość na kwas acetylosalicylowy występuje u 0,3% populacji, w tym u 20% chorych na astmę oskrzelową lub przewlekłą pokrzywkę. Objawy nadwrażliwości: pokrzywka, a nawet wstrząs, mogą wystąpić w ciągu 3 godzin od przyjęcia kwasu acetylosalicylowego. Nadwrażliwość na inne niesteroidowe leki przeciwzapalne, przebiegająca z objawami takimi jak: skurcz oskrzeli, katar sienny, wstrząs; Astma oskrzelowa, przewlekłe schorzenia układu oddechowego, gorączka sienna lub obrzęk błony śluzowej nosa, gdyż pacjenci z tymi schorzeniami mogą reagować na niesteroidowe leki przeciwzapalne napadami astmy, ograniczonym obrzękiem skóry i błony śluzowej (obrzęk naczynioruchowy) lub pokrzywką częściej niż inni pacjenci; Czynna choroba wrzodowa żołądka i (lub) dwunastnicy oraz stany zapalne lub krwawienia z przewodu pokarmowego (może dojść do wystąpienia krwawienia z przewodu pokarmowego lub uczynnienia choroby wrzodowej); Ciężka niewydolność wątroby i (lub) nerek; Ciężka niewydolność serca; Zaburzenia krzepnięcia krwi (np.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgPrzeciwwskazania
hemofilia, małopłytkowość) oraz jednoczesne leczenie środkami przeciwzakrzepowymi (np. pochodne kumaryny, heparyna); Niedobór dehydrogenazy glukozo-6-fosforanowej; Jednoczesne stosowanie z metotreksatem w dawkach 15 mg na tydzień lub większych, ze względu na mielotoksyczność (patrz punkt 4.5); U dzieci w wieku poniżej 12 lat, zwłaszcza w przebiegu infekcji wirusowych (np. ospa wietrzna, grypa), ze względu na ryzyko wystąpienia zespołu Reye’a; Trzeci trymestr ciąży i w okresie karmienia piersią.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produktu nie należy stosować u pacjentów przyjmujących doustne leki przeciwcukrzycowe z grupy sulfonylomocznika, ze względu na ryzyko nasilenia działania hipoglikemizującego, oraz u chorych przyjmujących leki przeciw dnie. Należy zachować ostrożność stosując produkt u pacjentów z zaburzeniami czynności nerek oraz z przewlekłą niewydolnością nerek. U pacjentów z młodzieńczym reumatoidalnym zapaleniem stawów i (lub) toczniem rumieniowatym układowym oraz niewydolnością wątroby produkt należy stosować ostrożnie, gdyż zwiększa się toksyczność salicylanów; u tych pacjentów należy kontrolować czynność wątroby. Przyjmowanie leku w najmniejszej skutecznej dawce przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz wpływ na przewód pokarmowy i układ krążenia, poniżej).
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgSpecjalne środki ostrozności
Kwas acetylosalicylowy należy odstawić na 5 do 7 dni przed planowanym zabiegiem chirurgicznym, ze względu na ryzyko wydłużonego czasu krwawienia zarówno w czasie jak i po zabiegu. Należy zachować ostrożność podczas stosowania z metotreksatem w dawkach mniejszych niż 15 mg na tydzień, ze względu na nasilenie toksycznego działania metotreksatu na szpik kostny. Jednoczesne stosowanie z metotreksatem w dawkach większych niż 15 mg na tydzień jest przeciwwskazane. Ostrożnie stosować w przypadku: krwotoków macicznych, nadmiernego krwawienia miesiączkowego, stosowania wewnątrzmacicznej wkładki antykoncepcyjnej, nadciśnienia tętniczego oraz niewydolności serca. Podczas leczenia kwasem acetylosalicylowym nie należy spożywać alkoholu, ze względu na zwiększone ryzyko wystąpienia uszkodzenia błony śluzowej przewodu pokarmowego.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgSpecjalne środki ostrozności
U pacjentów w podeszłym wieku produkt należy stosować w mniejszych dawkach i w większych odstępach czasowych, ze względu na zwiększone ryzyko występowania działań niepożądanych w tej grupie pacjentów. Produkt leczniczy zawiera 356 mg sodu w tabletce, co odpowiada 17,8% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych. Należy to wziąć pod uwagę u pacjentów ze zmniejszoną czynnością nerek i u pacjentów kontrolujących zawartość sodu w diecie. Istnieją dowody na to, że leki hamujące cyklooksygenazę (enzym uczestniczący w syntezie prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu leczenia. W przypadku uszkodzenia opakowania bezpośredniego, na skutek działania czynników zewnętrznych (dostęp powietrza i wilgoć) zawarta w tabletce witamina C ulega stopniowemu utlenieniu co prowadzi do zmiany barwy tabletki z białej na brązową. Tabletka o zmienionym kolorze nie może być stosowana.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Inhibitory konwertazy angiotensyny (ACE): Produkt zmniejsza działanie przeciwnadciśnieniowe inhibitorów konwertazy angiotensyny. Acetazolamid: Kwas acetylosalicylowy może w znacznym stopniu zwiększać stężenie, a tym samym toksyczność acetazolamidu. Leki przeciwzakrzepowe (np. heparyna, warfaryna): Jednoczesne stosowanie kwasu acetylosalicylowego i leków przeciwzakrzepowych może spowodować nasilenie działania przeciwzakrzepowego. Produkt osłabia działanie warfaryny. Kwas acetylosalicylowy może wypierać warfarynę z połączeń białkowych, prowadząc do wydłużenia czasu protrombinowego i czasu krwawienia. Produkt może nasilać działanie przeciwzakrzepowe heparyny, zwiększając tym samym ryzyko krwawienia. Leki przeciwpadaczkowe: Kwas acetylosalicylowy nasila działanie toksyczne kwasu walproinowego, zaś kwas walproinowy nasila działanie antyagregacyjne kwasu acetylosalicylowego.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgInterakcje
Leki moczopędne: Produkt może zmniejszyć skuteczność leków moczopędnych oraz nasilać ototoksyczność furosemidu. Metotreksat: Kwas acetylosalicylowy nasila toksyczne działanie metotreksatu na szpik kostny. Stosowanie kwasu acetylosalicylowego jednocześnie z metotreksatem w dawkach 15 mg na tydzień lub większych jest przeciwwskazane. Niesteroidowe leki przeciwzapalne: Jednoczesne stosowanie kwasu acetylosalicylowego i niesteroidowych leków przeciwzapalnych nie jest zalecane, ze względu na zwiększone ryzyko występowania działań niepożądanych ze strony przewodu pokarmowego. Glikokortykosteroidy stosowane układowo: z wyjątkiem hydrokortyzonu jako terapii zastępczej w chorobie Addisona, podawane jednocześnie z kwasem acetylosalicylowym zwiększają ryzyko wystąpienia choroby wrzodowej i krwawienia z przewodu pokarmowego oraz zmniejszają stężenie salicylanów w osoczu w trakcie terapii, a po jej zakończeniu zwiększa się ryzyko przedawkowania salicylanów.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgInterakcje
Leki przeciwcukrzycowe: Produkt nasila działanie hipoglikemizujące leków przeciwcukrzycowych. Produktu nie należy stosować jednocześnie z pochodnymi sulfonylomocznika. Leki zwiększające wydalanie kwasu moczowego (np. probenecyd, sulfinpirazon): Salicylany osłabiają działanie leków zwiększających wydalanie kwasu moczowego. Produktu nie należy stosować jednocześnie z lekami przeciw dnie. Digoksyna: Produkt może nasilać działanie digoksyny. Leki trombolityczne: Produkt może nasilać działanie leków trombolitycznych, takich jak streptokinaza i alteplaza. Alkohol: Alkohol zwiększa częstość i nasilenie krwawień z przewodu pokarmowego spowodowanych przez kwas acetylosalicylowy. W trakcie leczenia nie należy spożywać alkoholu. Omeprazol nie wpływa na wchłanianie kwasu acetylosalicylowego. Kwas askorbowy obniża pH moczu, co może wpływać na wydalanie innych leków. Kwas askorbowy może zmieniać wyniki badań laboratoryjnych opartych na reakcjach oksydo-redukcyjnych (silne działanie redukcyjne).
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgInterakcje
Obecność kwasu askorbowego w moczu daje fałszywie dodatnie wyniki oznaczeń poziomu glukozy z zastosowaniem miedzi siarczanu i wyniki fałszywie ujemne z zastosowaniem metody utleniania.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na przebieg ciąży i (lub) rozwój zarodka oraz płodu. Dane pochodzące z badań epidemiologicznych wskazują na zwiększone ryzyko poronienia oraz występowania wad serca oraz wad przewodu pokarmowego, związane ze stosowaniem inhibitorów syntezy prostaglandyn we wczesnych tygodniach ciąży. Bezwzględne ryzyko występowania wad układu sercowo-naczyniowego zwiększało się w tych badaniach z wartości <1% do prawie 1,5%. Prawdopodobnie ryzyko występowania powyższych wad wrodzonych zwiększa się wraz ze stosowaniem większych dawek leku a także z wydłużaniem okresu terapii. U noworodków, których matki stosowały kwas acetylosalicylowy przed porodem, obserwowano nieprawidłowe krwawienia, takie jak: wylewy podspojówkowe, krwiomocz, wybroczyny, krwiak podokostnowy czaszki.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgWpływ na płodność, ciążę i laktację
W innym badaniu obserwowano częstsze występowanie krwawień wewnątrzczaszkowych u wcześniaków urodzonych przez matki, które stosowały kwas acetylosalicylowy na tydzień przed porodem. U zwierząt dawka śmiertelna dla płodu była większa niż dawki stosowane klinicznie. U zwierząt, którym podawano inhibitory syntezy prostaglandyn w okresie organogenezy obserwowano zwiększoną częstość występowania różnych wad wrodzonych, w tym wad układu sercowo-naczyniowego. Kwas acetylosalicylowy bardzo łatwo przenika przez barierę łożyskową. W pierwszych 6 miesiącach ciąży produkt leczniczy może być stosowany jedynie w przypadku zdecydowanej konieczności. Jeśli zachodzi potrzeba zastosowania kwasu acetylosalicylowego u kobiet, które właśnie zaszły w ciążę, bądź podczas pierwszego lub drugiego trymestru ciąży należy podawać najmniejszą skuteczną dawkę przez możliwie najkrótszy okres czasu.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgWpływ na płodność, ciążę i laktację
W końcowych trzech miesiącach ciąży wszystkie inhibitory syntezy prostaglandyn mogą wpływać u płodu uszkadzająco: na układ krążenia (nadciśnienie płucne z przedwczesnym zamknięciem przewodu tętniczego Botalla), na nerki (może wystąpić niewydolność nerek z małowodziem). Wszystkie inhibitory syntezy prostaglandyn podawane kobietom w trzecim trymestrze ciąży mogą: powodować wydłużenie czasu krwawienia zarówno u matek jak i u noworodków oraz działanie antyagregacyjne, nawet podczas stosowania bardzo małych dawek, hamować kurczliwość macicy; taki wpływ na macicę związany był ze zwiększoną częstością występowania dystocji i opóźnionego porodu u zwierząt. W związku z tym kwas acetylosalicylowy jest przeciwwskazany w ostatnim trymestrze ciąży. Karmienie piersi? Produkt jest przeciwwskazany w okresie karmienia piersią (punkt 4.3).
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt Polopiryna C stosowany w zalecanych dawkach (patrz dawkowanie) nie powoduje upośledzenia sprawności psychofizycznej, zdolności prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgDziałania niepożądane
4.8 Działania niepożądane Po zastosowaniu produktu mogą wystąpić następujące działania niepożądane: Zaburzenia krwi i układu chłonnego małopłytkowość niedokrwistość wskutek mikrokrwawień z przewodu pokarmowego niedokrwistość hemolityczna u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej leukopenia agranulocytoza eozynopenia zwiększone ryzyko krwawień wydłużenie czasu krwawienia wydłużenie czasu protrombinowego Zaburzenia układu immunologicznego Reakcje nadwrażliwości: wysypka, pokrzywka, obrzęk naczynioruchowy, skurcz oskrzeli, wstrząs. Zaburzenia układu nerwowego szumy uszne (zazwyczaj jako objaw przedawkowania) zaburzenia słuchu zawroty głowy Kwas askorbowy może powodować znużenie, uczucie palenia za mostkiem, bezsenność lub senność. Zaburzenia serca niewydolność serca. Zaburzenia naczyniowe nadciśnienie zaczerwienienie twarzy.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgDziałania niepożądane
Zaburzenia żołądka i jelit niestrawność zgaga uczucie pełności w nadbrzuszu nudności wymioty brak łaknienia bóle brzucha krwawienia z przewodu pokarmowego uszkodzenie błony śluzowej żołądka uczynnienie choroby wrzodowej perforacje Owrzodzenie żołądka występuje u 15% pacjentów długotrwale przyjmujących kwas acetylosalicylowy. Zaburzenia wątroby i dróg żółciowych ogniskowa martwica komórek wątrobowych tkliwość i powiększenie wątroby, szczególnie u pacjentów z młodzieńczym reumatoidalnym zapaleniem stawów, układowym toczniem rumieniowatym, gorączką reumatyczną lub chorobą wątroby w wywiadzie przemijające zwiększenie aktywności aminotransferaz w surowicy fosfatazy alkalicznej i stężenia bilirubiny. Zaburzenia nerek i dróg moczowych białkomocz obecność leukocytów i erytrocytów w moczu martwica brodawek nerkowych śródmiąższowe zapalenie nerek.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgDziałania niepożądane
Kwas askorbowy zmniejsza pH moczu, co ułatwia wytrącanie się moczanów, cystyny lub szczawianów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgPrzedawkowanie
4.9 Przedawkowanie Po przedawkowaniu kwasu acetylosalicylowego mogą wystąpić: nudności, wymioty, szumy uszne i przyspieszenie oddechu. Obserwowano również inne objawy, takie jak: utrata słuchu, zaburzenia widzenia, bóle głowy, pobudzenie ruchowe, senność i śpiączka, drgawki, hipertermia. W ciężkich zatruciach występują zaburzenia gospodarki kwasowo-zasadowej i wodno-elektrolitowej (kwasica metaboliczna i odwodnienie). Łagodne lub średnio ciężkie objawy toksyczności występują po zastosowaniu kwasu acetylosalicylowego w dawce 150-300 mg/kg mc. Ciężkie objawy zatrucia występują po zażyciu dawki 300-500 mg/kg mc. Potencjalnie śmiertelna dawka kwasu acetylosalicylowego jest większa niż 500 mg/kg mc. Zgon w przebiegu zatrucia kwasem acetylosalicylowym obserwowano po przyjęciu przez osoby dorosłe jednorazowej dawki 10-30 g. Postępowanie po przedawkowaniu Pacjenta należy przewieźć do szpitala. Brak specyficznej odtrutki.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgPrzedawkowanie
Leczenie przedawkowania: Sprowokowanie wymiotów lub wykonanie płukania żołądka (w celu zmniejszenia wchłaniania). Takie postępowanie jest skuteczne w czasie 3-4 godzin po zażyciu kwasu acetylosalicylowego, a w przypadku dużej dawki nawet do 10 godzin. Podanie węgla aktywnego w postaci zawiesiny wodnej (50 do 100 g u dorosłych lub 30 do 60 g u dzieci). Obniżanie temperatury ciała (w przypadku hipertermii) poprzez utrzymywanie niskiej temperatury otoczenia oraz zastosowanie chłodnych okładów. Stałe kontrolowanie gospodarki wodno-elektrolitowej i wyrównywanie zaburzeń. W celu przyspieszenia wydalania kwasu acetylosalicylowego przez nerki oraz w leczeniu kwasicy należy podać dożylnie wodorowęglan sodu. U pacjentów z prawidłową czynnością nerek można zastosować diurezę alkaliczną aż do pH moczu w granicach 7,5-8. W ciężkich zatruciach można zastosować hemodializę lub dializę otrzewnową.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgPrzedawkowanie
Dializa skutecznie usuwa kwas acetylosalicylowy z organizmu oraz ułatwia wyrównanie zaburzeń gospodarki kwasowo-zasadowej i wodno-elektrolitowej. W przypadkach wydłużenia czasu protrombinowego podaje się witaminę K. Nie należy stosować leków działających hamująco na ośrodkowy układ nerwowy, np. barbituranów, ze względu na ryzyko zahamowania ośrodka oddechowego. Pacjentom z zaburzeniami oddychania należy podać tlen. Jeśli to konieczne, wykonać intubację dotchawiczą i zastosować oddech zastępczy. W przypadku wystąpienia wstrząsu zastosować typowe postępowanie przeciwwstrząsowe. Należy uzupełniać płyny oraz prowadzić ogólne leczenie objawowe.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inne leki przeciwbólowe i przeciwgorączkowe, kwas salicylowy i jego pochodne, kod ATC: N02BA01. Polopiryna C jest produktem złożonym z kwasu acetylosalicylowego i kwasu askorbowego. Kwas acetylosalicylowy należy do grupy niesteroidowych leków przeciwzapalnych (NLPZ). Jest estrem kwasu salicylowego o właściwościach przeciwbólowych, przeciwzapalnych i przeciwgorączkowych. Kwas askorbowy wpływa na oddychanie tkankowe i jest niezbędny w procesach przemian zachodzących w ustroju. Mechanizm działania kwasu acetylosalicylowego polega na hamowaniu syntezy prostaglandyn - prostaglandyny E2 (PGE2), prostaglandyny I2 (PGI2) oraz tromboksanu A2 - na skutek zahamowania cyklooksygenazy kwasu arachidonowego (hamowanie aktywności COX-1 i (lub) COX-2).
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgWłaściwości farmakodynamiczne
Związki te indukują proces zapalny przez działanie leukotaktyczne, zwiększoną przepuszczalność naczyń, powstawanie obrzęku, zwiększenie wrażliwości receptorów bólu na działanie neuroprzekaźników (serotoniny, bradykininy, acetylocholiny). W podwzgórzu PGE2 jest silnym czynnikiem gorączkotwórczym i hamowanie jej wytwarzania hamuje powstawanie gorączki. NLPZ wykazują także działanie przeciwbólowe w słabych bólach nocyceptywnych i w bólach neurogennych wywołanych stanami zapalnymi (lub z innych przyczyn), w których szkodliwe bodźce pobudzają aktywność cyklooksygenazy, zwiększając wytwarzanie nadtlenków i prostaglandyn. Wiele danych wskazuje, że możliwy jest także ośrodkowy mechanizm działania przeciwbólowego niesteroidowych leków przeciwzapalnych. Kwas acetylosalicylowy hamuje również agregację płytek krwi. Nieodwracalne hamowanie cyklooksygenazy jest szczególnie wyraźne w płytkach krwi, ponieważ nie mogą one ponownie wytworzyć tego enzymu.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgWłaściwości farmakodynamiczne
Przypuszczalnie kwas acetylosalicylowy wywiera również inne działania hamujące na płytki krwi. Kwas askorbowy jest odwracalnie utleniany do kwasu dehydroaskorbowego. Oba te związki mają duże znaczenie w procesach oksydacyjno-redukcyjnych zachodzących w organizmie. Kwas askorbowy potrzebny jest również do syntezy kolagenu i odnowy tkanek. Bierze udział w przemianie tyrozyny, w konwersji kwasu foliowego do folinowego, w przemianie węglowodanów, syntezie lipidów i białek. Ponadto uczestniczy w metabolizmie żelaza. Poprawia oddychanie tkankowe. W okresie choroby i zdrowienia zwiększa się zapotrzebowanie na kwas askorbowy.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Kwas acetylosalicylowy wchłania się z przewodu pokarmowego w 80-100%. Kwas askorbowy łatwo wchłania się po podaniu doustnym, ale w mniejszym stopniu u pacjentów z biegunką lub ze schorzeniami przewodu pokarmowego. Pokarm nie zmniejsza dostępności biologicznej kwasu acetylosalicylowego, ale może wydłużyć czas wchłaniania. Szybkość wchłaniania kwasu acetylosalicylowego z form rozpuszczalnych jest większa niż z postaci konwencjonalnych. Działanie przeciwbólowe i przeciwgorączkowe kwasu acetylosalicylowego zastosowanego w postaci tabletek rozpuszczalnych rozpoczyna się po 30 minutach od chwili zastosowania, osiągając maksimum po 1-3 godzinach. Po zastosowaniu jednorazowej dawki utrzymuje się przez 3 do 6 godzin. Pełne działanie przeciwzapalne występuje w ciągu 1-4 dni leczenia. Dystrybucja Około 33% kwasu acetylosalicylowego wiąże się z białkami, jeśli stężenie w surowicy wynosi 120 μg/ml.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgWłaściwości farmakokinetyczne
Stopień wiązania z białkami zależy od stężenia albumin; u zdrowych osób zmniejsza się wraz ze zmniejszeniem tego stężenia. Powstały po hydrolizie kwas salicylowy ulega szybkiej dystrybucji w całym organizmie. Objętość dystrybucji kwasu salicylowego w stężeniu terapeutycznym wynosi około 0,15-0,2 l/kg mc. i zwiększa się wraz ze zwiększaniem stężenia w surowicy. Kwas askorbowy rozmieszcza się szybko w tkankach. Największe stężenia osiąga w wątrobie, leukocytach, płytkach krwi i w soczewce oka. Około 25% kwasu askorbowego wiąże się z białkami osocza. Kwas askorbowy przenika przez barierę łożyska. Stężenie we krwi pępowinowej jest 2-4 razy większe niż we krwi matki. Kwas askorbowy przenika do mleka kobiecego. Metabolizm Kwas acetylosalicylowy jest hydrolizowany w osoczu do kwasu salicylowego. Kwas salicylowy jest sprzęgany w wątrobie do kwasu salicylurowego, glukuronidu fenolowego i acylowego oraz wielu innych metabolitów.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgWłaściwości farmakokinetyczne
Kwas askorbowy jest metabolizowany do nieaktywnych związków wydalanych z moczem, głównie do siarczanu kwasu askorbowego i szczawianów. Eliminacja Okres półtrwania kwasu acetylosalicylowego w osoczu wynosi około 2-3 godzin, a kwasu salicylowego około 6 godzin. W przeciwieństwie do innych salicylanów, niezhydrolizowany kwas acetylosalicylowy nie kumuluje się w surowicy krwi po wielokrotnym podaniu. Tylko około 1% doustnej dawki kwasu acetylosalicylowego wydala się z moczem w postaci niezhydrolizowanej, pozostała część wydalana jest z moczem w postaci kwasu salicylowego i jego metabolitów. U pacjentów z prawidłową czynnością nerek, po jednorazowym podaniu kwasu acetylosalicylowego 80-100% dawki wydalane jest z moczem w ciągu 24-72 godzin.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Właściwości mutagenne i zdolność do pobudzania wzrostu guzów Kwas acetylosalicylowy podawany szczurom przez 68 tygodni w ilości 0,5% karmy, nie działał rakotwórczo. W teście Amesa kwas acetylosalicylowy nie działał mutagennie, jednak w hodowli fibroblastów ludzkich powodował aberracje chromosomalne. Toksyczny wpływ na reprodukcję W badaniach na zwierzętach kwas acetylosalicylowy wykazywał działanie teratogenne. Opisywano zaburzenia zagnieżdżenia się jaja, działanie embrio- i fetotoksyczne oraz trudności w uczeniu się u potomstwa, jeżeli lek został zastosowany przed porodem. Kwas acetylosalicylowy hamował owulację u szczurów. Badania związane ze stosowaniem u ludzi, patrz punkt 4.6. Toksyczność ostra Ostre zatrucie kończące się zgonem może wystąpić po przyjęciu jednej dawki większej niż 10 g kwasu acetylosalicylowego u dorosłych i większej niż 4 g u dzieci.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgPrzedkliniczne dane o bezpieczeństwie
Stężenia kwasu salicylowego w osoczu od 300 do 350 μg/ml mogą wywołać objawy zatrucia, a stężenia od około 400 do 500 μg/ml mogą prowadzić do stanów śpiączki kończących się zgonem. Toksyczność przewlekła Kwas acetylosalicylowy oraz jego metabolity wywierają działanie miejscowo drażniące na błony śluzowe. Jeżeli w obrębie przewodu pokarmowego występują wrzody, zwiększona możliwość krwawienia stwarza ryzyko poważnego krwotoku. Poza tymi działaniami niepożądanymi opisano również uszkodzenie nerek u zwierząt, u których przewlekle i doraźnie stosowano duże dawki kwasu acetylosalicylowego.
- CHPL leku Polopiryna C, tabletki musujące, 500 mg + 200 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas cytrynowy bezwodny Sodu wodorowęglan 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Strips z folii aluminiowej laminowanej papierem i polietylenem „SURLYN” w tekturowym pudełku. Pudełko zawiera 6, 10 lub 18 tabletek musujących. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań. Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć w sposób zgodny z lokalnymi przepisami.
- CHPL leku Polopiryna S, tabletki, 300 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Polopiryna S, 300 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 300 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka Białe, obustronnie płaskie tabletki, z rowkiem dzielącym po jednej stronie.
- CHPL leku Polopiryna S, tabletki, 300 mgWskazania do stosowania
4.1 Wskazania do stosowania Dolegliwości bólowe różnego pochodzenia o lekkim i średnim nasileniu, w tym: bóle głowy, bóle zębów, bóle mięśni, bóle stawów. Dolegliwości towarzyszące przeziębieniu i grypie z gorączką. Stany chorobowe wymagające długotrwałego stosowania kwasu acetylosalicylowego w dużych dawkach, jak reumatoidalne zapalenie stawów (z przepisu lekarza). Zawał mięśnia sercowego i profilaktyka powtórnego zawału mięśnia sercowego.
- CHPL leku Polopiryna S, tabletki, 300 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Przeciwbólowo i przeciwgorączkowo, zwykle stosuje się: Dorośli: od 300 mg do 600 mg (od 1 do 2 tabletek) co 4 godziny. Nie przyjmować więcej niż 3 g produktu na dobę. Młodzież w wieku powyżej 16 lat: od 600 mg do 900 mg (od 2 do 3 tabletek) na dobę. W stanach zapalnych według wskazań lekarza, zwykle stosuje się: w gorączce reumatycznej: 900 mg (3 tabletki) 4 razy na dobę; w reumatoidalnym zapaleniu stawów: 600 mg (2 tabletki) od 3 do 4 razy na dobę. Zawał mięśnia sercowego, profilaktyka zawału mięśnia sercowego: od 150 mg do 300 mg (od ½ do 1 tabletki) na dobę. Sposób podawania Produkt należy przyjmować doustnie, najlepiej w czasie lub po posiłku, z dużą ilością płynu. Tabletkę przed użyciem można również rozpuścić w ½ szklanki wody lub mleka. Leczenie objawowe bez porady lekarskiej można prowadzić nie dłużej niż 3 dni. Należy stosować możliwie najmniejsze skuteczne dawki.
- CHPL leku Polopiryna S, tabletki, 300 mgPrzeciwwskazania
4.3 Przeciwwskazania Produktu nie należy stosować w następujących przypadkach: nadwrażliwość na substancję czynną lub którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. nadwrażliwość na kwas acetylosalicylowy występuje u 0,3% populacji, w tym u 20% chorych na astmę oskrzelową lub przewlekłą pokrzywkę. Objawy nadwrażliwości: pokrzywka, a nawet wstrząs, mogą wystąpić w ciągu 3 godzin od przyjęcia kwasu acetylosalicylowego; nadwrażliwość na inne niesteroidowe leki przeciwzapalne, przebiegająca z objawami takimi jak: skurcz oskrzeli, zapalenie błony śluzowej nosa, wstrząs; astma oskrzelowa, przewlekłe schorzenia układu oddechowego, gorączka sienna lub obrzęk błony śluzowej nosa, gdyż pacjenci z tymi schorzeniami mogą reagować na niesteroidowe leki przeciwzapalne napadami astmy, ograniczonym obrzękiem skóry i błony śluzowej (obrzęk naczynioruchowy) lub pokrzywką częściej niż inni pacjenci; czynna choroba wrzodowa żołądka i (lub) dwunastnicy oraz stany zapalne lub krwawienia z przewodu pokarmowego (może dojść do wystąpienia krwawienia z przewodu pokarmowego lub uczynnienia choroby wrzodowej); ciężka niewydolność wątroby lub nerek; ciężka niewydolność serca; zaburzenia krzepnięcia krwi (np.
- CHPL leku Polopiryna S, tabletki, 300 mgPrzeciwwskazania
hemofilia, małopłytkowość) oraz jednoczesne leczenie środkami przeciwzakrzepowymi (np. pochodne kumaryny, heparyna); niedobór dehydrogenazy glukozo-6-fosforanowej; jednoczesne stosowanie z metotreksatem w dawkach 15 mg tygodniowo lub większych, ze względu na mielotoksyczność (patrz punkt 4.5); u dzieci i młodzieży w wieku poniżej 16 lat, zwłaszcza w przebiegu infekcji wirusowych, ze względu na ryzyko wystąpienia zespołu Reye’a; ostatniego trymestru ciąży i karmienia piersią.
- CHPL leku Polopiryna S, tabletki, 300 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Kwas acetylosalicylowy należy stosować ostrożnie: w pierwszym i drugim trymestrze ciąży; w przypadku nadwrażliwości na niesteroidowe leki przeciwzapalne i przeciwreumatyczne lub inne substancje alergizujące; podczas jednoczesnego stosowania leków przeciwzakrzepowych; produktu nie należy stosować u pacjentów przyjmujących doustne leki przeciwcukrzycowe z grupy sulfonylomocznika, ze względu na ryzyko nasilenia działania hipoglikemizującego, oraz u pacjentów przyjmujących leki przeciw dnie; u pacjentów z chorobą wrzodową lub krwawieniami z przewodu pokarmowego w wywiadzie; u pacjentów z zaburzeniami czynności nerek oraz z przewlekłą niewydolnością nerek; u pacjentów z młodzieńczym reumatoidalnym zapaleniem stawów i (lub) toczniem rumieniowatym układowym oraz niewydolnością wątroby, gdyż zwiększa się toksyczność salicylanów; u tych pacjentów należy kontrolować czynność wątroby.
- CHPL leku Polopiryna S, tabletki, 300 mgSpecjalne środki ostrozności
Przyjmowanie produktu w najmniejszej skutecznej dawce przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych. Kwas acetylosalicylowy należy odstawić na 5 do 7 dni przed planowanym zabiegiem chirurgicznym, ze względu na ryzyko wydłużonego czasu krwawienia zarówno w czasie jak i po zabiegu. Należy zachować ostrożność podczas stosowania z metotreksatem w dawkach mniejszych niż 15 mg na tydzień, ze względu na nasilenie toksycznego działania metotreksatu na szpik kostny. Jednoczesne stosowanie z metotreksatem w dawkach większych niż 15 mg na tydzień jest przeciwwskazane. Ostrożnie stosować w przypadku: krwotoków macicznych, nadmiernego krwawienia miesiączkowego, stosowania wewnątrzmacicznej wkładki antykoncepcyjnej, nadciśnienia tętniczego oraz niewydolności serca. Podczas leczenia kwasem acetylosalicylowym nie należy spożywać alkoholu, ze względu na zwiększone ryzyko wystąpienia uszkodzenia błony śluzowej przewodu pokarmowego.
- CHPL leku Polopiryna S, tabletki, 300 mgSpecjalne środki ostrozności
U pacjentów w podeszłym wieku produkt należy stosować w mniejszych dawkach i w większych odstępach czasowych, ze względu na zwiększone ryzyko występowania objawów niepożądanych w tej grupie pacjentów. Istnieją dowody na to, że leki hamujące cyklooksygenazę (enzym uczestniczący w syntezie prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
- CHPL leku Polopiryna S, tabletki, 300 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Leki przeciwwskazane do jednoczesnego stosowania z kwasem acetylosalicylowym: Metotreksat w dawkach 15 mg na tydzień lub większych Nasilenie toksycznego wpływu metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z produktami przeciwzapalnymi - w tym z kwasem acetylosalicylowym - oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza - patrz punkt 4.3). Interakcje wymagające zachowania szczególnej ostrożności: Metotreksat w dawkach mniejszych niż 15 mg na tydzień Nasilenie toksycznego wpływu metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z preparatami przeciwzapalnymi - w tym z kwasem acetylosalicylowym - oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza - patrz wyżej). Leki przeciwzakrzepowe, np. pochodne kumaryny, heparyna oraz trombolityczne np.
- CHPL leku Polopiryna S, tabletki, 300 mgInterakcje
streptokinaza i alteplaza lub inne leki hamujące agregację płytek krwi, np. tyklopidyna Jednoczesne stosowanie kwasu acetylosalicylowego z lekami przeciwzakrzepowymi oraz trombolitycznymi może powodować nasilenie działania przeciwzakrzepowego: zwiększone ryzyko wydłużenia czasu krwawienia i krwotoków, wynikające z wypierania leków przeciwzakrzepowych z ich połączeń z białkami osocza oraz właściwości antyagregacyjnych kwasu acetylosalicylowego. Inne niesteroidowe leki przeciwzapalne, w tym salicylany w dużych dawkach Jednoczesne stosowanie niesteroidowych leków przeciwzapalnych z kwasem acetylosalicylowym zwiększa ryzyko wystąpienia choroby wrzodowej i krwawień z przewodu pokarmowego oraz uszkodzenia nerek, na skutek synergistycznego działania tych leków. Selektywne inhibitory zwrotnego wychwytu serotoniny (SSRI) Zwiększone ryzyko krwawień z górnego odcinka przewodu pokarmowego na skutek synergistycznego działania tych leków.
- CHPL leku Polopiryna S, tabletki, 300 mgInterakcje
Leki zwiększające wydalanie kwasu moczowego z moczem, np. benzbromaron, probenecyd Kwas acetylosalicylowy stosowany jednocześnie z lekami zwiększającymi wydalanie kwasu moczowego, powoduje osłabienie działania leków przeciwdnawych (konkurencja w procesie wydalania kwasu moczowego przez kanaliki nerkowe). Digoksyna Jednoczesne stosowanie kwasu acetylosalicylowego z digoksyną powoduje zwiększenie stężenia digoksyny w osoczu, wynikające ze zmniejszonego wydalania digoksyny przez nerki. Leki przeciwcukrzycowe, np. insulina, pochodne sulfonylomocznika Ze względu na właściwości hipoglikemizujące oraz wypieranie pochodnych sulfonylomocznika z połączeń z białkami osocza, kwas acetylosalicylowy nasila działanie leków przeciwcukrzycowych. Leki moczopędne stosowane jednocześnie z kwasem acetylosalicylowym w dużych dawkach - osłabienie działania moczopędnego poprzez zatrzymanie sodu i wody w organizmie na skutek zmniejszenia filtracji kłębuszkowej, spowodowanej zmniejszoną syntezą prostaglandyn w nerkach.
- CHPL leku Polopiryna S, tabletki, 300 mgInterakcje
Kwas acetylosalicylowy może nasilać działanie ototoksyczne furosemidu. Glikokortykosteroidy podawane ogólnie, z wyjątkiem hydrokortyzonu stosowanego jako terapia zastępcza w chorobie Addisona Stosowane jednocześnie z kwasem acetylosalicylowym - zwiększone ryzyko wystąpienia choroby wrzodowej i krwawienia z przewodu pokarmowego oraz zmniejszenie stężenia salicylanów w osoczu w trakcie kortykoterapii i zwiększenie ryzyka przedawkowania salicylanów po zakończeniu przyjmowania glikokortykosteroidów. Inhibitory konwertazy angiotensyny (ACE) stosowane jednocześnie z kwasem acetylosalicylowym w dużych dawkach Zmniejszenie działania przeciwnadciśnieniowego poprzez zmniejszenie filtracji kłębuszkowej, wynikające z hamowania produkcji prostaglandyn, działających rozszerzająco na naczynia krwionośne. Kwas walproinowy Kwas acetylosalicylowy zwiększa toksyczność kwasu walproinowego, poprzez wypieranie go z połączeń z białkami osocza.
- CHPL leku Polopiryna S, tabletki, 300 mgInterakcje
Kwas walproinowy nasila działanie antyagregacyjne kwasu acetylosalicylowego ze względu na synergistyczne działanie antyagregacyjne obu leków. Alkohol Alkohol może zwiększyć ryzyko wystąpienia działań niepożądanych ze strony przewodu pokarmowego, tj. owrzodzenie błony śluzowej lub krwawienia. W trakcie leczenia nie należy spożywać alkoholu. Omeprazol i kwas askorbowy - nie wpływają na wchłanianie kwasu acetylosalicylowego. Acetazolamid Kwas acetylosalicylowy może w znacznym stopniu zwiększać stężenie, a tym samym toksyczność acetazolamidu.
- CHPL leku Polopiryna S, tabletki, 300 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na przebieg ciąży i (lub) rozwój zarodka oraz płodu. Dane pochodzące z badań epidemiologicznych wskazują na zwiększone ryzyko poronienia oraz występowania wad serca oraz wad przewodu pokarmowego, związane ze stosowaniem inhibitorów syntezy prostaglandyn we wczesnych tygodniach ciąży. Bezwzględne ryzyko występowania wad układu sercowo-naczyniowego zwiększało się w tych badaniach z wartości <1% do prawie 1,5%. Prawdopodobnie ryzyko występowania powyższych wad wrodzonych zwiększa się wraz ze stosowaniem większych dawek kwasu acetylosalicylowego, a także z wydłużaniem okresu terapii. U noworodków, których matki stosowały kwas acetylosalicylowy przed porodem, obserwowano nieprawidłowe krwawienia, takie jak: wylewy podspojówkowe, krwiomocz, wybroczyny, krwiak podokostnowy czaszki.
- CHPL leku Polopiryna S, tabletki, 300 mgWpływ na płodność, ciążę i laktację
W innym badaniu obserwowano częstsze występowanie krwawień wewnątrzczaszkowych u wcześniaków urodzonych przez matki, które stosowały kwas acetylosalicylowy na tydzień przed porodem. U zwierząt dawka śmiertelna dla płodu była większa niż dawki stosowane klinicznie. U zwierząt, którym podawano inhibitory syntezy prostaglandyn w okresie organogenezy obserwowano zwiększoną częstość występowania różnych wad wrodzonych, w tym wad układu sercowo-naczyniowego. Kwas acetylosalicylowy bardzo łatwo przenika przez barierę łożyskową. W pierwszych 6 miesiącach ciąży produkt leczniczy może być stosowany jedynie w przypadku zdecydowanej konieczności. Jeśli zachodzi potrzeba zastosowania kwasu acetylosalicylowego u kobiet, które właśnie zaszły w ciążę, bądź podczas pierwszego lub drugiego trymestru ciąży należy podawać najmniejszą skuteczną dawkę produktu przez możliwie najkrótszy okres czasu.
- CHPL leku Polopiryna S, tabletki, 300 mgWpływ na płodność, ciążę i laktację
W końcowych trzech miesiącach ciąży wszystkie inhibitory syntezy prostaglandyn mogą wpływać u płodu uszkadzająco: na układ krążenia (nadciśnienie płucne z przedwczesnym zamknięciem przewodu tętniczego Botalla); na nerki (może wystąpić niewydolność nerek i małowodzie). Wszystkie inhibitory syntezy prostaglandyn podawane kobietom w trzecim trymestrze ciąży mogą: powodować wydłużenie czasu krwawienia zarówno u matek jak i u noworodków oraz działanie antyagregacyjne, nawet podczas stosowania bardzo małych dawek; hamować kurczliwość macicy; taki wpływ na macicę związany był ze zwiększoną częstością występowania dystocji i opóźnionego porodu u zwierząt. W związku z tym kwas acetylosalicylowy jest przeciwwskazany w ostatnim trymestrze ciąży. Karmienie piersi? Produkt jest przeciwwskazany w okresie karmienia piersią. Płodność Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację.
- CHPL leku Polopiryna S, tabletki, 300 mgWpływ na płodność, ciążę i laktację
Działanie to jest przemijające i ustępuje po zakończeniu terapii.
- CHPL leku Polopiryna S, tabletki, 300 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brak wpływu.
- CHPL leku Polopiryna S, tabletki, 300 mgDziałania niepożądane
4.8 Działania niepożądane Po zastosowaniu kwasu acetylosalicylowego mogą wystąpić następujące działania niepożądane: Zaburzenia krwi i układu chłonnego małopłytkowość niedokrwistość wskutek mikrokrwawień z przewodu pokarmowego niedokrwistość hemolityczna u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej leukopenia agranulocytoza eozynopenia zwiększone ryzyko krwawień wydłużenie czasu krwawienia wydłużenie czasu protrombinowego Zaburzenia układu immunologicznego reakcje nadwrażliwości: wysypka, pokrzywka, obrzęk naczynioruchowy, skurcz oskrzeli, wstrząs Zaburzenia układu nerwowego szumy uszne (zazwyczaj jako objaw przedawkowania) zaburzenia słuchu zawroty głowy Zaburzenia serca niewydolność serca Zaburzenia naczyniowe nadciśnienie Zaburzenia żołądka i jelit niestrawność zgaga uczucie pełności w nadbrzuszu nudności wymioty brak łaknienia bóle brzucha krwawienia z przewodu pokarmowego uszkodzenie błony śluzowej żołądka uczynnienie choroby wrzodowej perforacje Owrzodzenie żołądka występuje u 15% pacjentów długotrwale przyjmujących kwas acetylosalicylowy.
- CHPL leku Polopiryna S, tabletki, 300 mgDziałania niepożądane
Zaburzenia wątroby i dróg żółciowych ogniskowa martwica komórek wątrobowych tkliwość i powiększenie wątroby, szczególnie u pacjentów z młodzieńczym reumatoidalnym zapaleniem stawów, układowym toczniem rumieniowatym, gorączką reumatyczną lub chorobą wątroby w wywiadzie przemijające zwiększenie aktywności aminotransferaz w surowicy, fosfatazy alkalicznej i stężenia bilirubiny Zaburzenia nerek i dróg moczowych białkomocz obecność leukocytów i erytrocytów w moczu martwica brodawek nerkowych śródmiąższowe zapalenie nerek Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Polopiryna S, tabletki, 300 mgDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: ndl@urpl.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Polopiryna S, tabletki, 300 mgPrzedawkowanie
4.9 Przedawkowanie Po przedawkowaniu kwasu acetylosalicylowego mogą wystąpić: nudności, wymioty, szumy uszne i przyspieszenie oddechu. Obserwowano również inne objawy, takie jak: utrata słuchu, zaburzenia widzenia, bóle głowy, pobudzenie ruchowe, senność i śpiączka, drgawki, hipertermia. W ciężkich zatruciach występują zaburzenia gospodarki kwasowo-zasadowej i wodno-elektrolitowej (kwasica metaboliczna i odwodnienie). Łagodne lub średnio ciężkie objawy działania toksycznego występują po zastosowaniu kwasu acetylosalicylowego w dawce 150-300 mg/kg mc. Ciężkie objawy zatrucia występują po zażyciu dawki 300-500 mg/kg mc. Potencjalnie śmiertelna dawka kwasu acetylosalicylowego jest większa niż 500 mg/kg mc. Zgon w przebiegu zatrucia kwasem acetylosalicylowym obserwowano po przyjęciu przez osoby dorosłe jednorazowej dawki 10-30 g. Postępowanie po przedawkowaniu: Pacjenta należy przewieźć do szpitala. Brak specyficznej odtrutki.
- CHPL leku Polopiryna S, tabletki, 300 mgPrzedawkowanie
Leczenie przedawkowania: Sprowokowanie wymiotów lub wykonanie płukania żołądka (w celu zmniejszenia wchłaniania). Takie postępowanie jest skuteczne w czasie 3-4 godzin po zażyciu kwasu acetylosalicylowego, a w przypadku dużej dawki nawet do 10 godzin. Podanie węgla aktywnego w postaci zawiesiny wodnej (50 do 100 g u dorosłych lub 30 do 60 g u dzieci). Obniżanie temperatury ciała (w przypadku hipertermii) poprzez utrzymywanie niskiej temperatury otoczenia oraz zastosowanie chłodnych okładów. Stałe kontrolowanie gospodarki wodno-elektrolitowej i wyrównywanie zaburzeń. W celu przyspieszenia wydalania kwasu acetylosalicylowego przez nerki oraz w leczeniu kwasicy należy podać dożylnie wodorowęglan sodu. U pacjentów z prawidłową czynnością nerek można zastosować diurezę alkaliczną aż do pH moczu w granicach 7,5-8. W ciężkich zatruciach można zastosować hemodializę lub dializę otrzewnową.
- CHPL leku Polopiryna S, tabletki, 300 mgPrzedawkowanie
Dializa skutecznie usuwa kwas acetylosalicylowy z organizmu oraz ułatwia wyrównanie zaburzeń gospodarki kwasowo-zasadowej i wodno-elektrolitowej. W przypadkach wydłużenia czasu protrombinowego podaje się witaminę K. Nie należy stosować leków działających hamująco na ośrodkowy układ nerwowy, np. barbituranów, ze względu na ryzyko zahamowania ośrodka oddechowego. Pacjentom z zaburzeniami oddychania należy podać tlen. Jeśli to konieczne, wykonać intubację dotchawiczą i zastosować oddech zastępczy. W przypadku występowania wstrząsu zastosować typowe postępowanie przeciwwstrząsowe. Należy uzupełniać płyny oraz prowadzić ogólne leczenie objawowe.
- CHPL leku Polopiryna S, tabletki, 300 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inne leki przeciwbólowe i przeciwgorączkowe, kwas salicylowy i jego pochodne, kod ATC: N02BA01. Kwas acetylosalicylowy należy do grupy niesteroidowych leków przeciwzapalnych (NLPZ). Jest estrem kwasu salicylowego o właściwościach przeciwbólowych, przeciwzapalnych i przeciwgorączkowych. Mechanizm działania kwasu acetylosalicylowego polega na hamowaniu syntezy prostaglandyn - prostaglandyny E2 (PGE2), prostaglandyny I2 (PGI2) oraz tromboksanu A2 - na skutek zahamowania cyklooksygenazy kwasu arachidonowego (hamowanie aktywności COX-1 i (lub) COX-2). Związki te indukują proces zapalny przez działanie leukotaktyczne, zwiększoną przepuszczalność naczyń, powstawanie obrzęku, zwiększenie wrażliwości receptorów bólu na działanie neuroprzekaźników (serotoniny, bradykininy, acetylocholiny). W podwzgórzu PGE2 jest silnym czynnikiem gorączkotwórczym i hamowanie jej wytwarzania hamuje powstawanie gorączki.
- CHPL leku Polopiryna S, tabletki, 300 mgWłaściwości farmakodynamiczne
NLPZ wykazują także działanie przeciwbólowe w słabych bólach nocyceptywnych i w bólach neurogennych wywołanych stanami zapalnymi (lub z innych przyczyn), w których szkodliwe bodźce pobudzają aktywność cyklooksygenazy, zwiększając wytwarzanie nadtlenków i prostaglandyn. Wiele danych wskazuje, że możliwy jest także ośrodkowy mechanizm działania przeciwbólowego niesteroidowych leków przeciwzapalnych. Kwas acetylosalicylowy hamuje również agregację płytek krwi. Nieodwracalne hamowanie cyklooksygenazy jest szczególnie wyraźne w płytkach krwi, ponieważ nie mogą one ponownie wytworzyć tego enzymu. Przypuszczalnie kwas acetylosalicylowy wywiera również inne działania hamujące na płytki krwi.
- CHPL leku Polopiryna S, tabletki, 300 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Kwas acetylosalicylowy wchłania się z przewodu pokarmowego w 80-100%. Pokarm nie zmniejsza dostępności biologicznej kwasu acetylosalicylowego, ale może wydłużyć czas wchłaniania. Szybkość wchłaniania kwasu acetylosalicylowego z form rozpuszczalnych jest większa niż z postaci konwencjonalnych. Działanie przeciwbólowe i przeciwgorączkowe kwasu acetylosalicylowego zastosowanego w postaci zawiesiny (po rozpuszczeniu tabletki w wodzie) rozpoczyna się po 30 minutach od chwili zastosowania, osiągając maksimum po 1-3 godzinach. Po zastosowaniu jednorazowej dawki utrzymuje się przez 3 do 6 godzin. Pełne działanie przeciwzapalne występuje w ciągu 1-4 dni leczenia. Dystrybucja Około 33% kwasu acetylosalicylowego wiąże się z białkami, jeśli stężenie w surowicy wynosi 120 μg/ml. Stopień wiązania z białkami zależy od stężenia albumin; u zdrowych osób zmniejsza się wraz ze zmniejszeniem tego stężenia.
- CHPL leku Polopiryna S, tabletki, 300 mgWłaściwości farmakokinetyczne
Powstały po hydrolizie kwas salicylowy ulega szybkiej dystrybucji w całym organizmie. Objętość dystrybucji kwasu salicylowego w stężeniu terapeutycznym wynosi około 0,15-0,2 l/kg mc. i zwiększa się wraz ze zwiększaniem stężenia w surowicy. Metabolizm Kwas acetylosalicylowy jest hydrolizowany w osoczu do kwasu salicylowego. Kwas salicylowy jest sprzęgany w wątrobie do kwasu salicylurowego, glukuronidu fenolowego i acylowego oraz wielu innych metabolitów. Eliminacja Okres półtrwania kwasu acetylosalicylowego w osoczu wynosi około 2-3 godzin, a kwasu salicylowego około 6 godzin. W przeciwieństwie do innych salicylanów, niezhydrolizowany kwas acetylosalicylowy nie kumuluje się w surowicy krwi po wielokrotnym podaniu. Tylko około 1% doustnej dawki kwasu acetylosalicylowego wydala się z moczem w postaci niezhydrolizowanej, pozostała część wydalana jest z moczem w postaci kwasu salicylowego i jego metabolitów.
- CHPL leku Polopiryna S, tabletki, 300 mgWłaściwości farmakokinetyczne
U pacjentów z prawidłową czynnością nerek, po jednorazowym podaniu kwasu acetylosalicylowego 80-100% dawki wydalane jest z moczem w ciągu 24-72 godzin.
- CHPL leku Polopiryna S, tabletki, 300 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Właściwości mutagenne i zdolność do pobudzania wzrostu guzów Kwas acetylosalicylowy podawany szczurom przez 68 tygodni w ilości 0,5% karmy, nie działał rakotwórczo. W teście Amesa kwas acetylosalicylowy nie działał mutagennie, jednak w hodowli fibroblastów ludzkich powodował aberracje chromosomalne. Toksyczny wpływ na reprodukcję W badaniach na zwierzętach kwas acetylosalicylowy wykazywał działanie teratogenne. Opisywano zaburzenia zagnieżdżenia się jaja, działanie embrio- i fetotoksyczne oraz trudności w uczeniu się u potomstwa, jeżeli lek został zastosowany przed porodem. Kwas acetylosalicylowy hamował owulację u szczurów. Badania związane ze stosowaniem u ludzi, patrz punkt 4.6. Toksyczność ostra Ostre zatrucie kończące się zgonem może wystąpić po przyjęciu jednej dawki większej niż 10 g kwasu acetylosalicylowego u dorosłych i większej niż 4 g u dzieci.
- CHPL leku Polopiryna S, tabletki, 300 mgPrzedkliniczne dane o bezpieczeństwie
Stężenia kwasu salicylowego w osoczu od 300 do 350 μg/ml mogą wywołać objawy zatrucia, a stężenia od około 400 do 500 μg/ml mogą prowadzić do stanów śpiączki kończących się zgonem. Toksyczność przewlekła Kwas acetylosalicylowy oraz jego metabolity wywierają działanie miejscowo drażniące na błony śluzowe. Jeżeli w obrębie przewodu pokarmowego występują wrzody, zwiększona możliwość krwawienia stwarza ryzyko poważnego krwotoku. Poza tymi działaniami niepożądanymi opisano również uszkodzenie nerek u zwierząt, u których przewlekle i doraźnie stosowano duże dawki kwasu acetylosalicylowego.
- CHPL leku Polopiryna S, tabletki, 300 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Skrobia kukurydziana Celuloza sproszkowana Celuloza mikrokrystaliczna 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem i wilgocią. 6.5 Rodzaj i zawartość opakowania Blistry z folii Aluminium/PVC/PVDC w tekturowym pudełku. Opakowanie zawiera 6, 10, 12, 20, 30 lub 40 tabletek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Bez specjalnych wymagań. Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć w sposób zgodny z lokalnymi przepisami.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ETOPIRYNA KONTROL, 300 mg + 50 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 300 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum), 50 mg kofeiny (Coffeinum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki Białe, okrągłe, obustronnie wypukłe tabletki o średnicy 11 mm
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgWskazania do stosowania
4.1 Wskazania do stosowania Ból o słabym lub średnim nasileniu, np.: ból głowy, bóle mięśniowe i stawów oraz inne. Gorączka w przebiegu przeziębienia, zakażeń wirusowych i innych chorób.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zwykle stosuje się: U dorosłych i młodzieży powyżej 16 lat: 1 do 2 tabletek, w razie konieczności dawkę jednorazową można powtarzać 3 razy na dobę, nie częściej niż co 4 godziny. Należy stosować najmniejszą skuteczną dawkę leku. Nie należy stosować więcej niż 6 tabletek na dobę (czyli 1800 mg kwasu acetylosalicylowego oraz 300 mg kofeiny). U pacjentów w podeszłym wieku należy zwiększyć odstępy między kolejnymi dawkami kwasu acetylosalicylowego (patrz punkt 4.4). Dzieci i młodzież poniżej 16 lat: Nie stosować u dzieci i młodzieży poniżej 16 lat, chyba że lekarz zaleci inaczej. Sposób podawania Produkt należy przyjmować doustnie, najlepiej w czasie posiłku, popijając obficie wodą. Produktu nie należy stosować dłużej niż 3 dni bez konsultacji z lekarzem.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nadwrażliwość na kwas acetylosalicylowy występuje u 0,3% populacji, w tym u 20% chorych na astmę oskrzelową lub przewlekłą pokrzywkę. Objawy nadwrażliwości: pokrzywka, a nawet wstrząs, mogą wystąpić w ciągu 3 godzin od przyjęcia kwasu acetylosalicylowego. Nadwrażliwość na inne niesteroidowe leki przeciwzapalne przebiegająca z objawami, takimi jak: skurcz oskrzeli, alergiczne zapalenie błony śluzowej nosa, wstrząs. Astma oskrzelowa, przewlekłe schorzenia układu oddechowego, gorączka sienna lub obrzęk błony śluzowej nosa, gdyż pacjenci z tymi schorzeniami mogą reagować na niesteroidowe leki przeciwzapalne napadami astmy, ograniczonym obrzękiem skóry i błony śluzowej (obrzęk naczynioruchowy) lub pokrzywką, częściej niż inni pacjenci.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgPrzeciwwskazania
Czynna choroba wrzodowa żołądka i (lub) dwunastnicy oraz stany zapalne lub krwawienia z przewodu pokarmowego (może dojść do wystąpienia krwawienia z przewodu pokarmowego lub uczynnienia choroby wrzodowej). Ciężka niewydolność wątroby lub nerek, ciężkie uszkodzenie nerek. Ciężka niewydolność serca. Zaburzenia krzepnięcia krwi (np. hemofilia, małopłytkowość) oraz jednoczesne leczenie środkami przeciwzakrzepowymi (np. pochodne kumaryny, heparyna). Niedobór dehydrogenazy glukozo-6-fosforanowej. Dna moczanowa w wywiadzie. Jednoczesne stosowanie z metotreksatem w dawkach 15 mg tygodniowo lub większych, ze względu na mielotoksyczność (patrz punkt 4.5). Stosowanie u dzieci i młodzieży w wieku poniżej 16 lat, chyba że lekarz zaleci inaczej. Ostatni trymestr ciąży i okres karmienia piersią.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Przyjmowanie leku w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych. Długotrwałe stosowanie leku może być szkodliwe, dlatego powinno być pod nadzorem lekarza. Podczas długotrwałego leczenia dużymi dawkami kwasu acetylosalicylowego może wystąpić niedokrwistość z niedoboru żelaza lub działania niepożądane ze strony nerek; należy okresowo kontrolować czynność nerek i hematokryt. Produktu nie należy stosować u pacjentów przyjmujących doustne leki przeciwcukrzycowe z grupy sulfonylomocznika, ze względu na ryzyko nasilenia działania hipoglikemizującego. Produktu nie należy stosować u chorych przyjmujących leki przeciw dnie. Kwas acetylosalicylowy, nawet w małych dawkach, zmniejsza wydalanie kwasu moczowego. U pacjentów predysponowanych produkt może wywoływać napady dny moczanowej.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgSpecjalne środki ostrozności
Ponieważ kwas acetylosalicylowy i jego metabolity wydalają się z moczem, istnieje większe ryzyko wystąpienia działań niepożądanych u pacjentów z zaburzeniami czynności nerek i z przewlekłą niewydolnością nerek. U pacjentów z młodzieńczym reumatoidalnym zapaleniem stawów, z układowym toczniem rumieniowatym, ze współistniejącym uszkodzeniem wątroby zwiększa się toksyczność salicylanów - u tych pacjentów należy wykonać próby czynnościowe wątroby. Lek stosować ostrożnie u pacjentów z hipoprotrombinemią w wywiadzie, niedoborem witaminy K, trombocytopenią i leczonych produktami działającymi przeciwkrzepliwie. Ostrożnie stosować w przypadku: krwotoków macicznych, nadmiernego krwawienia miesiączkowego, stosowania wewnątrzmacicznej wkładki antykoncepcyjnej, nadciśnienia tętniczego oraz niewydolności serca. Kwas acetylosalicylowy należy odstawić na 5-7 dni przed planowanym zabiegiem operacyjnym, z uwagi na zmniejszenie krzepliwości krwi i zwiększone ryzyko krwawienia.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgSpecjalne środki ostrozności
Zachować ostrożność podczas stosowania z metotreksatem w dawkach mniejszych niż 15 mg/tydzień, ze względu na nasilenie toksycznego działania metotreksatu na szpik kostny. Jednoczesne stosowanie z metotreksatem w dawkach większych niż 15 mg/tydzień jest przeciwwskazane. Podczas leczenia kwasem acetylosalicylowym nie należy pić alkoholu, ponieważ istnieje większe ryzyko wystąpienia działań niepożądanych na przewód pokarmowy. U pacjentów w podeszłym wieku należy zwiększyć odstępy między kolejnymi dawkami kwasu acetylosalicylowego. U pacjentów tych częściej występuje podrażnienie błony śluzowej żołądka i krwawienia z przewodu pokarmowego. Może się również zmienić farmakokinetyka kwasu acetylosalicylowego. Produkt może powodować zaburzenia płodności u kobiet przez wpływ na owulację (patrz punkt 4.6). Nie należy stosować produktów zawierających kwas acetylosalicylowy u kobiet w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne (patrz punkt 4.6).
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgSpecjalne środki ostrozności
W przebiegu niektórych chorób wirusowych, szczególnie w przypadku zakażenia wirusem grypy typu A, wirusem grypy typu B lub ospy wietrznej, głównie u dzieci i młodzieży, istnieje ryzyko wystąpienia zespołu Reye’a - rzadkiej, ale zagrażającej życiu choroby. Występowanie uporczywych wymiotów w przebiegu infekcji może wskazywać na wystąpienie zespołu Reye’a, co wymaga natychmiastowej pomocy medycznej. Ryzyko wystąpienia zespołu Reye’a w przebiegu infekcji wirusowych może wzrosnąć, jeśli jednocześnie podaje się kwas acetylosalicylowy, chociaż związek przyczynowy nie został udowodniony. Z ww. względów u dzieci poniżej 16. roku życia nie należy stosować produktów zawierających kwas acetylosalicylowy, a u młodzieży powyżej 16. roku życia można stosować produkty zawierające kwas acetylosalicylowy wyłącznie na zlecenie lekarza. Produkt należy stosować ostrożnie u pacjentów pobudzonych psychoruchowo lub cierpiących na bezsenność.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgSpecjalne środki ostrozności
Podczas stosowania tego produktu należy unikać nadmiernego spożywania kofeiny (np. kawa, herbata i napoje w puszkach).
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Kwas acetylosalicylowy Inhibitory konwertazy angiotensyny (ACE): Produkt może zmniejszać działanie przeciwnadciśnieniowe inhibitorów konwertazy angiotensyny. Acetazolamid: Kwas acetylosalicylowy może w znacznym stopniu zwiększać stężenie, a tym samym toksyczność acetazolamidu. Leki przeciwzakrzepowe (np. heparyna, warfaryna): Jednoczesne stosowanie z lekami przeciwzakrzepowymi może spowodować nasilenie działania przeciwzakrzepowego. Kwas acetylosalicylowy może wypierać warfarynę z połączeń białkowych, prowadząc do wydłużenia czasu protrombinowego i czasu krwawienia. Produkt może nasilać działanie przeciwzakrzepowe heparyny, zwiększając tym samym ryzyko krwawienia. Leki przeciwpadaczkowe: Kwas acetylosalicylowy nasila działanie toksyczne kwasu walproinowego, zaś kwas walproinowy nasila działanie antyagregacyjne kwasu acetylosalicylowego.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgInterakcje
Beta-adrenolityki: Kwas acetylosalicylowy może zmniejszać działanie hipotensyjne beta-adrenolityków. Leki moczopędne: Produkt może zmniejszyć skuteczność leków moczopędnych oraz nasilać ototoksyczność furosemidu. Metotreksat: Kwas acetylosalicylowy nasila toksyczne działanie metotreksatu na szpik kostny. Stosowanie produktu jednocześnie z metotreksatem w dawkach 15 mg na tydzień lub większych jest przeciwwskazane. Niesteroidowe leki przeciwzapalne: Jednoczesne stosowanie salicylanów i innych niesteroidowych leków przeciwzapalnych nie jest zalecane, ze względu na zwiększone ryzyko występowania działań niepożądanych ze strony przewodu pokarmowego. Glikokortykosteroidy stosowane układowo: Z wyjątkiem hydrokortyzonu jako terapii zastępczej w chorobie Addisona, glikokortykosteroidy podawane jednocześnie z salicylanami zwiększają ryzyko wystąpienia choroby wrzodowej i krwawienia z przewodu pokarmowego oraz zmniejszają stężenie salicylanów w osoczu w trakcie terapii, zaś po jej zakończeniu zwiększa się ryzyko przedawkowania salicylanów.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgInterakcje
Leki przeciwcukrzycowe: Produkt może nasilać działanie hipoglikemizujące leków przeciwcukrzycowych. Produktu nie należy stosować jednocześnie z pochodnymi sulfonylomocznika. Leki zwiększające wydalanie kwasu moczowego (np. probenecyd, sulfinpirazon): Salicylany osłabiają działanie leków zwiększających wydalanie kwasu moczowego. Produktu nie należy stosować jednocześnie z lekami przeciw dnie. Digoksyna: Produkt może nasilać działanie digoksyny. Leki trombolityczne: Produkt może nasilać działanie leków trombolitycznych, takich jak streptokinaza i alteplaza. Alkohol: Alkohol zwiększa częstość i nasilenie krwawień z przewodu pokarmowego spowodowanych przez kwas acetylosalicylowy. W trakcie leczenia nie należy spożywać alkoholu. Omeprazol i kwas askorbowy: Omeprazol i kwas askorbowy nie wpływają na wchłanianie kwasu acetylosalicylowego.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgInterakcje
Ibuprofen: Dane doświadczalne wskazują na możliwość hamowania przez ibuprofen wpływu małych dawek kwasu acetylosalicylowego na agregację płytek krwi w przypadku jednoczesnego podawania obu leków. Z uwagi jednak na ograniczone dane oraz wątpliwości związane z ekstrapolacją danych uzyskanych ex vivo do warunków klinicznych, nie można wyciągnąć jednoznacznych wniosków dotyczących regularnego stosowania ibuprofenu, a w przypadku doraźnego stosowania ibuprofenu nie przewiduje się istotnej klinicznie interakcji (patrz punkt 5.1). Selektywne inhibitory zwrotnego wychwytu serotoniny (SSRI): Zwiększone ryzyko krwawień z górnego odcinka przewodu pokarmowego na skutek synergistycznego działania tych leków. Kofeina Doustne środki antykoncepcyjne, cymetydyna i disulfiram: zwalniają metabolizm kofeiny. Barbiturany: przyspieszają metabolizm kofeiny. Leki pobudzające (analeptyki) i ergotamina: produkt może nasilać działanie innych leków pobudzających i ergotaminy.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na ciążę i (lub) rozwój zarodka lub płodu. Wyniki badań epidemiologicznych wskazują na to, że stosowanie inhibitorów syntezy prostaglandyn we wczesnym okresie ciąży zwiększa ryzyko poronienia, występowania wad wrodzonych serca i wytrzewień wrodzonych. Całkowite ryzyko wystąpienia wrodzonych wad sercowo-naczyniowych zwiększa się z mniej niż 1% do około 1,5%. Uważa się, że ryzyko zwiększa się wraz z dawką i długością okresu terapii. U zwierząt, po podaniu inhibitorów syntezy prostaglandyn zaobserwowano zwiększone ryzyko obumarcia zapłodnionego jaja w okresie przed i po zagnieżdżeniu się w macicy oraz zwiększone ryzyko obumarcia zarodka lub płodu. Dodatkowo, u zwierząt, po podaniu inhibitorów syntezy prostaglandyn w okresie organogenezy, donoszono o zwiększonej ilości przypadków różnych wad rozwojowych, w tym wad sercowo-naczyniowych.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgWpływ na płodność, ciążę i laktację
Nie należy stosować produktów zawierających kwas acetylosalicylowy u kobiet w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. W razie stosowania kwasu acetylosalicylowego przez kobiety usiłujące zajść w ciążę lub w pierwszym i drugim trymestrze ciąży, należy stosować jak najmniejszą dawkę leku przez jak najkrótszy czas. W trzecim trymestrze ciąży wszystkie inhibitory syntezy prostaglandyn mogą powodować narażenie płodu na: działania toksyczne na układ krążenia i oddechowy (włącznie z przedwczesnym zamknięciem przewodu tętniczego i nadciśnieniem płucnym), zaburzenia czynności nerek mogące prowadzić do niewydolności nerek i małowodzia. W końcowym okresie ciąży wszystkie inhibitory prostaglandyn mogą spowodować narażenie matki i noworodka na: możliwość wydłużenia czasu krwawienia oraz działanie antyagregacyjne, które może ujawnić się nawet po zastosowaniu małych dawek, zahamowanie czynności skurczowej macicy prowadzącej do opóźnienia porodu lub przedłużenia akcji porodowej.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgWpływ na płodność, ciążę i laktację
W związku z tym kwas acetylosalicylowy jest przeciwwskazany w trzecim trymestrze ciąży. Karmienie piersi? Produkt jest przeciwwskazany w okresie karmienia piersią. Płodność Istnieją dowody na to, że leki hamujące cyklooksygenazę (enzym uczestniczący w syntezie prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brak wpływu.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgDziałania niepożądane
4.8 Działania niepożądane Po zastosowaniu kwasu acetylosalicylowego mogą wystąpić następujące objawy niepożądane: Zaburzenia krwi i układu chłonnego Małopłytkowość Niedokrwistość wskutek mikrokrwawień z przewodu pokarmowego Niedokrwistość hemolityczna u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej Leukopenia Agranulocytoza Eozynopenia Zwiększone ryzyko krwawień Wydłużenie czasu krwawienia Wydłużenie czasu protrombinowego Niedokrwistość z niedoboru żelaza potwierdzona wynikami badań laboratoryjnych i objawami klinicznymi Hemoliza Zaburzenia układu immunologicznego Reakcje nadwrażliwości (wysypka, pokrzywka, świąd) Obrzęk alergiczny i obrzęk naczynioruchowy Skurcz oskrzeli Reakcje anafilaktyczne Wstrząs anafilaktyczny potwierdzony wynikami badań laboratoryjnych i objawami klinicznymi Nadwrażliwość na kwas acetylosalicylowy występuje u 0,3% populacji oraz u 20% chorych na astmę oskrzelową lub przewlekłą pokrzywkę Objawy nadwrażliwości: pokrzywka, a nawet wstrząs mogą wystąpić w ciągu 3 godzin od chwili przyjęcia leku Zaburzenia układu nerwowego Krwotok mózgowy i wewnątrzczaszkowy Zawroty głowy Długotrwałe przyjmowanie leków zawierających kwas acetylosalicylowy może być przyczyną bólu głowy, który nasila się podczas przyjmowania kolejnych dawek Zaburzenia oka Zaburzenia widzenia Zaburzenia ucha i błędnika Szumy uszne Odwracalna utrata słuchu Szum i dzwonienie w uszach są pierwszymi objawami zatrucia salicylanami Zaburzenia serca Niewydolność serca Obrzęk Niewydolność krążeniowo-oddechowa Zaburzenia naczyniowe Nadciśnienie Krwotoki okołooperacyjne krwotoki Krwiaki Krwotoki do mięśni Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Obrzęk płuc pochodzenia pozasercowego (występuje głównie w przewlekłym lub ostrym zatruciu) Krwawienie z nosa Zespół astmy aspirynowej Zapalenie śluzówki nosa Przekrwienie błony śluzowej nosa Zaburzenia żołądka i jelit Niestrawność Zgaga Uczucie pełności w nadbrzuszu Nudności Wymioty Brak łaknienia Bóle brzucha Krwawienia z przewodu pokarmowego Uszkodzenie błony śluzowej żołądka Uczynnienie choroby wrzodowej Perforacje Krwawienie dziąseł Stany zapalne przewodu pokarmowego Owrzodzenie żołądka występuje u 15% pacjentów długotrwale przyjmujących kwas acetylosalicylowy Zaburzenia wątroby i dróg żółciowych Ogniskowa martwica komórek wątrobowych Tkliwość i powiększenie wątroby, szczególnie u pacjentów z młodzieńczym reumatoidalnym zapaleniem stawów, układowym toczniem rumieniowatym, gorączką reumatyczną lub chorobą wątroby w wywiadzie Przemijające zwiększenie aktywności aminotransferaz w surowicy Fosfatazy alkalicznej i stężenia bilirubiny Zaburzenia skóry i tkanki podskórnej Wykwity skórne różnego rodzaju Rzadko pęcherze lub plamica Zaburzenia nerek i dróg moczowych Białkomocz Obecność leukocytów i erytrocytów w moczu Nefropatia z martwicą brodawek nerkowych Śródmiąższowe zapalenie nerek Krwotoki z układu moczowo-płciowego Zaburzenia czynności nerek Ostra niewydolność nerek W przypadku przedawkowania: znaczne obniżenie klirensu kreatyniny lub ostra martwica kanalików nerkowych z zaburzeniami czynności nerek Zaburzenia ogólne i stany w miejscu podania Gorączka Działaniami niepożądanymi spowodowanymi przez kofeinę mogą być: Ból głowy Bezsenność Niemożność skupienia uwagi Drżenie rąk Zaburzenia ze strony układu pokarmowego (biegunka, nudności, wymioty) Kofeina może spowodować uzależnienie.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: ndl@urpl.gov.pl
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgPrzedawkowanie
4.9 Przedawkowanie Pierwszymi objawami zatrucia kwasem acetylosalicylowym są nudności, wymioty, szumy uszne i przyspieszenie oddechu. Obserwowano również inne objawy, takie jak: utrata słuchu, zaburzenia widzenia, bóle głowy, pobudzenie ruchowe, senność i śpiączkę, drgawki, hipertermię. W ciężkich zatruciach występują poważne zaburzenia gospodarki kwasowo-zasadowej i wodno-elektrolitowej (kwasica metaboliczna i odwodnienie). Łagodne lub średnio ciężkie objawy działania toksycznego występują po zastosowaniu kwasu acetylosalicylowego w dawce 150-300 mg/kg mc. Ciężkie objawy zatrucia występują po dawce 300-500 mg/kg mc. Potencjalnie śmiertelna dawka kwasu acetylosalicylowego jest większa niż 500 mg/kg mc. Zgon w przebiegu zatrucia kwasem acetylosalicylowym obserwowano po przyjęciu przez osoby dorosłe jednorazowej dawki leku wynoszącej od 10 do 30 g. Opisano również przypadek pacjenta, który przeżył po przyjęciu 130 g kwasu acetylosalicylowego.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgPrzedawkowanie
Leczenie przedawkowania Nie ma specyficznej odtrutki na kwas acetylosalicylowy. W razie zatrucia kwasem acetylosalicylowym należy: Sprowokować wymioty i przeprowadzić płukanie żołądka (w celu zmniejszenia wchłaniania leku). Takie postępowanie jest skuteczne w czasie 3-4 godzin po przyjęciu leku, a w razie zatrucia bardzo dużą dawką leku nawet do 10 godzin. Podać węgiel aktywny w postaci wodnej zawiesiny (w dawce 50-100 g u dorosłych, i 30-60 g u dzieci), aby zmniejszyć wchłanianie kwasu acetylosalicylowego. W przypadku hipertermii należy obniżyć temperaturę ciała przez utrzymywanie niskiej temperatury otoczenia oraz zastosowanie chłodnych okładów. Należy ściśle monitorować zaburzenia gospodarki wodno-elektrolitowej i szybko wyrównywać. W celu przyspieszenia wydalania kwasu acetylosalicylowego przez nerki oraz w leczeniu kwasicy należy podać dożylnie wodorowęglan sodowy. Należy utrzymywać pH moczu w granicach 7,0-7,5.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgPrzedawkowanie
W bardzo ciężkich zatruciach, gdy nie udaje się wyrównać zaburzeń gospodarki kwasowo-zasadowej leczeniem zachowawczym oraz w przypadkach współwystępującej niewydolności nerek należy zastosować hemodializę lub dializę otrzewnową. Dializa skutecznie usuwa kwas acetylosalicylowy z organizmu oraz ułatwia wyrównanie zaburzeń gospodarki kwasowo-zasadowej i wodno-elektrolitowej. W przypadkach wydłużenia się czasu protrombinowego podaje się witaminę K. Nie należy stosować leków działających hamująco na ośrodkowy układ nerwowy, np. barbituranów, z uwagi na możliwość wystąpienia kwasicy oddechowej i śpiączki. Pacjentom z zaburzeniami oddechu należy zapewnić dopływ świeżego powietrza, podać tlen. Jeśli konieczne, wykonać intubację wewnątrztchawiczą i zastosować oddech wspomagany. W przypadku wstrząsu zastosować typowe postępowanie przeciwwstrząsowe. Objawami przedawkowania kofeiny są: bezsenność, zmęczenie, drżenie mięśni, majaczenie, tachykardia, skurcze dodatkowe, drgawki.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgPrzedawkowanie
Brak specyficznej odtrutki. W razie przedawkowania należy zastosować leczenie objawowe.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inne leki przeciwbólowe, przeciwgorączkowe, kwas acetylosalicylowy, produkty złożone z wyjątkiem psycholeptyków. Kod ATC: N02BA51 Etopiryna Kontrol jest produktem złożonym z kwasu acetylosalicylowego i kofeiny. Kwas acetylosalicylowy działa przeciwbólowo, przeciwzapalnie i przeciwgorączkowo. Mechanizm działania kwasu acetylosalicylowego nie został w pełni wyjaśniony, ale wydaje się być zasadniczo związany z hamowaniem syntezy prostaglandyn w tkankach, co następuje w wyniku nieodwracalnej acetylacji oraz inaktywacji cyklooksygenazy - enzymu katalizującego powstawanie prekursorów prostaglandyn (endonadtlenków) z kwasu arachidonowego. Przeciwgorączkowe działanie kwasu acetylosalicylowego polega na hamowaniu syntezy prostaglandyn w OUN. Uważa się, że prostaglandyny są jednym z mediatorów odpowiedzialnym za powstawanie gorączki. Kwas acetylosalicylowy hamuje również agregację płytek krwi.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgWłaściwości farmakodynamiczne
Oba te związki mają duże znaczenie w procesach oksydacyjno-redukcyjnych zachodzących w organizmie. Dane z badań doświadczalnych wskazują na to, że ibuprofen może hamować wpływ małych dawek kwasu acetylosalicylowego na agregację płytek krwi w przypadku jednoczesnego podawania obu leków. W jednym z badań po podaniu pojedynczej dawki ibuprofenu 400 mg w ciągu 8 godzin przed lub w ciągu 30 minut po podaniu kwasu acetylosalicylowego w postaci farmaceutycznej o natychmiastowym uwalnianiu (81 mg), odnotowano osłabienie wpływu kwasu acetylosalicylowego na powstawanie tromboksanu lub agregację płytek. Z uwagi jednak na ograniczenia tych danych oraz wątpliwości związane z ekstrapolacją danych uzyskanych ex vivo do warunków klinicznych, nie można wyciągnąć jednoznacznych wniosków dotyczących regularnego stosowania ibuprofenu, a w przypadku doraźnego stosowania ibuprofenu nie przewiduje się istotnej klinicznie interakcji. Kofeina jest analeptykiem, pobudza ośrodek oddechowy i naczynioruchowy.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgWłaściwości farmakodynamiczne
Nasila działanie przeciwbólowe kwasu acetylosalicylowego. Mechanizm działania kofeiny oparty jest na uruchomieniu i przenoszeniu wewnątrzkomórkowo Ca2+, akumulacji cyklicznych nukleotydów i blokady receptora adenozyne.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Lek wchłania się z przewodu pokarmowego w 80-100%. Pokarm nie zmniejsza dostępności biologicznej kwasu acetylosalicylowego, ale może przedłużyć jego wchłanianie. Szybkość wchłaniania kwasu acetylosalicylowego z form rozpuszczalnych jest większa niż z postaci konwencjonalnych. W rzeczywistości dostępność biologiczna kwasu acetylosalicylowego jest mniejsza, ponieważ lek jest częściowo hydrolizowany w śluzówce przewodu pokarmowego podczas wchłaniania i podczas pierwszego przejścia przez wątrobę. Działanie przeciwbólowe i przeciwgorączkowe następuje, jeśli stężenie kwasu acetylosalicylowego w surowicy wynosi 30-100 μg/ml. Działanie przeciwbólowe i przeciwgorączkowe kwasu acetylosalicylowego stosowanego w formie tabletek rozpuszczalnych rozpoczyna się po 30 minutach od chwili zastosowania, osiągając maksimum po 1-3 h. Po zastosowaniu pojedynczej dawki utrzymuje się przez 3-6 h.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgWłaściwości farmakokinetyczne
Kofeina szybko wchłania się z przewodu pokarmowego, stężenie maksymalne występuje po 1-2 godzinach; okres półtrwania w surowicy wynosi od 3 do 7 godzin. Dystrybucja Kwas acetylosalicylowy szybko i w znacznym stopniu rozmieszcza się w większości tkanek i płynów ustrojowych. Objętość dystrybucji kwasu acetylosalicylowego w stężeniu terapeutycznym wynosi około 0,15-0,2 l/kg/mc. i zwiększa się wraz ze wzrostem jego stężenia w surowicy. Około 33% niezhydrolizowanego leku wiąże się z białkami, jeśli stężenie w surowicy wynosi 120 μg/ml. Stopień wiązania leku z białkami zależy od stężenia albumin; u zdrowych osobników zmniejsza się wraz z obniżeniem się tego stężenia. W niewydolności nerek, w ciąży i u noworodków wiązanie się kwasu acetylosalicylowego z białkami osocza zmniejsza się nie tylko z powodu hipoalbuminemii, ale także wskutek kumulowania się czynników endogennych, które wypierają lek z wiązań z białkami. Kofeina łatwo przenika do wszystkich narządów i tkanek.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgWłaściwości farmakokinetyczne
Przenika do mleka kobiecego, płynu mózgowo-rdzeniowego, przekracza barierę łożyska. W około 17% wiąże się z białkami surowicy krwi. Metabolizm Kwas acetylosalicylowy jest częściowo metabolizowany podczas wchłaniania. Proces ten zachodzi pod wpływem esterazy, głównie w wątrobie, ale także w surowicy krwi, erytrocytach i w mazi stawowej (w mazi stawowej postępuje znacznie wolniej niż w innych tkankach, prawdopodobnie ze względu na mniejszą aktywność esterazy). Salicylany sprzęgają się głównie z glicyną do kwasu salicylurowego i z kwasem glukuronowym do glukuronianu salicylo-fenolowego i salicylo-acylowego; tylko niewielka ich część ulega hydroksylacji do kwasu gentyzynowego, kwasu 2,3-dwuhydroksybenzoesowego i 2,3,5-trójhydroksybenzoesowego. U kobiet proces hydroksylacji zachodzi wolniej (niższy poziom esterazy w surowicy krwi). Kofeina metabolizowana jest w wątrobie na drodze demetylacji i utleniania do 1-metyloksantyny, 7-metyloksantyny, kwasu 1-metylomoczowego.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgWłaściwości farmakokinetyczne
Eliminacja Okres półtrwania kwasu acetylosalicylowego w osoczu wynosi około 15 do 20 minut. Okres półtrwania salicylanów w osoczu wynosi około 2-3 godzin, a kwasu salicylowego około 6 godzin. Ponieważ metabolizm salicylanów ulega wysyceniu, podczas stosowania dużych dawek okres półtrwania może przedłużyć się do 15-30 godzin. W przeciwieństwie do innych salicylanów, niezhydrolizowany kwas acetylosalicylowy nie kumuluje się w surowicy krwi po wielokrotnym podaniu. Tylko około 1% doustnej dawki kwasu acetylosalicylowego wydala się z moczem jako niezhydrolizowany lek, pozostała część wydala się z moczem w postaci salicylanów i ich metabolitów. U pacjentów z prawidłową czynnością nerek 80-100% pojedynczej dawki leku wydala się z moczem w ciągu 24-72 godzin. Kofeina i jej metabolity wydalane są przez nerki z moczem. Okres półtrwania kofeiny wynosi 3-7 godzin. Tylko 5-20% jest wydalane z moczem w postaci niezmienionej.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Właściwości mutagenne i zdolność do pobudzania wzrostu guzów Kwas acetylosalicylowy podawany szczurom przez 68 tygodni w ilości 0,5% karmy, nie działał rakotwórczo. W teście Amesa kwas acetylosalicylowy nie działał mutagennie, jednak w hodowli fibroblastów ludzkich powodował aberracje chromosomalne. Toksyczny wpływ na reprodukcję W badaniach na zwierzętach kwas acetylosalicylowy wykazywał działanie teratogenne. Opisywano zaburzenia zagnieżdżenia się jaja, działanie embrio- i fetotoksyczne oraz trudności w uczeniu się u potomstwa, jeżeli lek został zastosowany przed porodem. Kwas acetylosalicylowy hamował owulację u szczurów. Badania związane ze stosowaniem u ludzi, patrz punkt 4.6. Toksyczność ostra Ostre zatrucie kończące się zgonem może wystąpić po przyjęciu jednej dawki większej niż 10 g kwasu acetylosalicylowego u dorosłych i większej niż 4 g u dzieci.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgPrzedkliniczne dane o bezpieczeństwie
Stężenia kwasu salicylowego w osoczu od 300 do 350 μg/ml mogą wywołać objawy zatrucia, a stężenia od około 400 do 500 μg/ml mogą prowadzić do stanów śpiączki kończących się zgonem. Toksyczność przewlekła Kwas acetylosalicylowy oraz jego metabolity wywierają działanie miejscowo drażniące na błony śluzowe. Jeżeli w obrębie przewodu pokarmowego występują wrzody, zwiększona możliwość krwawienia stwarza ryzyko poważnego krwotoku. Poza tymi działaniami niepożądanymi opisano również uszkodzenie nerek u zwierząt, u których przewlekle i doraźnie stosowano duże dawki kwasu acetylosalicylowego. Dawka toksyczna kofeiny dla dorosłych jest większa niż 1 g. Dawka śmiertelna kofeiny po podaniu doustnym dla dorosłych wynosi 18-50 g.
- CHPL leku Etopiryna Kontrol, tabletki, 300 mg + 50 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Skrobia żelowana Celuloza mikrokrystaliczna 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25ºC. Przechowywać w oryginalnym opakowaniu. 6.5 Rodzaj i zawartość opakowania Blistry z folii Aluminium/PVC/PVDC w tekturowym pudełku. 10 tabletek 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Bez specjalnych wymagań.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA WŁASNA PRODUKTU LECZNICZEGO UPSARIN C, 330 mg + 200 mg, tabletki musujące 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Kwas acetylosalicylowy (Acidum acetylsalicylicum) 330 mg Kwas askorbowy (Acidum ascorbicum) 200 mg Pełny wykaz substancji pomocniczych, patrz punkt 6.1 3. POSTAĆ FARMACEUTYCZNA Tabletka musująca
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgWskazania do stosowania
4.1 Wskazania do stosowania Leczenie objawowe grypy, przeziębienia. Stany gorączkowe. Bóle różnego pochodzenia (bóle głowy, stawów mięśni, zębów, nerwobóle).
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgDawkowanie
4.2 Dawkowanie i sposób podawania Lek jest zalecany dla dorosłych i dzieci w wieku powyżej 12 lat. Sposób podawania Preparat jest podawany doustnie. Tabletkę należy rozpuścić w szklance wody, mleka lub soku owocowego i natychmiast po rozpuszczeniu wypić. Przyjmować po posiłkach. Dawkowanie Dorośli: 1 do 2 tabletek jednorazowo. W razie konieczności dawkę można powtarzać co 4 do 8 godzin. Maksymalna dawka dobowa dla dorosłych wynosi 3 g kwasu acetylosalicylowego i 1 g kwasu askorbowego. Nie należy stosować dawki większej niż 5 tabletek na dobę, ze względu na zawartość witaminy C. Osoby w podeszłym wieku: 1 do 2 tabletek jednorazowo. Maksymalna dawka dobowa dla osób w podeszłym wieku wynosi 2 g kwasu acetylosalicylowego i 1 g kwasu askorbowego. Nie należy stosować dawki większej niż 5 tabletek na dobę. Dzieci w wieku od 12 do 15 lat: 1 tabletka jednorazowo. W razie konieczności dawkę można powtórzyć co 4 do 8 godzin.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgDawkowanie
Maksymalna dawka dobowa kwasu acetylosalicylowego wynosi 50 mg/kg mc. Nie należy stosować dawki większej niż 5 tabletek na dobę. Częstość stosowania preparatu: Regularne podawanie preparatu pozwoli uniknąć wahań w natężeniu bólu i gorączki. Przerwy między kolejnymi dawkami powinny wynosić co najmniej 4 godziny. Ze względu na zawartość witaminy C nie zaleca się zażywania leku wieczorem. Jeśli pomimo przyjmowania preparatu dolegliwości bólowe utrzymują się ponad 5 dni lub gorączka ponad 3 dni należy zasięgnąć porady lekarza.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgPrzeciwwskazania
4.3 Przeciwwskazania Lek jest przeciwwskazany w następujących przypadkach: Czynna choroba wrzodowa żołądka lub dwunastnicy. Skazy krwotoczne i zaburzenia krzepnięcia krwi. Ostatni trymestr ciąży (patrz: punkt 4.6 Ciąża i laktacja), okres okołoporodowy. Okres karmienia piersią (patrz: punkt 4.6 Ciąża i laktacja). Dna moczanowa. Czynne krwawienie: do jamy ciała, do ośrodkowego układu nerwowego, krwawienie maciczne, krwawienia z ran, w tym pooperacyjnych. Kamica nerkowa. U pacjentów z napadami astmy oskrzelowej w wywiadzie, wywołanych podawaniem salicylanów lub substancji o podobnym działaniu, szczególnie niesteroidowych leków przeciwzapalnych. Nadwrażliwość na salicylany i inne niesteroidowe leki przeciwzapalne lub na którąkolwiek substancję pomocniczą. Nie stosować u dzieci w wieku poniżej 12 lat w przebiegu chorób gorączkowych, szczególnie grypy lub ospy wietrznej ze względu na ryzyko wystąpienia zespołu Reye’a. Ciężka niewydolność wątroby lub nerek.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgPrzeciwwskazania
Jednoczesne stosowanie z metotreksatem stosowanym w dawkach 15 mg na tydzień lub większych. Ciężka niewydolność serca.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie jest przemijające i ustępuje po zakończeniu terapii. Stosować ostrożnie: w pierwszym i drugim trymestrze ciąży, w przypadku choroby wrzodowej lub krwawień z przewodu pokarmowego w wywiadzie, w niewydolności nerek lub wątroby, kwas acetylosalicylowy może powodować skurcz oskrzeli i wywoływać napady astmy oskrzelowej lub inne reakcje nadwrażliwości. Czynniki ryzyka obejmują: astmę oskrzelową lub katar sienny z polipami błony śluzowej nosa, przewlekłe choroby układu oddechowego. Ostrzeżenie dotyczy także pacjentów wykazujących reakcje alergiczne (np. odczyny skórne, świąd, pokrzywka) na inne substancje.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgSpecjalne środki ostrozności
podczas obfitych menstruacji, przed i po zabiegach chirurgicznych (nawet takich jak ekstrakcja zęba), ponieważ kwas acetylosalicylowy może prowadzić do wydłużenia czasu krwawienia (ze względu na działanie antyagregacyjne, które może trwać kilka dni), u pacjentek stosujących wkładki wewnątrzmaciczne (patrz punkt 4.5 Interakcje z innymi lekami i inne rodzaje interakcji), u pacjentów pozostających na diecie ubogosodowej ze względu na zawartość 485 mg sodu w jednej tabletce musującej, podczas jednoczesnego stosowania leków przeciwzakrzepowych, u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej, kwas acetylosalicylowy, nawet w małych dawkach, zmniejsza wydalanie kwasu moczowego. U pacjentów ze zwiększonym wydalaniem kwasu moczowego preparat może wywołać napad dny moczanowej.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgSpecjalne środki ostrozności
Przyjmowanie leku w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz wpływ na przewód pokarmowy i układ krążenia poniżej). Wpływ na układ krążenia i naczynia mózgowe Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np. zawał serca lub udar). Dostępne dane są niewystarczające, aby wykluczyć takie ryzyko w przypadku przyjmowania kwasu acetylosalicylowego w dawkach dobowych w zakresie podanym w punkcie 4.2.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji DOTYCZĄCE KWASU ACETYLOSALICYLOWEGO Metotreksat w dawce mniejszej niż 15 mg na tydzień - zwiększa się toksyczny wpływ metotreksatu na szpik kostny (leki przeciwzapalne powodują zmniejszenie klirensu nerkowego metotreksatu, a kwas acetylosalicylowy wypiera metotreksat z połączeń z białkami osocza). W czasie pierwszych tygodni leczenia, należy raz w tygodniu kontrolować morfologię krwi. W przypadkach nieznacznego pogorszenia czynności nerek, jak również u osób w podeszłym wieku, zaleca się stosowanie intensywnego nadzoru. Doustne leki przeciwzakrzepowe i heparyna - zwiększenie ryzyka wydłużenia czasu krwawienia i krwotoków ze względu na wypieranie leków przeciwzakrzepowych z połączeń z białkami osocza oraz zwiększenie właściwości antyagregacyjnych kwasu acetylosalicylowego; Leki trombolityczne lub inne leki hamujące agregację, np.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgInterakcje
tyklopidyna - zwiększenie ryzyka wydłużenia czasu krwawienia i krwotoków oraz uszkodzenia błony śluzowej żołądka przez salicylany. Należy kontrolować parametry krzepnięcia krwi. Doustne leki przeciwcukrzycowe (szczególnie z grupy sulfonylomocznika) oraz insulina ze względu na właściwości hipoglikemizujące oraz wypieranie sulfonylomocznika z połączeń z białkami osocza, kwas acetylosalicylowy nasila działanie leków przeciwcukrzycowych. Należy kontrolować stężenie glukozy w osoczu. Inne niesteroidowe leki przeciwzapalne - zwiększenie ryzyka krwawienia z przewodu pokarmowego i wystąpienia choroby wrzodowej oraz uszkodzenia nerek. Leki zwiększające wydalanie kwasu moczowego (np. probenecyd) - osłabienie działania leków przeciwdnawych ze względu na konkurencję w procesie eliminacji kwasu moczowego przez kanaliki nerkowe.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgInterakcje
Glikokortykosteroidy podawane ogólnie z wyjątkiem hydrokortyzonu stosowanego jako terapia zastępcza w chorobie Addisona - w czasie leczenia glikokortykosteroidami następuje zmniejszenie stężenia salicylanów we krwi. Po odstawieniu glikokortykosteroidów istnieje ryzyko przedawkowania salicylanów i zwiększone ryzyko wystąpienia choroby wrzodowej i krwawień z przewodu pokarmowego. Interferon α - salicylany mogą hamować działanie interferonu, należy stosować leki przeciwbólowe i przeciwgorączkowe, które nie są pochodnymi salicylanów. Pentoksyfilina - zwiększone ryzyko krwawienia. Należy kontrolować parametry krzepnięcia krwi. Leki moczopędne - stosowane z kwasem acetylosalicylowym w dawce 3 g na dobę i większych - osłabienie działania moczopędnego przez zatrzymanie sodu i wody w organizmie na skutek zwiększenia filtracji kłębuszkowej, spowodowanej zmniejszeniem syntezy prostaglandyn w nerkach. Kwas acetylosalicylowy może nasilać ototoksyczność furosemidu.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgInterakcje
Inhibitory konwertazy angiotensyny (ACE) - podczas jednoczesnego stosowania z kwasem acetylosalicylowym w dawkach 3 g na dobę i większych - zmniejszenie działania przeciwnadciśnieniowego poprzez zmniejszenie filtracji kłębuszkowej, wynikające z hamowania produkcji prostaglandyn, działających rozszerzająco na naczynia krwionośne. Kwas walproinowy - kwas acetylosalicylowy zwiększa toksyczność kwasu walproinowego, poprzez wypieranie go z połączeń z białkami osocza. Kwas walproinowy nasila działanie antyagregacyjne kwasu acetylosalicylowego ze względu na synergiczne działanie antyagregacyjne obu leków. Alkohol - ryzyko owrzodzeń i krwawień z przewodu pokarmowego podczas jednoczesnego stosowania z kwasem acetylosalicylowym. Digoksyna - zwiększenie stężenia w osoczu podczas jednoczesnego stosowania kwasu acetylosalicylowego.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgInterakcje
DOTYCZĄCE WITAMINY C Kwas askorbowy stosowany w dużych dawkach może być przyczyną fałszywych wyników niektórych badań laboratoryjnych wykonywanych metodami oksydoredukcyjnymi (oznaczenie stężenia glukozy i kreatyniny). Kwas askorbowy zwiększa wchłanianie glinu z preparatów go zawierających, zwiększa wchłanianie żelaza, zmniejsza natomiast wchłanianie wit. B₁₂ (od 25 do 80%).
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja Ciąża Kwas acetylosalicylowy może być stosowany w pierwszym i drugim trymestrze ciąży jedynie w przypadku zdecydowanej konieczności, po dokładnym rozważeniu stosunku ryzyka do korzyści wynikających z leczenia. W trzecim trymestrze ciąży kwas acetylosalicylowy, może powodować przedwczesne zamknięcie przewodu tętniczego u płodu. Ponadto może przedłużać czas trwania ciąży, hamować czynności skurczowe i powodować komplikacje podczas porodu. Zarówno u matki, jak i dziecka zaobserwowano zwiększoną skłonność do krwawień. Dlatego w trzecim trymestrze ciąży stosowanie preparatu jest bezwzględnie przeciwwskazane. Laktacja Preparat jest przeciwwskazany w okresie karmienia piersią.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie wpływa na zdolność kierowania pojazdami i obsługę urządzeń mechanicznych.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgDziałania niepożądane
4.8 Działania niepożądane Zaburzenia układu nerwowego: szumy uszne, uczucie pogorszenia słuchu, zawroty głowy, które są zwykle objawem przedawkowania. Zaburzenia żołądka i jelit: ból brzucha, zgaga, nudności, wymioty (przy przedawkowaniu), choroba wrzodowa żołądka lub dwunastnicy, perforacja, krwawienie z przewodu pokarmowego - jawne (fusowate wymioty i smoliste stolce) lub utajone, powodujące niedokrwistość z niedoboru żelaza. Im większa dawka, tym częściej występują wyżej wymienione działania niepożądane. Zaburzenia wątroby i dróg żółciowych: W rzadkich przypadkach opisano zaburzenia czynności wątroby (zwiększenie aktywności aminotransferaz). Zaburzenia krwi i układu chłonnego: Zwiększone ryzyko krwawień, wydłużenie czasu krwawienia, czasu protrombinowego, trombocytopenia. Lek może spowodować ryzyko krwotoku u pacjenta, który ma być poddany operacji.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgDziałania niepożądane
Zaburzenia nerek i dróg moczowych: W rzadkich przypadkach po długotrwałym stosowaniu dużych dawek kwasu acetylosalicylowego odnotowano martwicę brodawek nerkowych i śródmiąższowe zapalenie nerek. Zaburzenia układu immunologicznego: Nadwrażliwość: obrzęk Quinckego, odczyny skórne, pokrzywka, astma oskrzelowa, reakcje anafilaktyczne. Długotrwałe przyjmowanie preparatów zawierających kwas acetylosalicylowy może być przyczyną bólu głowy, który nasila się podczas przyjmowania kolejnych dawek. Inne: Duże dawki kwasu askorbowego (powyżej 1 g na dobę) mogą spowodować powstawanie kamieni szczawianowych i moczanowych oraz zwiększać hemolizę u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej, powodując przewlekłą hemolizę. W związku z leczeniem NLPZ zgłaszano występowanie obrzęków, nadciśnienia i niewydolności serca.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgDziałania niepożądane
Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np. zawał mięśnia sercowego lub udar), patrz punkt 4.4.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedawkowania mogą wystąpić w ciągu 24 godzin po zażyciu kwasu acetylosalicylowego. Objawy przedawkowania to: bóle i zawroty głowy, szumy uszne, zaburzenia słuchu, dezorientacja, nadmierne pocenie, nudności, wymioty, niekontrolowane drżenie rąk, szczególnie u pacjentów w podeszłym wieku, bóle brzucha, biegunka. W przypadku ciężkiego zatrucia mogą wystąpić hiperwentylacja, gorączka, zaburzenia świadomości, kwasica ketonowa, zasadowica oddechowa, kwasica metaboliczna, wstrząs sercowo-naczyniowy, niewydolność oddechowa, ciężka hipoglikemia, krew w moczu, pobudzenie ruchowe, drgawki, śpiączka. Sposób postępowania po przedawkowaniu zależy od stopnia, stadium i objawów klinicznych zatrucia: natychmiastowe przewiezienie do szpitala, płukanie żołądka lub wywołanie wymiotów, podanie węgla aktywowanego, kontrola równowagi kwasowo-zasadowej (niezbędna jest kontrola następujących parametrów krwi: pH, pCO₂, stężenia wodorowęglanów, stężenia potasu), w razie potrzeby nawodnienie i wyrównanie zaburzeń równowagi elektrolitowej, jeśli zachowana jest prawidłowa czynność nerek, można zastosować diurezę alkaliczną lub forsowaną diurezę alkaliczną, leczenie objawowe, w przypadku ciężkiego zatrucia można zastosować hemodializę lub dializę otrzewnową.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Inne leki przeciwbólowe, przeciwgorączkowe, kwas acetylosalicylowy, preparaty złożone (z wyjątkiem psycholeptyków) Kod ATC: N 02 BA 51 Kwas acetylosalicylowy - należy do grupy niesteroidowych leków przeciwzapalnych. Jako ester kwasu salicylowego jest substancją o właściwościach przeciwbólowych, przeciwgorączkowych i przeciwzapalnych. Opisany mechanizm działania obejmuje hamowanie cyklooksygenazy kwasu arachidonowego, a co za tym idzie hamowanie syntezy prostanoidów: prostaglandyny E₂ (PGE₂), prostaglandyny I₂ (PGI₂) oraz tromboksanu A₂. Kwas acetylosalicylowy hamuje agregację płytek krwi. Nieodwracalne hamowanie cyklooksygenazy jest szczególnie wyraźne w trombocytach, ponieważ nie mogą one ponownie zsyntetyzować tego enzymu. Przypuszczalnie kwas acetylosalicylowy wywiera również inne działania hamujące na płytki krwi.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgWłaściwości farmakodynamiczne
Kwas askorbowy - bierze udział w syntezie kolagenu i substancji międzykomórkowej oraz w procesach oksydoredukcyjnych. Kwas askorbowy uczestniczy w wielu procesach metabolicznych takich, jak: metabolizm fenyloalaniny, tyrozyny, kwasu foliowego, noradrenaliny, histaminy, żelaza, a także w przemianie enzymatycznej niektórych leków, węglowodanów, syntezie lipidów, białek i karnityny, w procesach immunologicznych, hydroksylacji serotoniny, ochronie ciągłości naczyń krwionośnych. Ułatwia wchłanianie żelaza.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Kwas acetylosalicylowy Po podaniu doustnym, kwas acetylosalicylowy wchłania się szybko i całkowicie z przewodu pokarmowego. Jest przekształcany do głównego metabolitu - kwasu salicylowego - w czasie i po wchłonięciu. Maksymalne stężenie kwasu acetylosalicylowego w osoczu osiągane jest po 10-20 minutach, a kwasu salicylowego po 0,3 - 2 godzinach. Zarówno kwas acetylosalicylowy jak i kwas salicylowy wiążą się silnie z białkami osocza i ulegają szybkiej dystrybucji w całym organizmie. Kwas salicylowy przenika przez łożysko i do mleka kobiet karmiących piersią. Kwas salicylowy metabolizowany jest głównie w wątrobie. Główne metabolity to kwas salicylowy sprzężony z glicyną (kwas salicylurowy), eter i ester glukuronidowy kwasu salicylowego (fenylosalicylan glukuronidu i acetylosalicylan glukuronidu) oraz kwas gentyzynowy w postaci wolnej i sprzężonej z glicyną.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgWłaściwości farmakokinetyczne
Kinetyka eliminacji kwasu salicylowego zależy w dużym stopniu od dawki, ponieważ metabolizm kwasu salicylowego jest ograniczony przez aktywność enzymów wątrobowych. Okres półtrwania wynosi 2 do 3 godzin po zastosowaniu małych do około 12 godzin po zwykle stosowanych dawkach przeciwbólowych. Kwas salicylowy i jego metabolity są wydalane głównie przez nerki. Kwas askorbowy szybko wchłania się z przewodu pokarmowego i jest dystrybuowany do wszystkich tkanek. Największe stężenie stwierdzono w płytkach krwi, białych krwinkach, tkance wątroby i soczewkach oczu. Około 25% kwasu askorbowego wiąże się z białkami osocza. Kwas askorbowy jest metabolizowany w wątrobie i eliminowany przez nerki, częściowo w postaci niezmienionej, częściowo w postaci metabolitów szczawianowych.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach salicylany powodowały uszkodzenia nerek, lecz nie wywoływały innych zmian chorobowych. Nie znaleziono dowodów świadczących o właściwościach mutagennych i rakotwórczych kwasu acetylosalicylowego. Nie zaobserwowano działań teratogennych u myszy oraz u szczurów, którym podawano kwas askorbowy w dawkach 20-4000 razy przekraczających dobowe zapotrzebowanie dla człowieka.
- CHPL leku Upsarin C, tabletki musujące, 330 mg + 200 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Kwas cytrynowy bezwodny, sodu wodorowęglan, sodu benzoesan, powidon. 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3. Okres ważności 2 lata. 6.4. Specjalne środki ostrożności przy przechowywaniu Przechowywać w miejscu niedostępnym i niewidocznym dla dzieci. Przechowywać w temperaturze poniżej 25°C. Po użyciu leku szczelnie zamknąć tubę, aby chronić lek przed wilgocią. 6.5. Rodzaj i zawartość opakowania Tuba polipropylenowa z zamknięciem PE zawierającym substancję higroskopijną i z pierścieniem gwarancyjnym w tekturowym pudełku. Tekturowe pudełko zawiera 1 tubę lub 2 tuby po 10 tabletek. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Przed podaniem tabletkę należy rozpuścić w szklance wody, mleka lub soku owocowego.
- CHPL leku o rpl_id: 100114203Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO KOFERINA – TABLETKI OD BÓLU GŁOWY, 300 mg + 100 mg + 50 mg, tabletki 2. SKŁAD JAKOSCIOWY I ILOSCIOWY 1 tabletka zawiera 300 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum), 100 mg etoksybenzamidu (Ethenzamidum) i 50 mg kofeiny (Coffeinum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1 3. POSTAC FARMACEUTYCZNA Tabletki
- CHPL leku o rpl_id: 100114203Wskazania do stosowania
4.1. Wskazania do stosowania Bóle o lekkim i średnim nasileniu, np. bóle głowy, bóle mięśni, bóle menstruacyjne i gorączka.
- CHPL leku o rpl_id: 100114203Dawkowanie
4.2. Dawkowanie i sposób podawania Dorośli: zwykle 1 do 2 tabletek 3 razy na dobę. Dzieci w wieku powyżej 12 lat: ½ do 1 tabletki 3 razy na dobę. Produkt leczniczy KOFERINA – TABLETKI OD BÓLU GŁOWY jest przeciwwskazany do stosowania u dzieci w wieku poniżej 12 lat (patrz punkt 4.3). Nie należy stosować dawki dobowej większej niż 6 tabletek. Tabletki należy przyjmować podczas lub po posiłku, popijając obficie wodą.
- CHPL leku o rpl_id: 100114203Przeciwwskazania
4.3. Przeciwwskazania stwierdzona nadwrażliwość na kwas acetylosalicylowy, inne salicylany, inne niesteroidowe leki przeciwzapalne lub którąkolwiek substancję pomocniczą produktu wymienioną w punkcie 6.1; u pacjentów z czynną chorobą wrzodową żołądka i dwunastnicy; w przypadku krwawienia z przewodu pokarmowego, skaza krwotoczna; u pacjentów z ciężką niewydolnością wątroby i nerek; u pacjentów z ciężką niewydolnością serca; ciężkie, niewyrównane nadciśnienie; u pacjentów z napadami astmy oskrzelowej w wywiadzie, wywołanymi podaniem salicylanów lub substancji o podobnym działaniu, szczególnie niesteroidowych leków przeciwzapalnych; jednocześnie z metotreksatem w dawkach 15 mg na tydzień lub większych; w okresie ciąży i karmienia piersią; u dzieci w wieku do 12 lat w przebiegu infekcji wirusowych, ze względu na ryzyko wystąpienia zespołu Reye’a.
- CHPL leku o rpl_id: 100114203Specjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt leczniczy KOFERINA – TABLETKI OD BÓLU GŁOWY należy stosować ostrożnie, tylko w porozumieniu z lekarzem w przypadku: astmy oskrzelowej, przewlekłych schorzeń dróg oddechowych, kataru siennego, polipów błony śluzowej nosa, gdyż kwas acetylosalicylowy może powodować skurcz oskrzeli i wywoływać napady astmy lub inne reakcje nadwrażliwości; zaburzeń krzepnięcia krwi (niedobór witaminy K); zaburzeń czynności wątroby lub nerek; jednoczesne leczenie lekami przeciwzakrzepowymi (heparyna, leki przeciwpłytkowe); przebytej choroby wrzodowej żołądka lub dwunastnicy, a także po przebytych krwawieniach z przewodu pokarmowego; nadciśnienia; niedokrwistości; niewydolności serca; niedoboru dehydrogenazy glukozo-6-fosforanowej, ze względu na ryzyko wystąpienia niedokrwistości hemolitycznej. Kwas acetylosalicylowy, nawet w małych dawkach, zmniejsza wydalanie kwasu moczowego.
- CHPL leku o rpl_id: 100114203Specjalne środki ostrozności
U pacjentów ze zmniejszonym wydalaniem kwasu moczowego produkt może spowodować napad dny moczanowej. Picie alkoholu podczas stosowania leku zwiększa ryzyko krwawień z przewodu pokarmowego. Długotrwałe zażywanie leków przeciwbólowych zwłaszcza złożonych może prowadzić do trwałego uszkodzenia nerek. Nie należy przyjmować kwasu acetylosalicylowego co najmniej 5 dni przed zabiegiem chirurgicznym. Stosowanie kwasu acetylosalicylowego u dzieci z ostrymi chorobami gorączkowymi, szczególnie grypą i ospą wietrzną, może być związane z wystąpieniem zespołu Reye’a. Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
- CHPL leku o rpl_id: 100114203Interakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na zawartość kwasu acetylosalicylowego: metotreksat w dawkach mniejszych niż 15 mg na tydzień; nasilenie toksycznego wpływu metotreksatu na szpik (zmniejszony klirens nerkowy metotreksatu podczas jednoczesnego stosowania z produktami leczniczymi przeciwzapalnymi – w tym z kwasem acetylosalicylowym – oraz wypieranie przez salicylany metotreksatu z połączeń z białkami osocza); leki przeciwzakrzepowe, np. pochodne kumaryny, heparyna oraz trombolityczne lub inne leki hamujące agregację płytek krwi, np. tyklopidyna; jednoczesne stosowanie kwasu acetylosalicylowego z lekami przeciwzakrzepowymi oraz trombolitycznymi może powodować nasilenie działania przeciwzakrzepowego: zwiększone ryzyko wydłużenia czasu krwawienia i krwotoków; inne niesteroidowe leki przeciwzapalne, w tym salicylany w dużych dawkach; leki zwiększające wydalanie kwasu moczowego z moczem, np.
- CHPL leku o rpl_id: 100114203Interakcje
benzbromaron, probenecyd; digoksyna: jednoczesne stosowanie kwasu acetylosalicylowego z digoksyną powoduje zwiększenie stężenia digoksyny w osoczu; leki przeciwcukrzycowe, np. insulina, pochodne sulfonylomocznika: kwas acetylosalicylowy nasila działanie leków przeciwcukrzycowych; leki moczopędne stosowane jednocześnie z kwasem acetylosalicylowym w dużych dawkach – osłabienie działania moczopędnego; glikokortykosteroidy podawane ogólnie, z wyjątkiem hydrokortyzonu stosowanego jako terapia zastępcza w chorobie Addisona; inhibitory konwertazy angiotensyny (ACE) stosowane jednocześnie z kwasem acetylosalicylowym w dużych dawkach – zmniejszenie działania przeciwnadciśnieniowego; kwas walproinowy: kwas acetylosalicylowy zwiększa toksyczność kwasu walproinowego; alkohol: alkohol może zwiększyć ryzyko wystąpienia działań niepożądanych ze strony przewodu pokarmowego.
- CHPL leku o rpl_id: 100114203Interakcje
Ze względu na zawartość kofeiny: kofeina hamuje uspokajające i nasenne działanie wielu leków; kofeina nasila działanie leków wywołujących tachykardię; kofeina potencjalnie może wykazywać interakcje z lekami metabolizowanymi przez CYP1A2; kofeina hamuje wydalanie teofiliny oraz zwiększa możliwość uzależnienia od substancji o działaniu zbliżonym do efedryny; doustne środki antykoncepcyjne, cymetydyna i disulfiram hamują metabolizm kofeiny w wątrobie; jednoczesne stosowanie inhibitorów gyrazy z grupy pochodnych kwasu chinolinokarboksylowego i kofeiny może opóźnić wydalanie kofeiny oraz jej metabolitu paraksantyny.
- CHPL leku o rpl_id: 100114203Wpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Produktu nie należy stosować w okresie ciąży i karmienia piersią.
- CHPL leku o rpl_id: 100114203Wpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn. W razie wystąpienia działań niepożądanych zachować ostrożność (patrz punkt 4.8).
- CHPL leku o rpl_id: 100114203Działania niepożądane
4.8. Działania niepożądane Ze względu na zawartość kwasu acetylosalicylowego: Zaburzenia żołądka i jelit: bóle żołądka i brzucha, zgaga, nudności, wymioty, niestrawność, zapalenie przewodu pokarmowego, potencjalnie zagrażające życiu krwawienia z przewodu pokarmowego. Zaburzenia wątroby i dróg żółciowych: w rzadkich przypadkach opisano przemijające zaburzenia czynności wątroby. Zaburzenia układu nerwowego: zawroty głowy i szumy uszne, będące zazwyczaj objawami przedawkowania. Zaburzenia krwi i układu chłonnego: zwiększone ryzyko krwawień, krwotoki, małopłytkowość. Zaburzenia naczyniowe: wylew krwi do mózgu. Zaburzenia nerek i dróg moczowych: martwice brodawek nerkowych i śródmiąższowe zapalenie nerek. Zaburzenia układu immunologicznego: reakcje nadwrażliwości. Zaburzenia układu oddechowego: astma oskrzelowa. Długotrwałe przyjmowanie produktów leczniczych zawierających kwas acetylosalicylowy może być przyczyną bólu głowy.
- CHPL leku o rpl_id: 100114203Działania niepożądane
Ze względu na zawartość kofeiny: kofeina może być przyczyną bezsenności, niepokoju, kołatania serca, przyspieszenia rytmu serca, przemijającego wzrostu ciśnienia krwi oraz dolegliwości żołądkowo-jelitowych.
- CHPL leku o rpl_id: 100114203Przedawkowanie
4.9. Przedawkowanie Objawy przedawkowania pojawiają się z reguły po 2 godzinach. Działanie kwasu acetylosalicylowego powoduje przyspieszenie oddechu, nudności, wymioty, bóle brzucha, ból głowy, zawroty głowy, szumy uszne, głuchotę, nadmierne pocenie, zmniejszenie stężenia protrombiny. W przypadku ciężkiego zatrucia mogą wystąpić hiperwentylacja, gorączka, zaburzenia świadomości, zaburzenia równowagi kwasowo-zasadowej, wstrząs sercowo-naczyniowy, niewydolność oddechowa, ciężka hipoglikemia, krew w moczu, pobudzenie ruchowe, drgawki, śpiączka. Leczenie przedawkowania: w celu zmniejszenia wchłaniania – płukanie żołądka, jeżeli pacjent jest przytomny, spowodować wymioty; podanie węgla aktywnego; kontrola równowagi kwasowo-zasadowej; jeśli zachowana jest prawidłowa czynność nerek, można zastosować diurezę alkaliczną; leczenie objawowe; w przypadku ciężkiego zatrucia można zastosować hemodializę lub dializę otrzewnową.
- CHPL leku o rpl_id: 100114203Przedawkowanie
Skutki przedawkowania kofeiny, w tym drgawki, należy leczyć objawowo.
- CHPL leku o rpl_id: 100114203Właściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inne leki przeciwbólowe, przeciwgorączkowe, kwas acetylosalicylowy, produkty złożone (z wyjątkiem psycholeptyków), Kod ATC: N02B A51. Produkt zawiera trzy substancje czynne – kwas acetylosalicylowy, etoksybenzamid i kofeinę. Kwas acetylosalicylowy należy do grupy kwasowych niesteroidowych leków przeciwzapalnych o właściwościach przeciwbólowych, przeciwgorączkowych i przeciwzapalnych. Mechanizm jego działania polega na nieodwracalnym hamowaniu cyklooksygenazy kwasu arachidonowego, a tym samym hamowaniu syntezy prostanoidów: prostaglandyn (PGE2, PGI2) oraz tromboksanu A2. Hamując syntezę tromboksanu A2 w płytkach krwi, kwas acetylosalicylowy hamuje także agregację płytek krwi. Etoksybenzamid jest pochodną kwasu salicylowego. Wykazuje działanie przeciwbólowe i słabe działanie przeciwgorączkowe. W dużych dawkach działa przeciwzapalnie i zwiotczaj ąco na mięśnie.
- CHPL leku o rpl_id: 100114203Właściwości farmakodynamiczne
Mechanizm działania jest podobny do działania kwasu acetylosalicylowego. Kofeina jest pochodną ksantyny. Hamuje kompetycyjnie fosfodiesterazę, enzym, który powoduje rozpad cyklicznego adenozynomonofosforanu (cAMP). Wzrost zawartości wewnątrzkomórkowego cAMP pośredniczy w większości farmakologicznych oddziaływań kofeiny. Kofeina wykazuje działanie pobudzające o.u.n. i łagodnie moczopędne. Wpływa na czynność serca (przemijające przyspieszenie czynności serca i siły skurczu) i naczyń krwionośnych (kurczy naczynia krwionośne w mózgu i zmniejsza opór naczyń obwodowych). Uważa się, że podawana doustnie z lekami przeciwbólowymi zmniejsza zmęczenie i retencje płynów, związane z menstruacją. Kofeina nie wykazuje działania przeciwbólowego, niemniej jednak w połączeniu z innymi lekami o działaniu przeciwbólowym m.in. z kwasem acetylosalicylowym, zwiększa to działanie zwłaszcza w odniesieniu do bólów głowy.
- CHPL leku o rpl_id: 100114203Właściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Kwas acetylosalicylowy: Po podaniu doustnym, kwas acetylosalicylowy wchłania się szybko i całkowicie z przewodu pokarmowego. W trakcie wchłaniania oraz po wchłonięciu jest przekształcany do głównego metabolitu – kwasu salicylowego. Maksymalne stężenie kwasu acetylosalicylowego w osoczu osiągane jest po 10-20 minutach, a kwasu salicylowego po 0,3 - 2 godzinach. Zarówno kwas acetylosalicylowy jak i kwas salicylowy wiążą się silnie z białkami osocza i ulegają szybkiej dystrybucji w całym organizmie. Kwas salicylowy przenika przez łożysko i do mleka kobiet karmiących piersią. Kwas salicylowy metabolizowany jest głównie w wątrobie. Główne metabolity to kwas salicylowy sprzężony z glicyną (kwas salicylurowy), eter i ester glukuronidowy kwasu salicylowego (fenylosalicylan glukuronidu i acetylosalicylan glukuronidu) oraz kwas gentyzynowy w postaci wolnej i sprzężonej z glicyną.
- CHPL leku o rpl_id: 100114203Właściwości farmakokinetyczne
Kinetyka eliminacji kwasu salicylowego zależy w dużym stopniu od dawki, ponieważ metabolizm kwasu salicylowego jest ograniczony przez aktywność enzymów wątrobowych. Okres półtrwania wynosi od 2 do 3 godzin po zastosowaniu małych dawek (do 325 mg/dobę) do około 15 godzin po dużych dawkach terapeutycznych (powyżej 3 g/dobę) lub w przypadku zatrucia. Kwas salicylowy i jego metabolity są wydalane głównie przez nerki. Etoksybenzamid: Po podaniu doustnym lek wchłania się szybko i prawie całkowicie, osiągając po 30-60 minutach maksymalne stężenie we krwi. Okres półtrwania wynosi 1-2 h. Etoksybenzamid jest metabolizowany w wątrobie, a głównym metabolitem jest amid kwasu salicylowego. Mniej więcej 25% jest wydalane z moczem w postaci związku sprzężonego z salicylamidem. Kofeina: Okres półtrwania wchłaniania kofeiny wynosi od 2 do 13 minut i po podaniu doustnym kofeina wchłania się prawie całkowicie.
- CHPL leku o rpl_id: 100114203Właściwości farmakokinetyczne
Po podaniu dawki 5 mg/kg m.c., osiąga maksymalne stężenie w osoczu (Cmax= 9-10 μg/ml) po około 30-40 minutach. Biodostępność kofeiny po podaniu doustnym jest prawie całkowita. Wiąże się z białkami osocza w 30-40%, a objętość dystrybucji wynosi 0,52-1,05 l/kg. Kofeina podlega dystrybucji do wszystkich kompartmentów, przenika szybko przez barierę krew-mózg oraz przez łożysko, a także przenika do mleka. Okres półtrwania kofeiny w osoczu wynosi od 4,1 do 5,7 godziny; jednakże zdarzają się także różnice u tego samego pacjenta oraz różnice pomiędzy różnymi pacjentami dochodzące do 9-10 godzin. Kofeina i jej metabolity wydalają się głównie przez nerki. W ciągu 48 godzin w moczu znajduje się do 86% podanej dawki. Najwyżej 1,8% podanej dawki kofeiny pozostaje w postaci niezmienionej. Głównymi metabolitami są: kwas 1-metylomoczowy (12-38%), 1-metyloksantyna (8-19%) i 5-acetylamino-6-amino-3-metylouracyl (15%). Z żółcią wydala się tylko 2-5% podanej dawki.
- CHPL leku o rpl_id: 100114203Właściwości farmakokinetyczne
Główny metabolit to kwas 1,7-dimetylomoczowy, który stanowi 44% całkowitej ilości metabolitów wydalanych z kałem.
- CHPL leku o rpl_id: 100114203Przedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Nie przeprowadzono odpowiednich badań przedklinicznych potwierdzających bezpieczeństwo stosowania produktu leczniczego złożonego.
- CHPL leku o rpl_id: 100114203Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Skrobia ziemniaczana 6.2. Niezgodności farmaceutyczne Nie dotyczy. 6.3. Okres ważności 3 lata 6.4. Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5. Rodzaj i zawartość opakowania Blister z folii PP lub PVC/Aluminium w tekturowym pudełku lub bez tekturowego pudełka. 6 szt. (1 blister po 6 szt.) 10 szt. (1 blister po 10 szt.) 6.6. Specjalne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Bez specjalnych wymagań dotyczących usuwania.
- CHPL leku o rpl_id: 100255790Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Cardioteva, 75 mg, tabletki dojelitowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka dojelitowa zawiera: 75 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki dojelitowe. 75 mg: Owalne, białe, obustronnie wypukłe tabletki, o wymiarach 9,2 mm x 5,2 mm.
- CHPL leku o rpl_id: 100255790Wskazania do stosowania
4.1 Wskazania do stosowania Prewencja wtórna zawału mięśnia sercowego. Profilaktyka chorób sercowo-naczyniowych u pacjentów ze stabilną dławicą piersiową. Niestabilna dławica piersiowa w wywiadzie, z wyjątkiem ostrej fazy. Zapobieganie zatkaniu przeszczepu naczyniowego po kardiochirurgicznym zabiegu wszczepienia pomostów aortalno-wieńcowych (by-pass) (ang. Coronary Artery Bypass Grafting - CABG). Angioplastyka wieńcowa z wyjątkiem ostrej fazy. Profilaktyka wtórna u pacjentów po przebytym przejściowym niedokrwieniu mózgu (TIA) i incydentach niedokrwienia mózgowo-naczyniowego (CVA), pod warunkiem wykluczenia krwawień wewnątrzmózgowych. Produkt leczniczy Cardioteva nie jest zalecany w sytuacjach wymagających nagłej pomocy. Zastosowanie jest ograniczone do prewencji wtórnej w leczeniu przewlekłym.
- CHPL leku o rpl_id: 100255790Dawkowanie
4.2 Dawkowanie i sposób podawania Pacjenci dorośli Profilaktyka wtórna zawału: Zalecana dawka to 75-160 mg jeden raz na dobę. Profilaktyka chorób sercowo-naczyniowych u pacjentów ze stabilną dławicą piersiową: Zalecana dawka to 75-160 mg jeden raz na dobę. Niestabilna dławica piersiowa w wywiadzie, z wyjątkiem ostrej fazy: Zalecana dawka to 75-160 mg jeden raz na dobę. Zapobieganie zatkaniu przeszczepu naczyniowego po kardiochirurgicznym zabiegu wszczepienia pomostów aortalno-wieńcowych (CABG): Zalecana dawka to 75-160 mg jeden raz na dobę. Angioplastyka wieńcowa z wyjątkiem ostrej fazy: Zalecana dawka to 75-160 mg jeden raz na dobę. Profilaktyka wtórna u pacjentów po przebytym przejściowym niedokrwieniu mózgu (TIA) i incydentach niedokrwienia mózgowo-naczyniowego (CVA), pod warunkiem wykluczenia krwawień wewnątrzmózgowych: Zalecana dawka to 75-325 mg jeden raz na dobę.
- CHPL leku o rpl_id: 100255790Dawkowanie
Pacjenci w podeszłym wieku Ogólnie kwas acetylosalicylowy należy stosować z ostrożnością u pacjentów w podeszłym wieku, którzy są bardziej skłonni do występowania działań niepożądanych. Jeśli nie występuje ciężka niewydolność nerek lub wątroby, zalecana jest dawka zwykle stosowana u pacjentów dorosłych (patrz punkt 4.3 i 4.4). Leczenie powinno być oceniane w regularnych odstępach czasu. Dzieci i młodzież Kwasu acetylosalicylowego nie należy podawać dzieciom i młodzieży w wieku poniżej 16 lat, z wyjątkiem wyraźnych zaleceń lekarskich, gdy korzyści z leczenia przeważają nad ryzykiem związanym ze stosowaniem leku (patrz punkt 4.4). Sposób podawania Do stosowania doustnego. Tabletki należy połykać w całości, popijając wystarczającą ilością płynu (1/2 szklanki wody). Otoczka tabletki nie rozpada się w żołądku, dlatego tabletek nie należy kruszyć, łamać lub żuć, ponieważ otoczka zapobiega podrażnieniom błony śluzowej żołądka.
- CHPL leku o rpl_id: 100255790Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na związki zawierające kwas acetylosalicylowy lub inhibitory syntezy prostaglandyn (np. u niektórych pacjentów z astmą może wystąpić atak albo omdlenie), lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; Czynny lub nawracający w wywiadzie wrzód trawienny i (lub) krwawienia z przewodu pokarmowego lub innego rodzaju krwawienia, takie jak krwawienia z naczyń mózgowych; Skaza krwotoczna; choroby związane z krzepnięciem, takie jak hemofilia lub trombocytopenia; Ciężkie zaburzenia czynności wątroby; Ciężkie zaburzenia czynności nerek; Dawki > 100 mg na dobę podczas trzeciego trymestru ciąży (patrz punkt 4.6); Metotreksat stosowany w dawkach >15 mg na tydzień (patrz punkt 4.5).
- CHPL leku o rpl_id: 100255790Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt leczniczy Cardioteva nie jest zalecany do stosowania jako lek przeciwzapalny, przeciwbólowy, przeciwgorączkowy. Produkt leczniczy zalecany jest do stosowania u pacjentów dorosłych i młodzieży w wieku powyżej 16 lat. Ten produkt leczniczy nie jest zalecany do stosowania u młodzieży lub dzieci w wieku poniżej 16 lat, chyba że korzyść ze stosowania przeważa nad ryzykiem. U niektórych dzieci zastosowanie kwasu acetylosalicylowego może mieć związek z występowaniem zespołu Reya. Występuje zwiększone ryzyko krwawienia zwłaszcza podczas lub po zabiegu chirurgicznym (nawet w przypadku niewielkich zabiegów, np. ekstrakcji zęba). Należy stosować z ostrożnością przed zabiegiem, włączając ekstrakcję zęba. Może być konieczne czasowe przerwanie leczenia. Produkt leczniczy Cardioteva nie jest zalecany do stosowania podczas obfitego krwawienia miesiączkowego, ponieważ może nasilać krwawienie miesiączkowe.
- CHPL leku o rpl_id: 100255790Specjalne środki ostrozności
Produkt leczniczy Cardioteva powinien być stosowany z ostrożnością w przypadku nadciśnienia tętniczego i u pacjentów z owrzodzeniem żołądka lub dwunastnicy w wywiadzie, lub epizodami krwawienia albo poddawanych leczeniu lekami przeciwzakrzepowymi. Pacjenci powinni poinformować lekarza o jakimkolwiek nietypowym krwawieniu. Jeśli wystąpi krwawienie lub owrzodzenie przewodu pokarmowego, należy zaprzestać stosowania produktu. Kwas acetylosalicylowy należy podawać z ostrożnością pacjentom z umiarkowanymi zaburzeniami czynności nerek lub wątroby (przeciwwskazany, jeśli są to ciężkie zaburzenia) lub u pacjentów odwodnionych, ponieważ stosowanie leków z grupy NLPZ może spowodować pogorszenie czynności nerek. Należy regularnie przeprowadzać badania czynności wątroby u pacjentów wykazujących niewielką lub umiarkowaną niewydolność wątroby. Kwas acetylosalicylowy może prowokować skurcz oskrzeli lub napady astmy oskrzelowej lub inne reakcje nadwrażliwości.
- CHPL leku o rpl_id: 100255790Specjalne środki ostrozności
Czynniki ryzyka to istniejąca astma oskrzelowa, katar sienny, polipy błony śluzowej nosa lub przewlekłe choroby układu oddechowego. Dotyczy to również pacjentów, którzy także wykazują reakcje alergiczne na inne substancje (tj. reakcje skórne, świąd i pokrzywka). Poważne reakcje skórne, w tym zespół Stevens-Johnsona, obserwowano rzadko w związku z zastosowaniem kwasu acetylosalicylowego (patrz punkt 4.8). Stosowanie produktu leczniczego Cardioteva należy przerwać w przypadku wystąpienia pierwszych objawów wysypki na skórze, błonie śluzowej lub innych objawów nadwrażliwości. Pacjenci w podeszłym wieku są zwłaszcza wrażliwi na działania niepożądane spowodowane przez NLPZ, w tym kwas acetylosalicylowy, w szczególności są to: krwawienie z przewodu pokarmowego lub perforacja, które mogą być śmiertelne (patrz punkt 4.2). W przypadku, gdy konieczne jest długotrwałe leczenie, pacjentów należy poddawać regularnej ocenie.
- CHPL leku o rpl_id: 100255790Specjalne środki ostrozności
Nie zaleca się jednoczesnego stosowania produktu leczniczego Cardioteva z innymi lekami, które wpływają na hemostazę (tj. leki przeciwzakrzepowe, takie jak warfaryna, leki przeciwzapalne i selektywne inhibitory wychwytu zwrotnego serotoniny), chyba że jest to wyraźnie wskazane, ponieważ mogą one zwiększać ryzyko krwawienia (patrz punkt 4.5). Jeżeli nie można uniknąć takiego połączenia, zaleca się ścisłą obserwację w kierunku objawów krwawienia. Zaleca się ostrożność u pacjentów, którzy stosują jednocześnie leki, które zwiększają ryzyko owrzodzenia, takie jak doustne kortykosteroidy, selektywne inhibitory wychwytu zwrotnego serotoniny i deferazyroks (patrz punkt 4.5). Kwas acetylosalicylowy w małych dawkach zmniejsza wydalanie kwasu moczowego. Z tego względu, u pacjentów z tendencją do zmniejszonego wydalania kwasu moczowego może wystąpić atak dny moczanowej (patrz punkt 4.5).
- CHPL leku o rpl_id: 100255790Specjalne środki ostrozności
Ryzyko działania hipoglikemizującego pochodnych sulfonylomocznika i insuliny może być zwiększone w przypadku przyjmowania produktu Cardioteva w dawce większej niż zalecone dawkowanie (patrz punkt 4.5).
- CHPL leku o rpl_id: 100255790Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Połączenia przeciwwskazane Metotreksat (stosowany w dawkach >15 mg na tydzień): Skojarzenie metotreksatu i kwasu acetylosalicylowego powoduje nasilenie toksyczności hematologicznej z powodu zmniejszonego klirensu nerkowego metotreksatu przez kwas acetylosalicylowy. Dlatego jednoczesne stosowanie metotreksatu (w dawkach >15 mg na tydzień) z produktem Cardioteva jest przeciwwskazane (patrz punkt 4.3). Połączenia niezalecane Leki zwiększające wydalanie kwasu moczowego (urikozuryczne), np. probenecyd. Salicylany odwracają działanie probenecydu. Należy unikać takiego połączenia. Połączenia wymagające ostrożności lub które można rozważyć Leki przeciwzakrzepowe, np. kumaryna, heparyna, warfaryna: Zwiększone ryzyko krwawienia spowodowane hamowaniem czynności trombocytów, uszkodzenie błony śluzowej dwunastnicy i wypieranie leków przeciwzakrzepowych z ich połączeń z białkami osocza.
- CHPL leku o rpl_id: 100255790Interakcje
Czas krwawienia należy monitorować (patrz punkt 4.4). Leki przeciwpłytkowe (tj. klopidogrel i dipirydamol) i selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI; takie jak sertralina lub paroksetyna): Zwiększone ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.4). Leki przeciwcukrzycowe, np. sulfonomoczniki: Salicylany mogą zwiększać działanie hipoglikemiczne sulfonomocznika. Digoksyna i lit: Kwas acetylosalicylowy utrudnia wydalanie digoksyny i litu, co prowadzi do zwiększenia stężeń w osoczu. Monitorowanie stężenia digoksyny i litu w osoczu zaleca się w przypadku rozpoczynania i kończenia leczenia kwasem acetylosalicylowym. Może być konieczne dostosowanie dawkowania. Leki moczopędne i przeciwnadciśnieniowe: Leki NLPZ mogą zmniejszać działanie przeciwnadciśnieniowe leków moczopędnych i innych leków przeciwnadciśnieniowych. Tak jak w przypadku innych leków z grupy NLPZ, jednoczesne stosowanie z inhibitorami ACE zwiększa ryzyko ostrej niewydolności nerek.
- CHPL leku o rpl_id: 100255790Interakcje
Leki moczopędne: ryzyko wystąpienia ostrej niewydolności nerek z powodu zmniejszonej filtracji kłębuszkowej poprzez zmniejszenie syntezy prostaglandyn. Zalecane jest nawodnienie pacjenta i monitorowanie czynności nerek na początku leczenia. Inhibitory anhydrazy węglanowej (acetazolamid): Może powodować ciężką kwasicę i zwiększone toksyczne działanie na obwodowy układ nerwowy. Kortykosteroidy stosowane systemowo: Ryzyko wystąpienia owrzodzenia i krwawienia z przewodu pokarmowego może się zwiększyć podczas jednoczesnego stosowania kwasu acetylosalicylowego i kortykosteroidów (patrz punkt 4.4). Metotreksat (stosowany w dawkach <15 mg na tydzień): Skojarzenie metotreksatu i kwasu acetylosalicylowego powoduje nasilenie toksyczności hematologicznej z powodu zmniejszonego klirensu nerkowego metotreksatu przez kwas acetylosalicylowy. W ciągu pierwszych tygodni stosowania leczenia skojarzonego należy cotygodniowo kontrolować morfologię krwi.
- CHPL leku o rpl_id: 100255790Interakcje
Dokładne monitorowanie należy prowadzić w przypadku nawet łagodnych zaburzeń czynności nerek, jak również w przypadku pacjentów w podeszłym wieku. Inne leki NLPZ: Zwiększone ryzyko owrzodzeń i krwawień z przewodu pokarmowego z powodu działania synergicznego. Ibuprofen: Dane doświadczalne wskazują na możliwość hamowania przez ibuprofen wpływu małych dawek kwasu acetylosalicylowego na agregację płytek krwi w przypadku jednoczesnego podawania obu leków. Z uwagi jednak na ograniczenia wspomnianych danych oraz wątpliwości związane z ekstrapolacją danych uzyskanych ex vivo do warunków klinicznych, sformułowanie jednoznacznych wniosków dotyczących regularnego stosowania ibuprofenu nie jest możliwe, a kliniczne następstwa interakcji w przypadku doraźnego podawania ibuprofenu są mało prawdopodobne (patrz punkt 5.1). Metamizol: Metamizol może zmniejszać działanie kwasu acetylosalicylowego (aspiryny) na agregację płytek krwi, gdy jest przyjmowany jednocześnie.
- CHPL leku o rpl_id: 100255790Interakcje
Z tego względu połączenie to powinno być stosowane z ostrożnością u pacjentów przyjmujących małe dawki aspiryny w celach kardioprotekcyjnych. Cyklosporyna i takrolimus: Jednoczesne stosowanie NLPZ z cyklosporyną lub takrolimusem może zwiększać ryzyko nefrotoksyczności cyklosporyny i takrolimusu. Czynność nerek należy monitorować w przypadku jednoczesnego stosowania tych leków z kwasem acetylosalicylowym. Kwas walproinowy: Kwas acetylosalicylowy zmniejsza wiązanie walproinianu z białkami osocza, zwiększając tym samym stężenia wolnej frakcji walproinianu w osoczu w stanie stacjonarnym. Fenytoina: Salicylany zmniejszają wiązanie fenytoiny z białkami osocza. To może prowadzić do zmniejszonego całkowitego stężenia fenytoiny w osoczu i zwiększenia wolnej frakcji fenytoiny. Stężenie frakcji niezwiązanej a tym samym działanie terapeutyczne nie wydaje się być znacząco zmienione.
- CHPL leku o rpl_id: 100255790Interakcje
Alkohol: Jednoczesne spożywanie alkoholu i przyjmowanie kwasu acetylosalicylowego zwiększa ryzyko krwawienia z przewodu pokarmowego. Substancja pomocnicza - sód: Lek zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę, to znaczy lek uznaje się za „wolny od sodu”.
- CHPL leku o rpl_id: 100255790Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Małe dawki (do 100 mg na dobę): Badania kliniczne wskazują, że dawki do 100 mg na dobę do ograniczonego stosowania w położnictwie i wymagające specjalistycznego monitorowania, wydają się być bezpieczne. Dawki od 100 do 500 mg na dobę: Brak jest wystarczających danych klinicznych dotyczących zastosowania dawek powyżej 100 mg na dobę do 500 mg na dobę. Dlatego też poniższe zalecenia dla dawek 500 mg na dobę i większych, także odnoszą się do tego zakresu dawki. Dawka 500 mg na dobę i większa: Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na ciążę i (lub) rozwój zarodka lub płodu. Wyniki badań epidemiologicznych wskazują na to, że stosowanie inhibitorów syntezy prostaglandyn we wczesnym okresie ciąży zwiększa ryzyko poronienia, występowania wad wrodzonych serca i wytrzewień wrodzonych. Całkowite ryzyko wystąpienia wrodzonych wad sercowo-naczyniowych zwiększa się z mniej niż 1% do około 1,5%.
- CHPL leku o rpl_id: 100255790Wpływ na płodność, ciążę i laktację
Uważa się, że ryzyko zwiększa się wraz z dawką i długością okresu terapii. U zwierząt po podaniu inhibitorów syntezy prostaglandyn zaobserwowano zwiększone ryzyko obumarcia zapłodnionego jaja w okresie przed i po zagnieżdżeniu się w macicy oraz zwiększone ryzyko obumarcia zarodka lub płodu. Dodatkowo, u zwierząt, po podaniu inhibitorów syntezy prostaglandyn w okresie organogenezy, donoszono o zwiększonej liczbie przypadków różnych wad rozwojowych, w tym wad sercowo-naczyniowych. Kwasu acetylosalicylowego nie należy stosować u kobiet w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. W razie stosowania kwasu acetylosalicylowego przez kobiety usiłujące zajść w ciążę lub w pierwszym i drugim trymestrze ciąży, należy stosować jak najmniejszą dawkę produktu przez jak najkrótszy czas.
- CHPL leku o rpl_id: 100255790Wpływ na płodność, ciążę i laktację
W trzecim trymestrze ciąży wszystkie inhibitory syntezy prostaglandyn mogą powodować narażenie płodu na: działania toksyczne na układ krążenia i oddechowy (włącznie z przedwczesnym zamknięciem przewodu tętniczego i nadciśnieniem płucnym); zaburzenia czynności nerek mogące prowadzić do niewydolności nerek i małowodzia; W końcowym okresie ciąży wszystkie inhibitory prostaglandyn mogą spowodować narażenie matki i noworodka na: możliwość wydłużenia czasu krwawienia oraz działanie antyagregacyjne, które może ujawnić się nawet po zastosowaniu małych dawek; zahamowanie czynności skurczowej macicy prowadzącej do opóźnienia porodu lub przedłużenia akcji porodowej. W konsekwencji kwas acetylosalicylowy w dawkach 100 mg na dobę lub większych jest przeciwwskazany w trzecim trymestrze ciąży. Karmienie piersi? Kwas acetylosalicylowy i jego metabolity przenikają w niewielkich ilościach do mleka kobiet karmiących piersią.
- CHPL leku o rpl_id: 100255790Wpływ na płodność, ciążę i laktację
Ponieważ jak dotąd, podczas krótkotrwałego stosowania salicylanów przez matki, nie stwierdzono występowania działań niepożądanych u niemowląt karmionych piersią, przerywanie karmienia piersią nie jest konieczne. W przypadku długotrwałego stosowania i (lub) podawania większych dawek kwasu acetylosalicylowego, karmienie piersią powinno być przerwane.
- CHPL leku o rpl_id: 100255790Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brak danych dotyczących wpływu produktu leczniczego Cardioteva na zdolność prowadzenia pojazdów i obsługiwania maszyn. W oparciu o właściwości farmakodynamiczne i działania niepożądane, oczekuje się, że kwas acetylosalicylowy nie wpływa na reakcje i zdolność do prowadzenia pojazdów lub obsługiwania maszyn.
- CHPL leku o rpl_id: 100255790Działania niepożądane
4.8 Działania niepożądane Działania niepożądane zostały pogrupowane na podstawie klasyfikacji układów i narządów. W ramach każdej klasyfikacji układów i narządów częstości zostały zdefiniowane jako: bardzo często (≥1/10); często (≥1/100 do < /10); niezbyt często (≥1/1 000 do <1/100); rzadko (≥1/10 000 do < 1/1 000); bardzo rzadko (<1/10 000) i nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego Często: Zwiększona skłonność do krwawień. Rzadko: Trombocytopenia, granulocytoza, anemia aplastyczna. Nieznana: Przypadki krwawień z przedłużonym czasem krwawienia jak krwawienie z nosa, krwawienie z dziąsła. Objawy mogą się utrzymywać przez okres 4-8 dni po przerwaniu podawania kwasu acetylosalicylowego. W wyniku tego może zwiększyć się ryzyko krwawienia podczas zabiegu chirurgicznego.
- CHPL leku o rpl_id: 100255790Działania niepożądane
Istniejące krwawienie (krwawe wymioty, smoliste stolce) lub wystąpienie krwawienia z przewodu pokarmowego, może prowadzić do anemii z niedoboru żelaza (częstsze po większych dawkach). Zaburzenia układu immunologicznego Nieznana: Reakcje nadwrażliwości, obrzęk naczynioruchowy, obrzęk alergiczny, reakcje anafilaktyczne, włączając wstrząs. Zaburzenia metabolizmu i odżywiania Nieznana: Hiperurykemia. Zaburzenia układu nerwowego Rzadko: Krwawienie wewnątrzczaszkowe. Nieznana: Ból głowy, zawroty głowy. Zaburzenia ucha i błędnika Nieznana: Zaburzenia słuchu; szumy uszne. Zaburzenia naczyniowe Rzadko: Krwotoczne zapalenie naczyń. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Niezbyt często: Nieżyt nosa, duszność. Rzadko: Skurcz oskrzeli, ataki astmy oskrzelowej. Zaburzenia układu rozrodczego i piersi Rzadko: Obfite krwawienie miesiączkowe. Zaburzenia żołądka i jelit Często: Niestrawność.
- CHPL leku o rpl_id: 100255790Działania niepożądane
Rzadko: Ciężkie krwawienie z przewodu pokarmowego, nudności, wymioty. Nieznana: Owrzodzenie żołądka lub dwunastnicy i perforacja. Zaburzenie wątroby i dróg żółciowych Nieznana: Niewydolność wątroby. Zaburzenia skóry i tkanki podskórnej Niezbyt często: Pokrzywka. Rzadko: Zespół Stevensa-Johnsona, zespół Lyella, plamica, rumień guzowaty, rumień wielopostaciowy. Zaburzenie nerek i dróg moczowych Nieznana: Zaburzenie czynności nerek. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al.
- CHPL leku o rpl_id: 100255790Działania niepożądane
Jerozolimskie 181C, 02-222 Warszawa, tel.: +48 22 49 21 301, faks: +48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku o rpl_id: 100255790Przedawkowanie
4.9 Przedawkowanie Pomimo znacznych różnic międzyosobniczych można uznać, że dawka toksyczna wynosi około 200 mg/kg mc. u pacjentów dorosłych i 100 mg/kg mc. u dzieci. Śmiertelna dawka kwasu acetylosalicylowego wynosi 25-30 g. Stężenie salicylanów w osoczu powyżej 300 mg/l wskazuje na zatrucie. Stężenie w osoczu ponad 500 mg/l u pacjentów dorosłych i 300 mg/l u dzieci zazwyczaj powoduje ciężkie zatrucie. Przedawkowanie może być szkodliwe dla pacjentów dorosłych i szczególnie u małych dzieci (przedawkowanie terapeutyczne lub częste przypadkowe zatrucia mogą być śmiertelne). Objawy średnio nasilonego zatrucia Szumy uszne, zaburzenia słuchu, ból głowy, zawroty głowy, dezorientacja i zaburzenia żołądka i jelit (nudności, wymioty, ból brzucha). Objawy ciężkiego zatrucia Objawy są związane z poważnymi zaburzeniami równowagi kwasowo-zasadowej. W początkowym stadium występuje hiperwentylacja, która powoduje kwasicę oddechową.
- CHPL leku o rpl_id: 100255790Przedawkowanie
Kwasica oddechowa wywołana jest zahamowaniem ośrodka oddechowego. Dodatkowo kwasica metaboliczna spowodowana jest obecnością salicylanów. U młodszych dzieci objawy nie są często widoczne, aż do osiągnięcia końcowej fazy zatrucia, zwykle kiedy znajdują się one w fazie kwasicy mleczanowej. Ponadto, mogą wystąpić następujące objawy: hipertermia i pocenie się, czego wynikiem jest odwodnienie: uczucie niepokoju, drgawki, omamy i hipoglikemia. Depresja układu oddechowego może prowadzić do śpiączki, zapaści sercowo-naczyniowej lub zatrzymania oddechu. Leczenie przedawkowania Jeśli przyjęto dawkę toksyczną wymagana jest natychmiastowa hospitalizacja. W przypadku umiarkowanego zatrucia należy podjąć próbę sprowokowania wymiotów. Jeśli się to nie uda, w ciągu pierwszej godziny po przyjęciu znacznej ilości leku należy przeprowadzić płukanie żołądka. Następnie należy podać węgiel aktywowany (adsorbent) i siarczan sodu (środek przeczyszczający).
- CHPL leku o rpl_id: 100255790Przedawkowanie
Węgiel aktywowany może być podawany w pojedynczej dawce (50 g dla dorosłych, 1 g/kg masy ciała dla dzieci w wieku poniżej 12 lat). Zakwaszanie moczu (250 mmol NaHCO3) z jednoczesną kontrolą poziomu pH. W przypadku ciężkiego zatrucia preferuje się hemodializę. Inne objawy zatrucia należy leczyć objawowo.
- CHPL leku o rpl_id: 100255790Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Inhibitory agregacji płytek z wyłączeniem heparyn, kod ATC: B01AC06 Kwas acetylosalicylowy hamuje agregację płytek: blokuje cyklooksygenazę w płytkach krwi poprzez acetylację, co hamuje syntezę tromboksanu A2, fizjologicznie aktywowanej substancji, uwalnianej przez płytki krwi i odgrywającej rolę w powikłaniach miażdżycowych. Hamowanie syntezy TXA2 jest nieodwracalne, ponieważ trombocyty, które nie mają jąder, nie są zdolne (z powodu braku możliwości syntezy białek) do syntezowania nowej cyklooksygenazy, która była acetylowana przez kwas acetylosalicylowy. Dawki wielokrotne od 20 do 325 mg hamują aktywność enzymatyczną od 30 do 95%. Ze względu na nieodwracalny charakter wiążący, działanie utrzymuje się przez czas życia trombocytów (7-10 dni). Działanie hamujące nie wyczerpuje się podczas długotrwałego leczenia a aktywność enzymatyczna płytek krwi stopniowo powraca w ciągu 24-48 godzin po przerwaniu leczenia.
- CHPL leku o rpl_id: 100255790Właściwości farmakodynamiczne
Kwas acetylosalicylowy wydłuża czas krwawienia średnio o około 50 do 100%, ale obserwowano indywidualne zmiany w tym zakresie. Dane z badań doświadczalnych sugerują, że wpływ małych dawek kwasu acetylosalicylowego na agregację płytek krwi może być hamowany przez ibuprofen, w przypadku jednoczesnego podawania obu leków. W jednym z badań po podaniu pojedynczej dawki ibuprofenu 400 mg w ciągu 8 godzin przed lub w ciągu 30 minut po podaniu kwasu acetylosalicylowego w postaci farmaceutycznej o natychmiastowym uwalnianiu (81 mg), odnotowano osłabienie wpływu kwasu acetylosalicylowego na powstawanie tromboksanu lub agregację płytek. Z uwagi jednak na ograniczenia tych danych oraz wątpliwości związane z ekstrapolacją danych uzyskanych ex vivo do warunków klinicznych, sformułowanie jednoznacznych wniosków dotyczących regularnego stosowania ibuprofenu nie jest możliwe, a kliniczne następstwa interakcji w przypadku doraźnego podawania ibuprofenu są mało prawdopodobne.
- CHPL leku o rpl_id: 100255790Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Po podaniu doustnym kwas acetylosalicylowy jest szybko i całkowicie wchłaniany z przewodu pokarmowego. Głównym miejscem wchłaniania jest proksymalny odcinek jelita cienkiego. Jednak znaczna część dawki jest już hydrolizowana do kwasu salicylowego w ścianie jelita podczas wchłaniania. Stopień hydrolizy zależy od szybkości wchłaniania. Po przyjęciu produktu Cardioteva, tabletki dojelitowe, maksymalne stężenia w osoczu kwasu acetylosalicylowego i kwasu salicylowego są osiągane po około odpowiednio 5 i 6 godzinach po podaniu na czczo. Jeśli tabletki przyjmowane są z pokarmem, maksymalne stężenia w osoczu osiągane są około 3 godziny później niż po przyjęciu na czczo. Dystrybucja Kwas acetylosalicylowy, jak również główny metabolit, kwas salicylowy, są w dużym stopniu wiązane z białkami osocza i szybko dystrybuowane do wszystkich części ciała.
- CHPL leku o rpl_id: 100255790Właściwości farmakokinetyczne
Stopień wiązania kwasu acetylosalicylowego z białkami osocza zależy głównie od stężenia kwasu salicylowego i białka. Objętość dystrybucji kwasu acetylosalicylowego wynosi około 0,16 l/kg masy ciała. Kwas salicylowy powoli przenika do płynu stawowego, przenika przez barierę łożyska i do mleka matki. Metabolizm Kwas acetylosalicylowy jest szybko metabolizowany do kwasu salicylowego z okresem półtrwania 15-30 minut. Kwas salicylowy jest następnie przekształcany, głównie w sprzężenia z glicyną i kwasem glukuronowym, a niewielka część do kwasu gentyzynowego. Kinetyka eliminacji kwasu salicylowego jest zależna od dawki, ponieważ metabolizm jest ograniczony przez zdolność enzymów wątrobowych. Tak więc, okres półtrwania w fazie eliminacji różni się i wynosi 2-3 godzin po podaniu małych dawek, 12 godzin po zastosowaniu dawek przeciwbólowych oraz 15-30 godzin po podaniu dużych dawek terapeutycznych lub zatruciu. Eliminacja Kwas salicylowy i jego metabolity są wydalane głównie przez nerki.
- CHPL leku o rpl_id: 100255790Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Profil nieklinicznych danych o bezpieczeństwie jest dobrze udokumentowany. W badaniach eksperymentalnych na zwierzętach salicylany nie wykazywały żadnego innego uszkodzenia organów poza uszkodzeniem nerek. W badaniach na szczurach, obserwowano działanie fetotoksyczne i teratogenne kwasu acetylosalicylowego przy dawkach toksycznych dla matki. Znaczenie kliniczne nie jest znane, ponieważ dawki stosowane w badaniach przedklinicznych są znacznie większe (co najmniej 7 razy) niż maksymalne zalecane dawki dla wybranych wskazań sercowo-naczyniowych. Kwas acetylosalicylowy był szeroko badany z uwzględnieniem działania mutagennego i rakotwórczego. Wyniki jako całość nie wskazują na działanie mutagenne i rakotwórcze w badaniach na myszach i szczurach.
- CHPL leku o rpl_id: 100255790Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki: Celuloza mikrokrystaliczna Skrobia kukurydziana Krzemionka koloidalna bezwodna Kwas stearynowy Otoczka tabletki: Kwasu metakrylowego i etylu akrylanu kopolimer (1:1) Polisorbat 80 Sodu laurylosiarczan Trietylu cytrynian Talk 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Blistry: Przechowywać w temperaturze poniżej 25°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. Pojemnik do tabletek: Przechowywać w temperaturze poniżej 25°C. Przechowywać pojemnik szczelnie zamknięty w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Blister (PVC/Aluminium). Pojemnik do tabletek z HDPE z wieczkiem z LDPE. Pojemnik do tabletek z LDPE z wieczkiem z PP. Wielkości opakowań: Blistry: 10, 20, 28, 30, 50, 56, 60, 90, 100 tabletek dojelitowych.
- CHPL leku o rpl_id: 100255790Dane farmaceutyczne
Pojemniki do tabletek: 10, 30, 50, 100, 500 tabletek dojelitowych. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku o rpl_id: 100337400Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ASPIRIN PRO FORTE, 1000 mg, tabletki drażowane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka drażowana zawiera 1000 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum). Substancja pomocnicza o znanym działaniu: każda tabletka drażowana zawiera 6 mmol (143 mg) sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka drażowana Białe lub prawie białe, podłużne tabletki drażowane o wymiarach 19 mm x 9 mm z wytłoczonym napisem „BAYER” na jednej stronie oraz z pojedynczą linią podziału na drugiej stronie. Linia podziału na tabletce ułatwia tylko jej rozkruszenie, w celu łatwiejszego połknięcia, a nie podzielenia na równe dawki.
- CHPL leku o rpl_id: 100337400Wskazania do stosowania
4.1 Wskazania do stosowania Objawowe leczenie gorączki i (lub) bólu o małym lub umiarkowanym nasileniu. Produkt leczniczy Aspirin Pro Forte jest wskazany do stosowania u młodzieży i dorosłych w wieku od 16 do 65 lat.
- CHPL leku o rpl_id: 100337400Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Młodzież i dorośli (w wieku od 16 do 65 lat) Jedna tabletka; w razie potrzeby dawkę powtórzyć, jednak nie wcześniej niż po upływie 4–6 godzin. Nie stosować dawki większej niż maksymalna dawka dobowa 3 tabletki drażowane. Kwasu acetylosalicylowego nie należy przyjmować przez okres dłuższy niż 3 dni (w przypadku gorączki) lub 3–4 dni (w przypadku bólu), chyba że lekarz zaleci inaczej. Zaburzenia czynności nerek i (lub) wątroby U pacjentów z zaburzeniami czynności wątroby lub nerek bądź układu krążenia kwas acetylosalicylowy należy stosować z zachowaniem ostrożności (patrz punkt 4.4). Pacjenci w podeszłym wieku (powyżej 65. roku życia) Aspirin Pro Forte nie jest wskazany do stosowania u dorosłych w wieku powyżej 65 lat. Dostępne są produkty zawierające kwas acetylosalicylowy w innych postaciach farmaceutycznych i mocach.
- CHPL leku o rpl_id: 100337400Dawkowanie
Dzieci i młodzież Aspirin Pro Forte nie jest wskazany do stosowania u dzieci i młodzieży w wieku poniżej 16 lat. Sposób podawania Tabletki należy przyjmować doustnie, popijając dużą ilością wody. W celu otwarcia opakowania foliowego, należy oderwać jego brzeg w dowolnym miejscu.
- CHPL leku o rpl_id: 100337400Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na kwas acetylosalicylowy lub inne salicylany bądź na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, stwierdzona w wywiadzie astma oskrzelowa lub reakcja nadwrażliwości (np. pokrzywka, obrzęk naczynioruchowy, ciężkie zapalenie błony śluzowej nosa, wstrząs) indukowana podaniem salicylanów lub substancji o podobnym działaniu, szczególnie niesteroidowych leków przeciwzapalnych (NLPZ), ostra choroba wrzodowa żołądka i jelit, skaza krwotoczna, ciężka niewydolność nerek, ciężka niewydolność wątroby, ciężka nieskutecznie leczona niewydolność serca, jednoczesne stosowanie metotreksatu w dawkach powyżej 20 mg/tydzień (patrz punkt 4.5), jednoczesne stosowanie doustnych leków przeciwzakrzepowych wraz z kwasem acetylosalicylowym oraz u pacjentów z owrzodzeniami żołądka lub dwunastnicy w wywiadzie (patrz punkt 4.5), ostatni trymestr ciąży (wiek ciążowy powyżej 26. tygodnia) (patrz punkt 4.6).
- CHPL leku o rpl_id: 100337400Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Kwas acetylosalicylowy należy stosować z zachowaniem szczególnej ostrożności w opisanych poniżej przypadkach. Aby uniknąć potencjalnego ryzyka przedawkowania, należy sprawdzić, czy pozostałe produkty lecznicze stosowane przez pacjenta nie zawierają w swoim składzie kwasu acetylosalicylowego. Produktów zawierających kwas acetylosalicylowy nie należy bez konsultacji z lekarzem stosować u dzieci i młodzieży w celu leczenia zakażeń wirusowych przebiegających z lub bez gorączki. W przypadku niektórych chorób wirusowych, szczególnie grypy wywołanej wirusem typu A lub B oraz ospy wietrznej, istnieje ryzyko rozwoju zespołu Reye'a — bardzo rzadkiej, lecz potencjalnie zagrażającej życiu choroby wymagającej natychmiastowej interwencji lekarskiej. Ryzyko to może być zwiększone, gdy pacjentowi poda się kwas acetylosalicylowy, choć dotychczas nie udowodniono związku przyczynowo-skutkowego.
- CHPL leku o rpl_id: 100337400Specjalne środki ostrozności
Jeśli w przebiegu wymienionych zakażeń wirusowych wystąpiłyby uporczywe wymioty, mogą one być jednym z objawów zespołu Reye'a. W przypadku pojawienia się bólu głowy w trakcie długotrwałego stosowania wysokich dawek leków przeciwbólowych, nie należy leczyć go przez zastosowywanie wyższych dawek leku. Regularne stosowanie leków przeciwbólowych, szczególnie dwóch lub większej liczby substancji o działaniu przeciwbólowym jednocześnie, może prowadzić do trwałych zmian w nerkach z towarzyszącym ryzykiem rozwoju niewydolności nerek. W niektórych ciężkich postaciach niedoboru dehydrogenazy glukozo-6-fosforanu (niedoboru G6PD) wysokie dawki kwasu acetylosalicylowego mogą wywoływać hemolizę. U pacjentów z niedoborem G6PD kwas acetylosalicylowy musi być podawany pod nadzorem lekarza. Monitorowanie leczenia należy wprowadzić w następujących przypadkach: u pacjentów ze stwierdzonym w wywiadzie owrzodzeniem żołądka lub dwunastnicy, bądź krwawieniem z przewodu pokarmowego, bądź zapaleniem błony śluzowej żołądka, u pacjentów z niewydolnością nerek, u pacjentów z niewydolnością wątroby, u pacjentów z astmą oskrzelową — wystąpienie napadu astmy oskrzelowej może u niektórych pacjentów mieć związek z alergią na niesteroidowe leki przeciwzapalne lub na kwas acetylosalicylowy; w tym przypadku omawiany produkt leczniczy jest przeciwwskazany (patrz punkt 4.3), u pacjentek z krwotokiem macicznym (metrorrhagia) lub krwotokiem miesiączkowym (menorrhagia) (ze względu na ryzyko zwiększenia obfitości i czasu trwania miesiączki).
- CHPL leku o rpl_id: 100337400Specjalne środki ostrozności
Ze względu na hamujący wpływ na agregację płytek krwi, utrzymujący się przez kilka dni od podania, kwas acetylosalicylowy może zwiększać skłonność do krwawień w trakcie i po zakończeniu zabiegów chirurgicznych, nawet tych drobnych (np. po ekstrakcji zęba). W każdym momencie w trakcie stosowania omawianego produktu może dojść do krwawienia z przewodu pokarmowego lub owrzodzenia i (lub) perforacji przewodu pokarmowego — również bez żadnych uprzednich objawów na to wskazujących czy obciążenia w wywiadzie. Względne ryzyko wystąpienia tych powikłań jest zwiększone u pacjentów w podeszłym wieku, u pacjentów z niską masą ciała oraz u pacjentów otrzymujących leki przeciwzakrzepowe bądź inhibitory agregacji płytek krwi (patrz punkt 4.5). W przypadku wystąpienia krwawienia z przewodu pokarmowego stosowanie omawianego produktu leczniczego należy natychmiast przerwać. Kwas acetylosalicylowy zmniejsza wydalanie kwasu moczowego. Może to u predysponowanych pacjentów wywoływać napady dny moczanowej.
- CHPL leku o rpl_id: 100337400Specjalne środki ostrozności
Nie zaleca się stosowania omawianego produktu leczniczego w okresie karmienia piersią (patrz punkt 4.6).
- CHPL leku o rpl_id: 100337400Interakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Nie zaleca się stosowania kwasu acetylosalicylowego łącznie z następującymi lekami: doustnymi lekami przeciwzakrzepowymi u pacjentów bez owrzodzeń żołądka lub dwunastnicy w wywiadzie (patrz punkt 4.5), klopidogrelem (oprócz zarejestrowanych wskazń do stosowania skojarzonego leczenia klopidogrelu z kwasem acetylosalicylowym w ostrych zespołach wieńcowych) (patrz punkt 4.5), tyklopidyną (patrz punkt 4.5), anagrelidem — ze względu na ryzyko krwotoku i zmniejszonego efektu antytrombotycznego (patrz punkt 4.5), heparynami niskocząsteczkowymi (i pokrewnymi substancjami czynnymi) oraz heparynami niefrakcjonowanymi w dawkach leczniczych (patrz punkt 4.5), innymi niesteroidowymi lekami przeciwzapalnymi (NLPZ) (patrz punkt 4.5), glikokortykoidami (z wyjątkiem leczenia substytucyjnego hydrokortyzonem) (patrz punkt 4.5), lekami zwiększającymi wydalanie kwasu moczowego z moczem (patrz punkt 4.5), pemetreksedem u pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności nerek (klirens kreatyniny od 45 do 80 ml/min) (patrz punkt 4.5).
- CHPL leku o rpl_id: 100337400Wpływ na płodność, ciążę i laktację
4.6 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Ten produkt zawiera 143 mg sodu w jednej dawce, co jest równoważne 7 % zalecanej przez Światową Organizację Zdrowia (WHO) maksymalnej dawki dobowej spożycia sodu. Maksymalna dawka dobowa tego produktu jest równoważna 22 % zalecanej przez WHO maksymalnej dawki dobowej spożycia sodu. ASPIRIN PRO FORTE jest uważany za produkt o wysokiej zawartości sodu. Powinno to być szczególnie brane pod uwagę stosując go u osób będących na diecie niskosodowej. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Metotreksat w dawkach powyżej 20 mg/tydzień jest przeciwwskazany (patrz punkt 4.3). ¹ Ten punkt ChPL nie znajduje odzwierciedlenia w ulotce informacyjnej dla pacjenta, gdyż jego treść — z punktu widzenia pacjenta bez fachowego przygotowania medycznego — jest już w równoważnym stopniu zawarta w informacjach podanych w punkcie 4.5.
- CHPL leku o rpl_id: 100337400Wpływ na płodność, ciążę i laktację
Zwiększona toksyczność metotreksatu, szczególnie toksyczność hematologiczna (z powodu zmniejszenia klirensu nerkowego metotreksatu przez kwas acetylosalicylowy). Metotreksat w dawkach nie większych niż 20 mg/tydzień należy stosować z zachowaniem ostrożności. Zwiększona toksyczność metotreksatu, szczególnie toksyczność hematologiczna (z powodu zmniejszenia klirensu nerkowego metotreksatu przez kwas acetylosalicylowy). W pierwszych tygodniach jednoczesnego stosowania omawianego produktu leczniczego i metotreksatu należy raz w tygodniu wykonywać kontrolną morfologię krwi obwodowej. Dokładne monitorowanie konieczne jest u pacjentów z zaburzeniami czynności nerek (nawet łagodnymi) oraz u pacjentów w podeszłym wieku. Kilka substancji czynnych wchodzi w interakcje ze względu na swoje właściwości hamujące agregację płytek krwi (substancjami tymi są m.in.: abcyksymab, kwas acetylosalicylowy, cylostazol, klopidogrel, epoprostenol, eptyfibatyd, iloprost, iloprost w połączeniu z trometamolem, prasugrel, tyklopidyna, tyrofiban, tikagrelor oraz anagrelid): Jednoczesne stosowanie więcej niż jednego inhibitora agregacji płytek krwi, a także stosowanie inhibitora agregacji płytek krwi łącznie z heparyną lub pokrewnymi substancjami czynnymi, lekami przeciwzakrzepowymi lub innymi lekami trombolitycznymi zwiększa ryzyko krwawienia i musi być uwzględniane poprzez prowadzenie regularnych kontroli stanu klinicznego pacjenta.
- CHPL leku o rpl_id: 100337400Wpływ na płodność, ciążę i laktację
W konsekwencji wymienione poniżej połączenia są albo przeciwwskazane (patrz punkt 4.3), albo niezalecane, albo wymagają stosowania lub rozważenia stosowania środków ostrożności: kwas acetylosalicylowy z doustnymi lekami przeciwzakrzepowymi u pacjentów, którzy w przeszłości mieli lub nie owrzodzenia żołądka lub dwunastnicy: zwiększone ryzyko krwotoku. kwas acetylosalicylowy z heparynami niskocząsteczkowymi (i pokrewnymi substancjami czynnymi) oraz heparynami niefrakcjonowanymi – w dawkach leczniczych: zwiększone ryzyko krwotoku (hamowanie agregacji płytek krwi i uszkadzający wpływ na błonę śluzową przewodu pokarmowego przez kwas acetylosalicylowy) — należy zastosować inny lek przeciwzapalny lub inny lek przeciwbólowy lub przeciwgorączkowy. w dawkach profilaktycznych: w wyniku jednoczesnego podawania, wskutek oddziaływania na różnych poziomach kaskady reakcji biochemicznych prowadzącej do hemostazy, zwiększa się ryzyko krwotoku.
- CHPL leku o rpl_id: 100337400Wpływ na płodność, ciążę i laktację
kwas acetylosalicylowy z heparynami (lub pokrewnymi substancjami czynnymi) w dawkach profilaktycznych, bez względu na dawkę kwasu acetylosalicylowego — należy zwrócić szczególną uwagę poprzez prowadzenie kontroli stanu klinicznego pacjenta i parametrów laboratoryjnych, zależnie od potrzeby. kwas acetylosalicylowy z lekami trombolitycznymi: zwiększone ryzyko krwotoku. kwas acetylosalicylowy z klopidogrelem – oprócz zarejestrowanych wskazań do stosowania skojarzonego leczenia klopidogrelu z kwasem acetylosalicylowym w ostrych zespołach wieńcowych: zwiększone ryzyko krwotoku. jeśli nie jest możliwe uniknięcie jednoczesnego stosowania tych dwóch leków, zaleca się monitorowanie stanu klinicznego pacjenta. w zarejestrowanych wskazaniach do stosowania skojarzonego leczenia klopidogrelu z kwasem acetylosalicylowym w ostrych zespołach wieńcowych: zwiększone ryzyko krwotoku. zaleca się monitorowanie stanu klinicznego pacjenta. kwas acetylosalicylowy z tyklopidyną: zwiększone ryzyko krwotoku.
- CHPL leku o rpl_id: 100337400Wpływ na płodność, ciążę i laktację
jeśli nie jest możliwe uniknięcie jednoczesnego stosowania tych dwóch leków, zaleca się monitorowanie stanu klinicznego pacjenta. kwas acetylosalicylowy z anagrelidem: zwiększone ryzyko krwotoku i zmniejszenie efektu antytrombotycznego. jeśli nie jest możliwe uniknięcie jednoczesnego stosowania tych dwóch leków, zaleca się monitorowanie stanu klinicznego pacjenta. • kwas acetylosalicylowy lub inne salicylany w wysokich dawkach z innymi niesteroidowymi lekami przeciwzapalnymi (nlpz): zwiększone ryzyko owrzodzeń przewodu pokarmowego i krwotoku z powodu potencjalnego efektu synergistycznego. • kwas acetylosalicylowy z podawanymi ogólnie glikokortykoidami (z wyjątkiem leczenia substytucyjnego hydrokortyzonem) połączenia niezalecane do wzięcia pod uwagę: zwiększone ryzyko krwotoku z powodu potencjalnego efektu synergistycznego.
- CHPL leku o rpl_id: 100337400Wpływ na płodność, ciążę i laktację
• kwas acetylosalicylowy z wybiórczymi inhibitorami wychwytu zwrotnego serotoniny (SSRI) - np.: cytalopramem, escytalopramem, fluoksetyną, fluwoksaminą, paroksetyną, sertraliną: zwiększone ryzyko krwotoku. • kwas acetylosalicylowy z lekami moczopędnymi, inhibitorami konwertazy angiotensyny (inhibitorami ace) oraz antagonistami receptora angiotensyny ii: u pacjentów odwodnionych może rozwinąć się ostra niewydolność nerek z powodu zmniejszenia przesączania kłębuszkowego na skutek zmniejszonej syntezy nerkowych prostaglandyn. Oprócz tego może dojść do zmniejszenia działania zapobiegającemu nadciśnieniu. Należy dopilnować, by pacjent był odpowiednio nawodniony i kontrolować czynność nerek na początku leczenia. • Kwas acetylosalicylowy z lekami zwiększającymi wydalanie kwasu moczowego z moczem (np. benzobromaronem, probenecydem): Zmniejszenie wydalania kwasu moczowego z moczem z powodu współzawodniczenia z kwasem moczowym o eliminację w kanalikach nerkowych.
- CHPL leku o rpl_id: 100337400Wpływ na płodność, ciążę i laktację
• Kwas acetylosalicylowy z pemetreksedem: Zwiększone ryzyko toksyczności pemetreksedu z powodu zmniejszenia klirensu nerkowego pemetreksedu przez kwas acetylosalicylowy. • Kwas acetylosalicylowy z deferazyroksem: Zwiększone ryzyko owrzodzeń przewodu pokarmowego i krwotoku. • Leki działające miejscowo na błonę śluzową przewodu pokarmowego, zmniejszające kwaśność soku żołądkowego i węgiel aktywny: Zwiększone wydalanie nerkowe kwasu acetylosalicylowego z powodu alkalizacji moczu. Zaleca się zachowanie co najmniej dwugodzinnej przerwy między podaniem leków działających miejscowo na błonę śluzową przewodu pokarmowego oraz zmniejszających kwaśność soku żołądkowego a podaniem kwasu acetylosalicylowego. • Kwas acetylosalicylowy z alkoholem: Zwiększone ryzyko uszkodzenia błony śluzowej przewodu pokarmowego i wydłużenia czasu krzepnięcia z powodu addytywnego działania kwasu acetylosalicylowego i alkoholu.
- CHPL leku o rpl_id: 100337400Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na przebieg ciąży i (lub) rozwój zarodka i płodu. Dane uzyskane w badaniach epidemiologicznych wskazują na zwiększone ryzyko poronień, rozwoju wad wrodzonych serca i wytrzewień wrodzonych po stosowaniu inhibitorów syntezy prostaglandyn we wczesnym okresie ciąży. Odnotowano wzrost bezwzględnego ryzyka rozwoju wad wrodzonych serca i naczyń z mniej niż 1% do około 1,5%. Ryzyko to wydaje się wzrastać wraz ze zwiększeniem stosowanej dawki i wydłużeniem okresu leczenia. U zwierząt po podaniu inhibitorów syntezy prostaglandyn zaobserwowano zwiększone ryzyko obumarcia zapłodnionego jaja w okresie przed i po implantacji oraz do zwiększenia ryzyka obumarcia zarodka lub płodu. Dodatkowo, u zwierząt otrzymujących inhibitory syntezy prostaglandyn w okresie organogenezy odnotowywano zwiększoną częstość występowania różnych wad wrodzonych, w tym wad serca i naczyń.
- CHPL leku o rpl_id: 100337400Wpływ na płodność, ciążę i laktację
Produktów leczniczych zawierających kwas acetylosalicylowy nie należy podawać w pierwszym i drugim trymestrze ciąży, chyba że jest to zdecydowanie konieczne. W przypadku stosowania produktów leczniczych zawierających kwas acetylosalicylowy u kobiety próbującej zajść w ciążę bądź w pierwszym lub drugim trymestrze ciąży, należy stosować jak najmniejszą dawkę i produkt ten podawać możliwie najkrócej. W trzecim trymestrze ciąży wszystkie inhibitory syntezy prostaglandyn mogą narażać płód na: działania toksyczne w obrębie układu krążenia i układu oddechowego (z przedwczesnym zamknięciem przewodu tętniczego i rozwojem nadciśnienia płucnego); zaburzeń czynności nerek, która może ulegać progresji do niewydolności nerek i małowodzia. W trzecim trymestrze, pod koniec ciąży, wszystkie inhibitory syntezy prostaglandyn mogą narażać zarówno matkę, jak i noworodka, na: możliwe wydłużenie czasu krwawienia, na skutek efektu antyagregacyjnego, który może wystąpić nawet przy bardzo niskich dawkach; zahamowanie czynności skurczowej macicy prowadzące do opóźnienia lub wydłużenia akcji porodowej.
- CHPL leku o rpl_id: 100337400Wpływ na płodność, ciążę i laktację
W związku z powyższym stosowanie kwasu acetylosalicylowego jest przeciwwskazane w trzecim trymestrze ciąży (patrz punkt 4.3). Karmienie piersi? Kwas acetylosalicylowy przenika do mleka kobiecego. Nie zaleca się w związku z tym stosowania kwasu acetylosalicylowego w okresie karmienia piersią (patrz punkt 4.4). Wpływ na płodność Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
- CHPL leku o rpl_id: 100337400Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Kwas acetylosalicylowy nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku o rpl_id: 100337400Działania niepożądane
4.8 Działania niepożądane Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) Zaburzenia krwi i układu chłonnego Krwawienie i zwiększona skłonność do krwawień (krwotoki z nosa, krwawienia z dziąseł, plamica, krwiaki, krwawienia z dróg moczowych itp.) z wydłużeniem czasu krzepnięcia. Ryzyko krwawień może utrzymywać się przez okres od 4 do 8 dni od odstawienia kwasu acetylosalicylowego. Może być przyczyną zwiększonego ryzyka krwotoku w przypadku zabiegów chirurgicznych. Mogą również wystąpić krwotoki śródczaszkowe i z przewodu pokarmowego. Zaburzenia układu immunologicznego Reakcje nadwrażliwości z odpowiadającymi im objawami klinicznymi, w tym reakcje anafilaktyczne, astma oskrzelowa, obrzęk naczynioruchowy. Zaburzenia układu nerwowego Ból głowy, zawroty głowy, wrażenie utraty słuchu, szumy uszne, będące zazwyczaj objawami przedawkowania. Krwotok śródczaszkowy. Zaburzenia żołądka i jelit Ból brzucha.
- CHPL leku o rpl_id: 100337400Działania niepożądane
Utajone lub jawne krwawienie z przewodu pokarmowego (wymioty krwawe, smoliste stolce itp.) prowadzące do niedokrwistości z niedoboru żelaza. Ryzyko krwawienia wykazuje zależność od zastosowanej dawki. Owrzodzenia i perforacje przewodu pokarmowego. Zaburzenia wątroby i dróg żółciowych Wzrost aktywności enzymów wątrobowych, najczęściej ustępujący po odstawieniu omawianego produktu leczniczego, uszkodzenie wątroby głównie o charakterze uszkodzenia miąższowego (wątrobowokomórkowego). Zaburzenia skóry i tkanki podskórnej Pokrzywka, reakcje skórne. Zaburzenia ogólne Zespół Reye'a (patrz punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku o rpl_id: 100337400Działania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: ndl@urpl.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku o rpl_id: 100337400Przedawkowanie
4.9 Przedawkowanie Ryzyko przedawkowania stwarza największe zagrożenie u pacjentów w podeszłym wieku oraz, szczególnie, u małych dzieci (przedawkowanie w trakcie stosowania leku w celach leczniczych lub, co zdarza się częściej, przypadkowe zatrucie), gdyż w tych przypadkach może ono zakończyć się zgonem. Objawy Umiarkowane zatrucie: Takie objawy, jak szumy uszne, wrażenie utraty słuchu, ból głowy i zawroty głowy wskazują na przedawkowanie i można je opanować przez zmniejszenie dawki leku. Ciężkie zatrucie: Objawy obejmują: gorączkę, hiperwentylację, ketozę, zasadowicę oddechową, kwasicę metaboliczną, śpiączkę, zapaść krążeniową, niewydolność oddechową, ciężką hipoglikemię. Postępowanie ratunkowe Natychmiastowe przetransportowanie chorego do specjalistycznego oddziału szpitalnego Płukanie przewodu pokarmowego i podanie węgla aktywnego Korygowanie zaburzeń gospodarki kwasowo-zasadowej Alkalizacja moczu z monitorowaniem pH moczu W ciężkich przypadkach zatrucia hemodializa Leczenie objawowe
- CHPL leku o rpl_id: 100337400Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: układ nerwowy, inne leki przeciwbólowe i przeciwgorączkowe. Kod ATC: N02BA01 Kwas acetylosalicylowy należy do grupy kwasowych niesteroidowych leków przeciwzapalnych i cechuje się działaniem przeciwbólowym, przeciwgorączkowym i przeciwzapalnym. Jego mechanizm działania oparty jest na nieodwracalnym hamowaniu enzymów z grupy cyklooksygenaz uczestniczących w syntezie prostaglandyn. W badaniach klinicznych nad kwasem acetylosalicylowym podawanym doustnie w dawkach wynoszących, generalnie, od 300 mg do 1000 mg wykazano skuteczność w łagodzeniu różnorodnych dolegliwości bólowych, np. napięciowego bólu głowy, migrenowego bólu głowy, bólu zębów, bólu w przebiegu pierwotnego bolesnego miesiączkowania, bólu gardła, bólów mięśniowych i stawowych, a także skuteczność w obniżaniu temperatury w chorobach przebiegających z gorączką, takich jak przeziębienie i grypa.
- CHPL leku o rpl_id: 100337400Właściwości farmakodynamiczne
Jest on ponadto stosowany w ostrych i przewlekłych chorobach zapalnych, takich jak reumatoidalne zapalenie stawów, zapalenie kości i stawów i zesztywniające zapalenie stawów kręgosłupa. Kwas acetylosalicylowy hamuje ponadto agregację płytek krwi, blokując syntezę tromboksanu A2 w płytkach krwi. Jest on zatem stosowany w różnorodnych wskazaniach naczyniowych w dawkach wynoszących zwykle od 75 do 300 mg na dobę.
- CHPL leku o rpl_id: 100337400Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Omawiana postać kwasu acetylosalicylowego zapewnia szybkie łagodzenie bólu w schorzeniach przebiegających z dolegliwościami bólowymi o nasileniu od małego do umiarkowanego. Szybkie działanie przeciwbólowe jest efektem szybkiego początku działania dzięki skróceniu czasu do osiągnięcia maksymalnego stężenia w osoczu. Szybko rozpadający się rdzeń tabletki drażowanej stanowi połączenie rozdrobnionych cząstek substancji czynnej (kwasu acetylosalicylowego) ze składnikiem musującym. W wyniku szybkiego rozpadu produktu w przewodzie pokarmowym (dzięki zastosowaniu technologii MicroActive®) uzyskano szybsze wchłanianie kwasu acetylosalicylowego. Po podaniu doustnym, kwas acetylosalicylowy uwolniony z tej postaci produktu wchłania się z przewodu pokarmowego bardzo szybko i całkowite. Zgodnie z przeprowadzonymi badaniami biodostępności, kwas acetylosalicylowy jest obecny w osoczu w piątej minucie od podania.
- CHPL leku o rpl_id: 100337400Właściwości farmakokinetyczne
W trakcie i po zakończeniu wchłaniania kwas acetylosalicylowy ulega przemianie do głównego aktywnego metabolitu, którym jest kwas salicylowy. Jak wynika z badań biodostępności, średnie maksymalne stężenia w osoczu osiągane są po około 22,8 minuty dla kwasu acetylosalicylowego i po około 43,2 minuty dla kwasu salicylowego. Dzięki zastosowaniu omawianej technologii, w porównaniu z konwencjonalnymi tabletkami kwasu acetylosalicylowego (Aspirin®) czas do osiągnięcia maksymalnego stężenia kwasu acetylosalicylowego i kwasu salicylowego w osoczu uległ zmniejszeniu odpowiednio około 2,0 i 4,0 razy. Porównawcze badania skuteczności klinicznej z udziałem ponad 1000 pacjentów z pooperacyjnym bólem zębów, wykazały klinicznie szybszy początek działania tego produktu. W badaniach tych, czas do pierwszego wyczuwalnego złagodzenia bólu, czas do pierwszego potwierdzonego wyczuwalnego złagodzenia bólu oraz czas do znaczącego złagodzenia bólu — w porównaniu z konwencjonalnymi tabletkami kwasu acetylosalicylowego — był istotnie statystycznie krótszy, natomiast ogólna skuteczność (czas utrzymywania się i nasilenie uzyskanego efektu) nie uległa zmianie.
- CHPL leku o rpl_id: 100337400Właściwości farmakokinetyczne
W porównaniu z konwencjonalnymi tabletkami kwasu acetylosalicylowego czas do znaczącego złagodzenia bólu był dwa razy krótszy (49 minut wobec 99 minut).
- CHPL leku o rpl_id: 100337400Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Profil bezpieczeństwa kwasu acetylosalicylowego w badaniach przedklinicznych jest dobrze udokumentowany. W badaniach na zwierzętach salicylany powodowały uszkodzenie nerek i owrzodzenia żołądkowo-jelitowe. Kwas acetylosalicylowy został bardzo dokładnie przebadany w warunkach in vitro i in vivo pod kątem działania mutagennego; w badaniach tych nie znaleziono dowodów świadczących o właściwościach mutagennych. To samo dotyczy badań nad właściwościami rakotwórczymi. W badaniach na zwierzętach wykazano działanie teratogenne salicylanów u kilku gatunków zwierząt (przejawiające się np. wadami wrodzonymi serca i układu kostnego, wadami wrodzonymi w linii pośrodkowej). Opisywano też zaburzenia implantacji zarodka, działania embrio- i fetotoksyczne oraz upośledzenie zdolności uczenia się u potomstwa po ekspozycji na salicylany w okresie prenatalnym.
- CHPL leku o rpl_id: 100337400Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki: Krzemionka koloidalna bezwodna Sodu węglan bezwodny Otoczka tabletki: Wosk Carnauba Hypromeloza 5cP Cynku stearynian 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 30°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Blister miękki Papier/PE/Aluminium/Kopolimer lub PET/EEA/Aluminium/Kopolimer, zabezpieczony przed dostępem dzieci, w tekturowym pudełku. Opakowania zawierają po 4, 8 lub 12 tabletek drażowanych. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku o rpl_id: 100340431Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Acetylsalicylic Acid Sandoz, 100 mg, tabletki dojelitowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka dojelitowa zawiera 100 mg kwasu acetylosalicylowego (Acidum acetylsalicylicum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka dojelitowa Białe, okrągłe, obustronnie wypukłe tabletki powlekane o średnicy 7,2 mm.
- CHPL leku o rpl_id: 100340431Wskazania do stosowania
4.1 Wskazania do stosowania Stosowanie produktu leczniczego Acetylsalicylic Acid Sandoz ogranicza się do prewencji wtórnej w leczeniu przewlekłym: Prewencja wtórna u osób po przebytym zawale serca. Zapobieganie chorobom sercowo-naczyniowym u pacjentów ze stabilną dławicą piersiową. Niestabilna dławica piersiowa w wywiadzie (z wyjątkiem ostrej fazy). Zapobieganie zatkaniu przeszczepu naczyniowego po kardiochirurgicznym zabiegu wszczepienia pomostów aortalno-wieńcowych (by-pass) (ang. CABG - Coronary Artery Bypass Grafting). Stan po angioplastyce wieńcowej (z wyjątkiem ostrej fazy). Profilaktyka wtórna u pacjentów po przebytym przemijającym napadzie niedokrwiennym mózgu (ang. TIA - Transient Ischaemic Attacks) i incydentach niedokrwiennych mózgowo-naczyniowych (ang. CVA - Cerebrovascular Accidents), pod warunkiem wykluczenia krwawień śródmózgowych. Produkt leczniczy Acetylsalicylic Acid Sandoz nie jest zalecany w stanach nagłych.
- CHPL leku o rpl_id: 100340431Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Prewencja wtórna u osób po przebytym zawale serca: Zalecana dawka wynosi 100 mg raz na dobę. Zapobieganie chorobom sercowo-naczyniowym u pacjentów ze stabilną dławicą piersiową: Zalecana dawka wynosi 100 mg raz na dobę. Niestabilna dławica piersiowa w wywiadzie (z wyjątkiem ostrej fazy): Zalecana dawka wynosi 100 mg raz na dobę. Zapobieganie zatkaniu przeszczepu naczyniowego po zabiegu wszczepienia pomostów aortalno-wieńcowych (CABG): Zalecana dawka wynosi 100 mg raz na dobę. Stan po angioplastyce wieńcowej (z wyjątkiem ostrej fazy): Zalecana dawka wynosi 100 mg raz na dobę. Profilaktyka wtórna przemijających napadów niedokrwiennych mózgu (TIA) i incydentów niedokrwiennych mózgowo-naczyniowych (CVA), pod warunkiem wykluczenia krwawień śródmózgowych: Zalecana dawka wynosi 100 mg raz na dobę. Zwykle stosowana dawka w długotrwałym leczeniu wynosi 100 mg raz na dobę.
- CHPL leku o rpl_id: 100340431Dawkowanie
Produktu Acetylsalicylic Acid Sandoz nie należy stosować w większych dawkach bez zalecenia lekarza, a dawka przepisana przez lekarza nie powinna być większa niż 300 mg. Osoby w podeszłym wieku: Zasadniczo kwas acetylosalicylowy należy stosować ostrożnie u pacjentów w podeszłym wieku, którzy są bardziej podatni na występowanie działań niepożądanych. Jeśli pacjent nie ma ciężkiej niewydolności nerek lub wątroby, zalecana jest dawka stosowana zwykle u osób dorosłych (patrz punkty 4.3 i 4.4). Przebieg leczenia należy oceniać systematycznie. Dzieci i młodzież: Kwasu acetylosalicylowego nie należy podawać dzieciom i młodzieży w wieku poniżej 16 lat, z wyjątkiem wyraźnych zaleceń lekarskich, gdy korzyści z leczenia przeważają nad ryzykiem (patrz punkt 4.4). Sposób podawania Podanie doustne. Tabletki należy połykać w całości, popijając wystarczającą ilością płynu (1/2 szklanki wody).
- CHPL leku o rpl_id: 100340431Dawkowanie
Otoczka tabletki dojelitowej chroni błonę śluzową jelit przed podrażnieniem, dlatego tabletek nie należy kruszyć, łamać ani żuć. Produkt leczniczy Acetylsalicylic Acid Sandoz jest przeznaczony do długotrwałego stosowania.
- CHPL leku o rpl_id: 100340431Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na związki kwasu salicylowego lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Występujący w wywiadzie napad astmy wywołany podaniem salicylanów lub substancji o podobnym działaniu, zwłaszcza niesteroidowych leków przeciwzapalnych. Czynny lub nawracający w wywiadzie wrzód trawienny i (lub) krwawienia z przewodu pokarmowego lub innego rodzaju krwawienia, takie jak krwawienia z naczyń mózgowych. Skaza krwotoczna; zaburzenia krzepnięcia, takie jak hemofilia lub małopłytkowość. Ciężkie zaburzenia czynności wątroby. Ciężkie zaburzenia czynności nerek. Ciężka niewyrównana niewydolność serca. Stosowanie dawek dobowych 100 mg i większych w trzecim trymestrze ciąży (patrz punkt 4.6). Stosowanie metotreksatu w dawkach większych niż 15 mg na tydzień (patrz punkt 4.5).
- CHPL leku o rpl_id: 100340431Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Acetylsalicylic Acid Sandoz nie jest zalecany do stosowania jako lek przeciwzapalny, przeciwbólowy, przeciwgorączkowy. Działanie kwasu acetylosalicylowego hamujące agregację płytek utrzymuje się przez 4 do 8 dni po podaniu produktu leczniczego, dlatego istnieje zwiększone ryzyko krwawienia, zwłaszcza podczas lub po zabiegu chirurgicznym (nawet niewielkim, np. ekstrakcji zęba). Należy zachować ostrożność przed zabiegiem, włączając ekstrakcję zęba. Może być konieczne czasowe przerwanie leczenia. Nie zaleca się stosowania produktu Acetylsalicylic Acid Sandoz podczas obfitego krwawienia miesiączkowego, gdyż może on nasilić krwawienie. Produkt Acetylsalicylic Acid Sandoz należy stosować ostrożnie u pacjentów z nadciśnieniem tętniczym, z chorobą wrzodową żołądka lub dwunastnicy w wywiadzie, z epizodami krwawienia albo otrzymujących leki przeciwzakrzepowe. Pacjenci powinni zgłaszać lekarzowi każde nietypowe krwawienie.
- CHPL leku o rpl_id: 100340431Specjalne środki ostrozności
Jeśli u pacjenta wystąpi krwawienie z przewodu pokarmowego lub owrzodzenie, leczenie należy przerwać. Kwas acetylosalicylowy należy stosować ostrożnie u pacjentów z umiarkowanymi zaburzeniami czynności nerek lub wątroby (stosowanie jest przeciwwskazane u pacjentów z ciężkimi zaburzeniami) lub u pacjentów odwodnionych, gdyż stosowanie leków z grupy NLPZ może spowodować pogorszenie czynności nerek. U pacjentów z lekką lub umiarkowaną niewydolnością wątroby należy regularnie badać czynność wątroby. Kwas acetylosalicylowy może prowokować skurcz oskrzeli lub napady astmy oskrzelowej lub inne reakcje nadwrażliwości. Czynnikami ryzyka są istniejąca astma, katar sienny, polipy błony śluzowej nosa lub przewlekłe choroby układu oddechowego. Dotyczy to również pacjentów, u których występują reakcje alergiczne (tj. reakcje skórne, świąd lub pokrzywka) na inne substancje.
- CHPL leku o rpl_id: 100340431Specjalne środki ostrozności
Podczas stosowania kwasu acetylosalicylowego rzadko zgłaszano ciężkie reakcje skórne, w tym zespół Stevensa-Johnsona (patrz punkt 4.8). Stosowanie produktu leczniczego Acetylsalicylic Acid Sandoz należy przerwać po wystąpieniu pierwszych objawów wysypki skórnej, zmian na błonach śluzowych lub jakichkolwiek innych objawów nadwrażliwości. Pacjenci w podeszłym wieku są szczególnie wrażliwi na działania niepożądane spowodowane przez NLPZ, w tym kwas acetylosalicylowy, a zwłaszcza na krwawienie z przewodu pokarmowego i perforację, które mogą prowadzić do zgonu (patrz punkt 4.2). Jeśli konieczne jest długotrwałe leczenie, stan pacjentów należy poddawać regularnej ocenie. Produktu Acetylsalicylic Acid Sandoz nie należy stosować razem z innymi produktami leczniczymi zawierającymi kwas acetylosalicylowy lub z innymi NLPZ (patrz punkt 4.5).
- CHPL leku o rpl_id: 100340431Specjalne środki ostrozności
Ze względu na zwiększone ryzyko krwawienia nie zaleca się jednoczesnego stosowania produktu leczniczego Acetylsalicylic Acid Sandoz z innymi lekami, które wpływają na hemostazę (tzn. z lekami przeciwzakrzepowymi, takimi jak warfaryna, lekami o działaniu trombolitycznym i przeciwpłytkowym, lekami przeciwzapalnymi i selektywnymi inhibitorami wychwytu zwrotnego serotoniny), chyba że jest to bezwzględnie wskazane (patrz punkt 4.5). Jeśli takie leczenie skojarzone jest konieczne, zaleca się kontrolowanie czasu krwawienia i ścisłą obserwację, czy u pacjenta nie występują objawy krwawienia. Zaleca się ostrożność u pacjentów otrzymujących jednocześnie leki, które mogą zwiększyć ryzyko owrzodzenia, takie jak doustne kortykosteroidy, selektywne inhibitory wychwytu zwrotnego serotoniny i deferazyroks (patrz punkt 4.5). Alkohol zwiększa ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.5). Kwas acetylosalicylowy w małych dawkach zmniejsza wydalanie kwasu moczowego.
- CHPL leku o rpl_id: 100340431Specjalne środki ostrozności
Z tego względu u pacjentów ze skłonnością do zmniejszonego wydalania kwasu moczowego może wystąpić napad dny moczanowej (patrz punkt 4.5). Produkt Acetylsalicylic Acid Sandoz należy stosować ostrożnie u pacjentów z niedoborem dehydrogenazy glukozo-6-fosforanowej. Produkt Acetylsalicylic Acid Sandoz może nasilić hipoglikemizujące działanie pochodnych sulfonylomocznika i insuliny (patrz punkt 4.5). Dzieci i młodzież Ten produkt leczniczy zalecany jest do stosowania u dorosłych i młodzieży w wieku powyżej 16 lat. Nie zaleca się jego stosowania u młodzieży i dzieci w wieku poniżej 16 lat, chyba że przewidywane korzyści ze stosowania przeważają nad ryzykiem. U niektórych dzieci kwas acetylosalicylowy może przyczynić się do wystąpienia zespołu Reye’a, bardzo rzadkiej choroby dotyczącej mózgu i wątroby, która może prowadzić do zgonu.
- CHPL leku o rpl_id: 100340431Specjalne środki ostrozności
Z tego względu kwasu acetylosalicylowego nie należy stosować u dzieci i młodzieży w wieku poniżej 16 lat z czynną lub ustępującą ospą wietrzną albo chorobą przypominającą grypę. Jeśli podczas stosowania tego produktu leczniczego u pacjenta wystąpią zmiany zachowania z nudnościami i wymiotami, należy skonsultować się z lekarzem, gdyż mogą to być wczesne objawy zespołu Reye’a, wymagające natychmiastowego leczenia. Substancje pomocnicze Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu w tabletce, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
- CHPL leku o rpl_id: 100340431Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Połączenia przeciwwskazane Metotreksat (w dawkach >15 mg na tydzień) Stosowanie kwasu acetylosalicylowego z metotreksatem powoduje nasilenie toksyczności hematologicznej metotreksatu na skutek zmniejszenia jego klirensu nerkowego przez kwas acetylosalicylowy. Dlatego jednoczesne stosowanie metotreksatu (w dawkach >15 mg na tydzień) i produktu Acetylsalicylic Acid Sandoz jest przeciwwskazane (patrz punkt 4.3). Połączenia niezalecane Leki zwiększające wydalanie kwasu moczowego (urykozuryczne), np. probenecyd, sulfinpirazon Alkohol Salicylany odwracają działanie leków urykozurycznych przez hamowanie resorpcji kanalikowej. Należy unikać takiego połączenia. Spożywanie alkoholu podczas stosowania kwasu acetylosalicylowego zwiększa ryzyko krwawienia z przewodu pokarmowego. Należy unikać takiego połączenia.
- CHPL leku o rpl_id: 100340431Interakcje
Połączenia wymagające ostrożności lub które można rozważyć Leki przeciwzakrzepowe i trombolityczne, np. pochodne kumaryny (jak warfaryna), heparyna i alteplaza Leki przeciwpłytkowe (np. klopidogrel, tyklopidyna, dipirydamol lub cylostazol) i selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI, takie jak sertralina lub paroksetyna) Leki przeciwcukrzycowe, np. pochodne sulfonomocznika i insulina Digoksyna i lit Leki moczopędne i przeciwnadciśnieniowe Inhibitory anhydrazy węglanowej (acetazolamid) Kortykosteroidy działające ogólnie Metotreksat (w dawkach <15 mg na tydzień) Inne NLPZ Ibuprofen Cyklosporyna, takrolimus Kwas walproinowy Fenytoina Metamizol Zwiększone ryzyko krwawienia spowodowane hamowaniem czynności płytek krwi, uszkodzenie błony śluzowej dwunastnicy i wypieranie doustnych leków przeciwzakrzepowych z ich połączeń z białkami osocza. Należy monitorować czas krwawienia (patrz punkt 4.4).
- CHPL leku o rpl_id: 100340431Interakcje
Nie należy zwłaszcza rozpoczynać podawania kwasu acetylosalicylowego w ciągu pierwszych 24 godzin od zastosowania alteplazy u pacjentów z ostrym udarem. Nie zaleca się jednoczesnego stosowania. Salicylany mogą nasilić hipoglikemizujące działanie leków przeciwcukrzycowych. Z tego względu u pacjentów otrzymujących duże dawki salicylanów wskazane może być dostosowanie (zmniejszenie) dawki leków przeciwcukrzycowych. Zaleca się kontrolowanie stężenia glukozy we krwi. Kwas acetylosalicylowy zaburza wydalanie digoksyny i litu, co powoduje zwiększenie ich stężeń w osoczu. Na początku i po zakończeniu leczenia kwasem acetylosalicylowym zaleca się kontrolowanie stężenia digoksyny i litu w osoczu. Może być konieczne dostosowanie dawkowania. Niesteroidowe leki przeciwzapalne (NLPZ) mogą zmniejszać przeciwnadciśnieniowe działanie leków moczopędnych (takich jak furosemid, spironolakton, kanreonian) i innych leków przeciwnadciśnieniowych (inhibitorów ACE, antagonistów receptora angiotensyny II, antagonistów kanału wapniowego).
- CHPL leku o rpl_id: 100340431Interakcje
Należy uważnie monitorować ciśnienie tętnicze. Jednoczesne stosowanie kwasu acetylosalicylowego i kortykosteroidów zwiększa ryzyko owrzodzenia i krwawienia z przewodu pokarmowego (patrz punkt 4.4). U osób przyjmujących oba leki, zwłaszcza w podeszłym wieku, może być wskazane rozważenie zastosowania osłony przewodu pokarmowego. Nie zaleca się jednoczesnego stosowania kwasu acetylosalicylowego i kortykosteroidów. W pierwszych tygodniach leczenia skojarzonego należy co tydzień kontrolować morfologię krwi. Dokładniejsze monitorowanie należy prowadzić u pacjentów z zaburzeniami czynności nerek, nawet lekkimi, a także u pacjentów w podeszłym wieku. Jednoczesne stosowanie kwasu acetylosalicylowego i metotreksatu w dawkach większych niż 15 mg na tydzień jest przeciwwskazane (patrz punkt 4.3). Zwiększone ryzyko owrzodzeń i krwawienia z przewodu pokarmowego w wyniku działania synergicznego.
- CHPL leku o rpl_id: 100340431Interakcje
Jeśli jednoczesne stosowanie jest konieczne, należy w razie potrzeby zastosować ochronę przewodu pokarmowego w celu zapobiegania jego uszkodzeniu przez NLPZ. Dane doświadczalne wskazują na możliwość hamowania przez ibuprofen działania jednocześnie podawanych małych dawek kwasu acetylosalicylowego na agregację płytek krwi. Z uwagi jednak na ograniczenia tych danych oraz wątpliwości związane z ekstrapolacją danych uzyskanych ex vivo do warunków klinicznych, sformułowanie jednoznacznych wniosków dotyczących regularnego stosowania ibuprofenu nie jest możliwe, a kliniczne następstwa interakcji w przypadku doraźnego podawania ibuprofenu są mało prawdopodobne (patrz punkt 5.1). Jednoczesne stosowanie NLPZ i cyklosporyny lub takrolimusu może zwiększać nefrotoksyczne działanie cyklosporyny i takrolimusu. Podczas jednoczesnego stosowania tych leków z kwasem acetylosalicylowym należy kontrolować czynność nerek.
- CHPL leku o rpl_id: 100340431Interakcje
Istnieją doniesienia o zmniejszaniu przez kwas acetylosalicylowy wiązania walproinianu z albuminą, co powoduje zwiększenie wolnej frakcji walproinianu w osoczu w stanie stacjonarnym. Podczas jednoczesnego stosowania należy uważnie kontrolować stężenie walproinianu. Salicylany zmniejszają wiązanie fenytoiny z albuminami osocza, co może prowadzić do zmniejszenia stężenia całkowitego fenytoiny w osoczu i zwiększenia wolnej jej frakcji. Nie wydaje się, aby znacząco zmieniało się stężenie frakcji niezwiązanej i działanie terapeutyczne. Metamizol może zmniejszyć wpływ jednocześnie stosowanego kwasu acetylosalicylowego na agregację płytek krwi. Takie leczenie skojarzone należy stosować ostrożnie u pacjentów przyjmujących małe dawki kwasu acetylosalicylowego w kardioprotekcji.
- CHPL leku o rpl_id: 100340431Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Małe dawki (do 100 mg na dobę) Badania kliniczne wskazują, że dawki do 100 mg na dobę do ograniczonego stosowania w położnictwie, które wymaga specjalistycznego monitorowania, wydają się bezpieczne. Dawki od 100 do 500 mg na dobę Doświadczenie kliniczne dotyczące stosowania dawek dobowych od ponad 100 mg do 500 mg jest niewystarczające. Dlatego poniższe zalecenia dla dawek 500 mg na dobę i większych odnoszą się także do dawki z tego zakresu. Dawki 500 mg na dobę i większe Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na przebieg ciąży i (lub) rozwój zarodka lub płodu. Dane z badań epidemiologicznych sugerują, że stosowanie inhibitora syntezy prostaglandyn we wczesnym okresie ciąży może zwiększać ryzyko poronienia, wad rozwojowych serca i wodzonego defektu ściany brzusznej. Bezwzględne ryzyko dla wad rozwojowych układu sercowo-naczyniowego zwiększało się od wartości poniżej 1% do około 1,5%.
- CHPL leku o rpl_id: 100340431Wpływ na płodność, ciążę i laktację
Uznaje się, że ryzyko to zwiększa się wraz z dawką i długością leczenia. Wykazano, że podanie inhibitora syntezy prostaglandyny zwierzętom powodowało zwiększoną ilość strat przed- i poimplantacyjnych oraz zwiększoną śmiertelność zarodków i płodów. Stwierdzono ponadto, że u zwierząt, którym podawano inhibitor syntezy prostaglandyn w okresie organogenezy, z większą częstością występowały różne wady rozwojowe, w tym dotyczące układu sercowo-naczyniowego. Kwasu acetylosalicylowego nie należy stosować w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. Jeśli jest on stosowany u kobiety usiłującej zajść w ciążę albo w pierwszym i drugim trymestrze ciąży, dawka powinna być możliwie mała, a czas leczenia tak krótki, jak to możliwe. Wszystkie inhibitory syntezy prostaglandyn podawane w trzecim trymestrze ciąży mogą narażać płód na: d działanie toksyczne na serce i płuca (z przedwczesnym zamknięciem przewodu tętniczego i nadciśnieniem płucnym) zaburzenia czynności nerek, które mogą postępować do niewydolności nerek z małowodziem a stosowane pod koniec ciąży mogą spowodować u matki i noworodka: wydłużenie czasu krwawienia, działanie antyagregacyjne, które może wystąpić nawet po zastosowaniu małych dawek hamowanie skurczów macicy, prowadzące do opóźnionego lub przedłużonego porodu.
- CHPL leku o rpl_id: 100340431Wpływ na płodność, ciążę i laktację
Z tego względu stosowanie kwasu acetylosalicylowego w dawkach 100 mg/dobę i większych w trzecim trymestrze ciąży jest przeciwwskazane. Karmienie piersi? Małe ilości salicylanów i ich metabolitów przenikają do mleka kobiecego. Ponieważ dotychczas nie zgłaszano niepożądanego wpływu na niemowlęta, krótkotrwałe stosowanie zaleconych dawek nie wymaga przerwania karmienia piersią. Jeśli kwas acetylosalicylowy przyjmowany jest przez długi czas i (lub) w większych dawkach, karmienie piersią należy przerwać.
- CHPL leku o rpl_id: 100340431Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Kwas acetylosalicylowy nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku o rpl_id: 100340431Działania niepożądane
4.8 Działania niepożądane Najczęstszymi działaniami niepożądanymi kwasu acetylosalicylowego są zaburzenia żołądkowo-jelitowe, w tym nudności i wymioty. Ponadto obserwowano krwawienie i owrzodzenie przewodu pokarmowego. Działania niepożądane pogrupowano zgodnie z klasyfikacją układów i narządów. W obrębie każdej klasy częstości określono następująco: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000) i częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego Często: zwiększona skłonność do krwawień Rzadko: małopłytkowość, granulocytoza, niedokrwistość aplastyczna Częstość nieznana: krwawienie z wydłużeniem czasu krwawienia, tj. krwawienie z nosa, krwawienie z dziąseł. Objawy mogą utrzymywać się przez 4-8 dni po odstawieniu kwasu acetylosalicylowego.
- CHPL leku o rpl_id: 100340431Działania niepożądane
Skutkiem może być zwiększone ryzyko krwawienia podczas zabiegu chirurgicznego. Istniejące (krwawe wymioty, smoliste stolce) lub utajone krwawienie z przewodu pokarmowego, które może prowadzić do niedokrwistości z niedoboru żelaza (częstsze po zastosowaniu większych dawek). Zaburzenia układu immunologicznego Rzadko: reakcje nadwrażliwości, obrzęk naczynioruchowy, obrzęk alergiczny, reakcja anafilaktyczna, w tym wstrząs Zaburzenia metabolizmu i odżywiania Częstość nieznana: hiperurykemia, hipoglikemia Zaburzenia układu nerwowego Rzadko: krwawienie śródczaszkowe Częstość nieznana: ból głowy, zawroty głowy Zaburzenia ucha i błędnika Częstość nieznana: osłabienie słuchu, szumy uszne Zaburzenia naczyniowe Rzadko: krwotoczne zapalenie naczyń krwionośnych Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Niezbyt często: zapalenie błony śluzowej nosa, duszność Rzadko: skurcz oskrzeli, napady astmy Zaburzenia żołądka i jelit Często: niestrawność, nudności, wymioty, biegunka Rzadko: ciężki krwotok z przewodu pokarmowego Częstość nieznana: owrzodzenie żołądka lub dwunastnicy i perforacja Zaburzenia wątroby i dróg żółciowych Rzadko: zespół Reye’a Częstość nieznana: niewydolność wątroby, zwiększenie aktywności enzymów wątrobowych Zaburzenia skóry i tkanki podskórnej Niezbyt często: reakcja alergiczna (pokrzywka) Rzadko: zespół Stevensa-Johnsona, zespół Lyella, plamica, rumień guzowaty, rumień wielopostaciowy Zaburzenia nerek i dróg moczowych Częstość nieznana: zaburzenia czynności nerek, ostra niewydolność nerek Zaburzenia układu rozrodczego i piersi Rzadko: obfite, przedłużające się miesiączki Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku o rpl_id: 100340431Działania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa tel.: + 48 22 49 21 301/faks: + 48 22 49 21 309/e-mail: ndl@urpl.gov.pl Działania niepożądane można również zgłaszać podmiotowi odpowiedzialnemu.
- CHPL leku o rpl_id: 100340431Przedawkowanie
4.9 Przedawkowanie Mimo znacznych różnic międzyosobniczych można uznać, że dawka toksyczna dla dorosłych wynosi około 200 mg/kg mc., a dla dzieci 100 mg/kg mc. Śmiertelną dawką kwasu acetylosalicylowego jest 25 do 30 g. Stężenie salicylanów w osoczu powyżej 300 mg/l wskazuje na zatrucie, a ciężkie zatrucie występuje zazwyczaj, jeśli stężenie w osoczu ma wartość ponad 500 mg/l u dorosłych i 300 mg/l u dzieci. Przedawkowanie może być szkodliwe dla osób w podeszłym wieku i szczególnie dla małych dzieci (przedawkowanie produktu leczniczego stosowanego w dawkach leczniczych lub częste przypadkowe zatrucia mogą być śmiertelne). Objawy umiarkowanego zatrucia Szumy uszne, zaburzenia słuchu, ból głowy, zawroty głowy, splątanie i objawy żołądkowo-jelitowe (nudności, wymioty i ból brzucha). Objawy ciężkiego zatrucia Objawy są związane z poważnymi zaburzeniami równowagi kwasowo-zasadowej. Najpierw występuje hiperwentylacja, która powoduje zasadowicę oddechową.
- CHPL leku o rpl_id: 100340431Przedawkowanie
Kwasica oddechowa wywołana jest zahamowaniem ośrodka oddechowego. Ponadto kwasica metaboliczna spowodowana jest obecnością salicylanów. Ponieważ u młodszych dzieci objawy nie są często widoczne aż do późnej fazy zatrucia, zwykle stwierdza się u nich kwasicę. Ponadto mogą wystąpić następujące objawy: hipertermia i nadmierne pocenie się, prowadzące do odwodnienia: uczucie niepokoju, drgawki, omamy i hipoglikemia. Zahamowanie czynności układu nerwowego może prowadzić do śpiączki, zapaści sercowo-naczyniowej lub zatrzymania oddechu. Leczenie przedawkowania Jeśli przyjęta została dawka toksyczna, konieczna jest hospitalizacja. Jeśli występuje umiarkowane zatrucie, należy podjąć próbę wywołania wymiotów. W razie niepowodzenia, w ciągu pierwszej godziny po przyjęciu znacznej ilości produktu leczniczego można wykonać płukanie żołądka, a następnie podać węgiel aktywny (adsorbent) i siarczan sodu (środek przeczyszczający).
- CHPL leku o rpl_id: 100340431Przedawkowanie
Węgiel aktywny może być podawany w pojedynczej dawce (50 g dla dorosłych, 1 g/kg masy ciała dla dzieci do 12 lat). Alkalizacja moczu (250 mmol NaHCO3 przez trzy godziny) pod kontrolą pH moczu. W leczeniu ciężkiego zatrucia należy zastosować hemodializę. Inne objawy zatrucia należy leczyć objawowo.
- CHPL leku o rpl_id: 100340431Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwzakrzepowe: inhibitory agregacji płytek z wyłączeniem heparyny. Kod ATC: B01AC06 Kwas acetylosalicylowy hamuje aktywację płytek: hamuje płytkową cyklooksygenazę poprzez acetylację, co powoduje zatrzymanie syntezy tromboksanu A2, fizjologicznego czynnika aktywującego płytki krwi i odgrywającego rolę w powikłaniach miażdżycowych. Hamowanie syntezy TXA2 jest nieodwracalne, gdyż płytki krwi (komórki bezjądrzaste) nie są zdolne do syntezy białka - do zsyntetyzowania nowej cyklooksygenazy w miejsce tej, która została acetylowana przez kwas acetylosalicylowy. Dawki wielokrotne od 20 do 325 mg powodują zahamowanie aktywności enzymatycznej w 30-95%. Ze względu na nieodwracalny charakter wiązania, działanie to utrzymuje się przez czas życia płytek krwi (7-10 dni).
- CHPL leku o rpl_id: 100340431Właściwości farmakodynamiczne
Działanie hamujące nie wyczerpuje się podczas długotrwałego leczenia, a aktywność enzymatyczna płytek krwi powraca stopniowo wraz z odnowieniem płytek w ciągu 24-48 godzin po przerwaniu leczenia. Kwas acetylosalicylowy wydłuża czas krwawienia średnio o około 50 do 100%, ale obserwuje się indywidualną zmienność. Dane doświadczalne wskazują, że ibuprofen może hamować wpływ jednocześnie stosowanego kwasu acetylosalicylowego w małych dawkach na agregację płytek krwi. W jednym z badań podanie ibuprofenu w pojedynczej dawce 400 mg w ciągu 8 godzin przed lub w ciągu 30 minut po podaniu kwasu acetylosalicylowego w postaci o natychmiastowym uwalnianiu (81 mg) spowodowało osłabienie wpływu kwasu acetylosalicylowego na powstawanie tromboksanu lub agregację płytek. Jednak ze względu na ograniczenia tych danych oraz wątpliwości związane z ekstrapolacją danych uzyskanych ex vivo na warunki kliniczne, sformułowanie jednoznacznych wniosków dotyczących regularnego stosowania ibuprofenu nie jest możliwe, a kliniczne następstwa interakcji z doraźnie stosowanym ibuprofenem są mało prawdopodobne.
- CHPL leku o rpl_id: 100340431Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Kwas acetylosalicylowy podany doustnie jest szybko i całkowicie wchłaniany z przewodu pokarmowego. Głównym miejscem wchłaniania jest proksymalny odcinek jelita cienkiego. Jednak znaczna część dawki jest już hydrolizowana do kwasu salicylowego w ścianie jelita podczas wchłaniania. Stopień hydrolizy zależy od szybkości wchłaniania. Po przyjęciu na czczo tabletek dojelitowych Acetylsalicylic Acid Sandoz maksymalne stężenia kwasów acetylosalicylowego i salicylowego w osoczu osiągane są, odpowiednio, po około 5 i 6 godzinach. Jeśli tabletki przyjmowane są z pokarmem, maksymalne stężenia w osoczu osiągane są około 3 godzin później niż po przyjęciu na czczo. Dystrybucja Kwas acetylosalicylowy i jego główny metabolit, kwas salicylowy, są w dużym stopniu wiązane z białkami osocza (głównie albuminą) i szybko rozmieszczane do wszystkich części organizmu.
- CHPL leku o rpl_id: 100340431Właściwości farmakokinetyczne
Stopień wiązania kwasu salicylowego z białkami osocza istotnie zależy zarówno od stężenia kwasu salicylowego, jak i od stężenia albuminy. Objętość dystrybucji kwasu acetylosalicylowego wynosi około 0,16 l/kg mc. Kwas salicylowy powoli przenika do płynu stawowego, przez barierę łożyska i do mleka kobiecego. Metabolizm Kwas acetylosalicylowy jest szybko metabolizowany do kwasu salicylowego z okresem półtrwania 15-30 minut. Kwas salicylowy jest następnie przekształcany, głównie w procesie sprzęgania z glicyną i kwasem glukuronowym, a w śladowej ilości do kwasu gentyzynowego. Kinetyka eliminacji kwasu salicylowego jest zależna od dawki, gdyż metabolizm jest ograniczony zdolnością katalityczną enzymów wątrobowych. Dlatego okres półtrwania w fazie eliminacji różni się i wynosi 2 do 3 godzin po podaniu małych dawek, 12 godzin po podaniu zwykłych dawek przeciwbólowych oraz 15 do 30 godzin po podaniu dużych dawek leczniczych lub zatruciu.
- CHPL leku o rpl_id: 100340431Właściwości farmakokinetyczne
Wydalanie Kwas salicylowy i jego metabolity są wydalane głównie przez nerki.
- CHPL leku o rpl_id: 100340431Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Niekliniczny profil bezpieczeństwa kwasu acetylosalicylowego jest dobrze udokumentowany. W doświadczeniach na zwierzętach nie wykazano innych szkodliwych działań salicylanów na narządy niż uszkodzenie nerek. W badaniach na szczurach obserwowano fetotoksyczne i teratogenne działanie kwasu acetylosalicylowego w dawkach toksycznych dla matek. Znaczenie kliniczne tej obserwacji nie jest znane, gdyż dawki stosowane w badaniach nieklinicznych są znacznie większe (co najmniej siedmiokrotnie) niż maksymalne zalecane dawki w wybranych wskazaniach sercowo-naczyniowych. Przeprowadzono rozległe badania mutagennego i rakotwórczego działania kwasu acetylosalicylowego. Wyniki badań na myszach i szczurach nie wskazują na działanie genotoksyczne lub rakotwórcze.
- CHPL leku o rpl_id: 100340431Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Celuloza mikrokrystaliczna Skrobia kukurydziana Krzemionka koloidalna bezwodna Kwas stearynowy Otoczka Kwasu metakrylowego i etylu akrylanu kopolimer (1:1) Polisorbat 80 Sodu laurylosiarczan Trietylu cytrynian Talk 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Blister z folii PVC/Aluminium w tekturowym pudełku. Blister jednodawkowy (PVC/Aluminium). Wielkości opakowań (blistry): 30, 50, 100 tabletek dojelitowych. Wielkości opakowań (blistry jednodawkowe): 30 x 1, 50 x 1, 100 x 1 tabletek dojelitowych. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
- CHPL leku o rpl_id: 100340431Dane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku o rpl_id: 100089014Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Mefacit, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg kwasu mefenamowego (Acidum mefenamicum) Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki Białe lub prawie białe, okrągłe, obustronnie płaskie tabletki z wytłoczonym oznakowaniem „Mefacit” po jednej stronie
- CHPL leku o rpl_id: 100089014Wskazania do stosowania
4.1 Wskazania do stosowania Bóle o łagodnym lub umiarkowanym nasileniu różnego pochodzenia, w tym: bóle głowy, zębów, bóle mięśniowe, pourazowe, nerwobóle, reumatoidalne zapalenie stawów kręgosłupa, choroba zwyrodnieniowa stawów Bolesne miesiączkowanie
- CHPL leku o rpl_id: 100089014Dawkowanie
4.2 Dawkowanie i sposób podawania Produkt leczniczy podaje się doustnie. Produkt leczniczy należy przyjmować w trakcie lub po posiłku i popijać wodą. W przypadku ostrego bólu leczenie rozpoczyna się od początkowej dawki 500 mg co 6 godzin, a następnie dawkę zmniejsza się do 250 mg co 6 godzin. Leczenie nie powinno trwać dłużej niż 7 dni. W przypadku bolesnego miesiączkowania produkt leczniczy należy podawać początkowo w dawce 500 mg co 6 godzin, a następnie 250 mg co 6 godzin, rozpoczynając leczenie wraz z wystąpieniem krwawienia i początkowych objawów bólu. Zwykle wystarcza podawanie leku przez 2-3 dni. Przyjmowanie leku w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.4).
- CHPL leku o rpl_id: 100089014Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na kwas mefenamowy lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1 Astma oskrzelowa, pokrzywka lub reakcje nadwrażliwości na kwas acetylosalicylowy lub inne niesteroidowe leki przeciwzapalne w wywiadzie. Czynna lub w wywiadzie choroba wrzodowa żołądka i (lub) dwunastnicy, krwawienie lub perforacja, również występujące po zastosowaniu NLPZ (niesteroidowych leków przeciwzapalnych) oraz przewlekłe stany zapalne górnego i dolnego odcinka przewodu pokarmowego. Ciężka niewydolność nerek, wątroby i serca. Trzeci trymestr ciąży. Dzieci do 14 lat. Jednoczesne przyjmowanie innych niesteroidowych leków przeciwzapalnych, w tym wybiórczych inhibitorów cyklooksygenazy-2.
- CHPL leku o rpl_id: 100089014Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Przyjmowanie leku w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz punkt 4.2 oraz wpływ na przewód pokarmowy i układ krążenia poniżej). Istnieje ryzyko wystąpienia krwotoku z przewodu pokarmowego, owrzodzenia lub perforacji, który może być śmiertelny i który niekoniecznie musi być poprzedzony objawami ostrzegawczymi lub może wystąpić u pacjentów, u których takie objawy ostrzegawcze występowały. W razie wystąpienia krwotoku z przewodu pokarmowego czy owrzodzenia, należy natychmiast odstawić produkt leczniczy. Również w każdym okresie leczenia mogą wystąpić mniej groźne, ale często występujące objawy niepożądane, jak niestrawność. Należy poinformować pacjentów z chorobami przewodu pokarmowego w wywiadzie, szczególnie osoby w podeszłym wieku o konieczności informowania lekarza o wszelkich nietypowych objawach dotyczących układu pokarmowego (szczególnie o krwawieniu), zwłaszcza w początkowym okresie terapii.
- CHPL leku o rpl_id: 100089014Specjalne środki ostrozności
U tych osób powinna być stosowana jak najmniejsza dawka produktu leczniczego. Należy zachować ostrożność stosując produkt leczniczy u pacjentów, stosujących jednocześnie inne leki, które mogą zwiększać ryzyko zaburzeń żołądka i jelit lub krwawienia, takie jak kortykosteroidy lub leki przeciwzakrzepowe jak warfaryna (acenokumarol) lub leki antyagregacyjne jak kwas acetylosalicylowy. Do czynników zwiększających ryzyko krwawienia z przewodu pokarmowego należą również: palenie tytoniu, nadużywanie alkoholu, podeszły wiek oraz zły ogólny stan zdrowia. W przypadku wystąpienia biegunki produkt leczniczy należy czasowo odstawić. Nawracające, uporczywe biegunki występujące w trakcie stosowania kwasu mefenamowego stanowią przeciwwskazanie do dalszego podawania produktu leczniczego. Należy zachować ostrożność podczas stosowanie niesteroidowych leków przeciwzapalnych u pacjentów z wcześniej przebytymi chorobami przewodu pokarmowego (jak wrzodziejące zapalenie okrężnicy, choroba Leśniowskiego-Crohna), ponieważ ich stan może ulec pogorszeniu.
- CHPL leku o rpl_id: 100089014Specjalne środki ostrozności
Wpływ na układ krążenia i naczynia mózgowe Pacjentów z nadciśnieniem tętniczym w wywiadzie lub łagodną do umiarkowanej zastoinową niewydolnością serca, z zatrzymaniem płynów i obrzękami należy odpowiednio kontrolować i wydawać właściwe zalecenia. Zatrzymanie płynów i obrzęki były zgłaszane w związku z leczeniem NLPZ. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych niesteroidowych leków przeciwzapalnych (szczególnie długotrwale w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np. zawał serca lub udar). Dane te są niewystarczające, aby wykluczyć takie ryzyko w przypadku przyjmowania kwasu mefenamowego. Pacjenci z niekontrolowanym nadciśnieniem tętniczym, zastoinową niewydolnością serca, chorobą niedokrwienną serca, chorobą tętnic obwodowych lub chorobą naczyń mózgowych powinni być leczeni kwasem mefenamowym bardzo rozważnie.
- CHPL leku o rpl_id: 100089014Specjalne środki ostrozności
Podobną rozwagę należy zachować przed rozpoczęciem długotrwałego leczenia pacjentów z czynnikami ryzyka chorób układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Podobnie jak w przypadku innych niesteroidowych leków przeciwzapalnych reakcje rzekomoanafilaktyczne mogą wystąpić bez wcześniejszej ekspozycji na kwas mefenamowy. W szczególności produktu leczniczego nie należy podawać pacjentom z astmą oskrzelową i zapaleniem nosa z polipami lub bez oraz u tych pacjentów, u których występuje zagrażający życiu skurcz oskrzeli pod wpływem kwasu acetylosalicylowego lub innych niesteroidowych leków przeciwzapalnych. Kwasu mefenamowego nie należy również stosować u pacjentów odwodnionych oraz z zaburzonymi czynnościami nerek, zwłaszcza w okresie ich niewydolności. Długotrwałe podawanie kwasu mefenamowego może powodować martwicę brodawek nerkowych lub inne uszkodzenia rdzenia nerek.
- CHPL leku o rpl_id: 100089014Specjalne środki ostrozności
Nefrotoksyczne działanie niesteroidowych leków przeciwzapalnych może wystąpić również u pacjentów, u których prostaglandyny odgrywają istotną rolę w utrzymaniu prawidłowej perfuzji nerek. Do czynników zwiększających ryzyko uszkodzenia nerek należą: wcześniej występujące choroby nerek, niewydolność serca, uszkodzenie wątroby, leczenie środkami moczopędnymi i inhibitorami konwertazy angiotensyny oraz podeszły wiek. Powikłanie to jest zwykle przemijające i ustępuje po odstawieniu produktu leczniczego. Znaczne zwiększenie aktywności aminotransferaz i (lub) wystąpienie objawów uszkodzenia wątroby może powodować konieczność odstawienia produktu leczniczego. Niekiedy u pacjentów leczonych kwasem mefenamowym może wystąpić niedokrwistość. Może ona wynikać z retencji płynów, utraty krwi przez przewód pokarmowy lub wpływu leku na erytropoezę.
- CHPL leku o rpl_id: 100089014Specjalne środki ostrozności
Dlatego u pacjentów długotrwale leczonych niesteroidowymi lekami przeciwzapalnymi i wykazujących jakiekolwiek objawy niedokrwistości należy kontrolować wskaźniki morfologii krwi. Leki te mogą zaburzać również czynność płytek krwi i odpowiedź naczyniową na krwawienie, powodując wydłużenie czasu krwawienia. W porównaniu do kwasu acetylosalicylowego wpływ kwasu mefenamowego na czynność płytek jest mniejszy, trwa krócej i jest przemijający. Ciężkie reakcje skórne, niektóre z nich śmiertelne, włączając zapalenie skóry złuszczające, zespół Stevensa-Johnsona i martwica toksyczno-rozpływna naskórka były bardzo rzadko raportowane w związku ze stosowaniem leków z grupy NLPZ. Największe ryzyko wystąpienia tych ciężkich reakcji występuje na początku terapii, w większości przypadków w pierwszym miesiącu stosowania produktu. Należy zaprzestać stosowania produktu po wystąpieniu pierwszych objawów: wysypka skórna, uszkodzenia błony śluzowej lub inne objawy nadwrażliwości.
- CHPL leku o rpl_id: 100089014Specjalne środki ostrozności
U pacjentów z toczniem rumieniowatym układowym i mieszanymi chorobami tkanki łącznej może zwiększyć się ryzyko aseptycznego zapalenia opon mózgowych. Brak odpowiedzi na leczenie w bolesnym miesiączkowaniu powinno skłonić lekarza do szukania innych przyczyn. Należy zachować ostrożność u pacjentów z padaczką. Stosowanie kwasu mefenamowego może niekorzystnie wpływać na płodność u kobiet i nie jest ono zalecane u kobiet, które planują zajście w ciążę. W przypadku kobiet, które mają trudności z zajściem w ciążę lub które są poddawane badaniom w związku z niepłodnością, należy rozważyć zakończenie stosowania kwasu mefenamowego. W trakcie leczenia nie należy pić alkoholu.
- CHPL leku o rpl_id: 100089014Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie należy stosować kwasu mefenamowego jednocześnie z kwasem acetylosalicylowym i innymi niesteroidowymi lekami przeciwzapalnymi ze względu na zwiększone ryzyko wystąpienia działań niepożądanych. Produkt leczniczy może zwiększać działanie toksyczne metotreksatu w wyniku kompetycyjnego blokowania eliminacji nerkowej cytostatyku. Kwas mefenamowy może zwiększać działanie litu w wyniku zwiększenia jego stężenia w osoczu i zmniejszenia klirensu nerkowego w następstwie hamowania nerkowej syntezy prostaglandyn. Kwas mefenamowy może zmniejszać działanie obniżające ciśnienie krwi inhibitorów konwertazy angiotensyny, jak również działanie moczopędne furosemidu i tiazydowych leków moczopędnych w wyniku hamowania syntezy prostaglandyn w nerkach. Leki moczopędne mogą również zwiększać działanie nefrotoksyczne niesteroidowych leków przeciwzapalnych.
- CHPL leku o rpl_id: 100089014Interakcje
Produkt leczniczy zwiększa również ryzyko krwawienia z przewodu pokarmowego u pacjentów równocześnie przyjmujących warfarynę (acenokumarol). Wodorotlenek magnezu podawany doustnie zwiększa biodostępność kwasu mefenamowego. Produkt leczniczy nie wpływa na liczbę płytek krwi, czas kefalinowy (PTT), natomiast może wydłużać czas protrombinowy. Dlatego należy częściej monitorować parametry krzepnięcia u pacjentów otrzymujących leki przeciwzakrzepowe. Jednoczesne stosowanie niesteroidowych leków przeciwzapalnych i glikozydów nasercowych może spowodować zwiększenie niewydolności serca. NLPZ stosowane w okresie 8-12 dni po podaniu mifeprystonu mogą zmniejszać jego skuteczność. Produkt leczniczy może zwiększać działanie nefrotoksyczne cyklosporyny i takrolimusu. Jednoczesne stosowanie niesteroidowych leków przeciwzapalnych i glikokortykosteroidów może zwiększyć ryzyko krwawienia z przewodu pokarmowego.
- CHPL leku o rpl_id: 100089014Interakcje
Podczas podawania kwasu mefenamowego i fluorochinolonów zwiększa się ryzyko wystąpienia drgawek.
- CHPL leku o rpl_id: 100089014Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża U kobiet w trzecim trymestrze ciąży podawanie produktu leczniczego jest przeciwwskazane ze względu na możliwość przedwczesnego zamknięcia u płodu przewodu tętniczego i zaburzeń przebiegu porodu. Produkt leczniczy może być stosowany u kobiet w pierwszym i drugim trymestrze ciąży tylko wówczas, gdy potencjalna korzyść dla matki przewyższa zagrożenie dla płodu. Karmienie piersi? Kwas mefenamowy w niewielkich ilościach przenika do mleka matek karmiących piersią. Ze względu jednak na potencjalnie niekorzystny wpływ na dziecko nie należy podawać produktu leczniczego kobietom karmiącym piersią.
- CHPL leku o rpl_id: 100089014Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Ze względu na możliwość wystąpienia niektórych działań niepożądanych, jak senność czy zawroty głowy, należy zachować ostrożność, jeśli w czasie stosowania produktu leczniczego prowadzi się pojazdy i obsługuje maszyny. Jeżeli wystąpią wyżej wymienione działania niepożądane należy wstrzymać się od wykonywania czynności wymagających zachowania pełnej sprawności psychofizycznej.
- CHPL leku o rpl_id: 100089014Działania niepożądane
4.8 Działania niepożądane Częstość występowania niżej wymienionych działań niepożądanych nie jest znana (częstość nie może być określona na podstawie dostępnych danych): Zaburzenia żołądka i jelit: bóle brzucha, zaparcia, biegunka, niestrawność, wzdęcia, zgaga, nudności, wymioty, choroba wrzodowa żołądka i (lub) dwunastnicy, perforacje i krwawienia z przewodu pokarmowego, czasami zakończone zgonem, smoliste stolce, krwawe wymioty, zapalenie błony śluzowej odbytnicy, zapalenie błony śluzowej żołądka, zaostrzenie się zapalenia okrężnicy i choroby Leśniowskiego-Crohna, odbijanie się. Zaburzenia serca: zastoinowa niewydolność krążenia, nadciśnienie lub niedociśnienie tętnicze, częstoskurcz, omdlenie, zaburzenia rytmu serca, zawał serca, kołatania serca, niewydolność serca, obrzęki. Zaburzenia krwi i układu chłonnego: niedokrwistość, wydłużenie czasu krwawienia i protrombinowego, eozynofilia, leukopenia, małopłytkowość, agranulocytoza, niedokrwistość hemolityczna i aplastyczna, limfadenopatia, pancytopenia, neutropenia, plamica.
- CHPL leku o rpl_id: 100089014Działania niepożądane
Zaburzenia układu nerwowego: bóle i zawroty głowy, niepokój, osłabienie, depresja, zaburzenia snu, senność, bezsenność, złe samopoczucie, nadpobudliwość, parestezje, drgawki, śpiączka, omamy, zapalenie opon mózgowych, drżenia, dezorientacja. Zaburzenia oka: zaburzenia widzenia, zapalenie nerwu wzrokowego, zapalenie spojówek. Zaburzenia ucha i błędnika: szumy uszne, zaburzenia słuchu. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: duszność, astma, pogorszenie astmy, skurcz oskrzeli, niewydolność oddechowa, zapalenie płuc. Zaburzenia nerek i dróg moczowych: zaburzenia czynności nerek, zapalenie pęcherza moczowego, dyzuria, krwiomocz, kłębuszkowe zapalenie nerek, ostre śródmiąższowe zapalenie nerek z krwiomoczem lub białkomoczem, a niekiedy z zespołem nerczycowym, skąpomocz, wielomocz, niewydolność nerek.
- CHPL leku o rpl_id: 100089014Działania niepożądane
Zaburzenia skóry i tkanki podskórnej: świąd skóry, wysypki, wyłysienie, nadmierna potliwość, toksyczna nekroliza naskórka, złuszczające zapalenie skóry, rumień wielopostaciowy, zespół Stevensa-Johnsona, pokrzywka. Zaburzenia układu immunologicznego: nadwrażliwość, nadwrażliwość na światło, wstrząs. Zaburzenia metabolizmu i odżywiania: zmiany masy ciała, zaburzenia apetytu, hiperglikemia. Zaburzenia naczyniowe: zapalenie naczyń, wybroczyny i wylewy podskórne, obrzęk naczynioruchowy. Zaburzenia wątroby i dróg żółciowych: zwiększona aktywność enzymów wątrobowych, zapalenie wątroby, żółtaczka, niewydolność wątroby. Inne: gorączka, suchość błony śluzowej jamy ustnej, reakcje rzekomoanafilaktyczne, zapalenie trzustki, zapalenie błony śluzowej przełyku, zapalenie języka, wrzodziejące zapalenie błony śluzowej jamy ustnej.
- CHPL leku o rpl_id: 100089014Działania niepożądane
Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych NLPZ (szczególnie długotrwale w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zatorów tętnic (np. zawał serca lub udar), patrz punkt 4.4. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C, 02-222 Warszawa tel.: + 48 22 49 21 301 faks: + 48 22 49 21 309 e-mail: ndl@urpl.gov.pl. Działania niepożądane można również zgłaszać podmiotowi odpowiedzialnemu.
- CHPL leku o rpl_id: 100089014Przedawkowanie
4.9 Przedawkowanie Objawy przedawkowania niesteroidowych leków przeciwzapalnych obejmują: bóle głowy, nudności, wymioty, ból w nadbrzuszu, krwawienie z przewodu pokarmowego. Rzadko mogą wystąpić: biegunka, dezorientacja, pobudzenie, śpiączka, senność, szumy uszne, omdlenie, czasami drgawki. W przypadku znacznego przedawkowania może wystąpić niewydolność nerek i uszkodzenie wątroby. Postępowanie obejmuje leczenie objawowe i podtrzymujące. Nie istnieją specyficzne odtrutki. W przypadku, gdy od przyjęcia produktu leczniczego nie upłynęła 1 godzina lub przyjęto znaczną dawkę kwasu mefenamowego (5-10 razy przekraczającą dawkę terapeutyczną) wskazane jest płukanie żołądka i podanie doustne węgla aktywowanego (od 60 g do 100 g u dorosłych, od 1 g/kg mc. do 2g/kg mc. u dzieci). Należy zapewnić właściwą diurezę oraz monitorować czynność wątroby i nerek. Pacjentów należy obserwować przez co najmniej 4 godziny po ewentualnym przedawkowaniu produktu leczniczego.
- CHPL leku o rpl_id: 100089014Przedawkowanie
W przypadku wystąpienia częstych i utrzymujących się drgawek, może być konieczne podanie dożylne diazepamu. Ze względu na stan pacjenta mogą być podjęte inne działania. Ze względu na silne wiązanie z białkami osocza forsowna diureza, alkalizacja moczu, hemodializa i hemoperfuzja mogą być nieskuteczne.
- CHPL leku o rpl_id: 100089014Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne i przeciwreumatyczne; pochodne kwasu fenamowego. Kod ATC: M01AG01 Kwas mefenamowy jest niesteroidowym lekiem o działaniu przeciwzapalnym, przeciwbólowym i przeciwgorączkowym. Mechanizm działania produktu leczniczego związany jest głównie z nieselektywnym hamowaniem cyklooksygenazy i w następstwie tego syntezy prostaglandyn. Mechanizm ten jest prawdopodobnie odpowiedzialny również za występowanie niektórych działań niepożądanych, zwłaszcza dotyczących przewodu pokarmowego.
- CHPL leku o rpl_id: 100089014Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Ogólna charakterystyka wykonanych badań. Badania przeprowadzono u zdrowych mężczyzn w wieku 18-45 lat po pojedynczym i wielokrotnym podaniu kwasu mefenamowego w dawkach 500 mg i 1000 mg. Wchłanianie Po podaniu doustnym kwas mefenamowy wchłania się szybko z przewodu pokarmowego. Po jednokrotnym podaniu dawki 1 g maksymalne stężenie kwasu mefenamowego w osoczu (Cmax) wynosiło od 10 µg/ml do 20 µg/ml i uzyskano je w czasie (Tmax) od 2 godzin do 4 godzin. Po podawaniu kwasu mefenamowego w dawce 1 g czterokrotnie w ciągu doby stężenie w stanie stacjonarnym wystąpiło w drugiej dobie leczenia. Nie oceniano wpływu pokarmu na biodostępność produktu leczniczego. Dystrybucja Kwas mefenamowy wiąże się z białkami osocza w ponad 90%. Współczynnik objętości dystrybucji dawki 500 mg wynosi 1,06 l/kg mc. Metabolizm Kwas mefenamowy jest metabolizowany w wątrobie przez cytochrom P-450 (podtyp CYP2C9) do kwasu 3-hydroksymetylomefenamowego (pierwszy metabolit).
- CHPL leku o rpl_id: 100089014Właściwości farmakokinetyczne
Możliwa jest dalsza oksydacja do kwasu 3-karboksymefenamowego (drugi metabolit). Nie oceniano aktywności farmakologicznej obu metabolitów. Eliminacja Kwas mefenamowy jest w około 52% wydalany w moczu, zarówno jako kwas mefenamowy, jak i w formie metabolitów po sprzężeniu z kwasem glukuronowym. Z kałem ulega eliminacji do 20% podanej dawki kwasu mefenamowego głównie w postaci nie sprzężonego kwasu 3-karboksy-mefenamowego. Okres półtrwania (T0,5) wynosi około 2 godzin. Nie określono dokładnie okresów półtrwania metabolitów, ale wydają się dłuższe niż kwasu mefenamowego. Metabolity mogą się kumulować u pacjentów z niewydolnością wątroby i (lub) nerek.
- CHPL leku o rpl_id: 100089014Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach (myszy, szczury, psy) kwas mefenamowy wykazywał niewielką toksyczność niezależnie od drogi podania (doustna, dożylna, dootrzewnowa). Stwierdzono, że LD50 dla myszy i szczurów wynosi 1620 mg/kg mc. Dla szczurów dawka śmiertelna w zatruciu ostrym wynosi od 3,68 g/kg mc. do 4,3 g/kg mc., a w zatruciu podostrym 143 mg/kg mc. na dobę. Po 6-tygodniowym podawaniu leku u szczurów w dawkach znacznie większych niż dawki stosowane u ludzi wystąpiły początkowo zmiany zapalne błony śluzowej żołądka, a następnie rozległe owrzodzenia. W badaniach doświadczalnych na zwierzętach wykazano, że metabolity kwasu mefenamowego łatwo przenikają przez łożysko. U szczurów, którym podawano kwas mefenamowy w dawkach 10-krotnie większych niż dawki stosowane u ludzi stwierdzono zmniejszenie płodności, opóźnienie porodu oraz zmniejszony odsetek przeżyć po odstawieniu od piersi.
- CHPL leku o rpl_id: 100089014Przedkliniczne dane o bezpieczeństwie
U królików stwierdzono zwiększenie ryzyka resorpcji płodu po podaniu leku w dawkach 2,5-krotnie większych niż dawki stosowane u ludzi. Nie stwierdzono natomiast występowania anomalii płodowych u zwierząt w wyżej wymienionych badaniach oraz dodatkowo u psów otrzymujących 10-krotnie większe dawki niż u ludzi.
- CHPL leku o rpl_id: 100089014Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Skrobia ziemniaczana Krzemionka koloidalna bezwodna Sodu laurylosiarczan Talk Alkohol poliwinylowy Magnezu stearynian 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu. Przechowywać w temperaturze poniżej 25C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/Aluminium w tekturowym pudełku 30 szt. (3 blistry po 10 szt.) 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Zobacz również:
- Dawkowanie leku
Kwas salicylowy to substancja stosowana miejscowo na skórę, która pomaga w usuwaniu odcisków, zgrubień, brodawek oraz wspiera leczenie wielu chorób dermatologicznych. Dawkowanie tej substancji zależy od postaci leku, drogi podania oraz wskazań – może różnić się dla dzieci, dorosłych i osób starszych. Dowiedz się, jak bezpiecznie i skutecznie stosować kwas salicylowy w różnych schorzeniach skóry.
- Działania niepożądane i skutki uboczne
Kwas salicylowy to popularna substancja stosowana miejscowo na skórę, znana przede wszystkim ze swojego działania złuszczającego i przeciwzapalnego. Jego skuteczność wiąże się jednak z możliwością wystąpienia różnych działań niepożądanych – najczęściej są to łagodne reakcje miejscowe, ale w niektórych przypadkach mogą pojawić się poważniejsze objawy, zwłaszcza przy długotrwałym lub niewłaściwym stosowaniu. Warto poznać możliwe skutki uboczne, by bezpiecznie korzystać z preparatów zawierających kwas salicylowy.
- Mechanizm działania
Kwas salicylowy to substancja czynna, która odgrywa kluczową rolę w pielęgnacji i leczeniu skóry. Jego mechanizm działania polega przede wszystkim na zmiękczaniu i złuszczaniu zrogowaciałego naskórka, co przynosi ulgę w takich dolegliwościach jak odciski, nagniotki czy łuszczyca. Stosowany miejscowo, wykazuje również właściwości antyseptyczne, przeciwbakteryjne oraz wspomaga wchłanianie innych składników leczniczych. Poznaj, jak kwas salicylowy działa na poziomie skóry, jak jest wchłaniany i wydalany z organizmu, a także jakie są wyniki badań dotyczących jego bezpieczeństwa.
- Porównanie substancji czynnych
Kwas salicylowy, kwas acetylosalicylowy i kwas mefenamowy to substancje czynne należące do grupy niesteroidowych leków przeciwzapalnych lub preparatów do stosowania miejscowego na skórę. Mimo wielu podobieństw w działaniu i przynależności do tej samej grupy leków, różnią się one pod względem zastosowania, mechanizmu działania, przeciwwskazań oraz bezpieczeństwa stosowania w różnych grupach pacjentów. Poznaj kluczowe różnice i podobieństwa pomiędzy tymi trzema substancjami, by lepiej zrozumieć, kiedy i dlaczego są wybierane w terapii oraz na co zwrócić uwagę podczas ich stosowania.
- Profil bezpieczeństwa
Kwas salicylowy jest substancją czynną stosowaną miejscowo na skórę w leczeniu różnych problemów dermatologicznych, takich jak odciski, brodawki czy łuszczyca. Bezpieczeństwo jego stosowania zależy od wielu czynników, w tym postaci leku, dawki oraz powierzchni skóry, na którą jest aplikowany. W opisie znajdziesz szczegółowe informacje na temat bezpieczeństwa kwasu salicylowego u różnych grup pacjentów, przeciwwskazań oraz możliwych interakcji.
- Przeciwwskazania
Kwas salicylowy to substancja często stosowana w leczeniu problemów skórnych, takich jak odciski, zrogowacenia czy brodawki. Pomaga złuszczać martwy naskórek i działa keratolitycznie, czyli zmiękcza i rozpulchnia zrogowaciałą skórę. Jednak nie każdy może z niego korzystać bez ograniczeń. W zależności od postaci leku, dawki czy obecności innych składników, przeciwwskazania do stosowania kwasu salicylowego mogą być różne. Warto poznać sytuacje, w których jego użycie nie jest bezpieczne oraz dowiedzieć się, na co zwracać szczególną uwagę podczas terapii.
- Stosowanie u dzieci
Stosowanie kwasu salicylowego u dzieci wymaga dużej ostrożności i ścisłego przestrzegania zaleceń dotyczących wieku, dawki i postaci leku. Wiele preparatów z kwasem salicylowym jest przeciwwskazanych u najmłodszych, a niektóre można stosować wyłącznie pod nadzorem lekarza. Poznaj najważniejsze zasady bezpiecznego stosowania tej substancji w terapii dzieci, zwracając uwagę na różnice w dostępnych postaciach i potencjalne zagrożenia wynikające z nieprawidłowego użycia.
- Stosowanie u kierowców
Kwas salicylowy to substancja często stosowana w preparatach do pielęgnacji skóry, zwłaszcza przy problemach z nadmiernym rogowaceniem, odciskami czy łuszczycą. Wiele osób zastanawia się, czy jego używanie może wpływać na zdolność prowadzenia pojazdów lub obsługi maszyn. Sprawdź, co mówią dokumenty źródłowe i dowiedz się, czy po zastosowaniu preparatów z kwasem salicylowym należy zachować szczególną ostrożność podczas wykonywania codziennych czynności wymagających skupienia.
- Stosowanie w ciąży
Stosowanie kwasu salicylowego w ciąży i podczas karmienia piersią wymaga szczególnej ostrożności. Substancja ta, choć często stosowana miejscowo w leczeniu różnych problemów skórnych, może wchłaniać się przez skórę i wywierać wpływ na organizm kobiety oraz rozwijające się dziecko. W zależności od postaci leku, dawki oraz połączeń z innymi substancjami czynnymi, zalecenia dotyczące bezpieczeństwa stosowania kwasu salicylowego mogą się znacząco różnić.
- Wskazania - na co działa?
Kwas salicylowy jest szeroko stosowany w leczeniu różnych problemów skórnych, takich jak odciski, brodawki, łuszczyca, nadmierne rogowacenie, a także infekcje grzybicze czy bakteryjne. Dzięki swoim właściwościom złuszczającym i keratolitycznym, skutecznie pomaga usuwać zrogowaciały naskórek i wspiera proces regeneracji skóry. Występuje zarówno samodzielnie, jak i w połączeniu z innymi substancjami czynnymi, co pozwala na dopasowanie leczenia do konkretnego problemu skórnego i potrzeb pacjenta.
- Rzedawkowanie substancji
Kwas salicylowy jest szeroko stosowany w preparatach do pielęgnacji skóry i leczenia różnych schorzeń dermatologicznych. Przedawkowanie tej substancji jest rzadkie, ale może prowadzić do nieprzyjemnych objawów, szczególnie przy długotrwałym stosowaniu na dużych powierzchniach lub w przypadku przypadkowego połknięcia. W zależności od formy leku i sposobu jego użycia, skutki przedawkowania mogą się różnić. Poznaj objawy, możliwe powikłania i zasady postępowania w sytuacji przedawkowania kwasu salicylowego.
REKLAMA