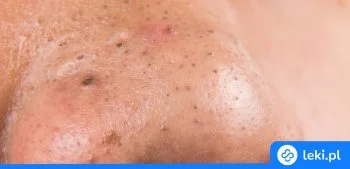
Kwas azelainowy to substancja o szerokim zastosowaniu w leczeniu różnych problemów skórnych, takich jak trądzik pospolity, trądzik różowaty czy przebarwienia. Jego działanie polega przede wszystkim na łagodzeniu zmian zapalnych, zmniejszaniu ilości bakterii na skórze oraz rozjaśnianiu przebarwień. Dzięki temu kwas azelainowy jest często wybierany przez osoby zmagające się z problemami cery w różnym wieku.
Jak działa kwas azelainowy?
Kwas azelainowy należy do grupy leków przeciwtrądzikowych stosowanych miejscowo. Jego działanie polega głównie na hamowaniu rozwoju bakterii odpowiedzialnych za trądzik oraz na zmniejszaniu nadmiernego rogowacenia skóry. Dodatkowo pomaga rozjaśniać przebarwienia i łagodzi stany zapalne, co sprawia, że jest skuteczny zarówno w leczeniu trądziku, jak i przebarwień skórnych123.
Dostępne postacie leku i dawki
W materiałach źródłowych nie opisano połączeń kwasu azelainowego z innymi substancjami czynnymi.
Wskazania
- Leczenie trądziku pospolitego (Acne vulgaris)202122
- Leczenie przebarwień skóry (chloasma, melasma)20
- Leczenie trądziku grudkowo-krostkowego23
- Leczenie trądziku różowatego24
Dawkowanie
Kwas azelainowy najczęściej stosuje się dwa razy dziennie – rano i wieczorem, nakładając cienką warstwę kremu lub żelu na chorobowo zmienioną skórę. Dawkę zwykle stanowi pasek kremu lub żelu o długości ok. 2,5 cm (ok. 0,5 g), co wystarcza na całą twarz252627.
Przeciwwskazania
Podstawowym przeciwwskazaniem jest nadwrażliwość na kwas azelainowy lub którykolwiek ze składników pomocniczych preparatu282930.
Profil bezpieczeństwa
Nie zaleca się stosowania kwasu azelainowego u dzieci poniżej 12 lat w przypadku trądziku, ani u osób poniżej 18 lat w przypadku trądziku różowatego, ze względu na brak danych dotyczących bezpieczeństwa i skuteczności313227. Brak informacji o wpływie na prowadzenie pojazdów lub obsługę maszyn. W badaniach nie wykazano istotnych różnic w bezpieczeństwie stosowania u osób starszych oraz u pacjentów z zaburzeniami czynności nerek czy wątroby312627. Brak danych dotyczących wpływu na ciążę i karmienie piersią w tej sekcji.
Przedawkowanie
Przedawkowanie kwasu azelainowego jest mało prawdopodobne, nawet w przypadku nałożenia dużej ilości na skórę lub przypadkowego spożycia. Nie ma ryzyka ostrego zatrucia333435.
Interakcje
Nie przeprowadzono badań dotyczących interakcji kwasu azelainowego z innymi lekami. Skład preparatów nie wskazuje na istotne ryzyko interakcji z innymi lekami363738.
Najczęstsze działania niepożądane
- Świąd skóry39404142
- Pieczenie i zaczerwienienie w miejscu podania39404142
- Suchość, łuszczenie się skóry4142
- Ból i podrażnienie skóry4142
Mechanizm działania
Kwas azelainowy działa przeciwbakteryjnie, zmniejsza ilość wolnych kwasów tłuszczowych na powierzchni skóry, hamuje nadmierne rogowacenie naskórka oraz ogranicza aktywność nieprawidłowych melanocytów, co przyczynia się do rozjaśniania przebarwień123.
Stosowanie w ciąży
Brak szczegółowych informacji dotyczących bezpieczeństwa stosowania kwasu azelainowego w ciąży w tej sekcji. Zaleca się ostrożność i konsultację z lekarzem przed zastosowaniem.
Stosowanie u dzieci
Kwas azelainowy można stosować u młodzieży powyżej 12. roku życia w leczeniu trądziku, ale nie jest zalecany u młodszych dzieci ze względu na brak danych dotyczących bezpieczeństwa i skuteczności313227.
Stosowanie u kierowców
Nie wykazano, aby kwas azelainowy wpływał na zdolność prowadzenia pojazdów lub obsługiwania maszyn.
Kwas azelainowy – porównanie substancji czynnych
Kwas azelainowy, adapalen i izotretynoina są stosowane w leczeniu trądziku, ale różnią się mechanizmem działania, wskazaniami i bezpieczeństwem u różnych grup pacjentów. Podobieństwa i różnice: jakie...
czytaj więcej ❯❯- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren, 200 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego (Acidum azelaicum). Substancje pomocnicze o znanym działaniu: kwas benzoesowy, glikol propylenowy i alkohol cetostearylowy. 1 g kremu zawiera 11,5 mg alkoholu cetostearylowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego (Acne vulgaris) i przebarwień (chloasma, melasma).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Podanie na skórę. Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu leczniczego.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt leczniczy przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu leczniczego Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt leczniczy systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8, Działania niepożądane), należy zmniejszyć ilość stosowanego produktu leczniczego Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt leczniczy stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu leczniczego Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem leczniczym Skinoren u dzieci w wieku poniżej 12 lat. Pacjenci w podeszłym wieku Nie przeprowadzono ukierunkowanych badań u pacjentów w wieku powyżej 65 lat. Pacjenci z niewydolnością wątroby Nie przeprowadzono ukierunkowanych badań u pacjentów z zaburzeniami czynności wątroby. Pacjenci z niewydolnością nerek Nie przeprowadzono ukierunkowanych badań u pacjentów z zaburzeniami czynności nerek.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Tylko do użytku zewnętrznego. Należy pouczyć pacjenta, że produkt leczniczy powinien być stosowany ostrożnie i że należy unikać kontaktu produktu leczniczego z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu produktu leczniczego z oczami, ustami i błonami śluzowymi należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji produktu leczniczego Skinoren krem należy umyć ręce. Produkt leczniczy Skinoren krem zawiera 2 mg kwasu benzoesowego w 1 g kremu. Kwas benzoesowy może powodować miejscowe podrażnienie skóry. Produkt leczniczy Skinoren krem zawiera 125 mg glikolu propylenowego w 1 g kremu. Produkt leczniczy Skinoren zawiera alkohol cetostearylowy, dlatego może powodować miejscową reakcję skórną (np. kontaktowe zapalenie skóry).
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
U pacjentów stosujących kwas azelainowy w leczeniu trądziku różowatego nie zaleca się stosowania preparatów do oczyszczania skóry na bazie alkoholu, nalewek, środków ściągających, ścierających i złuszczających skórę. Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem leczniczym Skinoren. Po wprowadzeniu produktu leczniczego Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach wykazują potencjalny wpływ kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy. Jednakże, wielkości dawek, po których nie zaobserwowano działań niepożądanych u zwierząt, były w poszczególnych badaniach od 3 do 32 razy większe od dawki zalecanej u ludzi, wyliczonej na podstawie powierzchni ciała (patrz punkt 5.3 „Przedkliniczne dane o bezpieczeństwie”). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersi? Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo. W badaniu dializy równowagowej in vitro wykazano jednak, że może on przenikać do mleka matki.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Przenikanie kwasu azelainowego do mleka matki nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż w 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego. Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią. Dzieci karmione piersią nie powinny mieć kontaktu z leczoną skórą, w tym skórą piersi. Płodność Brak danych dotyczących wpływu produktu leczniczego Skinoren krem na płodność u ludzi. Wyniki badań na zwierzętach nie wykazały wpływu na płodność samców lub samic szczurów (patrz punkt 5.3 „Przedkliniczne dane o bezpieczeństwie”).
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych i raportach z monitorowania po dopuszczeniu do obrotu najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych) Klasyfikacja układów i narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologicznego Nadwrażliwość na leki (która może objawiać się jednym z następujących działań niepożądanych: obrzęk naczynioruchowy, kontaktowe zapalenie skóry, obrzęk oka, obrzęk twarzy), pogorszenie objawów astmy (patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik, odbarwienie skóry Pokrzywka, zapalenie warg, wysypka Zaburzenia ogólne i stany w miejscu podania Pieczenie, świąd, rumień w miejscu podania Ból, łuszczenie skóry, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzęk w miejscu podania Pieczenie, pęcherze, egzema, owrzodzenie w miejscu podania Wymienione działania niepożądane zostały zgłoszone po dopuszczeniu do obrotu produktu leczniczego Skinoren krem.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja produktu leczniczego Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Jerozolimskie 181 C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu leczniczego, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Badania wpływu kwasu azelainowego podanego doustnie na rozwój zarodku i płodu przeprowadzone na szczurach, królikach i makakach w okresie organogenezy, wykazały embriotoksyczność kwasu azelainowego w dawkach, w których odnotowano toksyczne działanie na matki. Nie zaobserwowano działania teratogennego. Maksymalna dawka, po której nie obserwowano żadnych działań niepożądanych (ang. NOAEL – No Observed Adverse Effect Level) u zarodków była 32 razy większa niż maksymalna zalecana dawka u ludzi (ang. MRHD – Maximum Recommended Human Dose) wyliczona w oparciu o powierzchnię ciała (ang.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
BSA – Body Surface Area) szczurów, 6,5 razy większa niż MRHD wyliczona w oparciu o BSA królików i 19 razy większa niż MRHD wyliczona na podstawie BSA małp (patrz punkt 4.6 Wpływ na płodność, ciążę i laktację). W około- i poporodowym badaniu na szczurach, z zastosowaniem kwasu azelainowego podawanego doustnie od 15 dnia ciąży do 21 dnia po porodzie, zaobserwowano niewielkie zaburzenia w poporodowym rozwoju płodów w przypadku dawek doustnych, dla których zanotowano pewną toksyczność u matek. Wartość NOAEL była 3 razy większa niż MRHD wyliczona na podstawie BSA. W badaniu tym nie stwierdzono wpływu na dojrzewanie płciowe płodów. Badania na zwierzętach nie wykazały wpływu na płodność podczas stosowania produktu leczniczego Skinoren krem w dawkach terapeutycznych. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu leczniczego z oczami.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp. Kwas azelainowy w jednorazowym podaniu dożylnym nie wykazuje wpływu na układ nerwowy (test Irwina), układ krążenia, pośrednią przemianę materii, mięśnie gładkie oraz czynność wątroby i nerek.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy (E 210) Cetearylu oktanonian + izopropylu mirystynian (PCL Liquid) Glicerol 85% Glicerolu monostearynian 40-55 Alkohol cetostearylowy Glikol propylenowy Woda oczyszczona Makrogologlicerydów stearynian 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata Okres ważności po pierwszym otwarciu opakowania bezpośredniego: 6 miesięcy. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren, Żel, 150 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 150 mg/g żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 150 mg kwasu azelainowego (Acidum azelaicum). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel Biały lub żółtawo-biały, nieprzezroczysty żel.
- CHPL leku Skinoren, Żel, 150 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku grudkowo-krostkowego skóry twarzy o słabym lub średnim nasileniu.
- CHPL leku Skinoren, Żel, 150 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren żel należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę produktu nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę - rano i wieczorem. Produkt należy delikatnie wetrzeć. Pasek wyciśniętego z tubki produktu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na pokrycie skóry twarzy. Po nałożeniu produktu należy umyć ręce. Pacjenci w podeszłym wieku: Nie przeprowadzono ukierunkowanych badań u pacjentów w wieku powyżej 65 lat. Pacjenci z niewydolnością wątroby: Nie przeprowadzono ukierunkowanych badań u pacjentów z zaburzeniami czynności wątroby. Pacjenci z niewydolnością nerek: Nie przeprowadzono ukierunkowanych badań u pacjentów z zaburzeniami czynności nerek. Sposób podawania Podanie na skórę Przed zastosowaniem produktu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry.
- CHPL leku Skinoren, Żel, 150 mg/gDawkowanie
Bardzo istotne jest regularne stosowanie produktu Skinoren przez cały okres leczenia. Czas leczenia produktem Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych na skórze. Wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu. Aby uzyskać optymalny wynik leczenia, należy stosować produkt regularnie przez kilka miesięcy. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8), należy zmniejszyć ilość stosowanego produktu lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież: Produkt stosować u młodzieży (w wieku od 12 do 18 lat) w leczeniu trądziku grudkowo-krostkowego. Dostosowanie dawki u młodzieży w wieku od 12 do 18 lat nie jest konieczne. Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia trądziku grudkowo-krostkowego u dzieci w wieku poniżej 12 lat.
- CHPL leku Skinoren, Żel, 150 mg/gDawkowanie
W miejscu nałożenia produktu Skinoren nie należy stosować opatrunków okluzyjnych. W przypadku braku poprawy lub nasilenia się objawów trądziku po miesiącu stosowania produktu leczniczego Skinoren, produkt należy odstawić i rozważyć zastosowanie innej metody leczenia.
- CHPL leku Skinoren, Żel, 150 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, Żel, 150 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Żel Skinoren jest przeznaczony tylko do stosowania zewnętrznego. Należy pouczyć pacjenta, że produkt Skinoren żel powinien być stosowany ostrożnie i że należy unikać kontaktu produktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu produktu z oczami, ustami i błonami śluzowymi należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji produktu Skinoren należy umyć ręce. Skinoren żel zawiera 1 mg kwasu benzoesowego w 1 g żelu. Kwas benzoesowy może powodować miejscowe podrażnienie skóry. Produkt leczniczy Skinoren żel zawiera 120 mg glikolu propylenowego w 1g żelu. Po wprowadzeniu produktu do obrotu rzadko zgłaszano pogorszenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, Żel, 150 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, Żel, 150 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach wykazują potencjalny wpływ kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy. Jednakże, wielkości dawek, po których nie zaobserwowano działań niepożądanych u zwierząt, były w poszczególnych badaniach od 3 do 32 razy większe od maksymalnej dawki zalecanej u ludzi, wyliczonej na podstawie powierzchni ciała (patrz punkt 5.3). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersi? Nie wiadomo, czy kwas azelainowy przenika do mleka matki in vivo. W badaniu dializy równowagi in vitro wykazano jednak, że może wystąpić jego przenikanie do mleka matki.
- CHPL leku Skinoren, Żel, 150 mg/gWpływ na płodność, ciążę i laktację
Przenikanie kwasu azelainowego do mleka matki nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż w 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego. Jednakże należy zachować ostrożność przepisując Skinoren kobietom karmiącym piersią. Niemowlęta nie powinny mieć kontaktu z leczoną skórą, w tym skórą piersi. Płodność Brak danych dotyczących wpływu produktu Skinoren żel na płodność u ludzi. Wyniki badań na zwierzętach nie wykazały wpływu na płodność samców lub samic szczurów (patrz punkt 5.3).
- CHPL leku Skinoren, Żel, 150 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, Żel, 150 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych oraz po wprowadzeniu produktu do obrotu najczęściej obserwowano działania niepożądane w miejscu podania takie jak świąd, pieczenie, ból. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu do obrotu produktu leczniczego Skinoren, wymienionych w poniższej tabeli została przedstawiona zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych) Klasyfikacja układów i narządów Bardzo często Często Niezbyt często Rzadko 1 Zaburzenia układu immunologicznego: nadwrażliwość (która może objawiać się jedną lub więcej z następujących reakcji niepożądanych: obrzęk naczynioruchowy, obrzęk oka, obrzęk twarzy), pogorszenie objawów astmy (patrz punkt 4.4) 1 Zaburzenia skóry i tkanki podskórnej: trądzik, kontaktowe zapalenie skóry, podrażnienie skóry, pokrzywka Zaburzenia ogólne i stany w miejscu podania: świąd, pieczenie, ból w miejscu podania, suchość, wysypka, parestezje w miejscu podania, rumień, łuszczenie skóry, uczucie ciepła, odbarwienie skóry w miejscu podania Dodatkowe działania niepożądane zostały zgłoszone po dopuszczeniu do obrotu produktu Skinoren żel.
- CHPL leku Skinoren, Żel, 150 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Leczenie trądziku grudkowo-krostkowego u młodzieży w wieku od 12 do 18 lat. W 4 badaniach klinicznych II fazy i II/III fazy, całkowita częstość występowania działań niepożądanych, u włączonej w badanie młodzieży w wieku od 12 do 17 lat (120/383; 31%) stosującej Skinoren żel, była podobna do częstości występowania w grupie wiekowej od 12 do 17 lat (40%), w wieku 18 lat i powyżej (37%) i dla całkowitej populacji pacjentów (38%). To podobieństwo również odnosi się do grupy wiekowej od 12 do 20 lat (40%). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Skinoren, Żel, 150 mg/gDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181 C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Skinoren, Żel, 150 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki z badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia lekiem.
- CHPL leku Skinoren, Żel, 150 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego, kwas azelainowy. kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku grudkowo-krostkowatego wynika z jego przeciwbakteryjnego działania i hamowania nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje wzrost bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki dwóch randomizowanych, podwójnie ślepych badań klinicznych wskazują, że produkt Skinoren żel zmniejszał liczbę grudek i krostek skuteczniej niż podłoże leku, był jednak o 6% mniej skuteczny niż 5% nadtlenek benzoilu (p=0,056).
- CHPL leku Skinoren, Żel, 150 mg/gWłaściwości farmakodynamiczne
W badaniach tych skuteczność leczenia zaskórników produktem Skinoren żel była oceniana jako parametr drugorzędowy. Wyniki badań wskazują, że Skinoren żel znacznie skuteczniej zmniejsza względną liczbę zaskórników niż podłoże leku. Produkt był jednak mniej skuteczny niż 5% nadtlenek benzoilu.
- CHPL leku Skinoren, Żel, 150 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez skórę nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada około 5 g żelu) wchłania się około 3,6% zastosowanej dawki. Badania kliniczne wykazały podobny stopień wchłaniania kwasu azelainowego z obu postaci produktu Skinoren – kremu i żelu. Część kwasu azelainowego wchłoniętego przez skórę jest wydalany z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem. Po 8 tygodniach stosowania produktu Skinoren dwa razy dziennie u pacjentów z trądzikiem stężenie kwasu azelainowego w osoczu krwi w stanie równowagi mieściło się w granicach stężeń, jakie odnotowano u zdrowych ochotników stosujących prawidłową dietę.
- CHPL leku Skinoren, Żel, 150 mg/gWłaściwości farmakokinetyczne
Wyniki te wskazują, że ilość kwasu azelainowego wchłonięta przez skórę z produktu Skinoren żel stosowanego dwa razy dziennie nie wpływa znacząco na stężenie w organizmie kwasu azelainowego, przyjmowanego z pokarmem oraz z innych źródeł egzogennych w klinicznie istotny sposób.
- CHPL leku Skinoren, Żel, 150 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań toksyczności po podaniu wielokrotnym i toksycznego wpływu na rozród, nie ujawniają szczególnego zagrożenia dla człowieka. Badania wpływu kwasu azelainowego podanego doustnie na rozwój zarodku i płodu przeprowadzone na szczurach, królikach i makakach w okresie organogenezy, wykazały embriotoksyczność kwasu azelainowego w dawkach, w których odnotowana toksyczne działanie na matki. Nie zaobserwowano działania teratogennego. Maksymalna dawka, po której nie obserwowano żadnych działań niepożądanych (ang. NOAEL – No Observed Adverse Effect Level) u zarodków była 32 razy większa niż maksymalna zalecana dawka u ludzi (ang. MRHD – Maximum Recommended Human Dose) wyliczona na podstawie powierzchni ciała (ang. BSA – Body Surface Area) szczurów, 6,5 razy większa niż MRHD wyliczona na podstawie BSA królików i 19 razy większa niż MRHD wyliczona na podstawie BSA małp (patrz punkt 4.6).
- CHPL leku Skinoren, Żel, 150 mg/gPrzedkliniczne dane o bezpieczeństwie
W około- i poporodowym badaniu na szczurach, z zastosowaniem kwasu azelainowego podawanego doustnie od 15 dnia ciąży do 21 dnia po porodzie, zaobserwowano niewielkie zaburzenia w poporodowym rozwoju płodów w przypadku dawek doustnych, po zastosowaniu których odnotowano pewną toksyczność u matek. Wartość NOAEL była 3 razy większa niż MRHD wyliczona na podstawie BSA. W badaniu tym nie stwierdzono wpływu na dojrzewanie płciowe płodów. W badaniach in vitro i in vivo z zastosowaniem kwasu azelainowego nie stwierdzono mutagennego działania na zarodek i komórki somatyczne. W 26-tygodniowym badaniu rakotwórczości z wykorzystaniem transgenicznych myszy płci męskiej i żeńskiej (Tg.AC), zarówno żel Skinoren Rosacea, jak i podłoże żelu nie spowodowały zwiększenia liczby brodawczaków w miejscu podania u myszy płci męskiej, po zastosowaniu dwa razy na dobę. Nie zaobserwowano powyższego efektu po podaniu pojedynczej dawki u myszy płci męskiej i żeńskiej.
- CHPL leku Skinoren, Żel, 150 mg/gPrzedkliniczne dane o bezpieczeństwie
Ten efekt może być związany z działaniem podłoża żelu. Znaczenie kliniczne powyższych doniesień w przypadku zastosowania produktu u ludzi nie jest jasne, szczególnie w świetle wątpliwości dotyczących prawidłowości systemu badawczego w badaniach Tg.AC. Jeśli kwas azelainowy miał styczność z oczami małp i królików, widoczne były oznaki umiarkowanego lub nawet silnego podrażnienia. Z tego względu należy unikać kontaktu z oczami. Kwas azelainowy w jednorazowym podaniu dożylnym nie wykazuje wpływu na układ nerwowy (test Irwina), układ krążenia, pośrednią przemianę materii, mięśnie gładkie oraz czynność wątroby i nerek.
- CHPL leku Skinoren, Żel, 150 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy (E 210) Karbomer 980 Disodu edetynian Lecytyna Polisorbat 80 Glikol propylenowy Woda oczyszczona Sodu wodorotlenek Triglicerydy nasyconych kwasów tłuszczowych o średniej długości łańcucha 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Brak specjalnych zaleceń dotyczących przechowywania. 6.5 Rodzaj i zawartość opakowania Tuby zawierające 30 g i 50 g żelu. Tuba aluminiowa z zakrętką z HDPE w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren Rosacea 150 mg/g żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 150 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy 1 mg/g żelu glikol propylenowy 120 mg/g żelu Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel. Biały lub żółtawo-biały, nieprzezroczysty żel.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Miejscowe leczenie trądziku różowatego grudkowo-krostkowego.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Produkt leczniczy Skinoren Rosacea jest przeznaczony wyłącznie do stosowania na skórę. Dawkowanie Produkt leczniczy Skinoren Rosacea należy nanosić na zmienione chorobowo miejsca na skórze dwa razy na dobę (rano i wieczorem) i delikatnie wetrzeć w skórę. Około 0,5 g (= 2,5 cm) żelu wystarcza na pokrycie całej powierzchni twarzy. Dzieci i młodzież Produkt leczniczy Skinoren Rosacea nie jest zalecany do stosowania u dzieci i młodzieży w wieku poniżej 18 lat, ze względu na brak danych dotyczących bezpieczeństwa stosowania i skuteczności w leczeniu trądziku różowatego. Pacjenci w podeszłym wieku Nie przeprowadzono ukierunkowanych badań u pacjentów w wieku powyżej 65 lat. Pacjenci z niewydolnością wątroby Nie przeprowadzono ukierunkowanych badań u pacjentów z zaburzeniami czynności wątroby. Pacjenci z niewydolnością nerek Nie przeprowadzono ukierunkowanych badań u pacjentów z zaburzeniami czynności nerek.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gDawkowanie
Sposób podawania Przed zastosowaniem produktu leczniczego Skinoren Rosacea należy dokładnie oczyścić skórę wodą i wysuszyć. Można użyć łagodnego środka do mycia skóry. Nie należy używać opatrunków okluzyjnych i opatrunków osłaniających. Po nałożeniu żelu należy umyć ręce. Ważne jest regularne stosowanie produktu leczniczego Skinoren Rosacea przez cały okres leczenia. Okres stosowania produktu leczniczego Skinoren Rosacea u poszczególnych pacjentów może się różnić i zależy od nasilenia zmian na skórze. Zazwyczaj, wyraźna poprawa jest widoczna po 4 tygodniach leczenia. Aby uzyskać optymalne efekty, produkt Skinoren Rosacea można stosować przez kilka miesięcy, zgodnie z wynikiem klinicznym. W przypadku braku poprawy po 2 miesiącach stosowania lub w przypadku zaostrzenia objawów trądziku różowatego, należy przerwać stosowanie produktu Skinoren Rosacea i rozważyć inne metody leczenia.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gDawkowanie
Jeśli wystąpi podrażnienie skóry (patrz punkt 4.8 „Działania niepożądane”) należy zmniejszyć ilość lub ograniczyć częstość stosowania produktu leczniczego Skinoren Rosacea do jednego razu na dobę, aż do ustąpienia podrażnienia. W razie konieczności należy przerwać leczenie na kilka dni.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt Skinoren Rosacea jest przeznaczony tylko do stosowania miejscowego. Należy pouczyć pacjenta, że product Skinoren Rosacea powinien być stosowany ostrożnie i że należy unikać kontaktu produktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu produktu z oczami, ustami i błonami śluzowymi należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji produktu Skinoren Rosacea należy umyć ręce. Produkt leczniczy Skinoren Rosacea zawiera 1 mg kwasu benzoesowego w 1 g żelu . Kwas benzoesowy może powodować miejscowe podrażnienie skóry. Produkt leczniczy Skinoren Rosacea zawiera 120 mg glikolu propylenowego w 1g żelu.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gSpecjalne środki ostrozności
Ze względu na dużą wrażliwość skóry twarzy z trądzikiem różowatym, podczas leczenia produktem leczniczym Skinoren Rosacea należy powstrzymać się od leczenia innymi produktami podawanymi miejscowo, a także od stosowania produktów do pielęgnacji skóry, które mogłyby wywołać miejscowe podrażnienie, takich jak mydła, preparaty do czyszczenia twarzy zawierające alkohol, nalewki lecznicze, środki ściągające oraz środki ścierające do czyszczenia skóry. Po wprowadzeniu produktu do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji produktu leczniczego Skinoren Rosacea z innymi lekami. Skład produktu leczniczego Skinoren Rosacea nie wskazuje na to, żeby którykolwiek ze składników produktu wchodził w niepożądane interakcje, które mogłyby wpływać niekorzystnie na bezpieczeństwo jego stosowania. W żadnym z kontrolowanych badań klinicznych nie odnotowano interakcji specyficznych dla leku.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach wykazują potencjalny wpływ na przebieg ciąży, rozwój zarodka (płodu), przebieg porodu lub rozwój pourodzeniowy. Jednakże, wielkości dawek, po których nie zaobserwowano działań niepożądanych u zwierząt, były w poszczególnych badaniach od 3 do 32 razy większe od maksymalnej dawki zalecanej u ludzi, wyliczonej na podstawie powierzchni ciała (patrz punkt 5.3 „Przedkliniczne dane o bezpieczeństwie”). Należy zachować ostrożność przepisując kwas azelainowy kobietom w ciąży. Laktacja Nie wiadomo, czy kwas azelainowy przenika do mleka matki in vivo . Jednak w badaniu in vitro metodą dializy równowagi (ang. Equilibrium dialysis) wykazano, że lek może przenikać do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gWpływ na płodność, ciążę i laktację
Kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym mniej niż 4% kwasu azelainowego wchłania się do organizmu, nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego. Należy jednak zachować ostrożność przepisując produkt leczniczy Skinoren Rosacea kobietom karmiącym piersią. Niemowlęta nie powinny mieć kontaktu z leczoną skórą, w tym skórą piersi. Płodność Brak danych dotyczących wpływu produktu Skinoren Rosacea na płodność u ludzi. Wyniki badań na zwierzętach nie wykazały wpływu na płodność samców lub samic szczurów (patrz punkt 5.3 „Przedkliniczne dane o bezpieczeństwie”).
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren Rosacea nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych oraz po wprowadzeniu produktu do obrotu najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, ból. Działania niepożądane obserwowane w trakcie badań klinicznych oraz po wprowadzeniu do obrotu produktu leczniczego Skinoren Rosacea wymieniono w poniżej tabeli według częstości ich występowania. Częstość występowania działań niepożądanych przedstawiono zgodnie z konwencją MedDRA: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥ 1/1000 do < 1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (< 1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych).
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gDziałania niepożądane
Klasyfikacja układów i narządówMedDRA Bardzo często Często Niezbyt często Rzadko1 Zaburzenia układu immunologicznego Nadwrażliwość (która może objawiać się jedną lub więcej z następujących reakcji niepożądanych: obrzęk naczynioruchowy, obrzęk oka, obrzęk twarzy, duszność), pogorszenie objawów astmy(patrz punkt 4.4) Zaburzenia skóryi tkanki podskórnej Trądzik, kontaktowe zapalenie skóry Podrażnienie skóry, pokrzywka Zaburzenia ogólne i stany w miejscu podania Pieczenie w miejscu podania, ból w miejscu podania,świąd w miejscu podania Parestezje w miejscu podania, suchość skóry w miejscu podania, wysypka w miejscu podania, obrzęk w miejscupodania Uczucie dyskomfortu w miejscu podania, rumień w miejscu podania, pokrzywka w miejscu podania - CHPL leku Skinoren Rosacea, Żel, 150 mg/gDziałania niepożądane
1 Dodatkowe działania niepożądane zostały zgłoszone po dopuszczeniu do obrotu produktu Skinoren Rosacea. Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. W badaniach klinicznych u pacjentów leczonych kwasem azelainowym w postaci żelu z powodu trądziku pospolitego obserwowano zmianę zabarwienia w miejscu zastosowania, natomiast nie obserwowano tego u pacjentów leczonych z powodu trądziku różowatego, chociaż nie można tego wykluczyć (częstość nie znana). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gDziałania niepożądane
Jerozolimskie 181C 02-222 Warszawa Tel.:+48 22 49 21 301 Faks.:+48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gPrzedawkowanie
4.9 Przedawkowanie Ze względu na bardzo małą toksyczność miejscową i ogólnoustrojową kwasu azelainowego zatrucie jest mało prawdopodobne.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Lek przeciwtrądzikowy do stosowania miejscowego. Kod ATC: D10A X03 Patofizjologia trądziku różowatego nie jest w pełni poznana, jednak coraz częściej uznaje się, że stan zapalny, obejmujący podwyższenie poziomu kilku prozapalnych cząsteczek efektorowych, takich jak kalikreina-5 i katelicydyny oraz wolne rodniki tlenowe (ang. ROS – reactive oxigen species) jest głównym czynnikiem tej choroby. Wykazano, że kwas azelainowy moduluje reakcję zapalną w prawidłowych ludzkich keratynocytach przez: a) aktywację peroksysomów gamma receptora aktywowanego przez proliferatory (PPARγ); b) hamowanie trans-aktywacji czynnika jądrowego kB (NF-kB); c) hamowanie wytwarzania cytokin prozapalnych oraz d) hamowanie uwalniania wolnych rodników tlenowych z neutrofilów, jak również poprzez bezpośrednie działanie wychwytujące istniejące już wolne rodniki tlenowe.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gWłaściwości farmakodynamiczne
Ponadto wykazano, że kwas azelainowy bezpośrednio hamuje kalikreinę-5 i ekspresję katelicydyny w trzech modelach: in vitro (ludzkie keratynocyty), skóra myszy i skóra twarzy u pacjentów z trądzikiem różowatym. Właściwości przeciwzapalne kwasu azelainowego mogą odgrywać rolę w leczeniu trądziku różowatego. Kliniczne znaczenie powyższych doniesień dotyczących kalikreiny-5 i katelicydyny i ich wpływu na patofizjologię trądziku różowatego nie zostało jeszcze w pełni potwierdzone w dużym badaniu klinicznym, jednak wstępne wyniki badań na ludzkiej skórze twarzy wydają się potwierdzać wyniki uzyskane w badaniach na skórze myszy i w badaniach in vitro . W dwóch 12-tygodniowych badaniach klinicznych trądziku różowatego grudkowo-krostkowego kontrolowanych podłożem produktu leczniczego, produkt leczniczy Skinoren Rosacea przewyższa statystycznie znamiennie podłoże produktu leczniczego pod względem redukcji zapalnych zmian chorobowych, wskaźnika IGA (Investigator’s Global Assessment), ogólnej oceny poprawy oraz pod względem ograniczenia rumienia.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gWłaściwości farmakodynamiczne
W badaniu klinicznym trądziku różowatego grudkowo-krostkowego, w którym porównywano produkt Skinoren Rosacea z 0,75% żelem zawierającym substancję czynną metronidazol, produkt leczniczy Skinoren Rosacea wykazał znamienną przewagę pod względem redukcji ilości zmian chorobowych (72,7% wobec 55,8%), ogólnej oceny poprawy oraz pod względem zmniejszenia nasilenia rumienia (56% wobec 42%). Wskaźnik niepożądanych reakcji skórnych, które w większości przypadków były łagodne lub umiarkowane, wynosił 25,8% w przypadku produktu leczniczego Skinoren Rosacea i 7,1% w przypadku 0,75% metronidazolu w żelu. W trzech badaniach klinicznych nie zaobserwowano rozszerzenia drobnych naczyń krwionośnych.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu leczniczego Skinoren Rosacea, kwas azelainowy penetruje do wszystkich warstw skóry. Przenika on szybciej jeśli skóra jest uszkodzona. 3,6% podanej dawki wchłaniało się przezskórnie po pojedynczym zastosowaniu miejscowym 1 g kwasu azelainowego (w postaci 5 g kremu Skinoren). Badania kliniczne pacjentów z trądzikiem wykazały podobne wskaźniki wchłaniania kwasu azelainowego z produktów leczniczych Skinoren Rosacea i Skinoren krem. Część kwasu azelainowego wchłoniętego przez skórę jest wydalana w postaci niezmienionej w moczu. Pozostała jego ilość ulega rozkładowi w procesie -oksydacji do kwasów dikarboksylowych o krótszej długości łańcucha (C 7 , C 5 ), które również oznaczono w moczu. Stężenie kwasu azelainowego w osoczu w stanie równowagi u pacjentów z trądzikiem różowatym grudkowo-krostkowym po 8 tygodniach leczenia produktem leczniczym Skinoren Rosacea dwa razy na dobę mieściło się w zakresie obserwowanym również u ochotników i pacjentów z trądzikiem stosujących zwykłą dietę.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gWłaściwości farmakokinetyczne
Z powyższego wynika, że stopień wchłaniania przezskórnego kwasu azelainowego po stosowaniu produktu leczniczego Skinoren Rosacea dwa razy na dobę nie zmienia obciążenia ogólnoustrojowego kwasem azelainowym pochodzącym z pokarmu i źródeł endogennych w klinicznie istotny sposób.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, uzyskane na podstawie konwencjonalnych badań farmakologicznych toksyczności po podaniu wielokrotnym i toksycznego wpływu na reprodukcję, nie ujawniają występowania szczególnego zagrożenia dla człowieka. Badania wpływu kwasu azelainowego podanego doustnie na rozwój zarodku i płodu przeprowadzone na szczurach, królikach i makakach w okresie organogenezy, wykazały embriotoksyczność kwasu azelainowego w dawkach, w których odnotowana toksyczne działanie na matki. Nie zaobserwowano działania teratogennego. Maksymalna dawka, po której nie obserwowano żadnych działań niepożądanych (ang. NOAEL – No Observed Adverse Effect Level) u zarodków była 32 razy większa niż maksymalna zalecana dawka u ludzi (ang. MRHD – Maximum Recommended Human Dose) wyliczona na podstawie powierzchni ciała (ang.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gPrzedkliniczne dane o bezpieczeństwie
BSA – Body Surface Area) szczurów, 6,5 razy większa niż MRHD wyliczona na podstawie BSA królików i 19 razy większa niż MRHD wyliczona na podstawie BSA małp (patrz punkt 4.6 Ciąża i laktacja). W około- i poporodowym badaniu na szczurach, z zastosowaniem kwasu azelainowego podawanego doustnie od 15 dnia ciąży do 21 dnia po porodzie, zaobserwowano niewielkie zaburzenia w poporodowym rozwoju płodów w przypadku dawek doustnych, po zastosowaniu których odnotowano pewną toksyczność u matek. Wartość NOAEL była 3 razy większa niż MRHD wyliczona na podstawie BSA. W badaniu tym nie stwierdzono wpływu na dojrzewanie płciowe płodów. W badaniach in vitro i in vivo z zastosowaniem kwasu azelainowego nie stwierdzono mutagennego działania na zarodek i komórki somatyczne. Nie przeprowadzono konwencjonalnych, długotrwałych badań rakotwórczości kwasu azelainowego po podaniu doustnym.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gPrzedkliniczne dane o bezpieczeństwie
W 26-tygodniowym badaniu rakotwórczości z wykorzystaniem transgenicznych myszy płci męskiej i żeńskiej (Tg.AC), zarówno żel Skinoren Rosacea, jak i podłoże żelu nie spowodowały zwiększenia liczby brodawczaków w miejscu podania u myszy płci męskiej, po zastosowaniu dwa razy na dobę. Nie zaobserwowano powyższego efektu po podaniu pojedynczej dawki u myszy płci męskiej i żeńskiej. Ten efekt może być związany z działaniem podłoża żelu. Znaczenie kliniczne powyższych doniesień w przypadku zastosowania produktu u ludzi nie jest jasne, szczególnie w świetle wątpliwości dotyczących prawidłowości systemu badawczego w badaniach Tg.AC. Jeśli kwas azelainowy miał styczność z oczami małp i królików, widoczne były oznaki umiarkowanego lub nawet silnego podrażnienia. Z tego względu należy unikać kontaktu z oczami.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gPrzedkliniczne dane o bezpieczeństwie
Kwas azelainowy w jednorazowym podaniu dożylnym nie wykazuje wpływu na układ nerwowy (test Irwina), układ krążenia, pośrednią przemianę materii, mięśnie gładkie oraz czynność wątroby i nerek.
- CHPL leku Skinoren Rosacea, Żel, 150 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy (E 210) Karbomer 980 Disodu edetynian Lecytyna Polisorbat 80 Glikol propylenowy Woda oczyszczona Sodu wodorotlenek Triglicerydy nasyconych kwasów tłuszczowych o średniej długości łańcucha 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania. 6.5 Rodzaj i zawartość opakowania Tuba zawierająca 30 g żelu. Tuba aluminiowa wewnątrz powlekana żywicą epoksydową, z zakrętką z polietylenu (HDPE), w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak szczególnych wymagań.
- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 200 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego ( Acne vulgaris ) i przebarwień ( chloasma, melasma ).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8 ,,Działania niepożądane"), należy zmniejszyć ilość stosowanego produktu Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem Skinoren u dzieci poniżej 12 lat.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Krem Skinoren jest przeznaczony tylko do stosowania miejscowego. Skinoren zawiera substancje pomocnicze: kwas benzoesowy, który w niewielkim stopniu podrażnia skórę, oczy i błony śluzowe oraz glikol propylenowy, który może powodować podrażnienia skóry. Należy pouczyć pacjenta, że produkt leczniczy należy stosować ostrożnie i unikać kontaktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu z oczami, ustami lub błonami śluzowymi, należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji kremu Skinoren należy umyć ręce. Po wprowadzeniu Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem Skinoren.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3 Dane przedkliniczne). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo . W badaniu dializy równowagi in vitro wykazano jednak, że może zachodzić przenikanie do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych)
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Klasyfikacja układówi narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologiczneg o Nadwrażliwość,pogorszenie objawówastmy(patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik,odbarwienie skóry Zapalenie warg Zaburzenia ogólne i stany w miejscu podania Świąd, pieczenie, rumieńw miejscu podania Łuszczenie skóry, ból, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzękw miejscu podania Pęcherze, egzema, uczucie ciepła, owrzodzenie w miejscu podania - CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja kremu Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dzieci i dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Ul. Ząbkowska 41 03-736 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: adr@urpl.gov.pl
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu z oczami. Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy Makrogologlicerydów stearyniany Mieszanina mono-, di- i triglicerydów wyższych kwasów tłuszczowych Cetearylu oktanonian Glikol propylenowy Glicerol 85% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 200 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego ( Acne vulgaris ) i przebarwień ( chloasma, melasma ).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8 ,,Działania niepożądane"), należy zmniejszyć ilość stosowanego produktu Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem Skinoren u dzieci poniżej 12 lat.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Krem Skinoren jest przeznaczony tylko do stosowania miejscowego. Skinoren zawiera substancje pomocnicze: kwas benzoesowy, który w niewielkim stopniu podrażnia skórę, oczy i błony śluzowe oraz glikol propylenowy, który może powodować podrażnienia skóry. Należy pouczyć pacjenta, że produkt leczniczy należy stosować ostrożnie i unikać kontaktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu z oczami, ustami lub błonami śluzowymi, należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji kremu Skinoren należy umyć ręce. Po wprowadzeniu Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem Skinoren.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3 Dane przedkliniczne). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo . W badaniu dializy równowagi in vitro wykazano jednak, że może zachodzić przenikanie do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych)
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Klasyfikacja układówi narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologiczneg o Nadwrażliwość,pogorszenie objawówastmy(patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik,odbarwienie skóry Zapalenie warg Zaburzenia ogólne i stany w miejscu podania Świąd, pieczenie, rumieńw miejscu podania Łuszczenie skóry, ból, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzękw miejscu podania Pęcherze, egzema, uczucie ciepła, owrzodzenie w miejscu podania - CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja kremu Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dzieci i dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Ul. Ząbkowska 41 03-736 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: adr@urpl.gov.pl
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu z oczami. Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy Makrogologlicerydów stearyniany Mieszanina mono-, di- i triglicerydów wyższych kwasów tłuszczowych Cetearylu oktanonian Glikol propylenowy Glicerol 85% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 200 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego ( Acne vulgaris ) i przebarwień ( chloasma, melasma ).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8 ,,Działania niepożądane"), należy zmniejszyć ilość stosowanego produktu Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem Skinoren u dzieci poniżej 12 lat.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Krem Skinoren jest przeznaczony tylko do stosowania miejscowego. Skinoren zawiera substancje pomocnicze: kwas benzoesowy, który w niewielkim stopniu podrażnia skórę, oczy i błony śluzowe oraz glikol propylenowy, który może powodować podrażnienia skóry. Należy pouczyć pacjenta, że produkt leczniczy należy stosować ostrożnie i unikać kontaktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu z oczami, ustami lub błonami śluzowymi, należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji kremu Skinoren należy umyć ręce. Po wprowadzeniu Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem Skinoren.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3 Dane przedkliniczne). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo . W badaniu dializy równowagi in vitro wykazano jednak, że może zachodzić przenikanie do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych)
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Klasyfikacja układówi narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologiczneg o Nadwrażliwość,pogorszenie objawówastmy(patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik,odbarwienie skóry Zapalenie warg Zaburzenia ogólne i stany w miejscu podania Świąd, pieczenie, rumieńw miejscu podania Łuszczenie skóry, ból, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzękw miejscu podania Pęcherze, egzema, uczucie ciepła, owrzodzenie w miejscu podania - CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja kremu Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dzieci i dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Ul. Ząbkowska 41 03-736 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: adr@urpl.gov.pl
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu z oczami. Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy Makrogologlicerydów stearyniany Mieszanina mono-, di- i triglicerydów wyższych kwasów tłuszczowych Cetearylu oktanonian Glikol propylenowy Glicerol 85% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 200 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego ( Acne vulgaris ) i przebarwień ( chloasma, melasma ).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8 ,,Działania niepożądane"), należy zmniejszyć ilość stosowanego produktu Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem Skinoren u dzieci poniżej 12 lat.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Krem Skinoren jest przeznaczony tylko do stosowania miejscowego. Skinoren zawiera substancje pomocnicze: kwas benzoesowy, który w niewielkim stopniu podrażnia skórę, oczy i błony śluzowe oraz glikol propylenowy, który może powodować podrażnienia skóry. Należy pouczyć pacjenta, że produkt leczniczy należy stosować ostrożnie i unikać kontaktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu z oczami, ustami lub błonami śluzowymi, należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji kremu Skinoren należy umyć ręce. Po wprowadzeniu Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem Skinoren.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3 Dane przedkliniczne). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo . W badaniu dializy równowagi in vitro wykazano jednak, że może zachodzić przenikanie do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych)
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Klasyfikacja układówi narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologiczneg o Nadwrażliwość,pogorszenie objawówastmy(patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik,odbarwienie skóry Zapalenie warg Zaburzenia ogólne i stany w miejscu podania Świąd, pieczenie, rumieńw miejscu podania Łuszczenie skóry, ból, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzękw miejscu podania Pęcherze, egzema, uczucie ciepła, owrzodzenie w miejscu podania - CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja kremu Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dzieci i dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Ul. Ząbkowska 41 03-736 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: adr@urpl.gov.pl
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu z oczami. Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy Makrogologlicerydów stearyniany Mieszanina mono-, di- i triglicerydów wyższych kwasów tłuszczowych Cetearylu oktanonian Glikol propylenowy Glicerol 85% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 200 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego ( Acne vulgaris ) i przebarwień ( chloasma, melasma ).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8 ,,Działania niepożądane"), należy zmniejszyć ilość stosowanego produktu Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem Skinoren u dzieci poniżej 12 lat.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Krem Skinoren jest przeznaczony tylko do stosowania miejscowego. Skinoren zawiera substancje pomocnicze: kwas benzoesowy, który w niewielkim stopniu podrażnia skórę, oczy i błony śluzowe oraz glikol propylenowy, który może powodować podrażnienia skóry. Należy pouczyć pacjenta, że produkt leczniczy należy stosować ostrożnie i unikać kontaktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu z oczami, ustami lub błonami śluzowymi, należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji kremu Skinoren należy umyć ręce. Po wprowadzeniu Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem Skinoren.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3 Dane przedkliniczne). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo . W badaniu dializy równowagi in vitro wykazano jednak, że może zachodzić przenikanie do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych)
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Klasyfikacja układówi narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologiczneg o Nadwrażliwość,pogorszenie objawówastmy(patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik,odbarwienie skóry Zapalenie warg Zaburzenia ogólne i stany w miejscu podania Świąd, pieczenie, rumieńw miejscu podania Łuszczenie skóry, ból, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzękw miejscu podania Pęcherze, egzema, uczucie ciepła, owrzodzenie w miejscu podania - CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja kremu Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dzieci i dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Ul. Ząbkowska 41 03-736 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: adr@urpl.gov.pl
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu z oczami. Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy Makrogologlicerydów stearyniany Mieszanina mono-, di- i triglicerydów wyższych kwasów tłuszczowych Cetearylu oktanonian Glikol propylenowy Glicerol 85% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 200 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego ( Acne vulgaris ) i przebarwień ( chloasma, melasma ).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8 ,,Działania niepożądane"), należy zmniejszyć ilość stosowanego produktu Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem Skinoren u dzieci poniżej 12 lat.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Krem Skinoren jest przeznaczony tylko do stosowania miejscowego. Skinoren zawiera substancje pomocnicze: kwas benzoesowy, który w niewielkim stopniu podrażnia skórę, oczy i błony śluzowe oraz glikol propylenowy, który może powodować podrażnienia skóry. Należy pouczyć pacjenta, że produkt leczniczy należy stosować ostrożnie i unikać kontaktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu z oczami, ustami lub błonami śluzowymi, należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji kremu Skinoren należy umyć ręce. Po wprowadzeniu Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem Skinoren.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3 Dane przedkliniczne). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo . W badaniu dializy równowagi in vitro wykazano jednak, że może zachodzić przenikanie do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych)
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Klasyfikacja układówi narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologiczneg o Nadwrażliwość,pogorszenie objawówastmy(patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik,odbarwienie skóry Zapalenie warg Zaburzenia ogólne i stany w miejscu podania Świąd, pieczenie, rumieńw miejscu podania Łuszczenie skóry, ból, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzękw miejscu podania Pęcherze, egzema, uczucie ciepła, owrzodzenie w miejscu podania - CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja kremu Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dzieci i dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Ul. Ząbkowska 41 03-736 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: adr@urpl.gov.pl
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu z oczami. Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy Makrogologlicerydów stearyniany Mieszanina mono-, di- i triglicerydów wyższych kwasów tłuszczowych Cetearylu oktanonian Glikol propylenowy Glicerol 85% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 200 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego ( Acne vulgaris ) i przebarwień ( chloasma, melasma ).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8 ,,Działania niepożądane"), należy zmniejszyć ilość stosowanego produktu Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem Skinoren u dzieci poniżej 12 lat.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Krem Skinoren jest przeznaczony tylko do stosowania miejscowego. Skinoren zawiera substancje pomocnicze: kwas benzoesowy, który w niewielkim stopniu podrażnia skórę, oczy i błony śluzowe oraz glikol propylenowy, który może powodować podrażnienia skóry. Należy pouczyć pacjenta, że produkt leczniczy należy stosować ostrożnie i unikać kontaktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu z oczami, ustami lub błonami śluzowymi, należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji kremu Skinoren należy umyć ręce. Po wprowadzeniu Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem Skinoren.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3 Dane przedkliniczne). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo . W badaniu dializy równowagi in vitro wykazano jednak, że może zachodzić przenikanie do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych)
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Klasyfikacja układówi narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologiczneg o Nadwrażliwość,pogorszenie objawówastmy(patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik,odbarwienie skóry Zapalenie warg Zaburzenia ogólne i stany w miejscu podania Świąd, pieczenie, rumieńw miejscu podania Łuszczenie skóry, ból, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzękw miejscu podania Pęcherze, egzema, uczucie ciepła, owrzodzenie w miejscu podania - CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja kremu Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dzieci i dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Ul. Ząbkowska 41 03-736 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: adr@urpl.gov.pl
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu z oczami. Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy Makrogologlicerydów stearyniany Mieszanina mono-, di- i triglicerydów wyższych kwasów tłuszczowych Cetearylu oktanonian Glikol propylenowy Glicerol 85% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 200 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego ( Acne vulgaris ) i przebarwień ( chloasma, melasma ).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8 ,,Działania niepożądane"), należy zmniejszyć ilość stosowanego produktu Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem Skinoren u dzieci poniżej 12 lat.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Krem Skinoren jest przeznaczony tylko do stosowania miejscowego. Skinoren zawiera substancje pomocnicze: kwas benzoesowy, który w niewielkim stopniu podrażnia skórę, oczy i błony śluzowe oraz glikol propylenowy, który może powodować podrażnienia skóry. Należy pouczyć pacjenta, że produkt leczniczy należy stosować ostrożnie i unikać kontaktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu z oczami, ustami lub błonami śluzowymi, należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji kremu Skinoren należy umyć ręce. Po wprowadzeniu Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem Skinoren.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3 Dane przedkliniczne). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo . W badaniu dializy równowagi in vitro wykazano jednak, że może zachodzić przenikanie do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych)
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Klasyfikacja układówi narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologiczneg o Nadwrażliwość,pogorszenie objawówastmy(patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik,odbarwienie skóry Zapalenie warg Zaburzenia ogólne i stany w miejscu podania Świąd, pieczenie, rumieńw miejscu podania Łuszczenie skóry, ból, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzękw miejscu podania Pęcherze, egzema, uczucie ciepła, owrzodzenie w miejscu podania - CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja kremu Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dzieci i dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Ul. Ząbkowska 41 03-736 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: adr@urpl.gov.pl
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu z oczami. Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy Makrogologlicerydów stearyniany Mieszanina mono-, di- i triglicerydów wyższych kwasów tłuszczowych Cetearylu oktanonian Glikol propylenowy Glicerol 85% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 200 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego ( Acne vulgaris ) i przebarwień ( chloasma, melasma ).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8 ,,Działania niepożądane"), należy zmniejszyć ilość stosowanego produktu Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem Skinoren u dzieci poniżej 12 lat.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Krem Skinoren jest przeznaczony tylko do stosowania miejscowego. Skinoren zawiera substancje pomocnicze: kwas benzoesowy, który w niewielkim stopniu podrażnia skórę, oczy i błony śluzowe oraz glikol propylenowy, który może powodować podrażnienia skóry. Należy pouczyć pacjenta, że produkt leczniczy należy stosować ostrożnie i unikać kontaktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu z oczami, ustami lub błonami śluzowymi, należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji kremu Skinoren należy umyć ręce. Po wprowadzeniu Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem Skinoren.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3 Dane przedkliniczne). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo . W badaniu dializy równowagi in vitro wykazano jednak, że może zachodzić przenikanie do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych)
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Klasyfikacja układówi narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologiczneg o Nadwrażliwość,pogorszenie objawówastmy(patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik,odbarwienie skóry Zapalenie warg Zaburzenia ogólne i stany w miejscu podania Świąd, pieczenie, rumieńw miejscu podania Łuszczenie skóry, ból, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzękw miejscu podania Pęcherze, egzema, uczucie ciepła, owrzodzenie w miejscu podania - CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja kremu Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dzieci i dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Ul. Ząbkowska 41 03-736 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: adr@urpl.gov.pl
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu z oczami. Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy Makrogologlicerydów stearyniany Mieszanina mono-, di- i triglicerydów wyższych kwasów tłuszczowych Cetearylu oktanonian Glikol propylenowy Glicerol 85% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 200 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego ( Acne vulgaris ) i przebarwień ( chloasma, melasma ).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8 ,,Działania niepożądane"), należy zmniejszyć ilość stosowanego produktu Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem Skinoren u dzieci poniżej 12 lat.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Krem Skinoren jest przeznaczony tylko do stosowania miejscowego. Skinoren zawiera substancje pomocnicze: kwas benzoesowy, który w niewielkim stopniu podrażnia skórę, oczy i błony śluzowe oraz glikol propylenowy, który może powodować podrażnienia skóry. Należy pouczyć pacjenta, że produkt leczniczy należy stosować ostrożnie i unikać kontaktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu z oczami, ustami lub błonami śluzowymi, należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji kremu Skinoren należy umyć ręce. Po wprowadzeniu Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem Skinoren.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3 Dane przedkliniczne). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo . W badaniu dializy równowagi in vitro wykazano jednak, że może zachodzić przenikanie do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych)
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Klasyfikacja układówi narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologiczneg o Nadwrażliwość,pogorszenie objawówastmy(patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik,odbarwienie skóry Zapalenie warg Zaburzenia ogólne i stany w miejscu podania Świąd, pieczenie, rumieńw miejscu podania Łuszczenie skóry, ból, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzękw miejscu podania Pęcherze, egzema, uczucie ciepła, owrzodzenie w miejscu podania - CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja kremu Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dzieci i dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Ul. Ząbkowska 41 03-736 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: adr@urpl.gov.pl
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu z oczami. Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy Makrogologlicerydów stearyniany Mieszanina mono-, di- i triglicerydów wyższych kwasów tłuszczowych Cetearylu oktanonian Glikol propylenowy Glicerol 85% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 200 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego ( Acne vulgaris ) i przebarwień ( chloasma, melasma ).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8 ,,Działania niepożądane"), należy zmniejszyć ilość stosowanego produktu Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem Skinoren u dzieci poniżej 12 lat.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Krem Skinoren jest przeznaczony tylko do stosowania miejscowego. Skinoren zawiera substancje pomocnicze: kwas benzoesowy, który w niewielkim stopniu podrażnia skórę, oczy i błony śluzowe oraz glikol propylenowy, który może powodować podrażnienia skóry. Należy pouczyć pacjenta, że produkt leczniczy należy stosować ostrożnie i unikać kontaktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu z oczami, ustami lub błonami śluzowymi, należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji kremu Skinoren należy umyć ręce. Po wprowadzeniu Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem Skinoren.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3 Dane przedkliniczne). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo . W badaniu dializy równowagi in vitro wykazano jednak, że może zachodzić przenikanie do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych)
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Klasyfikacja układówi narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologiczneg o Nadwrażliwość,pogorszenie objawówastmy(patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik,odbarwienie skóry Zapalenie warg Zaburzenia ogólne i stany w miejscu podania Świąd, pieczenie, rumieńw miejscu podania Łuszczenie skóry, ból, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzękw miejscu podania Pęcherze, egzema, uczucie ciepła, owrzodzenie w miejscu podania - CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja kremu Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dzieci i dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Ul. Ząbkowska 41 03-736 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: adr@urpl.gov.pl
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu z oczami. Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy Makrogologlicerydów stearyniany Mieszanina mono-, di- i triglicerydów wyższych kwasów tłuszczowych Cetearylu oktanonian Glikol propylenowy Glicerol 85% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 200 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego ( Acne vulgaris ) i przebarwień ( chloasma, melasma ).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8 ,,Działania niepożądane"), należy zmniejszyć ilość stosowanego produktu Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem Skinoren u dzieci poniżej 12 lat.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Krem Skinoren jest przeznaczony tylko do stosowania miejscowego. Skinoren zawiera substancje pomocnicze: kwas benzoesowy, który w niewielkim stopniu podrażnia skórę, oczy i błony śluzowe oraz glikol propylenowy, który może powodować podrażnienia skóry. Należy pouczyć pacjenta, że produkt leczniczy należy stosować ostrożnie i unikać kontaktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu z oczami, ustami lub błonami śluzowymi, należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji kremu Skinoren należy umyć ręce. Po wprowadzeniu Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem Skinoren.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3 Dane przedkliniczne). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo . W badaniu dializy równowagi in vitro wykazano jednak, że może zachodzić przenikanie do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych)
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Klasyfikacja układówi narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologiczneg o Nadwrażliwość,pogorszenie objawówastmy(patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik,odbarwienie skóry Zapalenie warg Zaburzenia ogólne i stany w miejscu podania Świąd, pieczenie, rumieńw miejscu podania Łuszczenie skóry, ból, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzękw miejscu podania Pęcherze, egzema, uczucie ciepła, owrzodzenie w miejscu podania - CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja kremu Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dzieci i dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Ul. Ząbkowska 41 03-736 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: adr@urpl.gov.pl
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu z oczami. Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy Makrogologlicerydów stearyniany Mieszanina mono-, di- i triglicerydów wyższych kwasów tłuszczowych Cetearylu oktanonian Glikol propylenowy Glicerol 85% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Skinoren, krem, 200 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Skinoren 200 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego ( Acidum azelaicum ). Substancje pomocnicze o znanym działaniu: kwas benzoesowy i glikol propylenowy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krem Biały, nieprzezroczysty krem
- CHPL leku Skinoren, krem, 200 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie trądziku pospolitego ( Acne vulgaris ) i przebarwień ( chloasma, melasma ).
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Skinoren krem należy stosować wyłącznie na skórę. Dawkowanie Cienką warstwę kremu Skinoren nanosić na chorobowo zmienione miejsca na skórze dwa razy na dobę – rano i wieczorem. Krem należy delikatnie wetrzeć. Wyciśnięty z tuby pasek kremu o długości około 2,5 cm (około 0,5 g) całkowicie wystarcza na skórę twarzy. Po nałożeniu kremu należy umyć ręce. Sposób podawania Przed zastosowaniem kremu Skinoren należy dokładnie umyć skórę zwykłą wodą i osuszyć. Można również użyć łagodnego preparatu przeznaczonego do oczyszczania skóry. Bardzo istotne jest regularne stosowanie kremu Skinoren przez cały okres leczenia. Czas leczenia produktem leczniczym Skinoren jest różny u poszczególnych pacjentów i zależy od nasilenia zmian chorobowych skóry. W leczeniu trądziku pospolitego wyraźną poprawę uzyskuje się po około 4 tygodniach systematycznego stosowania produktu.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Aby uzyskać optymalny wynik leczenia, należy regularnie stosować produkt przez kilka miesięcy - nawet do 12 miesięcy. W leczeniu przebarwień zaleca się stosowanie produktu Skinoren co najmniej przez 3 miesiące. Najlepsze wyniki osiąga się stosując produkt systematycznie. Ponieważ promieniowanie słoneczne zaostrza zmiany chorobowe i (lub) powoduje ponowną pigmentację skóry, podczas całego okresu leczenia należy jednocześnie stosować kremy z filtrem UV B i UV A. W przypadku znacznego podrażnienia skóry (patrz punkt 4.8 ,,Działania niepożądane"), należy zmniejszyć ilość stosowanego produktu Skinoren lub stosować go raz na dobę, do czasu ustąpienia objawów podrażnienia. Jeżeli to konieczne, należy przerwać leczenie na kilka dni. Dzieci i młodzież Produkt stosować u młodzieży (w wieku od 12 do 18 lat). Dostosowanie dawki produktu Skinoren u młodzieży w wieku od 12 do 18 lat nie jest konieczne.
- CHPL leku Skinoren, krem, 200 mg/gDawkowanie
Brak danych dotyczących bezpieczeństwa stosowania i skuteczności leczenia produktem Skinoren u dzieci poniżej 12 lat.
- CHPL leku Skinoren, krem, 200 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Krem Skinoren jest przeznaczony tylko do stosowania miejscowego. Skinoren zawiera substancje pomocnicze: kwas benzoesowy, który w niewielkim stopniu podrażnia skórę, oczy i błony śluzowe oraz glikol propylenowy, który może powodować podrażnienia skóry. Należy pouczyć pacjenta, że produkt leczniczy należy stosować ostrożnie i unikać kontaktu z oczami, ustami i błonami śluzowymi (patrz punkt 5.3). W przypadku kontaktu z oczami, ustami lub błonami śluzowymi, należy je natychmiast przepłukać dużą ilością wody. W przypadku utrzymującego się podrażnienia oczu pacjent powinien skontaktować się z lekarzem. Po każdej aplikacji kremu Skinoren należy umyć ręce. Po wprowadzeniu Skinoren krem do obrotu rzadko zgłaszano zaostrzenie astmy u pacjentów leczonych kwasem azelainowym.
- CHPL leku Skinoren, krem, 200 mg/gSpecjalne środki ostrozności
Typ naskórkowy przebarwień i typ mieszany naskórkowo-skórny łatwo poddają się leczeniu, natomiast postać skórna przebarwień jest oporna na leczenie produktem Skinoren.
- CHPL leku Skinoren, krem, 200 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak odpowiednich i dobrze kontrolowanych badań z miejscowo stosowanym kwasem azelainowym u kobiet w ciąży. Badania na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu kwasu azelainowego na przebieg ciąży, rozwój zarodka lub płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3 Dane przedkliniczne). Należy zachować ostrożność w przypadku przepisywania kwasu azelainowego kobietom w ciąży. Karmienie piersią Nie wiadomo, czy kwas azelainowy przenika do mleka in vivo . W badaniu dializy równowagi in vitro wykazano jednak, że może zachodzić przenikanie do mleka. Przenikanie kwasu azelainowego do mleka nie powinno spowodować istotnych zmian wartości wyjściowych stężenia kwasu azelainowego w mleku, ponieważ kwas azelainowy nie występuje w mleku w dużym stężeniu, a po zastosowaniu miejscowym wchłania się do organizmu mniej niż 4% nie powodując zwiększenia ekspozycji na kwas azelainowy powyżej poziomu fizjologicznego.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na płodność, ciążę i laktację
Jednakże należy zachować ostrożność przepisując Skinoren krem kobietom karmiącym piersią.
- CHPL leku Skinoren, krem, 200 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Skinoren krem nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych najczęściej obserwowane działania niepożądane w miejscu podania to świąd, pieczenie, rumień. Częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych oraz po wprowadzeniu produktu leczniczego do obrotu, wymienionych w poniższej tabeli przedstawiono zgodnie z konwencją MedDRA. Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10) Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (<1/10 000) Nieznana (częstość nie może być określona na podstawie dostępnych danych)
- CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Klasyfikacja układówi narządów Bardzo często Często Niezbyt często Rzadko Zaburzenia układu immunologiczneg o Nadwrażliwość,pogorszenie objawówastmy(patrz punkt 4.4) Zaburzenia skóry i tkanki podskórnej Zapalenie łojotokowe skóry, trądzik,odbarwienie skóry Zapalenie warg Zaburzenia ogólne i stany w miejscu podania Świąd, pieczenie, rumieńw miejscu podania Łuszczenie skóry, ból, suchość, odbarwienie, podrażnienie w miejscu podania Parestezje, zapalenie skóry, uczucie dyskomfortu, obrzękw miejscu podania Pęcherze, egzema, uczucie ciepła, owrzodzenie w miejscu podania - CHPL leku Skinoren, krem, 200 mg/gDziałania niepożądane
Zazwyczaj, miejscowe podrażnienie skóry ustępuje w trakcie leczenia. Dzieci i młodzież Tolerancja kremu Skinoren u młodzieży w wieku od 12 do 18 lat włączonej w badania kliniczne (454/1336; 34%) była podobna do występującej u dzieci i dorosłych pacjentów. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Ul. Ząbkowska 41 03-736 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: adr@urpl.gov.pl
- CHPL leku Skinoren, krem, 200 mg/gPrzedawkowanie
4.9 Przedawkowanie Wyniki badań ostrej toksyczności wskazują, że po pojedynczym nałożeniu na skórę (zastosowanie na dużej powierzchni w warunkach korzystnych do wchłaniania) lub przypadkowym spożyciu nie ma ryzyka ostrego zatrucia.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego kod ATC: D 10 AX 03 Skuteczność kwasu azelainowego w leczeniu trądziku pospolitego wynika z jego przeciwbakteryjnego działania i bezpośredniego wpływu na hamowanie nadmiernego rogowacenia naskórka. Kwas azelainowy znacznie hamuje rozwój bakterii Propionibacterium acnes i zmniejsza frakcję wolnych kwasów tłuszczowych na powierzchni skóry. W badaniach in vitro oraz in vivo wykazano, że kwas azelainowy hamuje rozrost keratynocytów i normalizuje ich końcowe różnicowanie. Doświadczenia prowadzone na uchu królika udowodniły, że kwas azelainowy przyspiesza zmniejszanie liczby zaskórników indukowanych tetradekanem. Wyniki badań wskazują, że kwas azelainowy hamuje również wzrost i nadmierną aktywność nieprawidłowych melanocytów. Działanie to jest zależne zarówno od dawki, jak i czasu działania kwasu azelainowego.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakodynamiczne
Mechanizm cząsteczkowy tego procesu nie jest do końca wyjaśniony, ale skuteczność kwasu azelainowego w leczeniu przebarwień wiąże się z jego hamującym wpływem na syntezę DNA i (lub) na oddychanie komórkowe nieprawidłowych melanocytów.
- CHPL leku Skinoren, krem, 200 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu produktu, kwas azelainowy penetruje do wszystkich warstw skóry. Wchłanianie następuje szybciej przez skórę uszkodzoną niż przez nieuszkodzoną. Po jednorazowym, miejscowym nałożeniu 1 g kwasu azelainowego (co odpowiada 5 g kremu) wchłania się około 3,6% zastosowanej dawki. Część kwasu azelainowego wchłoniętego przez skórę wydala się z moczem w postaci niezmienionej. Pozostała ilość kwasu ulega β-oksydacji do kwasów dwukarboksylowych o krótszym łańcuchu węglowym (C7, C5), które są również wydalane z moczem.
- CHPL leku Skinoren, krem, 200 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Nie przeprowadzono badań oceniających nowotworowe działanie kwasu azelainowego. Należy unikać kontaktu produktu z oczami. Badania tolerancji miejscowej wykazały, że lek powodował umiarkowane lub silne podrażnienie oczu u królików i małp.
- CHPL leku Skinoren, krem, 200 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas benzoesowy Makrogologlicerydów stearyniany Mieszanina mono-, di- i triglicerydów wyższych kwasów tłuszczowych Cetearylu oktanonian Glikol propylenowy Glicerol 85% Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30°C. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuby aluminiowe z zakrętką z HDPE w tekturowym pudełku. 30 g kremu 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez szczególnych wymagań.
- CHPL leku Differin, Żel, 1 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Differin, 1 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 1 mg adapalenu (Adapalenum). Substancje pomocnicze o znanym działaniu: glikol propylenowy i metylu parahydroksybenzoesan. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel
- CHPL leku Differin, Żel, 1 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Trądzik pospolity (acne vulgaris) – łagodny lub średnio nasilony: trądzik zaskórnikowy (acne comedonica), trądzik grudkowo-krostkowy (acne papulo–pustulosa).
- CHPL leku Differin, Żel, 1 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Leczenie rozpoczyna się od nakładania małych ilości żelu na skórę, z wyjątkiem okolic oczu i ust oraz fałdów nosowo-policzkowych, 10 – 15 minut po umyciu i osuszeniu skóry ręcznikiem. Po nałożeniu żelu należy dokładnie umyć ręce. Jeżeli po trzech miesiącach nie nastąpi wyleczenie, lekarz powinien podjąć decyzję o dalszym stosowaniu produktu. Dzieci i młodzież Produktu leczniczego Differin żel nie należy stosować u dzieci w wieku poniżej 12 lat. Sposób podawania Differin żel należy stosować raz na dobę, najlepiej wieczorem, na miejsca objęte trądzikiem.
- CHPL leku Differin, Żel, 1 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Ciąża (patrz punkt 4.6) Kobiety planujące zajście w ciążę Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować: w nadwrażliwości na adapalen lub którykolwiek ze składników produktu leczniczego; w przypadku ciężkiego trądziku pospolitego lub trądziku obejmującego dużą powierzchnię skóry; na skórę uszkodzoną, opaloną lub z wypryskiem innym niż trądzikowy;
- CHPL leku Differin, Żel, 1 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Żel Differin przeznaczony jest wyłącznie do stosowania na skórę. Należy chronić usta, oczy i błony śluzowe przed kontaktem z preparatem. W razie przypadkowego kontaktu z ustami, oczami lub błonami śluzowymi, należy przemyć je dużą ilością wody. W krótkim czasie po rozpoczęciu leczenia może pojawić się zaczerwienienie, podrażnienie i wysuszenie twarzy. W takich przypadkach należy przerwać leczenie na kilka dni, aż do ustąpienia objawów. Podczas stosowania produktu leczniczego, na skutek zmniejszenia warstwy rogowej naskórka, skóra staje się bardziej wrażliwa na działanie promieniowania ultrafioletowego i stosowanych miejscowo leków lub kosmetyków. Z uwagi na to, podczas leczenia żelem Differin należy unikać nadmiernej ekspozycji na promieniowanie UV i światło słoneczne (stosując np.
- CHPL leku Differin, Żel, 1 mg/gSpecjalne środki ostrozności
nakrycie głowy i filtry ochronne) i nie należy stosować kosmetyków zalecanych do pielęgnacji skóry trądzikowej lub o działaniu ściągającym. Ze względu na zawartość substancji pomocniczych – glikolu propylenowego i parahydroksybenzoesanu metylu, produkt leczniczy może powodować reakcje alergiczne (możliwe reakcje typu późnego). Dzieci i młodzież Produktu leczniczego Differin żel nie należy stosować u dzieci w wieku poniżej 12 lat.
- CHPL leku Differin, Żel, 1 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Produktu leczniczego Differin żel nie należy stosować jednocześnie z lekami o podobnym mechanizmie działania i z innymi lekami stosowanymi na skórę zawierającymi retynoidy. Nie należy stosować na skórę innych preparatów, które mogą działać drażniąco (np. preparaty złuszczające, ściągające, ścierająco-czyszczące, alkohole). W razie równoczesnego stosowania innych leków przeciwtrądzikowych (erytromycyny 4%, fosforanu klindamycyny 1%, nadtlenku benzoilu 10%) należy stosować je rano, a żel Differin wieczorem.
- CHPL leku Differin, Żel, 1 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Retynoidy stosowane doustnie mają związek z występowaniem wad wrodzonych. Retynoidy do stosowania miejscowego, jeśli są stosowane zgodnie z zaleceniami, ogólnie są uznawane za wywołujące małą ekspozycję układową, ze względu na minimalne wchłanianie przezskórne. Mogą jednak wystąpić indywidualne okoliczności (jak np. uszkodzona skóra, przedawkowanie), które przyczynią się do zwiększonej ekspozycji ogólnoustrojowej. Ciąża Differin krem jest przeciwwskazany (patrz punkt 4.3) do stosowania u kobiet w ciąży oraz u kobiet planujących zajście w ciążę. Badania na zwierzętach wykazały toksyczne działanie adapalenu w przypadku podawania dużych dawek doustnie (patrz pkt. 5.3). Badania kliniczne dotyczące miejscowo stosowanego adapalenu u kobiet w ciąży są ograniczone. Jeśli produkt jest stosowany w trakcie ciąży, lub gdy pacjentka zajdzie w ciążę w trakcie przyjmowania leku, leczenie musi zostać przerwane. Karmienie piersi?
- CHPL leku Differin, Żel, 1 mg/gWpływ na płodność, ciążę i laktację
Nie przeprowadzono badań dotyczących przenikania adapalenu do mleka zwierząt lub ludzi podczas miejscowego stosowania produktu Differin. Nie oczekuje się wpływu adapalenu na dziecko karmione piersią, ponieważ po zastosowaniu miejscowym ekspozycja na lek kobiety karmiącej piersią jest pomijalna. Differin można stosować u kobiet karmiących piersią. Aby uniknąć kontaktu dziecka z produktem leczniczym, nie należy nakładać żelu, Differin na klatkę piersiową u kobiet karmiących piersią.
- CHPL leku Differin, Żel, 1 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Differin nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Differin, Żel, 1 mg/gDziałania niepożądane
4.8 Działania niepożądane Differin może powodować następujące działania niepożądane: Układy i narządy (MedDRA) Często (≥1/100 to <1/10): Sucha skóra, podrażnienie skóry, uczucie pieczenia skóry, rumień Niezbyt często (≥1/1000 to <1/100): Kontaktowe zapalenie skóry, wyprysk z podrażnienia, uczucie dyskomfortu skóry, oparzenie słoneczne, świąd, łuszczenie się skóry, trądzik Nieznana: Ból skóry, obrzęk skóry, alergiczne kontaktowe zapalenie skóry, oparzenie w miejscu aplikacji, hipopigmentacja skóry, hiperpigmentacja skóry Zaburzenia oka Nieznana: Podrażnienie powiek, rumień powiek, świąd powiek, obrzęk powiek Zaburzenia układu immunologicznego Nieznana: Reakcja anafilaktyczna, obrzęk naczynioruchowy *dane uzyskane po wprowadzeniu do obrotu ** Większość przypadków oparzeń w miejscu aplikacji była powierzchowna, jednak notowano przypadki oparzeń drugiego stopnia.
- CHPL leku Differin, Żel, 1 mg/gDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa Tel.: +48 22 49 21 301 Faks: +48 22 49 21 309 e-mail: ndl@urpl.gov.pl Działania niepożądane można zgłaszać także podmiotowi odpowiedzialnemu.
- CHPL leku Differin, Żel, 1 mg/gPrzedawkowanie
4.9 Przedawkowanie Stosowanie produktu w nadmiarze nie przyspiesza i nie polepsza wyniku leczenia, zaś może być przyczyną znacznego zaczerwienienia, złuszczania lub innych objawów podrażnienia skóry. Żel Differin wywołuje objawy toksyczne u myszy i szczurów po doustnym podaniu dawek większych niż 10 g/kg mc. Po przypadkowym, omyłkowym połknięciu produktu należy rozważyć płukanie żołądka.
- CHPL leku Differin, Żel, 1 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego; kod ATC: D 10 AD 03 Mechanizm działania: Adapalen - substancja czynna produktu leczniczego Differin żel jest pochodną kwasu naftalenokarboksylowego. Nie reaguje z tlenem i nie rozkłada się pod wpływem światła. Adapalen działa podobnie do retynoidów. Po przedostaniu się do wnętrza komórki łączy się z receptorami jądrowymi kwasu retynowego (ang. RAR – retinoic acid receptor), powodując zmianę ekspresji genów i syntezę nowego mRNA. W przeciwieństwie do retynoidów, nie wiąże się z receptorami cytoplazmatycznymi. Adapalen stosowany miejscowo wpływa na normalizację procesów keratynizacji i różnicowania naskórka. Prawdopodobnie normalizuje różnicowanie nabłonka komórkowego mieszków włosowych, w wyniku czego zmniejsza powstawanie zaskórników. Adapalen działa silniej przeciwzapalnie niż retynoidy.
- CHPL leku Differin, Żel, 1 mg/gWłaściwości farmakodynamiczne
Hamuje reakcję chemotaktyczną i chemokinetyczną leukocytów wielojądrzastych oraz peroksydację kwasu arachidonowego, ograniczając powstawanie odpowiednich mediatorów komórkowych odczynu zapalnego. W wyniku tego adapalen stosowany na skórę zapobiega powstawaniu zaskórników (otwartych i zamkniętych) oraz zmniejsza zmiany zapalne (grudki i krosty).
- CHPL leku Differin, Żel, 1 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po miejscowym zastosowaniu adapalen nie wchłania się przez skórę w istotnych ilościach. Nawet podczas stosowania produktu leczniczego przez kilka tygodni na duże powierzchnie ciała, nie stwierdzono obecności adapalenu w surowicy krwi pacjentów.
- CHPL leku Differin, Żel, 1 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W doświadczeniach na zwierzętach wykazano, że adapalen jest dobrze tolerowany po stosowaniu miejscowym w trwających 6 miesięcy badaniach na królikach i 2 lata na myszach. Główne objawy toksyczności po podaniu doustnym w przypadku wszystkich badanych gatunków to hiperwitaminoza A, zanik kości, zwiększona aktywność fosfatazy alkalicznej oraz niewielka niedokrwistość. Duże dawki adapalenu podawane zwierzętom p.o. wywołują łagodne objawy neurologiczne, kardiologiczne i związane z układem oddechowym. Adapalen nie działa mutagennie. Wykonano badania adapalenu na myszach po podaniu przezskórnym w dawkach 0,6 mg/kg mc./dobę, 2 i 6 mg/kg mc./dobę oraz na szczurach w dawkach doustnych 0,15 mg/kg mc./dobę, 0,5 mg/kg mc./dobę i 1,5 mg/kg mc./dobę. Wykazano statystycznie znamienny wzrost występowaniu raka chromochłonnego rdzenia nadnerczy tylko u samców szczurów po podawaniu 1,5 mg/kg mc./dobę p.o.. Nie dotyczy to przezskórnego podawania adapalenu.
- CHPL leku Differin, Żel, 1 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Glikol propylenowy Metylu parahydroksybenzoesan Fenoksyetanol Karbomer 940 Disodu edetynian Poloksamer 182 Sodu wodorotlenek Woda oczyszczona 6. Niezgodności farmaceutyczne Nie stwierdzono. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Brak szczególnych środków ostrożności dotyczących temperatury przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Tuba LDPE, zamknięta polipropylenową nakrętką w tekturowym pudełku. 1 tuba 15 g 1 tuba 30 g 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak szczególnych wymagań.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Epiduo 0,1% + 2,5% żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 g żelu zawiera: 1 mg (0.1% w/w) adapalenu (Adapalenum) Benzoilu nadtlenek uwodniony w ilości odpowiadającej 25 mg (2.5% w/w) benzoilu nadtlenku, bezwodnego (Benzoylis peroxidum) Substancja pomocnicza o znanym działaniu: glikol propylenowy (E1520) 40 mg/g (4.0%). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel. Biały lub lekko żółty, nieprzejrzysty żel.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Wskazania do stosowania
4.1. Wskazania do stosowania Miejscowe leczenie trądziku pospolitego z zaskórnikami, grudkami i krostkami (patrz punkt 5.1). Epiduo jest wskazany do stosowania u dorosłych, młodzieży oraz dzieci w wieku 9 lat i starszych.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Dawkowanie
4.2. Dawkowanie i sposób podawania Produkt leczniczy Epiduo należy nanosić na cały obszar skóry zajęty przez trądzik raz na dobę wieczorem, na czystą i suchą skórę. Opuszkami palców należy nanosić cienką warstwę żelu, omijając okolicę oczu i ust (patrz punkt 4.4). Jeśli wystąpi podrażnienie, należy zalecić pacjentowi zastosowanie kremów nawilżających, które nie wpływają na tworzenie się zaskórników, rzadsze stosowanie produktu leczniczego (np. co drugi dzień), czasowe lub całkowite zaprzestanie stosowania produktu leczniczego. Czas trwania leczenia powinien być określony przez lekarza na podstawie stanu klinicznego pacjenta. Pierwsze objawy poprawy stanu klinicznego pojawiają się zazwyczaj między 1 a 4 tygodniem leczenia. Nie badano bezpieczeństwa i skuteczności produktu leczniczego Epiduo u dzieci w wieku poniżej 9 lat.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Przeciwwskazania
4.3. Przeciwwskazania Ciąża (patrz punkt 4.6) Kobiety planujące zajście w ciążę (patrz punkt 4.6) Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Specjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produktu leczniczego Epiduo nie należy nanosić na uszkodzoną lub popękaną skórę (rozcięcia lub otarcia) oraz na skórę z egzemą lub opaloną. Należy unikać kontaktu produktu leczniczego Epiduo z oczami, ustami, nozdrzami i błonami śluzowymi. W razie dostania się produktu leczniczego do oka, należy przepłukać je natychmiast ciepłą wodą. Produkt leczniczy zawiera 40 mg glikolu propylenowego (E1520) w każdym gramie co odpowiada 4% w/w. W razie pojawienia się uczulenia na którykolwiek składnik produktu leczniczego Epiduo należy przerwać jego stosowanie. Unikać nadmiernego narażenia na promieniowanie słoneczne i promieniowanie UV. Należy unikać kontaktu produktu leczniczego Epiduo z jakimkolwiek farbowanym materiałem, np. tkaninami lub włosami, ponieważ może to spowodować odbarwienie lub zmianę koloru.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Interakcje
4.5. Interakcje z innymi lekami i inne rodzaje interakcji Nie przeprowadzono żadnych badań dotyczących interakcji. Na podstawie wcześniejszych doświadczeń z adapalenem i nadtlenkiem benzoilu można stwierdzić, że nie ma znanych interakcji z innymi produktami leczniczymi, które mogłyby być stosowane na skórę jednocześnie z produktem Epiduo. Nie należy stosować jednocześnie produktu Epiduo z innymi retynoidami, nadtlenkiem benzoilu lub lekami o podobnym mechanizmie działania. Ostrożnie stosować kosmetyki złuszczające, podrażniające i wysuszające, ponieważ mogą one nasilać działanie podrażniające podczas jednoczesnego stosowania z produktem Epiduo. Wchłanianie adapalenu przez skórę ludzką jest niewielkie (patrz punkt 5.2), dlatego też wystąpienie interakcji z produktami leczniczymi o działaniu ogólnoustrojowym jest mało prawdopodobne. Przenikanie benzoilu nadtlenku przez skórę jest niewielkie, jest on całkowicie metabolizowany do kwasu benzoesowego, który jest szybko eliminowany.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Interakcje
Dlatego też potencjalne interakcje kwasu benzoesowego z produktami leczniczymi o działaniu ogólnoustrojowym są mało prawdopodobne.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Wpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Retynoidy stosowane doustnie mają związek z występowaniem wad wrodzonych. Retynoidy do stosowania miejscowego, jeśli są stosowane zgodnie z zaleceniami, ogólnie są uznawane za wywołujące małą ekspozycję układową, ze względu na minimalne wchłanianie przezskórne. Mogą jednak wystąpić indywidualne okoliczności (jak np. uszkodzona skóra, przedawkowanie), które przyczynią się do zwiększonej ekspozycji ogólnoustrojowej. Ciąża: Epiduo jest przeciwwskazany (patrz punkt 4.3) do stosowania u kobiet w ciąży oraz u kobiet planujących zajście w ciążę. Brak danych lub istnieją ograniczone dane dotyczące stosowania adapalenu miejscowo u kobiet w ciąży. Badania na zwierzętach, w których podawano adapalen doustnie, wykazały działanie toksyczne na reprodukcję w przypadku stosowania dużych dawek o działaniu ogólnoustrojowym (patrz punkt 5.3). Doświadczenia kliniczne ze stosowanym miejscowo adapalenem i nadtlenkiem benzoilu u kobiet w ciąży są ograniczone.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Wpływ na płodność, ciążę i laktację
Jeśli produkt jest stosowany w trakcie ciąży, lub gdy pacjentka zajdzie w ciążę w trakcie przyjmowania leku, leczenie musi zostać przerwane. Karmienie piersią: Nie przeprowadzono badań dotyczących przenikania produktu leczniczego Epiduo (adapalen/nadtlenek benzoilu) do mleka zwierząt oraz ludzi po naniesieniu na skórę. Nie przewiduje się wpływu produktu leczniczego na dziecko karmione piersią, ponieważ ogólnoustrojowy wpływ produktu leczniczego Epiduo na kobietę karmiącą piersią jest znikomy. Produkt leczniczy Epiduo można stosować w okresie karmienia piersią. W okresie karmienia piersią, aby uniknąć narażenia dziecka na kontakt z produktem Epiduo, nie należy go nanosić na klatkę piersiową. Płodność: Nie przeprowadzono badań dotyczących wpływu na płodność u ludzi z żelem Epiduo. Nie stwierdzono jednak wpływu adapalenu lub nadtlenku benzoilu na płodność u szczurów w badaniach reprodukcyjnych (patrz punkt 5.3).
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Wpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie dotyczy.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Działania niepożądane
4.8. Działania niepożądane Epiduo może powodować wymienione poniżej działania niepożądane w miejscu naniesienia: Klasyfikacja układów i narządów wg MedDRA Częstość występowania działania niepożądanego Działanie niepożądane Zaburzenia oka: Nieznana (częstość nie może być określona na podstawie dostępnych danych)* Obrzęk powiek Zaburzenia układu immunologicznego: Nieznana (częstość nie może być określona na podstawie dostępnych danych)* Reakcja anafilaktyczna Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Nieznana (częstość nie może być określona na podstawie dostępnych danych)* Uczucie ucisku w gardle, duszność Zaburzenia skóry i tkanki podskórnej: Często (≥1/100 do <1/10) Suchość skóry, zapalenie kontaktowe skóry z podrażnienia, uczucie pieczenia, podrażnienie skóry, rumień, złuszczanie się skóry (łuszczenie) Niezbyt często (≥1/1000 do 1/100) Świąd skóry, oparzenia słoneczne Nieznana (częstość nie może być określona na podstawie dostępnych danych)* Alergiczne kontaktowe zapalenie skóry, swędzenie twarzy, ból skóry (piekący ból), pęcherzyki na skórze, przebarwienie skóry (nadmierne zabarwienie lub odbarwienie), pokrzywka, oparzenie w miejscu aplikacji** *Dane postmarketingowe **W większości przypadków „oparzenie w miejscu aplikacji” było powierzchowne, jednak notowano przypadki oparzenia drugiego stopnia lub ciężkiego oparzenia.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Działania niepożądane
Jeśli po naniesieniu produktu leczniczego Epiduo pojawia się podrażnienie skóry (zaczerwienienie, sucha, łuszczenie się lub pieczenie skóry oraz ból skóry (kłujący ból)), to jego intensywność jest niewielka lub średnia, a objawy tolerancji miejscowej osiągają najwyższe nasilenie w czasie pierwszego tygodnia stosowania, po czym ustępują samorzutnie.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Przedawkowanie
4.9. Przedawkowanie Epiduo przeznaczony jest wyłącznie do stosowania raz na dobę na skórę. W razie przypadkowego spożycia produktu leczniczego należy zastosować odpowiednie leczenie objawowe.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki przeciwtrądzikowe stosowane miejscowo. D10AD Retynoidy do stosowania miejscowego Kod ATC: D10AD53 Mechanizm działania i efekty farmakodynamiczne: Epiduo zawiera dwie substancje czynne, których mechanizmy działania są różne, ale wzajemnie dopełniające się. Adapalen: Adapalen jest stabilną chemicznie pochodną kwasu naftalenokarboksylowego o aktywności podobnej do retynoidów. Badania nad profilem biochemicznym i farmakologicznym adapalenu wykazały, że adapalen działa w patofizjologii trądziku pospolitego: jest on silnym modulatorem wpływającym na procesy różnicowania komórek naskórka i proces keratynizacji oraz wykazuje własności przeciwzapalne. Adapalen wiąże się ze swoistymi receptorami jądrowymi kwasu retynowego. Aktualne dane wskazują, że miejscowe stosowanie adapalenu doprowadza do prawidłowego różnicowania komórek nabłonka, co prowadzi do zmniejszenia ilości mikrozaskórników.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakodynamiczne
Adapalen hamuje chemotaktyczną (kierunkową) i chemokinetyczną (przypadkową) odpowiedź ludzkich leukocytów wielojądrzastych w modelach in vitro; hamuje również przemianę kwasu arachidonowego do mediatorów stanu zapalnego. Badania in vitro wykazały zahamowanie czynników AP-1 oraz ekspresji receptorów Toll-podobnych 2. Profil ten sugeruje, że adapalen osłabia komórkowy proces zapalny związany z trądzikiem. Benzoilu nadtlenek: Wykazano działanie przeciwbakteryjne nadtlenku benzoilu, szczególnie na bakterie Cutibacterium acnes, które występują w stanach patologicznych w mieszku łojowo-włosowym dotkniętym trądzikiem. Mechanizm działania benzoilu nadtlenku wyjaśniano jego dużą lipofilnością, która umożliwia jego przenikanie przez naskórek do błon komórkowych bakterii i keratynocytów w mieszku łojowo-włosowym. Benzoilu nadtlenek uważa się za bardzo skuteczny lek przeciwbakteryjny o szerokim spektrum w leczeniu trądziku pospolitego.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakodynamiczne
Wykazano, że wywiera działanie bakteriobójcze poprzez wytwarzanie wolnych rodników, które utleniają białka i inne niezbędne składniki komórkowe w ścianie bakterii. Minimalne stężenie hamujące benzoilu nadtlenku jest bakteriobójcze i wykazano jego działanie na antybiotykowrażliwe i antybiotykooporne szczepy C. acnes. Ponadto, wykazano, iż nadtlenek benzoilu ma działanie złuszczające i keratolityczne. Skuteczność kliniczna produktu leczniczego Epiduo u pacjentów w wieku 12 lat i starszych: Ocenę bezpieczeństwa i skuteczności produktu leczniczego Epiduo stosowanego raz na dobę w leczeniu trądziku pospolitego przeprowadzono w dwóch trwających 12 tygodni, wieloośrodkowych, kontrolowanych badaniach klinicznych, podobnie zaprojektowanych, porównujących działanie produktu leczniczego Epiduo z działaniem poszczególnych zawartych w nim substancji czynnych - adapalenu i nadtlenku benzoilu, oraz z działaniem podłoża żelu, u pacjentów z trądzikiem.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakodynamiczne
Do badania 1 i 2 włączono łącznie 2185 pacjentów. Rozkład statystyczny pacjentów przedstawiał się następująco: 49% mężczyzn oraz 51% kobiet, w wieku 12 lat lub więcej (średni wiek: 18,3 roku, w przedziale 12-50 lat), prezentujących od 20 do 50 wykwitów zapalnych oraz 30 do 100 wykwitów niezapalnych w momencie rozpoczęcia badania. Pacjenci stosowali produkt leczniczy na skórę twarzy i innych okolic ciała dotkniętych trądzikiem, w miarę potrzeb, raz na dobę wieczorem. Kryteria skuteczności były następujące: odsetek powodzeń, udział procentowy pacjentów zakwalifikowanych jako „wolny od trądziku” lub „prawie wolny od trądziku” w 12. tygodniu leczenia, na podstawie wskaźnika IGA (ang. - Investigator’s Global Assessment). zmiana w 12. tygodniu leczenia w odniesieniu do stanu wyjściowego (określona w procentach): liczby wykwitów zapalnych liczby wykwitów niezapalnych łącznej liczby wykwitów skórnych Wyniki skuteczności leczenia w każdym badaniu przedstawiono w Tabeli 1, natomiast skojarzone wyniki obu badań - w Tabeli 2.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakodynamiczne
W obu badaniach produkt leczniczy Epiduo okazał się bardziej skuteczny niż zawarte w nim substancje czynne oraz podłoże żelu. Łącznie, korzystne działanie netto (wynik działania substancji czynnych minus wynik działania podłoża) uzyskane po zastosowaniu produktu leczniczego Epiduo było większe niż suma korzystnych działań netto uzyskanych po zastosowaniu pojedynczych substancji czynnych zawartych w produkcie leczniczym, wskazując jednocześnie na nasilenie działania terapeutycznego tych substancji w przypadku zastosowania ich w preparacie złożonym w ustalonych dawkach. Wczesny wynik leczenia produktem Epiduo był konsekwentnie obserwowany w badaniu 1 i 2 w odniesieniu do wykwitów zapalnych w pierwszym tygodniu leczenia. Wykwity niezapalne (otwarte i zamknięte zaskórniki) wyraźnie reagowały na leczenie między pierwszym a czwartym tygodniem leczenia. Nie ustalono korzyści w odniesieniu do wykwitów guzkowych w trądziku. Tabela 1.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakodynamiczne
Skuteczność kliniczna w dwóch badaniach porównawczych Badanie 1 Badanie 1 Tydzień 12, dane z ostatniej obserwacji (LOCF); grupa objęta leczeniem (ITT) Adapalen+nadtlenek benzoilu N=149 Adapalen N=148 Nadtlenek benzoilu N=149 Podłoże żelu N=71 Liczba powodzeń (odsetek pacjentów „bez” lub „prawie bez” trądziku) 41 (27,5%) 23 (15,5%) p=0,008 23 (15,4%) p=0,003 7 (9,9%) p=0,002 Mediana redukcji (%) dotycząca: liczby wykwitów zapalnych 17 (62,8%) 13 (45,7%) p<0,001 liczby wykwitów niezapalnych 22 (51,2%) 17 (33,3%) p<0,001 łącznej liczby wykwitów 40 (51,0%) 29 (35,4%) p<0,001 Badanie 2 Badanie 2 Tydzień 12, dane z ostatniej obserwacji (LOCF); grupa objęta leczeniem (ITT) Adapalen+nadtlenek benzoilu N=415 Adapalen N=420 Nadtlenek benzoilu N=415 Podłoże N=418 Liczba powodzeń (odsetek pacjentów „bez” lub „prawie bez” trądziku) 125 (30,1%) 83 (19,8%) p<0,001 92 (22,2%) p=0,006 47 (11,3%) p<0,001 Mediana redukcji (%) dotycząca: liczby wykwitów zapalnych 16 (62,1%) 14 (50,0%) p<0,001 liczby wykwitów niezapalnych 24 (53,8%) 22 (49,1%) p=0,048 łącznej liczby wykwitów 45 (56,3%) 39 (46,9%) p=0,002 Tabela 2.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakodynamiczne
Skuteczność kliniczna w skojarzonych badaniach porównawczych Adapalen+nadtlenek benzoilu N=564 Adapalen N=568 Nadtlenek benzoilu N=564 Podłoże żelu N=489 Liczba powodzeń (odsetek pacjentów „bez” lub „prawie bez” trądziku) 166 (29,4%) 106 (18,7%) 115 (20,4%) 54 (11,1%) Mediana redukcji (%) dotycząca: liczby wykwitów zapalnych 16,0 (62,1) liczby wykwitów niezapalnych 23,5 (52,8) łącznej liczby wykwitów 41,0 (54,8) Skuteczność kliniczna produktu leczniczego Epiduo u dzieci w wieku od 9 do 11 lat: Podczas badania klinicznego z udziałem dzieci, 285 dzieci w wieku od 9 do 11 lat (53% pacjentów miało 11 lat, 33% miało 10 lat oraz 14% miało 9 lat), u których występował trądzik pospolity, którego ciężkość w skali IGA określono na poziomie 3 (umiarkowany) i ze zmianami (minimalnie 20, lecz nie więcej niż 100) zapalnymi i (lub) niezapalnymi na twarzy (w tym na nosie), leczono żelem Epiduo raz na dobę przez 12 tygodni.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakodynamiczne
Wyniki przeprowadzonego badania klinicznego, w którym badano skuteczność i bezpieczeństwo stosowania produktu Epiduo żel w leczeniu trądziku twarzy w specyficznej dziecięcej grupie wiekowej, są zgodne z wynikami innych wcześniejszych badań klinicznych przeprowadzonymi u pacjentów w wieku od 12 lat i starszych, oraz potwierdzają znaczną skuteczność oraz dopuszczalny poziom tolerancji. Trwałe, pierwsze efekty leczenia żelem Epiduo w porównaniu z leczeniem samym podłożem żelu, były obserwowane we wszystkich rodzajach zmian (zapalne, niezapalne, całkowita liczba) od pierwszego tygodnia do 12 tygodnia leczenia. 5.2. Właściwości farmakokinetyczne Właściwości farmakokinetyczne produktu leczniczego Epiduo są podobne do profilu farmakokinetycznego żelu zawierającego wyłącznie adapalen 0,1%. W 30-dniowym badaniu farmakokinetycznym pacjentów z trądzikiem, których leczono żelem o stałym składzie obu składników lub adapalenem 0,1% w warunkach maksymalnych (nanoszenie 2 g żelu na dobę), stężenie adapalenu było niemierzalne w większości próbek osocza (granica czułości 0,1 ng/ml).
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakodynamiczne
Niewielkie stężenie adapalenu (Cmax pomiędzy 0,1 a 0,2 ng/ml) odnotowano w dwóch próbkach krwi pobranych od osób leczonych żelem Epiduo i w trzech próbkach od osób leczonych adapalenem 0,1% w żelu. Najwyższe AUC 0-24h adapalenu w grupie pacjentów leczonych żelem ze stałym składem obu składników wyniosło 1,99 ng.h/ml. Wyniki te są porównywalne z wynikami uzyskanymi w poprzednich badaniach klinicznych obejmujących różne produkty lecznicze adapalenu 0,1%, gdzie ogólnoustrojowa ekspozycja na adapalen była zawsze mała. Przenikanie nadtlenku benzoilu przez skórę jest niewielkie; po nałożeniu na skórę substancja ta jest całkowicie metabolizowana do kwasu benzoesowego, który jest szybko eliminowany. 5.3. Przedkliniczne dane o bezpieczeństwie Dane przedkliniczne obejmujące konwencjonalne badania farmakologiczne, badanie toksyczności po podaniu dawki wielokrotnej, genotoksyczność, fototoksyczność i kancerogenność nie wykazują żadnych większych zagrożeń dla ludzi.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakodynamiczne
Przeprowadzono badania toksycznego działania adapalenu, podawanego doustnie i na skórę, na reprodukcję na szczurach i królikach. Wykazano działanie teratogenne przy wysokiej ekspozycji ogólnoustrojowej (dawki doustne od 25 mg/kg/dzień). W przypadku mniejszej ekspozycji na produkt leczniczy (podanie na skórę dawki 6mg/kg mc./dobę), obserwowane były zmiany liczby żeber lub kręgów. Badania żelu Epiduo przeprowadzone na zwierzętach nawet do 13 tygodni obejmowały badania tolerancji miejscowej oraz badania toksyczności dawki wielokrotnej u szczurów, psów i świń, wykazywały miejscowe podrażnienie i możliwość uczulenia. Jest to zgodne z oczekiwaniami dotyczących produktów leczniczych złożonych, zawierających nadtlenek benzoilu. Ekspozycja ogólnoustrojowa na adapalen po wielokrotnym nanoszeniu na skórę zwierząt produktu leczniczego złożonego zawierającego adapalen, jest bardzo mała, co jest zgodne z klinicznymi danymi farmakokinetycznymi.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakodynamiczne
W skórze nadtlenek benzoilu jest szybko i całkowicie metabolizowany do kwasu benzoesowego, który po wchłonięciu do organizmu jest wydalany z moczem. Ma to wpływ na zmniejszenie ekspozycji ogólnoustrojowej. Toksyczność reprodukcyjna adapalenu była badana po podaniu doustnym u szczurów pod kątem wpływu na płodność. Nie stwierdzono niekorzystnego wpływu na rozrodczość i płodność, przeżywalność miotu F1, wzrost i rozwój do odstawienia, a następnie wydajność reprodukcyjną po podaniu doustnym adapalenu w dawkach do 20 mg/kg/dobę. Badanie toksyczności reprodukcyjnej i rozwojowej przeprowadzone na szczurach z zastosowaniem dawek doustnych nadtlenku benzoilu w wysokości do 1000 mg/kg/dobę (5 ml/kg), wykazało, że nadtlenek benzoilu nie wywołał teratogenności ani wpływu na funkcje rozrodcze w dawkach do 500 mg/kg/dobę.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakokinetyczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki przeciwtrądzikowe stosowane miejscowo. D10AD Retynoidy do stosowania miejscowego Kod ATC: D10AD53 Mechanizm działania i efekty farmakodynamiczne: Epiduo zawiera dwie substancje czynne, których mechanizmy działania są różne, ale wzajemnie dopełniające się. Adapalen: Adapalen jest stabilną chemicznie pochodną kwasu naftalenokarboksylowego o aktywności podobnej do retynoidów. Badania nad profilem biochemicznym i farmakologicznym adapalenu wykazały, że adapalen działa w patofizjologii trądziku pospolitego: jest on silnym modulatorem wpływającym na procesy różnicowania komórek naskórka i proces keratynizacji oraz wykazuje własności przeciwzapalne. Adapalen wiąże się ze swoistymi receptorami jądrowymi kwasu retynowego. Aktualne dane wskazują, że miejscowe stosowanie adapalenu doprowadza do prawidłowego różnicowania komórek nabłonka, co prowadzi do zmniejszenia ilości mikrozaskórników.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakokinetyczne
Adapalen hamuje chemotaktyczną (kierunkową) i chemokinetyczną (przypadkową) odpowiedź ludzkich leukocytów wielojądrzastych w modelach in vitro; hamuje również przemianę kwasu arachidonowego do mediatorów stanu zapalnego. Badania in vitro wykazały zahamowanie czynników AP-1 oraz ekspresji receptorów Toll-podobnych 2. Profil ten sugeruje, że adapalen osłabia komórkowy proces zapalny związany z trądzikiem. Benzoilu nadtlenek: Wykazano działanie przeciwbakteryjne nadtlenku benzoilu, szczególnie na bakterie Cutibacterium acnes, które występują w stanach patologicznych w mieszku łojowo-włosowym dotkniętym trądzikiem. Mechanizm działania benzoilu nadtlenku wyjaśniano jego dużą lipofilnością, która umożliwia jego przenikanie przez naskórek do błon komórkowych bakterii i keratynocytów w mieszku łojowo-włosowym. Benzoilu nadtlenek uważa się za bardzo skuteczny lek przeciwbakteryjny o szerokim spektrum w leczeniu trądziku pospolitego.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakokinetyczne
Wykazano, że wywiera działanie bakteriobójcze poprzez wytwarzanie wolnych rodników, które utleniają białka i inne niezbędne składniki komórkowe w ścianie bakterii. Minimalne stężenie hamujące benzoilu nadtlenku jest bakteriobójcze i wykazano jego działanie na antybiotykowrażliwe i antybiotykooporne szczepy C. acnes. Ponadto, wykazano, iż nadtlenek benzoilu ma działanie złuszczające i keratolityczne. Skuteczność kliniczna produktu leczniczego Epiduo u pacjentów w wieku 12 lat i starszych: Ocenę bezpieczeństwa i skuteczności produktu leczniczego Epiduo stosowanego raz na dobę w leczeniu trądziku pospolitego przeprowadzono w dwóch trwających 12 tygodni, wieloośrodkowych, kontrolowanych badaniach klinicznych, podobnie zaprojektowanych, porównujących działanie produktu leczniczego Epiduo z działaniem poszczególnych zawartych w nim substancji czynnych - adapalenu i nadtlenku benzoilu, oraz z działaniem podłoża żelu, u pacjentów z trądzikiem.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakokinetyczne
Do badania 1 i 2 włączono łącznie 2185 pacjentów. Rozkład statystyczny pacjentów przedstawiał się następująco: 49% mężczyzn oraz 51% kobiet, w wieku 12 lat lub więcej (średni wiek: 18,3 roku, w przedziale 12-50 lat), prezentujących od 20 do 50 wykwitów zapalnych oraz 30 do 100 wykwitów niezapalnych w momencie rozpoczęcia badania. Pacjenci stosowali produkt leczniczy na skórę twarzy i innych okolic ciała dotkniętych trądzikiem, w miarę potrzeb, raz na dobę wieczorem. Kryteria skuteczności były następujące: odsetek powodzeń, udział procentowy pacjentów zakwalifikowanych jako „wolny od trądziku” lub „prawie wolny od trądziku” w 12. tygodniu leczenia, na podstawie wskaźnika IGA (ang. - Investigator’s Global Assessment). zmiana w 12. tygodniu leczenia w odniesieniu do stanu wyjściowego (określona w procentach): liczby wykwitów zapalnych liczby wykwitów niezapalnych łącznej liczby wykwitów skórnych Wyniki skuteczności leczenia w każdym badaniu przedstawiono w Tabeli 1, natomiast skojarzone wyniki obu badań - w Tabeli 2.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakokinetyczne
W obu badaniach produkt leczniczy Epiduo okazał się bardziej skuteczny niż zawarte w nim substancje czynne oraz podłoże żelu. Łącznie, korzystne działanie netto (wynik działania substancji czynnych minus wynik działania podłoża) uzyskane po zastosowaniu produktu leczniczego Epiduo było większe niż suma korzystnych działań netto uzyskanych po zastosowaniu pojedynczych substancji czynnych zawartych w produkcie leczniczym, wskazując jednocześnie na nasilenie działania terapeutycznego tych substancji w przypadku zastosowania ich w preparacie złożonym w ustalonych dawkach. Wczesny wynik leczenia produktem Epiduo był konsekwentnie obserwowany w badaniu 1 i 2 w odniesieniu do wykwitów zapalnych w pierwszym tygodniu leczenia. Wykwity niezapalne (otwarte i zamknięte zaskórniki) wyraźnie reagowały na leczenie między pierwszym a czwartym tygodniem leczenia. Nie ustalono korzyści w odniesieniu do wykwitów guzkowych w trądziku. Tabela 1.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakokinetyczne
Skuteczność kliniczna w dwóch badaniach porównawczych Badanie 1 Badanie 1 Tydzień 12, dane z ostatniej obserwacji (LOCF); grupa objęta leczeniem (ITT) Adapalen+nadtlenek benzoilu N=149 Adapalen N=148 Nadtlenek benzoilu N=149 Podłoże żelu N=71 Liczba powodzeń (odsetek pacjentów „bez” lub „prawie bez” trądziku) 41 (27,5%) 23 (15,5%) p=0,008 23 (15,4%) p=0,003 7 (9,9%) p=0,002 Mediana redukcji (%) dotycząca: liczby wykwitów zapalnych 17 (62,8%) 13 (45,7%) p<0,001 liczby wykwitów niezapalnych 22 (51,2%) 17 (33,3%) p<0,001 łącznej liczby wykwitów 40 (51,0%) 29 (35,4%) p<0,001 Badanie 2 Badanie 2 Tydzień 12, dane z ostatniej obserwacji (LOCF); grupa objęta leczeniem (ITT) Adapalen+nadtlenek benzoilu N=415 Adapalen N=420 Nadtlenek benzoilu N=415 Podłoże N=418 Liczba powodzeń (odsetek pacjentów „bez” lub „prawie bez” trądziku) 125 (30,1%) 83 (19,8%) p<0,001 92 (22,2%) p=0,006 47 (11,3%) p<0,001 Mediana redukcji (%) dotycząca: liczby wykwitów zapalnych 16 (62,1%) 14 (50,0%) p<0,001 liczby wykwitów niezapalnych 24 (53,8%) 22 (49,1%) p=0,048 łącznej liczby wykwitów 45 (56,3%) 39 (46,9%) p=0,002 Tabela 2.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakokinetyczne
Skuteczność kliniczna w skojarzonych badaniach porównawczych Adapalen+nadtlenek benzoilu N=564 Adapalen N=568 Nadtlenek benzoilu N=564 Podłoże żelu N=489 Liczba powodzeń (odsetek pacjentów „bez” lub „prawie bez” trądziku) 166 (29,4%) 106 (18,7%) 115 (20,4%) 54 (11,1%) Mediana redukcji (%) dotycząca: liczby wykwitów zapalnych 16,0 (62,1) liczby wykwitów niezapalnych 23,5 (52,8) łącznej liczby wykwitów 41,0 (54,8) Skuteczność kliniczna produktu leczniczego Epiduo u dzieci w wieku od 9 do 11 lat: Podczas badania klinicznego z udziałem dzieci, 285 dzieci w wieku od 9 do 11 lat (53% pacjentów miało 11 lat, 33% miało 10 lat oraz 14% miało 9 lat), u których występował trądzik pospolity, którego ciężkość w skali IGA określono na poziomie 3 (umiarkowany) i ze zmianami (minimalnie 20, lecz nie więcej niż 100) zapalnymi i (lub) niezapalnymi na twarzy (w tym na nosie), leczono żelem Epiduo raz na dobę przez 12 tygodni.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakokinetyczne
Wyniki przeprowadzonego badania klinicznego, w którym badano skuteczność i bezpieczeństwo stosowania produktu Epiduo żel w leczeniu trądziku twarzy w specyficznej dziecięcej grupie wiekowej, są zgodne z wynikami innych wcześniejszych badań klinicznych przeprowadzonymi u pacjentów w wieku od 12 lat i starszych, oraz potwierdzają znaczną skuteczność oraz dopuszczalny poziom tolerancji. Trwałe, pierwsze efekty leczenia żelem Epiduo w porównaniu z leczeniem samym podłożem żelu, były obserwowane we wszystkich rodzajach zmian (zapalne, niezapalne, całkowita liczba) od pierwszego tygodnia do 12 tygodnia leczenia. 5.2. Właściwości farmakokinetyczne Właściwości farmakokinetyczne produktu leczniczego Epiduo są podobne do profilu farmakokinetycznego żelu zawierającego wyłącznie adapalen 0,1%. W 30-dniowym badaniu farmakokinetycznym pacjentów z trądzikiem, których leczono żelem o stałym składzie obu składników lub adapalenem 0,1% w warunkach maksymalnych (nanoszenie 2 g żelu na dobę), stężenie adapalenu było niemierzalne w większości próbek osocza (granica czułości 0,1 ng/ml).
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakokinetyczne
Niewielkie stężenie adapalenu (Cmax pomiędzy 0,1 a 0,2 ng/ml) odnotowano w dwóch próbkach krwi pobranych od osób leczonych żelem Epiduo i w trzech próbkach od osób leczonych adapalenem 0,1% w żelu. Najwyższe AUC 0-24h adapalenu w grupie pacjentów leczonych żelem ze stałym składem obu składników wyniosło 1,99 ng.h/ml. Wyniki te są porównywalne z wynikami uzyskanymi w poprzednich badaniach klinicznych obejmujących różne produkty lecznicze adapalenu 0,1%, gdzie ogólnoustrojowa ekspozycja na adapalen była zawsze mała. Przenikanie nadtlenku benzoilu przez skórę jest niewielkie; po nałożeniu na skórę substancja ta jest całkowicie metabolizowana do kwasu benzoesowego, który jest szybko eliminowany. 5.3. Przedkliniczne dane o bezpieczeństwie Dane przedkliniczne obejmujące konwencjonalne badania farmakologiczne, badanie toksyczności po podaniu dawki wielokrotnej, genotoksyczność, fototoksyczność i kancerogenność nie wykazują żadnych większych zagrożeń dla ludzi.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakokinetyczne
Przeprowadzono badania toksycznego działania adapalenu, podawanego doustnie i na skórę, na reprodukcję na szczurach i królikach. Wykazano działanie teratogenne przy wysokiej ekspozycji ogólnoustrojowej (dawki doustne od 25 mg/kg/dzień). W przypadku mniejszej ekspozycji na produkt leczniczy (podanie na skórę dawki 6mg/kg mc./dobę), obserwowane były zmiany liczby żeber lub kręgów. Badania żelu Epiduo przeprowadzone na zwierzętach nawet do 13 tygodni obejmowały badania tolerancji miejscowej oraz badania toksyczności dawki wielokrotnej u szczurów, psów i świń, wykazywały miejscowe podrażnienie i możliwość uczulenia. Jest to zgodne z oczekiwaniami dotyczących produktów leczniczych złożonych, zawierających nadtlenek benzoilu. Ekspozycja ogólnoustrojowa na adapalen po wielokrotnym nanoszeniu na skórę zwierząt produktu leczniczego złożonego zawierającego adapalen, jest bardzo mała, co jest zgodne z klinicznymi danymi farmakokinetycznymi.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Właściwości farmakokinetyczne
W skórze nadtlenek benzoilu jest szybko i całkowicie metabolizowany do kwasu benzoesowego, który po wchłonięciu do organizmu jest wydalany z moczem. Ma to wpływ na zmniejszenie ekspozycji ogólnoustrojowej. Toksyczność reprodukcyjna adapalenu była badana po podaniu doustnym u szczurów pod kątem wpływu na płodność. Nie stwierdzono niekorzystnego wpływu na rozrodczość i płodność, przeżywalność miotu F1, wzrost i rozwój do odstawienia, a następnie wydajność reprodukcyjną po podaniu doustnym adapalenu w dawkach do 20 mg/kg/dobę. Badanie toksyczności reprodukcyjnej i rozwojowej przeprowadzone na szczurach z zastosowaniem dawek doustnych nadtlenku benzoilu w wysokości do 1000 mg/kg/dobę (5 ml/kg), wykazało, że nadtlenek benzoilu nie wywołał teratogenności ani wpływu na funkcje rozrodcze w dawkach do 500 mg/kg/dobę.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Przedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Dane przedkliniczne obejmujące konwencjonalne badania farmakologiczne, badanie toksyczności po podaniu dawki wielokrotnej, genotoksyczność, fototoksyczność i kancerogenność nie wykazują żadnych większych zagrożeń dla ludzi. Przeprowadzono badania toksycznego działania adapalenu, podawanego doustnie i na skórę, na reprodukcję na szczurach i królikach. Wykazano działanie teratogenne przy wysokiej ekspozycji ogólnoustrojowej (dawki doustne od 25 mg/kg/dzień). W przypadku mniejszej ekspozycji na produkt leczniczy (podanie na skórę dawki 6mg/kg mc./dobę), obserwowane były zmiany liczby żeber lub kręgów. Badania żelu Epiduo przeprowadzone na zwierzętach nawet do 13 tygodni obejmowały badania tolerancji miejscowej oraz badania toksyczności dawki wielokrotnej u szczurów, psów i świń, wykazywały miejscowe podrażnienie i możliwość uczulenia. Jest to zgodne z oczekiwaniami dotyczących produktów leczniczych złożonych, zawierających nadtlenek benzoilu.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Przedkliniczne dane o bezpieczeństwie
Ekspozycja ogólnoustrojowa na adapalen po wielokrotnym nanoszeniu na skórę zwierząt produktu leczniczego złożonego zawierającego adapalen, jest bardzo mała, co jest zgodne z klinicznymi danymi farmakokinetycznymi. W skórze nadtlenek benzoilu jest szybko i całkowicie metabolizowany do kwasu benzoesowego, który po wchłonięciu do organizmu jest wydalany z moczem. Ma to wpływ na zmniejszenie ekspozycji ogólnoustrojowej. Toksyczność reprodukcyjna adapalenu była badana po podaniu doustnym u szczurów pod kątem wpływu na płodność. Nie stwierdzono niekorzystnego wpływu na rozrodczość i płodność, przeżywalność miotu F1, wzrost i rozwój do odstawienia, a następnie wydajność reprodukcyjną po podaniu doustnym adapalenu w dawkach do 20 mg/kg/dobę. Badanie toksyczności reprodukcyjnej i rozwojowej przeprowadzone na szczurach z zastosowaniem dawek doustnych nadtlenku benzoilu w wysokości do 1000 mg/kg/dobę (5 ml/kg), wykazało, że nadtlenek benzoilu nie wywołał teratogenności ani wpływu na funkcje rozrodcze w dawkach do 500 mg/kg/dobę.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Simulgel 600 PHA (kopolimer akryloamidu i sodu akryloilodimetylotaurynianu dyspersja 40% w izoheksadekanie, polisorbat 80, sorbitanu oleinian) Sodu dokuzynian Disodu edetynian Glicerol Poloksamer 124 Glikol propylenowy (E1520) Woda oczyszczona 6.2. Niezgodności farmaceutyczne Nie występują. 6.3. Okres ważności 2 lata. Po pierwszym otwarciu: 6 miesięcy. 6.4. Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25°C. 6.5. Rodzaj i zawartość opakowania Epiduo jest dostępny w dwóch rodzajach opakowań. Tuba: Tuba z HDPE, z szyjką z HDPE, zamknięta zakrętką z PP, zawierająca 15 g, 30 g lub 60 g żelu, umieszczona w tekturowym pudełku. Pojemnik hermetyczny wielodawkowy z pompką: Pojemnik hermetyczny wielodawkowy z pompką, z wieczkiem, wykonany z PP, LDPE i HDPE zawierający 15 g, 30 g, 45 g lub 60 g żelu, umieszczony w tekturowym pudełku.
- CHPL leku Epiduo, Żel, 0,1% + 2,5%Dane farmaceutyczne
Nie wszystkie wielkości opakowania muszą znajdować się w obrocie. 6.6. Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak szczególnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego i odpadki powinny być utylizowane zgodnie z lokalnymi przepisami.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Epiduo Forte, 0,3% + 2,5%, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera: 3 mg (0,3% w/w) adapalenu (Adapalenum) oraz benzoilu nadtlenek uwodniony, w ilości odpowiadającej 25 mg (2,5% w/w) benzoilu nadtlenku bezwodnego (Benzoylis peroxidum). Substancja pomocnicza o znanym działaniu: glikol propylenowy (E1520) 40 mg/g (4,0%) Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel. Biały lub bardzo bladożółty, nieprzejrzysty żel.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Wskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy Epiduo Forte jest wskazany do stosowania w miejscowym leczeniu trądziku pospolitego (Acne vulgaris) z zaskórnikami, licznymi grudkami i krostkami (patrz punkty 4.2 i 5.1). Produkt leczniczy Epiduo Forte jest wskazany do stosowania u dorosłych i młodzieży od 12. roku życia.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Produkt leczniczy Epiduo Forte należy nanosić na cały obszar skóry twarzy i tułowia zajęty przez trądzik raz na dobę, wieczorem, na czystą i suchą skórę. Czas trwania leczenia powinien być określony przez lekarza na podstawie stanu klinicznego pacjenta oraz odpowiedzi terapeutycznej na leczenie. Pierwsze objawy poprawy stanu klinicznego pojawiają się zazwyczaj między 1. a 4. tygodniem leczenia. Jeśli nie zostanie zaobserwowana poprawa po 4-8 tygodniach leczenia, należy ponownie rozważyć korzyści z kontynuacji. Dostępny jest również produkt leczniczy Epiduo o mniejszej mocy dawki (Epiduo, 0,1% + 2,5%, żel), którego użycie rozważyć należy u pacjentów z trądzikiem o umiarkowanym nasileniu (patrz punkt 5.1). W przypadku pokrycia całej twarzy licznymi grudkami i krostkami, obserwowano zwiększone korzyści kliniczne u pacjentów leczonych produktem leczniczym Epiduo Forte (0,3% + 2,5%) w porównaniu z terapią referencyjną (Epiduo, 0,1% + 2,5%).
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Dawkowanie
Lekarz może dokonać wyboru pomiędzy dwoma stężeniami opierając się na aktualnym stanie klinicznym pacjenta oraz nasileniu objawów. Specjalne grupy pacjentów Osoby w podeszłym wieku: Nie określono bezpieczeństwa stosowania i skuteczności produktu leczniczego Epiduo Forte u pacjentów w podeszłym wieku (65 lat i starszych). Zaburzenia czynności nerek i wątroby: Nie badano stosowania produktu Epiduo Forte u pacjentów z zaburzeniami czynności nerek i wątroby. Dzieci i młodzież: Nie badano bezpieczeństwa stosowania i skuteczności produktu leczniczego Epiduo Forte u dzieci w wieku poniżej 12 lat. Sposób podawania Tylko do stosowania na skórę. Nanosić cienką warstwę żelu Epiduo Forte na zajęte obszary skóry na twarzy i (lub) tułowiu raz na dobę, po myciu. Nanieść ilość wielkości ziarna groszku na każdą okolicę twarzy (np. na czoło, brodę, każdy policzek), unikając oczu i warg (patrz punkt 4.4). Pacjentom należy zalecić, aby myli ręce po nałożeniu produktu leczniczego.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Dawkowanie
Kosmetyki można nakładać po wyschnięciu produktu leczniczego. Jeśli wystąpi podrażnienie, pacjentowi należy zalecić stosowanie, odpowiednio do potrzeb, niekomedogennych produktów nawilżających, stosowanie produktu leczniczego z mniejszą częstością (np. co drugi dzień), tymczasowe przerwanie jego stosowania lub całkowite odstawienie go.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Przeciwwskazania
4.3 Przeciwwskazania Ciąża (patrz punkt 4.6) Kobiety planujące zajście w ciążę (patrz punkt 4.6) Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produktu leczniczego Epiduo Forte nie należy nanosić na uszkodzoną skórę, skaleczenia lub otarcia, oparzenia słoneczne ani na skórę z wypryskiem. Unikać kontaktu z oczami, wargami, ustami, nozdrzami czy błonami śluzowymi. Jeśli produkt leczniczy dostanie się do oka, należy je natychmiast przemyć ciepłą wodą. W razie pojawienia się reakcji wskazującej na uczulenie na którykolwiek składnik produktu leczniczego Epiduo Forte należy przerwać jego stosowanie. Unikać nadmiernego narażenia na promieniowanie słoneczne i promieniowanie UV. Należy unikać kontaktu żelu Epiduo Forte z wszelkimi powierzchniami farbowanymi, np. z włosami lub tkaninami, ponieważ może on spowodować ich odbarwienie lub zmianę koloru. Produkt leczniczy zawiera 40 mg glikolu propylenowego (E1520) w każdym gramie co odpowiada 4% w/w.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Specjalne środki ostrozności
Nie określono bezpieczeństwa i skuteczności stosowania produktu leczniczego Epiduo Forte u pacjentów z ciężkim trądzikiem guzkowym lub głębokim trądzikiem guzkowo-torbielowatym. Ponieważ u pacjentów z ciężkim trądzikiem guzkowym lub guzkowo-torbielowatym istnieje zwiększone ryzyko wystąpienia trwałych blizn wtórnie do zmian trądzikowych, nie zaleca się stosowania leku Epiduo Forte u takich pacjentów w związku z ryzykiem uzyskania niezadowalającej reakcji na leczenie.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji produktu leczniczego Epiduo Forte. Na podstawie wcześniejszych doświadczeń z adapalenem i benzoilu nadtlenkiem można stwierdzić, że nie ma znanych interakcji z innymi produktami leczniczymi, które mogłyby być stosowane na skórę jednocześnie z produktem leczniczym Epiduo Forte. Nie należy jednak stosować produktu leczniczego Epiduo Forte jednocześnie z innymi retynoidami, benzoilu nadtlenkiem lub lekami o podobnym mechanizmie działania. Ostrożnie stosować kosmetyki złuszczające, podrażniające i wysuszające, ponieważ mogą działać podrażniająco podczas jednoczesnego stosowania z tym produktem leczniczym. Wchłanianie adapalenu przez skórę ludzką jest niewielkie (patrz punkt 5.2), dlatego też wystąpienie interakcji z produktami leczniczymi o działaniu ogólnoustrojowym jest mało prawdopodobne.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Interakcje
Przenikanie benzoilu nadtlenku przez skórę jest niewielkie i jest on całkowicie metabolizowany do kwasu benzoesowego, który jest szybko eliminowany. Dlatego też zaistnienie potencjalnych interakcji kwasu benzoesowego z produktami leczniczymi o działaniu ogólnoustrojowym jest mało prawdopodobne.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Retynoidy stosowane doustnie mają związek z występowaniem wad wrodzonych. Retynoidy do stosowania miejscowego, jeśli są stosowane zgodnie z zaleceniami, ogólnie są uznawane za wywołujące małą ekspozycję układową, ze względu na minimalne wchłanianie przezskórne. Mogą jednak wystąpić indywidualne okoliczności (jak np. uszkodzona skóra, przedawkowanie), które przyczynią się do zwiększonej ekspozycji ogólnoustrojowej. Ciąża Epiduo Forte jest przeciwwskazany (patrz punkt 4.3) do stosowania u kobiet w ciąży oraz u kobiet planujących zajście w ciążę. Brak danych lub istnieją tylko ograniczone dane dotyczące miejscowego stosowania adapalenu u kobiet w ciąży. Badania na zwierzętach, w których podawano adapalen doustnie, wykazały szkodliwy wpływ na reprodukcję w przypadku stosowania dużych dawek o działaniu ogólnoustrojowym (patrz punkt 5.3).
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Wpływ na płodność, ciążę i laktację
Doświadczenia kliniczne ze stosowanym miejscowo adapalenem i nadtlenkiem benzoilu u kobiet w ciąży są ograniczone. Jeśli produkt jest stosowany w trakcie ciąży, lub gdy pacjentka zajdzie w ciążę w trakcie przyjmowania leku, leczenie musi zostać przerwane. Karmienie piersi? Nie przeprowadzono badań dotyczących przenikania produktu leczniczego Epiduo Forte do mleka zwierząt oraz ludzi po naniesieniu na skórę. Na podstawie dostępnych danych farmakokinetycznych dotyczących szczurów stwierdzono przenikanie adapalenu do mleka po doustnym lub dożylnym podaniu adapalenu. Nie można wykluczyć, że istnieje ryzyko dla dzieci karmionych piersią. Decyzję o zaprzestaniu karmienia piersią lub o zaprzestaniu lub czasowym wstrzymaniu leczenia żelem Epiduo Forte należy podjąć po uwzględnieniu korzyści z karmienia piersią dla dziecka oraz korzyści z leczenia dla matki.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Wpływ na płodność, ciążę i laktację
W okresie karmienia piersią, aby uniknąć narażenia dziecka na kontakt z produktem leczniczym Epiduo Forte, nie należy go nanosić na klatkę piersiową. Płodność Nie przeprowadzono badań z udziałem ludzi, dotyczących wpływu produktu leczniczego Epiduo Forte na płodność. Nie stwierdzono jednak wpływu adapalenu czy benzoilu nadtlenku na płodność w badaniach dotyczących ich wpływu na reprodukcję u szczurów (patrz punkt 5.3).
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Epiduo Forte nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Działania niepożądane
4.8 Działania niepożądane Podsumowanie danych dotyczących bezpieczeństwa stosowania leku. Można się spodziewać wystąpienia działań niepożądanych na skórze u około 10% pacjentów. Do związanych z leczeniem działań niepożądanych, które były na ogół uznane za powiązane ze stosowaniem produktu Epiduo Forte, należą reakcje w miejscu aplikacji o nasileniu łagodnym lub umiarkowanym, takie jak podrażnienie skóry charakteryzujące się głównie łuszczeniem, suchością, rumieniem i paleniem/pieczeniem. Zaleca się zastosowanie kremu nawilżającego, tymczasowe zmniejszenie częstości aplikacji do nakładania produktu co drugi dzień lub tymczasowe przerwanie jego stosowania, aż będzie można powrócić do stosowania raz na dobę. Reakcje te występują na ogół wcześnie w trakcie leczenia i zazwyczaj z czasem stopniowo ustępują.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Działania niepożądane
Tabelaryczny wykaz działań niepożądanych Działania niepożądane zostały sklasyfikowane według układów i narządów i częstości występowania, zgodnie z następującą konwencją: bardzo często: (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) i zostały opisane po zastosowaniu produktu Epiduo Forte w badaniu klinicznym fazy 3., w którym jako produkt kontrolny zastosowano podłoże produktu (patrz tabela 1). Tabela 1: Działania niepożądane Klasyfikacja układów i narządów Częstość występowania Działania niepożądane Zaburzenia oka Niezbyt często: Rumień powieki Nieznana*: Obrzęk powieki Zaburzenia układu immunologicznego Nieznana*: Reakcja anafilaktyczna Zaburzenia układu nerwowego Niezbyt często: Parestezje (mrowienie w miejscu aplikacji) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Nieznana*: Uczucie ucisku w gardle, duszność Zaburzenia skóry i tkanki podskórnej Często: Atopowe zapalenie skóry, wyprysk, uczucie pieczenia skóry, podrażnienie skóry Niezbyt często: Suchość skóry, świąd, wysypka Nieznana*: Alergiczne kontaktowe zapalenie skóry, obrzęk twarzy, ból skóry (piekący ból), pęcherzyki, przebarwienie skóry (nadmierne zabarwienie lub odbarwienie), pokrzywka, oparzenie w miejscu aplikacji** * Dane z obserwacji po dopuszczeniu do obrotu odnotowane w okresie począwszy od pierwszego na świecie wprowadzenia do obrotu produktu leczniczego Epiduo, 0,1% + 2,5%, żel, pochodzące z populacji o nieznanej wielkości.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Działania niepożądane
**W większości przypadków „oparzenie w miejscu aplikacji” było powierzchowne, jednak notowano przypadki oparzenia drugiego stopnia lub ciężkiego oparzenia. Działania niepożądane dotyczące skóry były częstsze przy stosowaniu Epiduo Forte (adapalen 0,3% + benzoilu nadtlenek 2,5%) niż przy Epiduo (adapalen 0,1% + benzoilu nadtlenek 2,5%) w porównaniu do podłoża. W głównych badaniach (patrz punkt 5.1) działania niepożądane związane ze skórą wystąpiły u 9,2% badanych w mieszanej populacji, leczonych Epiduo Forte oraz u 3,7% w populacji leczonej Epiduo, w porównaniu z grupą u której zastosowano podłoże żelu – 2,9%. Poza niektórymi z działań niepożądanych wymienionych powyżej opisywano również występowanie innych działań niepożądanych po zastosowaniu produktu leczniczego Epiduo, żel (adapalen 0,1% + benzoilu nadtlenek 2,5%), wcześniej dopuszczonego do obrotu produktu złożonego zawierającego adapalen i benzoilu nadtlenek: Badania kliniczne: Innymi działaniami niepożądanymi, które opisywano w badaniach klinicznych z użyciem produktu Epiduo, żel (adapalen 0,1% + benzoilu nadtlenek 2,5%), są podrażnieniowe kontaktowe zapalenie skóry (występujące często) i oparzenia słoneczne (występujące niezbyt często).
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Działania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwi to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa Tel.: +48 22 49 21 301 Faks: +48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Przedawkowanie
4.9 Przedawkowanie Produkt leczniczy Epiduo Forte przeznaczony jest wyłącznie do stosowania raz na dobę na skórę. Nałożenie nadmiernej ilości produktu Epiduo Forte może spowodować nasilone podrażnienie. W takim wypadku należy przerwać stosowanie produktu leczniczego i poczekać, aż zmiany na skórze ustąpią. W razie przypadkowego połknięcia produktu leczniczego należy zastosować odpowiednie leczenie objawowe.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe stosowane miejscowo, kod ATC: D10AD53 Mechanizm działania i właściwości farmakodynamiczne Produkt Epiduo Forte zawiera dwie substancje czynne, których mechanizmy działania są różne, ale wzajemnie dopełniające się. Adapalen: adapalen jest stabilną chemicznie pochodną kwasu naftalenokarboksylowego o aktywności podobnej do retynoidów. Badania nad profilem biochemicznym i farmakologicznym adapalenu wykazały, że adapalen działa w patofizjologii trądziku pospolitego: jest silnym modulatorem różnicowania i keratynizacji komórek oraz wykazuje właściwości przeciwzapalne. Z mechanistycznego punktu widzenia adapalen wiąże się ze swoistymi receptorami jądrowymi kwasu retynowego. Aktualne dane wskazują, że miejscowe stosowanie adapalenu doprowadza do prawidłowego różnicowania komórek mieszkowych nabłonka, co prowadzi do zmniejszenia ilości mikrozaskómików.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Właściwości farmakodynamiczne
Adapalen hamuje chemotaktyczną (kierunkową) i chemokinetyczną (przypadkową) odpowiedź ludzkich leukocytów wielojądrzastych w modelach in vitro; hamuje również przemianę kwasu arachidonowego do mediatorów stanu zapalnego. Badania in vitro wykazały zahamowanie czynników AP-1 oraz ekspresji receptorów Toll-podobnych 2. Profil ten sugeruje, że adapalen osłabia komórkową komponentę zapalną w trądziku. Benzoilu nadtlenek: wykazano działanie przeciwdrobnoustrojowe benzoilu nadtlenku, szczególnie na bakterie Cutibacterium acnes, które występują w stanach patologicznych w mieszku łojowo-włosowym dotkniętym trądzikiem. Mechanizm działania benzoilu nadtlenku wyjaśniano jego dużą lipofilnością, która umożliwia jego przenikanie przez naskórek do błon komórkowych bakterii i keratynocytów w mieszku łojowo-włosowym. Benzoilu nadtlenek uważa się za bardzo skuteczny lek przeciwbakteryjny o szerokim spektrum w leczeniu trądziku pospolitego.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Właściwości farmakodynamiczne
Wykazano, że wywiera działanie bakteriobójcze poprzez wytwarzanie wolnych rodników, które utleniają białka i inne niezbędne składniki komórkowe w ścianie bakterii. Minimalne stężenie hamujące benzoilu nadtlenku jest bakteriobójcze i wykazano jego działanie na antybiotykowrażliwe i antybiotykooporne szczepy C. acnes. Ponadto wykazano, iż benzoilu nadtlenek ma działanie złuszczające i keratolityczne. Skuteczność kliniczna i bezpieczeństwo stosowania Ocenę bezpieczeństwa i skuteczności produktu leczniczego Epiduo Forte stosowanego raz na dobę w leczeniu trądziku pospolitego przeprowadzono w trwającym 12 tygodni, wieloośrodkowym, randomizowanym, prowadzonym metodą podwójnie ślepej próby, kontrolowanym badaniu klinicznym porównującym działanie produktu leczniczego Epiduo Forte z działaniem podłoża żelu, z udziałem 503 pacjentów z trądzikiem.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Właściwości farmakodynamiczne
W tym badaniu 217 pacjentów leczono produktem Epiduo Forte, żel, 217 pacjentów leczono żelem zawierającym adapalen w stężeniu 0,1% + benzoilu nadtlenek w stężeniu 2,5% i 69 pacjentów – podłożem żelu. Kryteria skuteczności były następujące: odsetek powodzeń zdefiniowany jako udział procentowy pacjentów zakwalifikowanych jako „wolny od trądziku” lub „prawie wolny od trądziku” po 12 tygodniach leczenia, z poprawą o co najmniej dwa stopnie wskaźnika ogólnej oceny przez lekarza (ang. Investigator’s Global Assessment, IGA). Wskaźnik IGA „wolny od trądziku” odpowiadał czystej skórze, bez zmian zapalnych czy niezapalnych. Wskaźnik IGA „prawie wolny od trądziku” odpowiadał obecności niewielkiej liczby rozproszonych zaskórników i niewielkiej liczby małych grudek. Bezwzględna zmiana po 12 tygodniach leczenia w stosunku do stanu wyjściowego liczby zmian zapalnych i niezapalnych.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Właściwości farmakodynamiczne
Podczas oceny początkowej u 50% pacjentów włączonych do badania nasilenie trądziku oceniano jako „umiarkowane” (IGA=3), a u 50% jako „ciężkie” (IGA=4). W całej badanej populacji dozwolona była obecność maksymalnie dwóch guzków. Jeśli chodzi o liczbę zmian, u pacjentów było średnio obecnych po 98 zmian łącznie (zakres: 51–226), przy czym średnia liczba zmian zapalnych wynosiła 38 (zakres: 20–99), a średnia liczba zmian niezapalnych wynosiła 60 (zakres: 30–149). Pacjenci byli w wieku od 12 do 57 lat (średni wiek: 19,6 roku), przy czym 273 (54,3%) pacjentów było w wieku od 12 do 17 lat. Do badania włączono podobną liczbę mężczyzn (47,7%) i kobiet (52,3%). W tym kluczowym badaniu u 55,2% pacjentów w grupie z chorobą o ciężkim nasileniu trądzik występował na tułowiu. Pacjenci stosowali produkt leczniczy na skórę twarzy i innych okolic ciała dotkniętych trądzikiem w miarę potrzeb, raz na dobę, wieczorem.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Właściwości farmakodynamiczne
Przeprowadzono analizy statystyczne w celu porównania i zinterpretowania wyników badania w sposób stopniowany: porównanie żelu Epiduo Forte z podłożem żelu w ogólnej populacji pacjentów z trądzikiem o nasileniu umiarkowanym i ciężkim (IGA=3 i IGA=4) porównanie żelu Epiduo Forte z podłożem żelu w podgrupie pacjentów z trądzikiem o nasileniu ciężkim (IGA=4) Wyniki dotyczące skuteczności produktu leczniczego Epiduo Forte w połączonych populacjach pacjentów z trądzikiem o umiarkowanym i ciężkim nasileniu przedstawiono w tabeli 2. Tabela 2: Skuteczność kliniczna w całej populacji: pacjenci z trądzikiem pospolitym o umiarkowanym i ciężkim nasileniu po 12 tygodniach (połączone wskaźniki IGA = 3 i 4, MI, populacja ITT) Parametry skuteczności Epiduo Forte, 0,3% + 2,5%, żel (N=217) Adapalen 0,1% + benzoilu nadtlenek 2,5%, żel (N=217) Podłoże żelu (N=69) Odsetek powodzeń (poprawa o minimum 2 stopnie i wskaźnik IGA „wolny od trądziku” lub „prawie wolny od trądziku”) Zmiana liczby zmian zapalnych, średnie zmniejszenie bezwzględne (procentowe) Zmiana liczby zmian niezapalnych, średnie zmniejszenie bezwzględne (procentowe) MI= imputacja wielokrotna; ITT= populacja wyodrębniona zgodnie z zaplanowanym leczeniem (intent-to-treat) a) Badanie nie zostało zaplanowane i nie dawało możliwości do oficjalnego porównania skuteczności Epiduo Forte do niższej mocy adapalenu 0,1% + benzoilu nadtlenku 2,5%, ani do porównania mniejszej mocy adapalenu 0,1% + benzoilu nadtlenek 2,5% do podłoża żelu b) p<0,001 w porównaniu do podłoża Tabela 3: Skuteczność kliniczna u pacjentów z trądzikiem pospolitym o ciężkim nasileniu (wskaźnik IGA = 4, MI, populacja ITT) Parametry skuteczności Epiduo Forte, 0,3% + 2,5%, żel (N=106) Adapalen 0,1% + benzoilu nadtlenek 2,5%, żel (N=112) Podłoże żelu (N=34) Odsetek powodzeń (poprawa o minimum 2 stopnie i wskaźnik IGA „wolny od trądziku” lub „prawie wolny od trądziku”) Zmiana liczby zmian zapalnych, średnie zmniejszenie bezwzględne (procentowe) Zmiana liczby zmian niezapalnych, średnie zmniejszenie bezwzględne (procentowe) MI= imputacja wielokrotna; ITT= populacja wyodrębniona zgodnie z zaplanowanym leczeniem (intent-to-treat) a) p=0,029 w porównaniu do podłoża b) p<0,001 w porównaniu do podłoża Żel zawierający adapalen w stężeniu 0,1% oraz benzoilu nadtlenek w stężeniu 2,5% był uwzględniony w tym badaniu jako lek referencyjny.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Właściwości farmakodynamiczne
U pacjentów, u których trądzik oceniono jako mający „umiarkowane” nasilenie (wskaźnik IGA 3), Epiduo Forte nie wykazało przewagi w skuteczności w porównaniu do leczenia referencyjnego. W analizie obejmującej pacjentów z trądzikiem ocenionym jako mający „ciężkie” nasilenie (wskaźnik IGA 4) osiągnięto wyższą skuteczność w porównaniu do podłoża żelu z różnicą w leczeniu 20,1% (31,9% w porównaniu do 11,8%; 95% CI: [6,0%, 34,2%], p=0,029), czego nie osiągnięto podczas leczenia produktem referencyjnym (różnica w leczeniu w porównaniu do podłoża – 8,8%). Działanie produktu leczniczego Epiduo Forte na blizny trądzikowe oceniono w badaniu OSCAR. Było to wieloośrodkowe, randomizowane, zaślepione dla badacza, kontrolowane podłożem badanie, z zastosowaniem porównania wewnątrzosobniczego (prawa połowa twarzy vs.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Właściwości farmakodynamiczne
lewa połowa twarzy), w którym uczestniczyli mężczyźni i kobiety w wieku od 16 do 35 lat (n = 67), z trądzikiem pospolitym twarzy o nasileniu umiarkowanym do ciężkiego, z wynoszącą 40 średnią liczbą zmian trądzikowych (18 zmian zapalnych, 22 zmiany niezapalne) po obu stronach twarzy. U zdecydowanej większości pacjentów (93%), występował trądzik o ogólnie umiarkowanym nasileniu. Zmiany trądzikowe były równomiernie rozłożone po obu stronach twarzy, nasilenie występowania blizn trądzikowych obejmowało po 12 blizn po każdej stronie twarzy, z przewagą blizn o wymiarach od 2 do 4 mm. U większości pacjentów (63%) występowały blizny o ogólnie łagodnym nasileniu, a u około 30% pacjentów występowały blizny o nasileniu umiarkowanym. Do badania włączono mężczyzn i kobiety w wieku od 16 do 35 lat włącznie, z fototypem skóry typu od I do IV według skali Fitzpatricka.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Właściwości farmakodynamiczne
Populacja włączona do badania składała się głównie z kobiet (65,7%), większość pacjentów stanowiły osoby rasy białej (86,6%), pozostałą część stanowili Azjaci (13,4%), pochodzenie etniczne nie zostało uwzględnione. Najczęściej występującymi fototypami skóry był typ II (47,8%) i typ III (34,3%), a pozostałą część stanowił typ IV (13,4%) i typ I (4,5%). Pacjenci włączeni do badania byli randomizowani do grupy stosującej produkt leczniczy Epiduo Forte na jednej połowie twarzy i podłoże żelu na drugiej połowie twarzy, raz na dobę, wieczorem, przez okres 24 tygodni. Pierwszorzędowym punktem końcowym oceny skuteczności była liczba zanikowych blizn trądzikowych, występujących na jednej połowie twarzy w 24 tygodniu badania. Analiza pierwszorzędowego punktu końcowego wykazała, że stosowanie produktu leczniczego Epiduo Forte wiązało się ze zmniejszeniem całkowitej liczby blizn trądzikowych (patrz Tabela 4).
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Właściwości farmakodynamiczne
Tabela 4: Całkowita liczba blizn trądzikowych (ITT/LOCF) Całkowita liczba blizn trądzikowych (ITT/LOCF) Epiduo Forte Podłoże żelu Różnica w leczeniu Wynik statystyczny Średnia ± SD Mediana (Q1, Q3) (Min, Max) Produkt leczniczy Epiduo Forte powodował przede wszystkim redukcję blizn o wielkości od 2 do 4 mm (średnia dla Epiduo Forte 9,0 ± 5,4; średnia dla podłoża żelu 12,1 ± 7,0; średnia różnica w leczeniu względem podłoża żelu -3,1 ± 4,1), podczas gdy redukcja blizn o wielkości > 4 mm była mniejsza (średnia dla Epiduo Forte 0,6 ± 0,8; średnia dla podłoża żelu 1,2 ± 1,9; średnia różnica w leczeniu względem podłoża żelu -0,6 ± 1,5). Wykres 1 przedstawia zmianę procentową całkowitej liczby blizn zanikowych obserwowaną podczas oceny połówek twarzy na których stosowano produkt leczniczy Epiduo Forte i połówek twarzy na których stosowano podłoże żelu. Wykres 1 * nominalna wartość p, nieskorygowana dla wielokrotnych testów
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Przeprowadzono badanie farmakokinetyki obejmujące podawanie produktu Epiduo Forte, żel 26 pacjentom w wieku dorosłym i młodzieńczym (od 12 do 33 lat) z ciężkim trądzikiem pospolitym. U pacjentów zastosowano leczenie polegające na aplikacji produktu leczniczego na wszystkie potencjalnie zajęte okolice w okresie 4 tygodni, w średniej dawce 2,3 grama/dobę (zakres: 1,6-3,1 grama/dobę) żelu Epiduo Forte nakładanego w postaci cienkiej warstwy na twarz, barki, górną część klatki piersiowej i górną część pleców. Po 4 tygodniach leczenia u 16 pacjentów (62%) stwierdzono mierzalne stężenie adapalenu w osoczu powyżej granicy oznaczalności (wartość LOQ 0,1 ng/ml), ze średnią wartością Cmax 0,16 ± 0,08 ng/ml i średnią wartością AUC0-24 h 2,49 ± 1,21 ng.h/ml. U pacjentów z największą ekspozycją wartości Cmax i AUC0-24 h adapalenu wynosiły odpowiednio 0,35 ng/ml i 6,41 ng.h/ml.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Właściwości farmakokinetyczne
W badaniach farmakokinetycznych przeprowadzonych z żelami Epiduo i Epiduo Forte wykazano, że benzoilu nadtlenek nie wpływa na przezskórne wchłanianie adapalenu. Przenikanie benzoilu nadtlenku przez skórę jest niewielkie; po nałożeniu na skórę jest on całkowicie przekształcany w kwas benzoesowy, który jest szybko eliminowany.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, fototoksyczności i działania rakotwórczego nie ujawniają żadnego szczególnego zagrożenia dla człowieka. Przeprowadzono badania toksycznego działania adapalenu, podawanego doustnie i na skórę, na reprodukcję na szczurach i królikach. Wykazano działanie teratogenne przy wysokiej ekspozycji ogólnoustrojowej (dawki doustne od 25 mg/kg mc./dobę). W przypadku mniejszej ekspozycji na produkt leczniczy (podanie na skórę dawki 6 mg/kg mc./dobę) obserwowane były zmiany liczby żeber lub kręgów. Badania produktu Epiduo lub Epiduo Forte przeprowadzone na zwierzętach obejmują badania tolerancji miejscowej oraz badania toksyczności dawki wielokrotnej podawanej na skórę u szczurów, psów i (lub) świń miniaturowych, trwające do 13 tygodni.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Przedkliniczne dane o bezpieczeństwie
Wykazano w nich miejscowe podrażnienie i możliwość uczulenia, co jest zgodne z oczekiwaniami dotyczącymi złożonych produktów leczniczych zawierających benzoilu nadtlenek. Ekspozycja ogólnoustrojowa na adapalen po wielokrotnym nanoszeniu na skórę zwierząt produktu leczniczego złożonego zawierającego adapalen jest bardzo mała, co jest zgodne z klinicznymi danymi farmakokinetycznymi. W skórze benzoilu nadtlenek jest szybko i całkowicie metabolizowany do kwasu benzoesowego, który po wchłonięciu do organizmu jest wydalany z moczem, przy ograniczonej ekspozycji ogólnoustrojowej. Toksyczność reprodukcyjna adapalenu była badana po podaniu doustnym u szczurów pod kątem wpływu na płodność. Nie stwierdzono niekorzystnego wpływu na rozrodczość i płodność, przeżywalność miotu F1, wzrost i rozwój do odstawienia, a następnie wydajność reprodukcyjną po podaniu doustnym adapalenu w dawkach do 20 mg/kg mc./dobę.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Przedkliniczne dane o bezpieczeństwie
Badanie toksyczności reprodukcyjnej i rozwojowej przeprowadzone na szczurach z zastosowaniem dawek doustnych nadtlenku benzoilu w wysokości do 1000 mg/kg/dobę (5 ml/kg), wykazało, że nadtlenek benzoilu nie wywołał teratogenności ani wpływu na funkcje rozrodcze w dawkach do 500 mg/kg mc./dobę. Ocena ryzyka dla środowiska (ERA) Badania oceniające ryzyko dla środowiska wykazały, że adapalen ma potencjalnie bardzo trwały i toksyczny wpływ na środowisko (patrz punkt 6.6). Badania oceniające ryzyko dla środowiska wykazały, że adapalen może stwarzać ryzyko dla środowiska wodnego.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Disodu edetynian Sodu dokuzynian Glicerol Poloksamer 124 Glikol propylenowy (E1520) Simulgel 600 PHA (kopolimer akryloamidu i sodu akryloilodimetylotaurynianu dyspersja 40% w izoheksadekanie, polisorbat 80, sorbitanu oleinian) Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata. Po pierwszym otwarciu: 3 miesiące. 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Produkt leczniczy Epiduo Forte jest dostarczany w dwóch rodzajach opakowań: Tuba: plastikowe tuby z korpusem z polietylenu wysokiej gęstości i z szyjką z polietylenu wysokiej gęstości, zamykane nakrętką z polipropylenu, o pojemności 2 g i 5 g.
- CHPL leku Epiduo forte, Żel, 0,3% + 2,5%Dane farmaceutyczne
Pojemnik hermetyczny wielodawkowy z pompką: pojemnik hermetyczny wielodawkowy z pompką i zatrzaskiwanym wieczkiem o pojemności 15 g, 30 g, 45 g i 60 g, wykonany z polipropylenu i polietylenu wysokiej gęstości, lub polipropylenu, polietylenu wysokiej gęstości i polietylenu bardzo niskiej gęstości. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Ten produkt leczniczy może stwarzać ryzyko dla środowiska (patrz punkt 5.3). Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Silseq, 1 mg/g + 25 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera: 1 mg adapalenu (0,1% w/w) oraz benzoilu nadtlenek z wodą, w ilości odpowiadającej 25 mg (2,5% w/w) benzoilu nadtlenku bezwodnego Substancja pomocnicza o znanym działaniu : glikol propylenowy (E1520) 40 mg/g (4,0% w/w) oraz 3 mg/g (0,3% w.w) polisorbatów. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel Jednorodny, nieprzezroczysty żel koloru białego do bardzo bladego żółtego.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Ten produkt leczniczy jest wskazany do stosowania w miejscowym leczeniu trądziku pospolitego z zaskórnikami, grudkami i krostkami (patrz punkt 5.1). Produkt leczniczy Silseq jest wskazany do stosowania u dorosłych oraz młodzieży i dzieci w wieku od 9 lat.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Żel należy nanosić na cały obszar skóry zajęty przez trądzik raz na dobę wieczorem, na czystą i suchą skórę. Opuszkami palców należy nanosić cienką warstwę żelu, omijając okolicę oczu i ust (patrz punkt 4.4). Jeśli wystąpi podrażnienie, należy zalecić pacjentowi stosowanie niekomedogennych preparatów nawilżających, stosowanie produktu leczniczego z mniejszą częstością (np. co drugi dzień), tymczasowe przerwanie jego stosowania lub całkowite jego odstawienie. Czas trwania leczenia powinien być określony przez lekarza na podstawie stanu klinicznego pacjenta. Nie badano bezpieczeństwa i skuteczności produktu leczniczego zawierającego adapalen i benzoilu nadtlenek u dzieci w wieku poniżej 9 lat. Sposób podawania Podanie wyłącznie na skórę. Pacjentów należy poinstruować, aby myli ręce po nałożeniu produktu leczniczego.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Ciąża (patrz punkt 4.6) Kobiety planujące ciążę (patrz punkt 4.6)
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produktu leczniczego Silseq nie należy stosować na uszkodzoną skórę ani skórę o przerwanej ciągłości (rozcięcia lub otarcia), z wypryskiem lub oparzeniem słonecznym. Należy unikać kontaktu produktu leczniczego Silseq z oczami, ustami, nozdrzami lub błonami śluzowymi. Jeśli produkt leczniczy dostanie się do oka, należy je natychmiast przemyć ciepłą wodą. Należy przerwać stosowanie tego produktu leczniczego w razie pojawienia się reakcji wskazującej na uczulenie na którykolwiek z jego składników. Należy unikać nadmiernej ekspozycji na promieniowanie słoneczne i promieniowanie UV. Należy unikać kontaktu produktu leczniczego Silseq z wszelkimi kolorowymi materiałami, w tym z włosami i farbowanymi tkaninami, ponieważ może to spowodować ich wybielenie i odbarwienie. Ten produkt leczniczy zawiera 40 mg glikolu propylenowego (E1520) w każdym gramie żelu, co odpowiada 4% w/w, który może spowodować podrażnienie skóry.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gSpecjalne środki ostrozności
Ten produkt leczniczy zawiera polisorbaty, które mogą powodować reakcje alergiczne. Ten produkt leczniczy zawiera do 2,5 mg kwasu benzoesowego w gramie żelu, produkt rozkładu benzoilu nadtlenku. Kwas benzoesowy może powodować miejscowe podrażnienie.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji. Na podstawie wcześniejszych doświadczeń z adapalenem i benzoilu nadtlenkiem można stwierdzić, że nie ma znanych interakcji z innymi produktami leczniczymi, które mogłyby być stosowane na skórę jednocześnie z żelem. Nie należy jednak stosować go jednocześnie z innymi retynoidami, benzoilu nadtlenkiem lub lekami o podobnym mechanizmie działania. Należy zachować ostrożność stosując kosmetyki złuszczające, podrażniające i wysuszające, ponieważ mogą one działać podrażniająco podczas jednoczesnego stosowania z tym produktem leczniczym. Wchłanianie adapalenu przez skórę u ludzi jest niewielkie (patrz punkt 5.2), dlatego też jest mało prawdopodobne wystąpienie interakcji z produktami leczniczymi o działaniu ogólnoustrojowym. Przenikanie benzoilu nadtlenku przez skórę jest niewielkie i jest on całkowicie metabolizowany do kwasu benzoesowego, który jest szybko eliminowany.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gInterakcje
Dlatego też potencjalne interakcje kwasu benzoesowego z produktami leczniczymi o działaniu ogólnoustrojowym są mało prawdopodobne.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Retynoidy podawane doustnie mają związek z występowaniem wad wrodzonych. Retynoidy stosowane miejscowo, jeśli są stosowane zgodnie z zaleceniami, ogólnie są uznawane są za wywołujące niewielką ekspozycję ogólnoustrojową, ze względu na minimalne wchłanianie przez skórę. Mogą jednak występować czynniki indywidualne (np. uszkodzona bariera skórna, nadmierne stosowanie), które przyczynią się do zwiększenia ekspozycji ogólnoustrojowej. Ciąża Stosowanie produktu leczniczego zawierającego adapalen i benzoilu nadtlenek jest przeciwwskazane u kobiet w ciąży oraz u kobiet planujących zajście w ciążę (patrz punkt 4.3). Brak danych lub istnieją tylko ograniczone dane dotyczące stosowania adapalenu miejscowo u kobiet w ciąży. Badania na zwierzętach, w których podawano adapalen doustnie, wykazały szkodliwy wpływ na reprodukcję w przypadku stosowania dużych dawek o działaniu ogólnoustrojowym (patrz punkt 5.3).
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWpływ na płodność, ciążę i laktację
Doświadczenia kliniczne ze stosowanym miejscowo adapalenu i nadtlenku benzoilu u kobiet w ciąży są ograniczone. Jeśli ten produkt leczniczy jest stosowany w czasie ciąży, lub gdy pacjentka zajdzie w ciążę w trakcie jego stosowania, leczenie należy przerwać. Karmienie piersią Nie przeprowadzono badań dotyczących przenikania złożonego produktu leczniczego zawierającego adapalen i nadtlenek benzoilu do mleka zwierząt oraz do mleka kobiecego po naniesieniu żelu na skórę. Nie przewiduje się wpływu produktu leczniczego na dziecko karmione piersią, ponieważ ogólnoustrojowy wpływ produktu leczniczego na kobietę karmiącą piersią jest znikomy. Produkt leczniczy Silseq można stosować w okresie karmienia piersią. W okresie karmienia piersią, aby uniknąć narażenia dziecka na kontakt z produktem leczniczym, nie należy nanosić żelu na klatkę piersiową.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWpływ na płodność, ciążę i laktację
Płodność Nie przeprowadzono badań z udziałem ludzi dotyczących wpływu złożonego produktu leczniczego zawierającego adapalen i benzoilu nadtlenek w postaci żelu na płodność. Nie stwierdzono jednak wpływu adapalenu i benzoilu nadtlenku na płodność w badaniach dotyczących ich wpływu na reprodukcję u szczurów (patrz punkt 5.3).
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie dotyczy.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gDziałania niepożądane
4.8 Działania niepożądane Produkt leczniczy Silseq może powodować wymienione poniżej działania niepożądane w miejscu nałożenia: Tabela 1: Działania niepożądane
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gDziałania niepożądane
Klasyfikacja układów i narządów Częstość Działania niepożądane Zaburzenia oka Częstość nieznana (częstość nie może być określona na podstawie dostępnychdanych)* Obrzęk powiek Zaburzenia układu immunologicznego Częstość nieznana (częstość nie może być określona na podstawie dostępnychdanych)* Reakcja anafilaktyczna Zaburzenia oddechowe, klatki piersiowej i śródpiersiaZaburzenia skóry i tkanki podskórnej Częstość nieznana (częstość nie może być określona na podstawie dostępnychdanych)* Ucisk w gardle, duszność Zaburzenia skóry i tkanki podskórnej Często (≥1/100 do <1/10) Suchość skóry, zapalenie kontaktowe skóry z podrażnienia, uczucie pieczenia, podraznienie skóry, rumień, złuszczanie sie skóry (łuszczenie) Niezbyt często(≥1/1000 do<1/100) Świąd, oparzenia słoneczne Nieznana (częstość nie może być określona na podstawie dostępnychdanych)* Alergiczne kontaktowe zapalenie skóry, obrzęk twarzy, ból skóry (piekący ból), pęcherze (pęcherzyki), przebarwienie skóry (nadmierne zabarwienie lub odbarwienie), pokrzywka, oparzenie w miejscu aplikacji** - CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gDziałania niepożądane
* Dane z obserwacji po dopuszczeniu do obrotu **W większości przypadków „oparzenie w miejscu aplikacji” było powierzchowne, jednak zgłaszano przypadki oparzenia drugiego stopnia lub ciężkiego oparzenia. Jeżeli po naniesieniu tego produktu leczniczego wystąpi podrażnienie skóry, jego nasilenie jest na ogół łagodne lub umiarkowane, z objawami nietolerancji miejscowej (zaczerwienienie, suchość, łuszczenie, pieczenie i ból skóry (kłujący ból)), które osiągają największe nasilenie w pierwszym tygodniu stosowania, po czym ustępują samoistnie. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gPrzedawkowanie
4.9 Przedawkowanie Produkt leczniczy Silseq przeznaczony jest wyłącznie do stosowania raz na dobę na skórę. W razie przypadkowego połknięcia produktu leczniczego, należy zastosować odpowiednie leczenie objawowe.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego; retynoidy do stosowania miejscowego w trądziku, kod ATC: D10AD53 Mechanizm działania i właściwości farmakodynamiczne Produkt leczniczy Silseq zawiera dwie substancje czynne, których mechanizmy działania są różne, ale wzajemnie dopełniające się: - Adapalen : adapalen jest stabilną chemicznie pochodną kwasu naftalenokarboksylowego o aktywności podobnej do retynoidów. Badania nad profilem biochemicznym i farmakologicznym adapalenu wykazały, że adapalen działa w patofizjologii trądziku pospolitego: jest silnym modulatorem różnicowania i keratynizacji komórek oraz wykazuje właściwości przeciwzapalne. Mechanizm działania adapalenu polega na wiązaniu się ze swoistymi receptorami jądrowymi kwasu retynowego.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Aktualne dane wskazują, że miejscowe stosowanie adapalenu doprowadza do prawidłowego różnicowania komórek nabłonka mieszków włosowych, co prowadzi do zmniejszenia ilości mikrozaskórników. Adapalen hamuje chemotaktyczną (kierunkową) i chemokinetyczną (przypadkową) odpowiedź ludzkich leukocytów wielojądrzastych w modelach in vitro ; hamuje również przemianę kwasu arachidonowego do mediatorów stanu zapalnego. Badania in vitro wykazały zahamowanie czynników AP-1 oraz ekspresji receptorów Toll-podobnych 2. Profil ten sugeruje, że adapalen osłabia komórkową komponentę zapalną w trądziku. - Benzoilu nadtlenek : wykazano działanie przeciwdrobnoustrojowe benzoilu nadtlenku, szczególnie na bakterie Cutibacterium acnes , które występują w stanach patologicznych w mieszku łojowo- włosowym dotkniętym trądzikiem.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Mechanizm działania benzoilu nadtlenku wyjaśniano jego dużą lipofilnością, która umożliwia jego przenikanie przez naskórek do błon komórkowych bakterii i keratynocytów w mieszku łojowo-włosowym. Benzoilu nadtlenek uważa się za bardzo skuteczny lek przeciwbakteryjny o szerokim spektrum w leczeniu trądziku pospolitego. Wykazano, że wywiera działanie bakteriobójcze poprzez wytwarzanie wolnych rodników, które utleniają białka i inne niezbędne składniki komórkowe w ścianie bakterii. Minimalne stężenie hamujące benzoilu nadtlenku jest bakteriobójcze i wykazano jego działanie na antybiotykowrażliwe i antybiotykooporne szczepy C. acnes . Ponadto wykazano, iż benzoilu nadtlenek ma działanie złuszczające i keratolityczne. Skuteczność kliniczna złożonego produktu leczniczego zawierającego adapalen i benzoilu nadtlenek u pacjentów w wieku 12 lat i starszych Ocenę bezpieczeństwa i skuteczności żelu zawierającego adapalen i benzoilu nadtlenek stosowanego raz na dobę w leczeniu trądziku pospolitego przeprowadzono w dwóch trwających 12 tygodni, wieloośrodkowych, kontrolowanych badaniach klinicznych, podobnie zaprojektowanych, porównujących działanie złożonego produktu leczniczego zawierającego adapalen i benzoilu nadtlenku z działaniem poszczególnych zawartych w nim substancji czynnych oraz z działaniem podłoża żelu u pacjentów z trądzikiem.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Do badania 1 i 2 włączono łącznie 2185 pacjentów. Rozkład statystyczny pacjentów przedstawiał się następująco: 49% mężczyzn oraz 51% kobiet, w wieku 12 lat lub starszych (średni wiek: 18,3 roku, w przedziale 12-50 lat), prezentujących od 20 do 50 wykwitów zapalnych oraz 30 do 100 wykwitów niezapalnych w momencie rozpoczęcia badania. Pacjenci stosowali produkt leczniczy na skórę twarzy i innych okolic ciała dotkniętych trądzikiem, w miarę potrzeb, raz na dobę wieczorem. Kryteria skuteczności były następujące: Odsetek powodzeń zdefiniowany jako udział procentowy pacjentów zakwalifikowanych jako „wolny od trądziku” lub „prawie wolny od trądziku” w 12 tygodniu leczenia na podstawie wskaźnika IGA (ang. Investigator’s Global Assessment ). Zmiana i zmiana procentowa w 12 tygodniu leczenia w stosunku do stanu wyjściowego: liczby wykwitów zapalnych, liczby wykwitów niezapalnych, łącznej liczby wykwitów skórnych.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Wyniki skuteczności leczenia w każdym badaniu przedstawiono w Tabeli 1, natomiast połączone wyniki obu badań - w Tabeli 2. W obu badaniach produkt leczniczy będący żelem zawierającym adapalen i benzoilu nadtlenek okazał się bardziej skuteczny niż zawarte w nim substancje czynne oraz podłoże żelu. Łącznie, korzystne działanie netto (wynik działania substancji czynnych minus wynik działania podłoża) uzyskane po zastosowaniu produktu złożonego zawierającego adapalen i benzoilu nadtlenek było większe niż suma korzystnych działań netto uzyskanych po zastosowaniu pojedynczych substancji czynnych zawartych w produkcie leczniczym, wskazując jednocześnie na nasilenie działania terapeutycznego tych substancji w przypadku zastosowania ich w złożonym produkcie leczniczym w ustalonych dawkach. Wczesny wynik leczenia złożonym produktem leczniczym zawierającym adapalen i benzoilu nadtlenek był konsekwentnie obserwowany w badaniu 1 i 2 w odniesieniu do wykwitów zapalnych w pierwszym tygodniu leczenia.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Wykwity niezapalne (otwarte i zamknięte zaskórniki) wyraźnie reagowały na leczenie między pierwszym a czwartym tygodniem leczenia. Nie ustalono korzyści w odniesieniu do wykwitów guzkowych w trądziku. Tabela 2: Skuteczność kliniczna w dwóch badaniach porównawczych
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Badanie 1 Badanie 1Tydzień 12, dane z ostatniej obserwacji (LOCF); grupa objęta leczeniem(ITT Adapalen+ Benzoilu nadtlenek N=149 AdapalenN=148 Benzoilu nadtlenek N=149 Podłoże żeluN=71 Liczba powodzeń (odsetek pacjentów „bez”lub „prawie bez” trądziku) 41 (27,5%) 23 (15,5%) p=0,008 23 (15,4%) p=0,003 7 (9,9%)p=0,002 Mediana redukcji (% ) dotycząca: liczby wykwitów zapalnych 17 (62,8%) 13 (45,7%) p<0,001 13 (43,6%) p<0,001 11 (37,8%) p<0,001 liczby wykwitówniezapalnych 22 (51,2%) 17 (33,3%) p<0,001 16 (36,4%) p<0,001 14 (37,5%) p<0,001 - CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Łącznej liczby wykwitów 40 (51.0%) 29 (35,4%) p<0,001 27 (35,6%) p<0,001 26 (31,0%) p<0,001 Badanie 2 Badanie 2Tydzień 12, dane z ostatniej obserwacji (LOCF); grupa objęta leczeniem(ITT) Adapalen+ Benzoilu nadtlenekN=415 AdapalenN=420 Benzoilu nadtlenek N=415 Podłoże żeluN=418 Liczba powodzeń (odsetek pacjentów „bez”lub „prawie bez” trądziku) 125 (30,1%) 83 (19,8%) p<0,001 92 (22,2%) p=0,006 47 (11,3%) p<0,001 Mediana reduccji (% ) dotycząca: liczby wykwitów zapalnych 16 (62,1%) 14 (50,0%) p<0,001 16 (55,6%) p=0,068 10 (34,3%) p<0,001 liczby wykwitów niezapalnych 24 (53,8%) 22 (49,1%) p=0,048 20 (44,1%) p<0,001 14 (29,5%) p<0,001 łącznej liczby wykwitów 45 (56,3%) 39 (46,9%) p=0,002 38 (48,1%) p<0,001 24 (28,0%) p<0,001 - CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Tabela 3: Skuteczność kliniczna w skojarzonych badaniach porównawczych
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Adapalen+ Benzoilu nadtlenekN=564 AdapalenN=568 Benzoilu nadtlenek N=564 Podłoże żeluN=489 Liczba powodzeń (odsetek pacjentów „bez” lub „prawie bez”trądziku) 166 (29,4%) 106 (18,7%) 115 (20,4%) 54 (11,1%) Mediana redukcji (% )dotycząca: liczby wykwitów zapalnych 16,0 (62,1) 14,0 (50,0) 15,0(54,0) 10,0 (35,0) liczby wykwitów niezapalnych 23,5 (52,8) 21,0 (45,0) 19,0 (42,5) 14,0 (30,7) łącznej liczbywykwitów 41,0 (54,8) 34,0 (44,0) 33,0 (44,9) 23,0 (29,1) - CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Skuteczność kliniczna produktu lerczniczego złożonego zawierającego adapalen i benzoilu nadtlenek u dzieci w wieku od 9 do 11 lat Podczas badania klinicznego z udziałem dzieci, 285 dzieci w wieku od 9 do 11 lat (53% pacjentów miało 11 lat, 33% miało 10 lat oraz 14% miało 9 lat ), u których występował trądzik pospolity, którego początkowe nasilenie w skali IGA określono na poziomie 3 (umiarkowany) i z co najmniej 20 zmianami, lecz nie więcej niż 100 zmianami) (zapalnymi i (lub) niezapalnymi) na twarzy (w tym na nosie), było leczonych żelem zawierającym adapalen i benzoilu nadtlenek stosowanym raz na dobę przez 12 tygodni. Wyniki przeprowadzonego badania klinicznego, w którym badano skuteczność i bezpieczeństwo stosowania żelu zawierającego adapalen i benzoilu nadtlenek w leczeniu trądziku twarzy w tej specyficznej młodszej grupie wiekowej, są zgodne z wynikami innych kluczowych badań klinicznych z udziałem pacjentów w wieku od 12 lat i starszych, oraz potwierdzają jego znaczną skuteczność oraz dopuszczalny poziom tolerancji.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Trwałe, pierwsze efekty leczenia żelem zawierającym adapalen i benzoilu nadtlenek w porównaniu z leczeniem samym podłożem żelu, były obserwowane we wszystkich rodzajach zmian (zapalne, niezapalne, całkowita liczba) po 1 tygodniu leczenia i utrzymywały się do 12 tygodnia leczenia.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Badanie 3 Tydzień 12dane z ostatniej obserwacji (LOCF); grupa objęta leczeniem (ITT) Adapalen+ Benzoilu nadtlenekN=142 Podłoże żeluN=143 Liczba powodzeń (odsetek pacjentów„bez” lub „prawie bez” trądziku) 67 (47,2%) 22 (15,4%) Mediana redukcji (%) dotycząca: liczby wykwitów zapalnych 6 (62,5%) 1 (11,5%) liczby wykwitów niezapalnych 19 (67,6%) 5 (13,2%) łącznej liczby wykwitów 26 (66,9%) 8 (18,4%) - CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Właściwości farmakokinetyczne żelu zawierającego adapalen i benzoilu nadtlenek są podobne do profilu farmakokinetycznego żelu zawierającego wyłącznie adapalen 0,1%. W 30-dniowym badaniu farmakokinetycznym przeprowadzonym u pacjentów z trądzikiem, których leczono żelem o stałym składzie obu składników lub adapalenem 0,1% w warunkach maksymalnych (stosowanie 2 g żelu na dobę), stężenie adapalenu było niemierzalne w większości próbek osocza (granica czułości 0,1 ng/mL). Niewielkie stężenie adapalenu (C max pomiędzy 0,1 a 0,2 ng/mL) odnotowano w dwóch próbkach krwi pobranych od osób leczonych żelem zawierającym adapalen i benzopilu nadtlenek i w trzech próbkach od osób leczonych żelem zawierającym adapalen 0,1% w. Najwyższa wartość AUC 0-24h adapalenu oznaczona w grupie pacjentów leczonych złożonym produktem leczniczym wyniosła 1,99 ng.h/mL.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gWłaściwości farmakokinetyczne
Wyniki te są porównywalne z wynikami uzyskanymi we wcześniejszych badaniach klinicznych oceniających FK różnych produktów leczniczych adapalenu 0,1%, gdzie ogólnoustrojowa ekspozycja na adapalen była zawsze mała. Przenikanie benzoilu nadtlenku przez skórę jest niewielkie; po nałożeniu na skórę jest on całkowicie przekształcany w kwas benzoesowy, który jest szybko eliminowany.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, fototoksyczności oraz działania rakotwórczego nie ujawniają szczególnego zagrożenia dla człowieka. Przeprowadzono badania toksycznego działania adapalenu, podawanego doustnie i na skórę, na reprodukcję na szczurach i królikach. Wykazano działanie teratogenne przy wysokiej ekspozycji ogólnoustrojowej (dawki doustne od 25 mg/kg masy ciała/dobę). W przypadku mniejszej ekspozycji na produkt leczniczy (podanie na skórę dawki 6 mg/kg masy ciała/dobę) obserwowane były zmiany liczby żeber lub kręgów. Badania żelu zawierającego adapalen i benzoilu nadtlenek przeprowadzone na zwierzętach obejmowały badania tolerancji miejscowej oraz badania toksyczności dawki wielokrotnej podawanej na skórę u szczurów, psów i świń miniaturowych, trwające do 13 tygodni.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gPrzedkliniczne dane o bezpieczeństwie
Wykazano w nich miejscowe podrażnienie i możliwość uczulenia, co jest zgodne z oczekiwaniami dotyczącymi złożonych produktów leczniczych zawierających benzoilu nadtlenek. Ekspozycja ogólnoustrojowa na adapalen po wielokrotnym nanoszeniu na skórę zwierząt złożonego produktu leczniczego zawierającego adapalen jest bardzo mała, co jest zgodne z klinicznymi danymi farmakokinetycznymi. W skórze benzoilu nadtlenek jest szybko i całkowicie metabolizowany do kwasu benzoesowego, który po wchłonięciu do organizmu jest wydalany z moczem, z ograniczoną ekspozycją ogólnoustrojową. Toksyczność reprodukcyjna adapalenu była badana po podaniu doustnym u szczurów pod kątem wpływu na płodność. Nie stwierdzono niekorzystnego wpływu adapalenu na sprawność reprodukcyjną i płodność, przeżywalność miotu F1, wzrost i rozwój do odstawienia, a następnie wydajność reprodukcyjną po podawaniu doustnym adapalenu w dawkach do 20 mg/kg masy ciała/dobę.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gPrzedkliniczne dane o bezpieczeństwie
W badaniu toksycznego wpływu na reprodukcję i rozwój potomstwa przeprowadzonym na szczurach narażonych na dawek doustnych nadtlenku benzoilu do 1000 mg/kg/dobę (5 mL/kg), wykazano, że nadtlenek benzoilu nie ma działania teratogennego ani nie wpływa na funkcje reprodukcyjne w dawkach do 500 mg/kg masy ciała/dobę.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Glikol propylenowy E1520 Glicerol Sepineo P600 Poloksamer 124 Disodu edetynian Sodu dokuzynian Woda oczyszczona Sepineo P600 to współprzetworzona substancja pomocnicza składająca się z: kopolimeru akryloamidu i sodu akryloilodimetylotaurynianu (1:1), izoheksadekanu, polisorbatu 80, sorbitanu oleinianu. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 18 miesięcy Okres przydatności (po pierwszym otwarciu): 3 miesiące. 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 30 ° C. 6.5 Rodzaj i zawartość opakowania Białe tuby z tworzywa sztucznego HDPE/LLDPE, z białą szyjką z HDPE i uszczelką typu peel-off z aluminium, z białą zakrętką z PP. Jedna tuba 30 g Jedna tuba 45 g Jedna tuba 60 g Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań.
- CHPL leku Silseq, Żel, 1 mg/g + 25 mg/gDane farmaceutyczne
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Silseq, 3 mg/g + 25 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera: 3 mg adapalenu (0,3% w/w) oraz benzoilu nadtlenek z wodą, w ilości odpowiadającej 25 mg (2,5% w/w) benzoilu nadtlenku bezwodnego. Substancje pomocnicze o znanym działaniu : glikol propylenowy (E1520) 40 mg/g (4,0% w/w) oraz 3 mg/g (0,3% w.w) polisorbatów. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel. Jednorodny, nieprzezroczysty żel koloru białego do bardzo bladego żółtego.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Ten produkt leczniczy jest wskazany do stosowania w miejscowym leczeniu trądziku pospolitego ( Acne vulgaris ) z zaskórnikami, licznymi grudkami i krostkami (patrz punkty 4.2 i 5.1). Produkt leczniczy Silseq jest wskazany do stosowania u dorosłych i młodzieży w wieku 12 lat i starszych.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Żel należy nanosić na cały obszar skóry twarzy i tułowia zajęty przez trądzik raz na dobę, wieczorem, na czystą i suchą skórę. Czas trwania leczenia powinien być określony przez lekarza na podstawie stanu klinicznego pacjenta oraz odpowiedzi terapeutycznej na leczenie. Pierwsze objawy poprawy stanu klinicznego pojawiają się zazwyczaj między 1. a 4. tygodniem leczenia. Jeśli po 4-8 tygodniach nie zostanie zaobserwowana poprawa, należy ponownie rozważyć korzyści z kontynuacji leczenia. W obrocie dostępny jest również produkt leczniczy Silseq, 1 mg/g + 25mg/g Ten żel dostępny jest o niższej mocy (Silseq, 1 mg/g + 25mg/g, żel), którego użycie należy rozważyć u pacjentów z trądzikiem o umiarkowanym nasileniu (patrz punkt 5.1). W przypadku pokrycia całej twarzy licznymi grudkami i krostkami, obserwowano zwiększone korzyści kliniczne u osób leczonych żelem zawierającym adapalen 0,3% i benzoilu nadtlenek 2,5% w porównaniu z terapią referencyjną (żel adapalen i benzoilu nadtlenek, 1 mg/g + 25mg/g).
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gDawkowanie
Lekarze mogą dokonać wyboru pomiędzy dwoma stężeniami opierając się na aktualnym stanie klinicznym pacjenta oraz nasileniu objawów. Szczególne grupy pacjentów Osoby w podeszłym wieku Nie określono bezpieczeństwa stosowania i skuteczności żelu zawierającego adapalen i benzoilu nadtlenek u pacjentów w podeszłym wieku (65 lat i starszych). Zaburzenia czynności nerek i wątroby Nie badano stosowania żelu zawierającego adapalen i benzoilu nadtlenek u pacjentów z zaburzeniami czynności nerek i wątroby. Dzieci i młodzież Nie badano bezpieczeństwa stosowania i skuteczności tego produktu leczniczego u dzieci w wieku poniżej 12 lat. Sposób podawania Podanie wyłącznie na skórę. Nanosić cienką warstwę żelu na zajęte obszary skóry na twarzy i (lub) tułowiu raz na dobę, po myciu. Zaleca się nanieść ilość wielkości ziarna grochu na każdą okolicę twarzy (np. na czoło, brodę, każdy policzek), unikając oczu i warg (patrz punkt 4.4).
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gDawkowanie
Pacjentom należy zalecić, aby myli ręce po nałożeniu produktu leczniczego. Kosmetyki można nakładać po wyschnięciu produktu leczniczego. Jeśli wystąpi podrażnienie, pacjentowi należy zalecić stosowanie, odpowiednio do potrzeb, niekomedogennych produktów nawilżających, stosowanie produktu leczniczego z mniejszą częstością (np. co drugi dzień), tymczasowe wstrzymanie jego stosowania lub całkowite jego odstawienie.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek z substancji pomocniczych wymienionych w punkcie 6.1. Ciąża (patrz punkt 4.6) Kobiety planujące zajście w ciążę (patrz punkt 4.6).
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produktu leczniczego Silseq nie należy nanosić na uszkodzoną skórę ani skórę o naruszonej ciągłości (rozcięcia lub otarcia), z wypryskiem lub oparzeniem słonecznym. Należy unikać kontaktu produktu leczniczego Silseq z oczami, wargami, ustami, nozdrzami lub błonami śluzowymi. Jeśli produkt leczniczy dostanie się do oka, należy je natychmiast przemyć ciepłą wodą. Należy przerwać stosowanie tego produktu leczniczego w razie pojawienia się reakcji wskazującej na uczulenie na którykolwiek z jego składników. Należy unikać nadmiernej ekspozycji na promieniowanie słoneczne i promieniowanie UV. Należy unikać kontaktu produktu leczniczego Silseq z wszelkimi kolorowymi materiałami, w tym z włosami i farbowanymi tkaninami, ponieważ może to spowodować ich wybielenie i odbarwienie.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gSpecjalne środki ostrozności
Nie określono bezpieczeństwa i skuteczności stosowania produktu leczniczego zawierającego adapalen i benzoilu nadtlenek u pacjentów z ciężkim trądzikiem guzkowym lub głębokim trądzikiem guzkowo-torbielowatym. Ponieważ u pacjentów z ciężkim trądzikiem guzkowym lub guzkowo- torbielowatym istnieje zwiększone ryzyko wystąpienia trwałych blizn wtórnie do zmian trądzikowych, nie zaleca się stosowania produktu leczniczego Silseq u takich pacjentów w związku z ryzykiem uzyskania niezadowalającej reakcji na leczenie. Ten produkt leczniczy zawiera 40 mg glikolu propylenowego (E1520) w każdym gramie żelu, co odpowiada 4% w/w, który może spowodować podrażnienie skóry. Ten produkt zawiera polisorbaty, które mogą powodować reakcje alergiczne. Ten produkt leczniczy może zawierać do 2,5 mg kwasu benzoesowego w gramie żelu, produkt rozkładu benzoilu nadtlenku. Kwas benzoesowy może powodować miejscowe podrażnienie.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji. Na podstawie wcześniejszych doświadczeń z adapalenem i benzoilu nadtlenkiem można stwierdzić, że nie ma znanych interakcji z innymi produktami leczniczymi, które mogłyby być stosowane na skórę jednocześnie z żelem. Nie należy jednak stosować go jednocześnie z innymi retynoidami, benzoilu nadtlenkiem lub lekami o podobnym mechanizmie działania. Należy zachować ostrożność stosując kosmetyki złuszczające, podrażniające i wysuszające, ponieważ mogą one działać podrażniająco podczas jednoczesnego stosowania z tym produktem leczniczym. Wchłanianie adapalenu przez skórę u ludzi jest niewielkie (patrz punkt 5.2), dlatego też jest mało prawdopodobne wystąpienie interakcji z produktami leczniczymi o działaniu ogólnoustrojowym. Przenikanie benzoilu nadtlenku przez skórę jest niewielkie i jest on całkowicie metabolizowany do kwasu benzoesowego, który jest szybko eliminowany.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gInterakcje
Dlatego też zaistnienie potencjalnych interakcji kwasu benzoesowego z produktami leczniczymi o działaniu ogólnoustrojowym jest mało prawdopodobne.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Retynoidy stosowane doustnie mają związek z występowaniem wad wrodzonych. Retynoidy do stosowania miejscowego, jeśli są stosowane zgodnie z zaleceniami, ogólnie są uznawane za wywołujące małą ekspozycję układową, ze względu na minimalne wchłanianie przezskórne. Mogą jednak wystąpić indywidualne czynniki (np. uszkodzona bariera skórna, nadmierne stosowanie), które przyczynią się do zwiększenia ekspozycji ogólnoustrojowej. Ciąża Stosowanie produktu leczniczego zawierającego adapalen i benzoilu nadtlenek jest przeciwwskazany u kobiet w ciąży oraz u kobiet planujących zajście w ciążę (patrz punkt 4.3). Brak danych lub istnieją tylko ograniczone dane dotyczące miejscowego stosowania adapalenu u kobiet w ciąży. Badania na zwierzętach, w których podawano adapalen doustnie, wykazały szkodliwy wpływ na reprodukcję w przypadku stosowania dużych dawek o działaniu ogólnoustrojowym (patrz punkt 5.3).
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWpływ na płodność, ciążę i laktację
Doświadczenia kliniczne ze stosowanym miejscowo adapalenem i nadtlenkiem benzoilu u kobiet w ciąży są ograniczone. Jeśli ten produkt leczniczy jest stosowany w czasie ciąży, lub gdy pacjentka zajdzie w ciążę w trakcie jego stosowania, leczenie należy przerwać. Karmienie piersią Nie przeprowadzono badań dotyczących przenikania złożonego produktu leczniczego zawierającego adapalenu i benzoilu nadtlenku do mleka zwierząt oraz do mleka kobiecego po naniesieniu żelu na skórę. Dostępne dane farmakokinetyczne dotyczące szczurów wykazują przenikanie adalapenu do mleka po doustnym lub dożylnym podaniu adapalenu. Nie można wykluczyć ryzyka dla dziecka karmionego piersią. Decyzję o zaprzestaniu karmienia piersią lub o zaprzestaniu lub czasowym wstrzymaniu leczenia należy podjąć po uwzględnieniu korzyści z karmienia piersią dla dziecka oraz korzyści z leczenia dla matki.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWpływ na płodność, ciążę i laktację
W okresie karmienia piersią, aby uniknąć narażenia dziecka na kontakt z produktem leczniczym, nie należy nanosić żelu na klatkę piersiową. Płodność Nie przeprowadzono badań z udziałem ludzi dotyczących wpływu złożonego produktu leczniczego zawierającego adapalen i benzoilu nadtlenek w postaci żelu na płodność u ludzi. Nie stwierdzono jednak wpływu adapalenu i benzoilu nadtlenku na płodność w badaniach dotyczących ich wpływu na reprodukcję u szczurów (patrz punkt 5.3).
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy Silseq nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Można się spodziewać wystąpienia działań niepożądanych na skórze u około 10% pacjentów. Do związanych z leczeniem działań niepożądanych, które były na ogół uznane za powiązane ze stosowaniem żelu zawierającego adapalen i benzoilu nadtlenek, należą reakcje w miejscu aplikacji o nasileniu łagodnym lub umiarkowanym, takie jak podrażnienie skóry charakteryzujące się głównie łuszczeniem, suchością, rumieniem i paleniem/pieczeniem. Zaleca się zastosowanie kremu nawilżającego, tymczasowe zmniejszenie częstości aplikacji do nakładania produktu co drugi dzień lub tymczasowe przerwanie jego stosowania, aż będzie można powrócić do stosowania raz na dobę. Reakcje te występują na ogół wcześnie w trakcie leczenia i zazwyczaj z czasem stopniowo ustępują.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gDziałania niepożądane
Tabelaryczne zestawienie działań niepożądanych Działania niepożądane zostały podzielone zgodnie z klasyfikacją układów i narządów (SOC) MedDRA oraz częstością występowania według następującej konwencji: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10000 to <1/1000); bardzo rzadko (<1/10000), o nieznanej częstości występowania (niemożliwej do określenia na podstawie dostępnych danych) i zostały opisane po zastosowaniu żelu zawierającego adapalen i benzoilu nadtlenek w badaniu klinicznym fazy 3., w którym jako produkt kontrolny zastosowano podłoże produktu (patrz tabela 1). Tabela 1: Działania niepożądane
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gDziałania niepożądane
Klasyfikacja układów i narządów Częstość Działania niepożądane Zaburzenia oka Niezbyt często Rumień powieki Częstośćnieznana* Obrzęk powieki Zaburzenia układu immunologicznego Częstość nieznana* Reakcja anafilaktyczna Zaburzenia układu nerwowego Niezbyt często Parestezje (mrowienie w miejscuaplikacji) Zaburzenia oddechowe, klatki piersiowej i śródpiersiaZaburzenia skóry i tkanki podskórnej Częstość nieznana* Uczucie ucisku w gardle, duszność Zaburzenia skóry i tkanki podskórnej Często Atopowe zapalenie skóry, wyprysk, uczucie pieczenia skóry, podrażnienie skóry Niezbyt często Suchość skóry, świąd, wysypka Częstość nieznana* Alergiczne kontaktowe zapalenie skóry, obrzęk twarzy, ból skóry (piekący ból), pęcherze (pęcherzyki), przebarwienie skóry (nadmierne zabarwienie lub odbarwienie),pokrzywka, oparzenie w miejscu aplikacji** - CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gDziałania niepożądane
* Dane z obserwacji po dopuszczeniu do obrotu odnotowane w okresie począwszy od pierwszego na świecie wprowadzenia do obrotu produktu leczniczego zawierającego w postaci żelu zawierającego adalapen 0,1% i benzoilu nadtlenek 2,5%, pochodzące z populacji o nieznanej wielkości. **W większości przypadków „oparzenie w miejscu aplikacji” było powierzchowne, jednak notowano przypadki oparzenia drugiego stopnia lub ciężkiego oparzenia. Działania niepożądane dotyczące skóry były częstsze przy stosowaniu żelu zawierającego adapalen 3 mg/g i benzoilu nadtlenek 25 mg/g niż przy stosowaniu żelu o mniejszym stężeniu (adapalen 0,1% + benzoilu nadtlenek 2,5%) w porównaniu do podłoża. W głównych badaniach (patrz punkt 5.1) działania niepożądane związane ze skórą wystąpiły u 9,2% badanych w mieszanej populacji, leczonych żelem zawierającym adapalen 3 mg/g i benzoilu nadtlenek 25 mg/g oraz u 3,7% w populacji leczonej żelem zawierającym adapalen i benzoilu nadtlenek, w porównaniu z grupą, u której zastosowano podłoże żelu – 2,9%.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gDziałania niepożądane
Poza niektórymi z działań niepożądanych wymienionymi powyżej, w badaniach klinicznych zgłaszano również występowanie innych działań niepożądanych po zastosowaniu żelu zawierającego adapalen 0,1% i benzoilu nadtlenek 2,5%, wcześniej dopuszczonego do obrotu produktu złożonego zawierającego adapalen i benzoilu nadtlenek: Innymi działaniami niepożądanymi, które opisywano w badaniach klinicznych z zastosowaniem żelu zawierającego adapalen i benzoilu nadtlenek są kontaktowe zapalenie skóry z podrażnienia (występujące często) i oparzenia słoneczne (występujące niezbyt często). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gPrzedawkowanie
4.9 Przedawkowanie Produkt leczniczy Silseq przeznaczony jest wyłącznie do stosowania raz na dobę na skórę. Nałożenie nadmiernej ilości żelu może spowodować silne podrażnienie. W takim wypadku pacjent musi przerwać leczenie i poczekać, aż zmiany na skórze ustąpią. W razie przypadkowego połknięcia produktu leczniczego, należy zastosować odpowiednie leczenie objawowe.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania miejscowego; retynoidy do stosowania miejscowego w trądziku, kod ATC: D10AD53 Mechanizm działania i właściwości farmakodynamiczne Produkt leczniczy Silseq zawiera dwie substancje czynne, których mechanizmy działania są różne, ale wzajemnie dopełniające się: - Adapalen : adapalen jest stabilną chemicznie pochodną kwasu naftalenokarboksylowego o aktywności podobnej do retynoidów. Badania nad profilem biochemicznym i farmakologicznym adapalenu wykazały, że adapalen działa w patofizjologii trądziku pospolitego: jest silnym modulatorem różnicowania i keratynizacji komórek oraz wykazuje właściwości przeciwzapalne. Z mechanistycznego punktu widzenia adapalen wiąże się ze swoistymi receptorami jądrowymi kwasu retynowego.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Aktualne dane wskazują, że miejscowe stosowanie adapalenu doprowadza do prawidłowego różnicowania komórek mieszkowych nabłonka, co prowadzi do zmniejszenia ilości mikrozaskórników. Adapalen hamuje chemotaktyczną (kierunkową) i chemokinetyczną (przypadkową) odpowiedź ludzkich leukocytów wielojądrzastych w modelach in vitro ; hamuje również przemianę kwasu arachidonowego do mediatorów stanu zapalnego. Badania in vitro wykazały zahamowanie czynników AP-1 oraz ekspresji receptorów Toll-podobnych 2. Profil ten sugeruje, że adapalen osłabia komórkową komponentę zapalną w trądziku. - Benzoilu nadtlenek : wykazano działanie przeciwdrobnoustrojowe benzoilu nadtlenku, szczególnie na bakterie Cutibacterium acnes , które występują w stanach patologicznych w mieszku łojowo- włosowym dotkniętym trądzikiem. Mechanizm działania benzoilu nadtlenku wyjaśniano jego dużą lipofilnością, która umożliwia jego przenikanie przez naskórek do błon komórkowych bakterii i keratynocytów w mieszku łojowo-włosowym.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Benzoilu nadtlenek uważa się za bardzo skuteczny lek przeciwbakteryjny o szerokim spektrum w leczeniu trądziku pospolitego. Wykazano, że wywiera działanie bakteriobójcze poprzez wytwarzanie wolnych rodników, które utleniają białka i inne niezbędne składniki komórkowe w ścianie bakterii. Minimalne stężenie hamujące benzoilu nadtlenku jest bakteriobójcze i wykazano jego działanie na antybiotykowrażliwe i antybiotykooporne szczepy C. acnes . Ponadto wykazano, iż benzoilu nadtlenek ma działanie złuszczające i keratolityczne. Skuteczność kliniczna i bezpieczeństwo stosowania Ocenę bezpieczeństwa i skuteczności żelu zawierającego adapalen i benzoilu nadtlenek stosowanego raz na dobę w leczeniu trądziku pospolitego przeprowadzono w trwającym 12 tygodni, wieloośrodkowym, randomizowanym, prowadzonym metodą podwójnie ślepej próby, kontrolowanym badaniu klinicznym porównującym działanie żelu zawierającego adapalen i benzoilu nadtlenek (3 mg/g + 25 mg/g) z działaniem podłoża żelu, z udziałem 503 pacjentów z trądzikiem.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
W tym badaniu 217 pacjentów leczono żelem zawierającym adapalen w stężeniu 0,3% i benzoilu nadtlenek w stężeniu 2,5%, 217 pacjentów leczono żelem zawierającym adapalen w stężeniu 0,1% i benzoilu nadtlenek w stężeniu 2,5% i 69 pacjentów – podłożem żelu. Kryteria skuteczności były następujące: odsetek powodzeń zdefiniowany jako udział procentowy pacjentów zakwalifikowanych jako „wolny od trądziku” lub „prawie wolny od trądziku” po 12 tygodniach leczenia, z poprawą o co najmniej dwa stopnie wskaźnika ogólnej oceny przez lekarza (ang. Investigator’s Global Assessment, IGA ). Wskaźnik IGA „wolny od trądziku” odpowiadał czystej skórze, bez zmian zapalnych czy niezapalnych. Wskaźnik IGA „prawie wolny od trądziku” odpowiadał obecności niewielkiej liczby rozproszonych zaskórników i niewielkiej liczby małych grudek. Bezwzględna zmiana po 12 tygodniach leczenia w stosunku do stanu wyjściowego liczby zmian zapalnych i niezapalnych.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Podczas oceny początkowej u 50% pacjentów włączonych do badania nasilenie trądziku oceniano jako „umiarkowane” (IGA=3), a u 50% jako „ciężkie” (IGA=4). W całej badanej populacji dozwolona była obecność maksymalnie dwóch guzków. Jeśli chodzi o liczbę zmian, u pacjentów było średnio obecnych po 98 zmian łącznie (zakres: 51–226), przy czym średnia liczba zmian zapalnych wynosiła 38 (zakres: 20–99), a średnia liczba zmian niezapalnych wynosiła 60 (zakres: 30–149). Pacjenci byli w wieku od 12 do 57 lat (średni wiek: 19,6 lat), przy czym 273 (54,3%) pacjentów było w wieku od 12 do 17 lat. Do badania włączono podobną liczbę mężczyzn (47,7%) i kobiet (52,3%). W tym kluczowym badaniu u 55,2% pacjentów w grupie z chorobą o ciężkim nasileniu trądzik występował na tułowiu. Pacjenci stosowali produkt leczniczy na skórę twarzy i innych okolic ciała dotkniętych trądzikiem w miarę potrzeb, raz na dobę, wieczorem.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Przeprowadzono analizy statystyczne w celu porównania i zinterpretowania wyników badania w sposób stopniowany: porównanie żelu zawierającego adapalen 0,3% i benzoilu nadtlenek 2,5% z podłożem żelu w ogólnej populacji pacjentów z trądzikiem o nasileniu umiarkowanym i ciężkim (IGA=3 i IGA=4) porównanie żelu zawierającego adapalen 0,3% i benzoilu nadtlenek 2,5% z podłożem żelu w podgrupie pacjentów z trądzikiem o nasileniu ciężkim (IGA=4) Wyniki dotyczące skuteczności w połączonych populacjach pacjentów z trądzikiem o umiarkowanym i ciężkim nasileniu przedstawiono w tabeli 2. Tabela 2: Skuteczność kliniczna w całej populacji: pacjenci z trądzikiem pospolitym o umiarkowanym i ciężkim nasileniu po 12 tygodniach (połączone wskaźniki IGA = 3 i 4, MI, populacja ITT)
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Parametry skuteczności Adapalen+nadtlenek benzoilu 0,3%+2,5% żelN=217 Adapalen+nadtlenek benzoilu 0,1%+2,5% żelN=217a Podłoże żeluN=69 Odsetek powodzeń(poprawa o minimum 2 stopnie i wskaźnik IGA „wolny od trądziku” lub „prawie wolny od trądziku”) 33,7%b 27,3% 11,0% Zmiana liczby zmian zapalnych,średnie zmniejszenie bezwzględne (procentowe) 27,8b (68,7%) 26,5(69,3%) 13,2(39,2%) Zmiana liczby zmian niezapalnych,średnie zmniejszeniebezwzględne (procentowe) 40,5b (68,3%) 40,0(68,0%) 19,7(37,4%) - CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
MI= imputacja wielokrotna; ITT= populacja wyodrębniona zgodnie z zaplanowanym leczeniem (intent-to-treat) a) Badanie nie zostało zaplanowane i nie dawało możliwości do oficjalnego porównania skuteczności żelu zawierającego adapalen 0,3% i benzoilu nadtlenku 2,5% do niższej mocy żelu zawierającego adapalen 0,1% i benzoilu nadtlenku 2,5%, ani do porównania mniejszej mocy żelu zawierającego adapalen 0,1% i benzoilu nadtlenku 2,5% do podłoża żelu b) p<0,001 w porównaniu do podłoża W tabeli 3 przedstawiono wyniki podstawowych analiz skuteczności w populacji pacjentów z trądzikiem o ciężkim nasileniu. Tabela 3: Skuteczność kliniczna u pacjentów z trądzikiem pospolitym o ciężkim nasileniu (wskaźnik IGA = 4, MI, populacja ITT)
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Parametry skuteczności Adapalen+nadtlenek benzoilu 0,3%+2,5% żel N=106 Adapalen+ nadtlenek benzoilu 0,1%+2,5% żelN=112 Podłoże żeluN=34 Odsetek powodzeń(poprawa o minimum 2 stopnie i wskaźnik IGA „wolny od trądziku” lub „prawie wolny od trądziku”) 31,9%a 20,5% 11,8% Zmiana liczby zmian zapalnych,średnie zmniejszenie bezwzględne (procentowe) 37,3b (74,4%) 30,2(68%) 14,3(33,0%) Zmiana liczby zmian niezapalnych,średnie zmniejszenie bezwzględne (procentowe) 46,3b (72,1%) 43,9(68,4%) 17,8(30,8%) - CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
MI= imputacja wielokrotna; ITT= populacja wyodrębniona zgodnie z zaplanowanym leczeniem (intent-to-treat) a p=0,029 w porównaniu do podłoża b p<0,001 w porównaniu do podłoża Żel zawierający adapalen 1 mg/g i benzoilu nadtlenek 25 mg/g był uwzględniony w tym badaniu jako lek referencyjny. U pacjentów, u których trądzik oceniono jako mający „umiarkowane” nasilenie (wskaźnik IGA 3), żel zawierający adapalen 3 mg/g i benzoilu nadtlenek 25 mg/g nie wykazał przewagi w skuteczności w porównaniu do leczenia referencyjnego. W analizie obejmującej pacjentów z trądzikiem ocenionym jako mający „ciężkie” nasilenie (wskaźnik IGA 4) żel zawierający adapalen 3 mg/g i benzoilu nadtlenek 25 mg/g uzyskał wyższą skuteczność w porównaniu do podłoża żelu z różnicą w leczeniu 20,1% (31,9% w porównaniu do 11,8%; 95% CI: [6,0%, 34,2%], p=0,029), czego nie osiągnięto podczas leczenia produktem referencyjnym (różnica w leczeniu w porównaniu do podłoża – 8,8%).
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Działanie żelu zawierającego adapalen 3 mg/g i benzoilu nadtlenek 25 mg/g na blizny trądzikowe oceniono w badaniu OSCAR. Było to wieloośrodkowe, randomizowane, zaślepione dla badacza, kontrolowane podłożem badanie, z zastosowaniem porównania wewnątrzosobniczego (prawa połowa twarzy vs. lewa połowa twarzy), w którym uczestniczyli mężczyźni i kobiety w wieku od 16 do 35 lat (n = 67), z trądzikiem pospolitym twarzy o nasileniu umiarkowanym do ciężkiego, z wynoszącą 40 średnią liczbą zmian trądzikowych (18 zmian zapalnych, 22 zmiany niezapalne) po obu stronach twarzy. U zdecydowanej większości pacjentów (93%), występował trądzik o ogólnie umiarkowanym nasileniu. Zmiany trądzikowe były równomiernie rozłożone po obu stronach twarzy, nasilenie występowania blizn trądzikowych obejmowało po 12 blizn po każdej stronie twarzy, z przewagą blizn o wymiarach od 2 do 4 mm.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
U większości pacjentów (63%) występowały blizny o ogólnie łagodnym nasileniu, a u około 30% pacjentów występowały blizny o nasileniu umiarkowanym. Do badania włączono mężczyzn i kobiety w wieku od 16 do 35 lat włącznie, z fototypem skóry typu od I do IV według skali Fitzpatricka. Populacja włączona do badania składała się głównie z kobiet (65,7%), większość pacjentów stanowiły osoby rasy białej (86,6%), pozostałą część stanowili Azjaci (13,4%), pochodzenie etniczne nie zostało uwzględnione. Najczęściej występującymi fototypami skóry był typ II (47,8%) i typ III (34,3%), a pozostałą część stanowił typ IV (13,4%) i typ I (4,5%). Wszyscy pacjenci włączeni do badania byli randomizowani do grupy stosującej żel zawierający adapalen 3 mg/g i benzoilu nadtlenek 25 mg/g na jednej połowie twarzy i podłoże żelu na drugiej połowie twarzy, raz na dobę, wieczorem, przez okres 24 tygodni.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Pierwszorzędowym punktem końcowym oceny skuteczności była liczba zanikowych blizn trądzikowych, występujących na jednej połowie twarzy w 24 tygodniu badania. Analiza pierwszorzędowego punktu końcowego wykazała, że stosowanie terapii lekowej wiązało się ze zmniejszeniem całkowitej liczby blizn trądzikowych (patrz Tabela 4). Tabela 4: Całkowita liczba blizn trądzikowych (ITT/LOCF)
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Całkowita liczba blizn trądzikowych (ITT/LOCF) Adapalen+nadtlenek benzoilu 0,3%+2,5% żel Podłoże żelu Różnica w leczeniu Wynik statystyczny Średnia ± SD 9,5 ± 5,5 13,3 ± 7,4 -3,7 ± 4,4 p<0,0001 Mediana 8,0 13,0 -3,0 (Q1,Q3) (6,0, 12,0) (8,0, 19,0) (-7,0, 0,0) (Min,Max) (0, 27) (0, 36) (-16, 3) - CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
Żel zawierający adapalen 3 mg/g i benzoilu nadtlenek 25 mg/g powodował przede wszystkim redukcję blizn o wielkości od 2 do 4 mm (średnia dla żelu zawierającego adapalen 3 mg/g i benzoilu nadtlenek 25 mg/g 9,0 ± 5,4; średnia dla podłoża żelu 12,1 ± 7,0; średnia różnica w leczeniu względem podłoża żelu -3,1 ± 4,1), podczas gdy redukcja blizn o wielkości > 4 mm była mniejsza (średnia dla żelu zawierającego adapalen 3 mg/g i benzoilu nadtlenek 25 mg/g 0,6 ± 0,8; średnia dla podłoża żelu 1,2 ± 1,9; średnia różnica w leczeniu względem podłoża żelu -0,6 ± 1,5). Wykres 1 przedstawia zmianę procentową całkowitej liczby blizn zanikowych obserwowaną podczas oceny połówek twarzy na których stosowano żel i połówek twarzy na których stosowano podłoże żelu. Wykres 1 Procentowa zmiana całkowitej liczby zanikowych blizn trądzikowych w stosunku do stanu wyjściowego podczas wizyt w kolejnych tygodniach leczenia (ITT/LOCF)
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakodynamiczne
* nominalna wartość p, nieskorygowana dla wielokrotnych testów
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Przeprowadzono badanie farmakokinetyki obejmujące podawanie żelu zawierającego adapalen 3 mg/g i benzoilu nadtlenek 25 mg/g 26 pacjentom w wieku dorosłym i młodzieńczym (od 12 do 33 lat) z ciężkim trądzikiem pospolitym. U pacjentów zastosowano leczenie polegające na aplikacji produktu leczniczego na wszystkie potencjalnie zajęte okolice w okresie 4 tygodni, w średniej dawce 2,3 grama/dobę (zakres: 1,6-3,1 grama/dobę) żelu Epiduo Forte nakładanego w postaci cienkiej warstwy na twarz, barki, górną część klatki piersiowej i górną część pleców. Po 4 tygodniach leczenia u 16 pacjentów (62%) stwierdzono mierzalne stężenie adapalenu w osoczu powyżej granicy oznaczalności (wartość LOQ 0,1 ng/mL), ze średnią wartością C max 0,16 ± 0,08 ng/ml i średnią wartością AUC 0-24 h 2,49 ± 1,21 ng.h/mL. U pacjentów z największą ekspozycją wartości C max i AUC 0-24 h adapalenu wynosiły odpowiednio 0,35 ng/mL i 6,41 ng.h/mL.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gWłaściwości farmakokinetyczne
W badaniach farmakokinetycznych przeprowadzonych z żelami (adapalen 1 mg/g i benzoilu nadtlenek + 25 mg/g oraz adapalen 3 mg/g i benzoilu nadtlenek 25 mg/g) wykazano, że benzoilu nadtlenek nie wpływa na przezskórne wchłanianie adapalenu. Przenikanie benzoilu nadtlenku przez skórę jest niewielkie; po nałożeniu na skórę jest on całkowicie przekształcany w kwas benzoesowy, który jest szybko eliminowany.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz fototoksyczności, nie ujawniają szczególnego zagrożenia dla człowieka. Przeprowadzono badania toksycznego działania adapalenu, podawanego doustnie i na skórę, na reprodukcję na szczurach i królikach. Wykazano działanie teratogenne przy wysokiej ekspozycji ogólnoustrojowej (dawki doustne od 25 mg/kg masy ciała/dobę). W przypadku mniejszej ekspozycji na produkt leczniczy (podanie na skórę dawki 6 mg/kg masy ciała/dobę) obserwowane były zmiany liczby żeber lub kręgów. Badania żelu zawierającego adapalen i benzoilu nadtlenek przeprowadzone na zwierzętach obejmują badania tolerancji miejscowej oraz badania toksyczności dawki wielokrotnej podawanej na skórę u szczurów, psów i (lub) świń miniaturowych, trwające do 13 tygodni.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gPrzedkliniczne dane o bezpieczeństwie
Wykazano w nich miejscowe podrażnienie i możliwość uczulenia, co jest zgodne z oczekiwaniami dotyczącymi złożonych produktów leczniczych zawierających benzoilu nadtlenek. Ekspozycja ogólnoustrojowa na adapalen po wielokrotnym nanoszeniu na skórę zwierząt produktu leczniczego złożonego zawierającego adapalen jest bardzo mała, co jest zgodne z klinicznymi danymi farmakokinetycznymi. W skórze benzoilu nadtlenek jest szybko i całkowicie metabolizowany do kwasu benzoesowego, który po wchłonięciu do organizmu jest wydalany z moczem, przy ograniczonej ekspozycji ogólnoustrojowej. Toksyczność reprodukcyjna adapalenu była badana po podaniu doustnym u szczurów pod kątem wpływu na płodność. Nie stwierdzono niekorzystnego wpływu na rozrodczość i płodność, przeżywalność miotu F1, wzrost i rozwój do odstawienia, a następnie wydajność reprodukcyjną po podaniu doustnym adapalenu w dawkach do 20 mg/kg masy ciała/dobę.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gPrzedkliniczne dane o bezpieczeństwie
Badanie toksyczności reprodukcyjnej i rozwojowej przeprowadzone na szczurach z zastosowaniem dawek doustnych nadtlenku benzoilu w wysokości do 1000 mg/kg masy ciała/dobę (5 mL/kg), wykazało, że nadtlenek benzoilu nie wywołał teratogenności ani wpływu na funkcje rozrodcze w dawkach do 500 mg/kg masy ciała/dobę. Ocena ryzyka dla środowiska (ERA) Badania oceniające ryzyko dla środowiska wykazały, że adapalen ma potencjalnie bardzo trwały i toksyczny wpływ na środowisko (patrz punkt 6.6). Badania oceniające ryzyko dla środowiska wykazały, że adapalen może stwarzać ryzyko dla środowiska wodnego.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Glikol propylenowy E1520 Glicerol Sepineo P600 Poloksamer 124 Disodu edetynian Sodu dokuzynian Woda oczyszczona Sepineo P600 to współprzetworzona substancja pomocnicza składająca się z: Kopolimeru akrylamidu i sodu akryloyldimetylotaurynianu (1:1), izoheksadekanu, polisorbatu 80, sorbitanu oleinianu. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 18 miesięcy Okres przydatności (po pierwszym otwarciu): 3 miesiące. 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 30°C. 6.5 Rodzaj i zawartość opakowania Białe tuby z tworzywa sztucznego HDPE/LLDPE, z białą szyjką z HDPE i uszczelką typu peel-off z aluminium, z białą zakrętką z PP. Jedna tuba 15 g Jedna tuba 30 g Jedna tuba 45 g Jedna tuba 60 g Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań.
- CHPL leku Silseq, Żel, 3 mg/g + 25 mg/gDane farmaceutyczne
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Aknenormin, 10 mg, kapsułki miękkie Aknenormin, 20 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Aknenormin 10 mg: 1 kapsułka miękka zawiera 10 mg izotretynoiny (Isotretinoinum). Aknenormin 20 mg: 1 kapsułka miękka zawiera 20 mg izotretynoiny (Isotretinoinum). Substancje pomocnicze o znanym działaniu: Aknenormin 10 mg kapsułki zawiera 132,8 mg oleju sojowego, rafinowanego; 7,7 mg oleju sojowego, częściowo uwodornionego; 5,3 mg sorbitolu oraz 0,0026 mg czerwieni koszenilowej (E124). Aknenormin 20 mg kapsułki zawiera 265,6 mg oleju sojowego, rafinowanego; 15,4 mg oleju sojowego, częściowo uwodornionego; 17,0 mg sorbitolu oraz 0,34 mg czerwieni koszenilowej (E124). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Kapsułki miękkie Wygląd kapsułek: Aknenormin 10 mg: jasnofioletowe podłużne miękkie kapsułki, wypełnione żółto-pomarańczowym nieprzezroczystym lepkim płynem.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
Aknenormin 20 mg: kasztanowo-brązowe podłużne miękkie kapsułki, wypełnione żółto-pomarańczowym nieprzezroczystym lepkim płynem.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgWskazania do stosowania
4.1. Wskazania do stosowania Ciężkie postaci trądziku (jak trądzik guzkowy, trądzik skupiony lub trądzik z ryzykiem powstawania trwałych blizn) oporne na odpowiednio przeprowadzone standardowe leczenie działającymi ogólnie lekami przeciwbakteryjnymi i lekami stosowanymi miejscowo.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDawkowanie
4.2 Dawkowanie i sposób podawania Izotretynoinę może przepisywać jedynie lekarz mający doświadczenie w stosowaniu działających ogólnie retynoidów w przebiegu ciężkich postaci trądziku i pełną wiedzę o ryzyku związanym ze stosowaniem izotretynoiny oraz wymogach dotyczących monitorowania pacjenta podczas stosowania produktu leczniczego. Leczenie musi się odbywać pod kontrolą lekarza spełniającego te warunki. Kapsułki należy przyjmować doustnie raz lub dwa razy na dobę, z pokarmem. Dorośli, w tym młodzież i osoby w wieku podeszłym: Leczenie izotretynoiną należy rozpoczynać od dawki 0,5 mg/kg masy ciała na dobę. Odpowiedź na leczenie izotretynoiną oraz niektóre działania niepożądane zależą od dawki i różnią się u poszczególnych pacjentów. Z tego względu podczas terapii konieczne jest indywidualne dostosowanie dawki produktu leczniczego. Dla większości pacjentów odpowiednia dawka mieści się w zakresie od 0,5 mg/kg mc. do 1 mg/kg mc. na dobę.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDawkowanie
Długotrwała remisja oraz odsetek nawrotów choroby zależą bardziej od całkowitej dawki niż od czasu leczenia lub dawki dobowej. Wykazano, że przekroczenie dawki skumulowanej produktu leczniczego 120 – 150 mg/kg mc. nie przynosi istotnych dodatkowych korzyści. Czas trwania leczenia zależy od indywidualnej dawki dobowej. Zwykle leczenie przez 16 do 24 tygodni jest wystarczające do uzyskania remisji. U większości pacjentów objawy trądziku ustępują całkowicie po jednym cyklu leczenia. W razie stwierdzenia nawrotu można rozważyć ponowny cykl leczenia izotretynoiną z zastosowaniem takiej samej dawki dobowej oraz skumulowanej produktu leczniczego. Ze względu na to, że dalsze ustępowanie objawów trądziku może wystąpić w ciągu 8 tygodni po zakończeniu leczenia, nie należy brać pod uwagę ponownego cyklu leczenia przed upływem tego czasu. Stosowanie u pacjentów z ciężką niewydolnością nerek: U pacjentów z ciężką niewydolnością nerek leczenie należy rozpoczynać od mniejszej dawki (np.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDawkowanie
10 mg na dobę). Dawkę należy następnie zwiększać do 1 mg/kg mc. na dobę lub do maksymalnej dawki tolerowanej przez pacjenta (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Dzieci i młodzież: Izotretynoina nie jest wskazana w leczeniu trądziku przed okresem dojrzewania i nie zaleca się jej stosowania u dzieci w wieku poniżej 12 lat. Stosowanie u pacjentów nietolerujących produktu leczniczego: U pacjentów z ciężką nietolerancją zalecanej dawki produktu leczniczego można kontynuować leczenie mniejszą dawką leku. Wiąże się to z dłuższym czasem leczenia oraz większym ryzykiem nawrotu choroby. Aby uzyskać możliwie największą skuteczność leczenia, należy kontynuować leczenie największą dawką tolerowaną przez pacjenta.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na substancję czynną, czerwień koszenilową (E124), orzeszki ziemne lub soję lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Izotretynoina jest przeciwwskazana u kobiet w ciąży i karmiących piersią (patrz punkt 4.6 Wpływ na płodność, ciążę i laktację). Izotretynoina jest przeciwwskazana u kobiet mogących zajść w ciążę, o ile nie są spełnione wszystkie warunki Programu Zapobiegania Ciąży (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Izotretynoina jest również przeciwwskazana u pacjentów: z niewydolnością wątroby, ze znacznie zwiększonymi stężeniami lipidów we krwi, z hiperwitaminozą A, z nadwrażliwością na izotretynoinę, olej sojowy, soję, orzeszki ziemne lub którąkolwiek substancję pomocniczą, jednocześnie przyjmujących tetracykliny (patrz punkt 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji).
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Działanie teratogenne: Aknenormin 10 mg oraz Aknenormin 20 mg są lekami o silnym działaniu teratogennym u ludzi powodującym często występujące ciężkie i zagrażające życiu wady wrodzone. Aknenormin 10 mg oraz Aknenormin 20 mg są bezwzględnie przeciwwskazane do stosowania u: kobiet w ciąży kobiet w wieku rozrodczym, chyba że spełnione zostały wszystkie poniższe warunki Programu Zapobiegania Ciąży. Program Zapobiegania Ciąży Ten produkt leczniczy ma działanie TERATOGENNE. Izotretynoina jest przeciwwskazana u kobiet w wieku rozrodczym, chyba że spełnione zostały wszystkie poniższe warunki Programu Zapobiegania Ciąży: U pacjentki występuje ciężka postać trądziku (jak trądzik guzkowy, trądzik skupiony lub trądzik z ryzykiem powstawania trwałych blizn) oporna na odpowiednio przeprowadzone standardowe leczenie działającymi ogólnie lekami przeciwbakteryjnymi i lekami stosowanymi miejscowo (patrz punkt 4.1 „Wskazania do stosowania”).
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Możliwość zajścia w ciążę musi zostać oceniona dla wszystkich pacjentek. Pacjentka rozumie ryzyko działań teratogennych. Pacjentka rozumie konieczność ścisłej comiesięcznej obserwacji. Pacjentka rozumie i akceptuje konieczność stosowania skutecznej, nieprzerywanej antykoncepcji przez 1 miesiąc przed rozpoczęciem leczenia, w trakcie trwania leczenia i przez 1 miesiąc po zakończeniu leczenia. Należy stosować co najmniej jedną wysoce skuteczną (tzn. niezależną od użytkownika) metodę antykoncepcji, lub dwie uzupełniające się metody antykoncepcji zależne od użytkownika. Przy wyborze metody antykoncepcji należy w każdym przypadku wziąć pod uwagę indywidualne uwarunkowania, z uwzględnieniem ich omówienia z pacjentką, tak aby zapewnić jej zaangażowanie i stosowanie się do zaleceń dotyczących wybranych środków. Nawet jeśli u pacjentki nie występuje miesiączka, pacjentka musi przestrzegać wszystkich zaleceń w zakresie skutecznej antykoncepcji.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Pacjentka jest poinformowana o potencjalnych konsekwencjach zajścia w ciążę, jest ich świadoma oraz rozumieć konieczność szybkiej konsultacji z lekarzem w razie ryzyka zajścia w ciążę, lub podejrzenia, że jest w ciąży. Pacjentka rozumie i akceptuje konieczność regularnego poddawania się testom ciążowym przed leczeniem, w trakcie leczenia - optymalnie co miesiąc - oraz po 1 miesiącu od zakończenia leczenia. Pacjentka poświadcza, że zrozumiała zagrożenia i niezbędne środki ostrożności związane ze stosowaniem izotretynoiny. Warunki te dotyczą również kobiet, które nie są obecnie aktywne seksualnie, chyba że lekarz wystawiający receptę na ten produkt leczniczy uzna, iż istnieją jednoznaczne powody wskazujące, że nie ma ryzyka zajścia w ciążę. Lekarz wystawiający receptę na ten produkt leczniczy powinien upewnić się, że: Pacjentka przestrzega wymagań dotyczących zapobiegania ciąży podanych powyżej i potwierdziła, że zrozumiała te zagadnienia.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Pacjentka potwierdziła zapoznanie się z wyżej wymienionymi wymaganiami. Pacjentka rozumie, że musi konsekwentnie i prawidłowo stosować co najmniej jedną wysoce skuteczną (tzn. niezależną od użytkownika) metodę antykoncepcji, lub dwie uzupełniające się metody antykoncepcji zależne od użytkownika przez co najmniej 1 miesiąc przed rozpoczęciem leczenia, w trakcie trwania leczenia i przez 1 miesiąc po zakończeniu leczenia. Ujemny wynik testu ciążowego uzyskano przed leczeniem, w trakcie leczenia i po 1 miesiącu od zakończenia leczenia. Należy udokumentować terminy i wyniki testów ciążowych. W przypadku zajścia w ciążę w trakcie leczenia izotretynoiną, leczenie musi być przerwane a pacjentkę należy skierować na badanie i po poradę do odpowiedniego lekarza doświadczonego w badaniu teratogenności. Jeżeli kobieta zajdzie w ciążę po zakończeniu leczenia, zachodzi wysokie ryzyko ciężkich i poważnych wad rozwojowych płodu.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Ryzyko to utrzymuje się do czasu całkowitej eliminacji produktu, czyli do jednego miesiąca po zakończeniu leczenia. Antykoncepcja Pacjentkom należy przekazać wyczerpujące informacje na temat zapobiegania ciąży i skierować je w celu uzyskania porady w sprawie antykoncepcji, jeśli nie stosują one skutecznej antykoncepcji. Jeśli lekarz wystawiający receptę na ten produkt leczniczy nie ma kompetencji, aby udzielić takich informacji, pacjentkę należy skierować do odpowiedniego lekarza specjalisty. Jako niezbędne minimum, pacjentki, które mogą zajść w ciążę muszą stosować co najmniej jedną wysoce skuteczną (tzn. niezależną od użytkownika) metodę antykoncepcji, lub dwie uzupełniające się metody antykoncepcji zależne od użytkownika przez co najmniej jeden miesiąc przed rozpoczęciem leczenia, w trakcie trwania leczenia i przez 1 miesiąc po zakończeniu leczenia izotretynoiną, nawet w przypadku całkowitego braku miesiączek.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Przy wyborze metody antykoncepcji należy w każdym przypadku wziąć pod uwagę indywidualne uwarunkowania, z uwzględnieniem ich omówienia z pacjentką, tak aby zapewnić jej zaangażowanie i stosowanie się do zaleceń dotyczących wybranych środków. Testy ciążowe Zgodnie z miejscową praktyką, zalecane jest przeprowadzenie nadzorowanych przez personel medyczny testów ciążowych o minimalnej czułości 25 mlU/mL w sposób opisany poniżej. Przed rozpoczęciem terapii: Co najmniej na jeden miesiąc po rozpoczęciu stosowania antykoncepcji oraz krótko (optymalnie na kilka dni) przed pierwszym przepisaniem produktu leczniczego, u pacjentki powinien być przeprowadzony test ciążowy nadzorowany przez personel medyczny. Test ten powinien wykazać, że pacjentka nie jest w ciąży w momencie rozpoczęcia leczenia izotretynoiną. Wizyty kontrolne Wizyty kontrolne należy przeprowadzać w regularnych odstępach czasu, optymalnie co miesiąc.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Należy ustalić konieczność przeprowadzenia wielokrotnych comiesięcznych testów ciążowych zgodnie z lokalnymi praktykami, biorąc pod uwagę między innymi aktywność seksualną pacjentki, ostatnie cykle miesiączkowe (zaburzenia miesiączkowania, nieregularne miesiączkowanie lub całkowity brak miesiączek) oraz metodę antykoncepcji. Jeśli jest to wskazane, kontrolne testy ciążowe należy przeprowadzić w dniu wizyty, podczas której lekarz przepisze produkt leczniczy lub w ciągu 3 dni przed tą wizytą. Zakończenie leczenia Miesiąc po zakończeniu leczenia, u kobiet należy wykonać końcowy test ciążowy. Ograniczenia dotyczące przepisywania i wydawania produktu leczniczego Kobietom w wieku rozrodczym należy optymalnie przepisywać Aknenormin 10 mg oraz Aknenormin 20 mg w ilości ograniczonej do 30 dni leczenia, w celu zapewnienia regularnego odbywania wizyt kontrolnych, w tym testów ciążowych i monitorowania.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Najlepiej, aby wykonanie testu ciążowego, wypisanie recepty i zrealizowanie recepty na Aknenormin 10 mg lub Aknenormin 20 nastąpiło tego samego dnia. Comiesięczne wizyty kontrolne pozwalają zagwarantować regularne przeprowadzanie testów ciążowych i monitorowanie oraz upewnienie się, że pacjentka nie jest w ciąży przed otrzymaniem kolejnego cyklu kuracji. Pacjenci płci męskiej Dostępne dane sugerują, że poziom ekspozycji matki na produkt leczniczy Aknenormin 10 mg oraz Aknenormin 20 zawarty w spermie pacjentów leczonych produktami leczniczymi Aknenormin 10 mg lub Aknenormin 20 nie jest wystarczająco wysoki, aby był związany z teratogennym działaniem. Pacjenci płci męskiej powinni pamiętać, że nie wolno im dzielić się produktem leczniczym z żadną inną osobą, a szczególnie z kobietami. Dodatkowe środki ostrożności Pacjentów należy pouczyć, aby nigdy nie przekazywali tego produktu leczniczego innej osobie i aby zwrócili wszystkie niezużyte kapsułki farmaceucie po zakończeniu leczenia.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Pacjenci nie powinni być dawcami krwi w trakcie terapii i przez 1 miesiąc po zaprzestaniu przyjmowania izotretynoiny, z powodu potencjalnego zagrożenia dla płodu u pacjentki w ciąży otrzymującej transfuzję krwi. Materiały edukacyjne Aby pomóc w zapobieganiu ekspozycji płodu na działanie izotretynoiny lekarzom wypisującym receptę, farmaceutom i pacjentom, przedstawiciel podmiotu odpowiedzialnego udostępni materiały edukacyjne w celu zwiększenia skuteczności ostrzeżeń o teratogenności izotretynoiny, udzielenia porad na temat antykoncepcji przed rozpoczęciem terapii i poinformowania o konieczności przeprowadzania testów ciążowych. Wszyscy pacjenci, zarówno mężczyźni, jak i kobiety, powinni otrzymać od lekarza wyczerpujące informacje na temat ryzyka teratogennego i rygorystycznych metod zapobiegania ciąży, które podano w Programie Zapobiegania Ciąży.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Zaburzenia psychiczne U pacjentów leczonych izotretynoiną (patrz punkt 4.8), zgłaszane były: depresja, nasilenie się depresji, lęk, skłonność do agresji, wahania nastroju, objawy psychotyczne oraz, bardzo rzadko, myśli samobójcze, próby samobójcze i samobójstwa (patrz punkt 4.8). Szczególna ostrożność konieczna jest u pacjentów z depresją w wywiadzie. Wszyscy pacjenci powinni być monitorowani pod względem objawów depresji i w razie konieczności, kierowani na odpowiednie leczenie. Jednak przerwanie podawania izotretynoiny może nie być wystarczające, aby złagodzić te objawy, dlatego konieczna może być dalsza ocena psychiatryczna lub psychologiczna. Uprzedzenie rodziny lub przyjaciół o możliwości wystąpienia takich objawów, może być pomocne w rozpoznaniu pogorszenia się stanu zdrowia psychicznego. Zaburzenia skóry i tkanki podskórnej Na początku terapii niekiedy obserwuje się zaostrzenie objawów trądziku. Zwykle ustępuje ono, pomimo kontynuowania leczenia, w ciągu 7 – 10 dni.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Przeważnie nie ma potrzeby zmiany dawkowania izotretynoiny. Należy unikać ekspozycji na intensywne promieniowanie słoneczne lub promieniowanie ultrafioletowe. Kiedy nie można tego uniknąć, należy stosować produkty zawierające filtry UV o dużej wartości współczynnika ochrony przed światłem, co najmniej o wartości SPF 15. U pacjentów przyjmujących izotretynoinę oraz w okresie do 5-6 miesięcy po zakończeniu terapii należy unikać agresywnej chemicznej dermabrazji oraz leczenia skóry laserem. Występuje bowiem wówczas ryzyko powstawania blizn o nietypowym umiejscowieniu oraz (rzadziej) pozapalnych przebarwień lub odbarwień w leczonych miejscach skóry. Co najmniej do 6 miesięcy po zakończeniu leczenia izotretynoiną należy zaniechać depilacji włosów z użyciem wosku, z uwagi na ryzyko zerwania naskórka.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Należy unikać jednoczesnego stosowania izotretynoiny z podawanymi miejscowo lekami keratolitycznymi lub produktami złuszczającymi stosowanymi w leczeniu trądziku, ponieważ mogłoby wystąpić nadmierne podrażnienie skóry. W okresie po wprowadzeniu produktu do obrotu zgłaszano przypadki ciężkich reakcji skórnych (np. rumień wielopostaciowy, zespół Stevensa-Johnsona i martwicę toksyczno-rozpływną naskórka) związanych ze stosowaniem izotretynoiny. Ze względu na to, że zdarzenia te mogą być trudne do odróżnienia od innych reakcji skórnych (patrz punkt 4.8 Działania niepożądane Należy poinformować pacjentów o możliwych objawach przedmiotowych i podmiotowych oraz prowadzić szczegółową obserwację pacjentów w kierunku ciężkich reakcji skórnych. W przypadku podejrzenia ciężkiej reakcji skórnej, należy przerwać leczenie izotretynoiną.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Należy poradzić pacjentom, żeby od początku leczenia izotretynoiną stosowali do pielęgnacji skóry maść nawilżającą lub krem nawilżający oraz balsam do ust, ponieważ izotretynoina powoduje wysuszenie skóry i ust. Choroby oczu Zespół suchego oka, zmętnienie rogówki, niedowidzenie w ciemnościach i zapalenie rogówki na ogół ustępują po przerwaniu stosowania izotretynoiny. Notowano przypadki suchości oka, która nie ustępowała po zakończeniu leczenia. Zespół suchego oka można łagodzić stosując maść nawilżającą do oczu albo produkt zastępujący łzy. Może wystąpić nietolerancja na soczewki kontaktowe, co oznacza, że podczas leczenia pacjent musi nosić okulary. Opisywano ponadto niedowidzenie w ciemnościach, które u niektórych pacjentów pojawiało się nagle (patrz punkt 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługę maszyn). Pacjentów z zaburzeniami widzenia należy skierować do okulisty. Może być konieczne przerwanie stosowania izotretynoiny.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Opisywano występowanie bólów mięśni, bólów stawów oraz zwiększenie aktywności kinazy kreatynowej w surowicy krwi u pacjentów przyjmujących izotretynoinę, szczególnie u osób wykonujących intensywny wysiłek fizyczny. Znaczny wzrost wartości CPK może być objawem rabdomiolizy (patrz punkt 4.8 Działania niepożądane). Ponieważ produkt leczniczy Aknenormin 10 mg oraz Aknenormin 20 mg wydaje się działać synergistycznie na CPK, pacjenci uprawiający intensywnie sport powinni być szczególnie świadomi ryzyka rabdomiolizy. Objawami ostrzegawczymi mogą być: bóle mięśni, ciemny mocz i osłabienie. Powinno unikać się intensywnego uprawiania sportu w czasie przyjmowania produktu leczniczego Aknenormin 10 mg lub Aknenormin 20 mg, w celu zmniejszenia ryzyka niekorzystnego wpływu leku na mięśnie.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Produkt leczniczy powinien być przepisywany z zachowaniem ostrożności pacjentom jednocześnie przyjmującym leki, które wykazują działanie miotoksyczne, jak inhibitory reduktazy HMG-CoA (statyny), kortykosteroidy, kolchicyna i penicylamina, a także pacjentom nadużywającym alkoholu. U pacjentów ze zwiększonym ryzykiem niekorzystnego wpływu na mięśnie należy badać wartości CPK przy rutynowych analizach krwi, również w związku z aktywnością fizyczną u pacjentów intensywnie uprawiających sport. W przypadku znacznego wzrostu CPK należy zaprzestać terapii produktem leczniczym Aknenormin 10 mg lub Aknenormin 20 mg. Po kilkuletnim stosowaniu izotretynoiny w bardzo dużych dawkach w leczeniu zaburzeń rogowacenia obserwowano zmiany kostne, w tym przedwczesne zarastanie chrząstek nasadowych, przerost kości i zwapnienia w ścięgnach i więzadłach.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
W tej grupie pacjentów stosowano na ogół znacznie większe dawki, dłuższe cykle leczenia i większe dawki skumulowane, w porównaniu do stosowanych w leczeniu trądziku. Łagodne nadciśnienie wewnątrzczaszkowe Opisywano przypadki łagodnego nadciśnienia wewnątrzczaszkowego, przy czym część dotyczyła pacjentów przyjmujących jednocześnie tetracykliny (patrz punkt 4.3 Przeciwwskazania oraz punkt 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji). Objawy przedmiotowe i podmiotowe łagodnego nadciśnienia wewnątrzczaszkowego są następujące: ból głowy, nudności i wymioty, zaburzenia widzenia i obrzęk tarczy nerwu wzrokowego. Pacjenci, u których pojawia się łagodne nadciśnienie wewnątrzczaszkowe, muszą natychmiast zaprzestać stosowania izotretynoiny. Zaburzenia wątroby i dróg żółciowych Należy kontrolować aktywność enzymów wątrobowych przed leczeniem, 1 miesiąc po rozpoczęciu leczenia a następnie w odstępach 3-miesięcznych, o ile nie będzie konieczne częstsze ich kontrolowanie.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Opisywano przejściowe i odwracalne zwiększenie aktywności aminotransferaz. W wielu przypadkach wartości te mieściły się w zakresie prawidłowych wartości i podczas leczenia powracały do stanu początkowego. Gdyby jednak doszło do przewlekłego i klinicznie istotnego zwiększenia aktywności aminotransferaz, należy rozważyć zmniejszenie dawki lub zaprzestanie stosowania izotretynoiny. Niewydolność nerek Zaburzenia czynności nerek i niewydolność nerek nie mają wpływu na właściwości farmakokinetyczne izotretynoiny. Dlatego izotretynoinę można podawać pacjentom z niewydolnością nerek. Jednakże zaleca się rozpoczynanie leczenia od mniejszej dawki i stopniowe zwiększanie jej do maksymalnej tolerowanej dawki (patrz punkt 4.2 Dawkowanie i sposób podawania). Metabolizm lipidów Należy kontrolować stężenia lipidów (na czczo) przed leczeniem, 1 miesiąc po rozpoczęciu leczenia, a następnie w odstępach 3-miesięcznych, o ile nie będzie konieczne częstsze ich kontrolowanie.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Zwiększone stężenia lipidów powracają na ogół do wartości prawidłowych po zmniejszeniu dawki lub zakończeniu terapii oraz po zmianie diety. Stosowanie izotretynoiny wiązało się ze zwiększeniem stężeń triglicerydów w osoczu. Należy przerwać leczenie izotretynoiną, jeżeli nie udaje się uzyskać możliwego do przyjęcia stężenia triglicerydów w osoczu albo kiedy występują objawy zapalenia trzustki (patrz punkt 4.8 Działania niepożądane). Stężenia triglicerydów ponad 800 mg/dl lub 9 mmol/l mogą być związane z wystąpieniem ostrego zapalenia trzustki, które może prowadzić do zgonu. Zaburzenia żołądkowo-jelitowe Opisywano związek pomiędzy stosowaniem izotretynoiny a wystąpieniem zapalnych chorób jelit (w tym choroby Leśniowskiego-Crohna) u pacjentów bez zaburzeń jelitowych w wywiadzie. W razie wystąpienia ciężkiej biegunki (niekiedy z krwią) należy natychmiast zaprzestać leczenia izotretynoiną.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Reakcje alergiczne Opisywano rzadkie przypadki reakcji anafilaktycznych, w niektórych przypadkach po wcześniejszym miejscowym stosowaniu retynoidów. Niezbyt często zgłaszano reakcje alergiczne ze strony skóry. Donoszono o ciężkich przypadkach alergicznego zapalenia naczyń, często z plamicą (siniaki i czerwone plamy) na kończynach oraz z innymi objawami nie dotyczącymi skóry. W razie wystąpienia ciężkich reakcji alergicznych należy przerwać leczenie i starannie obserwować pacjenta. Pacjenci z grupy dużego ryzyka U pacjentów z cukrzycą, otyłością, u alkoholików lub u pacjentów z zaburzeniami metabolizmu lipidów, leczonych izotretynoiną, może być konieczne częstsze kontrolowanie stężeń lipidów i (lub) stężenia glukozy we krwi. Opisywano zwiększone stężenia glukozy we krwi na czczo oraz rozpoznano nowe przypadki cukrzycy w czasie leczenia izotretynoiną.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgSpecjalne środki ostrozności
Informacja o niektórych składnikach produktu leczniczego Aknenormin 10 mg oraz Aknenormin 20 mg Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na kapsułkę, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na ryzyko hiperwitaminozy A, pacjentom nie wolno jednocześnie przyjmować produktów leczniczych zawierających witaminę A. Opisywano przypadki łagodnego nadciśnienia wewnątrzczaszkowego („rzekomy guz mózgu”) podczas jednoczesnego stosowania izotretynoiny i tetracyklin. Dlatego należy unikać przyjmowania izotretynoiny równocześnie z tetracyklinami (patrz punkt 4.3 Przeciwwskazania i punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania).
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Stosowanie izotretynoiny w okresie ciąży jest bezwzględnie przeciwwskazane (patrz punkt 4.3 Przeciwwskazania). Kobiety w wieku rozrodczym muszą stosować skuteczną antykoncepcję nieprzerwanie przez 1 miesiąc przed rozpoczęciem leczenia, przez cały okres leczenia i do 1 miesiąca po zakończeniu leczenia. Należy stosować co najmniej jedną wysoce skuteczną metodę antykoncepcji (tj. formę niezależną od użytkownika) lub dwie uzupełniające się formy antykoncepcji, zależne od użytkownika. Jeżeli pomimo stosowania tych środków ostrożności, w miesiącu poprzedzającym leczenie lekiem Aknenormin 10 mg lub Aknenormin 20 mg, w trakcie leczenia lub w następnym miesiącu po zakończeniu terapii lekiem Aknenormin 10 mg lub Aknenormin 20 mg pacjentka zajdzie w ciążę, istnieje duże ryzyko wystąpienia bardzo ciężkich i poważnych wad rozwojowych płodu.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgWpływ na płodność, ciążę i laktację
Do wad wrodzonych, które są związane z ekspozycją na izotretynoinę należą wady ośrodkowego układu nerwowego (wodogłowie, wady/nieprawidłowości móżdżku, małogłowie), deformacje twarzy, rozszczep podniebienia, wady ucha zewnętrznego (brak ucha zewnętrznego, małe zewnętrzne przewody słuchowe lub ich brak), wady oka (małoocze), wady układu sercowo-naczyniowego (wady stożka i pnia, takie jak tetralogia Fallota, przełożenie dużych naczyń, defekty przegrody), nieprawidłowości grasicy i przytarczyc. Ponadto, częściej występują poronienia samoistne. Jeżeli podczas leczenia izotretynoiną kobieta zajdzie w ciążę, leczenie musi być przerwane. Pacjentkę należy skierować do lekarza specjalizującego się w dziedzinie teratologii w celu wykonania badań i uzyskania porady. Karmienie piersi? Izotretynoina jest związkiem bardzo lipofilnym, dlatego jest bardzo prawdopodobne, że przenika do mleka kobiecego.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgWpływ na płodność, ciążę i laktację
Ze względu na ryzyko działań niepożądanych u matki i dziecka, stosowanie izotretynoiny w okresie karmienia piersią jest przeciwwskazane.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Podczas leczenia izotretynoiną w szeregu przypadków występowało osłabienie widzenia w nocy. W rzadkich przypadkach nie ustępowało po zakończeniu leczenia (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania oraz punkt 4.8 Działania niepożądane). Ponieważ wystąpiło ono u niektórych pacjentów nagle, należy zwracać uwagę pacjentów na możliwość wystąpienia tego zaburzenia i ostrzec, aby zachowali ostrożność w czasie prowadzenia pojazdów mechanicznych i obsługiwania maszyn. 4.9 Przedawkowanie Izotretynoina jest pochodną witaminy A. Toksyczność ostra izotretynoiny jest niewielka, jednak po przypadkowym przedawkowaniu produktu leczniczego mogą wystąpić objawy hiperwitaminozy A. Objawami ostrego działania toksycznego witaminy A są silne bóle głowy, nudności i wymioty, senność, drażliwość i świąd. Objawy podmiotowe i przedmiotowe przypadkowego lub umyślnego przedawkowania izotretynoiny są podobne.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgWpływ na zdolność prowadzenia pojazdów
Należy się spodziewać, że objawy przedawkowania są przejściowe i ustępują bez konieczności leczenia.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDziałania niepożądane
4.8 Działania niepożądane Należy poinformować pacjentów o możliwych objawach przedmiotowych i podmiotowych oraz prowadzić szczegółową obserwację pacjentów w kierunku ciężkich reakcji skórnych. W przypadku podejrzenia ciężkiej reakcji skórnej, należy przerwać leczenie izotretynoiną. Należy poradzić pacjentom, żeby od początku leczenia izotretynoiną stosowali do pielęgnacji skóry maść nawilżającą lub krem nawilżający oraz balsam do ust, ponieważ izotretynoina powoduje wysuszenie skóry i ust. Choroby oczu Zespół suchego oka, zmętnienie rogówki, niedowidzenie w ciemnościach i zapalenie rogówki na ogół ustępują po przerwaniu stosowania izotretynoiny. Notowano przypadki suchości oka, która nie ustępowała po zakończeniu leczenia. Zespół suchego oka można łagodzić stosując maść nawilżającą do oczu albo produkt zastępujący łzy. Może wystąpić nietolerancja na soczewki kontaktowe, co oznacza, że podczas leczenia pacjent musi nosić okulary.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDziałania niepożądane
Opisywano ponadto niedowidzenie w ciemnościach, które u niektórych pacjentów pojawiało się nagle (patrz punkt 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługę maszyn). Pacjentów z zaburzeniami widzenia należy skierować do okulisty. Może być konieczne przerwanie stosowania izotretynoiny. Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Opisywano występowanie bólów mięśni, bólów stawów oraz zwiększenie aktywności kinazy kreatynowej w surowicy krwi u pacjentów przyjmujących izotretynoinę, szczególnie u osób wykonujących intensywny wysiłek fizyczny. Znaczny wzrost wartości CPK może być objawem rabdomiolizy (patrz punkt 4.8 Działania niepożądane). Ponieważ produkt leczniczy Aknenormin 10 mg oraz Aknenormin 20 mg wydaje się działać synergistycznie na CPK, pacjenci uprawiający intensywnie sport powinni być szczególnie świadomi ryzyka rabdomiolizy. Objawami ostrzegawczymi mogą być: bóle mięśni, ciemny mocz i osłabienie.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDziałania niepożądane
Powinno unikać się intensywnego uprawiania sportu w czasie przyjmowania produktu leczniczego Aknenormin 10 mg lub Aknenormin 20 mg, w celu zmniejszenia ryzyka niekorzystnego wpływu leku na mięśnie. Produkt leczniczy powinien być przepisywany z zachowaniem ostrożności pacjentom jednocześnie przyjmującym leki, które wykazują działanie miotoksyczne, jak inhibitory reduktazy HMG-CoA (statyny), kortykosteroidy, kolchicyna i penicylamina, a także pacjentom nadużywającym alkoholu. U pacjentów ze zwiększonym ryzykiem niekorzystnego wpływu na mięśnie należy badać wartości CPK przy rutynowych analizach krwi, również w związku z aktywnością fizyczną u pacjentów intensywnie uprawiających sport. W przypadku znacznego wzrostu CPK należy zaprzestać terapii produktem leczniczym Aknenormin 10 mg lub Aknenormin 20 mg.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDziałania niepożądane
Po kilkuletnim stosowaniu izotretynoiny w bardzo dużych dawkach w leczeniu zaburzeń rogowacenia obserwowano zmiany kostne, w tym przedwczesne zarastanie chrząstek nasadowych, przerost kości i zwapnienia w ścięgnach i więzadłach. W tej grupie pacjentów stosowano na ogół znacznie większe dawki, dłuższe cykle leczenia i większe dawki skumulowane, w porównaniu do stosowanych w leczeniu trądziku. Łagodne nadciśnienie wewnątrzczaszkowe Opisywano przypadki łagodnego nadciśnienia wewnątrzczaszkowego, przy czym część dotyczyła pacjentów przyjmujących jednocześnie tetracykliny (patrz punkt 4.3 Przeciwwskazania oraz punkt 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji). Objawy przedmiotowe i podmiotowe łagodnego nadciśnienia wewnątrzczaszkowego są następujące: ból głowy, nudności i wymioty, zaburzenia widzenia i obrzęk tarczy nerwu wzrokowego. Pacjenci, u których pojawia się łagodne nadciśnienie wewnątrzczaszkowe, muszą natychmiast zaprzestać stosowania izotretynoiny.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDziałania niepożądane
Zaburzenia wątroby i dróg żółciowych Należy kontrolować aktywność enzymów wątrobowych przed leczeniem, 1 miesiąc po rozpoczęciu leczenia a następnie w odstępach 3-miesięcznych, o ile nie będzie konieczne częstsze ich kontrolowanie. Opisywano przejściowe i odwracalne zwiększenie aktywności aminotransferaz. W wielu przypadkach wartości te mieściły się w zakresie prawidłowych wartości i podczas leczenia powracały do stanu początkowego. Gdyby jednak doszło do przewlekłego i klinicznie istotnego zwiększenia aktywności aminotransferaz, należy rozważyć zmniejszenie dawki lub zaprzestanie stosowania izotretynoiny. Niewydolność nerek Zaburzenia czynności nerek i niewydolność nerek nie mają wpływu na właściwości farmakokinetyczne izotretynoiny. Dlatego izotretynoinę można podawać pacjentom z niewydolnością nerek. Jednakże zaleca się rozpoczynanie leczenia od mniejszej dawki i stopniowe zwiększanie jej do maksymalnej tolerowanej dawki (patrz punkt 4.2 Dawkowanie i sposób podawania).
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDziałania niepożądane
Metabolizm lipidów Należy kontrolować stężenia lipidów (na czczo) przed leczeniem, 1 miesiąc po rozpoczęciu leczenia, a następnie w odstępach 3-miesięcznych, o ile nie będzie konieczne częstsze ich kontrolowanie. Zwiększone stężenia lipidów powracają na ogół do wartości prawidłowych po zmniejszeniu dawki lub zakończeniu terapii oraz po zmianie diety. Stosowanie izotretynoiny wiązało się ze zwiększeniem stężeń triglicerydów w osoczu. Należy przerwać leczenie izotretynoiną, jeżeli nie udaje się uzyskać możliwego do przyjęcia stężenia triglicerydów w osoczu albo kiedy występują objawy zapalenia trzustki (patrz punkt 4.8 Działania niepożądane). Stężenia triglicerydów ponad 800 mg/dl lub 9 mmol/l mogą być związane z wystąpieniem ostrego zapalenia trzustki, które może prowadzić do zgonu. Zaburzenia żołądkowo-jelitowe Opisywano związek pomiędzy stosowaniem izotretynoiny a wystąpieniem zapalnych chorób jelit (w tym choroby Leśniowskiego-Crohna) u pacjentów bez zaburzeń jelitowych w wywiadzie.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDziałania niepożądane
W razie wystąpienia ciężkiej biegunki (niekiedy z krwią) należy natychmiast zaprzestać leczenia izotretynoiną. Reakcje alergiczne Opisywano rzadkie przypadki reakcji anafilaktycznych, w niektórych przypadkach po wcześniejszym miejscowym stosowaniu retynoidów. Niezbyt często zgłaszano reakcje alergiczne ze strony skóry. Donoszono o ciężkich przypadkach alergicznego zapalenia naczyń, często z plamicą (siniaki i czerwone plamy) na kończynach oraz z innymi objawami nie dotyczącymi skóry. W razie wystąpienia ciężkich reakcji alergicznych należy przerwać leczenie i starannie obserwować pacjenta. Pacjenci z grupy dużego ryzyka U pacjentów z cukrzycą, otyłością, u alkoholików lub u pacjentów z zaburzeniami metabolizmu lipidów, leczonych izotretynoiną, może być konieczne częstsze kontrolowanie stężeń lipidów i (lub) stężenia glukozy we krwi. Opisywano zwiększone stężenia glukozy we krwi na czczo oraz rozpoznano nowe przypadki cukrzycy w czasie leczenia izotretynoiną.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDziałania niepożądane
Informacja o niektórych składnikach produktu leczniczego Aknenormin 10 mg oraz Aknenormin 20 mg Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na kapsułkę, to znaczy produkt leczniczy uznaje się za „wolny od sodu”. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na ryzyko hiperwitaminozy A, pacjentom nie wolno jednocześnie przyjmować produktów leczniczych zawierających witaminę A. Opisywano przypadki łagodnego nadciśnienia wewnątrzczaszkowego („rzekomy guz mózgu”) podczas jednoczesnego stosowania izotretynoiny i tetracyklin. Dlatego należy unikać przyjmowania izotretynoiny równocześnie z tetracyklinami (patrz punkt 4.3 Przeciwwskazania i punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). 4.6 Wpływ na płodność, ciążę i laktację Ciąża Stosowanie izotretynoiny w okresie ciąży jest bezwzględnie przeciwwskazane (patrz punkt 4.3 Przeciwwskazania).
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDziałania niepożądane
Kobiety w wieku rozrodczym muszą stosować skuteczną antykoncepcję nieprzerwanie przez 1 miesiąc przed rozpoczęciem leczenia, przez cały okres leczenia i do 1 miesiąca po zakończeniu leczenia. Należy stosować co najmniej jedną wysoce skuteczną metodę antykoncepcji (tj. formę niezależną od użytkownika) lub dwie uzupełniające się formy antykoncepcji, zależne od użytkownika. Jeżeli pomimo stosowania tych środków ostrożności, w miesiącu poprzedzającym leczenie lekiem Aknenormin 10 mg lub Aknenormin 20 mg, w trakcie leczenia lub w następnym miesiącu po zakończeniu terapii lekiem Aknenormin 10 mg lub Aknenormin 20 mg pacjentka zajdzie w ciążę, istnieje duże ryzyko wystąpienia bardzo ciężkich i poważnych wad rozwojowych płodu. Do wad wrodzonych, które są związane z ekspozycją na izotretynoinę należą wady ośrodkowego układu nerwowego (wodogłowie, wady/nieprawidłowości móżdżku, małogłowie), deformacje twarzy, rozszczep podniebienia, wady ucha zewnętrznego (brak ucha zewnętrznego, małe zewnętrzne przewody słuchowe lub ich brak), wady oka (małoocze), wady układu sercowo-naczyniowego (wady stożka i pnia, takie jak tetralogia Fallota, przełożenie dużych naczyń, defekty przegrody), nieprawidłowości grasicy i przytarczyc.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDziałania niepożądane
Ponadto, częściej występują poronienia samoistne. Jeżeli podczas leczenia izotretynoiną kobieta zajdzie w ciążę, leczenie musi być przerwane. Pacjentkę należy skierować do lekarza specjalizującego się w dziedzinie teratologii w celu wykonania badań i uzyskania porady. Karmienie piersi? Izotretynoina jest związkiem bardzo lipofilnym, dlatego jest bardzo prawdopodobne, że przenika do mleka kobiecego. Ze względu na ryzyko działań niepożądanych u matki i dziecka, stosowanie izotretynoiny w okresie karmienia piersią jest przeciwwskazane. 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Podczas leczenia izotretynoiną w szeregu przypadków występowało osłabienie widzenia w nocy. W rzadkich przypadkach nie ustępowało po zakończeniu leczenia (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania oraz punkt 4.8 Działania niepożądane).
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDziałania niepożądane
Ponieważ wystąpiło ono u niektórych pacjentów nagle, należy zwracać uwagę pacjentów na możliwość wystąpienia tego zaburzenia i ostrzec, aby zachowali ostrożność w czasie prowadzenia pojazdów mechanicznych i obsługiwania maszyn.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgPrzedawkowanie
4.9 Przedawkowanie Izotretynoina jest pochodną witaminy A. Toksyczność ostra izotretynoiny jest niewielka, jednak po przypadkowym przedawkowaniu produktu leczniczego mogą wystąpić objawy hiperwitaminozy A. Objawami ostrego działania toksycznego witaminy A są silne bóle głowy, nudności i wymioty, senność, drażliwość i świąd. Objawy podmiotowe i przedmiotowe przypadkowego lub umyślnego przedawkowania izotretynoiny są podobne. Należy się spodziewać, że objawy przedawkowania są przejściowe i ustępują bez konieczności leczenia.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna; leki przeciwtrądzikowe do stosowania ogólnego Kod ATC: D 10 BA 01 Mechanizm działania Izotretynoina jest stereoizomerem kwasu all-trans-retinowego (tretynoiny). Dokładny mechanizm działania izotretynoiny nie jest jeszcze szczegółowo wyjaśniony. Stwierdzono jednak, że poprawa obrazu klinicznego w przebiegu ciężkiego trądziku jest związana z hamowaniem wytwarzania łoju przez gruczoły łojowe oraz histologicznie potwierdzonym zmniejszeniem gruczołów łojowych. Ponadto stwierdzono, że izotretynoina działa przeciwzapalnie na skórę. Skuteczność Nadmierne rogowacenie nabłonkowej wyściółki cebulek włosowych i gruczołów łojowych prowadzi do łuszczenia się keratynocytów do przewodu kanalika oraz jego zablokowania przez keratynę i nadmierną ilość łoju. W wyniku tego dochodzi do powstania zaskórników i ewentualnie zmian zapalnych.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgWłaściwości farmakodynamiczne
Izotretynoina hamuje proliferację komórek łojowych i w przebiegu trądziku działa w taki sposób, że odtwarza prawidłowy proces różnicowania komórek. Łój jest istotnym substratem sprzyjającym rozwojowi Propionibacterium acnes. Zmniejszenie wydzielania łoju hamuje więc namnażanie się bakterii w obrębie przewodu wyprowadzającego gruczołu łojowego.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Wchłanianie Wchłanianie izotretynoiny z przewodu pokarmowego jest zmienne i liniowo zależne w zakresie wartości terapeutycznych. Nie określono biodostępności izotretynoiny, ponieważ substancja ta nie jest dostępna w postaci dożylnej przeznaczonej do stosowania u ludzi. Ekstrapolacja wyników uzyskanych w doświadczeniach na psach wskazuje jednak na niewielką i zmienną układową biodostępność. Biodostępność produktu leczniczego, gdy jest podawany z pokarmem jest dwa razy większa niż jego biodostępność, gdy jest podawany na czczo. Dystrybucja Izotretynoina w znacznym stopniu wiąże się z białkami osocza, głównie z albuminami (99,9%). Nie określono objętości dystrybucji izotretynoiny u człowieka, ponieważ izotretynoina nie jest dostępna w postaci dożylnej przeznaczonej do stosowania u ludzi. Jest niewiele danych dotyczących dystrybucji izotretynoiny do tkanek u ludzi. Stężenia izotretynoiny w naskórku są o połowę mniejsze niż w surowicy krwi.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgWłaściwości farmakokinetyczne
Ze względu na słabą penetrację izotretynoiny do krwinek czerwonych, stężenie izotretynoiny w osoczu krwi jest około 1,7 razy większe niż w krwi pełnej. Metabolizm Po podaniu doustnym izotretynoiny w osoczu krwi wykrywa się trzy główne metabolity: 4-oksoizotretynoinę, tretynoinę (kwas all-trans-retinowy) i 4-oksotretynoinę. W testach in vitro wykazano aktywność biologiczną tych metabolitów. W badaniu klinicznym wykazano, że 4-oksoizotretynoina ma istotne znaczenie dla działania izotretynoiny (zmniejszenie szybkości wydzielania łoju, pomimo tego, że nie ma wpływu na stężenie izotretynoiny i tretynoiny w osoczu). Do innych, mniej ważnych metabolitów, należą glukuroniany. Głównym metabolitem jest 4-oksoizotretynoina, której stężenie w osoczu w stanie równowagi jest 2,5 razy większe niż stężenie substancji wyjściowej - izotretynoiny.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgWłaściwości farmakokinetyczne
Metabolizm tretynoiny jest związany z metabolizmem izotretynoiny, ponieważ izotretynoina i tretynoina (kwas all-trans retinowy) podlegają wzajemnemu odwracalnemu przekształcaniu się jedna w drugą (interkonwersja). Szacuje się, że 20% - 30% dawki izotretynoiny ulega izomeryzacji. Krążenie jelitowo-wątrobowe przypuszczalnie ma duże znaczenie w farmakokinetyce izotretynoiny u ludzi. Badania metabolizmu in vitro wskazują, że w metabolizmie izotretynoiny do 4-oksoizotretynoiny i tretynoiny uczestniczy wiele izoenzymów układu cytochromu P450. Wydaje się, że żaden z enzymów nie odgrywa roli dominującej. Izotretynoina i jej metabolity nie mają istotnego wpływu na aktywności izoenzymów cytochromu P450. Eliminacja (wydalanie) Po podaniu doustnym izotretynoiny znakowanej izotopem promieniotwórczym, podobne części dawki wykrywano w moczu i kale.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgWłaściwości farmakokinetyczne
Po podaniu doustnym izotretynoiny okres półtrwania w końcowej fazie eliminacji substancji niezmienionej u pacjentów z trądzikiem wynosił średnio 19 godzin. Okres półtrwania 4-oksoizotretynoiny w końcowej fazie eliminacji jest dłuższy, wynosi średnio 29 godzin. Izotretynoina jest retynoidem występującym fizjologicznie. Po dwóch tygodniach po zakończeniu leczenia izotretynoiną stężenia retynoidów odpowiadają wartościom fizjologicznym. Farmakokinetyka produktu leczniczego w szczególnych grupach pacjentów Stosowanie izotretynoiny u pacjentów z zaburzeniami czynności wątroby jest przeciwwskazane, dlatego dostępne są ograniczone dane na temat właściwości farmakokinetycznych produktu leczniczego w tej populacji pacjentów. Niewydolność nerek nie prowadzi do istotnego zmniejszenia klirensu osoczowego izotretynoiny lub 4-oksoizotretynoiny.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Toksyczność po podaniu jednorazowym Toksyczność ostrą po podaniu doustnym izotretynoiny badano na różnych gatunkach zwierząt. U królików LD50 wynosiła około 2000 mg/kg mc., u myszy – około 3000 mg/kg mc., a u szczurów ponad 4000 mg/kg mc. Toksyczność po podaniu wielokrotnym Długotrwałe badanie na szczurach (ponad 2 lata), w którym izotretynoinę podawano w dawkach 2, 8 i 32 mg/kg mc. na dobę) wykazało występowanie częściowego wypadania włosów i zwiększenie stężeń triglicerydów w osoczu krwi u szczurów, którym podawano większe dawki produktu leczniczego. Rodzaje i częstość występowania działań niepożądanych izotretynoiny są u gryzoni podobne do działań niepożądanych witaminy A. Nie obserwuje się jednak takich masywnych zwapnień tkanek i narządów, jak u szczurów, którym podawano witaminę A. Zmiany w komórkach wątrobowych, obserwowane podczas stosowania witaminy A nie występują podczas stosowania izotretynoiny.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgPrzedkliniczne dane o bezpieczeństwie
Wszystkie działania niepożądane, stanowiące zespół hiperwitaminozy A, ustępują samoistnie po zakończeniu leczenia izotretynoiną. Nawet u zwierząt doświadczalnych, których stan ogólny był zły, w ciągu 1 – 2 tygodni stwierdzono znaczną poprawę. Działanie teratogenne Podobnie jak w przypadku innych pochodnych witaminy A, w badaniach na zwierzętach wykazano, że izotretynoina ma działanie teratogenne i embriotoksyczne. W związku z działaniem teratogennym izotretynoiny, jej stosowanie u kobiet w wieku rozrodczym wiąże się ze szczególnymi wymaganiami (patrz punkt 4.3 Przeciwwskazania, punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania oraz punkt 4.6 Wpływ na ciążę, płodność i laktację). Wpływ na płodność Izotretynoina podawana w dawkach terapeutycznych mężczyznom nie ma wpływu na liczbę, ruchliwość i budowę plemników oraz nie ma szkodliwego wpływu na tworzenie się i rozwój zarodka.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgPrzedkliniczne dane o bezpieczeństwie
Działanie mutagenne W badaniach in vitro oraz in vivo na zwierzętach nie wykazano, że izotretynoina nie ma działania mutagennego ani karcynogennego.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Rdzeń kapsułki: Olej sojowy rafinowany all-rac-α-tokoferol disodu edetynian butylohydroksyanizol olej roślinny uwodorniony olej sojowy częściowo uwodorniony wosk żółty Otoczka kapsułki: Aknenormin 10 mg: żelatyna glicerol (98-101%) sorbitol ciekły niekrystalizujący woda oczyszczona czerwień koszenilowa (E124) żelaza tlenek czarny (E172) tytanu dwutlenek (E171) Aknenormin 20 mg: żelatyna glicerol (98-101%) sorbitol ciekły niekrystalizujący woda oczyszczona czerwień koszenilowa (E124) indygotyna (E132) tytanu dwutlenek (E171) 6.2. Niezgodności farmaceutyczne Nie dotyczy. 6.3. Okres ważności 3 lata. 6.4. Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu. 6.5. Rodzaj i zawartość opakowania Kapsułki miękkie pakowane są w blistry PVC/PVDC/Aluminium, umieszczone w tekturowym pudełku.
- CHPL leku Aknenormin 10 mg, kapsułki miękkie, 10 mgDane farmaceutyczne
Opakowania: 30, 60, 90 i 100 kapsułek miękkich. Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie. 6.6. Specjalne środki ostrożności dotyczące usuwania Usuwanie wszelkich niewykorzystanych produktów leczniczych lub ich odpadów powinno odbywać się zgodnie z przepisami dotyczącymi usuwania leków.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Curacne 40 mg, kapsułki, miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 40 mg izotretynoiny (Isotretinoinum). Substancje pomocnicze o znanym działaniu: 1 kapsułka miękka zawiera 191,50 mg rafinowanego oleju sojowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Kapsułki, miękkie. Każda kapsułka miękka 40 mg ma pomarańczowo/brązową nieprzezroczystą osłonkę żelatynową z jasno pomarańczowo/żółtym wypełnieniem oraz nadrukiem „I40” na jednej stronie.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWskazania do stosowania
4.1 Wskazania do stosowania Ciężkie postacie trądziku (jak trądzik guzkowy, trądzik skupiony lub trądzik z ryzykiem powstawania trwałych blizn) oporne na prawidłowo przeprowadzone standardowe leczenie lekami przeciwbakteryjnymi działającymi ogólnie oraz lekami stosowanymi miejscowo.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgDawkowanie
4.2 Dawkowanie i sposób podawania Izotretynoina może być przepisywana wyłącznie przez lekarza mającego doświadczenie w leczeniu ciężkich postaci trądziku działającymi ogólnie retynoidami oraz pełną wiedzę o ryzyku leczenia izotretynoiną i wymogach dotyczących monitorowania pacjenta, bądź pod nadzorem lekarza spełniającego te warunki. Dawkowanie Dorośli, w tym młodzież i pacjenci w podeszłym wieku Leczenie izotretynoiną należy rozpocząć od dawki 0,5 mg/kg mc. na dobę. Odpowiedź na leczenie izotretynoiną oraz niektóre działania niepożądane są zależne od dawki i różnią się u poszczególnych pacjentów. Z tego względu konieczne jest indywidualne dostosowanie dawkowania podczas terapii. Dla większości pacjentów dawka wynosi od 0,5 mg/kg mc. do 1 mg/kg mc. na dobę. Uzyskanie długotrwałej remisji oraz częstość występowania nawrotów choroby bardziej zależą od całkowitej podanej dawki, niż od czasu leczenia lub dawki dobowej.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgDawkowanie
Wykazano, że nie należy oczekiwać znaczących dodatkowych korzyści leczniczych po zastosowaniu dawki skumulowanej większej niż 120-150 mg/kg mc. Czas leczenia jest uzależniony od indywidualnej dawki dobowej. Leczenie trwające od 16 do 24 tygodni zwykle wystarcza do uzyskania remisji. U większości pacjentów, całkowite ustąpienie objawów trądziku uzyskuje się po jednorazowym cyklu leczenia. W przypadku wyraźnego nawrotu choroby, można rozważyć powtórzenie cyklu leczenia izotretynoiną, stosując taką samą dawkę dobową i skumulowaną. Ze względu na to, że dalsze ustępowanie objawów trądziku może wystąpić w czasie do 8 tygodni po zakończeniu leczenia, nie należy podejmować kolejnego cyklu leczenia przed upływem tego czasu. Szczególne grupy pacjentów Pacjenci z ciężką niewydolnością nerek U pacjentów z ciężką niewydolnością nerek, leczenie należy rozpoczynać od mniejszej dawki (np. 10 mg/dobę).
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgDawkowanie
Dawkę należy następnie zwiększać do wartości nie większej niż 1 mg/kg mc./dobę lub do maksymalnej dawki tolerowanej przez pacjenta (patrz punkt 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania”). Pacjenci z nietolerancj? U pacjentów z objawami ciężkiej nietolerancji produktu po zastosowaniu zalecanej dawki, można kontynuować leczenie mniejszą dawką. Powoduje to przedłużenie terapii oraz wiąże się z większym ryzykiem nawrotu choroby. Aby osiągnąć maksymalną możliwą skuteczność leczenia u tych pacjentów, należy kontynuować leczenie stosując największą dawkę tolerowaną przez pacjenta. Dzieci i młodzież Izotretynoina nie jest wskazana w leczeniu trądziku występującego przed okresem dojrzewania i nie zaleca się jej stosowania u dzieci w wieku poniżej 12 lat, gdyż nie ustalono bezpieczeństwa stosowania i skuteczności w tej grupie wiekowej. Sposób podawania Podanie doustne. Kapsułki należy przyjmować doustnie z pokarmem, raz lub dwa razy na dobę.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgPrzeciwwskazania
4.3 Przeciwwskazania Izotretynoina jest przeciwwskazana u kobiet w okresie ciąży i karmienia piersią (patrz punkt 4.6 „Wpływ na płodność, ciążę i laktację”). Izotretynoina jest przeciwwskazana u kobiet w okresie rozrodczym, o ile nie są spełnione wszystkie wymagania Programu Zapobiegania Ciąży (patrz punkt 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania”). Izotretynoina jest również przeciwwskazana u pacjentów: z nadwrażliwością na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, z niewydolnością wątroby, ze zwiększonym stężeniem lipidów we krwi, z hiperwitaminozą A, z alergią na orzeszki ziemne lub olej sojowy, ze względu na zawartość oleju sojowego w produkcie, jednocześnie leczonych tetracyklinami (patrz punkt 4.5 „Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji”). przyjmujących witaminę A, przyjmujących inne retynoidy (acytretyna, alitretynoina).
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Program Zapobiegania Ciąży Ten produkt leczniczy ma działanie TERATOGENNE. Izotretynoina jest przeciwwskazana u kobiet w wieku rozrodczym, chyba że spełnione zostaną wszystkie wymienione poniżej wymagania Programu Zapobiegania Ciąży: Pacjentka ma ciężką postać trądziku (jak trądzik guzkowy i trądzik skupiony lub trądzik stanowiący ryzyko powstania trwałych blizn) oporną na prawidłowo przeprowadzone standardowe leczenie lekami przeciwbakteryjnymi działającymi ogólnie oraz lekami stosowanymi miejscowo (patrz punkt 4.1 „Wskazania do stosowania”). Możliwość zajścia w ciążę musi zostać oceniona dla wszystkich pacjentek. Pacjentka rozumie ryzyko działań teratogennych. Pacjentka rozumie konieczność ścisłej comiesięcznej obserwacji.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgSpecjalne środki ostrozności
Pacjentka rozumie i akceptuje konieczność stosowania skutecznej, nieprzerywanej antykoncepcji przez 1 miesiąc przed rozpoczęciem leczenia, w trakcie trwania leczenia i przez 1 miesiąc po zakończeniu leczenia. Należy stosować co najmniej jedną wysoce skuteczną (tzn. niezależną od użytkownika) metodę antykoncepcji, lub dwie uzupełniające się metody antykoncepcji zależne od użytkownika. Przy wyborze metody antykoncepcji należy w każdym przypadku wziąć pod uwagę indywidualne uwarunkowania, z uwzględnieniem ich omówienia z pacjentką, tak aby zapewnić jej zaangażowanie i stosowanie się do zaleceń dotyczących wybranych środków. Nawet jeśli u pacjentki nie występuje miesiączka, pacjentka musi przestrzegać wszystkich zaleceń w zakresie skutecznej antykoncepcji. Pacjentka jest poinformowana o potencjalnych konsekwencjach zajścia w ciążę, jest ich świadoma oraz rozumie konieczność szybkiej konsultacji z lekarzem w razie ryzyka zajścia w ciążę, lub podejrzenia, że jest w ciąży.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgSpecjalne środki ostrozności
Pacjentka rozumie i akceptuje konieczność regularnego poddawania się testom ciążowym przed leczeniem, w trakcie leczenia - optymalnie co miesiąc - oraz po 1 miesiącu od zakończenia leczenia. Pacjentka poświadcza, że zrozumiała zagrożenia i niezbędne środki ostrożności związane ze stosowaniem izotretynoiny. Warunki te dotyczą również kobiet, które nie są obecnie aktywne seksualnie, chyba że lekarz wystawiający receptę na ten produkt leczniczy uzna, iż istnieją jednoznaczne powody wskazujące, że nie ma ryzyka zajścia w ciążę. Lekarz wystawiający receptę na ten produkt leczniczy powinien upewnić się, że: Pacjentka przestrzega wymagań dotyczących zapobiegania ciąży podanych powyżej i potwierdziła, że zrozumiała te zagadnienia. Pacjentka potwierdziła zapoznanie się z wyżej wymienionymi wymaganiami. Pacjentka rozumie, że musi konsekwentnie i prawidłowo stosować co najmniej jedną wysoce skuteczną (tzn.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgSpecjalne środki ostrozności
niezależną od użytkownika) metodę antykoncepcji, lub dwie uzupełniające się metody antykoncepcji zależne od użytkownika przez co najmniej 1 miesiąc przed rozpoczęciem leczenia, w trakcie trwania leczenia i przez 1 miesiąc po zakończeniu leczenia. Ujemny wynik testu ciążowego uzyskano przed leczeniem, w trakcie leczenia i po 1 miesiącu od zakończenia leczenia. Należy udokumentować terminy i wyniki testów ciążowych. W przypadku zajścia w ciążę w trakcie leczenia izotretynoiną, leczenie musi być przerwane a pacjentkę należy skierować na badanie i po poradę do odpowiedniego lekarza doświadczonego w badaniu teratogenności. Jeżeli kobieta zajdzie w ciążę po zakończeniu leczenia, zachodzi wysokie ryzyko ciężkich i poważnych wad rozwojowych płodu. Ryzyko to utrzymuje się do czasu całkowitej eliminacji produktu, czyli do jednego miesiąca po zakończeniu leczenia.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Przeciwwskazane skojarzone leczenie z: Witaminą A ze względu na ryzyko hiperwitaminozy A (patrz punkt 4.3). Innymi retynoidami (acytretyna, alitretynoina) ze względu na ryzyko hiperwitaminozy A (patrz punkt 4.3). Tetracyklinami. Opisywano przypadki nadciśnienia wewnątrzczaszkowego podczas jednoczesnego stosowania izotretynoiny i tetracyklin. Z tego powodu należy unikać równoczesnego leczenia izotretynoiną i tetracyklinami (patrz punkt 4.3 „Przeciwwskazania” i punkt 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania”). Należy unikać jednoczesnego leczenia izotretynoiną i środkami przeciwtrądzikowymi o miejscowym działaniu keratolitycznym lub złuszczającym, gdyż może wystąpić lokalne podrażnienie (patrz punkt 4.4). 4.6 Wpływ na płodność, ciążę i laktację Ciąża W okresie ciąży bezwzględnie przeciwwskazane jest leczenie izotretynoiną (patrz punkt 4.3 „Przeciwwskazania”).
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgInterakcje
Jeżeli pacjentka zajdzie w ciążę, pomimo zachowania wymaganych środków ostrożności podczas leczenia izotretynoiną lub w ciągu miesiąca po jego zakończeniu, istnieje znaczne ryzyko wystąpienia bardzo ciężkich wad rozwojowych u płodu. Do wad rozwojowych u płodu związanych ze stosowaniem izotretynoiny należą wady ośrodkowego układu nerwowego (wodogłowie, wady rozwojowe móżdżku, małogłowie), zniekształcenia twarzy, rozszczep podniebienia, wady ucha zewnętrznego (brak ucha zewnętrznego, małe zewnętrzne przewody słuchowe lub ich brak), wady oka (małoocze), wady w obrębie układu sercowo-naczyniowego (wady rozwojowe wspólnego pnia tętniczego, takie jak: tetralogia Fallota, przełożenie wielkich naczyń, uszkodzenie przegrody), nieprawidłowości grasicy i przytarczyc. Częściej występują poronienia samoistne.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgInterakcje
Jeżeli podczas leczenia izotretynoiną kobieta zajdzie w ciążę, należy przerwać leczenie, a pacjentkę skierować na konsultację do lekarza z doświadczeniem w dziedzinie teratologii, w celu zbadania i uzyskania porady. Kobiety w wieku rozrodczym/Antykoncepcja Jako wymóg minimalny, kobiety w wieku rozrodczym muszą stosować przynajmniej jedną wysoce skuteczną metodę antykoncepcyjną (tzn. niezależną od użytkownika) lub dwie uzupełniające się metody antykoncepcyjne zależne od użytkownika. Antykoncepcję należy stosować co najmniej 1 miesiąc przed rozpoczęciem leczenia, w trakcie leczenia oraz przez 1 miesiąc po zakończeniu leczenia izotretynoiną, nawet jeśli u pacjentki nie występuje miesiączka (patrz punkt 4.4). Karmienie piersi? Izotretynoina jest związkiem silnie lipofilnym, dlatego przenikanie izotretynoiny do mleka matki jest bardzo prawdopodobne.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgInterakcje
Biorąc pod uwagę potencjalne działania niepożądane u matki i dziecka, stosowanie izotretynoiny u kobiet w okresie karmienia piersią jest przeciwwskazane. Płodność Izotretynoina przyjmowana przez mężczyzn w dawkach terapeutycznych nie wpływa na liczbę, ruchliwość i budowę komórek plemnikowych i nie zagraża tworzeniu się i rozwojowi zarodka. 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy Curacne 40 mg może wpływać na zdolność prowadzenia pojazdów i obsługiwania maszyn. Podczas leczenia izotretynoiną odnotowano wiele przypadków pogorszenia widzenia w nocy; w rzadkich przypadkach ten objaw utrzymywał się po zakończeniu leczenia (patrz punkt 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania” i punkt 4.8 „Działania niepożądane”). Ponieważ u niektórych pacjentów objawy te występowały nagle, pacjentów należy informować o możliwości wystąpienia takiego zaburzenia i ostrzegać, aby zachowali ostrożność podczas prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgInterakcje
Bardzo rzadko donoszono o objawach senności, zawrotów głowy i zaburzeń widzenia. Pacjenci powinni być ostrzegani, że w wypadku wystąpienia tych objawów nie powinni prowadzić pojazdów mechanicznych, obsługiwać urządzeń mechanicznych w ruchu lub brać udziału w tego typu zajęciach, w których wystąpienie powyższych objawów może narazić ich lub inne osoby na ryzyko. 4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Następujące objawy stanowią najczęściej opisywane działania niepożądane izotretynoiny: suchość błon śluzowych, np. warg, zapalenie warg, suchość błony śluzowej nosa, krwawienie z nosa, suchość oka (zapalenie spojówek), suchość skóry. Niektóre działania niepożądane, związane ze stosowaniem izotretynoiny, są zależne od dawki. Działania niepożądane są ogólnie odwracalne po zmianie dawki lub zaprzestaniu leczenia; w niektórych przypadkach utrzymują się po zakończeniu leczenia.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgInterakcje
Tabelaryczne zestawienie działań niepożądanych Działania niepożądane zostały sklasyfikowane zgodnie z konwencją MedDRA według klasyfikacji układów i narządów oraz częstości ich występowania: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zakażenia: Bardzo rzadko Zakażenia (skóry i błon śluzowych) bakteriami Gram-dodatnimi Zaburzenia krwi i układu chłonnego: Bardzo często Często Bardzo rzadko Niedokrwistość, przyspieszone OB, małopłytkowość, nadpłytkowość Neutropenia Limfadenopatia Zaburzenia układu immunologicznego: Rzadko Skórne reakcje alergiczne, reakcje anafilaktyczne, nadwrażliwość Zaburzenia metabolizmu i odżywiania: Bardzo rzadko Cukrzyca, hiperurykemia Zaburzenia psychiczne: Rzadko Bardzo rzadko Depresja, nasilenie objawów depresji, skłonność do agresji, lęk, zmiany nastroju Samobójstwo, próby samobójcze, myśli samobójcze, zaburzenia psychotyczne, zaburzenia zachowania Zaburzenia układu nerwowego: Często Bardzo rzadko Bóle głowy Łagodne nadciśnienie wewnątrzczaszkowe, drgawki, senność, zawroty głowy Zaburzenia oczu: Bardzo często Bardzo rzadko Zapalenie powiek, zapalenie spojówek, suchość oczu, podrażnienie oczu Zaburzenia widzenia, niewyraźne widzenie, zaćma, ślepota barw (niedobór widzenia kolorów), nietolerancja soczewek kontaktowych, zmętnienie rogówki, pogorszenie widzenia w ciemności, zapalenie rogówki, tarcza zastoinowa (objaw łagodnego nadciśnienia wewnątrzczaszkowego), światłowstręt Zaburzenia ucha i błędnika: Bardzo rzadko Upośledzenie słuchu Zaburzenia naczyniowe: Bardzo rzadko Zapalenie naczyń (na przykład zapalenie ziarniniakowe Wegenera, alergiczne zapalenie naczyń) Zaburzenia oddechowe, klatki piersiowej i śródpiersia: Często Bardzo rzadko Krwawienie z nosa, suchość błony śluzowej nosa, zapalenie jamy nosowo-gardłowej Skurcz oskrzeli (szczególnie u pacjentów z astmą), chrypka Zaburzenia żołądkowo-jelitowe: Bardzo rzadko Zapalenie okrężnicy, zapalenie jelita krętego, suchość gardła, krwotoki żołądkowo-jelitowe, biegunka krwotoczna i choroba zapalna jelita, nudności, zapalenie trzustki (patrz punkt 4.4) Zaburzenia wątroby i dróg żółciowych: Bardzo często Bardzo rzadko Zwiększenie aktywności aminotransferaz (patrz punkt 4.4) Zapalenie wątroby Zaburzenia skóry i tkanki podskórnej: Bardzo często Rzadko Bardzo rzadko Zapalenie czerwieni warg, zapalenie skóry, suchość skóry, miejscowe złuszczanie naskórka, świąd, wysypka rumieniowa, nadwrażliwość skóry (ryzyko urazu w wyniku tarcia) Łysienie Trądzik piorunujący, zaostrzenie trądziku (nawrót trądziku), rumień (twarzy), wysypka, zaburzenia włosów, hirsutyzm, dystrofia paznokci, zanokcica, reakcje nadwrażliwości na światło, ziarniniak ropotwórczy, przebarwienia skóry, zwiększona potliwość Rumień wielopostaciowy, zespół Stevensa-Johnsona i martwica toksyczno-rozpływna naskórka Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Bardzo często Bardzo rzadko Nieznana Bóle stawów, bóle mięśni, ból pleców (szczególnie u pacjentów w wieku dojrzewania) Zapalenie stawów, wapnica (zwapnienie więzadeł i ścięgien), przedwczesne zrastanie nasad kości długich, wyrośle kostne (hiperostoza), zmniejszenie gęstości kości, zapalenie ścięgien, rozpad mięśni poprzecznie prążkowanych Zapalenie stawów krzyżowo-biodrowych Zaburzenia nerek i dróg moczowych: Bardzo rzadko Nieznana Zapalenie kłębuszkowe nerek Zapalenie cewki moczowej Zaburzenia układu rozrodczego i piersi: Nieznana Zaburzenia czynności seksualnych, w tym zaburzenia erekcji i zmniejszenie libido Ginekomastia Suchość pochwy i sromu Zaburzenia ogólne i stany w miejscu podania: Bardzo rzadko Nadmierne tworzenie się ziarniny, złe samopoczucie Nieprawidłowości w badaniach laboratoryjnych: Bardzo często Często Bardzo rzadko Zwiększenie stężenia trójglicerydów we krwi, zmniejszenie stężenia lipoprotein o dużej gęstości Zwiększenie stężenia cholesterolu we krwi, zwiększenie stężenia glukozy we krwi, krwiomocz, białkomocz Zwiększenie aktywności kinazy kreatynowej we krwi Częstość występowania działań niepożądanych obliczono na podstawie zbiorczych danych klinicznych uzyskanych od 824 pacjentów oraz na podstawie danych uzyskanych po wprowadzeniu produktu do obrotu.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgInterakcje
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: 22 49-21-301, fax: 22 49-21-309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. 4.9 Przedawkowanie Izotretynoina jest pochodną witaminy A. Pomimo, że ostra toksyczność izotretynoiny jest niewielka, w razie przypadkowego przedawkowania mogą pojawić się objawy hiperwitaminozy A.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgInterakcje
Zespół objawów ostrej toksyczności witaminy A obejmuje ciężki ból głowy, nudności, wymioty, senność, drażliwość i świąd. Podmiotowe i przedmiotowe objawy przypadkowego lub umyślnego przedawkowania izotretynoiny są przypuszczalnie podobne. Należy oczekiwać, że te objawy są odwracalne i powinny ustępować bez konieczności leczenia.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża W okresie ciąży bezwzględnie przeciwwskazane jest leczenie izotretynoiną (patrz punkt 4.3 „Przeciwwskazania”). Jeżeli pacjentka zajdzie w ciążę, pomimo zachowania wymaganych środków ostrożności podczas leczenia izotretynoiną lub w ciągu miesiąca po jego zakończeniu, istnieje znaczne ryzyko wystąpienia bardzo ciężkich wad rozwojowych u płodu. Do wad rozwojowych u płodu związanych ze stosowaniem izotretynoiny należą wady ośrodkowego układu nerwowego (wodogłowie, wady rozwojowe móżdżku, małogłowie), zniekształcenia twarzy, rozszczep podniebienia, wady ucha zewnętrznego (brak ucha zewnętrznego, małe zewnętrzne przewody słuchowe lub ich brak), wady oka (małoocze), wady w obrębie układu sercowo-naczyniowego (wady rozwojowe wspólnego pnia tętniczego, takie jak: tetralogia Fallota, przełożenie wielkich naczyń, uszkodzenie przegrody), nieprawidłowości grasicy i przytarczyc. Częściej występują poronienia samoistne.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWpływ na płodność, ciążę i laktację
Jeżeli podczas leczenia izotretynoiną kobieta zajdzie w ciążę, należy przerwać leczenie, a pacjentkę skierować na konsultację do lekarza z doświadczeniem w dziedzinie teratologii, w celu zbadania i uzyskania porady. Kobiety w wieku rozrodczym/Antykoncepcja Jako wymóg minimalny, kobiety w wieku rozrodczym muszą stosować przynajmniej jedną wysoce skuteczną metodę antykoncepcyjną (tzn. niezależną od użytkownika) lub dwie uzupełniające się metody antykoncepcyjne zależne od użytkownika. Antykoncepcję należy stosować co najmniej 1 miesiąc przed rozpoczęciem leczenia, w trakcie leczenia oraz przez 1 miesiąc po zakończeniu leczenia izotretynoiną, nawet jeśli u pacjentki nie występuje miesiączka (patrz punkt 4.4). Karmienie piersi? Izotretynoina jest związkiem silnie lipofilnym, dlatego przenikanie izotretynoiny do mleka matki jest bardzo prawdopodobne.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWpływ na płodność, ciążę i laktację
Biorąc pod uwagę potencjalne działania niepożądane u matki i dziecka, stosowanie izotretynoiny u kobiet w okresie karmienia piersią jest przeciwwskazane. Płodność Izotretynoina przyjmowana przez mężczyzn w dawkach terapeutycznych nie wpływa na liczbę, ruchliwość i budowę komórek plemnikowych i nie zagraża tworzeniu się i rozwojowi zarodka.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy Curacne 40 mg może wpływać na zdolność prowadzenia pojazdów i obsługiwania maszyn. Podczas leczenia izotretynoiną odnotowano wiele przypadków pogorszenia widzenia w nocy; w rzadkich przypadkach ten objaw utrzymywał się po zakończeniu leczenia (patrz punkt 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania” i punkt 4.8 „Działania niepożądane”). Ponieważ u niektórych pacjentów objawy te występowały nagle, pacjentów należy informować o możliwości wystąpienia takiego zaburzenia i ostrzegać, aby zachowali ostrożność podczas prowadzenia pojazdów i obsługiwania maszyn. Bardzo rzadko donoszono o objawach senności, zawrotów głowy i zaburzeń widzenia. Pacjenci powinni być ostrzegani, że w wypadku wystąpienia tych objawów nie powinni prowadzić pojazdów mechanicznych, obsługiwać urządzeń mechanicznych w ruchu lub brać udziału w tego typu zajęciach, w których wystąpienie powyższych objawów może narazić ich lub inne osoby na ryzyko.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWpływ na zdolność prowadzenia pojazdów
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Następujące objawy stanowią najczęściej opisywane działania niepożądane izotretynoiny: suchość błon śluzowych, np. warg, zapalenie warg, suchość błony śluzowej nosa, krwawienie z nosa, suchość oka (zapalenie spojówek), suchość skóry. Niektóre działania niepożądane, związane ze stosowaniem izotretynoiny, są zależne od dawki. Działania niepożądane są ogólnie odwracalne po zmianie dawki lub zaprzestaniu leczenia; w niektórych przypadkach utrzymują się po zakończeniu leczenia. Tabelaryczne zestawienie działań niepożądanych Działania niepożądane zostały sklasyfikowane zgodnie z konwencją MedDRA według klasyfikacji układów i narządów oraz częstości ich występowania: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych).
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWpływ na zdolność prowadzenia pojazdów
Zakażenia: Bardzo rzadko Zakażenia (skóry i błon śluzowych) bakteriami Gram-dodatnimi Zaburzenia krwi i układu chłonnego: Bardzo często Często Bardzo rzadko Niedokrwistość, przyspieszone OB, małopłytkowość, nadpłytkowość Neutropenia Limfadenopatia Zaburzenia układu immunologicznego: Rzadko Skórne reakcje alergiczne, reakcje anafilaktyczne, nadwrażliwość Zaburzenia metabolizmu i odżywiania: Bardzo rzadko Cukrzyca, hiperurykemia Zaburzenia psychiczne: Rzadko Bardzo rzadko Depresja, nasilenie objawów depresji, skłonność do agresji, lęk, zmiany nastroju Samobójstwo, próby samobójcze, myśli samobójcze, zaburzenia psychotyczne, zaburzenia zachowania Zaburzenia układu nerwowego: Często Bardzo rzadko Bóle głowy Łagodne nadciśnienie wewnątrzczaszkowe, drgawki, senność, zawroty głowy Zaburzenia oczu: Bardzo często Bardzo rzadko Zapalenie powiek, zapalenie spojówek, suchość oczu, podrażnienie oczu Zaburzenia widzenia, niewyraźne widzenie, zaćma, ślepota barw (niedobór widzenia kolorów), nietolerancja soczewek kontaktowych, zmętnienie rogówki, pogorszenie widzenia w ciemności, zapalenie rogówki, tarcza zastoinowa (objaw łagodnego nadciśnienia wewnątrzczaszkowego), światłowstręt Zaburzenia ucha i błędnika: Bardzo rzadko Upośledzenie słuchu Zaburzenia naczyniowe: Bardzo rzadko Zapalenie naczyń (na przykład zapalenie ziarniniakowe Wegenera, alergiczne zapalenie naczyń) Zaburzenia oddechowe, klatki piersiowej i śródpiersia: Często Bardzo rzadko Krwawienie z nosa, suchość błony śluzowej nosa, zapalenie jamy nosowo-gardłowej Skurcz oskrzeli (szczególnie u pacjentów z astmą), chrypka Zaburzenia żołądkowo-jelitowe: Bardzo rzadko Zapalenie okrężnicy, zapalenie jelita krętego, suchość gardła, krwotoki żołądkowo-jelitowe, biegunka krwotoczna i choroba zapalna jelita, nudności, zapalenie trzustki (patrz punkt 4.4) Zaburzenia wątroby i dróg żółciowych: Bardzo często Bardzo rzadko Zwiększenie aktywności aminotransferaz (patrz punkt 4.4) Zapalenie wątroby Zaburzenia skóry i tkanki podskórnej: Bardzo często Rzadko Bardzo rzadko Zapalenie czerwieni warg, zapalenie skóry, suchość skóry, miejscowe złuszczanie naskórka, świąd, wysypka rumieniowa, nadwrażliwość skóry (ryzyko urazu w wyniku tarcia) Łysienie Trądzik piorunujący, zaostrzenie trądziku (nawrót trądziku), rumień (twarzy), wysypka, zaburzenia włosów, hirsutyzm, dystrofia paznokci, zanokcica, reakcje nadwrażliwości na światło, ziarniniak ropotwórczy, przebarwienia skóry, zwiększona potliwość Rumień wielopostaciowy, zespół Stevensa-Johnsona i martwica toksyczno-rozpływna naskórka Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Bardzo często Bardzo rzadko Nieznana Bóle stawów, bóle mięśni, ból pleców (szczególnie u pacjentów w wieku dojrzewania) Zapalenie stawów, wapnica (zwapnienie więzadeł i ścięgien), przedwczesne zrastanie nasad kości długich, wyrośle kostne (hiperostoza), zmniejszenie gęstości kości, zapalenie ścięgien, rozpad mięśni poprzecznie prążkowanych Zapalenie stawów krzyżowo-biodrowych Zaburzenia nerek i dróg moczowych: Bardzo rzadko Nieznana Zapalenie kłębuszkowe nerek Zapalenie cewki moczowej Zaburzenia układu rozrodczego i piersi: Nieznana Zaburzenia czynności seksualnych, w tym zaburzenia erekcji i zmniejszenie libido Ginekomastia Suchość pochwy i sromu Zaburzenia ogólne i stany w miejscu podania: Bardzo rzadko Nadmierne tworzenie się ziarniny, złe samopoczucie Nieprawidłowości w badaniach laboratoryjnych: Bardzo często Często Bardzo rzadko Zwiększenie stężenia trójglicerydów we krwi, zmniejszenie stężenia lipoprotein o dużej gęstości Zwiększenie stężenia cholesterolu we krwi, zwiększenie stężenia glukozy we krwi, krwiomocz, białkomocz Zwiększenie aktywności kinazy kreatynowej we krwi Częstość występowania działań niepożądanych obliczono na podstawie zbiorczych danych klinicznych uzyskanych od 824 pacjentów oraz na podstawie danych uzyskanych po wprowadzeniu produktu do obrotu.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWpływ na zdolność prowadzenia pojazdów
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: 22 49-21-301, fax: 22 49-21-309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. 4.9 Przedawkowanie Izotretynoina jest pochodną witaminy A. Pomimo, że ostra toksyczność izotretynoiny jest niewielka, w razie przypadkowego przedawkowania mogą pojawić się objawy hiperwitaminozy A.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWpływ na zdolność prowadzenia pojazdów
Zespół objawów ostrej toksyczności witaminy A obejmuje ciężki ból głowy, nudności, wymioty, senność, drażliwość i świąd. Podmiotowe i przedmiotowe objawy przypadkowego lub umyślnego przedawkowania izotretynoiny są przypuszczalnie podobne. Należy oczekiwać, że te objawy są odwracalne i powinny ustępować bez konieczności leczenia.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Następujące objawy stanowią najczęściej opisywane działania niepożądane izotretynoiny: suchość błon śluzowych, np. warg, zapalenie warg, suchość błony śluzowej nosa, krwawienie z nosa, suchość oka (zapalenie spojówek), suchość skóry. Niektóre działania niepożądane, związane ze stosowaniem izotretynoiny, są zależne od dawki. Działania niepożądane są ogólnie odwracalne po zmianie dawki lub zaprzestaniu leczenia; w niektórych przypadkach utrzymują się po zakończeniu leczenia. Tabelaryczne zestawienie działań niepożądanych Działania niepożądane zostały sklasyfikowane zgodnie z konwencją MedDRA według klasyfikacji układów i narządów oraz częstości ich występowania: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych).
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgDziałania niepożądane
Zakażenia: Bardzo rzadko Zakażenia (skóry i błon śluzowych) bakteriami Gram-dodatnimi Zaburzenia krwi i układu chłonnego: Bardzo często Często Bardzo rzadko Niedokrwistość, przyspieszone OB, małopłytkowość, nadpłytkowość Neutropenia Limfadenopatia Zaburzenia układu immunologicznego: Rzadko Skórne reakcje alergiczne, reakcje anafilaktyczne, nadwrażliwość Zaburzenia metabolizmu i odżywiania: Bardzo rzadko Cukrzyca, hiperurykemia Zaburzenia psychiczne: Rzadko Bardzo rzadko Depresja, nasilenie objawów depresji, skłonność do agresji, lęk, zmiany nastroju Samobójstwo, próby samobójcze, myśli samobójcze, zaburzenia psychotyczne, zaburzenia zachowania Zaburzenia układu nerwowego: Często Bardzo rzadko Bóle głowy Łagodne nadciśnienie wewnątrzczaszkowe, drgawki, senność, zawroty głowy Zaburzenia oczu: Bardzo często Bardzo rzadko Zapalenie powiek, zapalenie spojówek, suchość oczu, podrażnienie oczu Zaburzenia widzenia, niewyraźne widzenie, zaćma, ślepota barw (niedobór widzenia kolorów), nietolerancja soczewek kontaktowych, zmętnienie rogówki, pogorszenie widzenia w ciemności, zapalenie rogówki, tarcza zastoinowa (objaw łagodnego nadciśnienia wewnątrzczaszkowego), światłowstręt Zaburzenia ucha i błędnika: Bardzo rzadko Upośledzenie słuchu Zaburzenia naczyniowe: Bardzo rzadko Zapalenie naczyń (na przykład zapalenie ziarniniakowe Wegenera, alergiczne zapalenie naczyń) Zaburzenia oddechowe, klatki piersiowej i śródpiersia: Często Bardzo rzadko Krwawienie z nosa, suchość błony śluzowej nosa, zapalenie jamy nosowo-gardłowej Skurcz oskrzeli (szczególnie u pacjentów z astmą), chrypka Zaburzenia żołądkowo-jelitowe: Bardzo rzadko Zapalenie okrężnicy, zapalenie jelita krętego, suchość gardła, krwotoki żołądkowo-jelitowe, biegunka krwotoczna i choroba zapalna jelita, nudności, zapalenie trzustki (patrz punkt 4.4) Zaburzenia wątroby i dróg żółciowych: Bardzo często Bardzo rzadko Zwiększenie aktywności aminotransferaz (patrz punkt 4.4) Zapalenie wątroby Zaburzenia skóry i tkanki podskórnej: Bardzo często Rzadko Bardzo rzadko Zapalenie czerwieni warg, zapalenie skóry, suchość skóry, miejscowe złuszczanie naskórka, świąd, wysypka rumieniowa, nadwrażliwość skóry (ryzyko urazu w wyniku tarcia) Łysienie Trądzik piorunujący, zaostrzenie trądziku (nawrót trądziku), rumień (twarzy), wysypka, zaburzenia włosów, hirsutyzm, dystrofia paznokci, zanokcica, reakcje nadwrażliwości na światło, ziarniniak ropotwórczy, przebarwienia skóry, zwiększona potliwość Rumień wielopostaciowy, zespół Stevensa-Johnsona i martwica toksyczno-rozpływna naskórka Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Bardzo często Bardzo rzadko Nieznana Bóle stawów, bóle mięśni, ból pleców (szczególnie u pacjentów w wieku dojrzewania) Zapalenie stawów, wapnica (zwapnienie więzadeł i ścięgien), przedwczesne zrastanie nasad kości długich, wyrośle kostne (hiperostoza), zmniejszenie gęstości kości, zapalenie ścięgien, rozpad mięśni poprzecznie prążkowanych Zapalenie stawów krzyżowo-biodrowych Zaburzenia nerek i dróg moczowych: Bardzo rzadko Nieznana Zapalenie kłębuszkowe nerek Zapalenie cewki moczowej Zaburzenia układu rozrodczego i piersi: Nieznana Zaburzenia czynności seksualnych, w tym zaburzenia erekcji i zmniejszenie libido Ginekomastia Suchość pochwy i sromu Zaburzenia ogólne i stany w miejscu podania: Bardzo rzadko Nadmierne tworzenie się ziarniny, złe samopoczucie Nieprawidłowości w badaniach laboratoryjnych: Bardzo często Często Bardzo rzadko Zwiększenie stężenia trójglicerydów we krwi, zmniejszenie stężenia lipoprotein o dużej gęstości Zwiększenie stężenia cholesterolu we krwi, zwiększenie stężenia glukozy we krwi, krwiomocz, białkomocz Zwiększenie aktywności kinazy kreatynowej we krwi Częstość występowania działań niepożądanych obliczono na podstawie zbiorczych danych klinicznych uzyskanych od 824 pacjentów oraz na podstawie danych uzyskanych po wprowadzeniu produktu do obrotu.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: 22 49-21-301, fax: 22 49-21-309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. 4.9 Przedawkowanie Izotretynoina jest pochodną witaminy A. Pomimo, że ostra toksyczność izotretynoiny jest niewielka, w razie przypadkowego przedawkowania mogą pojawić się objawy hiperwitaminozy A.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgDziałania niepożądane
Zespół objawów ostrej toksyczności witaminy A obejmuje ciężki ból głowy, nudności, wymioty, senność, drażliwość i świąd. Podmiotowe i przedmiotowe objawy przypadkowego lub umyślnego przedawkowania izotretynoiny są przypuszczalnie podobne. Należy oczekiwać, że te objawy są odwracalne i powinny ustępować bez konieczności leczenia.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgPrzedawkowanie
4.9 Przedawkowanie Izotretynoina jest pochodną witaminy A. Pomimo, że ostra toksyczność izotretynoiny jest niewielka, w razie przypadkowego przedawkowania mogą pojawić się objawy hiperwitaminozy A. Zespół objawów ostrej toksyczności witaminy A obejmuje ciężki ból głowy, nudności, wymioty, senność, drażliwość i świąd. Podmiotowe i przedmiotowe objawy przypadkowego lub umyślnego przedawkowania izotretynoiny są przypuszczalnie podobne. Należy oczekiwać, że te objawy są odwracalne i powinny ustępować bez konieczności leczenia.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania ogólnego Kod ATC: D10BA01 Mechanizm działania Izotretynoina jest stereoizomerem kwasu all-trans-retynowego (tretynoiny). Dokładny mechanizm działania izotretynoiny nie został szczegółowo wyjaśniony. Ustalono jednak, że poprawa stanu klinicznego ciężkiego trądziku jest związana z hamowaniem aktywności gruczołów łojowych oraz potwierdzonym histologicznie zmniejszeniem wielkości gruczołów łojowych. Ponadto wykazano przeciwzapalne działanie izotretynoiny na skórę. Skuteczność Nadmierne rogowacenie wierzchniej warstwy naskórka w obrębie mieszka włosowego prowadzi do złuszczania korneocytów do wnętrza kanalika i zatkania go przez keratynę i nadmiar łoju. W wyniku tego dochodzi do powstania zaskórników i zmian zapalnych. Izotretynoina hamuje proliferację sebocytów i prawdopodobnie przywraca prawidłowy proces różnicowania komórek.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWłaściwości farmakodynamiczne
Łój jest głównym substratem potrzebnym do wzrostu dla bakterii Propionibacterium acnes, dlatego zmniejszenie wydzielania łoju hamuje ich namnażanie się w obrębie przewodu wyprowadzającego gruczołu łojowego.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Wchłanianie izotretynoiny z przewodu pokarmowego jest zmienne i liniowo zależne od dawki w zakresie wartości terapeutycznych. Nie określono całkowitej biodostępności izotretynoiny, ponieważ nie ma dożylnych postaci leku. Ekstrapolacja wyników badań na psach wskazuje na dość małą i zmienną biodostępność ogólną. Jeżeli izotretynoina jest przyjmowana z posiłkiem, biodostępność wzrasta dwukrotnie w porównaniu do wartości po podaniu produktu na czczo. Dystrybucja Izotretynoina ulega w dużym stopniu wiązaniu z białkami osocza, głównie albuminą (99,9%). Objętość dystrybucji izotretynoiny u człowieka nie została określona, ponieważ nie ma dożylnych postaci leku przeznaczonych do stosowania u ludzi. Dostępne dane o dystrybucji izotretynoiny do tkanek u ludzi są nieliczne. Stężenia izotretynoiny w naskórku są o połowę mniejsze niż stężenia w surowicy.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWłaściwości farmakokinetyczne
Ze względu na słabe przenikanie izotretynoiny do krwinek czerwonych, stężenie izotretynoiny w surowicy jest około 1,7 razy większe niż w pełnej krwi. Metabolizm Po podaniu doustnym izotretynoiny wyodrębniono trzy główne metabolity w surowicy: 4-oksoizotretynoinę, tretynoinę (kwas all-trans-retynowy) i 4-oksotretynoinę. Wykazano aktywność biologiczną tych metabolitów w kilku testach in vitro. W badaniu klinicznym wykazano, że 4-oksoizotretynoina ma istotne znaczenie dla działania izotretynoiny (zmniejszenie wydzielania łoju pomimo, że nie wpływa na stężenie izotretynoiny i tretynoiny w osoczu). Inne mniej ważne metabolity to produkty glukuronizacji. Głównym metabolitem jest 4-oksoizotretynoina, której stężenie w osoczu w stanie stacjonarnym jest 2,5 razy większe niż stężenie związku macierzystego. Izotretynoina i tretynoina (kwas all-trans-retynowy) ulegają odwracalnym wzajemnym przemianom (interkonwersja) i dlatego metabolizm tretynoiny jest powiązany z metabolizmem izotretynoiny.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWłaściwości farmakokinetyczne
Szacuje się, że 20-30% dawki izotretynoiny ulega przemianom na drodze izomeryzacji. Krążenie jelitowo-wątrobowe może odgrywać znaczącą rolę w farmakokinetyce izotretynoiny u człowieka. Badania metabolizmu in vitro wykazały, że kilka enzymów układu cytochromu CYP bierze udział w przekształcaniu izotretynoiny w 4-okso-izotretynoinę i tretynoinę. Żaden izoenzym nie odgrywa dominującej roli. Izotretynoina i jej metabolity nie wpływają znamiennie na aktywność CYP. Eliminacja Po podaniu doustnym znakowanej izotopem radioaktywnym izotretynoiny, w moczu i kale wykrywano w przybliżeniu równe części podanej dawki. Po doustnym podaniu izotretynoiny okres półtrwania w końcowej fazie eliminacji niezmienionej postaci leku u pacjentów z trądzikiem, wynosi średnio 19 godzin. Okres półtrwania w końcowej fazie eliminacji 4-oksoizotretynoiny jest dłuższy i wynosi średnio 29 godzin. Izotretynoina jest fizjologicznym retynoidem.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgWłaściwości farmakokinetyczne
Po upływie 2 tygodni od zakończenia terapii izotretynoiną uzyskuje się stężenia właściwe dla endogennych retynoidów. Farmakokinetyka w wybranych populacjach Ponieważ izotretynoina jest przeciwwskazana u pacjentów z zaburzeniami czynności wątroby, dane dotyczące farmakokinetyki w tej grupie pacjentów są ograniczone. Niewydolność nerek nie zmniejsza w sposób istotny klirensu osoczowego izotretynoiny lub 4-oksoizotretynoiny.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Toksyczność ostra Toksyczność ostrą po podaniu doustnym izotretynoiny badano u różnych gatunków zwierząt. LD50 wynosi w przybliżeniu 2000 mg/kg mc. u królików, około 3000 mg/kg mc. u myszy i ponad 4000 mg/kg mc. u szczurów. Toksyczność przewlekła Długoterminowe badanie na szczurach (ponad 2 lata), w którym podawano izotretynoinę w dawkach 2, 8 i 32 mg/kg mc. na dobę, wykazało występowanie częściowej utraty sierści oraz zwiększenie stężenia trójglicerydów w osoczu w grupach, w których stosowano większą dawkę produktu. Zakres działań niepożądanych izotretynoiny u gryzoni przypomina działania niepożądane witaminy A. Nie obejmuje jednak masywnych zwapnień w tkankach i organach, obserwowanych po podaniu szczurom witaminy A. Zmiany w obrębie komórek wątrobowych, stwierdzane po stosowaniu witaminy A, nie występowały po stosowaniu izotretynoiny.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgPrzedkliniczne dane o bezpieczeństwie
Wszystkie działania niepożądane stanowiące zespół hiperwitaminozy A, ustępowały samoistnie po odstawieniu izotretynoiny. Nawet u zwierząt doświadczalnych w złym stanie ogólnym, stwierdzano w większości przypadków ustąpienie objawów w ciągu 1-2 tygodni. Działanie teratogenne Podobnie jak w przypadku innych pochodnych witaminy A, w badaniach na zwierzętach wykazano, że izotretynoina działa teratogennie i embriotoksycznie. Ze względu na działania teratogenne izotretynoiny, istnieją szczególne ograniczenia dotyczące jej stosowania u kobiet w wieku rozrodczym (patrz punkt 4.3 „Przeciwwskazania”, punkt 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania”, punkt 4.6 „Wpływ na płodność, ciążę i laktację”). Wpływ na płodność Izotretynoina podawana doustnie szczurom w dawkach do 32 mg/kg mc./dobę (tzn. 5,3-krotnie większych niż maksymalna zalecana dawka u ludzi) nie wywoływała niepożądanego wpływu na czynność gonad, płodność, ciążę ani poród.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgPrzedkliniczne dane o bezpieczeństwie
U psów po leczeniu izotretynoiną podawaną doustnie przez około 30 tygodni w dawce 20 lub 60 mg/kg mc./dobę (tzn. odpowiednio 10 lub 30-krotnie większej niż maksymalna zalecana dawka dla ludzi) odnotowano atrofię jąder. Zasadniczo uzyskano dowody w badaniach mikroskopowych na znaczne upośledzenie spermatogenezy, choć we wszystkich przebadanych jądrach występowały plemniki, a w żadnym przypadku nie odnotowano atroficznych kanalików nasiennych. Wykazano jednak, że dane przedkliniczne były uzależnione od danego gatunku, a zatem nie dotyczą mężczyzn, u których wykazano brak wpływu leczenia izotretynoiną na płodność. Działanie mutagenne Nie potwierdzono mutagennego ani karcynogennego działania izotretynoiny w badaniach in vitro i in vivo u zwierząt.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Olej sojowy oczyszczony, wosk żółty, olej roślinny uwodorniony; Skład otoczki kapsułki: żelatyna, glicerol, woda oczyszczona, żelaza tlenek czerwony (E 172), żelaza tlenek żółty (E 172), tytanu dwutlenek (E 171) 50% w glicerolu. Skład czarnego atramentu: Alkohol SDA 35, glikol propylenowy (E 1520), żelaza tlenek czarny (E 172), poliwinylowy octanoftalan, woda, alkohol izopropylowy, makrogol, amonowy wodorotlenek. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25°C. Przechowywać w oryginalnym opakowaniu. Przechowywać opakowanie szczelnie zamknięte, w celu ochrony przed światłem. 6.5 Rodzaj i zawartość opakowania Blistry PVC/PE/PVDC/Aluminium, zawierające 30 kapsułek miękkich.
- CHPL leku Curacne 40 mg, kapsułki miękkie, 40 mgDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Po zakończeniu leczenia, wszystkie pozostałe kapsułki należy zwrócić do apteki.
- CHPL leku Axotret, kapsułki miękkie, 20 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Axotret, 10 mg, kapsułki miękkie Axotret, 20 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Axotret, 10 mg: 1 kapsułka, miękka zawiera 10 mg izotretynoiny (Isotretinoinum). Axotret, 20 mg: 1 kapsułka, miękka zawiera 20 mg izotretynoiny (Isotretinoinum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Kapsułki, miękkie Axotret, 10 mg: jasnoróżowe nieprzezroczyste kapsułki żelatynowe o owalnym kształcie, z napisem ‘RR’ nadrukowanym atramentem, zawierające pomarańczowo-żółtą oleistą ciecz. Axotret, 20 mg: kasztanowe nieprzezroczyste kapsułki żelatynowe o owalnym kształcie, z napisem ‘RR’ nadrukowanym atramentem, zawierające pomarańczowo-żółtą oleistą ciecz.
- CHPL leku Axotret, kapsułki miękkie, 20 mgWskazania do stosowania
4.1 Wskazania do stosowania Ciężkie postaci trądziku (jak trądzik guzkowy lub skupiony, lub trądzik z ryzykiem powstawania trwałych blizn) oporne na odpowiednio przeprowadzone standardowe leczenie działającymi ogólnie lekami przeciwbakteryjnymi i lekami stosowanymi miejscowo.
- CHPL leku Axotret, kapsułki miękkie, 20 mgDawkowanie
4.2 Dawkowanie i sposób podawania Izotretynoinę może przepisywać jedynie lekarz dermatolog mający doświadczenie w stosowaniu działających ogólnie retynoidów w przebiegu ciężkich postaci trądziku i pełną wiedzę o ryzyku związanym ze stosowaniem izotretynoiny oraz wymogach dotyczących monitorowania pacjenta podczas stosowania izotretynoiny. Kapsułki należy przyjmować z pokarmem, raz lub dwa razy na dobę. Dorośli, w tym młodzież i osoby w podeszłym wieku Leczenie izotretynoiną należy rozpoczynać od dawki 0,5 mg/kg masy ciała (mc.) na dobę. Odpowiedź na leczenie izotretynoiną oraz niektóre działania niepożądane zależą od dawki i różnią się u poszczególnych pacjentów. Z tego względu podczas terapii konieczne jest indywidualne dostosowanie dawki produktu leczniczego. Dla większości pacjentów odpowiednia dawka wynosi od 0,5 mg/kg mc. do 1 mg/kg mc. na dobę.
- CHPL leku Axotret, kapsułki miękkie, 20 mgDawkowanie
Długotrwała remisja oraz odsetek nawrotów choroby zależą bardziej od całkowitej podanej dawki niż od czasu leczenia lub dawki dobowej. Wykazano, że przekroczenie dawki skumulowanej leku 120-150 mg/kg mc. nie przynosi istotnych dodatkowych korzyści. Czas trwania leczenia zależy od indywidualnej dawki dobowej. Zwykle leczenie przez 16 do 24 tygodni jest wystarczające do uzyskania remisji. U większości pacjentów objawy trądziku ustępują całkowicie po jednym cyklu leczenia. W razie wyraźnego nawrotu choroby można rozważyć powtórzenie cyklu leczenia izotretynoiną z zastosowaniem takiej samej dawki dobowej oraz skumulowanej leku. Ze względu na to, że dalsze ustępowanie objawów trądziku może wystąpić w czasie do 8 tygodni po zakończeniu leczenia, nie należy brać pod uwagę ponownego cyklu leczenia przed upływem tego czasu. Stosowanie u pacjentów z ciężką niewydolnością nerek U pacjentów z ciężką niewydolnością nerek leczenie należy rozpoczynać od mniejszej dawki (np. 10 mg na dobę).
- CHPL leku Axotret, kapsułki miękkie, 20 mgDawkowanie
Dawkę należy następnie zwiększać do 1 mg/kg mc. na dobę lub do maksymalnej dawki tolerowanej przez pacjenta (patrz punkt 4.4). Stosowanie u dzieci Izotretynoina nie jest wskazana w leczeniu trądziku przed okresem dojrzewania i nie zaleca się jej stosowania u dzieci poniżej 12 lat. Stosowanie u pacjentów nietolerujących produktu leczniczego U pacjentów z ciężką nietolerancją zalecanej dawki produktu leczniczego można kontynuować leczenie mniejszą dawką produktu leczniczego, co wiąże się z wydłużeniem czasu leczenia oraz większym ryzykiem nawrotu choroby. Aby uzyskać możliwie największą skuteczność leczenia, należy kontynuować leczenie największą dawką tolerowaną przez pacjenta.
- CHPL leku Axotret, kapsułki miękkie, 20 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, olej sojowy (orzeszki ziemne lub soję) lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Izotretynoina jest przeciwwskazana u kobiet w ciąży i karmiących piersią (patrz punkt 4.4 i 4.6). Izotretynoina jest przeciwwskazana u kobiet w wieku rozrodczym, o ile nie są spełnione wszystkie wymagania Programu Zapobiegania Ciąży (patrz punkt 4.4). Izotretynoina jest również przeciwwskazana u pacjentów: z niewydolnością wątroby, ze znacznie zwiększonymi stężeniami lipidów we krwi, z hiperwitaminozą A, przyjmujących jednocześnie tetracykliny (patrz punkt 4.5).
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Działanie teratogenne Axotret jest lekiem o silnym działaniu teratogennym u ludzi powodującym często występujące ciężkie i zagrażające życiu wady wrodzone. Axotret jest bezwzględnie przeciwwskazany do stosowania u: kobiet w ciąży kobiet w wieku rozrodczym, chyba że spełnione zostały wszystkie poniższe warunki Programu Zapobiegania Ciąży. Program Zapobiegania Ciąży Ten produkt leczniczy ma działanie TERATOGENNE. Izotretynoina jest przeciwwskazana u kobiet w wieku rozrodczym, chyba że spełnione zostały wszystkie poniższe warunki Programu Zapobiegania Ciąży: Ciężkie postaci trądziku (jak trądzik guzkowy lub skupiony, lub trądzik z ryzykiem powstawania trwałych blizn) oporne na odpowiednio przeprowadzone standardowe leczenie działającymi ogólnie lekami przeciwbakteryjnymi i lekami stosowanymi miejscowo (patrz punkt 4.1 „Wskazania do stosowania).
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Możliwość zajścia w ciążę musi zostać oceniona dla wszystkich pacjentek. Pacjentka rozumie ryzyko działań teratogennych. Pacjentka rozumie konieczność ścisłej comiesięcznej obserwacji. Pacjentka rozumie i akceptuje konieczność stosowania skutecznej, nieprzerywanej antykoncepcji przez 1 miesiąc przed rozpoczęciem leczenia, w trakcie trwania leczenia i przez 1 miesiąc po zakończeniu leczenia. Należy stosować co najmniej jedną wysoce skuteczną (tzn. niezależną od użytkownika) metodę antykoncepcji, lub dwie uzupełniające się metody antykoncepcji zależne od użytkownika. Przy wyborze metody antykoncepcji należy w każdym przypadku wziąć pod uwagę indywidualne uwarunkowania, z uwzględnieniem ich omówienia z pacjentką, tak aby zapewnić jej zaangażowanie i stosowanie się do zaleceń dotyczących wybranych środków. Nawet jeśli u pacjentki nie występuje miesiączka, pacjentka musi przestrzegać wszystkich zaleceń w zakresie skutecznej antykoncepcji.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Pacjentka jest poinformowana o potencjalnych konsekwencjach zajścia w ciążę, jest ich świadoma oraz rozumie konieczność szybkiej konsultacji z lekarzem w razie ryzyka zajścia w ciążę, lub podejrzenia, że jest w ciąży. Pacjentka rozumie i akceptuje konieczność regularnego poddawania się testom ciążowym przed leczeniem, w trakcie leczenia - optymalnie co miesiąc - oraz po 1 miesiącu od zakończenia leczenia. Pacjentka poświadcza, że zrozumiała zagrożenia i niezbędne środki ostrożności związane ze stosowaniem izotretynoiny. Warunki te dotyczą również kobiet, które nie są obecnie aktywne seksualnie, chyba że lekarz wystawiający receptę na ten produkt leczniczy uzna, iż istnieją jednoznaczne powody wskazujące, że nie ma ryzyka zajścia w ciążę. Lekarz wystawiający receptę na ten produkt leczniczy powinien upewnić się, że: Pacjentka przestrzega wymagań dotyczących zapobiegania ciąży podanych powyżej i potwierdziła, że zrozumiała te zagadnienia.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Pacjentka potwierdziła zapoznanie się z wyżej wymienionymi wymaganiami. Pacjentka rozumie, że musi konsekwentnie i prawidłowo stosować co najmniej jedną wysoce skuteczną (tzn. niezależną od użytkownika) metodę antykoncepcji, lub dwie uzupełniające się metody antykoncepcji zależne od użytkownika przez co najmniej 1 miesiąc przed rozpoczęciem leczenia, w trakcie trwania leczenia i przez 1 miesiąc po zakończeniu leczenia. Ujemny wynik testu ciążowego uzyskano przed leczeniem, w trakcie leczenia i po 1 miesiącu od zakończenia leczenia. Należy udokumentować terminy i wyniki testów ciążowych. W przypadku zajścia w ciążę w trakcie leczenia izotretynoiną, leczenie musi być przerwane a pacjentkę należy skierować na badanie i po poradę do odpowiedniego lekarza doświadczonego w badaniu teratogenności. Jeżeli kobieta zajdzie w ciążę po zakończeniu leczenia, zachodzi wysokie ryzyko ciężkich i poważnych wad rozwojowych płodu.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Ryzyko to utrzymuje się do czasu całkowitej eliminacji produktu, czyli do jednego miesiąca po zakończeniu leczenia. Antykoncepcja Pacjentkom należy przekazać wyczerpujące informacje na temat zapobiegania ciąży i skierować je w celu uzyskania porady w sprawie antykoncepcji, jeśli nie stosują one skutecznej antykoncepcji. Jeśli lekarz wystawiający receptę na ten produkt leczniczy nie ma kompetencji, aby udzielić takich informacji, pacjentkę należy skierować do odpowiedniego lekarza specjalisty. Jako niezbędne minimum, pacjentki, które mogą zajść w ciążę muszą stosować co najmniej jedną wysoce skuteczną (tzn. niezależną od użytkownika) metodę antykoncepcji, lub dwie uzupełniające się metody antykoncepcji zależne od użytkownika przez co najmniej jeden miesiąc przed rozpoczęciem leczenia, w trakcie trwania leczenia i przez 1 miesiąc po zakończeniu leczenia izotretynoiną, nawet w przypadku całkowitego braku miesiączek.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Przy wyborze metody antykoncepcji należy w każdym przypadku wziąć pod uwagę indywidualne uwarunkowania, z uwzględnieniem ich omówienia z pacjentką, tak aby zapewnić jej zaangażowanie i stosowanie się do zaleceń dotyczących wybranych środków. Testy ciążowe Zgodnie z miejscową praktyką, zalecane jest przeprowadzenie nadzorowanych przez personel medyczny testów ciążowych o minimalnej czułości 25 mlU/mL w sposób opisany poniżej. Przed rozpoczęciem terapii Co najmniej na jeden miesiąc po rozpoczęciu stosowania antykoncepcji oraz krótko (optymalnie na kilka dni) przed pierwszym przepisaniem produktu leczniczego, u pacjentki powinien być przeprowadzony test ciążowy nadzorowany przez personel medyczny. Test ten powinien wykazać, że pacjentka nie jest w ciąży w momencie rozpoczęcia leczenia izotretynoiną. Wizyty kontrolne Wizyty kontrolne należy przeprowadzać w regularnych odstępach czasu, optymalnie co miesiąc.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Należy ustalić konieczność przeprowadzenia wielokrotnych comiesięcznych testów ciążowych zgodnie z lokalnymi praktykami, biorąc pod uwagę między innymi aktywność seksualną pacjentki, ostatnie cykle miesiączkowe (zaburzenia miesiączkowania, nieregularne miesiączkowanie lub całkowity brak miesiączek) oraz metodę antykoncepcji. Jeśli jest to wskazane, kontrolne testy ciążowe należy przeprowadzić w dniu wizyty, podczas której lekarz przepisze produkt leczniczy lub w ciągu 3 dni przed tą wizytą. Zakończenie leczenia Miesiąc po zakończeniu leczenia, u kobiet należy wykonać końcowy test ciążowy. Ograniczenia dotyczące przepisywania i wydawania produktu leczniczego Kobietom w wieku rozrodczym należy optymalnie przepisywać produkt leczniczy Axotret w ilości ograniczonej do 30 dni leczenia, w celu zapewnienia regularnego odbywania wizyt kontrolnych, w tym testów ciążowych i monitorowania.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Najlepiej, aby wykonanie testu ciążowego, wypisanie recepty i zrealizowanie recepty na produkt leczniczy Axotret nastąpiło tego samego dnia. Comiesięczne wizyty kontrolne pozwalają zagwarantować regularne przeprowadzanie testów ciążowych i monitorowanie oraz upewnienie się, że pacjentka nie jest w ciąży przed otrzymaniem kolejnego cyklu kuracji. Pacjenci płci męskiej Dostępne dane sugerują, że poziom ekspozycji matki na produkt leczniczy Axotret zawarty w spermie pacjentów leczonych produktem leczniczym Axotret nie jest wystarczająco wysoki, aby był związany z teratogennym działaniem. Pacjenci płci męskiej powinni pamiętać, że nie wolno im dzielić się produktem leczniczym z żadną inną osobą, a szczególnie z kobietami. Dodatkowe środki ostrożności Pacjentów należy pouczyć, aby nigdy nie przekazywali tego produktu leczniczego innej osobie i aby zwrócili wszystkie niezużyte kapsułki farmaceucie po zakończeniu leczenia.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Pacjenci nie powinni być dawcami krwi w trakcie terapii i przez 1 miesiąc po zaprzestaniu przyjmowania produktu leczniczego Axotret, z powodu potencjalnego zagrożenia dla płodu u pacjentki w ciąży otrzymującej transfuzję krwi. Materiały edukacyjne Aby pomóc w zapobieganiu ekspozycji płodu na działanie izotretynoiny lekarzom wypisującym receptę, farmaceutom i pacjentom, przedstawiciel podmiotu odpowiedzialnego udostępni materiały edukacyjne w celu zwiększenia skuteczności ostrzeżeń o teratogenności izotretynoiny, udzielenia porad na temat antykoncepcji przed rozpoczęciem terapii i poinformowania o konieczności przeprowadzania testów ciążowych. Wszyscy pacjenci, zarówno mężczyźni, jak i kobiety, powinni otrzymać od lekarza wyczerpujące informacje na temat ryzyka teratogennego i rygorystycznych metod zapobiegania ciąży, które podano w Programie Zapobiegania Ciąży.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Zaburzenia psychiczne U pacjentów leczonych izotretynoiną (patrz punkt 4.8), zgłaszane były: depresja, nasilenie się depresji, lęk, skłonność do agresji, wahania nastroju, objawy psychotyczne oraz, bardzo rzadko, myśli samobójcze, próby samobójcze i samobójstwa (patrz punkt 4.8). Szczególna ostrożność konieczna jest u pacjentów z depresją w wywiadzie. Wszyscy pacjenci powinni być monitorowani pod względem objawów depresji i w razie konieczności, kierowani na odpowiednie leczenie. Jednak przerwanie podawania izotretynoiny może nie być wystarczające, aby złagodzić te objawy, dlatego konieczna może być dalsza ocena psychiatryczna lub psychologiczna. Uprzedzenie rodziny lub przyjaciół o możliwości wystąpienia takich objawów, może być pomocne w rozpoznaniu pogorszenia się stanu zdrowia psychicznego.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Zaburzenia skóry i tkanki podskórnej Na początku terapii niekiedy obserwuje się zaostrzenie objawów trądziku, jednak ustępuje ono wraz z kontynuacją leczenia, zwykle w ciągu 7-10 dni i przeważnie nie ma potrzeby zmiany dawkowania izotretynoiny. Należy unikać ekspozycji na intensywne promieniowanie słoneczne lub promieniowanie ultrafioletowe. W razie konieczności, należy zastosować produkty zawierające filtry UV, co najmniej o wartości SPF 15. U pacjentów przyjmujących izotretynoinę oraz w okresie do 5-6 miesięcy po zakończeniu terapii należy unikać agresywnej chemicznej dermabrazji oraz leczenia skóry laserem, występuje bowiem wówczas ryzyko powstawania blizn o nietypowym umiejscowieniu oraz rzadziej pozapalnych przebarwień lub odbarwień w leczonych miejscach skóry. Co najmniej do 6 miesięcy po zakończeniu leczenia izotretynoiną należy zaniechać depilacji z użyciem wosku, z uwagi na ryzyko zerwania naskórka.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Należy unikać jednoczesnego stosowania izotretynoiny z podawanymi miejscowo lekami keratolitycznymi lub produktami złuszczającymi stosowanymi w leczeniu trądziku, ponieważ mogłoby wystąpić nadmierne podrażnienie skóry (patrz punkt 4.5). Należy poradzić pacjentom, żeby od początku leczenia izotretynoiną stosowali do nawilżenia skóry maść lub krem oraz balsam do ust, ponieważ izotretynoina powoduje wysuszenie skóry i ust. Po wprowadzeniu produktu leczniczego do obrotu zgłaszano przypadki ciężkich reakcji skórnych (np. rumień wielopostaciowy, zespół Stevensa-Johnsona i martwica toksyczno-rozpływna naskórka) związanych ze stosowaniem izotretynoiny. Ze względu na to, że zdarzenia te mogą być trudne do odróżnienia od innych reakcji skórnych, które mogą wystąpić (patrz punkt 4.8), pacjenci powinni być poinformowani o możliwych objawach przedmiotowych i podmiotowych oraz uważnie monitorowani w kierunku ciężkich reakcji skórnych.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Jeżeli podejrzewa się wystąpienie ciężkiej reakcji skórnej, leczenie izotretynoiną należy przerwać. Reakcje alergiczne Opisywano rzadkie przypadki reakcji anafilaktycznych, w niektórych przypadkach po uprzednim miejscowym stosowaniu retynoidów. Niezbyt często zgłaszano skórne reakcje alergiczne. Donoszono o ciężkich przypadkach alergicznego zapalenia naczyń, często z plamicą (siniaki i czerwone plamy) w obrębie kończyn oraz z innymi objawami niedotyczącymi skóry. W razie wystąpienia ciężkich reakcji alergicznych należy przerwać leczenie i starannie obserwować pacjenta. Zaburzenia oka Suchość oczu, zmętnienie rogówki, pogorszenie widzenia w ciemnościach i zapalenie rogówki na ogół ustępuje po przerwaniu leczenia. Notowano przypadki suchości oka, która nie ustępowała po zakończeniu leczenia. Suchość oczu można łagodzić stosując maść nawilżającą do oczu albo preparat zastępujący łzy.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Może wystąpić nietolerancja na soczewki kontaktowe, co może oznaczać, że podczas leczenia pacjent będzie musiał nosić okulary. Opisywano ponadto niedowidzenie o zmroku, które u niektórych pacjentów pojawiało się nagle (patrz punkt 4.7). Pacjentów z zaburzeniami widzenia należy skierować do okulisty. Może być konieczne przerwanie stosowania izotretynoiny. Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Opisywano występowanie bólów mięśni, bólów stawów oraz zwiększenie aktywności fosfokinazy kreatynowej w surowicy krwi u pacjentów przyjmujących izotretynoinę, szczególnie u osób wykonujących intensywny wysiłek fizyczny (patrz punkt 4.8). Po kilkuletnim stosowaniu izotretynoiny w bardzo dużych dawkach w leczeniu zaburzeń rogowacenia obserwowano zmiany kostne, w tym przedwczesne zarastanie chrząstek nasadowych, przerost kości i zwapnienia w ścięgnach i więzadłach.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
W tej grupie pacjentów stosowano na ogół znacznie większe dawki, dłuższy czas leczenia i większe dawki skumulowane, w porównaniu do stosowanych w leczeniu trądziku. U pacjentów narażonych na izotretynoinę notowano zapalenie stawów krzyżowo-biodrowych. W celu odróżnienia zapalenia stawów krzyżowo-biodrowych od innych przyczyn bólu pleców, u pacjentów z klinicznymi objawami zapalenia stawów krzyżowo-biodrowych może być konieczna dalsza ocena obejmująca badania obrazowe, takie jak rezonans magnetyczny. W przypadkach odnotowanych po wprowadzeniu produktu do obrotu, objawy związane z zapaleniem stawów krzyżowo-biodrowych słabły po przerwaniu stosowania produktu leczniczego Axotret i zastosowaniu odpowiedniego leczenia. Łagodne nadciśnienie wewnątrzczaszkowe Opisano przypadki łagodnego nadciśnienia wewnątrzczaszkowego, przy czym część dotyczyła pacjentów przyjmujących jednocześnie tetracykliny (patrz punkty 4.3 i 4.5).
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Objawy przedmiotowe i podmiotowe łagodnego nadciśnienia wewnątrzczaszkowego są następujące: ból głowy, nudności i wymioty, zaburzenia widzenia i obrzęk tarczy nerwu wzrokowego. Pacjenci, u których pojawia się łagodne nadciśnienie wewnątrzczaszkowe, muszą natychmiast zaprzestać leczenia izotretynoiną. Zaburzenia wątroby i dróg żółciowych Należy kontrolować aktywność enzymów wątrobowych przed leczeniem, po upływie 1 miesiąca po rozpoczęciu leczenia a następnie, co 3 miesiące, o ile nie będzie wskazań klinicznych do częstszego ich kontrolowania. Opisywano przemijające i odwracalne zwiększenie aktywności aminotransferaz. W wielu przypadkach wartości te mieściły się w zakresie prawidłowych wartości i podczas leczenia powracały do stanu początkowego. Gdyby jednak doszło do utrzymującego się i klinicznie istotnego zwiększenia aktywności aminotransferaz, należy rozważyć zmniejszenie dawki lub zaprzestanie leczenia izotretynoiną.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Niewydolność nerek Zaburzenia czynności nerek i niewydolność nerek nie mają wpływu na właściwości farmakokinetyczne izotretynoiny. Dlatego też produkt leczniczy można stosować u pacjentów z niewydolnością nerek. Zaleca się jednak rozpoczynanie leczenia od mniejszej dawki i stopniowe zwiększanie jej do maksymalnej dawki tolerowanej przez pacjenta (patrz punkt 4.2). Metabolizm lipidów Należy kontrolować stężenia lipidów w surowicy (na czczo) przed leczeniem, po upływie 1 miesiąca po rozpoczęciu leczenia, a następnie, co 3 miesiące, o ile nie będzie wskazań klinicznych do częstszego ich kontrolowania. Zwiększone stężenia lipidów powracają na ogół do wartości prawidłowych po zmniejszeniu dawki lub zakończeniu terapii, może również wystąpić odpowiedź na zmianę diety. Opisywano związek między stosowaniem izotretynoiny a zwiększeniem stężeń trójglicerydów w osoczu.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Należy zaprzestać leczenia izotretynoiną, jeżeli nie udaje się ustabilizować hipertrójglicerydemii do osiągnięcia odpowiedniego stężenia trójglicerydów w osoczu lub kiedy występują objawy zapalenia trzustki (patrz punkt 4.8). Stężenia trójglicerydów ponad 800 mg/dl lub 9 mmol/l mogą wystąpić w przebiegu ostrego zapalenia trzustki, które może prowadzić do zgonu. Zaburzenia żołądka i jelit Stosowanie izotretynoiny wiązało się z wystąpieniem zapalnych chorób jelit (w tym choroby Leśniowskiego-Crohna) u pacjentów bez zaburzeń jelitowych w wywiadzie. W razie wystąpienia ciężkiej biegunki (krwotocznej) należy natychmiast zaprzestać leczenia izotretynoiną. Pacjenci z grupy wysokiego ryzyka U pacjentów z cukrzycą, otyłością, u alkoholików lub u pacjentów z zaburzeniami metabolizmu lipidów, leczonych izotretynoiną, może być konieczne częstsze kontrolowanie stężeń lipidów w surowicy i (lub) stężenia glukozy we krwi.
- CHPL leku Axotret, kapsułki miękkie, 20 mgSpecjalne środki ostrozności
Opisywano zwiększone stężenia glukozy we krwi na czczo oraz rozpoznano nowe przypadki cukrzycy w czasie leczenia izotretynoiną. Produkt leczniczy Axotret zawiera małe ilości etanolu (alkoholu), mniej niż 100 mg na dawkę. Produkt leczniczy Axotret zawiera olej sojowy. Nie stosować w razie stwierdzonej nadwrażliwości na orzeszki ziemne albo soję.
- CHPL leku Axotret, kapsułki miękkie, 20 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na ryzyko hiperwitaminozy A pacjentom nie wolno jednocześnie przyjmować leków zawierających witaminę A. Opisywano przypadki łagodnego nadciśnienia wewnątrzczaszkowego (rzekomy guz mózgu) podczas jednoczesnego stosowania izotretynoiny i tetracyklin. Dlatego należy unikać jednoczesnego stosowania izotretynoiny z tetracyklinami (patrz punkty 4.3 i 4.4). Należy unikać jednoczesnego stosowania izotretynoiny z podawanymi miejscowo lekami keratolitycznymi lub produktami złuszczającymi stosowanymi w leczeniu trądziku, ponieważ mogłoby wystąpić nadmierne podrażnienie skóry (patrz punkt 4.4).
- CHPL leku Axotret, kapsułki miękkie, 20 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Izotretynoina stosowana w czasie ciąży powoduje ciężkie wady wrodzone. Produkt leczniczy Axotret jest przeciwwskazany (patrz punkt 4.3 i 4.4) w okresie ciąży. Kobiety w wieku rozrodczym muszą stosować skuteczną antykoncepcję w czasie (oraz w ciągu jednego miesiąca po zakończeniu) leczenia. Stosowanie izotretynoiny w okresie ciąży jest bezwzględnie przeciwwskazane (patrz punkt 4.3 i 4.4). Jeżeli pomimo zachowania wymaganych, wymienionych środków ostrożności w czasie stosowania izotretynoiny lub w ciągu miesiąca po zaprzestaniu jej przyjmowania pacjentka zajdzie w ciążę, istnieje duże ryzyko wystąpienia bardzo ciężkich wad rozwojowych u płodu. Do wad rozwojowych, które są związane z ekspozycją na izotretynoinę należą: wady ośrodkowego układu nerwowego (wodogłowie, wady rozwojowe/zniekształcenia móżdżku, małogłowie), zniekształcenia twarzy, rozszczep podniebienia, wady ucha zewnętrznego (brak ucha zewnętrznego, małe zewnętrzne przewody słuchowe lub ich brak), wady oka (małoocze), wady układu sercowo-naczyniowego (wady rozwojowe wspólnego pnia tętniczego, takie jak tetralogia Fallota, przełożenie wielkich naczyń, defekty przegrody), wady grasicy i przytarczyc.
- CHPL leku Axotret, kapsułki miękkie, 20 mgWpływ na płodność, ciążę i laktację
Ponadto, częściej występują poronienia samoistne. Jeżeli podczas leczenia izotretynoiną kobieta zajdzie w ciążę, leczenie musi być przerwane. Pacjentkę należy skierować do lekarza specjalizującego się lub mającego doświadczenie w dziedzinie teratologii, w celu przeprowadzenia badań i uzyskania porady. Karmienie piersi? Izotretynoina jest związkiem silnie lipofilnym, dlatego jest bardzo prawdopodobne, że przenika do mleka kobiecego. Ze względu na ryzyko działań niepożądanych u matki i dziecka, stosowanie izotretynoiny w okresie karmienia piersią jest przeciwwskazane.
- CHPL leku Axotret, kapsułki miękkie, 20 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Podczas leczenia izotretynoiną w szeregu przypadków występowało osłabienie widzenia w nocy, które w rzadkich przypadkach utrzymywało się po zakończeniu leczenia (patrz punkty 4.4 i 4.8). Ponieważ wystąpiło ono u niektórych pacjentów nagle, należy zwracać uwagę pacjentów na możliwość wystąpienia tego zaburzenia i ostrzec, aby zachowali ostrożność w czasie prowadzenia pojazdów i obsługiwania maszyn. Senność, zawroty głowy i zaburzenia widzenia obserwowano bardzo rzadko. Pacjentów należy ostrzec, że w przypadku wystąpienia powyższych objawów, nie powinni prowadzić pojazdów ani uczestniczyć w innych aktywnościach, gdzie mogliby narazić siebie lub innych na niebezpieczeństwo.
- CHPL leku Axotret, kapsułki miękkie, 20 mgDziałania niepożądane
4.8 Działania niepożądane Do działań niepożądanych najczęściej zgłaszanych podczas stosowania izotretynoiny należą: suchość błon śluzowych, np. warg, zapalenie warg, suchość błony śluzowej nosa, krwawienia z nosa oraz oka, zapalenie spojówek, suchość skóry. Niektóre działania niepożądane izotretynoiny zależą od dawki. Objawy niepożądane na ogół ustępują po zmianie dawki lub zaprzestaniu leczenia, niektóre mogą jednak utrzymywać się po zakończeniu leczenia. Klasyfikacja układów i narządów MedDRA Zakażenia i zarażenia pasożytnicze: Bardzo rzadko (≤1/10 000) zakażenia (skóry i błon śluzowych) wywołane przez bakterie Gram-dodatnie Zaburzenia krwi i układu chłonnego: Bardzo często (≥1/10) niedokrwistość, przyspieszone OB, małopłytkowość, nadpłytkowość Często (≥1/100 do <1/10) neutropenia Bardzo rzadko (≤1/10 000) limfadenopatia Zaburzenia układu immunologicznego: Rzadko (≥1/10 000 do <1/1000) alergiczne reakcje skórne, reakcje anafilaktyczne, nadwrażliwość Zaburzenia metabolizmu i odżywiania: Bardzo rzadko (≤1/10 000) cukrzyca, hiperurykemia Zaburzenia psychiczne: Rzadko (≥1/10 000 do <1/1000) depresja, nasilenie objawów depresji, skłonność do agresji, lęk, zmiany nastroju Bardzo rzadko (≤1/10 000) samobójstwo, próby samobójcze, myśli samobójcze, zaburzenia psychotyczne, zaburzenia zachowania Zaburzenia układu nerwowego: Często (≥1/100 do <1/10) ból głowy Bardzo rzadko (≤1/10 000) łagodne nadciśnienie wewnątrzczaszkowe, drgawki, senność, zawroty głowy Zaburzenia oka: Bardzo często (≥1/10) zapalenie powiek, zapalenie spojówek, suchość oka, podrażnienie oka Bardzo rzadko (≤1/10 000) nieostre widzenie, zaćma, ślepota barw (zaburzenia widzenia barw), nietolerancja soczewek kontaktowych, zmętnienie rogówki, pogorszenie widzenia w ciemności, zapalenie rogówki, obrzęk tarczy nerwu wzrokowego (objaw łagodnego nadciśnienia wewnątrzczaszkowego), światłowstręt, zaburzenia widzenia Zaburzenia ucha i błędnika: Bardzo rzadko (≤1/10 000) zaburzenia słuchu Zaburzenia naczyniowe: Bardzo rzadko (≤1/10 000) zapalenie naczyń (np.
- CHPL leku Axotret, kapsułki miękkie, 20 mgDziałania niepożądane
ziarniniak Wegenera, alergiczne zapalenie naczyń) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Często (≥1/100 do <1/10) krwawienia z nosa, suchość błony śluzowej nosa, zapalenie jamy nosowo-gardłowej Bardzo rzadko (≤1/10 000) skurcz oskrzeli (szczególnie u pacjentów chorych na astmę), chrypka Zaburzenia żołądka i jelit: Bardzo rzadko (≤1/10 000) zapalenie okrężnicy, zapalenie jelita krętego, suchość błony śluzowej gardła, krwotok z przewodu pokarmowego, biegunka krwotoczna i choroba zapalna jelit, nudności, zapalenie trzustki (patrz: punkt 4.4) Zaburzenia wątroby i dróg żółciowych: Bardzo często (≥1/10) zwiększona aktywność aminotransferaz (patrz: punkt 4.4) Bardzo rzadko (≤1/10 000) zapalenie wątroby Zaburzenia skóry i tkanki podskórnej: Bardzo często (≥1/10) zapalenie czerwieni warg, zapalenie skóry, suchość skóry, miejscowe złuszczanie skóry, świąd, wysypka rumieniowa, kruchość skóry (ryzyko urazu w wyniku tarcia) Rzadko (≥1/10 000 do <1/1000) łysienie Bardzo rzadko (≤1/10 000) trądzik piorunujący, zaostrzenie objawów trądziku (nawrót trądziku), rumień (twarzy), wykwity, zaburzenia włosów, hirsutyzm, dystrofia paznokci, zanokcica, reakcje nadwrażliwości na światło, ziarniniak ropotwórczy, przebarwienie skóry, zwiększona potliwość Częstość nieznana* rumień wielopostaciowy, zespół Stevensa-Johnsona, toksyczno-rozpływna martwica naskórka; ciężka wysypka skórna (rumień wielopostaciowy) pojawiająca się początkowo jako okrągłe plamy często z pęcherzykiem w środku, zwykle na ramionach i rękach lub nogach i stopach, ale może dotyczyć także wszystkich części ciała.
- CHPL leku Axotret, kapsułki miękkie, 20 mgDziałania niepożądane
Jeśli wysypka się rozwinie, pacjent powinien przerwać leczenie produktem leczniczym Axotret i skontaktować się z lekarzem. Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Bardzo często (≥1/10) bóle stawów, bóle mięśni, bóle pleców (zwłaszcza u dzieci i młodzieży) Bardzo rzadko (≤1/10 000) zapalenie stawów, wapnica (zwapnienia więzadeł i ścięgien), przedwczesne kostnienie chrząstek nasadowych, wyrośle kostne (nadmierne kostnienie), zmniejszenie gęstości kości, zapalenie ścięgien, rabdomioliza Częstość nieznana* zapalenie stawów krzyżowo-biodrowych Zaburzenia nerek i dróg moczowych: Bardzo rzadko (≤1/10 000) kłębuszkowe zapalenie nerek Częstość nieznana* zapalenie cewki moczowej Zaburzenia układu rozrodczego i piersi: Częstość nieznana* zaburzenia czynności seksualnych, w tym zaburzenia erekcji i zmniejszenie libido, ginekomastia, suchość pochwy i sromu Zaburzenia ogólne i stany w miejscu podania: Bardzo rzadko (≤1/10 000) nadmierne tworzenie ziarniny, złe samopoczucie Badania diagnostyczne: Bardzo często (≥1/10) zwiększone stężenie trójglicerydów w surowicy krwi, zmniejszone stężenie lipoprotein o dużej gęstości Często (≥1/100 do <1/10) zwiększone stężenie cholesterolu w surowicy krwi, zwiększone stężenie glukozy we krwi, krwiomocz, białkomocz Bardzo rzadko (≤1/10 000) zwiększona aktywność fosfokinazy kreatynowej we krwi * częstość nie może być określona na podstawie dostępnych danych Występowanie działań niepożądanych zostało wyliczone nad podstawie danych z badań klinicznych obejmujących 842 pacjentów i z badań po wprowadzeniu izotretynoiny do obrotu.
- CHPL leku Axotret, kapsułki miękkie, 20 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49-21-301, fax: + 48 22 49-21-309, e-mail: ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Axotret, kapsułki miękkie, 20 mgPrzedawkowanie
4.9 Przedawkowanie Izotretynoina jest pochodną witaminy A. Toksyczność ostra izotretynoiny jest niewielka, jednak po przypadkowym przedawkowaniu produktu leczniczego mogą wystąpić objawy hiperwitaminozy A. Objawami ostrego działania toksycznego witaminy A są silne bóle głowy, nudności i wymioty, senność, drażliwość i świąd. Objawy przedmiotowe i podmiotowe przypadkowego lub umyślnego przedawkowania izotretynoiny byłyby podobne. Należy się spodziewać, że objawy przedawkowania są odwracalne i ustępują bez konieczności leczenia.
- CHPL leku Axotret, kapsułki miękkie, 20 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania ogólnego, kod ATC: D10 B A01. Mechanizm działania Izotretynoina jest stereoizomerem kwasu all-trans-retynowego (tretynoiny). Dokładny mechanizm działania izotretynoiny nie został jeszcze szczegółowo wyjaśniony. Stwierdzono jednak, że poprawa obrazu klinicznego w przebiegu ciężkiego trądziku jest związana z hamowaniem aktywności gruczołów łojowych oraz histologicznie potwierdzonym zmniejszeniem gruczołów łojowych. Ponadto stwierdzono, że izotretynoina działa przeciwzapalnie na skórę. Skuteczność kliniczna i bezpieczeństwo stosowania Nadmierne rogowacenie nabłonkowej wyściółki cebulek włosowych i gruczołów łojowych prowadzi do łuszczenia się korneocytów do przewodu kanalika oraz jego zablokowania przez keratynę i nadmierną ilość łoju. W wyniku tego dochodzi do powstania zaskórników i ostatecznie zmian zapalnych.
- CHPL leku Axotret, kapsułki miękkie, 20 mgWłaściwości farmakodynamiczne
Izotretynoina hamuje proliferację komórek łojowych i w przebiegu trądziku działa w taki sposób, że odtwarza prawidłowy proces różnicowania się tych komórek. Łój jest głównym substratem sprzyjającym rozwojowi bakterii Propionibacterium acnes. Zmniejszenie jego wydzielania hamuje więc namnażanie się bakterii w obrębie kanalika wyprowadzającego gruczołu łojowego.
- CHPL leku Axotret, kapsułki miękkie, 20 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Wchłanianie izotretynoiny z przewodu pokarmowego jest zmienne i liniowo zależne od dawki w zakresie wartości terapeutycznych. Nie określono całkowitej biodostępności izotretynoiny, gdyż nie ma postaci dożylnej leku przeznaczonej do stosowania u ludzi, jednak ekstrapolacja wyników uzyskanych w doświadczeniach na psach wskazuje na niewielką i zmienną układową biodostępność. Biodostępność produktu leczniczego, gdy jest podawany z pokarmem, jest dwa razy większa niż jego biodostępność, gdy jest podawany na czczo. Dystrybucja Izotretynoina w znacznym stopniu wiąże się z białkami osocza, głównie z albuminami (99,9%). Nie określono objętości dystrybucji izotretynoiny u człowieka, ponieważ nie ma postaci dożylnej izotretynoiny przeznaczonej do stosowania u ludzi. Jest niewiele danych dotyczących dystrybucji izotretynoiny do tkanek u ludzi. Stężenia izotretynoiny w naskórku są o połowę mniejsze niż w surowicy krwi.
- CHPL leku Axotret, kapsułki miękkie, 20 mgWłaściwości farmakokinetyczne
Ze względu na słabą penetrację izotretynoiny do krwinek czerwonych, stężenie izotretynoiny w osoczu krwi jest około 1,7 razy większe niż w pełnej krwi. Metabolizm Po podaniu doustnym izotretynoiny w osoczu krwi wyodrębniono trzy główne metabolity: 4-oksoizotretynoinę, tretynoinę (kwas all-trans-retynowy) i 4-oksotretynoinę. W szeregu badań in vitro wykazano aktywność biologiczną tych metabolitów. W badaniu klinicznym wykazano, że 4-oksoizotretynoina jest istotnym elementem aktywności izotretynoiny (zmniejszenie wydzielania łoju, pomimo tego, że nie ma wpływu na stężenie izotretynoiny i tretynoiny w osoczu). Do innych, mniej ważnych metabolitów, należą glukuronidy. Głównym metabolitem jest 4-oksoizotretynoina, której stężenie w osoczu w stanie równowagi stężeń jest 2,5 razy większe niż stężenie substancji macierzystej.
- CHPL leku Axotret, kapsułki miękkie, 20 mgWłaściwości farmakokinetyczne
Metabolizm tretynoiny jest związany z metabolizmem izotretynoiny, ponieważ izotretynoina i tretynoina (kwas all-trans-retynowy) ulegają wzajemnym odwracalnym przemianom jedna w drugą (interkonwersja). Szacuje się, że 20%-30% dawki izotretynoiny ulega izomeryzacji. Krążenie jelitowo-wątrobowe przypuszczalnie ma duże znaczenie w farmakokinetyce izotretynoiny u ludzi. Badania metabolizmu in vitro wskazują, że w metabolizmie izotretynoiny do 4-oksoizotretynoiny i tretynoiny uczestniczy szereg enzymów CYP. Wydaje się, że żaden enzym nie odgrywa dominującej roli. Izotretynoina i jej metabolity nie mają istotnego wpływu na aktywność CYP. Eliminacja Po podaniu doustnym izotretynoiny znakowanej radioizotopem, podobne części dawki wykrywano w moczu i kale. Po podaniu doustnym izotretynoiny okres półtrwania w końcowej fazie eliminacji w postaci niezmienionej u pacjentów z trądzikiem wynosił średnio 19 godzin.
- CHPL leku Axotret, kapsułki miękkie, 20 mgWłaściwości farmakokinetyczne
Okres półtrwania 4-oksoizotretynoiny w końcowej fazie eliminacji jest dłuższy, wynosi średnio 29 godzin. Izotretynoina jest retynoidem występującym fizjologicznie. Po upływie dwóch tygodni po zakończeniu leczenia izotretynoiną uzyskuje się stężenia właściwe dla endogennych retynoidów. Farmakokinetyka produktu leczniczego w szczególnych grupach pacjentów Stosowanie izotretynoiny u pacjentów z zaburzeniami czynności wątroby jest przeciwwskazane, dlatego dostępne są ograniczone dane o właściwościach farmakokinetycznych produktu leczniczego w tej populacji pacjentów. Niewydolność nerek nie prowadzi do istotnego zmniejszenia klirensu osoczowego izotretynoiny ani 4-oksoizotretynoiny.
- CHPL leku Axotret, kapsułki miękkie, 20 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Toksyczność ostra Toksyczność ostrą po podaniu doustnym izotretynoiny badano na różnych gatunkach zwierząt. U królików LD50 wynosiła około 2000 mg/kg mc., u myszy – około 3000 mg/kg mc., a u szczurów ponad 4000 mg/kg mc. Toksyczność przewlekła Dłogotrwałe badanie na szczurach trwające ponad 2 lata (w którym izotretynoinę podawano w dawkach 2, 8 i 32 mg/kg mc. na dobę) wykazało występowanie częściowego wypadania włosów i zwiększenie stężeń trójglicerydów w osoczu krwi u szczurów, którym podawano większe dawki leku. Rodzaje i częstość występowania działań niepożądanych izotretynoiny są u gryzoni podobne do działań niepożądanych witaminy A. Nie obserwuje się jednak takich masywnych zwapnień tkanek i narządów, jak u szczurów, którym podawano witaminę A. Zmiany w komórkach wątrobowych, obserwowane podczas stosowania witaminy A nie występują podczas stosowania izotretynoiny.
- CHPL leku Axotret, kapsułki miękkie, 20 mgPrzedkliniczne dane o bezpieczeństwie
Wszystkie działania niepożądane, stanowiące zespół hiperwitaminozy A, ustępują samoistnie po zakończeniu leczenia izotretynoiną. Nawet zwierzęta doświadczalne, których stan ogólny był zły, w ciągu 1–2 tygodni w większości wyzdrowiały. Działanie teratogenne Podobnie jak w przypadku innych pochodnych witaminy A, w badaniach na zwierzętach wykazano, że izotretynoina działa teratogennie i embriotoksycznie. Ze względu na działanie teratogenne izotretynoiny, jej stosowanie u kobiet w wieku rozrodczym wiąże się z konsekwencjami terapeutycznymi (patrz punkty 4.3, 4.4 oraz 4.6). Wpływ na płodność Izotretynoina przyjmowana w dawkach terapeutycznych przez mężczyzn nie ma wpływu na liczbę, ruchliwość i budowę plemników oraz nie ma szkodliwego wpływu na tworzenie się i rozwój zarodka. Działanie mutagenne W badaniach in vitro oraz in vivo na zwierzętach okazało się, że izotretynoina nie ma działania mutagennego ani rakotwórczego.
- CHPL leku Axotret, kapsułki miękkie, 20 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Uwodorniony olej sojowy Uwodorniony olej roślinny Wosk pszczeli biały Disodu edetynian Butylohydroksyanizol Olej sojowy rafinowany Otoczka (tylko dla Axotret, 10 mg): Żelatyna Glicerol Żelaza tlenek czerwony (E172) Tytanu dwutlenek (E171) Woda oczyszczona Otoczka (tylko dla Axotret, 20 mg): Żelatyna Glicerol Czerwień allura (E129) Błękit brylantowy (E133) Tytanu dwutlenek (E171) Woda oczyszczona Atrament do nadruku: Szelak Żelaza tlenek czarny (E172) N-butanol Glikol propylenowy Izopropanol Amonu wodorotlenek 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać w oryginalnym opakowaniu. 6.5 Rodzaj i zawartość opakowania Opakowanie bezpośrednie: Blister PVC/PVDC/PE/PP/Aluminium, w tekturowym pudełku.
- CHPL leku Axotret, kapsułki miękkie, 20 mgDane farmaceutyczne
Blister PVC/PVDC/PE/Aluminium/P/SL, w tekturowym pudełku. Blister PVC/PVDC/PE/Aluminium, w tekturowym pudełku. Wielkość opakowania: 30 lub 60 kapsułek, miękkich, umieszczonych w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania Po zakończeniu leczenia, wszystkie pozostałe kapsułki należy usuwać zgodnie z miejscowymi przepisami.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Curacne 5 mg, kapsułki, miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 5 mg izotretynoiny (Isotretinoinum). Substancje pomocnicze o znanym działaniu: 1 kapsułka miękka zawiera 52,1 mg rafinowanego oleju sojowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Kapsułki, miękkie. Każda kapsułka miękka 5 mg ma dwukolorową nieprzezroczystą czerwono/brązowo-kremową osłonkę żelatynową z jasno-żółto/pomarańczowym wypełnieniem oraz nadrukiem „5” na jednej stronie.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgWskazania do stosowania
4.1 Wskazania do stosowania Ciężkie postacie trądziku (jak trądzik guzkowy, trądzik skupiony lub trądzik z ryzykiem powstawania trwałych blizn) oporne na prawidłowo przeprowadzone standardowe leczenie lekami przeciwbakteryjnymi działającymi ogólnie oraz lekami stosowanymi miejscowo.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Izotretynoina może być przepisywana wyłącznie przez lekarza mającego doświadczenie w leczeniu ciężkich postaci trądziku działającymi ogólnie retynoidami oraz pełną wiedzę o ryzyku leczenia izotretynoiną i wymogach dotyczących monitorowania pacjenta, bądź pod nadzorem lekarza spełniającego te warunki. Dawkowanie Dorośli, w tym młodzież i pacjenci w podeszłym wieku: Leczenie izotretynoiną należy rozpocząć od dawki 0,5 mg/kg mc. na dobę. Odpowiedź na leczenie izotretynoiną oraz niektóre działania niepożądane są zależne od dawki i różnią się u poszczególnych pacjentów. Z tego względu konieczne jest indywidualne dostosowanie dawkowania podczas terapii. Dla większości pacjentów dawka wynosi od 0,5 mg/kg mc. do 1 mg/kg mc. na dobę. Uzyskanie długotrwałej remisji oraz częstość występowania nawrotów choroby bardziej zależą od całkowitej podanej dawki, niż od czasu leczenia lub dawki dobowej.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgDawkowanie
Wykazano, że nie należy oczekiwać znaczących dodatkowych korzyści leczniczych po zastosowaniu dawki skumulowanej większej niż 120-150 mg/kg mc. Czas leczenia jest uzależniony od indywidualnej dawki dobowej. Leczenie trwające od 16 do 24 tygodni zwykle wystarcza do uzyskania remisji. U większości pacjentów, całkowite ustąpienie objawów trądziku uzyskuje się po jednorazowym cyklu leczenia. W przypadku wyraźnego nawrotu choroby, można rozważyć powtórzenie cyklu leczenia izotretynoiną, stosując taką samą dawkę dobową i skumulowaną. Ze względu na to, że dalsze ustępowanie objawów trądziku może wystąpić w czasie do 8 tygodni po zakończeniu leczenia, nie należy podejmować kolejnego cyklu leczenia przed upływem tego czasu. Szczególne grupy pacjentów Pacjenci z ciężką niewydolnością nerek: U pacjentów z ciężką niewydolnością nerek, leczenie należy rozpoczynać od mniejszej dawki (np. 10 mg/dobę).
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgDawkowanie
Dawkę należy następnie zwiększać do wartości nie większej niż 1 mg/kg mc./dobę lub do maksymalnej dawki tolerowanej przez pacjenta (patrz punkt 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania”). Pacjenci z nietolerancją: U pacjentów z objawami ciężkiej nietolerancji produktu po zastosowaniu zalecanej dawki, można kontynuować leczenie mniejszą dawką. Powoduje to przedłużenie terapii oraz wiąże się z większym ryzykiem nawrotu choroby. Aby osiągnąć maksymalną możliwą skuteczność leczenia u tych pacjentów, należy kontynuować leczenie stosując największą dawkę tolerowaną przez pacjenta. Dzieci i młodzież: Izotretynoina nie jest wskazana w leczeniu trądziku występującego przed okresem dojrzewania i nie zaleca się jej stosowania u dzieci w wieku poniżej 12 lat, gdyż nie ustalono bezpieczeństwa stosowania i skuteczności w tej grupie wiekowej. Sposób podawania: Podanie doustne. Kapsułki należy przyjmować doustnie z pokarmem, raz lub dwa razy na dobę.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgPrzeciwwskazania
4.3 Przeciwwskazania Izotretynoina jest przeciwwskazana u kobiet w okresie ciąży i karmienia piersią (patrz punkt 4.6 „Wpływ na płodność, ciążę i laktację”). Izotretynoina jest przeciwwskazana u kobiet w okresie rozrodczym, o ile nie są spełnione wszystkie wymagania Programu Zapobiegania Ciąży (patrz punkt 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania”). Izotretynoina jest również przeciwwskazana u pacjentów: z nadwrażliwością na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, z niewydolnością wątroby, ze zwiększonym stężeniem lipidów we krwi, z hiperwitaminozą A, z alergią na orzeszki ziemne lub olej sojowy, ze względu na zawartość oleju sojowego w produkcie, jednocześnie leczonych tetracyklinami (patrz punkt 4.5 „Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji”). przyjmujących witaminę A, przyjmujących inne retynoidy (acytretyna, alitretynoina).
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgPrzeciwwskazania
Działanie teratogenne: Produkt leczniczy Curacne 5 mg jest lekiem o silnym działaniu teratogennym u ludzi powodującym często występujące ciężkie i zagrażające życiu wady wrodzone. Produkt leczniczy Curacne 5 mg jest bezwzględnie przeciwwskazany do stosowania u: kobiet w ciąży kobiet w wieku rozrodczym, chyba że spełnione zostały wszystkie poniższe warunki Programu Zapobiegania Ciąży.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Program Zapobiegania Ciąży Ten produkt leczniczy ma działanie TERATOGENNE. Izotretynoina jest przeciwwskazana u kobiet w wieku rozrodczym, chyba że spełnione zostaną wszystkie wymienione poniżej wymagania Programu Zapobiegania Ciąży: Pacjentka ma ciężką postać trądziku (jak trądzik guzkowy i trądzik skupiony lub trądzik stanowiący ryzyko powstania trwałych blizn) oporną na prawidłowo przeprowadzone standardowe leczenie lekami przeciwbakteryjnymi działającymi ogólnie oraz lekami stosowanymi miejscowo (patrz punkt 4.1 „Wskazania do stosowania”). Możliwość zajścia w ciążę musi zostać oceniona dla wszystkich pacjentek. Pacjentka rozumie ryzyko działań teratogennych. Pacjentka rozumie konieczność ścisłej comiesięcznej obserwacji.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Pacjentka rozumie i akceptuje konieczność stosowania skutecznej, nieprzerywanej antykoncepcji przez 1 miesiąc przed rozpoczęciem leczenia, w trakcie trwania leczenia i przez 1 miesiąc po zakończeniu leczenia. Należy stosować co najmniej jedną wysoce skuteczną (tzn. niezależną od użytkownika) metodę antykoncepcji, lub dwie uzupełniające się metody antykoncepcji zależne od użytkownika. Przy wyborze metody antykoncepcji należy w każdym przypadku wziąć pod uwagę indywidualne uwarunkowania, z uwzględnieniem ich omówienia z pacjentką, tak aby zapewnić jej zaangażowanie i stosowanie się do zaleceń dotyczących wybranych środków. Nawet jeśli u pacjentki nie występuje miesiączka, pacjentka musi przestrzegać wszystkich zaleceń w zakresie skutecznej antykoncepcji. Pacjentka jest poinformowana o potencjalnych konsekwencjach zajścia w ciążę, jest ich świadoma oraz rozumie konieczność szybkiej konsultacji z lekarzem w razie ryzyka zajścia w ciążę, lub podejrzenia, że jest w ciąży.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Pacjentka rozumie i akceptuje konieczność regularnego poddawania się testom ciążowym przed leczeniem, w trakcie leczenia - optymalnie co miesiąc - oraz po 1 miesiącu od zakończenia leczenia. Pacjentka poświadcza, że zrozumiała zagrożenia i niezbędne środki ostrożności związane ze stosowaniem izotretynoiny. Warunki te dotyczą również kobiet, które nie są obecnie aktywne seksualnie, chyba że lekarz wystawiający receptę na ten produkt leczniczy uzna, iż istnieją jednoznaczne powody wskazujące, że nie ma ryzyka zajścia w ciążę. Lekarz wystawiający receptę na ten produkt leczniczy powinien upewnić się, że: Pacjentka przestrzega wymagań dotyczących zapobiegania ciąży podanych powyżej i potwierdziła, że zrozumiała te zagadnienia. Pacjentka potwierdziła zapoznanie się z wyżej wymienionymi wymaganiami. Pacjentka rozumie, że musi konsekwentnie i prawidłowo stosować co najmniej jedną wysoce skuteczną (tzn.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
niezależną od użytkownika) metodę antykoncepcji, lub dwie uzupełniające się metody antykoncepcji zależne od użytkownika przez co najmniej 1 miesiąc przed rozpoczęciem leczenia, w trakcie trwania leczenia i przez 1 miesiąc po zakończeniu leczenia. Ujemny wynik testu ciążowego uzyskano przed leczeniem, w trakcie leczenia i po 1 miesiącu od zakończenia leczenia. Należy udokumentować terminy i wyniki testów ciążowych. W przypadku zajścia w ciążę w trakcie leczenia izotretynoiną, leczenie musi być przerwane a pacjentkę należy skierować na badanie i po poradę do odpowiedniego lekarza doświadczonego w badaniu teratogenności. Jeżeli kobieta zajdzie w ciążę po zakończeniu leczenia, zachodzi wysokie ryzyko ciężkich i poważnych wad rozwojowych płodu. Ryzyko to utrzymuje się do czasu całkowitej eliminacji produktu, czyli do jednego miesiąca po zakończeniu leczenia.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Antykoncepcja Pacjentkom należy przekazać wyczerpujące informacje na temat zapobiegania ciąży i skierować je w celu uzyskania porady w sprawie antykoncepcji, jeśli nie stosują one skutecznej antykoncepcji. Jeśli lekarz wystawiający receptę na ten produkt leczniczy nie ma kompetencji, aby udzielić takich informacji, pacjentkę należy skierować do odpowiedniego lekarza specjalisty. Jako niezbędne minimum, pacjentki, które mogą zajść w ciążę muszą stosować co najmniej jedną wysoce skuteczną (tzn. niezależną od użytkownika) metodę antykoncepcji, lub dwie uzupełniające się metody antykoncepcji zależne od użytkownika przez co najmniej jeden miesiąc przed rozpoczęciem leczenia, w trakcie trwania leczenia i przez 1 miesiąc po zakończeniu leczenia izotretynoiną, nawet w przypadku całkowitego braku miesiączek.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Przy wyborze metody antykoncepcji należy w każdym przypadku wziąć pod uwagę indywidualne uwarunkowania, z uwzględnieniem ich omówienia z pacjentką, tak aby zapewnić jej zaangażowanie i stosowanie się do zaleceń dotyczących wybranych środków. Testy ciążowe Zgodnie z miejscową praktyką, zalecane jest przeprowadzenie nadzorowanych przez personel medyczny testów ciążowych o minimalnej czułości 25 mUI/ml w sposób opisany poniżej. Przed rozpoczęciem terapii Co najmniej na jeden miesiąc po rozpoczęciu stosowania antykoncepcji oraz krótko (optymalnie na kilka dni) przed pierwszym przepisaniem produktu leczniczego, u pacjentki powinien być przeprowadzony test ciążowy nadzorowany przez personel medyczny. Test ten powinien wykazać, że pacjentka nie jest w ciąży w momencie rozpoczęcia leczenia izotretynoiną. Wizyty kontrolne Wizyty kontrolne należy przeprowadzać w regularnych odstępach czasu, optymalnie co miesiąc.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Należy ustalić konieczność przeprowadzenia wielokrotnych comiesięcznych testów ciążowych zgodnie z lokalnymi praktykami, biorąc pod uwagę między innymi aktywność seksualną pacjentki, ostatnie cykle miesiączkowe (zaburzenia miesiączkowania, nieregularne miesiączkowanie lub całkowity brak miesiączek) oraz metodę antykoncepcji. Jeśli jest to wskazane, kontrolne testy ciążowe należy przeprowadzić w dniu wizyty, podczas której lekarz przepisze produkt leczniczy lub w ciągu 3 dni przed tą wizytą. Zakończenie leczenia Miesiąc po zakończeniu leczenia, u kobiet należy wykonać końcowy test ciążowy. Ograniczenia dotyczące przepisywania i wydawania produktu leczniczego Kobietom w wieku rozrodczym należy optymalnie przepisywać Curacne 5 mg w ilości ograniczonej do 30 dni leczenia, w celu zapewnienia regularnego odbywania wizyt kontrolnych, w tym testów ciążowych i monitorowania.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Najlepiej, aby wykonanie testu ciążowego, wypisanie recepty i zrealizowanie recepty na Curacne 5 mg nastąpiło tego samego dnia. Comiesięczne wizyty kontrolne pozwalają zagwarantować regularne przeprowadzanie testów ciążowych i monitorowanie oraz upewnienie się, że pacjentka nie jest w ciąży przed otrzymaniem kolejnego cyklu kuracji. Pacjenci płci męskiej Dostępne dane wskazują, że poziom ekspozycji matki na produkt leczniczy Curacne 5 mg zawarty w spermie pacjentów leczonych Curacne 5 mg nie jest wystarczająco wysoki, aby był związany z teratogennym działaniem. Pacjenci płci męskiej powinni pamiętać, że nie wolno im dzielić się produktem leczniczym z żadną inną osobą, a szczególnie z kobietami. Dodatkowe środki ostrożności Pacjentów należy pouczyć, aby nigdy nie przekazywali tego produktu leczniczego innej osobie i aby zwrócili wszystkie niezużyte kapsułki farmaceucie po zakończeniu leczenia.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Pacjenci nie powinni być dawcami krwi w trakcie terapii i przez 1 miesiąc po zaprzestaniu przyjmowania izotretynoiny, z powodu potencjalnego zagrożenia dla płodu u pacjentki w ciąży otrzymującej transfuzję krwi. Materiały edukacyjne Aby pomóc w zapobieganiu ekspozycji płodu na działanie izotretynoiny lekarzom wypisującym receptę, farmaceutom i pacjentom, przedstawiciel podmiotu odpowiedzialnego udostępni materiały edukacyjne w celu zwiększenia skuteczności ostrzeżeń o teratogenności izotretynoiny, udzielenia porad na temat antykoncepcji przed rozpoczęciem terapii i poinformowania o konieczności przeprowadzania testów ciążowych. Wszyscy pacjenci, zarówno mężczyźni, jak i kobiety, powinni otrzymać od lekarza wyczerpujące informacje na temat ryzyka teratogennego i rygorystycznych metod zapobiegania ciąży, które podano w Programie Zapobiegania Ciąży.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Zaburzenia psychiczne U pacjentów leczonych izotretynoiną zgłaszane były: depresja, nasilenie się depresji, lęk, skłonność do agresji, wahania nastroju, objawy psychotyczne oraz, bardzo rzadko, myśli samobójcze, próby samobójcze i samobójstwa (patrz punkt 4.8). Szczególna ostrożność konieczna jest u pacjentów z depresją w wywiadzie. Wszyscy pacjenci powinni być monitorowani pod względem objawów depresji i w razie konieczności, kierowani na odpowiednie leczenie. Jednak przerwanie podawania izotretynoiny może nie być wystarczające, aby złagodzić te objawy, dlatego konieczna może być dalsza ocena psychiatryczna lub psychologiczna. Uprzedzenie rodziny lub przyjaciół o możliwości wystąpienia takich objawów, może być pomocne w rozpoznaniu pogorszenia się stanu zdrowia psychicznego. Zaburzenia skóry i tkanki podskórnej Zaostrzenie zmian trądzikowych obserwuje się niekiedy we wstępnym okresie leczenia, zwykle ustępuje ono podczas leczenia w ciągu 7-10 dni i nie wymaga zmiany dawkowania.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Należy unikać ekspozycji na intensywne promieniowanie słoneczne i na promieniowanie UV. W razie konieczności należy stosować preparaty ochronne zawierające filtry UV o wartości przynajmniej SPF 15. Należy unikać agresywnej dermabrazji chemicznej i leczenia skóry laserem podczas leczenia izotretynoiną i w ciągu 5-6 miesięcy po jego zakończeniu, ze względu na ryzyko powstania blizn przerostowych o nietypowym umiejscowieniu i (rzadziej) pozapalnych przebarwień oraz odbarwień w leczonych obszarach skóry. Należy unikać depilacji woskiem w ciągu przynajmniej 6 miesięcy po zakończeniu leczenia, ze względu na ryzyko zerwania naskórka. Należy unikać równoczesnego stosowania izotretynoiny z miejscowymi preparatami keratolitycznymi oraz złuszczającymi, ze względu na ryzyko miejscowego podrażnienia (patrz punkt 4.5). Pacjentom należy doradzić stosowanie maści lub kremów nawilżających oraz balsamów do ust od początku leczenia, ponieważ izotretynoina może powodować suchość skóry i ust.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Zgłaszano przypadki ciężkich reakcji skórnych (np. rumień wielopostaciowy, zespół Stevensa-Johnsona i martwicę toksyczno-rozpływną naskórka) związanych ze stosowaniem izotretynoiny. Ze względu na to, że zdarzenia te mogą być trudne do odróżnienia od innych reakcji skórnych (patrz punkt 4.8), należy poinformować pacjentów o możliwych objawach przedmiotowych i podmiotowych oraz prowadzić szczegółową obserwację pacjentów w kierunku ciężkich reakcji skórnych. W przypadku podejrzenia ciężkiej reakcji skórnej należy przerwać leczenie izotretynoiną. Zaburzenia oka Suchość oka, zmętnienie rogówki, pogorszenie widzenia w nocy i zapalenie rogówki zwykle ustępują po zakończeniu leczenia. Notowano przypadki suchości oka, która nie ustępowała po zakończeniu leczenia. Objawy suchości oka można łagodzić stosując nawilżającą maść do oczu lub preparaty zastępujące łzy. Może wystąpić nietolerancja soczewek kontaktowych, co powoduje konieczność noszenia okularów podczas leczenia.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
U niektórych pacjentów opisywano pogorszenie widzenia w ciemnościach, przy czym w pewnych przypadkach objawy te pojawiały się nagle (patrz punkt 4.7 „Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn”). Pacjentów z objawami zaburzeń widzenia należy skierować na konsultację okulistyczną. Konieczne może być odstawienie izotretynoiny. Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Opisywano bóle mięśniowe, stawowe oraz zwiększenie aktywności kinazy kreatynowej w surowicy u pacjentów leczonych izotretynoiną, szczególnie u osób bardzo aktywnych fizycznie (patrz punkt 4.8 „Działania niepożądane”). Zmiany kostne, w tym przedwczesne zamknięcie chrząstek nasadowych, hiperostoza oraz zwapnienie ścięgien i więzadeł, występowały po kilku latach stosowania dużych dawek izotretynoiny w leczeniu zaburzeń rogowacenia. Wielkość dawek, czas leczenia oraz dawka skumulowana u tych pacjentów znacznie przekraczały wartości zalecane w leczeniu trądziku.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
U pacjentów narażonych na izotretynoinę notowano zapalenie stawów krzyżowo-biodrowych. W celu odróżnienia zapalenia stawów krzyżowo-biodrowych od innych przyczyn bólu pleców, u pacjentów z klinicznymi objawami zapalenia stawów krzyżowo-biodrowych może być konieczna dalsza ocena obejmująca badania obrazowe, takie jak rezonans magnetyczny. W przypadkach odnotowanych po wprowadzeniu produktu do obrotu, objawy związane z zapaleniem stawów krzyżowo-biodrowych słabły po przerwaniu stosowania produktu leczniczego Curacne i zastosowaniu odpowiedniego leczenia. Łagodne nadciśnienie wewnątrzczaszkowe Opisywano przypadki łagodnego nadciśnienia wewnątrzczaszkowego; przy czym w części przypadków stosowano równocześnie tetracykliny (patrz punkt 4.3 „Przeciwwskazania” i punkt 4.5 „Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji”).
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Przedmiotowe i podmiotowe objawy łagodnego nadciśnienia wewnątrzczaszkowego obejmują ból głowy, nudności, wymioty, zaburzenia widzenia i obrzęk tarczy nerwu wzrokowego. U pacjentów, u których wystąpi łagodne nadciśnienie wewnątrzczaszkowe, należy natychmiast przerwać leczenie izotretynoiną. Zaburzenia wątroby i dróg żółciowych O ile nie istnieją kliniczne wskazania do częstszego monitorowania, enzymy wątrobowe należy oznaczyć przed rozpoczęciem leczenia, po upływie 1. miesiąca po rozpoczęciu leczenia, a następnie w odstępach trzymiesięcznych. Opisywano przemijające i odwracalne zwiększenie aktywności aminotransferaz. W wielu przypadkach wartości te mieściły się w zakresie normy i powracały do początkowego stanu podczas dalszego leczenia. Jednak w przypadku utrzymującego się klinicznie istotnego zwiększenia aktywności aminotransferaz należy rozważyć zmniejszenie dawki lub przerwanie leczenia.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Niewydolność nerek Niewydolność nerek różnego stopnia nie wpływa na farmakokinetykę izotretynoiny, dlatego izotretynoinę można stosować u pacjentów z niewydolnością nerek. Zaleca się jednak rozpoczynanie leczenia od małej dawki, którą następnie należy stopniowo zwiększać do maksymalnej dawki tolerowanej (patrz punkt 4.2 „Dawkowanie i sposób podawania”). Metabolizm lipidów Stężenie lipidów w surowicy (na czczo) należy oznaczać przed leczeniem, po upływie miesiąca po rozpoczęciu leczenia, a następnie w odstępach trzymiesięcznych, o ile nie jest wskazane częstsze monitorowanie. Zwiększone stężenia lipidów w surowicy zwykle powracają do normy po zmniejszeniu dawki lub zaprzestaniu leczenia; mogą także reagować na zmianę diety. Izotretynoina może także powodować zwiększenie stężenia triglicerydów w surowicy. Leczenie izotretynoiną należy przerwać, jeśli nie daje się wyrównać hipertriglicerydemii lub gdy wystąpią objawy zapalenia trzustki (patrz punkt 4.8 „Działania niepożądane”).
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Stężenia przekraczające 800 mg/dl lub 9 mmol/l mogą niekiedy prowadzić do wystąpienia ostrego zapalenia trzustki, które może spowodować zgon. Zaburzenia żołądkowo-jelitowe Stosowanie izotretynoiny wiązało się w niektórych przypadkach z występowaniem chorób zapalnych jelit (w tym odcinkowego zapalenia jelita krętego) u pacjentów bez zaburzeń jelitowych w wywiadzie. W razie wystąpienia ciężkiej (krwotocznej) biegunki, należy natychmiast przerwać leczenie izotretynoiną. Reakcje alergiczne Rzadko opisywano reakcje anafilaktyczne, w niektórych przypadkach występujące po uprzednim miejscowym leczeniu retynoidami. Niekiedy występowały skórne reakcje alergiczne. Donoszono o występowaniu ciężkich postaci alergicznego zapalenia naczyń, często przebiegającego z plamicą (siniaki i czerwone plamy) w obrębie kończyn i objawami poza skórnymi. W przypadku występowania ciężkich reakcji alergicznych konieczne jest przerwanie leczenia i ścisłe monitorowanie pacjenta.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgSpecjalne środki ostrozności
Pacjenci wysokiego ryzyka U pacjentów z cukrzycą, otyłością, nadużywających alkohol lub z zaburzeniami metabolizmu lipidów, którzy są leczeni izotretynoiną, konieczne może być częstsze kontrolowanie stężenia lipidów w surowicy i (lub) stężenia glukozy we krwi. Opisywano zwiększenie stężenia glukozy na czczo i rozpoznawano nowe przypadki cukrzycy podczas leczenia izotretynoiną.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Przeciwwskazane skojarzone leczenie z: Witaminą A ze względu na ryzyko hiperwitaminozy A (patrz punkt 4.3). Innymi retynoidami (acytretyna, alitretynoina) ze względu na ryzyko hiperwitaminozy A (patrz punkt 4.3). Tetracyklinami. Opisywano przypadki nadciśnienia wewnątrzczaszkowego podczas jednoczesnego stosowania izotretynoiny i tetracyklin. Z tego powodu należy unikać równoczesnego leczenia izotretynoiną i tetracyklinami (patrz punkt 4.3 „Przeciwwskazania” i punkt 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania”). Należy unikać jednoczesnego leczenia izotretynoiną i środkami przeciwtrądzikowymi o miejscowym działaniu keratolitycznym lub złuszczającym, gdyż może wystąpić lokalne podrażnienie (patrz punkt 4.4).
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża W okresie ciąży bezwzględnie przeciwwskazane jest leczenie izotretynoiną (patrz punkt 4.3 „Przeciwwskazania”). Jeżeli pacjentka zajdzie w ciążę, pomimo zachowania wymaganych środków ostrożności podczas leczenia izotretynoiną lub w ciągu miesiąca po jego zakończeniu, istnieje znaczne ryzyko wystąpienia bardzo ciężkich wad rozwojowych u płodu. Do wad rozwojowych u płodu związanych ze stosowaniem izotretynoiny należą wady ośrodkowego układu nerwowego (wodogłowie, wady rozwojowe móżdżku, małogłowie), zniekształcenia twarzy, rozszczep podniebienia, wady ucha zewnętrznego (brak ucha zewnętrznego, małe zewnętrzne przewody słuchowe lub ich brak), wady oka (małoocze), wady w obrębie układu sercowo-naczyniowego (wady rozwojowe wspólnego pnia tętniczego, takie jak: tetralogia Fallota, przełożenie wielkich naczyń, uszkodzenie przegrody), nieprawidłowości grasicy i przytarczyc. Częściej występują poronienia samoistne.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgWpływ na płodność, ciążę i laktację
Jeżeli podczas leczenia izotretynoiną kobieta zajdzie w ciążę, należy przerwać leczenie, a pacjentkę skierować na konsultację do lekarza z doświadczeniem w dziedzinie teratologii, w celu zbadania i uzyskania porady. Kobiety w wieku rozrodczym/Antykoncepcja Jako wymóg minimalny, kobiety w wieku rozrodczym muszą stosować przynajmniej jedną wysoce skuteczną metodę antykoncepcyjną (tzn. niezależną od użytkownika) lub dwie uzupełniające się metody antykoncepcyjne zależne od użytkownika. Antykoncepcję należy stosować co najmniej 1 miesiąc przed rozpoczęciem leczenia, w trakcie leczenia oraz przez 1 miesiąc po zakończeniu leczenia izotretynoiną, nawet jeśli u pacjentki nie występuje miesiączka (patrz punkt 4.4). Karmienie piersi? Izotretynoina jest związkiem silnie lipofilnym, dlatego przenikanie izotretynoiny do mleka matki jest bardzo prawdopodobne.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgWpływ na płodność, ciążę i laktację
Biorąc pod uwagę potencjalne działania niepożądane u matki i dziecka, stosowanie izotretynoiny u kobiet w okresie karmienia piersią jest przeciwwskazane. Płodność Izotretynoina przyjmowana przez mężczyzn w dawkach terapeutycznych nie wpływa na liczbę, ruchliwość i budowę komórek plemnikowych i nie zagraża tworzeniu się i rozwojowi zarodka.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy Curacne 5 mg może wpływać na zdolność prowadzenia pojazdów i obsługiwania maszyn. Podczas leczenia izotretynoiną odnotowano wiele przypadków pogorszenia widzenia w nocy; w rzadkich przypadkach ten objaw utrzymywał się po zakończeniu leczenia (patrz punkt 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania” i punkt 4.8 „Działania niepożądane”). Ponieważ u niektórych pacjentów objawy te występowały nagle, pacjentów należy informować o możliwości wystąpienia takiego zaburzenia i ostrzegać, aby zachowali ostrożność podczas prowadzenia pojazdów i obsługiwania maszyn. Bardzo rzadko donoszono o objawach senności, zawrotów głowy i zaburzeń widzenia. Pacjenci powinni być ostrzegani, że w wypadku wystąpienia tych objawów nie powinni prowadzić pojazdów mechanicznych, obsługiwać urządzeń mechanicznych w ruchu lub brać udziału w tego typu zajęciach, w których wystąpienie powyższych objawów może narazić ich lub inne osoby na ryzyko.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Następujące objawy stanowią najczęściej opisywane działania niepożądane izotretynoiny: suchość błon śluzowych, np. warg, zapalenie warg, suchość błony śluzowej nosa, krwawienie z nosa, suchość oka (zapalenie spojówek), suchość skóry. Niektóre działania niepożądane, związane ze stosowaniem izotretynoiny, są zależne od dawki. Działania niepożądane są ogólnie odwracalne po zmianie dawki lub zaprzestaniu leczenia; w niektórych przypadkach utrzymują się po zakończeniu leczenia. Tabelaryczne zestawienie działań niepożądanych Działania niepożądane zostały sklasyfikowane zgodnie z konwencją MedDRA według klasyfikacji układów i narządów oraz częstości ich występowania: bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych).
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgDziałania niepożądane
Zakażenia: Bardzo rzadko Zakażenia (skóry i błon śluzowych) bakteriami Gram-dodatnimi Zaburzenia krwi i układu chłonnego: Bardzo często Często Bardzo rzadko Niedokrwistość, przyspieszone OB, małopłytkowość, nadpłytkowość Neutropenia Limfadenopatia Zaburzenia układu immunologicznego: Rzadko Skórne reakcje alergiczne, reakcje anafilaktyczne, nadwrażliwość Zaburzenia metabolizmu i odżywiania: Bardzo rzadko Cukrzyca, hiperurykemia Zaburzenia psychiczne: Rzadko Bardzo rzadko Depresja, nasilenie objawów depresji, skłonność do agresji, lęk, zmiany nastroju Samobójstwo, próby samobójcze, myśli samobójcze, zaburzenia psychotyczne, zaburzenia zachowania Zaburzenia układu nerwowego: Często Bardzo rzadko Bóle głowy Łagodne nadciśnienie wewnątrzczaszkowe, drgawki, senność, zawroty głowy Zaburzenia oczu: Bardzo często Bardzo rzadko Zapalenie powiek, zapalenie spojówek, suchość oczu, podrażnienie oczu Zaburzenia widzenia, niewyraźne widzenie, zaćma, ślepota barw (niedobór widzenia kolorów), nietolerancja soczewek kontaktowych, zmętnienie rogówki, pogorszenie widzenia w ciemności, zapalenie rogówki, tarcza zastoinowa (objaw łagodnego nadciśnienia wewnątrzczaszkowego), światłowstręt Zaburzenia ucha i błędnika: Bardzo rzadko Upośledzenie słuchu Zaburzenia naczyniowe: Bardzo rzadko Zapalenie naczyń (na przykład zapalenie ziarniniakowe Wegenera, alergiczne zapalenie naczyń) Zaburzenia oddechowe, klatki piersiowej i śródpiersia: Często Bardzo rzadko Krwawienie z nosa, suchość błony śluzowej nosa, zapalenie jamy nosowo-gardłowej Skurcz oskrzeli (szczególnie u pacjentów z astmą), chrypka Zaburzenia żołądkowo-jelitowe: Bardzo rzadko Zapalenie okrężnicy, zapalenie jelita krętego, suchość gardła, krwotoki żołądkowo-jelitowe, biegunka krwotoczna i choroba zapalna jelita, nudności, zapalenie trzustki (patrz punkt 4.4) Zaburzenia wątroby i dróg żółciowych: Bardzo często Bardzo rzadko Zwiększenie aktywności aminotransferaz (patrz punkt 4.4) Zapalenie wątroby Zaburzenia skóry i tkanki podskórnej: Bardzo często Rzadko Bardzo rzadko Zapalenie czerwieni warg, zapalenie skóry, suchość skóry, miejscowe złuszczanie naskórka, świąd, wysypka rumieniowa, nadwrażliwość skóry (ryzyko urazu w wyniku tarcia) Łysienie Trądzik piorunujący, zaostrzenie trądziku (nawrót trądziku), rumień (twarzy), wysypka, zaburzenia włosów, hirsutyzm, dystrofia paznokci, zanokcica, reakcje nadwrażliwości na światło, ziarniniak ropotwórczy, przebarwienia skóry, zwiększona potliwość Rumień wielopostaciowy, zespół Stevensa-Johnsona i martwica toksyczno-rozpływna naskórka Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Bardzo często Bardzo rzadko Bóle stawów, bóle mięśni, ból pleców (szczególnie u pacjentów w wieku dojrzewania) Zapalenie stawów, wapnica (zwapnienie więzadeł i ścięgien), przedwczesne zrastanie nasad kości długich, wyrośle kostne (hiperostoza), zmniejszenie gęstości kości, zapalenie ścięgien, rozpad mięśni poprzecznie prążkowanych Zapalenie stawów krzyżowo-biodrowych Zaburzenia nerek i dróg moczowych: Bardzo rzadko Nieznana Zapalenie kłębuszkowe nerek Zapalenie cewki moczowej Zaburzenia układu rozrodczego i piersi: Nieznana Zaburzenia czynności seksualnych, w tym zaburzenia erekcji i zmniejszenie libido Ginekomastia Suchość pochwy i sromu Zaburzenia ogólne i stany w miejscu podania: Bardzo rzadko Nadmierne tworzenie się ziarniny, złe samopoczucie Nieprawidłowości w badaniach laboratoryjnych: Bardzo często Często Bardzo rzadko Zwiększenie stężenia trójglicerydów we krwi, zmniejszenie stężenia lipoprotein o dużej gęstości Zwiększenie stężenia cholesterolu we krwi, zwiększenie stężenia glukozy we krwi, krwiomocz, białkomocz Zwiększenie aktywności kinazy kreatynowej we krwi Częstość występowania działań niepożądanych obliczono na podstawie zbiorczych danych klinicznych uzyskanych od 824 pacjentów oraz na podstawie danych uzyskanych po wprowadzeniu produktu do obrotu.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: 22 49-21-301, fax: 22 49-21-309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgPrzedawkowanie
4.9 Przedawkowanie Izotretynoina jest pochodną witaminy A. Pomimo, że ostra toksyczność izotretynoiny jest niewielka, w razie przypadkowego przedawkowania mogą pojawić się objawy hiperwitaminozy A. Zespół objawów ostrej toksyczności witaminy A obejmuje ciężki ból głowy, nudności, wymioty, senność, drażliwość i świąd. Podmiotowe i przedmiotowe objawy przypadkowego lub umyślnego przedawkowania izotretynoiny są przypuszczalnie podobne. Należy oczekiwać, że te objawy są odwracalne i powinny ustępować bez konieczności leczenia.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwtrądzikowe do stosowania ogólnego Kod ATC: D10BA01 Mechanizm działania Izotretynoina jest stereoizomerem kwasu all-trans-retynowego (tretynoiny). Dokładny mechanizm działania izotretynoiny nie został szczegółowo wyjaśniony. Ustalono jednak, że poprawa stanu klinicznego ciężkiego trądziku jest związana z hamowaniem aktywności gruczołów łojowych oraz potwierdzonym histologicznie zmniejszeniem wielkości gruczołów łojowych. Ponadto wykazano przeciwzapalne działanie izotretynoiny na skórę. Skuteczność Nadmierne rogowacenie wierzchniej warstwy naskórka w obrębie mieszka włosowego prowadzi do złuszczania korneocytów do wnętrza kanalika i zatkania go przez keratynę i nadmiar łoju. W wyniku tego dochodzi do powstania zaskórników i zmian zapalnych. Izotretynoina hamuje proliferację sebocytów i prawdopodobnie przywraca prawidłowy proces różnicowania komórek.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgWłaściwości farmakodynamiczne
Łój jest głównym substratem potrzebnym do wzrostu dla bakterii Propionibacterium acnes, dlatego zmniejszenie wydzielania łoju hamuje ich namnażanie się w obrębie przewodu wyprowadzającego gruczołu łojowego.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Wchłanianie izotretynoiny z przewodu pokarmowego jest zmienne i liniowo zależne od dawki w zakresie wartości terapeutycznych. Nie określono całkowitej biodostępności izotretynoiny, ponieważ nie ma dożylnych postaci leku. Ekstrapolacja wyników badań na psach wskazuje na dość małą i zmienną biodostępność ogólną. Jeżeli izotretynoina jest przyjmowana z posiłkiem, biodostępność wzrasta dwukrotnie w porównaniu do wartości po podaniu produktu na czczo. Dystrybucja Izotretynoina ulega w dużym stopniu wiązaniu z białkami osocza, głównie albuminą (99,9%). Objętość dystrybucji izotretynoiny u człowieka nie została określona, ponieważ nie ma dożylnych postaci leku przeznaczonych do stosowania u ludzi. Dostępne dane o dystrybucji izotretynoiny do tkanek u ludzi są nieliczne. Stężenia izotretynoiny w naskórku są o połowę mniejsze niż stężenia w surowicy.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgWłaściwości farmakokinetyczne
Ze względu na słabe przenikanie izotretynoiny do krwinek czerwonych, stężenie izotretynoiny w surowicy jest około 1,7 razy większe niż w pełnej krwi. Metabolizm Po podaniu doustnym izotretynoiny wyodrębniono trzy główne metabolity w surowicy: 4-oksoizotretynoinę, tretynoinę (kwas all-trans-retynowy) i 4-oksotretynoinę. Wykazano aktywność biologiczną tych metabolitów w kilku testach in vitro. W badaniu klinicznym wykazano, że 4-oksoizotretynoina ma istotne znaczenie dla działania izotretynoiny (zmniejszenie wydzielania łoju pomimo, że nie wpływa na stężenie izotretynoiny i tretynoiny w osoczu). Inne mniej ważne metabolity to produkty glukuronizacji. Głównym metabolitem jest 4-oksoizotretynoina, której stężenie w osoczu w stanie stacjonarnym jest 2,5 razy większe niż stężenie związku macierzystego. Izotretynoina i tretynoina (kwas all-trans-retynowy) ulegają odwracalnym wzajemnym przemianom (interkonwersja) i dlatego metabolizm tretynoiny jest powiązany z metabolizmem izotretynoiny.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgWłaściwości farmakokinetyczne
Szacuje się, że 20-30% dawki izotretynoiny ulega przemianom na drodze izomeryzacji. Krążenie jelitowo-wątrobowe może odgrywać znaczącą rolę w farmakokinetyce izotretynoiny u człowieka. Badania metabolizmu in vitro wykazały, że kilka enzymów układu cytochromu CYP bierze udział w przekształcaniu izotretynoiny w 4-okso-izotretynoinę i tretynoinę. Żaden izoenzym nie odgrywa dominującej roli. Izotretynoina i jej metabolity nie wpływają znamiennie na aktywność CYP. Eliminacja Po podaniu doustnym znakowanej izotopem radioaktywnym izotretynoiny, w moczu i kale wykrywano w przybliżeniu równe części podanej dawki. Po doustnym podaniu izotretynoiny okres półtrwania w końcowej fazie eliminacji niezmienionej postaci leku u pacjentów z trądzikiem wynosi średnio 19 godzin. Okres półtrwania w końcowej fazie eliminacji 4-oksoizotretynoiny jest dłuższy i wynosi średnio 29 godzin. Izotretynoina jest fizjologicznym retynoidem.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgWłaściwości farmakokinetyczne
Po upływie 2 tygodni od zakończenia terapii izotretynoiną uzyskuje się stężenia właściwe dla endogennych retynoidów. Farmakokinetyka w wybranych populacjach Ponieważ izotretynoina jest przeciwwskazana u pacjentów z zaburzeniami czynności wątroby, dane dotyczące farmakokinetyki w tej grupie pacjentów są ograniczone. Niewydolność nerek nie zmniejsza w sposób istotny klirensu osoczowego izotretynoiny lub 4-oksoizotretynoiny.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Toksyczność ostra Toksyczność ostrą po podaniu doustnym izotretynoiny badano u różnych gatunków zwierząt. LD50 wynosi w przybliżeniu 2000 mg/kg mc. u królików, około 3000 mg/kg mc. u myszy i ponad 4000 mg/kg mc. u szczurów. Toksyczność przewlekła Długoterminowe badanie na szczurach (ponad 2 lata), w którym podawano izotretynoinę w dawkach 2, 8 i 32 mg/kg mc. na dobę, wykazało występowanie częściowej utraty sierści oraz zwiększenie stężenia trójglicerydów w osoczu w grupach, w których stosowano większą dawkę produktu. Zakres działań niepożądanych izotretynoiny u gryzoni przypomina działania niepożądane witaminy A. Nie obejmuje jednak masywnych zwapnień w tkankach i organach, obserwowanych po podaniu szczurom witaminy A. Zmiany w obrębie komórek wątrobowych, stwierdzane po stosowaniu witaminy A, nie występowały po stosowaniu izotretynoiny.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgPrzedkliniczne dane o bezpieczeństwie
Wszystkie działania niepożądane stanowiące zespół hiperwitaminozy A, ustępowały samoistnie po odstawieniu izotretynoiny. Nawet u zwierząt doświadczalnych w złym stanie ogólnym, stwierdzano w większości przypadków ustąpienie objawów w ciągu 1-2 tygodni. Działanie teratogenne Podobnie jak w przypadku innych pochodnych witaminy A, w badaniach na zwierzętach wykazano, że izotretynoina działa teratogennie i embriotoksycznie. Ze względu na działania teratogenne izotretynoiny, istnieją szczególne ograniczenia dotyczące jej stosowania u kobiet w wieku rozrodczym (patrz punkt 4.3 „Przeciwwskazania”, punkt 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania”, punkt 4.6 „Wpływ na płodność, ciążę i laktację”). Wpływ na płodność Izotretynoina przyjmowana przez mężczyzn w dawkach terapeutycznych nie wpływa na liczbę, ruchliwość i budowę komórek plemnikowych i nie zagraża tworzeniu się i rozwojowi zarodka.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgPrzedkliniczne dane o bezpieczeństwie
Izotretynoina podawana doustnie szczurom w dawkach do 32 mg/kg mc./dobę (tzn. 5,3-krotnie większych niż maksymalna zalecana dawka u ludzi) nie wywoływała niepożądanego wpływu na czynność gonad, płodność, ciążę ani poród. U psów po leczeniu izotretynoiną podawaną doustnie przez około 30 tygodni w dawce 20 lub 60 mg/kg mc./dobę (tzn. odpowiednio 10 lub 30-krotnie większej niż maksymalna zalecana dawka dla ludzi) odnotowano atrofię jąder. Zasadniczo uzyskano dowody w badaniu mikroskopowym na znaczne upośledzenie spermatogenezy, choć we wszystkich przebadanych jądrach występowały plemniki, a w żadnym przypadku nie odnotowano atroficznych kanalików nasiennych. Wykazano jednak, że dane przedkliniczne były uzależnione od danego gatunku, a zatem nie dotyczą mężczyzn, u których wykazano brak wpływu leczenia izotretynoiną na płodność. Działanie mutagenne Nie potwierdzono mutagennego ani karcynogennego działania izotretynoiny w badaniach in vitro i in vivo u zwierząt.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Olej sojowy oczyszczony, wosk żółty, olej roślinny uwodorniony; otoczka kapsułki: żelatyna, glicerol, woda oczyszczona, żelaza tlenek czerwony (E 172), żelaza tlenek żółty (E 172), tytanu dwutlenek (E 171) 50% w glicerolu. Skład czarnego atramentu: Alkohol SDA 35, glikol propylenowy (E 1520), żelaza tlenek czarny (E 172), poliwinylowy octanoftalan, woda, alkohol izopropylowy, makrogol, amonowy wodorotlenek. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25°C. Przechowywać w oryginalnym opakowaniu. Przechowywać opakowanie szczelnie zamknięte, w celu ochrony przed światłem. 6.5 Rodzaj i zawartość opakowania Blister PVC/PE/PVDC/Aluminium. 30 kapsułek miękkich (3 blistry po 10 szt.), w tekturowym pudełku.
- CHPL leku Curacne 5 mg, kapsułki miękkie, 5 mgDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Po zakończeniu leczenia, wszystkie pozostałe kapsułki należy zwrócić do apteki.
- CHPL leku Izotziaja, Żel, 0,5 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Izotziaja, 0,5 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 0,5 mg izotretynoiny (Isotretinoinum). Substancje pomocnicze o znanym działaniu: butylohydroksytoluen (E 321) oraz etanol 96%. 1 g żelu zawiera 0,50 mg butylohydroksytoluenu (E 321) oraz 922,5 mg etanolu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel
- CHPL leku Izotziaja, Żel, 0,5 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Leczenie łagodnej do umiarkowanej postaci trądziku pospolitego.
- CHPL leku Izotziaja, Żel, 0,5 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Dorośli Niewielką ilość produktu leczniczego Izotziaja należy rozprowadzić na chorobowo zmienionych miejscach na skórze raz lub dwa razy na dobę. Przed rozprowadzeniem żelu skóra powinna być umyta i wysuszona. Po kontakcie z żelem należy dokładnie umyć ręce. Zwykle skuteczność leczenia można zaobserwować po 6-8 tygodniach. Dzieci Produkt leczniczy Izotziaja nie jest przeznaczony do stosowania u dzieci. Trądzik pospolity rzadko występuje u dzieci przed okresem dojrzewania, z tego względu dawkowanie w tej grupie wiekowej nie zostało ustalone. Osoby w podeszłym wieku Nie zaleca się stosowania produktu leczniczego Izotziaja w tej grupie wiekowej, ponieważ trądzik pospolity nie występuje u osób w podeszłym wieku. Sposób podawania Podanie na skórę.
- CHPL leku Izotziaja, Żel, 0,5 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na izotretynoinę lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, Ciąża (patrz punkt 4.6), Kobiety planujące zajść w ciążę, Okres karmienia piersią.
- CHPL leku Izotziaja, Żel, 0,5 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy unikać kontaktu produktu leczniczego Izotziaja z oczami, błonami śluzowymi, ustami i uszkodzoną lub podrażnioną skórą. Należy uważać, aby żel nie gromadził się w fałdach skóry, szczególnie na szyi, skrzydełkach nosa. Tretynoina, substancja lecznicza podobna do izotretynoiny, nie wykazuje działania rakotwórczego u ludzi. Jednak u białych bezwłosych myszy, którym podawano miejscowo tretynoinę i które równocześnie poddawano działaniu promieniowania ultrafioletowego (UV), częściej występowały nowotwory skóry. U myszy leczonych miejscowo tretynoiną, których nie poddawano działaniu promieniowania UV, nie dochodziło do rozwoju nowotworów. Nie wiadomo, jakie jest znaczenie tych badań w odniesieniu do ludzi. Należy unikać stosowania produktu leczniczego Izotziaja u pacjentów z przypadkami nabłoniaka skórnego (cutaneous epithelioma) w wywiadzie.
- CHPL leku Izotziaja, Żel, 0,5 mg/gSpecjalne środki ostrozności
Miejsca na skórze leczone produktem leczniczym Izotziaja należy chronić przed działaniem promieni słonecznych. Jeśli nie można uniknąć światła słonecznego, należy stosować na skórę produkty z filtrami UV i odzież ochronną. Nie należy stosować produktu leczniczego Izotziaja u pacjentów z oparzeniami słonecznymi, gdyż w tym przypadku skóra może być bardziej wrażliwa na światło słoneczne. Należy unikać sztucznych źródeł promieniowania UV (np. lampy kwarcowe, solaria). Specjalne ostrzeżenia dotyczące substancji pomocniczych Butylohydroksytoluen (E 321) Produkt leczniczy Izotziaja zawiera butylohydroksytoluen (E 321), dlatego może powodować miejscową reakcję skórną (np. kontaktowe zapalenie skóry) lub podrażnienie oczu i błon śluzowych. Etanol 96% Produkt leczniczy zawiera 922,5 mg etanolu w każdym gramie żelu. Może powodować pieczenie uszkodzonej skóry. Produkt leczniczy łatwopalny. Nie stosować w pobliżu otwartego ognia, zapalonego papierosa lub niektórych urządzeń (np.
- CHPL leku Izotziaja, Żel, 0,5 mg/gSpecjalne środki ostrozności
suszarki do włosów).
- CHPL leku Izotziaja, Żel, 0,5 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Należy zachować ostrożność podczas jednoczesnego miejscowego leczenia innymi produktami leczniczymi. Podczas leczenia produktem leczniczym Izotziaja należy unikać jednoczesnego stosowania środków złuszczających (nadtlenek benzoilu), a także ścierająco-czyszczących, gdyż mogą one powodować nasilenie działania drażniącego.
- CHPL leku Izotziaja, Żel, 0,5 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Retynoidy stosowane doustnie mają związek z występowaniem wad wrodzonych. Retynoidy do stosowania miejscowego, jeśli są stosowane zgodnie z zaleceniami, ogólnie są uznawane za wywołujące małą ekspozycję układową, ze względu na minimalne wchłanianie przezskórne. Mogą jednak wystąpić indywidualne okoliczności (jak np. uszkodzona skóra, przedawkowanie), które przyczynią się do zwiększonej ekspozycji ogólnoustrojowej. Ciąża Produkt leczniczy Izotziaja jest przeciwwskazany (patrz punkt 4.3) do stosowania u kobiet w ciąży oraz u kobiet planujących zajście w ciążę. Jeśli produkt leczniczy jest stosowany w trakcie ciąży, lub gdy pacjentka zajdzie w ciążę w trakcie przyjmowania Izotziaja, leczenie musi zostać przerwane. U ludzi izotretynoina stosowana w postaci o działaniu ogólnym działa teratogennie. Karmienie piersi? Nie stosować produktu leczniczego Izotziaja u kobiet w okresie karmienia piersią.
- CHPL leku Izotziaja, Żel, 0,5 mg/gWpływ na płodność, ciążę i laktację
Nie ustalono czy izotretynoina przenika do mleka ludzkiego.
- CHPL leku Izotziaja, Żel, 0,5 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brak danych dotyczących wpływu Izotziaja na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Izotziaja, Żel, 0,5 mg/gDziałania niepożądane
4.8 Działania niepożądane Izotziaja może powodować pieczenie, zaczerwienienie i świąd skóry, zmiany rumieniowe oraz złuszczenie. Zazwyczaj są to objawy przemijające, gdyby jednak wystąpiło ich nasilenie, żel należy stosować rzadziej, a nawet przerwać leczenie na kilka dni, po czym zastosować produkt leczniczy Izotziaja ponownie. Gdyby jednak objawy podrażnienia znowu nasiliły się, leczenie nie powinno być kontynuowane. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al.
- CHPL leku Izotziaja, Żel, 0,5 mg/gDziałania niepożądane
Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 (22) 49 21 301 Fax: + 48 (22) 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Izotziaja, Żel, 0,5 mg/gPrzedawkowanie
4.9 Przedawkowanie Nie odnotowano objawów przedawkowania izotretynoiny w żelu. Przypadkowe spożycie produktu leczniczego Izotziaja w dużej dawce może spowodować objawy podobne do hiperwitaminozy A, takie jak bóle głowy, nudności, wymioty, senność, podrażnienie i świąd.
- CHPL leku Izotziaja, Żel, 0,5 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki dermatologiczne z grupy retinoidów stosowane miejscowo w leczeniu trądziku Kod ATC: D10AD04 Izotretynoina jest lekiem z grupy retynoidów, który reguluje wzrost i różnicowanie naskórka. Izotretynoina jest stereoizomerem tretynoiny. Działanie farmakologiczne izotretynoiny nie zostało całkowicie wyjaśnione. Izotretynoina stosowana ogólnie hamuje aktywność gruczołów łojowych i zmniejsza wytwarzanie łoju, wpływa również na powstawanie zaskórników, hamuje namnażanie bakterii Propionibacterium acnes i zmniejsza stan zapalny. Izotretynoina podawana miejscowo prawdopodobnie działa jak tretynoina. Tretynoina stymuluje mitozę w komórkach naskórka, zmniejsza spójność międzykomórkową w warstwie rogowej naskórka oraz wpływa na hiperkeratozę charakterystyczną dla trądziku pospolitego. Wspomagając złuszczanie naskórka, zapobiega tworzeniu się zmian na skórze.
- CHPL leku Izotziaja, Żel, 0,5 mg/gWłaściwości farmakodynamiczne
Tretynoina pośredniczy w wytwarzaniu komórek łojowych naskórka o mniejszej spoistości i w wyniku tego prawdopodobnie pobudza proces usuwania zaskórników oraz zapobiega tworzeniu się nowych zaskórników.
- CHPL leku Izotziaja, Żel, 0,5 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po stosowaniu miejscowym na skórę biodostępność izotretynoiny jest minimalna. Przezskórna absorpcja izotretynoiny w żelu jest znikoma. Pomiary metodą HPLC wykazały, że po aplikowaniu na trądzikową skórę twarzy 0,05% żelu z izotretynoiną w ilości 20 g na dobę przez miesiąc, stężenie izotretynoiny i jej izomeru tretynoiny w osoczu jest niewykrywalne (mniej niż 0,02 µg/ml). Po zastosowaniu izotretynoiny znakowanej radioizotopem 14C w podłożu kremowym na zdrową skórę ochotników wykazano, że tylko 0,03% dawki oznaczono we krwi, moczu i w kale w wyniku oceny radioaktywności.
- CHPL leku Izotziaja, Żel, 0,5 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak danych.
- CHPL leku Izotziaja, Żel, 0,5 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Hydroksypropyloceluloza Butylohydroksytoluen (E 321) Etanol 96% 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata Okres ważności po pierwszym otwarciu tuby: 2 miesiące. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Produkt leczniczy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Tuba aluminiowa z zakrętką, zawierająca 20 g żelu, umieszczona w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Zobacz również:
- Dawkowanie leku
Kwas azelainowy to substancja wykorzystywana w leczeniu trądziku oraz przebarwień skóry. Może być stosowany w postaci kremu lub żelu, a sposób dawkowania dostosowuje się do wieku pacjenta, rodzaju problemu skórnego oraz postaci leku. Regularność i właściwe stosowanie są kluczowe dla skuteczności terapii.
- Działania niepożądane i skutki uboczne
Kwas azelainowy, znany także jako Acidum azelaicum, jest popularnym składnikiem kremów i żeli stosowanych w leczeniu problemów skórnych, takich jak trądzik czy trądzik różowaty. Działania niepożądane po jego zastosowaniu występują najczęściej w miejscu podania i zazwyczaj są łagodne oraz ustępują w trakcie leczenia. Warto jednak wiedzieć, jakie objawy mogą się pojawić i jak różnią się w zależności od postaci leku.
- Mechanizm działania
Kwas azelainowy to substancja, która znajduje szerokie zastosowanie w leczeniu trądziku, przebarwień oraz trądziku różowatego. Jego mechanizm działania opiera się na wielokierunkowym wpływie na skórę: hamuje rozwój bakterii, reguluje procesy rogowacenia oraz pomaga zmniejszać przebarwienia. Działa bezpośrednio w miejscu zastosowania, a jego wchłanianie przez skórę jest ograniczone, co sprawia, że jest bezpieczny i dobrze tolerowany przez większość pacjentów.
- Porównanie substancji czynnych
Kwas azelainowy, adapalen i izotretynoina to substancje czynne szeroko stosowane w leczeniu trądziku oraz innych problemów skórnych. Choć łączy je przynależność do grupy leków przeciwtrądzikowych, różnią się mechanizmem działania, sposobem stosowania i profilem bezpieczeństwa. Poznaj ich podobieństwa i różnice, aby lepiej zrozumieć, kiedy mogą być zalecane i jakie mają ograniczenia w użyciu, szczególnie w odniesieniu do różnych grup pacjentów.
- Profil bezpieczeństwa
Kwas azelainowy to substancja wykorzystywana w leczeniu różnych schorzeń skóry, takich jak trądzik pospolity czy trądzik różowaty. Jego stosowanie jest na ogół dobrze tolerowane, ale – jak każdy lek – wymaga zachowania pewnych środków ostrożności, zwłaszcza u osób z określonymi schorzeniami czy w szczególnych sytuacjach, takich jak ciąża lub karmienie piersią. Dowiedz się, na co zwrócić uwagę, stosując kwas azelainowy w różnych postaciach i u różnych grup pacjentów.
- Przeciwwskazania
Kwas azelainowy to substancja czynna stosowana miejscowo w leczeniu trądziku pospolitego, trądziku różowatego oraz przebarwień skóry. Mimo że jest uznawany za bezpieczny, istnieją sytuacje, w których jego użycie jest przeciwwskazane lub wymaga szczególnej ostrożności. Poznaj, kiedy nie należy stosować kwasu azelainowego oraz na co zwrócić uwagę podczas terapii.
- Stosowanie u dzieci
Kwas azelainowy jest składnikiem aktywnym stosowanym miejscowo w leczeniu trądziku oraz przebarwień skóry. Choć wiele osób kojarzy go z pielęgnacją skóry u dorosłych, coraz częściej pojawiają się pytania o bezpieczeństwo jego stosowania u dzieci. W tym opisie znajdziesz rzetelne informacje na temat możliwości i ograniczeń związanych z używaniem kwasu azelainowego w różnych grupach wiekowych, ze szczególnym uwzględnieniem aspektów bezpieczeństwa, wskazań oraz praktycznych środków ostrożności.
- Stosowanie u kierowców
Kwas azelainowy to substancja często stosowana w leczeniu trądziku oraz trądziku różowatego. Pacjenci zastanawiają się, czy podczas terapii mogą bezpiecznie prowadzić samochód lub obsługiwać maszyny. W poniższym opisie znajdziesz jasne informacje na temat wpływu kwasu azelainowego na zdolność do wykonywania codziennych czynności wymagających skupienia i koordynacji.
- Stosowanie w ciąży
Stosowanie kwasu azelainowego w czasie ciąży i karmienia piersią budzi wiele pytań u przyszłych mam. Choć jest to lek często wykorzystywany w leczeniu problemów skórnych, takich jak trądzik pospolity czy trądzik różowaty, jego bezpieczeństwo w tych szczególnych okresach życia wymaga dokładnego omówienia. Dowiedz się, co mówią źródła o stosowaniu tej substancji w ciąży i podczas laktacji oraz jakie środki ostrożności należy zachować.
- Wskazania - na co działa?
Kwas azelainowy to substancja, która znalazła szerokie zastosowanie w leczeniu różnych problemów skórnych. Dzięki swoim właściwościom przeciwbakteryjnym, przeciwzapalnym oraz zdolności do regulowania rogowacenia naskórka, pomaga skutecznie zwalczać trądzik, przebarwienia oraz trądzik różowaty. Różne postacie leku – kremy i żele – umożliwiają dopasowanie terapii do indywidualnych potrzeb pacjenta, zarówno dorosłych, jak i młodzieży. Sprawdź, w jakich sytuacjach kwas azelainowy może okazać się pomocny.
- Rzedawkowanie substancji
Kwas azelainowy to substancja wykorzystywana głównie w leczeniu trądziku i trądziku różowatego. Stosowany miejscowo na skórę, jest dobrze tolerowany i cechuje się bardzo niskim ryzykiem toksyczności, nawet przy przypadkowym spożyciu lub użyciu na dużej powierzchni ciała. Przedawkowanie tej substancji praktycznie nie niesie ze sobą ryzyka poważnych powikłań, co potwierdzają badania toksykologiczne. Dowiedz się, co zrobić w razie nieumyślnego użycia zbyt dużej ilości kwasu azelainowego i jakie mogą być objawy przedawkowania.
REKLAMA