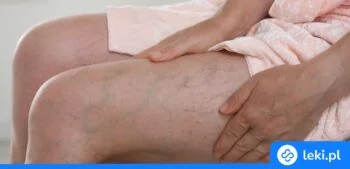
Diosmina to substancja czynna wykorzystywana w leczeniu przewlekłej niewydolności żylnej kończyn dolnych oraz do łagodzenia objawów żylaków odbytu. Działa wzmacniająco na naczynia krwionośne, poprawia mikrokrążenie i pomaga zmniejszyć takie dolegliwości jak ból, obrzęki, uczucie ciężkości czy nocne kurcze nóg. Poznaj podstawowe informacje dotyczące działania, wskazań i bezpieczeństwa stosowania diosminy.
Jak działa diosmina?
Diosmina to substancja należąca do grupy bioflawonoidów, której głównym działaniem jest wzmacnianie i ochrona naczyń krwionośnych. Stosowana jest głównie w leczeniu przewlekłej niewydolności żylnej nóg oraz w łagodzeniu dolegliwości związanych z żylakami odbytu. Poprawia napięcie żył, zmniejsza ich przepuszczalność i pomaga ograniczyć obrzęki oraz uczucie ciężkości nóg123.
Dostępne postacie leku i dawki
- Tabletki powlekane: 500 mg, 600 mg, 1000 mg diosminy w jednej tabletce45678910111213141516171819
- Proszek doustny: 1000 mg diosminy w jednej saszetce20
Diosmina występuje wyłącznie jako jednoskładnikowa substancja czynna – nie ma połączeń z innymi lekami w dostępnych preparatach.
Wskazania
Dawkowanie
Najczęściej stosowana dawka diosminy to 1 tabletka (500 mg lub 1000 mg) raz na dobę lub 2 tabletki (po 500 mg) dziennie, podczas posiłków. W przypadku ostrych dolegliwości związanych z żylakami odbytu dawka może być tymczasowo zwiększona zgodnie z zaleceniami lekarza252627.
Przeciwwskazania
Nie należy stosować diosminy w przypadku nadwrażliwości na tę substancję lub jakikolwiek składnik pomocniczy preparatu2829.
Profil bezpieczeństwa
Diosmina nie jest zalecana do stosowania w ciąży i podczas karmienia piersią, ponieważ nie ma wystarczających danych potwierdzających jej bezpieczeństwo w tych okresach. Brak informacji o wpływie na zdolność prowadzenia pojazdów, ale zgłaszane działania niepożądane nie sugerują istotnego ryzyka. Substancja może być stosowana u osób starszych oraz u osób z niewydolnością nerek lub wątroby, jednak w tych grupach nie przeprowadzono specjalnych badań3031.
Przedawkowanie
Nie odnotowano przypadków ciężkiego przedawkowania diosminy. W przypadku przyjęcia zbyt dużej dawki mogą wystąpić dolegliwości ze strony przewodu pokarmowego, takie jak nudności, wymioty czy biegunka. W razie przedawkowania należy zastosować standardowe postępowanie medyczne3233.
Interakcje
Diosmina rzadko wchodzi w interakcje z innymi lekami, ale może wpływać na metabolizm niektórych substancji, takich jak metronidazol, diklofenak, warfaryna czy karbamazepina. W większości przypadków nie są to interakcje istotne klinicznie343536.
Działania niepożądane
- Bóle i zawroty głowy, złe samopoczucie3738
- Dolegliwości żołądkowo-jelitowe: biegunka, nudności, niestrawność, wymioty3839
- Reakcje skórne: wysypka, świąd, pokrzywka37
Mechanizm działania
Diosmina wzmacnia ściany naczyń krwionośnych, poprawia ich elastyczność i ogranicza ich przepuszczalność. Dzięki temu zmniejsza objawy przewlekłej niewydolności żylnej, takie jak obrzęki, ból i uczucie ciężkości nóg2403.
Stosowanie w ciąży
Nie zaleca się stosowania diosminy u kobiet w ciąży ze względu na brak wystarczających danych potwierdzających jej bezpieczeństwo3031.
Stosowanie u dzieci
Diosmina nie jest przeznaczona do stosowania u dzieci i młodzieży, ponieważ brak jest odpowiednich danych dotyczących bezpieczeństwa i skuteczności w tej grupie wiekowej4126.
Stosowanie u kierowców
Brak danych wskazujących na negatywny wpływ diosminy na zdolność prowadzenia pojazdów. Działania niepożądane występują rzadko i zwykle nie są na tyle nasilone, by ograniczać codzienną aktywność38.
Diosmina – porównanie substancji czynnych
Diosmina, dobezylan wapnia i trokserutyna to leki stosowane w leczeniu przewlekłej niewydolności żylnej, różniące się zakresem wskazań i bezpieczeństwem stosowania. Podobieństwa i różnice: diosmina, d...
czytaj więcej ❯❯- CHPL leku Pelethrocin, tabletki powlekane, 500 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Pelethrocin, 500 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera: zmikronizowaną diosminę 500 mg (Diosminum) Pełny wykaz substancji pomocniczych, patrz punkt 6.1 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana Tabletki powlekane - owalne, obustronnie wypukłe, różowobeżowe z linią podziału. Linia podziału na tabletce nie jest przeznaczona do przełamywania tabletki.
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgWskazania do stosowania
4.1 Wskazania do stosowania Leczenie objawów związanych z niewydolnością żylną kończyn dolnych: uczucie ciężkości nóg ból nocne kurcze Leczenie objawowe w przypadku nasilenia dolegliwości związanych z żylakami odbytu (hemoroidami).
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zwykle stosuje się 2 tabletki na dobę (1 tabletka rano i 1 tabletka wieczorem) podczas posiłków. W przypadku zaostrzenia dolegliwości dotyczących żylaków odbytu dawka wynosi 6 tabletek na dobę (po 2 tabletki trzy razy na dobę) przez pierwsze 4 dni, następnie - przez kolejne 3 dni 4 tabletki (po 2 tabletki dwa razy na dobę). Sposób podawania Pelethrocin jest produktem leczniczym w postaci tabletek powlekanych do podawania doustnego. Podzielenie tabletki na połowy nie zapewnia równomiernego rozłożenia substancji czynnej w obu częściach tabletki.
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na diosminę lub którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku zaburzeń krążenia żylnego w kończynach dolnych, działanie terapeutyczne można zwiększyć poprzez odpowiedni tryb życia: unikanie ekspozycji na słońce, unikanie przebywania w pozycji stojącej przez długi czas, utrzymanie odpowiedniego ciężaru ciała, noszenie specjalnych pończoch. W przypadku nasilenia dolegliwości związanych z żylakami odbytu, należy pamiętać, że terapia produktem leczniczym Pelethrocin jest tylko objawowa i powinna być krótkotrwała. Jeżeli dolegliwości nie przemijają, lekarz przeprowadzi badanie proktologiczne i wybierze odpowiednią metodę leczenia. Stosowanie Pelethrocinu w leczeniu objawowym w przypadku zaostrzenia dolegliwości związanych z żylakami odbytu nie wyklucza podawania innych leków doodbytniczo.
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie stwierdzono istotnych klinicznie interakcji z innymi lekami.
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak wystarczających danych dotyczących stosowania diosminy u kobiet w ciąży. Badania doświadczalne na zwierzętach nie wykazały, aby produkt wywierał działanie teratogenne. W dotychczasowych obserwacjach stosowania diosminy u ludzi nie stwierdzono jakichkolwiek działań teratogennych ani toksycznego działania na płód. Jednak brak wystarczających danych, żeby całkowicie wykluczyć ryzyko. W związku z tym produkt może być stosowany w okresie ciąży, jedynie gdy jest to konieczne. Karmienie piersi? Nie badano czy produkt leczniczy przenika do mleka kobiet karmiących piersią, dlatego podczas karmienia piersią nie zaleca się stosowania produktu leczniczego. Płodność Niedostępne są informacje wskazujące na możliwość wpływu diosminy na płodność.
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pelethrocin nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane zostały opisane z uwzględnieniem częstości występowania zgodnie z poniższą konwencją: Bardzo często (≥1/10), często (≥1/100, <1/10), niezbyt często (≥ 1/1000,<1/100), rzadko (≥1/10000, <1/1000), bardzo rzadko (<1/10000). Działania niepożądane zgłaszane podczas stosowania diosminy to: Zaburzenia żołądka i jelit: Rzadko: biegunka, niestrawność, nudności, wymioty; Zaburzenia układu nerwowego: Rzadko: zawroty głowy, ból głowy, złe samopoczucie; Zaburzenia skóry i tkanki podskórnej: Rzadko: wysypka, świąd, pokrzywka W przypadku łagodnych działań niepożądanych, dotyczących żołądka i jelit, oraz zaburzeń neurowegetatywnych nie jest wymagane odstawienie produktu leczniczego.
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgPrzedawkowanie
4.9 Przedawkowanie Nie zgłoszono żadnego przypadku przedawkowania, lecz w razie przedawkowania spodziewane są następujące objawy: zaburzenia żołądka i jelit, wymioty i nudności. W przypadku przedawkowania powinno być przeprowadzone klasyczne postępowanie medyczne, tzn. wywołanie wymiotów, płukanie żołądka, podanie węgla aktywowanego oraz w dalszym etapie postępowanie objawowe polegające na zabezpieczeniu podstawowych funkcji życiowych.
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki działające ochronnie na naczynia. Bioflawonoidy. Kod ATC: C05CA03. Pelethrocin jest produktem leczniczym wpływającym na elastyczność naczyń. zwiększa napięcie żylne i działa ochronnie na naczynia. W farmakologii: Na poziomie naczyń żylnych: zmniejsza rozszerzalność i światło żył oraz zmniejsza zastój żylny. W zakresie mikrokrążenia: przywraca sprawność kapilar i zwiększa ich wytrzymałość. W farmakologii klinicznej: Badanie prowadzone metodą podwójnie ślepej próby na ludziach, używające metod umożliwiających ilościową ocenę działania hemodynamicznego w układzie żylnym potwierdziły właściwości farmakologiczne produktu leczniczego. Badania relacji dawka-działanie zostały przeprowadzone w zakresie następujących parametrów opisujących układ żylny: objętość, rozszerzalność i czas opróżniania w zakresie dawek.
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgWłaściwości farmakodynamiczne
Najkorzystniejszą relację dawki do osiągnięcia działania terapeutycznego zaobserwowano po podaniu 2 tabletek na dobę. Wpływ na napięcie naczyń żylnych: Produkt leczniczy zwiększa napięcie żylne, u osób z niewydolnością żylną skraca czas opróżnienia układu żylnego kończyn dolnych mierzony przy pomocy rtęciowych przyrządów pomiarowych. Wpływ na mikrokrążenie: Badanie przeprowadzone metodą podwójnie ślepej próby wykazało znamienną statystycznie różnicę pomiędzy działaniem terapeutycznym u pacjentów przyjmujących produkt leczniczy i placebo. Produkt leczniczy zwiększa wytrzymałość układu kapilarnego, szczególnie u pacjentów wykazujących podwyższoną kruchość naczyń. Pomiarów dokonywano metodą stereometrii naczyniowej. Badania kliniczne, prowadzone zgodnie z zasadą podwójnie ślepej próby, w porównaniu z placebo, wykazały działanie korzystne podczas leczenia przewlekłej niewydolności żylnej kończyn dolnych, związanych z funkcjonalną lub organiczną przyczyną, również wykazały działanie korzystne w leczeniu objawów żylaków odbytu.
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Badanie z użyciem diosminy znakowanej węglem C14 wykazało, że eliminacja diosminy zachodzi głównie poprzez wydalanie ze stolcem, a średnio 14% wydalane jest w moczu. Produkt leczniczy podlega intensywnemu metabolizmowi, manifestującemu się obecnością kwasów alkilo-fenolowych w moczu.
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak dodatkowych danych.
- CHPL leku Pelethrocin, tabletki powlekane, 500 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Skład rdzenia tabletki: karboksymetyloskrobia sodowa, celuloza mikrokrystaliczna, żelatyna, magnezu stearynian, talk; Otoczka: wosk pszczeli, glicerol, hypromeloza 2190, macrogol 6000, sodu laurylosiarczan, żelaza tlenek żółty (E 172), żelaza tlenek czerwony (E 172), tytanu dwutlenek (E 171), magnezu stearynian. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Pudełko tekturowe zawiera 2 blistry PVC/Aluminium, każdy po 15 tabletek powlekanych. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań, dotyczących usuwania.
- CHPL leku Otrex 600, tabletki, 600 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Otrex 600, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera jako substancję czynną 600 mg diosminy półsyntetycznej (Diosminum). Pełny wykaz substancji pomocniczych, patrz punkt. 6.1 3. POSTAĆ FARMACEUTYCZNA Tabletki, podłużne, szarożółte lub jasnożółte, z rowkiem dzielącym po obu stronach.
- CHPL leku Otrex 600, tabletki, 600 mgWskazania do stosowania
4.1 Wskazania do stosowania Zmniejszanie objawów związanych z niewydolnością krążenia żylnego kończyn dolnych, np: uczucia ciężkości i bólów nóg oraz dolegliwości spowodowanych odleżynami. Leczenie objawowe w przypadku zaostrzenia dolegliwości ze strony żylaków odbytu.
- CHPL leku Otrex 600, tabletki, 600 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dzieci i młodzież: Nie ma dostępnych danych. Dorośli: Niewydolność krążenia żylnego: 1 tabletka na dobę, rano, na czczo. Zaostrzenie dolegliwości ze strony żylaków odbytu: od 2 do 3 tabletek na dobę w trakcie posiłków. Sposób podawania Podawać doustnie.
- CHPL leku Otrex 600, tabletki, 600 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Otrex 600, tabletki, 600 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku zaostrzenia dolegliwości związanych z żylakami odbytu, podawanie diosminy nie wyklucza leczenia stosowanego w innych chorobach odbytu. Leczenie powinno być krótkotrwałe – do 15 dni. Jeżeli w trakcie leczenia diosminą dolegliwości związane z żylakami odbytu nie ustępują lub się nasilają, należy wykonać badanie proktologiczne i zastosować odpowiednie leczenie.
- CHPL leku Otrex 600, tabletki, 600 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nieznane.
- CHPL leku Otrex 600, tabletki, 600 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak wystarczających danych dotyczących stosowania diosminy u kobiet w ciąży. Badania doświadczalne na zwierzętach nie wykazały, aby produkt wywierał działanie teratogenne. W dotychczasowych obserwacjach stosowania diosminy u ludzi nie stwierdzono jakichkolwiek działań teratogennych ani toksycznego działania na płód. Jednak brak wystarczających danych, żeby całkowicie wykluczyć ryzyko. W związku z tym produkt może być stosowany w okresie ciąży, jedynie gdy jest to konieczne. Karmienie piersi? Ze względu na brak danych na temat przenikania diosminy do mleka kobiecego, stosowanie produktu w okresie karmienia piersią jest niewskazane.
- CHPL leku Otrex 600, tabletki, 600 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Otrex 600, tabletki, 600 mgDziałania niepożądane
4.8 Działania niepożądane W kilku przypadkach opisano działania niepożądane ze strony przewodu pokarmowego (nudności, wymioty), które spowodowały konieczność zaprzestania podawania produktu. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem: Departament Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: ndl@urpl.gov.pl
- CHPL leku Otrex 600, tabletki, 600 mgPrzedawkowanie
4.9 Przedawkowanie Nie zgłoszono żadnego przypadku przedawkowania. Objawy przedawkowania nie są znane.
- CHPL leku Otrex 600, tabletki, 600 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: produkty ochraniające ścianę naczyń, kod ATC: C 05 CA 03. Diosmina zwiększa napięcie ściany naczyń żylnych, normalizuje przepuszczalność naczyń, działa ochronnie na ścianę naczyń. Badania prowadzone na zwierzętach oraz badania kliniczne wykazały następujące właściwości produktu: U zwierząt: Wpływ diosminy na napięcie ściany naczyń żylnych: u psów poddanych znieczuleniu ogólnemu po dożylnym podaniu diosminy obserwowano podwyższenie ciśnienia żylnego. Właściwości ochronne diosminy na ścianę naczyń: u szczurów obserwowano normalizację przepuszczalności naczyń włosowatych, działanie przeciwobrzękowe i przeciwzapalne; u szczurów i świnek morskich z niedoborem witaminy P obserwowano zwiększenie oporu włośniczkowego; u świnek morskich z niedoborem witaminy P obserwowano skrócenie czasu krwawienia; obserwowano również zmniejszenie przepuszczalności naczyń włosowatych wywołane wcześniejszym podaniem chloroformu, histaminy lub hialuronidazy oraz poprawę odkształcalności erytrocytów mierzoną czasem filtracji erytrocytów.
- CHPL leku Otrex 600, tabletki, 600 mgWłaściwości farmakodynamiczne
U ludzi: Wpływ diosminy na napięcie ściany naczyń żylnych: zwiększanie właściwości naczyniozwężających adrenaliny, noradrenaliny i serotoniny w żyłach powierzchownych ręki i w izolowanej żyle odpiszczelowej; zwiększanie napięcia ściany naczyń żylnych wykazane metodą pletyzmografii tensometrycznej oraz zmniejszanie zastoju żylnego; wpływ obkurczający na naczynia żylne był proporcjonalny do podanej dawki diosminy; zmniejszanie średniego ciśnienia żylnego zarówno w naczyniach powierzchownych jak i głębokich (potwierdzono to za pomocą pomiaru dopplerowskiego w badaniu z podwójnie ślepą próbą kontrolowanym placebo); zwiększanie skurczowego i rozkurczowego ciśnienia tętniczego krwi u osób z pooperacyjnym niedociśnieniem ortostatycznym; przeciwdziałanie powikłaniom po usunięciu żyły odpiszczelowej. Ochronne działanie diosminy na ścianę naczyń: zwiększanie oporności naczyń włosowatych w stopniu proporcjonalnym do wielkości podanej dawki.
- CHPL leku Otrex 600, tabletki, 600 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Badania farmakokinetyki przeprowadzono na zwierzętach z użyciem diosminy znakowanej węglem radioaktywnym C14. W badaniach wykazano, że: od drugiej godziny po podaniu produktu rozpoczynała się faza szybkiego wchłaniania, a maksymalne natężenie radioaktywności uzyskano w piątej godzinie; dystrybucja produktu w organizmie była słaba, z wyjątkiem nerek, wątroby, płuc oraz ścian naczyń żylnych, w tym żył głównych i żył odpiszczelowych. W tych strukturach obserwowano większą radioaktywność niż w pozostałych badanych narządach i tkankach. Zwiększony wychwyt diosmetyny i (lub) jej metabolitów w naczyniach żylnych narastał do dziewiątej godziny od podania produktu i utrzymywał się przez 96 godzin; eliminacja produktu z organizmu następowała głównie z moczem (79%), a także z kałem (11%) i z żółcią (2,4%).
- CHPL leku Otrex 600, tabletki, 600 mgWłaściwości farmakokinetyczne
W kale stwierdzono obecność niezmienionej diosminy, diosmetyny i innych metabolitów zawierających radioaktywny C14, co wskazuje na złożony mechanizm wchłaniania i wydalania produktu w przewodzie pokarmowym (krążenie wątrobowo-jelitowe diosminy i jej metabolitów). Z moczem wydalane są metabolity diosminy, nie stwierdzono obecności niezmienionej diosminy. Powyższe wyniki wskazują na dobre wchłanianie produktu po podaniu doustnym, mierzone wielkością radioaktywności C14, oraz na znaczące powinowactwo produktu do naczyń żylnych.
- CHPL leku Otrex 600, tabletki, 600 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka. Toksyczność diosminy jest bardzo mała. LD50 diosminy u myszy po doustnym podaniu jednorazowej dawki jest większe niż 10 g/kg mc., a u szczurów LD50 jest większe niż 5 g/kg mc. Badania przewlekłej toksyczności prowadzone na myszach i świnkach morskich wykazały brak wpływu dawek w zakresie 50 - 620 mg/kg mc./dobę podawanych przez okres 6 miesięcy na parametry biologiczne, hematologiczne i parametry funkcji nerek.
- CHPL leku Otrex 600, tabletki, 600 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Skrobia kukurydziana, celuloza mikrokrystaliczna, powidon, magnezu stearynian. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. 6.5 Rodzaj i zawartość opakowania Opakowanie zawierające 30 tabletek; 2 blistry z folii PVC/Al po 15 tabletek, w tekturowym pudełku. Opakowanie zawierające 15 sztuk; 1 blister z folii PVC/Al po 15 tabletek, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania Brak szczególnych wymagań.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Phlebodia, 600 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 600 mg diosminy (Diosminum). Substancja pomocnicza o znanym działaniu: czerwień koszenilowa A, pąs 4R (E 124). Substancje pomocnicze, patrz: punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki powlekane.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgWskazania do stosowania
4.1. Wskazania do stosowania Zmniejszenie objawów niewydolności krążenia żylnego w obrębie kończyn dolnych (żylaki kończyn dolnych), uczucie ciężkości nóg, ból i inne dolegliwości spowodowane zespołem niespokojnych nóg zmuszające do zmiany pozycji ciała. Krótkotrwałe leczenie objawowe żylaków odbytu w okresie zaostrzeń dolegliwości. Produkt Phlebodia, 600 mg, tabletki powlekane wskazany jest dla dorosłych (od 18 lat).
- CHPL leku Phlebodia, tabletki powlekane, 600 mgDawkowanie
4.2. Dawkowanie i sposób podawania Dawkowanie Dorośli (od 18 lat) Niewydolność krążenia żylnego w obrębie kończyn dolnych: 1 tabletka na dobę (600 mg/dobę). Leczenie objawowe żylaków odbytu: 2 do 3 tabletek na dobę (1200 mg/dobę do 1800 mg/dobę), razem z posiłkiem. Dzieci i młodzież Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego Phlebodia u dzieci i młodzieży w wieku poniżej 18 lat. Sposób podawania Podanie doustne.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na substancję czynną lub którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt leczniczy zawiera czerwień koszenilową A, pąs 4R (E 124) (barwnik azowy), która może powodować reakcje alergiczne. W przypadku, gdy występuje nasilenie objawów choroby hemoroidalnej, przyjmowanie produktu nie zwalnia z leczenia chorób odbytu. Leczenie objawów związanych z żylakami odbytu powinno być krótkotrwałe. Jeśli objawy nie ustąpią szybko, należy wykonać badanie proktologiczne i zastosować odpowiednie leczenie.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji. Nie odnotowano istotnych klinicznie interakcji diosminy.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Ciąża Brak dostępnych danych lub dane są ograniczone, dotyczące stosowania diosminy w czasie ciąży. Badania na zwierzętach nie wykazały toksycznego wpływu na reprodukcję (patrz punkt 5.3). Jako działanie prewencyjne zaleca się unikania stosowania diosminy w czasie ciąży. Laktacja Brak danych na temat przenikania diosminy lub jej metabolitów do mleka kobiet karmiących piersią. Nie można wykluczyć wpływu na dziecko karmione piersią. Należy podjąć decyzję o zaprzestaniu karmienia piersią lub zaprzestaniu przyjmowania produktu Phlebodia, biorąc pod uwagę korzyści karmienia piersią dla dziecka i korzyści leczenia dla kobiety karmiącej piersią. Płodność Badania dotyczące szkodliwego wpływu na reprodukcję nie wykazały wpływu na płodność u samic i samców szczurów (patrz punkt 5.3).
- CHPL leku Phlebodia, tabletki powlekane, 600 mgWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie przeprowadzono badań dotyczących wpływu diosminy na zdolność prowadzenia pojazdów i obsługiwania maszyn. Jednakże, na podstawie ogólnego profilu bezpieczeństwa diosminy można stwierdzić, że produkt Phlebodia nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgDziałania niepożądane
4.8. Działania niepożądane Działania niepożądane zostały przedstawione zgodnie z klasyfikacją układów i narządów MedDRA, a częstość występowania zdarzeń niepożądanych określono w następujący sposób: często (≥1/100, <1/10); niezbyt często (≥1/1000, <1/100); rzadko (≥ 1/10000, <1/1000); bardzo rzadko (<1/10,000); częstość nieznana (nie może być określona na podstawie dostępnych danych). Klasyfikacja układów i narządów MedDRA Często: Zaburzenia żołądka i jelit* Niezbyt często: Bóle żołądka, wzdęcia, biegunka, niestrawność, mdłości Rzadko: Wymioty Zaburzenia skóry i tkanki podskórnej: Reakcje alergiczne takie jak wysypka, świąd, pokrzywka, obrzęk naczynioruchowy *Zaburzenia żołądka i jelit rzadko prowadzą do zaprzestania leczenia.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgPrzedawkowanie
4.9. Przedawkowanie Nie odnotowano działań niepożądanych towarzyszących przedawkowaniu produktu Phlebodia przyjmowanego samodzielnie.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: układ sercowo-naczyniowy, leki ochraniające ściankę naczyń, leki wpływające na elastyczność naczyń. Kod ATC: C 05 CA 03 Substancja czynna zwiększająca napięcie żylne i działająca naczynioochronnie. Diosmina zmniejsza podatność na pękanie małych naczyń krwionośnych, poprawia napięcie żył oraz zmniejsza przepuszczalność żylną. Właściwości te zostały wykazane w różnych badaniach farmakodynamicznych: Badania kliniczne Właściwości utrzymywania napięcia żylnego: nasila zwężenie naczyń spowodowane adrenaliną, noradrenaliną i serotoniną w żyłach powierzchownych ręki i w izolowanej żyle odpiszczelowej, powoduje zwiększenie napięcia żylnego (wykazany poprzez mierzenie objętości kończyny metodą pletyzmograficzną) oraz zmniejszenie zastoju żylnego, powoduje zwężenie naczyń żylnych, działanie to jest zależne od dawki, wyrównuje średnie ciśnienie w naczyniach żylnych powierzchownych i głębokich, co wykazano w badaniu klinicznym z podwójnie ślepą próbą kontrolowaną placebo (pomiar metodą Dopplera), powoduje zwiększenie ciśnienia skurczowego i rozkurczowego w pooperacyjnej hipotonii ortostatycznej, utrzymuje napięcie żylne po usunięciu żyły odpiszczelowej.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgWłaściwości farmakodynamiczne
Działanie ochronne na naczynia żylne: Działanie chroniące naczynia przed pękaniem zależne jest od dawki podawanej doustnie.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Wchłanianie Po podaniu doustnym produktu Phlebodia, 600 mg, diosmina jest metabolizowana do diosmetyny przez bakterie jelitowe. Następnie diosmetyna jest wchłaniana i występuje w osoczu w postaci związanej glukurokonidami i siarczanami. Wykazano, że głównym metabolitem diosminy jest diosmetyny-3-O-glukoronid. Maksymalne stężenie w osoczu osiągane jest między 12 a 15 godziną od przyjęcia produktu Phlebodia. Dystrybucja Badanie farmakokinetyczne u zwierząt z użyciem diosminy znakowanej węglem C-14 wykazało preferencyjną dystrybucję w żyle głównej i żyłach odpiszczelowych. Eliminacja U zwierząt wydalanie następuje przez nerki (79%), z kałem (11%) i z żółcią (2,4%), ze śladami metabolizmu w cyklu wątrobowym. U ludzi, diosmetyna-3-O-glukoronid jest obecna w moczu.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z badań toksyczności po podaniu wielokrotnym, genotoksyczności, oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają zagrożenia dla człowieka.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Kwas stearynowy Talk Krzemionka koloidalna bezwodna (Aerozol R 972) Celuloza mikrokrystaliczna Otoczka: Substancja powlekająca Sepifilm 002: hypromeloza, celuloza mikrokrystaliczna, makrogol 400, stearynian. Substancja barwiąca Sepisperse AP 5523: glikol propylenowy, hypromeloza, tytanu dwutlenek (E 171), czerwień koszenilowa A, pąs 4R (E 124), żelaza tlenek czarny (E 172), żelaza tlenek czerwony (E 172). Opaglos 6000: alkohol etylo wy 95%, guma lakowa (E 904), wosk Carnauba (E 903), wosk pszczeli (E 901). 6.2. Niezgodności farmaceutyczne Nie znane. 6.3. Okres ważności 5 lat 6.4. Specjalne środki ostrożności podczas przechowywania Brak szczególnych środków ostrożności dotyczących przechowywania produktu leczniczego. 6.5. Rodzaj i zawartość opakowania Opakowanie po 15 tabletek; 1 blister po 15 tabletek, w pudełku tekturowym.
- CHPL leku Phlebodia, tabletki powlekane, 600 mgDane farmaceutyczne
Opakowanie po 30 tabletek; 2 blistry po 15 tabletek, w pudełku tekturowym. Opakowanie po 60 tabletek: 4 blistry po 15 tabletek, w pudełku tekturowym. 6.6. Specjalne środki ostrożności dotyczące usuwania Nie ma specjalnych zaleceń.
- CHPL leku DIH, tabletki powlekane, 500 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO DIH, 500 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana zawiera 500 mg zmikronizowanej diosminy (Diosminum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana. Tabletki powlekane - owalne, różowe o gładkiej powierzchni.
- CHPL leku DIH, tabletki powlekane, 500 mgWskazania do stosowania
4.1. Wskazania do stosowania Objawy przewlekłej niewydolności krążenia żylnego kończyn dolnych: bóle i nocne kurcze nóg, uczucie pieczenia nóg, uczucie zimnych nóg, uczucie ciężkości nóg, zmęczenia, dyskomfortu lub niespokojnych nóg, żylaki kończyn dolnych, owrzodzenia żylne, poszerzenia bardzo drobnych naczyń żylnych, tzw. pajączki naczyniowe i żylaki/żyły siatkowate, obrzęki nóg (opuchlizna / puchnięcie nóg), świąd, parestezje (mrowienie), zaczerwienienie (rumień) lub zasinienie skóry. Objawowe leczenie żylaków odbytu. Monoterapia w początkowych stadiach zaawansowania przewlekłej niewydolności żylnej lub jako uzupełnienie innych terapii we wszystkich stopniach zaawansowania przewlekłej choroby żylnej (C0-C6 wg klasyfikacji CEAP).
- CHPL leku DIH, tabletki powlekane, 500 mgDawkowanie
4.2. Dawkowanie i sposób podawania Dawkowanie: Zwykle podaje się dwie tabletki na dobę podczas posiłku, tj. po 1 tabletce rano i wieczorem (co odpowiada podaniu dawki dobowej 1000 mg diosminy, w dwóch dawkach podzielonych po 500 mg). Jedynie w przypadkach zaostrzenia dolegliwości spowodowanych żylakami odbytu zaleca się podawanie większych dawek do 6 tabletek na dobę, tj. 2 razy na dobę po 3 tabletki przez 4 dni, a przez kolejne 3 dni: 4 tabletki na dobę, tj. 2 razy na dobę po 2 tabletki. Sposób podawania: Podanie doustne.
- CHPL leku DIH, tabletki powlekane, 500 mgPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku DIH, tabletki powlekane, 500 mgSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadkach zaostrzenia dolegliwości spowodowanych żylakami odbytu zastosowanie dużych dawek produktu leczniczego powinno być krótkotrwałe i jeśli dolegliwości nie przemijają, wymagana jest kompleksowa ocena proktologiczna stanu pacjenta.
- CHPL leku DIH, tabletki powlekane, 500 mgInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku DIH, tabletki powlekane, 500 mgWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Ciąża Badania przeprowadzone na zwierzętach nie wykazały działania teratogennego. Nie było doniesień o szkodliwym działaniu diosminy podczas stosowania jej u ludzi. Mimo to nie ma wystarczających danych, aby całkowicie wykluczyć ryzyko, dlatego też produkt leczniczy może być stosowany w czasie ciąży wyłącznie w przypadku zdecydowanej konieczności. Karmienie piersi? Nie wiadomo, czy produkt leczniczy przenika do mleka kobiet karmiących, dlatego zaleca się unikanie karmienia piersią w okresie jego przyjmowania.
- CHPL leku DIH, tabletki powlekane, 500 mgWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy DIH nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku DIH, tabletki powlekane, 500 mgDziałania niepożądane
4.8. Działania niepożądane Opisano rzadko występujące przypadki odczynów dermatologicznych (egzema, wysypka, świąd, pokrzywka, łupież różowy) wynikających z nadwrażliwości na diosminę. Po podaniu diosminy (wg dostępnej literatury w mniej niż 2% przypadków) mogą wystąpić zaburzenia żołądka i jelit (bóle żołądka, nudności, niestrawność, wymioty, biegunka lub inne zaburzenia dotyczące przewodu pokarmowego). Notowano także przypadki wystąpienia zaburzeń neurowegetatywnych (bezsenność, trudności w zasypianiu, zawroty i bóle głowy, niepokój), które na ogół nie wymagały przerwania podawania diosminy i przemijały wkrótce po jej odstawieniu. Zgłaszanie podejrzewanych działań niepożądanych: Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku DIH, tabletki powlekane, 500 mgDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181 C, 02-222 Warszawa, tel. +48 22 49 21 301, fax: + 48 22 49 21 309, Strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku DIH, tabletki powlekane, 500 mgPrzedawkowanie
4.9. Przedawkowanie Nie są znane objawy przedawkowania.
- CHPL leku DIH, tabletki powlekane, 500 mgWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki ochraniające ścianę naczyń, leki wpływające na elastyczność naczyń, bioflawonoidy. Kod ATC: C 05 CA 03 Tabletki powlekane DIH zawierają diosminę zaliczaną do flawonów – podgrupy bioflawonoidów. Diosmina jest półsyntetycznym analogiem naturalnego flawonoidu - 7-rutynozydem diosmetyny (7-ramnoglukozyd trójhydroksy - 5,7,3’-metoksy-4”-flawonowy). Diosmina wpływa na mikrokrążenie i parametry hemoreologiczne krążenia. Wykazuje działanie ochronne wobec naczyń żylnych (dwukrotnie silniejsze od trokserutyny), zmniejsza ich przepuszczalność, zapewnia elastyczność ścian naczyń i zwiększenie ich napięcia (m.in. na skutek przedłużenia skurczu włókien mięśniowych ściany naczyń żylnych w odpowiedzi na noradrenalinę i wzrost wrażliwości miocytów na jony wapniowe). Poprawiając powrót krwi z układu żylnego kończyn dolnych, zmniejsza nadciśnienie i zastój żylny w kończynach.
- CHPL leku DIH, tabletki powlekane, 500 mgWłaściwości farmakodynamiczne
Hamuje patologiczną aktywację i adhezję leukocytów do ścian naczyń włosowatych, zmniejsza nadmierną lepkość krwi. Dzięki hamowaniu wydzielania mediatorów reakcji zapalnej (hamuje syntezę prostaglandyn i działa przeciwutleniająco, zmniejsza stężenie wolnych rodników, ogranicza uwalnianie histaminy, zmniejsza aktywność hialuronidazy i ceruloplazminy) ma właściwości przeciwzapalne. Diosmina zwiększa przepływ w układzie chłonnym, podwyższa ciśnienie onkotyczne limfy. Tak jak inne flawonoidy, jest uznawana za silny inhibitor prostaglandyny E2, F2α i tromboksanu (A2 i lub B2), hamujący aktywację, migrację i adhezję leukocytów oraz aktywację neutrofili.
- CHPL leku DIH, tabletki powlekane, 500 mgWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Wchłanianie Diosmina po podaniu doustnym jest metabolizowana w jelitach przez florę bakteryjną do swojego aglikonu - diosmetyny i w tej postaci szybko wchłania się z przewodu pokarmowego. Dystrybucja Tmax dla diosmetyny wynosi ok. 1 h. Okres półtrwania diosmetyny w osoczu krwi (T½) wynosi średnio 31,5 godziny (24 - 36 h). Metabolizm Metabolitami diosminy są kwasy fenolowe i ich pochodne sprzężone z glicyną. Eliminacja W ciągu pierwszej doby leczenia metabolity są wydalane przez nerki oraz z kałem, a następnie tylko z kałem. Razem z kałem wydalana jest niewchłonięta część dawki diosminy i diosmetyny oraz nieaktywne metabolity diosmetyny, głównie kwasy fenolowe.
- CHPL leku DIH, tabletki powlekane, 500 mgPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Brak istotnych danych nieklinicznych o znaczeniu klinicznym, nieopisanych w pozostałych punktach Charakterystyki Produktu Leczniczego.
- CHPL leku DIH, tabletki powlekane, 500 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Celuloza mikrokrystaliczna Powidon Karboksymetyloskrobia sodowa Magnezu stearynian Otoczka Opadry II 85F24220 Pink Skład otoczk i: poliwinylowy alkohol, tytanu dwutlenek (E 171), Makrogol – PEG 3350, talk, żelaza tlenek żółty (E 172) oraz żelaza tlenek czerwony (E 172). 6.2. Niezgodności farmaceutyczne Nie dotyczy. 6.3. Okres ważności 3 lata 6.4. Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu, w temperaturze poniżej 25°C. 6.5. Rodzaj i zawartość opakowania 30 tabletek (2 blistry z folii PVC/PVDC/Aluminium po 15 tabletek powlekanych), w tekturowym pudełku; 60 tabletek (4 blistry z folii PVC/PVDC/ Aluminium po 15 tabletek powlekanych), w tekturowym pudełku; 90 tabletek (6 blistrów z folii PVC/PVDC/ Aluminium po 15 tabletek powlekanych), w tekturowym pudełku. 6.6.
- CHPL leku DIH, tabletki powlekane, 500 mgDane farmaceutyczne
Specjalne środki ostrożności dotyczące usuwania i przygotowywania produktu leczniczego do stosowania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Procto-Hemolan control, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1000 mg diosminy (Diosminum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka Tabletka z kreską dzielącą. Linia podziału na tabletce ułatwia tylko jej rozkruszenie, w celu łatwiejszego połknięcia, a nie podział na równe dawki.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgWskazania do stosowania
4.1 Wskazania do stosowania Leczenie objawowe w przypadku nasilenia dolegliwości związanych z żylakami odbytu (hemoroidy).
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgDawkowanie
4.2 Dawkowanie i sposób podawania Podanie doustne. Zaostrzenie dolegliwości dotyczących żylaków odbytu: 3 tabletki na dobę przez 4 dni, a następnie 2 tabletki na dobę przez kolejne 3 dni, podczas posiłków.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku zaostrzenia dolegliwości związanych z żylakami odbytu, należy pamiętać, że jest to tylko leczenie objawowe i powinno być krótkotrwałe. Jeżeli dolegliwości nie ustępują, należy wykonać badanie proktologiczne i wybrać odpowiednią metodę leczenia.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie stwierdzono istotnych klinicznie interakcji z innymi lekami.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża: Badania na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka (płodu) lub przebieg porodu (patrz punkt 5.3). W przypadku zdecydowanej konieczności produkt może zostać przepisany kobiecie w ciąży. Karmienie piersią: Nie należy stosować produktu leczniczego w okresie karmienia piersią z uwagi na brak danych dotyczących przenikania diosminy do mleka kobiecego.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane, które mogą wystąpić w czasie stosowania produktu leczniczego, są wymienione poniżej zgodnie z klasyfikacją układów i narządów oraz częstością występowania. Bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥ 1/1 000 do <1/100), rzadko (≥ 1/10 000 do <1/1 000), bardzo rzadko (<1/10 000). Zaburzenia żołądka i jelit Rzadko: biegunka, niestrawność, nudności, wymioty. Zaburzenia układu nerwowego Rzadko: zawroty głowy, ból głowy, złe samopoczucie. Zaburzenia skóry i tkanki podskórnej Wysypka, świąd, pokrzywka. Zaobserwowane działania niepożądane nie powodują konieczności odstawienia produktu leczniczego.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgPrzedawkowanie
4.9 Przedawkowanie Nie odnotowano przypadków wystąpienia zatrucia diosminą z powodu jej przedawkowania. Przedawkowanie może powodować zaburzenia żołądkowo-jelitowe, wymioty i nudności. W przypadku przedawkowania powinno być przeprowadzone klasyczne postępowanie medyczne, tzn. wywołanie wymiotów, płukanie żołądka, podanie węgla aktywnego oraz na dalszym etapie postępowanie objawowe, polegające na zabezpieczeniu podstawowych czynności życiowych.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki ochraniające ścianę naczyń, bioflawonoidy. kod ATC: C 05 CA 03 Diosmina zwiększa napięcie żylne i działa ochronnie na naczynia. W naczyniach żylnych zmniejsza rozszerzalność żył oraz zastój żylny. W mikrokrążeniu zmniejsza przepuszczalność włośniczek i zwiększa ich opór. Kontrolowane badania z zastosowaniem podwójnie ślepej próby przeprowadzone w celu zbadania wpływu diosminy na hemodynamikę żylną potwierdziły jej właściwości farmakologiczne. Statystycznie znamienny związek pomiędzy dawką diosminy a działaniem terapeutycznym wykazano na podstawie parametrów pletyzmografii żylnej: pojemności żylnej, rozszerzalności żylnej i czasu opróżniania naczynia żylnego. Optymalny efekt terapeutyczny zaobserwowano przy dawce 2 x 500 mg na dobę. Wpływ na napięcie naczyń żylnych: diosmina zwiększa napięcie naczyń żylnych; żylna pletyzmografia okluzyjna wykazała skrócenie czasu opróżniania naczynia żylnego.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgWłaściwości farmakodynamiczne
Wpływ na mikrokrążenie: kontrolowane badania z zastosowaniem podwójnie ślepej próby wykazały statystycznie znamienną różnicę pomiędzy efektami terapeutycznymi u pacjentów przyjmujących diosminę i placebo. Diosmina zwiększa wytrzymałość układu kapilarnego, szczególnie u pacjentów z nasiloną kruchością naczyń. Badania przeprowadzone z zastosowaniem podwójnie ślepej próby, kontrolowane za pomocą placebo, wykazały skuteczność terapeutyczną diosminy we flebografii, w terapii czynnościowej i organicznej przewlekłej niewydolności żylnej kończyn dolnych oraz w proktologii w leczeniu żylaków odbytu.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Diosmina po podaniu doustnym jest hydrolizowana w jelitach przez florę bakteryjną do aglikonu – diosmetyny, która szybko wchłania się z przewodu pokarmowego. Dystrybucja Tmax dla diosmetyny wynosi ok. 1h. Okres półtrwania diosmetyny w osoczu krwi (T1/2) wynosi średnio 31,5 godziny. Metabolizm Metabolitami diosminy są kwasy fenolowe i ich pochodne sprzężone z glicyną. Eliminacja W postaci zmetabolizowanej jest wydalana głównie z kałem i moczem. Niewchłonięta część dawki diosminy i diosmetyny jest wydalana z kałem.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na myszach i szczurach nie stwierdzono szkodliwego wpływu dużych dawek diosminy na przebieg ciąży i porodu oraz rozwój płodu.
- CHPL leku Procto-Hemolan control, tabletki, 1000 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Alkohol poliwinylowy Kroskarmeloza sodowa Talk Krzemionka koloidalna bezwodna Magnezu stearynian 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. 6.5 Rodzaj i zawartość opakowania Blistry z folii Aluminium/PVC/PVDC w tekturowym pudełku. 10 szt. (1 blister po 10 szt.) 20 szt. (2 blistry po 10 szt.) 30 szt. (3 blistry po 10 szt.) Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Diosminum Aflofarm, 500 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 500 mg diosminy (Diosminum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgWskazania do stosowania
4.1 Wskazania do stosowania Przewlekła niewydolność krążenia żylnego kończyn dolnych (żylaki): uczucie ciężkości nóg; ból nóg; nocne kurcze. Leczenie objawowe w przypadku nasilenia dolegliwości związanych z żylakami odbytu (hemoroidy).
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zazwyczaj stosowana dawka produktu leczniczego to 1 tabletka 2 razy na dobę (rano i wieczorem), podczas posiłków. W przypadku zaostrzenia dolegliwości ze strony żylaków odbytu stosować 6 tabletek na dobę przez 4 dni, a następnie 4 tabletki na dobę przez kolejne 3 dni, podczas posiłków. Sposób podawania Podanie doustne.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku zaostrzenia dolegliwości związanych z żylakami odbytu, należy pamiętać, że jest to tylko leczenie objawowe i powinno być krótkotrwałe. Jeżeli dolegliwości nie ustępują, należy wykonać badanie proktologiczne i wybrać odpowiednią metodę leczenia. Specjalne ostrzeżenia dotyczące substancji pomocniczych Sód Produkt leczniczy zawiera 0,429 mg sodu w każdej tabletce. Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu w 1 tabletce to znaczy lek uznaje się za „wolny od sodu”.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie stwierdzono istotnych klinicznie interakcji z innymi lekami.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża: Badania na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka (płodu) lub przebieg porodu (patrz punkt 5.3). W przypadku zdecydowanej konieczności produkt może zostać przepisany kobiecie w ciąży. Karmienie piersią: Nie należy stosować produktu leczniczego w okresie karmienia piersią z uwagi na brak danych dotyczących przenikania diosminy do mleka kobiecego.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane, które mogą wystąpić w czasie stosowania produktu leczniczego, są wymienione poniżej zgodnie z klasyfikacją układów i narządów oraz częstością występowania. Bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥ 1/1 000 do <1/100), rzadko (≥ 1/10 000 do <1/1 000), bardzo rzadko (<1/10 000). Zaburzenia żołądka i jelit Rzadko: biegunka, niestrawność, nudności, wymioty. Zaburzenia układu nerwowego Rzadko: zawroty głowy, ból głowy, złe samopoczucie. Zaburzenia skóry i tkanki podskórnej Wysypka, świąd, pokrzywka. Zaobserwowane działania niepożądane nie powodują konieczności odstawienia produktu leczniczego. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02 – 222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można również zgłaszać podmiotowi odpowiedzialnemu.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgPrzedawkowanie
4.9 Przedawkowanie Nie odnotowano przypadków wystąpienia zatrucia diosminą z powodu jej przedawkowania. Przedawkowanie może powodować zaburzenia żołądkowo-jelitowe, wymioty i nudności. W przypadku przedawkowania powinno być przeprowadzone klasyczne postępowanie medyczne, tzn. wywołanie wymiotów, płukanie żołądka, podanie węgla aktywnego oraz na dalszym etapie postępowanie objawowe, polegające na zabezpieczeniu podstawowych czynności życiowych.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki ochraniające ścianę naczyń, bioflawonoidy. kod ATC: C 05 CA 03 Diosmina zwiększa napięcie żylne i działa ochronnie na naczynia. W naczyniach żylnych zmniejsza rozszerzalność żył oraz zastój żylny. W mikrokrążeniu zmniejsza przepuszczalność włośniczek i zwiększa ich opór. Kontrolowane badania z zastosowaniem podwójnie ślepej próby przeprowadzone w celu zbadania wpływu diosminy na hemodynamikę żylną potwierdziły jej właściwości farmakologiczne. Statystycznie znamienny związek pomiędzy dawką diosminy a działaniem terapeutycznym wykazano na podstawie parametrów pletyzmografii żylnej: pojemności żylnej, rozszerzalności żylnej i czasu opróżniania naczynia żylnego. Optymalny efekt terapeutyczny zaobserwowano przy dawce 2 x 500 mg na dobę.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgWłaściwości farmakodynamiczne
W czterotygodniowym badaniu, w którym porównywano wpływ półsyntetycznej diosminy w dawce 600 mg, raz na dobę, z frakcją flawonoidową zawierającą 90% diosminy w dawce 2 x 500 mg na dobę wykazano, że obie badane substancje w porównywalny sposób zmniejszały dolegliwości związane z niewydolnością kończyn dolnych oraz charakteryzowały się podobnym profilem bezpieczeństwa. Wpływ na napięcie naczyń żylnych: diosmina zwiększa napięcie naczyń żylnych; żylna pletyzmografia okluzyjna wykazała skrócenie czasu opróżniania naczynia żylnego. Wpływ na mikrokrążenie: kontrolowane badania z zastosowaniem podwójnie ślepej próby wykazały statystycznie znamienną różnicę pomiędzy efektami terapeutycznymi u pacjentów przyjmujących diosminę i placebo. Diosmina zwiększa wytrzymałość układu kapilarnego, szczególnie u pacjentów z nasiloną kruchością naczyń.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgWłaściwości farmakodynamiczne
Badania przeprowadzone z zastosowaniem podwójnie ślepej próby kontrolowane za pomocą placebo, wykazały skuteczność terapeutyczną diosminy we flebografii, w terapii czynnościowej i organicznej przewlekłej niewydolności żylnej kończyn dolnych oraz w proktologii w leczeniu żylaków odbytu.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Diosmina po podaniu doustnym jest hydrolizowana w jelitach przez florę bakteryjną do aglikonu – diosmetyny, która szybko wchłania się z przewodu pokarmowego. Dystrybucja Tmax dla diosmetyny wynosi ok. 1h. Okres półtrwania diosmetyny w osoczu krwi (T1/2) wynosi średnio 31,5 godziny. Metabolizm Metabolitami diosminy są kwasy fenolowe i ich pochodne sprzężone z glicyną. Eliminacja W postaci zmetabolizowanej jest wydalana głównie z kałem i moczem. Niewchłonięta część dawki diosminy i diosmetyny jest wydalana z kałem.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na myszach i szczurach nie stwierdzono szkodliwego wpływu dużych dawek diosminy na przebieg ciąży i porodu oraz rozwój płodu.
- CHPL leku Diosminum Aflofarm, tabletki, 500 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Celuloza mikrokrystaliczna Mannitol Alkohol poliwinylowy Kroskarmeloza sodowa Talk Krzemionka koloidalna bezwodna Magnezu stearynian 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. 6.5 Rodzaj i zawartość opakowania Blistry z folii Aluminium/PVC/PVDC w tekturowym pudełku. 20 szt. (2 blistry po 10 szt.) 30 szt. (3 blistry po 10 szt.) 60 szt. (6 blistrów po 10 szt.) Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Diohespan Max, tabletki, 1000 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Diohespan max, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1000 mg zmikronizowanej diosminy (Diosminum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka Tabletka z linią podziału. Linia podziału na tabletce ułatwia tylko jej przełamanie, w celu łatwiejszego połknięcia, a nie podział na równe dawki.
- CHPL leku Diohespan Max, tabletki, 1000 mgWskazania do stosowania
4.1 Wskazania do stosowania Leczenie objawowe przewlekłej niewydolności krążenia żylnego kończyn dolnych u osób dorosłych, która obejmuje: żylaki owrzodzenia żylne teleangiektazje (poszerzenia bardzo drobnych naczyń żylnych, tzw. pajączki naczyniowe) żyły siatkowate uczucie ciężkości, dyskomfortu, zmęczenia nóg zespół niespokojnych nóg ból nóg uczucie pieczenia, swędzenia skóry nóg uczucie zimnych nóg nocne kurcze obrzęki nóg parestezje (mrowienie) zaczerwienienie (rumień) skóry zasinienie skóry. Diohespan max jest wskazany w monoterapii w początkowych stopniach zaawansowania przewlekłej niewydolności żylnej lub jako uzupełnienie innych terapii we wszystkich stopniach zaawansowania niewydolności żylnej (C0 – C6 wg klasyfikacji CEAP). Leczenie objawowe w przypadku nasilenia dolegliwości związanych z żylakami odbytu (hemoroidy).
- CHPL leku Diohespan Max, tabletki, 1000 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Przewlekła niewydolność krążenia żylnego kończyn dolnych Zazwyczaj stosowana dawka produktu leczniczego to 1 tabletka raz na dobę, podczas posiłku. Leczenie powinno trwać przez co najmniej 4-5 tygodni. Zaostrzenie dolegliwości dotyczących żylaków odbytu 3 tabletki na dobę przez 4 dni, a następnie 2 tabletki na dobę przez kolejne 3 dni, podczas posiłków. Sposób podawania Podanie doustne.
- CHPL leku Diohespan Max, tabletki, 1000 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Diohespan Max, tabletki, 1000 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku zaostrzenia dolegliwości związanych z żylakami odbytu, należy pamiętać, że jest to tylko leczenie objawowe i powinno być krótkotrwałe. Jeżeli dolegliwości nie ustępują, należy wykonać badanie proktologiczne i wybrać odpowiednią metodę leczenia. Specjalne ostrzeżenia dotyczące substancji pomocniczych Sód Produkt leczniczy zawiera 0,807 mg sodu w każdej tabletce. Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na 1 tabletkę, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
- CHPL leku Diohespan Max, tabletki, 1000 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie stwierdzono istotnych klinicznie interakcji z innymi produktami leczniczymi.
- CHPL leku Diohespan Max, tabletki, 1000 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Badania na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka (płodu) lub przebieg porodu (patrz punkt 5.3). W przypadku zdecydowanej konieczności produkt może zostać przepisany kobiecie w ciąży. Karmienie piersi? Nie należy stosować produktu leczniczego w okresie karmienia piersią z uwagi na brak danych dotyczących przenikania diosminy do mleka kobiecego.
- CHPL leku Diohespan Max, tabletki, 1000 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Diohespan Max, tabletki, 1000 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane, które mogą wystąpić w czasie stosowania produktu leczniczego, wymieniono poniżej zgodnie z klasyfikacją układów i narządów oraz częstością występowania. Bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥ 1/1 000 do <1/100), rzadko (≥ 1/10 000 do <1/1 000), bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia żołądka i jelit Rzadko: biegunka, niestrawność, nudności, wymioty. Zaburzenia układu nerwowego Rzadko: zawroty głowy, ból głowy, złe samopoczucie. Zaburzenia skóry i tkanki podskórnej Wysypka, świąd, pokrzywka. Zaobserwowane działania niepożądane nie powodują konieczności odstawienia produktu leczniczego.
- CHPL leku Diohespan Max, tabletki, 1000 mgPrzedawkowanie
4.9 Przedawkowanie Nie odnotowano przypadków wystąpienia zatrucia diosminą z powodu jej przedawkowania. Przedawkowanie może powodować zaburzenia żołądkowo-jelitowe, wymioty i nudności. W przypadku przedawkowania zaleca się rutynowe postępowanie medyczne, tzn. wywołanie wymiotów, płukanie żołądka, podanie węgla aktywnego oraz na dalszym etapie postępowanie objawowe, polegające na zabezpieczeniu podstawowych czynności życiowych.
- CHPL leku Diohespan Max, tabletki, 1000 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki ochraniające ścianę naczyń, bioflawonoidy. kod ATC: C 05 CA 0 3 Diosmina zwiększa napięcie żylne i działa ochronnie na naczynia. W naczyniach żylnych zmniejsza rozszerzalność oraz zastój żylny. W mikrokrążeniu zmniejsza przepuszczalność włośniczek i zwiększa ich opór. Kontrolowane badania z zastosowaniem podwójnie ślepej próby przeprowadzone w celu zbadania wpływu diosminy na hemodynamikę żylną potwierdziły jej właściwości farmakologiczne. Statystycznie znamienny związek pomiędzy dawką diosminy a działaniem terapeutycznym wykazano na podstawie parametrów pletyzmografii żylnej: pojemności żylnej, rozszerzalności żylnej i czasu opróżniania naczynia żylnego. Optymalny efekt leczniczy zaobserwowano przy dawce 1000 mg na dobę. Wpływ na napięcie naczyń żylnych: diosmina zwiększa napięcie naczyń żylnych; żylna pletyzmografia okluzyjna wykazała skrócenie czasu opróżniania naczynia żylnego.
- CHPL leku Diohespan Max, tabletki, 1000 mgWłaściwości farmakodynamiczne
Wpływ na mikrokrążenie: kontrolowane badania z zastosowaniem podwójnie ślepej próby wykazały statystycznie znamienną różnicę pomiędzy efektami terapeutycznymi u pacjentów przyjmujących diosminę i placebo. Diosmina zwiększa wytrzymałość układu kapilarnego, szczególnie u pacjentów z nasiloną kruchością naczyń. Badania przeprowadzone z zastosowaniem podwójnie ślepej próby kontrolowane za pomocą placebo, wykazały skuteczność leczniczą diosminy we flebografii, w terapii czynnościowej i organicznej przewlekłej niewydolności żylnej kończyn dolnych oraz w proktologii w leczeniu żylaków odbytu. W opublikowanych metaanalizach z badań klinicznych wykazano, że diosmina istotnie ogranicza występowanie objawów związanych z niewydolnością żylną: dyskomfort funkcjonalny, uczucie ciężkości, zmęczenia, ból lub pieczenie nóg, nocne kurcze nóg, parestezje, świąd, obrzęk nóg, zasinienie/zaczerwienienie nóg i poprawia jakość życia pacjentów z niewydolnością żylną kończyn dolnych.
- CHPL leku Diohespan Max, tabletki, 1000 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Diosmina po podaniu doustnym jest hydrolizowana w jelitach przez florę bakteryjną do aglikonu – diosmetyny, która szybko wchłania się z przewodu pokarmowego. Dystrybucja Tmax dla diosmetyny wynosi około 1 godzinę. Okres półtrwania diosmetyny w osoczu krwi (T1/2) wynosi średnio 31,5 godziny. Metabolizm Metabolitami diosminy są kwasy fenolowe i ich pochodne sprzężone z glicyną. Eliminacja W postaci zmetabolizowanej jest wydalana głównie z kałem i moczem. Niewchłonięta część dawki diosminy i diosmetyny jest wydalana z kałem.
- CHPL leku Diohespan Max, tabletki, 1000 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na myszach i szczurach nie stwierdzono szkodliwego wpływu dużych dawek diosminy na przebieg ciąży i porodu oraz rozwój płodu.
- CHPL leku Diohespan Max, tabletki, 1000 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Alkohol poliwinylowy Kroskarmeloza sodowa Talk Krzemionka koloidalna bezwodna Magnezu stearynian 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. 6.5 Rodzaj i zawartość opakowania Blistry z folii Aluminium/PVC/PVDC w tekturowym pudełku. 10 tabletek (1 blister po 10 szt.) 20 tabletek (2 blistry po 10 szt.) 30 tabletek (3 blistry po 10 szt.) 60 tabletek (6 blistrów po 10 szt.) Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Diosminex Max, 1000 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 1000 mg zmikronizowanej diosminy (Diosminum). Substancje pomocnicze o znanym działaniu: laktoza jednowodna (80 mg w tabletce powlekanej) oraz lak żółcieni pomarańczowej (0,063 mg w tabletce powlekanej). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana. Tabletki powlekane są zielone, podłużne, obustronnie wypukłe, o gładkiej powierzchni, bez plam i uszkodzeń.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgWskazania do stosowania
4.1 Wskazania do stosowania Diosminex Max jest wskazany w leczeniu objawów przewlekłej niewydolności żylnej u osób dorosłych, jak: żylaki kończyn dolnych owrzodzenia żylne teleangiektazje i żylaki/żyły siatkowate uczucie ciężkości, zmęczenia, dyskomfortu lub niespokojnych nóg ból nóg lub uczucie pieczenia nóg uczucie zimnych nóg nocne kurcze nóg obrzęki kończyn dolnych świąd, parestezje (mrowienie) zaczerwienienie (rumień) lub zasinienie skóry. Diosminex Max jest wskazany w monoterapii w początkowych stopniach zaawansowania przewlekłej niewydolności żylnej lub jako uzupełnienie innych terapii we wszystkich stopniach zaawansowania niewydolności żylnej (C0 – C6 wg klasyfikacji CEAP). Diosminex Max jest wskazany w leczeniu nasilonych dolegliwości związanych z żylakami odbytu u osób dorosłych.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Leczenie objawów przewlekłej niewydolności żylnej: Zalecana dawka to 1 tabletka raz na dobę podczas posiłku. Leczenie powinno trwać przez co najmniej 4-5 tygodni. Objawowe leczenie w nasileniu dolegliwości związanych z żylakami odbytu: W przypadku zaostrzenia dolegliwości związanych z żylakami odbytu zalecana dawka wynosi 3 tabletki na dobę przez pierwsze 4 dni, a następnie 2 tabletki na dobę przez kolejne 3 dni. Leczenie powinno być krótkotwałe. Jeżeli objawy szybko nie ustępują, należy wykonać badanie proktologiczne i leczenie dostosować do jego wyniku. Szczególne grupy pacjentów Brak badań dotyczących dawkowania u pacjentów w podeszłym wieku oraz u pacjentów z zaburzeniami czynności nerek i (lub) wątroby. Na podstawie dostępnych danych, nie stwierdza się szczególnego ryzyka u pacjentów w podeszłym wieku, z zaburzeniami czynności nerek i (lub) wątroby. Dzieci i młodzież Brak danych.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgDawkowanie
Sposób podawania Diosminex Max należy stosować doustnie.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku nasilenia dolegliwości związanych z żylakami odbytu, należy pamiętać, że terapia produktem leczniczym Diosminex Max jest tylko objawowa i powinna być krótkotrwała. Jeżeli dolegliwości nie ustępują, należy wykonać badanie proktologiczne i wybrać odpowiednią metodę leczenia. Stosowanie tego produktu leczniczego w leczeniu objawowym w przypadku zaostrzenia dolegliwości związanych z żylakami odbytu nie wyklucza jednoczesnego podawania innych leków doodbytniczo. Produkt leczniczy Diosminex Max nie jest skuteczny w leczeniu zastoinowej niewydolności serca i związanych nią obrzęków. Produktu leczniczego Diosminex Max nie należy stosować u pacjentów z niewydolnością serca. W przypadku zaburzeń krążenia żylnego w kończynach dolnych, działanie terapeutyczne produktu leczniczego Diosminex Max można zwiększyć poprzez odpowiedni tryb życia: unikanie ekspozycji słonecznej, unikanie przebywania w pozycji stojącej przez dłuższy czas, utrzymanie odpowiedniej masy ciała, noszenie specjalnych pończoch.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgSpecjalne środki ostrozności
Produkt leczniczy Diosminex Max zawiera laktozę jednowodną. Produkt ten nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy. Diosminex Max zawiera lak żółcieni pomarańczowej (E 110). Może powodować reakcje alergiczne. Diosminex Max zawiera mniej niż 1 mmol sodu (23 mg) na jedną tabletkę, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji W badaniach na nielicznej grupie zdrowych, dorosłych ochotników wykazano, że diosmina zmienia profil farmakokinetyczny metronidazolu podwyższając jego maksymalne stężenie w osoczu i wydłużając czas jego eliminacji. Diosmina może zwiększać także czas eliminacji i maksymalne stężenie w osoczu diklofenaku, feksofenadyny, warfaryny i karbamazepiny. Dzieci i młodzież Badania dotyczące interakcji z innymi produktami leczniczymi wykonano tylko u dorosłych.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych lub istnieją tylko ograniczone dane (mniej niż 300 kobiet w ciąży) dotyczące stosowania diosminy u kobiet w okresie ciąży. Badania na zwierzętach nie wykazały bezpośredniego ani pośredniego szkodliwego wpływu na reprodukcję (patrz punkt 5.3). W celu zachowania ostrożności zaleca się unikanie stosowania produktu leczniczego Diosminex Max podczas ciąży. Karmienie piersi? Nie wiadomo czy diosmina lub jej metabolity przenikają do mleka ludzkiego. Nie można wykluczyć zagrożenia dla noworodków i niemowląt karmionych piersią. Produktu leczniczego Diosminex Max nie należy stosować w okresie karmienia piersią. Płodność Niedostępne są informacje wskazujące na możliwość wpływu diosminy na płodność.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Diosminex Max nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane zostały opisane z uwzględnieniem częstości występowania zgodnie z poniższą konwencją: Bardzo często (≥1/10) często (≥1/100, <1/10) niezbyt często (≥ 1/1 000, <1/100) rzadko (≥ 1/10 000, <1/1 000) bardzo rzadko (<1/10 000) Zaburzenia układu nerwowego Rzadko: zawroty głowy, ból głowy. Zaburzenia ogólne i stany w miejscu podania Rzadko: złe samopoczucie. Zaburzenia żołądka i jelit Rzadko: biegunka, niestrawność, nudności, wymioty. Zaburzenia skóry i tkanki podskórnej Rzadko: wysypka, świąd, pokrzywka. W przypadku łagodnych działań niepożądanych, dotyczących żołądka i jelit, oraz zaburzeń neurowegetatywnych nie jest wymagane odstawienie produktu leczniczego. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181 C, 02-222 Warszawa Tel.: +48 22 49 21 301, Faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgPrzedawkowanie
4.9 Przedawkowanie Objawy: Nie odnotowano żadnego przypadku przedawkowania. Przedawkowanie może powodować zaburzenia żołądkowo-jelitowe, wymioty i nudności. W przypadku zastosowania bardzo dużych dawek może wystąpić biegunka. Leczenie: W przypadku przedawkowania należy przeprowadzić klasyczne postępowanie medyczne, tzn. wywołanie wymiotów, płukanie żołądka, podanie węgla aktywnego oraz w dalszym etapie postępowanie objawowe, w tym częste monitorowanie czynności życiowych i ścisłą obserwację pacjenta.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki działające ochronnie na naczynia. Leki stabilizujące naczynia włosowate. Bioflawonoidy. Kod ATC: C05CA03 Diosminex Max zwiększa napięcie żylne i działa ochronnie na naczynia. Na poziomie naczyń żylnych zmniejsza rozszerzalność żył oraz zastój żylny. Na poziomie mikrokrążenia zmniejsza przepuszczalność włośniczek i zwiększa ich opór. Kontrolowane badania z zastosowaniem podwójnie ślepej próby przeprowadzone w celu zbadania aktywności diosminy na hemodynamikę żylną potwierdziły jej właściwości farmakologiczne. Statystycznie znamienny związek pomiędzy dawką a działaniem terapeutycznym wykazano na podstawie parametrów pletyzmografii żylnej takich jak pojemność żylna, rozszerzalność żylna i czas opróżniania naczynia żylnego. Optymalne działanie terapeutyczne zaobserwowano podczas podawania dawki 1000 mg na dobę.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgWłaściwości farmakodynamiczne
Wpływ na stan napięcia naczyń żylnych: diosmina zwiększa napięcie naczyń żylnych – żylna pletyzmografia okluzyjna wykazała skrócenie czasu opróżniania naczynia żylnego. Wpływ na mikrokrążenie: badania z zastosowaniem podwójnie ślepej próby wykazały statystycznie istotną różnicę aktywności terapeutycznej u pacjentów przyjmujących placebo i diosminę. Diosmina zwiększa odporność naczyń włosowatych, szczególnie u pacjentów z objawami kruchości naczyń włosowatych. Badania przeprowadzone z zastosowaniem podwójnie ślepej próby, kontrolowane placebo, wykazały skuteczność terapeutyczną diosminy we flebologii, w terapii czynnościowej i organicznej, przewlekłej niewydolności żylnej kończyn dolnych oraz w proktologii w leczeniu zaostrzenia objawów związanych z obecnością żylaków odbytu. W opublikowanych metaanalizach z badań klinicznych wykazano, że diosmina istotnie ogranicza występowanie objawów związanych z niewydolnością żylną: dyskomfort funkcjonalny, uczucie ciężkości, zmęczenia, ból lub pieczenie nóg, nocne kurcze nóg, parestezje, świąd, obrzęk nóg, zasinienie/zaczerwienienie nóg i poprawia jakość życia pacjentów z niewydolnością żylną kończyn dolnych.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, diosmina wchłania się z przewodu pokarmowego jedynie po zmetabolizowaniu jej przez florę jelitową do aglikonu – diosmetyny. W postaci zarówno niezmetabolizowanej jak i zmetabolizowanej jest wydalana głównie z kałem i moczem. Biologiczny okres półtrwania diosmetyny w osoczu wynosi 31,5 ± 8,6 godzin. Metabolizm diosminy jest znaczny, czego dowodzi obecność różnych kwasów fenolowych w moczu. Diosmina metabolizowana jest także do pochodnych glukuronowych. W ciągu 24 godzin tylko 34% dawki zmikronizowanej diosminy jest wydalane (z moczem i kałem) z organizmu. W ciągu 48 godzin 86% dawki zmikronizowanej diosminy zostaje wydalone z organizmu.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają żadnego szczególnego zagrożenia dla człowieka. Dawki powodujące śmiertelność połowy zwierząt doświadczalnych (LD50) przekraczają maksymalną dobową dawkę diosminy około 180-krotnie. Badania toksyczności podostrej nie wykazały toksyczności diosminy podawanej w dawce 35-krotnie większej od podawanej ludziom. Badania toksyczności długookresowej wykazały, że diosmina podawana myszom i szczurom w dawce odpowiednio 620 mg/kg i 200 mg/kg przez okres 50 dni nie powodowała działania toksycznego. W badaniach na myszach i szczurach nie stwierdzono szkodliwego wpływu dużych dawek diosminy na przebieg ciąży i porodu oraz rozwój płodu.
- CHPL leku Diosminex Max, tabletki powlekane, 1000 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki: Celuloza mikrokrystaliczna Laktoza jednowodna Kroskarmeloza sodowa Krzemionka koloidalna Magnezu stearynian Otoczka (OPADRY II Green 85F21451): Alkohol poliwinylowy Tytanu dwutlenek (E 171) Makrogol 3350 Talk Lak żółcieni chinolinowej (E 104) Lak indygotyny (E 132) Lak żółcieni pomarańczowej (E 110) Żelaza tlenek czarny (E172) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. 6.5 Rodzaj i zawartość opakowania Blistry PVC/Aluminium, w tekturowym pudełku. 30 lub 60 tabletek powlekanych. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Diohespan, tabletki, 1000 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Diohespan, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1000 mg zmikronizowanej diosminy (Diosminum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka Tabletka z kreską dzielącą. Linia podziału na tabletce ułatwia tylko jej rozkruszenie, w celu łatwiejszego połknięcia, a nie podział na równe dawki.
- CHPL leku Diohespan, tabletki, 1000 mgWskazania do stosowania
4.1 Wskazania do stosowania Leczenie objawów przewlekłej niewydolności krążenia żylnego kończyn dolnych takich jak: uczucie ciężkości nóg, ból nóg, nocne kurcze, obrzęki. Leczenie owrzodzeń w przebiegu niewydolności krążenia żylnego kończyn dolnych jako uzupełnienie innych metod terapii. Leczenie objawowe w przypadku nasilenia dolegliwości związanych z żylakami odbytu (hemoroidy).
- CHPL leku Diohespan, tabletki, 1000 mgDawkowanie
4.2 Dawkowanie i sposób podawania Podanie doustne. Przewlekła niewydolność krążenia żylnego kończyn dolnych: 1 tabletka raz na dobę, podczas posiłku. Owrzodzenia w przebiegu niewydolności krążenia żylnego kończyn dolnych: 1 tabletka raz na dobę, podczas posiłku. Zaostrzenie dolegliwości dotyczących żylaków odbytu: 3 tabletki na dobę przez 4 dni, a następnie 2 tabletki na dobę przez kolejne 3 dni, podczas posiłków.
- CHPL leku Diohespan, tabletki, 1000 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Diohespan, tabletki, 1000 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku zaostrzenia dolegliwości związanych z żylakami odbytu, należy pamiętać, że jest to tylko leczenie objawowe i powinno być krótkotrwałe. Jeżeli dolegliwości nie ustępują, należy wykonać badanie proktologiczne i wybrać odpowiednią metodę leczenia.
- CHPL leku Diohespan, tabletki, 1000 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie stwierdzono istotnych klinicznie interakcji z innymi produktami leczniczymi.
- CHPL leku Diohespan, tabletki, 1000 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Badania na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka (płodu) lub przebieg porodu (patrz punkt 5.3). W przypadku zdecydowanej konieczności produkt może zostać przepisany kobiecie w ciąży. Karmienie piersi? Nie należy stosować produktu leczniczego w okresie karmienia piersią z uwagi na brak danych dotyczących przenikania produktu do mleka matki.
- CHPL leku Diohespan, tabletki, 1000 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Diohespan, tabletki, 1000 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane, które mogą wystąpić w czasie stosowania produktu leczniczego, są wymienione poniżej zgodnie z klasyfikacją układów i narządów i częstością występowania. Bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥ 1/1 000 do <1/100), rzadko (≥ 1/10 000 do <1/1 000), bardzo rzadko (<1/10 000). Zaburzenia żołądka i jelit Rzadko: biegunka, niestrawność, nudności, wymioty. Zaburzenia układu nerwowego Rzadko: zawroty głowy, ból głowy, złe samopoczucie. Zaburzenia skóry i tkanki podskórnej Rzadko: Wysypka, świąd, pokrzywka. Zaobserwowane działania niepożądane nie powodują konieczności odstawienia produktu leczniczego.
- CHPL leku Diohespan, tabletki, 1000 mgPrzedawkowanie
4.9 Przedawkowanie Nie odnotowano przypadków wystąpienia zatrucia diosminą z powodu jej przedawkowania. Przedawkowanie może powodować zaburzenia żołądkowo-jelitowe, wymioty i nudności. W przypadku przedawkowania powinno być przeprowadzone klasyczne postępowanie medyczne, tzn. wywołanie wymiotów, płukanie żołądka, podanie węgla aktywnego oraz na dalszym etapie postępowanie objawowe, polegające na zabezpieczeniu podstawowych funkcji życiowych.
- CHPL leku Diohespan, tabletki, 1000 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki ochraniające ścianę naczyń, bioflawonoidy; kod ATC: C 05 CA 03 Diosmina zwiększa napięcie żylne i działa ochronnie na naczynia. Na poziomie naczyń żylnych zmniejsza rozszerzalność żył oraz zastój żylny. Na poziomie mikrokrążenia zmniejsza zaś przepuszczalność włośniczek. Kontrolowane badania z zastosowaniem podwójnie ślepej próby, przeprowadzone w celu zbadania aktywności substancji czynnej na hemodynamikę żylną, potwierdziły jej właściwości farmakologiczne. Statystycznie znamienny związek pomiędzy dawką diosminy, a działaniem terapeutycznym wykazano na podstawie parametrów pletyzmografii żylnej: pojemności żylnej, rozszerzalności żylnej i czasu opróżniania naczynia żylnego. Optymalny efekt terapeutyczny zaobserwowano przy dawce 1000 mg na dobę. Wpływ na napięcie naczyń żylnych: diosmina zwiększa napięcie naczyń żylnych: żylna pletyzmografia okluzyjna wykazała skrócenie czasu opróżniania naczynia żylnego.
- CHPL leku Diohespan, tabletki, 1000 mgWłaściwości farmakodynamiczne
Wpływ na mikrokrążenie: kontrolowane badania z zastosowaniem podwójnie ślepej próby wykazały statystycznie znamienną różnicę pomiędzy efektami terapeutycznymi u pacjentów przyjmujących diosminę i placebo. Produkt leczniczy zwiększa wytrzymałość układu kapilarnego, szczególnie u pacjentów wykazujących podwyższoną kruchość naczyń. Badania przeprowadzone z zastosowaniem podwójnie ślepej próby, kontrolowane za pomocą placebo, wykazały skuteczność terapeutyczną diosminy we flebografii, w terapii czynnościowej i organicznej przewlekłej niewydolności żylnej kończyn dolnych oraz w proktologii w leczeniu żylaków odbytu.
- CHPL leku Diohespan, tabletki, 1000 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, diosmina wchłania się z przewodu pokarmowego i w postaci zmetabolizowanej jest wydalana głównie z kałem i moczem (14%). Biologiczny okres półtrwania wynosi 11 godzin.
- CHPL leku Diohespan, tabletki, 1000 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na myszach i szczurach nie stwierdzono szkodliwego wpływu dużych dawek diosminy na przebieg ciąży i porodu oraz rozwój płodu.
- CHPL leku Diohespan, tabletki, 1000 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Alkohol poliwinylowy Kroskarmeloza sodowa Talk Krzemionka koloidalna bezwodna Stearynian magnezu 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. Przechowywać w oryginalnym opakowaniu. 6.5 Rodzaj i zawartość opakowania Blistry z folii Aluminium/PVC/PVDC w tekturowym pudełku. 30 szt. (3 blistry po 10 szt.) 60 szt. (6 blistrów po 10 szt.) 90 szt. (9 blistrów po 10 szt.) 120 szt. (12 blisterów po 10 szt.) Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO DIH MAX COMFORT, 1000 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana zawiera 1000 mg zmikronizowanej diosminy (Diosminum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana Tabletki powlekane, owalne, obustronnie wypukłe, gładkie, barwy różowej.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgWskazania do stosowania
4.1 Wskazania do stosowania Objawy przewlekłej niewydolności krążenia żylnego kończyn dolnych: bóle i nocne kurcze nóg, uczucie pieczenia nóg, uczucie zimnych nóg, uczucie ciężkości nóg, zmęczenia, dyskomfortu lub niespokojnych nóg, żylaki kończyn dolnych, owrzodzenia żylne, poszerzenia bardzo drobnych naczyń żylnych, tzw. pajączki naczyniowe i żylaki/żyły siatkowate, obrzęki nóg (opuchlizna / puchnięcie nóg), świąd, parestezje (mrowienie), zaczerwienienie (rumień) lub zasinienie skóry. Objawowe leczenie żylaków odbytu. Monoterapia w początkowych stadiach zaawansowania przewlekłej niewydolności żylnej lub jako uzupełnienie innych terapii we wszystkich stopniach zaawansowania przewlekłej choroby żylnej (C0-C6 wg klasyfikacji CEAP).
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Podaje się 1 tabletkę powlekaną na dobę podczas posiłku. Jedynie w przypadkach zaostrzenia dolegliwości spowodowanych żylakami odbytu zaleca się okresowe podawanie większych dawek: po 1 tabletce powlekanej 3 razy na dobę przez 4 dni, a przez kolejne 3 dni po 1 tabletce powlekanej 2 razy na dobę, rano i wieczorem. Sposób podawania Podanie doustne.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadkach zaostrzenia dolegliwości spowodowanych żylakami odbytu zastosowanie dużych dawek produktu leczniczego powinno być krótkotrwałe i jeśli dolegliwości nie przemijają wymagana jest kompleksowa ocena proktologiczna stanu pacjenta. Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu w jednej tabletce, to znaczy lek uznaje się za „wolny od sodu”.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Badania przeprowadzone na zwierzętach nie wykazały działania teratogennego. Nie było doniesień o szkodliwym działaniu diosminy podczas stosowania jej u ludzi. Mimo to nie ma wystarczających danych, aby całkowicie wykluczyć ryzyko, dlatego też produkt leczniczy może być stosowany w czasie ciąży wyłącznie w przypadku zdecydowanej konieczności. Karmienie piersi? Nie wiadomo, czy produkt leczniczy przenika do mleka kobiet karmiących, dlatego zaleca się unikanie karmienia piersią w okresie jego przyjmowania.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy DIH MAX COMFORT nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgDziałania niepożądane
4.8 Działania niepożądane Opisano rzadko występujące przypadki odczynów dermatologicznych (egzema, wysypka, świąd, pokrzywka, łupież różowy) wynikających z nadwrażliwości na diosminę. Po podaniu diosminy (wg dostępnej literatury w mniej niż 2% przypadków) mogą wystąpić zaburzenia żołądka i jelit (bóle żołądka, nudności, niestrawność, wymioty, biegunka lub inne zaburzenia dotyczące przewodu pokarmowego). Notowano także przypadki wystąpienia zaburzeń neurowegetatywnych (bezsenność, trudności w zasypianiu, zawroty i bóle głowy, niepokój), które na ogół nie wymagały przerwania podawania diosminy i przemijały wkrótce po jej odstawieniu. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181 C, 02-222 Warszawa tel. +48 22 49 21 301, fax: + 48 22 49 21 309. Strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgPrzedawkowanie
4.9 Przedawkowanie Nie są znane objawy przedawkowania.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki ochraniające ścianę naczyń, leki wpływające na elastyczność naczyń, bioflawonoidy. Kod ATC: C 05 CA 03 Tabletki powlekane DIH MAX COMFORT zawierają diosminę zaliczaną do flawonów – podgrupy bioflawonoidów. Diosmina jest półsyntetycznym analogiem naturalnego flawonoidu - 7-rutynozydem diosmetyny (7-ramnoglukozyd trójhydroksy-5,7,3’-metoksy-4”-flawonowy). Mechanizm działania Diosmina wpływa na mikrokrążenie i parametry hemoreologiczne krążenia. Wykazuje działanie ochronne wobec naczyń żylnych (dwukrotnie silniejsze od trokserutyny), zmniejsza ich przepuszczalność, zapewnia elastyczność ścian naczyń i zwiększenie ich napięcia (m.in. na skutek przedłużenia skurczu włókien mięśniowych ściany naczyń żylnych w odpowiedzi na noradrenalinę i wzrost wrażliwości miocytów na jony wapniowe). Poprawiając powrót krwi z układu żylnego kończyn dolnych, zmniejsza nadciśnienie i zastój żylny w kończynach.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgWłaściwości farmakodynamiczne
Hamuje patologiczną aktywację i adhezję leukocytów do ścian naczyń włosowatych, zmniejsza nadmierną lepkość krwi. Dzięki hamowaniu wydzielania mediatorów reakcji zapalnej (hamuje syntezę prostaglandyn i działa przeciwutleniająco, zmniejsza stężenie wolnych rodników, ogranicza uwalnianie histaminy, zmniejsza aktywność hialuronidazy i ceruloplazminy), ma właściwości przeciwzapalne. Diosmina zwiększa przepływ w układzie chłonnym, podwyższa ciśnienie onkotyczne limfy. Tak jak inne flawonoidy, jest uznawana za silny inhibitor prostaglandyny E2, F2α i tromboksanu (A2 i lub B2), hamujący aktywację, migrację i adhezję leukocytów oraz aktywację neutrofili.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Diosmina po podaniu doustnym jest metabolizowana w jelitach przez florę bakteryjną do swojego aglikonu - diosmetyny i w tej postaci szybko wchłania się z przewodu pokarmowego. Dystrybucja Tmax dla diosmetyny wynosi ok. 1 h. Okres półtrwania diosmetyny w osoczu krwi (T ½) wynosi średnio 31,5 godziny (24 - 36 h). Metabolizm Metabolitami diosminy są kwasy fenolowe i ich pochodne sprzężone z glicyną. Eliminacja W ciągu pierwszej doby leczenia są one wydalane przez nerki oraz z kałem, a następnie tylko z kałem. Razem z kałem wydalana jest niewchłonięta część dawki diosminy i diosmetyny oraz nieaktywne metabolity diosmetyny, głównie kwasy fenolowe.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak istotnych danych nieklinicznych o znaczeniu klinicznym, nieopisanych w pozostałych punktach Charakterystyki Produktu Leczniczego.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Celuloza mikrokrystaliczna Powidon K 30 Karboksymetyloskrobia sodowa (typ A) Magnezu stearynian Otoczka Opadry II Pink 85F24220 Skład otoczki: Alkohol poliwinylowy, częściowo zhydrolizowany Makrogol/PEG MW 3350, Makrogol 4000 JP Talk Tlenek żelaza czerwony (E 172) Tlenek żelaza żółty (E 172) Tytanu dwutlenek (E 171) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 30 miesięcy 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu, w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry PVC/PVDC/Aluminium, umieszczone w tekturowym pudełku wraz z ulotką dla pacjenta. 30 szt. (3 blistry po 10 szt.) 60 szt. (6 blistrów po 10 szt.) 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku DIH MAX COMFORT, tabletki powlekane, 1000 mgDane farmaceutyczne
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Otrex 600, tabletki, 600 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Otrex 600 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera jako substancję czynną 600 mg diosminy półsyntetycznej (Diosminum) Substancje pomocnicze, patrz: pkt. 6.1 3. POSTAĆ FARMACEUTYCZNA Tabletki, podłużne, szarożółte lub jasnożółte, z rowkiem dzielącym po obu stronach.
- CHPL leku Otrex 600, tabletki, 600 mgWskazania do stosowania
4.1 Wskazania do stosowania Zmniejszanie objawów związanych z niewydolnością krążenia żylnego kończyn dolnych, np: uczucia ciężkości i bólów nóg oraz dolegliwości spowodowanych odleżynami. Leczenie objawowe w przypadku zaostrzenia dolegliwości ze strony żylaków odbytu.
- CHPL leku Otrex 600, tabletki, 600 mgDawkowanie
4.2 Dawkowanie i sposób podawania Sposób podawania: Doustnie. Dawkowanie: - Niewydolność krążenia żylnego: 1 tabletka na dobę, rano, na czczo. - Zaostrzenie dolegliwości ze strony żylaków odbytu: od 2 do 3 tabletek na dobę w trakcie posiłków. Dzieci: Bezpieczeństwo stosowania i skuteczność produktu u dzieci nie zostały ustalone.
- CHPL leku Otrex 600, tabletki, 600 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą.
- CHPL leku Otrex 600, tabletki, 600 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku zaostrzenia dolegliwości związanych z żylakami odbytu, podawanie diosminy nie wyklucza leczenia stosowanego w innych chorobach odbytu. Leczenie powinno być krótkotrwałe – do 15 dni. Jeżeli w trakcie leczenia diosminą dolegliwości związane z żylakami odbytu nie ustępują lub się nasilają, należy wykonać badanie proktologiczne i zastosować odpowiednie leczenie.
- CHPL leku Otrex 600, tabletki, 600 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nieznane.
- CHPL leku Otrex 600, tabletki, 600 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża: Brak wystarczających danych dotyczących stosowania diosminy u kobiet w ciąży. Badania doświadczalne na zwierzętach nie wykazały, aby produkt wywierał działanie teratogenne. W dotychczasowych obserwacjach stosowania diosminy u ludzi nie stwierdzono jakichkolwiek działań teratogennych ani toksycznego działania na płód. Jednak brak wystarczających danych, żeby całkowicie wykluczyć ryzyko. W związku z tym produkt może być stosowany w okresie ciąży, jedynie gdy jest to konieczne. Laktacja: Ze względu na brak danych na temat przenikania diosminy do mleka kobiecego, stosowanie produktu w okresie karmienia piersią jest niewskazane.
- CHPL leku Otrex 600, tabletki, 600 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt nie ma wpływu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu.
- CHPL leku Otrex 600, tabletki, 600 mgDziałania niepożądane
4.8 Działania niepożądane W kilku przypadkach opisano działania niepożądane ze strony przewodu pokarmowego (nudności, wymioty), które spowodowały konieczność zaprzestania podawania produktu.
- CHPL leku Otrex 600, tabletki, 600 mgPrzedawkowanie
4.9 Przedawkowanie Nie zgłoszono żadnego przypadku przedawkowania. Objawy przedawkowania nie są znane.
- CHPL leku Otrex 600, tabletki, 600 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: produkty ochraniające ścianę naczyń, kod ATC: C 05 CA 03 Diosmina zwiększa napięcie ściany naczyń żylnych, normalizuje przepuszczalność naczyń, działa ochronnie na ścianę naczyń. Badania prowadzone na zwierzętach oraz badania kliniczne wykazały następujące właściwości produktu: U zwierząt: Wpływ diosminy na napięcie ściany naczyń żylnych: - u psów poddanych znieczuleniu ogólnemu po dożylnym podaniu diosminy obserwowano podwyższenie ciśnienia żylnego. Właściwości ochronne diosminy na ścianę naczyń: - u szczurów obserwowano normalizację przepuszczalności naczyń włosowatych, działanie przeciwobrzękowe i przeciwzapalne; - u szczurów i świnek morskich z niedoborem witaminy P obserwowano zwiększenie oporu włośniczkowego; - u świnek morskich z niedoborem witaminy P obserwowano skrócenie czasu krwawienia; - obserwowano również zmniejszenie przepuszczalności naczyń włosowatych wywołane wcześniejszym podaniem chloroformu, histaminy lub hialuronidazy oraz poprawę odkształcalności erytrocytów mierzoną czasem filtracji erytrocytów.
- CHPL leku Otrex 600, tabletki, 600 mgWłaściwości farmakodynamiczne
U ludzi: Wpływ diosminy na napięcie ściany naczyń żylnych: - zwiększanie właściwości naczyniozwężających adrenaliny, noradrenaliny i serotoniny w żyłach powierzchownych ręki i w izolowanej żyle odpiszczelowej; - zwiększanie napięcia ściany naczyń żylnych wykazane metodą pletyzmografii tensometrycznej oraz zmniejszanie zastoju żylnego; wpływ obkurczający na naczynia żylne był proporcjonalny do podanej dawki diosminy; - zmniejszanie średniego ciśnienia żylnego zarówno w naczyniach powierzchownych jak i głębokich (potwierdzono to za pomocą pomiaru dopplerowskiego w badaniu z podwójnie ślepą próbą kontrolowanym placebo); - zwiększanie skurczowego i rozkurczowego ciśnienia tętniczego krwi u osób z pooperacyjnym niedociśnieniem ortostatycznym; - przeciwdziałanie powikłaniom po usunięciu żyły odpiszczelowej. Ochronne działanie diosminy na ścianę naczyń: - zwiększanie oporności naczyń włosowatych w stopniu proporcjonalnym do wielkości podanej dawki.
- CHPL leku Otrex 600, tabletki, 600 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Badania farmakokinetyki przeprowadzono na zwierzętach z użyciem diosminy znakowanej węglem radioaktywnym C 14 . W badaniach wykazano, że: - od drugiej godziny po podaniu produktu rozpoczynała się faza szybkiego wchłaniania, a maksymalne natężenie radioaktywności uzyskano w piątej godzinie; - dystrybucja produktu w organizmie była słaba, z wyjątkiem nerek, wątroby, płuc oraz ścian naczyń żylnych, w tym żył głównych i żył odpiszczelowych. W tych strukturach obserwowano większą radioaktywność niż w pozostałych badanych narządach i tkankach. Zwiększony wychwyt diosmetyny i (lub) jej metabolitów w naczyniach żylnych narastał do dziewiątej godziny od podania produktu i utrzymywał się przez 96 godzin; - eliminacja produktu z organizmu następowała głównie z moczem (79%), a także z kałem (11%) i z żółcią (2,4%).
- CHPL leku Otrex 600, tabletki, 600 mgWłaściwości farmakokinetyczne
W kale stwierdzono obecność niezmienionej diosminy, diosmetyny i innych metabolitów zawierających radioaktywny C 14 , co wskazuje na złożony mechanizm wchłaniania i wydalania produktu w przewodzie pokarmowym (krążenie wątrobowo-jelitowe diosminy i jej metabolitów). Z moczem wydalane są metabolity diosminy, nie stwierdzono obecności niezmienionej diosminy. Powyższe wyniki wskazują na dobre wchłanianie produktu po podaniu doustnym, mierzone wielkością radioaktywności C 14 , oraz na znaczące powinowactwo produktu do naczyń żylnych.
- CHPL leku Otrex 600, tabletki, 600 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane przedkliniczne uwzględniające wyniki konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, badań toksyczności po podaniu wielokrotnym, genotoksyczności, możliwego działania rakotwórczego i toksycznego wpływu na rozród, nie ujawniają szczególnego zagrożenia dla człowieka. Toksyczność diosminy jest bardzo mała. LD 50 diosminy u myszy po doustnym podaniu jednorazowej dawki jest większe niż 10 g/kg mc., a u szczurów LD 50 jest większe niż 5 g/kg mc. Badania przewlekłej toksyczności prowadzone na myszach i świnkach morskich wykazały brak wpływu dawek w zakresie 50 - 620 mg/kg mc./dobę podawanych przez okres 6 miesięcy na parametry biologiczne, hematologiczne i parametry funkcji nerek.
- CHPL leku Otrex 600, tabletki, 600 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Skrobia kukurydziana, celuloza mikrokrystaliczna, powidon, magnezu stearynian. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. 6.5 Rodzaj i zawartość opakowania Opakowanie zawierające 30 tabletek; 2 blistry z folii PVC/Al po 15 tabletek, w tekturowym pudełku Opakowanie zawierające 15 sztuk; 1 blister z folii PVC/Al po 15 tabletek, w tekturowym pudełku 6.6 Specjalne środki ostrożności dotyczące usuwania Brak szczególnych wymagań.
- CHPL leku Fladios, tabletki powlekane, 500 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Fladios, 500 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 500 mg diosminy w postaci zmikronizowanej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana Brunatnawożółte obustronnie wypukłe tabletki w kształcie kapsułki. Wymiary tabletek są określone przez dziurkowane kształtowniki o średnicy 16,0 mm × 8,5 mm.
- CHPL leku Fladios, tabletki powlekane, 500 mgWskazania do stosowania
4.1 Wskazania do stosowania Fladios jest wskazany do stosowania u osób dorosłych w leczeniu: objawów przedmiotowych i podmiotowych przewlekłej niewydolności krążenia żylnego, takich jak ból, uczucie ciężkości nóg, zmęczenie nóg, zespół niespokojnych nóg, kurcze nocne nóg, obrzęki nóg i zmiany troficzne. objawów w przypadku nasilenia dolegliwości związanych z żylakami odbytu (hemoroidy).
- CHPL leku Fladios, tabletki powlekane, 500 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Przewlekła niewydolność krążenia żylnego kończyn dolnych: Zazwyczaj 2 tabletki na dobę, przyjmowane jako dawka pojedyncza lub w dwóch dawkach podzielonych. Leczenie powinno trwać co najmniej 4 do 5 tygodni. Zaostrzenie dolegliwości dotyczących żylaków odbytu: 6 tabletek na dobę przez 4 pierwsze dni (przyjmowane po 3 tabletki dwa razy na dobę), a następnie 4 tabletki na dobę przez kolejne 3 dni (przyjmowane po 2 tabletki dwa razy na dobę). Zalecana dobowa dawka to 2 tabletki w leczeniu podtrzymującym (przyjmowane po 1 tabletce dwa razy na dobę). W tym wskazaniu produkt leczniczy Fladios przeznaczony jest tylko w leczeniu krótkotrwałym (patrz punkt 4.4). Dzieci i młodzież: Z powodu braku danych produktu Fladios nie należy stosować u dzieci i młodzieży. Szczególne grupy pacjentów: Nie przeprowadzono badań dotyczących dawkowania u pacjentów z zaburzeniami czynności nerek i (lub) wątroby lub u osób w podeszłym wieku.
- CHPL leku Fladios, tabletki powlekane, 500 mgDawkowanie
Na podstawie dostępnych danych nie stwierdzono szczególnego ryzyka w tych grupach pacjentów. Sposób podawania Podanie doustne. Tabletki należy przyjmować z posiłkiem.
- CHPL leku Fladios, tabletki powlekane, 500 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Fladios, tabletki powlekane, 500 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku zaostrzenia dolegliwości związanych z żylakami odbytu, należy pamiętać, że leczenie produktem leczniczym Fladios nie zastępuje leczenia innych chorób odbytu. Leczenie powinno być tylko krótkotrwałe. Jeżeli dolegliwości nie ustępują, należy wykonać badanie proktologiczne i wybrać odpowiednią metodę leczenia. U pacjentów z przewlekłą chorobą żylną leczenie jest najbardziej korzystne, gdy towarzyszy mu odpowiedni tryb życia: należy unikać ekspozycji słonecznej i przebywania w pozycji stojącej przez dłuższy czas; należy utrzymać odpowiednią wagę; noszenie specjalnych pończoch uciskowych może poprawić krążenie u niektórych pacjentów. Szczególną ostrożność zaleca się w przypadku pogorszenia się stanu pacjenta w trakcie leczenia. Może się to objawiać jako stan zapalny skóry, zapalenie żył, stwardnienie podskórne, silny ból, wrzody podskórne lub nietypowe objawy np. gwałtowny obrzęk jednej lub obu nóg.
- CHPL leku Fladios, tabletki powlekane, 500 mgSpecjalne środki ostrozności
Fladios nie jest skuteczny w zmniejszaniu obrzęku kończyn dolnych spowodowanego chorobą serca, wątroby lub nerek. Sód: Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na jedną dawkę, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Fladios, tabletki powlekane, 500 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji produktu leczniczego. Nie stwierdzono istotnych klinicznie interakcji diosminy z innymi produktami leczniczymi po wprowadzeniu do obrotu.
- CHPL leku Fladios, tabletki powlekane, 500 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Badania na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka (płodu) lub przebieg porodu (patrz punkt 5.3). Należy zachować ostrożność, stosując ten produkt u kobiet w ciąży. Karmienie piersi? Brak danych dotyczących przenikania diosminy do mleka matki. Dlatego nie należy stosować produktu leczniczego w okresie karmienia piersią. Płodność Badania toksycznego wpływu na reprodukcję nie wykazały wpływu na płodność u samców i samic szczurów (patrz punkt 5.3).
- CHPL leku Fladios, tabletki powlekane, 500 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie przeprowadzono badań dotyczących wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn. Jednakże, w oparciu o ogólny profil bezpieczeństwa, diosmina nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Fladios, tabletki powlekane, 500 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Większość działań niepożądanych zgłaszanych w badaniach klinicznych z diosminą była łagodna i przemijająca. Były one związane głównie z zaburzeniami żołądkowo-jelitowymi (biegunka, niestrawność, nudności, wymioty). Tabelaryczny wykazu działań niepożądanych Często (≥1/100 do <1/10) Niezbyt często (≥1/1 000 do <1/100) Rzadko (≥1/10 000 do <1/1 000) Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) Zaburzenia układu nerwowego Ból głowy, złe samopoczucie, zawroty głowy Zaburzenia żołądka i jelit Biegunka, niestrawność, nudności, wymioty Zapalenie okrężnicy Ból brzucha Zaburzenia skóry i tkanki podskórnej Wysypka, świąd, pokrzywka Obrzęk twarzy, warg i powiek Obrzęk naczynioruchowy (wyjątkowo) Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Fladios, tabletki powlekane, 500 mgDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem: Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181 C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Fladios, tabletki powlekane, 500 mgPrzedawkowanie
4.9 Przedawkowanie Nie odnotowano przypadków przedawkowania.
- CHPL leku Fladios, tabletki powlekane, 500 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki działające ochronnie na naczynia, bioflawonoidy; kod ATC: C05CA03. Mechanizm działania Działanie na żyły Diosmina zmniejsza rozszerzalność żył oraz zastój żylny. Działanie na mikrokrążenie Diosmina zmniejsza przepuszczalność naczyń włosowatych i zwiększa ich opór. Działanie przeciwzapalne wpływa również na syntezę prostaglandyn. Działanie farmakodynamiczne Kontrolowane badania u ludzi z zastosowaniem podwójnie ślepej próby przeprowadzone w celu zbadania aktywności diosminy na hemodynamikę żylną potwierdziły jej właściwości farmakologiczne. Wpływ na napięcie żylne Diosmina poprawia napięcie żylne, a tym samym zmniejsza pojemność i rozszerzalność żył oraz zastój żylny: wyniki żylnej pletyzmografii okluzyjnej wskazują na skrócenie czasu opróżniania naczynia żylnego. Efektem końcowym jest zmniejszenie nadciśnienia żylnego u chorych na choroby żylne.
- CHPL leku Fladios, tabletki powlekane, 500 mgWłaściwości farmakodynamiczne
Wpływ na układ limfatyczny Diosmina pobudza aktywność limfatyczną, poprawia drenaż przestrzeni międzypłaszczowej i zwiększa przepływ limfatyczny. Podawanie 1000 mg diosminy na dobę zmniejsza średnicę naczyń limfatycznych i ciśnienie wewnątrzczaszkowe, poprawiając liczbę funkcjonujących naczyń włosowatych, u pacjentów z ciężką przewlekłą niewydolnością żylną bez owrzodzeń. Wpływ na mikrokrążenie Kontrolowane, podwójnie ślepe badania kliniczne wykazały statystycznie istotną różnicę między diosminą a placebo. U pacjentów wykazujących podwyższoną kruchość naczyń, leczenie diosminą zwiększa oporność naczyń kapilarnych i zmniejsza objawy kliniczne. Obserwowano również spadek przepuszczalności naczyń krwionośnych po podaniu 1000 mg diosminy na dobę, w odniesieniu do placebo, z użyciem albuminy znakowanej technetem lub żylnej pletyzmografii.
- CHPL leku Fladios, tabletki powlekane, 500 mgWłaściwości farmakodynamiczne
Skuteczność kliniczna i bezpieczeństwo stosowania Badania przeprowadzone z zastosowaniem podwójnie ślepej próby, wykazały skuteczność terapeutyczną diosminy w leczeniu przewlekłej niewydolności żylnej kończyn dolnych oraz w leczeniu ostrej choroby hemoroidalnej.
- CHPL leku Fladios, tabletki powlekane, 500 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Po podaniu doustnym diosminy jest ona szybko hydrolizowana w jelitach przez florę jelitową i wchłaniana jako jej forma aglikonowa diosmetyna. Doustna biodostępność mikronizowanej diosminy wynosi około 60%. Dystrybucja Objętość dystrybucji diosmetyny wynosi 62,1 l, co wskazuje na jej szeroki rozkład w tkankach. Metabolizm Diosmetin jest w znacznym stopniu metabolizowany do kwasów fenolowych lub ich koniugatów glicynowych, które są eliminowane w moczu. Przeważającym metabolitem u człowieka znalezionym w moczu jest kwas m-hydroksyfenylopropionowy, który jest głównie eliminowany w postaci sprzężonej. Metabolity znalezione w mniejszych ilościach obejmują kwasy fenolowe odpowiadające kwasowi 3-hydroksy-4-metoksybenzoesowego i kwas 3-metoksy-4-hydroksyfenylooctowy.
- CHPL leku Fladios, tabletki powlekane, 500 mgWłaściwości farmakokinetyczne
Eliminacja Eliminacja mikronizowanej diosminy jest stosunkowo szybka, z około 34% wyznakowanej radioaktywnie dawki 14C-diosminy wydalanej z moczem i kałem w ciągu pierwszych 24 godzin a około 86% w ciągu pierwszych 48 godzin. Około połowa dawki jest eliminowana z kałem w postaci niezmienionej diosminy lub diosmetyny, podczas gdy te dwa związki nie są wydalane z moczem. Okres półtrwania w fazie eliminacji diosmetyny wynosił średnio 31,5 godziny, w zakresie od 26 do 43 godzin.
- CHPL leku Fladios, tabletki powlekane, 500 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne nie wykazują szczególnego zagrożenia dla ludzi w oparciu o badania toksyczności dawki wielokrotnej, genotoksyczności, potencjalnego działania rakotwórczego i toksycznego wpływu na rozród i rozwój potomstwa.
- CHPL leku Fladios, tabletki powlekane, 500 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń: Celuloza mikrokrystaliczna Alkohol poliwinylowy Karboksymetyloskrobia sodowa (typ A) Talk Magnezu stearynian Otoczka tabletki: Alkohol poliwinylowy Tytanu dwutlenek Makrogol 3000 Talk Żelaza tlenek żółty (E 172) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25ºC. Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Blister z folii PVC/PVDC/Aluminium. Wielkość opakowań: 15, 30, 60, 90, 120, 150 lub 180 tabletek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Brak szczególnych wymagań.
- CHPL leku Fladios, tabletki, 1000 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Fladios, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 1000 mg diosminy w postaci zmikronizowanej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka Jasnozielonkawe lub szarawożółte do jasnozielonkawch lub szarawobrunatne, obustronnie lekko owalne marmurkowe tabletki. Wymiary tabletek są określone przez dziurkowane kształtowniki o średnicy 18,0 mm × 9,0 mm.
- CHPL leku Fladios, tabletki, 1000 mgWskazania do stosowania
4.1 Wskazania do stosowania Fladios jest wskazany do stosowania u osób dorosłych w leczeniu: objawów przedmiotowych i podmiotowych przewlekłej niewydolności krążenia żylnego, takich jak ból, uczucie ciężkości nóg, zmęczenie nóg, zespół niespokojnych nóg, kurcze nocne nóg, obrzęki i zmiany troficzne. objawów w przypadku nasilenia dolegliwości związanych z żylakami odbytu (hemoroidy).
- CHPL leku Fladios, tabletki, 1000 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Przewlekła niewydolność krążenia żylnego kończyn dolnych: Zazwyczaj 1 tabletka raz na dobę. Leczenie powinno trwać co najmniej 4 do 5 tygodni. Zaostrzenie dolegliwości dotyczących żylaków odbytu: 3 tabletki na dobę przez pierwsze 4 dni, a następnie 2 tabletki na dobę przez kolejne 3 dni. Zalecana dobowa dawka to 1 tabletka w leczeniu podtrzymującym. W tym wskazaniu produkt leczniczy Fladios przeznaczony jest tylko w leczeniu krótkotrwałym (patrz punkt 4.4). Dzieci i młodzież Z powodu braku danych produktu Fladios nie należy stosować u dzieci i młodzieży. Szczególne grupy pacjentów Nie przeprowadzono badań dotyczących dawkowania u pacjentów z zaburzeniami czynności nerek i (lub) wątroby lub u osób w podeszłym wieku. Na podstawie dostępnych danych nie stwierdzono szczególnego ryzyka w tych grupach pacjentów. Sposób podawania Podanie doustne. Tabletki należy przyjmować z posiłkiem.
- CHPL leku Fladios, tabletki, 1000 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Fladios, tabletki, 1000 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku zaostrzenia dolegliwości związanych z żylakami odbytu, należy pamiętać, że leczenie produktem leczniczym Fladios nie zastępuje leczenia innych chorób odbytu. Leczenie powinno być tylko krótkotrwałe. Jeżeli dolegliwości nie ustępują, należy wykonać badanie proktologiczne i wybrać odpowiednią metodę leczenia. U pacjentów z przewlekłą chorobą żylną leczenie jest najbardziej korzystne, gdy towarzyszy mu odpowiedni tryb życia: należy unikać ekspozycji słonecznej i przebywania w pozycji stojącej przez dłuższy czas; należy utrzymać odpowiednią wagę; noszenie specjalnych pończoch uciskowych może poprawić krążenie u niektórych pacjentów. Szczególną ostrożność zaleca się w przypadku pogorszenia się stanu pacjenta w trakcie leczenia. Może się to objawiać, jako stan zapalny skóry, zapalenie żył, stwardnienie podskórne, silny ból, wrzody podskórne lub nietypowe objawy, np.
- CHPL leku Fladios, tabletki, 1000 mgSpecjalne środki ostrozności
gwałtowny obrzęk jednej lub obu nóg. Fladios nie jest skuteczny w zmniejszaniu obrzęku kończyn dolnych spowodowanego chorobą serca, wątroby lub nerek. Sód: Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na jedną dawkę, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Fladios, tabletki, 1000 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji produktu leczniczego. Nie stwierdzono istotnych klinicznie interakcji diosminy z innymi produktami leczniczymi po wprowadzeniu do obrotu.
- CHPL leku Fladios, tabletki, 1000 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Badania na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka (płodu) lub przebieg porodu (patrz punkt 5.3). Należy zachować ostrożność, stosując ten produkt u kobiet w ciąży. Karmienie piersi? Brak danych dotyczących przenikania diosminy do mleka matki. Dlatego nie należy stosować produktu leczniczego w okresie karmienia piersią. Płodność Badania toksycznego wpływu na reprodukcję nie wykazały wpływu na płodność u samców i samic szczurów (patrz punkt 5.3).
- CHPL leku Fladios, tabletki, 1000 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie przeprowadzono badań dotyczących wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn. Jednakże, w oparciu o ogólny profil bezpieczeństwa, diosmina nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Fladios, tabletki, 1000 mgDziałania niepożądane
4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Większość działań niepożądanych zgłaszanych w badaniach klinicznych z diosminą była łagodna i przemijająca. Były one związane głównie z zaburzeniami żołądkowo-jelitowymi (biegunka, niestrawność, nudności, wymioty). Tabelaryczny wykazu działań niepożądanych Często (≥1/100 do <1/10) Niezbyt często (≥1/1 000 do <1/100) Rzadko (≥1/10 000 do <1/1 000) Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) Zaburzenia układu nerwowego Ból głowy, złe samopoczucie, zawroty głowy Zaburzenia żołądka i jelit Biegunka, niestrawność, nudności, wymioty Zapalenie okrężnicy Ból brzucha Zaburzenia skóry i tkanki podskórnej Wysypka, świąd, pokrzywka Obrzęk twarzy, warg i powiek Obrzęk naczynioruchowy (wyjątkowo) Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Fladios, tabletki, 1000 mgDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem: Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181 C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Fladios, tabletki, 1000 mgPrzedawkowanie
4.9 Przedawkowanie Nie odnotowano przypadków przedawkowania.
- CHPL leku Fladios, tabletki, 1000 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki działające ochronnie na naczynia, bioflawonoidy; kod ATC: C05CA03. Mechanizm działania Działanie na żyły Diosmina zmniejsza rozszerzalność żył oraz zastój żylny. Działanie na mikrokrążenie Diosmina zmniejsza przepuszczalność naczyń włosowatych i zwiększa ich opór. Działanie przeciwzapalne wpływa również na syntezę prostaglandyn. Działanie farmakodynamiczne Kontrolowane badania u ludzi z zastosowaniem podwójnie ślepej próby przeprowadzone w celu zbadania aktywności diosminy na hemodynamikę żylną potwierdziły jej właściwości farmakologiczne. Wpływ na napięcie żylne Diosmina poprawia napięcie żylne, a tym samym zmniejsza pojemność i rozszerzalność żył oraz zastój żylny: wyniki żylnej pletyzmografii okluzyjnej wskazują na skrócenie czasu opróżniania naczynia żylnego. Efektem końcowym jest zmniejszenie nadciśnienia żylnego u chorych na choroby żylne.
- CHPL leku Fladios, tabletki, 1000 mgWłaściwości farmakodynamiczne
Wpływ na układ limfatyczny Diosmina pobudza aktywność limfatyczną, poprawia drenaż przestrzeni międzypłaszczowej i zwiększa przepływ limfatyczny. Podawanie 1000 mg diosminy na dobę zmniejsza średnicę naczyń limfatycznych i ciśnienie wewnątrzczaszkowe, poprawiając liczbę funkcjonujących naczyń włosowatych, u pacjentów z ciężką przewlekłą niewydolnością żylną bez owrzodzeń. Wpływ na mikrokrążenie Kontrolowane, podwójnie ślepe badania kliniczne wykazały statystycznie istotną różnicę między diosminą a placebo. U pacjentów wykazujących podwyższoną kruchość naczyń, leczenie diosminą zwiększa oporność naczyń kapilarnych i zmniejsza objawy kliniczne. Obserwowano również spadek przepuszczalności naczyń krwionośnych po podaniu 1000 mg diosminy na dobę, w odniesieniu do placebo, z użyciem albuminy znakowanej technetem lub żylnej pletyzmografii.
- CHPL leku Fladios, tabletki, 1000 mgWłaściwości farmakodynamiczne
Skuteczność kliniczna i bezpieczeństwo stosowania Badania przeprowadzone z zastosowaniem podwójnie ślepej próby, wykazały skuteczność terapeutyczną diosminy w leczeniu przewlekłej niewydolności żylnej kończyn dolnych oraz w leczeniu ostrej choroby hemoroidalnej.
- CHPL leku Fladios, tabletki, 1000 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Po podaniu doustnym diosminy jest ona szybko hydrolizowana w jelitach przez florę jelitową i wchłaniana jako jej forma aglikonowa diosmetyna. Doustna biodostępność mikronizowanej diosminy wynosi około 60%. Dystrybucja Objętość dystrybucji diosmetyny wynosi 62,1 l, co wskazuje na jej szeroki rozkład w tkankach. Metabolizm Diosmetin jest w znacznym stopniu metabolizowany do kwasów fenolowych lub ich koniugatów glicynowych, które są eliminowane w moczu. Przeważającym metabolitem u człowieka znalezionym w moczu jest kwas m-hydroksyfenylopropionowy, który jest głównie eliminowany w postaci sprzężonej. Metabolity znalezione w mniejszych ilościach obejmują kwasy fenolowe odpowiadające kwasowi 3-hydroksy-4-metoksybenzoesowego i kwas 3-metoksy-4-hydroksyfenylooctowy.
- CHPL leku Fladios, tabletki, 1000 mgWłaściwości farmakokinetyczne
Eliminacja Eliminacja mikronizowanej diosminy jest stosunkowo szybka, z około 34% wyznakowanej radioaktywnie dawki 14C-diosminy wydalanej z moczem i kałem w ciągu pierwszych 24 godzin a około 86% w ciągu pierwszych 48 godzin. Około połowa dawki jest eliminowana z kałem w postaci niezmienionej diosminy lub diosmetyny, podczas gdy te dwa związki nie są wydalane z moczem. Okres półtrwania w fazie eliminacji diosmetyny wynosił średnio 31,5 godziny, w zakresie od 26 do 43 godzin.
- CHPL leku Fladios, tabletki, 1000 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne nie wykazują szczególnego zagrożenia dla ludzi w oparciu o badania toksyczności dawki wielokrotnej, genotoksyczności, potencjalnego działania rakotwórczego i toksycznego wpływu na rozród i rozwój potomstwa.
- CHPL leku Fladios, tabletki, 1000 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Alkohol poliwinylowy Kroskarmeloza sodowa Magnezu stearynian 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25ºC. Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Blister z folii PVC/PVDC/Aluminium. Wielkość opakowań: Blister: 20, 30, 60, 90 lub 120 tabletek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Brak szczególnych wymagań.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Diosmina Colfarm Max, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1000 mg zmikronizowanej diosminy (Diosminum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka. Podłużna, obustronnie wypukła, beżowego koloru, z linią podziału. Linia podziału na tabletce ułatwia tylko jej rozkruszenie, w celu łatwiejszego połknięcia, a nie podział na równe dawki.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgWskazania do stosowania
4.1 Wskazania do stosowania Leczenie objawów związanych z przewlekłą niewydolnością krążenia żylnego i limfatycznego kończyn dolnych: uczucie ciężkości nóg; ból nóg; nocne kurcze nóg; pajączki naczyniowe, tj. teleangiektazje spowodowane przez rozszerzenie i rozgałęzienie powierzchownych skórnych naczyń krwionośnych. Leczenie objawowe w przypadku nasilenia dolegliwości związanych z żylakami odbytu.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zwykle zalecana dawka to 1 tabletka raz na dobę podczas posiłku. W przypadku zaostrzenia dolegliwości związanych z żylakami odbytu dawka wynosi 1 tabletka trzy razy na dobę przez 4 dni, a następnie przez kolejne 3 dni 1 tabletka dwa razy na dobę, podczas posiłków. Droga podania Podanie doustne.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku nasilenia dolegliwości związanych z żylakami odbytu, należy pamiętać, że terapia produktem leczniczym Diosmina Colfarm Max jest tylko objawowa i powinna być krótkotrwała. Jeżeli dolegliwości nie ustępują, należy wykonać badanie proktologiczne i wybrać odpowiednią metodę leczenia. Stosowanie produktu leczniczego Diosmina Colfarm Max w leczeniu objawowym w przypadku zaostrzenia dolegliwości związanych z żylakami odbytu nie wyklucza podawania innych leków doodbytniczo. W przypadku zaburzeń krążenia żylnego w kończynach dolnych, działanie terapeutyczne produktu leczniczego Diosmina Colfarm Max można zwiększyć poprzez odpowiedni tryb życia: unikanie ekspozycji słonecznej, unikanie przebywania w pozycji stojącej przez dłuższy czas, utrzymanie odpowiedniej masy ciała, noszenie specjalnych pończoch. Lek zawiera mniej niż 1 mmol (23 mg) sodu w każdej tabletce, tzn. lek uznaje się za „wolny od sodu”.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Diosmina zmienia profil farmakokinetyczny metronidazolu podwyższając jego maksymalne stężenie w osoczu i wydłużając czas jego eliminacji. Diosmina może zwiększać także czas eliminacji i maksymalne stężenie w osoczu diklofenaku. Diosmina hamuje agregację płytek krwi. Mechanizm ten może mieć wpływ na skumulowanie się działań niepożądanych u pacjentów przyjmujących leki przeciwzakrzepowe.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie zaleca się stosowania produktu leczniczego Diosmina Colfarm Max w okresie ciąży, ze względu na brak wystarczających danych wykluczających ryzyko stosowania u kobiet w ciąży. Badania przeprowadzone na zwierzętach nie wykazały działania teratogennego diosminy, nie odnotowano takiego działania również u człowieka. (patrz punkt 5.3). Karmienie piersi? Nie zaleca się stosowania produktu leczniczego Diosmina Colfarm Max w okresie karmienia piersią z uwagi na brak danych dotyczących przenikania produktu do mleka kobiet karmiących. Płodność Niedostępne są informacje wskazujące na możliwość wpływu diosminy na płodność.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Diosmina Colfarm Max nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane zostały opisane z uwzględnieniem częstości występowania zgodnie z poniższą konwencją: Bardzo często (≥1/10), często (≥1/100, <1/10), niezbyt często (≥ 1/1 000, <1/100), rzadko (≥ 1/10 000, <1/1 000), bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia żołądka i jelit Rzadko: biegunka, niestrawność, nudności, wymioty. Zaburzenia układu nerwowego Rzadko: zawroty głowy, ból głowy, złe samopoczucie. Zaburzenia psychiczne Częstość nieznana: bezsenność, wzmożony niepokój. Zaburzenia skóry i tkanki podskórnej Rzadko: wysypka, świąd, pokrzywka. Objawy skórne najczęściej towarzyszą nadwrażliwości. W przypadku łagodnych działań niepożądanych, dotyczących żołądka i jelit, oraz zaburzeń neurowegetatywnych nie jest wymagane odstawienie produktu leczniczego.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309; strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgPrzedawkowanie
4.9 Przedawkowanie Nie odnotowano żadnego przypadku przedawkowania.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki działające ochronnie na naczynia. Leki stabilizujące naczynia włosowate. Bioflawonoidy. Kod ATC: C05CA03 Mechanizm działania Diosmina wpływa na mikrokrążenie i parametry hemoreologiczne krążenia. Wykazuje działanie ochronne wobec naczyń żylnych, zmniejsza ich przepuszczalność, zapewnia elastyczność ścian naczyń i zwiększenie ich napięcia. Poprawiając powrót krwi z układu żylnego kończyn dolnych, zmniejsza nadciśnienie i zastój żylny w kończynach. Hamuje patologiczną aktywację i adhezję leukocytów do ścian naczyń włosowatych, zmniejsza nadmierną lepkość krwi. Dzięki hamowaniu wydzielania mediatorów reakcji zapalnej (hamuje syntezę prostaglandyn i działa przeciwutleniająco, zmniejsza stężenie wolnych rodników, ogranicza uwalnianie histaminy, zmniejsza aktywność hialuronidazy i ceruloplazminy) ma właściwości przeciwzapalne.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Diosmina po podaniu doustnym jest metabolizowana w jelitach przez florę bakteryjną do swojego aglikonu - diosmetyny i w tej postaci szybko wchłania się z przewodu pokarmowego. Dystrybucja Tmax dla diosmetyny wynosi około 1 h. Okres półtrwania diosmetyny w osoczu krwi (T½) wynosi średnio 31,5 godziny (24 - 36 h). Metabolizm Metabolitami diosminy są kwasy fenolowe i ich pochodne sprzężone z glicyną. Eliminacja W ciągu pierwszej doby leczenia są one wydalane przez nerki oraz z kałem, a następnie tylko z kałem. Razem z kałem wydalana jest niewchłonięta część dawki diosminy i diosmetyny oraz nieaktywne metabolity diosmetyny, głównie kwasy fenolowe.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają żadnego szczególnego zagrożenia dla człowieka.
- CHPL leku Diosmina Colfarm Max, tabletki, 1000 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Alkohol poliwinylowy Kroskarmeloza sodowa Magnezu stearynian 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. 6.5 Rodzaj i zawartość opakowania Blistry PVC/PVDC/Aluminium. 30, 60 lub 90 tabletek, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Diosminex, tabletki powlekane, 500 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Diosminex, 500 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 500 mg diosminy (Diosminum) w postaci zmikronizowanej. Substancje pomocnicze o znanym działaniu: 1 tabletka powlekana produktu leczniczego Diosminex zawiera 40 mg laktozy jednowodnej. Produkt leczniczy Diosminex zawiera żółcieni pomarańczowej, lak (E 110). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana. Tabletki powlekane są zielone, podłużne, obustronnie wypukłe o gładkiej powierzchni, bez plam i uszkodzeń.
- CHPL leku Diosminex, tabletki powlekane, 500 mgWskazania do stosowania
4.1 Wskazania do stosowania Diosminex jest wskazany w leczeniu objawów przewlekłej niewydolności żylnej u osób dorosłych, jak: żylaki kończyn dolnych owrzodzenia żylne teleangiektazje i żylaki/żyły siatkowate uczucie ciężkości, zmęczenia, dyskomfortu lub niespokojnych nóg ból lub uczucie pieczenia nóg uczucie zimnych nóg nocne skurcze nóg obrzęki kończyn dolnych świąd, parestezje (mrowienie) zaczerwienienie (rumień) lub zasinienie skóry. Diosminex jest stosowany w monoterapii w początkowych stopniach zaawansowania przewlekłej niewydolności żylnej lub jako uzupełnienie innych terapii we wszystkich stopniach zaawansowania niewydolności żylnej (C0 – C6 wg klasyfikacji CEAP). Diosminex jest wskazany w leczeniu nasilonych dolegliwości związanych z żylakami odbytu u osób dorosłych.
- CHPL leku Diosminex, tabletki powlekane, 500 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Leczenie objawów przewlekłej niewydolności żylnej: Zalecana dawka to 2 tabletki na dobę, po jednej tabletce rano i wieczorem. Objawowe leczenie w nasileniu dolegliwości związanych z żylakami odbytu: W przypadku zaostrzenia dolegliwości związanych z żylakami odbytu dawka wynosi 6 tabletek na dobę przez pierwsze 4 dni, a następnie 4 tabletki na dobę przez kolejne 3 dni. Sposób podawania Produkt leczniczy Diosminex należy przyjmować doustnie podczas posiłków.
- CHPL leku Diosminex, tabletki powlekane, 500 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Diosminex, tabletki powlekane, 500 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku nasilenia dolegliwości związanych z żylakami odbytu, należy pamiętać, że terapia produktem leczniczym Diosminex jest tylko objawowa i powinna być krótkotrwała. Jeżeli dolegliwości nie ustępują, należy wykonać badanie proktologiczne i wybrać odpowiednią metodę leczenia. Stosowanie produktu leczniczego Diosminex w leczeniu objawowym w przypadku zaostrzenia dolegliwości związanych z żylakami odbytu nie wyklucza podawania innych leków doodbytniczo. Produkt leczniczy Diosminex nie jest skuteczny w leczeniu zastoinowej niewydolności serca i związanych z nią obrzęków. Produktu leczniczego Diosminex nie należy stosować u pacjentów z niewydolnością serca. W przypadku zaburzeń krążenia żylnego w kończynach dolnych, działanie terapeutyczne produktu leczniczego Diosminex można zwiększyć poprzez odpowiedni tryb życia: unikanie ekspozycji słonecznej; unikanie długotrwałego przebywania w pozycji stojącej; utrzymanie odpowiedniej masy ciała; noszenie specjalnych pończoch.
- CHPL leku Diosminex, tabletki powlekane, 500 mgSpecjalne środki ostrozności
Specjalne ostrzeżenia dotyczące substancji pomocniczych: Laktoza Produkt leczniczy nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy. Żółcień pomarańczowa, lak (E110) Produkt leczniczy może powodować reakcje alergiczne. Sód Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu w jednej tabletce powlekanej, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
- CHPL leku Diosminex, tabletki powlekane, 500 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji W badaniach na niewielkiej grupie zdrowych ochotników wykazano, że diosmina zmienia profil farmakokinetyczny metronidazolu, podwyższając jego maksymalne stężenie w osoczu i wydłużając czas jego eliminacji. Diosmina może także zwiększać czas eliminacji i maksymalne stężenie diklofenaku w osoczu. Diosmina może hamować agregację płytek krwi. Może to zwiększać ryzyko wystąpienia działań niepożądanych u pacjentów przyjmujących leki przeciwzakrzepowe.
- CHPL leku Diosminex, tabletki powlekane, 500 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie zaleca się stosowania produktu leczniczego Diosminex w okresie ciąży. Badania przeprowadzone na zwierzętach nie wykazały działania teratogennego diosminy, nie odnotowano takiego działania również u człowieka (patrz punkt 5.3). Karmienie piersi? Nie są dostępne informacje na temat przenikania diosminy do mleka kobiet karmiących piersią. Nie zaleca się karmienia piersią podczas stosowania produktu leczniczego Diosminex. Płodność Brak jest kontrolowanych badań dotyczących potencjalnego wpływu diosminy na płodność.
- CHPL leku Diosminex, tabletki powlekane, 500 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy Diosminex nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Diosminex, tabletki powlekane, 500 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane wymienione poniżej zostały opisane z uwzględnieniem częstości występowania zgodnie z poniższą konwencją: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥ 1/1 000 do <1/100), rzadko (≥ 1/10 000 do <1/1 000), bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia psychiczne Częstość nieznana: bezsenność. Zaburzenia układu nerwowego Rzadko: zawroty głowy, ból głowy, złe samopoczucie. Zaburzenia żołądka i jelit: Rzadko: biegunka, niestrawność, nudności, wymioty. Zaburzenia skóry i tkanki podskórnej: Rzadko: wysypka, świąd, pokrzywka. W przypadku łagodnych działań niepożądanych dotyczących żołądka i jelit oraz zaburzeń neurowegetatywnych (np. zwiększonego niepokoju, podwyższonego tętna, zwiększonej potliwości, lękliwości) nie jest wymagane odstawienie produktu leczniczego.
- CHPL leku Diosminex, tabletki powlekane, 500 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181 C, 02-222 Warszawa Tel.: +48 22 49 21 301, Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Diosminex, tabletki powlekane, 500 mgPrzedawkowanie
4.9 Przedawkowanie Objawy Nie odnotowano żadnego przypadku przedawkowania. Przedawkowanie może powodować zaburzenia żołądkowo-jelitowe, wymioty i nudności. Postępowanie W przypadku przedawkowania powinno być przeprowadzone klasyczne postępowanie medyczne, tzn. wywołanie wymiotów, płukanie żołądka, podanie węgla aktywnego oraz w dalszym etapie postępowanie objawowe, polegające na zabezpieczeniu podstawowych funkcji życiowych.
- CHPL leku Diosminex, tabletki powlekane, 500 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki działające ochronnie na naczynia. Leki stabilizujące naczynia włosowate. Bioflawonoidy. Kod ATC: C05CA03 Produkt leczniczy Diosminex zwiększa napięcie żylne i działa ochronnie na naczynia. Na poziomie naczyń żylnych zmniejsza rozszerzalność żył oraz zastój żylny. Na poziomie mikrokrążenia zmniejsza przepuszczalność włośniczek i zwiększa ich opór. Kontrolowane badania z zastosowaniem podwójnie ślepej próby przeprowadzone w celu zbadania aktywności diosminy na hemodynamikę żylną potwierdziły jej właściwości farmakologiczne. Stwierdzono statystycznie istotny związek pomiędzy dawką produktu a działaniem terapeutycznym w odniesieniu do parametrów pletyzmografii żylnej, takich jak: pojemność żylna, rozszerzalność żylna i czas opróżniania naczynia żylnego. Optymalne działanie terapeutyczne obserwowano podczas podawania dawki 1000 mg na dobę.
- CHPL leku Diosminex, tabletki powlekane, 500 mgWłaściwości farmakodynamiczne
Wpływ na stan napięcia naczyń żylnych: diosmina zwiększa napięcie naczyń żylnych - żylna pletyzmografia okluzyjna wykazała skrócenie czasu opróżniania naczynia żylnego. Wpływ na mikrokrążenie: badania z zastosowaniem podwójnie ślepej próby wykazały statystycznie istotną różnicę aktywności terapeutycznej u pacjentów przyjmujących placebo i diosminę. Diosmina zwiększa odporność naczyń włosowatych, szczególnie u pacjentów z objawami kruchości naczyń włosowatych. Badania przeprowadzone z zastosowaniem podwójnie ślepej próby kontrolowane za pomocą placebo, wykazały skuteczność terapeutyczną diosminy we flebologii podczas długotrwałego leczenia czynnościowej i organicznej niewydolności żylnej kończyn dolnych. Jest ona również skuteczna w proktologii w leczeniu zaostrzenia objawów związanych z obecnością żylaków odbytu.
- CHPL leku Diosminex, tabletki powlekane, 500 mgWłaściwości farmakodynamiczne
W opublikowanych metaanalizach z badań klinicznych wykazano, że diosmina istotnie ogranicza występowanie objawów związanych z niewydolnością żylną: dyskomfort funkcjonalny, uczucie ciężkości, zmęczenia, ból lub pieczenie nóg, nocne skurcze nóg, parestezje, świąd, obrzęk nóg, zasinienie/zaczerwienienie nóg i poprawia jakość życia pacjentów z niewydolnością żylną kończyn dolnych.
- CHPL leku Diosminex, tabletki powlekane, 500 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym diosmina wchłania się z przewodu pokarmowego jedynie po zmetabolizowaniu jej przez florę jelitową do aglikonu – diosmetyny. Zarówno w postaci niezmetabolizowanej jak i zmetabolizowanej jest wydalana głównie z kałem i moczem. Biologiczny okres półtrwania diosmetyny w osoczu wynosi 31,5 ± 8,6 godzin. Metabolizm diosminy jest znaczny, czego dowodzi obecność różnych kwasów fenolowych w moczu. Diosmina metabolizowana jest także do pochodnych glukuronidowych.
- CHPL leku Diosminex, tabletki powlekane, 500 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają żadnego szczególnego zagrożenia dla człowieka. Dawki powodujące śmiertelność połowy zwierząt doświadczalnych (LD50) przekraczają maksymalną dobową dawkę diosminy około 180-krotnie. Badania toksyczności subchronicznej nie wykazały toksyczności diosminy podawanej w dawce 35-krotnie większej od zalecanej. Badania toksyczności długookresowej wykazały, że diosmina podawana myszom i szczurom w dawce odpowiednio 620 mg/kg i 200 mg/kg przez okres 50 dni nie powodowała działania toksycznego. W badaniach na myszach i szczurach nie stwierdzono szkodliwego wpływu dużych dawek diosminy na przebieg ciąży i porodu oraz rozwój płodu.
- CHPL leku Diosminex, tabletki powlekane, 500 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki: Celuloza mikrokrystaliczna Laktoza jednowodna Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Magnezu stearynian Skład otoczki: Talk Alkohol poliwinylowy Tytanu dwutlenek (E 171) Makrogol 3350 Żółcień chinolinowa, lak (E 104) Indygotyna, lak (E 132) Żółcień pomarańczowa, lak (E 110) Żelaza tlenek, czarny (E 172) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/Aluminium w tekturowym pudełku. 60 tabletek powlekanych. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Aflavic Max, tabletki, 1000 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO AFLAVIC MAX, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1000 mg zmikronizowanej diosminy (Diosminum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka Tabletki barwy beżowej, podłużne z linią podziału po jednej stronie, obustronnie wypukłe z widocznymi dopuszczalnymi przebarwieniami. Linia podziału na tabletce jest przeznaczona do przełamywania tabletki w celu ułatwienia połykania.
- CHPL leku Aflavic Max, tabletki, 1000 mgWskazania do stosowania
4.1 Wskazania do stosowania Przewlekła niewydolność krążenia żylnego kończyn dolnych (żylaki) uczucie ciężkości nóg ból nóg nocne kurcze Leczenie objawowe w przypadku nasilenia dolegliwości związanych z żylakami odbytu (hemoroidy).
- CHPL leku Aflavic Max, tabletki, 1000 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zazwyczaj stosowana dawka produktu leczniczego to 1 tabletka raz na dobę, podczas posiłku. Zaostrzenie dolegliwości dotyczących żylaków odbytu: 3 tabletki na dobę przez 4 dni, a następnie 2 tabletki na dobę przez kolejne 3 dni, podczas posiłków. Sposób podawania Podanie doustne.
- CHPL leku Aflavic Max, tabletki, 1000 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Aflavic Max, tabletki, 1000 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku nasilenia dolegliwości związanych z żylakami odbytu, należy pamiętać, że terapia produktem AFLAVIC MAX jest tylko objawowa i powinna być krótkotrwała. W przypadku, gdy podczas trwania terapii diosminą dolegliwości związane z żylakami odbytu nie przemijają lub nasilają się, zalecane jest wykonanie badania proktologicznego. Lek zawiera mniej niż 1 mmol (23 mg) sodu w 1 tabletce, to znaczy lek uznaje się za wolny od sodu.
- CHPL leku Aflavic Max, tabletki, 1000 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Diosmina zmienia profil farmakokinetyczny metronidazolu podwyższając jego maksymalne stężenie w osoczu i wydłużając czas jego eliminacji.
- CHPL leku Aflavic Max, tabletki, 1000 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Badania przeprowadzone na zwierzętach nie wykazały działania teratogennego. Nie było zgłoszeń o szkodliwym działaniu diosminy podczas stosowania jej u ludzi. Mimo to nie ma wystarczających danych, aby całkowicie wykluczyć ryzyko, dlatego też produkt leczniczy może być stosowany w czasie ciąży wyłącznie w przypadku zdecydowanej konieczności. Karmienie piersi? Nie wiadomo czy produkt leczniczy przenika do mleka kobiet karmiących, dlatego zaleca się unikanie karmienia piersią w okresie jego przyjmowania.
- CHPL leku Aflavic Max, tabletki, 1000 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie przeprowadzono badań dotyczących wpływu produktu leczniczego AFLAVIC MAX na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Aflavic Max, tabletki, 1000 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane, które mogą wystąpić w czasie stosowania produktu leczniczego, wymieniono poniżej zgodnie z klasyfikacją układów i narządów oraz częstością występowania. Bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥ 1/1 000 do <1/100), rzadko (≥ 1/10 000 do <1/1 000), bardzo rzadko (<1/10 000). Zaburzenia żołądka i jelit Rzadko: biegunka, niestrawność, nudności, wymioty. Zaburzenia układu nerwowego Rzadko: zawroty głowy, ból głowy, złe samopoczucie. Zaburzenia skóry i tkanki podskórnej Wysypka, świąd, pokrzywka. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Aflavic Max, tabletki, 1000 mgDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49-21-301 Faks:+48 22 49-21-309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Aflavic Max, tabletki, 1000 mgPrzedawkowanie
4.9 Przedawkowanie Nie są znane objawy przedawkowania.
- CHPL leku Aflavic Max, tabletki, 1000 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki działające ochronnie na naczynia; leki stabilizujące naczynia włosowate; bioflawonoidy, kod ATC: C05CA03 Diosmina poprawia napięcie żył, normalizuje przepuszczalność naczyń oraz działa na nie ochronnie. Badania doświadczalne przeprowadzone na zwierzętach oraz badania kliniczne wykazały właściwości produktu leczniczego opisane poniżej. Badania kliniczne Właściwości utrzymania napięcia żylnego Diosmina nasila zwężanie naczyń spowodowane adrenaliną, noradrenaliną i serotoniną w żyłach powierzchniowych ręki oraz w izolowanej żyle odpiszczelowej; powoduje zwiększenie napięcia ściany naczyń żylnych (wykazane podczas pomiaru pojemności naczyń żylnych metodą pletyzmograficzną); zmniejsza zastój żylny. Zwężenie naczyń żylnych jest zależne od przyjmowanej dawki produktu. Diosmina powoduje zmniejszenie średniego ciśnienia żylnego zarówno w naczyniach powierzchniowych, jak i głębokich.
- CHPL leku Aflavic Max, tabletki, 1000 mgWłaściwości farmakodynamiczne
Udowodniono to badaniem metodą Dopplera, podczas podwójnej ślepej próby z podawaniem placebo.
- CHPL leku Aflavic Max, tabletki, 1000 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Badania farmakokinetyki produktu leczniczego były prowadzone na zwierzętach z użyciem diosminy znakowanej węglem radioaktywnym 14C. Wchłanianie Diosmina dobrze się wchłania po podaniu doustnym. Od drugiej godziny po podaniu produktu leczniczego rozpoczyna się faza szybkiego wchłaniania. Maksymalne stężenia w surowicy uzyskuje się po pięciu godzinach. Dystrybucja W badaniach na zwierzętach, którym podawano diosminę znakowaną radioaktywnym izotopem węgla zwiększoną radioaktywność obserwowano w nerkach, wątrobie, płucach oraz naczyniach żylnych. Stężenie produktu leczniczego w naczyniach żylnych narastało do dziewiątej godziny od podania produktu i utrzymywało się przez kolejnych 96 godzin. Eliminacja Eliminacja produktu leczniczego z organizmu następuje głównie z moczem (79%), kałem (11%) i żółcią (2,4%).
- CHPL leku Aflavic Max, tabletki, 1000 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak istotnych danych nieklinicznych o znaczeniu klinicznym nie opisanych w pozostałych punktach ChPL.
- CHPL leku Aflavic Max, tabletki, 1000 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kroskarmeloza sodowa Alkohol poliwinylowy (8-88) Talk Magnezu stearynian Krzemionka koloidalna bezwodna 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Blistry PVC/ PVDC/Aluminium w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Diohespan max, 1000 mg, proszek doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna saszetka zawiera 1000 mg zmikronizowanej diosminy (Diosminum). Substancje pomocnicze o znanym działaniu: 1 saszetka zawiera: 445,69 mg sacharozy; 1 saszetka zawiera: 657,60 mg glukozy; 1 saszetka zawiera: 0,407 mg fruktozy; 1 saszetka zawiera: 0,157 mg alkoholu benzylowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Proszek doustny Sypki proszek o barwie od szaro-żółtej do jasnobrązowej z jaśniejszymi wtrąceniami, o zapachu pomarańczowo-wiśniowym.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgWskazania do stosowania
4.1 Wskazania do stosowania Objawy przewlekłej niewydolności krążenia żylnego kończyn dolnych: bóle i nocne kurcze nóg; uczucie ciężkości nóg; żylaki kończyn dolnych; obrzęki nóg (opuchlizna / puchnięcie nóg); poszerzenia bardzo drobnych naczyń żylnych, tzw. pajączki naczyniowe. Objawowe leczenie żylaków odbytu (hemoroidów).
- CHPL leku Diohespan Max, proszek doustny, 1000 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zazwyczaj stosowana dawka produktu leczniczego to 1 saszetka raz na dobę. Zaostrzenie dolegliwości dotyczących żylaków odbytu: 3 saszetki na dobę przez 4 dni, a następnie 2 saszetki na dobę przez kolejne 3 dni, podczas posiłków. Sposób podawania Podanie doustne. Należy wysypać proszek bezpośrednio na język i połknąć. W razie potrzeby można popić go wodą lub zawiesić w małej ilości wody i wypić.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku zaostrzenia dolegliwości związanych z żylakami odbytu, należy pamiętać, że jest to tylko leczenie objawowe i powinno być krótkotrwałe. Jeżeli dolegliwości nie ustępują, należy wykonać badanie proktologiczne i wybrać odpowiednią metodę leczenia. Specjalne ostrzeżenia dotyczące substancji pomocniczych Glukoza, sacharoza Produkt leczniczy zawiera glukozę i sacharozę i dlatego pacjenci z rzadkimi dziedzicznymi zaburzeniami związanymi z nietolerancją fruktozy, zespołem złego wchłaniania glukozy - galaktozy lub niedoborem sacharozy - izomaltazy, nie powinni przyjmować produktu leczniczego. Fruktoza Produkt leczniczy zawiera 0,407 mg fruktozy w każdej saszetce. Fruktoza zawarta w produkcie leczniczym może wpływać szkodliwie na zęby. Alkohol benzylowy Produkt leczniczy zawiera 0,157 mg alkoholu benzylowego w każdej saszetce. Alkohol benzylowy może powodować reakcje alergiczne.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Diosmina zmienia profil farmakokinetyczny metronidazolu podwyższając jego maksymalne stężenie w osoczu i wydłużając czas jego eliminacji. Diosmina może zwiększać także czas eliminacji i maksymalne stężenie w osoczu diklofenaku. Jednoczesne stosowanie diosminy z feksofenadyną może potencjalnie zwiększyć wchłanianie i biodostępność feksofenadyny. Diosmina hamuje metabolizm karbamazepiny.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Dane otrzymane z ograniczonej liczby zastosowań produktu w okresie ciąży nie wskazują, że diosmina wywołuje wady rozwojowe lub działa szkodliwie na płód lub noworodka. Badania na zwierzętach nie wykazują szkodliwego wpływu na reprodukcję (patrz punkt 5.3). Można rozważyć stosowanie produktu w okresie ciąży, jeśli to konieczne. Karmienie piersi? Nie należy stosować produktu leczniczego w okresie karmienia piersią z uwagi na brak danych dotyczących przenikania diosminy do mleka kobiet karmiących piersią.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane, które mogą wystąpić w czasie stosowania produktu leczniczego, wymieniono poniżej zgodnie z klasyfikacją układów i narządów oraz częstością występowania. Bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥ 1/1 000 do <1/100), rzadko (≥ 1/10 000 do <1/1 000), bardzo rzadko (<1/10 000). Zaburzenia żołądka i jelit Rzadko: biegunka, niestrawność, nudności, wymioty. Zaburzenia układu nerwowego Rzadko: zawroty głowy, ból głowy, złe samopoczucie. Zaburzenia skóry i tkanki podskórnej Rzadko: wysypka, świąd, pokrzywka. Zaobserwowane działania niepożądane nie powodują konieczności odstawienia produktu leczniczego. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgPrzedawkowanie
4.9 Przedawkowanie Nie odnotowano przypadków wystąpienia zatrucia diosminą z powodu jej przedawkowania. Przedawkowanie może powodować zaburzenia żołądkowo-jelitowe, wymioty i nudności. W przypadku przedawkowania zaleca się rutynowe postępowanie medyczne, tzn. wywołanie wymiotów, płukanie żołądka, podanie węgla aktywnego oraz na dalszym etapie postępowanie objawowe, polegające na zabezpieczeniu podstawowych czynności życiowych.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki ochraniające ścianę naczyń, bioflawonoidy, kod ATC: C 05 CA 03 Diosmina zwiększa napięcie żylne i działa ochronnie na naczynia. W naczyniach żylnych zmniejsza rozszerzalność oraz zastój żylny. W mikrokrążeniu zmniejsza przepuszczalność włośniczek i zwiększa ich opór. Kontrolowane badania z zastosowaniem podwójnie ślepej próby przeprowadzone w celu zbadania wpływu diosminy na hemodynamikę żylną potwierdziły jej właściwości farmakologiczne. Statystycznie znamienny związek pomiędzy dawką diosminy a działaniem terapeutycznym wykazano na podstawie parametrów pletyzmografii żylnej: pojemności żylnej, rozszerzalności żylnej i czasu opróżniania naczynia żylnego. Optymalne działanie terapeutyczne zaobserwowano po dawce 1000 mg na dobę. Wpływ na napięcie naczyń żylnych: diosmina zwiększa napięcie naczyń żylnych; żylna pletyzmografia okluzyjna wykazała skrócenie czasu opróżniania naczynia żylnego.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgWłaściwości farmakodynamiczne
Wpływ na mikrokrążenie: kontrolowane badania z zastosowaniem podwójnie ślepej próby wykazały statystycznie znamienną różnicę pomiędzy efektami terapeutycznymi u pacjentów przyjmujących diosminę i placebo. Diosmina zwiększa wytrzymałość układu kapilarnego, szczególnie u pacjentów z nasiloną kruchością naczyń. Badania przeprowadzone z zastosowaniem podwójnie ślepej próby kontrolowane za pomocą placebo, wykazały skuteczność terapeutyczną diosminy we flebologii, w terapii czynnościowej i organicznej przewlekłej niewydolności żylnej kończyn dolnych oraz w proktologii w leczeniu żylaków odbytu.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Diosmina po podaniu doustnym jest hydrolizowana w jelitach przez florę bakteryjną do aglikonu – diosmetyny, która szybko wchłania się z przewodu pokarmowego. Dystrybucja Tmax dla diosmetyny wynosi ok. 1h. Okres półtrwania diosmetyny w osoczu krwi (T1/2) wynosi średnio 31,5 godziny. Metabolizm Metabolitami diosminy są kwasy fenolowe i ich pochodne sprzężone z glicyną. Eliminacja W postaci zmetabolizowanej jest wydalana głównie z kałem i moczem. Niewchłonięta część dawki diosminy i diosmetyny jest wydalana z kałem.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na myszach i szczurach nie stwierdzono szkodliwego wpływu dużych dawek diosminy na przebieg ciąży i porodu oraz rozwój płodu.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sacharoza Alkohol poliwinylowy Polisorbat 80 Glukoza Kwas cytrynowy Guma ksantan Krzemionka koloidalna bezwodna Aromat pomarańczowy SD1918 (w tym: fruktoza) Aromat wiśniowy SD0559 (w tym: alkohol benzylowy) Sukraloza 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Saszetki PET/PE/Aluminium/LDPE w tekturowym pudełku lub saszetki Papier/Aluminium/LDPE w tekturowym pudełku lub saszetki PET/Aluminium/LDPE w tekturowym pudełku. 1 opakowanie zawiera 10, 20, 30 lub 60 saszetek po 2,2 g. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
- CHPL leku Diohespan Max, proszek doustny, 1000 mgDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami. Instrukcja dotycząca przygotowania produktu leczniczego – punkt 4.2
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO CALCIUM DOBESILATE GALENA, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg wapnia dobezylanu (Calcii dobesilas) w postaci wapnia dobezylanu jednowodnego. Substancja pomocnicza o znanym działaniu: laktoza jednowodna. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki Białe, okrągłe, obustronnie lekko wypukłe tabletki.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgWskazania do stosowania
4.1 Wskazania do stosowania Mikroangiopatie, zwłaszcza retinopatia cukrzycowa. Objawy kliniczne w przebiegu przewlekłej niewydolności żylnej kończyn dolnych (bóle, kurcze mięśni, parestezje, obrzęk, zmiany skórne związane z zastojem żylnym). Pomocniczo w zakrzepowym zapaleniu powierzchownych żył kończyn dolnych. Pomocniczo w żylakach odbytu. Pomocniczo w zaburzeniach mikrokrążenia pochodzenia tętniczo-żylnego.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zwykle stosuje się 500 mg do 1000 mg na dobę, tj. 2 tabletki jeden lub dwa razy na dobę. Dawkę produktu leczniczego należy ustalać indywidualnie dla pacjenta zależnie od nasilenia objawów choroby. Okres leczenia wynoszący zazwyczaj od kilku tygodni do wielu miesięcy, zależy od rodzaju choroby i jej przebiegu. Sposób podawania Produkt leczniczy stosuje się doustnie w trakcie głównych posiłków.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Produktu leczniczego nie należy stosować u dzieci (bezpieczeństwo stosowania i skuteczność nie były na tej grupie badane).
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W rzadkich przypadkach wapnia dobezylan może powodować agranulocytozę, związaną prawdopodobnie z reakcją nadwrażliwości. Agranulocytoza może objawiać się wysoką gorączką, zakażeniami w obrębie jamy ustnej (zapaleniem gardła i migdałków), stanami zapalnymi w obrębie odbytu i narządów płciowych. Należy poinformować pacjenta, że w przypadku pojawienia się jakichkolwiek objawów zakażenia podczas stosowania wapnia dobezylanu powinien skontaktować się z lekarzem. Wystąpienie wymienionych objawów jest wskazaniem do odstawienia produktu leczniczego i wykonania badania morfologii krwi z rozmazem. U osób z ciężką niewydolnością nerek, zwłaszcza dializowanych, należy stosować zmniejszone dawki produktu leczniczego. Należy zachować ostrożność u osób z czynną chorobą wrzodową żołądka i (lub) dwunastnicy lub z przewlekłym zapaleniem błony śluzowej żołądka. Wskazana jest okresowa kontrola czynności żołądka i dwunastnicy.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgSpecjalne środki ostrozności
W przypadku zaostrzenia objawów produkt leczniczy należy odstawić. Produkt leczniczy zawiera laktozę jednowodną. Nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, niedoborem laktazy (typu Lapp) lub zespołem złego wchłaniania glukozy-galaktozy.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Brak danych dotyczących interakcji wapnia dobezylanu z innymi produktami leczniczymi.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych dotyczących przenikania wapnia dobezylanu przez łożysko oraz wystąpienia ewentualnych zaburzeń rozwojowych u płodu. Produkt leczniczy może być stosowany u kobiet w ciąży wyłącznie wtedy, gdy potencjalna korzyść z takiej terapii przewyższa ryzyko dla płodu. Karmienie piersi? Wapnia dobezylan przenika w niewielkich ilościach do mleka kobiet karmiących piersią. Brak danych dotyczących wpływu wapnia dobezylanu na niemowlę karmione piersią. Przed rozpoczęciem stosowania produktu leczniczego kobieta powinna przerwać karmienie piersią.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy Calcium dobesilate Galena nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgDziałania niepożądane
4.8 Działania niepożądane Klasyfikacja częstości występowania działań niepożądanych: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (≥1/10 000), nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego Bardzo rzadko: zahamowanie czynności szpiku z agranulocytozą (0,32/milion kuracji). Zaburzenia żołądka i jelit Rzadko: ból w nadbrzuszu, nudności, biegunki, wymioty. Zaburzenia skóry i tkanki podskórnej Rzadko: reakcje skórne. Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Rzadko: bóle stawów. Zaburzenia naczyniowe Rzadko: bóle i zawroty głowy. Zaburzenia ogólne i stany w miejscu podania Rzadko: gorączka. U 27% chorych z retinopatią cukrzycową leczonych wapnia dobezylanem w dawce 1500 mg na dobę występowały bóle w nadbrzuszu o średnim nasileniu.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgDziałania niepożądane
Odnotowano przypadki reakcji alergicznych miejscowych (wysypki) i uogólnionych (pokrzywka). Większość reakcji niepożądanych przemija po odstawieniu produktu leczniczego lub po zmniejszeniu dawki. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: +48 22 49 21 301 Faks: +48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgPrzedawkowanie
4.9 Przedawkowanie Nie zgłoszono żadnego przypadku przedawkowania.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki ochraniające ścianę naczyń – leki stosowane w leczeniu żylaków, kod ATC: C05BX01. Wapnia dobezylan działa na ściany naczyń włosowatych, zmniejszając ich nadmierną przepuszczalność i zwiększając wytrzymałość. Punktem uchwytu wapnia dobezylanu jest śródbłonek i warstwa podstawna naczyń włosowatych. Wapnia dobezylan zmniejsza nadmierną przepuszczalność kapilar powodowaną przez histaminę i bradykininę, przez co zapobiega przesiąkaniu płynów z łożyska naczyniowego, zmniejsza też łamliwość naczyń włosowatych. Wapnia dobezylan zwiększa elastyczność erytrocytów, zaś u pacjentów z retinopatią cukrzycową zmniejsza nadmierną lepkość krwi, poprawiając jej właściwości reologiczne. Działanie antyagregacyjne wapnia dobezylanu polega na hamowaniu agregacji płytek wywołanej przez kolagen i trombinę, bez wpływu na agregację stymulowaną przez kwas arachidonowy.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgWłaściwości farmakodynamiczne
Wapnia dobezylan zmniejsza hamowanie syntezy kolagenu powodowane przez glukozę, przyspieszając fibrynogenezę kolagenu typu II, ważnego składnika strukturalnego ścian tętnic. Do zmniejszenia lepkości krwi dochodzi poprzez zmianę składu białek osocza oraz normalizację mechanicznych właściwości krwinek czerwonych (zwiększona odkształcalność). Dodatkowo działanie to jest zwiększane dzięki działaniu antyagregacyjnemu. Wymienione działania powodują usprawnienie obwodowego krążenia żylnego, zmniejszając zastój w naczyniach żylnych i hamując rozwój zmian zakrzepowych towarzyszących powstawaniu żylaków, zwłaszcza kończyn dolnych. Wapnia dobezylan zmniejsza przepuszczalność naczyń limfatycznych, ich łamliwość, a także poprawia drenaż układu limfatycznego, powodując zmniejszenie obrzęków.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Maksymalne stężenie wapnia dobezylanu w osoczu (8 µg/ml) osiągane jest po około 6 godzinach od podania doustnego 500 mg; po upływie 24 godzin stężenie wapnia dobezylanu w osoczu wynosi 3 µg/ml. Dystrybucja Wapnia dobezylan wiąże się z białkami osocza w około 20% do 25%. Eliminacja Wapnia dobezylan wydalany jest głównie w postaci niezmienionej, a tylko 10% przyjętego leku eliminowane jest w postaci metabolitów. Około 50% dawki doustnej wydalane jest w ciągu pierwszych 24 godzin w moczu.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach nie wykazano teratogennego działania wapnia dobezylanu, jednakże obserwacje te nie zostały potwierdzone w wystarczającym stopniu u ludzi.
- CHPL leku Calcium dobesilate Galena, tabletki, 250 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Laktoza jednowodna Celuloza mikrokrystaliczna Talk Magnezu stearynian Krzemionka koloidalna bezwodna 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30ºC. Przechowywać w oryginalnym opakowaniu. 6.5 Rodzaj i zawartość opakowania Dostępne opakowania: 30 tabletek 60 tabletek Blistry z folii PVC/PVDC/Aluminium w tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Brak specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO DOXIUM 500, 500 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka twarda zawiera 500 mg wapnia dobesylanu (Calcii dobesilas). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Kapsułka twarda Nieprzezroczyste kapsułki z żółtym korpusem i ciemno-zielonym wieczkiem
- CHPL leku Doxium 500, kapsułki twarde, 500 mgWskazania do stosowania
4.1. Wskazania do stosowania Kliniczne objawy przewlekłej niewydolności żylnej kończyn dolnych (ból nóg, skurcze nóg, parestezje, obrzęki, zmiany skórne na tle zastoju krwi), łagodna do umiarkowanej nieproliferacyjna retinopatia cukrzycowa, w celu opóźnienia postępu choroby. Doxium 500 jest wskazany do stosowania u dorosłych.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgDawkowanie
4.2. Dawkowanie i sposób podawania Dawkowanie tylko dla dorosłych Retinopatia cukrzycowa: od 1000 do 1500 mg na dobę. (500 mg 2 do 3 razy na dobę). Niewydolność żylna: od 500 do 1000 mg na dobę. (500 lub 1000 mg raz na dobę) Dawkę produktu leczniczego należy dostosowywać indywidualnie w zależności od ciężkości choroby. Okres leczenia zależy od rodzaju oraz przebiegu choroby i wynosi zazwyczaj od kilku tygodni do kilku miesięcy. Pacjenci z niewydolnością nerek Nie oceniano bezpieczeństwa stosowania ani skuteczności wapnia dobesylanu u pacjentów z niewydolnością nerek. Produkt leczniczy jest wydalany przez nerki, dlatego w przypadku pacjentów z niewydolnością nerek należy zachować ostrożność. W przypadku podawania produktu leczniczego DOXIUM 500 takim pacjentom dawka może zostać zmniejszona, szczególnie u pacjentów z ciężką niewydolnością nerek wymagającej dializoterapii.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgDawkowanie
Pacjenci z niewydolnością wątroby Nie oceniano bezpieczeństwa stosowania ani skuteczności wapnia dobesylanu u pacjentów z niewydolnością wątroby. Dlatego też należy zachować ostrożność podczas stosowania produktu leczniczego DOXIUM 500 u takich pacjentów. Sposób podawania Produkt leczniczy DOXIUM 500 przyjmuje się doustnie. Kapsułki należy połykać w całości, nie otwierając ich. W celu zminimalizowania ewentualnego uczucia dyskomfortu w żołądku produkt leczniczy DOXIUM 500 należy przyjmować podczas posiłku lub bezpośrednio po posiłku.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku ciężkiej niewydolności nerek wymagającej dializoterapii dawka produktu leczniczego powinna być zmniejszona. W bardzo rzadkich przypadkach podawanie wapnia dobesylanu może wywołać agranulocytozę (patrz punkt 4.8). W takiej sytuacji mogą pojawić się objawy, takie jak wysoka gorączka, zakażenia w obrębie jamy ustnej (zapalenie migdałków), ból gardła, zmiany zapalne w obrębie narządów płciowych i odbytu oraz inne objawy, które zwykle wskazują na obecność zakażenia. W razie wystąpienia któregokolwiek z powyższych objawów należy przerwać leczenie. Wówczas konieczne jest natychmiastowe wykonanie morfologii krwi oraz leukogramu. Produkt leczniczy DOXIUM 500 może wywoływać ciężką reakcję nadwrażliwości (reakcję anafilaktyczną lub wstrząs anafilaktyczny). W przypadku wystąpienia reakcji nadwrażliwości należy przerwać leczenie.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgSpecjalne środki ostrozności
Osoby w podeszłym wieku Osoby w podeszłym wieku były szeroko reprezentowane w badaniach klinicznych z zastosowaniem wapnia dobesylanu. Nie pojawiły się żadne ogólne kwestie dotyczące bezpieczeństwa stosowania. Dzieci i młodzież Nie przeprowadzono badań dotyczących stosowania wapnia dobesylanu u dzieci i młodzieży.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Interakcje z innymi produktami leczniczymi nie są znane. W dawkach terapeutycznych wapnia dobesylan może zakłócać oznaczenia kreatyniny metodą enzymatyczną, dając niższe niż oczekiwano wartości. W przypadku konieczności pobrania próbek do badań (np. próbek krwi) w trakcie leczenia wapnia dobesylanem, w celu zminimalizowania potencjalnego odziaływania leku na wyniki badań, należy je pobrać przed pierwszym codziennym podaniem leku.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Ciąża Istnieją tylko ograniczone dane dotyczące stosowania wapnia dobesylanu u kobiet w okresie ciąży. Badania na zwierzętach nie wskazały bezpośredniego lub pośredniego szkodliwego wpływu na reprodukcję. W celu zachowania ostrożności zaleca się unikanie stosowania wapnia dobesylanu w okresie ciąży. Karmienie piersi? Wapnia dobesylan przenika do mleka matki w bardzo małych ilościach (0,4 µg/ml po trzykrotnym przyjęciu dawki 500 mg). Podawanie produktu leczniczego DOXIUM 500 nie jest wskazane podczas karmienia piersią. Ze względów bezpieczeństwa należy przerwać albo leczenie, albo karmienie piersią.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy DOXIUM 500 nie ma wpływu lub wywiera nieistotny wpływ na prowadzenie pojazdów i obsługiwanie maszyn.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgDziałania niepożądane
4.8. Działania niepożądane Działania niepożądane zostały sklasyfikowane według klasyfikacji układów i narządów MedDRA oraz częstości występowania następująco: Bardzo często (≥1/10) Często (≥1/100 do <1/10) Niezbyt często (≥1/1000 do <1/100) Rzadko (≥1/10 000 do <1/1000) Bardzo rzadko (<1/10 000) Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) Zaburzenia krwi i układu chłonnego Bardzo rzadko: agranulocytoza (patrz punkt 4.4) Częstość nieznana: neutropenia, leukopenia Zaburzenia układu immunologicznego Niezbyt często: nadwrażliwość (wysypka, alergiczne zapalenie skóry, świąd, pokrzywka, obrzęk twarzy; patrz punkt 4.4) Bardzo rzadko: reakcja anafilaktyczna (patrz punkt 4.4) Zaburzenia układu nerwowego Często: ból głowy, zawroty głowy Zaburzenia żołądka i jelit Często: ból brzucha, nudności, biegunka, wymioty Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Często: ból stawów, ból mięśni Zaburzenia ogólne i stany w miejscu podania Niezbyt często: gorączka, dreszcze, astenia, zmęczenie Badania diagnostyczne Często: zwiększenie aktywności aminotransferazy alaninowej Reakcje te są zwykle odwracalne po zaprzestaniu leczenia.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa Strona internetowa: https://smz.ezdrowie.gov.pl
- CHPL leku Doxium 500, kapsułki twarde, 500 mgPrzedawkowanie
4.9. Przedawkowanie Nie zgłoszono żadnego przypadku przedawkowania ani nie są znane jego objawy kliniczne. Przedawkowanie produktu leczniczego należy leczyć zgodnie ze standardową praktyką medyczną.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: inne leki ochraniające ścianę naczyń, leki stosowane w leczeniu żylaków. Kod ATC: C05BX01. Ten produkt leczniczy reguluje czynność naczyń włosowatych. Wapnia dobesylan działa na poziomie ścian naczyń włosowatych, regulując zaburzenia ich funkcji fizjologicznych: zwiększoną przepuszczalność i zmniejszone napięcie. Produkt leczniczy zwiększa elastyczność erytrocytów, hamuje zwiększoną agregację płytek, a u pacjentów z retinopatią cukrzycową obniża zwiększoną lepkość osocza, poprawiając tym samym przepływ tkankowy. Działania te pozwalają zmniejszyć zaburzenia naczyń włosowatych niezależnie od tego, czy mają one podłoże funkcjonalne, czy związane są z działaniem czynników ogólnoustrojowych czy też nabytych zaburzeń metabolicznych. Wapnia dobesylan przyczynia się również do zmniejszania obrzęków.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Po podaniu doustnym 500 mg wapnia dobesylanu jego stężenie we krwi mierzone między 3 a 10 godziną po podaniu wynosi powyżej 6 µg/ml, a maksymalne stężenie około 8 µg/ml (Cmax) osiągane jest po 6 godzinach (tmax). Dwadzieścia cztery godziny po podaniu produktu leczniczego jego stężenie we krwi wynosi około 3 µg/ml. Stopień wiązania z białkami osocza wynosi 20–25%. U zwierząt doświadczalnych wapnia dobesylan nie przekracza bariery krew–mózg ani bariery łożyska. Dane dotyczące ludzi nie są dostępne. Wapnia dobesylan przenika do mleka matki jedynie w bardzo małych ilościach (jedno badanie kliniczne, po podaniu dawki 1500 mg stężenie produktu leczniczego w mleku matki wynosiło 0,4 µg/ml). Wapnia dobesylan nie przechodzi do krążenia jelitowo-wątrobowego i jest wydalany głównie w formie niezmienionej; tylko w 10% wydalany jest w postaci metabolitów. W ciągu pierwszych 24 godzin około 50% dawki doustnej wydalane jest z moczem, a około 10% z kałem.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgWłaściwości farmakokinetyczne
Okres półtrwania w osoczu wynosi około 5 godzin.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie W badaniach przewlekłej toksyczności u szczurów wapnia dobesylan wywoływał wzrost częstości występowania zmian histologicznych w nerkach w przypadku dawek około 13,5 razy wyższych od maksymalnej dawki terapeutycznej. Zmiany te są przypisywane podwyższonej ekspozycji na wapń. Wapnia dobesylan nie wykazywał działania fetotoksycznego ani teratogennego u myszy, szczurów ani królików w przypadku dawek doustnych do 30 razy (u szczurów) i odpowiednio 13,5 raza (u królików) wyższych od maksymalnej dawki terapeutycznej. Badania nie wykazały potencjalnego działania genotoksycznego produktu leczniczego. Nie badano potencjalnego działania rakotwórczego.
- CHPL leku Doxium 500, kapsułki twarde, 500 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Skrobia kukurydziana Stearynian magnezu Skład otoczki kapsułki: Żelaza tlenek żółty (E 172) Tytanu dwutlenek (E 171) Żelatyna Indygotyna (E132) 6.2. Niezgodności farmaceutyczne Dotychczas nieznane. 6.3. Okres ważności 5 lat 6.4. Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5. Rodzaj i zawartość opakowania Przezroczysty, bezbarwny, twardy blister wykonany z folii aluminiowej i drukowanej PVC/PVDC Opakowanie 30 kapsułek twardych Opakowanie 60 kapsułek twardych Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6. Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Kelicardina, krople doustne, -Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO KELICARDINA, krople doustne 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g kropli zawiera: Convallariae extractum fluidum (1:1) 50,0 g, ekstrahent: etanol 70% (V/V) Crataegi folii cum flore extractum fluidum (1:1) 42,0 g, ekstrahent: etanol 70% (V/V) Troxerutinum 0,5 g 1 ml (co odpowiada ok. 0,940 g płynu) zawiera: 0,47 g wyciągu płynnego (1:1) z Convallaria maialis L., herba (ziele konwalii), co odpowiada od 2,5 j.g. do 4,2 j.g. glikozydów nasercowych 0,40 g wyciągu płynnego (1:1) z Crataegus monogyna Jacquin i Crataegus oxycantha L. folium cum flos (kwiatostan głogu) 4,7 mg troxerutinum (trokserutyna) Produkt leczniczy zawiera 59% - 67% (V/V) etanolu, tj. 536 mg na dawkę (1 ml). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krople doustne
- CHPL leku Kelicardina, krople doustne, -Wskazania do stosowania
4.1 Wskazania do stosowania Lek tradycyjnie stosowany w początkowym okresie upośledzonej wydolności serca, niewymagającej stosowania innych leków, bez objawów zastoju krążenia i w osłabieniu mięśnia sercowego u osób w podeszłym wieku.
- CHPL leku Kelicardina, krople doustne, -Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli: 20 kropli (ok. 1 ml) 3 razy na dobę. Sposób podawania Lek stosować doustnie; zaleca się przyjmować między posiłkami. Jeśli objawy utrzymują się dłużej niż dwa tygodnie lub nasilają się podczas stosowania, należy skonsultować się z lekarzem lub wykwalifikowanym pracownikiem służby zdrowia.
- CHPL leku Kelicardina, krople doustne, -Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, zapalenie wsierdzia, miażdżyca naczyń wieńcowych, blok serca, zawał mięśnia sercowego, okres podawania sulfonamidów, stany niedoboru potasu. Ze względu na różną siłę działania nie zaleca się łączenia produktu z innymi glikozydami nasercowymi.
- CHPL leku Kelicardina, krople doustne, -Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku wystąpienia obrzęków spowodowanych przez niewydolność serca należy zastosować silniejsze środki nasercowe. Ze względu na zawartość etanolu, nie zaleca się stosowania produktu u pacjentów z chorobami wątroby, epilepsją oraz cierpiących na alkoholizm. Dzieci i młodzież Produkt leczniczy nie jest przeznaczony do stosowania u dzieci i młodzieży. Ostrzeżenia dotyczące substancji pomocniczej Produkt leczniczy zawiera 59% - 67% (V/V) etanolu tzn. 536 mg na dawkę (1 ml), co jest równoważne 14 ml piwa, 6 ml wina. Dawka 1 ml płynu podana dorosłemu o masie ciała (m.c.) 70 kg spowoduje narażenie na etanol wynoszące 7,7 mg/kg m.c., co może spowodować zwiększenie stężenia alkoholu we krwi (ang. blood alcohol concentration, BAC) o około 1,3 mg/100ml. Dla porównania, u osoby dorosłej pijącej kieliszek wina lub 500 ml piwa, stężenie alkoholu we krwi wyniesie prawdopodobnie około 50 mg/100 ml.
- CHPL leku Kelicardina, krople doustne, -Interakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie należy stosować produktu leczniczego z innymi lekami zawierającymi glikozydy nasercowe i beta-blokerami. Ze względu na obecność w składzie produktu leczniczego wyciągu z liści konwalii, może nastąpić zwiększenie siły działania preparatu jak również natężenie działań ubocznych przy równoczesnym stosowaniu chinidyny, soli wapnia, saluretyków, środków przeczyszczających oraz przy długotrwałej terapii glikokortykosteroidami.
- CHPL leku Kelicardina, krople doustne, -Wpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie zaleca się stosowania leku u kobiet w okresie ciąży i karmienia piersią, ponieważ nie wykonano kontrolowanych badań klinicznych u tej grupy pacjentów. Karmienie piersi? Nie zaleca się stosowania leku ponieważ nie wykonano kontrolowanych badań klinicznych u tej grupy pacjentów. Płodność Brak danych.
- CHPL leku Kelicardina, krople doustne, -Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt leczniczy zawiera 59% - 67% (V/V) etanolu (alkoholu), tzn. 536 mg na dawkę (1 ml), co jest równoważne 14 ml piwa, 6 ml wina. Mała ilość alkoholu w tym leku nie będzie powodowała zauważalnych skutków.
- CHPL leku Kelicardina, krople doustne, -Działania niepożądane
4.8 Działania niepożądane Możliwe działania niepożądane leku przedstawiono zgodnie z klasyfikacją narządów i układów wg MedDRA oraz częstością występowania: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000); nieznana (nie może być określona na podstawie dostępnych danych). Podczas stosowania produktu leczniczego Kelicardina mogą wystąpić: Zaburzenia przewodu pokarmowego (nudności) - bardzo rzadko Zaburzenia serca (zaburzenia rytmu serca) - bardzo rzadko Zaburzenia układu nerwowego (ból głowy) - bardzo rzadko Zaburzenia układu immunologicznego (pokrzywka) - bardzo rzadko Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Kelicardina, krople doustne, -Działania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181 C, 02-222 Warszawa, tel. +48 22 492-13-01, fax +48 22 492-13-09, Strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Kelicardina, krople doustne, -Przedawkowanie
4.9 Przedawkowanie Mogą wystąpić objawy przedawkowania glikozydami nasercowymi oraz alkoholem. Dotychczas nie odnotowano przypadków przedawkowania leku Kelicardina. Dane literaturowe na temat zatruć ostrych po przedawkowaniu u ludzi preparatów z konwalii wskazują, że głównymi objawami były: arytmia, zaburzenia ze strony przewodu pokarmowego (nudności, wymioty, biegunka) i ośrodkowego układu nerwowego (ból głowy, senność, zaburzenia widzenia). W przypadku zatrucia należy przywrócić równowagę wodno-elektrolitową organizmu i wyrównać niedobór magnezu. W ciężkich przypadkach należy zapewnić wspomaganie oddechowo-krążeniowe, podać tlen oraz atropinę.
- CHPL leku Kelicardina, krople doustne, -Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Lek stosowany tradycyjnie jako nieznacznie zwiększający siłę skurczu mięśnia sercowego (działanie inotropowo dodatnie) i zmniejszający częstotliwość jego skurczów (działanie chronotropowo ujemne). Glikozydy kardenolidowe zawarte w wyciągu z ziela konwalii mają udokumentowane słabe działanie podobne do strofantyny.
- CHPL leku Kelicardina, krople doustne, -Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Badania farmakokinetyczne leku nie zostały wykonane. Glikozydy konwalii łatwo wchłaniają się w jelicie cienkim, ale w niewielkim stopniu (ok. 10%); w małym stopniu wiążą się one z frakcją albumin osocza (około 16%), wobec czego ich działanie lecznicze występuje szybko, lecz trwa krótko; nie kumulują się w organizmie.
- CHPL leku Kelicardina, krople doustne, -Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Nie prowadzono badań toksyczności dla produktu jako kompozycji.
- CHPL leku Kelicardina, krople doustne, -Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Etanol 96% (V/V) 6.2 Niezgodności farmaceutyczne Nie mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonywano badań dotyczących zgodności. 6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze nie wyższej niż 25C. 6.5 Rodzaj i zawartość opakowania Butelka ze szkła barwnego zamknięta zakrętką z kroplomierzem z PE, zawierająca 40 g leku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Rutoven, Żel, 20 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Rutoven 20 mg/g żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: trokserutyna (Troxerutinum) 20 mg/g Substancje pomocnicze o znanym działaniu: etylu parahydroksybenzoesan, bronopol. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel
- CHPL leku Rutoven, Żel, 20 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Produkt stosowany w leczeniu przewlekłej niewydolności żylnej i jej objawach, obrzękach podudzi, uczuciu ciężkości nóg, uczuciu mrowienia, itp.
- CHPL leku Rutoven, Żel, 20 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Nanieść cienką warstwę żelu na skórę, w miejsca dotknięte dolegliwościami związanymi z niewydolnością żylną, obrzękami, uczuciem ciężkości, mrowieniem. Masować delikatnie do całkowitego wchłonięcia. Stosować 3 razy w ciągu doby przez okres 2 – 3 tygodni.
- CHPL leku Rutoven, Żel, 20 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Rutoven, Żel, 20 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stosować na uszkodzoną skórę. Produkt zawiera etylu parahydroksybenzoesan i w związku z tym może powodować reakcje alergiczne (możliwe reakcje typu późnego). Produkt zawiera także bronopol, co może wywołać u osób wrażliwych miejscowe podrażnienie skóry (zapalenie skóry kontaktowe). Nie określono bezpieczeństwa stosowania u dzieci.
- CHPL leku Rutoven, Żel, 20 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Brak danych na temat interakcji z innymi produktami.
- CHPL leku Rutoven, Żel, 20 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ze względu na brak danych potwierdzających bezpieczeństwo stosowania, nie stosować produktu w czasie ciąży i karmienia piersią.
- CHPL leku Rutoven, Żel, 20 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Rutoven nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Rutoven, Żel, 20 mg/gDziałania niepożądane
4.8 Działania niepożądane U osób wrażliwych na trokserutynę może pojawić się zaczerwienienie skóry, pokrzywka. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel. 48 22 49 21 301, fax 48 22 49 21 309, e-mail: ndl@urpl.gov.pl
- CHPL leku Rutoven, Żel, 20 mg/gPrzedawkowanie
4.9 Przedawkowanie Brak danych dotyczących przedawkowania.
- CHPL leku Rutoven, Żel, 20 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki wpływające na elastyczność naczyń, kod ATC: C 05 CA 04 Rutoven żel zawiera trokserutynę, która wykazuje działanie ochronne na naczynia krwionośne, poprzez utrzymanie odpowiedniej ich elastyczności oraz zmniejszanie ich przepuszczalności.
- CHPL leku Rutoven, Żel, 20 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Nie przeprowadzono badań farmakokinetycznych produktu Rutoven żel.
- CHPL leku Rutoven, Żel, 20 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Nie przeprowadzono badań przedklinicznych produktu Rutoven żel. Według danych literaturowych w badaniach toksyczności przewlekłej, przeprowadzonej w ciągu roku na myszach i szczurach przy dawce dobowej 5 mg/kg mc., nie stwierdzono żadnych działań niepożądanych.
- CHPL leku Rutoven, Żel, 20 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Karbomer Etylu parahydroksybenzoesan Bronopol Sodu wodorotlenek Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie stwierdzono niezgodności. 6.3 Okres ważności 3 lata 6 miesięcy – po pierwszym otwarciu 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25ºC. 6.5 Rodzaj i zawartość opakowania Tuba aluminiowa, zawierająca 30 g żelu, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak szczególnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Venotrex, kapsułki twarde, 200 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki twarde zawiera 200 mg trokserutyny (o-β-hydroksyetylorutozydy). 1 kapsułka twarda VENOTREX 300 mg kapsułki twarde zawiera 300 mg trokserutyny (o-β-hydroksyetylorutozydy). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Kapsułka twarda
- CHPL leku Venotrex, kapsułki twarde, 200 mgWskazania do stosowania
4.1. Wskazania do stosowania Leczenie objawowe w przypadku: niewydolności krążenia żylnego i limfatycznego, szczególnie w obrębie kończyn dolnych (uczucie ciężkości nóg, ból, kurcze nocne, żylaki) nasilenia dolegliwości związanych z żylakami odbytu
- CHPL leku Venotrex, kapsułki twarde, 200 mgDawkowanie
4.2. Dawkowanie i sposób podawania Zwykle produkt leczniczy stosuje się następująco: 400 mg (2 kapsułki twarde 200 mg) 3 razy na dobę lub 300 mg (1 kapsułka twarda 300 mg) 4 razy na dobę przez 2 do 4 tygodni. W leczeniu podtrzymującym lub w przypadku nawrotów zaleca się dawkowanie: 400 mg (2 kapsułki twarde 200 mg) 2 razy na dobę lub 300 mg (1 kapsułka twarda 300 mg) 3 razy na dobę. Leczenie podtrzymujące trwa zwykle od 3 do 4 tygodni. Zaleca się stosować lek w trakcie posiłku.
- CHPL leku Venotrex, kapsułki twarde, 200 mgPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Venotrex, kapsułki twarde, 200 mgSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produktu leczniczego nie zaleca się stosować u dzieci. Pacjenci, u których występują obrzęki w okolicach kostek spowodowane chorobami serca, wątroby lub nerek nie powinni stosować produktu leczniczego VENOTREX, ponieważ może nie wystąpić spodziewane działanie terapeutyczne. Substancje pomocnicze Laktoza: Produkt leczniczy nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy. Sód: Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na jedną tabletkę, to znaczy lek uznaje się za „wolny od sodu”. Żółcień pomarańczowa (E110): Produkt leczniczy może powodować reakcje alergiczne.
- CHPL leku Venotrex, kapsułki twarde, 200 mgInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie są znane interakcje trokserutyny z innymi produktami leczniczymi. Trokserutyna nie zmienia działania innych leków, nie wpływa też (w sposób statystycznie istotny) na wyniki podstawowych badań laboratoryjnych.
- CHPL leku Venotrex, kapsułki twarde, 200 mgWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Płodność Lek nie wywiera niekorzystnego wpływu na płodność u kobiet i mężczyzn. Ciąża Brak danych o ewentualnym niekorzystnym działaniu leku na płód. Jednak zgodnie z ogólnie przyjętymi zasadami nie zaleca się stosowania leku w pierwszych trzech miesiącach ciąży. Karmienie piersi? Brak danych o ewentualnym niekorzystnym działaniu leku na noworodka karmionego piersią.
- CHPL leku Venotrex, kapsułki twarde, 200 mgWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów obsługiwania maszyn Trokserutyna nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Venotrex, kapsułki twarde, 200 mgDziałania niepożądane
4.8. Działania niepożądane Działania niepożądane podano poniżej z następującą częstotliwością występowania: bardzo często (≥ 1/10); często (≥1/100, <1/10); niezbyt często (≥1/1000, <1/100); rzadko (≥1/10000, <1/1000); bardzo rzadko (<1/10000) w tym pojedyncze przypadki. Zaburzenia skóry i tkanki podskórnej: Bardzo rzadko: nadwrażliwość na światło, łysienie Rzadko: wysypka skórna, świąd, pokrzywka Zaburzenia żołądka i jelit: Bardzo rzadko: nudności, wymioty Rzadko: wzdęcia, biegunki, bóle brzucha, niestrawność, uczucie dyskomfortu w żołądku Zaburzenia układu nerwowego: Bardzo rzadko: bóle i zawroty głowy, zmęczenie Zaburzenia układu immunologicznego: Bardzo rzadko: wstrząs anafilaktyczny, reakcja rzekomoanafilaktyczna, nadwrażliwość Zaburzenia naczyniowe: Bardzo rzadko: uderzenia gorąca Zaburzenia ogólne i stany w miejscu podania: Bardzo rzadko: zmęczenie, znużenie Zaburzenia mięśniowo-szkieletowe: Bardzo rzadko: bóle stawowe W przypadku wystąpienia opisanych działań niepożądanych zaleca się zmniejszenie dawki o połowę lub okresowe odstawienie leku.
- CHPL leku Venotrex, kapsułki twarde, 200 mgPrzedawkowanie
4.9. Przedawkowanie Nie opisano przypadku przedawkowania o-β-hydroksyetylorutozydów. W razie przedawkowania leku należy spowodować opróżnienie żołądka i zastosować leczenie objawowe.
- CHPL leku Venotrex, kapsułki twarde, 200 mgWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki ochraniające naczynia, bioflawonoidy. Kod ATC: CO5C A04. Substancjami czynnymi trokserutyny są pochodne rutyny (o-β-hydroksyetylorutozydy). Wykazują one działanie osłaniające na ściany naczyń włosowatych, zmniejszają przepuszczalność małych naczyń, co przyczynia się do zmniejszenia obrzęków. Zwiększają napięcie i elastyczność naczyń krwionośnych, przeciwdziałają ich pękaniu. W dużych dawkach zwiększają plastyczność błony krwinek czerwonych i przeciwdziałają agregacji płytek krwi, poprawiając w ten sposób przepływ krwi w małych naczyniach.
- CHPL leku Venotrex, kapsułki twarde, 200 mgWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Trokserutyna podana doustnie wchłania się głównie w obrębie jelita cienkiego. Maksymalne stężenie we krwi występuje po 2 do 3 godzinach. Okres półtrwania leku wynosi od 10 do 18 godzin. Odwracalnie wiąże się z białkami osocza krwi. Ulega przemianom metabolicznym do glukuronianów, aglikonów i kwasów arylooctowych. Produkty tych przemian wydalane są w moczu i w kale. Lek nie przenika do mleka kobiet karmiących. W śladowych ilościach przenika przez łożysko. Nie przenika przez barierę krew - płyn mózgowo-rdzeniowy.
- CHPL leku Venotrex, kapsułki twarde, 200 mgPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Badania toksyczności ostrej przeprowadzone u myszy i szczurów potwierdziły, że o-β-hydroksyetylorutozydy są związkami praktycznie nietoksycznymi. W dawkach do 5,0 g/kg mc. nie stwierdzono objawów ich toksycznego działania.
- CHPL leku Venotrex, kapsułki twarde, 200 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych VENOTREX 200 mg kapsułki twarde: laktoza jednowodna, skrobia ziemniaczana, sodu laurylosiarczan, krzemionka koloidalna bezwodna. Skład kapsułki twardej: erytrozyna (E127), żółcień pomarańczowa (E110), tytanu dwutlenek (E171), żelatyna. VENOTREX 300 mg kapsułki twarde: laktoza jednowodna, skrobia ziemniaczana, sodu laurylosiarczan, krzemionka koloidalna bezwodna. Skład kapsułki twardej: żółcień chinolinowa (E104), żółcień pomarańczowa (E110), tytanu dwutlenek (E171), żelatyna. 6.2. Niezgodności farmaceutyczne Nie dotyczy. 6.3. Okres ważności 2 lata. 6.4. Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5. Rodzaj i zawartość opakowania VENOTREX 200 mg kapsułki twarde - 64 kapsułki twarde w blistrach PVC/PVdC/Aluminium w pudełku tekturowym. VENOTREX 300 mg kapsułki twarde - 50 kapsułek twardych w blistrach PVC/PVdC/Aluminium w pudełku tekturowym. 6.6.
- CHPL leku Venotrex, kapsułki twarde, 200 mgDane farmaceutyczne
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak specjalnych wymagań.
- CHPL leku Venolan, kapsułki twarde, 300 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Venolan, 300 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna kapsułka twarda zawiera 300 mg trokserutyny (Troxerutinum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Kapsułki twarde. Kapsułki twarde, podłużne, barwy różowo-brunatnej. Granulat w kapsułce jest barwy żółtej.
- CHPL leku Venolan, kapsułki twarde, 300 mgWskazania do stosowania
4.1 Wskazania do stosowania Trokserutyna stosowana jest w leczeniu zaburzeń krążenia żylnego i limfatycznego, w zespołach pozakrzepowych, w zapaleniu żył kończyn dolnych, w żylakach kończyn dolnych, w obrzękach pochodzenia żylnego, w owrzodzeniach podudzi, w nadmiernej przepuszczalności naczyń włosowatych, w przypadkach skłonności do wybroczyn i krwotoków.
- CHPL leku Venolan, kapsułki twarde, 300 mgDawkowanie
4.2 Dawkowanie i sposób podawania Podanie doustnie. Zaleca się jedną kapsułkę 300 mg dwa lub trzy razy na dobę po posiłkach. Dawka podtrzymująca - jedna kapsułka 300 mg na dobę po posiłku.
- CHPL leku Venolan, kapsułki twarde, 300 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Venolan, kapsułki twarde, 300 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produktu leczniczego nie stosuje się u dzieci. Pacjenci, u których występują obrzęki w okolicach kostek spowodowane chorobami serca, wątroby lub nerek, nie powinni stosować produktu leczniczego Venolan, ponieważ może u nich nie wystąpić spodziewane działanie lecznicze.
- CHPL leku Venolan, kapsułki twarde, 300 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie stwierdzono interakcji z innymi produktami leczniczymi.
- CHPL leku Venolan, kapsułki twarde, 300 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak jest danych na temat wpływu trokserutyny na płód i przebieg ciąży, dlatego nie zaleca się stosowania produktu leczniczego w całym okresie ciąży. Karmienie piersi? Nie ma dokładnych informacji na temat przechodzenia trokserutyny i jej metabolitów do mleka, dlatego nie zaleca się stosowania produktu leczniczego w okresie karmienia piersią.
- CHPL leku Venolan, kapsułki twarde, 300 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brak danych dotyczących negatywnego wpływu na sprawność psychofizyczną, zdolności prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Venolan, kapsułki twarde, 300 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane występują rzadko (≥1/10 000 do <1/1 000). Zaburzenia żołądka i jelit: nudności (które przemijają, jeśli produkt przyjmowany jest w trakcie posiłku) wzdęcia bóle brzucha Zaburzenia skóry i tkanki podskórnej: pokrzywka zaczerwienienie twarzy nadwrażliwość na światło Zaburzenia układu nerwowego: bóle głowy Zgłaszanie podejrzewanych działań niepożądanych: Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al.
- CHPL leku Venolan, kapsułki twarde, 300 mgDziałania niepożądane
Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Venolan, kapsułki twarde, 300 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania produktu leczniczego Venolan, 300 mg, kapsułki twarde, zaleca się wywołanie wymiotów lub wykonanie płukania żołądka i leczenie objawowe.
- CHPL leku Venolan, kapsułki twarde, 300 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki ochraniające ścianę naczyń, leki wpływające na elastyczność naczyń, bioflawonoidy; kod ATC: C05CA04 Trokserutyna (mieszanina hydroksyetylorutozydów) należy do flawonoiów. Działa ochronnie na naczynia krwionośne i wykazuje działanie lecznicze w mikroangiopatii spowodowanej zaburzeniem krążenia żylnego. W organizmie hamuje utlenianie kwasu askorbowego i pośrednio uczestniczy w syntezie elementów strukturalnych tkanki łącznej - kolagenu. Trokserutyna bierze udział w powstawaniu fizjologicznego inhibitora hialuronidazy - PHI - odpowiedzialnego za prawidłowy stan śródbłonka naczyń (przeciwdziała ich pękaniu). Wpływa na ukrwienie, ułatwiając przepływ krwinek przez naczynia włosowate, oraz hamując agregację płytek krwi i krwinek. Antyagregacyjne działanie trokserutyny może wynikać z hamowania aktywności lipooksygenazy i cyklooksygenazy.
- CHPL leku Venolan, kapsułki twarde, 300 mgWłaściwości farmakodynamiczne
Nie stwierdzono wpływu trokserutyny na aktywność granulocytów u osób z astmą oskrzelową. W badaniach wykazano, że O-(beta-hydroksyetylo)-rutozydy hamują adherencję leukocytów zarówno u osób zdrowych, jak i chorych na miażdżycę zarostową tętnic. Hamowanie zdolności adherencyjnej krwinek białych pod wpływem O-(beta-hydroksyetylo)-rutozydów jest niezależne od aktywności cAMP i tromboksanu w osoczu. Długotrwałe stosowanie flawonoidów może powodować powstawanie przeciwciał skierowanych przeciw flawonoidom. Wykazano w badaniach eksperymentalnych, że trokserutyna wywiera działanie hepatoprotekcyjne podczas jednoczesnego stosowania z kumaryną. Działanie to polega na hamowaniu peroksydacji lipidów wywołanej stosowaniem kumaryny. Ponadto trokserutyna hamuje wytwarzanie reaktywnych nadtlenków i wykazuje działanie kardioprotekcyjne oraz może chronić przed toksycznym wpływem reaktywnych nadtlenków na śródbłonek naczyń.
- CHPL leku Venolan, kapsułki twarde, 300 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Trokserutyna po podaniu doustnym wchłania się z przewodu pokarmowego w postaci niezmienionej lub po odłączeniu fragmentu cukrowego (rutynozy), czyli w postaci aglikonu - hydroksyetylokwercetyny. W badaniu biodostępności wykazano, że po podaniu jednorazowej dawki 0,5 – 4 g mono-3’-hydroksyetylokwercetyny wchłanianie jest proporcjonalne do zastosowanej dawki związku. Na podstawie wykonanego badania porównawczej oceny dostępności biologicznej i parametrów farmakokinetycznych trokserutyny stwierdzono, że maksymalne stężenie (Cmax) trokserutyny występuje po 1 godzinie, natomiast okres półtrwania wynosił 8,73 0,88 godziny. Dystrybucja i metabolizm W organizmie trokserutynę wykrywano w narządach biorących udział w wydalaniu. Trokserutyna nie przechodzi przez barierę krew/mózg. Nie wiadomo, czy u człowieka trokserutyna lub jej metabolit, hydroksyetylokwercetyna, przechodzi przez łożysko i do mleka kobiecego.
- CHPL leku Venolan, kapsułki twarde, 300 mgWłaściwości farmakokinetyczne
W badaniach na zwierzętach wykazano, że trokserutyna w niewielkim stopniu przechodzi przez łożysko i do organizmu płodu, z którego jest szybko eliminowana. Oprócz powstawania pochodnej kwercetyny w przewodzie pokarmowym, metabolizm trokserutyny u człowieka polega na sprzęganiu z kwasem glukuronowym. Eliminacja W badaniu na ochotnikach stwierdzono, że kinetyka eliminacji (T0,5) po podaniu dawki 0,5 – 4 g ma charakter liniowy i nie wykazuje zmian wskazujących na istnienie zależności od dawki. W większości pochodne trokserutyny są wydalane wraz z żółcią do dwunastnicy i mogą podlegać krążeniu wątrobowo-jelitowemu, stąd odznaczają się dosyć długim okresem eliminacji (72 godziny, T0,5 = 8,7 godziny). Tylko w niewielkim stopniu wydalanie zachodzi poprzez nerki po uprzednim sprzęgnięciu z kwasem glukuronowym.
- CHPL leku Venolan, kapsułki twarde, 300 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Trokserutyna wykazuje małą toksyczność ogólną. Dane niekliniczne, uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego i toksycznego wpływu na reprodukcję, nie ujawniają występowania szczególnego zagrożenia dla człowieka.
- CHPL leku Venolan, kapsułki twarde, 300 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Powidon K-25 Magnezu stearynian Talk Skład otoczki: Tytanu dwutlenek (E 171) Żelaza tlenek czerwony (E 172) Żelaza tlenek żółty (E 172) Żelatyna 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25ºC. 6.5 Rodzaj i zawartość opakowania Blistry z folii Aluminium/PVC/PE-PVDC w tekturowym pudełku. 25 lub 50 kapsułek. 6.6 Specjalne środki ostrożności dotyczące usuwania Brak szczególnych wymagań.
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Posorutin, 50 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 50 mg trokserutyny (Troxerutinum) Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krople do oczu, roztwór Przezroczysty, bezbarwny lub lekko żółty roztwór
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Terapia wspomagająca w niedomodze ścian naczyń krwionośnych, występującej np. w retinopatii cukrzycowej i krwawieniach podspojówkowych.
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zakraplać 3 razy na dobę po 1 kropli do worka spojówkowego. Lek przeznaczony do długotrwałej terapii. Sposób podawania Lek należy zakraplać do worka spojówkowego, odciągając lekko dolną powiekę i kierując jednocześnie wzrok ku górze. W czasie zakraplania należy unikać kontaktu końcówki zakraplacza z okiem i skórą twarzy. Po zakropleniu leku butelkę należy starannie zabezpieczyć zakrętką.
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku jednoczesnego stosowania innych produktów leczniczych podawanych do oka, leki należy podawać w odstępie przynajmniej 15 minut. Maści okulistyczne należy podawać jako ostatnie. W przypadku pogorszenia się stanu pacjenta należy ponownie przeanalizować przebieg terapii. Podczas kuracji lekiem Posorutin nie zaleca się noszenia miękkich soczewek kontaktowych. Jeśli jednak brak jest przeciwwskazań do ich używania, przed zakropleniem leku soczewki należy zdjąć i zakroplić lek do worka spojówkowego. Soczewki można ponownie założyć po 15 minutach. Ze względu na możliwość uszkodzenia, należy unikać kontaktu miękkich soczewek z lekiem.
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Dotychczas nieznane.
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Brak wystarczających danych dotyczących stosowania w czasie ciąży i laktacji.
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brak wpływu.
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlDziałania niepożądane
4.8 Działania niepożądane Zaburzenia oka: Rzadko (³ 1/10 000 do < 1/1 000) pieczenie oczu. Bardzo rzadko (³ 1/10 000) mogą wystąpić objawy nadwrażliwości polegające na reakcjach alergicznych na jeden ze składników leku. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa; tel.: +48 22 492 13 01, fax: + 48 22 492 13 09; e-mail: ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlPrzedawkowanie
4.9 Przedawkowanie Dotychczas nie opisano żadnego przypadku przedawkowania. Nie jest znane specyficzne postępowanie lecznicze po przedawkowaniu.
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: preparaty okulistyczne; inne; kod ATC: S01XA20 Trokserutyna jest półsyntetyczną pochodną naturalnej substancji – rutozydu (rutyny, witaminy P). Najważniejszym skutkiem farmakodynamicznym działania trokserutyny jest zmniejszenie kruchości naczyń włosowatych oraz ich przepuszczalności. Mechanizm działania hydroksyetylorutozydu nie jest do końca wyjaśniony. Istotnym czynnikiem w ochronnym wpływie trokserutyny na naczynia krwionośne jest hamujący wpływ na niefizjologiczne, nadmiernie silne działanie hialuronidazy. Enzym ten w warunkach fizjologicznych reguluje gęstość poprzecznego utkania elementów kolagenowych ścian naczyń krwionośnych. Wynikiem wzmożonej aktywności hialuronidazy jest zwiększenie kruchości i przepuszczalności naczyń krwionośnych, zatrzymywanie płynów na zewnątrz naczyń, utrudnienie wymiany substancji w zrębie naczyń. Trokserutyna zapobiega procesom wysiękowym i powstawaniu obrzęków.
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Ze względu na bardzo dobrą rozpuszczalność w wodzie, trokserutynę można stosować w postaci kropli ocznych. Podawana do oka działa w przednim odcinku oraz dyfunduje przez rogówkę. Substancja czynna, która dotrze do surowicy łączy się w około 30% z białkami. Okres półtrwania u zdrowych ochotników wynosi 18 godzin. Trokserutyna nie przenika przez barierę krew-mózg. W badaniach na zwierzętach (myszy) stwierdzono, że jedynie pomijalnie małe ilości przenikają do łożyska. Wchłonięta substancja czynna zostaje szybko przekształcona w glikozyd kwasu glukuronowego. W przewodzie pokarmowym niewchłonięta trokserutyna w większości rozkładana jest przez żółć i zostaje wydalona z kałem.
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Trokserutyna odznacza się bardzo dobrą tolerancją i minimalną toksycznością. LD50 dla szczurów po podaniu doustnym wynosi 27 g/kg, LD95 wynosi 45 g/kg. Badania toksyczności podostrej przeprowadzone na królikach i świnkach morskich (doustnie 1,25 g/kg przez okres 30 dni) i toksyczności subchronicznej u szczurów (doustnie 2,85 g/kg przez 3 miesiące), jak również badanie toksyczności ostrej u ludzi (doustnie, na dobę 3 g przez 3 doby), nie dostarczyły informacji o działaniach niepożądanych. Badanie mutagenności, toksycznego wpływu na płód i teratogenności nie wykazały szkodliwego działania trokserutyny.
- CHPL leku Posorutin, krople do oczu, roztwór, 50 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Chloroheksydyny diglukonianu roztwór 20% Sodu chlorek Disodu edytynian Woda do wstrzykiwań lub Woda wysokooczyszczona 6.2 Niezgodności farmaceutyczne Dotychczas nieznane. 6.3 Okres ważności 2 lata Nie stosować po terminie ważności (informacja na opakowaniu zewnętrznym lub butelce). Okres ważności po pierwszym otwarciu produktu leczniczego: 6 tygodni. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać w oryginalnym opakowaniu. 6.5 Rodzaj i zawartość opakowania Butelka z kroplomierzem z LDPE z zakrętką z HDPE i systemem zamknięcia (OCS) w tekturowym pudełku. 10 ml Edition 06/2016 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO SAPOVEN T, 200 mg + 20 mg glikozydów trójterpenowych w przeliczeniu na bezwodną escynę, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: 200 mg trokserutyny (Troxerutinum), 105,3 mg wyciągu suchego standaryzowanego z Aesculus hippocastanum L., semen (nasiona kasztanowca), co odpowiada 20 mg glikozydów trójterpenowych w przeliczeniu na bezwodną escynę (3,4-16,6:1), ekstrahent: etanol 80% (V/V). Substancja pomocnicza o znanym działaniu: olej sojowy oczyszczony (382,7 mg w kapsułce). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Kapsułka miękka. Kapsułki podłużne barwy jasnobrązowej, o gładkiej, lśniącej powierzchni i specyficznym zapachu.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgWskazania do stosowania
4.1. Wskazania do stosowania Produkt leczniczy stosuje się w objawach przewlekłej niewydolności żylnej kończyn dolnych np. przy uczuciu bólu, obrzęku nóg, nocnych kurczach łydek, uczuciu ciężkości nóg.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgDawkowanie
4.2. Dawkowanie i sposób podawania Dawkowanie Dorośli: 1 kapsułka 3 razy na dobę podczas posiłku. Zalecany okres stosowania wynosi od 3 do 4 tygodni, przy czym lekarz może zalecić kontynuowanie terapii. Dzieci i młodzież: Brak wskazań do stosowania u dzieci w wieku poniżej 12 lat. Nie zaleca się stosowania produktu leczniczego u młodzieży w wieku poniżej 18 lat (patrz punkt 4.4 "Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania"). Sposób podawania Podanie doustne.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować w razie stwierdzonej nadwrażliwości na orzeszki ziemne albo soję.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W przypadku stanu zapalnego skóry, zapalenia żył, podskórnego stwardnienia, silnego bólu, wrzodów, nagłego obrzęku jednej lub obu nóg, niewydolności serca lub nerek, należy skonsultować się z lekarzem. Jeżeli w trakcie stosowania produktu leczniczego objawy ulegną nasileniu lub wystąpią oznaki zakażenia skóry, należy skonsultować się z lekarzem lub farmaceutą. Nie zaleca się stosowania u młodzieży w wieku poniżej 18 lat ze względu na brak danych dotyczących bezpieczeństwa i skuteczności.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Z uwagi na zawartość escyny zachować ostrożność przy stosowaniu produktu leczniczego jednocześnie z lekami nefrotoksycznymi. Escyna może zwiększać ryzyko krwawienia przy jednoczesnym stosowaniu z pochodnymi kumaryny, niesteroidowymi lekami przeciwzapalnymi i heparyną.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Ciąża i karmienie piersi? Nie zaleca się stosowania produktu leczniczego Sapoven T w okresie ciąży i karmienia piersią. Brak danych na temat bezpieczeństwa stosowania escyny i wyciągu z nasion kasztanowca u kobiet w ciąży i w okresie karmienia piersią. Płodność W badaniach na zwierzętach nie wykazano działania teratogennego.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brak danych na temat wpływu produktu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgDziałania niepożądane
4.8. Działania niepożądane Zgłaszano przypadki podrażnienia błony śluzowej żołądka (objawiające się np. nudnościami), które ustępuje, jeżeli produkt leczniczy jest przyjmowany podczas posiłków, a także: napadowe zaczerwienienie twarzy, bóle i zawroty głowy, reakcje alergiczne oraz świąd i wysypkę. Ich częstość występowania nie jest znana. Jeśli wystąpią inne, niewymienione powyżej objawy niepożądane, należy skonsultować się z lekarzem. Zgłaszanie podejrzewanych działań niepożądanych: Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Aleje Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, fax: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgDziałania niepożądane
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgPrzedawkowanie
4.9. Przedawkowanie Brak doniesień na temat przedawkowania wyciągu suchego z nasion kasztanowca i trokserutyny. W przypadkach dużego przedawkowania zalecane jest podanie dużej ilości wody lub mleka, albo też zastosowanie węgla aktywowanego.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: flawonoidy; trokserutyna w połączeniach. Kod ATC: C05CA54 Produkt leczniczy Sapoven T, kapsułki miękkie zawiera trokserutynę w połączeniu z wyciągiem suchym standaryzowanym z nasion kasztanowca (zawierającym 20% escyny). Produkt wpływa na napięcie naczyń żylnych, zmniejsza ich przepuszczalność, usprawnia krążenie żylne, zapobiega zastojom żylnym, działa przeciwobrzękowo i przeciwwysiękowo.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Brak danych na temat właściwości farmakokinetycznych produktu Sapoven T. Biodostępność escyny z wyciągu z nasion kasztanowca po podaniu doustnym wynosi 1,5% podanej dawki. Dzieje się tak ze względu na silny efekt pierwszego przejścia (metabolizm w wątrobie i wydzielanie z żółcią). Największe stężenie we krwi escyna osiąga po ok. 2-3 godzinach po podaniu. Okres półtrwania escyny w osoczu krwi określono na 18 do 21 godzin. Escyna wiąże się z białkami osocza w 84%. Pole powierzchni pod krzywą (AUC) escyny w ciągu pierwszej doby po podaniu wyciągu z nasion kasztanowca wynosiło 84-114%. Escyna nie przenika do płynu mózgowo-rdzeniowego. Z moczem wydalane jest tylko ok. 0,1% escyny z podanej dawki. Badania ze znakowaną trokserutyną wykazały, że jest ona dobrze absorbowana z przewodu pokarmowego. Wydalana jest głównie z żółcią.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Nie przeprowadzono nieklinicznych badań dotyczących bezpieczeństwa stosowania produktu leczniczego Sapoven T. Badania pojedynczych substancji: trokserutyny i wyciągu z nasion kasztanowca wskazują na ich małą toksyczność i dobrą tolerancję. LD50 dla wyciągu z nasion kasztanowca po podaniu doustnym określono u myszy, szczurów, świnek morskich i królików i wyniosła 990-1530 mg/kg m.c. w zależności od gatunku zwierzęcia. Na podstawie badań przeprowadzonych na psach określono maksymalną dawkę bezpieczną na poziomie 30 mg/kg m.c., jaka może być podana doustnie bez powodowania objawów zatrucia. Nie obserwowano objawów toksyczności przewlekłej po podaniu doustnym wyciągu z nasion kasztanowca w dawce 8 (psy) do 40 (szczury) razy większej od dawki terapeutycznej u ludzi. W badaniach teratogenności dopiero dawka 300 mg/kg m.c.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgPrzedkliniczne dane o bezpieczeństwie
(30 razy większa od terapeutycznej dawki u ludzi) miała szkodliwy wpływ na płód w postaci redukcji masy ciała noworodków królików. Testy nie wykazały właściwości mutagennych i genotoksycznych escyny. Dawka LD50 dla trokserutyny wyznaczona dla szczura po podaniu dootrzewnowym wynosi 27160 mg/kg m.c. U zwierząt obserwowano zaburzenia ze strony układu sercowo-naczyniowego oraz zaburzenia rytmu serca, zaburzenia przewodnictwa i kardiomegalię. Badania toksyczności trokserutyny po podaniu wielokrotnym zostały przeprowadzone na pawianach. Podawano doustnie mieszaninę trokserutyny i kumaryny (stosunek wagowy 6:1) pawianom w dawkach 100, 300 i 1000 mg/kg masy ciała. Eksperyment prowadzono przez 26 tygodni. Zaobserwowano występowanie wymiotów natychmiastowych lub występujących do 3 godzin po podaniu. Natomiast w grupie zwierząt przyjmujących najwyższą dawkę badanej mieszanki obserwowano u dwóch osobników kilka epizodów zapaści, w jednym przypadku zakończonej zgonem zwierzęcia.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgPrzedkliniczne dane o bezpieczeństwie
U zwierząt, u których odnotowano zapaść stwierdzono powiększenie wątroby i podniesiony poziom enzymów aminopeptydazy leucynowej i karbamylotransferazy ornitynowej. W badaniach u szczurów i świni nad wpływem trokserutyny na płodność, rozwój zarodka i płodu nie zaobserwowano wpływu teratogennego ani efektów embriotoksycznych u potomstwa 1 i 2 generacji. Trokserutyna nie wykazała działania mutagennego wobec żadnej z testowanych bakterii Salmonella Typhimurium.
- CHPL leku Sapoven T, kapsułki miękkie, 200 mg + 20 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Olej sojowy oczyszczony Olej palmowy rafinowany Olej kokosowy uwodorniony Wosk żółty Lecytyna sojowa Otoczka żelatynowa: Żelatyna Glicerol Tytanu dwutlenek (E 171) Tlenek żelaza brązowy (E 172) Tlenek żelaza żółty (E 172) 6.2. Niezgodności farmaceutyczne Nie dotyczy. 6.3. Okres ważności 2 lata 6.4. Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu, w temperaturze nie wyższej niż 25°C. 6.5. Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Aluminium w tekturowym pudełku. 48 szt. (4 blistry po 12 szt.) 6.6. Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Venescin, (118 mg + 20 mg)/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g żelu Venescin zawiera: 11,8 g wyciągu gęstego z Aesculus hippocastanum L., semen (nasiona kasztanowca), (DER 5-6:1) ekstrahent: etanol 70 % V/V 2 g trokserutyny (Troxerutinum) Substancje pomocnicze o znanym działaniu: glikol propylenowy - 8,0 g metylu parahydroksybenzoesan - 0,07 g propylu parahydroksybenzoesan - 0,035 g Pełny wykaz substancji pomocniczych, patrz pkt. 6.1 3. POSTAĆ FARMACEUTYCZNA Żel
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gWskazania do stosowania
4.1. Wskazania do stosowania Venescin żel stosuje się w początkowych objawach przewlekłej niewydolności żylnej (w bólu, uczuciu ciężkości i puchnięciu nóg oraz kurczach łydek) oraz w przypadku objawów występujących po urazach (obrzęki, krwiaki).
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gDawkowanie
4.2. Dawkowanie i sposób podawania Lek do stosowania zewnętrznego. Nakładać 2 razy na dobę (zaleca się stosowanie rano i wieczorem). Niewielką ilość żelu - ok. 2 cm, po nałożeniu delikatnie wcierać. Okres trwania kuracji zależy od rodzaju i obrazu klinicznego choroby.
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Leku nie należy stosować na otwarte rany, błony śluzowe i obszary skóry poddane zabiegom napromieniania w radioterapii.
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Lek zawiera: glikol propylenowy - może powodować podrażnienie skóry metylu parahydroksybenzoesan i propylu parahydroksybenzoesan - może powodować reakcje alergiczne (możliwe reakcje typu późnego).
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczący interakcji.
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Ciąża i karmienie piersią. Lek nie powinien być stosowany w okresie ciąży i laktacji bez zasięgnięcia porady lekarskiej. Płodność. Brak danych.
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Venescin żel nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gDziałania niepożądane
4.8. Działania niepożądane Działania niepożądane leku przedstawiono zgodnie z klasyfikacją narządów i układów wg MedDRA oraz częstością występowania: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000) w tym pojedyncze przypadki; nieznana (nie może być określona na podstawie dostępnych danych). Podczas stosowania żelu Venescin mogą wystąpić: Zaburzenia skóry i tkanki podskórnej: podrażnienie i suchość skóry, pokrzywka – częstość nieznana Zaburzenia układu immunologicznego: uogólnione opóźnione odczyny nadwrażliwości takie, jak kontaktowe zapalenie skóry, niekiedy odczyny natychmiastowe z pokrzywką i skurczem oskrzeli – częstość nieznana
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gPrzedawkowanie
4.9. Przedawkowanie Produkt do stosowania zewnętrznego.
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki wpływające na elastyczność naczyń, kod ATC : C 05 CA 54 Brak danych na temat właściwości farmakologicznych produktu Venescin żel. Przyjmuje się, że produkt zawierający połączenie escyny (główny składnik wyciągu z nasion kasztanowca) oraz trokserutyny, wpływa na naczynia żylne m. in. zmniejszając ich przepuszczalność oraz wpływa na napięcie żylne. Zakłada się wystąpienie działania przeciwobrzękowego.
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Badania farmakokinetyki dla żelu Venescin nie zostały przeprowadzone.
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Brak danych.
- CHPL leku Venescin, Żel, (118 mg + 20 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Karbomer (carbopol 5984), sodu wodorotlenek, glicerol, glikol propylenowy, metylu parahydroksybenzoesan, propylu parahydroksybenzoesan, etanol, woda oczyszczona. 6.2. Niezgodności farmaceutyczne Nie dotyczy. 6.3. Okres ważności 3 lata 6.4. Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze nie wyższej niż 25° C. 6.5. Rodzaj i zawartość opakowania Tuba aluminiowa wewnątrz lakierowana zakończona membraną z zakrętką z polietylenu w tekturowym pudełku. Opakowanie zawiera 40 g żelu. 6.6. Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego Brak specjalnych wymagań dotyczących usuwania. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO SAPOVEN T, (20 mg + 10 mg)/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera: 20 mg trokserutyny (Troxerutinum) i 100 mg wyciągu zagęszczonego z nasion kasztanowca Aesculus hippocastanum L., zawierającego 10 mg glikozydów trójterpenowych w przeliczeniu na bezwodną escynę (DER 4:1); rozpuszczalnik ekstrakcyjny: etanol 80% V/V. Substancje pomocnicze o znanym działaniu: 1 g żelu zawiera 100 mg glikolu propylenowego, 1 mg metylu parahydroksybenzoesanu, 0,5 mg propylu parahydroksybenzoesanu oraz cytral (składnik aromatu cytrynowego). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Żel. Żel o barwie żółtej i cytrynowym zapachu.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gWskazania do stosowania
4.1. Wskazania do stosowania Produkt leczniczy stosuje się w przewlekłej niewydolności żylnej w tym: w leczeniu zaburzeń krążenia żylnego w obrębie kończyn dolnych (z objawami obrzęków, uczuciem świądu), w dolegliwościach związanych z żylakami i w stanach przedżylakowych, pomocniczo w obrzękach pourazowych oraz po zabiegach chirurgicznych.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gDawkowanie
4.2. Dawkowanie i sposób podawania Dawkowanie Dorośli: Nałożyć cienką warstwę żelu i wcierać w zmienione chorobowo miejsce 2 do 3 razy na dobę. Jeżeli objawy utrzymują się dłużej niż 2 tygodnie pomimo stosowania produktu leczniczego, należy skonsultować się z lekarzem. Równoczesne stosowanie produktów doustnych, zawierających te same substancje czynne co Sapoven T, żel, należy skonsultować z lekarzem. Dzieci i młodzież: Brak wskazań do stosowania u dzieci w wieku poniżej 12 lat. Nie zaleca się stosowania produktu leczniczego u młodzieży w wieku poniżej 18 lat (patrz punkt 4.4 "Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania"). Sposób podawania Produkt do stosowania miejscowego na skórę.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gPrzeciwwskazania
4.3. Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gSpecjalne środki ostrozności
4.4. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Jeżeli w trakcie stosowania produktu leczniczego objawy ulegną nasileniu lub wystąpią oznaki zakażenia skóry, należy skonsultować się z lekarzem lub farmaceutą. Produktu leczniczego nie należy stosować na otwarte, rozległe rany i uszkodzoną skórę, a także w pobliżu oczu i na błony śluzowe. W przypadku stanu zapalnego skóry, zapalenia żył, podskórnego stwardnienia, silnego bólu, wrzodów, nagłego obrzęku jednej lub obu nóg, niewydolności serca lub nerek, należy skonsultować się z lekarzem. Nie zaleca się stosowania u młodzieży w wieku poniżej 18 lat ze względu na brak danych dotyczących bezpieczeństwa stosowania i skuteczności w tej grupie wiekowej. Szczególne ostrzeżenia dotyczące substancji pomocniczych Glikol propylenowy: Produkt leczniczy zawiera 100 mg glikolu propylenowego w 1 g żelu. Glikol propylenowy może powodować podrażnienie skóry.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gSpecjalne środki ostrozności
Metylu parahydroksybenzoesan i propylu parahydroksybenzoesan: Produkt leczniczy może powodować reakcje alergiczne (możliwe reakcje typu późnego). Cytral: Produkt leczniczy zawiera cytral (składnik aromatu cytrynowego). Cytral może powodować reakcje alergiczne.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gInterakcje
4.5. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Dotychczas nie są znane interakcje z innymi lekami i inne rodzaje interakcji po zastosowaniu miejscowym trokserutyny i wyciągu z nasion kasztanowca.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gWpływ na płodność, ciążę i laktację
4.6. Wpływ na płodność, ciążę i laktację Ciąża i karmienie piersi? Nie zaleca się stosowania produktu leczniczego Sapoven T w okresie ciąży i karmienia piersią. Brak wystarczających danych na temat bezpieczeństwa stosowania escyny i wyciągu z nasion kasztanowca u kobiet w ciąży i w okresie karmienia piersią. Płodność Brak danych dotyczących wpływu na płodność.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gWpływ na zdolność prowadzenia pojazdów
4.7. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Produkt uważany jest za bezpieczny i nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gDziałania niepożądane
4.8. Działania niepożądane Zgłaszano przypadki reakcji nadwrażliwości skóry (swędzenie i rumień) i przemijającego uczucia ciepła, u osób nadwrażliwych może wystąpić pokrzywka. Częstość występowania tych działań niepożądanych nie jest znana. Należy skonsultować się z lekarzem, jeżeli wystąpią inne, niż wymienione powyżej działania niepożądane. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Aleje Jerozolimskie 181C, 02 - 222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gPrzedawkowanie
4.9. Przedawkowanie Nie są znane przypadki przedawkowania u ludzi.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gWłaściwości farmakodynamiczne
5.1. Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: trokserutyna w połączeniach, kod ATC: C05CA 54 Produkt Sapoven T, żel, zawiera trokserutynę oraz nieistotny dla działania farmakodynamicznego dodatek substancji roślinnej - zagęszczony wyciąg z nasion kasztanowca. Trokserutyna jest flawonową pochodną O-β-hydroksyetylorutozydu. Wykazuje działanie przeciwwysiękowe, uszczelnia ściany naczyń, zmniejsza ich przepuszczalność (wzmacnia barierę naczyniową), poprawia parametry reologiczne krwi. Ponadto jest antyoksydantem. Wyciąg z nasion kasztanowca zawiera głównie escynę należącą do acylowanych glikozydów trójterpenowych (saponiny). Wyciąg z nasion kasztanowca zwyczajnego (Aesculus hippocastani) stosowany jest tradycyjnie w terapii chorób naczyniowych. Produkt Sapoven T działa przeciwobrzękowo, uszczelniająco i tonizująco na żyły, poprawia stan śródbłonków naczyń włosowatych zmniejszając ich przepuszczalność i łamliwość.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gWłaściwości farmakokinetyczne
5.2. Właściwości farmakokinetyczne Brak jest dostępnych danych farmakokinetycznych u ludzi na temat trokserutyny stosowanej zewnętrznie. Brak jest danych farmakokinetycznych dotyczących zewnętrznego podania ekstraktów z nasion kasztanowca u ludzi. Dostępne dane dotyczą wyłącznie zwierząt (świń). Stwierdzono niskie wchłanianie escyny przez skórę świń (całkowita absorpcja escyny przez skórę nie przekraczała 2,5% escyny z podanej dawki). Tylko 1% escyny z zastosowanej dawki był wydalany z moczem w ciągu 24 godzin po podaniu, natomiast w tkankach w pobliżu miejsca podania stężenie escyny było wysokie.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gPrzedkliniczne dane o bezpieczeństwie
5.3. Przedkliniczne dane o bezpieczeństwie Brak danych.
- CHPL leku Sapoven T, Żel, (20 mg + 10 mg)/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych Glikol propylenowy (E 1520) Trometamol Karbomer Metylu parahydroksybenzoesan (E 218) Propylu parahydroksybenzoesan Disodu edetynian Aromat cytrynowy (zawiera cytral) Woda oczyszczona 6.2. Niezgodności farmaceutyczne Nie dotyczy. 6.3. Okres ważności 3 lata 6.4. Specjalne środki ostrożności podczas przechowywania Produkt należy przechowywać w zamkniętym, oryginalnym opakowaniu, w temperaturze poniżej 25°C. 6.5. Rodzaj i zawartość opakowania 30 g, tuba aluminiowa w tekturowym pudełku. 6.6. Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
Zobacz również:
- Dawkowanie leku
Diosmina to substancja stosowana w leczeniu problemów z krążeniem żylnym, takich jak uczucie ciężkości nóg, ból czy żylaki, a także w łagodzeniu objawów hemoroidów. Różne postacie leku i drogi podania pozwalają na dostosowanie dawkowania do indywidualnych potrzeb pacjenta. Poznaj szczegółowe schematy dawkowania diosminy, z uwzględnieniem różnych wskazań i grup pacjentów.
- Działania niepożądane i skutki uboczne
Diosmina jest szeroko stosowana w leczeniu dolegliwości żylnych i hemoroidalnych. Większość działań niepożądanych tej substancji ma łagodny przebieg i dotyczy głównie przewodu pokarmowego, układu nerwowego oraz skóry. Zdarza się, że pojawiają się objawy takie jak biegunka, nudności czy bóle głowy, jednak najczęściej nie wymagają one odstawienia leku. Warto poznać możliwe działania niepożądane, aby móc je rozpoznać i odpowiednio na nie zareagować.
- Mechanizm działania
Diosmina to substancja wykorzystywana przede wszystkim w leczeniu problemów z krążeniem żylnym i żylakami. Jej mechanizm działania polega na wzmacnianiu naczyń krwionośnych, poprawie elastyczności żył oraz ochronie ich ścian przed uszkodzeniami. Dzięki temu pomaga łagodzić objawy, takie jak uczucie ciężkości, ból czy obrzęki nóg, a także wspiera leczenie żylaków odbytu. Diosmina działa zarówno na poziomie dużych żył, jak i drobnych naczyń włosowatych, co przekłada się na poprawę komfortu życia pacjentów z przewlekłą niewydolnością żylną.
- Porównanie substancji czynnych
Diosmina, dobezylan wapnia i trokserutyna to substancje czynne stosowane w leczeniu przewlekłej niewydolności żylnej i związanych z nią dolegliwości, takich jak obrzęki, ból czy uczucie ciężkości nóg. Choć należą do tej samej grupy leków naczyniowych, różnią się nie tylko mechanizmem działania, ale także wskazaniami, bezpieczeństwem stosowania w różnych grupach pacjentów oraz dostępnością w różnych postaciach i drogach podania. Poznaj najważniejsze podobieństwa i różnice między tymi trzema popularnymi substancjami, aby lepiej zrozumieć ich zastosowanie i ograniczenia w codziennej terapii.
- Profil bezpieczeństwa
Diosmina to substancja stosowana przede wszystkim w leczeniu problemów z krążeniem żylnym, takich jak żylaki kończyn dolnych czy hemoroidy. Jej profil bezpieczeństwa jest korzystny – większość osób może przyjmować diosminę bez większych obaw o działania niepożądane. Jednak w niektórych sytuacjach, takich jak ciąża, karmienie piersią czy przyjmowanie określonych leków, należy zachować szczególną ostrożność. Poznaj najważniejsze zasady bezpiecznego stosowania diosminy oraz sytuacje, w których należy być czujnym.
- Przeciwwskazania
Diosmina to substancja czynna stosowana w leczeniu problemów z krążeniem żylnym, takich jak żylaki kończyn dolnych czy hemoroidy. Jej działanie polega na wzmacnianiu ścian naczyń krwionośnych i poprawie krążenia. Mimo szerokiego zastosowania, nie każdy może ją przyjmować – istnieją konkretne przeciwwskazania, które należy znać przed rozpoczęciem terapii. Poznaj, kiedy diosmina jest bezwzględnie przeciwwskazana, w jakich przypadkach należy zachować ostrożność oraz na co szczególnie zwrócić uwagę, wybierając lek z tą substancją.
- Stosowanie u dzieci
Diosmina to substancja stosowana głównie w leczeniu dolegliwości związanych z niewydolnością żylną i żylakami odbytu. Choć jest powszechnie używana u dorosłych, jej bezpieczeństwo stosowania u dzieci nie zostało potwierdzone. W opisach leków z diosminą brak jest wskazań pediatrycznych, a dostępne produkty są przeznaczone wyłącznie dla osób dorosłych. Poznaj szczegóły dotyczące bezpieczeństwa stosowania diosminy u najmłodszych pacjentów oraz dowiedz się, dlaczego należy zachować szczególną ostrożność w tej grupie wiekowej.
- Stosowanie u kierowców
Diosmina to substancja czynna często stosowana w leczeniu problemów z krążeniem żylnym. Wiele osób zastanawia się, czy przyjmowanie leków z diosminą może wpływać na bezpieczeństwo prowadzenia samochodu lub obsługi maszyn. Poznaj fakty na temat jej wpływu na zdolność do wykonywania codziennych czynności wymagających skupienia i koordynacji.
- Stosowanie w ciąży
Stosowanie leków w okresie ciąży i karmienia piersią zawsze powinno być poprzedzone dokładną oceną bezpieczeństwa, ponieważ wiele substancji czynnych może wpływać na rozwijające się dziecko. Diosmina, popularny składnik preparatów poprawiających krążenie żylne, również wymaga rozwagi w tych szczególnych okresach życia kobiety. Poznaj, co mówią badania i oficjalne zalecenia dotyczące diosminy w ciąży i podczas laktacji, z uwzględnieniem różnych postaci leku i potencjalnego wpływu na płód oraz niemowlę.
- Wskazania - na co działa?
Diosmina to substancja, która wspiera prawidłowe krążenie w żyłach, pomagając w leczeniu przewlekłej niewydolności żylnej oraz dolegliwości związanych z żylakami odbytu. Dzięki swojemu działaniu na naczynia krwionośne, diosmina może przynieść ulgę w takich objawach jak ból, uczucie ciężkości, obrzęki czy kurcze nóg. Wskazania do stosowania diosminy różnią się w zależności od postaci leku, dlatego warto poznać, kiedy jej użycie jest zalecane.
- Rzedawkowanie substancji
Diosmina to substancja stosowana głównie w leczeniu problemów z krążeniem żylnym, takich jak żylaki czy obrzęki nóg. Przedawkowanie diosminy zdarza się bardzo rzadko, jednak może prowadzić do nieprzyjemnych dolegliwości ze strony układu pokarmowego. Dowiedz się, jakie są objawy przedawkowania tej substancji oraz jak postępować w takiej sytuacji, by uniknąć poważniejszych konsekwencji dla zdrowia.
REKLAMA