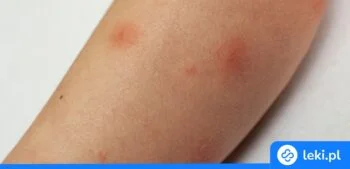
Cetyryzyna to popularna substancja czynna o działaniu przeciwalergicznym, która pomaga łagodzić objawy kataru siennego, alergicznego zapalenia nosa oraz pokrzywki. Jest dostępna w różnych postaciach i dawkach, co pozwala na dobranie odpowiedniego preparatu zarówno dla dorosłych, jak i dzieci. Poznaj najważniejsze informacje na temat jej działania, wskazań i bezpieczeństwa stosowania.
Jak działa cetyryzyna?
Cetyryzyna należy do grupy leków przeciwhistaminowych drugiej generacji, które blokują działanie histaminy odpowiedzialnej za reakcje alergiczne. Dzięki temu skutecznie łagodzi objawy alergii, takie jak katar, swędzenie nosa i oczu oraz wysypki skórne12.
Dostępne postacie leku i dawki
- Tabletki powlekane – najczęściej 10 mg cetyryzyny dichlorowodorku w jednej tabletce. Tabletki można dzielić na pół, co ułatwia dostosowanie dawki3456789.
- Syrop – 5 mg cetyryzyny w 5 ml syropu, przeznaczony szczególnie dla dzieci10.
- Krople doustne, roztwór – 10 mg cetyryzyny w 1 ml lub 0,5 mg w jednej kropli. Umożliwiają precyzyjne dawkowanie, szczególnie u dzieci1112.
- Roztwór doustny – 1 mg/ml, wygodny do podawania dzieciom13.
- Tabletki o przedłużonym uwalnianiu w połączeniu z pseudoefedryną – 5 mg cetyryzyny i 120 mg pseudoefedryny14.
- Lewocetyryzyna – 5 mg w jednej tabletce (lewocetyryzyna to aktywny izomer cetyryzyny)1516.
Cetyryzyna występuje także w preparatach złożonych, np. z pseudoefedryną, co zwiększa zakres jej działania14.
Najważniejsze wskazania
Dawkowanie
Najczęściej stosowaną dawką u dorosłych i młodzieży powyżej 12 lat jest 10 mg raz na dobę. U dzieci dawka zależy od wieku i postaci leku. Dzieci w wieku od 2 do 6 lat zwykle przyjmują 2,5 mg dwa razy dziennie, a dzieci starsze 5 mg dwa razy dziennie171819.
Przeciwwskazania
Nie należy stosować cetyryzyny w przypadku uczulenia na substancję czynną, hydroksyzynę lub pochodne piperazyny, a także przy ciężkiej niewydolności nerek (klirens kreatyniny poniżej 10–15 ml/min, w zależności od produktu)2021.
Profil bezpieczeństwa
Cetyryzyna może być stosowana przez osoby starsze, jeśli ich czynność nerek jest prawidłowa. U pacjentów z niewydolnością nerek konieczne jest dostosowanie dawki. U osób z samą niewydolnością wątroby zwykle nie ma potrzeby modyfikowania dawki2223. Stosowanie w ciąży i podczas karmienia piersią wymaga zachowania ostrożności – lek przenika do mleka matki24. Cetyryzyna nie wpływa istotnie na zdolność prowadzenia pojazdów, ale może wywołać senność, zwłaszcza u wrażliwych osób lub po przekroczeniu zalecanych dawek25.
Przedawkowanie
Przedawkowanie cetyryzyny może powodować senność, pobudzenie, zawroty głowy, biegunkę, bóle głowy, niepokój, tachykardię, drżenie czy zatrzymanie moczu. W razie przedawkowania zaleca się leczenie objawowe, a w niektórych przypadkach płukanie żołądka. Nie ma specyficznego antidotum, a lek nie jest skutecznie usuwany podczas dializy2627.
Interakcje
Cetyryzyna zwykle nie wchodzi w istotne interakcje z innymi lekami. Jednak należy zachować ostrożność podczas jednoczesnego stosowania z alkoholem lub lekami hamującymi ośrodkowy układ nerwowy, ponieważ może nasilać ich działanie uspokajające2829.
Najczęstsze działania niepożądane
- Senność
- Zmęczenie
- Bóle głowy
- Zawroty głowy
- Suchość w ustach
- Bóle brzucha
- Nudności
- Biegunka (szczególnie u dzieci)
- Reakcje skórne, takie jak świąd lub wysypka
Mechanizm działania
Cetyryzyna działa poprzez blokowanie receptorów histaminowych H1, dzięki czemu zapobiega rozwojowi i nasileniu objawów alergii. Wykazuje również działanie przeciwalergiczne, ograniczając napływ komórek zapalnych do skóry i błon śluzowych3031.
Stosowanie w ciąży
Dane na temat bezpieczeństwa stosowania cetyryzyny w ciąży są ograniczone. Lek powinien być stosowany tylko wtedy, gdy korzyść przewyższa potencjalne ryzyko32.
Stosowanie u dzieci
Cetyryzyna jest dopuszczona do stosowania u dzieci od 2. roku życia (w syropie, roztworze lub kroplach), a w postaci tabletek od 6. roku życia. Dawka dobierana jest indywidualnie w zależności od wieku i masy ciała dziecka3334.
Stosowanie u kierowców
U większości osób cetyryzyna nie wpływa na zdolność prowadzenia pojazdów. Jednak w przypadku wystąpienia senności lub innych objawów mogących wpłynąć na koncentrację, należy zachować ostrożność35.
Cetyryzyna – porównanie substancji czynnych
Cetyryzyna, lewocetyryzyna i feksofenadyna to nowoczesne leki przeciwhistaminowe, różniące się zakresem wskazań, możliwością stosowania u dzieci oraz profilem bezpieczeństwa, szczególnie u osób z chor...
czytaj więcej ❯❯- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Zyrtec, 1 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 1 mg cetyryzyny dichlorowodorku. Substancje pomocnicze o znanym działaniu: jeden ml roztworu zawiera 315 mg sorbitolu (E 420) jeden ml roztworu zawiera 1,35 mg metylu parahydroksybenzoesanu (E 218) jeden ml roztworu zawiera 0,15 mg propylu parahydroksybenzoesanu (E 216) jeden ml roztworu zawiera 50 mg glikolu propylenowego (E 1520) Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór doustny Przezroczysty i bezbarwny płyn o słodkawym smaku i aromacie bananowym.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Zyrtec, 1 mg/ml, roztwór doustny jest wskazany u dorosłych i dzieci w wieku 2 lat i starszych: w łagodzeniu objawów dotyczących nosa i oczu, związanych z sezonowym i przewlekłym alergicznym zapaleniem błony śluzowej nosa. w łagodzeniu objawów przewlekłej idiopatycznej pokrzywki.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli: 10 mg raz na dobę [10 ml roztworu doustnego (2 pełne łyżki miarowe)]. Szczególne grupy pacjentów Pacjenci w podeszłym wieku: Brak danych wskazujących na konieczność zmniejszenia dawki leku u osób w podeszłym wieku, jeśli czynność nerek jest u nich prawidłowa. Zaburzenia czynności nerek: Brak danych określających stosunek skuteczności do bezpieczeństwa stosowania u pacjentów z zaburzeniami czynności nerek. Ponieważ cetyryzyna jest wydalana głównie przez nerki (patrz punkt 5.2), w przypadku braku możliwości zastosowania alternatywnego leczenia, odstępy pomiędzy poszczególnymi dawkami muszą być ustalone indywidualnie w zależności od czynności nerek. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. Modyfikacja dawkowania u dorosłych pacjentów z zaburzeniami czynności nerek Prawidłowa czynność nerek: eGFR ≥ 90 ml/min - 10 mg raz na dobę Łagodne zaburzenia czynności nerek: eGFR 60 - < 90 ml/min - 10 mg raz na dobę Umiarkowane zaburzenia czynności nerek: eGFR 30 – < 60 ml/min - 5 mg raz na dobę Ciężkie zaburzenia czynności nerek: eGFR 15 - <30 ml/min, pacjent nie wymagający dializy - 5 mg co drugi dzień Schyłkowa choroba nerek: eGFR <15 ml/min, pacjent wymagający dializy - Stosowanie przeciwwskazane * Szacowany współczynnik filtracji kłębuszkowej (ang.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlDawkowanie
estimated Glomerular Filtration Rate, eGFR) Zaburzenia czynności wątroby: Nie ma konieczności dostosowania dawki u pacjentów, u których występują wyłącznie zaburzenia czynności wątroby. U pacjentów z zaburzeniami czynności wątroby oraz z zaburzeniami czynności nerek zaleca się dostosowanie dawki (patrz powyżej: „Zaburzenia czynności nerek”). Dzieci i młodzież: Dzieci w wieku od 2 do 6 lat: 2,5 mg dwa razy na dobę [2,5 ml roztworu doustnego dwa razy na dobę (pół łyżki miarowej dwa razy na dobę)]. Dzieci w wieku od 6 do 12 lat: 5 mg dwa razy na dobę [5 ml roztworu doustnego dwa razy na dobę (pełna łyżka miarowa dwa razy na dobę)]. Młodzież w wieku powyżej 12 lat: 10 mg raz na dobę [10 ml roztworu doustnego (2 pełne łyżki miarowe)]. U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy ustalać indywidualnie na podstawie klirensu kreatyniny, wieku oraz masy ciała pacjenta. Sposób podawania Roztwór można przyjmować doustnie bez rozcieńczania.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, hydroksyzynę lub pochodne piperazyny. Pacjenci ze schyłkową niewydolnością nerek z szacowanym współczynnikiem przesączania kłębuszkowego (estimated Glomerular Filtration Rate, eGFR) poniżej 15 ml/min.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stwierdzono istotnych klinicznie interakcji między alkoholem (w stężeniu 0,5 g/l we krwi) a cetyryzyną stosowaną w dawkach terapeutycznych. Jednakże zaleca się zachowanie ostrożności podczas przyjmowania cetyryzyny jednocześnie z alkoholem. Należy zachować ostrożność u pacjentów z czynnikami ryzyka zatrzymania moczu (np. uszkodzony rdzeń kręgowy, rozrost gruczołu krokowego), ponieważ cetyryzyna może zwiększać ryzyko zatrzymania moczu. Zaleca się ostrożność podczas stosowania u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstąpienie od stosowania leków przeciwhistaminowych na 3 dni przed wykonaniem testów. W przypadku przerwania stosowania cetyryzyny może wystąpić świąd i (lub) pokrzywka, nawet, jeśli objawy te nie występowały przed rozpoczęciem leczenia.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlSpecjalne środki ostrozności
W niektórych przypadkach objawy te mogą być nasilone i może być konieczne wznowienie leczenia. Objawy powinny ustąpić po wznowieniu leczenia.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na właściwości farmakokinetyczne, farmakodynamiczne oraz profil tolerancji cetyryzyny nie są spodziewane interakcje tego produktu leczniczego z innymi lekami. W przeprowadzonych badaniach interakcji lekowych nie donoszono o występowaniu interakcji farmakodynamicznych ani znaczących interakcji farmakokinetycznych, w szczególności z pseudoefedryną lub teofiliną (400 mg na dobę). Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, natomiast zmniejsza szybkość wchłaniania cetyryzyny. U wrażliwych pacjentów, jednoczesne stosowanie z alkoholem lub lekami o działaniu hamującym na ośrodkowy układ nerwowy, może dodatkowo zmniejszać zdolność reagowania i koncentrację. Cetyryzyna nie nasila jednak działania alkoholu (w stężeniu 0,5 g/l we krwi).
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Prospektywnie zebrane dane dotyczące stosowania cetyryzyny w okresie ciąży nie wskazują na zwiększone działanie toksyczne w stosunku do matki, płodu lub zarodka. Badania przeprowadzone na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy. Należy zachować ostrożność podczas przepisywania cetyryzyny kobietom w ciąży. Karmienie piersi? Cetyryzyna przenika do mleka matki. U niemowląt karmionych piersią nie można wykluczyć zagrożenia wystąpienia działań niepożądanych. Cetyryzyna przenika do mleka matki w stężeniach stanowiących 25 do 90% stężenia leku w osoczu (w zależności od czasu pobierania próbek po podaniu). Dlatego należy zachować ostrożność podczas przepisywania cetyryzyny u kobiet karmiących piersią.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlWpływ na płodność, ciążę i laktację
Płodność Dane dotyczące wpływu na płodność u ludzi są ograniczone, nie stwierdzono jednak zagrożenia dla bezpieczeństwa. Dane z badań na zwierzętach nie wskazują na zagrożenie dla bezpieczeństwa w zakresie rozrodczości u ludzi.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Obiektywne badania z zastosowaniem cetyryzyny w zalecanej dawce 10 mg nie wykazały istotnego klinicznie wpływu na zdolność prowadzenia pojazdów, odczuwanie senności oraz sprawność psychofizyczną. Pacjenci, u których wystąpiła senność powinni jednak unikać prowadzenia pojazdów, wykonywania potencjalnie niebezpiecznych czynności oraz obsługiwania maszyn. Pacjenci powinni zwrócić uwagę na reakcję organizmu na lek oraz nie powinni stosować dawek większych niż zalecane.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne W badaniach klinicznych wykazano, że cetyryzyna w zalecanych dawkach wywołuje działania niepożądane ze strony ośrodkowego układu nerwowego o nieznacznym nasileniu, w tym senność, zmęczenie, bóle i zawroty głowy. W niektórych przypadkach obserwowano paradoksalne pobudzenie ośrodkowego układu nerwowego. Mimo iż cetyryzyna jest selektywnym antagonistą obwodowych receptorów H1 i jest praktycznie pozbawiona aktywności cholinolitycznej, zgłaszano pojedyncze przypadki trudności w oddawaniu moczu, zaburzeń akomodacji oka i suchości błony śluzowej jamy ustnej. Zgłaszano przypadki zaburzeń czynności wątroby ze zwiększoną aktywnością enzymów wątrobowych i ze zwiększonym stężeniem bilirubiny. W większości przypadków ustępowały one po przerwaniu przyjmowania cetyryzyny dichlorowodorku.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlDziałania niepożądane
Zestawienie działań niepożądanych Dostępne są ilościowe dane dotyczące bezpieczeństwa z badań klinicznych prowadzonych metodą podwójnie ślepej próby, porównujących cetyryzynę z placebo oraz innymi lekami przeciwhistaminowymi stosowanymi w zalecanych dawkach (10 mg na dobę dla cetyryzyny). W badaniach uczestniczyło ponad 3 200 pacjentów leczonych cetyryzyną. W badaniach kontrolowanych placebo, z zastosowaniem cetyryzyny w dawce 10 mg obserwowano następujące działania niepożądane, występujące z częstością 1% lub większą: Działania niepożądane (zgodnie z terminologią działań niepożądanych wg WHO) Cetyryzyna 10 mg (n=3260) Placebo (n=3061) Zaburzenia ogólne i stany w miejscu podania Zmęczenie: 1,63% (Cetyryzyna), 0,95% (Placebo) Zaburzenia układu nerwowego Zawroty głowy: 1,10% (Cetyryzyna), 0,98% (Placebo) Ból głowy: 7,42% (Cetyryzyna), 8,07% (Placebo) Zaburzenia żołądka i jelit Ból brzucha: 0,98% (Cetyryzyna), 1,08% (Placebo) Suchość błony śluzowej jamy ustnej: 2,09% (Cetyryzyna), 0,82% (Placebo) Nudności: 1,07% (Cetyryzyna), 1,14% (Placebo) Zaburzenia psychiczne Senność: 9,63% (Cetyryzyna), 5,00% (Placebo) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zapalenie gardła: 1,29% (Cetyryzyna), 1,34% (Placebo) Mimo iż senność występowała statystycznie częściej u pacjentów stosujących cetyryzynę niż w grupie otrzymującej placebo, w większości przypadków miała ona nasilenie łagodne do umiarkowanego.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlDziałania niepożądane
Inne, obiektywne badania nie wykazały wpływu cetyryzyny w zalecanych dawkach dobowych na zwykłą, codzienną aktywność młodych, zdrowych ochotników. Dzieci i młodzież Działania niepożądane występujące z częstością 1% lub większą u dzieci w wieku od 6 miesięcy do 12 lat, stwierdzone w badaniach klinicznych kontrolowanych placebo, to: Działania niepożądane (zgodnie z terminologią działań niepożądanych wg WHO) Cetyryzyna (n=1656) Placebo (n=1294) Zaburzenia żołądka i jelit Biegunka: 1,0% (Cetyryzyna), 0,6% (Placebo) Zaburzenia psychiczne Senność: 1,8% (Cetyryzyna), 1,4% (Placebo) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zapalenie błony śluzowej nosa: 1,4% (Cetyryzyna), 1,1% (Placebo) Zaburzenia ogólne i stany w miejscu podania Zmęczenie: 1,0% (Cetyryzyna), 0,3% (Placebo) Dane pochodzące z okresu po wprowadzeniu leku do obrotu Oprócz wymienionych powyżej działań niepożądanych występujących podczas badań klinicznych, po wprowadzeniu leku do obrotu, zgłaszano następujące przypadki działań niepożądanych.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlDziałania niepożądane
Działania niepożądane opisano zgodnie z klasyfikacją układów i narządów MedDRA, a ich częstość oszacowano na podstawie danych dostępnych po wprowadzeniu produktu leczniczego do obrotu. Częstość występowania określono następująco: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego Bardzo rzadko: trombocytopenia Zaburzenia układu immunologicznego Rzadko: reakcje nadwrażliwości Bardzo rzadko: wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania Częstość nieznana: zwiększenie apetytu Zaburzenia psychiczne Niezbyt często: pobudzenie Rzadko: zachowanie agresywne, splątanie, depresja, omamy, bezsenność Bardzo rzadko: tiki Częstość nieznana: myśli samobójcze, koszmary senne Zaburzenia układu nerwowego Niezbyt często: parestezja Rzadko: drgawki Bardzo rzadko: zaburzenia smaku, omdlenie, drżenie, dystonia, dyskineza Częstość nieznana: amnezja, osłabienie pamięci Zaburzenia oka Bardzo rzadko: zaburzenia akomodacji, niewyraźne widzenie, napad mimowolnego patrzenia w górę z rotacją gałek Zaburzenia ucha i błędnika Częstość nieznana: zawroty głowy Zaburzenia serca Rzadko: tachykardia Zaburzenia żołądka i jelit Niezbyt często: biegunka Zaburzenia wątroby i dróg żółciowych Rzadko: nieprawidłowa czynność wątroby (zwiększona aktywność aminotransferaz, fosfatazy alkalicznej, GGTP i zwiększone stężenie bilirubiny) Częstość nieznana: zapalenie wątroby Zaburzenia skóry i tkanki podskórnej Niezbyt często: świąd, wysypka Rzadko: pokrzywka Bardzo rzadko: obrzęk naczynioruchowy, wysypka polekowa Częstość nieznana: ostra uogólniona osutka krostkowa Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Częstość nieznana: bóle stawów, bóle mięśni Zaburzenia nerek i dróg moczowych Bardzo rzadko: bolesne lub utrudnione oddawanie moczu, mimowolne oddawanie moczu Częstość nieznana: zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania Niezbyt często: osłabienie, złe samopoczucie Rzadko: obrzęki Badania diagnostyczne Rzadko: zwiększenie masy ciała Opis wybranych działań niepożądanych Zgłaszano przypadki świądu (intensywnego swędzenia) i (lub) pokrzywki po przerwaniu stosowania cetyryzyny.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181 C, 02-222 Warszawa, tel.: +48 22 49 21 301, faks: +48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy Objawy obserwowane po przedawkowaniu cetyryzyny są związane głównie z działaniem na ośrodkowy układ nerwowy lub mogą wskazywać na działanie przeciwcholinergiczne. Po przyjęciu dawki cetyryzyny co najmniej 5 razy większej od zalecanej dawki dobowej zgłaszano następujące działania niepożądane: splątanie, biegunkę, zawroty głowy, zmęczenie, bóle głowy, złe samopoczucie, rozszerzenie źrenic, świąd, niepokój ruchowy, sedację, senność, osłupienie, tachykardię, drżenie i zatrzymanie moczu. Postępowanie po przedawkowaniu Nie jest znane swoiste antidotum dla cetyryzyny. W razie przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Jeżeli od zażycia dawki leku upłynęło niewiele czasu, można rozważyć wykonanie płukania żołądka. Cetyryzyna nie jest skutecznie usuwana metodą hemodializy.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna Leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny, kod ATC: R06A E07 Mechanizm działania Cetyryzyna, metabolit hydroksyzyny u człowieka, jest silnym i selektywnym antagonistą obwodowych receptorów histaminowych H1. Badania wiązania z receptorem in vitro nie wykazały istotnego powinowactwa do innych receptorów niż H1. Działanie farmakodynamiczne Oprócz działania antagonistycznego w stosunku do receptorów H1, cetyryzyna wykazuje działanie przeciwalergiczne: u pacjentów z nadwrażliwością (atopią) poddawanych prowokacji alergenem, dawka 10 mg podawana raz lub dwa razy na dobę hamuje napływ do skóry i spojówek komórek późnej fazy reakcji zapalnej (eozynofili). Skuteczność kliniczna i bezpieczeństwo stosowania Badania u zdrowych ochotników wykazały, że cetyryzyna w dawkach 5 i 10 mg silnie hamuje reakcję prowadzącą do powstawania bąbli pokrzywkowych i zaczerwienienia, wywołaną śródskórnym podawaniem histaminy w bardzo dużych stężeniach, ale nie ustalono związku tego działania ze skutecznością.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
W sześciotygodniowym, kontrolowanym placebo badaniu z udziałem 186 pacjentów z alergicznym zapaleniem błony śluzowej nosa oraz współistniejącą, łagodną lub umiarkowaną astmą, cetyryzyna stosowana w dawce 10 mg raz na dobę łagodziła objawy zapalenia błony śluzowej nosa i nie wpływała na czynność płuc. Badanie to potwierdza bezpieczeństwo stosowania cetyryzyny u pacjentów z alergią i z łagodną lub umiarkowaną astmą. W badaniu kontrolowanym placebo cetyryzyna podawana w dużej dawce dobowej wynoszącej 60 mg przez siedem dni nie powodowała statystycznie znamiennego wydłużenia odstępu QT. Stosowanie cetyryzyny w zalecanych dawkach poprawia jakość życia pacjentów z przewlekłym i sezonowym alergicznym zapaleniem błony śluzowej nosa. Dzieci i młodzież W trwającym 35 dni badaniu, przeprowadzonym u dzieci w wieku od 5 do 12 lat, nie stwierdzono tolerancji na przeciwhistaminowe działanie cetyryzyny (hamowanie powstawania bąbli pokrzywkowych i zaczerwienienia).
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlWłaściwości farmakodynamiczne
Po przerwaniu leczenia cetyryzyną podawaną wielokrotnie, skóra odzyskuje normalną reaktywność na histaminę w ciągu 3 dni.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Maksymalne stężenie w osoczu w stanie stacjonarnym wynosi około 300 ng/ml i występuje w ciągu 1,0 ± 0,5 h. Rozkład parametrów farmakokinetycznych, takich jak stężenie maksymalne (Cmax) i pole pod krzywą (AUC), jest jednoznacznie zdefiniowany. Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, lecz zmniejsza szybkość wchłaniania cetyryzyny. W przypadku podawania cetyryzyny w postaci roztworu, kapsułek i tabletek, biodostępność jest podobna. Dystrybucja Pozorna objętość dystrybucji wynosi 0,50 l/kg. Cetyryzyna wiąże się z białkami osocza w 93 ± 0,3%. Cetyryzyna nie wpływa na stopień wiązania warfaryny z białkami. Metabolizm Cetyryzyna nie podlega w znaczącym stopniu metabolizmowi pierwszego przejścia. Eliminacja Końcowy okres półtrwania wynosi około 10 godzin. Nie zaobserwowano kumulacji cetyryzyny podczas stosowania dawek dobowych 10 mg przez 10 dni. Około dwie trzecie dawki jest wydalane w postaci niezmienionej z moczem.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlWłaściwości farmakokinetyczne
Liniowość lub nieliniowość Cetyryzyna wykazuje liniową kinetykę w zakresie dawek od 5 do 60 mg. Zaburzenia czynności nerek: Farmakokinetyka leku była podobna u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny powyżej 40 ml/min) oraz u zdrowych ochotników. U pacjentów z umiarkowanymi zaburzeniami czynności nerek okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u zdrowych ochotników. U pacjentów poddawanych hemodializie (klirens kreatyniny mniejszy niż 7 ml/min), którym podano doustnie cetyryzynę w pojedynczej dawce 10 mg, okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u osób zdrowych. Podczas hemodializy cetyryzyna była usuwana z osocza w niewielkim stopniu. Konieczne jest dostosowanie dawkowania u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2).
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlWłaściwości farmakokinetyczne
Zaburzenia czynności wątroby U pacjentów z przewlekłymi chorobami wątroby (marskość żółciowa, choroby dotyczące miąższu wątroby, choroby związane z zastojem żółci), którym podano 10 lub 20 mg cetyryzyny w pojedynczej dawce, okres półtrwania wydłużył się o 50%, a klirens zmniejszył o 40% w porównaniu do osób zdrowych. Dostosowanie dawkowania jest konieczne tylko u tych pacjentów z zaburzeniami czynności wątroby, u których jednocześnie występują zaburzenia czynności nerek. Osoby w podeszłym wieku U 16 ochotników w podeszłym wieku po podaniu doustnie pojedynczej dawki 10 mg okres półtrwania wydłużył się o około 50%, a klirens zmniejszył się o 40% w porównaniu z młodszymi pacjentami. Wydaje się, że zmniejszenie klirensu cetyryzyny u ochotników w podeszłym wieku jest związane z występującym w tej grupie osłabieniem czynności nerek. Dzieci i młodzież U dzieci w wieku od 6 do 12 lat okres półtrwania cetyryzyny wynosił około 6 godzin, a u dzieci w wieku od 2 do 6 lat - 5 godzin.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlWłaściwości farmakokinetyczne
U niemowląt i dzieci w wieku od 6 do 24 miesięcy okres półtrwania jest zmniejszony do 3,1 godziny.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sorbitol ciekły 70% (niekrystalizujący) (E 420) Glicerol (E 422) Glikol propylenowy (E 1520) Sacharyna sodowa Metylu parahydroksybenzoesan (E 218) Propylu parahydroksybenzoesan (E 216) Aromat bananowy 54.330/A (Firmenich) Sodu octan Kwas octowy lodowaty Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 5 lat Po pierwszym otwarciu opakowania: 3 miesiące. 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Butelka ze szkła oranżowego (typ III wg Ph. Eur.) zawierająca: 60, 75, 100, 150 lub 200 ml roztworu, zamknięta białym polipropylenowym wieczkiem zabezpieczającym przed dostępem dzieci, umieszczona w tekturowym pudełku. W opakowaniu znajduje się 5 ml łyżka miarowa z podziałką wyznaczającą objętość 2,5 ml.
- CHPL leku Zyrtec, roztwór doustny, 1 mg/mlDane farmaceutyczne
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Zyrtec, 10 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml kropli doustnych, roztworu zawiera 10 mg cetyryzyny dichlorowodorku, jedna kropla roztworu zawiera 0,5 mg cetyryzyny dichlorowodorku. Substancje pomocnicze o znanym działaniu: jeden ml roztworu zawiera 1,35 mg metylu parahydroksybenzoesanu. jeden ml roztworu zawiera 0,15 mg propylu parahydroksybenzoesanu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krople doustne, roztwór. Przezroczysty i bezbarwny płyn o słodkawym smaku i gorzkim aromacie.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Zyrtec, 10 mg/ml, krople doustne, roztwór jest wskazany u dorosłych i dzieci w wieku 2 lat i starszych: w łagodzeniu objawów dotyczących nosa i oczu, związanych z sezonowym i przewlekłym alergicznym zapaleniem błony śluzowej nosa. w łagodzeniu objawów przewlekłej idiopatycznej pokrzywki.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli: 10 mg raz na dobę (20 kropli). Szczególne grupy pacjentów Pacjenci w podeszłym wieku: Brak danych wskazujących na konieczność zmniejszenia dawki leku u osób w podeszłym wieku, jeśli czynność nerek jest u nich prawidłowa. Zaburzenia czynności nerek: Brak danych określających stosunek skuteczności do bezpieczeństwa stosowania u pacjentów z zaburzeniami czynności nerek. Ponieważ cetyryzyna jest wydalana głównie przez nerki (patrz punkt 5.2), w przypadku braku możliwości zastosowania alternatywnego leczenia, odstępy pomiędzy poszczególnymi dawkami muszą być ustalone indywidualnie w zależności od czynności nerek. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. Modyfikacja dawkowania u dorosłych pacjentów z zaburzeniami czynności nerek Prawidłowa czynność nerek: eGFR ≥ 90 ml/min - 10 mg raz na dobę Łagodne zaburzenia czynności nerek: eGFR 60 - < 90 ml/min - 10 mg raz na dobę Umiarkowane zaburzenia czynności nerek: eGFR 30 – < 60 ml/min - 5 mg raz na dobę Ciężkie zaburzenia czynności nerek: eGFR 15 - <30 ml/min, pacjent nie wymagający dializy - 5 mg co drugi dzień Schyłkowa choroba nerek: eGFR <15 ml/min, pacjent wymagający dializy - Stosowanie przeciwwskazane * Szacowany współczynnik filtracji kłębuszkowej (ang.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlDawkowanie
estimated Glomerular Filtration Rate, eGFR) Zaburzenia czynności wątroby: Nie ma konieczności dostosowania dawki u pacjentów, u których występują wyłącznie zaburzenia czynności wątroby. U pacjentów z zaburzeniami czynności wątroby oraz z zaburzeniami czynności nerek zaleca się dostosowanie dawki (patrz powyżej: „Zaburzenia czynności nerek”). Dzieci i młodzież: Dzieci w wieku od 2 do 6 lat: 2,5 mg dwa razy na dobę (5 kropli dwa razy na dobę). Dzieci w wieku od 6 do 12 lat: 5 mg dwa razy na dobę (10 kropli dwa razy na dobę). Młodzież w wieku 12 lat i powyżej: 10 mg raz na dobę (20 kropli). U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy ustalać indywidualnie na podstawie klirensu kreatyniny, wieku oraz masy ciała pacjenta. Sposób podawania Krople należy wlać na łyżkę lub rozcieńczyć w wodzie i przyjąć doustnie.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlDawkowanie
W przypadku rozcieńczania należy wziąć pod uwagę, że objętość wody, do której dodaje się krople, musi być dostosowana do objętości, jaką pacjent (w szczególności dziecko) jest w stanie połknąć. Rozcieńczony roztwór należy przyjąć bezpośrednio po jego przygotowaniu.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, hydroksyzynę lub pochodne piperyzyny. Pacjenci ze schyłkową niewydolnością nerek z szacowanym współczynnikiem przesączania kłębuszkowego (estimated Glomerular Filtration Rate, eGFR) poniżej 15 ml/min.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stwierdzono istotnych klinicznie interakcji między alkoholem (w stężeniu 0,5 g/l we krwi) a cetyryzyną stosowaną w dawkach terapeutycznych. Jednakże zaleca się zachowanie ostrożności podczas przyjmowania cetyryzyny jednocześnie z alkoholem. Należy zachować ostrożność u pacjentów z czynnikami ryzyka zatrzymania moczu (np. uszkodzony rdzeń kręgowy, rozrost gruczołu krokowego), ponieważ cetyryzyna może zwiększać ryzyko zatrzymania moczu. Zaleca się ostrożność podczas stosowania u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Metylu parahydroksybenzoesan i propylu parahydroksybenzoesan mogą powodować reakcje alergiczne (możliwe reakcje typu późnego). Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstawić leki przeciwhistaminowe na 3 dni przed wykonaniem testów.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlSpecjalne środki ostrozności
W przypadku przerwania stosowania cetyryzyny może wystąpić świąd i (lub) pokrzywka, nawet, jeśli objawy te nie występowały przed rozpoczęciem leczenia. W niektórych przypadkach objawy te mogą być nasilone i może być konieczne wznowienie leczenia. Objawy powinny ustąpić po wznowieniu leczenia.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na właściwości farmakokinetyczne, farmakodynamiczne oraz profil tolerancji cetyryzyny nie są spodziewane interakcje tego produktu leczniczego z innymi lekami. W przeprowadzonych badaniach interakcji lekowych nie donoszono o występowaniu interakcji farmakodynamicznych ani znaczących interakcji farmakokinetycznych, w szczególności z pseudoefedryną lub teofiliną (400 mg na dobę). Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, natomiast zmniejsza szybkość wchłaniania cetyryzyny. U wrażliwych pacjentów, jednoczesne stosowanie z alkoholem lub lekami o działaniu hamującym na ośrodkowy układ nerwowy, może dodatkowo zmniejszać zdolność reagowania i koncentrację. Cetyryzyna nie nasila jednak działania alkoholu (w stężeniu 0,5 g/l we krwi).
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Prospektywnie zebrane dane dotyczące stosowania cetyryzyny w okresie ciąży nie wskazują na zwiększone działanie toksyczne w stosunku do matki, płodu lub zarodka. Badania przeprowadzone na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy. Należy zachować ostrożność podczas przepisywania cetyryzyny kobietom w ciąży. Karmienie piersi? Cetyryzyna przenika do mleka matki. U niemowląt karmionych piersią nie można wykluczyć zagrożenia wystąpienia działań niepożądanych. Cetyryzyna przenika do mleka matki w stężeniach stanowiących od 25 do 90% stężenia leku w osoczu (w zależności od czasu pobierania próbek po podaniu). Dlatego należy zachować ostrożność podczas przepisywania cetyryzyny u kobiet karmiących piersią.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlWpływ na płodność, ciążę i laktację
Płodność Dane dotyczące wpływu na płodność u ludzi są ograniczone, nie stwierdzono jednak zagrożenia dla bezpieczeństwa. Dane z badań na zwierzętach nie wskazują na zagrożenie dla bezpieczeństwa w zakresie rozrodczości u ludzi.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Obiektywne badania z zastosowaniem cetyryzyny w zalecanej dawce 10 mg nie wykazały istotnego klinicznie wpływu na zdolność prowadzenia pojazdów, odczuwanie senności oraz sprawność psychofizyczną. Pacjenci, u których wystąpiła senność, powinni jednak unikać prowadzenia pojazdów, wykonywania potencjalnie niebezpiecznych czynności oraz obsługiwania maszyn. Pacjenci powinni zwrócić uwagę na reakcję organizmu na lek oraz nie powinni stosować dawek większych niż zalecane.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne W badaniach klinicznych wykazano, że cetyryzyna w zalecanych dawkach wywołuje działania niepożądane ze strony ośrodkowego układu nerwowego o nieznacznym nasileniu, w tym senność, zmęczenie, bóle i zawroty głowy. W niektórych przypadkach obserwowano paradoksalne pobudzenie ośrodkowego układu nerwowego. Mimo iż cetyryzyna jest selektywnym antagonistą obwodowych receptorów H1 i jest praktycznie pozbawiona aktywności cholinolitycznej, zgłaszano pojedyncze przypadki trudności w oddawaniu moczu, zaburzeń akomodacji oka i suchości błony śluzowej jamy ustnej. Zgłaszano przypadki zaburzeń czynności wątroby ze zwiększoną aktywnością enzymów wątrobowych i ze zwiększonym stężeniem bilirubiny. W większości przypadków ustępowały one po przerwaniu przyjmowania cetyryzyny dichlorowodorku.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlDziałania niepożądane
Zestawienie działań niepożądanych Dostępne są ilościowe dane dotyczące bezpieczeństwa z badań klinicznych prowadzonych metodą podwójnie ślepej próby, porównujących cetyryzynę z placebo oraz innymi lekami przeciwhistaminowymi stosowanymi w zalecanych dawkach (10 mg na dobę dla cetyryzyny). W badaniach uczestniczyło ponad 3 200 pacjentów leczonych cetyryzyną. W badaniach kontrolowanych placebo, z zastosowaniem cetyryzyny w dawce 10 mg obserwowano następujące działania niepożądane, występujące z częstością 1% lub większą: Działania niepożądane (zgodnie z terminologią działań niepożądanych wg WHO) Cetyryzyna 10 mg (n = 3 260) Placebo (n = 3 061) Zaburzenia ogólne i stany w miejscu podania Zmęczenie: 1,63% (Cetyryzyna), 0,95% (Placebo) Zaburzenia układu nerwowego Zawroty głowy: 1,10% (Cetyryzyna), 0,98% (Placebo) Ból głowy: 7,42% (Cetyryzyna), 8,07% (Placebo) Zaburzenia żołądka i jelit Ból brzucha: 0,98% (Cetyryzyna), 1,08% (Placebo) Suchość błony śluzowej jamy ustnej: 2,09% (Cetyryzyna), 0,82% (Placebo) Nudności: 1,07% (Cetyryzyna), 1,14% (Placebo) Zaburzenia psychiczne Senność: 9,63% (Cetyryzyna), 5,00% (Placebo) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zapalenie gardła: 1,29% (Cetyryzyna), 1,34% (Placebo) Mimo iż senność występowała statystycznie częściej u pacjentów stosujących cetyryzynę niż w grupie otrzymującej placebo, w większości przypadków miała ona nasilenie łagodne do umiarkowanego.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlDziałania niepożądane
Inne, obiektywne badania nie wykazały wpływu cetyryzyny w zalecanych dawkach dobowych na zwykłą, codzienną aktywność młodych, zdrowych ochotników. Dzieci i młodzież Działania niepożądane występujące z częstością 1% lub większą u dzieci w wieku od 6 miesięcy do 12 lat, stwierdzone w badaniach klinicznych kontrolowanych placebo, to: Działania niepożądane (zgodnie z terminologią działań niepożądanych wg WHO) Cetyryzyna (n = 1 656) Placebo (n = 1 294) Zaburzenia żołądka i jelit Biegunka: 1,0% (Cetyryzyna), 0,6% (Placebo) Zaburzenia psychiczne Senność: 1,8% (Cetyryzyna), 1,4% (Placebo) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zapalenie błony śluzowej nosa: 1,4% (Cetyryzyna), 1,1% (Placebo) Zaburzenia ogólne i stany w miejscu podania Zmęczenie: 1,0% (Cetyryzyna), 0,3% (Placebo) Dane pochodzące z okresu po wprowadzeniu leku do obrotu.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlDziałania niepożądane
Oprócz wymienionych powyżej działań niepożądanych występujących podczas badań klinicznych, po wprowadzeniu leku do obrotu, zgłaszano następujące przypadki działań niepożądanych. Działania niepożądane opisano zgodnie z klasyfikacją układów i narządów MedDRA, a ich częstość oszacowano na podstawie danych dostępnych po wprowadzeniu produktu leczniczego do obrotu. Częstość występowania określono następująco: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego Bardzo rzadko: trombocytopenia Zaburzenia układu immunologicznego Rzadko: reakcje nadwrażliwości Bardzo rzadko: wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania Częstość nieznana: zwiększenie apetytu Zaburzenia psychiczne Niezbyt często: pobudzenie Rzadko: zachowanie agresywne, splątanie, depresja, omamy, bezsenność Bardzo rzadko: tiki Częstość nieznana: myśli samobójcze, koszmary senne Zaburzenia układu nerwowego Niezbyt często: parestezja Rzadko: drgawki Bardzo rzadko: zaburzenia smaku, omdlenie, drżenie, dystonia, dyskineza Częstość nieznana: amnezja, osłabienie pamięci Zaburzenia oka Bardzo rzadko: zaburzenia akomodacji, niewyraźne widzenie, napad mimowolnego patrzenia w górę z rotacją gałek Zaburzenia ucha i błędnika Częstość nieznana: zawroty głowy Zaburzenia serca Rzadko: tachykardia Zaburzenia żołądka i jelit Niezbyt często: biegunka Zaburzenia wątroby i dróg żółciowych Rzadko: nieprawidłowa czynność wątroby (zwiększona aktywność aminotransferaz, fosfatazy alkalicznej, GGTP i zwiększone stężenie bilirubiny) Częstość nieznana: zapalenie wątroby Zaburzenia skóry i tkanki podskórnej Niezbyt często: świąd, wysypka Rzadko: pokrzywka Bardzo rzadko: obrzęk naczynioruchowy, wysypka polekowa Częstość nieznana: ostra uogólniona osutka krostkowa Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Częstość nieznana: bóle stawów, bóle mięśni Zaburzenia nerek i dróg moczowych Bardzo rzadko: bolesne lub utrudnione oddawanie moczu, mimowolne oddawanie moczu Częstość nieznana: zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania Niezbyt często: osłabienie, złe samopoczucie Rzadko: obrzęki Badania diagnostyczne Rzadko: zwiększenie masy ciała Opis wybranych działań niepożądanych: Zgłaszano przypadki świądu (intensywnego swędzenia) i (lub) pokrzywki po przerwaniu stosowania cetyryzyny.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181 C, 02-222 Warszawa, tel.: +48 22 49 21 301, faks: +48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy Objawy obserwowane po przedawkowaniu cetyryzyny są związane głównie z działaniem na ośrodkowy układ nerwowy lub mogą wskazywać na działanie przeciwcholinergiczne. Po przyjęciu dawki cetyryzyny co najmniej 5 razy większej od zalecanej dawki dobowej zgłaszano następujące działania niepożądane: splątanie, biegunkę, zawroty głowy, zmęczenie, bóle głowy, złe samopoczucie, rozszerzenie źrenic, świąd, niepokój ruchowy, sedację, senność, osłupienie, tachykardię, drżenie i zatrzymanie moczu. Postępowanie po przedawkowaniu Nie jest znane swoiste antidotum dla cetyryzyny. W razie przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Jeżeli od zażycia dawki leku upłynęło niewiele czasu, można rozważyć wykonanie płukania żołądka. Cetyryzyna nie jest skutecznie usuwana metodą hemodializy.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny, kod ATC: R06A E07 Mechanizm działania Cetyryzyna, metabolit hydroksyzyny u człowieka, jest silnym i selektywnym antagonistą obwodowych receptorów histaminowych H1. Badania wiązania z receptorem in vitro nie wykazały istotnego powinowactwa do innych receptorów niż H1. Działanie farmakodynamiczne Oprócz działania antagonistycznego w stosunku do receptorów H1, cetyryzyna wykazuje działanie przeciwalergiczne: u pacjentów z nadwrażliwością (atopią) poddawanych prowokacji alergenem, dawka 10 mg podawana raz lub dwa razy na dobę hamuje napływ do skóry i spojówek komórek późnej fazy reakcji zapalnej (eozynofili). Skuteczność kliniczna i bezpieczeństwo stosowania Badania u zdrowych ochotników wykazały, że cetyryzyna w dawkach 5 i 10 mg silnie hamuje reakcję prowadzącą do powstawania bąbli pokrzywkowych i zaczerwienienia, wywołaną śródskórnym podawaniem histaminy w bardzo dużych stężeniach, ale nie ustalono związku tego działania ze skutecznością.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakodynamiczne
W sześciotygodniowym, kontrolowanym placebo badaniu z udziałem 186 pacjentów z alergicznym zapaleniem błony śluzowej nosa oraz współistniejącą, łagodną lub umiarkowaną astmą, cetyryzyna stosowana w dawce 10 mg raz na dobę łagodziła objawy zapalenia błony śluzowej nosa i nie wpływała na czynność płuc. Badanie to potwierdza bezpieczeństwo stosowania cetyryzyny u pacjentów z alergią i z łagodną lub umiarkowaną astmą. W badaniu kontrolowanym placebo cetyryzyna podawana w dużej dawce dobowej wynoszącej 60 mg przez siedem dni nie powodowała statystycznie znamiennego wydłużenia odstępu QT. Stosowanie cetyryzyny w zalecanych dawkach poprawia jakość życia pacjentów z przewlekłym i sezonowym alergicznym zapaleniem błony śluzowej nosa. Dzieci i młodzież W trwającym 35 dni badaniu, przeprowadzonym u dzieci w wieku od 5 do 12 lat, nie stwierdzono tolerancji na przeciwhistaminowe działanie cetyryzyny (hamowanie powstawania bąbli pokrzywkowych i zaczerwienienia).
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakodynamiczne
Po przerwaniu leczenia cetyryzyną podawaną wielokrotnie, skóra odzyskuje normalną reaktywność na histaminę w ciągu 3 dni.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Maksymalne stężenie w osoczu w stanie stacjonarnym wynosi około 300 ng/ml i występuje w ciągu 1,0 ± 0,5 h. Rozkład parametrów farmakokinetycznych, takich jak stężenie maksymalne (Cmax) i pole pod krzywą (AUC), jest jednoznacznie zdefiniowany. Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, lecz zmniejsza szybkość wchłaniania cetyryzyny. W przypadku podawania cetyryzyny w postaci roztworu, kapsułek i tabletek, biodostępność jest podobna. Dystrybucja Pozorna objętość dystrybucji wynosi 0,50 l/kg. Cetyryzyna wiąże się z białkami osocza w 93 ± 0,3%. Cetyryzyna nie wpływa na stopień wiązania warfaryny z białkami. Metabolizm Cetyryzyna nie podlega w znaczącym stopniu metabolizmowi pierwszego przejścia. Eliminacja Końcowy okres półtrwania wynosi około 10 godzin. Nie zaobserwowano kumulacji cetyryzyny podczas stosowania dawek dobowych 10 mg przez 10 dni. Około dwie trzecie dawki jest wydalane w postaci niezmienionej z moczem.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakokinetyczne
Liniowość lub nieliniowość Cetyryzyna wykazuje liniową kinetykę w zakresie dawek od 5 do 60 mg. Zaburzenia czynności nerek Farmakokinetyka leku była podobna u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny powyżej 40 ml/min) oraz u zdrowych ochotników. U pacjentów z umiarkowanymi zaburzeniami czynności nerek okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u zdrowych ochotników. U pacjentów poddawanych hemodializie (klirens kreatyniny mniejszy niż 7 ml/min), którym podano doustnie cetyryzynę w pojedynczej dawce 10 mg, okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u osób zdrowych. Podczas hemodializy cetyryzyna była usuwana z osocza w niewielkim stopniu. Konieczne jest dostosowanie dawkowania u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2).
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakokinetyczne
Zaburzenia czynności wątroby U pacjentów z przewlekłymi chorobami wątroby (marskość żółciowa, choroby dotyczące miąższu wątroby, choroby związane z zastojem żółci), którym podano 10 lub 20 mg cetyryzyny w pojedynczej dawce, okres półtrwania wydłużył się o 50%, a klirens zmniejszył o 40% w porównaniu do osób zdrowych. Dostosowanie dawkowania jest konieczne tylko u tych pacjentów z zaburzeniami czynności wątroby, u których jednocześnie występują zaburzenia czynności nerek. Osoby w podeszłym wieku U 16 ochotników w podeszłym wieku po podaniu doustnie pojedynczej dawki 10 mg okres półtrwania wydłużył się o około 50%, a klirens zmniejszył się o 40% w porównaniu z młodszymi pacjentami. Wydaje się, że zmniejszenie klirensu cetyryzyny u ochotników w podeszłym wieku jest związane z występującym w tej grupie osłabieniem czynności nerek. Dzieci i młodzież U dzieci w wieku od 6 do 12 lat okres półtrwania cetyryzyny wynosił około 6 godzin, a u dzieci w wieku od 2 do 6 lat - 5 godzin.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakokinetyczne
U niemowląt i dzieci w wieku od 6 do 24 miesięcy okres półtrwania jest zmniejszony do 3,1 godziny.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Glicerol Glikol propylenowy Sacharyna sodowa Metylu parahydroksybenzoesan (E 218) Propylu parahydroksybenzoesan (E 216) Sodu octan Kwas octowy lodowaty Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 5 lat. Po pierwszym otwarciu opakowania: 3 miesiące. 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Butelka ze szkła oranżowego (typ III wg Ph. Eur.) zawierająca: 10, 15 lub 20 ml roztworu, wraz z białym kroplomierzem z polietylenu o niskiej gęstości, zamknięta białym, polipropylenowym wieczkiem zabezpieczającym przed dostępem dzieci, umieszczona w tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań.
- CHPL leku Zyrtec, krople doustne, roztwór, 10 mg/mlDane farmaceutyczne
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZ NICZEGO Zyrtec, 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 10 mg cetyryzyny dichlorowodorku. Substancja pomocnicza o znanym działaniu: jedna tabletka powlekana zawiera 66,40 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki powlekane. Biała, podłużna tabletka powlekana z rowkiem dzielącym i logo Y-Y. Tabletki można podzielić na 2 równe dawki.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgWskazania do stosowania
4.1 Wskazania do stosowania Zyrtec, 10 mg, tabletki powlekane jest wskazany u dorosłych i dzieci w wieku 6 lat i starszych: w łagodzeniu objawów dotyczących nosa i oczu, związanych z sezonowym i przewlekłym alergicznym zapaleniem błony śluzowej nosa. w łagodzeniu objawów przewlekłej idiopatycznej pokrzywki.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie: Dorośli: 10 mg (1 tabletka) raz na dobę. Szczególne grupy pacjentów: Pacjenci w podeszłym wieku: Brak danych wskazujących na konieczność zmniejszenia dawki leku u osób w podeszłym wieku, jeśli czynność nerek jest u nich prawidłowa. Zaburzenia czynności nerek: Brak danych określających stosunek skuteczności do bezpieczeństwa stosowania u pacjentów z zaburzeniami czynności nerek. Ponieważ cetyryzyna jest wydalana głównie przez nerki (patrz punkt 5.2), w przypadku braku możliwości zastosowania alternatywnego leczenia, odstępy pomiędzy poszczególnymi dawkami muszą być ustalone indywidualnie w zależności od czynności nerek. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. Modyfikacja dawkowania u dorosłych pacjentów z zaburzeniami czynności nerek Prawidłowa czynność nerek: eGFR ≥ 90 ml/min - 10 mg raz na dobę Łagodne zaburzenia czynności nerek: eGFR 60 - < 90 ml/min - 10 mg raz na dobę Umiarkowane zaburzenia czynności nerek: eGFR 30 – < 60 ml/min - 5 mg raz na dobę Ciężkie zaburzenia czynności nerek: eGFR 15 - <30 ml/min, pacjent nie wymagający dializy - 5 mg co drugi dzień Schyłkowa choroba nerek: eGFR <15 ml/min, pacjent wymagający dializy - Stosowanie przeciwwskazane * Szacowany współczynnik filtracji kłębuszkowej (ang.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgDawkowanie
estimated Glomerular Filtration Rate, eGFR) Zaburzenia czynności wątroby: Nie ma konieczności dostosowania dawki u pacjentów, u których występują wyłącznie zaburzenia czynności wątroby. U pacjentów z zaburzeniami czynności wątroby oraz z zaburzeniami czynności nerek zaleca się dostosowanie dawki (patrz powyżej: „Zaburzenia czynności nerek”). Dzieci i młodzież: Nie zaleca się stosowania produktu leczniczego w postaci tabletek u dzieci w wieku poniżej 6 lat, ponieważ ta postać farmaceutyczna nie pozwala na odpowiednie dostosowanie dawki. Dzieci w wieku od 6 do 12 lat: 5 mg dwa razy na dobę (pół tabletki dwa razy na dobę). Młodzież w wieku powyżej 12 lat: 10 mg raz na dobę (1 tabletka). U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy ustalać indywidualnie na podstawie klirensu kreatyniny, wieku oraz masy ciała pacjenta. Sposób podawania: Tabletki należy połykać popijając szklanką płynu.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, hydroksyzynę lub pochodne piperazyny. Pacjenci ze schyłkową niewydolnością nerek z szacowanym współczynnikiem przesączania kłębuszkowego (estimated Glomerular Filtration Rate, eGFR) poniżej 15 ml/min.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stwierdzono istotnych klinicznie interakcji między alkoholem (w stężeniu 0,5 g/l we krwi) a cetyryzyną stosowaną w dawkach terapeutycznych. Jednakże zaleca się zachowanie ostrożności podczas przyjmowania cetyryzyny jednocześnie z alkoholem. Należy zachować ostrożność u pacjentów z czynnikami ryzyka zatrzymania moczu (np. uszkodzony rdzeń kręgowy, rozrost gruczołu krokowego), ponieważ cetyryzyna może zwiększać ryzyko zatrzymania moczu. Zaleca się ostrożność podczas stosowania u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstąpienie od stosowania leków przeciwhistaminowych na 3 dni przed wykonaniem testów. Produkt leczniczy nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgSpecjalne środki ostrozności
W przypadku przerwania stosowania cetyryzyny może wystąpić świąd i (lub) pokrzywka, nawet, jeśli objawy te nie występowały przed rozpoczęciem leczenia. W niektórych przypadkach objawy te mogą być nasilone i może być konieczne wznowienie leczenia. Objawy powinny ustąpić po wznowieniu leczenia.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na właściwości farmakokinetyczne, farmakodynamiczne oraz profil tolerancji cetyryzyny nie są spodziewane interakcje tego produktu leczniczego z innymi lekami. W przeprowadzonych badaniach interakcji lekowych nie donoszono o występowaniu interakcji farmakodynamicznych ani znaczących interakcji farmakokinetycznych, w szczególności z pseudoefedryną lub teofiliną (400 mg na dobę). Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, natomiast zmniejsza szybkość wchłaniania cetyryzyny. U wrażliwych pacjentów, jednoczesne stosowanie z alkoholem lub lekami o działaniu hamującym na ośrodkowy układ nerwowy, może dodatkowo zmniejszać zdolność reagowania i koncentrację. Cetyryzyna nie nasila jednak działania alkoholu (w stężeniu 0,5 g/l we krwi).
- CHPL leku Zyrtec, tabletki powlekane, 10 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Prospektywnie zebrane dane dotyczące stosowania cetyryzyny w okresie ciąży nie wskazują na zwiększone działanie toksyczne w stosunku do matki, płodu lub zarodka. Badania przeprowadzone na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy. Należy zachować ostrożność podczas przepisywania cetyryzyny kobietom w ciąży. Karmienie piersi? Cetyryzyna przenika do mleka matki. U niemowląt karmionych piersią nie można wykluczyć zagrożenia wystąpienia działań niepożądanych. Cetyryzyna przenika do mleka matki w stężeniach stanowiących 25 do 90% stężenia leku w osoczu (w zależności od czasu pobierania próbek po podaniu). Dlatego należy zachować ostrożność podczas przepisywania cetyryzyny u kobiet karmiących piersią.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgWpływ na płodność, ciążę i laktację
Płodność Dane dotyczące wpływu na płodność u ludzi są ograniczone, nie stwierdzono jednak zagrożenia dla bezpieczeństwa. Dane z badań na zwierzętach nie wskazują na zagrożenie dla bezpieczeństwa w zakresie rozrodczości u ludzi.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Obiektywne badania z zastosowaniem cetyryzyny w zalecanej dawce 10 mg nie wykazały istotnego klinicznie wpływu na zdolność prowadzenia pojazdów, odczuwanie senności oraz sprawność psychofizyczną. Pacjenci, u których wystąpiła senność, powinni jednak unikać prowadzenia pojazdów, wykonywania potencjalnie niebezpiecznych czynności oraz obsługiwania maszyn. Pacjenci powinni zwrócić uwagę na reakcję organizmu na lek oraz nie powinni stosować dawek większych niż zalecane.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne Podsumowanie W badaniach klinicznych wykazano, że cetyryzyna w zalecanych dawkach wywołuje działania niepożądane ze strony ośrodkowego układu nerwowego o nieznacznym nasileniu, w tym senność, zmęczenie, bóle i zawroty głowy. W niektórych przypadkach obserwowano paradoksalne pobudzenie ośrodkowego układu nerwowego. Mimo iż cetyryzyna jest selektywnym antagonistą obwodowych receptorów H1 i jest praktycznie pozbawiona aktywności cholinolitycznej, zgłaszano pojedyncze przypadki trudności w oddawaniu moczu, zaburzeń akomodacji oka i suchości błony śluzowej jamy ustnej. Zgłaszano przypadki zaburzeń czynności wątroby ze zwiększoną aktywnością enzymów wątrobowych i ze zwiększonym stężeniem bilirubiny. W większości przypadków ustępowały one po przerwaniu przyjmowania cetyryzyny dichlorowodorku.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgDziałania niepożądane
Zestawienie działań niepożądanych Dostępne są ilościowe dane dotyczące bezpieczeństwa z badań klinicznych prowadzonych metodą podwójnie ślepej próby, porównujących cetyryzynę z placebo oraz innymi lekami przeciwhistaminowymi stosowanymi w zalecanych dawkach (10 mg na dobę dla cetyryzyny). W badaniach uczestniczyło ponad 3 200 pacjentów leczonych cetyryzyną. W badaniach kontrolowanych placebo, z zastosowaniem cetyryzyny w dawce 10 mg obserwowano następujące działania niepożądane, występujące z częstością 1% lub większą: Działania niepożądane (zgodnie z terminologią działań niepożądanych wg WHO) Cetyryzyna 10 mg (n = 3 260) Placebo (n = 3 061) Zaburzenia ogólne i stany w miejscu podania Zmęczenie: 1,63% (Cetyryzyna), 0,95% (Placebo) Zaburzenia układu nerwowego Zawroty głowy: 1,10% (Cetyryzyna), 0,98% (Placebo) Ból głowy: 7,42% (Cetyryzyna), 8,07% (Placebo) Zaburzenia żołądka i jelit Ból brzucha: 0,98% (Cetyryzyna), 1,08% (Placebo) Suchość błony śluzowej jamy ustnej: 2,09% (Cetyryzyna), 0,82% (Placebo) Nudności: 1,07% (Cetyryzyna), 1,14% (Placebo) Zaburzenia psychiczne Senność: 9,63% (Cetyryzyna), 5,00% (Placebo) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zapalenie gardła: 1,29% (Cetyryzyna), 1,34% (Placebo) Mimo iż senność występowała statystycznie częściej u pacjentów stosujących cetyryzynę niż w grupie otrzymującej placebo, w większości przypadków miała ona nasilenie łagodne do umiarkowanego.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgDziałania niepożądane
Inne, obiektywne badania nie wykazały wpływu cetyryzyny w zalecanych dawkach dobowych na zwykłą, codzienną aktywność młodych, zdrowych ochotników. Dzieci i młodzież Działania niepożądane występujące z częstością 1% lub większą u dzieci w wieku od 6 miesięcy do 12 lat, stwierdzone w badaniach klinicznych kontrolowanych placebo, to: Działania niepożądane (zgodnie z terminologią działań niepożądanych wg WHO) Cetyryzyna (n = 1 656) Placebo (n = 1 294) Zaburzenia żołądka i jelit Biegunka: 1,0% (Cetyryzyna), 0,6% (Placebo) Zaburzenia psychiczne Senność: 1,8% (Cetyryzyna), 1,4% (Placebo) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zapalenie błony śluzowej nosa: 1,4% (Cetyryzyna), 1,1% (Placebo) Zaburzenia ogólne i stany w miejscu podania Zmęczenie: 1,0% (Cetyryzyna), 0,3% (Placebo) Dane pochodzące z okresu po wprowadzeniu leku do obrotu Oprócz wymienionych powyżej działań niepożądanych występujących podczas badań klinicznych, po wprowadzeniu leku do obrotu, zgłaszano następujące przypadki działań niepożądanych.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgDziałania niepożądane
Działania niepożądane opisano zgodnie z klasyfikacją układów i narządów MedDRA, a ich częstość oszacowano na podstawie danych dostępnych po wprowadzeniu produktu leczniczego do obrotu. Częstość występowania określono następująco: bardzo często (≥1/10) często (≥1/100 do <1/10) niezbyt często (≥1/1 000 do <1/100) rzadko (≥1/10 000 do <1/1 000) bardzo rzadko (<1/10 000) częstość nieznana (nie może być określona na podstawie dostępnych danych) Zaburzenia krwi i układu chłonnego Bardzo rzadko: trombocytopenia Zaburzenia układu immunologicznego Rzadko: reakcje nadwrażliwości Bardzo rzadko: wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania Częstość nieznana: zwiększenie apetytu Zaburzenia psychiczne Niezbyt często: pobudzenie Rzadko: zachowanie agresywne, splątanie, depresja, omamy, bezsenność Bardzo rzadko: tiki Częstość nieznana: myśli samobójcze, koszmary senne Zaburzenia układu nerwowego Niezbyt często: parestezja Rzadko: drgawki Bardzo rzadko: zaburzenia smaku, omdlenie, drżenie, dystonia, dyskineza Częstość nieznana: amnezja, osłabienie pamięci Zaburzenia oka Bardzo rzadko: zaburzenia akomodacji, niewyraźne widzenie, napad mimowolnego patrzenia w górę z rotacją gałek Zaburzenia ucha i błędnika Częstość nieznana: zawroty głowy Zaburzenia serca Rzadko: tachykardia Zaburzenia żołądka i jelit Niezbyt często: biegunka Zaburzenia wątroby i dróg żółciowych Rzadko: nieprawidłowa czynność wątroby (zwiększona aktywność aminotransferaz, fosfatazy alkalicznej, GGTP i zwiększone stężenie bilirubiny) Częstość nieznana: zapalenie wątroby Zaburzenia skóry i tkanki podskórnej Niezbyt często: świąd, wysypka Rzadko: pokrzywka Bardzo rzadko: obrzęk naczynioruchowy, wysypka polekowa Częstość nieznana: ostra uogólniona osutka krostkowa Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Częstość nieznana: bóle stawów, bóle mięśni Zaburzenia nerek i dróg moczowych Bardzo rzadko: bolesne lub utrudnione oddawanie moczu, mimowolne oddawanie moczu Częstość nieznana: zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania Niezbyt często: osłabienie, złe samopoczucie Rzadko: obrzęki Badania diagnostyczne Rzadko: zwiększenie masy ciała Opis wybranych działań niepożądanych Zgłaszano przypadki świądu (intensywnego swędzenia) i (lub) pokrzywki po przerwaniu stosowania cetyryzyny.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 1 81 C, 02-222 Warszawa, tel.: +48 22 49 21 301, faks: +48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgPrzedawkowanie
4.9 Przedawkowanie Objawy Objawy obserwowane po przedawkowaniu cetyryzyny są związane głównie z działaniem na ośrodkowy układ nerwowy lub mogą wskazywać na działanie przeciwcholinergiczne. Po przyjęciu dawki cetyryzyny co najmniej 5 razy większej od zalecanej dawki dobowej zgłaszano następujące działania niepożądane: splątanie, biegunkę, zawroty głowy, zmęczenie, ból głowy, złe samopoczucie, rozszerzenie źrenic, świąd, niepokój ruchowy, sedację, senność, osłupienie, tachykardię, drżenie i zatrzymanie moczu. Postępowanie po przedawkowaniu Nie jest znane swoiste antidotum dla cetyryzyny. W razie przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Jeżeli od zażycia dawki leku upłynęło niewiele czasu, można rozważyć wykonanie płukania żołądka. Cetyryzyna nie jest skutecznie usuwana metodą hemodializy.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny, kod ATC: R06A E07 Mechanizm działania Cetyryzyna, metabolit hydroksyzyny u człowieka, jest silnym i selektywnym antagonistą obwodowych receptorów histaminowych H1. Badania wiązania z receptorem in vitro nie wykazały istotnego powinowactwa do innych receptorów niż H1. Działanie farmakodynamiczne Oprócz działania antagonistycznego w stosunku do receptorów H1, cetyryzyna wykazuje działanie przeciwalergiczne: u pacjentów z nadwrażliwością (atopią) poddawanych prowokacji alergenem, dawka 10 mg podawana raz lub dwa razy na dobę hamuje napływ do skóry i spojówek komórek późnej fazy reakcji zapalnej (eozynofili). Skuteczność kliniczna i bezpieczeństwo stosowania Badania u zdrowych ochotników wykazały, że cetyryzyna w dawkach 5 i 10 mg silnie hamuje reakcję prowadzącą do powstawania bąbli pokrzywkowych i zaczerwienienia, wywołaną śródskórnym podawaniem histaminy w bardzo dużych stężeniach, ale nie ustalono związku tego działania ze skutecznością.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
W sześciotygodniowym, kontrolowanym placebo badaniu z udziałem 186 pacjentów z alergicznym zapaleniem błony śluzowej nosa oraz współistniejącą, łagodną lub umiarkowaną astmą, cetyryzyna stosowana w dawce 10 mg raz na dobę łagodziła objawy zapalenia błony śluzowej nosa i nie wpływała na czynność płuc. Badanie to potwierdza bezpieczeństwo stosowania cetyryzyny u pacjentów z alergią i z łagodną lub umiarkowaną astmą. W badaniu kontrolowanym placebo cetyryzyna podawana w dużej dawce dobowej wynoszącej 60 mg przez siedem dni nie powodowała statystycznie znamiennego wydłużenia odstępu QT. Stosowanie cetyryzyny w zalecanych dawkach poprawia jakość życia pacjentów z przewlekłym i sezonowym alergicznym zapaleniem błony śluzowej nosa. Dzieci i młodzież W trwającym 35 dni badaniu, przeprowadzonym u dzieci w wieku od 5 do 12 lat, nie stwierdzono tolerancji na przeciwhistaminowe działanie cetyryzyny (hamowanie powstawania bąbli pokrzywkowych i zaczerwienienia).
- CHPL leku Zyrtec, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
Po przerwaniu leczenia cetyryzyną podawaną wielokrotnie, skóra odzyskuje normalną reaktywność na histaminę w ciągu 3 dni.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Maksymalne stężenie w osoczu w stanie stacjonarnym wynosi około 300 ng/ml i występuje w ciągu 1,0 ± 0,5 h. Rozkład parametrów farmakokinetycznych, takich jak stężenie maksymalne (Cmax) i pole pod krzywą (AUC), jest jednoznacznie zdefiniowany. Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, lecz zmniejsza szybkość wchłaniania cetyryzyny. W przypadku podawania cetyryzyny w postaci roztworu, kapsułek i tabletek, biodostępność jest podobna. Dystrybucja Pozorna objętość dystrybucji wynosi 0,50 l/kg. Cetyryzyna wiąże się z białkami osocza w 93 ± 0,3%. Cetyryzyna nie wpływa na stopień wiązania warfaryny z białkami. Metabolizm Cetyryzyna nie podlega w znaczącym stopniu metabolizmowi pierwszego przejścia. Eliminacja Końcowy okres półtrwania wynosi około 10 godzin. Nie zaobserwowano kumulacji cetyryzyny podczas stosowania dawek dobowych 10 mg przez 10 dni. Około dwie trzecie dawki jest wydalane w postaci niezmienionej z moczem.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Liniowość lub nieliniowość Cetyryzyna wykazuje liniową kinetykę w zakresie dawek od 5 do 60 mg. Zaburzenia czynności nerek Farmakokinetyka leku była podobna u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny powyżej 40 ml/min) oraz u zdrowych ochotników. U pacjentów z umiarkowanymi zaburzeniami czynności nerek okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u zdrowych ochotników. U pacjentów poddawanych hemodializie (klirens kreatyniny mniejszy niż 7 ml/min), którym podano doustnie cetyryzynę w pojedynczej dawce 10 mg, okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u osób zdrowych. Podczas hemodializy cetyryzyna była usuwana z osocza w niewielkim stopniu. Konieczne jest dostosowanie dawkowania u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2).
- CHPL leku Zyrtec, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Zaburzenia czynności wątroby U pacjentów z przewlekłymi chorobami wątroby (marskość żółciowa, choroby dotyczące miąższu wątroby, choroby związane z zastojem żółci), którym podano 10 lub 20 mg cetyryzyny w pojedynczej dawce, okres półtrwania wydłużył się o 50%, a klirens zmniejszył o 40% w porównaniu do osób zdrowych. Dostosowanie dawkowania jest konieczne tylko u tych pacjentów z zaburzeniami czynności wątroby, u których jednocześnie występują zaburzenia czynności nerek. Osoby w podeszłym wieku U 16 ochotników w podeszłym wieku po podaniu doustnie pojedynczej dawki 10 mg okres półtrwania wydłużył się o około 50%, a klirens zmniejszył się o 40% w porównaniu z młodszymi pacjentami. Wydaje się, że zmniejszenie klirensu cetyryzyny u ochotników w podeszłym wieku jest związane z występującym w tej grupie osłabieniem czynności nerek. Dzieci i młodzież U dzieci w wieku od 6 do 12 lat okres półtrwania cetyryzyny wynosił około 6 godzin, a u dzieci w wieku od 2 do 6 lat - 5 godzin.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
U niemowląt i dzieci w wieku od 6 do 24 miesięcy okres półtrwania jest zmniejszony do 3,1 godziny.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Celuloza mikrokrystaliczna Laktoza jednowodna Krzemionka koloidalna bezwodna Magnezu stearynian Opadry Y-1-7000, w skład którego wchodzą: Hypromeloza (E 464) Tytanu dwutlenek (E 171) Makrogol 400 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 5 lat. 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Termozgrzewalne, przezroczyste, bezbarwne, fizjologicznie obojętne blistry z folii PVC zgrzane z folią aluminiową, pokrytą warstwą lakieru, umieszczone w tekturowym pudełku. Opakowanie zawiera: 1, 4, 5, 7, 10, 14, 15, 20, 21, 30, 40, 45, 50, 60, 90, 100 lub 100 (10x10) tabletek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań.
- CHPL leku Zyrtec, tabletki powlekane, 10 mgDane farmaceutyczne
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Amertil, tabletki powlekane, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Amertil, 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana produktu leczniczego Amertil zawiera 10 mg cetyryzyny dichlorowodorku. Substancja pomocnicza o znanym działaniu: jedna tabletka powlekana zawiera 80,62 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana Białe, okrągłe, obustronnie wypukłe tabletki powlekane z rowkiem po jednej stronie ułatwiającym podział. Tabletkę można podzielić na dwie równe dawki.
- CHPL leku Amertil, tabletki powlekane, 10 mgWskazania do stosowania
4.1 Wskazania do stosowania U dorosłych oraz dzieci w wieku 6 lat i starszych: cetyryzyna jest wskazana w łagodzeniu objawów dotyczących nosa i oczu, związanych z sezonowym i przewlekłym alergicznym zapaleniem błony śluzowej nosa; cetyryzyna jest wskazana w łagodzeniu objawów przewlekłej idiopatycznej pokrzywki.
- CHPL leku Amertil, tabletki powlekane, 10 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dzieci w wieku od 6 lat do 12 lat: 5 mg dwa razy na dobę (pół tabletki dwa razy na dobę) Dorośli i młodzież w wieku powyżej 12 lat: 10 mg (1 tabletka) raz na dobę Pacjenci w podeszłym wieku: Brak danych wskazujących na konieczność zmniejszenia dawki leku u osób w podeszłym wieku, jeśli czynność nerek jest u nich prawidłowa. Pacjenci z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek: Brak danych określających stosunek skuteczności do bezpieczeństwa stosowania u pacjentów z zaburzeniami czynności nerek. Ponieważ cetyryzyna jest wydalana głównie przez nerki (patrz punkt 5.2), w przypadku braku możliwości zastosowania alternatywnego leczenia, odstępy pomiędzy poszczególnymi dawkami należy ustalać indywidualnie w zależności od czynności nerek. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. Aby skorzystać z tabeli dawkowania, należy obliczyć klirens kreatyniny (Clkr) w ml/min.
- CHPL leku Amertil, tabletki powlekane, 10 mgDawkowanie
Clkr (ml/min) można obliczyć na podstawie stężenia kreatyniny w surowicy krwi (mg/dl), posługując się następującym wzorem: Clkr = [140 – wiek (lata)] x masa ciała (kg) (x 0,85 dla kobiet) / (72 x stężenie kreatyniny w surowicy (mg/dl)) Modyfikacja dawkowania u dorosłych pacjentów z zaburzeniami czynności nerek: Prawidłowa czynność nerek: ≥ 80 - 10 mg raz na dobę Łagodne zaburzenia czynności nerek: 50-79 - 10 mg raz na dobę Umiarkowane zaburzenia czynności nerek: 30-49 - 5 mg na dobę Ciężkie zaburzenia czynności nerek: < 30 - 5 mg co drugi dzień Schyłkowa choroba nerek, pacjenci dializowani: < 10 - Stosowanie przeciwwskazane U dzieci z zaburzeniami czynności nerek dawkę należy ustalić indywidualnie na podstawie klirensu kreatyniny, wieku oraz masy ciała pacjenta. Pacjenci z zaburzeniami czynności wątroby: Nie ma konieczności dostosowania dawki u pacjentów z zaburzeniami czynności wątroby.
- CHPL leku Amertil, tabletki powlekane, 10 mgDawkowanie
Pacjenci z zaburzeniami czynności nerek oraz zaburzeniami czynności wątroby: Zaleca się dostosowanie dawkowania (patrz powyżej: „Pacjenci z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek”). Sposób podawania: Tabletki należy połykać, popijając szklanką płynu.
- CHPL leku Amertil, tabletki powlekane, 10 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, hydroksyzynę lub pochodne piperazyny. Ciężkie zaburzenia czynności nerek z klirensem kreatyniny mniejszym niż 10 ml/min.
- CHPL leku Amertil, tabletki powlekane, 10 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stwierdzono istotnych klinicznie interakcji między alkoholem (w stężeniu 0,5 g/l we krwi) a cetyryzyną stosowaną w dawkach terapeutycznych. Jednakże zaleca się zachowanie ostrożności podczas przyjmowania cetyryzyny jednocześnie z alkoholem. Należy zachować ostrożność u pacjentów z czynnikami ryzyka zatrzymania moczu (np. uszkodzony rdzeń kręgowy, rozrost gruczołu krokowego), ponieważ cetyryzyna może zwiększać ryzyko zatrzymania moczu. Zaleca się ostrożność podczas stosowania u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w skórnych testach alergicznych. Zaleca się odstawić leki przeciwhistaminowe na 3 dni przed planowanym wykonaniem takich testów.
- CHPL leku Amertil, tabletki powlekane, 10 mgSpecjalne środki ostrozności
Dzieci i młodzież: Nie zaleca się stosowania cetyryzyny w postaci tabletek powlekanych u dzieci w wieku poniżej 6 lat, ponieważ ta postać farmaceutyczna nie pozwala na odpowiednie dostosowanie dawki leku. Zaleca się stosowanie cetyryzyny w postaci farmaceutycznej przeznaczonej dla dzieci (np. krople doustne lub roztwór doustny). Substancje pomocnicze: Produkt leczniczy Amertil zawiera laktozę jednowodną. Pacjenci z rzadko występującą dziedziczną nietolerancją galaktozy, niedoborem laktazy (typu Lapp) lub zespołem złego wchłaniania glukozy-galaktozy nie powinni przyjmować tego produktu leczniczego.
- CHPL leku Amertil, tabletki powlekane, 10 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na właściwości farmakokinetyczne, farmakodynamiczne oraz profil tolerancji cetyryzyny nie są spodziewane interakcje tego produktu leczniczego z innymi lekami. W przeprowadzonych badaniach nie zgłaszano występowania interakcji farmakodynamicznych ani znaczących interakcji farmakokinetycznych, w szczególności z pseudoefedryną lub teofiliną (400 mg na dobę). Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, natomiast zmniejsza szybkość wchłaniania cetyryzyny.
- CHPL leku Amertil, tabletki powlekane, 10 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Dane kliniczne dotyczące stosowania cetyryzyny w ciąży są ograniczone. Badania przeprowadzone na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu czy rozwój pourodzeniowy (patrz punkt 5.3). Należy zachować ostrożność przepisując cetyryzynę kobietom w ciąży. Karmienie piersi? Cetyryzyna przenika do mleka w stężeniu stanowiącym 25 do 90% stężenia leku oznaczanego w osoczu, w zależności od czasu pobrania próbki po podaniu leku. Dlatego należy zachować ostrożność przepisując cetyryzynę kobietom karmiącym piersią.
- CHPL leku Amertil, tabletki powlekane, 10 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Obiektywne badania z zastosowaniem cetyryzyny w zalecanej dawce 10 mg nie wykazały istotnego klinicznie wpływu na zdolność prowadzenia pojazdów, odczuwanie senności oraz sprawność psychofizyczną. Pacjenci planujący prowadzenie pojazdów, wykonujący potencjalnie niebezpieczne czynności lub obsługujący maszyny powinni zwrócić uwagę na reakcję organizmu na lek oraz nie powinni stosować dawek większych niż zalecane. U pacjentów wrażliwych, jednoczesne stosowanie cetyryzyny z alkoholem lub lekami o działaniu hamującym na ośrodkowy układ nerwowy może nasilać wpływ leku na zdolność reagowania i koncentracji.
- CHPL leku Amertil, tabletki powlekane, 10 mgDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych wykazano, że cetyryzyna w zalecanych dawkach wywołuje działania niepożądane ze strony ośrodkowego układu nerwowego o nieznacznym nasileniu, w tym senność, zmęczenie, bóle i zawroty głowy. W niektórych przypadkach obserwowano paradoksalne pobudzenie ośrodkowego układu nerwowego. Mimo, iż cetyryzyna jest selektywnym antagonistą obwodowych receptorów H1 i jest praktycznie pozbawiona aktywności cholinolitycznej, zgłaszano pojedyncze przypadki trudności w oddawaniu moczu, zaburzeń akomodacji oka i suchości błony śluzowej jamy ustnej. Zgłaszano przypadki zaburzeń czynności wątroby ze zwiększoną aktywnością enzymów wątrobowych i ze zwiększonym stężeniem bilirubiny. W większości przypadków ustępowały one po przerwaniu przyjmowania cetyryzyny dichlorowodorku.
- CHPL leku Amertil, tabletki powlekane, 10 mgDziałania niepożądane
Badania kliniczne Dostępne są ilościowe dane dotyczące bezpieczeństwa z badań klinicznych prowadzonych metodą podwójnie ślepej próby, porównujących cetyryzynę z placebo oraz innymi lekami przeciwhistaminowymi stosowanymi w zalecanych dawkach (10 mg na dobę dla cetyryzyny). W tych badaniach uczestniczyło ponad 3200 pacjentów leczonych cetyryzyną. W badaniach kontrolowanych placebo, z zastosowaniem cetyryzyny w dawce 10 mg obserwowano następujące działania niepożądane, występujące z częstością 1% lub większą: Działania niepożądane (terminologia działań niepożądanych wg WHO) Cetyryzyna 10 mg (n = 3260) Placebo (n = 3061) Zaburzenia ogólne Zmęczenie: 1,63% (Cetyryzyna), 0,95% (Placebo) Zaburzenia ośrodkowego i obwodowego układu nerwowego Zawroty głowy: 1,10% (Cetyryzyna), 0,98% (Placebo) Ból głowy: 7,42% (Cetyryzyna), 8,07% (Placebo) Zaburzenia żołądka i jelit Ból brzucha: 0,98% (Cetyryzyna), 1,08% (Placebo) Suchość błony śluzowej jamy ustnej: 2,09% (Cetyryzyna), 0,82% (Placebo) Nudności: 1,07% (Cetyryzyna), 1,14% (Placebo) Zaburzenia psychiczne Senność: 9,63% (Cetyryzyna), 5,0% (Placebo) Zaburzenia układu oddechowego Zapalenie gardła: 1,29% (Cetyryzyna), 1,34% (Placebo) Mimo, iż senność występowała statystycznie częściej u pacjentów stosujących cetyryzynę niż w grupie otrzymującej placebo, w większości przypadków miała ona nasilenie łagodne do umiarkowanego.
- CHPL leku Amertil, tabletki powlekane, 10 mgDziałania niepożądane
Inne, obiektywne badania nie wykazały wpływu cetyryzyny w zalecanych dawkach dobowych na aktywność młodych, zdrowych ochotników. Działania niepożądane występujące z częstością 1% lub większą u dzieci w wieku od 6 miesięcy do 12 lat, pochodzące z badań klinicznych kontrolowanych placebo to: Działania niepożądane (terminologia działań niepożądanych wg WHO) Cetyryzyna 10 mg (n = 1656) Placebo (n = 1294) Zaburzenia żołądka i jelit Biegunka: 1,0% (Cetyryzyna), 0,6% (Placebo) Zaburzenia psychiczne Senność: 1,8% (Cetyryzyna), 1,4% (Placebo) Zaburzenia układu oddechowego Zapalenie błony śluzowej nosa: 1,4% (Cetyryzyna), 1,1% (Placebo) Zaburzenia ogólne Zmęczenie: 1,0% (Cetyryzyna), 0,3% (Placebo) Dane pochodzące z okresu po wprowadzeniu leku do obrotu Oprócz wymienionych powyżej działań niepożądanych występujących podczas badań klinicznych, po wprowadzeniu leku do obrotu zgłaszano następujące działania niepożądane.
- CHPL leku Amertil, tabletki powlekane, 10 mgDziałania niepożądane
Działania niepożądane są pogrupowane według klasyfikacji układów i narządów MedDRA, a ich częstość występowania oszacowano na podstawie danych z okresu po wprowadzeniu leku do obrotu. Częstość występowania działań niepożądanych określono następująco: bardzo często (≥1/10) często (≥1/100 do <1/10) niezbyt często (≥1/1 000 do <1/100) rzadko (≥1/10 000 do <1/1 000) bardzo rzadko (<1/10 000) częstość nieznana (nie może być określona na podstawie dostępnych danych) Zaburzenia krwi i układu chłonnego: Bardzo rzadko: małopłytkowość (trombocytopenia) Zaburzenia układu immunologicznego: Rzadko: reakcje nadwrażliwości Bardzo rzadko: wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania Częstość nieznana: zwiększenie apetytu Zaburzenia psychiczne: Niezbyt często: pobudzenie Rzadko: zachowanie agresywne, splątanie, depresja, omamy, bezsenność Bardzo rzadko: tiki Częstość nieznana: myśli samobójcze Zaburzenia układu nerwowego: Niezbyt często: parestezje Rzadko: drgawki Bardzo rzadko: zaburzenia smaku, omdlenie, drżenie, dystonia, dyskineza Częstość nieznana: amnezja, zaburzenia pamięci Zaburzenia oka: Bardzo rzadko: zaburzenia akomodacji, niewyraźne widzenie, rotacja gałek ocznych Zaburzenia ucha i błędnika Częstość nieznana: zawroty głowy Zaburzenia serca: Rzadko: tachykardia Zaburzenia żołądka i jelit: Niezbyt często: biegunka Zaburzenia wątroby i dróg żółciowych: Rzadko: nieprawidłowa czynność wątroby (zwiększona aktywność aminotransferaz, fosfatazy alkalicznej, GGTP (gamma-glutamylotransferazy) i zwiększone stężenie bilirubiny) Zaburzenia skóry i tkanki podskórnej: Niezbyt często: świąd, wysypka Rzadko: pokrzywka Bardzo rzadko: obrzęk naczynioruchowy, wysypka polekowa Zaburzenia nerek i dróg moczowych: Bardzo rzadko: bolesne lub utrudnione oddawanie moczu, mimowolne oddawanie moczu Częstość nieznana: zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania: Niezbyt często: osłabienie, złe samopoczucie Rzadko: obrzęki Badania diagnostyczne: Rzadko: zwiększenie masy ciała Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Amertil, tabletki powlekane, 10 mgDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: +48 22 49 21 301 Faks: +48 22 49 21 309 e-mail: ndl@urpl.gov.pl
- CHPL leku Amertil, tabletki powlekane, 10 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedawkowania Objawy obserwowane po przedawkowaniu cetyryzyny są związane głównie z działaniem na ośrodkowy układ nerwowy lub mogą wskazywać na działanie przeciwcholinergiczne. Po przyjęciu dawki cetyryzyny co najmniej 5 razy większej od zalecanej dawki dobowej zgłaszano następujące działania niepożądane: splątanie, biegunkę, zawroty głowy, zmęczenie, bóle głowy, złe samopoczucie, rozszerzenie źrenic, świąd, niepokój (zwłaszcza ruchowy), sedację, senność, osłupienie, tachykardię, drżenie i zatrzymanie moczu. Postępowanie po przedawkowaniu Swoiste antidotum nie jest znane. W razie przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Jeżeli od zażycia zbyt dużej dawki leku nie minęło zbyt wiele czasu, należy rozważyć wykonanie płukania żołądka. Cetyryzyna nie jest skutecznie usuwana metodą dializy.
- CHPL leku Amertil, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: pochodne piperazyny, kod ATC: R06AE07 Cetyryzyna, metabolit hydroksyzyny u człowieka, jest silnym i selektywnym antagonistą obwodowych receptorów histaminowych H1. Badania wiązania z receptorem in vitro nie wykazały istotnego powinowactwa do innych receptorów niż H1. Oprócz działania antagonistycznego w stosunku do receptorów H1, cetyryzyna wykazuje działanie przeciwalergiczne: u pacjentów z nadwrażliwością (atopią) poddawanych prowokacji alergenem, dawka 10 mg podawana raz lub dwa razy na dobę, hamuje napływ do skóry i spojówek komórek późnej fazy reakcji zapalnej (eozynofili). Badania u zdrowych ochotników wykazały, że cetyryzyna w dawkach 5 mg i 10 mg silnie hamuje reakcję prowadzącą do powstawania bąbli pokrzywkowych i zaczerwienienia, wywołaną śródskórnym podawaniem histaminy w bardzo dużych stężeniach, ale nie ustalono związku tego działania ze skutecznością.
- CHPL leku Amertil, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
W trwającym 35 dni badaniu, przeprowadzonym u dzieci w wieku od 5 do 12 lat nie stwierdzono tolerancji na przeciwhistaminowe działanie cetyryzyny (hamowanie powstawania bąbli pokrzywkowych i zaczerwienienia). Po przerwaniu leczenia cetyryzyną podawaną wielokrotnie skóra odzyskuje normalną reaktywność na histaminę w ciągu 3 dni. W sześciotygodniowym, kontrolowanym placebo badaniu z udziałem 186 pacjentów z alergicznym zapaleniem błony śluzowej nosa oraz współistniejącą, łagodną lub umiarkowaną astmą, cetyryzyna stosowana w dawce 10 mg raz na dobę łagodziła objawy zapalenia błony śluzowej nosa i nie wpływała na czynność płuc. Badanie to potwierdza bezpieczeństwo stosowania cetyryzyny u pacjentów z alergią i z łagodną lub umiarkowaną astmą. W badaniu kontrolowanym placebo cetyryzyna podawana w dużej dawce dobowej wynoszącej 60 mg przez siedem dni nie powodowała statystycznie znamiennego wydłużenia odstępu QT.
- CHPL leku Amertil, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
Stosowanie cetyryzyny w zalecanych dawkach poprawia jakość życia pacjentów z przewlekłym i sezonowym alergicznym zapaleniem błony śluzowej nosa.
- CHPL leku Amertil, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Maksymalne stężenie w osoczu w stanie stacjonarnym wynosi około 300 ng/ml i występuje w ciągu 1,0 ± 0,5 h. Nie zaobserwowano kumulacji cetyryzyny podczas stosowania dawek dobowych 10 mg przez 10 dni. U ochotników rozkład parametrów farmakokinetycznych, takich jak stężenie maksymalne (Cmax) i pole pod krzywą (AUC), jest jednoznacznie zdefiniowany. Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, lecz zmniejsza szybkość wchłaniania cetyryzyny. W przypadku podawania cetyryzyny w postaci roztworu, kapsułek i tabletek, biodostępność jest podobna. Dystrybucja Pozorna objętość dystrybucji wynosi 0,50 l/kg. Cetyryzyna wiąże się z białkami osocza w 93 ± 0,3%. Cetyryzyna nie wpływa na stopień wiązania warfaryny z białkami. Metabolizm Cetyryzyna nie podlega w znaczącym stopniu metabolizmowi pierwszego przejścia. Eliminacja Około dwie trzecie dawki jest wydalane w postaci niezmienionej z moczem.
- CHPL leku Amertil, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Końcowy okres półtrwania wynosi około 10 godzin. Liniowość lub nieliniowość Cetyryzyna wykazuje liniową kinetykę w zakresie dawek od 5 do 60 mg. Szczególne grupy pacjentów Osoby w podeszłym wieku: U 16 pacjentów w podeszłym wieku po podaniu doustnie pojedynczej dawki 10 mg okres półtrwania wydłużył się o około 50%, a klirens zmniejszył się o 40% w porównaniu z grupą kontrolną. Wydaje się, że zmniejszenie klirensu cetyryzyny u ochotników w podeszłym wieku jest związane z występującym w tej grupie osłabieniem czynności nerek. Dzieci i niemowlęta: U dzieci w wieku od 6 do 12 lat okres półtrwania cetyryzyny wynosił około 6 godzin, a u dzieci w wieku 2-6 lat - 5 godzin. U niemowląt i dzieci w wieku od 6 do 24 miesięcy okres półtrwania jest zmniejszony do 3,1 godziny. Pacjenci z zaburzeniami czynności nerek: Farmakokinetyka leku była podobna u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny powyżej 40 ml/min) oraz u zdrowych ochotników.
- CHPL leku Amertil, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
U pacjentów z umiarkowanymi zaburzeniami czynności nerek okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u zdrowych ochotników. U pacjentów poddawanych hemodializie (klirens kreatyniny mniejszy niż 7 ml/min), którym podano doustnie cetyryzynę w pojedynczej dawce 10 mg, okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u osób zdrowych. Podczas hemodializy cetyryzyna była usuwana z osocza w niewielkim stopniu. Konieczna jest modyfikacja dawkowania u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2). Pacjenci z zaburzeniami czynności wątroby: U pacjentów z przewlekłymi chorobami wątroby (marskość żółciowa, choroby dotyczące miąższu wątroby, choroby związane z zastojem żółci), którym podano 10 mg lub 20 mg cetyryzyny w pojedynczej dawce, okres półtrwania wydłużył się o 50%, a klirens zmniejszył o 40% w porównaniu do osób zdrowych.
- CHPL leku Amertil, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Dostosowanie dawkowania jest konieczne tylko u tych pacjentów z zaburzeniami czynności wątroby, u których jednocześnie występują zaburzenia czynności nerek.
- CHPL leku Amertil, tabletki powlekane, 10 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na reprodukcję, nie ujawniają występowania szczególnego zagrożenia dla człowieka.
- CHPL leku Amertil, tabletki powlekane, 10 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Laktoza jednowodna Celuloza mikrokrystaliczna Skrobia żelowana Krospowidon (typ A) Magnezu stearynian Skład otoczki: Hypromeloza Tytanu dwutlenek (E 171) Makrogol 400 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem i wilgocią. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Aluminium, w tekturowym pudełku. 20 tabletek powlekanych 30 tabletek powlekanych 60 tabletek powlekanych Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Allertec, tabletki powlekane, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ALLERTEC, 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 10 mg Cetirizini dihydrochloridum (cetyryzyny dichlorowodorku). Substancje pomocnicze o znanym działaniu: laktoza jednowodna i sód. Jedna tabletka powlekana zawiera 31 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki powlekane Tabletki barwy białej do kremowej, podłużne, obustronnie wypukłe z rowkiem dzielącym. Tabletkę można podzielić na równe dawki.
- CHPL leku Allertec, tabletki powlekane, 10 mgWskazania do stosowania
4.1 Wskazania do stosowania U dorosłych i dzieci w wieku 6 lat i powyżej: Cetyryzyna jest wskazana w łagodzeniu objawów dotyczących nosa i oczu, związanych z sezonowym i przewlekłym alergicznym zapaleniem błony śluzowej nosa. Cetyryzyna jest wskazana w łagodzeniu objawów przewlekłej idiopatycznej pokrzywki.
- CHPL leku Allertec, tabletki powlekane, 10 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dzieci i młodzież: Nie zaleca się stosowania produktu leczniczego w postaci tabletek u dzieci w wieku poniżej 6 lat, ponieważ ta postać farmaceutyczna nie pozwala na odpowiednie dostosowanie dawki. Dzieci w wieku od 6 do 12 lat: 5 mg (pół tabletki powlekanej) dwa razy na dobę. Młodzież w wieku powyżej 12 lat: 10 mg (1 tabletka powlekana) raz na dobę. Dorośli: 10 mg (1 tabletka powlekana) raz na dobę. Szczególne grupy pacjentów Pacjenci w podeszłym wieku: Brak danych wskazujących na konieczność zmniejszenia dawki leku u pacjentów w podeszłym wieku, jeśli czynność nerek jest u nich prawidłowa. Zaburzenia czynności nerek: Brak danych określających stosunek skuteczności do bezpieczeństwa stosowania u pacjentów z zaburzeniami czynności nerek.
- CHPL leku Allertec, tabletki powlekane, 10 mgDawkowanie
Ponieważ cetyryzyna jest wydalana głównie przez nerki (patrz punkt 5.2), w przypadku braku możliwości zastosowania alternatywnego leczenia, odstępy pomiędzy poszczególnymi dawkami muszą być ustalone indywidualnie w zależności od czynności nerek. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. Aby skorzystać z tabeli, należy obliczyć klirens kreatyniny (Clkr) w ml/min. Clkr (ml/min) można obliczyć na podstawie stężenia kreatyniny w surowicy krwi (mg/dl), posługując się następującym wzorem: [140 – wiek (lata)] x masa ciała (kg) Clkr = __________________________________________________ (x 0,85 dla kobiet) 72 x stężenie kreatyniny w surowicy (mg/dl) Modyfikacja dawkowania u dorosłych pacjentów z zaburzeniami czynności nerek Prawidłowa czynność nerek: ≥80 - 10 mg raz na dobę Łagodne zaburzenia czynności nerek: 50 do 79 - 10 mg raz na dobę Umiarkowane zaburzenia czynności nerek: 30 do 49 - 5 mg raz na dobę Ciężkie zaburzenia czynności nerek: <30 - 5 mg co drugi dzień Schyłkowa choroba nerek, pacjenci dializowani: <10 - stosowanie przeciwwskazane U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy ustalać indywidualnie na podstawie klirensu kreatyniny, wieku oraz masy ciała pacjenta.
- CHPL leku Allertec, tabletki powlekane, 10 mgDawkowanie
Zaburzenia czynności wątroby: Nie ma konieczności dostosowania dawki u pacjentów, u których występują wyłącznie zaburzenia czynności wątroby. U pacjentów z zaburzeniami czynności wątroby oraz zaburzeniami czynności nerek zaleca się dostosowanie dawki (patrz powyżej: „Zaburzenia czynności nerek”). Sposób podawania: Podanie doustne. Tabletki należy połykać popijając szklanką wody.
- CHPL leku Allertec, tabletki powlekane, 10 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na cetyryzyny dichlorowodorek, hydroksyzynę lub pochodne piperazyny, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. U pacjentów z ciężkimi zaburzeniami czynności nerek z klirensem kreatyniny poniżej 10 ml/min.
- CHPL leku Allertec, tabletki powlekane, 10 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stwierdzono istotnych klinicznie interakcji między alkoholem (w stężeniu 0,5 g/l we krwi) a cetyryzyną stosowaną w dawkach terapeutycznych. Jednakże zaleca się zachowanie ostrożności podczas przyjmowania cetyryzyny jednocześnie z alkoholem. Należy zachować ostrożność u pacjentów z czynnikami ryzyka zatrzymania moczu (np. uszkodzenia rdzenia kręgowego, rozrost gruczołu krokowego), ponieważ cetyryzyna może zwiększać ryzyko zatrzymania moczu. Zaleca się ostrożność podczas stosowania u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstąpienie leków przeciwhistaminowych na 3 dni przed wykonaniem testów. W przypadku przerwania stosowania cetyryzyny może wystąpić świąd i (lub) pokrzywka, nawet, jeśli objawy te nie występowały przed rozpoczęciem leczenia.
- CHPL leku Allertec, tabletki powlekane, 10 mgSpecjalne środki ostrozności
W niektórych przypadkach objawy te mogą być nasilone i może być konieczne wznowienie leczenia. Objawy powinny ustąpić po wznowieniu leczenia. Dzieci i młodzież: Nie zaleca się stosowania tego produktu leczniczego u dzieci w wieku poniżej 6 lat, ponieważ ta postać farmaceutyczna nie pozwala na odpowiednie dostosowanie dawki. Zaleca się stosowanie cetyryzyny w postaci farmaceutycznej przeznaczonej dla dzieci. Produkt nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy. Produkt zawiera mniej niż 1 mmol (23 mg) sodu w 1 tabletce powlekanej, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Allertec, tabletki powlekane, 10 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na właściwości farmakokinetyczne, farmakodynamiczne oraz profil tolerancji cetyryzyny nie są spodziewane interakcje tego produktu leczniczego z innymi lekami. W przeprowadzonych badaniach nie donoszono o występowaniu interakcji farmakodynamicznych ani znaczących interakcji farmakokinetycznych, w szczególności z pseudoefedryną lub teofiliną (400 mg na dobę). Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, natomiast zmniejsza szybkość wchłaniania cetyryzyny. U wrażliwych pacjentów, jednoczesne stosowanie z alkoholem lub lekami o działaniu hamującym na ośrodkowy układ nerwowy, może dodatkowo zmniejszać zdolność reagowania i koncentrację. Cetyryzyna nie nasila jednak działania alkoholu (w stężeniu 0,5 g/l we krwi).
- CHPL leku Allertec, tabletki powlekane, 10 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Prospektywnie zebrane dane dotyczące stosowania cetyryzyny w okresie ciąży nie wskazują na zwiększone działanie toksyczne w stosunku do matki, płodu lub zarodka. Badania przeprowadzone na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy. Należy zachować ostrożność podczas przepisywania cetyryzyny kobietom w ciąży. Karmienie piersi? Cetyryzyna przenika do mleka matki w stężeniach stanowiących 25 do 90% stężenia leku w osoczu (w zależności od czasu pobierania próbek po podaniu). Dlatego należy zachować ostrożność podczas przepisywania produktu kobietom karmiącym piersią. Płodność Dane dotyczące wpływu na płodność u ludzi są ograniczone, nie stwierdzono jednak zagrożenia dla bezpieczeństwa. Badania na zwierzętach nie wykazały zagrożenia dla bezpieczeństwa płodności u ludzi.
- CHPL leku Allertec, tabletki powlekane, 10 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Obiektywne badania z zastosowaniem cetyryzyny w zalecanej dawce 10 mg nie wykazały istotnego klinicznie wpływu na zdolność prowadzenia pojazdów, odczuwanie senności oraz sprawność psychofizyczną. Pacjenci, u których wystąpiła senność, powinni jednak unikać prowadzenia pojazdów, wykonywania potencjalnie niebezpiecznych czynności lub obsługiwania maszyn. Pacjenci powinni zwrócić uwagę na reakcję organizmu na lek oraz nie powinni stosować dawek większych niż zalecane.
- CHPL leku Allertec, tabletki powlekane, 10 mgDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne - Podsumowanie W badaniach klinicznych wykazano, że cetyryzyna podawana w zalecanych dawkach wywołuje działania niepożądane ze strony ośrodkowego układu nerwowego o nieznacznym nasileniu, w tym senność, zmęczenie, bóle i zawroty głowy. W niektórych przypadkach obserwowano paradoksalne pobudzenie ośrodkowego układu nerwowego. Mimo, iż cetyryzyna jest selektywnym antagonistą obwodowych receptorów H1 i jest praktycznie pozbawiona aktywności cholinolitycznej, zgłaszano pojedyncze przypadki trudności w oddawaniu moczu, zaburzeń akomodacji oka oraz suchości błony śluzowej jamy ustnej. Zgłaszano przypadki zaburzeń czynności wątroby ze zwiększoną aktywnością enzymów wątrobowych i ze zwiększonym stężeniem bilirubiny. W większości przypadków ustępowały one po przerwaniu przyjmowania cetyryzyny dichlorowodorku.
- CHPL leku Allertec, tabletki powlekane, 10 mgDziałania niepożądane
Zestawienie działań niepożądanych Dostępne są dane z klinicznych lub farmakoklinicznych badań prowadzonych metodą podwójnie ślepej próby, porównujących cetyryzynę z placebo oraz innymi lekami przeciwhistaminowymi stosowanymi w zalecanych dawkach (10 mg na dobę dla cetyryzyny). W badaniach uczestniczyło ponad 3200 pacjentów leczonych cetyryzyną. W badaniach kontrolowanych placebo, z zastosowaniem cetyryzyny w dawce 10 mg obserwowano następujące działania niepożądane, występujące z częstością 1% lub większą: Zaburzenia ogólne i stany w miejscu podania: Zmęczenie 1,63% (Cetyryzyna) vs 0,95% (Placebo) Zaburzenia układu nerwowego: Zawroty głowy 1,10% vs 0,98%, Ból głowy 7,42% vs 8,07% Zaburzenia żołądka i jelit: Ból brzucha 0,98% vs 1,08%, Suchość błony śluzowej jamy ustnej 2,09% vs 0,82%, Nudności 1,07% vs 1,14% Zaburzenia psychiczne: Senność 9,63% vs 5,00% Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Zapalenie gardła 1,29% vs 1,34% Mimo, iż senność występowała statystycznie częściej w grupie otrzymującej cetyryzynę niż w grupie otrzymującej placebo, w większości przypadków miała ona nasilenie łagodne do umiarkowanego.
- CHPL leku Allertec, tabletki powlekane, 10 mgDziałania niepożądane
Inne, obiektywne badania nie wykazały wpływu cetyryzyny w zalecanych dawkach dobowych na aktywność młodych, zdrowych ochotników. Dzieci i młodzież Działania niepożądane występujące z częstością 1% lub większą u dzieci w wieku od 6 miesięcy do 12 lat, pochodzące z badań klinicznych lub farmakoklinicznych kontrolowanych placebo to: Zaburzenia żołądka i jelit: Biegunka 1,0% vs 0,6% Zaburzenia psychiczne: Senność 1,8% vs 1,4% Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Zapalenie błony śluzowej nosa 1,4% vs 1,1% Zaburzenia ogólne i stany w miejscu podania: Zmęczenie 1,0% vs 0,3% Dane pochodzące z okresu po wprowadzeniu cetyryzyny do obrotu Oprócz wymienionych powyżej działań niepożądanych występujących podczas badań klinicznych, zgłaszano następujące działania niepożądane po wprowadzeniu cetyryzyny do obrotu.
- CHPL leku Allertec, tabletki powlekane, 10 mgDziałania niepożądane
Działania niepożądane opisano według klasyfikacji układów i narządów MedDRA, a częstość występowania określono na podstawie obserwacji z okresu po wprowadzeniu leku do obrotu. Częstość występowania określono w następujący sposób: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego: Bardzo rzadko: trombocytopenia Zaburzenia układu immunologicznego: Rzadko: reakcje nadwrażliwości, Bardzo rzadko: wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania: Częstość nieznana: zwiększenie apetytu Zaburzenia psychiczne: Niezbyt często: pobudzenie, Rzadko: zachowanie agresywne, splątanie, depresja, omamy, bezsenność, Bardzo rzadko: tiki, Częstość nieznana: myśli samobójcze, koszmary senne Zaburzenia układu nerwowego: Niezbyt często: parestezja, Rzadko: drgawki, Bardzo rzadko: zaburzenia smaku, omdlenie, drżenie, dystonia, dyskineza, Częstość nieznana: amnezja, zaburzenia pamięci Zaburzenia oka: Bardzo rzadko: zaburzenia akomodacji, niewyraźne widzenie, rotacja gałek ocznych Zaburzenia ucha i błędnika: Częstość nieznana: zawroty głowy Zaburzenia serca: Rzadko: tachykardia Zaburzenia żołądka i jelit: Niezbyt często: biegunka Zaburzenia wątroby i dróg żółciowych: Rzadko: nieprawidłowa czynność wątroby (zwiększona aktywność aminotransferaz, fosfatazy alkalicznej, γ-GT i zwiększone stężenie bilirubiny), Częstość nieznana: zapalenie wątroby Zaburzenia skóry i tkanki podskórnej: Niezbyt często: świąd, wysypka, Rzadko: pokrzywka, Bardzo rzadko: obrzęk naczynioruchowy, wysypka polekowa, Częstość nieznana: ostra uogólniona osutka krostkowa Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Częstość nieznana: bóle stawów Zaburzenia nerek i dróg moczowych: Bardzo rzadko: bolesne lub utrudnione oddawanie moczu, mimowolne oddawanie moczu, Częstość nieznana: zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania: Niezbyt często: osłabienie, złe samopoczucie, Rzadko: obrzęki Badania diagnostyczne: Rzadko: zwiększenie masy ciała Opis wybranych działań niepożądanych Zgłaszano przypadki świądu (intensywnego swędzenia) i (lub) pokrzywki po przerwaniu stosowania cetyryzyny.
- CHPL leku Allertec, tabletki powlekane, 10 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Allertec, tabletki powlekane, 10 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedawkowania Objawy obserwowane po przedawkowaniu cetyryzyny związane są przede wszystkim z działaniem na ośrodkowy układ nerwowy, mogą wskazywać także na działanie przeciwcholinergiczne. Po przyjęciu dawki cetyryzyny co najmniej 5 razy większej od zalecanej dawki dobowej zgłaszano następujące działania niepożądane: splątanie, biegunkę, zawroty głowy, zmęczenie, bóle głowy, złe samopoczucie, rozszerzenie źrenic, świąd, niepokój zwłaszcza ruchowy, sedację, senność, osłupienie, tachykardię, drżenie, zatrzymanie moczu. Postępowanie po przedawkowaniu Specyficzne antidotum nie jest znane. Zaleca się leczenie objawowe lub podtrzymujące. Jeżeli od zażycia zbyt dużej dawki produktu nie minęło zbyt wiele czasu, należy rozważyć wykonanie płukania żołądka. Cetyryzyna nie jest skutecznie usuwana metodą hemodializy.
- CHPL leku Allertec, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny, kod ATC: R06AE07 Mechanizm działania Cetyryzyna, metabolit hydroksyzyny u człowieka, jest silnym i selektywnym antagonistą obwodowych receptorów histaminowych H1. Badania wiązania z receptorem in vitro nie wykazały istotnego powinowactwa do innych receptorów niż H1. Działanie farmakodynamiczne Oprócz działania antagonistycznego w stosunku do receptorów H1, cetyryzyna wykazuje działanie przeciwalergiczne: u pacjentów z nadwrażliwością (atopią) poddawanych prowokacji alergenem, dawka 10 mg podawana raz lub dwa razy na dobę, hamuje napływ komórek późnej fazy reakcji zapalnej, eozynofili, do skóry i spojówek. Skuteczność kliniczna i bezpieczeństwo stosowania Badania u zdrowych ochotników wykazały, że cetyryzyna w dawkach 5 i 10 mg silnie hamuje reakcję prowadzącą do powstawania bąbli pokrzywkowych i zaczerwienienia, wywołaną śródskórnym podawaniem histaminy w bardzo dużych stężeniach, ale nie ustalono związku tego działania ze skutecznością.
- CHPL leku Allertec, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
W sześciotygodniowym, kontrolowanym placebo badaniu z udziałem 186 pacjentów z alergicznym zapaleniem błony śluzowej nosa oraz współistniejącą, łagodną lub umiarkowaną astmą, cetyryzyna stosowana w dawce 10 mg raz na dobę łagodziła objawy zapalenia błony śluzowej nosa i nie wpływała na czynność płuc. Badanie to potwierdza bezpieczeństwo stosowania cetyryzyny u pacjentów z alergią i z łagodną lub umiarkowaną astmą. W badaniu kontrolowanym placebo cetyryzyna podawana w dużej dawce dobowej wynoszącej 60 mg przez siedem dni nie powodowała statystycznie znamiennego wydłużenia odstępu QT. Stosowanie cetyryzyny w zalecanych dawkach poprawia jakość życia pacjentów z przewlekłym i sezonowym alergicznym zapaleniem błony śluzowej nosa. Dzieci i młodzież W trwającym 35 dni badaniu, przeprowadzonym u dzieci w wieku od 5 do 12 lat, nie stwierdzono tolerancji na przeciwhistaminowe działanie cetyryzyny (hamowanie powstawania bąbli pokrzywkowych i zaczerwienienia).
- CHPL leku Allertec, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
Po przerwaniu leczenia cetyryzyną podawaną wielokrotnie, skóra odzyskuje normalną reaktywność na histaminę w ciągu 3 dni.
- CHPL leku Allertec, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Maksymalne stężenie w osoczu w stanie stacjonarnym wynosi około 300 ng/ml i występuje w ciągu 1,0 ± 0,5 h. Rozkład parametrów farmakokinetycznych, takich jak stężenie maksymalne (Cmax) i pole pod krzywą (AUC), jest jednoznacznie zdefiniowany. Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, lecz zmniejsza szybkość wchłaniania cetyryzyny. W przypadku podawania cetyryzyny w postaci roztworu, kapsułek i tabletek, biodostępność jest podobna. Dystrybucja Pozorna objętość dystrybucji wynosi 0,50 l/kg. Cetyryzyna wiąże się z białkami osocza w 93 ± 0,3%. Cetyryzyna nie wpływa na stopień wiązania warfaryny z białkami. Metabolizm Cetyryzyna nie podlega w znaczącym stopniu metabolizmowi pierwszego przejścia. Eliminacja Końcowy okres półtrwania wynosi około 10 godzin. Nie zaobserwowano kumulacji cetyryzyny podczas stosowania dawek dobowych 10 mg przez 10 dni. Około dwie trzecie dawki jest wydalane w postaci niezmienionej z moczem.
- CHPL leku Allertec, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Liniowość lub nieliniowość Cetyryzyna wykazuje liniową kinetykę w zakresie dawek od 5 do 60 mg. Szczególne grupy pacjentów Zaburzenia czynności nerek Farmakokinetyka leku u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny powyżej 40 ml/min) oraz u zdrowych ochotników była podobna. U pacjentów z umiarkowanymi zaburzeniami czynności nerek okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u zdrowych ochotników. U pacjentów poddawanych hemodializie (klirens kreatyniny mniejszy niż 7 ml/min), którym podano doustnie cetyryzynę w pojedynczej dawce 10 mg, okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u osób zdrowych. Podczas hemodializy cetyryzyna była usuwana z osocza w niewielkim stopniu. Konieczna jest modyfikacja dawkowania u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2).
- CHPL leku Allertec, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Zaburzenia czynności wątroby U pacjentów z przewlekłymi chorobami wątroby (marskość żółciowa, choroby dotyczące miąższu wątroby, choroby związane z zastojem żółci), którym podano 10 lub 20 mg cetyryzyny w pojedynczej dawce, okres półtrwania wydłużył się o 50%, a klirens zmniejszył o 40% w porównaniu do osób zdrowych. Modyfikacja dawkowania jest konieczna tylko u tych pacjentów z zaburzeniami czynności wątroby, u których jednocześnie występują zaburzenia czynności nerek. Pacjenci w podeszłym wieku U 16 pacjentów w podeszłym wieku po podaniu doustnie pojedynczej dawki 10 mg okres półtrwania wydłużył się o około 50%, a klirens zmniejszył się o 40% w porównaniu z pozostałymi, młodszymi pacjentami. Wydaje się, że zmniejszenie klirensu cetyryzyny u ochotników w podeszłym wieku jest związane z występującym w tej grupie osłabieniem czynności nerek.
- CHPL leku Allertec, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Dzieci i młodzież U dzieci w wieku od 6 do 12 lat okres półtrwania cetyryzyny wynosi około 6 godzin, a u dzieci w wieku 2 do 6 lat wynosi 5 godzin. U niemowląt i dzieci w wieku od 6 do 24 miesięcy okres półtrwania jest zmniejszony do 3,1 godziny.
- CHPL leku Allertec, tabletki powlekane, 10 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne dotyczące cetyryzyny, uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozrodczość, nie ujawniają występowania szczególnego zagrożenia dla człowieka.
- CHPL leku Allertec, tabletki powlekane, 10 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Laktoza jednowodna Celuloza mikrokrystaliczna Skrobia kukurydziana Powidon K-25 Magnezu stearynian Karboksymetyloskrobia sodowa Krzemionka koloidalna bezwodna Sodu laurylosiarczan Hypromeloza Makrogol 6000 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 4 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać blister w opakowaniu zewnętrznym w celu ochrony przed światłem i wilgocią. 6.5 Rodzaj i zawartość opakowania Blister z folii Aluminium/PVC w tekturowym pudełku. Opakowanie zawiera 20 lub 30 tabletek powlekanych. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Nossin, tabletki powlekane, 5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Nossin, 5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Lewocetyryzyny dichlorowodorek Każda tabletka powlekana zawiera 5 mg lewocetyryzyny dichlorowodorku co odpowiada 4,2 mg lewocetyryzyny. Substancja pomocnicza o znanym działaniu: Każda tabletka powlekana zawiera 64,0 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARМACEUТYCZNA Tabletka powlekana. Tabletki powlekane białe lub prawie białe, owalne, obustronnie wypukłe, z wytłoczonym oznakowaniem ‘L9CZ’ po jednej stronie i ‘5’ po drugiej stronie.
- CHPL leku Nossin, tabletki powlekane, 5 mgWskazania do stosowania
4.1 Wskazania do stosowania Nossin, tabletki powlekane jest wskazany w leczeniu objawowym alergicznego zapalenia błony śluzowej nosa (w tym przewlekłego alergicznego zapalenia błony śluzowej nosa) oraz pokrzywki u dorosłych i dzieci w wieku od 6 lat.
- CHPL leku Nossin, tabletki powlekane, 5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i młodzież w wieku 12 lat i powyżej: Zalecana dawka dobowa wynosi 5 mg (1 tabletka powlekana). Pacjenci w podeszłym wieku: U pacjentów w podeszłym wieku z umiarkowanymi do ciężkich zaburzeniami czynności nerek zaleca się dostosowanie dawki produktu (patrz punkt „Zaburzenia czynności nerek”). Zaburzenia czynności nerek Odstępy czasu pomiędzy kolejnymi dawkami muszą być ustalone indywidualnie w zależności od stopnia wydolności nerek. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. W celu skorzystania z tabeli dawkowania należy obliczyć klirens kreatyniny (Clkr) w ml/min. Klirens kreatyniny (ml/min) można obliczyć, oznaczając stężenie kreatyniny w surowicy krwi (mg/dl) i stosując następujący wzór: [140 - wiek (lata)] x masa ciała (kg) Clkr = (x 0,85 dla kobiet) 72 x stężenie kreatyniny w surowicy (mg/dl) Dostosowanie dawki u pacjentów z zaburzeniami czynności nerek Prawidłowa czynność nerek: ≥ 80 - 1 tabletka raz na dobę Łagodne zaburzenia czynności nerek: 50 – 79 - 1 tabletka raz na dobę Umiarkowane zaburzenia czynności nerek: 30 – 49 - 1 tabletka co drugi dzień Ciężkie zaburzenia czynności nerek: < 30 - 1 tabletka co trzeci dzień Schyłkowa niewydolność nerek – pacjenci dializowani: < 10 - Produkt przeciwwskazany U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy dostosować indywidualnie po uwzględnieniu klirensu nerkowego i masy ciała pacjenta.
- CHPL leku Nossin, tabletki powlekane, 5 mgDawkowanie
Brak szczegółowych danych dotyczących stosowania u dzieci z zaburzeniami czynności nerek. Zaburzenia czynności wątroby Nie jest konieczne dostosowanie dawki u pacjentów, u których występują wyłącznie zaburzenia czynności wątroby. U pacjentów z zaburzeniami czynności wątroby oraz nerek zaleca się dostosowanie dawki (patrz powyżej „Zaburzenia czynności nerek”). Dzieci i młodzież Dzieci w wieku od 6 do 12 lat: Zalecana dawka dobowa wynosi 5 mg (1 tabletka powlekana). U dzieci w wieku od 2 do 6 lat nie jest możliwe dostosowanie dawki produktu w postaci tabletek powlekanych. Zaleca się stosowanie produktów lewocetyryzyny w postaciach farmaceutycznych przeznaczonych dla dzieci. Sposób podawania Tabletkę powlekaną należy przyjmować doustnie, połykając w całości i popijając płynem. Tabletkę można przyjmować z posiłkiem lub niezależnie od posiłku. Zaleca się przyjmowanie dawki raz na dobę.
- CHPL leku Nossin, tabletki powlekane, 5 mgDawkowanie
Czas trwania leczenia Okresowe alergiczne zapalenie błony śluzowej nosa (objawy występujące rzadziej niż 4 dni w tygodniu lub utrzymujące się krócej niż 4 tygodnie w roku) należy leczyć zgodnie z przebiegiem choroby; leczenie można przerwać po ustąpieniu objawów i wznowić po ponownym ich wystąpieniu. W przypadku przewlekłego alergicznego zapalenia błony śluzowej nosa (objawy występujące częściej niż 4 dni w tygodniu lub utrzymujące się dłużej niż 4 tygodnie w roku) można zalecić pacjentowi kontynuowanie leczenia w okresie narażenia na alergeny. Dostępne obecnie dane kliniczne dotyczą 6-miesięcznego okresu leczenia 5 mg lewocetyryzyny w postaci tabletek powlekanych. Doświadczenie kliniczne z zastosowaniem cetyryzyny (racematu) w leczeniu przewlekłej pokrzywki i przewlekłego alergicznego zapalenia błony śluzowej nosa dotyczy okresu do 1 roku.
- CHPL leku Nossin, tabletki powlekane, 5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, cetyryzynę, hydroksyzynę, inne pochodne piperazyny lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Ciężkie zaburzenia czynności nerek u pacjentów z klirensem kreatyniny mniejszym niż 10 ml/min.
- CHPL leku Nossin, tabletki powlekane, 5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy zachować ostrożność podczas przyjmowania produktu leczniczego jednocześnie z alkoholem (patrz punkt 4.5). Należy zachować ostrożność u pacjentów z ryzykiem zatrzymania moczu (np. uszkodzenie rdzenia kręgowego, rozrost gruczołu krokowego), gdyż lewocetyryzyna może nasilać ryzyko zatrzymania moczu. Lewocetyryzyna może powodować nasilenie napadów padaczkowych, z tego względu należy zachować ostrożność u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstąpienie leków przeciwhistaminowych na 3 dni przed wykonaniem testów. Produktu nie należy stosować u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, niedoborem laktazy (typu Lapp) lub zespołem złego wchłaniania glukozy-galaktozy.
- CHPL leku Nossin, tabletki powlekane, 5 mgSpecjalne środki ostrozności
W przypadku przerwania stosowania lewocetyryzyny możliwe jest wystąpienie świądu, nawet jeśli objawy te nie występowały przed rozpoczęciem leczenia. Te objawy mogą ustąpić samoistnie. W niektórych przypadkach objawy mogą być intensywne i może być konieczne wznowienie leczenia. Objawy powinny ustąpić po wznowieniu leczenia.
- CHPL leku Nossin, tabletki powlekane, 5 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji lewocetyryzyny (w tym badań z induktorami CYP3A4); badania z zastosowaniem racematu cetyryzyny nie wykazały istotnych klinicznie niepożądanych interakcji (z fenaz onem, pseudoefedryną, cymetydyną, ketokonazolem, erytromycyną, azytromycyną, glipizydem i diazepamem). Niewielkie zmniejszenie klirensu cetyryzyny (16%) obserwowano w badaniu, w którym stosowano dawki wielokrotne teofiliny (400 mg raz na dobę), natomiast jednoczesne podawanie cetyryzyny nie wpływało na ekspozycję na teofilinę. Stosowanie rytonawiru (600 mg dwa razy na dobę) i cetyryzyny (10 mg na dobę) w dawkach wielokrotnych zwiększało o ok. 40% całkowity wpływ cetyryzyny na organizm, podczas gdy w odniesieniu do rytonawiru był on w niewielkim stopniu zmniejszony (o 11%) podczas jednoczesnego stosowania z cetyryzyną.
- CHPL leku Nossin, tabletki powlekane, 5 mgInterakcje
Stosowanie z pokarmem nie zmniejsza stopnia wchłaniania lewocetyryzyny, natomiast zmniejsza szybkość jej wchłaniania. U wrażliwych pacjentów jednoczesne podawanie cetyryzyny lub lewocetyryzyny z alkoholem lub innymi środkami hamującymi czynność OUN może spowodować dodatkowe obniżenie czujności i zdolności reagowania.
- CHPL leku Nossin, tabletki powlekane, 5 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych lub istnieją ograniczone dane (mniej niż 300 ciąż) dotyczące stosowania lewocetyryzyny u kobiet w ciąży. Jednak dane otrzymane z dużej liczby zastosowań cetyryzyny (racemat) u kobiet w ciąży (ponad 1000 ciąż) nie wskazują, aby wywoływała ona wady rozwojowe lub działała toksycznie na płód i noworodka. Badania na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3). Można rozważyć zastosowanie lewocetyryzyny w okresie ciąży, jeżeli jest to konieczne. Karmienie piersi? Wykazano, że cetyryzyna (racemat) przenika do mleka kobiecego. Dlatego też jest prawdopodobne, że lewocetyryzyna przenika do mleka kobiecego. U niemowląt karmionych piersią mogą wystąpić działania niepożądane wynikające z zastosowania lewocetyryzyny przez matkę.
- CHPL leku Nossin, tabletki powlekane, 5 mgWpływ na płodność, ciążę i laktację
Dlatego należy zachować ostrożność, przepisując lewocetyryzynę kobietom karmiącym piersią. Płodność Brak danych klinicznych dotyczących lewocetyryzyny.
- CHPL leku Nossin, tabletki powlekane, 5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn W porównawczych badaniach klinicznych nie wykazano, aby lewocetyryzyna w zalecanej dawce osłabiała koncentrację uwagi, zdolność reagowania lub zdolność prowadzenia pojazdów. Jednakże niektórzy pacjenci mogą odczuwać senność, zmęczenie i osłabienie podczas leczenia lewocetyryzyną. Dlatego pacjenci zamierzający prowadzić pojazdy, wykonywać potencjalnie niebezpieczne czynności lub obsługiwać maszyny, powinni wziąć pod uwagę swoją reakcję na produkt leczniczy.
- CHPL leku Nossin, tabletki powlekane, 5 mgDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne Dorośli i młodzież w wieku powyżej 12 lat. W badaniach klinicznych z udziałem kobiet i mężczyzn w wieku od 12 do 71 lat, w grupie przyjmującej 5 mg lewocetyryzyny u 15,1% pacjentów wystąpiło co najmniej jedno działanie niepożądane, w porównaniu z 11,3% pacjentów z grupy przyjmującej placebo. 91,6% tych działań niepożądanych miało łagodne lub umiarkowane nasilenie. W badaniach klinicznych, odsetek pacjentów, którzy przerywali leczenie z powodu działań niepożądanych, wynosił 1,0% (9/935) w grupie stosującej 5 mg lewocetyryzyny i 1,8% (14/771) w grupie przyjmującej placebo. W badaniach klinicznych z zastosowaniem lewocetyryzyny uczestniczyło 935 osób, którym podawano produkt w zalecanej dawce 5 mg na dobę. W tej grupie, po zastosowaniu lewocetyryzyny w dawce 5 mg lub placebo, zgłaszano występowanie następujących działań niepożądanych z częstością 1% lub większą (często; ≥1/100 do <1/10): Ból głowy: Placebo 25 (3,2%), Lewocetyryzyna 24 (2,6%) Senność: Placebo 11 (1,4%), Lewocetyryzyna 49 (5,2%) Suchość w jamie ustnej: Placebo 12 (1,6%), Lewocetyryzyna 24 (2,6%) Zmęczenie: Placebo 9 (1,2%), Lewocetyryzyna 23 (2,5%) Zgłaszano także inne działania niepożądane występujące niezbyt często (≥1/1 000 do <1/100), takie jak osłabienie lub ból brzucha.
- CHPL leku Nossin, tabletki powlekane, 5 mgDziałania niepożądane
Częstość występowania sedatywnych działań niepożądanych, takich jak senność, zmęczenie i osłabienie, była łącznie większa (8,1%) u pacjentów przyjmujących lewocetyryzynę w dawce 5 mg niż u przyjmujących placebo (3,1%). Dzieci i młodzież W dwóch badaniach kontrolowanych placebo z udziałem dzieci w wieku od 6 do 11 miesięcy oraz dzieci w wieku od 1 roku do poniżej 6 lat, 159 pacjentom podawano lewocetyryzynę w dawce odpowiednio 1,25 mg na dobę przez 2 tygodnie oraz 1,25 mg dwa razy na dobę. Poniżej przedstawiono działania niepożądane zgłaszane po podaniu lewocetyryzyny lub placebo, występujące z częstością 1% lub większą. Biegunka: Placebo 0, Lewocetyryzyna 3 (1,9%) Wymioty: Placebo 1 (1,2%), Lewocetyryzyna 1 (0,6%) Zaparcia: Placebo 0, Lewocetyryzyna 2 (1,3%) Senność: Placebo 2 (2,4%), Lewocetyryzyna 3 (1,9%) Zaburzenia snu: Placebo 0, Lewocetyryzyna 2 (1,3%) W badaniach klinicznych z grupą kontrolną placebo, prowadzonych metodą podwójnie ślepej próby z udziałem dzieci w wieku od 6 do 12 lat, 243 dzieciom podawano lewocetyryzynę w dawce 5 mg na dobę przez różny okres czasu – od krótszego niż 1 tydzień do 13 tygodni.
- CHPL leku Nossin, tabletki powlekane, 5 mgDziałania niepożądane
Poniżej przedstawiono działania niepożądane zgłaszane po podaniu lewocetyryzyny lub placebo, występujące z częstością 1% lub większą. Bóle głowy: Placebo 5 (2,1%), Lewocetyryzyna 2 (0,8%) Senność: Placebo 1 (0,4%), Lewocetyryzyna 7 (2,9%) Doświadczenie po wprowadzeniu produktu do obrotu Działania niepożądane zgłoszone po wprowadzeniu produktu do obrotu przedstawiono zgodnie z klasyfikacją układowo-narządową oraz częstością występowania. Częstość występowania działań niepożądanych określono następująco: bardzo często (≥ 1/10), często (≥ 1/100 do <1/10), niezbyt często (≥ 1/1000 do <1/100), rzadko (≥ 1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia układu immunologicznego: Nadwrażliwość, w tym anafilaksja Zaburzenia metabolizmu i odżywiania: Zwiększenie łaknienia Zaburzenia psychiczne: Agresja, pobudzenie, omamy, depresja, bezsenność, myśli samobójcze, koszmary senne Zaburzenia układu nerwowego: Drgawki, parestezje, zaburzenia równowagi, omdlenie, drżenie, zaburzenia smaku Zaburzenia oka: Zaburzenia widzenia, widzenie niewyraźne, rotacyjne ruchy gałek ocznych Zaburzenia ucha i błędnika: zawroty głowy Zaburzenia serca: Kołatanie serca, tachykardia Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Duszność Zaburzenia żołądka i jelit: Nudności, wymioty, biegunka Zaburzenia wątroby i dróg żółciowych: Zapalenie wątroby Zaburzenia skóry i tkanki podskórnej: Obrzęk naczyniowo-ruchowy, trwały wyprysk polekowy, świąd, wysypka, pokrzywka Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Ból mięśni, ból stawów Zaburzenia nerek i dróg moczowych: dyzuria, zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania: Obrzęk Badania diagnostyczne: Zwiększenie masy ciała, nieprawidłowe wyniki badań czynności wątroby Opis wybranych działań niepożądanych Zgłaszano przypadki świądu po przerwaniu stosowania lewocetyryzyny.
- CHPL leku Nossin, tabletki powlekane, 5 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: +48 22 49-21-301, fax: +48 22 49-21-309, e-mail: ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Nossin, tabletki powlekane, 5 mgPrzedawkowanie
4.9 Przedawkowanie Objawy Objawy przedawkowania u dorosłych mogą być następujące: senność, a u dzieci początkowo pobudzenie i niepokój, zwłaszcza ruchowy, a następnie senność. Postępowanie w razie przedawkowania Nie jest znane specyficzne antidotum dla lewocetyryzyny. W razie przedawkowania zalecane jest leczenie objawowe lub podtrzymujące. Należy rozważyć płukanie żołądka, jeśli od przyjęcia leku upłynęło niewiele czasu. Lewocetyryzyna nie jest skutecznie usuwana za pomocą hemodializy.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny; kod ATC: R06A E09. Mechanizm działania Lewocetyryzyna, (R)-enancjomer cetyryzyny, jest silnym i wybiorczym antagonistą obwodowych receptorów histaminowych H1. Badania dotyczące wiązania z receptorami wykazały, że lewocetyryzyna ma duże powinowactwo do receptorów H1 u ludzi (Ki = 3,2 nmol/l). Lewocetyryzyna ma dwukrotnie większe powinowactwo niż cetyryzyna (Ki = 6,3 nmol/l). Okres półtrwania dysocjacji lewocetyryzyny od receptorów H1 wynosi 115 ± 38 min. Po 4 godzinach od jednorazowego podania stwierdzono zablokowanie receptorów przez lewocetyryzynę w 90%, a po 24 godzinach w 57%. Badania farmakodynamiczne u zdrowych ochotników wykazały, że działanie dawki lewocetyryzyny równej połowie dawki cetyryzyny jest porównywalne do działania cetyryzyny, zarówno na skórę, jak i na błonę śluzową nosa.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
Działanie farmakodynamiczne Właściwości farmakodynamiczne lewocetyryzyny oceniano w badaniach randomizowanych przeprowadzonych z grupą kontrolną: W badaniu porównującym działanie lewocetyryzyny w dawce 5 mg, desloratadyny w dawce 5 mg i placebo na pohistaminowy bąbel i rumień, leczenie lewocetyryzyną powodowało istotne hamowanie powstawania bąbla i rumienia - działanie to było najsilniejsze w ciągu pierwszych 12 godzin i utrzymywało się przez 24 godziny (p<0,001), w porównaniu z placebo i desloratadyną. W badaniach klinicznych z grupą kontrolną placebo, dotyczących objawów wywołanych narażeniem na pyłki roślin w modelu z użyciem komory do prowokacji alergenowych, początek działania lewocetyryzyny w dawce 5 mg obserwowano po 1 godzinie od podania produktu. W badaniach in vitro (komory Boydena i linie komórkowe) wykazano, że lewocetyryzyna hamuje indukowaną przez eotaksynę przezśródbłonkową migrację eozynofilów przez komórki skóry i płuc.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
W eksperymentalnym badaniu farmakodynamicznym in vivo (technika okienek skórnych) u 14 dorosłych pacjentów wykazano, w porównaniu z placebo, trzy główne działania hamujące lewocetyryzyny w dawce 5 mg zastosowanej w ciągu pierwszych 6 godzin reakcji wywołanej pyłkami: hamowanie uwalniania VCAM-1, zmianę przepuszczalności naczyń i zmniejszenie napływu eozynofilów. Skuteczność kliniczna i bezpieczeństwo stosowania Skuteczność i bezpieczeństwo stosowania lewocetyryzyny wykazano w kilku badaniach klinicznych przeprowadzonych z grupą kontrolną placebo, metodą podwójnie ślepej próby u dorosłych pacjentów z sezonowym alergicznym zapaleniem błony śluzowej nosa, całorocznym alergicznym zapaleniem błony śluzowej nosa lub przewlekłym alergicznym zapaleniem błony śluzowej nosa. Lewocetyryzyna w istotnym stopniu łagodziła objawy alergicznego zapalenia błony śluzowej nosa, w tym także niedrożność nosa w niektórych badaniach.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
W trwającym 6 miesięcy badaniu klinicznym u 551 dorosłych pacjentów (w tym 276 pacjentów leczonych lewocetyryzyną) z przewlekłym alergicznym zapaleniem błony śluzowej nosa (objawy występowały przez 4 dni w tygodniu, przez co najmniej 4 kolejne tygodnie) i uczulonych na roztocza kurzu domowego i pyłki traw wykazano, że lewocetyryzyna w dawce 5 mg była klinicznie i statystycznie istotnie bardziej skuteczna niż placebo w łagodzeniu objawów alergicznego zapalenia błony śluzowej nosa ocenianych w skali TSS (punktowy wskaźnik nasilenia objawów klinicznych, ang. Total Symptom Score - TSS) przez cały czas trwania badania, przy czym nie występowało zjawisko tachyfilaksji. Przez cały czas trwania badania lewocetyryzyna istotnie poprawiała jakość życia pacjentów. W badaniu klinicznym z grupą kontrolną placebo, w którym uczestniczyło 166 pacjentów z przewlekłą pokrzywką idiopatyczną, 85 pacjentów przyjmowało placebo, a 81 lewocetyryzynę w dawce 5 mg raz na dobę przez 6 tygodni.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
Leczenie lewocetyryzyną w porównaniu z placebo powodowało istotne zmniejszenie nasilenia świądu w pierwszym tygodniu oraz w całym okresie leczenia. Stosowanie lewocetyryzyny w porównaniu z placebo powodowało także większą poprawę zależnej od stanu zdrowia jakości życia pacjentów, ocenianej na podstawie wskaźnika wpływu dolegliwości skórnych na jakość życia (ang. Dermatology Life Quality Index). Przewlekła idiopatyczna pokrzywka była badana jako model zaburzeń pokrzywkowych. Ponieważ uwalnianie histaminy jest przyczyną występowania pokrzywki można oczekiwać, że lewocetyryzyna będzie skuteczna w łagodzeniu objawów innych rodzajów pokrzywek, nie tylko przewlekłej idiopatycznej pokrzywki. W zapisach EKG nie wykazano znaczącego wpływu lewocetyryzyny na odstęp QT. Dzieci i młodzież W dwóch badaniach klinicznych z grupą kontrolną placebo, w których uczestniczyli pacjenci w wieku od 6 do 12 lat z sezonowym lub całorocznym alergicznym zapaleniem błony śluzowej nosa, oceniano bezpieczeństwo stosowania i skuteczność lewocetyryzyny w postaci tabletek.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
W obydwu badaniach leczenie lewocetyryzyną powodowało istotne złagodzenie objawów oraz poprawę zależnej od stanu zdrowia jakości życia pacjentów. Bezpieczeństwo stosowania lewocetyryzyny u dzieci w wieku do 6 lat oceniano w warunkach klinicznych w kilku krótko- i długoterminowych badaniach klinicznych: w badaniu klinicznym u 29 dzieci w wieku 2 do 6 lat z alergicznym zapaleniem błony śluzowej nosa, leczonych lewocetyryzyną w dawce 1,25 mg 2 razy na dobę przez 4 tygodnie, w badaniu klinicznym u 114 dzieci w wieku od 1 roku życia do 5 lat z alergicznym zapaleniem błony śluzowej nosa lub przewlekłą pokrzywką idiopatyczną, leczonych lewocetyryzyną w dawce 1,25 mg 2 razy na dobę przez 2 tygodnie, w badaniu klinicznym u 45 dzieci w wieku od 6 do 11 miesięcy z alergicznym zapaleniem błony śluzowej nosa lub przewlekłą pokrzywką idiopatyczną, leczonych lewocetyryzyną w dawce 1,25 mg raz na dobę przez 2 tygodnie, w długoterminowym badaniu klinicznym (18 miesięcy) u 255 dzieci z atopią, leczonych lewocetyryzyną, których wiek w chwili rozpoczęcia badania wynosił od 12 do 24 miesięcy życia.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
Profil bezpieczeństwa był podobny do obserwowanego w badaniach krótkoterminowych przeprowadzonych u dzieci w wieku od 1 do 5 lat.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Farmakokinetyka lewocetyryzyny ma przebieg liniowy i jest niezależna od dawki i czasu, oraz wykazuje małą zmienność osobniczą. Profil farmakokinetyczny w przypadku podania enancjomeru jest taki sam, jak w przypadku podania cetyryzyny. Podczas procesu wchłaniania i eliminacji nie dochodzi do odwrócenia chiralności. Wchłanianie Po podaniu doustnym lewocetyryzyna wchłania się szybko i w znacznym stopniu. Maksymalne stężenie w osoczu występuje 0,9 godziny po podaniu. Stan równowagi występuje po dwóch dniach. Stężenie maksymalne wynosi zwykle 270 ng/ml i 308 ng/ml, odpowiednio po jednorazowym i wielokrotnym podawaniu dawki 5 mg raz na dobę. Stopień wchłaniania nie zależy od dawki ani od przyjmowania pokarmu, natomiast maksymalne stężenie jest zmniejszone i występuje później. Dystrybucja Brak dostępnych danych dotyczących tkankowej dystrybucji lewocetyryzyny u ludzi i przenikania lewocetyryzyny przez barierę krew-mózg.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
U szczurów i psów największe stężenia stwierdzono w wątrobie i nerkach, najmniejsze w kompartmencie ośrodkowego układu nerwowego. U ludzi lewocetyryzyna w 90% wiąże się z białkami osocza. Dystrybucja lewocetyryzyny jest ograniczona, ponieważ jej objętość dystrybucji wynosi 0,4 l/kg. Biotransformacja U ludzi metabolizowane jest mniej niż 14% podanej dawki lewocetyryzyny, dlatego różnice wynikające z polimorfizmu genetycznego lub równoczesnego stosowania inhibitorów enzymów uważa się za mało istotne. Szlaki metaboliczne obejmują: utlenianie pierścienia aromatycznego, N- i O-dealkilację oraz sprzęganie z tauryną. Reakcje dealkilacji przebiegają głównie z udziałem CYP 3A4, natomiast utlenianie pierścienia aromatycznego przebiega z udziałem licznych i (lub) niezidentyfikowanych izoenzymów CYP. Lewocetyryzyna w stężeniach znacznie większych niż stężenie maksymalne występujące po podaniu dawki doustnej 5 mg, nie ma wpływu na aktywność izoenzymów CYP 1A2, 2C9, 2C19, 2D6, 2E1 i 3A4.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Ze względu na słabo nasilony metabolizm i brak potencjalnych możliwości jego hamowania, interakcje lewocetyryzyny z innymi substancjami są mało prawdopodobne. Eliminacja Okres półtrwania w osoczu wynosi u dorosłych 7,9 ± 1,9 godziny. Średni pozorny klirens całkowity wynosi 0,63 ml/min/kg mc. Lewocetyryzyna i jej metabolity wydalane są głównie z moczem, średnio 85,4% dawki. Z kałem wydalane jest tylko 12,9% dawki. Lewocetyryzyna wydala się zarówno w wyniku przesączania kłębuszkowego, jak i czynnego wydzielania kanalikowego. Specjalne grupy pacjentów Zaburzenia czynności nerek Pozorny klirens całkowity lewocetyryzyny z organizmu koreluje z klirensem kreatyniny. Dlatego u pacjentów z umiarkowanymi i ciężkimi zaburzeniami czynności nerek zaleca się dostosowanie odstępów pomiędzy kolejnymi dawkami lewocetyryzyny w zależności od klirensu kreatyniny. U osób ze schyłkową niewydolnością nerek z bezmoczem, klirens całkowity jest zmniejszony o około 80% w porównaniu z zdrowymi.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Ilość lewocetyryzyny usunięta w czasie standardowego 4-godzinnego zabiegu hemodializy wynosiła mniej niż 10%. Dzieci i młodzież Wyniki farmakokinetycznego badania u dzieci, w którym u 14 dzieci w wieku 6 do 11 lat o masie ciała 20 kg do 40 kg zastosowano dawkę jednorazową 5 mg lewocetyryzyny doustnie, wykazały około dwukrotne zwiększenie wartości Cmax i AUC w porównaniu z dorosłymi zdrowymi uczestnikami skrzyżowanego badania porównawczego. Średnia wartość Cmax (450 ng/ml) występowała średnio po 1,2 godziny, klirens całkowity znormalizowany względem masy ciała był o 30% większy, zaś okres półtrwania w fazie eliminacji o 24% krótszy w populacji pediatrycznej niż u dorosłych. Nie prowadzono badań farmakokinetyki u dzieci w wieku do 6 lat. Dokonano retrospektywnej analizy danych z farmakokinetyki populacyjnej u 323 osób (181 dzieci w wieku od 1 do 5 lat, 18 dzieci w wieku od 6 do 11 lat i 124 dorosłych w wieku od 18 do 55 lat), które otrzymały dawkę jednorazową lub dawki wielokrotne lewocetyryzyny wynoszące od 1,25 do 30 mg.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Dane z analizy wykazują, że po podaniu dawki 1,25 mg raz na dobę u dzieci w wieku od 6 miesięcy do 5 lat można spodziewać się stężenia w osoczu podobnego, jak u dorosłych otrzymujących dawkę 5 mg raz na dobę. Pacjenci w podeszłym wieku Dane dotyczące farmakokinetyki u pacjentów w podeszłym wieku są ograniczone. Po wielokrotnym podaniu doustnym lewocetyryzyny w dawce 30 mg raz na dobę przez 6 dni, u 9 pacjentów (w wieku od 65 do 74 lat) klirens całkowity był o około 33% mniejszy w porównaniu z młodymi dorosłymi. Wykazano, że po podaniu cetyryzyny (racematu) jego wydalanie było bardziej zależne od czynności nerek niż od wieku. Dotyczy to także lewocetyryzyny, gdyż zarówno ona, jak i cetyryzyna są wydalane głównie z moczem. Dawkowanie lewocetyryzyny u pacjentów w podeszłym wieku powinno więc być dostosowane do czynności nerek. Płeć Poddano ocenie potencjalny wpływ płci na farmakokinetykę lewocetyryzyny (badanie u 77 pacjentów: 40 mężczyzn, 37 kobiet).
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Okres półtrwania był nieznacznie krótszy u kobiet (7,08 ± 1,72 godziny) niż u mężczyzn (8,62 ± 1,84 godziny), jednak wydaje się, że klirens po podaniu doustnym dawki dostosowanej do masy ciała u kobiet (0,67 ± 0,16 ml/min/kg) jest porównywalny z klirensem u mężczyzn (0,59 ± 0,12 ml/min/kg). U kobiet i mężczyzn z prawidłową czynnością nerek stosuje się takie same dawki dobowe i takie same odstępy między nimi. Rasa Nie badano wpływu rasy na farmakokinetykę lewocetyryzyny. Nie należy spodziewać się występowania różnic farmakokinetycznych w zależności od rasy, gdyż lewocetyryzyna jest wydalana głównie przez nerki, a brak jest istotnych różnic w odniesieniu do klirensu kreatyniny w zależności od rasy. Nie odnotowano występowania różnic w kinetyce cetyryzyny (racematu) w zależności od rasy. Zaburzenia czynności wątroby Nie badano farmakokinetyki lewocetyryzyny u pacjentów z zaburzeniami czynności wątroby.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
U pacjentów z przewlekłymi chorobami wątroby (wątrobowokomórkowymi, cholestatycznymi lub z żółciową marskością wątroby) po jednorazowym podaniu dawki 10 mg lub 20 mg cetyryzyny (racematu), okres półtrwania był wydłużony o 50%, a jednocześnie klirens zmniejszony o 40% w porównaniu z osobami zdrowymi. Zależności farmakokinetyczno-farmakodynamiczne Wpływ na reakcje skórne spowodowane przez histaminę nie zależy od stężenia produktu leczniczego w osoczu.
- CHPL leku Nossin, tabletki powlekane, 5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań dotyczących farmakologii bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród, nie ujawniają żadnego szczególnego zagrożenia dla człowieka.
- CHPL leku Nossin, tabletki powlekane, 5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń Laktoza jednowodna Celuloza mikrokrystaliczna Magnezu stearynian Otoczka (Opadry white) Hypromeloza Tytanu dwu tlenek (E 171) Makrogol 400. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Blistry PVC/PVDC/Aluminium lub blistry O PA/Aluminium/PVC/Aluminium w tekturowym pudełku. Wielkości opakowań: 7, 10, 14, 15, 20, 21, 28, 30, 40, 50, 56, 60, 70, 90, 100, 112 lub 120 tabletek powlekanych. Pojedyncze blistry zawierające 30 x 1 tabletek powlekanych. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ALLERTEC, 5 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 5 ml syropu zawiera 5 mg Cetirizini dihydrochloridum (cetyryzyny dichlorowodorku). Substancje pomocnicze o znanym działaniu: sorbitol (E420) metylu parahydroksybenzoesan (E218) propylu parahydroksybenzoesan (E216) glikol propylenowy sód Jeden ml syropu zawiera: 350 mg sorbitolu (E420) 0,333 mg metylu parahydroksybenzoesanu (E218) 0,167 mg propylu parahydroksybenzoesanu (E216) 50 mg glikolu propylenowego Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Syrop Bezbarwny, przezroczysty płyn
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlWskazania do stosowania
4.1 Wskazania do stosowania U dorosłych i dzieci w wieku 2 lat i powyżej: Cetyryzyna jest wskazana w łagodzeniu objawów dotyczących nosa i oczu, związanych z sezonowym i przewlekłym alergicznym zapaleniem błony śluzowej nosa. Cetyryzyna jest wskazana w łagodzeniu objawów przewlekłej idiopatycznej pokrzywki.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlDawkowanie
4.2 Dawkowanie i sposób podawania Do opakowania dołączona jest miarka o całkowitej pojemności 10 ml z podziałką pozwalającą na odmierzanie 2,5 ml, 5 ml, 10 ml syropu. Dawkowanie Dzieci i młodzież Dzieci w wieku od 2 lat do 6 lat: 2,5 mg (2,5 ml syropu) dwa razy na dobę. Dzieci w wieku od 6 lat do 12 lat: 5 mg (5 ml syropu) dwa razy na dobę. Młodzież w wieku powyżej 12 lat: 10 mg (10 ml syropu) raz na dobę. Dorośli: 10 mg (10 ml syropu) raz na dobę. Szczególne grupy pacjentów Pacjenci w podeszłym wieku Brak danych wskazujących na konieczność zmniejszenia dawki leku u pacjentów w podeszłym wieku, jeśli czynność nerek jest u nich prawidłowa. Zaburzenia czynności nerek Brak danych określających stosunek skuteczności do bezpieczeństwa stosowania u pacjentów z zaburzeniami czynności nerek.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlDawkowanie
Ponieważ cetyryzyna jest wydalana głównie przez nerki (patrz punkt 5.2), w przypadku braku możliwości zastosowania alternatywnego leczenia, odstępy pomiędzy poszczególnymi dawkami muszą być ustalone indywidualnie w zależności od czynności nerek. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. Aby skorzystać z tabeli, należy obliczyć klirens kreatyniny (Clkr) w ml/min. Clkr (ml/min) można obliczyć na podstawie stężenia kreatyniny w surowicy krwi (mg/dl), posługując się następującym wzorem: [140 – wiek (lata)] x masa ciała (kg) Clkr = __________________________________________________ (x 0,85 dla kobiet) 72 x stężenie kreatyniny w surowicy (mg/dl) Modyfikacja dawkowania u dorosłych pacjentów z zaburzeniami czynności nerek Stopień wydolności nerek Klirens kreatyniny (ml/min) Dawka i częstość podawania Prawidłowa czynność nerek ≥ 80 10 mg raz na dobę Łagodne zaburzenia czynności nerek 50 do 79 10 mg raz na dobę Umiarkowane zaburzenia czynności nerek 30 do 49 5 mg raz na dobę Ciężkie zaburzenia czynności nerek < 30 5 mg co drugi dzień Schyłkowa choroba nerek, pacjenci dializowani < 10 stosowanie przeciwwskazane U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy ustalać indywidualnie na podstawie klirensu kreatyniny, wieku oraz masy ciała.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlDawkowanie
Zaburzenia czynności wątroby Nie ma konieczności dostosowania dawki u pacjentów, u których występują wyłącznie zaburzenia czynności wątroby. U pacjentów z zaburzeniami czynności wątroby oraz zaburzeniami czynności nerek zaleca się dostosowanie dawkowania (patrz powyżej: „Zaburzenia czynności nerek”). Sposób podawania Podanie doustne.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, hydroksyzynę lub pochodne piperazyny. U pacjentów z ciężkimi zaburzeniami czynności nerek z klirensem kreatyniny poniżej 10 ml/min.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stwierdzono istotnych klinicznie interakcji między alkoholem (w stężeniu 0,5 g/l we krwi) a cetyryzyną stosowaną w dawkach terapeutycznych. Jednakże zaleca się zachowanie ostrożności podczas przyjmowania cetyryzyny jednocześnie z alkoholem. Należy zachować ostrożność u pacjentów z czynnikami ryzyka zatrzymania moczu (np. uszkodzenia rdzenia kręgowego, rozrost gruczołu krokowego), ponieważ cetyryzyna może zwiększać ryzyko zatrzymania moczu. Zaleca się ostrożność podczas stosowania u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstąpienie od stosowania leków przeciwhistaminowych na 3 dni przed wykonaniem testów. W przypadku przerwania stosowania cetyryzyny może wystąpić świąd i (lub) pokrzywka, nawet jeśli objawy te nie występowały przed rozpoczęciem leczenia.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlSpecjalne środki ostrozności
W niektórych przypadkach objawy te mogą być nasilone i może być konieczne wznowienie leczenia. Objawy powinny ustąpić po wznowieniu leczenia. Dzieci i młodzież Nie zaleca się stosowania tego produktu leczniczego u dzieci w wieku poniżej 2 lat. Produkt zawiera 350 mg sorbitolu w każdym ml syropu. Pacjenci z dziedziczną nietolerancją fruktozy nie mogą przyjmować tego produktu leczniczego. Należy wziąć pod uwagę addytywne działanie podawanych jednocześnie produktów zawierających fruktozę (lub sorbitol) oraz pokarmu zawierającego fruktozę (lub sorbitol). Sorbitol zawarty w produkcie leczniczym może wpływać na biodostępność innych, podawanych równocześnie drogą doustną, produktów leczniczych. U małych dzieci (o masie ciała poniżej 12,5 kg, dla których dawka sorbitolu przyjęta z produktem Allertec przekracza 140 mg/kg mc. na dobę) sorbitol może powodować dyskomfort ze strony układu pokarmowego i może mieć łagodne działanie przeczyszczające.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlSpecjalne środki ostrozności
Metylu parahydroksybenzoesan i propylu parahydroksybenzoesan mogą powodować reakcje alergiczne (możliwe reakcje typy późnego). Produkt zawiera 50 mg glikolu propylenowego w 1 ml syropu. Produkt zawiera mniej niż 1 mmol (23 mg) sodu w 10 ml syropu, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na właściwości farmakokinetyczne, farmakodynamiczne oraz profil tolerancji cetyryzyny nie są spodziewane interakcje tego produktu leczniczego z innymi lekami. W przeprowadzonych badaniach nie donoszono o występowaniu interakcji farmakodynamicznych ani znaczących interakcji farmakokinetycznych, w szczególności z pseudoefedryną lub teofiliną (400 mg na dobę). Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, natomiast zmniejsza szybkość wchłaniania cetyryzyny. U wrażliwych pacjentów, jednoczesne stosowanie z alkoholem lub lekami o działaniu hamującym na ośrodkowy układ nerwowy, może dodatkowo zmniejszać zdolność reagowania i koncentrację. Cetyryzyna nie nasila jednak działania alkoholu (w stężeniu 0,5 g/l we krwi).
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Prospektywnie zebrane dane dotyczące stosowania cetyryzyny w okresie ciąży nie wskazują na zwiększone działanie toksyczne w stosunku do matki, płodu lub zarodka. Badania przeprowadzone na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy. Należy zachować ostrożność podczas przepisywania cetyryzyny kobietom w ciąży. Karmienie piersi? Cetyryzyna przenika do mleka matki w stężeniach stanowiących 25 do 90% stężenia leku w osoczu w zależności od czasu pobierania próbek po podaniu. Dlatego należy zachować ostrożność podczas przepisywania produktu kobietom karmiącym piersią. Płodność Dane dotyczące wpływu na płodność u ludzi są ograniczone, nie stwierdzono jednak zagrożenia dla bezpieczeństwa. Badania na zwierzętach nie wykazały zagrożenia dla bezpieczeństwa płodności u ludzi.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Obiektywne badania z zastosowaniem cetyryzyny w zalecanej dawce 10 mg nie wykazały istotnego klinicznie wpływu na zdolność prowadzenia pojazdów, odczuwanie senności oraz sprawność psychofizyczną. Pacjenci, u których wystąpiła senność, powinni jednak unikać prowadzenia pojazdów, wykonywania potencjalnie niebezpiecznych czynności oraz obsługiwania maszyn. Pacjenci powinni zwrócić uwagę na reakcję organizmu na produkt oraz nie powinni stosować dawek większych niż zalecane.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne - Podsumowanie W badaniach klinicznych wykazano, że cetyryzyna podawana w zalecanych dawkach wywołuje działania niepożądane ze strony ośrodkowego układu nerwowego o nieznacznym nasileniu, w tym senność, zmęczenie, bóle i zawroty głowy. W niektórych przypadkach obserwowano paradoksalne pobudzenie ośrodkowego układu nerwowego. Mimo, iż cetyryzyna jest selektywnym antagonistą obwodowych receptorów H1 i jest praktycznie pozbawiona aktywności cholinolitycznej, zgłaszano pojedyncze przypadki trudności w oddawaniu moczu, zaburzeń akomodacji oka oraz suchości błony śluzowej jamy ustnej. Zgłaszano przypadki zaburzeń czynności wątroby ze zwiększoną aktywnością enzymów wątrobowych i ze zwiększonym stężeniem bilirubiny. W większości przypadków ustępowały one po przerwaniu przyjmowania cetyryzyny dichlorowodorku.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlDziałania niepożądane
Zestawienie działań niepożądanych Dostępne są ilościowe dane dotyczące bezpieczeństwa z badań klinicznych prowadzonych metodą podwójnie ślepej próby, porównujących cetyryzynę z placebo oraz innymi lekami przeciwhistaminowymi stosowanymi w zalecanych dawkach (10 mg na dobę dla cetyryzyny). W badaniach uczestniczyło ponad 3200 pacjentów leczonych cetyryzyną. W badaniach kontrolowanych placebo, z zastosowaniem cetyryzyny w dawce 10 mg obserwowano następujące działania niepożądane, występujące z częstością 1% lub większą: Działania niepożądane (zgodnie z terminologią działań niepożądanych wg WHO) Cetyryzyna 10 mg (n=3260) Placebo (n=3061) Zaburzenia ogólne i stany w miejscu podania Zmęczenie: 1,63% (Cetyryzyna), 0,95% (Placebo) Zaburzenia układu nerwowego Zawroty głowy: 1,10% (Cetyryzyna), 0,98% (Placebo) Ból głowy: 7,42% (Cetyryzyna), 8,07% (Placebo) Zaburzenia żołądka i jelit Ból brzucha: 0,98% (Cetyryzyna), 1,08% (Placebo) Suchość błony śluzowej jamy ustnej: 2,09% (Cetyryzyna), 0,82% (Placebo) Nudności: 1,07% (Cetyryzyna), 1,14% (Placebo) Zaburzenia psychiczne Senność: 9,63% (Cetyryzyna), 5,00% (Placebo) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zapalenie gardła: 1,29% (Cetyryzyna), 1,34% (Placebo) Mimo, iż senność występowała statystycznie częściej w grupie otrzymującej cetyryzynę niż w grupie otrzymującej placebo, w większości przypadków miała ona nasilenie łagodne do umiarkowanego.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlDziałania niepożądane
Inne, obiektywne badania nie wykazały wpływu cetyryzyny w zalecanych dawkach dobowych na aktywność młodych, zdrowych ochotników. Dzieci i młodzież Działania niepożądane występujące z częstością 1% lub większą u dzieci w wieku od 6 miesięcy do 12 lat, pochodzące z badań klinicznych lub farmakoklinicznych kontrolowanych placebo to: Działania niepożądane (zgodnie z terminologią działań niepożądanych wg WHO) Cetyryzyna (n=1656) Placebo (n=1294) Zaburzenia żołądka i jelit Biegunka: 1,0% (Cetyryzyna), 0,6% (Placebo) Zaburzenia psychiczne Senność: 1,8% (Cetyryzyna), 1,4% (Placebo) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zapalenie błony śluzowej nosa: 1,4% (Cetyryzyna), 1,1% (Placebo) Zaburzenia ogólne i stany w miejscu podania Zmęczenie: 1,0% (Cetyryzyna), 0,3% (Placebo) Dane pochodzące z okresu po wprowadzeniu cetyryzyny do obrotu Oprócz wymienionych powyżej działań niepożądanych występujących podczas badań klinicznych, zgłaszano następujące działania niepożądane po wprowadzeniu cetyryzyny do obrotu.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlDziałania niepożądane
Działania niepożądane opisano według klasyfikacji układów i narządów MedDRA, a częstość występowania określono na podstawie obserwacji z okresu po wprowadzeniu leku do obrotu. Częstość występowania określono w następujący sposób: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do < 1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego Bardzo rzadko: trombocytopenia Zaburzenia układu immunologicznego Rzadko: reakcje nadwrażliwości Bardzo rzadko: wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania Częstość nieznana: zwiększenie apetytu Zaburzenia psychiczne Niezbyt często: pobudzenie Rzadko: zachowanie agresywne, splątanie, depresja, omamy, bezsenność Bardzo rzadko: tiki Częstość nieznana: myśli samobójcze, koszmary senne Zaburzenia układu nerwowego Niezbyt często: parestezja Rzadko: drgawki Bardzo rzadko: zaburzenia smaku, omdlenie, drżenie, dystonia, dyskineza Częstość nieznana: amnezja, zaburzenia pamięci Zaburzenia oka Bardzo rzadko: zaburzenia akomodacji, niewyraźne widzenie, rotacja gałek ocznych Zaburzenia ucha i błędnika Częstość nieznana: zawroty głowy Zaburzenia serca Rzadko: tachykardia Zaburzenia żołądka i jelit Niezbyt często: biegunka Zaburzenia wątroby i dróg żółciowych Rzadko: nieprawidłowa czynność wątroby (zwiększona aktywność aminotransferaz, fosfatazy alkalicznej, γ-GT i zwiększone stężenie bilirubiny) Częstość nieznana: zapalenie wątroby Zaburzenia skóry i tkanki podskórnej Niezbyt często: świąd, wysypka Rzadko: pokrzywka Bardzo rzadko: obrzęk naczynioruchowy, wysypka polekowa Częstość nieznana: ostra uogólniona osutka krostkowa Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Częstość nieznana: bóle stawów Zaburzenia nerek i dróg moczowych Bardzo rzadko: bolesne lub utrudnione oddawanie moczu, mimowolne oddawanie moczu Częstość nieznana: zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania Niezbyt często: osłabienie, złe samopoczucie Rzadko: obrzęki Badania diagnostyczne Rzadko: zwiększenie masy ciała Opis wybranych działań niepożądanych Zgłaszano przypadki świądu (intensywnego swędzenia) i (lub) pokrzywki po przerwaniu stosowania cetyryzyny.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlPrzedawkowanie
4.9 Przedawkowanie Objawy przedawkowania Objawy obserwowane po przedawkowaniu cetyryzyny związane są przede wszystkim z działaniem na ośrodkowy układ nerwowy, mogą wskazywać także na działanie przeciwcholinergiczne. Po przyjęciu dawki cetyryzyny co najmniej 5 razy większej od zalecanej dawki dobowej zgłaszano następujące działania niepożądane: splątanie, biegunkę, zawroty głowy, zmęczenie, bóle głowy, złe samopoczucie, rozszerzenie źrenic, świąd, niepokój, zwłaszcza ruchowy, sedację, senność, osłupienie, tachykardię, drżenie, zatrzymanie moczu. Postępowanie po przedawkowaniu Specyficzne antidotum nie jest znane. W razie przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Jeżeli od zażycia zbyt dużej dawki produktu nie minęło zbyt wiele czasu, należy rozważyć wykonanie płukania żołądka. Cetyryzyna nie jest skutecznie usuwana metodą hemodializy.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny, kod ATC: R06AE07 Mechanizm działania Cetyryzyna, metabolit hydroksyzyny u człowieka, jest silnym i selektywnym antagonistą obwodowych receptorów histaminowych H1. Badania wiązania z receptorem in vitro nie wykazały istotnego powinowactwa do innych receptorów niż H1. Działanie farmakodynamiczne Oprócz działania antagonistycznego w stosunku do receptorów H1, cetyryzyna wykazuje działanie przeciwalergiczne: u pacjentów z nadwrażliwością (atopią) poddawanych prowokacji alergenem, dawka 10 mg podawana raz lub dwa razy na dobę, hamuje napływ komórek późnej fazy reakcji zapalnej, eozynofili, do skóry i spojówek. Skuteczność kliniczna i bezpieczeństwo stosowania Badania u zdrowych ochotników wykazały, że cetyryzyna w dawkach 5 i 10 mg silnie hamuje reakcję prowadzącą do powstawania bąbli pokrzywkowych i zaczerwienienia, wywołaną śródskórnym podawaniem histaminy w bardzo dużych stężeniach, ale nie ustalono związku tego działania ze skutecznością.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlWłaściwości farmakodynamiczne
W sześciotygodniowym, kontrolowanym placebo badaniu z udziałem 186 pacjentów z alergicznym zapaleniem błony śluzowej nosa oraz współistniejącą, łagodną lub umiarkowaną astmą, cetyryzyna stosowana w dawce 10 mg raz na dobę łagodziła objawy zapalenia błony śluzowej nosa i nie wpływała na czynność płuc. Badanie to potwierdza bezpieczeństwo stosowania cetyryzyny u pacjentów z alergią i z łagodną lub umiarkowaną astmą. W badaniu kontrolowanym placebo cetyryzyna podawana w dużej dawce dobowej wynoszącej 60 mg przez siedem dni nie powodowała statystycznie znamiennego wydłużenia odstępu QT. Stosowanie cetyryzyny w zalecanych dawkach poprawia jakość życia pacjentów z przewlekłym i sezonowym alergicznym zapaleniem błony śluzowej nosa. Dzieci i młodzież W trwającym 35 dni badaniu, przeprowadzonym u dzieci w wieku od 5 do 12 lat nie stwierdzono tolerancji na przeciwhistaminowe działanie cetyryzyny (hamowanie powstawania bąbli pokrzywkowych i zaczerwienienia).
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlWłaściwości farmakodynamiczne
Po przerwaniu leczenia cetyryzyną podawaną wielokrotnie, skóra odzyskuje normalną reaktywność na histaminę w ciągu 3 dni.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Maksymalne stężenie w osoczu w stanie stacjonarnym wynosi około 300 ng/ml i występuje w ciągu 1,0 ± 0,5 h. Rozkład parametrów farmakokinetycznych, takich jak stężenie maksymalne (Cmax) i pole pod krzywą (AUC), jest jednoznacznie zdefiniowany. Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, lecz zmniejsza szybkość wchłaniania cetyryzyny. W przypadku podawania cetyryzyny w postaci roztworu, kapsułek i tabletek, biodostępność jest podobna. Dystrybucja Pozorna objętość dystrybucji wynosi 0,50 l/kg. Cetyryzyna wiąże się z białkami osocza w 93 ± 0,3%. Cetyryzyna nie wpływa na stopień wiązania warfaryny z białkami. Metabolizm Cetyryzyna nie podlega w znaczącym stopniu metabolizmowi pierwszego przejścia. Eliminacja Końcowy okres półtrwania wynosi około 10 godzin. Nie zaobserwowano kumulacji cetyryzyny podczas stosowania dawek dobowych 10 mg przez 10 dni. Około dwie trzecie dawki jest wydalane w postaci niezmienionej z moczem.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlWłaściwości farmakokinetyczne
Liniowość lub nieliniowość Cetyryzyna wykazuje liniową kinetykę w zakresie dawek od 5 do 60 mg. Szczególne grupy pacjentów Zaburzenia czynności nerek Farmakokinetyka leku u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny powyżej 40 ml/min) oraz u zdrowych ochotników była podobna. U pacjentów z umiarkowanymi zaburzeniami czynności nerek okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u zdrowych ochotników. U pacjentów poddawanych hemodializie (klirens kreatyniny mniejszy niż 7 ml/min), którym podano doustnie cetyryzynę w pojedynczej dawce 10 mg, okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u osób zdrowych. Podczas hemodializy cetyryzyna była usuwana z osocza w niewielkim stopniu. Konieczna jest modyfikacja dawkowania u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2).
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlWłaściwości farmakokinetyczne
Zaburzenia czynności wątroby U pacjentów z przewlekłymi chorobami wątroby (marskość żółciowa, choroby dotyczące miąższu wątroby, choroby związane z zastojem żółci), którym podano 10 lub 20 mg cetyryzyny w pojedynczej dawce, okres półtrwania wydłużył się o 50%, a klirens zmniejszył o 40% w porównaniu do osób zdrowych. Modyfikacja dawkowania jest konieczna tylko u tych pacjentów z zaburzeniami czynności wątroby, u których jednocześnie występują zaburzenia czynności nerek. Pacjenci w podeszłym wieku U 16 pacjentów w podeszłym wieku po podaniu doustnie pojedynczej dawki 10 mg okres półtrwania wydłużył się o około 50%, a klirens zmniejszył się o 40% w porównaniu z pozostałymi, młodszymi pacjentami. Wydaje się, że zmniejszenie klirensu cetyryzyny u ochotników w podeszłym wieku jest związane z występującym w tej grupie osłabieniem czynności nerek.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlWłaściwości farmakokinetyczne
Dzieci i młodzież U dzieci w wieku od 6 do 12 lat okres półtrwania cetyryzyny wynosi około 6 godzin, a u dzieci w wieku 2 do 6 lat wynosi 5 godzin. U niemowląt i dzieci w wieku od 6 do 24 miesięcy okres półtrwania jest zmniejszony do 3,1 godziny.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne dotyczące cetyryzyny, uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozrodczość, nie ujawniają występowania szczególnego zagrożenia dla człowieka.
- CHPL leku Allertec Kids, syrop, 5 mg/5 mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sorbitol (E420) Glicerol Glikol propylenowy Metylu parahydroksybenzoesan (E218) Propylu parahydroksybenzoesan (E216) Sacharyna sodowa (E954) Kwas octowy lodowaty Sodu octan trójwodny Esencja owocu granatu Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata. Okres ważności produktu po pierwszym otwarciu butelki wynosi 3 miesiące. 6.4 Specjalne środki ostrożności podczas przechowywania Chronić od światła. 6.5 Rodzaj i zawartość opakowania Butelka z brązowego PET zamknięta z akrętką z polietylenu (HDPE) z nasadzoną miarką z polipropylenu (PP), w tekturowym pudełku. 100 ml – 1 butelka po 100 ml. Miarka o całkowitej pojemności 10 ml umożliwia odmierzenie 2,5 ml, 5 ml, 10 ml syropu. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Letizen, tabletki powlekane, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Letizen, 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 10 mg cetyryzyny dichlorowodorku (Cetirizini dihydrochloridum). Substancja pomocnicza o znanym działaniu: Jedna tabletka powlekana zawiera 75 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana Okrągłe, lekko dwuwypukłe, białe tabletki powlekane z nacięciem na jednej stronie.
- CHPL leku Letizen, tabletki powlekane, 10 mgWskazania do stosowania
4.1 Wskazania do stosowania Letizen jest wskazany u dorosłych i dzieci w wieku 6 lat i starszych: w łagodzeniu objawów dotyczących nosa i oczu, związanych z sezonowym i przewlekłym alergicznym zapaleniem błony śluzowej nosa, w łagodzeniu objawów przewlekłej idiopatycznej pokrzywki.
- CHPL leku Letizen, tabletki powlekane, 10 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli: 10 mg (1 tabletka) raz na dobę. Szczególne grupy pacjentów Pacjenci w podeszłym wieku Brak danych wskazujących na konieczność zmniejszenia dawki leku u osób w podeszłym wieku, jeśli czynność nerek jest u nich prawidłowa. Zaburzenia czynności nerek Brak danych określających stosunek skuteczności do bezpieczeństwa stosowania u pacjentów z zaburzeniami czynności nerek. Ponieważ cetyryzyna jest wydalana głównie przez nerki (patrz punkt 5.2), w przypadku braku możliwości zastosowania alternatywnego leczenia, odstępy pomiędzy poszczególnymi dawkami muszą być ustalone indywidualnie w zależności od czynności nerek. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. W celu skorzystania z tabeli dawkowania, należy obliczyć klirens kreatyniny (Clkr) w ml/min.
- CHPL leku Letizen, tabletki powlekane, 10 mgDawkowanie
Clkr (ml/min) można obliczyć na podstawie stężenia kreatyniny w surowicy krwi (mg/dl), posługując się następującym wzorem: Clkr = 2 [140 - wiek (lata)] x masa ciała (kg) ——————————————————————————— (x 0,85 dla kobiet) 72 x stężenie kreatyniny w surowicy (mg/dl) Dostosowanie dawki u dorosłych pacjentów z zaburzeniami czynności nerek Stopień wydolności nerek Klirens kreatyniny (ml/min) Dawka i częstość podawania Prawidłowa czynność nerek ≥ 80: 10 mg raz na dobę Łagodne zaburzenia czynności nerek 50-79: 10 mg raz na dobę Umiarkowane zaburzenia czynności nerek 30-49: 5 mg raz na dobę Ciężkie zaburzenia czynności nerek < 30: 5 mg co drugi dzień Schyłkowa choroba nerek, pacjenci dializowani < 10: Stosowanie przeciwwskazane Zaburzenia czynności wątroby Nie ma konieczności dostosowania dawki u pacjentów, u których występują wyłącznie zaburzenia czynności wątroby.
- CHPL leku Letizen, tabletki powlekane, 10 mgDawkowanie
U pacjentów z zaburzeniami czynności wątroby i nerek zaleca się dostosowanie dawki (patrz powyżej: „Zaburzenia czynności nerek”). Dzieci i młodzież Nie zaleca się stosowania produktu leczniczego w postaci tabletek u dzieci w wieku poniżej 6 lat, ponieważ ta postać farmaceutyczna nie pozwala na odpowiednie dostosowanie dawki. Dzieci w wieku od 6 do 12 lat: 5 mg dwa razy na dobę (pół tabletki dwa razy na dobę). Młodzież w wieku powyżej 12 lat: 10 mg raz na dobę (1 tabletka). U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy ustalać indywidualnie na podstawie klirensu kreatyniny, wieku oraz masy ciała pacjenta. Sposób podawania Tabletki należy połykać popijając szklanką płynu.
- CHPL leku Letizen, tabletki powlekane, 10 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nadwrażliwość na hydroksyzynę lub pochodne piperazyny. U pacjentów z ciężkimi zaburzeniami czynności nerek z klirensem kreatyniny mniejszym niż 10 ml/min.
- CHPL leku Letizen, tabletki powlekane, 10 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stwierdzono istotnych klinicznie interakcji między alkoholem (w stężeniu 0,5 g/l we krwi) a cetyryzyną stosowaną w dawkach terapeutycznych. Jednakże zaleca się zachowanie ostrożności podczas przyjmowania cetyryzyny jednocześnie z alkoholem. Należy zachować ostrożność u pacjentów z czynnikami ryzyka zatrzymania moczu (np. uszkodzony rdzeń kręgowy, rozrost gruczołu krokowego), ponieważ cetyryzyna może zwiększać ryzyko zatrzymania moczu. Zaleca się ostrożność podczas stosowania produktu leczniczego u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych i dlatego należy na 3 dni przed wykonaniem testów skórnych przerwać stosowanie tych leków. W przypadku przerwania stosowania cetyryzyny może wystąpić świąd i (lub) pokrzywka, nawet, jeśli objawy te nie występowały przed rozpoczęciem leczenia.
- CHPL leku Letizen, tabletki powlekane, 10 mgSpecjalne środki ostrozności
W niektórych przypadkach objawy te mogą być nasilone i może być konieczne wznowienie leczenia. Objawy powinny ustąpić po wznowieniu leczenia. Produkt leczniczy Letizen nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy. Dzieci i młodzież Nie zaleca się stosowania produktu leczniczego w postaci tabletek powlekanych u dzieci w wieku poniżej 6 lat, ponieważ ta postać farmaceutyczna nie pozwala na odpowiednie dostosowanie dawki. Zaleca się stosowanie cetyryzyny w postaci farmaceutycznej przeznaczonej dla dzieci.
- CHPL leku Letizen, tabletki powlekane, 10 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na właściwości farmakokinetyczne, farmakodynamiczne oraz profil tolerancji cetyryzyny nie są spodziewane interakcje tego produktu leczniczego z innymi lekami. W przeprowadzonych badaniach nie donoszono o występowaniu interakcji farmakodynamicznych ani znaczących interakcji farmakokinetycznych, w szczególności z pseudoefedryną lub teofiliną (400 mg na dobę). Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, natomiast zmniejsza szybkość wchłaniania cetyryzyny. U wrażliwych pacjentów, jednoczesne stosowanie z alkoholem lub lekami o działaniu hamującym na ośrodkowy układ nerwowy, może dodatkowo zmniejszać zdolność reagowania i koncentrację. Cetyryzyna nie nasila jednak działania alkoholu (w stężeniu 0,5 g/l we krwi).
- CHPL leku Letizen, tabletki powlekane, 10 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Prospektywnie zebrane dane dotyczące stosowania cetyryzyny w okresie ciąży nie wskazują na zwiększone działanie toksyczne w stosunku do matki, płodu lub zarodka. Badania przeprowadzone na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu i rozwój pourodzeniowy. Należy zachować ostrożność przepisując cetyryzynę kobietom w ciąży. Karmienie piersi? Cetyryzyna przenika do mleka matki w stężeniach stanowiących 25 do 90% stężenia leku w osoczu, w zależności od czasu pobierania próbek po podaniu leku. Dlatego też należy zachować ostrożność przepisując cetyryzynę kobietom karmiącym piersią. Płodność Dane dotyczące wpływu na płodność u ludzi są ograniczone, nie stwierdzono jednak zagrożenia dla bezpieczeństwa. Dane z badań na zwierzętach nie wskazują na zagrożenie dla bezpieczeństwa w zakresie rozrodczości u ludzi.
- CHPL leku Letizen, tabletki powlekane, 10 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Obiektywne badania z zastosowaniem cetyryzyny w zalecanej dawce 10 mg nie wykazały istotnego klinicznie wpływu na zdolność prowadzenia pojazdów, odczuwanie senności oraz sprawność psychofizyczną. Pacjenci, u których wystąpiła senność, powinni jednak unikać prowadzenia pojazdów, wykonywania potencjalnie niebezpiecznych czynności oraz obsługiwania maszyn. Pacjenci powinni zwrócić uwagę na reakcję organizmu na lek oraz nie powinni stosować dawek większych niż zalecane.
- CHPL leku Letizen, tabletki powlekane, 10 mgDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne Podsumowanie W badaniach klinicznych wykazano, że cetyryzyna w zalecanych dawkach wywołuje działania niepożądane ze strony ośrodkowego układu nerwowego o nieznacznym nasileniu, w tym senność, zmęczenie, bóle i zawroty głowy. W niektórych przypadkach obserwowano paradoksalne pobudzenie ośrodkowego układu nerwowego. Mimo, iż cetyryzyna jest selektywnym antagonistą obwodowych receptorów H1 i jest praktycznie pozbawiona aktywności cholinolitycznej, zgłaszano pojedyncze przypadki trudności w oddawaniu moczu, zaburzeń akomodacji oka i suchości błony śluzowej jamy ustnej. Zgłaszano przypadki zaburzeń czynności wątroby ze zwiększoną aktywnością enzymów wątrobowych i ze zwiększonym stężeniem bilirubiny. W większości przypadków ustępowały one po przerwaniu przyjmowania cetyryzyny dichlorowodorku.
- CHPL leku Letizen, tabletki powlekane, 10 mgDziałania niepożądane
Zestawienie działań niepożądanych Dostępne są ilościowe dane dotyczące bezpieczeństwa z badań klinicznych prowadzonych metodą podwójnie ślepej próby, porównujących cetyryzynę z placebo oraz innymi lekami przeciwhistaminowymi stosowanymi w zalecanych dawkach (10 mg na dobę dla cetyryzyny). W badaniach uczestniczyło ponad 3200 pacjentów leczonych cetyryzyną. W badaniach kontrolowanych placebo, z zastosowaniem cetyryzyny w dawce 10 mg obserwowano następujące działania niepożądane, występujące z częstością 1% lub większą: Działania niepożądane (zgodnie z terminologią działań niepożądanych wg WHO) Cetyryzyna 10 mg (n = 3260) Placebo (n = 3061) Zaburzenia ogólne i stany w miejscu podania Zmęczenie 1,63% - 0,95% Zaburzenia układu nerwowego Zawroty głowy 1,10% - 0,98% Ból głowy 7,42% - 8,07% Zaburzenia żołądka i jelit Bóle brzucha 0,98% - 1,08% Suchość błony śluzowej jamy ustnej 2,09% - 0,82% Nudności 1,07% - 1,14% Zaburzenia psychiczne Senność 9,63% - 5,00% Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zapalenie gardła 1,29% - 1,34% Mimo, iż senność występowała statystycznie częściej u pacjentów stosujących cetyryzynę niż w grupie otrzymującej placebo, w większości przypadków miała ona nasilenie łagodne do umiarkowanego.
- CHPL leku Letizen, tabletki powlekane, 10 mgDziałania niepożądane
Inne, obiektywne badania nie wykazały wpływu cetyryzyny w zalecanych dawkach dobowych na zwykłą, codzienną aktywność młodych, zdrowych ochotników. Dzieci i młodzież Działania niepożądane występujące z częstością 1% lub większą u dzieci w wieku od 6 miesięcy do 12 lat, stwierdzone w badaniach klinicznych kontrolowanych placebo, to: Działania niepożądane (zgodnie z terminologią działań niepożądanych wg WHO) Cetyryzyna (n = 1656) Placebo (n = 1294) Zaburzenia żołądka i jelit Biegunka 1,0% - 0,6% Zaburzenia psychiczne Senność 1,8% - 1,4% Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zapalenie błony śluzowej nosa 1,4% - 1,1% Zaburzenia ogólne i stany w miejscu podania Zmęczenie 1,0% - 0,3% Dane pochodzące z okresu po wprowadzeniu cetyryzyny do obrotu Oprócz wymienionych powyżej działań niepożądanych występujących podczas badań klinicznych, po wprowadzeniu leku do obrotu zgłaszano następujące działania niepożądane.
- CHPL leku Letizen, tabletki powlekane, 10 mgDziałania niepożądane
Działania niepożądane przedstawiono zgodnie z klasyfikacją układów i narządów MedDRA, a ich częstość występowania określono na podstawie danych dostępnych po wprowadzeniu produktu leczniczego do obrotu. Częstość występowania działań niepożądanych określono następująco: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) Zaburzenia krwi i układu chłonnego Bardzo rzadko: trombocytopenia Zaburzenia układu immunologicznego Rzadko: reakcje nadwrażliwości Bardzo rzadko: wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania Częstość nieznana: zwiększenie apetytu Zaburzenia psychiczne Niezbyt często: pobudzenie Rzadko: zachowanie agresywne, splątanie, depresja, omamy, bezsenność Bardzo rzadko: tiki Częstość nieznana: myśli samobójcze, koszmary senne Zaburzenia układu nerwowego Niezbyt często: parestezja Rzadko: drgawki Bardzo rzadko: zaburzenia smaku, dyskineza, dystonia, omdlenia, drżenie Częstość nieznana: amnezja, zaburzenia pamięci Zaburzenia oka Bardzo rzadko: zaburzenia akomodacji, niewyraźne widzenie, rotacja gałek ocznych Zaburzenia ucha i błędnika Częstość nieznana: zawroty głowy Zaburzenia serca Rzadko: tachykardia Zaburzenia żołądka i jelit Niezbyt często: biegunka Zaburzenia wątroby i dróg żółciowych Rzadko: zaburzenia czynności wątroby (zwiększona aktywność aminotransferaz, fosfatazy alkalicznej, GGTP i zwiększone stężenie bilirubiny) Częstość nieznana: zapalenie wątroby Zaburzenia skóry i tkanki podskórnej Niezbyt często: świąd, wysypka Rzadko: pokrzywka Bardzo rzadko: obrzęk naczynioruchowy, wysypka polekowa Częstość nieznana: ostra uogólniona osutka krostkowa Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Częstość nieznana: bóle stawów Zaburzenia nerek i dróg moczowych Bardzo rzadko: bolesne lub utrudnione oddawanie moczu, mimowolne oddawanie moczu Częstość nieznana: zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania Niezbyt często: osłabienie, złe samopoczucie Rzadko: obrzęki Badania diagnostyczne Rzadko: zwiększenie masy ciała Opis wybranych działań niepożądanych Zgłaszano przypadki świądu (intensywnego swędzenia) i (lub) pokrzywki po przerwaniu stosowania cetyryzyny.
- CHPL leku Letizen, tabletki powlekane, 10 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 fax: + 48 22 49 21 309 e-mail: ndl@urpl.gov.pl Działania niepożądane można również zgłaszać podmiotowi odpowiedzialnemu.
- CHPL leku Letizen, tabletki powlekane, 10 mgPrzedawkowanie
4.9 Przedawkowanie Objawy Objawy obserwowane po przedawkowaniu cetyryzyny są związane głównie z działaniem na ośrodkowy układ nerwowy lub mogą wskazywać na działanie przeciwcholinergiczne. Po przyjęciu dawki cetyryzyny co najmniej 5 razy większej od zalecanej dawki dobowej zgłaszano następujące działania niepożądane: splątanie, biegunkę, zawroty głowy, zmęczenie, bóle głowy, złe samopoczucie, rozszerzenie źrenic, świąd, niepokój, zwłaszcza ruchowy, sedację, senność, osłupienie, tachykardię, drżenie, zatrzymanie moczu. Postępowanie po przedawkowaniu Specyficzne antidotum dla cetyryzyny nie jest znane. W przypadku przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Jeżeli od zażycia zbyt dużej dawki leku nie minęło zbyt wiele czasu, należy rozważyć wykonanie płukania żołądka. Cetyryzyna nie jest skutecznie usuwana metodą hemodializy.
- CHPL leku Letizen, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny, kod ATC: R06AE07. Mechanizm działania Cetyryzyna, metabolit hydroksyzyny u człowieka, jest silnym i selektywnym antagonistą obwodowych receptorów histaminowych H1. Badania wiązania z receptorem in vitro nie wykazały istotnego powinowactwa do innych receptorów niż H1. Działanie farmakodynamiczne Oprócz działania antagonistycznego w stosunku do receptorów H1, cetyryzyna wykazuje działanie przeciwalergiczne: u pacjentów z nadwrażliwością (atopią) poddawanych prowokacji alergenem, dawka 10 mg podawana raz lub dwa razy na dobę, hamuje napływ komórek późnej fazy reakcji zapalnej (eozynofilów) do skóry i spojówek. Skuteczność kliniczna i bezpieczeństwo stosowania Badania u zdrowych ochotników wykazały, że cetyryzyna w dawkach 5 i 10 mg silnie hamuje reakcję prowadzącą do powstawania bąbli pokrzywkowych i zaczerwienienia, wywołaną śródskórnym podawaniem histaminy w bardzo dużych stężeniach, ale nie ustalono związku tego działania ze skutecznością.
- CHPL leku Letizen, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
W sześciotygodniowym, kontrolowanym placebo badaniu z udziałem 186 pacjentów z alergicznym zapaleniem błony śluzowej nosa oraz współistniejącą, łagodną lub umiarkowaną astmą, cetyryzyna stosowana w dawce 10 mg raz na dobę łagodziła objawy zapalenia błony śluzowej nosa i nie wpływała na czynność płuc. Badanie to potwierdza bezpieczeństwo stosowania cetyryzyny u pacjentów z alergią i z łagodną lub umiarkowaną astmą. W badaniu kontrolowanym placebo cetyryzyna podawana w dużej dawce dobowej wynoszącej 60 mg przez siedem dni nie powodowała statystycznie znamiennego wydłużenia odstępu QT. Stosowanie cetyryzyny w zalecanych dawkach poprawia jakość życia pacjentów z przewlekłym i sezonowym alergicznym zapaleniem błony śluzowej nosa. Dzieci i młodzież W trwającym 35 dni badaniu, przeprowadzonym u dzieci w wieku od 5 do 12 lat nie stwierdzono tolerancji na przeciwhistaminowe działanie cetyryzyny (hamowanie powstawania bąbli pokrzywkowych i zaczerwienienia).
- CHPL leku Letizen, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
Po przerwaniu leczenia cetyryzyną podawaną wielokrotnie, skóra odzyskuje normalną reaktywność na histaminę w ciągu 3 dni.
- CHPL leku Letizen, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Maksymalne stężenie w osoczu w stanie stacjonarnym wynosi około 300 ng/ml i występuje w ciągu 1,0 ± 0,5 h. Rozkład parametrów farmakokinetycznych, takich jak stężenie maksymalne (Cmax) i pole pod krzywą (AUC), jest jednoznacznie zdefiniowany. Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, lecz zmniejsza szybkość wchłaniania cetyryzyny. W przypadku podawania cetyryzyny w postaci roztworu, kapsułek i tabletek, biodostępność jest podobna. Dystrybucja Pozorna objętość dystrybucji wynosi 0,50 l/kg. Cetyryzyna wiąże się z białkami osocza w 93 ± 0,3%. Cetyryzyna nie wpływa na stopień wiązania warfaryny z białkami. Metabolizm Cetyryzyna nie podlega w znaczącym stopniu metabolizmowi pierwszego przejścia. Eliminacja Końcowy okres półtrwania wynosi około 10 godzin. Nie zaobserwowano kumulacji cetyryzyny podczas stosowania dawek dobowych 10 mg przez 10 dni. Około dwie trzecie dawki jest wydalane w postaci niezmienionej z moczem.
- CHPL leku Letizen, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Liniowość lub nieliniowość Cetyryzyna wykazuje liniową kinetykę w zakresie dawek od 5 do 60 mg. Zaburzenia czynności nerek Farmakokinetyka leku była podobna u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny powyżej 40 ml/min) oraz u zdrowych ochotników. U pacjentów z umiarkowanymi zaburzeniami czynności nerek okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u zdrowych ochotników. U pacjentów poddawanych hemodializie (klirens kreatyniny mniejszy niż 7 ml/min), którym podano doustnie cetyryzynę w pojedynczej dawce 10 mg, okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u osób zdrowych. Podczas hemodializy cetyryzyna była usuwana z osocza w niewielkim stopniu. Konieczne jest dostosowanie dawkowania u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2).
- CHPL leku Letizen, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Zaburzenia czynności wątroby U pacjentów z przewlekłymi chorobami wątroby (marskość żółciowa, choroby dotyczące miąższu wątroby, choroby związane z zastojem żółci), którym podano 10 lub 20 mg cetyryzyny w pojedynczej dawce, okres półtrwania wydłużył się o 50%, a klirens zmniejszył o 40% w porównaniu do osób zdrowych. Dostosowanie dawkowania jest konieczne tylko u tych pacjentów z zaburzeniami czynności wątroby, u których jednocześnie występują zaburzenia czynności nerek. Osoby w podeszłym wieku U 16 ochotników w podeszłym wieku po podaniu doustnym pojedynczej dawki 10 mg okres półtrwania wydłużył się o około 50%, a klirens zmniejszył się o 40% w porównaniu z młodszymi pacjentami. Wydaje się, że zmniejszenie klirensu cetyryzyny u ochotników w podeszłym wieku jest związane z zaburzeniem czynności nerek. Dzieci i młodzież U dzieci w wieku od 6 do 12 lat okres półtrwania cetyryzyny wynosił około 6 godzin, a u dzieci w wieku od 2 do 6 lat - 5 godzin.
- CHPL leku Letizen, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
U niemowląt i dzieci w wieku od 6 do 24 miesięcy okres półtrwania jest zmniejszony do 3,1 godziny.
- CHPL leku Letizen, tabletki powlekane, 10 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród, nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Letizen, tabletki powlekane, 10 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Laktoza jednowodna Skrobia kukurydziana Powidon Magnezu stearynian Skład otoczki (Opadry 33G28707): Laktoza jednowodna Hypromeloza Tytanu dwutlenek Makrogol Triacetyna 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 5 lat 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 30ºC. 6.5 Rodzaj i zawartość opakowania Blister Al/PVC w pudełku tekturowym Wielkość opakowania: 7 lub 20 tabletek powlekanych. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak specjalnych wymagań.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Cirrus Duo, 5 mg + 120 mg, tabletki o przedłużonym uwalnianiu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 5 mg cetyryzyny dichlorowodorku (Cetirizini dihydrochloridum) o natychmiastowym uwalnianiu oraz 120 mg pseudoefedryny chlorowodorku (Pseudoephedrini hydrochloridum) o przedłużonym uwalnianiu. Substancje pomocnicze o znanym działaniu: każda tabletka zawiera 43,23 mg laktozy jednowodnej i mniej niż 1 mmol (23 mg) sodu (patrz punkt 4.4). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka o przedłużonym uwalnianiu. Biała lub biaława, okrągła, dwuwypukła tabletka.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgWskazania do stosowania
4.1 Wskazania do stosowania Cirrus Duo jest wskazany w leczeniu objawów sezonowego i całorocznego alergicznego zapalenia błony śluzowej nosa, takich jak: przekrwienie błony śluzowej nosa, kichanie, wodnista wydzielina z nosa (katar) oraz świąd nosa i spojówek. Cirrus Duo jest przeznaczony do stosowania w przypadkach, gdy pożądane jest zarówno działanie przeciwalergiczne cetyryzyny dichlorowodorku, jak i zmniejszające przekrwienie błony śluzowej nosa działanie pseudoefedryny chlorowodorku.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Jedna tabletka dwa razy na dobę (rano i wieczorem), w czasie posiłków lub między posiłkami. Specjalne grupy pacjentów Zaburzenia czynności nerek Należy dostosować dawkowanie w zależności od czynności nerek. Dawkę należy ustalić korzystając z poniższej tabeli: Dostosowanie dawkowania u dorosłych pacjentów z zaburzeniami czynności nerek Prawidłowa czynność nerek 90: 1 tabletka dwa razy na dobę Łagodne zaburzenia czynności nerek 60 do < 90: 1 tabletka dwa razy na dobę Umiarkowane zaburzenia czynności nerek 30 do < 60: 1 tabletka raz na dobę Ciężkie zaburzenia czynności nerek 15 do < 30, pacjenci nie wymagający dializy: 1 tabletka co drugi dzień Schyłkowa niewydolność nerek < 15, pacjenci wymagający dializy: Stosowanie przeciwwskazane *GFR - Glomerular Filtration Rate, wskaźnik przesączania kłębuszkowego Zaburzenia czynności wątroby U pacjentów z umiarkowaną niewydolnością wątroby należy zmniejszyć dawkę do jednej tabletki na dobę.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgDawkowanie
Dzieci i młodzież Młodzież (osoby w wieku 12 lat do poniżej 18 lat): jedna tabletka dwa razy na dobę (rano i wieczorem), w czasie posiłków lub między posiłkami. Dzieci w wieku poniżej 12 lat: stosowanie produktu jest przeciwwskazane (patrz punkty 4.3 i 4.4). Czas trwania leczenia Czas trwania leczenia nie powinien przekraczać okresu występowania objawów i nie powinien być dłuższy niż 2 do 3 tygodni. Po zmniejszeniu nasilenia objawów alergicznego zapalenia błony śluzowej nosa, można kontynuować leczenie samą cetyryzyną, jeśli to konieczne. Sposób podawania Tabletki należy połykać w całości, bez rozgryzania i popijać odpowiednią ilością płynu. Tabletek nie wolno przełamywać, żuć ani kruszyć.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgPrzeciwwskazania
4.3 Przeciwwskazania Cirrus Duo jest przeciwwskazany u pacjentów z: nadwrażliwością na substancje czynne, efedrynę, piperazynę lub jej pochodne, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, ciężkim nadciśnieniem tętniczym lub niekontrolowanym nadciśnieniem tętniczym lub ciężką postacią choroby niedokrwiennej serca, ciężką ostrą lub przewlekłą chorobą nerek / niewydolnością nerek / schyłkową niewydolnością nerek (pacjenci z GRF mniejszym niż 15 ml/min) (patrz punkt 4.2 Zaburzenia czynności nerek), niewyrównaną nadczynnością tarczycy, ciężkimi zaburzeniami rytmu serca, guzem chromochłonnym rdzenia nadnerczy, jaskrą lub zwiększonym ciśnieniem śródgałkowym, zatrzymaniem moczu, udarem mózgu w wywiadzie, grupą wysokiego ryzyka wystąpienia udaru krwotocznego mózgu.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgPrzeciwwskazania
Cirrus Duo jest przeciwwskazany u pacjentów stosujących jednocześnie: dihydroergotaminę, inhibitory monoaminooksydazy (IMAO), a także w ciągu dwóch tygodni po przerwaniu leczenia takimi produktami. Produkt leczniczy Cirrus Duo jest przeciwwskazany do stosowania u dzieci w wieku poniżej 12 lat (patrz punkty 4.2 i 4.4).
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ze względu na zawartość pseudoefedryny należy zachować ostrożność podczas stosowania produktu leczniczego Cirrus Duo u pacjentów z cukrzycą, nadczynnością tarczycy, nadciśnieniem tętniczym, tachykardią, zaburzeniami rytmu serca, chorobą niedokrwienną serca, umiarkowaną niewydolnością nerek lub niewydolnością wątroby oraz u osób w podeszłym wieku. Produkt leczniczy Cirrus Duo jest przeciwwskazany do stosowania u dzieci w wieku poniżej 12 lat (patrz punkty 4.2 i 4.3), ponieważ połączenia substancji czynnych produktu Cirrus Duo nie badano w tej grupie wiekowej oraz ze względu na zawartość pseudoefedryny. Należy także zachować ostrożność podczas stosowania produktu leczniczego u pacjentów przyjmujących: leki sympatykomimetyczne, takie jak leki zmniejszające przekrwienie błony śluzowej nosa, zmniejszające łaknienie oraz psychostymulujące, jak np.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgSpecjalne środki ostrozności
amfetamina i jej pochodne (nasilenie działania na układ krążenia), trójpierścieniowe leki przeciwdepresyjne, leki przeciwnadciśnieniowe (osłabienie działania przeciwnadciśnieniowego) (patrz punkt 4.5), alkohol lub leki hamujące czynność ośrodkowego układu nerwowego (nasilenie działania hamującego czynność ośrodkowego układu nerwowego oraz pogorszenie sprawności psychofizycznej), glikozydy nasercowe, takie jak digoksyna lub digitoksyna (ryzyko zaburzeń rytmu serca). Szczególną ostrożność należy także zachować u pacjentów z czynnikami ryzyka udaru krwotocznego mózgu (takimi jak jednoczesne stosowanie leków zwężających naczynia krwionośne (np. bromokryptyny, pergolidu, lizurydu, kabergoliny, ergotaminy) lub jakiegokolwiek innego leku zmniejszającego przekrwienie błony śluzowej (np. fenylopropanolaminy, fenylefryny, efedryny), podawanego doustnie lub donosowo), ponieważ skurcz naczyń krwionośnych i wzrost ciśnienia tętniczego zwiększają ryzyko udaru krwotocznego mózgu.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgSpecjalne środki ostrozności
W związku z naczyniozwężającym działaniem pseudoefedryny zaleca się zachowanie ostrożności u pacjentów z ryzykiem występowania stanów nadkrzepliwości, na przykład w przebiegu chorób zapalnych jelit. Podczas stosowania pseudoefedryny odnotowano kilka przypadków niedokrwiennego zapalenia jelita grubego. Jeśli u pacjenta wystąpi nagły ból brzucha, krwawienie z odbytu lub inne objawy świadczące o rozwoju niedokrwiennego zapalenia jelita grubego, należy odstawić produkt leczniczy, a pacjent powinien zasięgnąć porady lekarza. Należy zachować ostrożność u pacjentów z nadciśnieniem tętniczym, którzy przyjmują jednocześnie niesteroidowe leki przeciwzapalne (NLPZ), ponieważ zarówno NLPZ, jak i pseudoefedryna mogą zwiększać ciśnienie tętnicze. Stwierdzano przypadki nadużywania pseudoefedryny, podobnie jak w przypadku innych substancji działających pobudzająco na ośrodkowy układ nerwowy.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgSpecjalne środki ostrozności
Należy zachować ostrożność u pacjentów ze stanami, w których działanie przeciwcholinergiczne jest niepożądane, szczególnie dotyczy to pacjentów z czynnikami predysponującymi do wystąpienia zatrzymania moczu (np. urazy rdzenia kręgowego, przerost gruczołu krokowego, rozrost gruczołu krokowego lub niedrożność pęcherza), ponieważ produkt leczniczy Cirrus Duo może zwiększać ryzyko zatrzymania moczu. Zespół tylnej odwracalnej encefalopatii (ang. posterior reversible encephalopathy syndrome, PRES) i zespół odwracalnego zwężenia naczyń mózgowych (ang. reversible cerebral vasoconstriction syndrome, RCVS). Zgłaszano przypadki PRES i RCVS podczas stosowania produktów zawierających pseudoefedrynę (patrz punkt 4.8). Ryzyko jest zwiększone u pacjentów z ciężkim lub niekontrolowanym nadciśnieniem tętniczym lub z ciężką ostrą lub przewlekłą chorobą nerek/niewydolnością nerek (patrz punkt 4.3).
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgSpecjalne środki ostrozności
Należy przerwać stosowanie pseudoefedryny i natychmiast zwrócić się o pomoc lekarską, jeśli wystąpią następujące objawy: nagły, silny ból głowy lub piorunujący ból głowy, nudności, wymioty, splątanie, drgawki i (lub) zaburzenia widzenia. Większość zgłoszonych przypadków PRES i RCVS ustąpiła po przerwaniu leczenia i zastosowaniu odpowiedniego leczenia. Niedokrwienna neuropatia nerwu wzrokowego Podczas stosowania pseudoefedryny zgłaszano przypadki niedokrwiennej neuropatii nerwu wzrokowego. Należy zaprzestać podawania pseudoefedryny, jeśli u pacjenta wystąpi nagła utrata wzroku lub pogorszenie ostrości widzenia, np. w postaci mroczków. Ciężkie reakcje skórne Po zastosowaniu produktów zawierających pseudoefedrynę mogą wystąpić ciężkie reakcje skórne, takie jak ostra uogólniona osutka krostkowa (AGEP, ang. acute generalized exanthematous pustulosis).
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgSpecjalne środki ostrozności
Ostra osutka krostkowa może wystąpić w ciągu pierwszych 2 dni leczenia, razem z gorączką oraz licznymi, małymi, zwykle niepęcherzykowymi krostkami pojawiającymi się na obrzmiałych zmianach rumieniowych i głównie umiejscowionymi w zgięciach skóry, na tułowiu i na kończynach górnych. Pacjentów należy uważnie obserwować. Jeśli wystąpią takie objawy, jak gorączka, rumień lub pojawienie się licznych, niewielkich krostek, należy odstawić produkt Cirrus Duo i, jeśli to konieczne, wdrożyć odpowiednie leczenie. Produkt leczniczy zawiera laktozę jednowodną. Produkt nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, niedoborem laktazy (typu Lapp) lub zespołem złego wchłaniania glukozy-galaktozy. Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu w tabletce, to znaczy produkt uznaje się za „wolny od sodu”. Należy poinformować sportowców, że stosowanie pseudoefedryny może prowadzić do uzyskania pozytywnego wyniku badania antydopingowego.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgSpecjalne środki ostrozności
Przeciwhistaminowe produkty lecznicze hamują reakcję alergiczną w testach skórnych, stąd też zaleca się ich odstawienie na 3 dni przed wykonaniem testów.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji dla skojarzenia cetyryzyny z pseudoefedryną. Badania nie wykazały interakcji farmakokinetycznych podczas jednoczesnego podawania cetyryzyny oraz cymetydyny, ketokonazolu, erytromycyny, azytromycyny, antypiryny lub pseudoefedryny. W badaniu po podaniu wielokrotnym teofiliny (400 mg raz na dobę) i cetyryzyny obserwowano niewielkie (o 16%) zmniejszenie klirensu cetyryzyny; natomiast jednoczesne podawanie cetyryzyny nie wpływało na ekspozycję na teofilinę. Nie wykazano niepożądanych interakcji farmakodynamicznych w badaniach z cetyryzyną i cymetydyną, glipizydem, diazepamem i pseudoefedryną. Nie wykazano występowania niepożądanych interakcji klinicznych w badaniach z cetyryzyną i azytromycyną, erytromycyną, ketokonazolem, teofiliną, antypiryną i pseudoefedryną.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgInterakcje
W szczególności jednoczesne podawanie cetyryzyny i makrolidów lub ketokonazolu nie powodowało istotnych klinicznie zmian w zapisie elektrokardiograficznym (EKG). W badaniu po podaniu wielokrotnym rytonawiru (600 mg dwa razy na dobę) i cetyryzyny (10 mg na dobę) ekspozycja organizmu na cetyryzynę uległa zwiększeniu o około 40%, podczas gdy ekspozycja organizmu na rytonawir uległa nieznacznej zmianie (-11%) podczas jednoczesnego podawania cetyryzyny. Podczas równoczesnego stosowania amin sympatykomimetycznych i inhibitorów MAO może wystąpić przełom nadciśnieniowy. W związku z długim okresem działania inhibitorów MAO istnieje możliwość wystąpienia takiej interakcji nawet 15 dni po przerwaniu podawania tych produktów. Aminy sympatykomimetyczne mogą osłabiać działanie przeciwnadciśnieniowe produktów blokujących receptory β-adrenergiczne oraz produktów działających na układ współczulny, np. metylodopy, guanetydyny i rezerpiny (patrz punkt 4.4).
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgInterakcje
Jednoczesne stosowanie linezolidu z pseudoefedryną może powodować zwiększenie ciśnienia tętniczego u osób z prawidłowym ciśnieniem krwi. Podczas jednoczesnego stosowania pseudoefedryny z glikozydami nasercowymi, takimi jak digoksyna lub digitoksyna, może dojść do zwiększenia ekotopowej aktywności układu bodźcoprzewodzącego serca. Dlatego należy unikać stosowania produktu leczniczego Cirrus Duo u pacjentów przyjmujących glikozydy naparstnicy nasercowe. Leki zobojętniające sok żołądkowy oraz inhibitory pompy protonowej zwiększają szybkość wchłaniania pseudoefedryny, natomiast kaolin zmniejsza ją. Jednoczesne stosowanie z halogenowanymi środkami do znieczulenia ogólnego może powodować lub nasilać komorowe zaburzenia rytmu. Nie stwierdzono, by posiłek wysokotłuszczowy zmieniał biodostępność obu substancji czynnych produktu leczniczego. Jednak wtedy maksymalne stężenie cetyryzyny w osoczu występuje później i jest mniejsze.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak wystarczających danych dotyczących stosowania produktu Cirrus Duo u kobiet w okresie ciąży. Nie należy stosować produktu Cirrus Duo w okresie ciąży. Stosowanie pseudoefedryny w pierwszym trymestrze ciąży wiąże się ze zwiększeniem częstości wrodzonego wytrzewienia (wada rozwojowa powłok jamy brzusznej z przemieszczeniem jelit na zewnątrz jamy brzusznej) oraz artrezji jelita cienkiego (wrodzona niedrożność jelita cienkiego). Ze względu na naczyniozwężające działanie pseudoefedryny nie należy jej stosować w trzecim trymestrze ciąży, ponieważ może to wywoływać zmniejszenie przepływu w krążeniu maciczno-łożyskowym. Dane otrzymane z ograniczonej liczby zastosowań cetyryzyny w okresie ciąży nie wskazują na niepożądane działanie cetyryzyny na przebieg ciąży lub stan zdrowia płodu i noworodka.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgWpływ na płodność, ciążę i laktację
Brak wystarczających danych z badań na zwierzętach dotyczących wpływu na przebieg ciąży, rozwój zarodka i płodu, przebieg porodu i rozwój pourodzeniowy (patrz punkt 5.3). Karmienie piersi? Cetyryzyna i pseudoefedryna przenikają do mleka matki. Dlatego produktu Cirrus Duo nie należy stosować w okresie karmienia piersią. Płodność Badanie na szczurach nie wykazało wpływu na płodność po podaniu doustnym dawki 160 mg/kg mc. (cetyryzyny w dawce 6,4 mg/kg mc. oraz pseudoefedryny w dawce 153,6 mg/kg mc.), co odpowiadało 2-krotnie większej ogólnoustrojowej ekspozycji na cetyryzynę niż po podaniu dawek terapeutycznych u ludzi. Brak danych dotyczących wpływu na płodność u ludzi.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjenci planujący prowadzenie pojazdów, wykonywanie potencjalnie niebezpiecznych czynności lub obsługiwanie maszyn nie powinni przekraczać zalecanej dawki oraz powinni zwrócić uwagę na indywidualną reakcję organizmu na produkt leczniczy. Pacjenci, u których występuje senność, powinni powstrzymać się od prowadzenia pojazdów, wykonywania potencjalnie niebezpiecznych czynności i obsługiwania maszyn. U pacjentów przyjmujących cetyryzynę w zalecanej dawce 10 mg na dobę, obiektywne badania wpływu na zdolność prowadzenia pojazdów, odczuwanie senności i sprawność psychofizyczną nie wykazały istotnego klinicznie wpływu na oceniane parametry. Niemniej jednak, jednoczesne stosowanie cetyryzyny z alkoholem lub innymi substancjami o działaniu hamującym na ośrodkowy układ nerwowy, może dodatkowo osłabiać zdolność reagowania i koncentrację.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgWpływ na zdolność prowadzenia pojazdów
Nie odnotowano ani nie oczekuje się negatywnego wpływu pseudoefedryny na zdolność prowadzenia pojazdów i obsługiwania maszyn. Należy jednak zaznaczyć, że występują różnice osobnicze w reakcji na produkty lecznicze: u niektórych osób biorących udział w badaniach klinicznych występowała senność. Cetyryzyna w dawkach większych niż zalecane może wpływać na ośrodkowy układ nerwowy.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne W kontrolowanych badaniach klinicznych działania niepożądane, występujące u więcej niż 1% pacjentów przyjmujących cetyryzynę w skojarzeniu z pseudoefedryną, nie różniły się od tych obserwowanych u pacjentów przyjmujących jedynie cetyryzynę lub pseudoefedrynę. Dane pochodzące z okresu po wprowadzeniu leku do obrotu Objawy niepożądane wywoływane przez cetyryzynę są związane głównie z hamującym lub paradoksalnie, pobudzającym działaniem na ośrodkowy układ nerwowy, działaniem przeciwcholinergicznym i reakcjami nadwrażliwości (włączając wstrząs anafilaktyczny). Podczas stosowania wyłącznie cetyryzyny zgłaszano pojedyncze przypadki zapalenia wątroby. Objawy niepożądane wywoływane przez pseudoefedrynę są najprawdopodobniej związane z pobudzającym działaniem na ośrodkowy układ nerwowy i zaburzeniami czynności układu sercowo-naczyniowego.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgDziałania niepożądane
Opisywano pojedyncze przypadki udaru mózgu i niedokrwiennego zapalenia okrężnicy związane ze stosowaniem pseudoefedryny. Działania niepożądane opisano zgodnie z klasyfikacją układów i narządów MedDRA, a ich częstość oszacowano na podstawie danych uzyskanych w badaniach klinicznych i (lub) po wprowadzeniu produktu leczniczego do obrotu. Częstość występowania działań niepożądanych uporządkowano w następujący sposób: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i nieznana (częstość nie może być określona na podstawie dostępnych danych). Klasyfikacja układów i narządów MedDRA Często: Zaburzenia układu immunologicznego - reakcje nadwrażliwości (w tym wstrząs anafilaktyczny) Niezbyt często: Zaburzenia psychiczne - nerwowość, bezsenność, niepokój, pobudzenie, omamy, zaburzenia psychotyczne, agresja, stan splątania, depresja, tiki, euforia, myśli samobójcze Rzadko: Zaburzenia układu nerwowego - zawroty głowy (pochodzenia błędnikowego), zawroty głowy (pochodzenia ośrodkowego), bóle głowy, senność, drgawki, drżenie, zaburzenia smaku, incydenty mózgowo-naczyniowe (udar mózgu) Bardzo rzadko: Zaburzenia oka - zaburzenia akomodacji, niewyraźne widzenie, rozszerzenie źrenic, ból oka, osłabienie widzenia, światłowstręt, kryzys okulogiryczny, niedokrwienna neuropatia nerwu wzrokowego Nieznana: Zaburzenia serca - tachykardia, zaburzenia rytmu serca, kołatanie serca, zawał serca Często: Zaburzenia naczyniowe - bladość, nadciśnienie tętnicze, zapaść krążeniowa, niedociśnienie Często: Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia - duszność Często: Zaburzenia żołądka i jelit - suchość błony śluzowej jamy ustnej, nudności, wymioty, niedokrwienne zapalenie jelita grubego, biegunka, dyskomfort w podbrzuszu Bardzo rzadko: Zaburzenia wątroby i dróg żółciowych - zaburzenia czynności wątroby (zwiększenie aktywności aminotransferaz, fosfatazy alkalicznej, gamma-glutamylotransferazy, zwiększenie stężenia bilirubiny) Bardzo rzadko: Zaburzenia skóry i tkanki podskórnej - suchość skóry, wysypka, zwiększona potliwość, pokrzywka, wysypka polekowa, obrzęk naczynioruchowy, ciężkie reakcje skórne, w tym ostra uogólniona osutka krostkowa (AGEP), świąd Bardzo rzadko: Zaburzenia mięśniowo-szkieletowe i tkanki łącznej - ból stawów, ból mięśni Bardzo rzadko: Zaburzenia nerek i dróg moczowych - dyzuria (bolesne lub utrudnione oddawanie moczu), zatrzymanie moczu, moczenie Bardzo rzadko: Zaburzenia układu rozrodczego i piersi - zaburzenia erekcji Bardzo rzadko: Zaburzenia ogólne i stany w miejscu podania - astenia, obrzęk, złe samopoczucie Opis wybranych działań niepożądanych Po zakończeniu leczenia u niektórych pacjentów wystąpił świąd.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181 C, 02-222 Warszawa, tel.: +48 22 49 21 301, faks: +48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgPrzedawkowanie
4.9 Przedawkowanie Objawy obserwowane po przedawkowaniu cetyryzyny są związane głównie z działaniem na ośrodkowy układ nerwowy (OUN) lub z objawami mogącymi wskazywać na działanie przeciwcholinergiczne. Produkty sympatykomimetyczne w dużych dawkach mogą powodować psychozę toksyczną z urojeniami i omamami. U niektórych pacjentów mogą wystąpić zaburzenia rytmu serca, zapaść krążeniowa, drgawki, śpiączka i niewydolność oddechowa. Objawy te mogą doprowadzić do zgonu. Objawy ostrego przedawkowania produktu leczniczego Cirrus Duo to: biegunka, zawroty głowy, zmęczenie, bóle głowy, złe samopoczucie, rozszerzenie źrenicy, zatrzymanie moczu, tachykardia, zaburzenia rytmu serca, zwiększenie ciśnienia tętniczego krwi, objawy hamowania OUN (uspokojenie, bezdech, utrata przytomności, sinica i zapaść sercowo-naczyniowa) lub objawy pobudzenia OUN (bezsenność, omamy, drżenie, drgawki), które mogą prowadzić do zgonu.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgPrzedawkowanie
Leczenie przedawkowania (objawowe i podtrzymujące) powinno być prowadzone w warunkach szpitalnych. Należy wziąć pod uwagę inne równocześnie przyjmowane produkty lecznicze. Należy wywołać wymioty, jeżeli nie wystąpią samoistnie. Zaleca się wykonanie płukania żołądka. Nie jest znane antidotum. Nie należy podawać amin sympatykomimetycznych. W przypadku wysokiego ciśnienia tętniczego krwi i tachykardii należy stosować leki blokujące receptory α–adrenergiczne i (lub) leki blokujące receptory β-adrenergiczne. Jeśli wystąpią drgawki, należy podać dożylnie diazepam (doodbytniczo u dzieci). Hemodializa w niewielkim stopniu usuwa cetyryzynę i pseudoefedrynę z organizmu.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki udrożniające nos do stosowania wewnętrznego, sympatykomimetyki, kod ATC: R01B A52. Właściwości farmakodynamiczne produktu leczniczego Cirrus Duo są bezpośrednio związane z sumującym się działaniem każdego ze składników. Cetyryzyna, metabolit hydroksyzyny u ludzi, jest silnym i wybiórczym antagonistą obwodowych receptorów histaminowych H1. Oprócz aktywności przeciw H1, cetyryzyna ma działanie przeciwalergiczne. W dawce 10 mg raz lub dwa razy na dobę cetyryzyna hamuje późną fazę rekrutacji komórek zapalnych, zwłaszcza eozynofili, w skórze i spojówkach pacjentów z chorobami atopowymi, poddanych ekspozycji na alergen. W dawce 30 mg na dobę hamuje napływ eozynofili w płynie z płukania oskrzelowo-pęcherzykowego podczas późnej fazy skurczu oskrzeli wywołanego ekspozycją na alergeny wziewne u pacjentów z astmą.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgWłaściwości farmakodynamiczne
Zmniejsza również ekspresję cząsteczek adhezyjnych, takich jak ICAM-1 oraz VCAM-1, które są markerami zapalenia alergicznego. Pseudoefedryna to amina sympatykomimetyczna stosowana doustnie, silniej pobudzająca receptory α- niż β-adrenergiczne. Pseudoefedryna zwęża naczynia krwionośne w błonie śluzowej nosa i w wyniku tego zmniejsza przekrwienie błony śluzowej nosa.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie i wydalanie cetyryzyny nie zależą od dawki. Zmienność tych parametrów u danego pacjenta i u różnych pacjentów jest niewielka. Nie stwierdzono istotnych interakcji farmakokinetycznych między cetyryzyną i pseudoefedryną. Wchłanianie Po podaniu doustnym cetyryzyna wchłania się szybko i prawie całkowicie z przewodu pokarmowego. Maksymalne stężenie w osoczu występuje zazwyczaj w ciągu 1 godziny po podaniu produktu na czczo. Pseudoefedryna podawana w postaci tabletek o przedłużonym uwalnianiu, osiąga maksymalne stężenie w osoczu w ciągu 2 do 6 godzin po podaniu wielokrotnym. Nie stwierdzono, by posiłek wysokotłuszczowy zmieniał biodostępność obu substancji czynnych produktu leczniczego. Jednak wtedy maksymalne stężenie cetyryzyny w osoczu występuje później i jest mniejsze. Dystrybucja Cetyryzyna w dużym stopniu wiąże się z białkami osocza (93%). Objętość dystrybucji jest niewielka: około 0,5 l/kg mc.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgWłaściwości farmakokinetyczne
Nie ma dostępnych danych dotyczących dystrybucji pseudoefedryny. Metabolizm Cetyryzyna nie podlega w istotnym stopniu metabolizmowi pierwszego przejścia przez wątrobę. Nie ma dostępnych danych dotyczących metabolizmu pseudoefedryny. Eliminacja Po wielokrotnym podaniu doustnym około 65% dawki cetyryzyny wydala się w postaci niezmienionej z moczem w ciągu doby. Okres półtrwania cetyryzyny w osoczu wynosi około 9 godzin i wydłuża się u pacjentów z zaburzeniami czynności nerek. Pseudoefedryna jest wydalana głównie w postaci niezmienionej z moczem. Wydalanie przez nerki jest szybsze przy zmniejszonym pH moczu, a wolniejsze, gdy mocz ma odczyn zasadowy. Oceniono, że po wielokrotnym podaniu doustnym (co 12 godzin) w stanie stacjonarnym okres półtrwania leku wynosi około 9 godzin. Specjalne grupy pacjentów Pacjenci z zaburzeniami czynności nerek U pacjentów z umiarkowaną lub ciężką niewydolnością nerek niezbędne jest dostosowanie dawki (patrz punkt 4.2).
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach na zwierzętach nie stwierdzono działania toksycznego podczas podawania produktu w dawkach ≥30 mg/kg mc./dobę u szczurów i 40 mg/kg mc./dobę u małp z gatunku Cynomolgus (tzn. odpowiednio 8- i 11-krotnie większych niż zalecane u ludzi). Ogólnoustrojowe narażenie na te dawki produktu u małp było większe, a u szczurów mniejsze niż u ludzi. W badaniach dotyczących toksycznego wpływu na reprodukcję u szczurów ustalono, że dawka 40 mg/kg mc./dobę nie powodowała działań niepożądanych związanych z toksycznością. Jednak, ze względu na małe narażenie na produkt leczniczy u szczura, wyniki badań nie mogą być brane pod uwagę jako dowód bezpieczeństwa stosowania produktu u kobiet w okresie ciąży i karmienia piersią. Nie przeprowadzono badań rakotwórczości cetyryzyny stosowanej w skojarzeniu z pseudoefedryną.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgPrzedkliniczne dane o bezpieczeństwie
Skojarzenie cetyryzyny i pseudoefedryny nie ma działania mutagennego ani klastogennego i dlatego prawdopodobnie nie wykazuje działania rakotwórczego u ludzi. W badaniach dotyczących toksycznego wpływu na reprodukcję nie wykazano wpływu na płodność samców i samic szczura po zastosowaniu doustnych dawek wynoszących do 160 mg/kg mc. na dobę (1:24), co odpowiada ogólnoustrojowej ekspozycji na cetyryzynę 2-krotnie większej od występującej po zastosowaniu dawek leczniczych u ludzi. W istotnych klinicznie dawkach połączenie cetyryzyny z pseudoefedryną nie wykazywało negatywnego wpływu na parametry życiowe zarodka i płodu oraz rozwój potomstwa.
- CHPL leku Cirrus Duo, tabletki o przedłużonym uwalnianiu, 5 mg + 120 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Warstwa o natychmiastowym uwalnianiu: Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Magnezu stearynian Warstwa o przedłużonym uwalnianiu: Hypromeloza Celuloza mikrokrystaliczna Krzemionka koloidalna bezwodna Magnezu stearynian Skład otoczki Opadry Y-1-7000 white: Hypromeloza Tytanu dwutlenek (E171) Makrogol 400 6. Niezgodności farmaceutyczne 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Blister PVC-Aclar/Rx160/Al w tekturowym pudełku. Opakowanie zawiera 6 tabletek. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak specjalnych wymagań.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ALLERTEC WZF, 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 10 mg cetyryzyny dichlorowodorku (Cetirizini dihydrochloridum). Substancje pomocnicze o znanym działaniu: laktoza jednowodna i sód. Jedna tabletka powlekana zawiera 31 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki powlekane Tabletki barwy białej do kremowej, podłużne, obustronnie wypukłe z rowkiem dzielącym. Tabletkę można podzielić na równe dawki.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgWskazania do stosowania
4.1 Wskazania do stosowania U dorosłych i dzieci w wieku 6 lat i powyżej: Cetyryzyna jest wskazana w łagodzeniu objawów dotyczących nosa i oczu, związanych z sezonowym i przewlekłym alergicznym zapaleniem błony śluzowej nosa. Cetyryzyna jest wskazana w łagodzeniu objawów przewlekłej idiopatycznej pokrzywki.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dzieci i młodzież Nie zaleca się stosowania produktu leczniczego w postaci tabletek u dzieci w wieku poniżej 6 lat, ponieważ ta postać farmaceutyczna nie pozwala na odpowiednie dostosowanie dawki. Dzieci w wieku od 6 do 12 lat: 5 mg (pół tabletki powlekanej) dwa razy na dobę. Młodzież w wieku powyżej 12 lat: 10 mg (1 tabletka powlekana) raz na dobę. Dorośli: 10 mg (1 tabletka powlekana) raz na dobę. Szczególne grupy pacjentów Pacjenci w podeszłym wieku: Brak danych wskazujących na konieczność zmniejszenia dawki leku u pacjentów w podeszłym wieku, jeśli czynność nerek jest u nich prawidłowa. Zaburzenia czynności nerek: Brak danych określających stosunek skuteczności do bezpieczeństwa stosowania u pacjentów z zaburzeniami czynności nerek.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgDawkowanie
Ponieważ cetyryzyna jest wydalana głównie przez nerki (patrz punkt 5.2), w przypadku braku możliwości zastosowania alternatywnego leczenia, odstępy pomiędzy poszczególnymi dawkami muszą być ustalone indywidualnie w zależności od czynności nerek. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. Aby skorzystać z tabeli, należy obliczyć klirens kreatyniny (Clkr) w ml/min. Clkr (ml/min) można obliczyć na podstawie stężenia kreatyniny w surowicy krwi (mg/dl), posługując się następującym wzorem: [140 – wiek (lata)] x masa ciała (kg) Clkr = __________________________________________________ (x 0,85 dla kobiet) 72 x stężenie kreatyniny w surowicy (mg/dl) Modyfikacja dawkowania u dorosłych pacjentów z zaburzeniami czynności nerek Prawidłowa czynność nerek: ≥80 - 10 mg raz na dobę Łagodne zaburzenia czynności nerek: 50 do 79 - 10 mg raz na dobę Umiarkowane zaburzenia czynności nerek: 30 do 49 - 5 mg raz na dobę Ciężkie zaburzenia czynności nerek: <30 - 5 mg co drugi dzień Schyłkowa choroba nerek, pacjenci dializowani: <10 - stosowanie przeciwwskazane U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy ustalać indywidualnie na podstawie klirensu kreatyniny, wieku oraz masy ciała pacjenta.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgDawkowanie
Zaburzenia czynności wątroby: Nie ma konieczności dostosowania dawki u pacjentów, u których występują wyłącznie zaburzenia czynności wątroby. U pacjentów z zaburzeniami czynności wątroby oraz zaburzeniami czynności nerek zaleca się dostosowanie dawki (patrz powyżej: „Zaburzenia czynności nerek”). Sposób podawania: Podanie doustne. Tabletki należy połykać popijając szklanką wody.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na cetyryzyny dichlorowodorek, hydroksyzynę lub pochodne piperazyny, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. U pacjentów z ciężkimi zaburzeniami czynności nerek z klirensem kreatyniny poniżej 10 ml/min.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stwierdzono istotnych klinicznie interakcji między alkoholem (w stężeniu 0,5 g/l we krwi) a cetyryzyną stosowaną w dawkach terapeutycznych. Jednakże zaleca się zachowanie ostrożności podczas przyjmowania cetyryzyny jednocześnie z alkoholem. Należy zachować ostrożność u pacjentów z czynnikami ryzyka zatrzymania moczu (np. uszkodzenia rdzenia kręgowego, rozrost gruczołu krokowego), ponieważ cetyryzyna może zwiększać ryzyko zatrzymania moczu. Zaleca się ostrożność podczas stosowania u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstawić leki przeciwhistaminowe na 3 dni przed wykonaniem testów. W przypadku przerwania stosowania cetyryzyny może wystąpić świąd i (lub) pokrzywka, nawet jeśli objawy te nie występowały przed rozpoczęciem leczenia.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgSpecjalne środki ostrozności
W niektórych przypadkach objawy te mogą być nasilone i może być konieczne wznowienie leczenia. Objawy powinny ustąpić po wznowieniu leczenia. Dzieci i młodzież: Nie zaleca się stosowania tego produktu leczniczego u dzieci w wieku poniżej 6 lat, ponieważ ta postać farmaceutyczna nie pozwala na odpowiednie dostosowanie dawki. Zaleca się stosowanie cetyryzyny w postaci farmaceutycznej przeznaczonej dla dzieci. Produkt nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy. Produkt zawiera mniej niż 1 mmol (23 mg) sodu w 1 tabletce powlekanej, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na właściwości farmakokinetyczne, farmakodynamiczne oraz profil tolerancji cetyryzyny nie są spodziewane interakcje tego produktu leczniczego z innymi lekami. W przeprowadzonych badaniach nie donoszono o występowaniu interakcji farmakodynamicznych ani znaczących interakcji farmakokinetycznych, w szczególności z pseudoefedryną lub teofiliną (400 mg na dobę). Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, natomiast zmniejsza szybkość wchłaniania cetyryzyny. U wrażliwych pacjentów, jednoczesne stosowanie z alkoholem lub lekami o działaniu hamującym na ośrodkowy układ nerwowy, może dodatkowo zmniejszać zdolność reagowania i koncentrację. Cetyryzyna nie nasila jednak działania alkoholu (w stężeniu 0,5 g/l we krwi).
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Prospektywnie zebrane dane dotyczące stosowania cetyryzyny w okresie ciąży nie wskazują na zwiększone działanie toksyczne w stosunku do matki, płodu lub zarodka. Badania przeprowadzone na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy. Należy zachować ostrożność podczas przepisywania cetyryzyny kobietom w ciąży. Karmienie piersi? Cetyryzyna przenika do mleka matki w stężeniach stanowiących 25 do 90% stężenia leku w osoczu (w zależności od czasu pobierania próbek po podaniu). Dlatego należy zachować ostrożność podczas przepisywania produktu kobietom karmiącym piersią. Płodność Dane dotyczące wpływu na płodność u ludzi są ograniczone, nie stwierdzono jednak zagrożenia dla bezpieczeństwa. Badania na zwierzętach nie wykazały zagrożenia dla bezpieczeństwa płodności u ludzi.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Obiektywne badania z zastosowaniem cetyryzyny w zalecanej dawce 10 mg nie wykazały istotnego klinicznie wpływu na zdolność prowadzenia pojazdów, odczuwanie senności oraz sprawność psychofizyczną. Pacjenci, u których wystąpiła senność, powinni jednak unikać prowadzenia pojazdów, wykonywania potencjalnie niebezpiecznych czynności lub obsługiwania maszyn. Pacjenci powinni zwrócić uwagę na reakcję organizmu na lek oraz nie powinni stosować dawek większych niż zalecane.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne - Podsumowanie W badaniach klinicznych wykazano, że cetyryzyna podawana w zalecanych dawkach wywołuje działania niepożądane ze strony ośrodkowego układu nerwowego o nieznacznym nasileniu, w tym senność, zmęczenie, bóle i zawroty głowy. W niektórych przypadkach obserwowano paradoksalne pobudzenie ośrodkowego układu nerwowego. Mimo, iż cetyryzyna jest selektywnym antagonistą obwodowych receptorów H1 i jest praktycznie pozbawiona aktywności cholinolitycznej, zgłaszano pojedyncze przypadki trudności w oddawaniu moczu, zaburzeń akomodacji oka oraz suchości błony śluzowej jamy ustnej. Zgłaszano przypadki zaburzeń czynności wątroby ze zwiększoną aktywnością enzymów wątrobowych i ze zwiększonym stężeniem bilirubiny. W większości przypadków ustępowały one po przerwaniu przyjmowania cetyryzyny dichlorowodorku.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgDziałania niepożądane
Zestawienie działań niepożądanych Dostępne są dane z klinicznych lub farmakoklinicznych badań prowadzonych metodą podwójnie ślepej próby, porównujących cetyryzynę z placebo oraz innymi lekami przeciwhistaminowymi stosowanymi w zalecanych dawkach (10 mg na dobę dla cetyryzyny). W badaniach uczestniczyło ponad 3200 pacjentów leczonych cetyryzyną. W badaniach kontrolowanych placebo, z zastosowaniem cetyryzyny w dawce 10 mg obserwowano następujące działania niepożądane, występujące z częstością 1% lub większą: Działania niepożądane (zgodnie z terminologią działań niepożądanych wg WHO) Cetyryzyna 10 mg (n=3260) Placebo (n=3061) Zaburzenia ogólne i stany w miejscu podania Zmęczenie: 1,63% (Cetyryzyna), 0,95% (Placebo) Zaburzenia układu nerwowego Zawroty głowy: 1,10% (Cetyryzyna), 0,98% (Placebo) Ból głowy: 7,42% (Cetyryzyna), 8,07% (Placebo) Zaburzenia żołądka i jelit Ból brzucha: 0,98% (Cetyryzyna), 1,08% (Placebo) Suchość błony śluzowej jamy ustnej: 2,09% (Cetyryzyna), 0,82% (Placebo) Nudności: 1,07% (Cetyryzyna), 1,14% (Placebo) Zaburzenia psychiczne Senność: 9,63% (Cetyryzyna), 5,00% (Placebo) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zapalenie gardła: 1,29% (Cetyryzyna), 1,34% (Placebo) Mimo, iż senność występowała statystycznie częściej w grupie otrzymującej cetyryzynę niż w grupie otrzymującej placebo, w większości przypadków miała ona nasilenie łagodne do umiarkowanego.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgDziałania niepożądane
Inne, obiektywne badania nie wykazały wpływu cetyryzyny w zalecanych dawkach dobowych na aktywność młodych, zdrowych ochotników. Dzieci i młodzież Działania niepożądane występujące z częstością 1% lub większą u dzieci w wieku od 6 miesięcy do 12 lat, pochodzące z badań klinicznych lub farmakoklinicznych kontrolowanych placebo to: Działania niepożądane (zgodnie z terminologią działań niepożądanych wg WHO) Cetyryzyna (n=1656) Placebo (n=1294) Zaburzenia żołądka i jelit Biegunka: 1,0% (Cetyryzyna), 0,6% (Placebo) Zaburzenia psychiczne Senność: 1,8% (Cetyryzyna), 1,4% (Placebo) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zapalenie błony śluzowej nosa: 1,4% (Cetyryzyna), 1,1% (Placebo) Zaburzenia ogólne i stany w miejscu podania Zmęczenie: 1,0% (Cetyryzyna), 0,3% (Placebo) Dane pochodzące z okresu po wprowadzeniu cetyryzyny do obrotu.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgDziałania niepożądane
Oprócz wymienionych powyżej działań niepożądanych występujących podczas badań klinicznych, zgłaszano następujące działania niepożądane po wprowadzeniu cetyryzyny do obrotu. Działania niepożądane opisano według klasyfikacji układów i narządów MedDRA, a częstość występowania określono na podstawie obserwacji z okresu po wprowadzeniu leku do obrotu. Częstość występowania określono w następujący sposób: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego Bardzo rzadko: trombocytopenia Zaburzenia układu immunologicznego Rzadko: reakcje nadwrażliwości Bardzo rzadko: wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania Częstość nieznana: zwiększenie apetytu Zaburzenia psychiczne Niezbyt często: pobudzenie Rzadko: zachowanie agresywne, splątanie, depresja, omamy, bezsenność Bardzo rzadko: tiki Częstość nieznana: myśli samobójcze, koszmary senne Zaburzenia układu nerwowego Niezbyt często: parestezja Rzadko: drgawki Bardzo rzadko: zaburzenia smaku, omdlenie, drżenie, dystonia, dyskineza Częstość nieznana: amnezja, zaburzenia pamięci Zaburzenia oka Bardzo rzadko: zaburzenia akomodacji, niewyraźne widzenie, rotacja gałek ocznych Zaburzenia ucha i błędnika Częstość nieznana: zawroty głowy Zaburzenia serca Rzadko: tachykardia Zaburzenia żołądka i jelit Niezbyt często: biegunka Zaburzenia wątroby i dróg żółciowych Rzadko: nieprawidłowa czynność wątroby (zwiększona aktywność aminotransferaz, fosfatazy alkalicznej, γ-GT i zwiększone stężenie bilirubiny) Częstość nieznana: zapalenie wątroby Zaburzenia skóry i tkanki podskórnej Niezbyt często: świąd, wysypka Rzadko: pokrzywka Bardzo rzadko: obrzęk naczynioruchowy, wysypka polekowa Częstość nieznana: ostra uogólniona osutka krostkowa Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Częstość nieznana: bóle stawów Zaburzenia nerek i dróg moczowych Bardzo rzadko: bolesne lub utrudnione oddawanie moczu, mimowolne oddawanie moczu Częstość nieznana: zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania Niezbyt często: osłabienie, złe samopoczucie Rzadko: obrzęki Badania diagnostyczne Rzadko: zwiększenie masy ciała Opis wybranych działań niepożądanych.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgDziałania niepożądane
Zgłaszano przypadki świądu (intensywnego swędzenia) i (lub) pokrzywki po przerwaniu stosowania cetyryzyny.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedawkowania Objawy obserwowane po przedawkowaniu cetyryzyny związane są przede wszystkim z działaniem na ośrodkowy układ nerwowy, mogą wskazywać także na działanie przeciwcholinergiczne. Po przyjęciu dawki cetyryzyny co najmniej 5 razy większej od zalecanej dawki dobowej zgłaszano następujące działania niepożądane: splątanie, biegunkę, zawroty głowy, zmęczenie, bóle głowy, złe samopoczucie, rozszerzenie źrenic, świąd, niepokój zwłaszcza ruchowy, sedację, senność, osłupienie, tachykardię, drżenie, zatrzymanie moczu. Postępowanie po przedawkowaniu Specyficzne antidotum nie jest znane. Zaleca się leczenie objawowe lub podtrzymujące. Jeżeli od zażycia zbyt dużej dawki produktu nie minęło zbyt wiele czasu, należy rozważyć wykonanie płukania żołądka. Cetyryzyna nie jest skutecznie usuwana metodą hemodializy.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny, kod ATC: R06AE07 Mechanizm działania Cetyryzyna, metabolit hydroksyzyny u człowieka, jest silnym i selektywnym antagonistą obwodowych receptorów histaminowych H1. Badania wiązania z receptorem in vitro nie wykazały istotnego powinowactwa do innych receptorów niż H1. Działanie farmakodynamiczne Oprócz działania antagonistycznego w stosunku do receptorów H1, cetyryzyna wykazuje działanie przeciwalergiczne: u pacjentów z nadwrażliwością (atopią) poddawanych prowokacji alergenem, dawka 10 mg podawana raz lub dwa razy na dobę hamuje napływ komórek późnej fazy reakcji zapalnej, eozynofili, do skóry i spojówek. Skuteczność kliniczna i bezpieczeństwo stosowania Badania u zdrowych ochotników wykazały, że cetyryzyna w dawkach 5 i 10 mg silnie hamuje reakcję prowadzącą do powstawania bąbli pokrzywkowych i zaczerwienienia, wywołaną śródskórnym podawaniem histaminy w bardzo dużych stężeniach, ale nie ustalono związku tego działania ze skutecznością.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
W sześciotygodniowym, kontrolowanym placebo badaniu z udziałem 186 pacjentów z alergicznym zapaleniem błony śluzowej nosa oraz współistniejącą, łagodną lub umiarkowaną astmą, cetyryzyna stosowana w dawce 10 mg raz na dobę łagodziła objawy zapalenia błony śluzowej nosa i nie wpływała na czynność płuc. Badanie to potwierdza bezpieczeństwo stosowania cetyryzyny u pacjentów z alergią i z łagodną lub umiarkowaną astmą. W badaniu kontrolowanym placebo cetyryzyna podawana w dużej dawce dobowej wynoszącej 60 mg przez siedem dni nie powodowała statystycznie znamiennego wydłużenia odstępu QT. Stosowanie cetyryzyny w zalecanych dawkach poprawia jakość życia pacjentów z przewlekłym i sezonowym alergicznym zapaleniem błony śluzowej nosa. Dzieci i młodzież W trwającym 35 dni badaniu, przeprowadzonym u dzieci w wieku od 5 do 12 lat, nie stwierdzono tolerancji na przeciwhistaminowe działanie cetyryzyny (hamowanie powstawania bąbli pokrzywkowych i zaczerwienienia).
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
Po przerwaniu leczenia cetyryzyną podawaną wielokrotnie, skóra odzyskuje normalną reaktywność na histaminę w ciągu 3 dni.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Maksymalne stężenie w osoczu w stanie stacjonarnym wynosi około 300 ng/ml i występuje w ciągu 1,0 ± 0,5 h. Rozkład parametrów farmakokinetycznych, takich jak stężenie maksymalne (Cmax) i pole pod krzywą (AUC), jest jednoznacznie zdefiniowany. Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, lecz zmniejsza szybkość wchłaniania cetyryzyny. W przypadku podawania cetyryzyny w postaci roztworu, kapsułek i tabletek, biodostępność jest podobna. Dystrybucja Pozorna objętość dystrybucji wynosi 0,50 l/kg. Cetyryzyna wiąże się z białkami osocza w 93 ± 0,3%. Cetyryzyna nie wpływa na stopień wiązania warfaryny z białkami. Metabolizm Cetyryzyna nie podlega w znaczącym stopniu metabolizmowi pierwszego przejścia. Eliminacja Końcowy okres półtrwania wynosi około 10 godzin. Nie zaobserwowano kumulacji cetyryzyny podczas stosowania dawek dobowych 10 mg przez 10 dni. Około dwie trzecie dawki jest wydalane w postaci niezmienionej z moczem.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Liniowość lub nieliniowość Cetyryzyna wykazuje liniową kinetykę w zakresie dawek od 5 do 60 mg. Szczególne grupy pacjentów Zaburzenia czynności nerek Farmakokinetyka leku u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny powyżej 40 ml/min) oraz u zdrowych ochotników była podobna. U pacjentów z umiarkowanymi zaburzeniami czynności nerek okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u zdrowych ochotników. U pacjentów poddawanych hemodializie (klirens kreatyniny mniejszy niż 7 ml/min), którym podano doustnie cetyryzynę w pojedynczej dawce 10 mg, okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u osób zdrowych. Podczas hemodializy cetyryzyna była usuwana z osocza w niewielkim stopniu. Konieczna jest modyfikacja dawkowania u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2).
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Zaburzenia czynności wątroby U pacjentów z przewlekłymi chorobami wątroby (marskość żółciowa, choroby dotyczące miąższu wątroby, choroby związane z zastojem żółci), którym podano 10 lub 20 mg cetyryzyny w pojedynczej dawce, okres półtrwania wydłużył się o 50%, a klirens zmniejszył o 40% w porównaniu do osób zdrowych. Modyfikacja dawkowania jest konieczna tylko u tych pacjentów z zaburzeniami czynności wątroby, u których jednocześnie występują zaburzenia czynności nerek. Pacjenci w podeszłym wieku U 16 pacjentów w podeszłym wieku po podaniu doustnie pojedynczej dawki 10 mg okres półtrwania wydłużył się o około 50%, a klirens zmniejszył się o 40% w porównaniu z pozostałymi, młodszymi pacjentami. Wydaje się, że zmniejszenie klirensu cetyryzyny u ochotników w podeszłym wieku jest związane z występującym w tej grupie osłabieniem czynności nerek.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Dzieci i młodzież U dzieci w wieku od 6 do 12 lat okres półtrwania cetyryzyny wynosi około 6 godzin, a u dzieci w wieku 2 do 6 lat wynosi 5 godzin. U niemowląt i dzieci w wieku od 6 do 24 miesięcy okres półtrwania jest zmniejszony do 3,1 godziny.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne dotyczące cetyryzyny, uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozrodczość, nie ujawniają występowania szczególnego zagrożenia dla człowieka.
- CHPL leku Allertec WZF, tabletki powlekane, 10 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Laktoza jednowodna Celuloza mikrokrystaliczna Skrobia kukurydziana Powidon K-25 Magnezu stearynian Karboksymetyloskrobia sodowa Krzemionka koloidalna bezwodna Sodu laurylosiarczan Hypromeloza Makrogol 6000 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 4 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać blister w opakowaniu zewnętrznym w celu ochrony przed światłem i wilgocią. 6.5 Rodzaj i zawartość opakowania Blister Aluminium/PVC w tekturowym pudełku. Opakowanie zawiera 7, 10, 14 lub 20 tabletek powlekanych. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Alermed, tabletki powlekane, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Alermed, 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 10 mg cetyryzyny dichlorowodorku (Cetirizini dihydrochloridum). Substancje pomocnicze o manvm działaniu: laktytol jednowodny i laktoza jednowodna. Jedna tabletka powlekana zawiera 30 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki powlekane Białe, okrągłe tabletki powlekane o gładkiej powierzchni, z rowkiem umożliwiającym podzielenie tabletki na pół. Tabletkę można podzielić na 2 równe dawki.
- CHPL leku Alermed, tabletki powlekane, 10 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy Alermed jest wskazany u dorosłych i dzieci w wieku 6 lat i starszych: w łagodzeniu objawów dotyczących nosa i oczu, związanych z sezonowym i przewlekłym alergicznym zapaleniem błony śluzowej nosa. w łagodzeniu objawów przewlekłej idiopatycznej pokrzywki.
- CHPL leku Alermed, tabletki powlekane, 10 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli: 10 mg (1 tabletka) raz na dobę. Szczególne grupy pacjentów Pacjenci w podeszłym wieku: Brak danych wskazujących na konieczność zmniejszenia dawki leku u osób w podeszłym wieku, jeśli czynność nerek jest u nich prawidłowa. Zaburzenia czynności nerek: Brak danych określających stosunek skuteczności do bezpieczeństwa stosowania u pacjentów z zaburzeniami czynności nerek. Ponieważ cetyryzyna jest wydalana głównie przez nerki (patrz punkt 5.2), w przypadku braku możliwości zastosowania alternatywnego leczenia, odstępy pomiędzy poszczególnymi dawkami muszą być ustalone indywidualnie w zależności od czynności nerek. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. W celu skorzystania z tabeli dawkowania, należy obliczyć klirens kreatyniny (Ch) w ml/min.
- CHPL leku Alermed, tabletki powlekane, 10 mgDawkowanie
Ch (ml/min) można obliczyć na podstawie stężenia kreatyniny w surowicy krwi (mg/dl), posługując się następującym wzorem: Ch= [140 — wiek (lata)] x masa ciała (kg) 72 x stężenie kreatyniny w surowicy (mg/dl) (x 0,85 dla kobiet) Modyfikacja dawkowania u dorosłych pacjentów z zaburzeniami czynności nerek Prawidłowa czynność nerek: ? 80 ml/min - 10 mg raz na dobę Łagodne zaburzenia czynności nerek: 50-79 ml/min - 10 mg raz na dobę Umiarkowane zaburzenia czynności nerek: 30-49 ml/min - 5 mg raz na dobę Ciężkie zaburzenia czynności nerek: < 30 ml/min - 5 mg co drugi dzień Schyłkowa choroba nerek, pacjenci dializowani: < 10 ml/min - Stosowanie przeciwwskazane Nie ma konieczności dostosowania dawki u pacjentów, u których występują wyłącznie zaburzenia czynności wątroby. U pacjentów z zaburzeniami czynności wątroby oraz z zaburzeniami czynności nerek zaleca się dostosowanie dawki (patrz powyżej: „Zaburzenia czynności nerek”).
- CHPL leku Alermed, tabletki powlekane, 10 mgDawkowanie
Dzieci i młodzież: Nie zaleca się stosowania produktu leczniczego w postaci tabletek u dzieci w wieku poniżej 6 lat, ponieważ ta postać farmaceutyczna nie pozwala na odpowiednie dostosowanie dawki. Dzieci w wieku od 6 do 12 lat: 5 mg dwa razy na dobę (pół tabletki dwa razy na dobę). Młodzież w wieku powyżej 12 lat: 10 mg raz na dobę (1 tabletka). U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy ustalać indywidualnie na podstawie klirensu kreatyniny, wieku oraz masy ciała pacjenta. Sposób podawania Tabletki należy połykać, popijając szklanką płynu.
- CHPL leku Alermed, tabletki powlekane, 10 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, hydroksyzynę lub pochodne piperazyny. Pacjenci z ciężkimi zaburzeniami czynności nerek (klirens kreatyniny < 10 ml/min).
- CHPL leku Alermed, tabletki powlekane, 10 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stwierdzono istotnych klinicznie interakcji między alkoholem (w stężeniu 0,5 g/l we krwi) a cetyryzyną stosowaną w dawkach terapeutycznych. Jednakże zaleca się zachowanie ostrożności podczas przyjmowania cetyryzyny jednocześnie z alkoholem. Należy zachować ostrożność u pacjentów z czynnikami ryzyka zatrzymania moczu (np. uszkodzony rdzeń kręgowy, rozrost gruczołu krokowego), ponieważ cetyryzyna może zwiększać ryzyko zatrzymania moczu. Zaleca się ostrożność podczas stosowania u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstawienie leków przeciwhistaminowych na 3 dni przed wykonaniem testów. Produkt leczniczy nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją fruktozy, nietolerancją galaktozy, galaktozemią, brakiem laktazy (typu Lapp) lub zespołem złego wchłaniania glukozy-galaktozy.
- CHPL leku Alermed, tabletki powlekane, 10 mgSpecjalne środki ostrozności
W przypadku przerwania stosowania cetyryzyny może wystąpić świąd i (lub) pokrzywka, nawet, jeśli objawy te nie występowały przed rozpoczęciem leczenia. W niektórych przypadkach objawy te mogą być nasilone i może być konieczność wznowienia leczenia. Objawy powinny ustąpić po wznowieniu leczenia. Dzieci i młodzież: Nie zaleca się stosowania produktu leczniczego w postaci tabletek powlekanych u dzieci w wieku poniżej 6 lat, ponieważ ta postać farmaceutyczna nie pozwala na odpowiednie dostosowanie dawki. Zaleca się stosowanie cetyryzyny w postaci farmaceutycznej przeznaczonej dla dzieci.
- CHPL leku Alermed, tabletki powlekane, 10 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na właściwości farmakokinetyczne, farmakodynamiczne oraz profil tolerancji cetyryzyny nie są spodziewane interakcje tego produktu leczniczego z innymi lekami. W przeprowadzonych badaniach interakcji lekowych nie donoszono o występowaniu interakcji farmakodynamicznych ani maczących interakcji farmakokinetycznych, w szczególności z pseudoefedryną lub teofiliną (400 mg na dobę). Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, natomiast zmniejsza szybkość wchłaniania cetyryzyny. U wrażliwych pacjentów jednoczesne stosowanie z alkoholem lub lekami o działaniu hamującym na ośrodkowy układ nerwowy może dodatkowo zmniejszać zdolność reagowania i koncentrację. Cetyryzyna nie nasila jednak działania alkoholu (w stężeniu 0,5 g/1 we krwi).
- CHPL leku Alermed, tabletki powlekane, 10 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Prospektywnie zebrane dane dotyczące stosowania cetyryzyny w okresie ciąży nie wskazują na zwiększone działanie toksyczne w stosunku do matki, płodu lub zarodka. Badania przeprowadzone na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy. Należy zachować ostrożność podczas przepisywania cetyryzyny kobietom w ciąży. Karmienie piersi? Cetyryzyna przenika do mleka ludzkiego w stężeniach stanowiących 25 do 90% stężenia leku w osoczu (w zależności od czasu pobierania próbek po podaniu). Dlatego należy zachować ostrożność podczas przepisywania cetyryzyny u kobiet karmiących piersią. Płodność Dane dotyczące wpływu na płodność u ludzi są ograniczone, nie stwierdzono jednak zagrożenia dla bezpieczeństwa. Dane z badań na zwierzętach nie wskazują na zagrożenie dla bezpieczeństwa w zakresie rozrodczości u ludzi.
- CHPL leku Alermed, tabletki powlekane, 10 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Obiektywne badania z zastosowaniem cetyryzyny w zalecanej dawce 10 mg na dobę nie wykazały istotnego klinicznie wpływu na zdolność prowadzenia pojazdów, odczuwanie senności oraz sprawność psychofizyczną. Pacjenci, u których wystąpiła senność, powinni jednak unikać prowadzenia pojazdów, wykonywania potencjalnie niebezpiecznych czynności oraz obsługiwania maszyn. Pacjenci powinni zwrócić uwagę na reakcję organizmu na lek oraz nie powinni stosować dawek większych niż zalecane.
- CHPL leku Alermed, tabletki powlekane, 10 mgDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne W badaniach klinicznych wykazano, że cetyryzyna w zalecanych dawkach wywołuje działania niepożądane ze strony ośrodkowego układu nerwowego o niemacznym nasileniu, w tym senność, zmęczenie, bóle i zawroty głowy. W niektórych przypadkach obserwowano paradoksalne pobudzenie ośrodkowego układu nerwowego. Mimo, iż cetyryzyna jest selektywnym antagonistą obwodowych receptorów H1 i jest praktycznie pozbawiona aktywności cholinolitycznej, zgłaszano pojedyncze przypadki trudności w oddawaniu moczu, zaburzeń akomodacji oka i suchości błony śluzowej jamy ustnej. Zgłaszano przypadki zaburzeń czynności wątroby ze zwiększoną aktywnością enzymów wątrobowych i ze zwiększonym stężeniem bilirubiny. W większości przypadków ustępowały one po przerwaniu przyjmowania cetyryzyny dichlorowodorku.
- CHPL leku Alermed, tabletki powlekane, 10 mgDziałania niepożądane
Zestawienie działań niepożądanych Dostępne są ilościowe dane dotyczące bezpieczeństwa z badań klinicznych, prowadzonych metodą podwójnie ślepej próby, porównujących cetyryzynę z placebo oraz innymi lekami przeciwhistaminowymi, stosowanymi w zalecanych dawkach (10 mg na dobę dla cetyryzyny). W badaniach uczestniczyło ponad 3200 pacjentów leczonych cetyryzyną. W badaniach kontrolowanych placebo, z zastosowaniem cetyryzyny w dawce 10 mg, obserwowano następujące działania niepożądane, występujące z częstością 1% lub większą: Zmęczenie Zawroty głowy Ból głowy Ból brzucha Suchość błony śluzowej jamy ustnej Nudności Senność Zapalenie gardła Mimo, iż senność występowała statystycznie częściej u pacjentów stosujących cetyryzynę niż w grupie otrzymującej placebo, w większości przypadków miała ona nasilenie łagodne do umiarkowanego.
- CHPL leku Alermed, tabletki powlekane, 10 mgDziałania niepożądane
Inne, obiektywne badania nie wykazały wpływu cetyryzyny w zalecanych dawkach dobowych na zwykłą, codzienną aktywność młodych, zdrowych ochotników. Dzieci i młodzież Działania niepożądane występujące z częstością 1% lub większą u dzieci w wieku od 6 miesięcy do 12 lat, pochodzące z badań klinicznych kontrolowanych placebo, to: Biegunka Senność Zapalenie błony śluzowej nosa Zmęczenie Dane pochodzące z okresu po wprowadzeniu cetyryzyny do obrotu. Oprócz wymienionych powyżej działań niepożądanych występujących podczas badań klinicznych, po wprowadzeniu cetyryzyny do obrotu zgłaszano następujące działania niepożądane. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Alermed, tabletki powlekane, 10 mgDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa, Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 e-mail: ndl@urpl.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Alermed, tabletki powlekane, 10 mgPrzedawkowanie
4.9 Przedawkowanie Obiawv Objawy obserwowane po przedawkowaniu cetyryzyny są związane głównie z działaniem na ośrodkowy układ nerwowy lub mogą wskazywać na działanie przeciwcholinergicme. Po przyjęciu dawki cetyryzyny co najmniej 5 razy większej od zalecanej dawki dobowej zgłaszano następujące działania niepożądane: splątanie, biegunkę, zawroty głowy, zmęczenie, bóle głowy, złe samopoczucie, rozszerzenie źrenic, świąd, niepokój ruchowy, sedację, senność, osłupienie, tachykardię, drżenie i zatrzymanie moczu. Po o ie o r ed kowa u Nie jest mane swoiste antidotum dla cetyryzyny. W razie przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Jeżeli od zażycia dawki leku upłynęło niewiele czasu, można rozważyć wykonanie płukania żołądka. Cetyryzyna nie jest skutecznie usuwana metodą hemodializy.
- CHPL leku Alermed, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiezne Grupa farmakoterapeutyczna: leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny, kod ATC: R06AE07 Mechanizm działania Cetyryzyna, metabolit hydroksyzyny u człowieka, jest silnym i selektywnym antagonistą obwodowych receptorów histaminowych Hi. Badania wiązania z receptorem in vitro nie wykazały istotnego powinowactwa do innych receptorów niż Hi. Działanie farmakodvnamiczne Oprócz działania antagonistycznego w stosunku do receptorów Hi, cetyryzyna wykazuje działanie przeciwalergiczne: u pacjentów z nadwrażliwością (atopią) poddawanych prowokacji alergenem, dawka 10 mg podawana raz lub dwa razy na dobę hamuje napływ do skóry i spojówek komórek póżnej fazy reakcji zapalnej (eozynofili). Skutecmość kliniczna i bezpieczeństwo stosowania Badania u zdrowych ochotników wykazały, że cetyryzyna w dawkach 5 mg i 10 mg silnie hamuje reakcję prowadzącą do powstawania bąbli pokrzywkowych i zaczerwienienia, wywołaną śródskórnym podawaniem histaminy w bardzo dużych stężeniach, ale nie ustalono związku tego działania ze skutecmością.
- CHPL leku Alermed, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
W sześciotygodniowym, kontrolowanym placebo badaniu z udziałem 186 pacjentów z alergicmym zapaleniem błony śluzowej nosa oraz współistniejącą, łagodną lub umiarkowaną astmą, cetyryzyna stosowana w dawce 10 mg raz na dobę łagodziła objawy zapalenia błony śluzowej nosa i nie wplywała na czynność płuc. Badanie to potwierdza bezpieczeństwo stosowania cetyryzyny u pacjentów z alergią i z łagodną lub umiarkowaną astmą. W badaniu kontrolowanym placebo, cetyryzyna podawana w dużej dawce dobowej 60 mg na dobę przez 7 dni, nie powodowała statystycznie znamiennego wydłużenia odstępu QT. Stosowanie cetyryzyny w zalecanych dawkach poprawia jakość życia pacjentów z przewlekłym i sezonowym alergicznym zapaleniem błony śluzowej nosa. Dzieci i młodzież W trwającym 35 dni badaniu, przeprowadzonym u dzieci w wieku od 5 do 12 lat, nie stwierdzono tolerancji na przeciwhistaminowe działanie cetyryzyny (hamowanie powstawania bąbli pokrzywkowych i zaczerwienienia).
- CHPL leku Alermed, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
Po przerwaniu leczenia cetyryzyną podawaną wielokrotnie, skóra odzyskuje normalną reaktywność na histaminę w ciągu 3 dni. 5.2 Wlaściwości farmakokinetyczne Wchłanianie Maksymalne stężenie w osoczu w stanie stacjonamym wynosi około 300 ng/ml i występuje w ciągu 1,0 0,5 h. Rozkład parametrów farmakokinetycmych, takich jak stężenie maksymalne (Cz,) i pole pod krzywą (AUC), jest jednomacznie zdefiniowany. Pokarm nie zmniejsza stopnia wchłaniania cetyiyzyny, lecz zmniejsza szybkość wchłaniania cetyryzyny. W przypadku podawania cetyryzyny w postaci roztworu, kapsułek i tabletek, biodostępność jest podobna. DvstrYbucia Pozorna objętość dystrybucji wynosi 0,50 l/kg. Cetyryzyna wiąże się z białkami osocza w 93 + 0,3%. Cetyryzyna nie wpływa na stopień wiązania warfaryny z białkami. Metabolizm Cetyryzyna nie podlega w znaczącym stopniu metabolizmowi podczas pierwszego przejścia. Eliminacia Końcowy okres półtrwania wynosi około 10 godzin.
- CHPL leku Alermed, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
Nie zaobserwowano kumulacji cetyryzyny podczas stosowania dawek dobowych 10 mg przez 10 dni. Około dwie trzecie dawki jest wydalane w postaci niezmienionej z moczem. Liniowość lub nieliniowość Cetyryzyna wykazuje liniową kinetykę w zakresie dawek od 5 do 60 mg. Zaburzenia czynności nerek Farmakokinetyka leku była podobna u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny powyżej 40 m1/min) oraz u zdrowych ochotników. U pacjentów z umiarkowanymi zaburzeniami czynności nerek, okres półtrwania cetyryzyny był 3 razy dłuższy, a klirens o 70% mniejszy niż u zdrowych ochotników. U pacjentów poddawanych hemodializie (klirens kreatyniny mniejszy niż 7 ml/min), którym podano doustnie cetyryzynę w pojedynczej dawce 10 mg, okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u osób zdrowych. Podczas hemodializy cetyryzyna była usuwana z osocza w niewielkim stopniu.
- CHPL leku Alermed, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
Koniecme jest dostosowanie dawkowania u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2). Zaburzenia czynności wqtroby U pacjentów z przewlekłymi chorobami wątroby (marskość żółciowa, choroby dotyczące miąższu wątroby, choroby związane z zastojem żółci), którym podano 10 lub 20 mg cetyryzyny w pojedynczej dawce, okres półtrwania wydłużył się o 50%, a klirens zmniejszył się o 40% w porównaniu do osób zdrowych. Dostosowanie dawkowania jest koniecme tylko u tych pacjentów z zaburzeniami czynności wątroby, u których jednocześnie występują zaburzenia czynności nerek. Osoby w podeszłym wieku U 16 ochotników w podeszłym wieku po podaniu doustnie pojedynczej dawki 10 mg okres półtrwania wydłużył się o około 50%, a klirens zmniejszył się o 40% w porównaniu z młodszymi pacjentami. Wydaje się, że zmniejszenie klirensu cetyryzyny u ochotników w podeszłym wieku jest związane z występującym w tej grupie osłabieniem czynności nerek.
- CHPL leku Alermed, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
Dzieci i młodzież U dzieci w wieku od 6 do 12 lat okres półtrwania cetyryzyny wynosił około 6 godzin, a u dzieci w wieku od 2 do 6 lat - 5 godzin. U niemowląt i dzieci w wieku od 6 do 24 miesięcy okres półtrwania był zmniejszony do 3,1 godziny. 5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniGzne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksycmości, rakotwórczości oraz toksycmego wpływu na rozród, nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Alermed, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
5.1 Właściwości farmakodynamiezne Grupa farmakoterapeutyczna: leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny, kod ATC: R06AE07 Mechanizm działania Cetyryzyna, metabolit hydroksyzyny u człowieka, jest silnym i selektywnym antagonistą obwodowych receptorów histaminowych Hi. Badania wiązania z receptorem in vitro nie wykazały istotnego powinowactwa do innych receptorów niż Hi. Działanie farmakodvnamiczne Oprócz działania antagonistycznego w stosunku do receptorów Hi, cetyryzyna wykazuje działanie przeciwalergiczne: u pacjentów z nadwrażliwością (atopią) poddawanych prowokacji alergenem, dawka 10 mg podawana raz lub dwa razy na dobę hamuje napływ do skóry i spojówek komórek póżnej fazy reakcji zapalnej (eozynofili). Skutecmość kliniczna i bezpieczeństwo stosowania Badania u zdrowych ochotników wykazały, że cetyryzyna w dawkach 5 mg i 10 mg silnie hamuje reakcję prowadzącą do powstawania bąbli pokrzywkowych i zaczerwienienia, wywołaną śródskórnym podawaniem histaminy w bardzo dużych stężeniach, ale nie ustalono związku tego działania ze skutecmością.
- CHPL leku Alermed, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
W sześciotygodniowym, kontrolowanym placebo badaniu z udziałem 186 pacjentów z alergicmym zapaleniem błony śluzowej nosa oraz współistniejącą, łagodną lub umiarkowaną astmą, cetyryzyna stosowana w dawce 10 mg raz na dobę łagodziła objawy zapalenia błony śluzowej nosa i nie wplywała na czynność płuc. Badanie to potwierdza bezpieczeństwo stosowania cetyryzyny u pacjentów z alergią i z łagodną lub umiarkowaną astmą. W badaniu kontrolowanym placebo, cetyryzyna podawana w dużej dawce dobowej 60 mg na dobę przez 7 dni, nie powodowała statystycznie znamiennego wydłużenia odstępu QT. Stosowanie cetyryzyny w zalecanych dawkach poprawia jakość życia pacjentów z przewlekłym i sezonowym alergicznym zapaleniem błony śluzowej nosa. Dzieci i młodzież W trwającym 35 dni badaniu, przeprowadzonym u dzieci w wieku od 5 do 12 lat, nie stwierdzono tolerancji na przeciwhistaminowe działanie cetyryzyny (hamowanie powstawania bąbli pokrzywkowych i zaczerwienienia).
- CHPL leku Alermed, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Po przerwaniu leczenia cetyryzyną podawaną wielokrotnie, skóra odzyskuje normalną reaktywność na histaminę w ciągu 3 dni. 5.2 Wlaściwości farmakokinetyczne Wchłanianie Maksymalne stężenie w osoczu w stanie stacjonamym wynosi około 300 ng/ml i występuje w ciągu 1,0 0,5 h. Rozkład parametrów farmakokinetycmych, takich jak stężenie maksymalne (Cz,) i pole pod krzywą (AUC), jest jednomacznie zdefiniowany. Pokarm nie zmniejsza stopnia wchłaniania cetyiyzyny, lecz zmniejsza szybkość wchłaniania cetyryzyny. W przypadku podawania cetyryzyny w postaci roztworu, kapsułek i tabletek, biodostępność jest podobna. DvstrYbucia Pozorna objętość dystrybucji wynosi 0,50 l/kg. Cetyryzyna wiąże się z białkami osocza w 93 + 0,3%. Cetyryzyna nie wpływa na stopień wiązania warfaryny z białkami. Metabolizm Cetyryzyna nie podlega w znaczącym stopniu metabolizmowi podczas pierwszego przejścia. Eliminacia Końcowy okres półtrwania wynosi około 10 godzin.
- CHPL leku Alermed, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Nie zaobserwowano kumulacji cetyryzyny podczas stosowania dawek dobowych 10 mg przez 10 dni. Około dwie trzecie dawki jest wydalane w postaci niezmienionej z moczem. Liniowość lub nieliniowość Cetyryzyna wykazuje liniową kinetykę w zakresie dawek od 5 do 60 mg. Zaburzenia czynności nerek Farmakokinetyka leku była podobna u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny powyżej 40 m1/min) oraz u zdrowych ochotników. U pacjentów z umiarkowanymi zaburzeniami czynności nerek, okres półtrwania cetyryzyny był 3 razy dłuższy, a klirens o 70% mniejszy niż u zdrowych ochotników. U pacjentów poddawanych hemodializie (klirens kreatyniny mniejszy niż 7 ml/min), którym podano doustnie cetyryzynę w pojedynczej dawce 10 mg, okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u osób zdrowych. Podczas hemodializy cetyryzyna była usuwana z osocza w niewielkim stopniu.
- CHPL leku Alermed, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Koniecme jest dostosowanie dawkowania u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2). Zaburzenia czynności wqtroby U pacjentów z przewlekłymi chorobami wątroby (marskość żółciowa, choroby dotyczące miąższu wątroby, choroby związane z zastojem żółci), którym podano 10 lub 20 mg cetyryzyny w pojedynczej dawce, okres półtrwania wydłużył się o 50%, a klirens zmniejszył się o 40% w porównaniu do osób zdrowych. Dostosowanie dawkowania jest koniecme tylko u tych pacjentów z zaburzeniami czynności wątroby, u których jednocześnie występują zaburzenia czynności nerek. Osoby w podeszłym wieku U 16 ochotników w podeszłym wieku po podaniu doustnie pojedynczej dawki 10 mg okres półtrwania wydłużył się o około 50%, a klirens zmniejszył się o 40% w porównaniu z młodszymi pacjentami. Wydaje się, że zmniejszenie klirensu cetyryzyny u ochotników w podeszłym wieku jest związane z występującym w tej grupie osłabieniem czynności nerek.
- CHPL leku Alermed, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Dzieci i młodzież U dzieci w wieku od 6 do 12 lat okres półtrwania cetyryzyny wynosił około 6 godzin, a u dzieci w wieku od 2 do 6 lat - 5 godzin. U niemowląt i dzieci w wieku od 6 do 24 miesięcy okres półtrwania był zmniejszony do 3,1 godziny. 5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniGzne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksycmości, rakotwórczości oraz toksycmego wpływu na rozród, nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Alermed, tabletki powlekane, 10 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniGzne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksycmości, rakotwórczości oraz toksycmego wpływu na rozród, nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Alermed, tabletki powlekane, 10 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki: Celuloza mikrokrystalicma Krzemioaka koloidalna bezwodna Magnezu stearynian Laktoza jednowodna Krospowidon Talk Laktytol jednowodny Makrogol 3350 Hypromeloza Tytanu dwutlenek (El71) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/Aluminium lub PVC/PVDC/Aluminium pakowane są w tekturowe pudetko wraz z ulotką dla pacjenta. W opakowaniu znajduje się 20 lub 30 tabletek powlekanych. Pojemnik polietylenowy pakowany w tekturowe pudetko wraz z ulotką dla pacjenta. Opakowanie zawiera 20 tabletek powlekanych. Nie wszystkie wielkości opakowań muszą majdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Alermed, tabletki powlekane, 10 mgDane farmaceutyczne
Wszelkie niewykorzystane resztki produktu lecmiczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Alerzina, tabletki powlekane, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Alerzina, 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 10 mg cetyryzyny dichlorowodorku (Cetirizini dihydrochloridum). Substancja pomocnicza o znanym działaniu: laktoza jednowodna. Jedna tabletka powlekana zawiera 30 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki powlekane Białe, okrągłe tabletki powlekane o gładkiej powierzchni, z rowkiem umożliwiającym podzielenie tabletki na pół.
- CHPL leku Alerzina, tabletki powlekane, 10 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt leczniczy Alerzina wskazany jest w leczeniu: przewlekłego alergicznego zapalenia błony śluzowej nosa, sezonowego alergicznego zapalenia błony śluzowej nosa (katar sienny), alergicznego zapalenia spojówek, przewlekłej idiopatycznej pokrzywki.
- CHPL leku Alerzina, tabletki powlekane, 10 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dzieci w wieku od 6 lat do 12 lat: 5 mg dwa razy na dobę (pół tabletki dwa razy na dobę). Dorośli i młodzież w wieku powyżej 12 lat: 10 mg (1 tabletka) raz na dobę. Pacjenci w podeszłym wieku: brak danych wskazujących na konieczność zmniejszenia dawki leku u osób w podeszłym wieku, jeśli czynność nerek jest u nich prawidłowa. Pacjenci z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek: brak danych określających stosunek skuteczności do bezpieczeństwa stosowania u pacjentów z zaburzeniami czynności nerek. Ponieważ cetyryzyna jest wydalana głównie przez nerki (patrz punkt 5.2), w przypadku braku możliwości zastosowania alternatywnego leczenia, odstępy pomiędzy poszczególnymi dawkami muszą być ustalone indywidualnie w zależności od czynności nerek. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. W celu skorzystania z tabeli dawkowania, należy obliczyć klirens kreatyniny (Clkr) w ml/min.
- CHPL leku Alerzina, tabletki powlekane, 10 mgDawkowanie
Clkr (ml/min) można obliczyć na podstawie stężenia kreatyniny w surowicy krwi (mg/dl), posługując się następującym wzorem: [140 – wiek (lata)] x masa ciała (kg) Clkr = _______________________________________________________ (x 0,85 dla kobiet) 72 x stężenie kreatyniny w surowicy (mg/dl) Modyfikacja dawkowania u dorosłych pacjentów z zaburzeniami czynności nerek Prawidłowa czynność nerek ≥ 80: 10 mg raz na dobę Łagodne zaburzenia czynności nerek 50-79: 10 mg raz na dobę Umiarkowane zaburzenia czynności nerek 30-49: 5 mg raz na dobę Ciężkie zaburzenia czynności nerek < 30: 5 mg co drugi dzień Schyłkowa choroba nerek, pacjenci dializowani < 10: Stosowanie przeciwwskazane U dzieci z zaburzeniami czynności nerek dawkę należy ustalać indywidualnie na podstawie klirensu kreatyniny, wieku oraz masy ciała pacjenta. Pacjenci z zaburzeniami czynności wątroby: nie ma konieczności dostosowania dawki u pacjentów z zaburzeniami czynności wątroby.
- CHPL leku Alerzina, tabletki powlekane, 10 mgDawkowanie
Pacjenci z zaburzeniami czynności nerek oraz z zaburzeniami czynności wątroby: zaleca się dostosowanie dawkowania (patrz powyżej: „Pacjenci z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek”). Sposób podawania Tabletki należy połykać, popijając szklanką wody.
- CHPL leku Alerzina, tabletki powlekane, 10 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, hydroksyzynę lub pochodne piperazyny. Pacjenci z ciężkimi zaburzeniami czynności nerek (klirens kreatyniny < 10 ml/min).
- CHPL leku Alerzina, tabletki powlekane, 10 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stwierdzono istotnych klinicznie interakcji między alkoholem (w stężeniu 0,5 g/l we krwi) a cetyryzyną stosowaną w dawkach terapeutycznych. Jednakże zaleca się zachowanie ostrożności podczas przyjmowania cetyryzyny jednocześnie z alkoholem. Należy zachować ostrożność u pacjentów z czynnikami ryzyka zatrzymania moczu (np. uszkodzony rdzeń kręgowy, rozrost gruczołu krokowego), ponieważ cetyryzyna może zwiększać ryzyko zatrzymania moczu. Zaleca się ostrożność podczas stosowania u pacjentów z padaczką oraz u pacjentów z ryzykiem drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstawić leki przeciwhistaminowe na 3 dni przed wykonaniem testów. Pacjenci z rzadko występującą dziedziczną nietolerancją galaktozy, niedoborem laktazy (typu Lapp) lub zespołem złego wchłaniania glukozy-galaktozy nie powinni stosować cetyryzyny w postaci tabletek powlekanych.
- CHPL leku Alerzina, tabletki powlekane, 10 mgSpecjalne środki ostrozności
U pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek należy stosować mniejsze dawki cetyryzyny (patrz punkt 4.2). Dzieci i młodzież: Nie zaleca się stosowania produktu leczniczego w postaci tabletek powlekanych 10 mg u dzieci w wieku poniżej 6 lat, ponieważ ta postać farmaceutyczna nie pozwala na odpowiednie dostosowanie dawki.
- CHPL leku Alerzina, tabletki powlekane, 10 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na właściwości farmakokinetyczne, farmakodynamiczne oraz profil tolerancji cetyryzyny nie są spodziewane interakcje tego produktu leczniczego z innymi lekami. W przeprowadzonych badaniach nie donoszono o występowaniu interakcji farmakodynamicznych ani znaczących interakcji farmakokinetycznych, w szczególności z pseudoefedryną lub teofiliną (400 mg na dobę). Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, natomiast zmniejsza szybkość jej wchłaniania.
- CHPL leku Alerzina, tabletki powlekane, 10 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Dane kliniczne dotyczące stosowania cetyryzyny w ciąży są ograniczone. Badania przeprowadzone na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy. Należy zachować ostrożność podczas przepisywania cetyryzyny kobietom w ciąży. Karmienie piersi? Cetyryzyna przenika do mleka ludzkiego w stężeniach stanowiących 0,25 do 0,90 stężenia leku w osoczu (w zależności od czasu pobierania próbek po podaniu). Dlatego należy zachować ostrożność podczas przepisywania cetyryzyny u kobiet karmiących piersią.
- CHPL leku Alerzina, tabletki powlekane, 10 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Obiektywne badania z zastosowaniem cetyryzyny w zalecanej dawce 10 mg na dobę nie wykazały istotnego klinicznie wpływu na zdolność prowadzenia pojazdów, odczuwanie senności oraz sprawność psychofizyczną. Pacjenci planujący prowadzenie pojazdów, wykonujący potencjalnie niebezpieczne czynności lub obsługujący maszyny, powinni zwrócić uwagę na reakcję organizmu na lek oraz nie powinni stosować dawek większych niż zalecane. U pacjentów wrażliwych, jednoczesne stosowanie cetyryzyny z alkoholem lub lekami o działaniu hamującym na ośrodkowy układ nerwowy, może nasilać wpływ leku na zdolność reagowania i koncentracji.
- CHPL leku Alerzina, tabletki powlekane, 10 mgDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych wykazano, że cetyryzyna w zalecanych dawkach wywołuje działania niepożądane ze strony ośrodkowego układu nerwowego o nieznacznym nasileniu, w tym senność, zmęczenie, bóle i zawroty głowy. W niektórych przypadkach obserwowano paradoksalne pobudzenie ośrodkowego układu nerwowego. Mimo, iż cetyryzyna jest selektywnym antagonistą obwodowych receptorów H1 i jest praktycznie pozbawiona aktywności cholinolitycznej, zgłaszano pojedyncze przypadki trudności w oddawaniu moczu, zaburzeń akomodacji oka i suchości błony śluzowej jamy ustnej. Zgłaszano przypadki zaburzeń czynności wątroby ze zwiększoną aktywnością enzymów wątrobowych i ze zwiększonym stężeniem bilirubiny. W większości przypadków ustępowały one po przerwaniu przyjmowania cetyryzyny dichlorowodorku.
- CHPL leku Alerzina, tabletki powlekane, 10 mgDziałania niepożądane
Badania kliniczne Dostępne są ilościowe dane dotyczące bezpieczeństwa z kontrolowanych badań klinicznych, prowadzonych metodą podwójnie ślepej próby, porównujących cetyryzynę z placebo oraz innymi lekami przeciwhistaminowymi, stosowanymi w zalecanych dawkach (10 mg na dobę dla cetyryzyny). W badaniach uczestniczyło ponad 3200 pacjentów leczonych cetyryzyną. W badaniach kontrolowanych placebo, z zastosowaniem cetyryzyny w dawce 10 mg, obserwowano następujące działania niepożądane, występujące z częstością 1% lub większą: Działania niepożądane (zgodnie z terminologią działań niepożądanych wg WHO) Cetyryzyna 10 mg (n=3260) Placebo (n=3061) Zmęczenie: 1,63% 0,95% Zawroty głowy: 1,10% 0,98% Ból głowy: 7,42% 8,07% Ból brzucha: 0,98% 1,08% Suchość błony śluzowej jamy ustnej: 2,09% 0,82% Nudności: 1,07% 1,14% Senność: 9,63% 5,00% Zapalenie gardła: 1,29% 1,34% Mimo, iż senność występowała statystycznie częściej u pacjentów stosujących cetyryzynę niż w grupie otrzymującej placebo, w większości przypadków miała ona nasilenie łagodne do umiarkowanego.
- CHPL leku Alerzina, tabletki powlekane, 10 mgDziałania niepożądane
Inne, obiektywne badania nie wykazały wpływu cetyryzyny w zalecanych dawkach dobowych na aktywność młodych, zdrowych ochotników. Działania niepożądane występujące z częstością 1% lub większą u dzieci w wieku od 6 miesięcy do 12 lat Cetyryzyna (n=1656) Placebo (n=1294) Biegunka: 1,0% 0,6% Senność: 1,8% 1,4% Zapalenie błony śluzowej nosa: 1,4% 1,1% Zmęczenie: 1,0% 0,3% Dane pochodzące z okresu po wprowadzeniu cetyryzyny do obrotu Oprócz wymienionych powyżej działań niepożądanych występujących podczas badań klinicznych, po wprowadzeniu cetyryzyny do obrotu zgłaszano następujące działania niepożądane. Działania niepożądane opisano zgodnie z klasyfikacją układów i narządów MedDRA, a ich częstość oszacowano na podstawie danych dostępnych po wprowadzeniu cetyryzyny do obrotu.
- CHPL leku Alerzina, tabletki powlekane, 10 mgDziałania niepożądane
Częstość występowania działań niepożądanych została określona zgodnie z klasyfikacją: bardzo często (≥1/10), często (≥1/100, <1/10), niezbyt często (≥1/1 000, <1/100), rzadko (≥1/10 000, <1/1 000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego: Bardzo rzadko: trombocytopenia Zaburzenia układu immunologicznego: Rzadko: reakcje nadwrażliwości Bardzo rzadko: wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania Częstość nieznana: zwiększenie apetytu Zaburzenia psychiczne: Niezbyt często: pobudzenie Rzadko: zachowanie agresywne, splątanie, depresja, omamy, bezsenność Bardzo rzadko: tiki Częstość nieznana: myśli samobójcze Zaburzenia układu nerwowego: Niezbyt często: parestezje Rzadko: drgawki Bardzo rzadko: zaburzenia smaku, omdlenie, drżenie, dystonia, dyskineza Częstość nieznana: niepamięć, zaburzenia pamięci Zaburzenia oka: Bardzo rzadko: zaburzenia akomodacji, niewyraźne widzenie, rotacja gałek ocznych Zaburzenia ucha i błędnika: Częstość nieznana: zawroty głowy Zaburzenia serca: Rzadko: tachykardia Zaburzenia żołądka i jelit: Niezbyt często: biegunka Zaburzenia wątroby i dróg żółciowych: Rzadko: nieprawidłowa czynność wątroby (zwiększona aktywność aminotransferaz, fosfatazy alkalicznej, γ-GT i zwiększone stężenie bilirubiny) Zaburzenia skóry i tkanki podskórnej: Niezbyt często: świąd, wysypka Rzadko: pokrzywka Bardzo rzadko: obrzęk naczynioruchowy, wysypka polekowa Zaburzenia nerek i dróg moczowych: Bardzo rzadko: bolesne lub utrudnione oddawanie moczu, mimowolne oddawanie moczu Częstość nieznana: zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania: Niezbyt często: osłabienie, złe samopoczucie Rzadko: obrzęki Badania diagnostyczne: Rzadko: zwiększenie masy ciała Zgłaszanie podejrzewanych działań niepożądanych: Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Alerzina, tabletki powlekane, 10 mgDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl
- CHPL leku Alerzina, tabletki powlekane, 10 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedawkowania Objawy obserwowane po przedawkowaniu cetyryzyny są związane głównie z działaniem na ośrodkowy układ nerwowy lub mogą wskazywać na działanie przeciwcholinergiczne. Po przyjęciu dawki cetyryzyny co najmniej 5 razy większej od zalecanej dawki dobowej zgłaszano następujące działania niepożądane: splątanie, biegunkę, zawroty głowy, zmęczenie, bóle głowy, złe samopoczucie, rozszerzenie źrenic, świąd, niepokój ruchowy, sedację, senność, osłupienie, tachykardię, drżenie i zatrzymanie moczu. Postępowanie po przedawkowaniu Specyficzne antidotum dla cetyryzyny nie jest znane. W razie przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Jeżeli od zażycia zbyt dużej dawki leku nie minęło zbyt wiele czasu, należy rozważyć płukanie żołądka. Cetyryzyna nie jest skutecznie usuwana z organizmu metodą dializy.
- CHPL leku Alerzina, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwhistaminowe o działaniu ogólnym; pochodne piperazyny. Kod ATC: R06 AE07 Cetyryzyna, metabolit hydroksyzyny u człowieka, jest silnym, selektywnym antagonistą obwodowych receptorów histaminowych H1. Badania wiązania z receptorem in vitro nie wykazały istotnego powinowactwa do innych receptorów niż H1. Oprócz działania antagonistycznego w stosunku do receptorów H1, cetyryzyna wykazuje działanie przeciwalergiczne: u pacjentów z nadwrażliwością (atopią) poddawanych prowokacji alergenem, dawka 10 mg podawana raz lub dwa razy na dobę hamuje napływ komórek późnej fazy reakcji zapalnej, szczególnie eozynofilów, do skóry i spojówek. Badania u zdrowych ochotników wykazały, że cetyryzyna w dawkach 5 mg i 10 mg silnie hamuje reakcję prowadzącą do powstawania bąbli pokrzywkowych i zaczerwienienia, wywołaną śródskórnym podawaniem histaminy w bardzo dużych stężeniach, ale nie ustalono związku ze skutecznością.
- CHPL leku Alerzina, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
W trwającym 35 dni badaniu, przeprowadzonym u dzieci w wieku od 5 do 12 lat, nie stwierdzono tolerancji na przeciwhistaminowe działanie cetyryzyny (ustępowanie bąbli pokrzywkowych i zaczerwienienia). Po przerwaniu leczenia cetyryzyną podawaną wielokrotnie, skóra odzyskuje normalną reaktywność na histaminę w ciągu 3 dni. W sześciotygodniowym, kontrolowanym placebo badaniu z udziałem pacjentów z alergicznym zapaleniem błony śluzowej nosa oraz współistniejącą, łagodną lub umiarkowaną astmą, cetyryzyna stosowana w dawce 10 mg raz na dobę łagodziła objawy zapalenia błony śluzowej nosa i nie wpływała na czynność płuc. Badanie to potwierdza bezpieczeństwo stosowania cetyryzyny u pacjentów z alergią i z łagodną lub umiarkowaną astmą. W badaniu kontrolowanym placebo, cetyryzyna podawana w dużej dawce dobowej 60 mg na dobę przez 7 dni, nie powodowała statystycznie znamiennego wydłużenia odstępu QT.
- CHPL leku Alerzina, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
Stosowanie cetyryzyny w zalecanych dawkach poprawia jakość życia pacjentów z przewlekłym i sezonowym alergicznym zapaleniem błony śluzowej nosa.
- CHPL leku Alerzina, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Maksymalne stężenie w osoczu w stanie stacjonarnym wynosi około 300 ng/ml i występuje w ciągu 1,0 ± 0,5 h. Nie zaobserwowano kumulacji cetyryzyny podczas stosowania dawek dobowych 10 mg przez 10 dni. U ochotników rozkład parametrów farmakokinetycznych, takich jak stężenie maksymalne (Cmax) i pole pod krzywą (AUC), jest jednoznacznie zdefiniowany. Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, lecz zmniejsza szybkość wchłaniania cetyryzyny. W przypadku podawania cetyryzyny w postaci roztworu, kapsułek i tabletek, biodostępność jest podobna. Pozorna objętość dystrybucji wynosi 0,50 l/kg. Cetyryzyna wiąże się z białkami osocza w 93 ± 0,3%. Cetyryzyna nie wpływa na stopień wiązania warfaryny z białkami. Cetyryzyna nie podlega w znaczącym stopniu metabolizmowi podczas pierwszego przejścia. Około dwie trzecie dawki jest wydalane w postaci niezmienionej z moczem. Końcowy okres półtrwania wynosi około 10 godzin.
- CHPL leku Alerzina, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Cetyryzyna wykazuje liniową kinetykę w zakresie dawek od 5 do 60 mg. Szczególne grupy pacjentów: Pacjenci w podeszłym wieku: U 16 pacjentów w podeszłym wieku po podaniu doustnie pojedynczej dawki 10 mg cetyryzyny okres półtrwania wydłużył się o około 50%, a klirens zmniejszył się o 40% w porównaniu z pozostałymi pacjentami. Wydaje się, że zmniejszenie klirensu cetyryzyny u ochotników w podeszłym wieku jest związane z zaburzeniem czynności nerek. Dzieci i niemowlęta: U dzieci w wieku od 6 do 12 lat okres półtrwania cetyryzyny wynosił około 6 godzin, a u dzieci w wieku 2-6 lat - 5 godzin. U niemowląt i dzieci w wieku od 6 do 24 miesięcy okres półtrwania był zmniejszony do 3,1 godziny. Pacjenci z zaburzeniami czynności nerek: Farmakokinetyka leku była podobna u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny powyżej 40 ml/min) oraz u zdrowych ochotników.
- CHPL leku Alerzina, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
U pacjentów z umiarkowanymi zaburzeniami czynności nerek, okres półtrwania cetyryzyny był 3 razy dłuższy, a klirens o 70% mniejszy niż u zdrowych ochotników. U pacjentów poddawanych hemodializie (klirens kreatyniny poniżej 7 ml/min), którym podano doustnie cetyryzynę w pojedynczej dawce 10 mg, okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u osób zdrowych. Podczas hemodializy cetyryzyna była usuwana z osocza w niewielkim stopniu. Konieczna jest modyfikacja dawkowania u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2). Pacjenci z zaburzeniami czynności wątroby: U pacjentów z przewlekłymi chorobami wątroby (marskość żółciowa, choroby dotyczące miąższu wątroby, choroby związane z zastojem żółci), którym podano 10 lub 20 mg cetyryzyny w pojedynczej dawce, okres półtrwania wydłużył się o 50%, a klirens zmniejszył się o 40% w porównaniu do osób zdrowych.
- CHPL leku Alerzina, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Modyfikacja dawkowania jest konieczna tylko u tych pacjentów z zaburzeniami czynności wątroby, u których jednocześnie występują zaburzenia czynności nerek.
- CHPL leku Alerzina, tabletki powlekane, 10 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na reprodukcję, nie ujawniają występowania szczególnego zagrożenia dla człowieka.
- CHPL leku Alerzina, tabletki powlekane, 10 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki: Celuloza mikrokrystaliczna Krzemionka koloidalna bezwodna Magnezu stearynian Laktoza jednowodna Krospowidon Otoczka: Talk Laktytol jednowodny Makrogol 3350 Hypromeloza Tytanu dwutlenek (E171) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25 o C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/Aluminium lub PVC/PVDC/Aluminium pakowane są w tekturowe pudełko wraz z ulotką dla pacjenta. W opakowaniu znajduje się 10 tabletek powlekanych. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Amertil Bio, 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana produktu leczniczego Amertil Bio zawiera 10 mg cetyryzyny dichlorowodorku. Substancja pomocnicza o znanym działaniu: jedna tabletka powlekana zawiera 80,62 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana Białe, okrągłe, obustronnie wypukłe tabletki powlekane, z jednej strony z nacięciem umożliwiającym podział tabletki na dwie równe dawki. Powierzchnia tabletek powlekanych jest gładka, bez plam i wykruszeń. Tabletkę można podzielić na dwie równe dawki.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgWskazania do stosowania
4.1 Wskazania do stosowania U dorosłych i dzieci w wieku 6 lat i starszych: cetyryzyna jest wskazana w łagodzeniu objawów dotyczących nosa i oczu, związanych z sezonowym i przewlekłym alergicznym zapaleniem błony śluzowej nosa, cetyryzyna jest wskazana w łagodzeniu objawów przewlekłej idiopatycznej pokrzywki.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dzieci w wieku od 6 lat do 12 lat: 5 mg dwa razy na dobę (pół tabletki dwa razy na dobę) Dorośli i młodzież w wieku powyżej 12 lat: 10 mg (1 tabletka) raz na dobę. Pacjenci w podeszłym wieku: Brak danych wskazujących na konieczność zmniejszenia dawki leku u osób w podeszłym wieku, jeśli czynność nerek jest u nich prawidłowa. Pacjenci z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek: Brak danych określających stosunek skuteczności do bezpieczeństwa stosowania u pacjentów z zaburzeniami czynności nerek. Ponieważ cetyryzyna jest wydalana głównie przez nerki (patrz punkt 5.2), w przypadku braku możliwości zastosowania alternatywnego leczenia, odstępy pomiędzy poszczególnymi dawkami muszą być ustalone indywidualnie w zależności od czynności nerek. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. Aby skorzystać z tabeli dawkowania, należy obliczyć klirens kreatyniny (Clkr) w ml/min.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgDawkowanie
Clkr (ml/min) można obliczyć na podstawie stężenia kreatyniny w surowicy krwi (mg/dl), posługując się następującym wzorem: Clkr = [140 – wiek (lata)] x masa ciała (kg) (x 0,85 dla kobiet) / (72 x stężenie kreatyniny w surowicy (mg/dl)) Modyfikacja dawkowania u dorosłych pacjentów z zaburzeniami czynności nerek: Prawidłowa czynność nerek: ≥ 80 - 10 mg raz na dobę Łagodne zaburzenia czynności nerek: 50-79 - 10 mg raz na dobę Umiarkowane zaburzenia czynności nerek: 30-49 - 5 mg na dobę Ciężkie zaburzenia czynności nerek: < 30 - 5 mg co drugi dzień Schyłkowa choroba nerek, pacjenci dializowani: < 10 - Stosowanie przeciwwskazane U dzieci z zaburzeniami czynności nerek dawkę należy ustalić indywidualnie na podstawie klirensu kreatyniny, wieku oraz masy ciała pacjenta. Pacjenci z zaburzeniami czynności wątroby: Nie ma konieczności dostosowania dawki u pacjentów z zaburzeniami czynności wątroby.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgDawkowanie
Pacjenci z zaburzeniami czynności nerek oraz z zaburzeniami czynności wątroby: Zaleca się dostosowanie dawkowania (patrz powyżej: „Pacjenci z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek”). Sposób podawania: Tabletki należy połykać, popijając szklanką płynu.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, którąkolwiek substancję pomocniczą, hydroksyzynę lub pochodne piperazyny. Ciężkie zaburzenia czynności nerek z klirensem kreatyniny mniejszym niż 10 ml/min.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stwierdzono istotnych klinicznie interakcji między alkoholem (w stężeniu 0,5 g/l we krwi) a cetyryzyną stosowaną w dawkach terapeutycznych. Jednakże zaleca się zachowanie ostrożności podczas przyjmowania cetyryzyny jednocześnie z alkoholem. Należy zachować ostrożność u pacjentów z czynnikami ryzyka zatrzymania moczu (np. uszkodzony rdzeń kręgowy, rozrost gruczołu krokowego), ponieważ cetyryzyna może zwiększać ryzyko zatrzymania moczu. Zaleca się ostrożność podczas stosowania u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w skórnych testach alergicznych. Zaleca się odstawić leki przeciwhistaminowe na 3 dni przed planowanym wykonaniem takich testów.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na właściwości farmakokinetyczne, farmakodynamiczne oraz profil tolerancji cetyryzyny nie są spodziewane interakcje tego produktu leczniczego z innymi lekami. W przeprowadzonych badaniach nie zgłaszano występowania interakcji farmakodynamicznych ani znaczących interakcji farmakokinetycznych, w szczególności z pseudoefedryną lub teofiliną (400 mg na dobę). Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, natomiast zmniejsza szybkość wchłaniania cetyryzyny. 4.6 Wpływ na płodność, ciążę i laktację Ciąża Dane kliniczne dotyczące stosowania cetyryzyny w ciąży są ograniczone. Badania przeprowadzone na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu czy rozwój pourodzeniowy (patrz punkt 5.3). Należy zachować ostrożność przepisując cetyryzynę kobietom w ciąży. Karmienie piersi?
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgInterakcje
Cetyryzyna przenika do mleka matki w stężeniu stanowiącym 25 do 90% stężenia leku oznaczanego w osoczu, w zależności od czasu pobrania próbki po podaniu leku. Dlatego należy zachować ostrożność przepisując cetyryzynę kobietom karmiącym piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Obiektywne badania z zastosowaniem cetyryzyny w zalecanej dawce 10 mg nie wykazały istotnego klinicznie wpływu na zdolność prowadzenia pojazdów, odczuwanie senności oraz sprawność psychofizyczną. Pacjenci planujący prowadzenie pojazdów, wykonujący potencjalnie niebezpieczne czynności lub obsługujący maszyny powinni zwrócić uwagę na reakcję organizmu na lek oraz nie powinni stosować dawek większych niż zalecane. U pacjentów wrażliwych, jednoczesne stosowanie cetyryzyny z alkoholem lub lekami o działaniu hamującym na ośrodkowy układ nerwowy, może nasilać wpływ leku na zdolność reagowania i koncentracji.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgInterakcje
4.8 Działania niepożądane W badaniach klinicznych wykazano, że cetyryzyna w zalecanych dawkach wywołuje działania niepożądane ze strony ośrodkowego układu nerwowego o nieznacznym nasileniu, w tym senność, zmęczenie, bóle i zawroty głowy. W niektórych przypadkach obserwowano paradoksalne pobudzenie ośrodkowego układu nerwowego. Mimo, iż cetyryzyna jest selektywnym antagonistą obwodowych receptorów H1 i jest praktycznie pozbawiona aktywności cholinolitycznej, zgłaszano pojedyncze przypadki trudności w oddawaniu moczu, zaburzeń akomodacji oka i suchości błony śluzowej jamy ustnej. Zgłaszano przypadki zaburzeń czynności wątroby ze zwiększoną aktywnością enzymów wątrobowych i ze zwiększonym stężeniem bilirubiny. W większości przypadków ustępowały one po przerwaniu przyjmowania cetyryzyny dichlorowodorku.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgInterakcje
Badania kliniczne Dostępne są ilościowe dane dotyczące bezpieczeństwa z badań klinicznych prowadzonych metodą podwójnie ślepej próby, porównujących cetyryzynę z placebo oraz innymi lekami przeciwhistaminowymi stosowanymi w zalecanych dawkach (10 mg na dobę dla cetyryzyny). W tych badaniach uczestniczyło ponad 3200 pacjentów leczonych cetyryzyną. W badaniach kontrolowanych placebo, z zastosowaniem cetyryzyny w dawce 10 mg obserwowano następujące działania niepożądane, występujące z częstością 1% lub większą: Działania niepożądane (terminologia działań niepożądanych wg WHO) Cetyryzyna 10 mg (n = 3260) Placebo (n = 3061) Zaburzenia ogólne Zmęczenie: 1,63% (Cetyryzyna), 0,95% (Placebo) Zaburzenia ośrodkowego i obwodowego układu nerwowego Zawroty głowy: 1,10% (Cetyryzyna), 0,98% (Placebo) Ból głowy: 7,42% (Cetyryzyna), 8,07% (Placebo) Zaburzenia żołądka i jelit Ból brzucha: 0,98% (Cetyryzyna), 1,08% (Placebo) Suchość błony śluzowej jamy ustnej: 2,09% (Cetyryzyna), 0,82% (Placebo) Nudności: 1,07% (Cetyryzyna), 1,14% (Placebo) Zaburzenia psychiczne Senność: 9,63% (Cetyryzyna), 5,0% (Placebo) Zaburzenia układu oddechowego Zapalenie gardła: 1,29% (Cetyryzyna), 1,34% (Placebo) Mimo, iż senność występowała statystycznie częściej u pacjentów stosujących cetyryzynę niż w grupie otrzymującej placebo, w większości przypadków miała ona nasilenie łagodne do umiarkowanego.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgInterakcje
Inne, obiektywne badania nie wykazały wpływu cetyryzyny w zalecanych dawkach dobowych na aktywność młodych, zdrowych ochotników. Działania niepożądane występujące z częstością 1% lub większą u dzieci w wieku od 6 miesięcy do 12 lat, pochodzące z badań klinicznych kontrolowanych placebo to: Działania niepożądane (terminologia działań niepożądanych wg WHO) Cetyryzyna 10 mg (n = 1656) Placebo (n = 1294) Zaburzenia żołądka i jelit Biegunka: 1,0% (Cetyryzyna), 0,6% (Placebo) Zaburzenia psychiczne Senność: 1,8% (Cetyryzyna), 1,4% (Placebo) Zaburzenia układu oddechowego Zapalenie błony śluzowej nosa: 1,4% (Cetyryzyna), 1,1% (Placebo) Zaburzenia ogólne Zmęczenie: 1,0% (Cetyryzyna), 0,3% (Placebo) Dane pochodzące z okresu po wprowadzeniu leku do obrotu Oprócz wymienionych powyżej działań niepożądanych występujących podczas badań klinicznych, po wprowadzeniu leku do obrotu zgłaszano następujące działania niepożądane.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgInterakcje
Działania niepożądane są pogrupowane według klasyfikacji układów i narządów MedDRA, a ich częstość występowania oszacowano na podstawie danych z okresu po wprowadzeniu leku do obrotu. Częstość występowania działań niepożądanych określono następująco: bardzo często (≥1/10) często (≥1/100 do <1/10) niezbyt często (≥1/1 000 do <1/100) rzadko (≥1/10 000 do <1/1 000) bardzo rzadko (<1/10 000) częstość nieznana (nie może być określona na podstawie dostępnych danych) Zaburzenia krwi i układu chłonnego: Bardzo rzadko: małopłytkowość (trombocytopenia) Zaburzenia układu immunologicznego: Rzadko: reakcje nadwrażliwości Bardzo rzadko: wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania: Częstość nieznana: zwiększenie apetytu Zaburzenia psychiczne: Niezbyt często: pobudzenie Rzadko: zachowanie agresywne, splątanie, depresja, omamy, bezsenność Bardzo rzadko: tiki Częstość nieznana: myśli samobójcze Zaburzenia układu nerwowego: Niezbyt często: parestezje Rzadko: drgawki Bardzo rzadko: zaburzenia smaku, omdlenie, drżenie, dystonia, dyskineza Częstość nieznana: amnezja, zaburzenia pamięci Zaburzenia oka: Bardzo rzadko: zaburzenia akomodacji, niewyraźne widzenie, rotacja gałek ocznych Zaburzenia ucha i błędnika: Częstość nieznana: zawroty głowy Zaburzenia serca: Rzadko: tachykardia Zaburzenia żołądka i jelit: Niezbyt często: biegunka Zaburzenia wątroby i dróg żółciowych: Rzadko: nieprawidłowa czynność wątroby (zwiększona aktywność aminotransferaz, fosfatazy alkalicznej, GGTP (gamma-glutamylotransferazy) i zwiększone stężenie bilirubiny) Zaburzenia skóry i tkanki podskórnej: Niezbyt często: świąd, wysypka Rzadko: pokrzywka Bardzo rzadko: obrzęk naczynioruchowy, wysypka polekowa Zaburzenia nerek i dróg moczowych: Bardzo rzadko: bolesne lub utrudnione oddawanie moczu, mimowolne oddawanie moczu Częstość nieznana: zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania: Niezbyt często: osłabienie, złe samopoczucie Rzadko: obrzęki Badania diagnostyczne: Rzadko: zwiększenie masy ciała Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgInterakcje
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: +48 22 49 21 301 Faks: +48 22 49 21 309 strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. 4.9 Przedawkowanie Objawy przedawkowania Objawy obserwowane po przedawkowaniu cetyryzyny są związane głównie z działaniem na ośrodkowy układ nerwowy lub mogą wskazywać na działanie przeciwcholinergiczne.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgInterakcje
Po przyjęciu dawki cetyryzyny co najmniej 5 razy większej od zalecanej dawki dobowej zgłaszano następujące działania niepożądane: splątanie, biegunkę, zawroty głowy, zmęczenie, bóle głowy, złe samopoczucie, rozszerzenie źrenic, świąd, niepokój (zwłaszcza ruchowy), sedację, senność, osłupienie, tachykardię, drżenie i zatrzymanie moczu. Postępowanie po przedawkowaniu Swoiste antidotum nie jest znane. W razie przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Jeżeli od zażycia zbyt dużej dawki leku nie minęło zbyt wiele czasu, należy rozważyć wykonanie płukania żołądka. Cetyryzyna nie jest skutecznie usuwana metodą dializy.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Dane kliniczne dotyczące stosowania cetyryzyny w ciąży są ograniczone. Badania przeprowadzone na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu czy rozwój pourodzeniowy (patrz punkt 5.3). Należy zachować ostrożność przepisując cetyryzynę kobietom w ciąży. Karmienie piersi? Cetyryzyna przenika do mleka matki w stężeniu stanowiącym 25 do 90% stężenia leku oznaczanego w osoczu, w zależności od czasu pobrania próbki po podaniu leku. Dlatego należy zachować ostrożność przepisując cetyryzynę kobietom karmiącym piersią.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Obiektywne badania z zastosowaniem cetyryzyny w zalecanej dawce 10 mg nie wykazały istotnego klinicznie wpływu na zdolność prowadzenia pojazdów, odczuwanie senności oraz sprawność psychofizyczną. Pacjenci planujący prowadzenie pojazdów, wykonujący potencjalnie niebezpieczne czynności lub obsługujący maszyny powinni zwrócić uwagę na reakcję organizmu na lek oraz nie powinni stosować dawek większych niż zalecane. U pacjentów wrażliwych, jednoczesne stosowanie cetyryzyny z alkoholem lub lekami o działaniu hamującym na ośrodkowy układ nerwowy, może nasilać wpływ leku na zdolność reagowania i koncentracji.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgDziałania niepożądane
4.8 Działania niepożądane W badaniach klinicznych wykazano, że cetyryzyna w zalecanych dawkach wywołuje działania niepożądane ze strony ośrodkowego układu nerwowego o nieznacznym nasileniu, w tym senność, zmęczenie, bóle i zawroty głowy. W niektórych przypadkach obserwowano paradoksalne pobudzenie ośrodkowego układu nerwowego. Mimo, iż cetyryzyna jest selektywnym antagonistą obwodowych receptorów H1 i jest praktycznie pozbawiona aktywności cholinolitycznej, zgłaszano pojedyncze przypadki trudności w oddawaniu moczu, zaburzeń akomodacji oka i suchości błony śluzowej jamy ustnej. Zgłaszano przypadki zaburzeń czynności wątroby ze zwiększoną aktywnością enzymów wątrobowych i ze zwiększonym stężeniem bilirubiny. W większości przypadków ustępowały one po przerwaniu przyjmowania cetyryzyny dichlorowodorku.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgDziałania niepożądane
Badania kliniczne Dostępne są ilościowe dane dotyczące bezpieczeństwa z badań klinicznych prowadzonych metodą podwójnie ślepej próby, porównujących cetyryzynę z placebo oraz innymi lekami przeciwhistaminowymi stosowanymi w zalecanych dawkach (10 mg na dobę dla cetyryzyny). W tych badaniach uczestniczyło ponad 3200 pacjentów leczonych cetyryzyną. W badaniach kontrolowanych placebo, z zastosowaniem cetyryzyny w dawce 10 mg obserwowano następujące działania niepożądane, występujące z częstością 1% lub większą: Działania niepożądane (terminologia działań niepożądanych wg WHO) Cetyryzyna 10 mg (n = 3260) Placebo (n = 3061) Zaburzenia ogólne Zmęczenie: 1,63% (Cetyryzyna), 0,95% (Placebo) Zaburzenia ośrodkowego i obwodowego układu nerwowego Zawroty głowy: 1,10% (Cetyryzyna), 0,98% (Placebo) Ból głowy: 7,42% (Cetyryzyna), 8,07% (Placebo) Zaburzenia żołądka i jelit Ból brzucha: 0,98% (Cetyryzyna), 1,08% (Placebo) Suchość błony śluzowej jamy ustnej: 2,09% (Cetyryzyna), 0,82% (Placebo) Nudności: 1,07% (Cetyryzyna), 1,14% (Placebo) Zaburzenia psychiczne Senność: 9,63% (Cetyryzyna), 5,0% (Placebo) Zaburzenia układu oddechowego Zapalenie gardła: 1,29% (Cetyryzyna), 1,34% (Placebo) Mimo, iż senność występowała statystycznie częściej u pacjentów stosujących cetyryzynę niż w grupie otrzymującej placebo, w większości przypadków miała ona nasilenie łagodne do umiarkowanego.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgDziałania niepożądane
Inne, obiektywne badania nie wykazały wpływu cetyryzyny w zalecanych dawkach dobowych na aktywność młodych, zdrowych ochotników. Działania niepożądane występujące z częstością 1% lub większą u dzieci w wieku od 6 miesięcy do 12 lat, pochodzące z badań klinicznych kontrolowanych placebo to: Działania niepożądane (terminologia działań niepożądanych wg WHO) Cetyryzyna 10 mg (n = 1656) Placebo (n = 1294) Zaburzenia żołądka i jelit Biegunka: 1,0% (Cetyryzyna), 0,6% (Placebo) Zaburzenia psychiczne Senność: 1,8% (Cetyryzyna), 1,4% (Placebo) Zaburzenia układu oddechowego Zapalenie błony śluzowej nosa: 1,4% (Cetyryzyna), 1,1% (Placebo) Zaburzenia ogólne Zmęczenie: 1,0% (Cetyryzyna), 0,3% (Placebo) Dane pochodzące z okresu po wprowadzeniu leku do obrotu Oprócz wymienionych powyżej działań niepożądanych występujących podczas badań klinicznych, po wprowadzeniu leku do obrotu zgłaszano następujące działania niepożądane.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgDziałania niepożądane
Działania niepożądane są pogrupowane według klasyfikacji układów i narządów MedDRA, a ich częstość występowania oszacowano na podstawie danych z okresu po wprowadzeniu leku do obrotu. Częstość występowania działań niepożądanych określono następująco: bardzo często (≥1/10) często (≥1/100 do <1/10) niezbyt często (≥1/1 000 do <1/100) rzadko (≥1/10 000 do <1/1 000) bardzo rzadko (<1/10 000) częstość nieznana (nie może być określona na podstawie dostępnych danych) Zaburzenia krwi i układu chłonnego: Bardzo rzadko: małopłytkowość (trombocytopenia) Zaburzenia układu immunologicznego: Rzadko: reakcje nadwrażliwości Bardzo rzadko: wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania: Częstość nieznana: zwiększenie apetytu Zaburzenia psychiczne: Niezbyt często: pobudzenie Rzadko: zachowanie agresywne, splątanie, depresja, omamy, bezsenność Bardzo rzadko: tiki Częstość nieznana: myśli samobójcze Zaburzenia układu nerwowego: Niezbyt często: parestezje Rzadko: drgawki Bardzo rzadko: zaburzenia smaku, omdlenie, drżenie, dystonia, dyskineza Częstość nieznana: amnezja, zaburzenia pamięci Zaburzenia oka: Bardzo rzadko: zaburzenia akomodacji, niewyraźne widzenie, rotacja gałek ocznych Zaburzenia ucha i błędnika: Częstość nieznana: zawroty głowy Zaburzenia serca: Rzadko: tachykardia Zaburzenia żołądka i jelit: Niezbyt często: biegunka Zaburzenia wątroby i dróg żółciowych: Rzadko: nieprawidłowa czynność wątroby (zwiększona aktywność aminotransferaz, fosfatazy alkalicznej, GGTP (gamma-glutamylotransferazy) i zwiększone stężenie bilirubiny) Zaburzenia skóry i tkanki podskórnej: Niezbyt często: świąd, wysypka Rzadko: pokrzywka Bardzo rzadko: obrzęk naczynioruchowy, wysypka polekowa Zaburzenia nerek i dróg moczowych: Bardzo rzadko: bolesne lub utrudnione oddawanie moczu, mimowolne oddawanie moczu Częstość nieznana: zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania: Niezbyt często: osłabienie, złe samopoczucie Rzadko: obrzęki Badania diagnostyczne: Rzadko: zwiększenie masy ciała Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: +48 22 49 21 301 Faks: +48 22 49 21 309 strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgPrzedawkowanie
4.9 Przedawkowanie Objawy przedawkowania Objawy obserwowane po przedawkowaniu cetyryzyny są związane głównie z działaniem na ośrodkowy układ nerwowy lub mogą wskazywać na działanie przeciwcholinergiczne. Po przyjęciu dawki cetyryzyny co najmniej 5 razy większej od zalecanej dawki dobowej zgłaszano następujące działania niepożądane: splątanie, biegunkę, zawroty głowy, zmęczenie, bóle głowy, złe samopoczucie, rozszerzenie źrenic, świąd, niepokój (zwłaszcza ruchowy), sedację, senność, osłupienie, tachykardię, drżenie i zatrzymanie moczu. Postępowanie po przedawkowaniu Swoiste antidotum nie jest znane. W razie przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Jeżeli od zażycia zbyt dużej dawki leku nie minęło zbyt wiele czasu, należy rozważyć wykonanie płukania żołądka. Cetyryzyna nie jest skutecznie usuwana metodą dializy.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Pochodne piperazyny, kod ATC: R06AE07 Cetyryzyna, metabolit hydroksyzyny u człowieka, jest silnym i selektywnym antagonistą obwodowych receptorów histaminowych H1. Badania wiązania z receptorem in vitro nie wykazały istotnego powinowactwa do innych receptorów niż H1. Oprócz działania antagonistycznego w stosunku do receptorów H1, cetyryzyna wykazuje działanie przeciwalergiczne: u pacjentów z nadwrażliwością (atopią) poddawanych prowokacji alergenem, dawka 10 mg podawana raz lub dwa razy na dobę, hamuje napływ do skóry i spojówek komórek późnej fazy reakcji zapalnej (eozynofili). Badania u zdrowych ochotników wykazały, że cetyryzyna w dawkach 5 i 10 mg silnie hamuje reakcję prowadzącą do powstawania bąbli pokrzywkowych i zaczerwienienia, wywołaną śródskórnym podawaniem histaminy w bardzo dużych stężeniach, ale nie ustalono związku tego działania ze skutecznością.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
W trwającym 35 dni badaniu, przeprowadzonym u dzieci w wieku od 5 do 12 lat nie stwierdzono tolerancji na przeciwhistaminowe działanie cetyryzyny (hamowanie powstawania bąbli pokrzywkowych i zaczerwienienia). Po przerwaniu leczenia cetyryzyną podawaną wielokrotnie skóra odzyskuje normalną reaktywność na histaminę w ciągu 3 dni. W sześciotygodniowym, kontrolowanym placebo badaniu z udziałem 186 pacjentów z alergicznym zapaleniem błony śluzowej nosa oraz współistniejącą, łagodną lub umiarkowaną astmą, cetyryzyna stosowana w dawce 10 mg raz na dobę łagodziła objawy zapalenia błony śluzowej nosa i nie wpływała na czynność płuc. Badanie to potwierdza bezpieczeństwo stosowania cetyryzyny u pacjentów z alergią i z łagodną lub umiarkowaną astmą. W badaniu kontrolowanym placebo cetyryzyna podawana w dużej dawce dobowej wynoszącej 60 mg przez siedem dni nie powodowała statystycznie znamiennego wydłużenia odstępu QT.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgWłaściwości farmakodynamiczne
Stosowanie cetyryzyny w zalecanych dawkach poprawia jakość życia pacjentów z przewlekłym i sezonowym alergicznym zapaleniem błony śluzowej nosa.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Maksymalne stężenie w osoczu w stanie stacjonarnym wynosi około 300 ng/ml i występuje w ciągu 1,0 ± 0,5 h. Nie zaobserwowano kumulacji cetyryzyny podczas stosowania dawek dobowych 10 mg przez 10 dni. U ochotników rozkład parametrów farmakokinetycznych, takich jak stężenie maksymalne (Cmax) i pole pod krzywą (AUC), jest jednoznacznie zdefiniowany. Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, lecz zmniejsza szybkość wchłaniania cetyryzyny. W przypadku podawania cetyryzyny w postaci roztworu, kapsułek i tabletek, biodostępność jest podobna. Dystrybucja Pozorna objętość dystrybucji wynosi 0,50 l/kg. Cetyryzyna wiąże się z białkami osocza w 93 ± 0,3%. Cetyryzyna nie wpływa na stopień wiązania warfaryny z białkami. Metabolizm Cetyryzyna nie podlega w znaczącym stopniu metabolizmowi pierwszego przejścia. Eliminacja Około dwie trzecie dawki jest wydalane w postaci niezmienionej z moczem.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Końcowy okres półtrwania wynosi około 10 godzin. Liniowość lub nieliniowość Cetyryzyna wykazuje liniową kinetykę w zakresie dawek od 5 do 60 mg. Szczególne grupy pacjentów Osoby w podeszłym wieku: U 16 pacjentów w podeszłym wieku po podaniu doustnie pojedynczej dawki 10 mg okres półtrwania wydłużył się o około 50%, a klirens zmniejszył się o 40% w porównaniu z grupą kontrolną. Wydaje się, że zmniejszenie klirensu cetyryzyny u ochotników w podeszłym wieku jest związane z występującym w tej grupie osłabieniem czynności nerek. Dzieci i niemowlęta: U dzieci w wieku od 6 do 12 lat okres półtrwania cetyryzyny wynosił około 6 godzin, a u dzieci w wieku 2-6 lat - 5 godzin. U niemowląt i dzieci w wieku od 6 do 24 miesięcy okres półtrwania jest zmniejszony do 3,1 godziny. Pacjenci z zaburzeniami czynności nerek: Farmakokinetyka leku była podobna u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny powyżej 40 ml/min) oraz u zdrowych ochotników.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
U pacjentów z umiarkowanymi zaburzeniami czynności nerek okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u zdrowych ochotników. U pacjentów poddawanych hemodializie (klirens kreatyniny mniejszy niż 7 ml/min), którym podano doustnie cetyryzynę w pojedynczej dawce 10 mg, okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u osób zdrowych. Podczas hemodializy cetyryzyna była usuwana z osocza w niewielkim stopniu. Konieczna jest modyfikacja dawkowania u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2). Pacjenci z zaburzeniami czynności wątroby: U pacjentów z przewlekłymi chorobami wątroby (marskość żółciowa, choroby dotyczące miąższu wątroby, choroby związane z zastojem żółci), którym podano 10 mg lub 20 mg cetyryzyny w pojedynczej dawce, okres półtrwania wydłużył się o 50%, a klirens zmniejszył o 40% w porównaniu do osób zdrowych.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgWłaściwości farmakokinetyczne
Dostosowanie dawkowania jest konieczne tylko u tych pacjentów z zaburzeniami czynności wątroby, u których jednocześnie występują zaburzenia czynności nerek.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na reprodukcję, nie ujawniają występowania szczególnego zagrożenia dla człowieka.
- CHPL leku Amertil Bio, tabletki powlekane, 10 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki: Laktoza jednowodna Celuloza mikrokrystaliczna Skrobia żelowana Krospowidon (typ A) Magnezu stearynian Skład otoczki: Hypromeloza Tytanu dwutlenek (E 171) Makrogol 400 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem i wilgocią. 6.5 Rodzaj i zawartość opakowania Blistry PVC/PVDC/Aluminium w tekturowym pudełku. Wielkość opakowania: 7 tabletek powlekanych 10 tabletek powlekanych 20 tabletek powlekanych Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO ALLERTEC, 10 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg Cetirizini dihydrochloridum (cetyryzyny dichlorowodorku); jedna kropla roztworu zawiera 0,5 mg cetyryzyny dichlorowodorku. Substancje pomocnicze o znanym działaniu: metylu parahydroksybenzoesan (E218), propylu parahydroksybenzoesan (E216), glikol propylenowy i sód. Jeden ml roztworu zawiera 0,333 mg metylu parahydroksybenzoesanu (E218). Jeden ml roztworu zawiera 0,167 mg propylu parahydroksybenzoesanu (E216). Jeden ml roztworu zawiera 350 mg glikolu propylenowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krople doustne, roztwór. Bezbarwny lub prawie bezbarwny, przezroczysty płyn.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania U dorosłych i dzieci w wieku 2 lat i powyżej: Cetyryzyna jest wskazana w łagodzeniu objawów dotyczących nosa i oczu, związanych z sezonowym i przewlekłym alergicznym zapaleniem błony śluzowej nosa. Cetyryzyna jest wskazana w łagodzeniu objawów przewlekłej idiopatycznej pokrzywki.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dzieci i młodzież: Dzieci w wieku od 2 lat do 6 lat: 2,5 mg dwa razy na dobę (5 kropli dwa razy na dobę). Dzieci w wieku od 6 lat do 12 lat: 5 mg dwa razy na dobę (10 kropli dwa razy na dobę). Młodzież w wieku powyżej 12 lat: 10 mg raz na dobę (20 kropli raz na dobę). Dorośli: 10 mg raz na dobę (20 kropli raz na dobę). Szczególne grupy pacjentów: Pacjenci w podeszłym wieku: Brak danych wskazujących na konieczność zmniejszenia dawki leku u pacjentów w podeszłym wieku, jeśli czynność nerek jest u nich prawidłowa. Zaburzenia czynności nerek: Brak danych określających stosunek skuteczności do bezpieczeństwa stosowania u pacjentów z zaburzeniami czynności nerek. Ponieważ cetyryzyna jest wydalana głównie przez nerki (patrz punkt 5.2), w przypadku braku możliwości zastosowania alternatywnego leczenia, odstępy pomiędzy poszczególnymi dawkami muszą być ustalone indywidualnie w zależności od czynności nerek.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlDawkowanie
Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. Aby skorzystać z tabeli, należy obliczyć klirens kreatyniny (Clkr) w ml/min. Clkr (ml/min) można obliczyć na podstawie stężenia kreatyniny w surowicy krwi (mg/dl), posługując się następującym wzorem: [140 – wiek (lata)] x masa ciała (kg) Clkr = __________________________________________________ (x 0,85 dla kobiet) 72 x stężenie kreatyniny w surowicy (mg/dl) Modyfikacja dawkowania u dorosłych pacjentów z zaburzeniami czynności nerek Prawidłowa czynność nerek: ≥ 80 - 10 mg raz na dobę Łagodne zaburzenia czynności nerek: 50 do 79 - 10 mg raz na dobę Umiarkowane zaburzenia czynności nerek: 30 do 49 - 5 mg raz na dobę Ciężkie zaburzenia czynności nerek: < 30 - 5 mg co drugi dzień Schyłkowa choroba nerek, pacjenci dializowani: < 10 - stosowanie przeciwwskazane U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy ustalać indywidualnie na podstawie klirensu kreatyniny, wieku oraz masy ciała pacjenta.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlDawkowanie
Zaburzenia czynności wątroby: Nie ma konieczności dostosowania dawki u pacjentów, u których występują wyłącznie zaburzenia czynności wątroby. U pacjentów z zaburzeniami czynności wątroby oraz zaburzeniami czynności nerek zaleca się dostosowanie dawkowania (patrz powyżej: „Zaburzenia czynności nerek”). Sposób podawania: Podanie doustne. Krople należy odmierzyć na łyżkę lub rozcieńczyć w wodzie i przyjąć doustnie. W przypadku przygotowania roztworu należy wziąć pod uwagę fakt, że objętość wody, do której dodaje się krople, powinna być dostosowana do ilości, jaką pacjent (w szczególności dziecko) jest w stanie połknąć. Roztwór należy przyjąć bezpośrednio po przyrządzeniu.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, hydroksyzynę lub pochodne piperazyny. U pacjentów z ciężkimi zaburzeniami czynności nerek z klirensem kreatyniny poniżej 10 ml/min.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stwierdzono istotnych klinicznie interakcji między alkoholem (w stężeniu 0,5 g/l we krwi) a cetyryzyną stosowaną w dawkach terapeutycznych. Jednakże zaleca się zachowanie ostrożności podczas przyjmowania cetyryzyny jednocześnie z alkoholem. Należy zachować ostrożność u pacjentów z czynnikami ryzyka zatrzymania moczu (np. uszkodzenia rdzenia kręgowego, rozrost gruczołu krokowego), ponieważ cetyryzyna może zwiększać ryzyko zatrzymania moczu. Zaleca się ostrożność podczas stosowania u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstąpienie leków przeciwhistaminowych na 3 dni przed wykonaniem testów. W przypadku przerwania stosowania cetyryzyny może wystąpić świąd i (lub) pokrzywka, nawet jeśli objawy te nie występowały przed rozpoczęciem leczenia.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlSpecjalne środki ostrozności
W niektórych przypadkach objawy te mogą być nasilone i może być konieczne wznowienie leczenia. Objawy powinny ustąpić po wznowieniu leczenia. Metylu parahydroksybenzoesan (E218) i propylu parahydroksybenzoesan (E216) mogą powodować reakcje alergiczne (możliwe reakcje typy późnego). Produkt zawiera 350 mg glikolu propylenowego w 1 ml roztworu. Produkt zawiera mniej niż 1 mmol (23 mg) sodu w 1 ml roztworu, to znaczy produkt uznaje się za „wolny od sodu”. Dzieci: Nie zaleca się stosowania tego produktu leczniczego u dzieci w wieku poniżej 2 lat.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Ze względu na właściwości farmakokinetyczne, farmakodynamiczne oraz profil tolerancji cetyryzyny nie są spodziewane interakcje tego produktu leczniczego z innymi lekami. W przeprowadzonych badaniach nie donoszono o występowaniu interakcji farmakodynamicznych ani znaczących interakcji farmakokinetycznych, w szczególności z pseudoefedryną lub teofiliną (400 mg na dobę). Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, natomiast zmniejsza szybkość wchłaniania cetyryzyny. U wrażliwych pacjentów, jednoczesne stosowanie z alkoholem lub lekami o działaniu hamującym na ośrodkowy układ nerwowy, może dodatkowo zmniejszać zdolność reagowania i koncentrację. Cetyryzyna nie nasila jednak działania alkoholu (w stężeniu 0,5 g/l we krwi).
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Prospektywnie zebrane dane dotyczące stosowania cetyryzyny w okresie ciąży nie wskazują na zwiększone działanie toksyczne w stosunku do matki, płodu lub zarodka. Badania przeprowadzone na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy. Należy zachować ostrożność podczas przepisywania cetyryzyny kobietom w ciąży. Karmienie piersi? Cetyryzyna przenika do mleka matki w stężeniach stanowiących 25 do 90% stężenia leku w osoczu w zależności od czasu pobierania próbek po podaniu. Dlatego należy zachować ostrożność podczas przepisywania produktu kobietom karmiącym piersią. Płodność Dane dotyczące wpływu na płodność u ludzi są ograniczone, nie stwierdzono jednak zagrożenia dla bezpieczeństwa. Badania na zwierzętach nie wykazały zagrożenia dla bezpieczeństwa płodności u ludzi.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Obiektywne badania z zastosowaniem cetyryzyny w zalecanej dawce 10 mg nie wykazały istotnego klinicznie wpływu na zdolność prowadzenia pojazdów, odczuwanie senności oraz sprawność psychofizyczną. Pacjenci, u których wystąpiła senność, powinni jednak unikać prowadzenia pojazdów, wykonywania potencjalnie niebezpiecznych czynności oraz obsługiwania maszyn. Pacjenci powinni zwrócić uwagę na reakcję organizmu na lek oraz nie powinni stosować dawek większych niż zalecane.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne - Podsumowanie W badaniach klinicznych wykazano, że cetyryzyna podawana w zalecanych dawkach wywołuje działania niepożądane ze strony ośrodkowego układu nerwowego o nieznacznym nasileniu, w tym senność, zmęczenie, bóle i zawroty głowy. W niektórych przypadkach obserwowano paradoksalne pobudzenie ośrodkowego układu nerwowego. Mimo, iż cetyryzyna jest selektywnym antagonistą obwodowych receptorów H1 i jest praktycznie pozbawiona aktywności cholinolitycznej, zgłaszano pojedyncze przypadki trudności w oddawaniu moczu, zaburzeń akomodacji oka oraz suchości błony śluzowej jamy ustnej. Zgłaszano przypadki zaburzeń czynności wątroby ze zwiększoną aktywnością enzymów wątrobowych i ze zwiększonym stężeniem bilirubiny. W większości przypadków ustępowały one po przerwaniu przyjmowania cetyryzyny dichlorowodorku.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlDziałania niepożądane
Zestawienie działań niepożądanych Dostępne są ilościowe dane dotyczące bezpieczeństwa z badań klinicznych prowadzonych metodą podwójnie ślepej próby, porównujących cetyryzynę z placebo oraz innymi lekami przeciwhistaminowymi stosowanymi w zalecanych dawkach (10 mg na dobę dla cetyryzyny). W badaniach uczestniczyło ponad 3200 pacjentów leczonych cetyryzyną. W badaniach kontrolowanych placebo, z zastosowaniem cetyryzyny w dawce 10 mg obserwowano następujące działania niepożądane, występujące z częstotliwością 1% lub większą: Zaburzenia ogólne i stany w miejscu podania: Zmęczenie - 1,63% (Placebo - 0,95%) Zaburzenia układu nerwowego: Zawroty głowy - 1,10% (Placebo - 0,98%), Ból głowy - 7,42% (Placebo - 8,07%) Zaburzenia żołądka i jelit: Ból brzucha - 0,98% (Placebo - 1,08%), Suchość błony śluzowej jamy ustnej - 2,09% (Placebo - 0,82%), Nudności - 1,07% (Placebo - 1,14%) Zaburzenia psychiczne: Senność - 9,63% (Placebo - 5,00%) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Zapalenie gardła - 1,29% (Placebo - 1,34%) Mimo, iż senność występowała statystycznie częściej w grupie otrzymującej cetyryzynę niż w grupie otrzymującej placebo, w większości przypadków miała ona nasilenie łagodne do umiarkowanego.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlDziałania niepożądane
Inne, obiektywne badania nie wykazały wpływu cetyryzyny w zalecanych dawkach dobowych na aktywność młodych, zdrowych ochotników. Dzieci i młodzież Działania niepożądane występujące z częstością 1% lub większą u dzieci w wieku od 6 miesięcy do 12 lat, pochodzące z badań klinicznych lub farmakoklinicznych kontrolowanych placebo to: Zaburzenia żołądka i jelit: Biegunka - 1,0% (Placebo - 0,6%) Zaburzenia psychiczne: Senność - 1,8% (Placebo - 1,4%) Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Zapalenie błony śluzowej nosa - 1,4% (Placebo - 1,1%) Zaburzenia ogólne i stany w miejscu podania: Zmęczenie - 1,0% (Placebo - 0,3%) Dane pochodzące z okresu po wprowadzeniu cetyryzyny do obrotu. Oprócz wymienionych powyżej działań niepożądanych występujących podczas badań klinicznych, zgłaszano następujące działania niepożądane po wprowadzeniu cetyryzyny do obrotu.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlDziałania niepożądane
Działania niepożądane opisano według klasyfikacji układów i narządów MedDRA, a częstość występowania określono na podstawie obserwacji z okresu po wprowadzeniu leku do obrotu. Częstość występowania określono w następujący sposób: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia krwi i układu chłonnego: Bardzo rzadko: trombocytopenia Zaburzenia układu immunologicznego: Rzadko: reakcje nadwrażliwości, Bardzo rzadko: wstrząs anafilaktyczny Zaburzenia metabolizmu i odżywiania: Częstość nieznana: zwiększenie apetytu Zaburzenia psychiczne: Niezbyt często: pobudzenie, Rzadko: zachowanie agresywne, splątanie, depresja, omamy, bezsenność, Bardzo rzadko: tiki, Częstość nieznana: myśli samobójcze, koszmary senne Zaburzenia układu nerwowego: Niezbyt często: parestezja, Rzadko: drgawki, Bardzo rzadko: zaburzenia smaku, omdlenie, drżenie, dystonia, dyskineza, Częstość nieznana: amnezja, zaburzenia pamięci Zaburzenia oka: Bardzo rzadko: zaburzenia akomodacji, niewyraźne widzenie, rotacja gałek ocznych Zaburzenia ucha i błędnika: Częstość nieznana: zawroty głowy Zaburzenia serca: Rzadko: tachykardia Zaburzenia żołądka i jelit: Niezbyt często: biegunka Zaburzenia wątroby i dróg żółciowych: Rzadko: nieprawidłowa czynność wątroby (zwiększona aktywność aminotransferaz, fosfatazy alkalicznej, γ-GT i zwiększone stężenie bilirubiny), Częstość nieznana: zapalenie wątroby Zaburzenia skóry i tkanki podskórnej: Niezbyt często: świąd, wysypka, Rzadko: pokrzywka, Bardzo rzadko: obrzęk naczynioruchowy, wysypka polekowa, Częstość nieznana: ostra uogólniona osutka krostkowa Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Częstość nieznana: bóle stawów Zaburzenia nerek i dróg moczowych: Bardzo rzadko: bolesne lub utrudnione oddawanie moczu, mimowolne oddawanie moczu, Częstość nieznana: zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania: Niezbyt często: osłabienie, złe samopoczucie, Rzadko: obrzęki Badania diagnostyczne: Rzadko: zwiększenie masy ciała Opis wybranych działań niepożądanych Zgłaszano przypadki świądu (intensywnego swędzenia) i (lub) pokrzywki po przerwaniu stosowania cetyryzyny.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy przedawkowania Objawy obserwowane po przedawkowaniu cetyryzyny związane są przede wszystkim z działaniem na ośrodkowy układ nerwowy, mogą wskazywać także na działanie przeciwcholinergiczne. Po przyjęciu dawki cetyryzyny co najmniej 5 razy większej od zalecanej dawki dobowej zgłaszano następujące działania niepożądane: splątanie, biegunkę, zawroty głowy, zmęczenie, bóle głowy, złe samopoczucie, rozszerzenie źrenic, świąd, niepokój zwłaszcza ruchowy, sedację, senność, osłupienie, tachykardię, drżenie, zatrzymanie moczu. Postępowanie po przedawkowaniu Specyficzne antidotum nie jest znane. W razie przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Jeżeli od zażycia zbyt dużej dawki produktu nie minęło zbyt wiele czasu, należy rozważyć wykonanie płukania żołądka. Cetyryzyna nie jest skutecznie usuwana metodą hemodializy.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny, kod ATC: R06AE07 Mechanizm działania Cetyryzyna, metabolit hydroksyzyny u człowieka, jest silnym i selektywnym antagonistą obwodowych receptorów histaminowych H1. Badania wiązania z receptorem in vitro nie wykazały istotnego powinowactwa do innych receptorów niż H1. Działanie farmakodynamiczne Oprócz działania antagonistycznego w stosunku do receptorów H1, cetyryzyna wykazuje działanie przeciwalergiczne: u pacjentów z nadwrażliwością (atopią) poddawanych prowokacji alergenem, dawka 10 mg podawana raz lub dwa razy na dobę, hamuje napływ komórek późnej fazy reakcji zapalnej, eozynofili, do skóry i spojówek. Skuteczność kliniczna i bezpieczeństwo stosowania Badania u zdrowych ochotników wykazały, że cetyryzyna w dawkach 5 i 10 mg silnie hamuje reakcję prowadzącą do powstawania bąbli pokrzywkowych i zaczerwienienia, wywołaną śródskórnym podawaniem histaminy w bardzo dużych stężeniach, ale nie ustalono związku tego działania ze skutecznością.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakodynamiczne
W sześciotygodniowym, kontrolowanym placebo badaniu z udziałem 186 pacjentów z alergicznym zapaleniem błony śluzowej nosa oraz współistniejącą, łagodną lub umiarkowaną astmą, cetyryzyna stosowana w dawce 10 mg raz na dobę łagodziła objawy zapalenia błony śluzowej nosa i nie wpływała na czynność płuc. Badanie to potwierdza bezpieczeństwo stosowania cetyryzyny u pacjentów z alergią i z łagodną lub umiarkowaną astmą. W badaniu kontrolowanym placebo cetyryzyna podawana w dużej dawce dobowej wynoszącej 60 mg przez siedem dni nie powodowała statystycznie znamiennego wydłużenia odstępu QT. Stosowanie cetyryzyny w zalecanych dawkach poprawia jakość życia pacjentów z przewlekłym i sezonowym alergicznym zapaleniem błony śluzowej nosa. Dzieci i młodzież W trwającym 35 dni badaniu, przeprowadzonym u dzieci w wieku od 5 do 12 lat nie stwierdzono tolerancji na przeciwhistaminowe działanie cetyryzyny (hamowanie powstawania bąbli pokrzywkowych i zaczerwienienia).
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakodynamiczne
Po przerwaniu leczenia cetyryzyną podawaną wielokrotnie, skóra odzyskuje normalną reaktywność na histaminę w ciągu 3 dni.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Maksymalne stężenie w osoczu w stanie stacjonarnym wynosi około 300 ng/ml i występuje w ciągu 1,0 ± 0,5 h. Rozkład parametrów farmakokinetycznych, takich jak stężenie maksymalne (Cmax) i pole pod krzywą (AUC), jest jednoznacznie zdefiniowany. Pokarm nie zmniejsza stopnia wchłaniania cetyryzyny, lecz zmniejsza szybkość wchłaniania cetyryzyny. W przypadku podawania cetyryzyny w postaci roztworu, kapsułek i tabletek, biodostępność jest podobna. Dystrybucja Pozorna objętość dystrybucji wynosi 0,50 l/kg. Cetyryzyna wiąże się z białkami osocza w 93 ± 0,3%. Cetyryzyna nie wpływa na stopień wiązania warfaryny z białkami. Metabolizm Cetyryzyna nie podlega w znaczącym stopniu metabolizmowi pierwszego przejścia. Eliminacja Końcowy okres półtrwania wynosi około 10 godzin. Nie zaobserwowano kumulacji cetyryzyny podczas stosowania dawek dobowych 10 mg przez 10 dni. Około dwie trzecie dawki jest wydalane w postaci niezmienionej z moczem.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakokinetyczne
Liniowość lub nieliniowość Cetyryzyna wykazuje liniową kinetykę w zakresie dawek od 5 do 60 mg. Szczególne grupy pacjentów Zaburzenia czynności nerek Farmakokinetyka leku u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny powyżej 40 ml/min) oraz u zdrowych ochotników była podobna. U pacjentów z umiarkowanymi zaburzeniami czynności nerek okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u zdrowych ochotników. U pacjentów poddawanych hemodializie (klirens kreatyniny mniejszy niż 7 ml/min), którym podano doustnie cetyryzynę w pojedynczej dawce 10 mg, okres półtrwania był 3 razy dłuższy, a klirens o 70% mniejszy niż u osób zdrowych. Podczas hemodializy cetyryzyna była usuwana z osocza w niewielkim stopniu. Konieczna jest modyfikacja dawkowania u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2.).
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakokinetyczne
Zaburzenia czynności wątroby U pacjentów z przewlekłymi chorobami wątroby (marskość żółciowa, choroby dotyczące miąższu wątroby, choroby związane z zastojem żółci), którym podano 10 lub 20 mg cetyryzyny w pojedynczej dawce, okres półtrwania wydłużył się o 50%, a klirens zmniejszył o 40% w porównaniu do osób zdrowych. Modyfikacja dawkowania jest konieczna tylko u tych pacjentów z zaburzeniami czynności wątroby, u których jednocześnie występują zaburzenia czynności nerek. Pacjenci w podeszłym wieku U 16 pacjentów w podeszłym wieku po podaniu doustnie pojedynczej dawki 10 mg okres półtrwania wydłużył się o około 50%, a klirens zmniejszył się o 40% w porównaniu z pozostałymi, młodszymi pacjentami. Wydaje się, że zmniejszenie klirensu cetyryzyny u ochotników w podeszłym wieku jest związane z występującym w tej grupie osłabieniem czynności nerek.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlWłaściwości farmakokinetyczne
Dzieci i niemowlęta U dzieci w wieku od 6 do 12 lat okres półtrwania cetyryzyny wynosi około 6 godzin, a u dzieci w wieku 2 do 6 lat wynosi 5 godzin. U niemowląt i dzieci w wieku od 6 do 24 miesięcy okres półtrwania jest zmniejszony do 3,1 godziny.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne dotyczące cetyryzyny, uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozrodczość, nie ujawniają występowania szczególnego zagrożenia dla człowieka.
- CHPL leku Allertec, krople doustne, roztwór, 10 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Glicerol Glikol propylenowy Sacharyna sodowa (E954) Metylu parahydroksybenzoesan (E218) Propylu parahydroksybenzoesan (E216) Sodu octan trójwodny Kwas octowy lodowaty Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata Okres ważności produktu po pierwszym otwarciu butelki wynosi 3 miesiące. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Chronić od światła. 6.5 Rodzaj i zawartość opakowania Butelka szklana o pojemności 10 lub 20 ml, z kroplomierzem PE i zakrętką gwarancyjną, zawierająca 10 ml lub 20 ml roztworu, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Xyzal, tabletki powlekane, 5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Xyzal, 5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 5 mg lewocetyryzyny dichlorowodorku (Levocetirizini dihydrochloridum). Substancja pomocnicza o znanym działaniu: każda tabletka zawiera 63,50 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana. Białe lub prawie białe, owalne tabletki powlekane z logo Y na jednej stronie.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWskazania do stosowania
4.1 Wskazania do stosowania Xyzal, 5 mg, tabletki powlekane jest wskazany w objawowym leczeniu alergicznego zapalenia błony śluzowej nosa (w tym przewlekłego alergicznego zapalenia błony śluzowej nosa) i pokrzywki u dorosłych i dzieci w wieku od 6 lat.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i młodzież w wieku 12 lat i powyżej: Zalecana dawka dobowa wynosi 5 mg (1 tabletka powlekana). Osoby w podeszłym wieku: U pacjentów w podeszłym wieku z umiarkowanymi do ciężkich zaburzeniami czynności nerek zaleca się dostosowanie dawki (patrz punkt poniżej „Zaburzenia czynności nerek”). Zaburzenia czynności nerek: Odstępy pomiędzy kolejnymi dawkami muszą być ustalone indywidualnie w zależności od stopnia wydolności nerek [szacowany współczynnik filtracji kłębuszkowej, (ang. estimated Glomerular Filtration Rate, eGFR)]. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. Dostosowanie dawki u pacjentów z zaburzeniami czynności nerek: Grupa eGFR (ml/min) Dawka i częstość podawania Prawidłowa czynność nerek ≥ 90 1 tabletka raz na dobę Łagodne zaburzenia czynności nerek 60 – < 90 1 tabletka raz na dobę Umiarkowane zaburzenia czynności nerek 30 – < 60 1 tabletka co drugi dzień Ciężkie zaburzenia czynności nerek 15 – < 30 (pacjent nie wymagający dializy) 1 tabletka co trzeci dzień Schyłkowa niewydolność nerek (ang.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDawkowanie
End Stage Renal Disease, ESRD) < 15 (pacjent wymagający dializy) Lek przeciwwskazany U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy dostosować indywidualnie po uwzględnieniu klirensu nerkowego i masy ciała pacjenta. Brak szczegółowych danych dotyczących stosowania leku u dzieci z zaburzeniami czynności nerek. Zaburzenia czynności wątroby: Nie jest konieczne dostosowanie dawki u pacjentów z zaburzeniami czynności wątroby. U pacjentów z zaburzeniami czynności wątroby oraz nerek zaleca się dostosowanie dawki (patrz powyżej „Zaburzenia czynności nerek”). Dzieci i młodzież: Dzieci w wieku od 6 do 12 lat: Zalecana dawka dobowa wynosi 5 mg (1 tabletka powlekana). U dzieci w wieku od 2 do 6 lat nie jest możliwe dostosowanie dawki produktu w postaci tabletek powlekanych. Zaleca się stosowanie produktów lewocetyryzyny w postaciach farmaceutycznych przeznaczonych dla dzieci.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDawkowanie
Sposób podawania Tabletkę powlekaną należy przyjmować doustnie, połykając w całości i popijając płynem. Tabletkę można przyjmować z posiłkiem lub niezależnie od posiłku. Zaleca się przyjmowanie dawki raz na dobę. Czas trwania leczenia: Okresowe alergiczne zapalenie błony śluzowej nosa (objawy występujące rzadziej niż cztery dni w tygodniu lub utrzymujące się krócej niż cztery tygodnie w ciągu roku) należy leczyć zgodnie z przebiegiem choroby; leczenie można przerwać od razu po ustąpieniu objawów i wznowić po ponownym ich wystąpieniu. W przypadku przewlekłego alergicznego zapalenia błony śluzowej nosa (objawy występujące częściej niż cztery dni w tygodniu lub utrzymujące się dłużej niż cztery tygodnie w roku) można zalecić pacjentowi kontynuowanie leczenia w okresie ekspozycji na alergeny. Doświadczenie kliniczne dotyczące stosowania lewocetyryzyny obejmuje co najmniej 6-miesięczny okres leczenia.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDawkowanie
Doświadczenie kliniczne z zastosowaniem cetyryzyny (racemat) w leczeniu przewlekłej pokrzywki i przewlekłego alergicznego zapalenia błony śluzowej nosa obejmuje okres do 1 roku.
- CHPL leku Xyzal, tabletki powlekane, 5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, cetyryzynę, hydroksyzynę, jakiekolwiek inne pochodne piperazyny lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Pacjenci ze schyłkową niewydolnością nerek z szacowanym współczynnikiem przesączania kłębuszkowego (eGFR) poniżej 15 ml/min (wymagający dializy).
- CHPL leku Xyzal, tabletki powlekane, 5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy zachować ostrożność podczas przyjmowania leku jednocześnie z alkoholem (patrz punkt 4.5). Należy zachować ostrożność u pacjentów z ryzykiem zatrzymania moczu (np.: uszkodzenie rdzenia kręgowego, rozrost gruczołu krokowego), ponieważ lewocetyryzyna może zwiększać ryzyko zatrzymania moczu. Lewocetyryzyna może powodować nasilenie napadów padaczkowych, z tego względu należy zachować ostrożność u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstąpienie leków przeciwhistaminowych na 3 dni przed wykonaniem testów. Produkt nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy.
- CHPL leku Xyzal, tabletki powlekane, 5 mgSpecjalne środki ostrozności
W przypadku przerwania stosowania lewocetyryzyny możliwe jest wystąpienie świądu, nawet jeśli objawy te nie występowały przed rozpoczęciem leczenia. Te objawy mogą ustąpić samoistnie. W niektórych przypadkach objawy mogą być intensywne i może być konieczne wznowienie leczenia. Objawy powinny ustąpić po wznowieniu leczenia. Dzieci i młodzież: Nie zaleca się podawania produktu w postaci tabletek powlekanych dzieciom w wieku poniżej 6 lat, ponieważ nie jest możliwe odpowiednie dostosowanie dawki w przypadku tej postaci produktu. Zaleca się stosowanie produktów lewocetyryzyny w postaciach farmaceutycznych przeznaczonych dla dzieci.
- CHPL leku Xyzal, tabletki powlekane, 5 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji lewocetyryzyny (w tym badań z induktorami CYP3A4); badania z zastosowaniem cetyryzyny (racematu) nie wykazały istotnych klinicznie niepożądanych interakcji (z antypiryną, azytromycyną, cymetydyną, diazepamem, erytromycyną, glipizydem, ketokonazolem i pseudoefedryną). W badaniu, w którym cetyryzynę podawano wielokrotnie z teofiliną (400 mg raz na dobę), zaobserwowano niewielkie zmniejszenie klirensu cetyryzyny (16%); natomiast jednoczesne podawanie cetyryzyny nie wpływało na ekspozycję na teofilinę. W badaniu po podaniu wielokrotnym rytonawiru (600 mg dwa razy na dobę) i cetyryzyny (10 mg na dobę), ekspozycja na cetyryzynę zwiększyła się o około 40%, podczas gdy ekspozycja na rytonawir podczas jednoczesnego podawania cetyryzyny zmieniła się nieznacznie (-11%).
- CHPL leku Xyzal, tabletki powlekane, 5 mgInterakcje
Podawanie z pokarmem nie zmniejsza stopnia wchłaniania lewocetyryzyny, natomiast zmniejsza szybkość jej wchłaniania. U wrażliwych pacjentów jednoczesne podawanie cetyryzyny lub lewocetyryzyny z alkoholem lub innymi substancjami hamującymi czynność OUN może spowodować dodatkowe obniżenie czujności i zdolności reagowania.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych lub istnieją ograniczone dane (mniej niż 300 ciąż) dotyczące stosowania lewocetyryzyny u kobiet w ciąży. Jednak dane otrzymane z dużej liczby zastosowań cetyryzyny (racemat) u kobiet w ciąży (ponad 1000 ciąż) nie wskazują, aby wywoływała ona wady rozwojowe lub działała toksycznie na płód i noworodka. Badania na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3). Można rozważyć zastosowanie lewocetyryzyny w okresie ciąży, jeżeli jest to konieczne. Karmienie piersi? Wykazano, że cetyryzyna (racemat) przenika do mleka u ludzi. Dlatego też jest prawdopodobne, że lewocetyryzyna przenika do mleka u ludzi. U niemowląt karmionych piersią mogą wystąpić działania niepożądane związane z lewocetyryzyną. Dlatego należy zachować ostrożność, przepisując lewocetyryzynę kobietom karmiącym piersią.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWpływ na płodność, ciążę i laktację
Płodność Brak danych klinicznych dotyczących lewocetyryzyny.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn W porównawczych badaniach klinicznych nie wykazano, aby lewocetyryzyna w zalecanej dawce osłabiała koncentrację uwagi, zdolność reagowania lub zdolność prowadzenia pojazdów lub obsługi maszyn. Jednakże niektórzy pacjenci mogą odczuwać senność, zmęczenie i osłabienie podczas leczenia lewocetyryzyną. Dlatego pacjenci zamierzający prowadzić pojazdy, wykonywać potencjalnie niebezpieczne czynności lub obsługiwać maszyny, powinni wziąć pod uwagę swoją reakcję na produkt leczniczy.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne Dorośli i młodzież w wieku powyżej 12 lat: W badaniach klinicznych z udziałem kobiet i mężczyzn w wieku od 12 do 71 lat wystąpiło co najmniej jedno działanie niepożądane u 15,1% pacjentów w grupie otrzymującej lewocetyryzynę w dawce 5 mg, w porównaniu z 11,3% pacjentów z grupy otrzymującej placebo. 91,6% tych działań niepożądanych miało nasilenie łagodne lub umiarkowane. W badaniach klinicznych odsetek pacjentów, którzy nie ukończyli badania z powodu zdarzeń niepożądanych, wynosił 1% (9/935) w grupie otrzymującej lewocetyryzynę w dawce 5 mg i 1,8% (14/771) w grupie otrzymującej placebo. W badaniach klinicznych z zastosowaniem lewocetyryzyny uczestniczyło 935 osób, którym podawano produkt leczniczy w zalecanej dawce 5 mg na dobę. W tej grupie zgłaszano następujące działania niepożądane występujące z częstością 1% lub większą (często: ≥1/100 do <1/10) po zastosowaniu lewocetyryzyny w dawce 5 mg lub placebo: Ból głowy: Placebo (n=771) 25 (3,2%), Lewocetyryzyna 5 mg (n=935) 24 (2,6%) Senność: Placebo (n=771) 11 (1,4%), Lewocetyryzyna 5 mg (n=935) 49 (5,2%) Suchość w jamie ustnej: Placebo (n=771) 12 (1,6%), Lewocetyryzyna 5 mg (n=935) 24 (2,6%) Zmęczenie: Placebo (n=771) 9 (1,2%), Lewocetyryzyna 5 mg (n=935) 23 (2,5%) Obserwowano także działania niepożądane występujące niezbyt często (niezbyt często ≥1/1000 do <1/100), takie jak osłabienie lub bóle brzucha.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDziałania niepożądane
Przypadki sedatywnych działań niepożądanych, takich jak: senność, zmęczenie i osłabienie, występowały częściej po podaniu lewocetyryzyny w dawce 5 mg (8,1%) niż po podaniu placebo (3,1%). Dzieci i młodzież W dwóch badaniach kontrolowanych placebo z udziałem dzieci w wieku od 6 do 11 miesięcy oraz dzieci w wieku od 1 do poniżej 6 lat, 159 pacjentom podawano lewocetyryzynę w dawce odpowiednio 1,25 mg na dobę przez 2 tygodnie oraz 1,25 mg dwa razy na dobę. Poniżej przedstawiono działania niepożądane zgłaszane po podaniu lewocetyryzyny lub placebo, występujące z częstością 1% lub większą. Biegunka: Placebo (n=83) 0, Lewocetyryzyna (n=159) 3 (1,9%) Wymioty: Placebo (n=83) 1 (1,2%), Lewocetyryzyna (n=159) 1 (0,6%) Zaparcia: Placebo (n=83) 0, Lewocetyryzyna (n=159) 2 (1,3%) Senność: Placebo (n=83) 2 (2,4%), Lewocetyryzyna (n=159) 3 (1,9%) Zaburzenia snu: Placebo (n=83) 0, Lewocetyryzyna (n=159) 2 (1,3%) W badaniach klinicznych z grupą kontrolną placebo, prowadzonych metodą podwójnie ślepej próby z udziałem dzieci w wieku od 6 do 12 lat, 243 dzieciom podawano lewocetyryzynę w dawce 5 mg na dobę przez różny okres – od krótszego niż 1 tydzień do 13 tygodni.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDziałania niepożądane
Poniżej przedstawiono działania niepożądane zgłaszane po podaniu lewocetyryzyny lub placebo, występujące z częstością 1% lub większą. Ból głowy: Placebo (n=240) 5 (2,1%), Lewocetyryzyna 5 mg (n=243) 2 (0,8%) Senność: Placebo (n=240) 1 (0,4%), Lewocetyryzyna 5 mg (n=243) 7 (2,9%) Okres po wprowadzeniu produktu do obrotu Działania niepożądane obserwowane po wprowadzeniu do obrotu przedstawiono według klasyfikacji układów i narządów oraz częstości występowania. Częstość występowania zdefiniowano w następujący sposób: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia układu immunologicznego: Częstość nieznana: nadwrażliwość, w tym anafilaksja. Zaburzenia metabolizmu i odżywiania: Częstość nieznana: zwiększone łaknienie.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDziałania niepożądane
Zaburzenia psychiczne: Częstość nieznana: agresja, pobudzenie, omamy, depresja, bezsenność, myśli samobójcze, koszmary senne. Zaburzenia układu nerwowego: Częstość nieznana: drgawki, parestezja, zawroty głowy (pochodzenia ośrodkowego), omdlenia, drżenie, zaburzenia smaku. Zaburzenia ucha i błędnika: Częstość nieznana: zawroty głowy (pochodzenia błędnikowego). Zaburzenia oka: Częstość nieznana: zaburzenia widzenia, niewyraźne widzenie, rotacyjne ruchy gałek ocznych. Zaburzenia serca: Częstość nieznana: kołatanie serca, tachykardia. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Częstość nieznana: duszność. Zaburzenia żołądka i jelit: Częstość nieznana: nudności, wymioty, biegunka. Zaburzenia wątroby i dróg żółciowych: Częstość nieznana: zapalenie wątroby. Zaburzenia nerek i dróg moczowych: Częstość nieznana: bolesne lub utrudnione oddawanie moczu, zatrzymanie moczu.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDziałania niepożądane
Zaburzenia skóry i tkanki podskórnej: Częstość nieznana: obrzęk naczynioruchowy, trwały wyprysk polekowy, świąd, wysypka, pokrzywka. Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Częstość nieznana: bóle mięśni, ból stawów. Zaburzenia ogólne i stany w miejscu podania: Częstość nieznana: obrzęk. Badania diagnostyczne: Częstość nieznana: zwiększenie masy ciała, nieprawidłowe wyniki testów czynności wątroby. Opis wybranych działań niepożądanych Zgłaszano przypadki świądu po przerwaniu stosowania lewocetyryzyny. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDziałania niepożądane
Jerozolimskie 181C, 02-222 Warszawa, tel: + 48 22 49 21 301, fax: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Xyzal, tabletki powlekane, 5 mgPrzedawkowanie
4.9 Przedawkowanie Objawy Objawy przedawkowania mogą obejmować senność u osób dorosłych. U dzieci może wystąpić początkowo pobudzenie i niepokój, zwłaszcza ruchowy, a następnie senność. Postępowanie w przypadku przedawkowania Nie jest znane specyficzne antidotum dla lewocetyryzyny. W przypadku przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Jeśli od przyjęcia produktu leczniczego upłynęło niewiele czasu, można rozważyć płukanie żołądka. Lewocetyryzyna nie jest skutecznie usuwana za pomocą hemodializy.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny; kod ATC: R06A E09. Mechanizm działania Lewocetyryzyna, (R)-enancjomer cetyryzyny jest silnym i wybiórczym antagonistą obwodowych receptorów histaminowych H1. Badania dotyczące wiązania z receptorami wykazały, że lewocetyryzyna ma duże powinowactwo do receptorów H1 u ludzi (Ki = 3,2 nmol/l). Lewocetyryzyna ma dwukrotnie większe powinowactwo niż cetyryzyna (Ki = 6,3 nmol/l). Okres półtrwania procesu odłączania lewocetyryzyny od receptorów H1 wynosi 115 ± 38 min. Po 4 godzinach od jednorazowego podania stwierdzono zablokowanie receptorów przez lewocetyryzynę w 90%, a po 24 godzinach w 57%. Badania farmakodynamiczne z udziałem zdrowych ochotników wykazały, że działanie dawki lewocetyryzyny równej połowie dawki cetyryzyny jest porównywalne do działania cetyryzyny, zarówno na skórę, jak i na błonę śluzową nosa.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
Działanie farmakodynamiczne Działanie farmakodynamiczne lewocetyryzyny oceniano w randomizowanych badaniach przeprowadzonych z grupą kontrolną. W badaniu porównującym wpływ stosowania lewocetyryzyny w dawce 5 mg, desloratadyny w dawce 5 mg i placebo na pohistaminowy bąbel i rumień, leczenie lewocetyryzyną powodowało istotne hamowanie powstawania bąbla i rumienia – działanie to było najsilniejsze w ciągu pierwszych 12 godzin i utrzymywało się przez 24 godziny, (p<0,001) w porównaniu z placebo i desloratadyną. W badaniach klinicznych z grupą kontrolną placebo, w modelu z użyciem komory prowokacyjnej początek działania lewocetyryzyny w dawce 5 mg w łagodzeniu objawów wywołanych ekspozycją na pyłki obserwowano po 1 godzinie od przyjęcia leku. Badania in vitro (komory Boydena i linie komórkowe) wykazały, że lewocetyryzyna hamuje indukowaną przez eotaksynę przezśródbłonkową migrację eozynofilów przez komórki skóry i płuc.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
W eksperymentalnym badaniu farmakodynamicznym in vivo (technika okienek skórnych) u 14 dorosłych pacjentów, w porównaniu z placebo, wykazano trzy główne działania hamujące lewocetyryzyny w dawce 5 mg w ciągu pierwszych 6 godzin reakcji wywołanej pyłkami: hamowanie uwalniania VCAM-1, zmianę przepuszczalności naczyń i zmniejszenie napływu eozynofilów. Skuteczność kliniczna i bezpieczeństwo stosowania Skuteczność i bezpieczeństwo stosowania lewocetyryzyny wykazano w kilku badaniach klinicznych przeprowadzonych z grupą kontrolną placebo, metodą podwójnie ślepej próby, z udziałem dorosłych pacjentów z sezonowym alergicznym zapaleniem błony śluzowej nosa, całorocznym alergicznym zapaleniem błony śluzowej nosa lub przewlekłym alergicznym zapaleniem błony śluzowej nosa. W niektórych badaniach wykazano, że lewocetyryzyna w istotnym stopniu łagodzi objawy alergicznego zapalenia błony śluzowej nosa, w tym uczucie zatkania nosa.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
W trwającym 6 miesięcy badaniu klinicznym z udziałem 551 dorosłych pacjentów (w tym 276 pacjentów leczonych lewocetyryzyną) z przewlekłym alergicznym zapaleniem błony śluzowej nosa (objawy występowały przez 4 dni w tygodniu, przez co najmniej 4 kolejne tygodnie) i uczulonych na roztocza kurzu domowego i pyłki traw wykazano, że lewocetyryzyna w dawce 5 mg była klinicznie i statystycznie istotnie bardziej skuteczna niż placebo w łagodzeniu objawów alergicznego zapalenia błony śluzowej nosa ocenianych w skali TSS (punktowy wskaźnik nasilenia objawów klinicznych, ang. total symptom score - TSS) przez cały czas trwania badania; nie występowało zjawisko tachyfilaksji. Przez cały czas trwania badania lewocetyryzyna istotnie poprawiała jakość życia pacjentów. W badaniu klinicznym z grupą kontrolną placebo, w którym uczestniczyło 166 pacjentów z przewlekłą pokrzywką idiopatyczną, 85 pacjentów przyjmowało placebo, a 81 lewocetyryzynę w dawce 5 mg raz na dobę przez 6 tygodni.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
Leczenie lewocetyryzyną w porównaniu z placebo powodowało istotne zmniejszenie nasilenia świądu w pierwszym tygodniu oraz w całym okresie leczenia. Stosowanie lewocetyryzyny w porównaniu z placebo powodowało także większą poprawę zależnej od stanu zdrowia jakości życia pacjentów, ocenianej na podstawie wskaźnika wpływu dolegliwości skórnych na jakość życia (ang. Dermatology Life Quality Index). Przewlekła idiopatyczna pokrzywka była badana jako model zaburzeń pokrzywkowych. Ponieważ uwalnianie histaminy jest czynnikiem związanym z występowaniem pokrzywki można oczekiwać, że lewocetyryzyna będzie skuteczna w łagodzeniu objawów innych rodzajów pokrzywek, nie tylko przewlekłej idiopatycznej pokrzywki. W zapisach EKG nie wykazano znaczącego wpływu lewocetyryzyny na odstęp QT. Dzieci i młodzież Bezpieczeństwo stosowania i skuteczność lewocetyryzyny w postaci tabletek u dzieci oceniano w dwóch badaniach klinicznych z grupą kontrolną placebo, w których uczestniczyli pacjenci w wieku od 6 do 12 lat z sezonowym i całorocznym alergicznym zapaleniem błony śluzowej nosa.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
W obydwu badaniach lewocetyryzyna znacząco łagodziła objawy i poprawiała zależną od stanu zdrowia jakość życia pacjentów. Bezpieczeństwo kliniczne u dzieci w wieku poniżej 6 lat ustalono na podstawie kilku krótko- i długoterminowych badań klinicznych: badanie kliniczne, w którym 29 dzieci w wieku od 2 do 6 lat z alergicznym zapaleniem błony śluzowej nosa leczono lewocetyryzyną w dawce 1,25 mg podawaną dwa razy na dobę przez 4 tygodnie badanie kliniczne, w którym 114 dzieci w wieku od 1 roku do 5 lat z alergicznym zapaleniem błony śluzowej nosa lub przewlekłą pokrzywką idiopatyczną leczono lewocetyryzyną w dawce 1,25 mg podawaną dwa razy na dobę przez 2 tygodnie badanie kliniczne, w którym 45 dzieci w wieku od 6 do 11 miesięcy z alergicznym zapaleniem błony śluzowej nosa lub przewlekłą pokrzywką idiopatyczną leczono lewocetyryzyną w dawce 1,25 mg podawaną raz na dobę przez 2 tygodnie długoterminowe (18-miesięczne) badanie kliniczne z udziałem 255 pacjentów z chorobą atopową leczonych lewocetyryzyną, będących w wieku od 12 do 24 miesięcy w momencie włączania do badania.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
Profil bezpieczeństwa był podobny do profilu obserwowanego w badaniach krótkoterminowych prowadzonych z udziałem dzieci w wieku od 1 do 5 lat.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Farmakokinetyka lewocetyryzyny ma przebieg liniowy i jest niezależna od dawki i czasu, oraz wykazuje małą zmienność osobniczą. Profil farmakokinetyczny w przypadku podania samego enancjomeru jest taki sam, jak w przypadku podania cetyryzyny. Podczas procesu wchłaniania i eliminacji nie dochodzi do odwrócenia chiralności. Wchłanianie Po podaniu doustnym lewocetyryzyna wchłania się szybko i w znacznym stopniu. Maksymalne stężenie w osoczu występuje 0,9 h po podaniu. Stan stacjonarny jest osiągany po dwóch dniach. Stężenie maksymalne wynosi zwykle 270 ng/ml i 308 ng/ml, odpowiednio po jednorazowym i wielokrotnym doustnym podaniu dawki 5 mg. Stopień wchłaniania nie zależy od dawki ani od przyjmowania pokarmu, natomiast maksymalne stężenie jest zmniejszone i występuje później. Dystrybucja Nie ma dostępnych danych dotyczących tkankowej dystrybucji lewocetyryzyny u ludzi i przenikania lewocetyryzyny przez barierę krew-mózg.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
U szczurów i psów największe stężenia leku stwierdzono w wątrobie i nerkach, najmniejsze w kompartmencie ośrodkowego układu nerwowego. U ludzi lewocetyryzyna w 90% wiąże się z białkami osocza. Dystrybucja lewocetyryzyny jest ograniczona, ponieważ jej objętość dystrybucji wynosi 0,4 l/kg. Metabolizm U ludzi metabolizowane jest mniej niż 14% dawki lewocetyryzyny, dlatego różnice wynikające z polimorfizmu genetycznego lub równoczesnego przyjmowania inhibitorów enzymatycznych uważa się za mało istotne. Szlaki metaboliczne obejmują: utlenianie pierścienia aromatycznego, N- i O-dealkilację oraz sprzęganie z tauryną. Reakcje dealkilacji przebiegają głównie z udziałem CYP 3A4, natomiast utlenianie pierścienia aromatycznego przebiega z udziałem licznych i (lub) niezidentyfikowanych izoform CYP. Lewocetyryzyna w stężeniach znacznie większych niż stężenia maksymalne występujące po podaniu dawki doustnej 5 mg, nie miała wpływu na aktywność izoenzymów CYP 1A2, 2C9, 2C19, 2D6, 2E1 i 3A4.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Ze względu na słaby metabolizm i brak możliwości hamowania metabolizmu, wzajemne interakcje lewocetyryzyny z innymi substancjami są mało prawdopodobne. Eliminacja Okres półtrwania w osoczu u osób dorosłych wynosi 7,9 ± 1,9 godziny. Okres półtrwania u małych dzieci jest krótszy. Średni pozorny całkowity klirens u dorosłych wynosi 0,63 ml/min/kg mc. Lewocetyryzyna i jej metabolity wydalane są głównie z moczem, średnio 85,4% dawki. Z kałem wydalane jest tylko 12,9% dawki. Lewocetyryzyna jest wydalana zarówno w wyniku przesączania kłębuszkowego, jak i aktywnego wydzielania kanalikowego. Specjalne grupy pacjentów Zaburzenia czynności nerek Pozorny klirens lewocetyryzyny zależy od klirensu kreatyniny. Dlatego u pacjentów z umiarkowanymi i ciężkimi zaburzeniami czynności nerek zaleca się dostosowanie odstępów pomiędzy kolejnymi dawkami lewocetyryzyny (patrz punkt 4.2).
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
U osób ze schyłkową niewydolnością nerek z bezmoczem całkowity klirens leku z organizmu jest zmniejszony o około 80% w porównaniu z osobami zdrowymi. Ilość lewocetyryzyny usunięta w czasie standardowego czterogodzinnego zabiegu hemodializy wynosiła < 10%. Dzieci i młodzież Dane z badania oceniającego farmakokinetykę u dzieci, w którym 14 dzieciom w wieku od 6 do 11 lat, o masie ciała od 20 do 40 kg podawano doustnie lewocetyryzynę w pojedynczej dawce 5 mg, wykazały w porównaniu krzyżowym, że wartości Cmax i AUC były około 2-krotnie większe niż u zdrowych dorosłych ochotników. Średnie stężenie maksymalne (Cmax) wynosiło 450 ng/ml i było osiągane średnio po 1,2 godziny; znormalizowany względem masy ciała klirens całkowity był o 30% większy, a okres półtrwania eliminacji był o 24% krótszy u dzieci niż u osób dorosłych. Nie przeprowadzono badań farmakokinetycznych u dzieci w wieku poniżej 6 lat.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Przeprowadzono retrospektywną analizę farmakokinetyczną w populacji 323 pacjentów (181 dzieci w wieku od 1 do 5 lat, 18 dzieci w wieku od 6 do 11 lat i 124 dorosłych w wieku od 18 do 55 lat), którzy otrzymywali lewocetyryzynę w dawce pojedynczej lub w dawkach wielokrotnych od 1,25 mg do 30 mg. Uzyskane z tej analizy dane wskazują, że przewidywane stężenie w osoczu po podaniu dawki 1,25 mg raz na dobę dzieciom w wieku od 6 miesięcy do 5 lat jest podobne do stężenia w osoczu osób dorosłych otrzymujących dawkę 5 mg raz na dobę. Pacjenci w podeszłym wieku Dane dotyczące farmakokinetyki u osób w podeszłym wieku są ograniczone. Po wielokrotnym podaniu doustnym lewocetyryzyny w dawce 30 mg raz na dobę dziewięciu pacjentom w podeszłym wieku (65– 74 lat) przez okres 6 dni, klirens całkowity był o około 33% mniejszy niż u młodszych dorosłych. Wykazano, że rozkład cetyryzyny (racematu) jest zależny raczej od czynności nerek niż od wieku.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Zależność ta dotyczy również lewocetyryzyny, ponieważ zarówno lewocetyryzyna, jak i cetyryzyna są wydalane głównie z moczem. Dlatego u pacjentów w podeszłym wieku dawkę lewocetyryzyny należy dostosować do czynności nerek. Płeć Poddano ocenie potencjalną zależność farmakokinetyki leku od płci (badanie z udziałem 77 pacjentów: 40 mężczyzn i 37 kobiet). Okres półtrwania był nieznacznie krótszy u kobiet (7,08 ± 1,72 godziny) niż u mężczyzn (8,62 ± 1,84 godziny); jednak wydaje się, że klirens po podaniu doustnym dawki dostosowanej do masy ciała u kobiet (0,67 ± 0,16 ml/min/kg mc.) jest porównywalny z klirensem u mężczyzn (0,59 ± 0,12 ml/min/kg mc.). U mężczyzn i kobiet z prawidłową czynnością nerek stosuje się takie same dawki dobowe, z zachowaniem takich samych odstępów pomiędzy dawkami. Rasa Nie zbadano wpływu rasy na działanie lewocetyryzyny.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Ze względu na fakt, że lewocetyryzyna jest wydalana głównie przez nerki, a nie istnieją ważne, zależne od rasy różnice w klirensie kreatyniny, nie należy się spodziewać istnienia zależnych od rasy różnic we właściwościach farmakokinetycznych lewocetyryzyny. Nie obserwowano związanych z rasą różnic w kinetyce cetyryzyny (racematu). Zaburzenia czynności wątroby Nie badano farmakokinetyki lewocetyryzyny u pacjentów z zaburzeniami czynności wątroby. U pacjentów z przewlekłymi chorobami wątroby (wątrobowokomórkowymi, cholestatycznymi lub z żółciową marskością wątroby), którym podawano 10 lub 20 mg cetyryzyny (racematu) w dawce pojedynczej, obserwowano wydłużenie okresu półtrwania o 50% przy jednoczesnym zmniejszeniu klirensu o 40% w porównaniu ze zdrowymi osobami. Zależności farmakokinetyczno-farmakodynamiczne Wpływ na reakcje skórne wywołane przez histaminę nie jest związany ze stężeniem leku w osoczu.
- CHPL leku Xyzal, tabletki powlekane, 5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń: Celuloza mikrokrystaliczna Laktoza jednowodna Krzemionka koloidalna bezwodna Magnezu stearynian Otoczka: Opadry Y-1-7000 w skład, której wchodzą: Hypromeloza (E 464) Tytanu dwutlenek (E 171) Makrogol 400 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 4 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania. 6.5 Rodzaj i zawartość opakowania Blister Aluminium/OPA/Aluminium/PVC w tekturowym pudełku. Wielkości opakowań: 1, 2, 4, 5, 7, 10, 2 ×10, 10 × 10, 14, 15, 20, 21, 28, 30, 40, 50, 60, 70, 90, 100. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań.
- CHPL leku Nossin, tabletki powlekane, 5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Nossin, 5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Lewocetyryzyny dichlorowodorek Każda tabletka powlekana zawiera 5 mg lewocetyryzyny dichlorowodorku co odpowiada 4,2 mg lewocetyryzyny. Substancja pomocnicza o znanym działaniu: Każda tabletka powlekana zawiera 64,0 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARМACEUТYCZNA Tabletka powlekana. Tabletki powlekane białe lub prawie białe, owalne, obustronnie wypukłe, z wytłoczonym oznakowaniem ‘L9CZ’ po jednej stronie i ‘5’ po drugiej stronie.
- CHPL leku Nossin, tabletki powlekane, 5 mgWskazania do stosowania
4.1 Wskazania do stosowania Nossin, tabletki powlekane jest wskazany w leczeniu objawowym alergicznego zapalenia błony śluzowej nosa (w tym przewlekłego alergicznego zapalenia błony śluzowej nosa) oraz pokrzywki u dorosłych i dzieci w wieku od 6 lat.
- CHPL leku Nossin, tabletki powlekane, 5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i młodzież w wieku 12 lat i powyżej: Zalecana dawka dobowa wynosi 5 mg (1 tabletka powlekana). Pacjenci w podeszłym wieku: U pacjentów w podeszłym wieku z umiarkowanymi do ciężkich zaburzeniami czynności nerek zaleca się dostosowanie dawki produktu (patrz punkt „Zaburzenia czynności nerek”). Zaburzenia czynności nerek Odstępy czasu pomiędzy kolejnymi dawkami muszą być ustalone indywidualnie w zależności od stopnia wydolności nerek. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. W celu skorzystania z tabeli dawkowania należy obliczyć klirens kreatyniny (Clkr) w ml/min. Klirens kreatyniny (ml/min) można obliczyć, oznaczając stężenie kreatyniny w surowicy krwi (mg/dl) i stosując następujący wzór: [140 - wiek (lata)] x masa ciała (kg) Clkr = (x 0,85 dla kobiet) 72 x stężenie kreatyniny w surowicy (mg/dl) Dostosowanie dawki u pacjentów z zaburzeniami czynności nerek Prawidłowa czynność nerek: ≥ 80 - 1 tabletka raz na dobę Łagodne zaburzenia czynności nerek: 50 – 79 - 1 tabletka raz na dobę Umiarkowane zaburzenia czynności nerek: 30 – 49 - 1 tabletka co drugi dzień Ciężkie zaburzenia czynności nerek: < 30 - 1 tabletka co trzeci dzień Schyłkowa niewydolność nerek – pacjenci dializowani: < 10 - Produkt przeciwwskazany U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy dostosować indywidualnie po uwzględnieniu klirensu nerkowego i masy ciała pacjenta.
- CHPL leku Nossin, tabletki powlekane, 5 mgDawkowanie
Brak szczegółowych danych dotyczących stosowania u dzieci z zaburzeniami czynności nerek. Zaburzenia czynności wątroby Nie jest konieczne dostosowanie dawki u pacjentów, u których występują wyłącznie zaburzenia czynności wątroby. U pacjentów z zaburzeniami czynności wątroby oraz nerek zaleca się dostosowanie dawki (patrz powyżej „Zaburzenia czynności nerek”). Dzieci i młodzież Dzieci w wieku od 6 do 12 lat: Zalecana dawka dobowa wynosi 5 mg (1 tabletka powlekana). U dzieci w wieku od 2 do 6 lat nie jest możliwe dostosowanie dawki produktu w postaci tabletek powlekanych. Zaleca się stosowanie produktów lewocetyryzyny w postaciach farmaceutycznych przeznaczonych dla dzieci. Sposób podawania Tabletkę powlekaną należy przyjmować doustnie, połykając w całości i popijając płynem. Tabletkę można przyjmować z posiłkiem lub niezależnie od posiłku. Zaleca się przyjmowanie dawki raz na dobę.
- CHPL leku Nossin, tabletki powlekane, 5 mgDawkowanie
Czas trwania leczenia Okresowe alergiczne zapalenie błony śluzowej nosa (objawy występujące rzadziej niż 4 dni w tygodniu lub utrzymujące się krócej niż 4 tygodnie w roku) należy leczyć zgodnie z przebiegiem choroby; leczenie można przerwać po ustąpieniu objawów i wznowić po ponownym ich wystąpieniu. W przypadku przewlekłego alergicznego zapalenia błony śluzowej nosa (objawy występujące częściej niż 4 dni w tygodniu lub utrzymujące się dłużej niż 4 tygodnie w roku) można zalecić pacjentowi kontynuowanie leczenia w okresie narażenia na alergeny. Dostępne obecnie dane kliniczne dotyczą 6-miesięcznego okresu leczenia 5 mg lewocetyryzyny w postaci tabletek powlekanych. Doświadczenie kliniczne z zastosowaniem cetyryzyny (racematu) w leczeniu przewlekłej pokrzywki i przewlekłego alergicznego zapalenia błony śluzowej nosa dotyczy okresu do 1 roku.
- CHPL leku Nossin, tabletki powlekane, 5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, cetyryzynę, hydroksyzynę, inne pochodne piperazyny lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Ciężkie zaburzenia czynności nerek u pacjentów z klirensem kreatyniny mniejszym niż 10 ml/min.
- CHPL leku Nossin, tabletki powlekane, 5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy zachować ostrożność podczas przyjmowania produktu leczniczego jednocześnie z alkoholem (patrz punkt 4.5). Należy zachować ostrożność u pacjentów z ryzykiem zatrzymania moczu (np. uszkodzenie rdzenia kręgowego, rozrost gruczołu krokowego), gdyż lewocetyryzyna może nasilać ryzyko zatrzymania moczu. Lewocetyryzyna może powodować nasilenie napadów padaczkowych, z tego względu należy zachować ostrożność u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstąpienie leków przeciwhistaminowych na 3 dni przed wykonaniem testów. Produktu nie należy stosować u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, niedoborem laktazy (typu Lapp) lub zespołem złego wchłaniania glukozy-galaktozy.
- CHPL leku Nossin, tabletki powlekane, 5 mgSpecjalne środki ostrozności
W przypadku przerwania stosowania lewocetyryzyny możliwe jest wystąpienie świądu, nawet jeśli objawy te nie występowały przed rozpoczęciem leczenia. Te objawy mogą ustąpić samoistnie. W niektórych przypadkach objawy mogą być intensywne i może być konieczne wznowienie leczenia. Objawy powinny ustąpić po wznowieniu leczenia.
- CHPL leku Nossin, tabletki powlekane, 5 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji lewocetyryzyny (w tym badań z induktorami CYP3A4); badania z zastosowaniem racematu cetyryzyny nie wykazały istotnych klinicznie niepożądanych interakcji (z fenaz onem, pseudoefedryną, cymetydyną, ketokonazolem, erytromycyną, azytromycyną, glipizydem i diazepamem). Niewielkie zmniejszenie klirensu cetyryzyny (16%) obserwowano w badaniu, w którym stosowano dawki wielokrotne teofiliny (400 mg raz na dobę), natomiast jednoczesne podawanie cetyryzyny nie wpływało na ekspozycję na teofilinę. Stosowanie rytonawiru (600 mg dwa razy na dobę) i cetyryzyny (10 mg na dobę) w dawkach wielokrotnych zwiększało o ok. 40% całkowity wpływ cetyryzyny na organizm, podczas gdy w odniesieniu do rytonawiru był on w niewielkim stopniu zmniejszony (o 11%) podczas jednoczesnego stosowania z cetyryzyną.
- CHPL leku Nossin, tabletki powlekane, 5 mgInterakcje
Stosowanie z pokarmem nie zmniejsza stopnia wchłaniania lewocetyryzyny, natomiast zmniejsza szybkość jej wchłaniania. U wrażliwych pacjentów jednoczesne podawanie cetyryzyny lub lewocetyryzyny z alkoholem lub innymi środkami hamującymi czynność OUN może spowodować dodatkowe obniżenie czujności i zdolności reagowania.
- CHPL leku Nossin, tabletki powlekane, 5 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych lub istnieją ograniczone dane (mniej niż 300 ciąż) dotyczące stosowania lewocetyryzyny u kobiet w ciąży. Jednak dane otrzymane z dużej liczby zastosowań cetyryzyny (racemat) u kobiet w ciąży (ponad 1000 ciąż) nie wskazują, aby wywoływała ona wady rozwojowe lub działała toksycznie na płód i noworodka. Badania na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3). Można rozważyć zastosowanie lewocetyryzyny w okresie ciąży, jeżeli jest to konieczne. Karmienie piersi? Wykazano, że cetyryzyna (racemat) przenika do mleka kobiecego. Dlatego też jest prawdopodobne, że lewocetyryzyna przenika do mleka kobiecego. U niemowląt karmionych piersią mogą wystąpić działania niepożądane wynikające z zastosowania lewocetyryzyny przez matkę.
- CHPL leku Nossin, tabletki powlekane, 5 mgWpływ na płodność, ciążę i laktację
Dlatego należy zachować ostrożność, przepisując lewocetyryzynę kobietom karmiącym piersią. Płodność Brak danych klinicznych dotyczących lewocetyryzyny.
- CHPL leku Nossin, tabletki powlekane, 5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn W porównawczych badaniach klinicznych nie wykazano, aby lewocetyryzyna w zalecanej dawce osłabiała koncentrację uwagi, zdolność reagowania lub zdolność prowadzenia pojazdów. Jednakże niektórzy pacjenci mogą odczuwać senność, zmęczenie i osłabienie podczas leczenia lewocetyryzyną. Dlatego pacjenci zamierzający prowadzić pojazdy, wykonywać potencjalnie niebezpieczne czynności lub obsługiwać maszyny, powinni wziąć pod uwagę swoją reakcję na produkt leczniczy.
- CHPL leku Nossin, tabletki powlekane, 5 mgDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne Dorośli i młodzież w wieku powyżej 12 lat. W badaniach klinicznych z udziałem kobiet i mężczyzn w wieku od 12 do 71 lat, w grupie przyjmującej 5 mg lewocetyryzyny u 15,1% pacjentów wystąpiło co najmniej jedno działanie niepożądane, w porównaniu z 11,3% pacjentów z grupy przyjmującej placebo. 91,6% tych działań niepożądanych miało łagodne lub umiarkowane nasilenie. W badaniach klinicznych, odsetek pacjentów, którzy przerywali leczenie z powodu działań niepożądanych, wynosił 1,0% (9/935) w grupie stosującej 5 mg lewocetyryzyny i 1,8% (14/771) w grupie przyjmującej placebo. W badaniach klinicznych z zastosowaniem lewocetyryzyny uczestniczyło 935 osób, którym podawano produkt w zalecanej dawce 5 mg na dobę. W tej grupie, po zastosowaniu lewocetyryzyny w dawce 5 mg lub placebo, zgłaszano występowanie następujących działań niepożądanych z częstością 1% lub większą (często; ≥1/100 do <1/10): Ból głowy: Placebo 25 (3,2%), Lewocetyryzyna 24 (2,6%) Senność: Placebo 11 (1,4%), Lewocetyryzyna 49 (5,2%) Suchość w jamie ustnej: Placebo 12 (1,6%), Lewocetyryzyna 24 (2,6%) Zmęczenie: Placebo 9 (1,2%), Lewocetyryzyna 23 (2,5%) Zgłaszano także inne działania niepożądane występujące niezbyt często (≥1/1 000 do <1/100), takie jak osłabienie lub ból brzucha.
- CHPL leku Nossin, tabletki powlekane, 5 mgDziałania niepożądane
Częstość występowania sedatywnych działań niepożądanych, takich jak senność, zmęczenie i osłabienie, była łącznie większa (8,1%) u pacjentów przyjmujących lewocetyryzynę w dawce 5 mg niż u przyjmujących placebo (3,1%). Dzieci i młodzież W dwóch badaniach kontrolowanych placebo z udziałem dzieci w wieku od 6 do 11 miesięcy oraz dzieci w wieku od 1 roku do poniżej 6 lat, 159 pacjentom podawano lewocetyryzynę w dawce odpowiednio 1,25 mg na dobę przez 2 tygodnie oraz 1,25 mg dwa razy na dobę. Poniżej przedstawiono działania niepożądane zgłaszane po podaniu lewocetyryzyny lub placebo, występujące z częstością 1% lub większą. Biegunka: Placebo 0, Lewocetyryzyna 3 (1,9%) Wymioty: Placebo 1 (1,2%), Lewocetyryzyna 1 (0,6%) Zaparcia: Placebo 0, Lewocetyryzyna 2 (1,3%) Senność: Placebo 2 (2,4%), Lewocetyryzyna 3 (1,9%) Zaburzenia snu: Placebo 0, Lewocetyryzyna 2 (1,3%) W badaniach klinicznych z grupą kontrolną placebo, prowadzonych metodą podwójnie ślepej próby z udziałem dzieci w wieku od 6 do 12 lat, 243 dzieciom podawano lewocetyryzynę w dawce 5 mg na dobę przez różny okres czasu – od krótszego niż 1 tydzień do 13 tygodni.
- CHPL leku Nossin, tabletki powlekane, 5 mgDziałania niepożądane
Poniżej przedstawiono działania niepożądane zgłaszane po podaniu lewocetyryzyny lub placebo, występujące z częstością 1% lub większą. Bóle głowy: Placebo 5 (2,1%), Lewocetyryzyna 2 (0,8%) Senność: Placebo 1 (0,4%), Lewocetyryzyna 7 (2,9%) Doświadczenie po wprowadzeniu produktu do obrotu Działania niepożądane zgłoszone po wprowadzeniu produktu do obrotu przedstawiono zgodnie z klasyfikacją układowo-narządową oraz częstością występowania. Częstość występowania działań niepożądanych określono następująco: bardzo często (≥ 1/10), często (≥ 1/100 do <1/10), niezbyt często (≥ 1/1000 do <1/100), rzadko (≥ 1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia układu immunologicznego: Nadwrażliwość, w tym anafilaksja Zaburzenia metabolizmu i odżywiania: Zwiększenie łaknienia Zaburzenia psychiczne: Agresja, pobudzenie, omamy, depresja, bezsenność, myśli samobójcze, koszmary senne Zaburzenia układu nerwowego: Drgawki, parestezje, zaburzenia równowagi, omdlenie, drżenie, zaburzenia smaku Zaburzenia oka: Zaburzenia widzenia, widzenie niewyraźne, rotacyjne ruchy gałek ocznych Zaburzenia ucha i błędnika: zawroty głowy Zaburzenia serca: Kołatanie serca, tachykardia Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Duszność Zaburzenia żołądka i jelit: Nudności, wymioty, biegunka Zaburzenia wątroby i dróg żółciowych: Zapalenie wątroby Zaburzenia skóry i tkanki podskórnej: Obrzęk naczyniowo-ruchowy, trwały wyprysk polekowy, świąd, wysypka, pokrzywka Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Ból mięśni, ból stawów Zaburzenia nerek i dróg moczowych: dyzuria, zatrzymanie moczu Zaburzenia ogólne i stany w miejscu podania: Obrzęk Badania diagnostyczne: Zwiększenie masy ciała, nieprawidłowe wyniki badań czynności wątroby Opis wybranych działań niepożądanych Zgłaszano przypadki świądu po przerwaniu stosowania lewocetyryzyny.
- CHPL leku Nossin, tabletki powlekane, 5 mgDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: +48 22 49-21-301, fax: +48 22 49-21-309, e-mail: ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Nossin, tabletki powlekane, 5 mgPrzedawkowanie
4.9 Przedawkowanie Objawy Objawy przedawkowania u dorosłych mogą być następujące: senność, a u dzieci początkowo pobudzenie i niepokój, zwłaszcza ruchowy, a następnie senność. Postępowanie w razie przedawkowania Nie jest znane specyficzne antidotum dla lewocetyryzyny. W razie przedawkowania zalecane jest leczenie objawowe lub podtrzymujące. Należy rozważyć płukanie żołądka, jeśli od przyjęcia leku upłynęło niewiele czasu. Lewocetyryzyna nie jest skutecznie usuwana za pomocą hemodializy.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny; kod ATC: R06A E09. Mechanizm działania Lewocetyryzyna, (R)-enancjomer cetyryzyny, jest silnym i wybiorczym antagonistą obwodowych receptorów histaminowych H1. Badania dotyczące wiązania z receptorami wykazały, że lewocetyryzyna ma duże powinowactwo do receptorów H1 u ludzi (Ki = 3,2 nmol/l). Lewocetyryzyna ma dwukrotnie większe powinowactwo niż cetyryzyna (Ki = 6,3 nmol/l). Okres półtrwania dysocjacji lewocetyryzyny od receptorów H1 wynosi 115 ± 38 min. Po 4 godzinach od jednorazowego podania stwierdzono zablokowanie receptorów przez lewocetyryzynę w 90%, a po 24 godzinach w 57%. Badania farmakodynamiczne u zdrowych ochotników wykazały, że działanie dawki lewocetyryzyny równej połowie dawki cetyryzyny jest porównywalne do działania cetyryzyny, zarówno na skórę, jak i na błonę śluzową nosa.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
Działanie farmakodynamiczne Właściwości farmakodynamiczne lewocetyryzyny oceniano w badaniach randomizowanych przeprowadzonych z grupą kontrolną: W badaniu porównującym działanie lewocetyryzyny w dawce 5 mg, desloratadyny w dawce 5 mg i placebo na pohistaminowy bąbel i rumień, leczenie lewocetyryzyną powodowało istotne hamowanie powstawania bąbla i rumienia - działanie to było najsilniejsze w ciągu pierwszych 12 godzin i utrzymywało się przez 24 godziny (p<0,001), w porównaniu z placebo i desloratadyną. W badaniach klinicznych z grupą kontrolną placebo, dotyczących objawów wywołanych narażeniem na pyłki roślin w modelu z użyciem komory do prowokacji alergenowych, początek działania lewocetyryzyny w dawce 5 mg obserwowano po 1 godzinie od podania produktu. W badaniach in vitro (komory Boydena i linie komórkowe) wykazano, że lewocetyryzyna hamuje indukowaną przez eotaksynę przezśródbłonkową migrację eozynofilów przez komórki skóry i płuc.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
W eksperymentalnym badaniu farmakodynamicznym in vivo (technika okienek skórnych) u 14 dorosłych pacjentów wykazano, w porównaniu z placebo, trzy główne działania hamujące lewocetyryzyny w dawce 5 mg zastosowanej w ciągu pierwszych 6 godzin reakcji wywołanej pyłkami: hamowanie uwalniania VCAM-1, zmianę przepuszczalności naczyń i zmniejszenie napływu eozynofilów. Skuteczność kliniczna i bezpieczeństwo stosowania Skuteczność i bezpieczeństwo stosowania lewocetyryzyny wykazano w kilku badaniach klinicznych przeprowadzonych z grupą kontrolną placebo, metodą podwójnie ślepej próby u dorosłych pacjentów z sezonowym alergicznym zapaleniem błony śluzowej nosa, całorocznym alergicznym zapaleniem błony śluzowej nosa lub przewlekłym alergicznym zapaleniem błony śluzowej nosa. Lewocetyryzyna w istotnym stopniu łagodziła objawy alergicznego zapalenia błony śluzowej nosa, w tym także niedrożność nosa w niektórych badaniach.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
W trwającym 6 miesięcy badaniu klinicznym u 551 dorosłych pacjentów (w tym 276 pacjentów leczonych lewocetyryzyną) z przewlekłym alergicznym zapaleniem błony śluzowej nosa (objawy występowały przez 4 dni w tygodniu, przez co najmniej 4 kolejne tygodnie) i uczulonych na roztocza kurzu domowego i pyłki traw wykazano, że lewocetyryzyna w dawce 5 mg była klinicznie i statystycznie istotnie bardziej skuteczna niż placebo w łagodzeniu objawów alergicznego zapalenia błony śluzowej nosa ocenianych w skali TSS (punktowy wskaźnik nasilenia objawów klinicznych, ang. Total Symptom Score - TSS) przez cały czas trwania badania, przy czym nie występowało zjawisko tachyfilaksji. Przez cały czas trwania badania lewocetyryzyna istotnie poprawiała jakość życia pacjentów. W badaniu klinicznym z grupą kontrolną placebo, w którym uczestniczyło 166 pacjentów z przewlekłą pokrzywką idiopatyczną, 85 pacjentów przyjmowało placebo, a 81 lewocetyryzynę w dawce 5 mg raz na dobę przez 6 tygodni.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
Leczenie lewocetyryzyną w porównaniu z placebo powodowało istotne zmniejszenie nasilenia świądu w pierwszym tygodniu oraz w całym okresie leczenia. Stosowanie lewocetyryzyny w porównaniu z placebo powodowało także większą poprawę zależnej od stanu zdrowia jakości życia pacjentów, ocenianej na podstawie wskaźnika wpływu dolegliwości skórnych na jakość życia (ang. Dermatology Life Quality Index). Przewlekła idiopatyczna pokrzywka była badana jako model zaburzeń pokrzywkowych. Ponieważ uwalnianie histaminy jest przyczyną występowania pokrzywki można oczekiwać, że lewocetyryzyna będzie skuteczna w łagodzeniu objawów innych rodzajów pokrzywek, nie tylko przewlekłej idiopatycznej pokrzywki. W zapisach EKG nie wykazano znaczącego wpływu lewocetyryzyny na odstęp QT. Dzieci i młodzież W dwóch badaniach klinicznych z grupą kontrolną placebo, w których uczestniczyli pacjenci w wieku od 6 do 12 lat z sezonowym lub całorocznym alergicznym zapaleniem błony śluzowej nosa, oceniano bezpieczeństwo stosowania i skuteczność lewocetyryzyny w postaci tabletek.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
W obydwu badaniach leczenie lewocetyryzyną powodowało istotne złagodzenie objawów oraz poprawę zależnej od stanu zdrowia jakości życia pacjentów. Bezpieczeństwo stosowania lewocetyryzyny u dzieci w wieku do 6 lat oceniano w warunkach klinicznych w kilku krótko- i długoterminowych badaniach klinicznych: w badaniu klinicznym u 29 dzieci w wieku 2 do 6 lat z alergicznym zapaleniem błony śluzowej nosa, leczonych lewocetyryzyną w dawce 1,25 mg 2 razy na dobę przez 4 tygodnie, w badaniu klinicznym u 114 dzieci w wieku od 1 roku życia do 5 lat z alergicznym zapaleniem błony śluzowej nosa lub przewlekłą pokrzywką idiopatyczną, leczonych lewocetyryzyną w dawce 1,25 mg 2 razy na dobę przez 2 tygodnie, w badaniu klinicznym u 45 dzieci w wieku od 6 do 11 miesięcy z alergicznym zapaleniem błony śluzowej nosa lub przewlekłą pokrzywką idiopatyczną, leczonych lewocetyryzyną w dawce 1,25 mg raz na dobę przez 2 tygodnie, w długoterminowym badaniu klinicznym (18 miesięcy) u 255 dzieci z atopią, leczonych lewocetyryzyną, których wiek w chwili rozpoczęcia badania wynosił od 12 do 24 miesięcy życia.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
Profil bezpieczeństwa był podobny do obserwowanego w badaniach krótkoterminowych przeprowadzonych u dzieci w wieku od 1 do 5 lat.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Farmakokinetyka lewocetyryzyny ma przebieg liniowy i jest niezależna od dawki i czasu, oraz wykazuje małą zmienność osobniczą. Profil farmakokinetyczny w przypadku podania enancjomeru jest taki sam, jak w przypadku podania cetyryzyny. Podczas procesu wchłaniania i eliminacji nie dochodzi do odwrócenia chiralności. Wchłanianie Po podaniu doustnym lewocetyryzyna wchłania się szybko i w znacznym stopniu. Maksymalne stężenie w osoczu występuje 0,9 godziny po podaniu. Stan równowagi występuje po dwóch dniach. Stężenie maksymalne wynosi zwykle 270 ng/ml i 308 ng/ml, odpowiednio po jednorazowym i wielokrotnym podawaniu dawki 5 mg raz na dobę. Stopień wchłaniania nie zależy od dawki ani od przyjmowania pokarmu, natomiast maksymalne stężenie jest zmniejszone i występuje później. Dystrybucja Brak dostępnych danych dotyczących tkankowej dystrybucji lewocetyryzyny u ludzi i przenikania lewocetyryzyny przez barierę krew-mózg.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
U szczurów i psów największe stężenia stwierdzono w wątrobie i nerkach, najmniejsze w kompartmencie ośrodkowego układu nerwowego. U ludzi lewocetyryzyna w 90% wiąże się z białkami osocza. Dystrybucja lewocetyryzyny jest ograniczona, ponieważ jej objętość dystrybucji wynosi 0,4 l/kg. Biotransformacja U ludzi metabolizowane jest mniej niż 14% podanej dawki lewocetyryzyny, dlatego różnice wynikające z polimorfizmu genetycznego lub równoczesnego stosowania inhibitorów enzymów uważa się za mało istotne. Szlaki metaboliczne obejmują: utlenianie pierścienia aromatycznego, N- i O-dealkilację oraz sprzęganie z tauryną. Reakcje dealkilacji przebiegają głównie z udziałem CYP 3A4, natomiast utlenianie pierścienia aromatycznego przebiega z udziałem licznych i (lub) niezidentyfikowanych izoenzymów CYP. Lewocetyryzyna w stężeniach znacznie większych niż stężenie maksymalne występujące po podaniu dawki doustnej 5 mg, nie ma wpływu na aktywność izoenzymów CYP 1A2, 2C9, 2C19, 2D6, 2E1 i 3A4.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Ze względu na słabo nasilony metabolizm i brak potencjalnych możliwości jego hamowania, interakcje lewocetyryzyny z innymi substancjami są mało prawdopodobne. Eliminacja Okres półtrwania w osoczu wynosi u dorosłych 7,9 ± 1,9 godziny. Średni pozorny klirens całkowity wynosi 0,63 ml/min/kg mc. Lewocetyryzyna i jej metabolity wydalane są głównie z moczem, średnio 85,4% dawki. Z kałem wydalane jest tylko 12,9% dawki. Lewocetyryzyna wydala się zarówno w wyniku przesączania kłębuszkowego, jak i czynnego wydzielania kanalikowego. Specjalne grupy pacjentów Zaburzenia czynności nerek Pozorny klirens całkowity lewocetyryzyny z organizmu koreluje z klirensem kreatyniny. Dlatego u pacjentów z umiarkowanymi i ciężkimi zaburzeniami czynności nerek zaleca się dostosowanie odstępów pomiędzy kolejnymi dawkami lewocetyryzyny w zależności od klirensu kreatyniny. U osób ze schyłkową niewydolnością nerek z bezmoczem, klirens całkowity jest zmniejszony o około 80% w porównaniu z zdrowymi.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Ilość lewocetyryzyny usunięta w czasie standardowego 4-godzinnego zabiegu hemodializy wynosiła mniej niż 10%. Dzieci i młodzież Wyniki farmakokinetycznego badania u dzieci, w którym u 14 dzieci w wieku 6 do 11 lat o masie ciała 20 kg do 40 kg zastosowano dawkę jednorazową 5 mg lewocetyryzyny doustnie, wykazały około dwukrotne zwiększenie wartości Cmax i AUC w porównaniu z dorosłymi zdrowymi uczestnikami skrzyżowanego badania porównawczego. Średnia wartość Cmax (450 ng/ml) występowała średnio po 1,2 godziny, klirens całkowity znormalizowany względem masy ciała był o 30% większy, zaś okres półtrwania w fazie eliminacji o 24% krótszy w populacji pediatrycznej niż u dorosłych. Nie prowadzono badań farmakokinetyki u dzieci w wieku do 6 lat. Dokonano retrospektywnej analizy danych z farmakokinetyki populacyjnej u 323 osób (181 dzieci w wieku od 1 do 5 lat, 18 dzieci w wieku od 6 do 11 lat i 124 dorosłych w wieku od 18 do 55 lat), które otrzymały dawkę jednorazową lub dawki wielokrotne lewocetyryzyny wynoszące od 1,25 do 30 mg.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Dane z analizy wykazują, że po podaniu dawki 1,25 mg raz na dobę u dzieci w wieku od 6 miesięcy do 5 lat można spodziewać się stężenia w osoczu podobnego, jak u dorosłych otrzymujących dawkę 5 mg raz na dobę. Pacjenci w podeszłym wieku Dane dotyczące farmakokinetyki u pacjentów w podeszłym wieku są ograniczone. Po wielokrotnym podaniu doustnym lewocetyryzyny w dawce 30 mg raz na dobę przez 6 dni, u 9 pacjentów (w wieku od 65 do 74 lat) klirens całkowity był o około 33% mniejszy w porównaniu z młodymi dorosłymi. Wykazano, że po podaniu cetyryzyny (racematu) jego wydalanie było bardziej zależne od czynności nerek niż od wieku. Dotyczy to także lewocetyryzyny, gdyż zarówno ona, jak i cetyryzyna są wydalane głównie z moczem. Dawkowanie lewocetyryzyny u pacjentów w podeszłym wieku powinno więc być dostosowane do czynności nerek. Płeć Poddano ocenie potencjalny wpływ płci na farmakokinetykę lewocetyryzyny (badanie u 77 pacjentów: 40 mężczyzn, 37 kobiet).
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Okres półtrwania był nieznacznie krótszy u kobiet (7,08 ± 1,72 godziny) niż u mężczyzn (8,62 ± 1,84 godziny), jednak wydaje się, że klirens po podaniu doustnym dawki dostosowanej do masy ciała u kobiet (0,67 ± 0,16 ml/min/kg) jest porównywalny z klirensem u mężczyzn (0,59 ± 0,12 ml/min/kg). U kobiet i mężczyzn z prawidłową czynnością nerek stosuje się takie same dawki dobowe i takie same odstępy między nimi. Rasa Nie badano wpływu rasy na farmakokinetykę lewocetyryzyny. Nie należy spodziewać się występowania różnic farmakokinetycznych w zależności od rasy, gdyż lewocetyryzyna jest wydalana głównie przez nerki, a brak jest istotnych różnic w odniesieniu do klirensu kreatyniny w zależności od rasy. Nie odnotowano występowania różnic w kinetyce cetyryzyny (racematu) w zależności od rasy. Zaburzenia czynności wątroby Nie badano farmakokinetyki lewocetyryzyny u pacjentów z zaburzeniami czynności wątroby.
- CHPL leku Nossin, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
U pacjentów z przewlekłymi chorobami wątroby (wątrobowokomórkowymi, cholestatycznymi lub z żółciową marskością wątroby) po jednorazowym podaniu dawki 10 mg lub 20 mg cetyryzyny (racematu), okres półtrwania był wydłużony o 50%, a jednocześnie klirens zmniejszony o 40% w porównaniu z osobami zdrowymi. Zależności farmakokinetyczno-farmakodynamiczne Wpływ na reakcje skórne spowodowane przez histaminę nie zależy od stężenia produktu leczniczego w osoczu.
- CHPL leku Nossin, tabletki powlekane, 5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań dotyczących farmakologii bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród, nie ujawniają żadnego szczególnego zagrożenia dla człowieka.
- CHPL leku Nossin, tabletki powlekane, 5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń Laktoza jednowodna Celuloza mikrokrystaliczna Magnezu stearynian Otoczka (Opadry white) Hypromeloza Tytanu dwu tlenek (E 171) Makrogol 400. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. 6.5 Rodzaj i zawartość opakowania Blistry PVC/PVDC/Aluminium lub blistry O PA/Aluminium/PVC/Aluminium w tekturowym pudełku. Wielkości opakowań: 7, 10, 14, 15, 20, 21, 28, 30, 40, 50, 56, 60, 70, 90, 100, 112 lub 120 tabletek powlekanych. Pojedyncze blistry zawierające 30 x 1 tabletek powlekanych. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Xyzal, tabletki powlekane, 5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Xyzal, 5 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 5 mg lewocetyryzyny dichlorowodorku (Levocetirizini dihydrochloridum). Substancja pomocnicza o znanym działaniu: każda tabletka zawiera 63,50 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana. Białe lub prawie białe, owalne tabletki powlekane z logo Y na jednej stronie.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWskazania do stosowania
4.1 Wskazania do stosowania Xyzal, 5 mg, tabletki powlekane jest wskazany w objawowym leczeniu alergicznego zapalenia błony śluzowej nosa (w tym przewlekłego alergicznego zapalenia błony śluzowej nosa) i pokrzywki u dorosłych i dzieci w wieku od 6 lat.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i młodzież w wieku 12 lat i powyżej: Zalecana dawka dobowa wynosi 5 mg (1 tabletka powlekana). Osoby w podeszłym wieku: U pacjentów w podeszłym wieku z umiarkowanymi do ciężkich zaburzeniami czynności nerek zaleca się dostosowanie dawki (patrz punkt poniżej „Zaburzenia czynności nerek”). Zaburzenia czynności nerek: Odstępy pomiędzy kolejnymi dawkami muszą być ustalone indywidualnie w zależności od stopnia wydolności nerek [szacowany współczynnik filtracji kłębuszkowej, (ang. estimated Glomerular Filtration Rate, eGFR)]. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. Dostosowanie dawki u pacjentów z zaburzeniami czynności nerek: Grupa eGFR (ml/min) Dawka i częstość podawania Prawidłowa czynność nerek ≥ 90 1 tabletka raz na dobę Łagodne zaburzenia czynności nerek 60 – < 90 1 tabletka raz na dobę Umiarkowane zaburzenia czynności nerek 30 – < 60 1 tabletka co drugi dzień Ciężkie zaburzenia czynności nerek 15 – < 30 (pacjent nie wymagający dializy) 1 tabletka co trzeci dzień Schyłkowa niewydolność nerek (ang.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDawkowanie
End Stage Renal Disease, ESRD) < 15 (pacjent wymagający dializy) Lek przeciwwskazany U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy dostosować indywidualnie po uwzględnieniu klirensu nerkowego i masy ciała pacjenta. Brak szczegółowych danych dotyczących stosowania leku u dzieci z zaburzeniami czynności nerek. Zaburzenia czynności wątroby: Nie jest konieczne dostosowanie dawki u pacjentów z zaburzeniami czynności wątroby. U pacjentów z zaburzeniami czynności wątroby oraz nerek zaleca się dostosowanie dawki (patrz powyżej „Zaburzenia czynności nerek”). Dzieci i młodzież: Dzieci w wieku od 6 do 12 lat: Zalecana dawka dobowa wynosi 5 mg (1 tabletka powlekana). U dzieci w wieku od 2 do 6 lat nie jest możliwe dostosowanie dawki produktu w postaci tabletek powlekanych. Zaleca się stosowanie produktów lewocetyryzyny w postaciach farmaceutycznych przeznaczonych dla dzieci.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDawkowanie
Sposób podawania Tabletkę powlekaną należy przyjmować doustnie, połykając w całości i popijając płynem. Tabletkę można przyjmować z posiłkiem lub niezależnie od posiłku. Zaleca się przyjmowanie dawki raz na dobę. Czas trwania leczenia: Okresowe alergiczne zapalenie błony śluzowej nosa (objawy występujące rzadziej niż cztery dni w tygodniu lub utrzymujące się krócej niż cztery tygodnie w ciągu roku) należy leczyć zgodnie z przebiegiem choroby; leczenie można przerwać od razu po ustąpieniu objawów i wznowić po ponownym ich wystąpieniu. W przypadku przewlekłego alergicznego zapalenia błony śluzowej nosa (objawy występujące częściej niż cztery dni w tygodniu lub utrzymujące się dłużej niż cztery tygodnie w roku) można zalecić pacjentowi kontynuowanie leczenia w okresie ekspozycji na alergeny. Doświadczenie kliniczne dotyczące stosowania lewocetyryzyny obejmuje co najmniej 6-miesięczny okres leczenia.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDawkowanie
Doświadczenie kliniczne z zastosowaniem cetyryzyny (racemat) w leczeniu przewlekłej pokrzywki i przewlekłego alergicznego zapalenia błony śluzowej nosa obejmuje okres do 1 roku.
- CHPL leku Xyzal, tabletki powlekane, 5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, cetyryzynę, hydroksyzynę, jakiekolwiek inne pochodne piperazyny lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Pacjenci ze schyłkową niewydolnością nerek z szacowanym współczynnikiem przesączania kłębuszkowego (eGFR) poniżej 15 ml/min (wymagający dializy).
- CHPL leku Xyzal, tabletki powlekane, 5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy zachować ostrożność podczas przyjmowania leku jednocześnie z alkoholem (patrz punkt 4.5). Należy zachować ostrożność u pacjentów z ryzykiem zatrzymania moczu (np.: uszkodzenie rdzenia kręgowego, rozrost gruczołu krokowego), ponieważ lewocetyryzyna może zwiększać ryzyko zatrzymania moczu. Lewocetyryzyna może powodować nasilenie napadów padaczkowych, z tego względu należy zachować ostrożność u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstąpienie leków przeciwhistaminowych na 3 dni przed wykonaniem testów. Produkt nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy.
- CHPL leku Xyzal, tabletki powlekane, 5 mgSpecjalne środki ostrozności
W przypadku przerwania stosowania lewocetyryzyny możliwe jest wystąpienie świądu, nawet jeśli objawy te nie występowały przed rozpoczęciem leczenia. Te objawy mogą ustąpić samoistnie. W niektórych przypadkach objawy mogą być intensywne i może być konieczne wznowienie leczenia. Objawy powinny ustąpić po wznowieniu leczenia. Dzieci i młodzież: Nie zaleca się podawania produktu w postaci tabletek powlekanych dzieciom w wieku poniżej 6 lat, ponieważ nie jest możliwe odpowiednie dostosowanie dawki w przypadku tej postaci produktu. Zaleca się stosowanie produktów lewocetyryzyny w postaciach farmaceutycznych przeznaczonych dla dzieci.
- CHPL leku Xyzal, tabletki powlekane, 5 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji lewocetyryzyny (w tym badań z induktorami CYP3A4); badania z zastosowaniem cetyryzyny (racematu) nie wykazały istotnych klinicznie niepożądanych interakcji (z antypiryną, azytromycyną, cymetydyną, diazepamem, erytromycyną, glipizydem, ketokonazolem i pseudoefedryną). W badaniu, w którym cetyryzynę podawano wielokrotnie z teofiliną (400 mg raz na dobę), zaobserwowano niewielkie zmniejszenie klirensu cetyryzyny (16%); natomiast jednoczesne podawanie cetyryzyny nie wpływało na ekspozycję na teofilinę. W badaniu po podaniu wielokrotnym rytonawiru (600 mg dwa razy na dobę) i cetyryzyny (10 mg na dobę), ekspozycja na cetyryzynę zwiększyła się o około 40%, podczas gdy ekspozycja na rytonawir podczas jednoczesnego podawania cetyryzyny zmieniła się nieznacznie (-11%).
- CHPL leku Xyzal, tabletki powlekane, 5 mgInterakcje
Podawanie z pokarmem nie zmniejsza stopnia wchłaniania lewocetyryzyny, natomiast zmniejsza szybkość jej wchłaniania. U wrażliwych pacjentów jednoczesne podawanie cetyryzyny lub lewocetyryzyny z alkoholem lub innymi substancjami hamującymi czynność OUN może spowodować dodatkowe obniżenie czujności i zdolności reagowania.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych lub istnieją ograniczone dane (mniej niż 300 ciąż) dotyczące stosowania lewocetyryzyny u kobiet w ciąży. Jednak dane otrzymane z dużej liczby zastosowań cetyryzyny (racemat) u kobiet w ciąży (ponad 1000 ciąż) nie wskazują, aby wywoływała ona wady rozwojowe lub działała toksycznie na płód i noworodka. Badania na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3). Można rozważyć zastosowanie lewocetyryzyny w okresie ciąży, jeżeli jest to konieczne. Karmienie piersi? Wykazano, że cetyryzyna (racemat) przenika do mleka u ludzi. Dlatego też jest prawdopodobne, że lewocetyryzyna przenika do mleka u ludzi. U niemowląt karmionych piersią mogą wystąpić działania niepożądane związane z lewocetyryzyną. Dlatego należy zachować ostrożność, przepisując lewocetyryzynę kobietom karmiącym piersią.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWpływ na płodność, ciążę i laktację
Płodność Brak danych klinicznych dotyczących lewocetyryzyny.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn W porównawczych badaniach klinicznych nie wykazano, aby lewocetyryzyna w zalecanej dawce osłabiała koncentrację uwagi, zdolność reagowania lub zdolność prowadzenia pojazdów lub obsługi maszyn. Jednakże niektórzy pacjenci mogą odczuwać senność, zmęczenie i osłabienie podczas leczenia lewocetyryzyną. Dlatego pacjenci zamierzający prowadzić pojazdy, wykonywać potencjalnie niebezpieczne czynności lub obsługiwać maszyny, powinni wziąć pod uwagę swoją reakcję na produkt leczniczy.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne Dorośli i młodzież w wieku powyżej 12 lat: W badaniach klinicznych z udziałem kobiet i mężczyzn w wieku od 12 do 71 lat wystąpiło co najmniej jedno działanie niepożądane u 15,1% pacjentów w grupie otrzymującej lewocetyryzynę w dawce 5 mg, w porównaniu z 11,3% pacjentów z grupy otrzymującej placebo. 91,6% tych działań niepożądanych miało nasilenie łagodne lub umiarkowane. W badaniach klinicznych odsetek pacjentów, którzy nie ukończyli badania z powodu zdarzeń niepożądanych, wynosił 1% (9/935) w grupie otrzymującej lewocetyryzynę w dawce 5 mg i 1,8% (14/771) w grupie otrzymującej placebo. W badaniach klinicznych z zastosowaniem lewocetyryzyny uczestniczyło 935 osób, którym podawano produkt leczniczy w zalecanej dawce 5 mg na dobę. W tej grupie zgłaszano następujące działania niepożądane występujące z częstością 1% lub większą (często: ≥1/100 do <1/10) po zastosowaniu lewocetyryzyny w dawce 5 mg lub placebo: Ból głowy: Placebo (n=771) 25 (3,2%), Lewocetyryzyna 5 mg (n=935) 24 (2,6%) Senność: Placebo (n=771) 11 (1,4%), Lewocetyryzyna 5 mg (n=935) 49 (5,2%) Suchość w jamie ustnej: Placebo (n=771) 12 (1,6%), Lewocetyryzyna 5 mg (n=935) 24 (2,6%) Zmęczenie: Placebo (n=771) 9 (1,2%), Lewocetyryzyna 5 mg (n=935) 23 (2,5%) Obserwowano także działania niepożądane występujące niezbyt często (niezbyt często ≥1/1000 do <1/100), takie jak osłabienie lub bóle brzucha.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDziałania niepożądane
Przypadki sedatywnych działań niepożądanych, takich jak: senność, zmęczenie i osłabienie, występowały częściej po podaniu lewocetyryzyny w dawce 5 mg (8,1%) niż po podaniu placebo (3,1%). Dzieci i młodzież W dwóch badaniach kontrolowanych placebo z udziałem dzieci w wieku od 6 do 11 miesięcy oraz dzieci w wieku od 1 do poniżej 6 lat, 159 pacjentom podawano lewocetyryzynę w dawce odpowiednio 1,25 mg na dobę przez 2 tygodnie oraz 1,25 mg dwa razy na dobę. Poniżej przedstawiono działania niepożądane zgłaszane po podaniu lewocetyryzyny lub placebo, występujące z częstością 1% lub większą. Biegunka: Placebo (n=83) 0, Lewocetyryzyna (n=159) 3 (1,9%) Wymioty: Placebo (n=83) 1 (1,2%), Lewocetyryzyna (n=159) 1 (0,6%) Zaparcia: Placebo (n=83) 0, Lewocetyryzyna (n=159) 2 (1,3%) Senność: Placebo (n=83) 2 (2,4%), Lewocetyryzyna (n=159) 3 (1,9%) Zaburzenia snu: Placebo (n=83) 0, Lewocetyryzyna (n=159) 2 (1,3%) W badaniach klinicznych z grupą kontrolną placebo, prowadzonych metodą podwójnie ślepej próby z udziałem dzieci w wieku od 6 do 12 lat, 243 dzieciom podawano lewocetyryzynę w dawce 5 mg na dobę przez różny okres – od krótszego niż 1 tydzień do 13 tygodni.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDziałania niepożądane
Poniżej przedstawiono działania niepożądane zgłaszane po podaniu lewocetyryzyny lub placebo, występujące z częstością 1% lub większą. Ból głowy: Placebo (n=240) 5 (2,1%), Lewocetyryzyna 5 mg (n=243) 2 (0,8%) Senność: Placebo (n=240) 1 (0,4%), Lewocetyryzyna 5 mg (n=243) 7 (2,9%) Okres po wprowadzeniu produktu do obrotu Działania niepożądane obserwowane po wprowadzeniu do obrotu przedstawiono według klasyfikacji układów i narządów oraz częstości występowania. Częstość występowania zdefiniowano w następujący sposób: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia układu immunologicznego: Częstość nieznana: nadwrażliwość, w tym anafilaksja. Zaburzenia metabolizmu i odżywiania: Częstość nieznana: zwiększone łaknienie.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDziałania niepożądane
Zaburzenia psychiczne: Częstość nieznana: agresja, pobudzenie, omamy, depresja, bezsenność, myśli samobójcze, koszmary senne. Zaburzenia układu nerwowego: Częstość nieznana: drgawki, parestezja, zawroty głowy (pochodzenia ośrodkowego), omdlenia, drżenie, zaburzenia smaku. Zaburzenia ucha i błędnika: Częstość nieznana: zawroty głowy (pochodzenia błędnikowego). Zaburzenia oka: Częstość nieznana: zaburzenia widzenia, niewyraźne widzenie, rotacyjne ruchy gałek ocznych. Zaburzenia serca: Częstość nieznana: kołatanie serca, tachykardia. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Częstość nieznana: duszność. Zaburzenia żołądka i jelit: Częstość nieznana: nudności, wymioty, biegunka. Zaburzenia wątroby i dróg żółciowych: Częstość nieznana: zapalenie wątroby. Zaburzenia nerek i dróg moczowych: Częstość nieznana: bolesne lub utrudnione oddawanie moczu, zatrzymanie moczu.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDziałania niepożądane
Zaburzenia skóry i tkanki podskórnej: Częstość nieznana: obrzęk naczynioruchowy, trwały wyprysk polekowy, świąd, wysypka, pokrzywka. Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Częstość nieznana: bóle mięśni, ból stawów. Zaburzenia ogólne i stany w miejscu podania: Częstość nieznana: obrzęk. Badania diagnostyczne: Częstość nieznana: zwiększenie masy ciała, nieprawidłowe wyniki testów czynności wątroby. Opis wybranych działań niepożądanych Zgłaszano przypadki świądu po przerwaniu stosowania lewocetyryzyny. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDziałania niepożądane
Jerozolimskie 181C, 02-222 Warszawa, tel: + 48 22 49 21 301, fax: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Xyzal, tabletki powlekane, 5 mgPrzedawkowanie
4.9 Przedawkowanie Objawy Objawy przedawkowania mogą obejmować senność u osób dorosłych. U dzieci może wystąpić początkowo pobudzenie i niepokój, zwłaszcza ruchowy, a następnie senność. Postępowanie w przypadku przedawkowania Nie jest znane specyficzne antidotum dla lewocetyryzyny. W przypadku przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Jeśli od przyjęcia produktu leczniczego upłynęło niewiele czasu, można rozważyć płukanie żołądka. Lewocetyryzyna nie jest skutecznie usuwana za pomocą hemodializy.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny; kod ATC: R06A E09. Mechanizm działania Lewocetyryzyna, (R)-enancjomer cetyryzyny jest silnym i wybiórczym antagonistą obwodowych receptorów histaminowych H1. Badania dotyczące wiązania z receptorami wykazały, że lewocetyryzyna ma duże powinowactwo do receptorów H1 u ludzi (Ki = 3,2 nmol/l). Lewocetyryzyna ma dwukrotnie większe powinowactwo niż cetyryzyna (Ki = 6,3 nmol/l). Okres półtrwania procesu odłączania lewocetyryzyny od receptorów H1 wynosi 115 ± 38 min. Po 4 godzinach od jednorazowego podania stwierdzono zablokowanie receptorów przez lewocetyryzynę w 90%, a po 24 godzinach w 57%. Badania farmakodynamiczne z udziałem zdrowych ochotników wykazały, że działanie dawki lewocetyryzyny równej połowie dawki cetyryzyny jest porównywalne do działania cetyryzyny, zarówno na skórę, jak i na błonę śluzową nosa.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
Działanie farmakodynamiczne Działanie farmakodynamiczne lewocetyryzyny oceniano w randomizowanych badaniach przeprowadzonych z grupą kontrolną. W badaniu porównującym wpływ stosowania lewocetyryzyny w dawce 5 mg, desloratadyny w dawce 5 mg i placebo na pohistaminowy bąbel i rumień, leczenie lewocetyryzyną powodowało istotne hamowanie powstawania bąbla i rumienia – działanie to było najsilniejsze w ciągu pierwszych 12 godzin i utrzymywało się przez 24 godziny, (p<0,001) w porównaniu z placebo i desloratadyną. W badaniach klinicznych z grupą kontrolną placebo, w modelu z użyciem komory prowokacyjnej początek działania lewocetyryzyny w dawce 5 mg w łagodzeniu objawów wywołanych ekspozycją na pyłki obserwowano po 1 godzinie od przyjęcia leku. Badania in vitro (komory Boydena i linie komórkowe) wykazały, że lewocetyryzyna hamuje indukowaną przez eotaksynę przezśródbłonkową migrację eozynofilów przez komórki skóry i płuc.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
W eksperymentalnym badaniu farmakodynamicznym in vivo (technika okienek skórnych) u 14 dorosłych pacjentów, w porównaniu z placebo, wykazano trzy główne działania hamujące lewocetyryzyny w dawce 5 mg w ciągu pierwszych 6 godzin reakcji wywołanej pyłkami: hamowanie uwalniania VCAM-1, zmianę przepuszczalności naczyń i zmniejszenie napływu eozynofilów. Skuteczność kliniczna i bezpieczeństwo stosowania Skuteczność i bezpieczeństwo stosowania lewocetyryzyny wykazano w kilku badaniach klinicznych przeprowadzonych z grupą kontrolną placebo, metodą podwójnie ślepej próby, z udziałem dorosłych pacjentów z sezonowym alergicznym zapaleniem błony śluzowej nosa, całorocznym alergicznym zapaleniem błony śluzowej nosa lub przewlekłym alergicznym zapaleniem błony śluzowej nosa. W niektórych badaniach wykazano, że lewocetyryzyna w istotnym stopniu łagodzi objawy alergicznego zapalenia błony śluzowej nosa, w tym uczucie zatkania nosa.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
W trwającym 6 miesięcy badaniu klinicznym z udziałem 551 dorosłych pacjentów (w tym 276 pacjentów leczonych lewocetyryzyną) z przewlekłym alergicznym zapaleniem błony śluzowej nosa (objawy występowały przez 4 dni w tygodniu, przez co najmniej 4 kolejne tygodnie) i uczulonych na roztocza kurzu domowego i pyłki traw wykazano, że lewocetyryzyna w dawce 5 mg była klinicznie i statystycznie istotnie bardziej skuteczna niż placebo w łagodzeniu objawów alergicznego zapalenia błony śluzowej nosa ocenianych w skali TSS (punktowy wskaźnik nasilenia objawów klinicznych, ang. total symptom score - TSS) przez cały czas trwania badania; nie występowało zjawisko tachyfilaksji. Przez cały czas trwania badania lewocetyryzyna istotnie poprawiała jakość życia pacjentów. W badaniu klinicznym z grupą kontrolną placebo, w którym uczestniczyło 166 pacjentów z przewlekłą pokrzywką idiopatyczną, 85 pacjentów przyjmowało placebo, a 81 lewocetyryzynę w dawce 5 mg raz na dobę przez 6 tygodni.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
Leczenie lewocetyryzyną w porównaniu z placebo powodowało istotne zmniejszenie nasilenia świądu w pierwszym tygodniu oraz w całym okresie leczenia. Stosowanie lewocetyryzyny w porównaniu z placebo powodowało także większą poprawę zależnej od stanu zdrowia jakości życia pacjentów, ocenianej na podstawie wskaźnika wpływu dolegliwości skórnych na jakość życia (ang. Dermatology Life Quality Index). Przewlekła idiopatyczna pokrzywka była badana jako model zaburzeń pokrzywkowych. Ponieważ uwalnianie histaminy jest czynnikiem związanym z występowaniem pokrzywki można oczekiwać, że lewocetyryzyna będzie skuteczna w łagodzeniu objawów innych rodzajów pokrzywek, nie tylko przewlekłej idiopatycznej pokrzywki. W zapisach EKG nie wykazano znaczącego wpływu lewocetyryzyny na odstęp QT. Dzieci i młodzież Bezpieczeństwo stosowania i skuteczność lewocetyryzyny w postaci tabletek u dzieci oceniano w dwóch badaniach klinicznych z grupą kontrolną placebo, w których uczestniczyli pacjenci w wieku od 6 do 12 lat z sezonowym i całorocznym alergicznym zapaleniem błony śluzowej nosa.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
W obydwu badaniach lewocetyryzyna znacząco łagodziła objawy i poprawiała zależną od stanu zdrowia jakość życia pacjentów. Bezpieczeństwo kliniczne u dzieci w wieku poniżej 6 lat ustalono na podstawie kilku krótko- i długoterminowych badań klinicznych: badanie kliniczne, w którym 29 dzieci w wieku od 2 do 6 lat z alergicznym zapaleniem błony śluzowej nosa leczono lewocetyryzyną w dawce 1,25 mg podawaną dwa razy na dobę przez 4 tygodnie badanie kliniczne, w którym 114 dzieci w wieku od 1 roku do 5 lat z alergicznym zapaleniem błony śluzowej nosa lub przewlekłą pokrzywką idiopatyczną leczono lewocetyryzyną w dawce 1,25 mg podawaną dwa razy na dobę przez 2 tygodnie badanie kliniczne, w którym 45 dzieci w wieku od 6 do 11 miesięcy z alergicznym zapaleniem błony śluzowej nosa lub przewlekłą pokrzywką idiopatyczną leczono lewocetyryzyną w dawce 1,25 mg podawaną raz na dobę przez 2 tygodnie długoterminowe (18-miesięczne) badanie kliniczne z udziałem 255 pacjentów z chorobą atopową leczonych lewocetyryzyną, będących w wieku od 12 do 24 miesięcy w momencie włączania do badania.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakodynamiczne
Profil bezpieczeństwa był podobny do profilu obserwowanego w badaniach krótkoterminowych prowadzonych z udziałem dzieci w wieku od 1 do 5 lat.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Farmakokinetyka lewocetyryzyny ma przebieg liniowy i jest niezależna od dawki i czasu, oraz wykazuje małą zmienność osobniczą. Profil farmakokinetyczny w przypadku podania samego enancjomeru jest taki sam, jak w przypadku podania cetyryzyny. Podczas procesu wchłaniania i eliminacji nie dochodzi do odwrócenia chiralności. Wchłanianie Po podaniu doustnym lewocetyryzyna wchłania się szybko i w znacznym stopniu. Maksymalne stężenie w osoczu występuje 0,9 h po podaniu. Stan stacjonarny jest osiągany po dwóch dniach. Stężenie maksymalne wynosi zwykle 270 ng/ml i 308 ng/ml, odpowiednio po jednorazowym i wielokrotnym doustnym podaniu dawki 5 mg. Stopień wchłaniania nie zależy od dawki ani od przyjmowania pokarmu, natomiast maksymalne stężenie jest zmniejszone i występuje później. Dystrybucja Nie ma dostępnych danych dotyczących tkankowej dystrybucji lewocetyryzyny u ludzi i przenikania lewocetyryzyny przez barierę krew-mózg.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
U szczurów i psów największe stężenia leku stwierdzono w wątrobie i nerkach, najmniejsze w kompartmencie ośrodkowego układu nerwowego. U ludzi lewocetyryzyna w 90% wiąże się z białkami osocza. Dystrybucja lewocetyryzyny jest ograniczona, ponieważ jej objętość dystrybucji wynosi 0,4 l/kg. Metabolizm U ludzi metabolizowane jest mniej niż 14% dawki lewocetyryzyny, dlatego różnice wynikające z polimorfizmu genetycznego lub równoczesnego przyjmowania inhibitorów enzymatycznych uważa się za mało istotne. Szlaki metaboliczne obejmują: utlenianie pierścienia aromatycznego, N- i O-dealkilację oraz sprzęganie z tauryną. Reakcje dealkilacji przebiegają głównie z udziałem CYP 3A4, natomiast utlenianie pierścienia aromatycznego przebiega z udziałem licznych i (lub) niezidentyfikowanych izoform CYP. Lewocetyryzyna w stężeniach znacznie większych niż stężenia maksymalne występujące po podaniu dawki doustnej 5 mg, nie miała wpływu na aktywność izoenzymów CYP 1A2, 2C9, 2C19, 2D6, 2E1 i 3A4.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Ze względu na słaby metabolizm i brak możliwości hamowania metabolizmu, wzajemne interakcje lewocetyryzyny z innymi substancjami są mało prawdopodobne. Eliminacja Okres półtrwania w osoczu u osób dorosłych wynosi 7,9 ± 1,9 godziny. Okres półtrwania u małych dzieci jest krótszy. Średni pozorny całkowity klirens u dorosłych wynosi 0,63 ml/min/kg mc. Lewocetyryzyna i jej metabolity wydalane są głównie z moczem, średnio 85,4% dawki. Z kałem wydalane jest tylko 12,9% dawki. Lewocetyryzyna jest wydalana zarówno w wyniku przesączania kłębuszkowego, jak i aktywnego wydzielania kanalikowego. Specjalne grupy pacjentów Zaburzenia czynności nerek Pozorny klirens lewocetyryzyny zależy od klirensu kreatyniny. Dlatego u pacjentów z umiarkowanymi i ciężkimi zaburzeniami czynności nerek zaleca się dostosowanie odstępów pomiędzy kolejnymi dawkami lewocetyryzyny (patrz punkt 4.2).
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
U osób ze schyłkową niewydolnością nerek z bezmoczem całkowity klirens leku z organizmu jest zmniejszony o około 80% w porównaniu z osobami zdrowymi. Ilość lewocetyryzyny usunięta w czasie standardowego czterogodzinnego zabiegu hemodializy wynosiła < 10%. Dzieci i młodzież Dane z badania oceniającego farmakokinetykę u dzieci, w którym 14 dzieciom w wieku od 6 do 11 lat, o masie ciała od 20 do 40 kg podawano doustnie lewocetyryzynę w pojedynczej dawce 5 mg, wykazały w porównaniu krzyżowym, że wartości Cmax i AUC były około 2-krotnie większe niż u zdrowych dorosłych ochotników. Średnie stężenie maksymalne (Cmax) wynosiło 450 ng/ml i było osiągane średnio po 1,2 godziny; znormalizowany względem masy ciała klirens całkowity był o 30% większy, a okres półtrwania eliminacji był o 24% krótszy u dzieci niż u osób dorosłych. Nie przeprowadzono badań farmakokinetycznych u dzieci w wieku poniżej 6 lat.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Przeprowadzono retrospektywną analizę farmakokinetyczną w populacji 323 pacjentów (181 dzieci w wieku od 1 do 5 lat, 18 dzieci w wieku od 6 do 11 lat i 124 dorosłych w wieku od 18 do 55 lat), którzy otrzymywali lewocetyryzynę w dawce pojedynczej lub w dawkach wielokrotnych od 1,25 mg do 30 mg. Uzyskane z tej analizy dane wskazują, że przewidywane stężenie w osoczu po podaniu dawki 1,25 mg raz na dobę dzieciom w wieku od 6 miesięcy do 5 lat jest podobne do stężenia w osoczu osób dorosłych otrzymujących dawkę 5 mg raz na dobę. Pacjenci w podeszłym wieku Dane dotyczące farmakokinetyki u osób w podeszłym wieku są ograniczone. Po wielokrotnym podaniu doustnym lewocetyryzyny w dawce 30 mg raz na dobę dziewięciu pacjentom w podeszłym wieku (65– 74 lat) przez okres 6 dni, klirens całkowity był o około 33% mniejszy niż u młodszych dorosłych. Wykazano, że rozkład cetyryzyny (racematu) jest zależny raczej od czynności nerek niż od wieku.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Zależność ta dotyczy również lewocetyryzyny, ponieważ zarówno lewocetyryzyna, jak i cetyryzyna są wydalane głównie z moczem. Dlatego u pacjentów w podeszłym wieku dawkę lewocetyryzyny należy dostosować do czynności nerek. Płeć Poddano ocenie potencjalną zależność farmakokinetyki leku od płci (badanie z udziałem 77 pacjentów: 40 mężczyzn i 37 kobiet). Okres półtrwania był nieznacznie krótszy u kobiet (7,08 ± 1,72 godziny) niż u mężczyzn (8,62 ± 1,84 godziny); jednak wydaje się, że klirens po podaniu doustnym dawki dostosowanej do masy ciała u kobiet (0,67 ± 0,16 ml/min/kg mc.) jest porównywalny z klirensem u mężczyzn (0,59 ± 0,12 ml/min/kg mc.). U mężczyzn i kobiet z prawidłową czynnością nerek stosuje się takie same dawki dobowe, z zachowaniem takich samych odstępów pomiędzy dawkami. Rasa Nie zbadano wpływu rasy na działanie lewocetyryzyny.
- CHPL leku Xyzal, tabletki powlekane, 5 mgWłaściwości farmakokinetyczne
Ze względu na fakt, że lewocetyryzyna jest wydalana głównie przez nerki, a nie istnieją ważne, zależne od rasy różnice w klirensie kreatyniny, nie należy się spodziewać istnienia zależnych od rasy różnic we właściwościach farmakokinetycznych lewocetyryzyny. Nie obserwowano związanych z rasą różnic w kinetyce cetyryzyny (racematu). Zaburzenia czynności wątroby Nie badano farmakokinetyki lewocetyryzyny u pacjentów z zaburzeniami czynności wątroby. U pacjentów z przewlekłymi chorobami wątroby (wątrobowokomórkowymi, cholestatycznymi lub z żółciową marskością wątroby), którym podawano 10 lub 20 mg cetyryzyny (racematu) w dawce pojedynczej, obserwowano wydłużenie okresu półtrwania o 50% przy jednoczesnym zmniejszeniu klirensu o 40% w porównaniu ze zdrowymi osobami. Zależności farmakokinetyczno-farmakodynamiczne Wpływ na reakcje skórne wywołane przez histaminę nie jest związany ze stężeniem leku w osoczu.
- CHPL leku Xyzal, tabletki powlekane, 5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Xyzal, tabletki powlekane, 5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń: Celuloza mikrokrystaliczna Laktoza jednowodna Krzemionka koloidalna bezwodna Magnezu stearynian Otoczka: Opadry Y-1-7000 w skład, której wchodzą: Hypromeloza (E 464) Tytanu dwutlenek (E 171) Makrogol 400 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 4 lata. 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania. 6.5 Rodzaj i zawartość opakowania Blister Aluminium/OPA/Aluminium/PVC w tekturowym pudełku. Wielkości opakowań: 1, 2, 4, 5, 7, 10, 2 ×10, 10 × 10, 14, 15, 20, 21, 28, 30, 40, 50, 60, 70, 90, 100. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Xyzal, 0,5 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu doustnego zawiera 0,5 mg lewocetyryzyny dichlorowodorku (Levocetirizini dihydrochloridum). Substancje pomocnicze o znanym działaniu: 0,675 mg metylu parahydroksybenzoesanu/ml 0,075 mg propylu parahydroksybenzoesanu/ml 0,4 g maltitolu ciekłego/ml Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór doustny. Klarowny i bezbarwny roztwór.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Xyzal, 0,5 mg/ml, roztwór doustny jest wskazany w objawowym leczeniu alergicznego zapalenia błony śluzowej nosa (w tym przewlekłego alergicznego zapalenia błony śluzowej nosa) i pokrzywki u dorosłych i dzieci w wieku od 2 lat.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i młodzież w wieku od 12 lat: Zalecana dawka dobowa wynosi 5 mg (10 ml roztworu). Osoby w podeszłym wieku: U pacjentów w podeszłym wieku z umiarkowanymi do ciężkich zaburzeniami czynności nerek zaleca się dostosowanie dawki leku (patrz punkt poniżej „Zaburzenia czynności nerek”). Zaburzenia czynności nerek Odstępy czasu pomiędzy kolejnymi dawkami muszą być ustalone indywidualnie w zależności od stopnia wydolności nerek [szacowany współczynnik filtracji kłębuszkowej, (ang. estimated Glomerular Filtration Rate, eGFR)]. Dawkowanie należy zmodyfikować zgodnie z poniższą tabelą. Dostosowanie dawki u pacjentów z zaburzeniami czynności nerek: Prawidłowa czynność nerek ≥ 90: 5 mg raz na dobę Łagodne zaburzenia czynności nerek 60 – < 90: 5 mg raz na dobę Umiarkowane zaburzenia czynności nerek 30 – < 60: 5 mg co drugi dzień Ciężkie zaburzenia czynności nerek 15 – < 30 (pacjent nie wymagający dializy): 5 mg co trzeci dzień Schyłkowa niewydolność nerek (ang.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlDawkowanie
End Stage Renal Disease, ESRD) < 15 (pacjent wymagający dializy): Produkt leczniczy przeciwwskazany U dzieci i młodzieży z zaburzeniami czynności nerek dawkę należy dostosować indywidualnie po uwzględnieniu klirensu nerkowego i masy ciała pacjenta. Brak szczegółowych danych dotyczących stosowania u dzieci z zaburzeniami czynności nerek. Zaburzenia czynności wątroby Nie jest konieczne dostosowanie dawki u pacjentów wyłącznie z zaburzeniami czynności wątroby. U pacjentów z zaburzeniami czynności wątroby oraz zaburzeniami czynności nerek zaleca się dostosowanie dawki (patrz powyżej „Zaburzenia czynności nerek”). Dzieci i młodzież Dzieci w wieku od 6 do 12 lat: Zalecana dawka dobowa wynosi 5 mg (10 ml roztworu). Dzieci w wieku od 2 do 6 lat: Zalecana dawka dobowa wynosi 2,5 mg podawana w dwóch dawkach po 1,25 mg (2,5 ml roztworu dwa razy na dobę).
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlDawkowanie
Dostępne dane kliniczne dotyczące dzieci w wieku od 6 miesięcy do 12 lat (patrz punkt 4.8, 5.1 i 5.2) nie są wystarczające, aby uzasadnić zastosowanie lewocetyryzyny u niemowląt i dzieci w wieku poniżej 2 lat (patrz również punkt 4.4). Sposób podawania Do opakowania dołączona jest strzykawka doustna. Odpowiednią objętość roztworu doustnego należy odmierzyć strzykawką, a następnie przelać roztwór na łyżkę lub dodać do szklanki wody. Roztwór należy wypić bezpośrednio po jego rozcieńczeniu. Produkt można przyjmować z posiłkiem lub niezależnie od posiłku. Czas trwania leczenia: Okresowe alergiczne zapalenie błony śluzowej nosa (objawy występujące rzadziej niż cztery dni w tygodniu lub utrzymujące się krócej niż cztery tygodnie w roku) należy leczyć zgodnie z przebiegiem choroby; leczenie można przerwać od razu po ustąpieniu objawów i wznowić po ponownym ich wystąpieniu.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlDawkowanie
W przypadku przewlekłego alergicznego zapalenia błony śluzowej nosa (objawy występujące częściej niż cztery dni w tygodniu lub utrzymujące się dłużej niż cztery tygodnie w roku) można zalecić pacjentowi kontynuowanie leczenia w okresie ekspozycji na alergeny. Doświadczenie kliniczne dotyczące stosowania lewocetyryzyny obejmuje co najmniej 6-miesięczny okres leczenia. Doświadczenie kliniczne z zastosowaniem cetyryzyny (racemat) w leczeniu przewlekłej pokrzywki i przewlekłego alergicznego zapalenia błony śluzowej nosa obejmuje okres do 1 roku.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną, cetyryzynę, hydroksyzynę, jakiekolwiek inne pochodne piperazyny lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Pacjenci ze schyłkową niewydolnością nerek z szacowanym współczynnikiem przesączania kłębuszkowego (eGFR) poniżej 15 ml/min (wymagający dializy).
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy zachować ostrożność podczas przyjmowania leku jednocześnie z alkoholem (patrz punkt 4.5). Xyzal zawiera metylu parahydroksybenzoesan i propylu parahydroksybenzoesan, które mogą wywoływać reakcje alergiczne (możliwe reakcje typu późnego). Lewocetyryzyna może powodować nasilenie napadów padaczkowych, z tego względu należy zachować ostrożność u pacjentów z padaczką oraz u pacjentów z ryzykiem wystąpienia drgawek. Xyzal zawiera maltitol ciekły. Produkt nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją fruktozy. Należy zachować ostrożność u pacjentów z ryzykiem zatrzymania moczu (np.: uszkodzenie rdzenia kręgowego, rozrost gruczołu krokowego), ponieważ lewocetyryzyna może zwiększać ryzyko zatrzymania moczu. Leki przeciwhistaminowe hamują reakcję alergiczną w testach skórnych, dlatego zaleca się odstąpienie leków przeciwhistaminowych na 3 dni przed wykonaniem testów.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlSpecjalne środki ostrozności
W przypadku przerwania stosowania lewocetyryzyny możliwe jest wystąpienie świądu, nawet jeśli objawy te nie występowały przed rozpoczęciem leczenia. Te objawy mogą ustąpić samoistnie. W niektórych przypadkach objawy te mogą być intensywne i może być konieczne wznowienie leczenia. Objawy powinny ustąpić po wznowieniu leczenia. Dzieci i młodzież: Dostępne dane kliniczne dotyczące dzieci w wieku od 6 miesięcy do 12 lat (patrz punkty 4.8, 5.1 i 5.2) nie są wystarczające, aby uzasadnić zastosowanie lewocetyryzyny u niemowląt i dzieci w wieku poniżej 2 lat. Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na ml, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań dotyczących interakcji lewocetyryzyny (w tym badań z induktorami CYP3A4); badania z zastosowaniem cetyryzyny (racemat) nie wykazały istotnych klinicznie niepożądanych interakcji (z antypiryną, azytromycyną, cymetydyną, diazepamem, erytromycyną, glipizydem, ketokonazolem i pseudoefedryną). W badaniu po podaniu wielokrotnym z teofiliną (400 mg raz na dobę) zaobserwowano niewielkie zmniejszenie klirensu cetyryzyny (16%); natomiast jednoczesne podawanie cetyryzyny nie wpływało na ekspozycję na teofilinę. W badaniu po podaniu wielokrotnym rytonawiru (600 mg dwa razy na dobę) i cetyryzyny (10 mg na dobę), ekspozycja na cetyryzynę zwiększyła się o około 40%, podczas gdy ekspozycja na rytonawir podczas jednoczesnego podawania cetyryzyny zmieniła się nieznacznie (-11%). Podawanie z pokarmem nie zmniejsza stopnia wchłaniania lewocetyryzyny, natomiast zmniejsza szybkość jej wchłaniania.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlInterakcje
U wrażliwych pacjentów jednoczesne podawanie cetyryzyny lub lewocetyryzyny z alkoholem lub innymi substancjami hamującymi czynność OUN, może spowodować dodatkowe obniżenie czujności i zdolności reagowania.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak danych lub istnieją ograniczone dane (mniej niż 300 ciąż) dotyczące stosowania lewocetyryzyny u kobiet w ciąży. Jednak, dane otrzymane z dużej liczby zastosowań cetyryzyny (racemat) u kobiet w ciąży (ponad 1000 ciąż) nie wskazują, aby wywoływała ona wady rozwojowe lub działała toksycznie na płód i noworodka. Badania na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i (lub) płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3). Można rozważyć zastosowanie lewocetyryzyny w okresie ciąży, jeżeli jest to konieczne. Karmienie piersi? Wykazano, że cetyryzyna (racemat) przenika do mleka u ludzi. Dlatego też, jest prawdopodobne, że lewocetyryzyna przenika do mleka u ludzi. U niemowląt karmionych piersią mogą wystąpić działania niepożądane związane z lewocetyryzyną. Dlatego należy zachować ostrożność przepisując lewocetyryzynę kobietom karmiącym piersią.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWpływ na płodność, ciążę i laktację
Płodność Brak danych klinicznych dotyczących lewocetyryzyny.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn W porównawczych badaniach klinicznych nie wykazano, aby lewocetyryzyna w zalecanej dawce osłabiała koncentrację uwagi, zdolność reagowania lub zdolność prowadzenia pojazdów lub obsługiwania maszyn. Jednakże niektórzy pacjenci mogą odczuwać senność, zmęczenie i osłabienie podczas leczenia lewocetyryzyną. Dlatego pacjenci zamierzający prowadzić pojazdy, wykonywać potencjalnie niebezpieczne czynności lub obsługiwać maszyny, powinni wziąć pod uwagę swoją reakcję na produkt leczniczy.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlDziałania niepożądane
4.8 Działania niepożądane Badania kliniczne Dorośli i młodzież w wieku powyżej 12 lat W badaniach klinicznych z udziałem kobiet i mężczyzn w wieku od 12 do 71 lat wystąpiło co najmniej jedno działanie niepożądane u 15,1% pacjentów w grupie otrzymującej lewocetyryzynę w dawce 5 mg, w porównaniu z 11,3% pacjentów z grupy otrzymującej placebo. 91,6% tych działań niepożądanych miało nasilenie łagodne lub umiarkowane. W badaniach klinicznych odsetek pacjentów, którzy nie ukończyli badania z powodu wystąpienia działań niepożądanych, wynosił 1% (9/935) w grupie otrzymującej lewocetyryzynę w dawce 5 mg i 1,8% (14/771) w grupie otrzymującej placebo. W badaniach klinicznych z zastosowaniem lewocetyryzyny uczestniczyło 935 osób, którym podawano produkt leczniczy w zalecanej dawce 5 mg na dobę.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlDziałania niepożądane
W tej grupie następujące działania niepożądane po zastosowaniu lewocetyryzyny w dawce 5 mg lub placebo notowano z częstością 1% lub większą (często: ≥1/100 do <1/10): Ból głowy 25 (3,2%) 24 (2,6%) Senność 11 (1,4%) 49 (5,2%) Suchość w jamie ustnej 12 (1,6%) 24 (2,6%) Zmęczenie 9 (1,2%) 23 (2,5%) Obserwowano także działania niepożądane występujące niezbyt często (niezbyt często: ≥1/1000 do <1/100), takie jak osłabienie lub bóle brzucha. Przypadki sedatywnych działań niepożądanych, takich jak: senność, zmęczenie i osłabienie, występowały częściej po podaniu lewocetyryzyny w dawce 5 mg (8,1%) niż po podaniu placebo (3,1%). Dzieci i młodzież W dwóch kontrolowanych placebo badaniach z udziałem dzieci w wieku od 6 do 11 miesięcy oraz w wieku od 1 do poniżej 6 lat, 159 pacjentom podawano lewocetyryzynę w dawce odpowiednio 1,25 mg na dobę przez 2 tygodnie oraz 1,25 mg dwa razy na dobę.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlDziałania niepożądane
Poniżej przedstawiono działania niepożądane po zastosowaniu lewocetyryzyny lub placebo występujące z częstością 1% lub większą. Biegunka 0 3 (1,9%) Wymioty 1 (1,2%) 1 (0,6%) Zaparcia 0 2 (1,3%) Senność 2 (2,4%) 3 (1,9%) Zaburzenia snu 0 2 (1,3%) W badaniach klinicznych z grupą kontrolną placebo, prowadzonych metodą podwójnie ślepej próby z udziałem dzieci w wieku od 6 do 12 lat, 243 dzieciom podawano lewocetyryzynę w dawce 5 mg na dobę przez różny okres – od krótszego niż 1 tydzień do 13 tygodni. Poniżej przedstawiono działania niepożądane zgłaszane po podaniu lewocetyryzyny lub placebo, występujące z częstością 1% lub większą. Ból głowy 5 (2,1%) 2 (0,8%) Senność 1 (0,4%) 7 (2,9%) Zgodnie z zapisami w punktach 4.2 i 4.4 dostępne dane kliniczne dotyczące dzieci w wieku od 6 miesięcy do 12 lat są niewystarczające, aby uzasadnić stosowanie lewocetyryzyny u niemowląt i dzieci w wieku poniżej 2 lat.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlDziałania niepożądane
Okres po wprowadzeniu produktu do obrotu Działania niepożądane obserwowane po wprowadzeniu produktu do obrotu przedstawiono według klasyfikacji układów i narządów oraz częstości występowania. Częstość występowania zdefiniowano w następujący sposób: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia układu immunologicznego: Częstość nieznana: nadwrażliwość, w tym anafilaksja Zaburzenia metabolizmu i odżywiania: Częstość nieznana: zwiększone łaknienie Zaburzenia psychiczne: Częstość nieznana: agresja, pobudzenie, omamy, depresja, bezsenność, myśli samobójcze, koszmary senne Zaburzenia układu nerwowego: Częstość nieznana: drgawki, parestezje, zawroty głowy (pochodzenia ośrodkowego), omdlenia, drżenie, zaburzenia smaku Zaburzenia ucha i błędnika: Częstość nieznana: zawroty głowy (pochodzenia błędnikowego) Zaburzenia oka: Częstość nieznana: zaburzenia widzenia, niewyraźne widzenie, rotacyjne ruchy gałek ocznych Zaburzenia serca: Częstość nieznana: kołatanie serca, tachykardia Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Częstość nieznana: duszność Zaburzenia żołądka i jelit: Częstość nieznana: nudności, wymioty, biegunka Zaburzenia wątroby i dróg żółciowych: Częstość nieznana: zapalenie wątroby Zaburzenia nerek i dróg moczowych: Częstość nieznana: bolesne lub utrudnione oddawanie moczu, zatrzymanie moczu Zaburzenia skóry i tkanki podskórnej: Częstość nieznana: obrzęk naczynioruchowy, trwały wyprysk polekowy, świąd, wysypka, pokrzywka Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Częstość nieznana: bóle mięśni, ból stawów Zaburzenia ogólne i stany w miejscu podania: Częstość nieznana: obrzęk Badania diagnostyczne: Częstość nieznana: zwiększenie masy ciała, nieprawidłowe wyniki testów czynności wątroby Metylu parahydroksybenzoesan i propylu parahydroksybenzoesan mogą powodować reakcje alergiczne (możliwe reakcje typu późnego).
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlDziałania niepożądane
Opis wybranych działań niepożądanych Zgłaszano przypadki świądu po przerwaniu stosowania lewocetyryzyny. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel: + 48 22 49 21 301, fax: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy Objawy przedawkowania mogą obejmować senność u osób dorosłych. U dzieci może wystąpić początkowo pobudzenie i niepokój, zwłaszcza ruchowy, a następnie senność. Postępowanie w razie przedawkowania Nie jest znane specyficzne antidotum dla lewocetyryzyny. W przypadku przedawkowania zaleca się leczenie objawowe lub podtrzymujące. Wkrótce po przyjęciu produktu leczniczego można rozważyć płukanie żołądka. Lewocetyryzyna nie jest skutecznie usuwana za pomocą hemodializy.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwhistaminowe do stosowania ogólnego, pochodne piperazyny; kod ATC: R06A E09. Mechanizm działania Lewocetyryzyna, (R)-enancjomer cetyryzyny jest silnym i wybiórczym antagonistą obwodowych receptorów histaminowych H1. Badania dotyczące wiązania z receptorami wykazały, że lewocetyryzyna ma duże powinowactwo do receptorów H1 u ludzi (Ki = 3,2 nmol/l). Lewocetyryzyna ma dwukrotnie większe powinowactwo niż cetyryzyna (Ki = 6,3 nmol/l). Okres półtrwania dysocjacji lewocetyryzyny od receptorów H1 wynosi 115 ± 38 min. Po 4 godzinach od jednorazowego podania stwierdzono zablokowanie receptorów przez lewocetyryzynę w 90%, a po 24 godzinach w 57%. Działanie farmakodynamiczne Działanie farmakodynamiczne lewocetyryzyny oceniano w randomizowanych badaniach przeprowadzonych z grupą kontrolną.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWłaściwości farmakodynamiczne
W badaniu porównującym wpływ lewocetyryzyny w dawce 5 mg, desloratadyny w dawce 5 mg i placebo na pohistaminowy bąbel i rumień, leczenie lewocetyryzyną powodowało istotne hamowanie powstawania bąbla i rumienia – działanie to było najsilniejsze w ciągu pierwszych 12 godzin i utrzymywało się przez 24 godziny, (p<0,001) w porównaniu z placebo i desloratadyną. W badaniach klinicznych z grupą kontrolną placebo, w modelu z użyciem komory prowokacyjnej, początek działania lewocetyryzyny w dawce 5 mg w łagodzeniu objawów wywołanych ekspozycją na pyłki obserwowano po 1 godzinie od przyjęcia leku. Badania in vitro (komory Boydena i linie komórkowe) wykazały, że lewocetyryzyna hamuje indukowaną przez eotaksynę przezśródbłonkową migrację eozynofilów przez komórki skóry i płuc. W eksperymentalnym badaniu farmakodynamicznym in vivo (technika okienek skórnych) u 14 dorosłych pacjentów, w porównaniu z placebo, wykazano trzy główne działania hamujące lewocetyryzyny w dawce 5 mg w ciągu pierwszych 6 godzin reakcji wywołanej pyłkami: hamowanie uwalniania VCAM-1, zmianę przepuszczalności naczyń i zmniejszenie napływu eozynofilów.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWłaściwości farmakodynamiczne
Skuteczność kliniczna i bezpieczeństwo stosowania Skuteczność i bezpieczeństwo stosowania lewocetyryzyny wykazano w kilku badaniach klinicznych przeprowadzonych z grupą kontrolną placebo, metodą podwójnie ślepej próby, z udziałem dorosłych pacjentów z sezonowym alergicznym zapaleniem błony śluzowej nosa, całorocznym alergicznym zapaleniem błony śluzowej nosa lub przewlekłym alergicznym zapaleniem błony śluzowej nosa. W niektórych badaniach wykazano, że lewocetyryzyna w istotnym stopniu łagodzi objawy alergicznego zapalenia błony śluzowej nosa, w tym uczucie zatkania nosa. W trwającym 6 miesięcy badaniu klinicznym z udziałem 551 dorosłych pacjentów (w tym 276 pacjentów leczonych lewocetyryzyną) z przewlekłym alergicznym zapaleniem błony śluzowej nosa (objawy występowały przez 4 dni w tygodniu, przez co najmniej 4 kolejne tygodnie) i uczulonych na roztocza kurzu domowego i pyłki traw wykazano, że lewocetyryzyna w dawce 5 mg była klinicznie i statystycznie istotnie bardziej skuteczna niż placebo w łagodzeniu objawów alergicznego zapalenia błony śluzowej nosa ocenianych w skali TSS (punktowy wskaźnik nasilenia objawów klinicznych, ang.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWłaściwości farmakodynamiczne
total symptom score - TSS) przez cały czas trwania badania; nie występowało zjawisko tachyfilaksji. Przez cały czas trwania badania lewocetyryzyna istotnie poprawiała jakość życia pacjentów. W badaniu klinicznym z grupą kontrolną placebo, w którym uczestniczyło 166 pacjentów z przewlekłą pokrzywką idiopatyczną, 85 pacjentów przyjmowało placebo, a 81 lewocetyryzynę w dawce 5 mg raz na dobę przez 6 tygodni. Leczenie lewocetyryzyną w porównaniu z placebo powodowało istotne zmniejszenie nasilenia świądu w pierwszym tygodniu oraz w całym okresie leczenia. Stosowanie lewocetyryzyny w porównaniu z placebo powodowało także większą poprawę zależnej od stanu zdrowia jakości życia pacjentów ocenianej na podstawie wskaźnika wpływu dolegliwości skórnych na jakość życia (ang. Dermatology Life Quality Index). Przewlekła idiopatyczna pokrzywka była badana jako model zaburzeń pokrzywowych.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWłaściwości farmakodynamiczne
Ponieważ uwalnianie histaminy jest czynnikiem związanym z występowaniem pokrzywki można oczekiwać, że lewocetyryzyna będzie skuteczna w łagodzeniu objawów innych rodzajów pokrzywek, nie tylko przewlekłej idiopatycznej pokrzywki. W zapisach EKG nie wykazano znaczącego wpływu lewocetyryzyny na odstęp QT. Dzieci i młodzież Bezpieczeństwo stosowania i skuteczność lewocetyryzyny w postaci tabletek u dzieci oceniano w dwóch badaniach klinicznych z grupą kontrolną placebo, w których uczestniczyli pacjenci w wieku od 6 do 12 lat z sezonowym i całorocznym alergicznym zapaleniem błony śluzowej nosa. W obydwu badaniach lewocetyryzyna znacząco łagodziła objawy i poprawiała zależną od stanu zdrowia jakość życia pacjentów. Bezpieczeństwo kliniczne u dzieci w wieku poniżej 6 lat ustalono na podstawie kilku krótko- i długoterminowych badań klinicznych: badanie kliniczne, w którym 29 dzieci w wieku od 2 do 6 lat z alergicznym zapaleniem błony śluzowej nosa leczono lewocetyryzyną w dawce 1,25 mg podawaną dwa razy na dobę przez 4 tygodnie badanie kliniczne, w którym 114 dzieci w wieku od 1 roku do 5 lat z alergicznym zapaleniem błony śluzowej nosa lub przewlekłą pokrzywką idiopatyczną leczono lewocetyryzyną w dawce 1,25 mg podawaną dwa razy na dobę przez 2 tygodnie badanie kliniczne, w którym 45 dzieci w wieku od 6 do 11 miesięcy z alergicznym zapaleniem błony śluzowej nosa lub przewlekłą pokrzywką idiopatyczną leczono lewocetyryzyną w dawce 1,25 mg podawaną raz na dobę przez 2 tygodnie długoterminowe (18-miesięczne) badanie kliniczne z udziałem 255 pacjentów z chorobą atopową leczonych lewocetyryzyną, będących w wieku od 12 do 24 miesięcy w momencie włączania do badania.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWłaściwości farmakodynamiczne
Profil bezpieczeństwa był podobny do profilu obserwowanego w badaniach krótkoterminowych prowadzonych z udziałem dzieci w wieku od 1 do 5 lat.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Farmakokinetyka lewocetyryzyny ma przebieg liniowy i jest niezależna od dawki i czasu, oraz wykazuje małą zmienność osobniczą. Profil farmakokinetyczny w przypadku podania samego enancjomeru jest taki sam, jak w przypadku podania cetyryzyny. Podczas procesu wchłaniania i eliminacji nie dochodzi do odwrócenia chiralności. Wchłanianie Po podaniu doustnym lewocetyryzyna wchłania się szybko i w znacznym stopniu. U dorosłych maksymalne stężenie w osoczu występuje 0,9 godziny po podaniu. Stan stacjonarny jest osiągany po dwóch dniach. Stężenie maksymalne wynosi zwykle 270 ng/ml i 308 ng/ml, odpowiednio po jednorazowym i wielokrotnym doustnym podaniu dawki 5 mg. Stopień wchłaniania nie zależy od dawki ani od przyjmowania pokarmu, natomiast maksymalne stężenie jest zmniejszone i występuje później.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWłaściwości farmakokinetyczne
Dystrybucja Nie ma dostępnych danych dotyczących tkankowej dystrybucji lewocetyryzyny do tkanek u ludzi i przenikania lewocetyryzyny przez barierę krew-mózg. U szczurów i psów największe stężenia leku stwierdzono w wątrobie i nerkach, a najmniejsze w kompartmencie ośrodkowego układu nerwowego. U ludzi lewocetyryzyna w 90% wiąże się z białkami osocza. Dystrybucja lewocetyryzyny jest ograniczona, ponieważ jej objętość dystrybucji wynosi 0,4 l/kg. Metabolizm U ludzi metabolizowane jest mniej niż 14% dawki lewocetyryzyny, dlatego różnice wynikające z polimorfizmu genetycznego lub równoczesnego przyjmowania inhibitorów enzymów uważa się za mało istotne. Szlaki metaboliczne obejmują: utlenianie pierścienia aromatycznego, N- i O-dealkilację oraz sprzęganie z tauryną. Reakcje dealkilacji przebiegają głównie z udziałem CYP 3A4, natomiast utlenianie pierścienia aromatycznego przebiega z udziałem licznych i (lub) niezidentyfikowanych izoform CYP.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWłaściwości farmakokinetyczne
Lewocetyryzyna w stężeniach znacznie większych niż stężenia maksymalne występujące po podaniu dawki doustnej 5 mg, nie miała wpływu na aktywność izoenzymów CYP 1A2, 2C9, 2C19, 2D6, 2E1 i 3A4. Ze względu na słaby metabolizm i brak możliwości hamowania metabolizmu, wzajemne interakcje lewocetyryzyny z innymi substancjami są mało prawdopodobne. Eliminacja Okres półtrwania w osoczu u osób dorosłych wynosi 7,9 ± 1,9 godziny. Okres półtrwania u małych dzieci jest krótszy. Średni pozorny całkowity klirens u dorosłych wynosi 0,63 ml/min/kg mc. Lewocetyryzyna i jej metabolity wydalane są głównie z moczem, średnio 85,4% dawki. Z kałem wydalane jest tylko 12,9% dawki. Lewocetyryzyna wydala się zarówno w wyniku przesączania kłębuszkowego, jak i aktywnego wydzielania kanalikowego. Specjalne grupy pacjentów Zaburzenia czynności nerek: Pozorny klirens lewocetyryzyny zależy od klirensu kreatyniny.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWłaściwości farmakokinetyczne
Dlatego u pacjentów z umiarkowanymi i ciężkimi zaburzeniami czynności nerek zaleca się dostosowanie odstępów pomiędzy kolejnymi dawkami lewocetyryzyny (patrz punkt 4.2). U osób ze schyłkową niewydolnością nerek, z bezmoczem całkowity klirens leku z organizmu jest zmniejszony o około 80% w porównaniu z osobami zdrowymi. Ilość lewocetyryzyny usunięta w czasie standardowego czterogodzinnego zabiegu hemodializy wynosiła < 10%. Dzieci i młodzież: Dane z badania oceniającego farmakokinetykę u dzieci, w którym 14 dzieciom w wieku od 6 do 11 lat, o masie ciała od 20 do 40 kg podawano doustnie lewocetyryzynę w pojedynczej dawce 5 mg, wykazały w porównaniu krzyżowym, że wartości Cmax i AUC były około 2-krotnie większe niż u zdrowych dorosłych ochotników. Średnie stężenie maksymalne (Cmax) wyniosło 450 ng/ml i było osiągane średnio po 1,2 godziny; znormalizowany względem masy ciała klirens całkowity był o 30% większy, a okres półtrwania eliminacji był o 24% krótszy u dzieci niż u osób dorosłych.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWłaściwości farmakokinetyczne
Nie przeprowadzono badań farmakokinetycznych u dzieci w wieku poniżej 6 lat. Przeprowadzono retrospektywną analizę farmakokinetyczną w populacji 323 pacjentów (181 dzieci w wieku od 1 do 5 lat, 18 dzieci w wieku od 6 do 11 lat i 124 dorosłych w wieku od 18 do 55 lat), którzy otrzymywali lewocetyryzynę w dawce pojedynczej lub w dawkach wielokrotnych od 1,25 mg do 30 mg. Uzyskane z tej analizy dane wykazały, że przewidywane stężenie w osoczu po podaniu dawki 1,25 mg raz na dobę dzieciom w wieku od 6 miesięcy do 5 lat jest podobne do stężenia w osoczu osób dorosłych otrzymujących dawkę 5 mg raz na dobę. Pacjenci w podeszłym wieku: Dane dotyczące farmakokinetyki u osób w podeszłym wieku są ograniczone. Po wielokrotnym podaniu doustnym lewocetyryzyny w dawce 30 mg raz na dobę dziewięciu pacjentom w podeszłym wieku (65–74 lat) przez okres 6 dni, klirens całkowity był o około 33% mniejszy niż u młodszych dorosłych.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWłaściwości farmakokinetyczne
Wykazano, że rozkład cetyryzyny (racematu) jest zależny raczej od czynności nerek niż od wieku. Zależność ta dotyczy również lewocetyryzyny, ponieważ zarówno lewocetyryzyna, jak i cetyryzyna są wydalane głównie z moczem. Dlatego u pacjentów w podeszłym wieku dawkę lewocetyryzyny należy dostosować do czynności nerek. Płeć: Wyniki badania farmakokinetyki u 77 pacjentów (40 mężczyzn, 37 kobiet) oceniono pod kątem ewentualnej zależności od płci. Okres półtrwania był nieznacznie krótszy u kobiet (7,08 ± 1,72 godziny) niż u mężczyzn (8,62 ± 1,84 godziny), jednak wydaje się, że klirens po podaniu doustnym dawki dostosowanej do masy ciała u kobiet (0,67 ± 0,16 ml/min/kg mc.) jest porównywalny z klirensem u mężczyzn (0,59 ± 0,12 ml/min/kg mc.). U mężczyzn i kobiet z prawidłową czynnością nerek stosuje się takie same dawki dobowe, z zachowaniem takich samych odstępów pomiędzy dawkami. Rasa: Nie zbadano wpływu rasy na działanie lewocetyryzyny.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlWłaściwości farmakokinetyczne
Ze względu na fakt, że lewocetyryzyna jest wydalana głównie przez nerki, a nie istnieją ważne, zależne od rasy różnice w klirensie kreatyniny, nie należy się spodziewać istnienia zależnych od rasy różnic we właściwościach farmakokinetycznych lewocetyryzyny. Nie obserwowano związanych z rasą różnic w kinetyce cetyryzyny (racemat). Zaburzenia czynności wątroby: Nie badano farmakokinetyki lewocetyryzyny u pacjentów z zaburzeniami czynności wątroby. U pacjentów z przewlekłymi chorobami wątroby (wątrobowokomórkowymi, cholestatycznymi lub z żółciową marskością wątroby), którym podawano 10 lub 20 mg cetyryzyny (racemat) w dawce pojedynczej, obserwowano wydłużenie okresu półtrwania o 50% przy jednoczesnym zmniejszeniu klirensu o 40% w porównaniu ze zdrowymi osobami. Zależności farmakokinetyczno-farmakodynamiczne Wpływ na reakcje skórne wywołane przez histaminę nie jest związany ze stężeniem leku w osoczu.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego i toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla człowieka.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu octan trójwodny (do ustalenia pH) Kwas octowy lodowaty (do ustalenia pH) Metylu parahydroksybenzoesan (E 218) Propylu parahydroksybenzoesan (E 216) Glicerol 85% Maltitol ciekły (E 965) Sacharyna sodowa (E 954) Aromat Tutti frutti zawierający: triacetyna (E1518) benzaldehyd olejek pomarańczowy wanilina etylu maślan koncentrat olejku pomarańczowego izopentylu octan allilu kapronian gamma-undekalakton cytral geraniol cytronellol alfa-tokoferol (E307) Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata. Po pierwszym otwarciu: 3 miesiące. 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
- CHPL leku Xyzal 0,5 mg/ml roztwór doustny, roztwór doustny, 0,5 mg/mlDane farmaceutyczne
6.5 Rodzaj i zawartość opakowania Butelka ze szkła oranżowego (klasy III) z białym polipropylenowym zamknięciem zabezpieczającym przed dostępem dzieci, umieszczona w tekturowym pudełku zawierającym również 10 ml strzykawkę z podziałką co 0,25 ml (polietylen, polistyren). Wielkości opakowań: 75 ml, 150 ml i 200 ml. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Bez specjalnych wymagań.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Allegra Telfast 180, 180 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 180 mg feksofenadyny chlorowodorku (Fexofenadini hydrochloridum), co odpowiada 168 mg feksofenadyny. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki powlekane.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgWskazania do stosowania
4.1 Wskazania do stosowania Leczenie objawowe przewlekłej idiopatycznej pokrzywki.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli i dzieci w wieku powyżej 12 lat Zalecana dawka feksofenadyny chlorowodorku dla dorosłych i dzieci w wieku powyżej 12 lat wynosi 180 mg raz na dobę, przed posiłkiem. Feksofenadyna jest farmakologicznie czynnym metabolitem terfenadyny. Dzieci w wieku poniżej 12 lat Nie badano skuteczności i bezpieczeństwa stosowania feksofenadyny chlorowodorku w dawce 180 mg u dzieci w wieku poniżej 12 lat. Grupy zwiększonego ryzyka Badania przeprowadzone w grupach zwiększonego ryzyka (osoby w podeszłym wieku, osoby z zaburzeniem czynności nerek lub wątroby) wykazały, że nie jest konieczne dostosowanie dawkowania feksofenadyny chlorowodorku w tych grupach pacjentów.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Dane dotyczące stosowania u pacjentów w podeszłym wieku oraz u pacjentów z zaburzeniami czynności nerek lub wątroby są ograniczone. W tych grupach pacjentów feksofenadyny chlorowodorek należy stosować ze szczególną ostrożnością (patrz punkt 4.2). Pacjentów z chorobą układu krążenia obecnie lub w wywiadzie należy ostrzec, że stosowanie leków przeciwhistaminowych może wiązać się z wystąpieniem takich działań niepożądanych, jak: tachykardia i kołatanie serca (patrz punkt 4.8). Allegra Telfast 180 zawiera sód Lek zawiera mniej niż 1 mmol (23 mg) sodu w jednej tabletce to znaczy lek uznaje się za „wolny od sodu”.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Feksofenadyna nie jest metabolizowana w wątrobie, tak więc nie wchodzi w interakcje z innymi lekami z udziałem mechanizmów wątrobowych. Feksofenadyna jest substratem glikoproteiny P (P-gp) oraz polipeptydu transportującego aniony organiczne (OATP). Jednoczesne podawanie feksofenadyny i inhibitorów lub induktorów P-gp może wpływać na ogólny wpływ feksofenadyny na organizm. Stwierdzono, że jednoczesne stosowanie feksofenadyny chlorowodorku z inhibitorami P-gp: erytromycyną lub ketokonazolem powoduje 2-3 krotne zwiększenie stężenia feksofenadyny w osoczu. Nie miało to wpływu na odstęp QT i nie powodowało zwiększenia częstości występowania działań niepożądanych w porównaniu z sytuacją, gdy każdy z tych leków podawany był oddzielnie.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgInterakcje
W badaniu klinicznym interakcji wykazano, że jednoczesne podanie apalutamidu (słabego induktora P-gp) i pojedynczej dawki doustnej 30 mg feksofenadyny powodowało zmniejszenie AUC feksofenadyny o 30%. Nie stwierdzono interakcji feksofenadyny z omeprazolem. Podanie leków zobojętniających sok żołądkowy, zawierających wodorotlenek glinu i magnezu na 15 minut przed podaniem feksofenadyny chlorowodorku powodowało zmniejszenie biodostępności feksofenadyny, najprawdopodobniej w wyniku wiązania w przewodzie pokarmowym. Zaleca się zachowanie 2-godzinnego odstępu między podaniem feksofenadyny chlorowodorku i leków zobojętniających sok żołądkowy zawierających wodorotlenek glinu i magnezu.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak wystarczających danych dotyczących stosowania feksofenadyny chlorowodorku u kobiet w ciąży. Ograniczone dane z badań na zwierzętach nie wykazują bezpośredniego lub pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3). Feksofenadyny chlorowodorku nie wolno stosować w okresie ciąży, jeśli nie jest to bezwzględnie konieczne. Karmienie piersi? Nie ma danych dotyczących stężenia feksofenadyny w mleku kobiecym po podaniu feksofenadyny chlorowodorku. Jednak podczas stosowania terfenadyny stwierdzono obecność feksofenadyny w mleku matki. Dlatego nie zaleca się stosowania feksofenadyny chlorowodorku u kobiet karmiących piersią.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Biorąc pod uwagę profil farmakodynamiczny i zgłaszane działania niepożądane jest mało prawdopodobne, aby feksofenadyny chlorowodorek wpływał na zdolność prowadzenia pojazdów i obsługiwania maszyn. W obiektywnych testach wykazano, że Allegra Telfast 180 nie wywiera znaczącego wpływu na czynność ośrodkowego układu nerwowego. Oznacza to, że pacjenci mogą prowadzić pojazdy mechaniczne i wykonywać zadania wymagające koncentracji. Jednakże w celu identyfikacji wrażliwych osób, u których występuje nietypowa reakcja na leki, zaleca się sprawdzenie indywidualnej reakcji na produkt zanim pacjent będzie prowadził pojazd lub wykonywał skomplikowane zadania.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane są wymienione poniżej według klasyfikacji układów i narządów oraz częstości występowania. Częstość występowania jest określona jako bardzo często (> 1/10), często (> 1/100 do < 1/10), niezbyt często (> 1/1000 do < 1/100), rzadko (> 1/10 000 do < 1/1000) lub bardzo rzadko (< 1/10 000), nieznana (częstość nie może być określona na podstawie dostępnych danych). U dorosłych zgłaszane były następujące działania niepożądane w badaniach klinicznych z częstością występowania podobną do obserwowanej w grupie otrzymującej placebo: Zaburzenia układu nerwowego Często (≥1/100 do <1/10): bóle głowy, senność, zawroty głowy Zaburzenia oka Częstość nieznana: nieostre widzenie Zaburzenia żołądka i jelit Często (≥1/100 do <1/10): nudności Zaburzenia ogólne i stany w miejscu podania Niezbyt często (≥1/1 000 do <1/100): zmęczenie U dorosłych zgłaszane były następujące działania niepożądane zebrane z obserwacji w okresie po wprowadzeniu produktu do obrotu.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgDziałania niepożądane
Częstość ich występowania jest nieznana (nie może być określona na podstawie dostępnych danych): Zaburzenia układu immunologicznego reakcje nadwrażliwości z objawami, takimi jak: obrzęk naczynioruchowy, uczucie ucisku w klatce piersiowej, duszność, nagłe zaczerwienienie skóry i uogólnione objawy anafilaksji Zaburzenia psychiczne bezsenność, nerwowość, zaburzenia snu lub koszmary senne/wyraziste sny Zaburzenia serca tachykardia, kołatanie serca Zaburzenia żołądka i jelit biegunka Zaburzenia skóry i tkanki podskórnej wysypka, pokrzywka, świąd
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania feksofenadyny chlorowodorku występowały: zawroty głowy, senność, zmęczenie oraz suchość błony śluzowej jamy ustnej. Podczas stosowania pojedynczych dawek do 800 mg oraz dawek do 690 mg dwa razy na dobę przez jeden miesiąc lub 240 mg raz na dobę przez jeden rok, u zdrowych osób, nie występowały klinicznie istotne działania niepożądane, w porównaniu z placebo. Nie ustalono maksymalnej tolerowanej dawki chlorowodorku feksofenadyny. W przypadku przedawkowania leku należy zastosować standardowe postępowanie mające na celu usunięcie niewchłoniętego leku. Zaleca się leczenie objawowe i podtrzymujące. Hemodializa nie jest skuteczną metodą usuwania feksofenadyny chlorowodorku z krwi.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki przeciwhistaminowe do stosowania ogólnego, kod ATC: R06AX26 Feksofenadyny chlorowodorek jest lekiem przeciwhistaminowym, blokującym receptory H1, nie wywierającym działania sedatywnego. Feksofenadyna jest farmakologicznie czynnym metabolitem terfenadyny. W badaniach na modelu reakcji skórnej wywołanej przez histaminę, przeprowadzonych u ludzi, którym podawano feksofenadyny chlorowodorek raz lub dwa razy na dobę, stwierdzono, że działanie przeciwhistaminowe leku rozpoczyna się w ciągu godziny, osiąga maksimum po 6 godzinach i utrzymuje się przez 24 godziny. Nie wykazano rozwoju tolerancji na lek po 28 dniach stosowania leku. Podczas stosowania doustnego dawek od 10 mg do 130 mg stwierdzono pozytywną zależność pomiędzy dawką a reakcją.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgWłaściwości farmakodynamiczne
W opisanym modelu działania przeciwhistaminowego wykazano, że w celu uzyskania stałego działania terapeutycznego utrzymującego się przez 24 godziny konieczne jest stosowanie leku w dawkach wynoszących co najmniej 130 mg. Maksymalne zahamowanie wystąpienia pęcherzy i zaczerwienienia skóry wynosiło więcej niż 80%. U pacjentów z sezonowym alergicznym zapaleniem błony śluzowej nosa, którym podawano feksofenadyny chlorowodorek w dawkach do 240 mg dwa razy na dobę przez okres 2 tygodni, nie stwierdzono, w porównaniu z placebo, istotnych zmian odstępu QTc. Nie stwierdzono również istotnych zmian odstępu QTc u zdrowych ochotników, którym podawano chlorowodorek feksofenadyny w dawkach do 60 mg dwa razy na dobę przez 6 miesięcy, 400 mg dwa razy na dobę przez 6,5 dnia i 240 mg raz na dobę przez okres 1 roku w porównaniu do placebo. Feksofenadyna w stężeniach 32 razy większych niż stężenia terapeutyczne u ludzi nie wpływała na wolne kanały potasowe sklonowane z komórek mięśnia sercowego człowieka.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgWłaściwości farmakodynamiczne
Feksofenadyny chlorowodorek (5–10 mg/kg, podany doustnie) hamuje indukowany antygenem skurcz oskrzeli u uczulonych świnek morskich, a w stężeniach większych niż lecznicze (10-100 μM) hamuje uwalnianie histaminy z otrzewnowych komórek tucznych.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Chlorowodorek feksofenadyny jest szybko wchłaniany po podaniu doustnym, Tmax osiągane jest po około 1-3 godzinach po podaniu. Podczas podawania dawki 180 mg raz na dobę, średnia wartość Cmax wyniosła około 494 ng/ml. Feksofenadyna wiąże się w 60-70% z białkami osocza i w minimalnym stopniu jest metabolizowana (w wątrobie i poza wątrobą); jest jedynym związkiem stwierdzanym w moczu i kale u zwierząt i ludzi. Stężenia feksofenadyny w osoczu zmniejszają się w sposób dwuwykładniczy, z okresem półtrwania w końcowej fazie eliminacji wynoszącym od 11 do 15 godzin po podaniu wielokrotnym. Farmakokinetyka feksofenadyny po podaniu jednorazowym i wielokrotnym jest liniowa w zakresie dawek do 180 mg dwa razy na dobę. Dawka 240 mg podawana dwa razy na dobę powoduje nieco większe (o 8,8%) niż wprost proporcjonalne zwiększenie pola pod krzywą AUC w stanie stacjonarnym.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgWłaściwości farmakokinetyczne
To wskazuje, że w zakresie dawek dobowych od 40 do 240 mg farmakokinetyka feksofenadyny jest praktycznie liniowa. Główną drogą eliminacji leku z organizmu jest wydalanie z żółcią, a do 10% podanej dawki wydalane jest w postaci niezmienionej z moczem.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach prowadzonych u psów podawano produkt w dawce 450 mg/kg masy ciała dwa razy na dobę przez 6 miesięcy. Z wyjątkiem sporadycznie występujących wymiotów, nie stwierdzono innych objawów działania toksycznego. Również po podaniu pojedynczej dawki psom i gryzoniom nie stwierdzono w badaniu sekcyjnym istotnych zmian, które mogłyby mieć związek ze stosowaniem produktu. Badania dystrybucji tkankowej znakowanego izotopem radioaktywnym chlorowodorku feksofenadyny u szczurów wykazały, że feksofenadyna nie przenika przez barierę krew–mózg. W różnych testach mutagenności in vitro i in vivo nie wykazano właściwości mutagennych feksofenadyny. Potencjalne rakotwórcze działanie feksofenadyny chlorowodorku badano po podaniu terfenadyny oceniając następnie pośrednimi metodami farmakokinetycznymi stopień ekspozycji na feksofenadyny chlorowodorek (wartość AUC w osoczu).
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgPrzedkliniczne dane o bezpieczeństwie
U szczurów i myszy, którym podawano terfenadynę (dawki do 150 mg/kg mc./dobę) nie stwierdzono działania rakotwórczego. W badaniu toksycznego wpływu na reprodukcję, przeprowadzonym na myszach, feksofenadyny chlorowodorek nie zaburzał płodności, nie był teratogenny oraz nie zaburzał rozwoju przed- i pourodzeniowego.
- CHPL leku Allegra Telfast 180, tabletki powlekane, 180 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kroskarmeloza sodowa Skrobia kukurydziana żelowana Celuloza mikrokrystaliczna Magnezu stearynian 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry Al/PVC/PE/PVDC zawierające po 10 tabletek, w tekturowym pudełku. Wielkość opakowań: 20, 50 lub 100 tabletek powlekanych. Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Telfexo 120 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 120 mg feksofenadyny chlorowodorku, co odpowiada 112 mg feksofenadyny. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana Podłużna, dwuwypukła tabletka powlekana barwy brzoskwiniowej; po obu stronach gładka, o wymiarach 14,9-15,3 mm x 6,4-6,8 mm.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgWskazania do stosowania
4.1 Wskazania do stosowania Produkt Telfexo 120 mg jest wskazany do stosowania u dorosłych i dzieci w wieku 12 lat i starszych w celu łagodzenia objawów sezonowego alergicznego zapalenia błony śluzowej nosa.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Zalecana dawka feksofenadyny chlorowodorku dla dorosłych to 120 mg raz na dobę, przyjmowana przed posiłkiem. Feksofenadyna jest czynnym farmakologicznie metabolitem terfenadyny. Dzieci i młodzież Dzieci w wieku 12 lat i powyżej Zalecana dawka feksofenadyny chlorowodorku dla dzieci w wieku 12 lat i starszych to 120 mg raz na dobę, przyjmowana przed posiłkiem. Dzieci w wieku poniżej 12 lat Nie określono skuteczności ani bezpieczeństwa stosowania feksofenadyny chlorowodorku w dawce 120 mg u dzieci w wieku poniżej 12 lat. Dzieci w wieku od lat 6 do 11 lat: w tej grupie wiekowej odpowiedni produkt do podawania i dawkowania to tabletka zawierająca 30 mg feksofenadyny chlorowodorku. Szczególne grupy pacjentów Dostępne dane dotyczące stosowania produktu w szczególnych grupach pacjentów zwiększonego ryzyka (u pacjentów w podeszłym wieku, u pacjentów z zaburzeniami czynności nerek lub wątroby) wykazały, że dostosowanie dawki feksofenadyny chlorowodorku u tych pacjentów nie jest konieczne.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Podobnie jak w przypadku większości nowych produktów leczniczych są dostępne jedynie ograniczone dane dotyczące stosowania u pacjentów w podeszłym wieku oraz u pacjentów z zaburzeniami czynności nerek lub wątroby. W tych grupach pacjentów feksofenadyny chlorowodorek należy stosować ostrożnie. Pacjentów z chorobami układu krążenia w wywiadzie należy ostrzec, że leki przeciwhistaminowe z tej grupy mogą mieć związek z występowaniem działań niepożądanych takich jak tachykardia i kołatanie serca (patrz punkt 4.8). Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę, to znaczy produkt uznaje się za „wolny od sodu”.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Feksofenadyna nie jest metabolizowana w wątrobie i z tego powodu nie występują interakcje z lekami metabolizowanymi w wątrobie. Feksofenadyna jest substratem glikoproteiny P (P-gp) oraz polipeptydu transportującego aniony organiczne (OATP). Jednoczesne podawanie feksofenadyny i inhibitorów lub induktorów P-gp może wpływać na ogólny wpływ feksofenadyny na organizm. Stwierdzono, że równoczesne podawanie feksofenadyny chlorowodorku z inhibitorami P-gp: erytromycyną lub ketokonazolem powodowało 2 – 3-krotne zwiększenie stężenia feksofenadyny w osoczu. Zmianom tym nie towarzyszył żaden wpływ na odstęp QT i nie było to związane ze zwiększeniem występowania działań niepożądanych w porównaniu z tymi produktami leczniczymi podawanymi w monoterapii.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgInterakcje
W badaniu klinicznym interakcji wykazano, że jednoczesne podanie apalutamidu (słabego induktora P-gp) i pojedynczej dawki doustnej 30 mg feksofenadyny powodowało zmniejszenie AUC feksofenadyny o 30%. Nie zaobserwowano interakcji pomiędzy feksofenadyną i omeprazolem. Jednakże podawanie leków zobojętniających kwas solny w żołądku zawierających wodorotlenek glinu i magnezu 15 minut przed przyjęciem feksofenadyny chlorowodorku powodowało zmniejszenie biodostępności, najprawdopodobniej z powodu jej wiązania w przewodzie pokarmowym. Zaleca się odczekać 2 godziny między przyjęciem feksofenadyny chlorowodorku a leków zobojętniających kwas solny w żołądku zawierających wodorotlenek glinu i magnezu.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak wystarczających danych dotyczących stosowania feksofenadyny chlorowodorku u kobiet w ciąży. Ograniczone badania prowadzone na zwierzętach nie wykazały bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka/płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3). Feksofenadyny chlorowodorek nie może być stosowany u kobiet w ciąży, jeśli nie jest to bezwzględnie konieczne. Karmienie piersi? Nie są dostępne dane dotyczące zawartości feksofenadyny chlorowodorku w mleku kobiecym po podaniu produktu. Jednakże, gdy podawano terfenadynę kobietom karmiącym piersią, stwierdzono przenikanie feksofenadyny do mleka kobiecego. Dlatego nie zaleca się podawania feksofenadyny chlorowodorku kobietom karmiącym piersią. Płodność Brak danych dotyczących wpływu feksofenadyny chlorowodorku na płodność u ludzi.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgWpływ na płodność, ciążę i laktację
Badania przeprowadzone na myszach nie wykazały szkodliwego wpływu feksofenadyny chlorowodorku na reprodukcję (patrz punkt 5.3).
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Na podstawie danych farmakodynamicznych i zgłaszanych działań niepożądanych jest mało prawdopodobne, aby feksofenadyny chlorowodorek wywierał wpływ na zdolność prowadzenia pojazdów i obsługę maszyn. W obiektywnych badaniach wykazano, że Telfexo nie wywiera znaczącego wpływu na ośrodkowy układ nerwowy. Oznacza to, że pacjenci mogą prowadzić pojazdy lub wykonywać czynności wymagające koncentracji. Jednakże w celu określenia nadwrażliwości u osób, u których występuje nietypowa reakcja na leki, zaleca się sprawdzenie indywidualnej reakcji na produkt przed prowadzeniem pojazdu lub wykonywaniem skomplikowanych zadań.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgDziałania niepożądane
4.8 Działania niepożądane Częstości występowania określono następująco: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000) lub częstość nieznana (nie może być określona na podstawie dostępnych danych). W obrębie każdej grupy określającej częstość występowania, działania niepożądane wymieniono zgodnie ze zmniejszającym się nasileniem. W kontrolowanych badaniach klinicznych częstość występowania działań niepożądanych była podobna do obserwowanej w grupie placebo. Zaburzenia układu nerwowego Często: bóle głowy, senność, zawroty głowy Zaburzenia żołądka i jelit Często: nudności Zaburzenia ogólne i stany w miejscu podania Niezbyt często: zmęczenie Następujące działania niepożądane były zgłaszane u osób dorosłych w ramach nadzoru po wprowadzeniu feksofenadyny chlorowodorku do obrotu.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgDziałania niepożądane
Częstość ich występowania nie jest znana (nie może być określona na podstawie dostępnych danych): Zaburzenia układu immunologicznego reakcje nadwrażliwości z objawami, takimi jak: obrzęk naczynioruchowy, uczucie ucisku w klatce piersiowej, duszność, nagłe zaczerwienienie skóry i uogólnione objawy anafilaksji Zaburzenia psychiczne bezsenność, nerwowość, zaburzenia snu lub koszmary senne/nieprawidłowe sny Zaburzenia serca tachykardia, kołatanie serca Zaburzenia żołądka i jelit biegunka Zaburzenia skóry i tkanki podskórnej wysypka, pokrzywka, świąd Zaburzenia oka nieostre widzenie Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania feksofenadyny chlorowodorku zgłaszano: zawroty głowy, senność, zmęczenie i suchość w jamie ustnej. Podawanie zdrowym osobom pojedynczych dawek do 800 mg i dawek do 690 mg dwa razy na dobę przez miesiąc lub dawki 240 mg raz na dobę przez rok nie powodowało istotnych klinicznie działań niepożądanych w porównaniu z placebo. Nie ustalono maksymalnej tolerowanej dawki feksofenadyny chlorowodorku. W przypadku przedawkowania należy rozważyć zastosowanie standardowych środków w celu usunięcia niewchłoniętego produktu leczniczego. Zaleca się leczenie objawowe i podtrzymujące. Hemodializa nie usuwa skutecznie feksofenadyny chlorowodorku z krwi.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Inne leki przeciwhistaminowe do stosowania ogólnego, kod ATC: R06AX26 Mechanizm działania Feksofenadyny chlorowodorek jest lekiem przeciwhistaminowym blokującym receptory H1, nie wywołującym uspokojenia. Feksofenadyna jest czynnym farmakologicznie metabolitem terfenadyny. Skuteczność kliniczna i bezpieczeństwo stosowania W badaniach na modelu reakcji skórnej wywołanej przez histaminę, przeprowadzonych u ludzi, którym podawano feksofenadyny chlorowodorek raz lub dwa razy na dobę, stwierdzono że działanie przeciwhistaminowe produktu rozpoczyna się w ciągu godziny, osiąga maksimum po 6 godzinach i utrzymuje się przez 24 godziny. Nie wykazano rozwoju tolerancji na produkt po 28 dniach stosowania. Podczas stosowania doustnego dawek od 10 mg do 130 mg stwierdzono pozytywną zależność pomiędzy dawką a reakcją.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgWłaściwości farmakodynamiczne
W opisanym modelu działania przeciwhistaminowego wykazano, że w celu uzyskania stałego działania terapeutycznego utrzymującego się przez 24 godziny konieczne jest stosowanie produktu w dawkach wynoszących co najmniej 130 mg. Maksymalne zahamowanie wystąpienia pęcherzy i zaczerwienienia skóry wynosiło więcej niż 80%. Badania kliniczne dotyczące leczenia sezonowego alergicznego zapalenia błony śluzowej nosa wykazały, że dawka 120 mg jest wystarczająca do zapewnienia skutecznego działania przez 24 godziny. Nie obserwowano, w porównaniu z placebo, istotnych zmian odstępu QTc u pacjentów z sezonowym alergicznym zapaleniem błony śluzowej nosa leczonych feksofenadyny chlorowodorkiem podawanym w dawce 240 mg dwa razy na dobę przez dwa tygodnie. Nie obserwowano również istotnych zmian odstępu QTc u zdrowych ochotników, którzy otrzymywali dawki feksofenadyny chlorowodorku do 60 mg dwa razy na dobę przez 6 miesięcy, 400 mg dwa razy na dobę przez 6,5 dnia oraz 240 mg raz na dobę przez rok, w porównaniu do placebo.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgWłaściwości farmakodynamiczne
Feksofenadyna w stężeniach 32 razy większych niż stężenie terapeutyczne u ludzi nie wywiera wpływu na wolne kanały K+, sklonowane z ludzkiego serca. Feksofenadyny chlorowodorek (5-10 mg/kg mc., podany doustnie) hamuje indukowany antygenem skurcz oskrzeli u uczulonych świnek morskich, a w stężeniach większych niż leczone (10-100 µM) hamuje uwalnianie histaminy z otrzewnowych komórek tucznych.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Feksofenadyny chlorowodorek jest szybko wchłaniany po podaniu doustnym, Tmax osiągane jest po około 1–3 godzinach po podaniu. Średnia wartość Cmax wynosiła około 427 ng/ml po podaniu dawki 120 mg raz na dobę. Dystrybucja Feksofenadyna w 60% do 70% wiąże się z białkami osocza. Metabolizm i eliminacja Feksofenadyna jest metabolizowana tylko w nieznacznym stopniu (w wątrobie lub poza wątrobą) i jest jedynym związkiem wykrywanym w moczu i kale u zwierząt i ludzi. Stężenie feksofenadyny w osoczu zmniejsza się w sposób dwuwykładniczy, z okresem półtrwania w końcowej fazie eliminacji wynoszącym od 11 do 15 godzin po podaniu wielokrotnym. Farmakokinetyka feksofenadyny po podaniu jednorazowym lub wielokrotnym jest liniowa dla dawek doustnych do 120 mg dwa razy na dobę. Dawka 240 mg podawana dwa razy na dobę powoduje nieco większe (8,8 %) niż wprost proporcjonalne zwiększenie pola pod krzywą w stanie stacjonarnym.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgWłaściwości farmakokinetyczne
To wskazuje, że farmakokinetyka feksofenadyny jest praktycznie liniowa w zakresie dawek od 40 do 240 mg na dobę. Główną drogą eliminacji produktu z organizmu jest wydalanie z żółcią, podczas gdy do 10% podanej dawki leku wydala się w postaci niezmienionej z moczem.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Psy tolerowały dawki wynoszące 450 mg/kg mc. podawane dwa razy na dobę przez 6 miesięcy i nie stwierdzono u nich objawów toksyczności innych, niż sporadycznie występujące wymioty. Również po podaniu pojedynczej dawki psom i gryzoniom nie stwierdzono w badaniu sekcyjnym istotnych zmian, które mogłyby mieć związek ze stosowaniem produktu. W badaniach dotyczących dystrybucji tkankowej znakowanego radioaktywnie feksofenadyny chlorowodorku, przeprowadzonych na szczurach wykazano, że feksofenadyna nie przenika przez barierę krew-mózg. W różnych testach mutagenności in vitro i in vivo nie wykazano właściwości mutagennych feksofenadyny chlorowodorku. Potencjalne działanie rakotwórcze feksofenadyny chlorowodorku badano po podaniu terfenadyny, oceniając pośrednimi metodami farmakokinetycznymi stopień ekspozycji na feksofenadyny chlorowodorek (wartość AUC w osoczu).
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgPrzedkliniczne dane o bezpieczeństwie
U szczurów i myszy, którym podawano terfenadynę (do 150 mg/kg mc./dobę) nie obserwowano działania rakotwórczego. W badaniu prowadzonym na myszach dotyczącym toksycznego wpływu na reprodukcję, feksofenadyny chlorowodorek nie zaburzał płodności, nie był teratogenny i nie zaburzał rozwoju przed- i pourodzeniowego.
- CHPL leku Telfexo 120 mg, tabletki powlekane, 120 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Rdzeń tabletki: Celuloza mikrokrystaliczna Kroskarmeloza sodowa Skrobia kukurydziana Powidon PVP Magnezu stearynian Otoczka: Hypromeloza 6cP (E 464) Tytanu dwutlenek (E 171) Makrogol PEG 400 Makrogol PEG 4000 Żelaza tlenek żółty (E 172) Żelaza tlenek czerwony (E 172) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania. 6.5 Rodzaj i zawartość opakowania Blistry PVC/PVDC/Aluminium pakowane są w pudełko tekturowe. 2, 7, 10, 15, 20, 30, 50, 100 lub 200 (10 x 20) tabletek w opakowaniu. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Telfast 30, 30 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 30 mg feksofenadyny chlorowodorku (Fexofenadini hydrochloridum), co odpowiada 28 mg feksofenadyny. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletka powlekana. Okrągła tabletka powlekana koloru brzoskwiniowego z oznakowaniem „03” na jednej stronie i „e” na drugiej stronie.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgWskazania do stosowania
4.1 Wskazania do stosowania Telfast 30 jest wskazany do stosowania u dzieci w wieku od 6 do 11 lat w leczeniu objawów sezonowego alergicznego zapalenia błony śluzowej nosa.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dzieci Dzieci w wieku 6 do 11 lat: Zalecana dawka feksofenadyny chlorowodorku u dzieci w wieku 6 do 11 lat wynosi 30 mg dwa razy na dobę. Dzieci w wieku poniżej 6 lat: Nie określono skuteczności feksofenadyny chlorowodorku u dzieci w wieku poniżej 6 lat. Grupy zwiększonego ryzyka: Nie określono bezpieczeństwa stosowania i skuteczności feksofenadyny chlorowodorku u dzieci z zaburzeniami czynności nerek lub wątroby (patrz punkt 4.4). Badania przeprowadzone u dorosłych z grup zwiększonego ryzyka (pacjenci z zaburzeniem czynności nerek lub wątroby) wykazały, że nie jest konieczne dostosowanie dawkowania feksofenadyny chlorowodorku u dorosłych. Sposób podawania: Podanie doustne.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie określono bezpieczeństwa stosowania i skuteczności feksofenadyny chlorowodorku u dzieci z zaburzeniami czynności nerek lub wątroby (patrz punkt 4.2). Feksofenadyny chlorowodorek należy stosować z ostrożnością u tych pacjentów. Pacjentów z chorobą układu krążenia występującą obecnie lub w przeszłości należy ostrzec, że stosowanie leków przeciwhistaminowych może wiązać się z występowaniem takich działań niepożądanych, jak: tachykardia i kołatanie serca (patrz punkt 4.8). Telfast 30 zawiera sód: Lek zawiera mniej niż 1 mmol (23 mg) sodu w jednej tabletce, to znaczy lek uznaje się za „wolny od sodu”.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Badania dotyczące interakcji przeprowadzono wyłącznie u dorosłych. Feksofenadyna nie jest metabolizowana w wątrobie, dlatego nie wchodzi w interakcje z innymi lekami z udziałem mechanizmów wątrobowych. Feksofenadyna jest substratem glikoproteiny P (P-gp) oraz polipeptydu transportującego aniony organiczne (OATP). Jednoczesne podawanie feksofenadyny i inhibitorów lub induktorów P-gp może wpływać na ogólny wpływ feksofenadyny na organizm. Wykazano, że jednoczesne stosowanie feksofenadyny chlorowodorku z inhibitorami P-gp: erytromycyną lub ketokonazolem powoduje 2–3-krotne zwiększenie stężenia feksofenadyny w osoczu. Zmiany te nie miały wpływu na odstęp QT i nie powodowały zwiększenia częstości występowania działań niepożądanych w porównaniu z sytuacją, gdy każdy z tych leków podawany był oddzielnie.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgInterakcje
W badaniu klinicznym interakcji wykazano, że jednoczesne podanie apalutamidu (słabego induktora P-gp) i pojedynczej dawki doustnej 30 mg feksofenadyny powodowało zmniejszenie AUC feksofenadyny o 30%. Nie stwierdzono interakcji feksofenadyny chlorowodorku z omeprazolem. Podanie leku zobojętniającego kwas solny w żołądku, zawierającego wodorotlenek glinu i magnezu na 15 minut przed podaniem feksofenadyny chlorowodorku powodowało zmniejszenie biodostępności, najprawdopodobniej w wyniku wiązania w przewodzie pokarmowym. Zaleca się zachowanie 2-godzinnej przerwy między podaniem feksofenadyny chlorowodorku i leków zobojętniających sok żołądkowy zawierających wodorotlenek glinu i magnezu.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak wystarczających danych dotyczących stosowania feksofenadyny chlorowodorku u kobiet w ciąży. Ograniczone dane z badań na zwierzętach nie wykazują bezpośredniego ani pośredniego szkodliwego wpływu na przebieg ciąży, rozwój zarodka i płodu, przebieg porodu lub rozwój pourodzeniowy (patrz punkt 5.3). Feksofenadyny chlorowodorku nie wolno stosować w okresie ciąży, jeśli nie jest to bezwzględnie konieczne. Karmienie piersi? Brak danych dotyczących stężenia feksofenadyny w mleku kobiecym po podaniu feksofenadyny chlorowodorku. Jednak podczas podawania terfenadyny kobietom karmiącym piersią stwierdzono obecność feksofenadyny w mleku matki. Dlatego nie zaleca się stosowania feksofenadyny chlorowodorku u kobiet karmiących piersią. Wpływ na płodność Brak danych dotyczących wpływu feksofenadyny chlorowodorku na płodność u ludzi.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgWpływ na płodność, ciążę i laktację
Badania przeprowadzone na myszach nie wykazują szkodliwego wpływu feksofenadyny chlorowodorku na reprodukcję (patrz punkt 5.3).
- CHPL leku Telfast 30, tabletki powlekane, 30 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Biorąc pod uwagę profil farmakodynamiczny i zgłaszane działania niepożądane jest mało prawdopodobne, aby feksofenadyny chlorowodorek w postaci tabletek wpływał na zdolność prowadzenia pojazdów i obsługiwania maszyn. W obiektywnych testach wykazano, że Telfast 30 nie wywiera znaczącego wpływu na czynność ośrodkowego układu nerwowego. Oznacza to, że pacjenci mogą prowadzić pojazdy i wykonywać zadania wymagające koncentracji. Jednakże, w celu identyfikacji wrażliwych osób, u których występuje nietypowa reakcja na leki, zaleca się sprawdzenie indywidualnej reakcji na produkt przed rozpoczęciem prowadzenia pojazdów lub wykonywania skomplikowanych zadań.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgDziałania niepożądane
4.8 Działania niepożądane Klasyfikacja spodziewanej częstości występowania: Bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000); częstość nieznana (nie może być określona na podstawie dostępnych danych). W ramach każdej grupy o określonej częstości występowania objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. W kontrolowanych badaniach klinicznych z udziałem dzieci w wieku 6 do 11 lat, najczęściej zgłaszanym działaniem niepożądanym, uznanym przez badacza za co najmniej potencjalnie związane z podawaniem feksofenadyny chlorowodorku, był ból głowy. Częstość występowania bólu głowy w połączonych danych z badań klinicznych wynosiła 1,0% wśród pacjentów przyjmujących feksofenadyny chlorowodorek w dawce 30 mg (673 dzieci) i wśród pacjentów przyjmujących placebo (700 dzieci).
- CHPL leku Telfast 30, tabletki powlekane, 30 mgDziałania niepożądane
Brak danych klinicznych dotyczących bezpieczeństwa stosowania u dzieci leczonych feksofenadyny chlorowodorkiem przez okres dłuższy niż dwa tygodnie. W kontrolowanych badaniach klinicznych z udziałem 845 dzieci w wieku 6 miesięcy do 5 lat z alergicznym zapaleniem błony śluzowej nosa, 415 dzieci otrzymywało feksofenadyny chlorowodorek w dawce 15 mg lub 30 mg (zawartość kapsułki rozpryskiwano na podłożu farmaceutycznym), a 430 dzieci otrzymywało placebo. Nie zaobserwowano niespodziewanych działań niepożądanych u dzieci leczonych feksofenadyną, a profil działań niepożądanych był podobny do tego, jaki obserwowano u starszych dzieci i u osób dorosłych (patrz punkt 4.2). U dorosłych opisywano w badaniach klinicznych następujące działania niepożądane, z częstością występowania podobną do obserwowanej w grupie otrzymującej placebo: Zaburzenia układu nerwowego Często: ból głowy, senność, zawroty głowy Zaburzenia oka Częstość nieznana: nieostre widzenie Zaburzenia żołądka i jelit Często: nudności Zaburzenia ogólne i stany w miejscu podania Niezbyt często: zmęczenie U dorosłych były zgłaszane następujące działania niepożądane, zebrane z obserwacji w okresie po wprowadzeniu leku do obrotu.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgDziałania niepożądane
Częstość ich występowania jest nieznana (nie może być określona na podstawie dostępnych danych): Zaburzenia układu immunologicznego reakcje nadwrażliwości z objawami, takimi jak: obrzęk naczynioruchowy, ucisk w klatce piersiowej, duszność, nagłe zaczerwienienie skóry i uogólnione objawy anafilaksji Zaburzenia psychiczne bezsenność, nerwowość, zaburzenia snu lub koszmary senne i (lub) wyraziste sny Zaburzenia serca tachykardia, kołatanie serca Zaburzenia żołądka i jelit biegunka Zaburzenia skóry i tkanki podskórnej wysypka, pokrzywka, świąd Zgłaszanie podejrzewanych działań niepożądanych. Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego w Polsce.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgPrzedawkowanie
4.9 Przedawkowanie Po przedawkowaniu feksofenadyny chlorowodorku opisywano: zawroty głowy, senność, zmęczenie oraz suchość błony śluzowej jamy ustnej. Podczas stosowania u dzieci dawek do 60 mg dwa razy na dobę przez dwa tygodnie i stosowania u zdrowych osób dorosłych pojedynczych dawek do 800 mg i dawek do 690 mg dwa razy na dobę przez jeden miesiąc lub 240 mg raz na dobę przez jeden rok, nie odnotowano klinicznie istotnych działań niepożądanych, w porównaniu z placebo. Nie ustalono maksymalnej tolerowanej dawki feksofenadyny chlorowodorku. W celu usunięcia niewchłoniętego leku należy rozważyć zastosowanie standardowego postępowania. Zaleca się leczenie objawowe i podtrzymujące. Hemodializa nie jest skuteczną metodą usuwania feksofenadyny chlorowodorku z krwi.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki przeciwhistaminowe do stosowania ogólnego, kod ATC: R06AX26 Mechanizm działania Feksofenadyny chlorowodorek jest lekiem przeciwhistaminowym, blokującym receptory H1, pozbawionym działania sedatywnego. Feksofenadyna jest farmakologicznie czynnym metabolitem terfenadyny. Skuteczność kliniczna i bezpieczeństwo stosowania U dzieci w wieku 6 do 11 lat hamujące działanie feksofenadyny chlorowodorku na wywołane przez histaminę pęcherze i zaczerwienie skóry było porównywalne do działania u osób dorosłych po zastosowaniu podobnej dawki. Hamowanie indukowanych histaminą pęcherzy i zaczerwienienia skóry obserwowano jedną godzinę po podaniu pojedynczej dawki 30 i 60 mg feksofenadyny chlorowodorku. Maksymalne działanie hamujące występowało zazwyczaj po 3-6 godzinach po podaniu dawki.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgWłaściwości farmakodynamiczne
W połączonej analizie danych zebranych z trzech badań klinicznych fazy III, kontrolowanych placebo, z podwójnie ślepą próbą, z udziałem 1369 dzieci w wieku 6 do 11 lat z sezonowym alergicznym zapaleniem błony śluzowej nosa, feksofenadyny chlorowodorek podawany w dawce 30 mg dwa razy na dobę był znacznie skuteczniejszy niż placebo pod względem zmniejszania łącznego wyniku oceny nasilenia objawów (p=0,0001). Wszystkie pojedyncze objawy składowe, w tym: wodnisty wyciek z nosa (p=0,0058), kichanie (p=0,0001), swędzące, zaczerwienione, łzawiące oczy (p=0,0001), swędzenie nosa, podniebienia i gardła (p=0,0001) oraz uczucie zatkania nosa (p=0,0334) uległy znacznemu zmniejszeniu po zastosowaniu feksofenadyny chlorowodorku. U dzieci w wieku 6 do 11 lat, którym podawano feksofenadyny chlorowodorek w dawkach do 60 mg dwa razy na dobę przez dwa tygodnie nie obserwowano istotnych, w porównaniu z placebo, zmian odstępu QTc.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgWłaściwości farmakodynamiczne
U dorosłych i młodzieży z sezonowym alergicznym zapaleniem błony śluzowej nosa, którym podawano feksofenadyny chlorowodorek w dawkach do 240 mg dwa razy na dobę przez okres 2 tygodni, nie stwierdzono, w porównaniu z placebo, istotnych zmian odstępu QTc. Nie stwierdzono również istotnych zmian odstępu QTc u zdrowych dorosłych ochotników, którym podawano chlorowodorek feksofenadyny w dawkach do 60 mg dwa razy na dobę przez 6 miesięcy, 400 mg dwa razy na dobę przez 6,5 dnia oraz 240 mg raz na dobę przez okres 1 roku, w porównaniu do placebo. Feksofenadyna w stężeniach 32 razy większych niż stężenia terapeutyczne u ludzi nie wpływała na czynność wolnego kanału potasowego sklonowanego z komórek mięśnia sercowego człowieka.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Feksofenadyny chlorowodorek jest szybko wchłaniany po podaniu doustnym, Tmax osiągane jest po około 1-3 godzinach po podaniu dawki. U dzieci po podaniu feksofenadyny chlorowodorku doustnie w pojedynczej dawce 30 mg, średnia wartość Cmax wynosiła około 128 ng/ml. Zaobserwowano, że dawka 30 mg podawana dwa razy na dobę zapewnia u dzieci stężenie leku w surowicy krwi (AUC) porównywalne do oznaczanego u osób dorosłych, którym podawano dopuszczony do stosowania u dorosłych schemat stosowania leku w dawce 120 mg raz na dobę. Dystrybucja Po podaniu doustnym osobom dorosłym feksofenadyna wiąże się w 60-70% z białkami osocza. Metabolizm i eliminacja Feksofenadyna jest metabolizowana w minimalnym stopniu (w wątrobie i poza wątrobą), gdyż jest jedynym, głównym związkiem wykrywanym w moczu i kale u zwierząt i ludzi.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgWłaściwości farmakokinetyczne
Stężenia feksofenadyny w osoczu zmniejszają się w sposób dwuwykładniczy, z okresem półtrwania w końcowej fazie eliminacji wynoszącym od 11 do 15 godzin po podaniu wielokrotnym. Farmakokinetyka feksofenadyny po podaniu jednorazowym i wielokrotnym jest liniowa w zakresie dawek doustnych do 120 mg dwa razy na dobę. Dawka 240 mg podawana dwa razy na dobę powodowała nieco większe (o 8,8%) niż wprost proporcjonalne zwiększenie pola pod krzywą AUC w stanie stacjonarnym, co wskazuje, że farmakokinetyka feksofenadyny jest praktycznie liniowa w zakresie przyjmowanych codziennie dawek od 40 do 240 mg. Uważa się, że główną drogą eliminacji leku z organizmu jest wydalanie z żółcią, natomiast do 10% przyjętej dawki wydalane jest w postaci niezmienionej z moczem.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach prowadzonych u psów podawano produkt w dawce 450 mg/kg masy ciała dwa razy na dobę przez 6 miesięcy. Z wyjątkiem sporadycznie występujących wymiotów, nie stwierdzono innych objawów działania toksycznego. Również po podaniu pojedynczej dawki psom i gryzoniom nie stwierdzono w badaniu sekcyjnym istotnych zmian, które mogłyby mieć związek ze stosowaniem produktu. Badania dystrybucji tkankowej znakowanego izotopem radioaktywnym feksofenadyny chlorowodorku u szczurów wykazały, że feksofenadyna nie przenika przez barierę krew–mózg. W różnych testach mutagenności in vitro i in vivo nie wykazano właściwości mutagennych feksofenadyny chlorowodorku. Potencjalne rakotwórcze działanie feksofenadyny chlorowodorku badano po podaniu terfenadyny, oceniając następnie pośrednimi metodami farmakokinetycznymi stopień ekspozycji na feksofenadyny chlorowodorek (wartość AUC w osoczu).
- CHPL leku Telfast 30, tabletki powlekane, 30 mgPrzedkliniczne dane o bezpieczeństwie
U szczurów i myszy otrzymujących terfenadynę (dawki do 150 mg/kg mc./dobę) nie stwierdzono działania rakotwórczego. W badaniu toksycznego wpływu na reprodukcję przeprowadzonym na myszach, feksofenadyny chlorowodorek nie zaburzał płodności, nie był teratogenny oraz nie zaburzał rozwoju przed- i pourodzeniowego.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Skład rdzenia tabletki Kroskarmeloza sodowa Skrobia żelowana Celuloza mikrokrystaliczna Magnezu stearynian Skład otoczki Hypromeloza E-15 Hypromeloza E-5 Powidon Tytanu dwutlenek (E171) Krzemionka koloidalna bezwodna Makrogol 400 Mieszanina barwiąca różowa [żelaza tlenek czerwony (E172), tytanu dwutlenek (E171)] Mieszanina barwiąca żółta [żelaza tlenek żółty (E172), tytanu dwutlenek (E171)] 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. 6.5 Rodzaj i zawartość opakowania Blistry PVC/PE/PVDC/Aluminium w tekturowym pudełku. Wielkości opakowań: 1, 2, 4, 8, 10 lub 15 tabletek powlekanych (tylko próbki); 20, 30, 40, 50, 60 lub 100 tabletek powlekanych. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
- CHPL leku Telfast 30, tabletki powlekane, 30 mgDane farmaceutyczne
6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Bez specjalnych wymagań.
Zobacz również:
- Dawkowanie leku
Cetyryzyna to popularny lek przeciwhistaminowy, który pomaga łagodzić objawy alergii, takie jak katar sienny czy pokrzywka. Może być stosowana w różnych postaciach i dawkach, a schemat dawkowania różni się w zależności od wieku pacjenta, drogi podania oraz stanu zdrowia. Poznaj najważniejsze zasady dawkowania cetyryzyny, aby stosować ją bezpiecznie i skutecznie.
- Działania niepożądane i skutki uboczne
Cetyryzyna to substancja czynna o działaniu przeciwalergicznym, która jest szeroko stosowana zarówno u dorosłych, jak i u dzieci. Choć jej działania niepożądane najczęściej są łagodne i mijają po zakończeniu leczenia, warto wiedzieć, że mogą się one różnić w zależności od postaci leku, dawki oraz indywidualnych cech pacjenta. Poznaj pełny profil bezpieczeństwa cetyryzyny, aby świadomie korzystać z jej właściwości.
- Mechanizm działania
Cetyryzyna to jedna z najczęściej stosowanych substancji przeciwalergicznych, która skutecznie łagodzi objawy alergii, takie jak katar, swędzenie nosa czy pokrzywka. Dzięki swojemu działaniu cetyryzyna blokuje wpływ histaminy – substancji odpowiedzialnej za reakcje alergiczne. Poznaj, jak działa cetyryzyna w organizmie, jak jest przyswajana i wydalana oraz co pokazują badania na jej temat.
- Porównanie substancji czynnych
Cetyryzyna, lewocetyryzyna i feksofenadyna to jedne z najczęściej wybieranych leków przeciwhistaminowych stosowanych w leczeniu alergii. Choć działają podobnie, blokując objawy uczulenia, różnią się między sobą pod względem wskazań, bezpieczeństwa stosowania w różnych grupach wiekowych i osób z chorobami współistniejącymi. Poznaj najważniejsze różnice i podobieństwa pomiędzy tymi substancjami, aby lepiej zrozumieć, która z nich może być dla Ciebie odpowiednia w zależności od sytuacji.
- Profil bezpieczeństwa
Cetyryzyna to popularny lek przeciwhistaminowy stosowany w leczeniu objawów alergii. Uważana jest za bezpieczną w większości przypadków, ale jak każdy lek, wymaga zachowania ostrożności u niektórych grup pacjentów. Profil bezpieczeństwa cetyryzyny zależy m.in. od drogi podania, wieku pacjenta, stanu zdrowia oraz obecności innych schorzeń, takich jak niewydolność nerek czy wątroby. Dowiedz się, jak bezpiecznie stosować cetyryzynę i na co zwrócić uwagę, by uniknąć niepożądanych działań.
- Przeciwwskazania
Cetyryzyna to popularny lek przeciwalergiczny, stosowany w łagodzeniu objawów alergii takich jak katar sienny czy pokrzywka. Choć uznawana jest za bezpieczną w wielu przypadkach, istnieją sytuacje, w których jej stosowanie jest przeciwwskazane lub wymaga szczególnej ostrożności. Warto poznać te ograniczenia, aby korzystać z cetyryzyny w sposób odpowiedzialny i świadomy.
- Stosowanie u dzieci
Stosowanie cetyryzyny u dzieci wymaga szczególnej ostrożności, ponieważ organizmy najmłodszych pacjentów różnią się od dorosłych pod względem reakcji na leki. Cetyryzyna występuje w różnych postaciach i dawkach, a jej bezpieczeństwo zależy od wieku dziecka oraz wybranej formy leku. Poznaj kluczowe informacje dotyczące stosowania cetyryzyny u dzieci, wskazania, dostępne formy oraz zalecenia i ograniczenia wiekowe.
- Stosowanie u kierowców
Cetyryzyna to popularny lek przeciwalergiczny, który stosowany jest zarówno w tabletkach, jak i w postaci syropu czy kropli. Pacjenci często zastanawiają się, czy przyjmowanie cetyryzyny może wpłynąć na bezpieczeństwo prowadzenia samochodu lub obsługi maszyn. Badania pokazują, że stosowanie cetyryzyny w zalecanych dawkach zazwyczaj nie powoduje zaburzeń koncentracji ani nadmiernej senności, ale każda osoba może reagować na lek nieco inaczej. Warto wiedzieć, na co zwrócić uwagę podczas leczenia, aby uniknąć nieprzyjemnych niespodzianek w codziennym funkcjonowaniu.
- Stosowanie w ciąży
Cetyryzyna to popularny lek przeciwhistaminowy, często wybierany w leczeniu alergii. Dla kobiet w ciąży oraz karmiących piersią, każda decyzja dotycząca stosowania leków wymaga szczególnej ostrożności. Sprawdź, jakie informacje dotyczące bezpieczeństwa cetyryzyny w tych okresach przekazują oficjalne źródła i na co należy zwrócić uwagę przy jej stosowaniu.
- Wskazania - na co działa?
Cetyryzyna to substancja czynna, która skutecznie łagodzi objawy alergii – zarówno sezonowej, jak i przewlekłej. Działa na różne dolegliwości, takie jak katar sienny, świąd, kichanie czy pokrzywka, a jej bezpieczeństwo i skuteczność zostały potwierdzone u dorosłych oraz dzieci od 2. roku życia (w zależności od postaci leku). Cetyryzyna dostępna jest w różnych formach i może być stosowana również w połączeniu z innymi substancjami w leczeniu bardziej nasilonych objawów alergicznych.
- Rzedawkowanie substancji
Cetyryzyna to popularny lek przeciwhistaminowy, stosowany w leczeniu alergii. Przedawkowanie tej substancji może prowadzić do różnych objawów, które dotyczą głównie układu nerwowego, a także innych narządów. Objawy przedawkowania mogą być łagodne, ale w niektórych przypadkach mogą stanowić zagrożenie dla zdrowia. Dowiedz się, jakie symptomy mogą się pojawić po przyjęciu zbyt dużej dawki cetyryzyny oraz jak wygląda postępowanie w takich sytuacjach.
REKLAMA