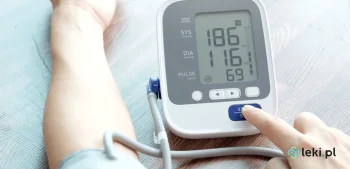
Midodryna to substancja czynna stosowana w leczeniu niedociśnienia ortostatycznego, która pomaga poprawić komfort życia pacjentów cierpiących na nagłe spadki ciśnienia przy zmianie pozycji ciała. Działa poprzez zwężenie naczyń krwionośnych, co skutkuje podniesieniem ciśnienia tętniczego. Stosowanie midodryny wymaga jednak przestrzegania określonych zasad bezpieczeństwa i regularnej kontroli ciśnienia.
Jak działa midodryna?
Midodryna należy do leków pobudzających układ sercowo-naczyniowy i jest stosowana głównie w leczeniu niedociśnienia ortostatycznego, czyli nagłego spadku ciśnienia krwi podczas wstawania123. Substancja ta działa poprzez pobudzanie receptorów w naczyniach krwionośnych, co prowadzi do ich zwężenia i podwyższenia ciśnienia tętniczego456.
Dostępne postacie leku i dawki
- Tabletki, każda zawiera 2,5 mg chlorowodorku midodryny789.
Obecnie midodryna występuje wyłącznie w postaci tabletek w dawce 2,5 mg. Nie występuje w połączeniu z innymi substancjami czynnymi789.
Wskazania do stosowania
Najczęściej stosowane dawki
Najczęściej leczenie zaczyna się od 1 do 2 razy po pół tabletki na dobę u dorosłych i młodzieży powyżej 12 lat. Dawka może być stopniowo zwiększana do 2–3 razy po 1 tabletce na dobę, w zależności od potrzeb i reakcji organizmu101112. Lek przyjmuje się w ciągu dnia, z zachowaniem kilku godzin przerwy pomiędzy dawkami.
Przeciwwskazania
- Nadwrażliwość na midodrynę lub inne składniki leku
- Poważne choroby serca i układu krążenia
- Nadciśnienie tętnicze
- Zaburzenia rytmu serca
- Ostre zapalenie lub niewydolność nerek
- Przerost gruczołu krokowego z zaleganiem moczu
- Jaskra z wąskim kątem przesączania
- Ciąża i karmienie piersią
Profil bezpieczeństwa
Nie zaleca się stosowania midodryny w ciąży i podczas karmienia piersią131415. Brakuje danych dotyczących bezpieczeństwa stosowania u dzieci, osób starszych oraz pacjentów z zaburzeniami pracy nerek i wątroby161718. Nie przeprowadzono badań dotyczących wpływu midodryny na prowadzenie pojazdów, jednak podczas leczenia mogą wystąpić objawy takie jak niepokój lub rozdrażnienie, które mogą wpłynąć na zdolność prowadzenia samochodu192021.
Przedawkowanie
W przypadku przedawkowania mogą pojawić się nasilone działania niepożądane, w tym wysokie ciśnienie krwi, bradykardia (wolne tętno), zatrzymanie moczu oraz uczucie zimna222324. W takiej sytuacji należy niezwłocznie zgłosić się po pomoc medyczną.
Najważniejsze interakcje
- Nie zaleca się stosowania z innymi lekami podwyższającymi ciśnienie, jak sympatykomimetyki, niektóre leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy oraz inhibitory MAO.
- Leki blokujące receptory alfa-adrenergiczne mogą osłabiać działanie midodryny.
- Niektóre leki nasercowe mogą nasilać działania niepożądane.
Najczęstsze działania niepożądane
- Nadciśnienie w pozycji leżącej
- Bóle głowy
- Zawroty głowy
- Bradykardia (spowolnienie tętna)
- Nudności
- Parestezje (mrowienie, drętwienie)
- Uczucie zimna
- Zatrzymanie moczu
Mechanizm działania
Midodryna jest prolekiem, który po podaniu przekształca się w organizmie w aktywną substancję pobudzającą receptory alfa1-adrenergiczne w naczyniach krwionośnych. Skutkuje to zwężeniem naczyń i podwyższeniem ciśnienia tętniczego456.
Stosowanie w ciąży
Nie należy stosować midodryny w ciąży, ponieważ nie ma wystarczających danych dotyczących bezpieczeństwa jej stosowania u kobiet ciężarnych192021.
Stosowanie u dzieci
Brakuje danych dotyczących bezpieczeństwa i skuteczności stosowania midodryny u dzieci161718.
Stosowanie u kierowców
Podczas leczenia midodryną mogą wystąpić objawy, takie jak niepokój, pobudliwość lub rozdrażnienie, które mogą wpłynąć na zdolność prowadzenia pojazdów192021.
Midodryna – porównanie substancji czynnych
Midodryna, etylefryna i noradrenalina to leki stosowane w leczeniu niskiego ciśnienia. Różnią się wskazaniami, drogą podania oraz bezpieczeństwem stosowania w różnych grupach pacjentów. Podobieństwa i...
czytaj więcej ❯❯- CHPL leku Gutron, tabletki, 2,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gutron , 2,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg chlorowodorku midodryny (Midodrini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Biała, okrągła obustronnie płaska tabletka o ściętych brzegach z wytłoczonymi literami „GU” nad i oznaczeniem dawki „2,5”pod linią podziału.
- CHPL leku Gutron, tabletki, 2,5 mgWskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie ortostatyczne.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Niedociśnienie ortostatyczne Leczenie powinno być dostosowane indywidualnie i prowadzone zależnie od napięcia i reaktywności układu wegetatywnego pacjenta. Zazwyczaj zalecane jest dawkowanie: Dorośli i młodzież ( > 12 lat): Początkowo 1 do 2 razy po pół tabletki na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 1 tabletce na dobę. Dawkowanie u pacjentów z niedociśnieniem w trakcie terapii preparatami psychotropowymi: 2 razy po 1 tabletce na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 2 tabletki na dobę. Midodrynę należy przyjmować w ciągu dnia, kiedy pacjent znajduje się w pozycji stojącej i wykonuje codzienne zajęcia. Zalecana przerwa między kolejnymi dawkami wynosi 3 do 4 godzin. Pierwszą dawkę należy przyjąć krótko po porannym wstaniu, następną w porze obiadowej i ewentualnie trzecią późnym popołudniem.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
Aby zminimalizować ryzyko nadmiernego podwyższenia ciśnienia tętniczego w pozycji leżącej, nie należy przyjmować midodryny po kolacji lub później niż 4 godziny przed położeniem się do łóżka. Dzieci Brak danych dotyczących stosowania. Pacjenci w podeszłym wieku Brak danych dotyczących stosowania. Pacjenci z zaburzeniami czynności wątroby i nerek Brak danych dotyczących stosowania. Sposób podawania Doustnie z płynem.
- CHPL leku Gutron, tabletki, 2,5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą; Ciężkie organiczne schorzenia serca i układu krwionośnego, nadciśnienie tętnicze, zaburzenia rytmu serca; Ostre zapalenie nerek, niewydolność nerek, przerost gruczołu krokowego z zaleganiem moczu, mechaniczne upośledzenie oddawania moczu, zatrzymanie moczu; Guz chromochłonny nadnerczy (Phaeochromocytoma); Nadczynność tarczycy; Jaskra z wąskim kątem przesączania; Ciąża i kamienie piersią.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W trakcie leczenia należy regularnie kontrolować ciśnienie tętnicze w pozycji leżącej, siedzącej oraz stojącej. Ryzyko wystąpienia nadciśnienia w pozycji leżącej lub siedzącej należy ocenić na początku leczenia. Należy zwrócić uwagę pacjenta na objawy wskazujące na wystąpienie nadciśnienia tętniczego (np. zawroty głowy, bóle głowy, zaburzenia widzenia) i pouczyć, aby w takim przypadku przerwać terapię i natychmiast skontaktować się z lekarzem. Nadciśnienia tętniczego w pozycji leżącej można uniknąć poprzez zmniejszenie dawki. Długotrwałe leczenie zaleca się wyłącznie u pacjentów, u których wystąpiła odpowiedź na leczenie początkowe. W przypadku wystąpienia dużych zmian ciśnienia krwi stosowanie midodryny należy przerwać. Należy unikać równoczesnego stosowania sympatykomimetyków i innych substancji obkurczających naczynia jak: rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy i inhibitory MAO, ponieważ może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
Podczas leczenia może wystąpić odruchowa bradykardia, dlatego należy zachować szczególną ostrożność podczas równoczesnego stosowania leków, które bezpośrednio lub pośrednio spowalniają częstość pracy serca (np. pochodne naparstnicy, leki blokujące receptory beta-adrenergiczne, substancje psychoaktywne). Pacjentów należy poinformować o konieczności zwrócenia uwagi na objawy subiektywne i obiektywne wskazujące na bradykardię (spowolnienie tętna, nasilone zawroty głowy, omdlenia, utrata świadomości) oraz należy zalecić przerwanie leczenia i natychmiastowy kontakt z lekarzem w razie wystąpienia tych objawów. Należy kontrolować ze szczególną starannością pacjentów z przerostem prawej komory serca. Należy zachować szczególną ostrożność również u pacjentów z jaskrą/zwiększonym ciśnieniem śródgałkowym lub znajdujących się w grupie zwiększonego ryzyka wystąpienia tych schorzeń, jak również podczas równoczesnego stosowania mineralokortykoidów/octanu fludrokortyzonu (ze względu na możliwość zwiększania ciśnienia śródgałkowego).
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
U pacjentów poddanych długotrwałemu leczeniu zaleca się kontrolowanie czynności nerek. Brak jest dostępnych danych dotyczących stosowania midodryny u dzieci, osób w podeszłym wieku i pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Równoczesne stosowanie z midodryną leków sympatykomimetycznych i innych substancji obkurczających naczynia krwionośne, jak rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki antyhistaminowe, hormony tarczycy i inhibitory MAO, może powodować znaczny wzrost ciśnienia krwi. Efekt działania midodryny może być zniesiony przez leki blokujące receptory alfa-adrenergiczne (takie jak prazosyna i fentolamina). Jednoczesne stosowanie środków blokujących receptory beta- adrenergiczne, może prowadzić do nasilonej bradykardii. Alkaloidy rauwolfii (rezerpina) mogą nieznacznie zwiększać działanie midodryny podwyższające ciśnienie krwi. Glikozydy naparstnicy mogą nasilać odruchową bradykardię i inne rodzaje zaburzeń przewodzenia wewnątrzsercowego lub zaburzenia rytmu. Przy równoczesnym stosowaniu atropiny i kortykosteroidów może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, z wykluczeniem glikozydów naczyniowych oraz leków wpływających na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA17 Midodryna jest pro-lekiem; przekształcana jest na drodze hydrolizy enzymatycznej do właściwej substancji czynnej - deglimidodryny. Deglimidodryna pobudza wybiórczo obwodowe receptory alfa1- adrenergiczne. Nie działa na receptory beta-adrenergiczne mięśnia sercowego. Działanie midodryny odpowiada zasadniczo działaniu innych leków alfa-sympatykomimetycznych. Po podaniu midodryny dochodzi do zwiększenia skurczowego i rozkurczowego ciśnienia krwi, jak również do odruchowej bradykardii. Zwiększenie ciśnienia krwi zasadniczo spowodowane jest poprzez obkurczenie drobnych żył i - w mniejszym stopniu – tętniczek, tj. przez zwiększenie oporu obwodowego. Deglimidodryna zmniejsza nieznacznie pojemność minutową serca i przepływ krwi przez nerki.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
Midodryna, działając na pęcherz moczowy zwiększa napięcie mięśniowe zwieracza pęcherza i tym samym opóźnia opróżnienie pęcherza.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, midodryna wchłania się szybko i niemal całkowicie. Po podaniu dawki 2,5 mg osiąga maksymalne stężenie w osoczu 10 µg/l w ciągu 30 minut od podania. Midodryna jest metabolizowana w drodze enzymatycznej hydrolizy w różnych tkankach (także w wątrobie) do właściwej substancji czynnej: deglimidodryny. Maksymalne stężenie deglimidodryny w osoczu u zdrowych ochotników i pacjentów z niedociśnieniem ortostatycznym występuje w ciągu ok. 1 godziny. Całkowita biodostępność midodryny (w postaci deglimidodryny) wynosi 93% po podaniu doustnym. Okres półtrwania eliminacji z osocza (t 1/2 ) midodryny wynosi 0,49 godziny, a jej czynnego metabolitu od 2 do 4 godzin. Midodryna i jej metabolity są niemal całkowicie wydalane z moczem w ciągu 24 godzin, ok. 40-60% w postaci aktywnego, głównego metabolitu, 2-5% w postaci niezmetabolizowanej midodryny, reszta jako farmakologiczne nieaktywne metabolity.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
Należy uwzględnić możliwość przeniknięcia przez midodrynę bariery krew-mózg. Brak danych klinicznych dotyczących farmakokinetyki midodryny lub jej metabolitu deglimidodryny u pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach toksyczności po podaniu wielokrotnym dawki przekraczającej 12-50 krotnie maksymalną dawkę terapeutyczną podawaną u ludzi przeliczeniu w mg/kg obserwowano, oprócz działania farmakologicznego midodryny, zwyrodnieniowe zmiany nerek u szczurów oraz zmiany w obrębie wątroby u szczurów i psów. Midodryna nie wykazuje właściwości mutagennych. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku Gutron, tabletki, 2,5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Magnezu stearynian, talk, krzemionka koloidalna bezwodna, celuloza mikrokrystaliczna, skrobia kukurydziana. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Al. 20 tabletek w dwóch blistrach po 10 sztuk. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Brak szczególnych wymagań.
- CHPL leku Gutron, tabletki, 2,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gutron , 2,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg chlorowodorku midodryny (Midodrini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Biała, okrągła obustronnie płaska tabletka o ściętych brzegach z wytłoczonymi literami „GU” nad i oznaczeniem dawki „2,5”pod linią podziału.
- CHPL leku Gutron, tabletki, 2,5 mgWskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie ortostatyczne.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Niedociśnienie ortostatyczne Leczenie powinno być dostosowane indywidualnie i prowadzone zależnie od napięcia i reaktywności układu wegetatywnego pacjenta. Zazwyczaj zalecane jest dawkowanie: Dorośli i młodzież ( > 12 lat): Początkowo 1 do 2 razy po pół tabletki na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 1 tabletce na dobę. Dawkowanie u pacjentów z niedociśnieniem w trakcie terapii preparatami psychotropowymi: 2 razy po 1 tabletce na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 2 tabletki na dobę. Midodrynę należy przyjmować w ciągu dnia, kiedy pacjent znajduje się w pozycji stojącej i wykonuje codzienne zajęcia. Zalecana przerwa między kolejnymi dawkami wynosi 3 do 4 godzin. Pierwszą dawkę należy przyjąć krótko po porannym wstaniu, następną w porze obiadowej i ewentualnie trzecią późnym popołudniem.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
Aby zminimalizować ryzyko nadmiernego podwyższenia ciśnienia tętniczego w pozycji leżącej, nie należy przyjmować midodryny po kolacji lub później niż 4 godziny przed położeniem się do łóżka. Dzieci Brak danych dotyczących stosowania. Pacjenci w podeszłym wieku Brak danych dotyczących stosowania. Pacjenci z zaburzeniami czynności wątroby i nerek Brak danych dotyczących stosowania. Sposób podawania Doustnie z płynem.
- CHPL leku Gutron, tabletki, 2,5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą; Ciężkie organiczne schorzenia serca i układu krwionośnego, nadciśnienie tętnicze, zaburzenia rytmu serca; Ostre zapalenie nerek, niewydolność nerek, przerost gruczołu krokowego z zaleganiem moczu, mechaniczne upośledzenie oddawania moczu, zatrzymanie moczu; Guz chromochłonny nadnerczy (Phaeochromocytoma); Nadczynność tarczycy; Jaskra z wąskim kątem przesączania; Ciąża i kamienie piersią.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W trakcie leczenia należy regularnie kontrolować ciśnienie tętnicze w pozycji leżącej, siedzącej oraz stojącej. Ryzyko wystąpienia nadciśnienia w pozycji leżącej lub siedzącej należy ocenić na początku leczenia. Należy zwrócić uwagę pacjenta na objawy wskazujące na wystąpienie nadciśnienia tętniczego (np. zawroty głowy, bóle głowy, zaburzenia widzenia) i pouczyć, aby w takim przypadku przerwać terapię i natychmiast skontaktować się z lekarzem. Nadciśnienia tętniczego w pozycji leżącej można uniknąć poprzez zmniejszenie dawki. Długotrwałe leczenie zaleca się wyłącznie u pacjentów, u których wystąpiła odpowiedź na leczenie początkowe. W przypadku wystąpienia dużych zmian ciśnienia krwi stosowanie midodryny należy przerwać. Należy unikać równoczesnego stosowania sympatykomimetyków i innych substancji obkurczających naczynia jak: rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy i inhibitory MAO, ponieważ może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
Podczas leczenia może wystąpić odruchowa bradykardia, dlatego należy zachować szczególną ostrożność podczas równoczesnego stosowania leków, które bezpośrednio lub pośrednio spowalniają częstość pracy serca (np. pochodne naparstnicy, leki blokujące receptory beta-adrenergiczne, substancje psychoaktywne). Pacjentów należy poinformować o konieczności zwrócenia uwagi na objawy subiektywne i obiektywne wskazujące na bradykardię (spowolnienie tętna, nasilone zawroty głowy, omdlenia, utrata świadomości) oraz należy zalecić przerwanie leczenia i natychmiastowy kontakt z lekarzem w razie wystąpienia tych objawów. Należy kontrolować ze szczególną starannością pacjentów z przerostem prawej komory serca. Należy zachować szczególną ostrożność również u pacjentów z jaskrą/zwiększonym ciśnieniem śródgałkowym lub znajdujących się w grupie zwiększonego ryzyka wystąpienia tych schorzeń, jak również podczas równoczesnego stosowania mineralokortykoidów/octanu fludrokortyzonu (ze względu na możliwość zwiększania ciśnienia śródgałkowego).
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
U pacjentów poddanych długotrwałemu leczeniu zaleca się kontrolowanie czynności nerek. Brak jest dostępnych danych dotyczących stosowania midodryny u dzieci, osób w podeszłym wieku i pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Równoczesne stosowanie z midodryną leków sympatykomimetycznych i innych substancji obkurczających naczynia krwionośne, jak rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki antyhistaminowe, hormony tarczycy i inhibitory MAO, może powodować znaczny wzrost ciśnienia krwi. Efekt działania midodryny może być zniesiony przez leki blokujące receptory alfa-adrenergiczne (takie jak prazosyna i fentolamina). Jednoczesne stosowanie środków blokujących receptory beta- adrenergiczne, może prowadzić do nasilonej bradykardii. Alkaloidy rauwolfii (rezerpina) mogą nieznacznie zwiększać działanie midodryny podwyższające ciśnienie krwi. Glikozydy naparstnicy mogą nasilać odruchową bradykardię i inne rodzaje zaburzeń przewodzenia wewnątrzsercowego lub zaburzenia rytmu. Przy równoczesnym stosowaniu atropiny i kortykosteroidów może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, z wykluczeniem glikozydów naczyniowych oraz leków wpływających na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA17 Midodryna jest pro-lekiem; przekształcana jest na drodze hydrolizy enzymatycznej do właściwej substancji czynnej - deglimidodryny. Deglimidodryna pobudza wybiórczo obwodowe receptory alfa1- adrenergiczne. Nie działa na receptory beta-adrenergiczne mięśnia sercowego. Działanie midodryny odpowiada zasadniczo działaniu innych leków alfa-sympatykomimetycznych. Po podaniu midodryny dochodzi do zwiększenia skurczowego i rozkurczowego ciśnienia krwi, jak również do odruchowej bradykardii. Zwiększenie ciśnienia krwi zasadniczo spowodowane jest poprzez obkurczenie drobnych żył i - w mniejszym stopniu – tętniczek, tj. przez zwiększenie oporu obwodowego. Deglimidodryna zmniejsza nieznacznie pojemność minutową serca i przepływ krwi przez nerki.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
Midodryna, działając na pęcherz moczowy zwiększa napięcie mięśniowe zwieracza pęcherza i tym samym opóźnia opróżnienie pęcherza.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, midodryna wchłania się szybko i niemal całkowicie. Po podaniu dawki 2,5 mg osiąga maksymalne stężenie w osoczu 10 µg/l w ciągu 30 minut od podania. Midodryna jest metabolizowana w drodze enzymatycznej hydrolizy w różnych tkankach (także w wątrobie) do właściwej substancji czynnej: deglimidodryny. Maksymalne stężenie deglimidodryny w osoczu u zdrowych ochotników i pacjentów z niedociśnieniem ortostatycznym występuje w ciągu ok. 1 godziny. Całkowita biodostępność midodryny (w postaci deglimidodryny) wynosi 93% po podaniu doustnym. Okres półtrwania eliminacji z osocza (t 1/2 ) midodryny wynosi 0,49 godziny, a jej czynnego metabolitu od 2 do 4 godzin. Midodryna i jej metabolity są niemal całkowicie wydalane z moczem w ciągu 24 godzin, ok. 40-60% w postaci aktywnego, głównego metabolitu, 2-5% w postaci niezmetabolizowanej midodryny, reszta jako farmakologiczne nieaktywne metabolity.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
Należy uwzględnić możliwość przeniknięcia przez midodrynę bariery krew-mózg. Brak danych klinicznych dotyczących farmakokinetyki midodryny lub jej metabolitu deglimidodryny u pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach toksyczności po podaniu wielokrotnym dawki przekraczającej 12-50 krotnie maksymalną dawkę terapeutyczną podawaną u ludzi przeliczeniu w mg/kg obserwowano, oprócz działania farmakologicznego midodryny, zwyrodnieniowe zmiany nerek u szczurów oraz zmiany w obrębie wątroby u szczurów i psów. Midodryna nie wykazuje właściwości mutagennych. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku Gutron, tabletki, 2,5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Magnezu stearynian, talk, krzemionka koloidalna bezwodna, celuloza mikrokrystaliczna, skrobia kukurydziana. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Al. 20 tabletek w dwóch blistrach po 10 sztuk. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Brak szczególnych wymagań.
- CHPL leku Gutron, tabletki, 2,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gutron , 2,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg chlorowodorku midodryny (Midodrini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Biała, okrągła obustronnie płaska tabletka o ściętych brzegach z wytłoczonymi literami „GU” nad i oznaczeniem dawki „2,5”pod linią podziału.
- CHPL leku Gutron, tabletki, 2,5 mgWskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie ortostatyczne.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Niedociśnienie ortostatyczne Leczenie powinno być dostosowane indywidualnie i prowadzone zależnie od napięcia i reaktywności układu wegetatywnego pacjenta. Zazwyczaj zalecane jest dawkowanie: Dorośli i młodzież ( > 12 lat): Początkowo 1 do 2 razy po pół tabletki na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 1 tabletce na dobę. Dawkowanie u pacjentów z niedociśnieniem w trakcie terapii preparatami psychotropowymi: 2 razy po 1 tabletce na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 2 tabletki na dobę. Midodrynę należy przyjmować w ciągu dnia, kiedy pacjent znajduje się w pozycji stojącej i wykonuje codzienne zajęcia. Zalecana przerwa między kolejnymi dawkami wynosi 3 do 4 godzin. Pierwszą dawkę należy przyjąć krótko po porannym wstaniu, następną w porze obiadowej i ewentualnie trzecią późnym popołudniem.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
Aby zminimalizować ryzyko nadmiernego podwyższenia ciśnienia tętniczego w pozycji leżącej, nie należy przyjmować midodryny po kolacji lub później niż 4 godziny przed położeniem się do łóżka. Dzieci Brak danych dotyczących stosowania. Pacjenci w podeszłym wieku Brak danych dotyczących stosowania. Pacjenci z zaburzeniami czynności wątroby i nerek Brak danych dotyczących stosowania. Sposób podawania Doustnie z płynem.
- CHPL leku Gutron, tabletki, 2,5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą; Ciężkie organiczne schorzenia serca i układu krwionośnego, nadciśnienie tętnicze, zaburzenia rytmu serca; Ostre zapalenie nerek, niewydolność nerek, przerost gruczołu krokowego z zaleganiem moczu, mechaniczne upośledzenie oddawania moczu, zatrzymanie moczu; Guz chromochłonny nadnerczy (Phaeochromocytoma); Nadczynność tarczycy; Jaskra z wąskim kątem przesączania; Ciąża i kamienie piersią.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W trakcie leczenia należy regularnie kontrolować ciśnienie tętnicze w pozycji leżącej, siedzącej oraz stojącej. Ryzyko wystąpienia nadciśnienia w pozycji leżącej lub siedzącej należy ocenić na początku leczenia. Należy zwrócić uwagę pacjenta na objawy wskazujące na wystąpienie nadciśnienia tętniczego (np. zawroty głowy, bóle głowy, zaburzenia widzenia) i pouczyć, aby w takim przypadku przerwać terapię i natychmiast skontaktować się z lekarzem. Nadciśnienia tętniczego w pozycji leżącej można uniknąć poprzez zmniejszenie dawki. Długotrwałe leczenie zaleca się wyłącznie u pacjentów, u których wystąpiła odpowiedź na leczenie początkowe. W przypadku wystąpienia dużych zmian ciśnienia krwi stosowanie midodryny należy przerwać. Należy unikać równoczesnego stosowania sympatykomimetyków i innych substancji obkurczających naczynia jak: rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy i inhibitory MAO, ponieważ może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
Podczas leczenia może wystąpić odruchowa bradykardia, dlatego należy zachować szczególną ostrożność podczas równoczesnego stosowania leków, które bezpośrednio lub pośrednio spowalniają częstość pracy serca (np. pochodne naparstnicy, leki blokujące receptory beta-adrenergiczne, substancje psychoaktywne). Pacjentów należy poinformować o konieczności zwrócenia uwagi na objawy subiektywne i obiektywne wskazujące na bradykardię (spowolnienie tętna, nasilone zawroty głowy, omdlenia, utrata świadomości) oraz należy zalecić przerwanie leczenia i natychmiastowy kontakt z lekarzem w razie wystąpienia tych objawów. Należy kontrolować ze szczególną starannością pacjentów z przerostem prawej komory serca. Należy zachować szczególną ostrożność również u pacjentów z jaskrą/zwiększonym ciśnieniem śródgałkowym lub znajdujących się w grupie zwiększonego ryzyka wystąpienia tych schorzeń, jak również podczas równoczesnego stosowania mineralokortykoidów/octanu fludrokortyzonu (ze względu na możliwość zwiększania ciśnienia śródgałkowego).
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
U pacjentów poddanych długotrwałemu leczeniu zaleca się kontrolowanie czynności nerek. Brak jest dostępnych danych dotyczących stosowania midodryny u dzieci, osób w podeszłym wieku i pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Równoczesne stosowanie z midodryną leków sympatykomimetycznych i innych substancji obkurczających naczynia krwionośne, jak rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki antyhistaminowe, hormony tarczycy i inhibitory MAO, może powodować znaczny wzrost ciśnienia krwi. Efekt działania midodryny może być zniesiony przez leki blokujące receptory alfa-adrenergiczne (takie jak prazosyna i fentolamina). Jednoczesne stosowanie środków blokujących receptory beta- adrenergiczne, może prowadzić do nasilonej bradykardii. Alkaloidy rauwolfii (rezerpina) mogą nieznacznie zwiększać działanie midodryny podwyższające ciśnienie krwi. Glikozydy naparstnicy mogą nasilać odruchową bradykardię i inne rodzaje zaburzeń przewodzenia wewnątrzsercowego lub zaburzenia rytmu. Przy równoczesnym stosowaniu atropiny i kortykosteroidów może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, z wykluczeniem glikozydów naczyniowych oraz leków wpływających na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA17 Midodryna jest pro-lekiem; przekształcana jest na drodze hydrolizy enzymatycznej do właściwej substancji czynnej - deglimidodryny. Deglimidodryna pobudza wybiórczo obwodowe receptory alfa1- adrenergiczne. Nie działa na receptory beta-adrenergiczne mięśnia sercowego. Działanie midodryny odpowiada zasadniczo działaniu innych leków alfa-sympatykomimetycznych. Po podaniu midodryny dochodzi do zwiększenia skurczowego i rozkurczowego ciśnienia krwi, jak również do odruchowej bradykardii. Zwiększenie ciśnienia krwi zasadniczo spowodowane jest poprzez obkurczenie drobnych żył i - w mniejszym stopniu – tętniczek, tj. przez zwiększenie oporu obwodowego. Deglimidodryna zmniejsza nieznacznie pojemność minutową serca i przepływ krwi przez nerki.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
Midodryna, działając na pęcherz moczowy zwiększa napięcie mięśniowe zwieracza pęcherza i tym samym opóźnia opróżnienie pęcherza.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, midodryna wchłania się szybko i niemal całkowicie. Po podaniu dawki 2,5 mg osiąga maksymalne stężenie w osoczu 10 µg/l w ciągu 30 minut od podania. Midodryna jest metabolizowana w drodze enzymatycznej hydrolizy w różnych tkankach (także w wątrobie) do właściwej substancji czynnej: deglimidodryny. Maksymalne stężenie deglimidodryny w osoczu u zdrowych ochotników i pacjentów z niedociśnieniem ortostatycznym występuje w ciągu ok. 1 godziny. Całkowita biodostępność midodryny (w postaci deglimidodryny) wynosi 93% po podaniu doustnym. Okres półtrwania eliminacji z osocza (t 1/2 ) midodryny wynosi 0,49 godziny, a jej czynnego metabolitu od 2 do 4 godzin. Midodryna i jej metabolity są niemal całkowicie wydalane z moczem w ciągu 24 godzin, ok. 40-60% w postaci aktywnego, głównego metabolitu, 2-5% w postaci niezmetabolizowanej midodryny, reszta jako farmakologiczne nieaktywne metabolity.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
Należy uwzględnić możliwość przeniknięcia przez midodrynę bariery krew-mózg. Brak danych klinicznych dotyczących farmakokinetyki midodryny lub jej metabolitu deglimidodryny u pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach toksyczności po podaniu wielokrotnym dawki przekraczającej 12-50 krotnie maksymalną dawkę terapeutyczną podawaną u ludzi przeliczeniu w mg/kg obserwowano, oprócz działania farmakologicznego midodryny, zwyrodnieniowe zmiany nerek u szczurów oraz zmiany w obrębie wątroby u szczurów i psów. Midodryna nie wykazuje właściwości mutagennych. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku Gutron, tabletki, 2,5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Magnezu stearynian, talk, krzemionka koloidalna bezwodna, celuloza mikrokrystaliczna, skrobia kukurydziana. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Al. 20 tabletek w dwóch blistrach po 10 sztuk. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Brak szczególnych wymagań.
- CHPL leku Gutron, tabletki, 2,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gutron , 2,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg chlorowodorku midodryny (Midodrini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Biała, okrągła obustronnie płaska tabletka o ściętych brzegach z wytłoczonymi literami „GU” nad i oznaczeniem dawki „2,5”pod linią podziału.
- CHPL leku Gutron, tabletki, 2,5 mgWskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie ortostatyczne.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Niedociśnienie ortostatyczne Leczenie powinno być dostosowane indywidualnie i prowadzone zależnie od napięcia i reaktywności układu wegetatywnego pacjenta. Zazwyczaj zalecane jest dawkowanie: Dorośli i młodzież ( > 12 lat): Początkowo 1 do 2 razy po pół tabletki na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 1 tabletce na dobę. Dawkowanie u pacjentów z niedociśnieniem w trakcie terapii preparatami psychotropowymi: 2 razy po 1 tabletce na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 2 tabletki na dobę. Midodrynę należy przyjmować w ciągu dnia, kiedy pacjent znajduje się w pozycji stojącej i wykonuje codzienne zajęcia. Zalecana przerwa między kolejnymi dawkami wynosi 3 do 4 godzin. Pierwszą dawkę należy przyjąć krótko po porannym wstaniu, następną w porze obiadowej i ewentualnie trzecią późnym popołudniem.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
Aby zminimalizować ryzyko nadmiernego podwyższenia ciśnienia tętniczego w pozycji leżącej, nie należy przyjmować midodryny po kolacji lub później niż 4 godziny przed położeniem się do łóżka. Dzieci Brak danych dotyczących stosowania. Pacjenci w podeszłym wieku Brak danych dotyczących stosowania. Pacjenci z zaburzeniami czynności wątroby i nerek Brak danych dotyczących stosowania. Sposób podawania Doustnie z płynem.
- CHPL leku Gutron, tabletki, 2,5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą; Ciężkie organiczne schorzenia serca i układu krwionośnego, nadciśnienie tętnicze, zaburzenia rytmu serca; Ostre zapalenie nerek, niewydolność nerek, przerost gruczołu krokowego z zaleganiem moczu, mechaniczne upośledzenie oddawania moczu, zatrzymanie moczu; Guz chromochłonny nadnerczy (Phaeochromocytoma); Nadczynność tarczycy; Jaskra z wąskim kątem przesączania; Ciąża i kamienie piersią.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W trakcie leczenia należy regularnie kontrolować ciśnienie tętnicze w pozycji leżącej, siedzącej oraz stojącej. Ryzyko wystąpienia nadciśnienia w pozycji leżącej lub siedzącej należy ocenić na początku leczenia. Należy zwrócić uwagę pacjenta na objawy wskazujące na wystąpienie nadciśnienia tętniczego (np. zawroty głowy, bóle głowy, zaburzenia widzenia) i pouczyć, aby w takim przypadku przerwać terapię i natychmiast skontaktować się z lekarzem. Nadciśnienia tętniczego w pozycji leżącej można uniknąć poprzez zmniejszenie dawki. Długotrwałe leczenie zaleca się wyłącznie u pacjentów, u których wystąpiła odpowiedź na leczenie początkowe. W przypadku wystąpienia dużych zmian ciśnienia krwi stosowanie midodryny należy przerwać. Należy unikać równoczesnego stosowania sympatykomimetyków i innych substancji obkurczających naczynia jak: rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy i inhibitory MAO, ponieważ może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
Podczas leczenia może wystąpić odruchowa bradykardia, dlatego należy zachować szczególną ostrożność podczas równoczesnego stosowania leków, które bezpośrednio lub pośrednio spowalniają częstość pracy serca (np. pochodne naparstnicy, leki blokujące receptory beta-adrenergiczne, substancje psychoaktywne). Pacjentów należy poinformować o konieczności zwrócenia uwagi na objawy subiektywne i obiektywne wskazujące na bradykardię (spowolnienie tętna, nasilone zawroty głowy, omdlenia, utrata świadomości) oraz należy zalecić przerwanie leczenia i natychmiastowy kontakt z lekarzem w razie wystąpienia tych objawów. Należy kontrolować ze szczególną starannością pacjentów z przerostem prawej komory serca. Należy zachować szczególną ostrożność również u pacjentów z jaskrą/zwiększonym ciśnieniem śródgałkowym lub znajdujących się w grupie zwiększonego ryzyka wystąpienia tych schorzeń, jak również podczas równoczesnego stosowania mineralokortykoidów/octanu fludrokortyzonu (ze względu na możliwość zwiększania ciśnienia śródgałkowego).
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
U pacjentów poddanych długotrwałemu leczeniu zaleca się kontrolowanie czynności nerek. Brak jest dostępnych danych dotyczących stosowania midodryny u dzieci, osób w podeszłym wieku i pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Równoczesne stosowanie z midodryną leków sympatykomimetycznych i innych substancji obkurczających naczynia krwionośne, jak rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki antyhistaminowe, hormony tarczycy i inhibitory MAO, może powodować znaczny wzrost ciśnienia krwi. Efekt działania midodryny może być zniesiony przez leki blokujące receptory alfa-adrenergiczne (takie jak prazosyna i fentolamina). Jednoczesne stosowanie środków blokujących receptory beta- adrenergiczne, może prowadzić do nasilonej bradykardii. Alkaloidy rauwolfii (rezerpina) mogą nieznacznie zwiększać działanie midodryny podwyższające ciśnienie krwi. Glikozydy naparstnicy mogą nasilać odruchową bradykardię i inne rodzaje zaburzeń przewodzenia wewnątrzsercowego lub zaburzenia rytmu. Przy równoczesnym stosowaniu atropiny i kortykosteroidów może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, z wykluczeniem glikozydów naczyniowych oraz leków wpływających na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA17 Midodryna jest pro-lekiem; przekształcana jest na drodze hydrolizy enzymatycznej do właściwej substancji czynnej - deglimidodryny. Deglimidodryna pobudza wybiórczo obwodowe receptory alfa1- adrenergiczne. Nie działa na receptory beta-adrenergiczne mięśnia sercowego. Działanie midodryny odpowiada zasadniczo działaniu innych leków alfa-sympatykomimetycznych. Po podaniu midodryny dochodzi do zwiększenia skurczowego i rozkurczowego ciśnienia krwi, jak również do odruchowej bradykardii. Zwiększenie ciśnienia krwi zasadniczo spowodowane jest poprzez obkurczenie drobnych żył i - w mniejszym stopniu – tętniczek, tj. przez zwiększenie oporu obwodowego. Deglimidodryna zmniejsza nieznacznie pojemność minutową serca i przepływ krwi przez nerki.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
Midodryna, działając na pęcherz moczowy zwiększa napięcie mięśniowe zwieracza pęcherza i tym samym opóźnia opróżnienie pęcherza.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, midodryna wchłania się szybko i niemal całkowicie. Po podaniu dawki 2,5 mg osiąga maksymalne stężenie w osoczu 10 µg/l w ciągu 30 minut od podania. Midodryna jest metabolizowana w drodze enzymatycznej hydrolizy w różnych tkankach (także w wątrobie) do właściwej substancji czynnej: deglimidodryny. Maksymalne stężenie deglimidodryny w osoczu u zdrowych ochotników i pacjentów z niedociśnieniem ortostatycznym występuje w ciągu ok. 1 godziny. Całkowita biodostępność midodryny (w postaci deglimidodryny) wynosi 93% po podaniu doustnym. Okres półtrwania eliminacji z osocza (t 1/2 ) midodryny wynosi 0,49 godziny, a jej czynnego metabolitu od 2 do 4 godzin. Midodryna i jej metabolity są niemal całkowicie wydalane z moczem w ciągu 24 godzin, ok. 40-60% w postaci aktywnego, głównego metabolitu, 2-5% w postaci niezmetabolizowanej midodryny, reszta jako farmakologiczne nieaktywne metabolity.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
Należy uwzględnić możliwość przeniknięcia przez midodrynę bariery krew-mózg. Brak danych klinicznych dotyczących farmakokinetyki midodryny lub jej metabolitu deglimidodryny u pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach toksyczności po podaniu wielokrotnym dawki przekraczającej 12-50 krotnie maksymalną dawkę terapeutyczną podawaną u ludzi przeliczeniu w mg/kg obserwowano, oprócz działania farmakologicznego midodryny, zwyrodnieniowe zmiany nerek u szczurów oraz zmiany w obrębie wątroby u szczurów i psów. Midodryna nie wykazuje właściwości mutagennych. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku Gutron, tabletki, 2,5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Magnezu stearynian, talk, krzemionka koloidalna bezwodna, celuloza mikrokrystaliczna, skrobia kukurydziana. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Al. 20 tabletek w dwóch blistrach po 10 sztuk. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Brak szczególnych wymagań.
- CHPL leku o rpl_id: 100386410Nazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gutron , 2,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg chlorowodorku midodryny (Midodrini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Biała, okrągła obustronnie płaska tabletka o ściętych brzegach z wytłoczonymi literami „GU” nad i oznaczeniem dawki „2,5”pod linią podziału.
- CHPL leku o rpl_id: 100386410Wskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie ortostatyczne.
- CHPL leku o rpl_id: 100386410Dawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Niedociśnienie ortostatyczne Leczenie powinno być dostosowane indywidualnie i prowadzone zależnie od napięcia i reaktywności układu wegetatywnego pacjenta. Zazwyczaj zalecane jest dawkowanie: Dorośli i młodzież ( > 12 lat): Początkowo 1 do 2 razy po pół tabletki na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 1 tabletce na dobę. Dawkowanie u pacjentów z niedociśnieniem w trakcie terapii preparatami psychotropowymi: 2 razy po 1 tabletce na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 2 tabletki na dobę. Midodrynę należy przyjmować w ciągu dnia, kiedy pacjent znajduje się w pozycji stojącej i wykonuje codzienne zajęcia. Zalecana przerwa między kolejnymi dawkami wynosi 3 do 4 godzin. Pierwszą dawkę należy przyjąć krótko po porannym wstaniu, następną w porze obiadowej i ewentualnie trzecią późnym popołudniem.
- CHPL leku o rpl_id: 100386410Dawkowanie
Aby zminimalizować ryzyko nadmiernego podwyższenia ciśnienia tętniczego w pozycji leżącej, nie należy przyjmować midodryny po kolacji lub później niż 4 godziny przed położeniem się do łóżka. Dzieci Brak danych dotyczących stosowania. Pacjenci w podeszłym wieku Brak danych dotyczących stosowania. Pacjenci z zaburzeniami czynności wątroby i nerek Brak danych dotyczących stosowania. Sposób podawania Doustnie z płynem.
- CHPL leku o rpl_id: 100386410Przeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą; Ciężkie organiczne schorzenia serca i układu krwionośnego, nadciśnienie tętnicze, zaburzenia rytmu serca; Ostre zapalenie nerek, niewydolność nerek, przerost gruczołu krokowego z zaleganiem moczu, mechaniczne upośledzenie oddawania moczu, zatrzymanie moczu; Guz chromochłonny nadnerczy (Phaeochromocytoma); Nadczynność tarczycy; Jaskra z wąskim kątem przesączania; Ciąża i kamienie piersią.
- CHPL leku o rpl_id: 100386410Specjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W trakcie leczenia należy regularnie kontrolować ciśnienie tętnicze w pozycji leżącej, siedzącej oraz stojącej. Ryzyko wystąpienia nadciśnienia w pozycji leżącej lub siedzącej należy ocenić na początku leczenia. Należy zwrócić uwagę pacjenta na objawy wskazujące na wystąpienie nadciśnienia tętniczego (np. zawroty głowy, bóle głowy, zaburzenia widzenia) i pouczyć, aby w takim przypadku przerwać terapię i natychmiast skontaktować się z lekarzem. Nadciśnienia tętniczego w pozycji leżącej można uniknąć poprzez zmniejszenie dawki. Długotrwałe leczenie zaleca się wyłącznie u pacjentów, u których wystąpiła odpowiedź na leczenie początkowe. W przypadku wystąpienia dużych zmian ciśnienia krwi stosowanie midodryny należy przerwać. Należy unikać równoczesnego stosowania sympatykomimetyków i innych substancji obkurczających naczynia jak: rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy i inhibitory MAO, ponieważ może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku o rpl_id: 100386410Specjalne środki ostrozności
Podczas leczenia może wystąpić odruchowa bradykardia, dlatego należy zachować szczególną ostrożność podczas równoczesnego stosowania leków, które bezpośrednio lub pośrednio spowalniają częstość pracy serca (np. pochodne naparstnicy, leki blokujące receptory beta-adrenergiczne, substancje psychoaktywne). Pacjentów należy poinformować o konieczności zwrócenia uwagi na objawy subiektywne i obiektywne wskazujące na bradykardię (spowolnienie tętna, nasilone zawroty głowy, omdlenia, utrata świadomości) oraz należy zalecić przerwanie leczenia i natychmiastowy kontakt z lekarzem w razie wystąpienia tych objawów. Należy kontrolować ze szczególną starannością pacjentów z przerostem prawej komory serca. Należy zachować szczególną ostrożność również u pacjentów z jaskrą/zwiększonym ciśnieniem śródgałkowym lub znajdujących się w grupie zwiększonego ryzyka wystąpienia tych schorzeń, jak również podczas równoczesnego stosowania mineralokortykoidów/octanu fludrokortyzonu (ze względu na możliwość zwiększania ciśnienia śródgałkowego).
- CHPL leku o rpl_id: 100386410Specjalne środki ostrozności
U pacjentów poddanych długotrwałemu leczeniu zaleca się kontrolowanie czynności nerek. Brak jest dostępnych danych dotyczących stosowania midodryny u dzieci, osób w podeszłym wieku i pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku o rpl_id: 100386410Interakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Równoczesne stosowanie z midodryną leków sympatykomimetycznych i innych substancji obkurczających naczynia krwionośne, jak rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki antyhistaminowe, hormony tarczycy i inhibitory MAO, może powodować znaczny wzrost ciśnienia krwi. Efekt działania midodryny może być zniesiony przez leki blokujące receptory alfa-adrenergiczne (takie jak prazosyna i fentolamina). Jednoczesne stosowanie środków blokujących receptory beta- adrenergiczne, może prowadzić do nasilonej bradykardii. Alkaloidy rauwolfii (rezerpina) mogą nieznacznie zwiększać działanie midodryny podwyższające ciśnienie krwi. Glikozydy naparstnicy mogą nasilać odruchową bradykardię i inne rodzaje zaburzeń przewodzenia wewnątrzsercowego lub zaburzenia rytmu. Przy równoczesnym stosowaniu atropiny i kortykosteroidów może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku o rpl_id: 100386410Interakcje
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku o rpl_id: 100386410Interakcje
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku o rpl_id: 100386410Interakcje
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku o rpl_id: 100386410Wpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią.
- CHPL leku o rpl_id: 100386410Wpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku o rpl_id: 100386410Działania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku o rpl_id: 100386410Przedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku o rpl_id: 100386410Właściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, z wykluczeniem glikozydów naczyniowych oraz leków wpływających na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA17 Midodryna jest pro-lekiem; przekształcana jest na drodze hydrolizy enzymatycznej do właściwej substancji czynnej - deglimidodryny. Deglimidodryna pobudza wybiórczo obwodowe receptory alfa1- adrenergiczne. Nie działa na receptory beta-adrenergiczne mięśnia sercowego. Działanie midodryny odpowiada zasadniczo działaniu innych leków alfa-sympatykomimetycznych. Po podaniu midodryny dochodzi do zwiększenia skurczowego i rozkurczowego ciśnienia krwi, jak również do odruchowej bradykardii. Zwiększenie ciśnienia krwi zasadniczo spowodowane jest poprzez obkurczenie drobnych żył i - w mniejszym stopniu – tętniczek, tj. przez zwiększenie oporu obwodowego. Deglimidodryna zmniejsza nieznacznie pojemność minutową serca i przepływ krwi przez nerki.
- CHPL leku o rpl_id: 100386410Właściwości farmakodynamiczne
Midodryna, działając na pęcherz moczowy zwiększa napięcie mięśniowe zwieracza pęcherza i tym samym opóźnia opróżnienie pęcherza.
- CHPL leku o rpl_id: 100386410Właściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, midodryna wchłania się szybko i niemal całkowicie. Po podaniu dawki 2,5 mg osiąga maksymalne stężenie w osoczu 10 µg/l w ciągu 30 minut od podania. Midodryna jest metabolizowana w drodze enzymatycznej hydrolizy w różnych tkankach (także w wątrobie) do właściwej substancji czynnej: deglimidodryny. Maksymalne stężenie deglimidodryny w osoczu u zdrowych ochotników i pacjentów z niedociśnieniem ortostatycznym występuje w ciągu ok. 1 godziny. Całkowita biodostępność midodryny (w postaci deglimidodryny) wynosi 93% po podaniu doustnym. Okres półtrwania eliminacji z osocza (t 1/2 ) midodryny wynosi 0,49 godziny, a jej czynnego metabolitu od 2 do 4 godzin. Midodryna i jej metabolity są niemal całkowicie wydalane z moczem w ciągu 24 godzin, ok. 40-60% w postaci aktywnego, głównego metabolitu, 2-5% w postaci niezmetabolizowanej midodryny, reszta jako farmakologiczne nieaktywne metabolity.
- CHPL leku o rpl_id: 100386410Właściwości farmakokinetyczne
Należy uwzględnić możliwość przeniknięcia przez midodrynę bariery krew-mózg. Brak danych klinicznych dotyczących farmakokinetyki midodryny lub jej metabolitu deglimidodryny u pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku o rpl_id: 100386410Przedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach toksyczności po podaniu wielokrotnym dawki przekraczającej 12-50 krotnie maksymalną dawkę terapeutyczną podawaną u ludzi przeliczeniu w mg/kg obserwowano, oprócz działania farmakologicznego midodryny, zwyrodnieniowe zmiany nerek u szczurów oraz zmiany w obrębie wątroby u szczurów i psów. Midodryna nie wykazuje właściwości mutagennych. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku o rpl_id: 100386410Dane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Magnezu stearynian, talk, krzemionka koloidalna bezwodna, celuloza mikrokrystaliczna, skrobia kukurydziana. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Al. 20 tabletek w dwóch blistrach po 10 sztuk. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Brak szczególnych wymagań.
- CHPL leku Gutron, tabletki, 2,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gutron , 2,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg chlorowodorku midodryny (Midodrini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Biała, okrągła obustronnie płaska tabletka o ściętych brzegach z wytłoczonymi literami „GU” nad i oznaczeniem dawki „2,5”pod linią podziału.
- CHPL leku Gutron, tabletki, 2,5 mgWskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie ortostatyczne.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Niedociśnienie ortostatyczne Leczenie powinno być dostosowane indywidualnie i prowadzone zależnie od napięcia i reaktywności układu wegetatywnego pacjenta. Zazwyczaj zalecane jest dawkowanie: Dorośli i młodzież ( > 12 lat): Początkowo 1 do 2 razy po pół tabletki na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 1 tabletce na dobę. Dawkowanie u pacjentów z niedociśnieniem w trakcie terapii preparatami psychotropowymi: 2 razy po 1 tabletce na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 2 tabletki na dobę. Midodrynę należy przyjmować w ciągu dnia, kiedy pacjent znajduje się w pozycji stojącej i wykonuje codzienne zajęcia. Zalecana przerwa między kolejnymi dawkami wynosi 3 do 4 godzin. Pierwszą dawkę należy przyjąć krótko po porannym wstaniu, następną w porze obiadowej i ewentualnie trzecią późnym popołudniem.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
Aby zminimalizować ryzyko nadmiernego podwyższenia ciśnienia tętniczego w pozycji leżącej, nie należy przyjmować midodryny po kolacji lub później niż 4 godziny przed położeniem się do łóżka. Dzieci Brak danych dotyczących stosowania. Pacjenci w podeszłym wieku Brak danych dotyczących stosowania. Pacjenci z zaburzeniami czynności wątroby i nerek Brak danych dotyczących stosowania. Sposób podawania Doustnie z płynem.
- CHPL leku Gutron, tabletki, 2,5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą; Ciężkie organiczne schorzenia serca i układu krwionośnego, nadciśnienie tętnicze, zaburzenia rytmu serca; Ostre zapalenie nerek, niewydolność nerek, przerost gruczołu krokowego z zaleganiem moczu, mechaniczne upośledzenie oddawania moczu, zatrzymanie moczu; Guz chromochłonny nadnerczy (Phaeochromocytoma); Nadczynność tarczycy; Jaskra z wąskim kątem przesączania; Ciąża i kamienie piersią.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W trakcie leczenia należy regularnie kontrolować ciśnienie tętnicze w pozycji leżącej, siedzącej oraz stojącej. Ryzyko wystąpienia nadciśnienia w pozycji leżącej lub siedzącej należy ocenić na początku leczenia. Należy zwrócić uwagę pacjenta na objawy wskazujące na wystąpienie nadciśnienia tętniczego (np. zawroty głowy, bóle głowy, zaburzenia widzenia) i pouczyć, aby w takim przypadku przerwać terapię i natychmiast skontaktować się z lekarzem. Nadciśnienia tętniczego w pozycji leżącej można uniknąć poprzez zmniejszenie dawki. Długotrwałe leczenie zaleca się wyłącznie u pacjentów, u których wystąpiła odpowiedź na leczenie początkowe. W przypadku wystąpienia dużych zmian ciśnienia krwi stosowanie midodryny należy przerwać. Należy unikać równoczesnego stosowania sympatykomimetyków i innych substancji obkurczających naczynia jak: rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy i inhibitory MAO, ponieważ może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
Podczas leczenia może wystąpić odruchowa bradykardia, dlatego należy zachować szczególną ostrożność podczas równoczesnego stosowania leków, które bezpośrednio lub pośrednio spowalniają częstość pracy serca (np. pochodne naparstnicy, leki blokujące receptory beta-adrenergiczne, substancje psychoaktywne). Pacjentów należy poinformować o konieczności zwrócenia uwagi na objawy subiektywne i obiektywne wskazujące na bradykardię (spowolnienie tętna, nasilone zawroty głowy, omdlenia, utrata świadomości) oraz należy zalecić przerwanie leczenia i natychmiastowy kontakt z lekarzem w razie wystąpienia tych objawów. Należy kontrolować ze szczególną starannością pacjentów z przerostem prawej komory serca. Należy zachować szczególną ostrożność również u pacjentów z jaskrą/zwiększonym ciśnieniem śródgałkowym lub znajdujących się w grupie zwiększonego ryzyka wystąpienia tych schorzeń, jak również podczas równoczesnego stosowania mineralokortykoidów/octanu fludrokortyzonu (ze względu na możliwość zwiększania ciśnienia śródgałkowego).
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
U pacjentów poddanych długotrwałemu leczeniu zaleca się kontrolowanie czynności nerek. Brak jest dostępnych danych dotyczących stosowania midodryny u dzieci, osób w podeszłym wieku i pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Równoczesne stosowanie z midodryną leków sympatykomimetycznych i innych substancji obkurczających naczynia krwionośne, jak rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki antyhistaminowe, hormony tarczycy i inhibitory MAO, może powodować znaczny wzrost ciśnienia krwi. Efekt działania midodryny może być zniesiony przez leki blokujące receptory alfa-adrenergiczne (takie jak prazosyna i fentolamina). Jednoczesne stosowanie środków blokujących receptory beta- adrenergiczne, może prowadzić do nasilonej bradykardii. Alkaloidy rauwolfii (rezerpina) mogą nieznacznie zwiększać działanie midodryny podwyższające ciśnienie krwi. Glikozydy naparstnicy mogą nasilać odruchową bradykardię i inne rodzaje zaburzeń przewodzenia wewnątrzsercowego lub zaburzenia rytmu. Przy równoczesnym stosowaniu atropiny i kortykosteroidów może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, z wykluczeniem glikozydów naczyniowych oraz leków wpływających na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA17 Midodryna jest pro-lekiem; przekształcana jest na drodze hydrolizy enzymatycznej do właściwej substancji czynnej - deglimidodryny. Deglimidodryna pobudza wybiórczo obwodowe receptory alfa1- adrenergiczne. Nie działa na receptory beta-adrenergiczne mięśnia sercowego. Działanie midodryny odpowiada zasadniczo działaniu innych leków alfa-sympatykomimetycznych. Po podaniu midodryny dochodzi do zwiększenia skurczowego i rozkurczowego ciśnienia krwi, jak również do odruchowej bradykardii. Zwiększenie ciśnienia krwi zasadniczo spowodowane jest poprzez obkurczenie drobnych żył i - w mniejszym stopniu – tętniczek, tj. przez zwiększenie oporu obwodowego. Deglimidodryna zmniejsza nieznacznie pojemność minutową serca i przepływ krwi przez nerki.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
Midodryna, działając na pęcherz moczowy zwiększa napięcie mięśniowe zwieracza pęcherza i tym samym opóźnia opróżnienie pęcherza.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, midodryna wchłania się szybko i niemal całkowicie. Po podaniu dawki 2,5 mg osiąga maksymalne stężenie w osoczu 10 µg/l w ciągu 30 minut od podania. Midodryna jest metabolizowana w drodze enzymatycznej hydrolizy w różnych tkankach (także w wątrobie) do właściwej substancji czynnej: deglimidodryny. Maksymalne stężenie deglimidodryny w osoczu u zdrowych ochotników i pacjentów z niedociśnieniem ortostatycznym występuje w ciągu ok. 1 godziny. Całkowita biodostępność midodryny (w postaci deglimidodryny) wynosi 93% po podaniu doustnym. Okres półtrwania eliminacji z osocza (t 1/2 ) midodryny wynosi 0,49 godziny, a jej czynnego metabolitu od 2 do 4 godzin. Midodryna i jej metabolity są niemal całkowicie wydalane z moczem w ciągu 24 godzin, ok. 40-60% w postaci aktywnego, głównego metabolitu, 2-5% w postaci niezmetabolizowanej midodryny, reszta jako farmakologiczne nieaktywne metabolity.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
Należy uwzględnić możliwość przeniknięcia przez midodrynę bariery krew-mózg. Brak danych klinicznych dotyczących farmakokinetyki midodryny lub jej metabolitu deglimidodryny u pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach toksyczności po podaniu wielokrotnym dawki przekraczającej 12-50 krotnie maksymalną dawkę terapeutyczną podawaną u ludzi przeliczeniu w mg/kg obserwowano, oprócz działania farmakologicznego midodryny, zwyrodnieniowe zmiany nerek u szczurów oraz zmiany w obrębie wątroby u szczurów i psów. Midodryna nie wykazuje właściwości mutagennych. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku Gutron, tabletki, 2,5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Magnezu stearynian, talk, krzemionka koloidalna bezwodna, celuloza mikrokrystaliczna, skrobia kukurydziana. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Al. 20 tabletek w dwóch blistrach po 10 sztuk. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Brak szczególnych wymagań.
- CHPL leku Gutron, tabletki, 2,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gutron , 2,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg chlorowodorku midodryny (Midodrini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Biała, okrągła obustronnie płaska tabletka o ściętych brzegach z wytłoczonymi literami „GU” nad i oznaczeniem dawki „2,5”pod linią podziału.
- CHPL leku Gutron, tabletki, 2,5 mgWskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie ortostatyczne.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Niedociśnienie ortostatyczne Leczenie powinno być dostosowane indywidualnie i prowadzone zależnie od napięcia i reaktywności układu wegetatywnego pacjenta. Zazwyczaj zalecane jest dawkowanie: Dorośli i młodzież ( > 12 lat): Początkowo 1 do 2 razy po pół tabletki na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 1 tabletce na dobę. Dawkowanie u pacjentów z niedociśnieniem w trakcie terapii preparatami psychotropowymi: 2 razy po 1 tabletce na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 2 tabletki na dobę. Midodrynę należy przyjmować w ciągu dnia, kiedy pacjent znajduje się w pozycji stojącej i wykonuje codzienne zajęcia. Zalecana przerwa między kolejnymi dawkami wynosi 3 do 4 godzin. Pierwszą dawkę należy przyjąć krótko po porannym wstaniu, następną w porze obiadowej i ewentualnie trzecią późnym popołudniem.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
Aby zminimalizować ryzyko nadmiernego podwyższenia ciśnienia tętniczego w pozycji leżącej, nie należy przyjmować midodryny po kolacji lub później niż 4 godziny przed położeniem się do łóżka. Dzieci Brak danych dotyczących stosowania. Pacjenci w podeszłym wieku Brak danych dotyczących stosowania. Pacjenci z zaburzeniami czynności wątroby i nerek Brak danych dotyczących stosowania. Sposób podawania Doustnie z płynem.
- CHPL leku Gutron, tabletki, 2,5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą; Ciężkie organiczne schorzenia serca i układu krwionośnego, nadciśnienie tętnicze, zaburzenia rytmu serca; Ostre zapalenie nerek, niewydolność nerek, przerost gruczołu krokowego z zaleganiem moczu, mechaniczne upośledzenie oddawania moczu, zatrzymanie moczu; Guz chromochłonny nadnerczy (Phaeochromocytoma); Nadczynność tarczycy; Jaskra z wąskim kątem przesączania; Ciąża i kamienie piersią.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W trakcie leczenia należy regularnie kontrolować ciśnienie tętnicze w pozycji leżącej, siedzącej oraz stojącej. Ryzyko wystąpienia nadciśnienia w pozycji leżącej lub siedzącej należy ocenić na początku leczenia. Należy zwrócić uwagę pacjenta na objawy wskazujące na wystąpienie nadciśnienia tętniczego (np. zawroty głowy, bóle głowy, zaburzenia widzenia) i pouczyć, aby w takim przypadku przerwać terapię i natychmiast skontaktować się z lekarzem. Nadciśnienia tętniczego w pozycji leżącej można uniknąć poprzez zmniejszenie dawki. Długotrwałe leczenie zaleca się wyłącznie u pacjentów, u których wystąpiła odpowiedź na leczenie początkowe. W przypadku wystąpienia dużych zmian ciśnienia krwi stosowanie midodryny należy przerwać. Należy unikać równoczesnego stosowania sympatykomimetyków i innych substancji obkurczających naczynia jak: rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy i inhibitory MAO, ponieważ może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
Podczas leczenia może wystąpić odruchowa bradykardia, dlatego należy zachować szczególną ostrożność podczas równoczesnego stosowania leków, które bezpośrednio lub pośrednio spowalniają częstość pracy serca (np. pochodne naparstnicy, leki blokujące receptory beta-adrenergiczne, substancje psychoaktywne). Pacjentów należy poinformować o konieczności zwrócenia uwagi na objawy subiektywne i obiektywne wskazujące na bradykardię (spowolnienie tętna, nasilone zawroty głowy, omdlenia, utrata świadomości) oraz należy zalecić przerwanie leczenia i natychmiastowy kontakt z lekarzem w razie wystąpienia tych objawów. Należy kontrolować ze szczególną starannością pacjentów z przerostem prawej komory serca. Należy zachować szczególną ostrożność również u pacjentów z jaskrą/zwiększonym ciśnieniem śródgałkowym lub znajdujących się w grupie zwiększonego ryzyka wystąpienia tych schorzeń, jak również podczas równoczesnego stosowania mineralokortykoidów/octanu fludrokortyzonu (ze względu na możliwość zwiększania ciśnienia śródgałkowego).
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
U pacjentów poddanych długotrwałemu leczeniu zaleca się kontrolowanie czynności nerek. Brak jest dostępnych danych dotyczących stosowania midodryny u dzieci, osób w podeszłym wieku i pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Równoczesne stosowanie z midodryną leków sympatykomimetycznych i innych substancji obkurczających naczynia krwionośne, jak rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki antyhistaminowe, hormony tarczycy i inhibitory MAO, może powodować znaczny wzrost ciśnienia krwi. Efekt działania midodryny może być zniesiony przez leki blokujące receptory alfa-adrenergiczne (takie jak prazosyna i fentolamina). Jednoczesne stosowanie środków blokujących receptory beta- adrenergiczne, może prowadzić do nasilonej bradykardii. Alkaloidy rauwolfii (rezerpina) mogą nieznacznie zwiększać działanie midodryny podwyższające ciśnienie krwi. Glikozydy naparstnicy mogą nasilać odruchową bradykardię i inne rodzaje zaburzeń przewodzenia wewnątrzsercowego lub zaburzenia rytmu. Przy równoczesnym stosowaniu atropiny i kortykosteroidów może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, z wykluczeniem glikozydów naczyniowych oraz leków wpływających na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA17 Midodryna jest pro-lekiem; przekształcana jest na drodze hydrolizy enzymatycznej do właściwej substancji czynnej - deglimidodryny. Deglimidodryna pobudza wybiórczo obwodowe receptory alfa1- adrenergiczne. Nie działa na receptory beta-adrenergiczne mięśnia sercowego. Działanie midodryny odpowiada zasadniczo działaniu innych leków alfa-sympatykomimetycznych. Po podaniu midodryny dochodzi do zwiększenia skurczowego i rozkurczowego ciśnienia krwi, jak również do odruchowej bradykardii. Zwiększenie ciśnienia krwi zasadniczo spowodowane jest poprzez obkurczenie drobnych żył i - w mniejszym stopniu – tętniczek, tj. przez zwiększenie oporu obwodowego. Deglimidodryna zmniejsza nieznacznie pojemność minutową serca i przepływ krwi przez nerki.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
Midodryna, działając na pęcherz moczowy zwiększa napięcie mięśniowe zwieracza pęcherza i tym samym opóźnia opróżnienie pęcherza.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, midodryna wchłania się szybko i niemal całkowicie. Po podaniu dawki 2,5 mg osiąga maksymalne stężenie w osoczu 10 µg/l w ciągu 30 minut od podania. Midodryna jest metabolizowana w drodze enzymatycznej hydrolizy w różnych tkankach (także w wątrobie) do właściwej substancji czynnej: deglimidodryny. Maksymalne stężenie deglimidodryny w osoczu u zdrowych ochotników i pacjentów z niedociśnieniem ortostatycznym występuje w ciągu ok. 1 godziny. Całkowita biodostępność midodryny (w postaci deglimidodryny) wynosi 93% po podaniu doustnym. Okres półtrwania eliminacji z osocza (t 1/2 ) midodryny wynosi 0,49 godziny, a jej czynnego metabolitu od 2 do 4 godzin. Midodryna i jej metabolity są niemal całkowicie wydalane z moczem w ciągu 24 godzin, ok. 40-60% w postaci aktywnego, głównego metabolitu, 2-5% w postaci niezmetabolizowanej midodryny, reszta jako farmakologiczne nieaktywne metabolity.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
Należy uwzględnić możliwość przeniknięcia przez midodrynę bariery krew-mózg. Brak danych klinicznych dotyczących farmakokinetyki midodryny lub jej metabolitu deglimidodryny u pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach toksyczności po podaniu wielokrotnym dawki przekraczającej 12-50 krotnie maksymalną dawkę terapeutyczną podawaną u ludzi przeliczeniu w mg/kg obserwowano, oprócz działania farmakologicznego midodryny, zwyrodnieniowe zmiany nerek u szczurów oraz zmiany w obrębie wątroby u szczurów i psów. Midodryna nie wykazuje właściwości mutagennych. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku Gutron, tabletki, 2,5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Magnezu stearynian, talk, krzemionka koloidalna bezwodna, celuloza mikrokrystaliczna, skrobia kukurydziana. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Al. 20 tabletek w dwóch blistrach po 10 sztuk. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Brak szczególnych wymagań.
- CHPL leku Gutron, tabletki, 2,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gutron , 2,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg chlorowodorku midodryny (Midodrini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Biała, okrągła obustronnie płaska tabletka o ściętych brzegach z wytłoczonymi literami „GU” nad i oznaczeniem dawki „2,5”pod linią podziału.
- CHPL leku Gutron, tabletki, 2,5 mgWskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie ortostatyczne.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Niedociśnienie ortostatyczne Leczenie powinno być dostosowane indywidualnie i prowadzone zależnie od napięcia i reaktywności układu wegetatywnego pacjenta. Zazwyczaj zalecane jest dawkowanie: Dorośli i młodzież ( > 12 lat): Początkowo 1 do 2 razy po pół tabletki na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 1 tabletce na dobę. Dawkowanie u pacjentów z niedociśnieniem w trakcie terapii preparatami psychotropowymi: 2 razy po 1 tabletce na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 2 tabletki na dobę. Midodrynę należy przyjmować w ciągu dnia, kiedy pacjent znajduje się w pozycji stojącej i wykonuje codzienne zajęcia. Zalecana przerwa między kolejnymi dawkami wynosi 3 do 4 godzin. Pierwszą dawkę należy przyjąć krótko po porannym wstaniu, następną w porze obiadowej i ewentualnie trzecią późnym popołudniem.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
Aby zminimalizować ryzyko nadmiernego podwyższenia ciśnienia tętniczego w pozycji leżącej, nie należy przyjmować midodryny po kolacji lub później niż 4 godziny przed położeniem się do łóżka. Dzieci Brak danych dotyczących stosowania. Pacjenci w podeszłym wieku Brak danych dotyczących stosowania. Pacjenci z zaburzeniami czynności wątroby i nerek Brak danych dotyczących stosowania. Sposób podawania Doustnie z płynem.
- CHPL leku Gutron, tabletki, 2,5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą; Ciężkie organiczne schorzenia serca i układu krwionośnego, nadciśnienie tętnicze, zaburzenia rytmu serca; Ostre zapalenie nerek, niewydolność nerek, przerost gruczołu krokowego z zaleganiem moczu, mechaniczne upośledzenie oddawania moczu, zatrzymanie moczu; Guz chromochłonny nadnerczy (Phaeochromocytoma); Nadczynność tarczycy; Jaskra z wąskim kątem przesączania; Ciąża i kamienie piersią.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W trakcie leczenia należy regularnie kontrolować ciśnienie tętnicze w pozycji leżącej, siedzącej oraz stojącej. Ryzyko wystąpienia nadciśnienia w pozycji leżącej lub siedzącej należy ocenić na początku leczenia. Należy zwrócić uwagę pacjenta na objawy wskazujące na wystąpienie nadciśnienia tętniczego (np. zawroty głowy, bóle głowy, zaburzenia widzenia) i pouczyć, aby w takim przypadku przerwać terapię i natychmiast skontaktować się z lekarzem. Nadciśnienia tętniczego w pozycji leżącej można uniknąć poprzez zmniejszenie dawki. Długotrwałe leczenie zaleca się wyłącznie u pacjentów, u których wystąpiła odpowiedź na leczenie początkowe. W przypadku wystąpienia dużych zmian ciśnienia krwi stosowanie midodryny należy przerwać. Należy unikać równoczesnego stosowania sympatykomimetyków i innych substancji obkurczających naczynia jak: rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy i inhibitory MAO, ponieważ może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
Podczas leczenia może wystąpić odruchowa bradykardia, dlatego należy zachować szczególną ostrożność podczas równoczesnego stosowania leków, które bezpośrednio lub pośrednio spowalniają częstość pracy serca (np. pochodne naparstnicy, leki blokujące receptory beta-adrenergiczne, substancje psychoaktywne). Pacjentów należy poinformować o konieczności zwrócenia uwagi na objawy subiektywne i obiektywne wskazujące na bradykardię (spowolnienie tętna, nasilone zawroty głowy, omdlenia, utrata świadomości) oraz należy zalecić przerwanie leczenia i natychmiastowy kontakt z lekarzem w razie wystąpienia tych objawów. Należy kontrolować ze szczególną starannością pacjentów z przerostem prawej komory serca. Należy zachować szczególną ostrożność również u pacjentów z jaskrą/zwiększonym ciśnieniem śródgałkowym lub znajdujących się w grupie zwiększonego ryzyka wystąpienia tych schorzeń, jak również podczas równoczesnego stosowania mineralokortykoidów/octanu fludrokortyzonu (ze względu na możliwość zwiększania ciśnienia śródgałkowego).
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
U pacjentów poddanych długotrwałemu leczeniu zaleca się kontrolowanie czynności nerek. Brak jest dostępnych danych dotyczących stosowania midodryny u dzieci, osób w podeszłym wieku i pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Równoczesne stosowanie z midodryną leków sympatykomimetycznych i innych substancji obkurczających naczynia krwionośne, jak rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki antyhistaminowe, hormony tarczycy i inhibitory MAO, może powodować znaczny wzrost ciśnienia krwi. Efekt działania midodryny może być zniesiony przez leki blokujące receptory alfa-adrenergiczne (takie jak prazosyna i fentolamina). Jednoczesne stosowanie środków blokujących receptory beta- adrenergiczne, może prowadzić do nasilonej bradykardii. Alkaloidy rauwolfii (rezerpina) mogą nieznacznie zwiększać działanie midodryny podwyższające ciśnienie krwi. Glikozydy naparstnicy mogą nasilać odruchową bradykardię i inne rodzaje zaburzeń przewodzenia wewnątrzsercowego lub zaburzenia rytmu. Przy równoczesnym stosowaniu atropiny i kortykosteroidów może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, z wykluczeniem glikozydów naczyniowych oraz leków wpływających na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA17 Midodryna jest pro-lekiem; przekształcana jest na drodze hydrolizy enzymatycznej do właściwej substancji czynnej - deglimidodryny. Deglimidodryna pobudza wybiórczo obwodowe receptory alfa1- adrenergiczne. Nie działa na receptory beta-adrenergiczne mięśnia sercowego. Działanie midodryny odpowiada zasadniczo działaniu innych leków alfa-sympatykomimetycznych. Po podaniu midodryny dochodzi do zwiększenia skurczowego i rozkurczowego ciśnienia krwi, jak również do odruchowej bradykardii. Zwiększenie ciśnienia krwi zasadniczo spowodowane jest poprzez obkurczenie drobnych żył i - w mniejszym stopniu – tętniczek, tj. przez zwiększenie oporu obwodowego. Deglimidodryna zmniejsza nieznacznie pojemność minutową serca i przepływ krwi przez nerki.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
Midodryna, działając na pęcherz moczowy zwiększa napięcie mięśniowe zwieracza pęcherza i tym samym opóźnia opróżnienie pęcherza.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, midodryna wchłania się szybko i niemal całkowicie. Po podaniu dawki 2,5 mg osiąga maksymalne stężenie w osoczu 10 µg/l w ciągu 30 minut od podania. Midodryna jest metabolizowana w drodze enzymatycznej hydrolizy w różnych tkankach (także w wątrobie) do właściwej substancji czynnej: deglimidodryny. Maksymalne stężenie deglimidodryny w osoczu u zdrowych ochotników i pacjentów z niedociśnieniem ortostatycznym występuje w ciągu ok. 1 godziny. Całkowita biodostępność midodryny (w postaci deglimidodryny) wynosi 93% po podaniu doustnym. Okres półtrwania eliminacji z osocza (t 1/2 ) midodryny wynosi 0,49 godziny, a jej czynnego metabolitu od 2 do 4 godzin. Midodryna i jej metabolity są niemal całkowicie wydalane z moczem w ciągu 24 godzin, ok. 40-60% w postaci aktywnego, głównego metabolitu, 2-5% w postaci niezmetabolizowanej midodryny, reszta jako farmakologiczne nieaktywne metabolity.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
Należy uwzględnić możliwość przeniknięcia przez midodrynę bariery krew-mózg. Brak danych klinicznych dotyczących farmakokinetyki midodryny lub jej metabolitu deglimidodryny u pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach toksyczności po podaniu wielokrotnym dawki przekraczającej 12-50 krotnie maksymalną dawkę terapeutyczną podawaną u ludzi przeliczeniu w mg/kg obserwowano, oprócz działania farmakologicznego midodryny, zwyrodnieniowe zmiany nerek u szczurów oraz zmiany w obrębie wątroby u szczurów i psów. Midodryna nie wykazuje właściwości mutagennych. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku Gutron, tabletki, 2,5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Magnezu stearynian, talk, krzemionka koloidalna bezwodna, celuloza mikrokrystaliczna, skrobia kukurydziana. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Al. 20 tabletek w dwóch blistrach po 10 sztuk. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Brak szczególnych wymagań.
- CHPL leku Gutron, tabletki, 2,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gutron , 2,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg chlorowodorku midodryny (Midodrini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Biała, okrągła obustronnie płaska tabletka o ściętych brzegach z wytłoczonymi literami „GU” nad i oznaczeniem dawki „2,5”pod linią podziału.
- CHPL leku Gutron, tabletki, 2,5 mgWskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie ortostatyczne.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Niedociśnienie ortostatyczne Leczenie powinno być dostosowane indywidualnie i prowadzone zależnie od napięcia i reaktywności układu wegetatywnego pacjenta. Zazwyczaj zalecane jest dawkowanie: Dorośli i młodzież ( > 12 lat): Początkowo 1 do 2 razy po pół tabletki na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 1 tabletce na dobę. Dawkowanie u pacjentów z niedociśnieniem w trakcie terapii preparatami psychotropowymi: 2 razy po 1 tabletce na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 2 tabletki na dobę. Midodrynę należy przyjmować w ciągu dnia, kiedy pacjent znajduje się w pozycji stojącej i wykonuje codzienne zajęcia. Zalecana przerwa między kolejnymi dawkami wynosi 3 do 4 godzin. Pierwszą dawkę należy przyjąć krótko po porannym wstaniu, następną w porze obiadowej i ewentualnie trzecią późnym popołudniem.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
Aby zminimalizować ryzyko nadmiernego podwyższenia ciśnienia tętniczego w pozycji leżącej, nie należy przyjmować midodryny po kolacji lub później niż 4 godziny przed położeniem się do łóżka. Dzieci Brak danych dotyczących stosowania. Pacjenci w podeszłym wieku Brak danych dotyczących stosowania. Pacjenci z zaburzeniami czynności wątroby i nerek Brak danych dotyczących stosowania. Sposób podawania Doustnie z płynem.
- CHPL leku Gutron, tabletki, 2,5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą; Ciężkie organiczne schorzenia serca i układu krwionośnego, nadciśnienie tętnicze, zaburzenia rytmu serca; Ostre zapalenie nerek, niewydolność nerek, przerost gruczołu krokowego z zaleganiem moczu, mechaniczne upośledzenie oddawania moczu, zatrzymanie moczu; Guz chromochłonny nadnerczy (Phaeochromocytoma); Nadczynność tarczycy; Jaskra z wąskim kątem przesączania; Ciąża i kamienie piersią.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W trakcie leczenia należy regularnie kontrolować ciśnienie tętnicze w pozycji leżącej, siedzącej oraz stojącej. Ryzyko wystąpienia nadciśnienia w pozycji leżącej lub siedzącej należy ocenić na początku leczenia. Należy zwrócić uwagę pacjenta na objawy wskazujące na wystąpienie nadciśnienia tętniczego (np. zawroty głowy, bóle głowy, zaburzenia widzenia) i pouczyć, aby w takim przypadku przerwać terapię i natychmiast skontaktować się z lekarzem. Nadciśnienia tętniczego w pozycji leżącej można uniknąć poprzez zmniejszenie dawki. Długotrwałe leczenie zaleca się wyłącznie u pacjentów, u których wystąpiła odpowiedź na leczenie początkowe. W przypadku wystąpienia dużych zmian ciśnienia krwi stosowanie midodryny należy przerwać. Należy unikać równoczesnego stosowania sympatykomimetyków i innych substancji obkurczających naczynia jak: rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy i inhibitory MAO, ponieważ może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
Podczas leczenia może wystąpić odruchowa bradykardia, dlatego należy zachować szczególną ostrożność podczas równoczesnego stosowania leków, które bezpośrednio lub pośrednio spowalniają częstość pracy serca (np. pochodne naparstnicy, leki blokujące receptory beta-adrenergiczne, substancje psychoaktywne). Pacjentów należy poinformować o konieczności zwrócenia uwagi na objawy subiektywne i obiektywne wskazujące na bradykardię (spowolnienie tętna, nasilone zawroty głowy, omdlenia, utrata świadomości) oraz należy zalecić przerwanie leczenia i natychmiastowy kontakt z lekarzem w razie wystąpienia tych objawów. Należy kontrolować ze szczególną starannością pacjentów z przerostem prawej komory serca. Należy zachować szczególną ostrożność również u pacjentów z jaskrą/zwiększonym ciśnieniem śródgałkowym lub znajdujących się w grupie zwiększonego ryzyka wystąpienia tych schorzeń, jak również podczas równoczesnego stosowania mineralokortykoidów/octanu fludrokortyzonu (ze względu na możliwość zwiększania ciśnienia śródgałkowego).
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
U pacjentów poddanych długotrwałemu leczeniu zaleca się kontrolowanie czynności nerek. Brak jest dostępnych danych dotyczących stosowania midodryny u dzieci, osób w podeszłym wieku i pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Równoczesne stosowanie z midodryną leków sympatykomimetycznych i innych substancji obkurczających naczynia krwionośne, jak rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki antyhistaminowe, hormony tarczycy i inhibitory MAO, może powodować znaczny wzrost ciśnienia krwi. Efekt działania midodryny może być zniesiony przez leki blokujące receptory alfa-adrenergiczne (takie jak prazosyna i fentolamina). Jednoczesne stosowanie środków blokujących receptory beta- adrenergiczne, może prowadzić do nasilonej bradykardii. Alkaloidy rauwolfii (rezerpina) mogą nieznacznie zwiększać działanie midodryny podwyższające ciśnienie krwi. Glikozydy naparstnicy mogą nasilać odruchową bradykardię i inne rodzaje zaburzeń przewodzenia wewnątrzsercowego lub zaburzenia rytmu. Przy równoczesnym stosowaniu atropiny i kortykosteroidów może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, z wykluczeniem glikozydów naczyniowych oraz leków wpływających na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA17 Midodryna jest pro-lekiem; przekształcana jest na drodze hydrolizy enzymatycznej do właściwej substancji czynnej - deglimidodryny. Deglimidodryna pobudza wybiórczo obwodowe receptory alfa1- adrenergiczne. Nie działa na receptory beta-adrenergiczne mięśnia sercowego. Działanie midodryny odpowiada zasadniczo działaniu innych leków alfa-sympatykomimetycznych. Po podaniu midodryny dochodzi do zwiększenia skurczowego i rozkurczowego ciśnienia krwi, jak również do odruchowej bradykardii. Zwiększenie ciśnienia krwi zasadniczo spowodowane jest poprzez obkurczenie drobnych żył i - w mniejszym stopniu – tętniczek, tj. przez zwiększenie oporu obwodowego. Deglimidodryna zmniejsza nieznacznie pojemność minutową serca i przepływ krwi przez nerki.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
Midodryna, działając na pęcherz moczowy zwiększa napięcie mięśniowe zwieracza pęcherza i tym samym opóźnia opróżnienie pęcherza.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, midodryna wchłania się szybko i niemal całkowicie. Po podaniu dawki 2,5 mg osiąga maksymalne stężenie w osoczu 10 µg/l w ciągu 30 minut od podania. Midodryna jest metabolizowana w drodze enzymatycznej hydrolizy w różnych tkankach (także w wątrobie) do właściwej substancji czynnej: deglimidodryny. Maksymalne stężenie deglimidodryny w osoczu u zdrowych ochotników i pacjentów z niedociśnieniem ortostatycznym występuje w ciągu ok. 1 godziny. Całkowita biodostępność midodryny (w postaci deglimidodryny) wynosi 93% po podaniu doustnym. Okres półtrwania eliminacji z osocza (t 1/2 ) midodryny wynosi 0,49 godziny, a jej czynnego metabolitu od 2 do 4 godzin. Midodryna i jej metabolity są niemal całkowicie wydalane z moczem w ciągu 24 godzin, ok. 40-60% w postaci aktywnego, głównego metabolitu, 2-5% w postaci niezmetabolizowanej midodryny, reszta jako farmakologiczne nieaktywne metabolity.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
Należy uwzględnić możliwość przeniknięcia przez midodrynę bariery krew-mózg. Brak danych klinicznych dotyczących farmakokinetyki midodryny lub jej metabolitu deglimidodryny u pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach toksyczności po podaniu wielokrotnym dawki przekraczającej 12-50 krotnie maksymalną dawkę terapeutyczną podawaną u ludzi przeliczeniu w mg/kg obserwowano, oprócz działania farmakologicznego midodryny, zwyrodnieniowe zmiany nerek u szczurów oraz zmiany w obrębie wątroby u szczurów i psów. Midodryna nie wykazuje właściwości mutagennych. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku Gutron, tabletki, 2,5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Magnezu stearynian, talk, krzemionka koloidalna bezwodna, celuloza mikrokrystaliczna, skrobia kukurydziana. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Al. 20 tabletek w dwóch blistrach po 10 sztuk. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Brak szczególnych wymagań.
- CHPL leku Gutron, tabletki, 2,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gutron , 2,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg chlorowodorku midodryny (Midodrini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Biała, okrągła obustronnie płaska tabletka o ściętych brzegach z wytłoczonymi literami „GU” nad i oznaczeniem dawki „2,5”pod linią podziału.
- CHPL leku Gutron, tabletki, 2,5 mgWskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie ortostatyczne.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Niedociśnienie ortostatyczne Leczenie powinno być dostosowane indywidualnie i prowadzone zależnie od napięcia i reaktywności układu wegetatywnego pacjenta. Zazwyczaj zalecane jest dawkowanie: Dorośli i młodzież ( > 12 lat): Początkowo 1 do 2 razy po pół tabletki na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 1 tabletce na dobę. Dawkowanie u pacjentów z niedociśnieniem w trakcie terapii preparatami psychotropowymi: 2 razy po 1 tabletce na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 2 tabletki na dobę. Midodrynę należy przyjmować w ciągu dnia, kiedy pacjent znajduje się w pozycji stojącej i wykonuje codzienne zajęcia. Zalecana przerwa między kolejnymi dawkami wynosi 3 do 4 godzin. Pierwszą dawkę należy przyjąć krótko po porannym wstaniu, następną w porze obiadowej i ewentualnie trzecią późnym popołudniem.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
Aby zminimalizować ryzyko nadmiernego podwyższenia ciśnienia tętniczego w pozycji leżącej, nie należy przyjmować midodryny po kolacji lub później niż 4 godziny przed położeniem się do łóżka. Dzieci Brak danych dotyczących stosowania. Pacjenci w podeszłym wieku Brak danych dotyczących stosowania. Pacjenci z zaburzeniami czynności wątroby i nerek Brak danych dotyczących stosowania. Sposób podawania Doustnie z płynem.
- CHPL leku Gutron, tabletki, 2,5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą; Ciężkie organiczne schorzenia serca i układu krwionośnego, nadciśnienie tętnicze, zaburzenia rytmu serca; Ostre zapalenie nerek, niewydolność nerek, przerost gruczołu krokowego z zaleganiem moczu, mechaniczne upośledzenie oddawania moczu, zatrzymanie moczu; Guz chromochłonny nadnerczy (Phaeochromocytoma); Nadczynność tarczycy; Jaskra z wąskim kątem przesączania; Ciąża i kamienie piersią.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W trakcie leczenia należy regularnie kontrolować ciśnienie tętnicze w pozycji leżącej, siedzącej oraz stojącej. Ryzyko wystąpienia nadciśnienia w pozycji leżącej lub siedzącej należy ocenić na początku leczenia. Należy zwrócić uwagę pacjenta na objawy wskazujące na wystąpienie nadciśnienia tętniczego (np. zawroty głowy, bóle głowy, zaburzenia widzenia) i pouczyć, aby w takim przypadku przerwać terapię i natychmiast skontaktować się z lekarzem. Nadciśnienia tętniczego w pozycji leżącej można uniknąć poprzez zmniejszenie dawki. Długotrwałe leczenie zaleca się wyłącznie u pacjentów, u których wystąpiła odpowiedź na leczenie początkowe. W przypadku wystąpienia dużych zmian ciśnienia krwi stosowanie midodryny należy przerwać. Należy unikać równoczesnego stosowania sympatykomimetyków i innych substancji obkurczających naczynia jak: rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy i inhibitory MAO, ponieważ może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
Podczas leczenia może wystąpić odruchowa bradykardia, dlatego należy zachować szczególną ostrożność podczas równoczesnego stosowania leków, które bezpośrednio lub pośrednio spowalniają częstość pracy serca (np. pochodne naparstnicy, leki blokujące receptory beta-adrenergiczne, substancje psychoaktywne). Pacjentów należy poinformować o konieczności zwrócenia uwagi na objawy subiektywne i obiektywne wskazujące na bradykardię (spowolnienie tętna, nasilone zawroty głowy, omdlenia, utrata świadomości) oraz należy zalecić przerwanie leczenia i natychmiastowy kontakt z lekarzem w razie wystąpienia tych objawów. Należy kontrolować ze szczególną starannością pacjentów z przerostem prawej komory serca. Należy zachować szczególną ostrożność również u pacjentów z jaskrą/zwiększonym ciśnieniem śródgałkowym lub znajdujących się w grupie zwiększonego ryzyka wystąpienia tych schorzeń, jak również podczas równoczesnego stosowania mineralokortykoidów/octanu fludrokortyzonu (ze względu na możliwość zwiększania ciśnienia śródgałkowego).
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
U pacjentów poddanych długotrwałemu leczeniu zaleca się kontrolowanie czynności nerek. Brak jest dostępnych danych dotyczących stosowania midodryny u dzieci, osób w podeszłym wieku i pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Równoczesne stosowanie z midodryną leków sympatykomimetycznych i innych substancji obkurczających naczynia krwionośne, jak rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki antyhistaminowe, hormony tarczycy i inhibitory MAO, może powodować znaczny wzrost ciśnienia krwi. Efekt działania midodryny może być zniesiony przez leki blokujące receptory alfa-adrenergiczne (takie jak prazosyna i fentolamina). Jednoczesne stosowanie środków blokujących receptory beta- adrenergiczne, może prowadzić do nasilonej bradykardii. Alkaloidy rauwolfii (rezerpina) mogą nieznacznie zwiększać działanie midodryny podwyższające ciśnienie krwi. Glikozydy naparstnicy mogą nasilać odruchową bradykardię i inne rodzaje zaburzeń przewodzenia wewnątrzsercowego lub zaburzenia rytmu. Przy równoczesnym stosowaniu atropiny i kortykosteroidów może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, z wykluczeniem glikozydów naczyniowych oraz leków wpływających na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA17 Midodryna jest pro-lekiem; przekształcana jest na drodze hydrolizy enzymatycznej do właściwej substancji czynnej - deglimidodryny. Deglimidodryna pobudza wybiórczo obwodowe receptory alfa1- adrenergiczne. Nie działa na receptory beta-adrenergiczne mięśnia sercowego. Działanie midodryny odpowiada zasadniczo działaniu innych leków alfa-sympatykomimetycznych. Po podaniu midodryny dochodzi do zwiększenia skurczowego i rozkurczowego ciśnienia krwi, jak również do odruchowej bradykardii. Zwiększenie ciśnienia krwi zasadniczo spowodowane jest poprzez obkurczenie drobnych żył i - w mniejszym stopniu – tętniczek, tj. przez zwiększenie oporu obwodowego. Deglimidodryna zmniejsza nieznacznie pojemność minutową serca i przepływ krwi przez nerki.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
Midodryna, działając na pęcherz moczowy zwiększa napięcie mięśniowe zwieracza pęcherza i tym samym opóźnia opróżnienie pęcherza.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, midodryna wchłania się szybko i niemal całkowicie. Po podaniu dawki 2,5 mg osiąga maksymalne stężenie w osoczu 10 µg/l w ciągu 30 minut od podania. Midodryna jest metabolizowana w drodze enzymatycznej hydrolizy w różnych tkankach (także w wątrobie) do właściwej substancji czynnej: deglimidodryny. Maksymalne stężenie deglimidodryny w osoczu u zdrowych ochotników i pacjentów z niedociśnieniem ortostatycznym występuje w ciągu ok. 1 godziny. Całkowita biodostępność midodryny (w postaci deglimidodryny) wynosi 93% po podaniu doustnym. Okres półtrwania eliminacji z osocza (t 1/2 ) midodryny wynosi 0,49 godziny, a jej czynnego metabolitu od 2 do 4 godzin. Midodryna i jej metabolity są niemal całkowicie wydalane z moczem w ciągu 24 godzin, ok. 40-60% w postaci aktywnego, głównego metabolitu, 2-5% w postaci niezmetabolizowanej midodryny, reszta jako farmakologiczne nieaktywne metabolity.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
Należy uwzględnić możliwość przeniknięcia przez midodrynę bariery krew-mózg. Brak danych klinicznych dotyczących farmakokinetyki midodryny lub jej metabolitu deglimidodryny u pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach toksyczności po podaniu wielokrotnym dawki przekraczającej 12-50 krotnie maksymalną dawkę terapeutyczną podawaną u ludzi przeliczeniu w mg/kg obserwowano, oprócz działania farmakologicznego midodryny, zwyrodnieniowe zmiany nerek u szczurów oraz zmiany w obrębie wątroby u szczurów i psów. Midodryna nie wykazuje właściwości mutagennych. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku Gutron, tabletki, 2,5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Magnezu stearynian, talk, krzemionka koloidalna bezwodna, celuloza mikrokrystaliczna, skrobia kukurydziana. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Al. 20 tabletek w dwóch blistrach po 10 sztuk. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Brak szczególnych wymagań.
- CHPL leku Gutron, tabletki, 2,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gutron , 2,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg chlorowodorku midodryny (Midodrini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Biała, okrągła obustronnie płaska tabletka o ściętych brzegach z wytłoczonymi literami „GU” nad i oznaczeniem dawki „2,5”pod linią podziału.
- CHPL leku Gutron, tabletki, 2,5 mgWskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie ortostatyczne.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Niedociśnienie ortostatyczne Leczenie powinno być dostosowane indywidualnie i prowadzone zależnie od napięcia i reaktywności układu wegetatywnego pacjenta. Zazwyczaj zalecane jest dawkowanie: Dorośli i młodzież ( > 12 lat): Początkowo 1 do 2 razy po pół tabletki na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 1 tabletce na dobę. Dawkowanie u pacjentów z niedociśnieniem w trakcie terapii preparatami psychotropowymi: 2 razy po 1 tabletce na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 2 tabletki na dobę. Midodrynę należy przyjmować w ciągu dnia, kiedy pacjent znajduje się w pozycji stojącej i wykonuje codzienne zajęcia. Zalecana przerwa między kolejnymi dawkami wynosi 3 do 4 godzin. Pierwszą dawkę należy przyjąć krótko po porannym wstaniu, następną w porze obiadowej i ewentualnie trzecią późnym popołudniem.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
Aby zminimalizować ryzyko nadmiernego podwyższenia ciśnienia tętniczego w pozycji leżącej, nie należy przyjmować midodryny po kolacji lub później niż 4 godziny przed położeniem się do łóżka. Dzieci Brak danych dotyczących stosowania. Pacjenci w podeszłym wieku Brak danych dotyczących stosowania. Pacjenci z zaburzeniami czynności wątroby i nerek Brak danych dotyczących stosowania. Sposób podawania Doustnie z płynem.
- CHPL leku Gutron, tabletki, 2,5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą; Ciężkie organiczne schorzenia serca i układu krwionośnego, nadciśnienie tętnicze, zaburzenia rytmu serca; Ostre zapalenie nerek, niewydolność nerek, przerost gruczołu krokowego z zaleganiem moczu, mechaniczne upośledzenie oddawania moczu, zatrzymanie moczu; Guz chromochłonny nadnerczy (Phaeochromocytoma); Nadczynność tarczycy; Jaskra z wąskim kątem przesączania; Ciąża i kamienie piersią.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W trakcie leczenia należy regularnie kontrolować ciśnienie tętnicze w pozycji leżącej, siedzącej oraz stojącej. Ryzyko wystąpienia nadciśnienia w pozycji leżącej lub siedzącej należy ocenić na początku leczenia. Należy zwrócić uwagę pacjenta na objawy wskazujące na wystąpienie nadciśnienia tętniczego (np. zawroty głowy, bóle głowy, zaburzenia widzenia) i pouczyć, aby w takim przypadku przerwać terapię i natychmiast skontaktować się z lekarzem. Nadciśnienia tętniczego w pozycji leżącej można uniknąć poprzez zmniejszenie dawki. Długotrwałe leczenie zaleca się wyłącznie u pacjentów, u których wystąpiła odpowiedź na leczenie początkowe. W przypadku wystąpienia dużych zmian ciśnienia krwi stosowanie midodryny należy przerwać. Należy unikać równoczesnego stosowania sympatykomimetyków i innych substancji obkurczających naczynia jak: rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy i inhibitory MAO, ponieważ może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
Podczas leczenia może wystąpić odruchowa bradykardia, dlatego należy zachować szczególną ostrożność podczas równoczesnego stosowania leków, które bezpośrednio lub pośrednio spowalniają częstość pracy serca (np. pochodne naparstnicy, leki blokujące receptory beta-adrenergiczne, substancje psychoaktywne). Pacjentów należy poinformować o konieczności zwrócenia uwagi na objawy subiektywne i obiektywne wskazujące na bradykardię (spowolnienie tętna, nasilone zawroty głowy, omdlenia, utrata świadomości) oraz należy zalecić przerwanie leczenia i natychmiastowy kontakt z lekarzem w razie wystąpienia tych objawów. Należy kontrolować ze szczególną starannością pacjentów z przerostem prawej komory serca. Należy zachować szczególną ostrożność również u pacjentów z jaskrą/zwiększonym ciśnieniem śródgałkowym lub znajdujących się w grupie zwiększonego ryzyka wystąpienia tych schorzeń, jak również podczas równoczesnego stosowania mineralokortykoidów/octanu fludrokortyzonu (ze względu na możliwość zwiększania ciśnienia śródgałkowego).
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
U pacjentów poddanych długotrwałemu leczeniu zaleca się kontrolowanie czynności nerek. Brak jest dostępnych danych dotyczących stosowania midodryny u dzieci, osób w podeszłym wieku i pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Równoczesne stosowanie z midodryną leków sympatykomimetycznych i innych substancji obkurczających naczynia krwionośne, jak rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki antyhistaminowe, hormony tarczycy i inhibitory MAO, może powodować znaczny wzrost ciśnienia krwi. Efekt działania midodryny może być zniesiony przez leki blokujące receptory alfa-adrenergiczne (takie jak prazosyna i fentolamina). Jednoczesne stosowanie środków blokujących receptory beta- adrenergiczne, może prowadzić do nasilonej bradykardii. Alkaloidy rauwolfii (rezerpina) mogą nieznacznie zwiększać działanie midodryny podwyższające ciśnienie krwi. Glikozydy naparstnicy mogą nasilać odruchową bradykardię i inne rodzaje zaburzeń przewodzenia wewnątrzsercowego lub zaburzenia rytmu. Przy równoczesnym stosowaniu atropiny i kortykosteroidów może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, z wykluczeniem glikozydów naczyniowych oraz leków wpływających na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA17 Midodryna jest pro-lekiem; przekształcana jest na drodze hydrolizy enzymatycznej do właściwej substancji czynnej - deglimidodryny. Deglimidodryna pobudza wybiórczo obwodowe receptory alfa1- adrenergiczne. Nie działa na receptory beta-adrenergiczne mięśnia sercowego. Działanie midodryny odpowiada zasadniczo działaniu innych leków alfa-sympatykomimetycznych. Po podaniu midodryny dochodzi do zwiększenia skurczowego i rozkurczowego ciśnienia krwi, jak również do odruchowej bradykardii. Zwiększenie ciśnienia krwi zasadniczo spowodowane jest poprzez obkurczenie drobnych żył i - w mniejszym stopniu – tętniczek, tj. przez zwiększenie oporu obwodowego. Deglimidodryna zmniejsza nieznacznie pojemność minutową serca i przepływ krwi przez nerki.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
Midodryna, działając na pęcherz moczowy zwiększa napięcie mięśniowe zwieracza pęcherza i tym samym opóźnia opróżnienie pęcherza.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, midodryna wchłania się szybko i niemal całkowicie. Po podaniu dawki 2,5 mg osiąga maksymalne stężenie w osoczu 10 µg/l w ciągu 30 minut od podania. Midodryna jest metabolizowana w drodze enzymatycznej hydrolizy w różnych tkankach (także w wątrobie) do właściwej substancji czynnej: deglimidodryny. Maksymalne stężenie deglimidodryny w osoczu u zdrowych ochotników i pacjentów z niedociśnieniem ortostatycznym występuje w ciągu ok. 1 godziny. Całkowita biodostępność midodryny (w postaci deglimidodryny) wynosi 93% po podaniu doustnym. Okres półtrwania eliminacji z osocza (t 1/2 ) midodryny wynosi 0,49 godziny, a jej czynnego metabolitu od 2 do 4 godzin. Midodryna i jej metabolity są niemal całkowicie wydalane z moczem w ciągu 24 godzin, ok. 40-60% w postaci aktywnego, głównego metabolitu, 2-5% w postaci niezmetabolizowanej midodryny, reszta jako farmakologiczne nieaktywne metabolity.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
Należy uwzględnić możliwość przeniknięcia przez midodrynę bariery krew-mózg. Brak danych klinicznych dotyczących farmakokinetyki midodryny lub jej metabolitu deglimidodryny u pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach toksyczności po podaniu wielokrotnym dawki przekraczającej 12-50 krotnie maksymalną dawkę terapeutyczną podawaną u ludzi przeliczeniu w mg/kg obserwowano, oprócz działania farmakologicznego midodryny, zwyrodnieniowe zmiany nerek u szczurów oraz zmiany w obrębie wątroby u szczurów i psów. Midodryna nie wykazuje właściwości mutagennych. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku Gutron, tabletki, 2,5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Magnezu stearynian, talk, krzemionka koloidalna bezwodna, celuloza mikrokrystaliczna, skrobia kukurydziana. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Al. 20 tabletek w dwóch blistrach po 10 sztuk. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Brak szczególnych wymagań.
- CHPL leku Gutron, tabletki, 2,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gutron , 2,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg chlorowodorku midodryny (Midodrini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Biała, okrągła obustronnie płaska tabletka o ściętych brzegach z wytłoczonymi literami „GU” nad i oznaczeniem dawki „2,5”pod linią podziału.
- CHPL leku Gutron, tabletki, 2,5 mgWskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie ortostatyczne.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Niedociśnienie ortostatyczne Leczenie powinno być dostosowane indywidualnie i prowadzone zależnie od napięcia i reaktywności układu wegetatywnego pacjenta. Zazwyczaj zalecane jest dawkowanie: Dorośli i młodzież ( > 12 lat): Początkowo 1 do 2 razy po pół tabletki na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 1 tabletce na dobę. Dawkowanie u pacjentów z niedociśnieniem w trakcie terapii preparatami psychotropowymi: 2 razy po 1 tabletce na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 2 tabletki na dobę. Midodrynę należy przyjmować w ciągu dnia, kiedy pacjent znajduje się w pozycji stojącej i wykonuje codzienne zajęcia. Zalecana przerwa między kolejnymi dawkami wynosi 3 do 4 godzin. Pierwszą dawkę należy przyjąć krótko po porannym wstaniu, następną w porze obiadowej i ewentualnie trzecią późnym popołudniem.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
Aby zminimalizować ryzyko nadmiernego podwyższenia ciśnienia tętniczego w pozycji leżącej, nie należy przyjmować midodryny po kolacji lub później niż 4 godziny przed położeniem się do łóżka. Dzieci Brak danych dotyczących stosowania. Pacjenci w podeszłym wieku Brak danych dotyczących stosowania. Pacjenci z zaburzeniami czynności wątroby i nerek Brak danych dotyczących stosowania. Sposób podawania Doustnie z płynem.
- CHPL leku Gutron, tabletki, 2,5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą; Ciężkie organiczne schorzenia serca i układu krwionośnego, nadciśnienie tętnicze, zaburzenia rytmu serca; Ostre zapalenie nerek, niewydolność nerek, przerost gruczołu krokowego z zaleganiem moczu, mechaniczne upośledzenie oddawania moczu, zatrzymanie moczu; Guz chromochłonny nadnerczy (Phaeochromocytoma); Nadczynność tarczycy; Jaskra z wąskim kątem przesączania; Ciąża i kamienie piersią.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W trakcie leczenia należy regularnie kontrolować ciśnienie tętnicze w pozycji leżącej, siedzącej oraz stojącej. Ryzyko wystąpienia nadciśnienia w pozycji leżącej lub siedzącej należy ocenić na początku leczenia. Należy zwrócić uwagę pacjenta na objawy wskazujące na wystąpienie nadciśnienia tętniczego (np. zawroty głowy, bóle głowy, zaburzenia widzenia) i pouczyć, aby w takim przypadku przerwać terapię i natychmiast skontaktować się z lekarzem. Nadciśnienia tętniczego w pozycji leżącej można uniknąć poprzez zmniejszenie dawki. Długotrwałe leczenie zaleca się wyłącznie u pacjentów, u których wystąpiła odpowiedź na leczenie początkowe. W przypadku wystąpienia dużych zmian ciśnienia krwi stosowanie midodryny należy przerwać. Należy unikać równoczesnego stosowania sympatykomimetyków i innych substancji obkurczających naczynia jak: rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy i inhibitory MAO, ponieważ może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
Podczas leczenia może wystąpić odruchowa bradykardia, dlatego należy zachować szczególną ostrożność podczas równoczesnego stosowania leków, które bezpośrednio lub pośrednio spowalniają częstość pracy serca (np. pochodne naparstnicy, leki blokujące receptory beta-adrenergiczne, substancje psychoaktywne). Pacjentów należy poinformować o konieczności zwrócenia uwagi na objawy subiektywne i obiektywne wskazujące na bradykardię (spowolnienie tętna, nasilone zawroty głowy, omdlenia, utrata świadomości) oraz należy zalecić przerwanie leczenia i natychmiastowy kontakt z lekarzem w razie wystąpienia tych objawów. Należy kontrolować ze szczególną starannością pacjentów z przerostem prawej komory serca. Należy zachować szczególną ostrożność również u pacjentów z jaskrą/zwiększonym ciśnieniem śródgałkowym lub znajdujących się w grupie zwiększonego ryzyka wystąpienia tych schorzeń, jak również podczas równoczesnego stosowania mineralokortykoidów/octanu fludrokortyzonu (ze względu na możliwość zwiększania ciśnienia śródgałkowego).
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
U pacjentów poddanych długotrwałemu leczeniu zaleca się kontrolowanie czynności nerek. Brak jest dostępnych danych dotyczących stosowania midodryny u dzieci, osób w podeszłym wieku i pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Równoczesne stosowanie z midodryną leków sympatykomimetycznych i innych substancji obkurczających naczynia krwionośne, jak rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki antyhistaminowe, hormony tarczycy i inhibitory MAO, może powodować znaczny wzrost ciśnienia krwi. Efekt działania midodryny może być zniesiony przez leki blokujące receptory alfa-adrenergiczne (takie jak prazosyna i fentolamina). Jednoczesne stosowanie środków blokujących receptory beta- adrenergiczne, może prowadzić do nasilonej bradykardii. Alkaloidy rauwolfii (rezerpina) mogą nieznacznie zwiększać działanie midodryny podwyższające ciśnienie krwi. Glikozydy naparstnicy mogą nasilać odruchową bradykardię i inne rodzaje zaburzeń przewodzenia wewnątrzsercowego lub zaburzenia rytmu. Przy równoczesnym stosowaniu atropiny i kortykosteroidów może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, z wykluczeniem glikozydów naczyniowych oraz leków wpływających na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA17 Midodryna jest pro-lekiem; przekształcana jest na drodze hydrolizy enzymatycznej do właściwej substancji czynnej - deglimidodryny. Deglimidodryna pobudza wybiórczo obwodowe receptory alfa1- adrenergiczne. Nie działa na receptory beta-adrenergiczne mięśnia sercowego. Działanie midodryny odpowiada zasadniczo działaniu innych leków alfa-sympatykomimetycznych. Po podaniu midodryny dochodzi do zwiększenia skurczowego i rozkurczowego ciśnienia krwi, jak również do odruchowej bradykardii. Zwiększenie ciśnienia krwi zasadniczo spowodowane jest poprzez obkurczenie drobnych żył i - w mniejszym stopniu – tętniczek, tj. przez zwiększenie oporu obwodowego. Deglimidodryna zmniejsza nieznacznie pojemność minutową serca i przepływ krwi przez nerki.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
Midodryna, działając na pęcherz moczowy zwiększa napięcie mięśniowe zwieracza pęcherza i tym samym opóźnia opróżnienie pęcherza.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, midodryna wchłania się szybko i niemal całkowicie. Po podaniu dawki 2,5 mg osiąga maksymalne stężenie w osoczu 10 µg/l w ciągu 30 minut od podania. Midodryna jest metabolizowana w drodze enzymatycznej hydrolizy w różnych tkankach (także w wątrobie) do właściwej substancji czynnej: deglimidodryny. Maksymalne stężenie deglimidodryny w osoczu u zdrowych ochotników i pacjentów z niedociśnieniem ortostatycznym występuje w ciągu ok. 1 godziny. Całkowita biodostępność midodryny (w postaci deglimidodryny) wynosi 93% po podaniu doustnym. Okres półtrwania eliminacji z osocza (t 1/2 ) midodryny wynosi 0,49 godziny, a jej czynnego metabolitu od 2 do 4 godzin. Midodryna i jej metabolity są niemal całkowicie wydalane z moczem w ciągu 24 godzin, ok. 40-60% w postaci aktywnego, głównego metabolitu, 2-5% w postaci niezmetabolizowanej midodryny, reszta jako farmakologiczne nieaktywne metabolity.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
Należy uwzględnić możliwość przeniknięcia przez midodrynę bariery krew-mózg. Brak danych klinicznych dotyczących farmakokinetyki midodryny lub jej metabolitu deglimidodryny u pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach toksyczności po podaniu wielokrotnym dawki przekraczającej 12-50 krotnie maksymalną dawkę terapeutyczną podawaną u ludzi przeliczeniu w mg/kg obserwowano, oprócz działania farmakologicznego midodryny, zwyrodnieniowe zmiany nerek u szczurów oraz zmiany w obrębie wątroby u szczurów i psów. Midodryna nie wykazuje właściwości mutagennych. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku Gutron, tabletki, 2,5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Magnezu stearynian, talk, krzemionka koloidalna bezwodna, celuloza mikrokrystaliczna, skrobia kukurydziana. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Al. 20 tabletek w dwóch blistrach po 10 sztuk. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Brak szczególnych wymagań.
- CHPL leku Gutron, tabletki, 2,5 mgNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Gutron , 2,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 2,5 mg chlorowodorku midodryny (Midodrini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Tabletki. Biała, okrągła obustronnie płaska tabletka o ściętych brzegach z wytłoczonymi literami „GU” nad i oznaczeniem dawki „2,5”pod linią podziału.
- CHPL leku Gutron, tabletki, 2,5 mgWskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie ortostatyczne.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Niedociśnienie ortostatyczne Leczenie powinno być dostosowane indywidualnie i prowadzone zależnie od napięcia i reaktywności układu wegetatywnego pacjenta. Zazwyczaj zalecane jest dawkowanie: Dorośli i młodzież ( > 12 lat): Początkowo 1 do 2 razy po pół tabletki na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 1 tabletce na dobę. Dawkowanie u pacjentów z niedociśnieniem w trakcie terapii preparatami psychotropowymi: 2 razy po 1 tabletce na dobę. Przy braku dostatecznego działania dawkę można zwiększyć do 2 - 3 razy po 2 tabletki na dobę. Midodrynę należy przyjmować w ciągu dnia, kiedy pacjent znajduje się w pozycji stojącej i wykonuje codzienne zajęcia. Zalecana przerwa między kolejnymi dawkami wynosi 3 do 4 godzin. Pierwszą dawkę należy przyjąć krótko po porannym wstaniu, następną w porze obiadowej i ewentualnie trzecią późnym popołudniem.
- CHPL leku Gutron, tabletki, 2,5 mgDawkowanie
Aby zminimalizować ryzyko nadmiernego podwyższenia ciśnienia tętniczego w pozycji leżącej, nie należy przyjmować midodryny po kolacji lub później niż 4 godziny przed położeniem się do łóżka. Dzieci Brak danych dotyczących stosowania. Pacjenci w podeszłym wieku Brak danych dotyczących stosowania. Pacjenci z zaburzeniami czynności wątroby i nerek Brak danych dotyczących stosowania. Sposób podawania Doustnie z płynem.
- CHPL leku Gutron, tabletki, 2,5 mgPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą; Ciężkie organiczne schorzenia serca i układu krwionośnego, nadciśnienie tętnicze, zaburzenia rytmu serca; Ostre zapalenie nerek, niewydolność nerek, przerost gruczołu krokowego z zaleganiem moczu, mechaniczne upośledzenie oddawania moczu, zatrzymanie moczu; Guz chromochłonny nadnerczy (Phaeochromocytoma); Nadczynność tarczycy; Jaskra z wąskim kątem przesączania; Ciąża i kamienie piersią.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W trakcie leczenia należy regularnie kontrolować ciśnienie tętnicze w pozycji leżącej, siedzącej oraz stojącej. Ryzyko wystąpienia nadciśnienia w pozycji leżącej lub siedzącej należy ocenić na początku leczenia. Należy zwrócić uwagę pacjenta na objawy wskazujące na wystąpienie nadciśnienia tętniczego (np. zawroty głowy, bóle głowy, zaburzenia widzenia) i pouczyć, aby w takim przypadku przerwać terapię i natychmiast skontaktować się z lekarzem. Nadciśnienia tętniczego w pozycji leżącej można uniknąć poprzez zmniejszenie dawki. Długotrwałe leczenie zaleca się wyłącznie u pacjentów, u których wystąpiła odpowiedź na leczenie początkowe. W przypadku wystąpienia dużych zmian ciśnienia krwi stosowanie midodryny należy przerwać. Należy unikać równoczesnego stosowania sympatykomimetyków i innych substancji obkurczających naczynia jak: rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki przeciwhistaminowe, hormony tarczycy i inhibitory MAO, ponieważ może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
Podczas leczenia może wystąpić odruchowa bradykardia, dlatego należy zachować szczególną ostrożność podczas równoczesnego stosowania leków, które bezpośrednio lub pośrednio spowalniają częstość pracy serca (np. pochodne naparstnicy, leki blokujące receptory beta-adrenergiczne, substancje psychoaktywne). Pacjentów należy poinformować o konieczności zwrócenia uwagi na objawy subiektywne i obiektywne wskazujące na bradykardię (spowolnienie tętna, nasilone zawroty głowy, omdlenia, utrata świadomości) oraz należy zalecić przerwanie leczenia i natychmiastowy kontakt z lekarzem w razie wystąpienia tych objawów. Należy kontrolować ze szczególną starannością pacjentów z przerostem prawej komory serca. Należy zachować szczególną ostrożność również u pacjentów z jaskrą/zwiększonym ciśnieniem śródgałkowym lub znajdujących się w grupie zwiększonego ryzyka wystąpienia tych schorzeń, jak również podczas równoczesnego stosowania mineralokortykoidów/octanu fludrokortyzonu (ze względu na możliwość zwiększania ciśnienia śródgałkowego).
- CHPL leku Gutron, tabletki, 2,5 mgSpecjalne środki ostrozności
U pacjentów poddanych długotrwałemu leczeniu zaleca się kontrolowanie czynności nerek. Brak jest dostępnych danych dotyczących stosowania midodryny u dzieci, osób w podeszłym wieku i pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.5 Interakcje z innymi lekami i inne rodzaje interakcji Równoczesne stosowanie z midodryną leków sympatykomimetycznych i innych substancji obkurczających naczynia krwionośne, jak rezerpina, guanetydyna, trójpierścieniowe leki przeciwdepresyjne, leki antyhistaminowe, hormony tarczycy i inhibitory MAO, może powodować znaczny wzrost ciśnienia krwi. Efekt działania midodryny może być zniesiony przez leki blokujące receptory alfa-adrenergiczne (takie jak prazosyna i fentolamina). Jednoczesne stosowanie środków blokujących receptory beta- adrenergiczne, może prowadzić do nasilonej bradykardii. Alkaloidy rauwolfii (rezerpina) mogą nieznacznie zwiększać działanie midodryny podwyższające ciśnienie krwi. Glikozydy naparstnicy mogą nasilać odruchową bradykardię i inne rodzaje zaburzeń przewodzenia wewnątrzsercowego lub zaburzenia rytmu. Przy równoczesnym stosowaniu atropiny i kortykosteroidów może dojść do nadmiernego wzrostu ciśnienia krwi.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgInterakcje
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na płodność, ciążę i laktację
4.6 Ciąża i laktacja W badaniach na zwierzętach nie wykazano działania teratogennego midodryny. Dawki przekraczające 50. krotnie maksymalną dawkę stosowaną u ludzi w przeliczeniu na mg/kg masy ciała, powodowały zwiększenie częstości obumierania zarodków po zagnieżdżeniu się w macicy u szczurów i królików. Brak danych dotyczących stosowania u ludzi. Nie wiadomo, czy midodryna lub deglimidodryna przenika do mleka. Z tego powodu nie należy stosować midodryny podczas ciąży i karmienia piersią.
- CHPL leku Gutron, tabletki, 2,5 mgWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem midodryny na zdolność reakcji i zdolność prowadzenia pojazdów. Podczas kierowania pojazdem lub obsługi maszyn należy pamiętać o tym, że podczas leczenia może niekiedy wystąpić niepokój, pobudliwość i rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgDziałania niepożądane
4.8 Działania niepożądane Następujące działania niepożądane mogą wystąpić bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i łącznie z pojedynczymi przypadkami. Zaburzenia serca, krwi i układu chłonnego Często i w zależności od dawki Nadciśnienie tętnicze w pozycji leżącej. Niezbyt często Bradykardia, tachykardia, kołatanie serca. Rzadko Zaburzenia rytmu pochodzenia komorowego. Zaburzenia skóry i tkanki podskórnej Często Parestezje, świąd (głównie w obrębie głowy), uczucie zimna, jeżenie się włosów. Zaburzenia żołądkowo-jelitowe Niezbyt często Nudności/niestrawność, zgaga, zapalenie błony śluzowej jamy ustnej. Zaburzenia nerek i dróg moczowych Niezbyt często i w zależności od dawki Zatrzymanie moczu, zaburzenia oddawania moczu. Zaburzenia ukłądu nerwowego Niezbyt często Bóle głowy, niepokój, pobudliwość, rozdrażnienie.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedawkowanie
4.9 Przedawkowanie W przypadku przedawkowania mogą w nasilonym stopniu wystąpić działania niepożądane, szczególnie nadciśnienie tętnicze, jeżenie się włosów, uczucie zimna, bradykardia i zatrzymanie moczu. Oprócz ogólnego postępowania przy zatruciu może być konieczne zastosowanie leków alfa-sympatykolitycznych (np. fentolamina). Przy bradykardii i zaburzeniach rytmu serca można zastosować atropinę (uwaga: wzrost ciśnienia tętniczego!). Deglimidodrynę można usunąć na drodze dializy.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, z wykluczeniem glikozydów naczyniowych oraz leków wpływających na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA17 Midodryna jest pro-lekiem; przekształcana jest na drodze hydrolizy enzymatycznej do właściwej substancji czynnej - deglimidodryny. Deglimidodryna pobudza wybiórczo obwodowe receptory alfa1- adrenergiczne. Nie działa na receptory beta-adrenergiczne mięśnia sercowego. Działanie midodryny odpowiada zasadniczo działaniu innych leków alfa-sympatykomimetycznych. Po podaniu midodryny dochodzi do zwiększenia skurczowego i rozkurczowego ciśnienia krwi, jak również do odruchowej bradykardii. Zwiększenie ciśnienia krwi zasadniczo spowodowane jest poprzez obkurczenie drobnych żył i - w mniejszym stopniu – tętniczek, tj. przez zwiększenie oporu obwodowego. Deglimidodryna zmniejsza nieznacznie pojemność minutową serca i przepływ krwi przez nerki.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakodynamiczne
Midodryna, działając na pęcherz moczowy zwiększa napięcie mięśniowe zwieracza pęcherza i tym samym opóźnia opróżnienie pęcherza.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Po podaniu doustnym, midodryna wchłania się szybko i niemal całkowicie. Po podaniu dawki 2,5 mg osiąga maksymalne stężenie w osoczu 10 µg/l w ciągu 30 minut od podania. Midodryna jest metabolizowana w drodze enzymatycznej hydrolizy w różnych tkankach (także w wątrobie) do właściwej substancji czynnej: deglimidodryny. Maksymalne stężenie deglimidodryny w osoczu u zdrowych ochotników i pacjentów z niedociśnieniem ortostatycznym występuje w ciągu ok. 1 godziny. Całkowita biodostępność midodryny (w postaci deglimidodryny) wynosi 93% po podaniu doustnym. Okres półtrwania eliminacji z osocza (t 1/2 ) midodryny wynosi 0,49 godziny, a jej czynnego metabolitu od 2 do 4 godzin. Midodryna i jej metabolity są niemal całkowicie wydalane z moczem w ciągu 24 godzin, ok. 40-60% w postaci aktywnego, głównego metabolitu, 2-5% w postaci niezmetabolizowanej midodryny, reszta jako farmakologiczne nieaktywne metabolity.
- CHPL leku Gutron, tabletki, 2,5 mgWłaściwości farmakokinetyczne
Należy uwzględnić możliwość przeniknięcia przez midodrynę bariery krew-mózg. Brak danych klinicznych dotyczących farmakokinetyki midodryny lub jej metabolitu deglimidodryny u pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Gutron, tabletki, 2,5 mgPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach toksyczności po podaniu wielokrotnym dawki przekraczającej 12-50 krotnie maksymalną dawkę terapeutyczną podawaną u ludzi przeliczeniu w mg/kg obserwowano, oprócz działania farmakologicznego midodryny, zwyrodnieniowe zmiany nerek u szczurów oraz zmiany w obrębie wątroby u szczurów i psów. Midodryna nie wykazuje właściwości mutagennych. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku Gutron, tabletki, 2,5 mgDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Magnezu stearynian, talk, krzemionka koloidalna bezwodna, celuloza mikrokrystaliczna, skrobia kukurydziana. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 25°C. 6.5 Rodzaj i zawartość opakowania Blistry z folii PVC/PVDC/Al. 20 tabletek w dwóch blistrach po 10 sztuk. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Brak szczególnych wymagań.
- CHPL leku Effortil, krople doustne, 7,5 mg/gNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Effortil 7,5 mg/g; krople doustne 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu (około 15 kropli) zawiera 7,5 mg chlorowodorku etylefryny (2-etyloamino-1-(3-hydroksyfenylo)etanolu) – Etilefrini hydrochloridum. oraz substancje pomocnicze, w tym: parahydroksybenzoesan metylu i parahydroksybenzoesan propylu oraz pirosiarczyn sodu. 1 ml produktu (około 15 kropli) zawiera 0,24 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Krople doustne
- CHPL leku Effortil, krople doustne, 7,5 mg/gWskazania do stosowania
4.1 Wskazania do stosowania Niedociśnienie tętnicze objawowe lub ortostatyczne (zależne od pozycji ciała), ogólnie związane z objawami takimi jak zawroty głowy, niewytłumaczalne uczucie zmęczenia, rozmyte widzenie lub utrata widzenia, uczucie osłabienia.
- CHPL leku Effortil, krople doustne, 7,5 mg/gDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Zalecana dawka to: Dorośli i dzieci powyżej 6 roku życia: 10-20 kropli trzy razy na dobę. Dzieci pomiędzy 2 i 6 rokiem życia: 5-10 kropli trzy razy na dobę. Dzieci poniżej 2 roku życia: 2-5 kropli trzy razy na dobę. 10 kropli odpowiada około 5 mg chlorowodorku etylefryny. Krople doustne Effortil powinny być przyjmowane z płynem. Szczególnie szybkie działanie można osiągnąć, jeżeli produkt leczniczy jest podawany przed posiłkami.
- CHPL leku Effortil, krople doustne, 7,5 mg/gPrzeciwwskazania
4.3 Przeciwwskazania Effortil jest przeciwwskazany w następujących przypadkach: nadwrażliwość na substancję czynną lub którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. (patrz też punkt 4.4) nadciśnienie tętnicze nadczynność tarczycy guz chromochłonny nadnerczy (pheochromocytoma) jaskra z wąskim kątem przesączania rozrost gruczołu krokowego z zaleganiem moczu choroba wieńcowa zdekompensowana niewydolność serca kardiomiopatia przerostowa z zawężeniem drogi odpływu komory lewej zwężenie zastawek serca lub dużych tętnic pierwszy trymestr ciąży (patrz punkt 4.6) karmienie piersią (patrz punkt 4.6)
- CHPL leku Effortil, krople doustne, 7,5 mg/gSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy zachować ostrożność podczas stosowania produktu leczniczego u pacjentów z przyspieszoną czynnością serca (tachykardią), zaburzeniami rytmu serca lub ciężkimi chorobami układu sercowo-naczyniowego. Należy zachować ostrożność podczas stosowania produktu leczniczego u pacjentów z cukrzycą (patrz punkt 4.5). Należy zachować ostrożność podczas stosowania produktu leczniczego u pacjentów z nadczynnością tarczycy. Stosowanie etylefryny podczas zawodów sportowych skutkuje dodatnim wynikiem badań w kierunku pozaklinicznego stosowania leków (tj. badań antydopingowych). Produkt leczniczy Effortil w postaci kropli zawiera jako substancje pomocnicze parahydroksybenzoesan metylu i parahydroksybenzoesan propylu, które mogą powodować reakcje alergiczne (możliwe reakcje typu późnego). Produkt leczniczy Effortil zawiera pirosiarczyn sodu i może rzadko powodować ciężkie reakcje nadwrażliwości i skurcz oskrzeli.
- CHPL leku Effortil, krople doustne, 7,5 mg/gSpecjalne środki ostrozności
1 ml roztworu produktu (około 15 kropli) zawiera 0,24 mg sodu. Zatem produkt zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy lek uznaje się za „wolny od sodu”.
- CHPL leku Effortil, krople doustne, 7,5 mg/gInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Jednoczesne stosowanie guanetydyny, mineralokortykoidów, rezerpiny, hormonów tarczycy, adrenomimetyków lub leków wykazujących działanie sympatykomimetyczne [jak trójpierścieniowe leki przeciwdepresyjne, inhibitory monoaminooksydazy (inhibitory MAO)] może nasilać działanie produktu leczniczego Effortil. Halogenowe pochodne węglowodorów alifatycznych oraz glikozydy nasercowe w wyższych dawkach mogą zwiększać działanie na serce leków działających sympatykomimetycznie, prowadząc do występowania zaburzeń rytmu serca. Dihydroergotamina zwiększa wchłanianie jelitowe produktu leczniczego Effortil, a przez to nasila jego działanie. Atropina może nasilać działanie produktu leczniczego Effortil i przyspieszać czynność serca. Leki blokujące receptory adrenergiczne (leki alfa- i beta-adrenolityczne) mogą całkowicie lub częściowo usunąć efekt działania etylefryny.
- CHPL leku Effortil, krople doustne, 7,5 mg/gInterakcje
Leczenie z zastosowaniem leków beta-adrenolitycznych może wywołać bradykardię odruchową. Działanie leków przeciwcukrzycowych polegające na obniżeniu poziomu cukru we krwi może być osłabione.
- CHPL leku Effortil, krople doustne, 7,5 mg/gWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Ze względu na niewystarczające dane kliniczne i dane niekliniczne wskazujące na działanie teratogenne produkt leczniczy jest przeciwwskazany w pierwszym trymestrze ciąży (patrz punkt 4.3 i 5.3). W drugim i trzecim trymestrze ciąży produkt leczniczy może być stosowany jedynie po wnikliwym rozważeniu ryzyka i korzyści stosowania. Etylefryna może zaburzać krążenie krwi w macicy i łożysku i powodować zwiotczenie mięśnia macicy. Karmienie piersi? Produktu leczniczego nie należy stosować w okresie karmienia piersią, ponieważ nie można wykluczyć przenikania leku do mleka matki (patrz punkt 4.3). Płodność Nie przeprowadzono badań nieklinicznych ani badań z udziałem ludzi dotyczących wpływu etylefryny na płodność.
- CHPL leku Effortil, krople doustne, 7,5 mg/gWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie przeprowadzono badań nad wpływem produktu leczniczego na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu. Niemniej jednak pacjentów należy uprzedzać, że podczas stosowania produktu leczniczego Effortil mogą u nich wystąpić działania niepożądane, takie jak zawroty głowy. Należy zatem zalecać ostrożność podczas prowadzenia pojazdów i obsługiwania urządzeń.
- CHPL leku Effortil, krople doustne, 7,5 mg/gDziałania niepożądane
4.8 Działania niepożądane Zaburzenia układu immunologicznego: Częstość nieznana: nadwrażliwość (reakcje alergiczne) Zaburzenia psychiczne: Niezbyt często: niepokój, bezsenność Zaburzenia układu nerwowego: Często: ból głowy Niezbyt często: drżenie, niepokój ruchowy Zaburzenia ucha i błędnika: Niezbyt często: zawroty głowy Zaburzenia serca: Niezbyt często: kołatanie serca, tachykardia, zaburzenia rytmu serca Częstość nieznana: dusznica bolesna, wzrost ciśnienia tętniczego krwi Zaburzenia żołądkowo-jelitowe: Niezbyt często: nudności Zaburzenia ogólne i stany w miejscu podania: Częstość nieznana: nadmierne pocenie się Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Effortil, krople doustne, 7,5 mg/gDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181 C, 02-222 Warszawa. Tel: + 48 22 49 21 301, Faks: + 48 22 49 21 309, https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego.
- CHPL leku Effortil, krople doustne, 7,5 mg/gPrzedawkowanie
4.9 Przedawkowanie Objawy przedawkowania Ostre przedawkowanie nasila opisane powyżej działania niepożądane. Ponadto może wystąpić pobudzenie i wymioty. U niemowląt i małych dzieci przedawkowanie może prowadzić do hamowania czynności ośrodka oddechowego i śpiączki. Leczenie przedawkowania Należy zastosować leczenie objawowe. W przypadku ciężkiego przedawkowania należy zastosować intensywną opiekę medyczną. Objawy związane z pobudzeniem receptorów beta-1 mogą być leczone z użyciem leków blokujących receptory beta-adrenergiczne podawanych zgodnie z ogólnymi zasadami dla tej klasy leków.
- CHPL leku Effortil, krople doustne, 7,5 mg/gWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy (bez glikozydów nasercowych); kod ATC: C01CA01 Etylefryna, substancja czynna produktu leczniczego, jest lekiem adrenomimetycznym o wysokim powinowactwie do receptorów alfa-1 i beta-1. W wyższych dawkach może również aktywować receptory beta2. Zwiększa kurczliwość mięśnia serca oraz zwiększa pojemność minutową serca (rzut serca) przez zwiększenie objętości wyrzutowej. Dodatkowo zwiększa tonus żylny i ośrodkowe ciśnienie żylne, prowadząc do wzrostu objętości krwi krążącej. Wykazuje dodatnie działanie inotropowe u pacjentów z prawidłową lub nieznacznie zaburzoną czynnością serca. Produkt leczniczy zwiększa skurczowe ciśnienie tętnicze w większej mierze niż ciśnienie rozkurczowe, obserwowano też nieznacznie działanie chronotropowe.
- CHPL leku Effortil, krople doustne, 7,5 mg/gWłaściwości farmakodynamiczne
U pacjentów z zaburzeniami czynnościowymi układu sercowo-naczyniowego może prowadzić do złagodzenia objawów takich jak zawroty głowy, zmęczenie i tendencja do omdleń oraz stabilizacji parametrów hemodynamicznych.
- CHPL leku Effortil, krople doustne, 7,5 mg/gWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Wchłanianie Na skutek efektu „pierwszego przejścia” biodostępność leku po podaniu w postaci roztworu doustnego wynosi około 8%. Dystrybucja Około 23% leku wiąże się z białkami osocza. Po podaniu doustnym pojedynczej dawki 10 mg w postaci roztworu doustnego maksymalne stężenie leku w osoczu (mediana) występuje po około 30 min (5 ng/ml). W badaniach z zastosowaniem leku znakowanego radioizotopem nie stwierdzono, aby przekraczał on barierę krew-mózg u szczurów. Nie wiadomo jak dotąd, czy etylefryna przechodzi przez barierę łożyskową lub przenika do mleka matki. Metabolizm Eliminacja etylefryny odbywa się głównie drogą rozkładu metabolicznego. Podstawowy metabolit u człowieka powstaje poprzez sprzężenie z resztą kwasu siarkowego. Nie ma danych wskazujących na aktywność któregokolwiek metabolitu. Eliminacja Końcowy okres półtrwania w fazie eliminacji wynosi około 2 godzin.
- CHPL leku Effortil, krople doustne, 7,5 mg/gWłaściwości farmakokinetyczne
Po podaniu etylefryny znakowanej trytem 75-80% całkowitej aktywności stwierdzano w moczu. Ponieważ etylefryna i jej metabolity wydalane są głównie przez nerki, możliwa jest kumulacja metabolitów u pacjentów z niewydolnością nerek.
- CHPL leku Effortil, krople doustne, 7,5 mg/gPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach dotyczących toksyczności po podaniu etylefryny w pojedynczej dawce doustnej u myszy, szczurów, królików i psów wartość wskaźnika LD50 wynosiła od 66,4 mg/kg (u szczurów) do 2300 mg/kg (u myszy). Po podaniu dożylnym u myszy, królików i psów odpowiednie wartości wynosiły od 6,8 do 16,7 mg/kg. Głównymi objawami toksyczności były: jeżenie się sierści, wytrzeszcz oczu, sinica, tachypnoe, ślinienie się, ataksja i drgawki (u gryzoni) oraz dodatkowo rozszerzenie źrenic, drżenia i wymioty u psów. Po podaniu podskórnym u gryzoni wartość LD50 wynosiła 200-300 mg/kg. W badaniach dotyczących toksyczności przy podawaniu etylefryny w powtarzanej dawce doustnej do 26 tygodni poziom braku obserwowanych działań niepożądanych (ang. No Observed Adverse Effect Level – NOAEL) wynosił 3 mg/kg u szczurów i 0,6 mg/kg u psów.
- CHPL leku Effortil, krople doustne, 7,5 mg/gPrzedkliniczne dane o bezpieczeństwie
Po podawaniu leku w dawce 3 mg/kg - szczurom i 6 mg/kg – psom obserwowano spadek częstości akcji serca i stężenia glukozy we krwi (u szczurów) oraz wzrost ciśnienia tętniczego krwi i ciśnienia śródgałkowego, rozszerzenie źrenic i wzrost aktywności SGPT (AlAT) (u psów). U obu gatunków stwierdzano zmiany zwłóknieniowe w mięśniu sercowym i zastawce dwudzielnej przy stosowaniu leku w dawce 6-30 mg/kg. Ponadto u psów obserwowano wzrost masy serca i rozrost warstwy środkowej ściany małych tętnic. W czterotygodniowym badaniu toksyczności przy dożylnym podawaniu leku u psów wskaźnik NOAEL wynosił 0,625 mg/kg. Przy dawce 3,1 mg/kg stwierdzano wymioty, zmniejszony wzrost masy ciała oraz podwyższoną aktywność fosfatazy alkalicznej (AP) w surowicy. Nie stwierdzono jakiegokolwiek działania mutagennego etylefryny (in vitro) na bakterie lub komórki ssaków. Brak jest badań dotyczących rakotwórczego działania leku.
- CHPL leku Effortil, krople doustne, 7,5 mg/gPrzedkliniczne dane o bezpieczeństwie
Doustne dawki etylefryny do 15 mg/kg nie były śmiertelne dla zarodków ani teratogenne u myszy, szczurów ani królików. Dawki toksyczne dla matki (> 30 mg/kg p.o.) powodowały zahamowanie rozwoju płodu u szczurów i wzrost częstości występowania wad wrodzonych u myszy. Skutki te są konsekwencją niedożywienia płodu z powodu zmniejszenia przepływu krwi w macicy u matki spowodowanego toksyczną dawką. U ciężarnych świnek morskich stwierdzono zmniejszenie przepływu krwi przez macicę po podaniu etylefryny. U królików obserwowano dobrą tolerancję etylefryny po podaniu na skórę oraz umiarkowane podrażnienie po podaniu domięśniowym.
- CHPL leku Effortil, krople doustne, 7,5 mg/gDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych metylu parahydroksybenzoesan (E 218) propylu parahydroksybenzoesan (E216) sodu pirosiarczyn (E 223) woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 5 lat 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Nie zamrażać. 6.5 Rodzaj i zawartość opakowania Butelka z oranżowego szkła z zakrętką PP i kroplomierzem PE w tekturowym pudełku. 15 g w butelce. 6.6 Specjalne środki ostrożności dotyczące usuwania Brak szczególnych wymagań dotyczących usuwania. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO LEVONOR, 1 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml koncentratu zawiera 1 mg noradrenaliny (Noradrenalinum) w postaci noradrenaliny winianu. Ampułka o pojemności 1 ml zawiera 1 mg noradrenaliny. Ampułka o pojemności 4 ml zawiera 4 mg noradrenaliny. Substancje pomocnicze o znanym działaniu: sód – produkt leczniczy zawiera 0,147 mmol (3,39 mg) sodu w 1 ml koncentratu; sodu pirosiarczyn - produkt leczniczy zawiera 1 mg sodu pirosiarczynu w 1 ml koncentratu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Koncentrat do sporządzania roztworu do infuzji Bezbarwny koncentrat
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Levonor stosuje się w groźnych stanach niedociśnienia tętniczego w celu przywrócenia prawidłowego ciśnienia tętniczego.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Wyłącznie do podania dożylnego, po uprzednim rozcieńczeniu, za pośrednictwem cewnika wprowadzonego do żyły centralnej. Sposób podawania Produkt leczniczy podawać dożylnie we wlewie, po uprzednim rozcieńczeniu (sposób rozcieńczania - patrz poniżej) poprzez centralny cewnik żylny. Szybkość wlewu należy kontrolować za pomocą pompy strzykawkowej, infuzyjnej lub licznika kropli. Sposób rozcieńczania Produkt leczniczy można rozcieńczać następującymi roztworami do infuzji: 5% roztwór glukozy, 0,9% roztwór NaCl, izotoniczny roztwór glukozy w soli fizjologicznej (5% roztwór glukozy i 0,9% roztwór NaCl 1:1). 1. Jeśli noradrenalina ma być podawana przy użyciu pompy strzykawkowej: 2 mg noradrenaliny (2 ml produktu Levonor 1 mg/ml) dodać do 48 ml rozcieńczalnika. 2. Jeśli noradrenalina ma być podawana przy użyciu licznika kropli: 20 mg noradrenaliny (20 ml produktu Levonor 1 mg/ml) dodać do 480 ml rozcieńczalnika.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlDawkowanie
Stężenie noradrenaliny uzyskane po rozcieńczeniu w obu przypadkach wynosi 40 mg/l. Jeśli zachodzi konieczność zastosowania innego rozcieńczenia, należy dokładnie przeliczyć dawki. Rozcieńczenie należy przygotowywać w kontrolowanych i zwalidowanych aseptycznych warunkach. Przygotowany roztwór jest stabilny pod względem chemicznym i fizycznym przez 24 godziny w temperaturze poniżej 30°C, nie wymaga ochrony przed światłem. Z mikrobiologicznego punktu widzenia roztwór należy przygotować bezpośrednio przed użyciem. UWAGA: Produkt leczniczy o zmienionym zabarwieniu nie nadaje się do stosowania. Dawkowanie Dorośli Dawkowanie określa się indywidualnie, zależnie od stanu pacjenta. Podczas podawania obowiązuje stała kontrola ciśnienia tętniczego. Początkowo 10 ml/godz. do 20 ml/godz. (0,16 ml/min do 0,33 ml/min), co odpowiada 0,4 mg/godz. do 0,8 mg/godz. noradrenaliny. Dawki podtrzymujące - szybkość wlewu jest zależna od wartości ciśnienia tętniczego.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlDawkowanie
Celem leczenia jest uzyskanie wartości skurczowego ciśnienia krwi na dolnej granicy normy (100-120 mm Hg) lub uzyskanie odpowiedniej wartości średniego ciśnienia tętniczego krwi (ponad 80 mm Hg). Czas trwania leczenia: noradrenalinę należy podawać do momentu uzyskania poprawy stanu pacjenta. Podczas podawania produktu pacjent powinien być monitorowany. Pacjenci w podeszłym wieku Patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania. Dzieci Nie zaleca się stosowania.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Uwaga: w stanach zagrożenia życia nie ma bezwzględnych przeciwwskazań do zastosowania noradrenaliny. Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Hipotensja po zawale mięśnia sercowego. Dławica Prinzmetala. Choroby zakrzepowe (szczególnie zakrzepica naczyń wieńcowych, krezkowych oraz obwodowych). Jednoczesne stosowanie niektórych wziewnych anestetyków (halotan, cyklopropan) oraz innych leków zwiększających wrażliwość serca. Znacznego stopnia hipoksja lub hiperkapnia.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Noradrenalinę należy podawać wyłącznie pacjentom odpowiednio nawodnionym (z odpowiednio wypełnionym łożyskiem naczyniowym). Podczas stosowania noradrenaliny zaleca się częste pomiary ciśnienia tętniczego oraz tempa wlewu, aby uniknąć nadciśnienia tętniczego. Należy często kontrolować miejsce infuzji. Podanie produktu poza naczynie może prowadzić do lokalnej martwicy tkanek. Miejsce, w którym nastąpiło wstrzyknięcie poza żyłę, należy natychmiast ostrzyknąć roztworem fentolaminy. Sugerowano, że fentolaminę można dodać bezpośrednio do butelki z roztworem do wlewu, przez co może przeciwdziałać martwicy tkanek, nie wpływając na aktywność wazopresyjną noradrenaliny. Noradrenalinę należy podawać ostrożnie pacjentom w podeszłym wieku, ponieważ osoby te są szczególnie wrażliwe na działanie tej substancji. Produkt zawiera sodu pirosiarczyn, który rzadko może powodować ciężkie reakcje nadwrażliwości i skurcz oskrzeli.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlSpecjalne środki ostrozności
Ampułka o pojemności 1 ml: Produkt leczniczy zawiera 3,39 mg sodu w 1 ml, co odpowiada 0,17% maksymalnej zalecanej przez WHO dawki dobowej, wynoszącej u osób dorosłych 2 g sodu. Ampułka o pojemności 4 ml: Produkt leczniczy zawiera 13,56 mg sodu w 4 ml co odpowiada 0,68% maksymalnej zalecanej przez WHO dawki dobowej, wynoszącej u osób dorosłych 2 g sodu. Produkt może być rozcieńczany w: 0,9% roztworze NaCl, 5% roztworze glukozy lub izotonicznym roztworze glukozy w soli fizjologicznej (5% roztwór glukozy i 0,9% roztwór NaCl 1:1). Zawartość sodu pochodzącego z rozcieńczalnika, powinna być brana pod uwagę w obliczeniu całkowitej zawartości sodu w przygotowanym rozcieńczeniu produktu. W celu uzyskania dokładnej informacji dotyczącej zawartości sodu w roztworze wykorzystanym do rozcieńczenia produktu, należy zapoznać się z charakterystyką produktu leczniczego stosowanego rozcieńczalnika.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne formy interakcji Stosowanie noradrenaliny w czasie ogólnego znieczulenia cyklopropanem lub halotanem może prowadzić do wystąpienia ciężkich zaburzeń rytmu serca. Noradrenalinę należy bardzo ostrożnie podawać pacjentom przyjmującym inhibitory monoaminooksydazy (IMAO) lub trójpierścieniowe leki przeciwdepresyjne, ponieważ może wystąpić długotrwałe ciężkie nadciśnienie tętnicze.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Noradrenalina zastosowana u kobiet w ciąży może zaburzać przepływ krwi przez łożysko oraz powodować bradykardię u płodu. Może również wywoływać skurcze macicy, a w końcowym okresie ciąży doprowadzić do niedotlenienia płodu. Stosowanie noradrenaliny w ciąży jest dopuszczalne tylko w przypadku, jeśli w opinii lekarza korzyść dla matki przeważa nad potencjalnym zagrożeniem dla płodu. Karmienie piersi? Nie wiadomo, czy noradrenalina przenika do mleka kobiecego. Nie jest to istotne, ponieważ stan wymagający stosowania noradrenaliny i tak nie pozwala na karmienie piersią.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie dotyczy - produkt jest stosowany w stanach zagrożenia życia.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlDziałania niepożądane
4.8 Działania niepożądane Częstość występowania wymienionych działań niepożądanych nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia układu nerwowego Ból głowy. Zaburzenia serca Bradykardia. Zaburzenia rytmu serca (podczas stosowania z lekami zwiększającymi wrażliwość mięśnia sercowego zwłaszcza u pacjentów z niedotlenieniem lub hiperkapnią). Kardiomiopatia indukowana stresem. Zaburzenia naczyniowe Nadmierne zwiększenie ciśnienia tętniczego, któremu może towarzyszyć obwodowe niedokrwienie tkanek, w tym zgorzel kończyn. Zmniejszenie objętości osocza po dłuższym stosowaniu produktu. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlDziałania niepożądane
Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlPrzedawkowanie
4.9 Przedawkowanie Przedawkowanie może prowadzić do wystąpienia ciężkiego nadciśnienia tętniczego, odruchowej bradykardii, znacznego zwiększenia oporu obwodowego, zmniejszenia pojemności minutowej. Objawom tym może towarzyszyć nasilony ból głowy, światłowstręt, wymioty, ból zamostkowy, bladość, nadmierne wydzielanie potu. Jeśli dojdzie do przedawkowania, należy przerwać podawanie produktu i zastosować odpowiednie leczenie objawowe.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki stosowane w chorobach serca; leki wpływające na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA03. Działanie noradrenaliny, podawanej w typowych dawkach terapeutycznych, na naczynia wynika z jednoczesnego pobudzania receptorów alfa- i beta-adrenergicznych w sercu i w układzie naczyniowym. Poza sercem, noradrenalina działa przede wszystkim na receptory alfa. Powoduje zwiększenie siły skurczu mięśnia sercowego (przy braku hamowania poprzez nerw błędny). Zwiększa się opór obwodowy prowadząc do zwiększenia skurczowego i rozkurczowego ciśnienia krwi.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Do 16% podanej dożylnie dawki noradrenaliny jest wydalane w postaci niezmienionej z moczem wraz z metylowanymi i deaminowanymi metabolitami w postaci wolnej i sprzężonej.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Brak przedklinicznych danych istotnych dla lekarza przepisującego produkt leczniczy.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Sodu pirosiarczyn (E223) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Produktu nie należy mieszać ze środkami o odczynie zasadowym lub właściwościach utleniających, barbituranami, chlorfeniraminą, chlorotiazydem, nitrofurantoiną, nowobiocyną, fenytoiną, wodorowęglanem sodu, jodkiem sodu, streptomycyną. 6.3 Okres ważności 2 lata Okres ważności po rozcieńczeniu: Przygotowany roztwór jest stabilny pod względem chemicznym i fizycznym przez 24 godziny w temperaturze poniżej 30°C, nie wymaga ochrony przed światłem. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w lodówce (2°C-8°C). Chronić od światła. Nie zamrażać. 6.5 Rodzaj i zawartość opakowania Ampułki ze szkła bezbarwnego we wkładkach folii z PVC w tekturowym pudełku.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlDane farmaceutyczne
10 ampułek po 1 ml 5 ampułek po 4 ml 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego Dostosowania Produkt podawać dożylnie we wlewie, po uprzednim rozcieńczeniu w 5% roztworze glukozy lub 0,9% roztworze NaCl, lub izotonicznym roztworze glukozy w soli fizjologicznej (5% roztwór glukozy i 0,9% roztwór NaCl 1:1) poprzez centralny cewnik żylny. Rozcieńczenie należy przygotowywać w kontrolowanych i zwalidowanych aseptycznych warunkach. Przygotowany roztwór jest stabilny pod względem chemicznym i fizycznym przez 24 godziny w temperaturze poniżej 30°C, nie wymaga ochrony przed światłem. Z mikrobiologicznego punktu widzenia roztwór należy przygotować bezpośrednio przed użyciem. Szybkość wlewu należy kontrolować za pomocą pompy strzykawkowej, infuzyjnej lub licznika kropli. Szczegółowe informacje - patrz punkt 4.2.
- CHPL leku Levonor, koncentrat do sporządzania roztworu do infuzji, 1 mg/mlDane farmaceutyczne
Instrukcja otwierania ampułki Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu. Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia. Aby otworzyć ampułkę, należy trzymać ją pionowo w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki. Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3. Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami. Rysunki Rysunek 1 Rysunek 2 Rysunek 3
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO LIGNOCAINUM 2% c. NORADRENALINO 0,00125% WZF (20 mg + 0,025 mg)/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg lidokainy chlorowodorku jednowodnego (Lidocaini hydrochloridum monohydricum) i 0,025 mg noradrenaliny winianu (Noradrenalini tartras). Substancja pomocnicza o znanym działaniu: sodu pirosiarczyn (E 223), sód. Każdy ml zawiera 1 mg sodu pirosiarczynu, 2 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do wstrzykiwań Bezbarwny lub prawie bezbarwny, przezroczysty płyn
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWskazania do stosowania
4.1 Wskazania do stosowania Znieczulenie regionalne – nasiękowe, blokady nerwów, pni nerwowych i splotów nerwowych – w chirurgii ogólnej, urologii, ortopedii, ginekologii, położnictwie, stomatologii, ponadto w różnych procedurach diagnostycznych i terapeutycznych.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlDawkowanie
4.2 Dawkowanie i sposób podawania Maksymalna, jednorazowa dawka lidokainy z dodatkiem noradrenaliny dla dorosłego pacjenta, w dobrym stanie ogólnym i bez chorób współistniejących wynosi 500 mg i nie powinna przekraczać 7 mg/kg mc. Lidokainę należy dawkować indywidualnie, kierując się masą ciała pacjenta i jego stanem ogólnym. W trakcie znieczulenia pacjent musi być nadzorowany i należy monitorować jego czynności życiowe. Siła i czas działania lidokainy zależą od stężenia i objętości podanego roztworu. Zwiększenie objętości i stężenia przyspiesza, wydłuża i nasila działanie miejscowo znieczulające. Dodatek noradrenaliny ma na celu spowolnienie wchłaniania lidokainy z miejsca podania. Należy zawsze stosować minimalne skuteczne dawki lidokainy, aby ograniczyć ryzyko przedawkowania. Produkt można rozcieńczać 0,9% roztworem chlorku sodu.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlDawkowanie
Znieczulenie regionalne Stężenie leku: 0,5 - 2% Rodzaj znieczulenia: Znieczulenie nasiękowe Maksymalna dawka lidokainy z dodatkiem noradrenaliny: Do 500 mg Rodzaj znieczulenia: Blokady pni i splotów nerwowych Maksymalna dawka lidokainy z dodatkiem noradrenaliny: Do 500 mg
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na lidokainę lub inne leki miejscowo znieczulające o budowie amidowej, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Nie stosować do znieczuleń obszarów ciała z anatomicznym lub czynnościowym unaczynieniem końcowym (np. palców u rąk i nóg, czubka nosa, uszu, penisa) ze względu na naczyniokurczowe działanie noradrenaliny mogące doprowadzić do niedokrwienia i martwicy tkanek.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Znieczulenie miejscowe przy pomocy lidokainy powinno być wykonywane wyłącznie przez lekarzy dobrze znających technikę wykonania znieczulenia oraz przeszkolonych w diagnostyce i leczeniu następstw przedawkowania lidokainy, które mogą pojawić się w trakcie znieczulenia regionalnego. W pomieszczeniu, w którym wykonywane są znieczulenia musi znajdować się źródło tlenu, sprzęt resuscytacyjny i niezbędne leki. Przed przystąpieniem do znieczulenia należy zapewnić dostęp do żyły. Opóźnienie podjęcia działań resuscytacyjnych może prowadzić do niedotlenienia, kwasicy, zatrzymania czynności serca, a nawet zgonu pacjenta. Każde wstrzyknięcie lidokainy należy poprzedzić próbą aspiracji, aby uniknąć niezamierzonego podania donaczyniowego.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlSpecjalne środki ostrozności
Warunkami bezpiecznego stosowania lidokainy są: odpowiednie dawkowanie, poprawna technika znieczulenia, przestrzeganie środków ostrożności oraz gotowość do podjęcia postępowania resuscytacyjnego. Należy unikać wstrzykiwania w miejscach objętych stanem zapalnym lub zakażeniem, ponieważ stany te mogą zmniejszyć skuteczność znieczulania miejscowego. Powtarzanie dawek lidokainy może doprowadzić do niebezpiecznego wzrostu jej stężenia w surowicy krwi. Ponieważ ogólna reakcja na wysokie stężenie tego środka zależy od stanu pacjenta, u osób wyniszczonych, w podeszłym wieku oraz dzieci dawkę lidokainy należy dostosować do masy ciała i stanu zdrowia. Lidokaina jest metabolizowana w wątrobie, dlatego w przypadkach jej niewydolności należy liczyć się z wyższym stężeniem tego środka w płynach ustrojowych.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlSpecjalne środki ostrozności
Pomimo że znieczulenie miejscowe uznawane jest za optymalną technikę znieczulenia, u niektórych pacjentów należy zachować szczególną ostrożność, aby zmniejszyć ryzyko wystąpienia ciężkich działań niepożądanych. Są to pacjenci: z padaczką; z zaburzeniami układu oddechowego; w podeszłym wieku i chorzy w złym stanie ogólnym; z częściowym lub całkowitym blokiem przewodzenia, ponieważ środki miejscowo znieczulające mogą hamować czynność układu przewodzącego serca; z zaawansowaną chorobą wątroby lub ciężkimi zaburzeniami czynności nerek; stosujący leki przeciwarytmiczne klasy III (np. amiodaron) - powinni oni znajdować pod ścisłą obserwacją i należy u tych pacjentów rozważyć monitorowanie zapisu EKG, ponieważ działania lidokainy i leków przeciwarytmicznych klasy III na mięsień sercowy mogą się sumować (patrz punkt 4.5); z ostrą porfirią.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlSpecjalne środki ostrozności
Lidokaina przypuszczalnie zwiększa syntezę porfiryn, dlatego należy go stosować u pacjentów z ostrą porfirią wyłącznie w uzasadnionych lub nagłych wskazaniach. Wobec wszystkich pacjentów z porfirią należy zachować odpowiednie środki ostrożności. Określone metody znieczulenia miejscowego mogą się wiązać z ciężkimi działaniami niepożądanymi, niezależnie od rodzaju użytego środka miejscowo znieczulającego, np.: Przy wstrzykiwaniu w okolice głowy i szyi można omyłkowo podać lek do tętnicy, powodując objawy ze strony ośrodkowego układu nerwowego nawet przy małych dawkach leku. Blokada okołoszyjkowa może niekiedy wywoływać bradykardię lub tachykardię u płodu, dlatego konieczne jest dokładne monitorowanie czynności serca płodu. Istnieją doniesienia postmarketingowe o przypadkach chondrolizy u pacjentów otrzymujących pooperacyjnie dostawowo ciągły wlew środków miejscowo znieczulających. Większość doniesień dotyczyła chondrolizy w obrębie stawu barkowego.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlSpecjalne środki ostrozności
Ze względu na wiele czynników mogących się przyczyniać do wystąpienia chondrolizy i niespójności w piśmiennictwie naukowym związek przyczynowo-skutkowy nie został ustalony. Ciągły wlew dostawowy nie został zatwierdzony jako wskazanie do stosowania lidokainy. Należy zachować ostrożność stosując produkt lidokainy z dodatkiem noradrenaliny u pacjentów z ciężkimi schorzeniami układu sercowo-naczyniowego (nadciśnienie tętnicze, choroba wieńcowa, stenoza mitralna), z nadczynnością tarczycy, cukrzycą, guzem chromochłonnym nadnerczy, jaskrą z wąskim kątem. Podczas znieczulenia należy stale monitorować zarówno stan świadomości, jak i czynność układów krążenia i oddychania. Wczesnymi objawami toksycznych stężeń lidokainy w ośrodkowym układzie nerwowym są: metaliczny smak w ustach, niepokój, szumy uszne, zawroty głowy, zaburzenia widzenia, drżenia mięśniowe lub senność. Produkt przeznaczony do wykonywania znieczuleń miejscowych.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlSpecjalne środki ostrozności
Roztworów zawierających środki konserwujące nie należy podawać do przestrzeni podpajęczynówkowej, zewnątrzoponowej, do zbiornika móżdżkowo-rdzeniowego ani jakąkolwiek inną drogą, w której dochodziłoby do kontaktu z płynem mózgowo-rdzeniowym, jak również śródgałkowo czy pozagałkowo. Ze względu na zawartość sodu pirosiarczynu, produkt rzadko może powodować ciężkie reakcje nadwrażliwości i skurcz oskrzeli. Produkt leczniczy zawiera 4 mg sodu na każdej ampułce (2 ml) co odpowiada 0,2% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych. Produkt może być rozcieńczany w 0,9% roztworze NaCl. Zawartość sodu pochodzącego z rozcieńczalnika powinna być brana pod uwagę w obliczeniu całkowitej zawartości sodu w przygotowanym rozcieńczeniu produktu. W celu uzyskania dokładnej informacji dotyczącej zawartości sodu w roztworze wykorzystanym do rozcieńczenia produktu, należy zapoznać się z charakterystyką produktu leczniczego stosowanego rozcieńczalnika.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Należy zachować szczególne środki ostrożności, jeżeli lidokaina jest stosowana u pacjentów, u których jednocześnie są stosowane inne środki miejscowo znieczulające lub leki o budowie chemicznej podobnej do amidowych środków miejscowo znieczulających jak np. leki przeciwarytmiczne (np. meksyletyna), ponieważ działania toksyczne tych leków mogą się sumować. Badania interakcji lidokainy z lekami przeciwarytmicznymi klasy III (np. amiodaron) nie były prowadzone, jednak podczas jednoczesnego stosowania obu leków należy zachować ostrożność (patrz punkt 4.4). Stosowane w leczeniu przeciwdrgawkowym pochodne hydantoiny (np. fenytoina) mogą nasilać kardiodepresyjne działanie lidokainy, ale mogą również przyspieszać jej metabolizm dzięki indukcji enzymatycznej. Jednoczesne, uzasadnione terapeutycznie stosowanie lidokainy z innymi lekami przeciwarytmicznymi może nasilać jej niepożądane działania.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlInterakcje
Leki beta-adrenolityczne mogą spowolniać metabolizm lidokainy w wątrobie i nasilać jej toksyczność. Cymetydyna hamuje metabolizm lidokainy, zmniejsza jej klirens wątrobowy i podwyższa stężenie w osoczu. Duże dawki lidokainy mogą nasilać działanie środków zwiotczających mięśnie. Noradrenalina może powodować nagły wzrost ciśnienia tętniczego u pacjentów stosujących trójpierścieniowe leki przeciwdepresyjne, inhibitory MAO lub guanetydynę. Może też osłabiać działanie doustnych leków przeciwcukrzycowych i powodować zaburzenia rytmu serca.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Badania przeprowadzone na zwierzętach nie wykazały teratogennego działania lidokainy. Nie przeprowadzono dotychczas dostatecznie dużych, dobrze kontrolowanych badań u ciężarnych kobiet. W związku z tym, produkt może być stosowany u ciężarnych w czasie trwania organogenezy tylko w wyjątkowych przypadkach. Okres porodu Środki miejscowo znieczulające podawane w trakcie porodu z łatwością przenikają przez łożysko w związku z czym mogą wywoływać objawy zatrucia zarówno u matki, jak i płodu. Toksyczność lidokainy zależy od metody i techniki znieczulenia oraz zastosowanej dawki. Zatrucie lidokainą wywołuje u płodu zaburzenia czynności serca. Zastosowanie środków o budowie amidowej do blokady okołoszyjkowej w trakcie porodu wywołuje bradykardię u około 30% płodów. Dlatego w tych przypadkach wskazane jest stałe monitorowanie tętna płodu. Zbyt wysokie stężenie lidokainy we krwi matki może wywołać spadek ciśnienia tętniczego.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWpływ na płodność, ciążę i laktację
Znieczulenie może też hamować czynność skurczową macicy i przedłużać poród. Podejmując decyzję o zastosowaniu znieczulenia okołoszyjkowego w szczególnych sytuacjach położniczych, takich jak: poród przedwczesny, zatrucie ciążowe oraz stan wewnątrzmacicznego zagrożenia płodu należy rozważyć, czy oczekiwane korzyści przeważają nad potencjalnym ryzykiem. U noworodków, których matki otrzymywały podczas porodu niektóre środki miejscowo znieczulające, obserwowano w pierwszych dwu dniach życia obniżone napięcie mięśni szkieletowych. Jednak nie wiadomo, czy to zjawisko wiąże się z jakimiś odległymi konsekwencjami. Okres karmienia Ponieważ lidokaina w niewielkich ilościach przenika do mleka kobiecego, jej stosowanie u matek karmiących piersią wymaga zachowania ostrożności.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Pacjent znieczulany lidokainą nie powinien prowadzić i obsługiwać pojazdów i maszyn przez co najmniej 24 godziny po zakończeniu zabiegu.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlDziałania niepożądane
4.8 Działania niepożądane Działania niepożądane lidokainy są zazwyczaj rezultatem nadmiernego wzrostu jej stężenia w płynach ustrojowych w wyniku zastosowania zbyt dużej dawki (przedawkowanie względne lub bezwzględne), zaburzeń kinetyki lub niewłaściwej techniki wstrzykiwania. Zaburzenia naczyniowe obniżenie ciśnienia tętniczego. Zaburzenia żołądka i jelit nudności, wymioty. Zaburzenia układu nerwowego metaliczny smak w ustach, uczucie oszołomienia, pobudzenie, niepokój, euforia, drżenia mięśniowe, zaburzenia świadomości, utrata świadomości, bóle i zawroty głowy, szumy uszne, zaburzenia widzenia, uczucie gorąca, chłodu lub odrętwienia, drgawki, depresja ośrodkowego układu nerwowego. Zaburzenia serca bradykardia, zatrzymanie czynności serca (w skrajnie ciężkich przypadkach). Zaburzenia układu immunologicznego zmiany skórne, pokrzywka, obrzęk, objawy anafilaktoidalne.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlDziałania niepożądane
Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlPrzedawkowanie
4.9 Przedawkowanie Objawy toksyczne pojawiają się po przekroczeniu określonego stężenia lidokainy w surowicy krwi i zależą od podanej dawki, dodatku leków obkurczających naczynia krwionośne, miejsca wstrzyknięcia, dystrybucji w tkankach, metabolizmu i stanu ogólnego pacjenta. Przedawkowanie może być rezultatem: przedawkowania względnego, gdy lek zostaje podany bezpośrednio do naczynia krwionośnego lub w okolicę bogato unaczynioną; przedawkowania bezwzględnego, gdy zostaje przekroczona dawka dopuszczalna. Objawy przedawkowania: faza pobudzenia ośrodkowego układu nerwowego - zaburzenia czucia w obrębie warg i języka, metaliczny smak w ustach, niespójność mowy, zawroty głowy, szumy uszne, zaburzenia widzenia, dreszcze, pobudzenie ruchowe, drżenia mięśni, drgawki; faza depresji ośrodkowego układu nerwowego - śpiączka, depresja oddychania i krążenia.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlPrzedawkowanie
Ponadto mogą wystąpić: tachykardia, wzrost ciśnienia tętniczego i oporu naczyniowego, osłabienie automatyzmu serca, bradykardia, asystolia, rozszerzenie oskrzeli. Objawy zatrucia są wskazaniem do natychmiastowego przerwania podawania leku. Jeżeli ich natężenie jest niewielkie (zaburzenia widzenia, zawroty głowy) należy uspokoić pacjenta, podać mu tlen do oddychania i sprawdzić dostęp do żyły. W przypadku silniejszej reakcji toksycznej (ograniczenie świadomości i drżenia mięśni), gdy to konieczne, należy zastosować wentylację zastępczą płuc, dożylnie podać leki podwyższające ciśnienie krwi (atropina, efedryna, katecholaminy) oraz leki przeciwdrgawkowe (midazolam lub diazepam). Jeżeli dochodzi do utraty świadomości z drgawkami kloniczno-tonicznymi należy natychmiast zaintubować tchawicę i podjąć wentylację zastępczą płuc 100% tlenem, podać dożylnie leki przeciwdrgawkowe (diazepam, tiopental), korygować kwasicę i leczyć objawowo zgodnie z zasadami intensywnej terapii.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlPrzedawkowanie
Duże dawki noradrenaliny mogą wywołać objawy ogólne ze strony układu krążenia: tachykardię, wzrost ciśnienia, zaburzenia rytmu serca. W tych przypadkach należy zastosować leczenie objawowe. Dializa w przypadkach ostrego przedawkowania lidokainy nie jest skuteczna.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: lidokaina w skojarzeniu z innymi lekami, kod ATC: N01BB52 Lidokaina jest środkiem miejscowo znieczulającym i przeciwarytmicznym o budowie amidowej. Hamuje ona powstawanie i przewodzenie bodźców we włóknach nerwowych i układzie bodźco-przewodzącym serca. Lidokaina blokuje kanały sodowe błon komórek nerwowych. Zahamowanie napływu jonów Na+ uniemożliwia generowanie i przewodzenie impulsów pojawiających się w odpowiedzi na depolaryzację. Wzrasta próg pobudliwości włókien nerwowych aż do całkowitego zablokowania przewodzenia. Stężenie lidokainy blokujące przewodnictwo jest odwrotnie proporcjonalne do średnicy włókna. W pierwszej kolejności blokowane są cienkie włókna tzw. bólowe, następnie grubsze - czuciowe. Dla zablokowania włókien ruchowych (najgrubszych) konieczne są najwyższe stężenia lidokainy. Noradrenalina obkurcza naczynia krwionośne.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWłaściwości farmakodynamiczne
Dodatek leku sympatykomimetycznego ma na celu zmniejszenie wchłaniania lidokainy z miejsca podania. W wyższych dawkach może wystąpić działanie ogólnoustrojowe noradrenaliny.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Lidokaina wchłania się całkowicie z miejsca zdeponowania w tkankach. Szybkość narastania jej stężenia we krwi zależy od wielu czynników, z których ważnym jest miejsce podania. Najwyższe stężenie lidokainy w osoczu (poza przypadkami, gdy podawana jest dożylnie) stwierdza się w trakcie blokady nerwów międzyżebrowych, nieco niższe u pacjentów znieczulanych zewnątrzoponowo, natomiast najniższe stężenie obserwuje się w trakcie znieczulenia nasiękowego. Stopień wiązania lidokainy z białkami zależy od jej stężenia w osoczu. Przy stężeniach od 1 μg/ml do 4 μg/ml, z białkami wiąże się od 40% do 80% środka. Lidokaina przenika przez barierę krew-mózg i przez łożysko, docierając do krążenia płodu. Lidokaina jest gwałtownie metabolizowana w wątrobie do kilku metabolitów, pochodnych N-dealkilowanych, które wykazują farmakologiczną aktywność, jednak słabszą niż lidokaina.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlWłaściwości farmakokinetyczne
Lek jest wydalany przez nerki przede wszystkim w postaci metabolitów, a tylko 10% w postaci niezmienionej. Po wstrzyknięciu dożylnym okres półtrwania lidokainy w surowicy wynosi 1,6 godz. Kinetyka lidokainy zmienia się u osób z upośledzoną czynnością wątroby i w tych przypadkach okres półtrwania może być wydłużony nawet dwukrotnie. Natomiast na kinetykę lidokainy nie ma wpływu upośledzenie czynności nerek, jakkolwiek w tych przypadkach stwierdza się podwyższone stężenie metabolitów we krwi. Toksyczne działanie lidokainy na ośrodkowy układ nerwowy manifestuje się drgawkami, które pojawiają się po przekroczeniu stężenia 6 μg/ml w surowicy. Objawy zatrucia może nasilać kwasica oraz stosowanie leków pobudzających aktywność OUN. Dodanie noradrenaliny ogranicza szybkość wchłaniania lidokainy z tkanek do krwioobiegu, dzięki czemu wydłuża się czas działania oraz zmniejsza jej stężenie w surowicy, co pozwala na zastosowanie większej dawki.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie W badaniach przedklinicznych nie wykazano działania teratogennego i mutagennego lidokainy ani wpływu na płodność zwierząt. Nie przeprowadzono badań rakotwórczości lidokainy.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Sodu pirosiarczyn (E 223) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Ze względu na noradrenaliny winian znajdujący się w składzie, produktu nie należy mieszać ze środkami o odczynie zasadowym lub właściwościach utleniających, ponieważ mogą wystąpić niezgodności. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać ampułki w oryginalnym opakowaniu w celu ochrony przed światłem, w lodówce (2C-8C). Nie zamrażać. 6.5 Rodzaj i zawartość opakowania 10 ampułek z bezbarwnego szkła o pojemności 2 ml, w tekturowym pudełku. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Roztwór należy zużyć natychmiast po otwarciu ampułki. Pozostałą, niewykorzystaną część roztworu należy wylać.
- CHPL leku Lignocainum 2% c. noradrenalino 0,00125% WZF, roztwór do wstrzykiwań, (20 mg + 0,025 mg)/mlDane farmaceutyczne
Instrukcja otwierania ampułki Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu. Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia. Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki. Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3. Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Sinora, 0,1 mg/ml, roztwór do infuzji. Sinora, 0,2 mg/ml, roztwór do infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Sinora 0,1 mg/ml 1 ml roztworu do infuzji zawiera 0,2 mg noradrenaliny winianu, co odpowiada 0,1 mg noradrenaliny (Noradrenalinum). Każda fiolka 50 ml roztworu do infuzji zawiera 10 mg noradrenaliny winianu, co odpowiada 5 mg noradrenaliny. Sinora 0,2 mg/ml 1 ml roztworu do infuzji zawiera 0,4 mg noradrenaliny winianu, co odpowiada 0,2 mg noradrenaliny (Noradrenalinum). Każda 50 ml fiolka zawiera 20 mg noradrenaliny winianu, co odpowiada 10 mg noradrenaliny. Substancja pomocnicza o znanym działaniu 1 ml roztworu do infuzji zawiera 0,14 mmol (lub 3,3 mg) sodu. Każda 50 ml fiolka zawiera 7,19 mmol (lub 165,3 mg) sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do infuzji. Przejrzysty, bezbarwny roztwór. pH 3,0-4,5.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Lek wskazany do stosowania jako działanie ratunkowe w przywracaniu ciśnienia tętniczego krwi w przypadku ostrego niedociśnienia tętniczego.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Droga podania: Podanie dożylne. Sposób podawania: Produkt leczniczy Sinora, roztwór do infuzji podaje się w infuzji dożylnej. W celu uniknięcia martwicy niedokrwiennej (skóry, kończyn) do infuzji należy zastosować kaniulę umieszczaną w wystarczająco dużej żyle lub centralny dostęp dożylny. Szybkość infuzji należy kontrolować za pomocą pompy strzykawkowej, infuzyjnej lub licznika kropli. Roztworu do infuzji nie należy rozcieńczać przed użyciem: jest dostarczany w formie gotowej do użycia. Dawkowanie: Dorośli Dawka początkowa: Dawka początkowa w przypadku pacjenta o masie ciała 70 kg powinna wynosić od 0,4 mg/godzinę do 0,8 mg/godzinę noradrenaliny (0,8 mg/godzinę do 1,6 mg/godzinę noradrenaliny winianu). Lekarz może zdecydować o rozpoczęciu od mniejszej dawki wynoszącej 0,2 mg/godzinę noradrenaliny (0,4 mg/godzinę noradrenaliny winianu).
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlDawkowanie
Odmierzanie dawki: Po rozpoczęciu infuzji noradrenaliny dawkę należy stopniowo zwiększać o 0,05-0,1 µg/kg/min noradrenaliny zgodnie z obserwowanym działaniem presyjnym. Istnieje duże zróżnicowanie międzyosobnicze w zakresie dawki wymaganej do uzyskania i utrzymania prawidłowego ciśnienia tętniczego. Celem leczenia powinno być ustalenie niskiej prawidłowej wartości skurczowego ciśnienia krwi (100-120 mm Hg) lub uzyskanie odpowiedniej średniej wartości ciśnienia tętniczego (powyżej 65-80 mm Hg w zależności od stanu pacjenta). Noradrenalina 0,1 mg/ml roztwór do infuzji 50 ml fiolka zawierająca 5 mg noradrenaliny Masa ciała pacjenta Dawkowanie (µg/kg/min) noradrenaliny w formie zasady Dawkowanie (mg/godzinę) noradrenaliny w formie zasady Szybkość infuzji (ml/godz.) 50 kg 0,05 0,15 1,5 0,1 0,3 3 0,25 0,75 7,5 0,5 1,5 15 1 3 30 60 kg 0,05 0,18 1,8 0,1 0,36 3,6 0,25 0,9 9 0,5 1,8 18 1 3,6 36 70 kg 0,05 0,21 2,1 0,1 0,42 4,2 0,25 1,05 10,5 0,5 2,1 21 1 4,2 42 80 kg 0,05 0,24 2,4 0,1 0,48 4,8 0,25 1,2 12 0,5 2,4 24 1 4,8 48 90 kg 0,05 0,27 2,7 0,1 0,54 5,4 0,25 1,35 13,5 0,5 2,7 27 1 5,4 54 Noradrenalina 0,2 mg/ml roztwór do infuzji 50 ml fiolka zawierająca 10 mg noradrenaliny Masa ciała pacjenta Dawkowanie (µg/kg/min) noradrenaliny w formie zasady Dawkowanie (mg/godzinę) noradrenaliny w formie zasady Szybkość infuzji (ml/godz.) 50 kg 0,05 0,15 0,75 0,1 0,3 1,5 0,25 0,75 3,75 0,5 1,5 7,5 1 3 15 60 kg 0,05 0,18 0,9 0,1 0,36 1,8 0,25 0,9 4,5 0,5 1,8 9 1 3,6 18 70 kg 0,05 0,21 1,05 0,1 0,42 2,1 0,25 1,05 5,25 0,5 2,1 10,5 1 4,2 21 80 kg 0,05 0,24 1,2 0,1 0,48 2,4 0,25 1,2 6 0,5 2,4 12 1 4,8 24 90 kg 0,05 0,27 1,35 0,1 0,54 2,7 0,25 1,35 6,75 0,5 2,7 13,5 1 5,4 27 Pacjenci z zaburzeniami czynności nerek lub wątroby: Brak doświadczenia w leczeniu pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlDawkowanie
Pacjenci w podeszłym wieku: Tak jak w przypadku dorosłych pacjentów, patrz punkt 4.4. Dzieci i młodzież: Nie ustalono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Sinora u dzieci i młodzieży. Czas trwania leczenia i monitorowanie: Produkt leczniczy Sinora należy stosować tak długo jak wskazane jest jego działanie wazoaktywne. W czasie leczenia należy ściśle monitorować pacjenta. W czasie leczenia należy ściśle monitorować ciśnienie krwi. Przerwanie leczenia: Infuzję produktu leczniczego Sinora należy stopniowo zmniejszać, ponieważ nagłe przerwanie może prowadzić do ostrego niedociśnienia tętniczego.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania - Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. - Niedociśnienie tętnicze spowodowane zmniejszeniem objętości krwi (hipowolemia). - Stosowanie amin presyjnych podczas znieczulenia cyklopropanem lub halotanem może spowodować poważne zaburzenia rytmu serca. Ze względu na możliwość zwiększenia ryzyka wystąpienia migotania komór, noradrenalinę należy stosować z zachowaniem ostrożności u pacjentów, którzy otrzymują te lub jakiekolwiek inne produkty lecznicze zwiększające wrażliwość serca lub u których występuje znacznego stopnia hipoksja lub hiperkarbia.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt leczniczy Sinora powinien być podawany wyłącznie przez osoby należące do fachowego personelu medycznego posiadające doświadczenie w jego stosowaniu. Ostrzeżenia Noradrenalinę należy stosować wyłącznie w skojarzeniu z odpowiednimi płynami do przywracania prawidłowej objętości krwi. Podczas infuzji noradrenaliny należy często monitorować ciśnienie krwi i szybkość przepływu, aby uniknąć wystąpienia nadciśnienia tętniczego. Produkty podawane we wstrzyknięciu należy zawsze kontrolować wzrokowo i nie wolno ich używać w przypadku zaobserwowania cząstek stałych lub zmiany zabarwienia. Ryzyko wynaczynienia: Miejsce podania infuzji należy często sprawdzać pod kątem swobodnego przepływu. Należy zachować ostrożność, aby uniknąć wynaczynienia, które spowodowałoby martwicę tkanek otaczających żyłę używaną do wstrzyknięcia.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlSpecjalne środki ostrozności
Ze względu na obkurczenie ścian naczynia żylnego i zwiększoną przepuszczalność może dojść do niewielkiego wycieku noradrenaliny do tkanek otaczających żyłę, do której podawana jest infuzja, powodując zblednięcie tkanek, które nie jest wywołane ewidentnym wynaczynieniem. W przypadku wystąpienia zblednięcia należy rozważyć zmianę miejsca infuzji, aby umożliwić ustąpienie miejscowego działania obkurczającego naczynie. Leczenie niedokrwienia spowodowanego wynaczynieniem: Podczas wycieku produktu leczniczego poza naczynie lub wstrzyknięcia poza żyłę może dojść do uszkodzenia tkanek spowodowanego działaniem obkurczającym produktu leczniczego na naczynia krwionośne. Obszar wstrzyknięcia należy wtedy jak najszybciej przepłukać 10 do 15 ml roztworu soli fizjologicznej zawierającego 5 do 10 mg mezylanu fentolaminy. Do tego celu należy użyć strzykawki z cienką igłą i wstrzykiwać miejscowo.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlSpecjalne środki ostrozności
Środki ostrożności dotyczące stosowania Należy zachować ostrożność i ściśle stosować się do wskazań w poniższych przypadkach: Ciężka niewydolność lewej komory serca związana z ostrym niedociśnieniem tętniczym; niezbędna jest dokładna ocena ciśnienia krwi pacjenta. Należy rozpocząć leczenie podtrzymujące równocześnie z oceną diagnostyczną. Stosowanie noradrenaliny należy ograniczyć do pacjentów ze wstrząsem kardiogennym i opornym na leczenie niedociśnieniem tętniczym, w szczególności do pacjentów, u których nie występuje podwyższony układowy opór naczyniowy. Należy rozpocząć od dawki od 2 do 4 μg/min i stopniowo ją zwiększać zgodnie z potrzebami. Jeśli stosując dawkę 15 μg/min nie można utrzymać wartość perfuzji układowej lub ciśnienia skurczowego na poziomie >90 mmHg, jest mało prawdopodobne, aby dalsze zwiększanie dawki było korzystne.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlSpecjalne środki ostrozności
Należy zachować szczególną ostrożność u pacjentów z zakrzepicą naczyń wieńcowych, krezkowych lub obwodowych, ponieważ noradrenalina może zwiększać niedokrwienie i obszar objęty zawałem. Taką samą ostrożność należy zachować u pacjentów z niedociśnieniem tętniczym po zawale mięśnia sercowego i u pacjentów z dusznicą Prinzmetala. Wystąpienie zaburzeń rytmu serca podczas leczenia musi prowadzić do zmniejszenia dawki. Zaleca się zachowanie ostrożności u pacjentów z nadczynnością tarczycy lub cukrzycą. Pacjenci w podeszłym wieku mogą być szczególnie wrażliwi na działanie noradrenaliny. Perfuzja noradrenaliny musi odbywać się ze stałym monitorowaniem ciśnienia krwi i częstości akcji serca. Przedłużone podawanie dowolnego silnie działającego leku wazopresyjnego może prowadzić do zmniejszenia objętości osocza, co należy stale korygować stosując odpowiednie uzupełnianie płynów i elektrolitów.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlSpecjalne środki ostrozności
Brak korekcji objętości osocza może prowadzić do nawrotu niedociśnienia tętniczego w momencie przerwania infuzji lub utrzymywania się ciśnienia tętniczego z równoczesnym ryzykiem silnego obkurczenia naczyń obwodowych i trzewnych (np. obniżona perfuzja nerek) ze spadkiem przepływu krwi i perfuzji tkanek prowadzącym do hipoksji tkanek i kwasicy mleczanowej oraz ewentualnego urazu niedokrwiennego. Działanie wazopresyjne (wynikające z wpływu na receptory adrenergiczne w naczyniach) można osłabić jednocześnie podając leki blokujące receptory alfa, podczas gdy podanie leków blokujących receptory beta może prowadzić do osłabienia działania pobudzającego produktu na serce i nasilenia działania zwiększającego ciśnienie (poprzez zmniejszenie rozszerzenia tętniczek), co jest spowodowane pobudzaniem receptora adrenergicznego beta 1. W przypadkach, gdy konieczne jest jednoczesne podanie noradrenaliny i krwi pełnej lub osocza, należy je podawać w osobnej kroplówce.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlSpecjalne środki ostrozności
Produkt leczniczy zawiera 165,3 mg sodu na 50 ml fiolkę co odpowiada 8,3% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Niezalecane stosowanie skojarzone: Wziewne halogenowe środki znieczulające: ciężkie komorowe zaburzenia rytmu serca (zwiększenie pobudliwości serca). Leki przeciwdepresyjne zawierające imipraminę: napadowe nadciśnienie tętnicze z możliwymi zaburzeniami rytmu serca (hamowanie przenikania sympatomimetyków do włókien współczulnych). Leki przeciwdepresyjne mające wpływ na receptory serotoninergiczne i adrenergiczne: napadowe nadciśnienie tętnicze z możliwymi zaburzeniami rytmu serca (hamowanie przenikania sympatomimetyków do włókien współczulnych). Stosowanie skojarzone wymagające środków ostrożności dotyczących stosowania: Nieselektywne inhibitory MAO: nasilenie działania presyjnego sympatomimetyku, które zwykle jest umiarkowane. Do stosowania wyłącznie pod ścisłym nadzorem medycznym.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlInterakcje
Selektywne inhibitory MAO typu A: poprzez ekstrapolację z nieselektywnymi inhibitorami MAO, ryzyko nasilenia działania presyjnego. Do stosowania wyłącznie pod ścisłym nadzorem medycznym. Linezolid: poprzez ekstrapolację z nieselektywnymi inhibitorami MAO, ryzyko nasilenia działania presyjnego. Do stosowania wyłącznie pod ścisłym nadzorem medycznym. Należy zachować ostrożność podczas stosowania noradrenaliny z beta-blokerami, ponieważ może wystąpić ciężkie nadciśnienie tętnicze. Należy zachować ostrożność podczas stosowania noradrenaliny z poniższymi lekami, ponieważ mogą powodować nasilenie działania na serce: hormony tarczycy, glikozydy nasercowe i leki przeciwarytmiczne. Alkaloidy sporyszu lub oksytocyna mogą nasilać działanie wazopresyjne i obkurczające naczynia.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Produkt leczniczy Sinora może upośledzać przepływ krwi przez łożysko i powodować bradykardię u płodu. Może również wywoływać skurcze macicy, a w końcowym okresie ciąży niedotlenienie płodu. Należy ocenić stosunek możliwych zagrożeń dla płodu do potencjalnych korzyści dla matki. Karmienie piersi? Informacje dotyczące stosowania produktu leczniczego Sinora w okresie karmienia piersią nie są dostępne.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie ma wpływu.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlDziałania niepożądane
4.8 Działania niepożądane Częstość występowania działań niepożądanych nie może być określona na podstawie dostępnych danych. Klasyfikacja układów i narządów Działanie niepożądane: Zaburzenia psychiczne: Niepokój, bezsenność, splątanie, osłabienie, stan psychotyczny. Działanie niepożądane: Zaburzenia układu nerwowego: Ból głowy, drżenie. Działanie niepożądane: Zaburzenia oka: Ostra jaskra (bardzo częsta u pacjentów z anatomiczną predyspozycją w formie zamykającego się kąta tęczówkowo-rogówkowego). Działanie niepożądane: Zaburzenia serca: Tachykardia, bradykardia (prawdopodobnie jako odruch w wyniku wzrostu ciśnienia krwi), zaburzenia rytmu serca, kołatanie serca, wzrost kurczliwości mięśnia sercowego spowodowany działaniem beta-adrenergicznym na serce (inotropowe i chronotropowe), ostra niewydolność serca, kardiomiopatia indukowana stresem.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlDziałania niepożądane
Działanie niepożądane: Zaburzenia naczyniowe: Nadciśnienie tętnicze i hipoksja tkankowa, uraz niedokrwienny (w tym zgorzel kończyn) spowodowany silnym działaniem obkurczającym naczynia może prowadzić do uczucia zimna oraz bladości kończyn i twarzy. Działanie niepożądane: Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Niewydolność oddechowa lub trudności z oddychaniem, duszność. Działanie niepożądane: Zaburzenia żołądka i jelit: Nudności, wymioty. Działanie niepożądane: Zaburzenia nerek i dróg moczowych: Zatrzymanie moczu. Działanie niepożądane: Zaburzenia ogólne i stany w miejscu podania: Możliwość podrażnienia lub martwicy w miejscu wstrzyknięcia. Ciągłe podawanie leku wazopresyjnego w celu utrzymania ciśnienia krwi bez stosowania leczenia uzupełniającego objętość krwi może powodować następujące objawy: silne obkurczenie naczyń obwodowych i trzewnych, zmniejszenie przepływu krwi przez nerki, zmniejszenie ilości wytwarzania moczu, hipoksja, zwiększenie stężenia mleczanów w surowicy.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlDziałania niepożądane
W przypadku nadwrażliwości lub przedawkowania następujące działania niepożądane mogą występować częściej: nadciśnienie tętnicze, światłowstręt, ból zamostkowy, ból jamy ustnej i gardła, bladość, nadmierne pocenie się i wymioty.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlPrzedawkowanie
4.9 Przedawkowanie Przedawkowanie może prowadzić do ciężkiego nadciśnienia tętniczego, bradykardii odruchowej, znacznego zwiększenia oporu obwodowego i zmniejszenia pojemności minutowej serca. Objawom tym może towarzyszyć nasilony ból głowy, światłowstręt, ból zamostkowy, bladość, nadmierne pocenie się i wymioty. W przypadku przedawkowania należy przerwać podawanie produktu leczniczego i podjąć odpowiednie leczenie...
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki wpływające na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA03 Mechanizm działania Działanie na naczynia wywierane przez dawki zwykle stosowane w warunkach klinicznych wynika z jednoczesnego pobudzania receptorów alfa- i beta-adrenergicznych w sercu i układzie naczyniowym. Z wyjątkiem serca, działanie to jest wywierane przede wszystkim na receptory alfa. Działanie farmakodynamiczne Powoduje to zwiększenie siły (i przy braku hamowania poprzez nerw błędny, częstości) skurczów mięśnia sercowego. Zwiększa się opór obwodowy prowadząc do zwiększenia skurczowego i rozkurczowego ciśnienia krwi. Skuteczność kliniczna i bezpieczeństwo stosowania Wzrost ciśnienia krwi może spowodować odruchowy spadek częstości akcji serca. Działanie obkurczające naczynia może prowadzić do zmniejszenia przepływu krwi w nerkach, wątrobie, skórze i mięśniach gładkich.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlWłaściwości farmakodynamiczne
Miejscowe obkurczenie naczyń może powodować hemostazę i (lub) martwicę. Działanie wywierane na ciśnienie krwi ustępuje w ciągu 1-2 minut od przerwania infuzji.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Istnieją dwa stereoizomery noradrenaliny: biologicznie czynny izomer L jest tym, który znajduje się w produkcie leczniczym Sinora roztwór do infuzji. Wchłanianie: Podskórnie: słabe. Dousto: po podaniu doustnym noradrenalina ulega szybkiej inaktywacji w przewodzie pokarmowym. Okres półtrwania w osoczu po podaniu dożylnym noradrenaliny wynosi około 1 do 2 minut. Dystrybucja: Noradrenalina jest szybko usuwana z osocza za pośrednictwem wychwytu komórkowego i metabolizmu. Nie przenika łatwo przez barierę krew-mózg. Metabolizm: Metylacja za pośrednictwem katecholo-O-metylotransferazy. Deaminacja za pośrednictwem monoaminooksydazy (MAO). Ostateczny metabolit obu procesów to kwas 4-hydroksy-3-metoksymigdałowy. Metabolity pośrednie to normetanefryna i kwas 3,4-dihydroksymigdałowy. Eliminacja: Noradrenalina jest wydalana głównie w postaci koniugatów glukuronidu lub siarczanu z metabolitami w moczu.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Większość działań niepożądanych przypisywanych działaniu sympatykomimetycznemu wynika z nadmiernego pobudzania współczulnego układu nerwowego za pośrednictwem różnych receptorów adrenergicznych. Noradrenalina może upośledzać przepływ przez łożysko i powodować bradykardię u płodu. Może również wywoływać skurcze macicy, a w końcowym okresie ciąży niedotlenienie płodu.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Kwas solny stężony (do ustalenia pH) Woda do wstrzykiwań. 6.2 Niezgodności farmaceutyczne Nie mieszać produktu leczniczego Sinora z innymi produktami leczniczymi. Zgłaszano niezgodności farmaceutyczne roztworów do infuzji zawierających noradrenaliny winian z następującymi substancjami: środki o odczynie zasadowym lub o właściwościach utleniających, barbiturany, chlorfeniramina, chlorotiazyd, nitrofurantoina, nowobiocyna, fenytoina, wodorowęglan sodu, jodek sodu, streptomycyna. 6.3 Okres ważności 18 miesięcy. Po pierwszym otwarciu produkt należy natychmiast użyć. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Nie zamrażać. Przechowywać fiolkę w opakowaniu zewnętrznym w celu ochrony przed światłem.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlDane farmaceutyczne
6.5 Rodzaj i zawartość opakowania Sinora 0,1 mg/1 ml Fiolka z przejrzystego, bezbarwnego szkła typu I zamknięta korkiem z gumy bromobutylowej i wieczkiem aluminiowym typu flip-off, zawierająca 50 ml roztworu do infuzji, z przylepną etykietą i zapakowana pojedynczo. Sinora 0,2 mg/1 ml Fiolka z przejrzystego, bezbarwnego szkła typu I zamknięta korkiem z gumy bromobutylowej i wieczkiem aluminiowym typu flip-off, zawierająca 50 ml roztworu do infuzji, z przylepną etykietą, zapakowana pojedynczo. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Roztwór do infuzji Sinora jest już rozcieńczony i gotowy do użycia. Należy go użyć bez uprzedniego rozcieńczania oraz podać z użyciem odpowiedniej strzykawki lub pompy strzykawkowej, infuzyjnej lub licznika kropli, które zapewnią dokładne i stałe podawanie minimalnej określonej objętości ze ściśle kontrolowaną szybkością infuzji zgodnie z instrukcjami dotyczącymi zwiększania dawki zawartymi w punkcie 4.2.
- CHPL leku Sinora, roztwór do infuzji, 0,1 mg/mlDane farmaceutyczne
Produktu leczniczego nie należy stosować, jeśli roztwór ma zabarwienie ciemniejsze niż lekko żółtawe lub różowe lub jeśli zawiera osad. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Sinora, 0,1 mg/ml, roztwór do infuzji. Sinora, 0,2 mg/ml, roztwór do infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Sinora 0,1 mg/ml 1 ml roztworu do infuzji zawiera 0,2 mg noradrenaliny winianu, co odpowiada 0,1 mg noradrenaliny (Noradrenalinum). Każda fiolka 50 ml roztworu do infuzji zawiera 10 mg noradrenaliny winianu, co odpowiada 5 mg noradrenaliny. Sinora 0,2 mg/ml 1 ml roztworu do infuzji zawiera 0,4 mg noradrenaliny winianu, co odpowiada 0,2 mg noradrenaliny (Noradrenalinum). Każda 50 ml fiolka zawiera 20 mg noradrenaliny winianu, co odpowiada 10 mg noradrenaliny. Substancja pomocnicza o znanym działaniu 1 ml roztworu do infuzji zawiera 0,14 mmol (lub 3,3 mg) sodu. Każda 50 ml fiolka zawiera 7,19 mmol (lub 165,3 mg) sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do infuzji. Przejrzysty, bezbarwny roztwór. pH 3,0-4,5.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Lek wskazany do stosowania jako działanie ratunkowe w przywracaniu ciśnienia tętniczego krwi w przypadku ostrego niedociśnienia tętniczego.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Droga podania: Podanie dożylne. Sposób podawania: Produkt leczniczy Sinora, roztwór do infuzji podaje się w infuzji dożylnej. W celu uniknięcia martwicy niedokrwiennej (skóry, kończyn) do infuzji należy zastosować kaniulę umieszczaną w wystarczająco dużej żyle lub centralny dostęp dożylny. Szybkość infuzji należy kontrolować za pomocą pompy strzykawkowej, infuzyjnej lub licznika kropli. Roztworu do infuzji nie należy rozcieńczać przed użyciem: jest dostarczany w formie gotowej do użycia. Dawkowanie: Dorośli Dawka początkowa: Dawka początkowa w przypadku pacjenta o masie ciała 70 kg powinna wynosić od 0,4 mg/godzinę do 0,8 mg/godzinę noradrenaliny (0,8 mg/godzinę do 1,6 mg/godzinę noradrenaliny winianu). Lekarz może zdecydować o rozpoczęciu od mniejszej dawki wynoszącej 0,2 mg/godzinę noradrenaliny (0,4 mg/godzinę noradrenaliny winianu).
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlDawkowanie
Odmierzanie dawki: Po rozpoczęciu infuzji noradrenaliny dawkę należy stopniowo zwiększać o 0,05-0,1 µg/kg/min noradrenaliny zgodnie z obserwowanym działaniem presyjnym. Istnieje duże zróżnicowanie międzyosobnicze w zakresie dawki wymaganej do uzyskania i utrzymania prawidłowego ciśnienia tętniczego. Celem leczenia powinno być ustalenie niskiej prawidłowej wartości skurczowego ciśnienia krwi (100-120 mm Hg) lub uzyskanie odpowiedniej średniej wartości ciśnienia tętniczego (powyżej 65-80 mm Hg w zależności od stanu pacjenta). Noradrenalina 0,1 mg/ml roztwór do infuzji 50 ml fiolka zawierająca 5 mg noradrenaliny Masa ciała pacjenta Dawkowanie (µg/kg/min) noradrenaliny w formie zasady Dawkowanie (mg/godzinę) noradrenaliny w formie zasady Szybkość infuzji (ml/godz.) 50 kg 0,05 0,15 1,5 0,1 0,3 3 0,25 0,75 7,5 0,5 1,5 15 1 3 30 60 kg 0,05 0,18 1,8 0,1 0,36 3,6 0,25 0,9 9 0,5 1,8 18 1 3,6 36 70 kg 0,05 0,21 2,1 0,1 0,42 4,2 0,25 1,05 10,5 0,5 2,1 21 1 4,2 42 80 kg 0,05 0,24 2,4 0,1 0,48 4,8 0,25 1,2 12 0,5 2,4 24 1 4,8 48 90 kg 0,05 0,27 2,7 Pacjenci z zaburzeniami czynności nerek lub wątroby: Brak doświadczenia w leczeniu pacjentów z zaburzeniami czynności nerek lub wątroby.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlDawkowanie
Pacjenci w podeszłym wieku: Tak jak w przypadku dorosłych pacjentów, patrz punkt 4.4. Dzieci i młodzież: Nie ustalono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Sinora u dzieci i młodzieży. Czas trwania leczenia i monitorowanie: Produkt leczniczy Sinora należy stosować tak długo jak wskazane jest jego działanie wazoaktywne. W czasie leczenia należy ściśle monitorować pacjenta. W czasie leczenia należy ściśle monitorować ciśnienie krwi. Przerwanie leczenia: Infuzję produktu leczniczego Sinora należy stopniowo zmniejszać, ponieważ nagłe przerwanie może prowadzić do ostrego niedociśnienia tętniczego.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Niedociśnienie tętnicze spowodowane zmniejszeniem objętości krwi (hipowolemia). Stosowanie amin presyjnych podczas znieczulenia cyklopropanem lub halotanem może spowodować poważne zaburzenia rytmu serca. Ze względu na możliwość zwiększenia ryzyka wystąpienia migotania komór, noradrenalinę należy stosować z zachowaniem ostrożności u pacjentów, którzy otrzymują te lub jakiekolwiek inne produkty lecznicze zwiększające wrażliwość serca lub u których występuje znacznego stopnia hipoksja lub hiperkarbia.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Produkt leczniczy Sinora powinien być podawany wyłącznie przez osoby należące do fachowego personelu medycznego posiadające doświadczenie w jego stosowaniu. Ostrzeżenia Noradrenalinę należy stosować wyłącznie w skojarzeniu z odpowiednimi płynami do przywracania prawidłowej objętości krwi. Podczas infuzji noradrenaliny należy często monitorować ciśnienie krwi i szybkość przepływu, aby uniknąć wystąpienia nadciśnienia tętniczego. Produkty podawane we wstrzyknięciu należy zawsze kontrolować wzrokowo i nie wolno ich używać w przypadku zaobserwowania cząstek stałych lub zmiany zabarwienia. Ryzyko wynaczynienia: Miejsce podania infuzji należy często sprawdzać pod kątem swobodnego przepływu. Należy zachować ostrożność, aby uniknąć wynaczynienia, które spowodowałoby martwicę tkanek otaczających żyłę używaną do wstrzyknięcia.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlSpecjalne środki ostrozności
Ze względu na obkurczenie ścian naczynia żylnego i zwiększoną przepuszczalność może dojść do niewielkiego wycieku noradrenaliny do tkanek otaczających żyłę, do której podawana jest infuzja, powodując zblednięcie tkanek, które nie jest wywołane ewidentnym wynaczynieniem. W przypadku wystąpienia zblednięcia należy rozważyć zmianę miejsca infuzji, aby umożliwić ustąpienie miejscowego działania obkurczającego naczynie. Leczenie niedokrwienia spowodowanego wynaczynieniem Podczas wycieku produktu leczniczego poza naczynie lub wstrzyknięcia poza żyłę może dojść do uszkodzenia tkanek spowodowanego działaniem obkurczającym produktu leczniczego na naczynia krwionośne. Obszar wstrzyknięcia należy wtedy jak najszybciej przepłukać 10 do 15 ml roztworu soli fizjologicznej zawierającego 5 do 10 mg mezylanu fentolaminy. Do tego celu należy użyć strzykawki z cienką igłą i wstrzykiwać miejscowo.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlSpecjalne środki ostrozności
Środki ostrożności dotyczące stosowania Należy zachować ostrożność i ściśle stosować się do wskazań w poniższych przypadkach: Ciężka niewydolność lewej komory serca związana z ostrym niedociśnieniem tętniczym; niezbędna jest dokładna ocena ciśnienia krwi pacjenta. Należy rozpocząć leczenie podtrzymujące równocześnie z oceną diagnostyczną. Stosowanie noradrenaliny należy ograniczyć do pacjentów ze wstrząsem kardiogennym i opornym na leczenie niedociśnieniem tętniczym, w szczególności do pacjentów, u których nie występuje podwyższony układowy opór naczyniowy. Należy rozpocząć od dawki od 2 do 4 μg/min i stopniowo ją zwiększać zgodnie z potrzebami. Jeśli stosując dawkę 15 μg/min nie można utrzymać wartość perfuzji układowej lub ciśnienia skurczowego na poziomie >90 mmHg, jest mało prawdopodobne, aby dalsze zwiększanie dawki było korzystne.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlSpecjalne środki ostrozności
Należy zachować szczególną ostrożność u pacjentów z zakrzepicą naczyń wieńcowych, krezkowych lub obwodowych, ponieważ noradrenalina może zwiększać niedokrwienie i obszar objęty zawałem. Taką samą ostrożność należy zachować u pacjentów z niedociśnieniem tętniczym po zawale mięśnia sercowego i u pacjentów z dusznicą Prinzmetala. Wystąpienie zaburzeń rytmu serca podczas leczenia musi prowadzić do zmniejszenia dawki. Zaleca się zachowanie ostrożności u pacjentów z nadczynnością tarczycy lub cukrzycą. Pacjenci w podeszłym wieku mogą być szczególnie wrażliwi na działanie noradrenaliny. Perfuzja noradrenaliny musi odbywać się ze stałym monitorowaniem ciśnienia krwi i częstości akcji serca. Przedłużone podawanie dowolnego silnie działającego leku wazopresyjnego może prowadzić do zmniejszenia objętości osocza, co należy stale korygować stosując odpowiednie uzupełnianie płynów i elektrolitów.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlSpecjalne środki ostrozności
Brak korekcji objętości osocza może prowadzić do nawrotu niedociśnienia tętniczego w momencie przerwania infuzji lub utrzymywania się ciśnienia tętniczego z równoczesnym ryzykiem silnego obkurczenia naczyń obwodowych i trzewnych (np. obniżona perfuzja nerek) ze spadkiem przepływu krwi i perfuzji tkanek prowadzącym do hipoksji tkanek i kwasicy mleczanowej oraz ewentualnego urazu niedokrwiennego. Działanie wazopresyjne (wynikające z wpływu na receptory adrenergiczne w naczyniach) można osłabić jednocześnie podając leki blokujące receptory alfa, podczas gdy podanie leków blokujących receptory beta może prowadzić do osłabienia działania pobudzającego produktu na serce i nasilenia działania zwiększającego ciśnienie (poprzez zmniejszenie rozszerzenia tętniczek), co jest spowodowane pobudzaniem receptora adrenergicznego beta 1. W przypadkach, gdy konieczne jest jednoczesne podanie noradrenaliny i krwi pełnej lub osocza, należy je podawać w osobnej kroplówce.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlSpecjalne środki ostrozności
Produkt leczniczy zawiera 165,3 mg sodu na 50 ml fiolkę co odpowiada 8,3% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Niezalecane stosowanie skojarzone: Wziewne halogenowe środki znieczulające: ciężkie komorowe zaburzenia rytmu serca (zwiększenie pobudliwości serca). Leki przeciwdepresyjne zawierające imipraminę: napadowe nadciśnienie tętnicze z możliwymi zaburzeniami rytmu serca (hamowanie przenikania sympatomimetyków do włókien współczulnych). Leki przeciwdepresyjne mające wpływ na receptory serotoninergiczne i adrenergiczne: napadowe nadciśnienie tętnicze z możliwymi zaburzeniami rytmu serca (hamowanie przenikania sympatomimetyków do włókien współczulnych). Stosowanie skojarzone wymagające środków ostrożności dotyczących stosowania: Nieselektywne inhibitory MAO: nasilenie działania presyjnego sympatomimetyku, które zwykle jest umiarkowane. Do stosowania wyłącznie pod ścisłym nadzorem medycznym.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlInterakcje
Selektywne inhibitory MAO typu A: poprzez ekstrapolację z nieselektywnymi inhibitorami MAO, ryzyko nasilenia działania presyjnego. Do stosowania wyłącznie pod ścisłym nadzorem medycznym. Linezolid: poprzez ekstrapolację z nieselektywnymi inhibitorami MAO, ryzyko nasilenia działania presyjnego. Do stosowania wyłącznie pod ścisłym nadzorem medycznym. Należy zachować ostrożność podczas stosowania noradrenaliny z beta-blokerami, ponieważ może wystąpić ciężkie nadciśnienie tętnicze. Należy zachować ostrożność podczas stosowania noradrenaliny z poniższymi lekami, ponieważ mogą powodować nasilenie działania na serce: hormony tarczycy, glikozydy nasercowe i leki przeciwarytmiczne. Alkaloidy sporyszu lub oksytocyna mogą nasilać działanie wazopresyjne i obkurczające naczynia.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Produkt leczniczy Sinora może upośledzać przepływ krwi przez łożysko i powodować bradykardię u płodu. Może również wywoływać skurcze macicy, a w końcowym okresie ciąży niedotlenienie płodu. Należy ocenić stosunek możliwych zagrożeń dla płodu do potencjalnych korzyści dla matki. Karmienie piersi? Informacje dotyczące stosowania produktu leczniczego Sinora w okresie karmienia piersią nie są dostępne.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie ma wpływu.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlDziałania niepożądane
4.8 Działania niepożądane Częstość występowania działań niepożądanych nie może być określona na podstawie dostępnych danych. Klasyfikacja układów i narządów Działanie niepożądane: Zaburzenia psychiczne: Niepokój, bezsenność, splątanie, osłabienie, stan psychotyczny. Działanie niepożądane: Zaburzenia układu nerwowego: Ból głowy, drżenie. Działanie niepożądane: Zaburzenia oka: Ostra jaskra (bardzo częsta u pacjentów z anatomiczną predyspozycją w formie zamykającego się kąta tęczówkowo-rogówkowego). Działanie niepożądane: Zaburzenia serca: Tachykardia, bradykardia (prawdopodobnie jako odruch w wyniku wzrostu ciśnienia krwi), zaburzenia rytmu serca, kołatanie serca, wzrost kurczliwości mięśnia sercowego spowodowany działaniem beta-adrenergicznym na serce (inotropowe i chronotropowe), ostra niewydolność serca, kardiomiopatia indukowana stresem.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlDziałania niepożądane
Działanie niepożądane: Zaburzenia naczyniowe: Nadciśnienie tętnicze i hipoksja tkankowa, uraz niedokrwienny (w tym zgorzel kończyn) spowodowany silnym działaniem obkurczającym naczynia może prowadzić do uczucia zimna oraz bladości kończyn i twarzy. Działanie niepożądane: Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Niewydolność oddechowa lub trudności z oddychaniem, duszność. Działanie niepożądane: Zaburzenia żołądka i jelit: Nudności, wymioty. Działanie niepożądane: Zaburzenia nerek i dróg moczowych: Zatrzymanie moczu. Działanie niepożądane: Zaburzenia ogólne i stany w miejscu podania: Możliwość podrażnienia lub martwicy w miejscu wstrzyknięcia. Ciągłe podawanie leku wazopresyjnego w celu utrzymania ciśnienia krwi bez stosowania leczenia uzupełniającego objętość krwi może powodować następujące objawy: silne obkurczenie naczyń obwodowych i trzewnych, zmniejszenie przepływu krwi przez nerki, zmniejszenie ilości wytwarzania moczu, hipoksja, zwiększenie stężenia mleczanów w surowicy.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlDziałania niepożądane
W przypadku nadwrażliwości lub przedawkowania następujące działania niepożądane mogą występować częściej: nadciśnienie tętnicze, światłowstręt, ból zamostkowy, ból jamy ustnej i gardła, bladość, nadmierne pocenie się i wymioty.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlPrzedawkowanie
4.9 Przedawkowanie Przedawkowanie może prowadzić do ciężkiego nadciśnienia tętniczego, bradykardii odruchowej, znacznego zwiększenia oporu obwodowego i zmniejszenia pojemności minutowej serca. Objawom tym może towarzyszyć nasilony ból głowy, światłowstręt, ból zamostkowy, bladość, nadmierne pocenie się i wymioty. W przypadku przedawkowania należy przerwać podawanie produktu leczniczego i podjąć odpowiednie leczenie...
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Leki wpływające na receptory adrenergiczne i dopaminergiczne, kod ATC: C01CA03 Mechanizm działania Działanie na naczynia wywierane przez dawki zwykle stosowane w warunkach klinicznych wynika z jednoczesnego pobudzania receptorów alfa- i beta-adrenergicznych w sercu i układzie naczyniowym. Z wyjątkiem serca, działanie to jest wywierane przede wszystkim na receptory alfa. Działanie farmakodynamiczne Powoduje to zwiększenie siły (i przy braku hamowania poprzez nerw błędny, częstości) skurczów mięśnia sercowego. Zwiększa się opór obwodowy prowadząc do zwiększenia skurczowego i rozkurczowego ciśnienia krwi. Skuteczność kliniczna i bezpieczeństwo stosowania Wzrost ciśnienia krwi może spowodować odruchowy spadek częstości akcji serca. Działanie obkurczające naczynia może prowadzić do zmniejszenia przepływu krwi w nerkach, wątrobie, skórze i mięśniach gładkich.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlWłaściwości farmakodynamiczne
Miejscowe obkurczenie naczyń może powodować hemostazę i (lub) martwicę. Działanie wywierane na ciśnienie krwi ustępuje w ciągu 1-2 minut od przerwania infuzji.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Istnieją dwa stereoizomery noradrenaliny: biologicznie czynny izomer L jest tym, który znajduje się w produkcie leczniczym Sinora roztwór do infuzji. Wchłanianie: Podskórnie: słabe. Doustnie: po podaniu doustnym noradrenalina ulega szybkiej inaktywacji w przewodzie pokarmowym. Okres półtrwania w osoczu po podaniu dożylnym noradrenaliny wynosi około 1 do 2 minut. Dystrybucja: Noradrenalina jest szybko usuwana z osocza za pośrednictwem wychwytu komórkowego i metabolizmu. Nie przenika łatwo przez barierę krew-mózg. Metabolizm: Metylacja za pośrednictwem katecholo-O-metylotransferazy. Deaminacja za pośrednictwem monoaminooksydazy (MAO). Ostateczny metabolit obu procesów to kwas 4-hydroksy-3-metoksymigdałowy. Metabolity pośrednie to normetanefryna i kwas 3,4-dihydroksymigdałowy. Eliminacja: Noradrenalina jest wydalana głównie w postaci koniugatów glukuronidu lub siarczanu z metabolitami w moczu.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Większość działań niepożądanych przypisywanych działaniu sympatykomimetycznemu wynika z nadmiernego pobudzania współczulnego układu nerwowego za pośrednictwem różnych receptorów adrenergicznych. Noradrenalina może upośledzać przepływ przez łożysko i powodować bradykardię u płodu. Może również wywoływać skurcze macicy, a w końcowym okresie ciąży niedotlenienie płodu.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Kwas solny stężony (do ustalenia pH) Woda do wstrzykiwań. 6.2 Niezgodności farmaceutyczne Nie mieszać produktu leczniczego Sinora z innymi produktami leczniczymi. Zgłaszano niezgodności farmaceutyczne roztworów do infuzji zawierających noradrenaliny winian z następującymi substancjami: środki o odczynie zasadowym lub o właściwościach utleniających, barbiturany, chlorfeniramina, chlorotiazyd, nitrofurantoina, nowobiocyna, fenytoina, wodorowęglan sodu, jodek sodu, streptomycyna. 6.3 Okres ważności 18 miesięcy. Po pierwszym otwarciu produkt należy natychmiast użyć. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25°C. Nie zamrażać. Przechowywać fiolkę w opakowaniu zewnętrznym w celu ochrony przed światłem.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlDane farmaceutyczne
6.5 Rodzaj i zawartość opakowania Sinora 0,1 mg/1 ml Fiolka z przejrzystego, bezbarwnego szkła typu I zamknięta korkiem z gumy bromobutylowej i wieczkiem aluminiowym typu flip-off, zawierająca 50 ml roztworu do infuzji, z przylepną etykietą i zapakowana pojedynczo. Sinora 0,2 mg/1 ml Fiolka z przejrzystego, bezbarwnego szkła typu I zamknięta korkiem z gumy bromobutylowej i wieczkiem aluminiowym typu flip-off, zawierająca 50 ml roztworu do infuzji, z przylepną etykietą, zapakowana pojedynczo. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Roztwór do infuzji Sinora jest już rozcieńczony i gotowy do użycia. Należy go użyć bez uprzedniego rozcieńczania oraz podać z użyciem odpowiedniej strzykawki lub pompy strzykawkowej, infuzyjnej lub licznika kropli, które zapewnią dokładne i stałe podawanie minimalnej określonej objętości ze ściśle kontrolowaną szybkością infuzji zgodnie z instrukcjami dotyczącymi zwiększania dawki zawartymi w punkcie 4.2.
- CHPL leku Sinora, roztwór do infuzji, 0,2 mg/mlDane farmaceutyczne
Produktu leczniczego nie należy stosować, jeśli roztwór ma zabarwienie ciemniejsze niż lekko żółtawe lub różowe lub jeśli zawiera osad. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Noradrenaline Aguettant, 0,08 mg/ml, roztwór do infuzji (Noradrenalinum) 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu do infuzji zawiera 0,16 mg noradrenaliny winianu, co odpowiada 0,08 mg noradrenaliny. Każda fiolka o pojemności 50 ml zawiera 8 mg noradrenaliny winianu, co odpowiada 4 mg noradrenaliny. Substancja pomocnicza o znanym działaniu: Każdy ml roztworu do infuzji zawiera 3,5 mg sodu, co odpowiada 0,2 mmol sodu. Każda fiolka o pojemności 50 ml zawiera około 177,3 mg sodu, co odpowiada 7,7 mmol sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Roztwór do infuzji. Przezroczysty, bezbarwny lub lekko żółtawy roztwór. pH od 3,2 do 3,8. Osmolalność: od 260 do 320 mOsm/kg.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Produkt Noradrenaline Aguettant jest wskazany do stosowania w leczeniu nagłego stanu niedociśnienia tętniczego, u osób dorosłych o masie ciała większej niż 50 kg.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Wyłącznie podanie dożylne. Produkt Noradrenaline Aguettant należy podawać wyłącznie w infuzji dożylnej, przez cewnik wprowadzony do żyły centralnej, w celu zminimalizowania ryzyka wystąpienia wynaczynienia, które może prowadzić do martwicy tkanek. Produkt Noradrenaline Aguettant należy podawać w infuzji z kontrolowaną prędkością, używając pompy infuzyjnej lub pompy strzykawkowej. Produkt Noradrenaline Aguettant jest roztworem do infuzji gotowym do użycia - przed użyciem nie należy go rozcieńczać. Produktu nie należy mieszać z innymi lekami. Pomiary ciśnienia tętniczego: W trakcie leczenia należy dokładnie kontrolować ciśnienie tętnicze, najlepiej poprzez monitorowanie ciśnienia tętniczego. Przez cały czas podawania produktu Noradrenaline Aguettant należy ściśle kontrolować stan pacjenta. Dawkowanie Dawka początkowa: Początkowa dawka noradrenaliny wynosi zazwyczaj od 0,05 do 0,15 mikrograma/kg mc./min.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlDawkowanie
Zalecana dawka podtrzymująca: Zalecana dawka podtrzymująca noradrenaliny wynosi od 0,05 do 1,5 mikrograma/kg mc./min. Stopniowe zwiększanie dawki: Infuzję produktu Noradrenaline Aguettant należy wykonać za pomocą odpowiedniej pompy infuzyjnej lub pompy strzykawkowej, która w sposób precyzyjny i ciągły umożliwi podaż minimalnej określonej objętości w ramach ściśle monitorowanej prędkości infuzji, zgodnie z instrukcjami dotyczącymi stopniowego zwiększania dawki. Po rozpoczęciu infuzji należy stopniowo zwiększać dawkę noradrenaliny o 0,05-0,1 mikrograma/kg mc./min, zgodnie z obserwowanym działaniem presyjnym. Istnieją znaczne różnice międzyosobnicze, odnośnie wielkości dawki wymaganej do uzyskania i utrzymania prawidłowych wartości ciśnienia tętniczego. Celem leczenia powinno być osiągnięcie niskiej wartości prawidłowego ciśnienia skurczowego (100-120 mm Hg) lub osiągnięcie odpowiedniej wartości średniego ciśnienia tętniczego (powyżej 65 mm Hg - w zależności od stanu pacjenta).
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlDawkowanie
Nie zaleca się rozpoczynania infuzji od wstrzyknięcia dożylnego w postaci bolusu. Należy zachować ostrożność podczas zmiany infuzji, w celu uniknięcia niestabilności hemodynamicznej. Zaleca się wykonywanie ciągłej infuzji noradrenaliny za pomocą systemu z podwójną pompą i zestawu przedłużającego, zmniejszającego objętość przestrzeni martwej. Noradrenaline Aguettant 0,08 mg/ml, roztwór do infuzji Masa ciała pacjenta (kg) Dawka noradrenaliny (µg/kg/min) Dawka noradrenaliny winianu (µg/kg/min) Dawka noradrenaliny (mg/h) Dawka noradrenaliny winianu (mg/h) Prędkość infuzji (ml/h) 50 0,05 0,1 0,15 0,3 1,9 60 0,05 0,1 0,18 0,36 2,3 70 0,05 0,1 0,21 0,42 2,6 80 0,05 0,1 0,24 0,48 3,0 90 0,05 0,1 0,27 0,54 3,4 100 0,05 0,1 0,3 0,6 3,8 Czas trwania leczenia Leczenie należy stosować do momentu, gdy nie będzie już wskazań do podawania dużej dawki leku wazoaktywnego.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlDawkowanie
Od tego momentu infuzję należy stopniowo zmniejszać, a następnie zastosować infuzję o mniejszym stężeniu noradrenaliny. Nagłe odstawienie leku może spowodować ostre niedociśnienie. Pacjenci w podeszłym wieku Patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania. Dzieci i młodzież Produkt Noradrenaline Aguettant jest wskazany do stosowania wyłącznie u osób dorosłych. Nie ustalono skuteczności i bezpieczeństwa stosowania produktu Noradrenaline Aguettant 50 ml, gotowego do użycia roztworu do infuzji u dzieci i młodzieży. Pacjenci z zaburzeniami czynności nerek i wątroby. Brak danych dotyczących leczenia pacjentów z zaburzeniami czynności nerek i wątroby.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Podawanie przez kaniulę obwodową i (lub) żyłę obwodową. Nadwrażliwość na noradrenalinę lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ostrzeżenia: Noradrenalina jest przeciwwskazana u pacjentów z niedociśnieniem, u których zapaść krążeniowa jest związana z hipowolemią, z wyjątkiem działań ratunkowych w celu utrzymania dopływu krwi do tętnic wieńcowych i mózgowych, do momentu zastosowania leczenia uzupełniającego objętość wewnątrznaczyniową. Produkt Noradrenaline Aguettant podaje się w infuzji dożylnej, wyłącznie przez cewnik wprowadzony do żyły centralnej. W takim przypadku ryzyko wynaczynienia i związanej z nim martwicy tkanek jest niewielkie. Należy regularnie sprawdzać miejsce podania. Jednak w przypadku wynaczynienia infuzję należy natychmiast przerwać, a miejsce wynaczynienia niezwłocznie ostrzyknąć fentolaminą, a następnie monitorować, czy następuje poprawa i ocenić konieczność dalszego leczenia w celu odwrócenia skutków niedokrwienia.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlSpecjalne środki ostrozności
Środki ostrożności dotyczące stosowania: Szczególnie ostrożną ocenę zaleca się w następujących przypadkach niedociśnienia tętniczego i hipoperfuzji, w których konieczne może być zmniejszenie dawki noradrenaliny: ciężkie zaburzenia czynności lewej komory serca, związane z gwałtownym obniżeniem ciśnienia tętniczego. Leczenie podtrzymujące należy rozpocząć równocześnie z podjęciem oceny diagnostycznej. Podawanie noradrenaliny należy zarezerwować dla pacjentów ze wstrząsem kardiogennym i niedociśnieniem opornym na leczenie, w szczególności dla pacjentów bez zwiększonego układowego oporu naczyniowego. pacjenci z niedociśnieniem, u których zdiagnozowano zakrzepicę naczyń wieńcowych, krezki lub obwodowych, zawał mięśnia sercowego lub dławicę Prinzmetala. W takich przypadkach należy zachować szczególną ostrożność, ponieważ noradrenalina może zwiększać objawy niedokrwienia i obszar zawału. wystąpienie zaburzeń rytmu serca w trakcie leczenia noradrenaliną.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlSpecjalne środki ostrozności
Należy zachować ostrożność w przypadku leczenia pacjentów z nadczynnością tarczycy lub cukrzycą. W przypadkach, w których konieczne jest podanie w tym samym czasie noradrenaliny i wykonanie transfuzji krwi lub osocza, wówczas krew lub osocze należy przetoczyć w oddzielnej infuzji. Ten produkt leczniczy zawiera 177,3 mg sodu na fiolkę, co odpowiada 8,9% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Jednoczesne stosowanie niewskazane: wziewne anestetyki halogenowe: ciężkie komorowe zaburzenia rytmu serca (zwiększenie pobudliwości serca); leki przeciwdepresyjne zawierające imipraminę: napadowe nadciśnienie tętnicze z ryzykiem wystąpienia zaburzeń rytmu serca (zahamowanie przenikania leków sympatykomimetycznych do włókien współczulnych); leki przeciwdepresyjne pobudzające receptory adrenergiczne i serotoninergiczne: napadowe nadciśnienie tętnicze z ryzykiem wystąpienia zaburzeń rytmu serca (zahamowanie przenikania leków sympatykomimetycznych do włókien współczulnych). Jednoczesne stosowanie wymagające zachowania ostrożności: niewybiórcze inhibitory MAO: nasilenie działania presyjnego leków sympatykomimetycznych, które zazwyczaj jest umiarkowane - leki te należy stosować wyłącznie pod ścisłym nadzorem lekarza; wybiórcze inhibitory MAO-A, linezolid i błękit metylenowy: na podstawie podobieństwa do działania niewybiórczych inhibitorów MAO, ryzyko nasilenia działania presyjnego - leki te należy stosować wyłącznie pod ścisłym nadzorem lekarza.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Ze względu na wskazania, noradrenalinę można stosować w czasie ciąży, jeśli jest to konieczne. Należy jednak wziąć pod uwagę właściwości farmakodynamiczne tej substancji. Noradrenalina może zaburzać przepływ krwi przez łożysko i powodować u płodu bradykardię. Może również wywierać działanie skurczowe na ciężarną macicę, co może doprowadzić do niedotlenienia płodu w późniejszym okresie ciąży, prowadzącego do obumarcia płodu. Karmienie piersi? Brak danych na temat stosowania noradrenaliny u kobiet karmiących piersią.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie dotyczy.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlDziałania niepożądane
4.8 Działania niepożądane Zaburzenia psychiczne: Niepokój. Zaburzenia układu nerwowego: Ból głowy, drżenie. Zaburzenia oka: Ostra jaskra (bardzo częsta u pacjentów z anatomiczną predyspozycją do zamykania kąta tęczówkowo-rogówkowego). Zaburzenia serca: Tachykardia, bradykardia (prawdopodobnie w wyniku reakcji odruchowej na zwiększenie ciśnienia tętniczego), zaburzenia rytmu serca, kołatanie serca, zwiększenie kurczliwości mięśnia sercowego wynikające z działania inotropowego i chronotropowego dodatniego, za pośrednictwem receptorów ß-adrenergicznych w sercu, ostra niewydolność serca, kardiomiopatia indukowana stresem. Zaburzenia naczyniowe: Nadciśnienie tętnicze i niedotlenienie tkanek, uszkodzenie o podłożu niedokrwiennym, spowodowane silnym działaniem zwężającym naczynia krwionośne (zimne i blade kończyny oraz twarz), zgorzel kończyn. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Niewydolność oddechowa lub trudności w oddychaniu, duszność.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlDziałania niepożądane
Zaburzenia żołądka i jelit: Wymioty. Zaburzenia nerek i dróg moczowych: Zatrzymanie moczu. Zaburzenia ogólne i stany w miejscu podania: Miejscowe działania niepożądane: możliwość wystąpienia podrażnienia i martwicy w miejscu wstrzyknięcia. Kontynuacja leczenia wazopresyjnego w celu utrzymania ciśnienia tętniczego, bez uzupełnienia objętości wewnątrznaczyniowej, może powodować następujące objawy: silne zwężenie naczyń obwodowych i trzewnych; zmniejszenie przepływu krwi przez nerki; zmniejszenie wytwarzania moczu; niedotlenienie; zwiększenie stężenia mleczanów w surowicy. W przypadku nadwrażliwości lub przedawkowania, częściej mogą wystąpić następujące działania niepożądane: nadciśnienie tętnicze, światłowstręt, ból zamostkowy, ból gardła, bladość, nadmierne pocenie i wymioty. 6. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlDziałania niepożądane
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane do: Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlPrzedawkowanie
4.9 Przedawkowanie W razie przedawkowania mogą wystąpić następujące objawy: skurcz naczyń skórnych, odleżyny, zapaść krążeniowa oraz nadciśnienie. W przypadku wystąpienia działań niepożądanych związanych z przyjęciem zbyt dużej dawki leku zaleca się zmniejszenie dawki leku, jeśli jest to możliwe.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki adrenergiczne i dopaminergiczne, kod ATC: C01CA03. Noradrenalina silnie pobudza receptory alfa-adrenergiczne w naczyniach krwionośnych. Oddziałuje również na receptory beta1-adrenergiczne w sercu, co skutkuje uzyskaniem dodatniego działania inotropowego i początkowo dodatniego działania chronotropowego. Zwiększenie ciśnienia tętniczego może spowodować odruchowe zwolnienie czynności serca. Zwężenie naczyń krwionośnych może prowadzić do zmniejszenia przepływu krwi przez nerki, wątrobę, skórę i mięśnie gładkie. Miejscowe zwężenie naczyń może prowadzić do hemostazy i (lub) martwicy. Działanie presyjne ustępuje po 1-2 min po zakończeniu infuzji. Może ponadto wystąpić tolerancja na działanie noradrenaliny.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Istnieją dwa stereoizomery noradrenaliny; w produkcie Noradrenaline Aguettant znajduje się biologicznie czynny izomer L. Wchłanianie: podanie podskórne: słabe; podanie doustne: szybka inaktywacja noradrenaliny w przewodzie pokarmowym; podanie dożylne: okres półtrwania w osoczu noradrenaliny wynosi około 1 do 2 minut. Dystrybucja: noradrenalina jest szybko usuwana z osocza za pośrednictwem wychwytu komórkowego i metabolizmu. Nie przenika łatwo przez barierę krew-mózg. Metabolizm: metylacja za pośrednictwem katecholo-O-metylotransferazy; deaminacja za pośrednictwem monoaminooksydazy (MAO); ostateczny metabolit obu procesów to kwas 4-hydroksy-3-metoksymigdałowy; metabolity pośrednie to normetanefryna i kwas 3,4-dihydroksymigdałowy. Eliminacja: noradrenalina jest wydalana głównie w postaci sprzężonej z kwasem glukuronowym lub siarkowym w moczu.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Większość działań niepożądanych związana jest z działaniem sympatykomimetycznym, powodującym nadmierne pobudzenie współczulnego układu nerwowego przez różne receptory adrenergiczne. Noradrenalina może zaburzać przepływ krwi przez łożysko i powodować u płodu bradykardię prowadzącą do obumarcia. Może również wywierać działanie skurczowe na ciężarną macicę, co może doprowadzić do niedotlenienia płodu w późniejszym okresie ciąży, prowadzącego do obumarcia płodu.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Disodu edetynian Kwas solny lub sodu wodorotlenek (do ustalenia pH) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie mieszać produktu leczniczego z innymi produktami leczniczymi. 6.3 Okres ważności 18 miesięcy. Po pierwszym otwarciu produkt należy zużyć natychmiast. 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25°C. Przechowywać fiolkę w opakowaniu zewnętrznym – tekturowym pudełku w celu ochrony przed światłem. 6.5 Rodzaj i zawartość opakowania Fiolka z przezroczystego szkła typu II, zamknięta korkiem z gumy bromobutylowej z aluminiowym uszczelnieniem, zawierająca 50 ml roztworu do infuzji. Wielkości opakowań: 1, 10 i 25 fiolek, w tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania.
- CHPL leku Noradrenaline Aguettant, roztwór do infuzji, 0,08 mg/mlDane farmaceutyczne
Wyłącznie do jednorazowego użytku. Niewykorzystany lek należy usunąć. Produkt Noradrenaline Aguettant jest rozcieńczonym roztworem do infuzji gotowym do użycia. Nie należy go rozcieńczać przed użyciem. Infuzję noradrenaliny należy wykonać używając odpowiedniej pompy infuzyjnej lub pompy strzykawkowej, która w sposób precyzyjny i systematyczny umożliwi podaż minimalnej określonej objętości w ramach ściśle monitorowanej prędkości infuzji, zgodnie z instrukcjami dotyczącymi stopniowego zwiększania dawki, określonymi w punkcie 4.2. Nie należy stosować leku, jeśli roztwór ma kolor ciemniejszy niż lekko żółty lub różowy, bądź jeśli zawiera osad. Nie należy stosować jałowego roztworu, jeżeli nie jest przezroczysty i zawiera cząstki lub jeśli plomba zabezpieczająca fiolkę została naruszona. Wszelkie niewykorzystane pozostałości produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
1. NAZWA PRODUKTU LECZNICZEGO Noradrenalin Kalceks, 1 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy 1 ml koncentratu do sporządzania roztworu do infuzji zawiera noradrenaliny winian w ilości odpowiadającej 1 mg noradrenaliny. Każda ampułka zawierająca 2 ml koncentratu do sporządzania roztworu do infuzji zawiera noradrenaliny winian w ilości odpowiadającej 2 mg noradrenaliny. Każda ampułka zawierająca 4 ml koncentratu do sporządzania roztworu do infuzji zawiera noradrenaliny winian w ilości odpowiadającej 4 mg noradrenaliny. Każda ampułka zawierająca 5 ml koncentratu do sporządzania roztworu do infuzji zawiera noradrenaliny winian w ilości odpowiadającej 5 mg noradrenaliny. Każda ampułka zawierająca 8 ml koncentratu do sporządzania roztworu do infuzji zawiera noradrenaliny winian w ilości odpowiadającej 8 mg noradrenaliny.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlNazwa produktu leczniczego, skład i postać farmaceutyczna
Każda ampułka zawierająca 10 ml koncentratu do sporządzania roztworu do infuzji zawiera noradrenaliny winian w ilości odpowiadającej 10 mg noradrenaliny. Po odpowiednim rozcieńczeniu każdy ml zawiera noradrenaliny winian w ilości odpowiadającej 40 mikrogramom noradrenaliny. Substancje pomocnicze o znanym działaniu 8 ml koncentratu do sporządzania roztworu do infuzji zawiera 26,4 mg (lub 1,12 mmol) sodu. 10 ml koncentratu do sporządzania roztworu do infuzji zawiera 33 mg (lub 1,40 mmol) sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. 3. POSTAĆ FARMACEUTYCZNA Koncentrat do sporządzania roztworu do infuzji (jałowy koncentrat). Przezroczysty, bezbarwny lub żółtawy roztwór, praktycznie wolny od widocznych cząstek. Wartość pH roztworu wynosi od 3,0 do 4,0. Osmolalność wynosi 260-310 mOsm/kg.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlWskazania do stosowania
4.1 Wskazania do stosowania Noradrenalin Kalceks, 1 mg/ml, koncentrat do sporządzania roztworu do infuzji jest wskazany do stosowania u osób dorosłych w stanach nagłych, w celu przywrócenia prawidłowego ciśnienia tętniczego, w przypadku ostrego niedociśnienia tętniczego.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlDawkowanie
4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Należy dodać 2 ml produktu Noradrenalin Kalceks do 48 ml roztworu glukozy 50 mg/ml (5%) (lub innych roztworów do rozcieńczenia wymienionych w punkcie 6.6) i podać za pomocą pompy strzykawkowej. Końcowe stężenie roztworu do infuzji wynosi 80 mg/litr noradrenaliny winianu, co odpowiada 40 mg/litr noradrenaliny. W przypadku zastosowania innych rozcieńczeń należy dokonać dokładnych przeliczeń przed rozpoczęciem leczenia. Początkowa szybkość infuzji Początkowa szybkość infuzji powinna wynosić od 10 ml/godzinę do 20 ml/godzinę (0,16 ml/min do 0,32 ml/min). Taka szybkość jest równoważna z 0,8 mg/godzinę do 1,6 mg/godzinę noradrenaliny winianu (lub 0,4 mg/godzinę do 0,8 mg/godzinę noradrenaliny). Dostosowanie dawki Po zabezpieczeniu dostępu dożylnego dla noradrenaliny, należy stopniowo zwiększać dawkę, biorąc pod uwagę obserwowane działanie zwiększające ciśnienie tętnicze.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlDawkowanie
Istnieje duża indywidualna zmienność dawki wymaganej do osiągnięcia i utrzymania prawidłowego ciśnienia tętniczego. Celem powinno być osiągnięcie niskiego prawidłowego ciśnienia skurczowego (100-120 mm Hg) lub odpowiedniego średniego ciśnienia tętniczego (wyższego niż 65-80 mm Hg - w zależności od stanu pacjenta). Tabela 1 Dostosowanie dawki roztworu noradrenaliny do infuzji Roztwór noradrenaliny do infuzji 40 mg/l (40 μg/ml) noradrenaliny Masa ciała pacjenta Dawkowanie (µg/kg/min) noradrenaliny Dawkowanie (mg/godzinę) noradrenaliny Szybkość infuzji (ml/godzinę) 40 kg 0,05 - 0,12 - 3,0 0,1 - 0,24 - 6,0 0,25 - 0,60 - 15,0 0,5 - 1,2 - 30,0 1 - 2,4 - 60 50 kg 0,05 - 0,15 - 3,75 0,1 - 0,3 - 7,5 0,25 - 0,75 - 18,75 0,5 - 1,5 - 37,5 1 - 3 - 75 60 kg 0,05 - 0,18 - 4,5 0,1 - 0,36 - 9 0,25 - 0,9 - 22,5 0,5 - 1,8 - 45 1 - 3,6 - 90 70 kg 0,05 - 0,21 - 5,25 0,1 - 0,42 - 10,5 0,25 - 1,05 - 26,25 0,5 - 2,1 - 52,5 1 - 4,2 - 105 80 kg 0,05 - 0,24 - 6 0,1 - 0,48 - 12 0,25 - 1,2 - 30 0,5 - 2,4 - 60 1 - 4,8 - 120 90 kg 0,05 - 0,27 - 6,75 0,1 - 0,54 - 13,5 0,25 - 1,35 - 33,75 0,5 - 2,7 - 67,5 1 - 5,4 - 135 Czas trwania leczenia i monitorowania stanu pacjenta Noradrenalinę należy podawać tak długo, aby możliwe było utrzymanie bez leczenia odpowiedniego ciśnienia tętniczego i perfuzji tkanek.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlDawkowanie
Przez cały czas podawania noradrenaliny należy uważnie monitorować stan pacjenta. Noradrenalina powinna być podawana wyłącznie przez wykwalifikowanych pracowników ochrony zdrowia, którzy mają doświadczenie w jej stosowaniu i dysponują odpowiednimi urządzeniami do monitorowania stanu pacjenta. Zakończenie leczenia Infuzje należy odstawiać stopniowo, unikając nagłego zakończenia leczenia, ponieważ może to wywołać ostre niedociśnienie tętnicze. Zaburzenia czynności wątroby i (lub) nerek Brak doświadczenia w leczeniu pacjentów z zaburzeniami czynności wątroby lub nerek. Pacjenci w podeszłym wieku Na ogół dobór dawki u osób w podeszłym wieku należy prowadzić ostrożnie, rozpoczynając od najmniejszej dawki z zakresu dawek, gdyż w tej grupie wiekowej częściej występuje zaburzenie czynności wątroby, nerek lub serca, a także współistniejące choroby i przyjmowanie innych leków.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlDawkowanie
Dzieci i młodzież Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności noradrenaliny u dzieci w wieku poniżej 18 lat. Brak dostępnych danych. Sposób podawania Droga podania: Podanie dożylne po rozcieńczeniu. Noradrenalin Kalceks należy podawać w postaci rozcieńczonego roztworu przez centralny cewnik żylny. Infuzja powinna odbywać się z kontrolowaną szybkością z zastosowaniem pompy strzykawkowej, pompy infuzyjnej lub licznika kropli. Instrukcja dotycząca rozcieńczania produktu leczniczego przed podaniem, patrz punkt 6.6.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlPrzeciwwskazania
4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Niedociśnienie tętnicze spowodowane zmniejszeniem objętości krwi (hipowolemia). Nie stosować z anestetykami, takimi jak – cyklopropan i halotan. Interakcje - patrz punkt 4.5. Stosowanie amin presyjnych podczas znieczulenia cyklopropanem lub halotanem może powodować ciężkie zaburzenia rytmu serca. Ze względu na możliwość zwiększenia ryzyka migotania komór, noradrenalinę należy stosować ostrożnie u pacjentów otrzymujących powyższe leki lub inne substancje zwiększające wrażliwość mięśnia sercowego oraz u pacjentów ze znacznego stopnia hipoksją lub hiperkapnią. U osób w podeszłym wieku i pacjentów z chorobami okluzyjnymi należy unikać podawania do żył kończyn dolnych, z powodu możliwego skurczu naczyń (patrz punkt 4.4).
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlSpecjalne środki ostrozności
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie stosować bez uprzedniego rozcieńczenia. Noradrenaliny nie należy podawać pacjentom z niedociśnieniem tętniczym spowodowanym zmniejszeniem objętości krwi, z wyjątkiem sytuacji nagłych w celu utrzymania perfuzji tętnic wieńcowych i mózgowych do czasu zakończenia terapii zastępczej objętości krwi. Noradrenalinę należy podawać wyłącznie w skojarzeniu z płynami uzupełniającymi objętość krwi. W przypadku ciągłego podawania noradrenaliny w celu utrzymania ciśnienia tętniczego, bez przetaczania płynów uzupełniających objętość krwi, może wystąpić: silny skurcz naczyń obwodowych i trzewnych naczyń krwionośnych, zmniejszenie przepływu krwi przez nerki i zmniejszenie ilości wytwarzanego moczu, zaburzenie ogólnoustrojowego przepływu krwi, pomimo „prawidłowego” ciśnienia krwi, hipoksja tkankowa i kwasica mleczanowa.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlSpecjalne środki ostrozności
Płyny uzupełniające objętość krwi mogą być przetaczane przed i (lub) jednocześnie z tym produktem; jeśli jednak wskazane w celu zwiększenia objętości krwi jest przetoczenie krwi pełnej lub osocza, należy je podać oddzielnie (np. w przypadku przetaczania jednocześnie z lekiem, należy zastosować przyrząd z rozgałęźnikiem typu Y i osobne pojemniki). Długotrwałe podawanie jakiegokolwiek silnego leku obkurczającego naczynia krwionośne może prowadzić do zmniejszenia objętości osocza - należy je stale wyrównywać, odpowiednio uzupełniając płyny i elektrolity. Konsekwencją niewyrównania objętości osocza może być nawrót niedociśnienia po odstawieniu noradrenaliny lub utrzymanie ciśnienia krwi z ryzykiem silnego skurczu naczyń obwodowych i trzewnych (np. osłabienia przepływu krwi przez nerki), ze zmniejszeniem przepływu krwi i zmniejszeniem perfuzji tkanek, prowadzącym do niedotlenienia tkanek i kwasicy mleczanowej oraz możliwego uszkodzenia tkanek o podłożu niedokrwiennym; w rzadkich przypadkach zgłaszano wystąpienie zgorzeli kończyn.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlSpecjalne środki ostrozności
Podczas podawania noradrenaliny należy często sprawdzać ciśnienie krwi i szybkość jej przepływu, aby uniknąć nadciśnienia tętniczego, które może być związane z bradykardią, bólem głowy i niedokrwieniem obwodowym, w tym, rzadko, zgorzelą kończyn. Wynaczynienie może powodować miejscową martwicę tkanek (patrz punkt „Wynaczynienie” poniżej). Zaleca się ostrożność u pacjentów z ciężkimi zaburzeniami czynności lewej komory związanymi z ostrym niedociśnieniem tętniczym. Leczenie wspomagające należy rozpocząć jednocześnie z oceną diagnostyczną. Noradrenalina zalecana jest dla pacjentów ze wstrząsem kardiogennym i opornym niedociśnieniem tętniczym, w szczególności tych bez podwyższonego ogólnoustrojowego oporu naczyniowego. W przypadku wystąpienia zaburzeń rytmu serca podczas leczenia, należy zmniejszyć dawkę.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlSpecjalne środki ostrozności
Zaburzenia rytmu serca mogą wystąpić, gdy noradrenalina jest stosowana w skojarzeniu z produktami zwiększającymi wrażliwość mięśnia sercowego - mogą one być bardziej prawdopodobne u pacjentów z niedotlenieniem lub hiperkapnią. Należy zachować szczególną ostrożność u pacjentów z zakrzepicą naczyń wieńcowych, krezkowych lub obwodowych, ponieważ noradrenalina może zwiększać niedokrwienie i rozszerzyć obszar martwicy niedokrwiennej, chyba że w ocenie lekarza prowadzącego, podanie noradrenaliny jest konieczne do uratowania życia pacjenta. Podobną ostrożność należy zachować u pacjentów z niedociśnieniem tętniczym po zawale mięśnia sercowego oraz u pacjentów z dławicą piersiową, szczególnie z dławicą Prinzmetala, z cukrzycą, nadciśnieniem tętniczym lub nadczynnością tarczycy (patrz punkt 4.8). Należy zachować szczególną ostrożność u pacjentów z niewydolnością wątroby, ciężkimi zaburzeniami czynności nerek, chorobami niedokrwiennymi serca i podwyższonym ciśnieniem śródczaszkowym.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlSpecjalne środki ostrozności
Przedawkowanie lub stosowanie zalecanych dawek u osób z nadwrażliwością (np. pacjenci z nadczynnością tarczycy) może powodować ciężkie nadciśnienie tętnicze z gwałtownym bólem głowy, światłowstrętem, przeszywającym bólem zamostkowym, bladością, intensywnym poceniem się i wymiotami. Nadciśnienie tętnicze może ostatecznie doprowadzić do ostrego obrzęku płuc, arytmii lub zatrzymania krążenia. Należy zachować ostrożność u pacjentów chorych na cukrzycę, ponieważ noradrenalina zwiększa stężenie glukozy we krwi (z powodu działania glikogenolitycznego w wątrobie i hamowania uwalniania insuliny z trzustki). Osoby w podeszłym wieku mogą być szczególnie wrażliwe na działanie noradrenaliny ze względu na częstsze występowanie zaburzeń czynności wątroby, nerek lub serca oraz z powodu chorób współistniejących i przyjmowania innych leków. Nie zaleca się stosowania noradrenaliny u dzieci i młodzieży (patrz punkty 4.2 i 5.2).
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlSpecjalne środki ostrozności
Noradrenalina powinna być podawana wyłącznie przez lekarzy mających wiedzę o selektywnych wskazaniach do jej stosowania. Jeśli jest to wskazane, należy zastosować odpowiednią terapię z użyciem preparatów krwiozastępczych lub podaż płynów, wraz z ułożeniem pacjenta w pozycji na wznak, z uniesieniem nóg, przed i (lub) podczas podawania produktu. Aby uniknąć nadciśnienia tętniczego w czasie infuzji noradrenaliny, należy monitorować ciśnienie tętnicze i szybkość przepływu. Dlatego zaleca się pomiary ciśnienia tętniczego co dwie minuty od rozpoczęcia infuzji do momentu osiągnięcia pożądanego ciśnienia krwi, a następnie, co pięć minut, jeśli lek jest w dalszym ciągu podawany. Należy stale monitorować szybkość przepływu, a pacjenta nie należy zostawiać bez opieki w czasie podawania noradrenaliny. Nadciśnienie tętnicze może doprowadzić do ostrego obrzęku płuc, zaburzeń rytmu serca lub zatrzymania akcji serca.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlSpecjalne środki ostrozności
Infuzję noradrenaliny należy kończyć stopniowo, ponieważ nagłe przerwanie może spowodować gwałtowne obniżenie ciśnienia krwi.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlInterakcje
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Niezalecane jednoczesne stosowanie Wziewne halogenowe środki znieczulające: ciężkie komorowe zaburzenia rytmu serca (zwiększenie pobudliwości serca). Leki przeciwdepresyjne pochodne imipraminy: napadowe nadciśnienie tętnicze z możliwością arytmii (hamowanie przenikania sympatykomimetyków do włókien współczulnych). Serotoninergiczno-adrenergiczne leki przeciwdepresyjne: napadowe nadciśnienie tętnicze z możliwością wystąpienia arytmii (hamowanie przenikania sympatykomimetyków do włókien współczulnych). Glikozydy naparstnicy. Lewodopa. Chlorfeniraminy chlorowodorek, tripelennaminy chlorowodorek i dezypramina: znacznie zwiększają toksyczność noradrenaliny. Leki przeciwhistaminowe, ponieważ niektóre mogą blokować przyjmowanie katecholamin przez tkanki obwodowe i zwiększać toksyczność wstrzykniętej noradrenaliny.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlInterakcje
Stosowanie amin presyjnych z cyklopropanem, halotanem, chloroformem, enfluranem lub innymi, halogenowymi środkami znieczulającymi, może powodować ciężkie zaburzenia rytmu serca. Ze względu na możliwość zwiększenia ryzyka migotania komór, noradrenalinę należy ostrożnie stosować u pacjentów otrzymujących powyższe leki lub inne leki zwiększające wrażliwość mięśnia sercowego oraz u pacjentów ze znacznego stopnia hipoksją lub hiperkapnią. Jednoczesne stosowanie z zachowaniem ostrożności Nieselektywne inhibitory monoaminooksydazy (MAO): nasilenie działania presyjnego sympatykomimetycznego, które jest zwykle umiarkowane. Należy stosować wyłącznie pod ścisłym nadzorem lekarza. Selektywne inhibitory MAO-A: poprzez ekstrapolację z nieselektywnych inhibitorów MAO, ryzyko zwiększenia działania presyjnego. Należy stosować wyłącznie pod ścisłym nadzorem lekarza. Linezolid: poprzez ekstrapolację z nieselektywnych inhibitorów MAO: ryzyko zwiększenia działania presyjnego.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlInterakcje
Należy stosować wyłącznie pod ścisłym nadzorem lekarza. Noradrenalinę należy podawać szczególnie ostrożnie pacjentom przyjmującym inhibitory MAO lub w ciągu 14 dni po odstawieniu tych leków. Działanie noradrenaliny może być nasilone przez guanetydynę, guanadrel, rezerpinę, metylodopę lub trójpierścieniowe leki przeciwdepresyjne, amfetaminę, doksapram, mazindol, alkaloidy rauwolfii. Należy zachować ostrożność podczas stosowania noradrenaliny z lekami blokującymi receptory alfa i beta, ponieważ może to spowodować ciężkie nadciśnienie tętnicze. Należy zachować ostrożność podczas stosowania noradrenaliny z następującymi produktami lecznicznymi, ponieważ mogą one nasilić działanie nasercowe: hormony tarczycy, glikozydy nasercowe, leki przeciwarytmiczne. Alkaloidy sporyszu (mezylany ergoloidu, ergotamina, dihydroergotamina, ergometryna, metyloergometryna i metysergid) lub oksytocyna mogą nasilać działanie obkurczające naczynia i zwężające naczynia krwionośne.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlInterakcje
Jednoczesne podawanie propofolu i noradrenaliny może prowadzić do rozwinięcia zespołu propofolowego (ang. propofol infusion syndrome, PRIS). Desmopresyna lub wazopresyna: jej działanie antydiuretyczne jest zmniejszone. Lit zmniejsza działanie noradrenaliny. Roztworów do infuzji noradrenaliny nie należy mieszać z innymi lekami (z wyjątkiem wymienionych w punkcie 6.6). 4.6 Wpływ na płodność, ciążę i laktację Ciąża Noradrenalina może zaburzać przepływ krwi przez łożysko i powodować bradykardię u płodu. Może również wywoływać skurcze macicy i doprowadzić do asfiksji płodu w zaawansowanej ciąży. Należy więc rozważyć stosunek możliwego zagrożenia dla płodu do potencjalnych korzyści dla matki. Karmienie piersi? Nie wiadomo, czy lek przenika do mleka ludzkiego. Należy zachować ostrożność podczas podawania noradrenaliny kobiecie karmiącej piersią, ponieważ wiele leków przenika do mleka ludzkiego. Płodność Nie przeprowadzono badań dotyczących wpływu noradrenaliny na płodność.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlInterakcje
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brak dostępnych informacji. Dlatego nie zaleca się prowadzenia pojazdów lub obsługiwania maszyn. 4.8 Działania niepożądane W Tabeli 2 wymieniono działania niepożądane, które wystąpiły u pacjentów leczonych noradrenaliną. Przedstawione dane pochodzą głównie ze zgłoszeń spontanicznych, a ponieważ trudno na podstawie takich zgłoszeń ustalić częstość występowania, w przypadku wymienionych działań niepożądanych jest ona nieznana (częstość nie może być określona na podstawie dostępnych danych). W każdej grupie układów i narządów (ang. System Organ Class, SOC) działania niepożądane są wymienione zgodnie z malejącą częstością występowania. Tabela 2 Działania niepożądane noradrenaliny na podstawie zgłoszeń spontanicznych Klasyfikacja układów i narządów Działania niepożądane Zaburzenia psychiczne Lęk, bezsenność, splątanie, osłabienie, stan psychotyczny Zaburzenia układu nerwowego Przemijający ból głowy, drżenie Zaburzenia serca Bradykardia, zaburzenia rytmu serca, zmiany w elektrokardiogramie, tachykardia, wstrząs kardiogenny, kardiomiopatia stresowa, kołatanie serca, zwiększenie kurczliwości mięśnia sercowego wynikające z działania beta-adrenergicznego na serce (działanie inotropowe i chronotropowe) Zaburzenia naczyniowe Nadciśnienie tętnicze, niedokrwienie obwodowe, w tym zgorzel kończyn, zmniejszenie objętości osocza podczas długotrwałego stosowania, uraz niedokrwienny spowodowany silnym działaniem zwężającym naczynia może powodować uczucie zimna i bladość kończyn Zaburzenia żołądka i jelit Nudności, wymioty Zaburzenia skóry i tkanki podskórnej Bladość, bliznowacenie skóry, niebieskawe zabarwienie skóry, uderzenia gorąca lub zaczerwienienie skóry, wysypka skórna, pokrzywka lub swędzenie Zaburzenia nerek i dróg moczowych Zatrzymanie moczu Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Duszność Zaburzenia ogólne i stany w miejscu podania Wynaczynienie, martwica w miejscu wkłucia Długotrwałe podawanie wazopresora w celu utrzymania ciśnienia krwi w przypadku braku wymiany objętości krwi może powodować następujące objawy: ciężkie zwężenie naczyń obwodowych i trzewnych zmniejszenie przepływu krwi przez nerki zmniejszenie wytwarzania moczu niedotlenienie zwiększenie stężenia mleczanu w surowicy.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlInterakcje
W przypadku nadwrażliwości lub przedawkowania częściej mogą wystąpić następujące objawy: nadciśnienie tętnicze, światłowstręt, ból zamostkowy, ból gardła, bladość, intensywne pocenie się i wymioty. Działanie wazopresyjne (wynikające z działania adrenergicznego na naczynia) można zmniejszyć przez jednoczesne podawanie leku blokującego receptory alfa (mezylan fentolaminy), natomiast podawanie leku blokującego receptory beta (propranololu) może powodować zmniejszenie pobudzającego działania produktu na serce i zwiększenie nadciśnienia (poprzez zmniejszenie rozszerzenia tętniczek), wynikające z pobudzenia receptorów beta-1-adrenergicznych. Długotrwałe podawanie jakiegokolwiek silnego wazopresora może powodować zmniejszenie objętości osocza, które należy stale korygować za pomocą odpowiedniej terapii zastępczej polegającej na uzupełnianiu wody i elektrolitów.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlInterakcje
Jeśli objętość osocza nie zostanie skorygowana, po przerwaniu wlewu noradrenaliny może ponownie wystąpić niedociśnienie tętnicze lub ciśnienie krwi może być utrzymane z ryzykiem ciężkiego skurczu naczyń obwodowych i trzewnych ze zmniejszeniem przepływu krwi. Może wystąpić nadciśnienie tętnicze, któremu może towarzyszyć bradykardia, jak i ból głowy oraz niedokrwienie obwodowe, w tym zgorzel kończyn. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem: Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlInterakcje
Jerozolimskie 181C PL-02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. 4.9 Przedawkowanie Objawy Przedawkowanie może powodować ból głowy, ciężkie nadciśnienie tętnicze, odruchową bradykardię, znaczne zwiększenie oporu obwodowego i zmniejszenie pojemności minutowej serca. Objawom tym może towarzyszyć bardzo silny ból głowy, krwotok mózgowy, światłowstręt, ból za mostkiem, bladość, gorączka, intensywne pocenie się, obrzęk płuc i wymioty. Leczenie W razie przypadkowego przedawkowania, objawiającego się znacznym zwiększeniem ciśnienia tętniczego, należy przerwać podawanie leku do czasu ustabilizowania się stanu pacjenta.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlWpływ na płodność, ciążę i laktację
4.6 Wpływ na płodność, ciążę i laktację Ciąża Noradrenalina może zaburzać przepływ krwi przez łożysko i powodować bradykardię u płodu. Może również wywoływać skurcze macicy i doprowadzić do asfiksji płodu w zaawansowanej ciąży. Należy więc rozważyć stosunek możliwego zagrożenia dla płodu do potencjalnych korzyści dla matki. Karmienie piersi? Nie wiadomo, czy lek przenika do mleka ludzkiego. Należy zachować ostrożność podczas podawania noradrenaliny kobiecie karmiącej piersią, ponieważ wiele leków przenika do mleka ludzkiego. Płodność Nie przeprowadzono badań dotyczących wpływu noradrenaliny na płodność.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlWpływ na zdolność prowadzenia pojazdów
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Brak dostępnych informacji. Dlatego nie zaleca się prowadzenia pojazdów lub obsługiwania maszyn.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlDziałania niepożądane
4.8 Działania niepożądane W Tabeli 2 wymieniono działania niepożądane, które wystąpiły u pacjentów leczonych noradrenaliną. Przedstawione dane pochodzą głównie ze zgłoszeń spontanicznych, a ponieważ trudno na podstawie takich zgłoszeń ustalić częstość występowania, w przypadku wymienionych działań niepożądanych jest ona nieznana (częstość nie może być określona na podstawie dostępnych danych). W każdej grupie układów i narządów (ang. System Organ Class, SOC) działania niepożądane są wymienione zgodnie z malejącą częstością występowania. Tabela 2 Działania niepożądane noradrenaliny na podstawie zgłoszeń spontanicznych Klasyfikacja układów i narządów Działania niepożądane Zaburzenia psychiczne Lęk, bezsenność, splątanie, osłabienie, stan psychotyczny Zaburzenia układu nerwowego Przemijający ból głowy, drżenie Zaburzenia serca Bradykardia, zaburzenia rytmu serca, zmiany w elektrokardiogramie, tachykardia, wstrząs kardiogenny, kardiomiopatia stresowa, kołatanie serca, zwiększenie kurczliwości mięśnia sercowego wynikające z działania beta-adrenergicznego na serce (działanie inotropowe i chronotropowe) Zaburzenia naczyniowe Nadciśnienie tętnicze, niedokrwienie obwodowe, w tym zgorzel kończyn, zmniejszenie objętości osocza podczas długotrwałego stosowania, uraz niedokrwienny spowodowany silnym działaniem zwężającym naczynia może powodować uczucie zimna i bladość kończyn Zaburzenia żołądka i jelit Nudności, wymioty Zaburzenia skóry i tkanki podskórnej Bladość, bliznowacenie skóry, niebieskawe zabarwienie skóry, uderzenia gorąca lub zaczerwienienie skóry, wysypka skórna, pokrzywka lub swędzenie Zaburzenia nerek i dróg moczowych Zatrzymanie moczu Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Duszność Zaburzenia ogólne i stany w miejscu podania Wynaczynienie, martwica w miejscu wkłucia Długotrwałe podawanie wazopresora w celu utrzymania ciśnienia krwi w przypadku braku wymiany objętości krwi może powodować następujące objawy: ciężkie zwężenie naczyń obwodowych i trzewnych zmniejszenie przepływu krwi przez nerki zmniejszenie wytwarzania moczu niedotlenienie zwiększenie stężenia mleczanu w surowicy.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlDziałania niepożądane
W przypadku nadwrażliwości lub przedawkowania częściej mogą wystąpić następujące objawy: nadciśnienie tętnicze, światłowstręt, ból zamostkowy, ból gardła, bladość, intensywne pocenie się i wymioty. Działanie wazopresyjne (wynikające z działania adrenergicznego na naczynia) można zmniejszyć przez jednoczesne podawanie leku blokującego receptory alfa (mezylan fentolaminy), natomiast podawanie leku blokującego receptory beta (propranololu) może powodować zmniejszenie pobudzającego działania produktu na serce i zwiększenie nadciśnienia (poprzez zmniejszenie rozszerzenia tętniczek), wynikające z pobudzenia receptorów beta-1-adrenergicznych. Długotrwałe podawanie jakiegokolwiek silnego wazopresora może powodować zmniejszenie objętości osocza, które należy stale korygować za pomocą odpowiedniej terapii zastępczej polegającej na uzupełnianiu wody i elektrolitów.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlDziałania niepożądane
Jeśli objętość osocza nie zostanie skorygowana, po przerwaniu wlewu noradrenaliny może ponownie wystąpić niedociśnienie tętnicze lub ciśnienie krwi może być utrzymane z ryzykiem ciężkiego skurczu naczyń obwodowych i trzewnych ze zmniejszeniem przepływu krwi. Może wystąpić nadciśnienie tętnicze, któremu może towarzyszyć bradykardia, jak i ból głowy oraz niedokrwienie obwodowe, w tym zgorzel kończyn. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem: Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlDziałania niepożądane
Jerozolimskie 181C PL-02-222 Warszawa Tel.: + 48 22 49 21 301 Faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlPrzedawkowanie
4.9 Przedawkowanie Objawy Przedawkowanie może powodować ból głowy, ciężkie nadciśnienie tętnicze, odruchową bradykardię, znaczne zwiększenie oporu obwodowego i zmniejszenie pojemności minutowej serca. Objawom tym może towarzyszyć bardzo silny ból głowy, krwotok mózgowy, światłowstręt, ból za mostkiem, bladość, gorączka, intensywne pocenie się, obrzęk płuc i wymioty. Leczenie W razie przypadkowego przedawkowania, objawiającego się znacznym zwiększeniem ciśnienia tętniczego, należy przerwać podawanie leku do czasu ustabilizowania się stanu pacjenta.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlWłaściwości farmakodynamiczne
5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki stosowane w chorobach serca, leki adrenergiczne i dopaminergiczne, kod ATC: C01CA03. Noradrenalina ma bardzo silne działanie na receptory alfa i bardziej umiarkowane działanie na receptory beta-1. Noradrenalina powoduje zwężenie naczyń krwionośnych, z wyjątkiem naczyń wieńcowych, które pośrednio rozszerza poprzez zwiększenie zużycia tlenu. Powoduje to zwiększenie siły i częstości skurczu mięśnia sercowego (gdy nie jest hamowany przez nerw błędny). Zwiększa się opór obwodowy oraz ciśnienie rozkurczowe i skurczowe. Działanie na naczynia krwionośne noradrenaliny w zwykle stosowanych dawkach klinicznych, wynika z jednoczesnego pobudzenia receptorów alfa- i beta-adrenergicznych w sercu i układzie naczyniowym. Z wyjątkiem serca, jej działanie wpływa głównie na receptory alfa. Powoduje to zwiększenie siły i (przy braku hamowania nerwu błędnego) częstości skurczu mięśnia sercowego.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlWłaściwości farmakodynamiczne
Zwiększa się opór obwodowy i wzrasta ciśnienie rozkurczowe i skurczowe.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlWłaściwości farmakokinetyczne
5.2 Właściwości farmakokinetyczne Istnieją dwa stereoizomery noradrenaliny. Produkt Noradrenalin Kalceks, 1 mg/ml, koncentrat do sporządzania roztworu do infuzji zawiera biologicznie aktywny izomer L. Wchłanianie Podskórne: słabe Doustnie: noradrenalina jest szybko inaktywowana w przewodzie pokarmowym po podaniu doustnym. Po podaniu dożylnym okres półtrwania noradrenaliny w osoczu wynosi około 1 do 2 minut. Dystrybucja Noradrenalina jest szybko usuwana z osocza poprzez komórkowy wychwyt zwrotny i metabolizm. Nie przenika łatwo przez barierę krew-mózg. Metabolizm Metylacja przez katecholo-O-metylotransferazę Deaminacja przez monoaminooksydazę (MAO) W obu reakcjach metabolitem końcowym jest kwas 4-hydroksy-3-metoksymigdałowy Metabolitami pośrednimi są normetanefryna i kwas 3,4-dihydroksymigdałowy. Eliminacja Noradrenalina jest wydalana głównie w postaci metabolitów sprzężonych z kwasem glukuronowym lub siarkowym w moczu.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlWłaściwości farmakokinetyczne
Do 16% dawki podanej dożylnie jest wydalane w postaci niezmienionej z moczem wraz z metylowanymi i deaminowanymi metabolitami w postaci wolnej i sprzężonej. Dzieci i młodzież Brak dostępnych danych z badań farmakokinetycznych w populacji dzieci i młodzieży.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlPrzedkliniczne dane o bezpieczeństwie
5.3 Przedkliniczne dane o bezpieczeństwie Większość z działań niepożądanych można przypisać działaniu sympatykomimetycznemu wskutek nadmiernego pobudzenia współczulnego układu nerwowego poprzez różne receptory adrenergiczne. Noradrenalina może zaburzać przepływ krwi przez łożysko i powodować bradykardię u płodu. Może również wywoływać skurcze macicy i doprowadzić do asfiksji płodu w zaawansowanej ciąży.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlDane farmaceutyczne
6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Kwas solny stężony (do ustalenia pH) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Zgłaszano występowanie niezgodności farmaceutycznych roztworów do infuzji zawierających noradrenaliny winian z następującymi substancjami: solami żelaza, związkami alkalizującymi i utleniającymi, barbituranami, chlorfeniraminą, chlorotiazydem, nitrofurantoiną, nowobiocyną, fenytoiną, wodorowęglanem sodu, jodkiem sodu, streptomycyną, sulfadiazyną, sulfafurazolem. Tego produktu leczniczego nie wolno mieszać z innymi produktami leczniczymi oprócz wymienionych w punkcie 6.6. 6.3 Okres ważności Nieotwarte: 1 ml, 2 ml: 18 miesięcy 4 ml, 5 ml, 8 ml, 10 ml: 2 lata Okres ważności po otwarciu ampułki: Po otwarciu należy natychmiast przygotować rozcieńczony roztwór.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlDane farmaceutyczne
Okres ważności po rozcieńczeniu: Wykazano stabilność chemiczną i fizyczną produktu przez 48 godzin w temperaturze 25°C i 2–8°C po rozcieńczeniu do 4 mg/litr i 40 mg/litr noradrenaliny w roztworze chlorku sodu 9 mg/ml (0,9%) lub w roztworze glukozy 50 mg/ml (5%) lub chlorku sodu 9 mg/ml (0,9%) z roztworem glukozy 50 mg/ml (5%). Z mikrobiologicznego punktu widzenia rozcieńczony roztwór należy zużyć natychmiast. Jeśli roztwór nie zostanie zużyty natychmiast, za czas i warunki przechowywania przed użyciem odpowiada użytkownik i zwykle nie powinien być on dłuższy niż 24 godziny w temperaturze 2–8°C, jeśli rozcieńczenie miało miejsce w kontrolowanych i zwalidowanych warunkach aseptycznych. 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25°C. Przechowywać ampułki w opakowaniu zewnętrznym w celu ochrony przed światłem. Warunki przechowywania produktu leczniczego po rozcieńczeniu, patrz punkt 6.3.
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlDane farmaceutyczne
6.5 Rodzaj i zawartość opakowania 1 ml, 2 ml, 4 ml, 5 ml, 8 ml lub 10 ml roztworu znajduje się w ampułkach z bezbarwnego szkła typu I, z punktem przełamywania. Ampułki są pakowane we wkładkę i umieszczane w tekturowym pudełku. Wielkości opakowań: 5 ampułek 10 ampułek Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Tylko do jednorazowego użycia. Należy usunąć niezużytą zawartości ampułki. Roztwór należy obejrzeć przed użyciem. Nie należy stosować roztworu, jeśli zawiera widoczne cząstki/ciała stałe. Nie należy używać roztworu do infuzji, jeśli ma brązowy kolor. Rozcieńczyć przed użyciem za pomocą: roztworu glukozy 50 mg/ml (5%) lub roztworu chlorku sodu 9 mg/ml (0,9%) lub chlorku sodu 9 mg/ml (0,9%) z roztworem glukozy 50 mg/ml (5%).
- CHPL leku Noradrenalin Kalceks, koncentrat do sporządzania roztworu do infuzji, 1mg/mlDane farmaceutyczne
Dodać 2 ml koncentratu do 48 ml roztworu glukozy 50 mg/ml (5%) (lub dowolnego z wyżej wymienionych roztworów do rozcieńczania) w celu podania za pomocą pompy strzykawkowej lub dodać 20 ml koncentratu do 480 ml roztworu glukozy 50 mg/ml (5%) (lub dowolnego z wyżej wymienionych roztworów do rozcieńczania) w celu podania za pomocą licznika kroplówek. W obu przypadkach końcowe stężenie roztworu do infuzji wynosi 40 mg/litr noradrenaliny (co odpowiada 80 mg/litr winianu noradrenaliny). Można również stosować rozcieńczenia noradrenaliny inne niż 40 mg/litr (patrz punkt 4.2). W przypadku stosowania rozcieńczeń innych niż 40 mg/litr noradrenaliny, należy dokładnie przeliczyć szybkość infuzji przed rozpoczęciem leczenia. Produkt jest kompatybilny z workami infuzyjnymi z polichlorku winylu (PVC), octanu etylowinylu (EVA) lub polietylenu (PE). Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Zobacz również:
- Dawkowanie leku
Midodryna to substancja czynna stosowana w leczeniu niedociśnienia ortostatycznego, czyli nagłego spadku ciśnienia krwi po zmianie pozycji ciała. Lek podawany jest doustnie, a dawkowanie dobierane jest indywidualnie do potrzeb pacjenta. Właściwe przyjmowanie midodryny pomaga poprawić komfort codziennego funkcjonowania, szczególnie u osób, które doświadczają zawrotów głowy lub omdleń po wstaniu z łóżka. Warto wiedzieć, jak prawidłowo dawkować ten lek, by uniknąć działań niepożądanych i osiągnąć najlepsze efekty terapii.
- Działania niepożądane i skutki uboczne
Midodryna to substancja czynna stosowana przede wszystkim w leczeniu niskiego ciśnienia krwi. Jej działania niepożądane są w większości łagodne i przewidywalne, ale w niektórych przypadkach mogą pojawić się poważniejsze objawy, zwłaszcza przy wyższych dawkach lub w określonych grupach pacjentów. Warto znać możliwe reakcje organizmu na midodrynę, by w razie ich wystąpienia szybko zareagować.
- Mechanizm działania
Midodryna to substancja czynna stosowana w leczeniu niedociśnienia ortostatycznego. Jej mechanizm działania polega na pobudzaniu określonych receptorów w naczyniach krwionośnych, co prowadzi do wzrostu ciśnienia krwi. Midodryna jest pro-lekiem, który po podaniu doustnym szybko przekształca się w aktywną formę. Poznaj, jak działa midodryna w organizmie, jak jest wchłaniana i wydalana oraz jakie wyniki przyniosły badania przedkliniczne.
- Porównanie substancji czynnych
Midodryna, etylefryna i noradrenalina to substancje czynne, które mają wspólny cel – podnoszenie ciśnienia tętniczego u osób z niedociśnieniem. Choć należą do podobnej grupy leków, różnią się między sobą mechanizmem działania, sposobem podawania oraz zastosowaniem w różnych sytuacjach klinicznych. Każda z nich ma też odmienne przeciwwskazania i zalecenia dotyczące stosowania u dzieci, kobiet w ciąży czy osób starszych. Poznaj podobieństwa i różnice między tymi lekami, aby lepiej zrozumieć, jak mogą pomóc w leczeniu niedociśnienia i w jakich sytuacjach są stosowane.
- Profil bezpieczeństwa
Midodryna to substancja czynna stosowana głównie w leczeniu niskiego ciśnienia krwi. Jej działanie może jednak wiązać się z pewnymi zagrożeniami, zwłaszcza u osób z określonymi chorobami serca, nerek czy wątroby. Nie każdy pacjent może ją przyjmować bez ograniczeń, dlatego ważne jest poznanie zasad bezpiecznego stosowania tej substancji. Poniżej znajdziesz przystępnie wyjaśnione informacje dotyczące bezpieczeństwa midodryny w różnych grupach pacjentów.
- Przeciwwskazania
Midodryna to substancja wykorzystywana w leczeniu niedociśnienia ortostatycznego, czyli nagłych spadków ciśnienia przy zmianie pozycji ciała. Mimo skuteczności, jej stosowanie nie jest zalecane dla wszystkich – istnieją sytuacje, w których podanie midodryny może być niebezpieczne dla zdrowia. Poznaj przeciwwskazania i dowiedz się, kiedy należy zachować szczególną ostrożność podczas jej przyjmowania.
- Stosowanie u dzieci
Bezpieczeństwo stosowania leków u dzieci to kwestia, która wymaga szczególnej uwagi. Organizm dziecka reaguje na leki inaczej niż organizm dorosłego, dlatego każda substancja czynna powinna być dokładnie przebadana pod kątem tej grupy wiekowej. Midodryna, znana z leczenia niedociśnienia ortostatycznego, jest przykładem substancji, w przypadku której nie istnieją odpowiednie dane dotyczące stosowania u dzieci. Poznaj najważniejsze informacje na temat bezpieczeństwa stosowania midodryny w pediatrii.
- Stosowanie u kierowców
Midodryna to substancja czynna stosowana w leczeniu niskiego ciśnienia krwi. Jej działanie może wiązać się z pewnymi skutkami ubocznymi, które są istotne dla osób prowadzących pojazdy i obsługujących maszyny. Warto wiedzieć, jakie środki ostrożności zachować podczas stosowania midodryny, aby zapewnić sobie bezpieczeństwo w codziennych czynnościach wymagających koncentracji i szybkiej reakcji.
- Stosowanie w ciąży
Midodryna jest substancją wykorzystywaną w leczeniu niektórych zaburzeń krążenia, jednak jej stosowanie w ciąży i podczas karmienia piersią jest przeciwwskazane. W niniejszym opisie wyjaśniamy, dlaczego kobiety spodziewające się dziecka lub karmiące piersią nie powinny przyjmować midodryny, jak również co wiadomo o jej wpływie na płód oraz laktację na podstawie aktualnych danych z dokumentacji leków.
- Wskazania - na co działa?
Midodryna to substancja czynna stosowana w leczeniu niedociśnienia ortostatycznego, czyli nagłego spadku ciśnienia krwi po zmianie pozycji ciała. Dzięki swojemu działaniu poprawia komfort życia osób zmagających się z tym schorzeniem, zwiększając ciśnienie krwi i zmniejszając ryzyko omdleń. Sprawdź, w jakich sytuacjach jej stosowanie jest zalecane i dla kogo jest przeznaczona.
- Rzedawkowanie substancji
Midodryna jest substancją stosowaną w leczeniu niektórych zaburzeń ciśnienia krwi, jednak jej przedawkowanie może prowadzić do poważnych objawów, takich jak bardzo wysokie ciśnienie, zaburzenia pracy serca czy problemy z oddawaniem moczu. Poznaj objawy, możliwe konsekwencje oraz najważniejsze zasady postępowania w razie przyjęcia zbyt dużej dawki tej substancji.
REKLAMA